Observación del parasitismo por moscas (Philornis bellus) en tres especies de colibríes del Occidente de México
Laura E. Nuñez-Rosas a, Enrique Ramírez-García b, Carlos Lara c y Ma. del Coro Arizmendi d, *
a Universidad Autónoma de Tlaxcala, Carretera Tlaxcala-Puebla Km 1.5, 90062 Tlaxcala, Tlaxcala, México
b Estación de Biología Chamela, Instituto de Biología, Universidad Nacional Autónoma de México, Km. 59 Carretera Federal 200, Barra de Navidad-Puerto Vallarta, 48854 Chamela, Jalisco México
c Centro de Investigaciones Biológicas, Universidad Autónoma de Tlaxcala, Km 10.5 Carretera Tlaxcala-San Martín Texmelucan, 90120 Ixtacuixtla, Tlaxcala, México
d Facultad de Estudios Superiores Iztacala, Universidad Nacional Autónoma de México, Laboratorio de Ecología, UBIPRO, Av. De los Barrios 1, Los Reyes Iztacala, 54090 Tlanepantla, Estado de México, México
*Autor para correspondencia: coro@unam.mx (M.C. Arizmendi)
Resumen
Tanto factores bióticos como abióticos se han resaltado como negativos para el éxito de la anidación en las aves, destacando entre ellos la depredación, fenómenos naturales y enfermedades emergentes. Sin embargo, las aves también suelen ser muy susceptibles a los endo- y ectoparásitos. Los dípteros son los parásitos más comunes, y se encuentran las familias Calliphoridae, Muscidae y Piophilidae. El género Philornis (Muscidae) está estrechamente relacionado con las aves, causando un impacto negativo en las nidadas y en el desarrollo de los pichones. En colibríes se ha reportado la presencia de Philornis en Glaucis hirsuta, Thalurania glaucopis y Eupetomena macroura. En nuestro estudio reportamos la presencia de Philornis bellus en pollos de Amazilia rutila, Cynanthus latirostris y Chlorostilbon auriceps en una selva baja. Cynanthus latirostris presentó el mayor número de larvas y A. rutila presentó menor número. Aunque se ha afirmado que un número mayor de 7 larvas resulta letal, para hacer tal aseveración es necesario hacer estudios experimentales, así como considerar un monitoreo sistemático en mayor número de nidos para determinar el efecto a nivel poblacional de estos parásitos.
Keywords:
Philornis; Parasitismo; Colibríes; Bosque tropical seco
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Observation of parasitism by flies (Philornis bellus) in three hummingbird species from Western Mexico
Abstract
Both biotic and abiotic factors have been highlighted as negative for nesting success in birds, including predation, natural phenomena and emerging diseases. However, birds are also susceptible to endo- and ectoparasites. Diptera are the most common parasites, being families as Calliphoridae, Muscidae and Piophilidae the more reported as bird parasites. The genus Philornis (Muscidae) is closely related to birds, causing a negative impact on nestlings and their development. In hummingbirds the presence of Philornis has been reported in nestlings of Glaucis hirsuta, Thalurania glaucopis and Eupetomena macroura. In this study, we recorded the presence of Philornis bellus in nestlings of Amazilia rutila, Cynanthus latirostris, and Chlorostilbon auriceps in a tropical dry forest. Cynanthus latirostris presented the highest larvae number and A. rutila the lowest. Although it has been affirmed that more than 7 larvae are lethal for birds, it is necessary to conduct experimental studies and to consider a systematic monitoring of nests to determine the population-level effects of these parasites.
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Palabras clave:
Philornis; Parasitism; Hummingbirds; Tropical dry forest
Introducción
Diversos factores bióticos y abióticos han sido resaltados como negativos para el éxito de anidación en las aves, entre los que destacan la depredación, la ocurrencia de fenómenos naturales catastróficos y las enfermedades emergentes (Ornelas, 2010; Quinn y Ueta, 2008). Sin embargo, al igual que la gran mayoría de los vertebrados silvestres, las aves son susceptibles al endo y ecto parasitismo (West y Butler, 2010). Los ectoparásitos más conocidos en el grupo, son ácaros de plumas y garrapatas (Acari), piojos (Phthiraptera, pulgas (Siphonaptera), chinches (Hemiptera), y moscas (Diptera: Boyd, 1951; Clayton et al., 2010; de Lope et al., 1993; Douglas III et al., 2004; Knee et al., 2008; Lehmann, 1993; Mappes et al., 1994; Moller et al., 1994; Thomas, 1941; Worth, 1942). Entre los dípteros que comúnmente parasitan a las aves se encuentran 3 familias que se caracterizan por sus similitudes morfológicas (Calliphoridae, Muscidae y Piophilidae: Spalding et al., 2002). Sin embargo, el género más común es Philornis (Diptera: Muscidae). Este género es de distribución tropical principalmente, con 49 especies reconocidas (Löwenberg-Neto, 2008; Pont, 1972).
El Género Philornis está estrechamente relacionado con las aves, ya que la mayoría de sus especies presentan estadios larvales que son parásitos obligados de éstas (de la Peña et al., 2003). Estos parásitos ocasionan un impacto negativo sobre la nidada y el desarrollo de los pichones (Arendt, 1985a), y aunque no existe una evidencia de causalidad sobre su efecto, de acuerdo con algunos estudios, los daños cutáneos (miasis) provocados por Philornis están asociados a la mortalidad (Arendt, 1985b; de la Peña et al., 2003; Fraga, 1984; Nielsen, 1911; Smith, 1968; Spalding et al., 2002).
En colibríes (Trochilidae), se tienen reportes previos sobre el parasitismo por moscas del género Philornis. Dodge y Aitken (1968) mencionan la infección de la mosca Philornis glaucinus en Glaucis hirsuta. A su vez, Oniki y Willis (2000) reportan presencia de larvas de Philornis sp. en crías de Eupetomena macroura. Estos autores señalan la posibilidad de muerte de los pollos si no les hubiesen retirado las larvas. Así mismo, mencionan que el parasitismo por estas moscas es más común en las áreas suburbanas y el ecotono, mientras que disminuye en el interior del bosque. Posteriormente, Couri et al. (2006) reportaron un nido del colibrí corona violácea Thalurania glaucopis parasitado por moscas Philornis sp. En este estudio los autores resaltan la dificultad para la identificación de la especie de mosca debido a la disponibilidad solo de larvas y pupas, aunque sugieren que podría ser Philornis insularis, especie reportada previamente por Sick (1977), en la misma especie de colibrí. Pese a estos reportes, se tiene un desconocimiento general sobre la presencia de moscas parásitas del género Philornis en nidos de otras especies de colibríes. Esta información es necesaria para determinar la generalidad del fenómeno y sentar las bases para establecer los potenciales costos reproductivos en este grupo de aves.
En el presente estudio se reporta por vez primera para México el parasitismo de moscas Philornis bellus en 3 especies de colibríes habitando una selva baja: Amazilia rutila, Cynanthus latirostris y Chlorostilbon auriceps.
Materiales y métodos
La presencia de moscas parásitas P. bellus en colibríes fue descrita entre mayo a junio del 2012 en los alrededores de la Estación de Biología Chamela, IB-UNAM, perteneciente a la reserva de la Biosfera Chamela-Cuixmala. Esta área natural protegida se localiza en la vertiente del Pacífico mexicano en la región Costa Sur del estado de Jalisco, entre las coordenadas 19º29’ y 19º34’ N, 104º25’ y 104º04’ O, aproximadamente a 65 km de Barra de Navidad. Cuenta con una extensión de 3,319 ha y un rango de elevación de 50 a 500 m snm (Bullock, 1985; Macías-Rodríguez y Pérez-Jiménez, 1994). La temperatura media anual en la región es de 24.6 ºC y la oscilación entre el mes más frío y el más caliente es de 4.3 ºC. La precipitación media anual es de 788 mm con una variación interanual de 453 mm (Noguera et al., 2002). En la región, la vegetación dominante es la selva baja caducifolia la cual es fácil de identificar debido a su estacionalidad, fisonomía y afinidad climática (Trejo y Dirzo, 2000). Sin embargo, también se presentan pequeños parches de selva mediana subperennifolia, la cual se encuentra principalmente en los márgenes de los cauces de arroyos y cañadas húmedas (Macías-Rodríguez y Pérez-Jiménez, 1994; Noguera et al., 2002; Trejo y Dirzo, 2000).
Las pupas de las moscas parásitas fueron recolectadas en los nidos de A. rutila, C. latirostris y C. auriceps una vez que los nidos estuvieron inactivos. Las pupas recolectadas fueron medidas utilizando un vernier electrónico y pesadas con una balanza electrónica de precisión Ohaus con sensibilidad a 0.001 g y capacidad para 200 g. Después de tomar las medidas, las pupas fueron colocadas en un frasco con arena (en la tapa se le hizo un hoyo y se cubrió con malla mosquitera para permitir el paso de aire), con la finalidad de que las larvas eclosionaran y pudieran ser identificadas.
Las moscas adultas fueron colocadas en una cámara letal con cianuro de potasio. Una vez muertas se montaron con alfileres entomológicos. A las moscas adultas se les colocó una etiqueta con la especie de colibrí hospedero. Para la identificación de las especies de mosca se utilizaron las guías de Carvalho et al. (2005), Couri (1984, 1989) y Pont (1972).
Resultados
Las larvas de moscas parásitas encontradas en los 3 nidos se identificaron como P. bellus. Las primeras larvas se observaron en 2 crías de C. latirostris el 13 de marzo de 2012. Estas crías presentaron el mayor número de larvas (7 y 9, respectivamente). Posteriormente se encontró el nido de C. auriceps con 2 crías (3 de abril de 2012), ambos presentaron larvas, aunque en menor número (5 y 4 larvas). Así mismo, el nido de A. rutila presentó 2 crías, sin embargo, solo fue posible examinar a una de ellas cuando salió del nido (30 de marzo de 2012), evidenciándose la presencia de 4 larvas. Se monitorearon las crías de las 3 especies hasta que dejaron los nidos (A. rutila y C. auriceps) o murieron (C. latirostris). En todas las crías de colibríes estudiadas, la zona del vientre y el área cloacal son los sitos donde se encontró el 70% de larvas, mientras que el 10% de las larvas fue encontrada en el área de la garganta y el restante 20% con larvas distribuidas entre las alas y costados del cuerpo (tabla 1, figs. 1, 2).
Cuando concluyó el monitoreo de los nidos (sin uso evidente de la hembra y ya sin la presencia de las crías), éstos fueron recolectados debido a que cuando las larvas dejan al huésped, pupan en la base del nido (fig. 3). En este tipo de muestreo, se recolectaron 15 pupas en los nidos de A. rutila, 15 de C. latirostris y solo 9 de C. auriceps. En los nidos depredados durante la incubación o abandonados por las hembras durante la construcción no se observaron pupas.
Se recolectó una larva la cual pesó 0.062 g y midió 10.2 mm de longitud. El color es beige con espiráculo oscuro. El cuerpo se observó segmentado. Por su parte las pupas son de forma cóncava con el espiráculo oscuro. La pupa se encuentra inmersa en un capullo espumoso blanco (fig. 3). En promedio, el peso de la pupa fue de 0.048 ± 0.006 g y sus medidas fueron 9.75 ± 0.98 mm de largo y 3.74 ± 0.32 mm de ancho. El tiempo que tardan en emerger los adultos es de 5 a 8 días. Finalmente, el adulto de P. bellus se caracteriza por la pilosidad color amarillo naranja en las mejillas y las cerdas que presenta en la pared postalar, además de la lejanía de la vena M del ápice alar y los palpos color amarillo naranja (fig. 4).
De las crías que presentaron larvas, únicamente las de C. latirostris murieron, las crías de A. rutila y C. auriceps llegaron a volantones y salieron del nido.
Discusión
El parasitismo es una relación donde uno de los organismos se beneficia y otro se perjudica (Markell y Voge, 1984). Tal relación es una adaptación gradual de un conjunto de características ecológicas, etológicas, fisiológicas y bioquímicas para dirigir esta asociación hacía el equilibrio (Stoner et al., 2005). Para lograr tal equilibrio es necesario que: i) el parásito pueda entrar en contacto con el hospedero, ii) el hospedero proporcione las condiciones adecuadas para el desarrollo y iii) el parásito sea capaz de resistir la reacción del hospedero (Campillo et al., 1999). En este sentido, las moscas del género Philornis sp. están asociadas a las aves como un parásito en sus estadios larvales.
Tabla 1
Colibríes infectados con larvas de Philornis bellus. CL = Cynanthus latirostris, CA = Chlorostilbon auriceps y AR = Amazilia rutila.
|
Cría |
Peso |
# de larvas |
Localización de larvas |
Vivo/muerto |
Días de supervivencia |
|
CL1 |
2.9±0.141 |
9 |
Vientre, cuello, costados y área cloacal |
Muerto |
9 |
|
CL2 |
2.7±0.141 |
7 |
Vientre, cuello, costados y área cloacal |
Muerto |
11 |
|
CA1 |
2.4±0.095 |
4 |
Costados y área cloacal |
Vivo |
27 |
|
CA2 |
2.6±0.1 |
5 |
Cuello, costados y área cloacal |
Vivo |
29 |
|
AR1 |
? |
4 |
Área cloacal y vientre |
Vivo |
13 |
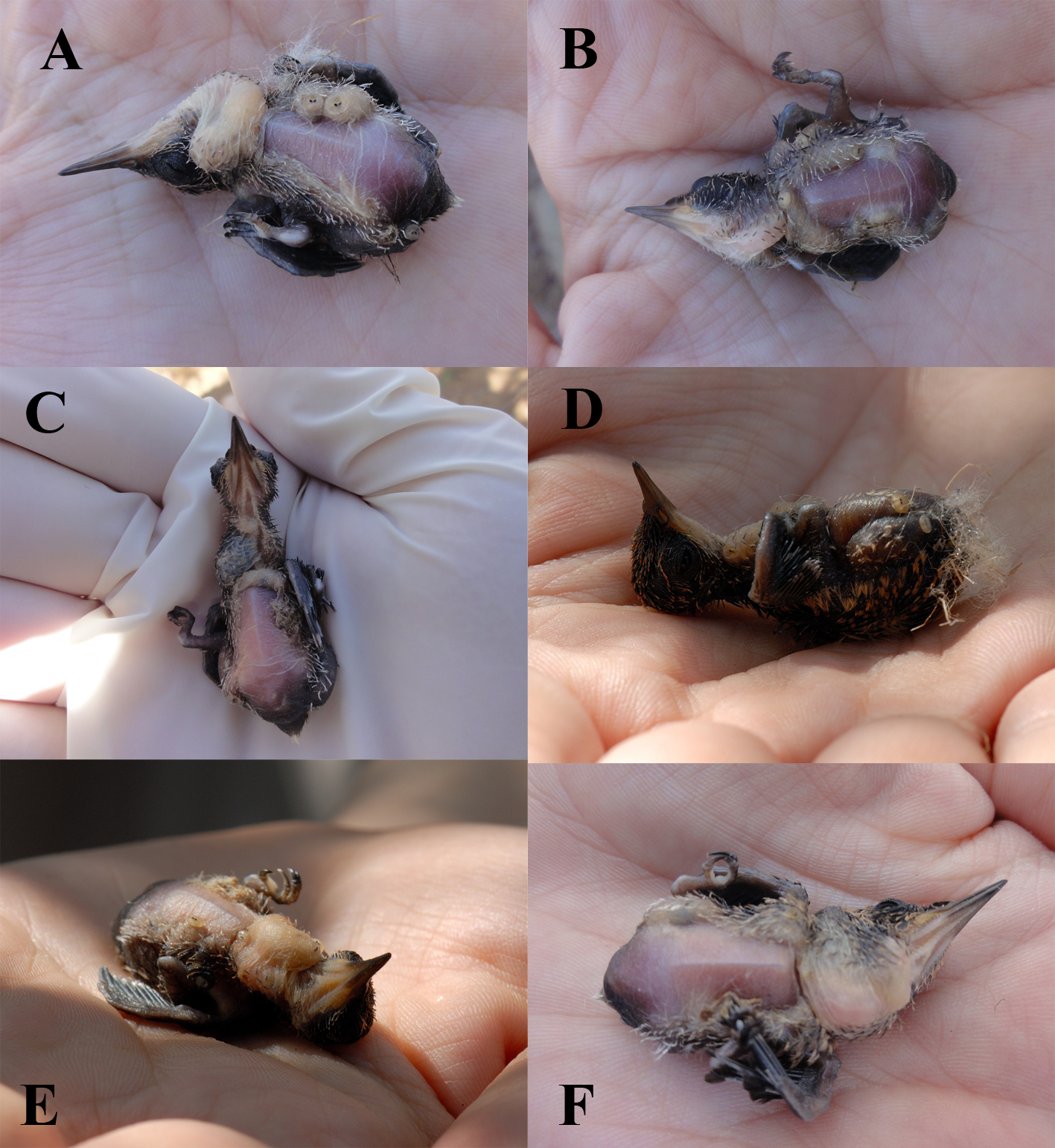



Este tipo de parasitosis ocasiona un impacto negativo en las nidadas y el desarrollo de los pichones (Arendt, 1985a, b).
En México se tiene reporte de 4 especies del género Philornis (P. bellus, P. fasciventris, P. grandis y P. obsucra: Carvalho et al., 2005; Couri, 1984; Couri y Lopes, 1987; Couri et al., 2007; Pont, 1977) y la parasitosis en 3 especies de aves: Tyrannus melancholicus (Selander y Giller, 1959), Falco femoralis (Hector, 1982) y Amazona finschi (Renton, 2002; en el mismo sitio de estudio que nuestro trabajo). Sin embargo, nuestro estudio presenta la primera evidencia de parasitismo por moscas de Philornis bellus para los colibríes en México.
Las cargas parasitarias obtenidas durante nuestras recolectas, así como la muerte de algunas de las crías monitoreadas, resaltan el potencial efecto negativo de estas moscas en el éxito de las nidadas en colibríes, así como el potencial efecto sobre las crías después de que dejan el nido. En este sentido, estudios previos han determinado que la carga parasitaria de moscas puede ser determinante en la mortalidad de crías. Por ejemplo, Smith (1968) asegura que la presencia de 7 o más larvas en crías de oropéndolas y caciques (Icteridae) resulta letal. Sin embargo, para demostrar que Philornis sp. es causante de muerte se debe realizar confirmación experimental, puesto que una enfermedad subyacente puede aumentar la susceptibilidad al parasitismo produciendo así una mayor carga parasitaria de las crías (de la Peña et al., 2003).
Por último, se tienen reportes previos de que los niveles de parasitismo por moscas del género Philornis en diversas especies de aves pueden ser controlados e incluso disminuidos por la participación de los padres, esto a través de la remoción directa de las larvas (de la Peña et al., 2003; Smith, 1968). Sin embargo, este fenómeno no fue observado por nosotros en alguna de las 3 especies de colibríes estudiadas. Estudios futuros deben considerar el monitoreo sistemático de un mayor número de nidos y de especies dentro del grupo, para determinar el efecto potencial a nivel poblacional de estas moscas parásitas.
Agradecimientos
Al PAPIIT [IN217511] y US Fish and Wildlife Service´s Neotropical Migratory Birds Conservation Act [Grant 5087]. Al Conacyt por la beca 261593 otorgada a L. Nuñez-Rosas, quien pertenece al programa de la Maestría en Ciencias Biológicas de la Universidad Autónoma de Tlaxcala.
Referencias
Arendt, W. J. (1985a). Philornis ectoparasitism of pearly-eyed thrashers. I. Impact on growth and development of nestlings. Auk, 102, 270–280.
Arendt, W. J. (1985b). Philornis ectoparasitism of pearly-eyed thrashers. II. Efects on adults and reproduction. Auk, 102, 281–292.
Boyd, E. M. (1951). The external parasites of birds: a review. Wilson Bulletin, 63, 363–369
Bullock, S. H. (1985). Breeding systems in the flora of a tropical deciduous forest in Mexico. Biotropica, 17, 287–301.
Campillo, M. C., Vázquez, F. A., Fernández, A. R. M., Acedo, M. C. S., Rodríguez, S. H., López-Cozar, I. N. et al. (1999). Parasitología veterinaria. Madrid: McGraw-Hill-Interamericana.
Carvalhao, C. J. B., Couri, M. S., Pont, A. C., Pamplona, D. y Lopes, M. S. (2005). A catalogue of the Muscidae (Diptera) of the Neotropical Region. Zootaxa, 860, 1–282.
Clayton, D. H., Koop, J. A. H., Harbison, C. W., Moyer, B. R. y Bush, S. E. (2010). How birds combat ectoparasites. Open Ornithology Journal, 3, 41–71.
Couri, M. S. (1984). Notes and descriptions of the Philornis flies (Diptera, Muscidae, Cyrtoneurininae). Revista Brasileira de Entomología, 28, 473–490.
Couri, M. S. (1989). Philornis Meinert, 1980 –Key to adults (Diptera, Muscidae, Reinwardtinae). Revista Brasileira de Zoología, 6, 569–579.
Couri, M. S. y Lopes, S. M. (1987). Descrição de Polietina distincta sp. n. (Diptera, Muscidae, Cyrtoneurininae). Revista Brasileira de Biologia, 47, 629–631.
Couri, M. S., Murphy, T. G. y Hoebeke, R. (2007). Philornis fasciventris (Wulp) (Diptera: Muscidae): description of the male, larva and puparium, with notes on biology and host association. Neotropical Entomology, 36, 889–893.
Couri, M. S., Tavares, M. T. y Stenzel, R. R. (2006). Parasitoidism of Chalcidid wasps (Hymenoptera, Chalcididae) on Philornis sp. (Diptera, Muscidae). Brazilian Journal of Biology, 66, 553–557.
de la Peña, M. R., Beldoménico, P. M. y Antoniazzi, R. L. (2003). Pichones de aves parasitados por larvas de Philornis sp. (Diptera: Muscidae) en un sector de la provincia biogeográfica del Espinal de Santa Fe, Argentina. Revista FAVE-Ciencias Veterinarias, 2, 141–146.
de Lope, F., González, G., Pérez, J. J. y Moller, A. P. (1993). Increased detrimental effects of ectoparasites on their bird hosts during adverse environmental conditions. Oecologia, 95, 234–240.
Dodge, H. R. y Aitken, T. H. G. (1968). Philornis flies from Trinidad (Diptera: Muscidae). Journal of the Kansas Entomological Society, 41, 134–154.
Douglas III, H. D., Co, J. E., Jones, T. H. y Conner, W. E. (2004). Interespecific differences in Aethia spp. Auklet Odorant and evidence for chemical defense against ectoparasites. Journal of Chemical Ecology, 30, 1921–1935.
Fraga, R. (1984). Bay-winged cowbirds (Molothrus badius) remove ectoparasites from their brood parasites, the Screaming cowbirds (M. rufoaxillaris). Biotropica16, 223–226.
Hector, D. P. (1982). Botfly (Diptera, Muscidae) parasitism of nestling Aplomado Falcons. Condor, 84, 443–444.
Knee, W., Proctor, H. y Galloway, T. (2008). Survey of nasal mites (Rhinonyssidae, Ereynetidae, and Turbinoptidae) associated with birds in Alberta and Manitoba, Canada. Canadian Entomologist, 140, 364–379.
Lehmann, T. (1993). Ectoparasites: direct impact on host fitness. Prasitology Today, 9, 8–13
Löwenberg-Neto, P. (2008). The structure of the parasite-host interactions between Philornis (Diptera: Muscidae) and neotropical birds. Journal of Tropical Ecology, 24, 575–580.
Macías-Rodríguez, M. A. y Pérez-Jiménez, L. A. (1994). Estudio morfológico preliminar en plántulas de especies arbóreas de la región de Chamela, Jalisco, México. Boletín Instituto de Biología, Guadalajara, 2, 69–96.
Mappes, T., Mappes, J. y Kotiaho, J. (1994). Ectoparasites, nest site choice and breeding success in the pied flycatcher. Oecologia, 98, 147–149.
Markell, E. K. y Voge, M. (1984). Parasitología: diagnostico, prevención y tratamiento. México D.F.: El Manual Moderno.
Moller, A. P., de Lope, F., Moreno, J., González, G. y Pérez, J. J. (1994). Ectoparasites and host energetics: house martin bugs and house martin nestlings. Oecologia, 98, 263–268.
Nielsen, J. (1911). Mydaea anomala Jaenn, a parasite of South-American birds. Videnskabelige Meddelelser fra Dansk Naturhistorisk Forening, 63, 40–45.
Noguera, F. A., Vega-Rivera, J. H., García-Andrade, A. N. y Quesada-Avedaño, M. (2002). Historia natural de Chamela. México, D.F.: Instituto de Biología, Universidad Nacional Autónoma de México.
Oniki, Y. y Willis, O. E. (2000). Nesting behavior of the swallow-tailed hummingbird, Eupetomena macroura (Trochilidae, Aves). Revista Brasileira de Biologia, 60, 655–662.
Ornelas, J. F. (2010). Neest, eggs, and young of the Azure-crowned hummingbird (Amazilia cyanocephala). Wilson Journal of Ornithology, 122, 592–597.
Pont, A. C. (1972). A catalogue of the Diptera of the Americas South of the United States. Säo Paulo: Museu de Zoolooia, Universidade de Säo Paulo.
Quinn, J. L. y Ueta, M. (2008). Protective nesting associations in birds. Ibis, 150, 146–167.
Renton, K. (2002). Influence of environmental variability on the growth of Lilac-crowned Parrot nestlings. Ibis, 144, 331–339.
Selander, R. K. y Giller, D. R. (1959). The avifauna of the Barranca de Oblatos, Jalisco, Mexico. Condor, 61, 210–222.
Sick, H. (199)7. Ornitologia brasileira. Rio de Janeiro: Ed. Nova Fronteira.
Smith, N. (1968). The advantage of being parasitized. Nature, 219, 690–694.
Spalding, M. G., Mertins, J. W., Walsh, P. B., Morin, K. C., Dunmore, D. E. y Forrester. D. J. (2002). Burrowing fly larvae (Philornis porteri) associated with mortality of eastern bluebirds in Florida. Journal of Wildlife Diseases, 38, 776–783.
Stoner, K. E., González-Di, Pierro, A. M. y Maldonado-López, S. (2005). Infecciones de parásitos intestinales de primates: implicaciones para la conservación. Universidad y Ciencia, Número Especial II, 61–72.
Thomas, R. H. (1941). Ticks affecting birds’ eyesight. Auk, 58, 590–591.
Trejo, I. y Dirzo, R. (2000). Deforestation of seasonally dry tropical forest: a national and local analysis in Mexico. Biological Conservation, 94,133–142.
West, C. G. y Butler, C. A. (2010). Do hummingbrids humm? Fascinating answers to questions about hummingbirds. New Brunkwick, New Jersey and London: Rutgers University Press.
Worth, C. B. (1942). Ticks affecting birds’ eyesight. Auk, 59, 576–577.



