Efectos del cambio climático en una especie de lagartija termófila de amplia distribución (Dipsosaurus dorsalis): un enfoque ecofisiológico
Rafael A. Lara-Resendiz a, *, Patricia Galina-Tessaro a, Ana Gisel Pérez-Delgadillo b, Jorge H. Valdez-Villavicencio c y Fausto R. Méndez-de la Cruz b
a Centro de Investigaciones Biológicas del Noroeste, Playa Palo de Santa Rita Sur, 23096 La Paz, Baja California Sur, México
b Laboratorio de Herpetología II, Departamento de Zoología, Instituto de Biología, Universidad Nacional Autónoma de México, Coyoacán, Apartado postal 70515, 04510 Ciudad de México, México
c Conservación de Fauna del Noroeste, A.C., 22785 Ensenada, Baja California, México
*Autor para correspondencia: rafas.lara@gmail.com (R.A. Lara-Resendiz)
Resumen
El cambio climático global se considera una gran amenaza contra la biodiversidad, sin embargo, aún es incierto cómo afectará a diferentes grupos taxonómicos, pues la respuesta dependerá de su historia natural y de la complejidad del hábitat. Así, los reptiles de ambientes desérticos son de particular preocupación porque deben termorregular dentro de límites óptimos a pesar de las altas temperaturas ambientales. Este estudio se enfocó en la iguana del desierto (Dipsosaurus dorsalis), una lagartija termófila de amplia distribución en los desiertos de Sonora y Mojave, que representa un modelo ideal para evaluar los efectos del calentamiento global en ambientes extremos. Los modelos de vulnerabilidad se construyeron usando un enfoque mecanicista combinando variables ecofisiológicas y biofísicas. Primero, se recolectaron temperaturas corporales de campo y temperaturas operativas en 4 sitios contrastantes; segundo, se construyeron 2 capas ecofisiológicas según las horas de actividad, restricción y precipitación, y tercero, se realizaron modelos para el presente y futuro (2050 y 2070) bajo 2 escenarios (RCP 4.5 y 8.5). Como resultado de su alta tolerancia térmica, los modelos sugieren que D. dorsalis es resiliente al calentamiento global, debido a la expansión de nichos climáticos adecuados y la potencial ampliación de su distribución bajo todos los escenarios.
Palabras clave: Ampliación de distribución; Ecofisiología; Iguana del desierto; Modelo mecanicista; Modelo de distribución de especies; Temperatura operativa
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Effects of climate change on a widely distributed thermophilic lizard (Dipsosaurus dorsalis): an ecophysiological approach
Abstract
Global climate change is a major known threat against biodiversity, however, it is still unclear how it will affect different taxonomic groups as the answer is dependent on species-specific natural history and habitat complexity. Desert reptiles are of particular concern because they must thermoregulate within optimal limits despite high environmental temperatures. As such, our study focused on the desert iguana (Dipsosaurus dorsalis), a thermophilic lizard widely distributed in the Sonoran and Mojave deserts and an ideal model to evaluate global warming effects in extreme environments. We created our vulnerability models using a mechanistic approach combining ecophysiological and biophysical variables. First, field body temperatures and the operative temperatures were collected at 4 contrasting sites. Second, 2 ecophysiological layers were constructed according to hours of activity, hours of restriction and precipitation. Lastly, models for the present and future (2050 and 2070) were created under 2 scenarios (RCP 4.5 and 8.5). As a result of their high thermal tolerance, our models suggest that D. dorsalis shows strong potential for resilience to global warming, through an increase in suitable climate niches and a potential distribution range expansion under all climate scenarios.
Keywords: Range expansion; Ecophysiology; Desert iguana; Mechanistic model; Species distribution model; Operative temperature
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
El cambio climático global (CCG) y las alteraciones del hábitat debido a las actividades humanas ejercen presiones selectivas significativas y efectos negativos sobre las poblaciones naturales de muchos grupos taxonómicos, por ejemplo en plantas, anfibios, mamíferos, aves y reptiles (Cahill et al., 2013; Chen et al., 2011; Pereira et al., 2010; Winter et al., 2016). Para reducir la amenaza de la pérdida de biodiversidad y establecer medidas de mitigación, los estudios sobre el riesgo de extinción de las especies deberían ser fundamentales para lograr los objetivos de conservación. Además, es imperativo determinar como la exposición a factores estresantes, como las altas temperaturas, provocan que las especies sean vulnerables ante un entorno cambiante.
Actualmente, los organismos ectotermos están amenazados por el calentamiento global debido a la alteración de su nicho térmico (Deutsch et al., 2008; Huey et al., 2009; Sinervo et al., 2010). Esto se debe, a que la mayoría de estos organismos tienen que termorregular para mantener su temperatura corporal (Tc) dentro de un intervalo óptimo, sin embargo, los ambientes con altas temperaturas podrían aumentar el riesgo de sobrecalentamiento, acortando en consecuencia el tiempo propicio de actividad (Avery, 1982; Cowles y Bogert, 1944; Dunham, 1993; Huey, 1982), e impactando demográficamente a través de múltiples vías potenciales, lo que podría incrementar el riesgo de extinción. Investigaciones recientes han demostrado que 12% de 200 poblaciones mexicanas estudiadas de lagartijas del género Sceloporus, ha desaparecido como resultado del aumento de las temperaturas ambientales (Sinervo et al., 2010). Lo anterior se debe a que las lagartijas han estado expuestas a temperaturas operativas ambientales (To) que exceden sus temperaturas corporales preferidas, por lo que se restringe el tiempo de actividad, provocando una disminución de la energía neta que está destinada al periodo de reproducción durante años consecutivos (Dunham, 1993; Huey et al., 2010; Sinervo et al., 2010). Esta disminución en el periodo de actividad se define como horas de restricción térmica u horas de inactividad forzada (Lara-Resendiz et al., 2015).
En este contexto, los modelos de distribución de especies (MDS) han sido utilizados para evaluar la vulnerabilidad de las especies de reptiles ante el CCG (Ballesteros-Barrera et al., 2007; Barrows, 2011; Barrows et al., 2010; Güizado-Rodríguez et al., 2012; Lara-Resendiz et al., 2015; Sinervo et al., 2010). Por ejemplo, los MDS pueden dividirse según su enfoque en 2 categorías principales: correlativos y mecanicistas. Los modelos correlativos (e.g., máxima entropía [Maxent] y modelos lineales generalizados) incluyen una asociación estadística entre las condiciones ambientales y la distribución actual de las especies para proyectar distribuciones potenciales bajo múltiples escenarios climáticos (Angert et al., 2011). Por el contrario, los modelos mecanicistas se construyen a partir de datos biofísicos, fisiológicos y, cuando es posible, demográficos (Sinervo et al., 2017). En este último enfoque, la relación entre las variables ambientales y fisiológicas, como el desempeño o la preferencia térmica, pueden proyectarse a través del paisaje en climas actuales, pasados o futuros (Buckley et al., 2010; Kearney y Porter, 2009). Así, los modelos mecanicistas podrían ser más apropiados y explicativos que los correlativos, debido a que los primeros permiten aislar el efecto del entorno abiótico sobre el rendimiento del organismo y la distribución potencial (Angert et al., 2011; Buckley et al., 2010). Sin embargo, los modelos mecanicistas requieren una comprensión más precisa de las relaciones entre la aptitud de la especie y su ambiente con estimaciones de diversos parámetros fenotípicos (que pudieran reflejar los costos adaptativos), en una amplia gama de condiciones ambientales.
Existen controversias en las propuestas sobre la forma en la que el CCG afectará a los diferentes grupos taxonómicos. Sin embargo, la respuesta debe considerar los requerimientos térmicos, tolerancias y adaptaciones de las especies, así como la complejidad térmica del hábitat. Por otro lado, se ha propuesto que algunos grupos, entre ellos los termófilos, pueden resultar favorecidos por el CCG (Deutsch et al., 2008; Yuan et al., 2018). Por esta razón, este trabajo se enfocó en una especie de lagartija termófila y de amplia distribución (Dipsosaurus dorsalis), que representa un modelo ideal para evaluar cómo será afectada por el CCG utilizando MDS con un enfoque mecanicista. En primer lugar, esta especie tiene una amplia distribución en Norteamérica desde Sinaloa y Baja California Sur en México hasta Nevada y Utah en Estados Unidos. En segundo lugar, a lo largo de su distribución D. dorsalis habita en un gradiente de hábitats desde los desiertos más áridos en el norte hasta bosques tropicales caducifolios en el sur. En tercer lugar, es una especie termófila con requerimientos térmicos y temperaturas críticas al límite en sitios particulares de su distribución, donde otros reptiles son vulnerables (Barrows, 2011; Barrows et al., 2010; Lara-Resendiz et al., 2014; Sinervo et al., 2017). Por último, D. dorsalis es relativamente bien conocida ecofisiológicamente, con numerosos estudios de su ecología e historia natural (Krekorian, 1984; Muth, 1980; Norris, 1953), biogeografía (Valdivia-Carrillo et al., 2017), termorregulación (Berk y Heath, 1975; DeWitt, 1967), temperaturas críticas y requerimientos térmicos (Brattstrom, 1965; Cowles y Bogert, 1944), así como reproducción (Mayhew, 1971).
Por otro lado, las proyecciones climáticas sobre el riesgo de extinción en reptiles bajo un enfoque mecanicista han sido realizadas a gran escala geográfica y al nivel taxonómico de familia (Kearney, 2013; Sinervo et al., 2010), por lo que es fundamental evaluar escenarios en especies con características de vida particulares ya que las consecuencias son diferenciales para las especies (Winter et al., 2016). Por esta razón, el objetivo principal es evaluar los posibles impactos directos del CCG a lo largo de la distribución de D. dorsalis mediante un modelo ecofisiológico y biofísico.
Materiales y métodos
Dipsosaurus dorsalis es una lagartija diurna de tamaño mediano que llega a medir hasta 154 mm de longitud hocico-cloaca (LHC). Esta es una especie principalmente herbívora y tiene una amplia distribución en hábitats áridos del oeste de Norteamérica, que se extiende desde el suroeste de Utah, sur de Nevada y el sureste de California hasta el suroeste de Arizona en EUA, mientras que en México desde la península de Baja California y Sonora hasta el sur de Sinaloa (Valdivia-Carrillo et al., 2017). Esta especie habita grandes regiones como la Gran Cuenca, los desiertos de Mojave y Sonora, la península de Baja California y varias islas del golfo de California y del Pacífico, donde ocupa terrenos planos, abiertos y arenosos tales como dunas, pavimento desértico, llanuras de inundación y arroyos (Grismer, 2002; Stebbins, 2003); en estos sitios la vegetación abierta está dominada por la gobernadora (Larrea spp.), mezquites (Prosopis spp.), acacias (Acacia spp.) y diversas cactáceas (Jones y Lovich, 2009). Su intervalo altitudinal va por debajo del nivel del mar hasta los 1,500 m (Stebbins, 2003). Es una especie activa de febrero a octubre y su reproducción ha sido ampliamente estudiada; de acuerdo con Mayhew (1971) la longitud mínima de reproducción son 110 mm de LHC y la estación de reproducción inicia en abril y termina en julio-agosto, aunque puede haber variación poblacional.
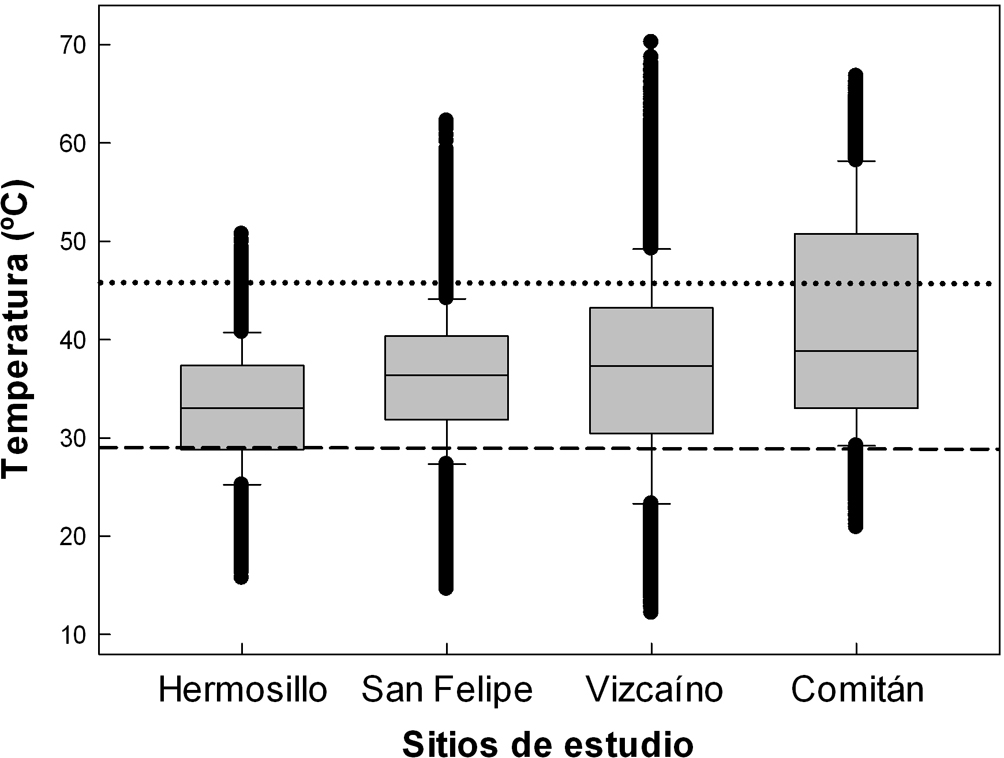
Para monitorear las Tc y To dentro de la distribución de D. dorsalis, se eligieron 4 localidades representativas: A) desierto de Sonora. Ubicado al sureste del municipio de Hermosillo (designado como Hermosillo; 28°48’57.6” N, 110°49’38.9” O, elevación 234 m). La temperatura promedio anual es 24.2 °C (14.3-32.2 °C) y en el verano es de 30 °C aunque puede superar los 45 ºC. La precipitación anual varía entre 230 y 365 mm, donde cerca del 60% ocurre entre junio y septiembre. El tipo de vegetación principal es matorral desértico representado por gobernadora (Larrea tridentata) y árboles pequeños como palo verde (Parkinsonia spp.), palo fierro (Olneya tesota), torote (Bursera spp.) y mezquite (Prosopis spp.). B) Desierto de San Felipe. Ubicado al noreste de Baja California (designado como San Felipe; 31°7’56.16” N, 114°56’29.34” O, elevación 97 m). Este sitio es considerado como uno de los desiertos más secos y calientes de Norteamérica. La temperatura promedio es 21.8 °C (14.8-28.9 °C) y el mes más cálido es agosto con una media de 30 °C. Durante junio y septiembre se presenta la época más caliente, alcanzando los 50 °C a la sombra. La precipitación anual puede llegar a los 50 mm, aunque con varios años consecutivos sin lluvia. El tipo de vegetación es matorral xerófilo principalmente con gobernadora (Larrea tridentata), la hierba del burro (Ambrosia dumosa), ocotillo (Fouquieria splendens), palo verde (Parkinsonia florida) y mezquite (Prosopis pubescens) (González-Abraham et al., 2010). C) Desierto de Vizcaíno. El sitio se ubicó en el ejido Guillermo Prieto al norte de Baja California Sur (designado como Vizcaíno; 27°54’15.37” N, 113°56’42.50” O, elevación 90 m). Esta localidad está formada por una serie de extensas llanuras áridas por debajo de 100 m de altitud a lo largo de la vertiente del Pacífico, con alta influencia marina, la cual da como resultado un desierto de neblina de clima fresco, nuboso y ventoso durante la mayor parte del año, recibe alrededor de 100 mm de lluvia, concentrada principalmente en invierno. El clima es seco con temperatura media anual de 19.1 °C (13.0-25.2 °C), aunque en verano puede llegar a 42.5 °C. La vegetación está compuesta por pequeños arbustos perennes como yuca (Yucca valida), palo Adán (Fouquieria diguetti) y lomboy (Jatropha cinerea) (González-Abraham et al., 2010). D) El Comitán – El Mogote (designado como Comitán; 24º8’2.08” N, 110º25’33.42” O, elevación 7 m). Está ubicado dentro de la región de la costa central del golfo en la parte sureste de Baja California Sur, en el municipio de La Paz. Es una estrecha banda de desierto que se extiende a lo largo de la costa del golfo de California con una barra arenosa (El Mogote) que enmarca la ensenada de La Paz. El clima es desértico con temperaturas cálidas a muy cálidas, con promedio anual de 23.4 °C (16.2-30.4 °C), aunque en junio puede llegar a 43 °C. La precipitación procede de las tormentas y huracanes de verano que afectan la parte sur de la península, con precipitación pluvial promedio de 180 mm. La vegetación es de tipo matorral sarcocaule, dominando especies como mezquite (Prosopis articulata), torote (Bursera microphylla), palo Adán (Fouquieria diguetii), lomboy (Jatropha cinerea), además en la zona de dunas abunda el hierbajo lechoso (Asclepias albicans), ciruelo (Cyrtocarpa edulis), cardón (Pachycereus pringlei) y numerosas especies de Opuntia (González-Abraham et al., 2010).
El trabajo de campo se realizó de septiembre de 2016 a septiembre de 2018 en las 4 localidades para monitorear la Tc y conocer las temperaturas voluntarias mínima y máxima (TVmin y TVmax) de D. dorsalis, además de monitorear la To del hábitat, con la finalidad de conjuntar la mayor cantidad de información ecofisiológica a lo largo de su distribución. Las TVmin y TVmax corresponden a las registradas por los organismos durante la actividad, las cuales se utilizaron como umbral para los modelos (ver “modelo fisiológico para el riesgo de extinción”). Se buscaron los organismos entre las 6:00 y las 20:00 h. Se recolectó el mayor número posible de organismos por localidad y se midió su Tc con un termómetro digital (Fluke modelo 51-II) con una termocupla T (± 0.1 °C) insertada a 1 cm en la cloaca dentro de los primeros 20 segundos después de la captura. También se registró la hora, la LHC (mm) y la ubicación usando un GPS.
La To representa la temperatura de equilibrio de un objeto inanimado con su entorno y permite explorar el ambiente térmico a la misma escala espacial experimentada por los organismos, lo que se puede replicar fácilmente para medir condiciones térmicas espaciales y temporales múltiples (Bakken, 1992). Estudios previos han utilizado diversos materiales (e.g., cobre, aluminio, agar o taxidermias) para medir la To (Dzialowski, 2005), pero recientemente se han utilizado modelos de tubos de cloruro de polivinilo (PVC) para monitorear la To de lagartijas (Dzialowski, 2005; Lara-Resendiz et al., 2015, 2014; Sinervo et al., 2010).
Los modelos biofísicos de PVC se diseñaron para asemejar las propiedades térmicas de D. dorsalis según su forma y tamaño, además se pintaron de gris al 33% para aproximarse a la reflectividad, es decir, la propiedad de reflejar la luz o radiación (Adolph, 1990; Sinervo et al., 2010). Se colocaron en total 14 modelos de PVC conectados a registradores de datos (HOBO® Pro V2 de 2 canales) programados para la toma de la To cada 20 minutos, de septiembre de 2016 a septiembre de 2018. Con el objetivo de representar los extremos de temperatura en cada sitio, los modelos de PVC fueron colocados en 3 diferentes microhábitats: 1) sol directo todo el tiempo, 2) sombra bajo vegetación natural, y 3) transición de sol y sombra (mosaico). Estos tipos de microhábitats son refugios y lugares de actividad basados en el conocimiento de la biología y conducta de la especie según las observaciones durante el trabajo de campo y de literatura (Jones y Lovich, 2009; Norris, 1953; Valdivia-Carrillo et al., 2017).
Previamente, el modelo de PVC fue calibrado con un organismo en el laboratorio, utilizando un Omega TC-08 con termocuplas ultradelgadas (1 mm de diámetro y 2 m de largo) para comparar simultáneamente la temperatura de una lagartija y un modelo de PVC (2.5 cm de diámetro y 13 cm de largo; hueco, sellado con corcho y silicón) cada 3 minutos durante 3 horas alternando entre sol y sombra. El organismo representativo fue de la localidad de El Comitán. La calibración mostró una correlación lineal altamente significativa entre Tc y To (r = 0.92, n = 4870, p < 0.001). Por lo tanto, en este estudio se asumió que los modelos de PVC emularon con precisión la To disponible para D. dorsalis.
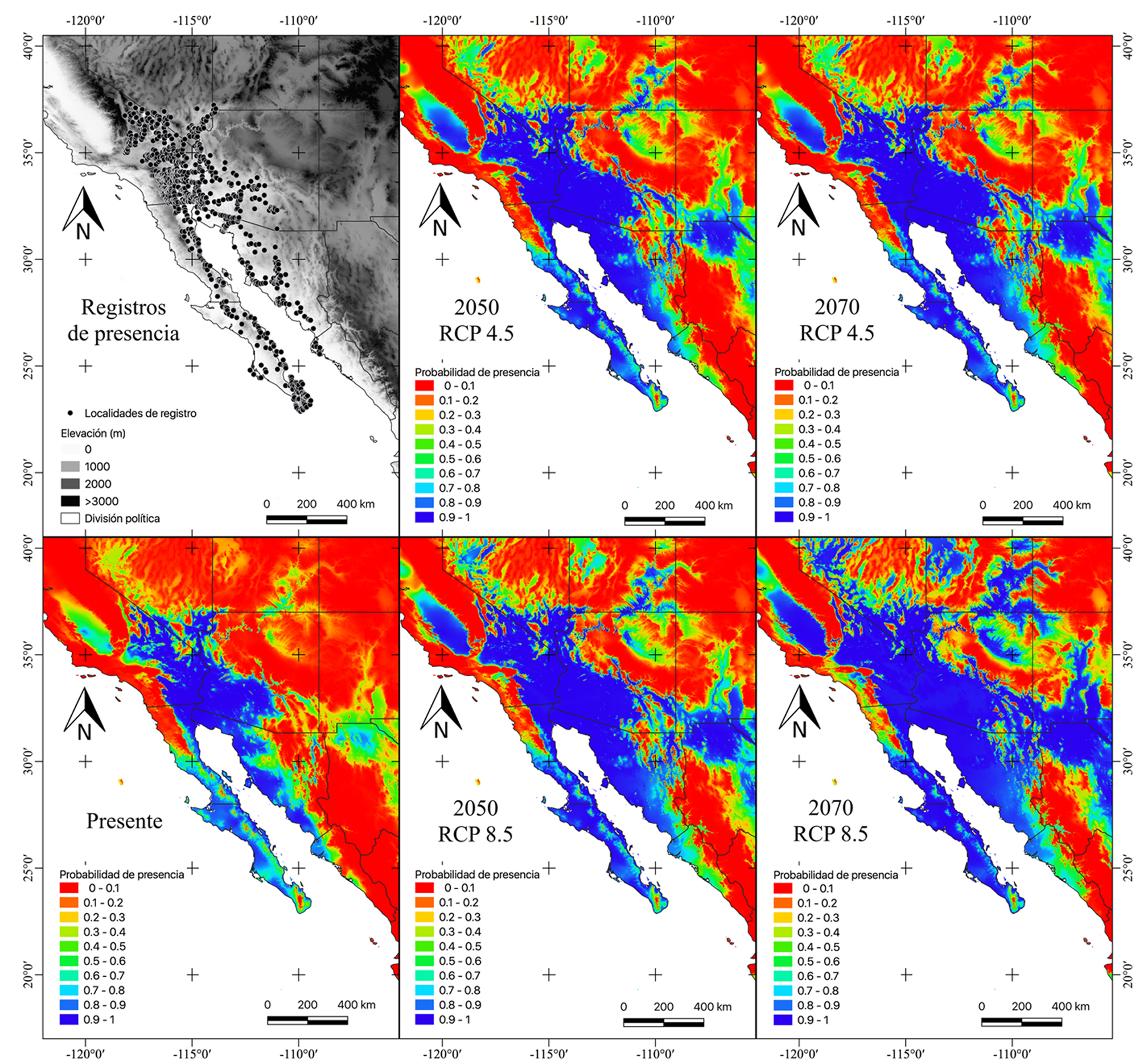
Los datos para la distribución geográfica de D. dorsalis se obtuvieron y curaron a partir de una variedad de fuentes: Global Biodiversity Information Facility (GBIF; https://www.gbif.org), Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (Conabio; http://enciclovida.mx), Colección Nacional de Anfibios y Reptiles (CNAR), Amphibian and Reptile Atlas of Peninsular California (http://herpatlas.sdnhm.org), trabajo previo de campo y literatura especializada. Se eliminaron los datos con localidades inciertas o erróneas en identificación o descripción de la localidad. El conjunto de datos consistió en 1,534 registros, que representan 1,043 puntos de distribución diferentes (1 km), el filtrado de los duplicados y registros únicos se realizó en el programa R (R Development Core Team, 2012). La figura 1 muestra la distribución conocida de D. dorsalis.
Para realizar los modelos y proyecciones se siguió el enfoque de Sinervo et al. (2010) mediante el paquete Mapinguari para el programa R (R Development Core Team, 2012), el cual incorpora la extrapolación de procesos biológicos, en este caso la fisiología térmica (TVmax y TVmin) y temperaturas microclimáticas con modelos biofísicos (To), además de las variables climáticas de importancia para lacertilios de climas desérticos (temperatura máxima: Tmax; temperatura mínima: Tmin y precipitación; Flesch et al., 2017), las que se obtuvieron de WorldClim (http://www.worldclim.org) a una resolución espacial de 30 arc s (~ 1 km; Hijmans et al., 2005). Así, estas extrapolaciones espaciales complementan los MDS correlativos tradicionales mediante la mezcla de predictores ambientales y los basados en procesos. A continuación, se resume el método, pero la descripción detallada del paquete está en Caetano et al. (2017).
Primero, se construyeron 2 capas ecofisiológicas basadas en las horas de actividad (Ha) consideradas como el número de horas por día potencialmente disponibles para la actividad cuando la To estuvo dentro del intervalo de temperatura voluntaria en campo. Después, las horas de restricción térmica (Hr), o también conocidas como las horas de inactividad forzada debido a temperaturas altas (Lara-Resendiz et al., 2015) que fueron estimadas como el tiempo cuando la To supera a la TVmax (Kubisch et al., 2015; Yuan et al., 2018) como el límite que restringe la actividad. A pesar de que la To se monitoreó de septiembre de 2016 a septiembre de 2018 en las 4 localidades, únicamente se utilizó la To de abril a septiembre para calcular tanto Ha como Hr según el periodo de reproducción descrito por Mayhew (1971).
Posteriormente, para obtener la función general basada en la relación entre las Hr y Ha para predecir la extinción se obtuvieron los datos diarios de temperatura del aire (Taire) mediante registradores de temperatura (HOBO® Pro V2 U23-002) colocados en los sitios de estudio. Únicamente para la localidad de El Comitán, se utilizaron los datos de la estación meteorológica del sitio de trabajo. Se utilizó el programa R (R Development Core Team, 2012) para generar un modelo de función logística generalizada (curva de crecimiento de Richards) entre Ha, Hr y Taire. La ecuación de Ha y Hr en el código fue: Ha o Hr = Asym / ((1 + M * exp (-K * (Taire -Infl))) ^ (1 / M))), donde: Asym es la parte superior de la asíntota; M es el parámetro de forma; K es la pendiente; e Infl es el punto de inflexión. A partir de ésto, se construyeron 2 capas ecofisiológicas (Ha y Hr) dentro del área de distribución de D. dorsalis, tomando como referencia los puntos de presencia; además, se incluyó la capa de precipitación.
Se consideró un margen de proyección de 4 grados geográficos a partir de los puntos de presencia más extremos para recortar las superficies climáticas y crear las capas ecofisiológicas. Finalmente, se construyeron los MDS en el programa R (R Development Core Team, 2012) usando la paquetería Biomod2 (Thuiller et al., 2016) para un modelo lineal generalizado (GLM) y un modelo aditivo generalizado (GAM) con 1,000 pseudoausencias. Los modelos se calibraron con una muestra aleatoria del 80% de los datos de presencia y se evaluó la precisión predictiva con el 20% restante, posteriormente fueron validados con base en el criterio de la curva ROC, seleccionando únicamente los modelos con valores mayores a 0.85. En este modelo de nicho climático se aplicó el enfoque del ensamble de modelos (GLM y GAM) implementado en el paquete de R “biomod2”, con el argumento “em.by” de la función “BIOMOD_EnsembleModeling” para proyectar la idoneidad del hábitat de D. dorsalis a lo largo de su distribución (Yuan et al., 2018). Se generaron MDS para el presente, 2050 y 2070 bajo 2 diferentes escenarios de CCG (RCP 4.5 y 8.5) del Instituto Max Planck (MPI-ESM-LR) a una resolución espacial de 30 arc s (~ 1km; Hijmans et al., 2005).
Uno de los principales criterios que se tomaron en cuenta para la selección del modelo MPI-ESM-LR fue la evaluación de Anav et al. (2013), ya que éste funcionó mejor a escala global al proyectar las condiciones climáticas futuras considerando la estructura actual del ciclo del carbono terrestre, la dinámica de la vegetación y cambio de uso de suelo (Giorgetta et al., 2013), por lo que tiene mayor confianza en las proyecciones del cambio climático futuro (Kirchhof et al., 2017), además permite inferir efectos sobre la adaptación, impacto y vulnerabilidad de la especie estudiada. Además, este modelo se ha utilizado ampliamente en trabajos con reptiles (Pontes-da Silva et al., 2018; Sinervo et al., 2017, 2018). Por otro lado, el RCP 4.5 representa un escenario de estabilización, mientras que el RCP 8.5 representa un modelo de alta cantidad de emisiones de gases de efecto invernadero.
Por último, para evaluar el impacto del cambio climático en D. dorsalis se utilizó la fórmula del porcentaje de cambio en el área potencial de la siguiente manera: % de cambio = [(S1-S0)/ S0]*100%, donde S0 es el área adecuada para la especie según el escenario presente y S1 es el área adecuada para la especie en condiciones climáticas futuras (Berriozábal-Islas et al., 2018). Este análisis se realizó en QGIS3 y el umbral de corte según la probabilidad de presencia (ROC) fue de 0.93 para la realización y comparación de los mapas binarios.
Resultados
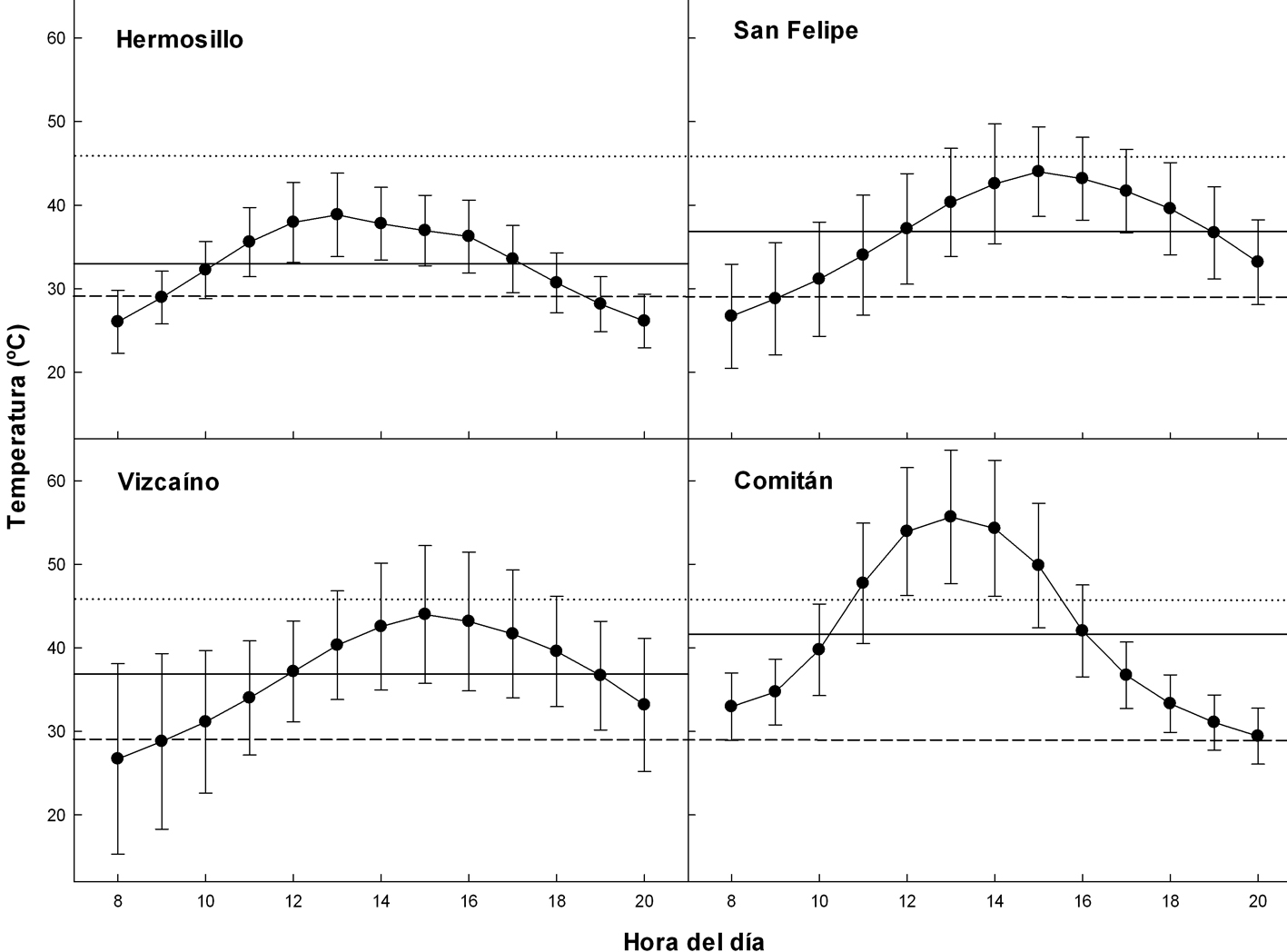
Se recolectaron 129 individuos de D. dorsalis que fueron encontrados mayoritariamente en sustrato arenoso. La Tc de D. dorsalis fue 40.3 ± 0.22 ºC y la Tc más baja y más alta registrada fue 29.2 y 45.9 ºC, respectivamente. Estas temperaturas fueron consideradas como el intervalo voluntario térmico de D. dorsalis para calibrar los modelos ecofisiológicos. El período de actividad observado fue de 09:15 a las 19:10 horas, cuando se observó la primera y la última lagartija en el campo fuera de sus refugios, respectivamente. Este intervalo se utilizó como horario de actividad para calcular las Ha y Hr. La actividad de D. dorsalis comenzó cuando la To fue de 29.5 ºC y terminó cuando llegó a 29.8 °C.
La distribución de la To a lo largo del día en los sitios de estudio se muestra en la figura 2. La figura 3 muestra la tendencia de la To en las 4 localidades. No se realizaron pruebas estadísticas entre la To de las localidades.
Las fórmulas para construir las capas ecofisiológicas de D. dorsalis fueron: Hr = (13.6292)/((1+(6.2512)*exp(-(1.2253)*(Taire-(42.2823))))^(1/(6.25121))) y Ha =(22.1238)/((1+(15.4225)*exp(-(3.5186)*(Taire -(36.0872))))^(1/(15.4225))).
Los modelos de distribución de D. dorsalis mostraron un valor AUC superior a 0.93 y los mapas se muestran en la figura 1. Este modelo ecofisiológico en condiciones ambientales presentes tuvo un área de 208,771.68 km2. Todos los escenarios futuros mostraron un incremento en el área del hábitat adecuado. Bajo el escenario 2050-RCP 4.5 aumentará 89.9% (396,508.46 km2) su distribución, para 2070-RCP 4.5 crecerá un 103.05% (423,917.42 km2), en 2050-RCP 8.5 aumentará 125.02% (469,783.15 km2) y finalmente, para 2070-RCP 8.5, se registró un aumento potencial de 239.39% (708,569.69 km2).
Discusión
La Tc en campo de D. dorsalis en este trabajo (40.3 ± 0.22 ºC) fue similar a las registradas en trabajos previos 37.4 ºC (Cowles y Bogert, 1944) y 42 ºC (Norris, 1953). Asimismo, los límites voluntarios en este trabajo (29.2 y 45.9 ºC) concuerdan con trabajos previos, donde Cowles y Bogert (1944) obtuvieron que la TVmin fue de 27 ºC y TVmax de 41 ºC, mientras que en esta última, Norris (1953) menciona que puede ser de 46.4 ºC. Los valores aquí obtenidos fueron similares a los intervalos publicados para otras especies relacionadas y de ambientes desérticos (Clusella-Trullas et al., 2011; Sinervo et al., 2010).
La actividad reproductora de D. dorsalis inicia después de que emergen de la inactividad invernal (principios de abril; Mayhew, 1971) y los machos presentan testículos en condiciones de reproducción completa en julio, que es el mes más caluroso del año en los desiertos de Norteamérica y según Mayhew (1971), la capacidad de los machos de D. dorsalis para reproducirse durante la parte más calurosa del verano también puede estar presente en otras lagartijas de ambientes desérticos como Uma spp.; sin embargo, D. dorsalis está activo a temperaturas corporales más altas que las registradas por cualquier otro reptil (Brattstrom, 1965; Cowles y Bogert, 1944; Norris, 1953). En la literatura y en el presente trabajo, D. dorsalis ha registrado temperaturas corporales en campo superiores a 45 ºC, incluso dentro de la época de reproducción, por lo que la gametogénesis puede ocurrir a temperaturas más altas que en la mayoría de los vertebrados (Mayhew, 1971). Por lo tanto, D. dorsalis es considerada una especie termófila y altamente tolerante al calor en aspectos fisiológicos, incluso se ha determinado que su temperatura crítica máxima es de 47.5 ºC, mientras que la letal es de 50.5 ºC (Brattstrom, 1965; Cowles y Bogert, 1944).
En este sentido, las especies diurnas del desierto y ampliamente tolerantes al calor podrían ser más resilientes al incremento de la temperatura ambiental según los modelos ecofisiológicos, lo cual se refleja en sus intervalos de actividad térmica y resistencia al calor (Lara-Resendiz et al., 2014), no obstante D. dorsalis frecuentemente mantiene su actividad durante las horas más calientes del día, cuando otras lagartijas se refugian (e.g., Callisaurus draconoides, Phrynosoma mcallii, Aspidoscelis tigris y Uma spp.). Por ejemplo, se han descrito conductas particulares de D. dorsalis asociadas a la termorregulación en situaciones térmicamente extremas, como las posturas elevadas del cuerpo, la cola e incluso los dedos que minimizan el contacto con superficies calientes en altas temperaturas como estrategia de enfriamiento (Weathers, 1970). Además, la conducta de trepar arbustos para tener acceso a temperaturas más frescas (e.g., Larrea tridentata o Fouquieria splendens) ha sido ampliamente discutida como una estrategia importante en la conducta termorreguladora de esta especie (Norris, 1953).
El modelo ecofisiológico de D. dorsalis, al presente, mostró similitud con los modelos previos (Maxent; Valdivia-Carrillo et al., 2017). A pesar de que se ha documentado la prevalencia de efectos negativos ante el cambio climático en los anfibios y reptiles, es importante tener en cuenta que el CCG también puede afectar positivamente a algunas especies o poblaciones (Winter et al., 2016). En este caso, si el CCG (aumento en Tmax) continúa en el noroeste de México y suroeste de EUA, según lo proyectado por la Evaluación Climática del IPCC III (Hijmans et al., 2005), habrá un incremento en el hábitat adecuado para D. dorsalis. Éste es considerado un efecto positivo ya que su distribución podría incrementarse hasta 240% para 2070 en el escenario más extremo. La ampliación mencionada coincide con trabajos previos realizados con herpetofauna de zonas desérticas, donde las lagartijas son consideradas como menos vulnerables en relación con los altos cambios en temperatura proyectados en comparación con serpientes y anfibios (Griffis-Kyle et al., 2018). Varios estudios apoyan la idea de que los ectotermos que habitan en ambientes térmicamente más variables muestran una mayor tolerancia fisiológica al calentamiento, lo que representa una menor vulnerabilidad al CCG en comparación con aquellos que se distribuyen en condiciones estables (Bonebrake y Deutsch, 2012; Deutsch et al., 2008; Huey et al., 2009; Tewksbury et al., 2008; Yuan et al., 2018).
Los principales sitios con alta probabilidad de presencia en escenarios futuros para D. dorsalis son el desierto de Chihuahua (Chihuahua y Nuevo México), expandiéndose hacia el oeste de California, sureste de Utah, sur de Nevada y aumentando considerablemente su distribución dentro del estado de Sonora y la península de Baja California. De acuerdo con estos resultados, proyecciones previas para el suroeste de los EUA, incluidos los desiertos de Chihuahua, Sonora y Mojave, sugieren que se experimentará significativamente más días extremadamente calurosos (> 35 °C); por lo tanto, se prevé que en estas áreas habrá una disminución en la disponibilidad de agua, incluida la descarga de arroyos y la frecuencia de lluvias, afectando la humedad relativa y la humedad del suelo con periodos de sequía prolongados, las cuales afectarán directamente la cobertura vegetal (Garfin et al., 2013; Griffis-Kyle et al., 2018 y sus referencias; Westphal et al., 2016). A pesar de que Sinervo et al. (2010) proyectaron que los efectos más severos del calentamiento climático en lagartijas son debidos a las Hr, Kearney (2013) apuntó a que los efectos más fuertes del calentamiento serán a causa de la baja disponibilidad de sombra. Los modelos climáticos para la región del suroeste de EUA proyectan para el siglo XXI, con un alto grado de confianza, un calentamiento de 2.6 a 4.8 ºC y una disminución en las precipitaciones (Garfin et al., 2013). Por lo que es muy probable que ocurra una reducción de la cobertura vegetal con un aumento de la temperatura y la evapotranspiración.
Estudios futuros deberían considerar el cambio de la cobertura vegetal como la modificación del hábitat, la deforestación, el crecimiento urbano y la pérdida de vegetación (e.g., índice de vegetación de diferencia normalizada) dado que D. dorsalis es principalmente herbívora y sus principales estrategias de termorregulación están relacionadas con la vegetación, principalmente con Larrea spp. (Norris, 1953). Es fundamental incluir estas relaciones bióticas y su adaptación conjunta al CCG para determinar cómo estos factores pueden afectar la sobrevivencia y persistencia de las poblaciones. El modelo empleado en este trabajo fue ecofisiológico y biofísico, ya que permitió incorporar los requerimientos termofisiológicos, periodos de actividad, época de reproducción, variables climáticas, registros de presencia y modelos biofísicos calibrados para D. dorsalis, es por esto que, es altamente probable que los escenarios puedan ser similares para otras especies filogenéticamente relacionadas, aquellas que habitan en simpatría o incluso especies de ambientes ecológicamente similares, aunque es importante destacar que los modelos fueron construidos de acuerdo con aspectos particulares de D. dorsalis. El modelo de estudio en este trabajo fue una especie termófila y de amplia distribución, entonces, estudios futuros deberían ampliar el alcance a nivel poblacional, ontogenético, especies de distribución restringida o estenotérmicas para proporcionar un modelo explícito del riesgo potencial de extinción debido al CCG en zonas áridas.
Existen diversas especies con requerimientos similares de hábitat en los sitios hacia donde podría expandirse la distribución de D. dorsalis. Por lo tanto, es importante considerar que dicha expansión puede ser concomitante con interacciones de competencia y, eventualmente, exclusión de especies que resultan de las interacciones que puedan provocarse, de acuerdo con los mapas proyectados por los escenarios abordados. Es importante considerar a futuro los efectos potenciales sobre las especies, principalmente las de distribución restringida, para definir si pudieran sufrir mermas en su distribución que pongan en riesgo su persistencia. En conclusión, los hallazgos de este estudio demuestran que D. dorsalis es un termorregulador activo, altamente tolerante a temperaturas cercanas a los límites críticos y que tiene un patrón termorregulador que permite el uso efectivo de los microhábitats disponibles. De acuerdo con las variables ecofisiológicas y biofísicas en este trabajo, el CCG podría tener un impacto positivo en esta especie.
Agradecimientos
Este proyecto fue financiado por el Conacyt PDCPN 2015-1319. Lara-Resendiz R. A fue apoyado con una beca postdoctoral Conacyt (1319). Pérez-Delgadillo A. G. fue apoyada por una beca de posgrado Conacyt (817676). Agradecemos el apoyo del CIBNOR (Unidad La Paz y Guerrero Negro [Rigoberto López Amador]), a los laboratorios de Ecología Animal y Ecología del Comportamiento y a los técnicos Abelino Cota Castro y Patricia Vázquez Correa. También a Yolanda Maya, Enrique Troyo, Álvaro Gonzalo y Raúl Martínez, por proporcionar los datos climáticos. A Diego Arenas, Saúl Domínguez, Isaí Valle, Yaredh Ramírez y Giovanna Segundo, por su ayuda en el trabajo de campo. A William Clark, por su ayuda y hospitalidad. Finalmente, a dos revisores anónimos y a Pauline Blaimont por la revisión del inglés. Los permisos de colecta (SGPA/DGVS/08184/16, 02490/17, 06768/17 y 003209/18) fueron emitidos por la Dirección General de Vida Silvestre de México.
Referencias
Adolph, S. C. (1990). Influence of behavioral thermoregulation on microhabitat use by two Sceloporus lizards. Ecology, 71, 315–327. https://doi.org/10.2307/1940271
Anav, A., Friedlingstein, P., Kidston, M., Bopp, L., Ciais, P., Cox, P. et al. (2013). Evaluating the land and ocean components of the global carbon cycle in the CMIP5 earth system models. Journal of Climate, 26, 6801–6843. https://doi.org/10.1175/jcli-d-12-00417.1
Angert, A. L., Sheth, S. N. y Paul, J. R. (2011). Incorporating population-level variation in thermal performance into predictions of geographic range shifts. Integrative and Comparative Biology, 51, 733–750. https://doi.org/10.1093/icb/icr048
Avery, R. A. (1982). Field studies of body temperatures and thermoregulation. En C. Gans y F. H. Pough (Eds.), Biology of the Reptilia (pp. 93–166). New York: Academic Press.
Bakken, G. S. (1992). Measurement and application of operative and standard operative temperatures in ecology. American Zoologist, 32, 194–216. https://doi.org/10.1093/icb/32.2.194
Ballesteros-Barrera, C., Martínez-Meyer, E. y Gadsden, H. (2007). Effects of land-cover transformation and climate change on the distribution of two microendemic lizards, genus Uma, of Northern Mexico. Journal of Herpetology, 41, 733–740. https://doi.org/10.1670/06-276.1
Barrows, C. W. (2011). Sensitivity to climate change for two reptiles at the Mojave-Sonoran Desert interface. Journal of Arid Environments, 75, 629–635. https://doi.org/10.1016/j.jaridenv.2011.01.018
Barrows, C. W., Rotenberry, J. T. y Allen, M. F. (2010). Assessing sensitivity to climate change and drought variability of a sand dune endemic lizard. Biological Conservation, 143, 731–736. https://doi.org/10.1016/j.biocon.2009.12.013
Berk, M. L. y Heath, J. E. (1975). Analysis of behavioral thermoregulation in lizard, Dipsosaurus dorsalis. Journal of Thermal Biology, 1, 15–22. https://doi.org/10.1016/0306-4565(75)90006-6
Berriozábal-Islas, C., Mota, R. J. F., Ramírez-Bautista, A., Becerra-López, J. L. y Nieto-Montes de Oca, A. (2018). Effect of climate change in lizards of the genus Xenosaurus (Xenosauridae) based on projected changes in climatic suitability and climatic niche conservatism. Ecology and Evolution, 8, 6860–6871. https://doi.org/10.1002/ece3.4200
Bonebrake, T. C. y Deutsch, C. A. (2012). Climate heterogeneity modulates impact of warming on tropical insects. Ecology, 93, 449–455. https://doi.org/10.1890/11-1187.1
Brattstrom, B. H. (1965). Body temperatures of reptiles. American Midland Naturalist, 73, 376–422. https://doi.org/10.2307/2423461
Buckley, L. B., Urban, M. C., Angilletta, M. J., Crozier, L. G., Rissler, L. J. y Sears, M. W. (2010). Can mechanism inform species’ distribution models? Ecology Letters, 13, 1041–1054. https://doi.org/10.1111/j.1461-0248.2010.01479.x
Caetano, G., Santos, J. C. y Sinervo, B. (2017). Mapinguari. Recuperado el 20 de agosto, 2018 de: http://github.com/gabrielhoc/Mapinguari
Cahill, A. E., Aiello-Lammens, M. E., Fisher-Reid, M. C., Hua, X., Karanewsky, C. J., Ryu, H. Y. et al. (2013). How does climate change cause extinction? Proceedings of the Royal Society B-Biological Sciences, 280, 1–9. https://doi.org/10.1098/rspb.2012.1890
Chen, I. C., Hill, J. K., Ohlemüeller, R., Roy, D. B. y Thomas, C. D. (2011). Rapid range shifts of species associated with high levels of climate warming. Science, 333, 1024–1026. https://doi.org/10.1126/science.1206432
Clusella-Trullas, S., Blackburn, T. M. y Chown, S. L. (2011). Climatic predictors of temperature performance curve parameters in ectotherms imply complex responses to climate change. American Naturalist, 177, 738–751. https://doi.org/10.1086/660021
Cowles, R. B. y Bogert, C. M. (1944). A preliminary study of the thermal requirements of desert reptiles. Bulletin of the American Museum of Natural History, 83, 263–296. https://doi.org/10.1086/394795
Deutsch, C. A., Tewksbury, J. J., Huey, R. B., Sheldon, K. S., Ghalambor, C. K., Haak, D. C. et al. (2008). Impacts of climate warming on terrestrial ectotherms across latitude. Proceedings of the National Academy of Sciences of the United States of America, 105, 6668–6672. https://doi.org/10.1073/pnas.0709472105
DeWitt, C. B. (1967). Precision of thermoregulation and its relation to environmental factors in the desert iguana, Dipsosaurus dorsalis. Physiological Zoology, 40, 49–66. https://doi.org/10.1086/physzool.40.1.30152438
Dunham, A. E. (1993). Population responses to environmental change: physiologically structured models, operative environments, and population dynamics. En P. M. Kareiva, J. G. Kingsolver y R. B. Huey (Eds.), Biotic interactions and global change (pp. 95–119). Sunderland, Massachusetts: Sinauer. https://doi.org/10.5860/choice.30-6153
Dzialowski, E. M. (2005). Use of operative temperature and standard operative temperature models in thermal biology. Journal of Thermal Biology, 30, 317–334. https://doi.org/10.1016/j.jtherbio.2005.01.005
Flesch, A. D., Rosen, P. C. y Holm, P. (2017). Long-term changes in abundances of Sonoran Desert lizards reveal complex responses to climatic variation. Global Change Biology, 23, 5492–5508. https://doi.org/10.1111/gcb.13813
Garfin, G., Jardin, A., Merideth, R., Black, M. y LeRoy, S. (2013). Assessment of climate change in the Southwestern United States. Washington, D.C.: Island Press. https://doi.org/10.5822/978-1-61091-484-0
Giorgetta, M. A., Jungclaus, J., Reick, C. H., Legutke, S., Bader, J., Böttinger, M. et al. (2013). Climate and carbon cycle changes from 1850 to 2100 in MPI-ESM simulations for the Coupled Model Intercomparison Project phase 5. Journal of Advances in Modeling Earth Systems, 5, 572–597. https://doi.org/10.1002/jame.20038
González-Abraham, C. E., Garcillán, P. P. y Ezcurra, E. (2010). Ecorregiones de la península de Baja California: Una síntesis. Boletín de la Sociedad Botánica de México, 87, 79–92. https://doi.org/10.17129/botsci.302
Griffis-Kyle, K. L., Mougey, K., Vanlandeghem, M., Swain, S. y Drake, J. C. (2018). Comparison of climate vulnerability among desert herpetofauna. Biological Conservation, 225, 164–175. https://doi.org/10.1016/j.biocon.2018.06.009
Grismer, L. L. (2002). Amphibians and reptiles of Baja California, including its Pacific islands and the islands in the Sea of Cortés. Los Angeles: University of California Press. https://doi.org/10.1525/california/9780520224179.001.0001
Güizado-Rodríguez, M. A., Ballesteros-Barrera, C., Casas-Andreu, G., Barradas-Miranda, V. L., Téllez-Valdés, O. y Salgado-Ugarte, I. H. (2012). The Impact of global warming on the range distribution of different climatic groups of Aspidoscelis costata costata. Zoological Science, 29, 834–843. https://doi.org/10.2108/zsj.29.834
Hijmans, R. J., Cameron, S. E., Parra, J. L., Jones, P. G. y Jarvis, A. (2005). Very high resolution interpolated climate surfaces for global land areas. International Journal of Climatology, 25, 1965–1978. https://doi.org/10.1002/joc.1276
Huey, R. B. (1982), Temperature, physiology, and ecology of reptiles. En C. Gans y F. H. Pough (Eds.), Biology of the Reptilia (pp. 25–91). New York: Academic Press.
Huey, R. B., Deutsch, C. A., Tewksbury, J. J., Vitt, L. J., Hertz, P. E., Perez, H. J. A. et al. (2009). Why tropical forest lizards are vulnerable to climate warming? Proceedings of the Royal Society B-Biological Sciences, 276, 1939–1948. https://doi.org/10.1098/rspb.2008.1957
Huey, R. B., Losos, J. B. y Moritz, C. (2010). Are lizards toast? Science, 328, 832–833. https://doi: 10.1126/science.1190374
Jones, L. L. C. y Lovich, R. E. (2009). Lizards of the American Southwest: a photographic field guide. Tucson: Rio Nuevo Publishers.
Kearney, R. M. (2013). Activity restriction and the mechanistic basis for extinctions under climate warming. Ecology Letters, 16, 1470–1479. https://doi.org/10.1111/ele.12192
Kearney, M. y Porter, W. (2009). Mechanistic niche modelling: combining physiological and spatial data to predict species’ ranges. Ecology Letters, 12, 334–350. https://doi.org/10.1111/j.1461-0248.2008.01277.x
Kirchhof, S., Hetem, R. S., Lease, H. M., Miles, D. B., Mitchell, D., Müller, J. et al. (2017). Thermoregulatory behavior and high thermal preference buffer impact of climate change in a Namib Desert lizard. Ecosphere, 8, e02033. https://doi.org/10.1002/ecs2.2033
Krekorian, C. O. (1984). Life-history of the desert iguana, Dipsosaurus dorsalis. Herpetologica, 40, 415–424.
Kubisch, E. L., Corbalán, V., Ibargüengoytía, N. R. y Sinervo, B. (2015). Local extinction risk of three species of lizard from Patagonia as a result of global warming. Canadian Journal of Zoology, 94, 49–59. https://doi.org/10.1139/cjz-2015-0024
Lara-Resendiz, R. A., Gadsden, H., Rosen, P. C., Sinervo, B. y Méndez-de la Cruz, F. (2015). Thermoregulation of two sympatric species of horned lizards in the Chihuahuan Desert and their local extinction risk. Journal of Thermal Biology, 48, 1–10. https://doi.org/10.1016/j.jtherbio.2014.11.010
Lara-Resendiz, R. A., Jezkova, T., Rosen, P. C. y Méndez-de la Cruz, F. R. (2014). Thermoregulation during the summer season in the Goode’s horned lizard Phrynosoma goodei (Iguania: Phrynosomatidae) in Sonoran Desert. Amphibia-Reptilia, 35, 161–172. https://doi.org/10.1163/15685381-00002938
Mayhew, W. W. (1971). Reproduction in the desert lizard, Dipsosaurus dorsalis. Herpetologica, 27, 57–77.
Muth, A. (1980). Physiological ecology of desert iguana (Dipsosaurus dorsalis) eggs – temperature and water relations. Ecology, 61, 1335–1343. https://doi.org/10.2307/1939042
Norris, K. S. (1953). The ecology of the desert iguana Dipsosaurus dorsalis. Ecology, 34, 265–287. https://doi.org/10.2307/1930895
Pereira, H. M., Leadley, P. W., Proenca, V., Alkemade, R., Scharlemann, J. P. W., Fernandez-Manjarres, J. F. et al. (2010). Scenarios for global biodiversity in the 21st century. Science, 330, 1496–1501. https://doi.org/10.1126/science.1196624
Pontes-da Silva, E., Magnusson, W. E., Sinervo, B., Caetano, G. H., Miles, D. B., Colli, G. R. et al. (2018). Extinction risks forced by climatic change and intraspecific variation in the thermal physiology of a tropical lizard. Journal of Thermal Biology, 73, 50–60. https://doi.org/10.1016/j.jtherbio.2018.01.013
R Development Core Team. (2012). R: a language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. http://www.Rproject.org
Sinervo, B., Lara-Reséndiz, R. A., Miles, D. B., Lovich, J. E., Ennen, J. R., Müller, J. et al. (2017). Climate change and collapsing thermal niches of Mexican endemic reptiles. White paper for the environmental working group of the UC-Mexico initiative, University of California. Available at: http://escholarship.org/uc/item/4xk077hp
Sinervo, B., Méndez-de la Cruz, F., Miles, D. B., Heulin, B., Bastiaans, E., Villagrán-Santa Cruz, M. et al. (2010). Erosion of lizard diversity by climate change and altered thermal niches. Science, 328, 894–899. http://doi.org/10.1126/science.1184695
Sinervo, B., Miles, D. B., Wu, Y., Méndez-de la Cruz, F. R., Kirchoff, S. y Qi, Y. (2018). Climate change, thermal niches, extinction risk and maternal-effect rescue of Toad-headed lizards, Phrynocephalus, in thermal extremes of the Arabian Peninsula to the Tibetan Plateau. Integrative Zoology, 13, 450–470. https://doi.org/10.1111/1749-4877.12315
Stebbins, R. C. (2003). A field guide to western reptiles and amphibians. Third edition. Boston: Houghton Mifflin Company. https://doi.org/10.2307/1442166
Tewksbury, J. J., Huey, R. B. y Deutsch, C. A. (2008). Putting the heat on tropical animals. Science, 320, 1296–1297. https://doi.org/10.1126/science.1159328
Thuiller, W., Georges, D., Engler, R. y Breiner, F. (2016). biomod2:Ensemble platform for species distribution modeling. Rpackage version 3.1-7. http://CRAN.R-project.org/package=biomod2
Valdivia-Carrillo, T., García-De León, F. J., Blázquez, M. C., Gutiérrez-Flores, C. y González-Zamorano, P. (2017). Phylogeography and ecological niche modeling of the desert iguana (Dipsosaurus dorsalis, Baird & Girard 1852) in the Baja California Peninsula. Journal of Heredity, 108, 640–649. https://doi.org/10.1093/jhered/esx064
Weathers, W. W. (1970). Physiological thermoregulation in the lizard Dipsosaurus dorsalis. Copeia, 1970, 549–557. https://doi.org/10.2307/1442284
Westphal, M. F., Stewart, J. A. E., Tennant, E. N., Butterfield, H. S. y Sinervo, B. (2016). Contemporary drought and future effects of climate change on the endangered blunt-nosed leopard lizard, Gambelia sila. Plos One, 11, e0154838. https://doi.org/10.1371/journal.pone.0154838
Winter, M., Fiedler, W., Hochachka, W. M., Koehncke, A., Meiri, S. y De la Riva, I. (2016). Patterns and biases in climate change research on amphibians and reptiles: a systematic review. Royal Society Open Science, 3, 160158. https://doi.org/10.1098/rsos.160158
Yuan, F. L., Freedman, A. H., Chirio, L., LeBreton, M. y Bonebrake, T. C. (2018). Ecophysiological variation across a forest-ecotone gradient produces divergent climate change vulnerability within species. Ecography, 41, 1627–1637. https://doi.org/10.1111/ecog.03427



