Celene Espadas-Manrique, Martin Linares, Roger Orellana, Stephany Peniche-Aké y Casandra Reyes-García *
Unidad de Recursos Naturales, Centro de Investigación Científica de Yucatán, A.C., Calle 43 Núm. 130, Col. Chuburná de Hidalgo, 97205 Mérida, Yucatán, México
*Autor para correspondencia: creyes@cicy.mx (C. Reyes-García)
Recibido: 19 marzo 2020; aceptado: 10 junio 2020
Resumen
Beaucarnea pliabilis es una especie endémica de la península de Yucatán, clasificada en 1994 por la NOM-059-ECOL-1994 como amenazada debido a su fuerte extracción con fines comerciales y a la fragilidad de su hábitat. Si bien en los últimos años ha habido esfuerzos para su propagación ex situ, la destrucción de su hábitat ha avanzado. El objetivo de este estudio fue aplicar el “Método de evaluación de riesgo de especies silvestres en México” (MER) para poder revalorar la clasificación de esta especie. Se caracterizaron morfología y demografía de 6 poblaciones de B. pliabilis y se utilizaron series del INEGI para evaluar los cambios en el uso de suelo y su distribución utilizando bases de datos cercanos a su primera clasificación y al presente. Información adicional fue obtenida de herbarios y de la literatura. El valor total obtenido del MER fue de 2.312, lo cual, por estar encima de 2, la ubica en la categoría de “en peligro de extinción”. Las principales causas son la destrucción de su hábitat y su extracción, también por ser dioica y sin reproducción clonal, que dificultan su reproducción en condiciones naturales.
Palabras clave: Norma Oficial Mexicana; Conservación; Selva baja caducifolia; Cambio de uso de suelo; Deforestación; Degradación ambiental; Peligro de extinción
© 2020 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Evaluation of the extinction risk of Beaucarnea pliabilis (Asparagaceae) (despeinada or tsiipil), an endemic species of the Yucatan Peninsula
Abstract
Beaucarnea pliabilis, an endemic species from the Yucatán Peninsula, was classified in 1994 as a threatened species under the NOM-059-ECOL-1994 due to its fragile environment and its increasing extraction for commerce. Although ex situ reproduction efforts have been carried out in the past years, habitat destruction has advanced. This study aimed to apply the official methodology (MER, Método de evaluación de riesgo de especies silvestres en México) in order to update the status of the species. Population structure, size and morphological variability were assessed at 6 sites. using open access databases from INEGI to evaluate changes in land use and distribution contrasting current conditions with those present under the previous assessment. Additional data were obtained from herbaria and published accounts. The total value of MER obtained was 2.312, which being above 2, leaves the species as “endangered”. The main cause of the reclassification is habitat loss and fragmentation, but also because it is dioecious without clonal reproduction, a condition that hinders its reproduction in the wild.
Keywords: Mexican Official Norm; Conservation; Seasonally dry forest; Land use change; Deforestation; Habitat degradation; Brink of extinction
© 2020 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
Las especies del género Beaucarnea (Asparagaceae Juss.: Nolinoideae Burnett.), también conocidas comúnmente como “patas de elefante”, son especies conspicuas en su hábitat natural y son muy cotizadas como ornamentales a nivel mundial. Al igual que ocurre en la mayoría de las especies del género, Beaucarnea pliabilis (Baker) Rose, se encuentra amenazada debido a la pérdida de su hábitat, distribución restringida en hábitats concretos y lento crecimiento, que se suman a factores como la extracción de semillas, plántulas y adultos del medio natural (Golubov et al., 2007; Hernández-Sandoval, 1993; Hernández-Sandoval et al., 2012). Lo anterior se debe a la demanda con fines ornamentales y comerciales, exacerbando su fragilidad y poniendo en riesgo su permanencia. En 1994, B. pliabilis, junto con otras 6 especies del género (B. gracilis, B. goldmanii, B. hiriartiae, B. purpusii, B. recurvata, y B. stricta), fue incluida en la lista de especies amenazadas de la Norma Oficial Mexicana (NOM-059-ECOL-1994). Esta categoría se aplica a especies que “podría(n) llegar a encontrarse en peligro de extinción si siguen operando factores que ocasionen el deterioro o modificación del hábitat o disminución de sus poblaciones” (Diario Oficial de la Federación, 1994). En el entendido de que especie amenazada es equivalente a especie vulnerable. En la última edición de la NOM-059, se incluyeron a B. sanctomariana y B. inermis, mientras que B. purpusii cambió a categoría de especie en peligro de extinción (Semarnat, 2010). No habiendo estudios que actualicen el estatus de conservación de B. pliabilis, ésta continúa en la categoría de especie amenazada.
Ante los registros de decomisos de miles de ejemplares del género Beaucarnea y ante la problemática de su extracción indiscriminada e ilegal en campo, la Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (Conabio) promovió la inclusión de este grupo de especies en el apéndice II del acuerdo de la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES, 2017; Golubov et al., 2007; Hernández-Sandoval, 1993; Hernández-Sandoval et al., 2012; Reyes-Santiago, 2009). No obstante el registro de estas especies en la NOM-059 y en el CITES, continúan operando factores que ocasionan la pérdida de hábitat y la disminución de sus poblaciones.
Beaucarnea pliabilis es arbustiva de lento crecimiento, alcanza 18 m de altura en comunidades conservadas. Forma parte de un grupo de monocotiledóneas que se distinguen por la base del tallo ensanchada, globosa o cónica y corteza fisurada con placas poligonales grises que semejan patas de elefante, hojas dispuestas en rosetas apicales e inflorescencias con flores unisexuadas (Hernández-Sandoval et al., 2012). Al igual que otras especies de este género, se distribuye en forma de “demes” en una gran matriz climática y edáfica ocupando hábitats específicos en las selvas bajas caducifolias y medianas subcaducifolias de la península de Yucatán, ecosistemas que han sido reportados entre los más perturbados por las actividades humanas (Hernández-Sandoval et al., 2012; Janzen, 1988; Trejo y Dirzo, 2000).
Beaucarnea pliabilis es endémica de la provincia biogeográfica península de Yucatán (Carnevali et al., 2010; Durán et al., 1998). Esta especie se ha registrado principalmente en la selva baja caducifolia y en la selva baja espinosa, una variante más xerófila donde destacan elementos candelabriformes de Cactaceae y donde se han registrado, a nivel peninsular, un mayor número de especies de plantas endémicas, así como en las selvas subcaducifolias y subperennifolias (Espadas-Manrique et al., 2003). En México, estos tipos de vegetación han sufrido una degradación de más de 50% de su superficie a una tasa anual de pérdida de 10,000 a 20,000 ha (Cuevas et al., 2010). En los estados mexicanos de la península de Yucatán, se estima que la mayor extensión de vegetación remanente se encuentra en estado secundario. En Yucatán, la vegetación primaria o conservada, es de 5.5%, en tanto que en Quintana Roo y Campeche, la extensión estimada es 38% y 32%, respectivamente (Semarnat, 2016).
La despeinada o tsiipil, como se conoce localmente a la especie B. pliabilis, es utilizada como planta ornamental en pueblos y ciudades de la península de Yucatán. En el municipio de Mérida se ha estimado que en las calles, avenidas, parques y casas, hay 2,318,000 árboles, de los cuales las despeinadas representan 1.1% (De la Concha et al., 2017). Pero, en el campo, la continua transformación y pérdida de las selvas que son hábitat de esta especie alteran su frecuencia y su área de distribución.
Con base en lo anterior, el objetivo de este trabajo fue evaluar el riesgo de extinción de B. pliabilis en el territorio mexicano mediante el “Método de evaluación de riesgo en especies silvestres en México” (MER-Plantas) (Semarnat, 2010), con la finalidad de actualizar el estado de conservación de la especie. Este método consiste en la evaluación de 4 criterios, que tienen como finalidad justificar de modo técnico-científico la propuesta de confirmación o cambio de categoría, en este caso de B. pliabilis en la NOM-059-SEMARNAT-2010. Los criterios son: a) características de la distribución geográfica, b) características del hábitat, c) vulnerabilidad biológica intrínseca y d) impacto de la actividad humana. Los criterios del MER deben ser valorados y jerarquizados con base en la mejor información disponible y documentada, la cual debe ser ajustada a los puntajes establecidos en cada uno de los criterios (Tambutti et al., 2001).
Materiales y métodos
Para poder evaluar el estado de conservación de las poblaciones de Beaucarnea pliabilis, se aplicó el Método de Evaluación de Riesgo de Extinción de Plantas en México (MER-Plantas) (Semarnat, 2010). Este método constituye la herramienta reconocida para situar a la especie de estudio dentro de una de las categorías de la NOM-059 (Sánchez-Salas et al., 2013). Las categorías de riesgo, en peligro de extinción (P), amenazada (A) o sujeta a protección especial (Pr), son asignadas mediante la sumatoria de los puntos en cada criterio, normalizada con el puntaje máximo para ese criterio, de tal forma que el valor máximo sea 1 (Semarnat, 2010). Una mayor puntuación indica un mayor riesgo de extinción, y aquellos subcriterios para los cuales no se cuente con información deben recibir el valor de cero.
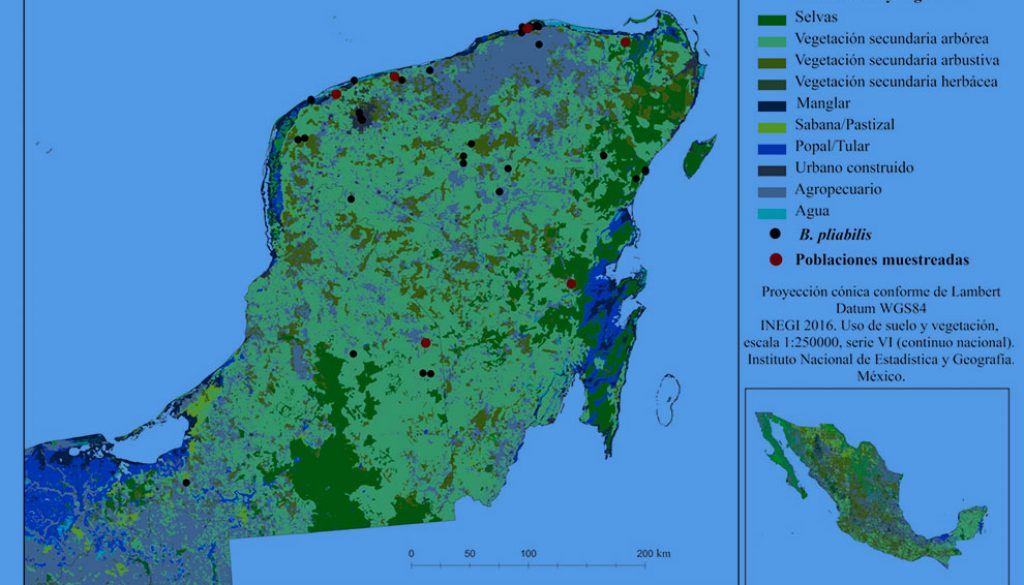
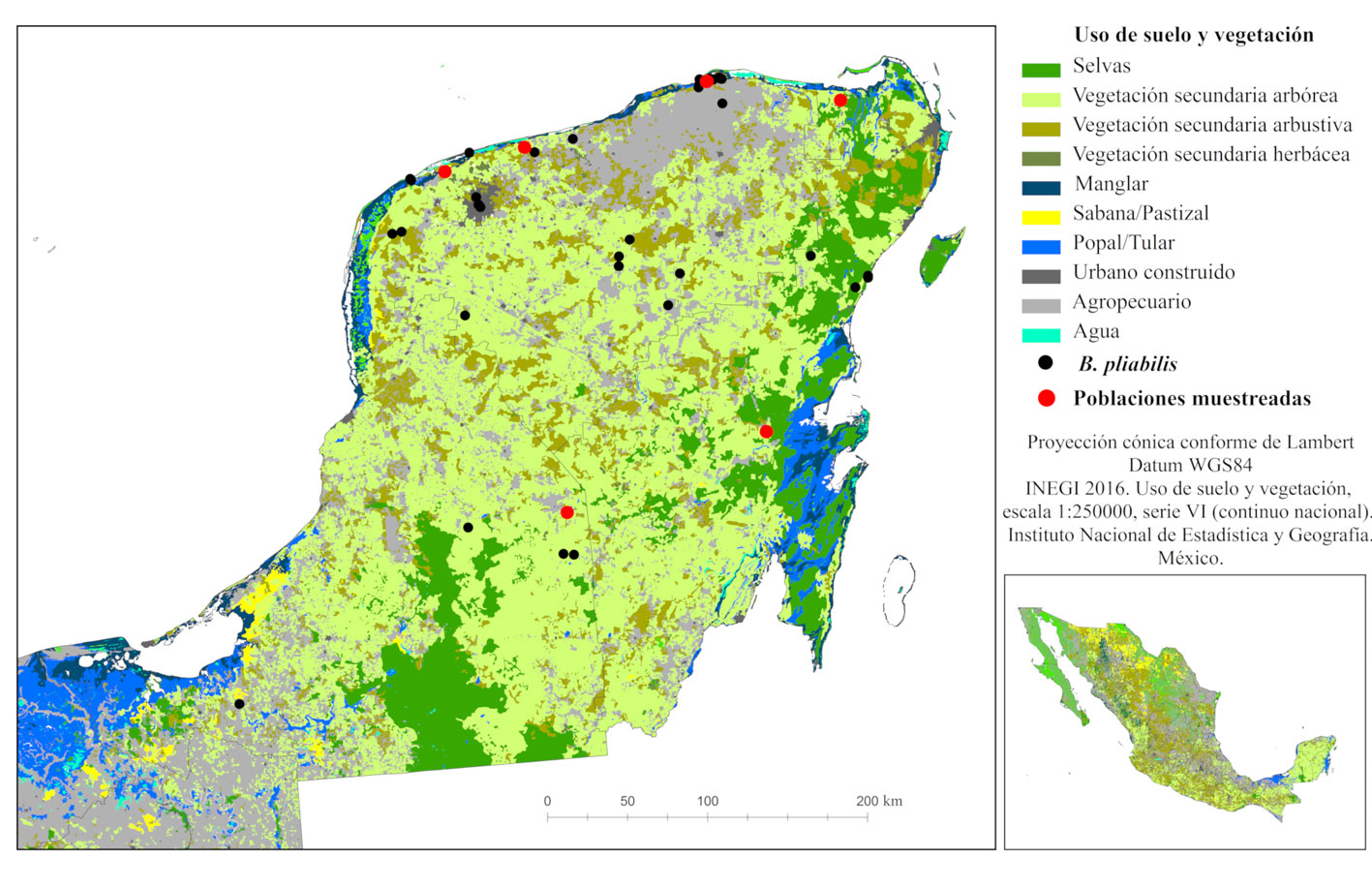
Se recabó información de la ubicación de la especie utilizando datos de herbarios nacionales e internacionales: CAS, CICY, ENCB, F, GH, K, LL, MEXU, MICH, MO, NY, UAT, US y XAL (Holmgren y Holmgrem, 2020). Se realizaron salidas de campo a lo largo de la península de Yucatán para verificar o descartar la presencia de las poblaciones. De manera adicional, se evaluaron 6 poblaciones distribuidas a lo largo de la península, para tener estimaciones de la demografía, ecología y variabilidad morfológica de la especie. Las poblaciones evaluadas son referidas con las siglas de las localidades más cercanas al sitio, CHI (Chiquilá, Q. Roo), DZE (Dzemul, Yuc.), FCP (Felipe Carrillo Puerto, Q. Roo), RL (Río Lagartos, Yuc.), SP (Sierra Papacal, Yuc.) y XMA (Xmabén, Camp.) (fig. 1). En cada sitio se delimitó un transecto de 100 × 10 m donde se contaron los individuos presentes, categorizándolos de acuerdo con su etapa de desarrollo (adultos, juveniles o plántulas). Las plántulas se definieron como aquellos individuos donde aún no había evidencia de suberización y ensanchamiento del tallo, en éstas sólo se podían observar hojas y un pequeño bulbo verde en la base. Los juveniles se definieron como aquellos individuos con suberización y ensanchamiento del tallo, pero con altura menor a 1 m. Los restantes se definieron como adultos. En los individuos adultos, se midieron el diámetro de la base del tallo y la altura total. También, se registraron observaciones de las condiciones de las poblaciones para identificar daño estructural o presencia de parásitos, tipo de suelo, pedregosidad, tipo de vegetación y su estado de conservación, distancia a carreteras y zonas de producción agropecuaria. Adicionalmente, se listaron las especies de flora presentes.
Evaluación de Criterios del Anexo Normativo II,
Método de evaluación del riesgo de extinción de plantas en México
Criterio A. Características de la distribución geográfica. Subcriterio A-1), extensión de la distribución. Se consultaron los registros de presencia de la especie en los herbarios. Los registros de presencia de la especie en la península de Yucatán fueron superpuestos al mapa de uso de suelo y vegetación Serie VI del INEGI (2016), se descartaron aquellos que se encuentran en zonas urbanas o de uso agropecuario. La superficie ocupada por B. pliabilis fue estimada con base en la extensión de los remanentes de vegetación primaria que son hábitat de esta especie. También se consideró para la estimación el trabajo en campo. Subcriterio A-2), número de poblaciones o localidades conocidas existentes. Las localidades de los sitios de presencia se superpusieron a un mapa 1:4,000,000 para discernir las poblaciones. También, los registros se superpusieron a las cartas de uso de suelo y vegetación del INEGI Serie II (INEGI, 2001) y Serie VI (INEGI, 2016) para identificar las poblaciones remanentes. Los períodos fueron seleccionados considerando la fecha de inclusión de la especie en la NOM-059-ECOL-1994 como especie amenazada y una fecha reciente para su comparación. Para estimar el aislamiento geográfico entre las poblaciones, se calculó espacialmente la distancia euclidiana entre las 6 poblaciones silvestres muestreadas. Subcriterio A-3), número de provincias biogeográficas en las que se encuentra el taxón (distribución histórica). Los registros conocidos se superpusieron al mapa de provincias biogeográficas (Conabio, 1997). La representatividad de la distribución de B. pliabilis en el territorio mexicano se estimó considerando el área de distribución biogeográfica conocida para esta especie.
Criterio B. Características del hábitat. Subcriterio B-1), ¿en cuántos tipos de vegetación se presenta? Los registros conocidos de B. pliabilis se superpusieron al mapa de vegetación potencial de Rzedowski (1990) para identificar los tipos de vegetación donde se presenta. Los subcriterios B-2), ¿el taxón tiene un hábitat especializado? B-3), ¿la permanencia de la población es dependiente de un hábitat primario? y B-4), ¿la permanencia de la población requiere de regímenes de perturbación particulares o está asociada a etapas transitorias en la sucesión? fueron respondidos con base en la revisión bibliográfica y mediante la caracterización biofísica de las poblaciones conocidas, empleando mapas temáticos de suelo, clima y características geomorfológicas de la península de Yucatán (Bautista et al., 2005; INEGI, 2008; Inifap-Conabio, 1995).
Criterio C. Vulnerabilidad biológica intrínseca. Subcriterio C-1), demografía. El número total de individuos, reclutamiento y densodependencia fueron estimados en las 6 poblaciones silvestres caracterizadas de B. pliabilis. Los datos recabados fueron analizados estadísticamente para estimar la densidad poblacional y la relación entre la altura y el diámetro de la base de las poblaciones. Subcriterio C-2, genética. Para este subcriterio no se cuenta con estudios genéticos por lo que sólo se estimó el nivel de diferenciación entre poblaciones, con base en caracteres morfológicos de las 6 poblaciones caracterizadas. Subcriterio C-3), interacciones bióticas especializadas. La información biológica de B. pliabilis relacionada con su reproducción y propagación fue obtenida de Hernández- Sandoval et al. (2012).
Criterio D. Impacto de la actividad humana. Subcriterio D-1), ¿cómo afecta al taxón la alteración antrópica del hábitat?, D-2), ¿cuál es el nivel de impacto de las actividades humanas sobre el hábitat del taxón?, y D-3), ¿existe evidencia que indique un deterioro en la calidad o extensión del hábitat como efecto de cambios globales o se prevé un cambio drástico en el uso del suelo? Para actualizar el nivel de impacto de las actividades humanas sobre el hábitat de B. pliabilis se generaron espacialmente áreas de influencia a distancias de 0.1, 1, 2 y 3 km de cada una de las 6 poblaciones caracterizadas en campo. En las áreas de influencia se estimó la superficie de uso de suelo y la vegetación presente, reportada en cartografía del INEGI Serie II (INEGI, 2001) y Serie VI (INEGI, 2016); también se estimó la distancia a carreteras, densidad de vías de comunicación y distancia a localidades urbanas y rurales. Los subcriterios D-4), ¿cuál es el impacto del uso sobre el taxón? y D-5), ¿el taxón es cultivado o propagado ex situ? Fueron respondidos con base en una revisión bibliográfica.
Resultados
Índice de Rareza
Criterio A. Características de la distribución geográfica. Subcriterio A-1), extensión de la distribución. Los datos de herbario y de campo confirmaron que Beaucarnea pliabilis es endémica de la provincia biogeográfica península de Yucatán, cuya principal área de distribución se encuentra en los estados mexicanos de Campeche, Quintana Roo y Yucatán, en el Petén guatemalteco y al norte de Belice. En lo que respecta a México, los 3 estados representan 7.2% de la superficie total del país.
Los tipos de selvas donde habita B. pliabilis, en las últimas décadas, han reducido su cobertura en el país y en la península de Yucatán, donde su extensión es menor a 1% con respecto al territorio nacional (tabla 1). Solo en caso de la selva baja caducifolia, se presentó un ligero aumento del 0.001%, correspondiente a la regeneración de la selva en ese periodo. La mayoría de las localidades donde fueron colectados u observados ejemplares de B. pliabilis han sido transformados en uso de suelo de tipo agropecuario y urbano. Actualmente, los remanentes de las poblaciones se restringen a parches de vegetación secundaria arbórea y de selva mediana subperennifolia. En la península de Yucatán, la vegetación secundaria arbórea ocupaba, en 2001, una extensión de 2.63% con respecto a la superficie continental del país y, recientemente (datos del 2016), se estima que ocupa 1.92%. Con esta información, se le asigna un valor de 3 al criterio A1 (tabla 2).
Subcriterio A-2), número de poblaciones o localidades conocidas existentes. Con base en las colecciones de herbarios, la especie se ha distribuido en 17 municipios de la península de Yucatán, que podrían corresponder a alrededor de 15 poblaciones. Pero el cambio de uso de suelo ha impactado las poblaciones y actualmente se pueden encontrar en aproximadamente 10 localidades en la península (fig. 1). La pérdida y transformación de las selvas primarias ha ocasionado la fragmentación y aislamiento de poblaciones de B. pliabilis. Es importante resaltar que es una especie dioica, que sus poblaciones han sido severamente saqueadas y que se desconoce en las poblaciones remanentes la proporción de sexos. Para estimar la distancia entre las poblaciones remanentes, seleccionamos 6 sitios que se encuentran en parches de vegetación secundaria arbórea y en un parche de selva mediana subperennifolia, la distancia más corta entre ellas es de 51.9 km, con una distancia promedio entre las poblaciones de alrededor de 200 km (tabla 3). Dada esta densidad de las poblaciones, que corresponde a 4-8 poblaciones visibles en un mapa a una escala 1:4,000,000, se le asignó un valor de 2 al subcriterio A-2 (tabla 2).
Subcriterio A-3), número de provincias biogeográficas en las que se encuentra el taxón. Históricamente, las poblaciones de esta especie se distribuían ampliamente en 2 de las 19 provincias biogeográficas de México (Conabio, 1997): Yucatán y Petén que representan 6.8% de la superficie del país (fig. 2). El mayor número de recolectas se registró en la selva baja caducifolia y en la selva mediana subcaducifolia de la provincia Yucatán, sobre suelos rocosos y formando asociaciones con especies características de estas selvas como las cactáceas candelabriformes, Actualmente, ya no se encuentran las poblaciones registradas en la selva mediana subcaducifolia, debido a la transformación de su hábitat para uso agropecuario. Por lo anterior, se le asignó un valor de 2 al subcriterio A-3 (tabla 2).
Tabla 1
Tipos de selva que han sido hábitat de Beaucarnea pliabilis y su extensión en México y en la península de Yucatán, expresada en porcentaje con respecto al territorio nacional. Los datos comparan la serie INEGI de 2001, que representa el estado del hábitat cuando se clasificó B. pliabilis como amenazada, y la serie de 2016, que es la más reciente.
| Tipos de selva | México
(%) |
Península de Yucatán (%) | ||
| 2001 | 2016 | 2001 | 2016 | |
| Baja caducifolia | 3.552 | 3.183 | 0.000 | 0.001 |
| Baja espinosa caducifolia | 0.113 | 0.106 | 0.000 | 0.000 |
| Baja subcaducifolia | 0.025 | 0.014 | 0.017 | 0.010 |
| Mediana caducifolia | 0.073 | 0.069 | 0.000 | 0.000 |
| Mediana subcaducifolia | 0.278 | 0.207 | 0.042 | 0.037 |
| Mediana subperennifolia | 0.876 | 0.735 | 0.809 | 0.658 |
| Total | 4.917 | 4.314 | 0.868 | 0.706 |
Tabla 2
Criterios del método de evaluación de riesgo de extinción de plantas en México (MER) (Semarnat, 2010) aplicado a Beaucarnea pliabilis.
| Tabla 2
Continuación |
|
| I. Índice de rareza | |
| Criterios/Subcriterios | Puntaje |
| I. Índice de rareza | |
| Criterios/Subcriterios | Puntaje |
| Criterio A. Características de la distribución geográfica | |
| 1) Las poblaciones del taxón se distribuyen en parches de vegetación de selvas caducifolias y subcaducifolias de la península de Yucatán, ocupando una superficie de más de 1 km, pero < 1% del territorio nacional | 3 |
| 2) Las poblaciones o localidades conocidas existentes que pueden ser discernibles en un mapa a una escala 1:4000000 son entre 4 a 8 | 2 |
| 3) Las poblaciones conocidas se encuentran en 2 provincias biogeográficas | 2 |
| 4) El taxón es endémico a este país, por lo que su distribución es no periférica o extra-limital | 0 |
| Suma | 7/11 |
| Criterio B. Características del hábitat | |
| 1) Las poblaciones conocidas de la especie se encuentran en 3 tipos de vegetación potencial | 1 |
| 2) Aunque la especie ha sido reportada en casi todos los tipos de vegetación potencial clasificados para la península de Yucatán, localmente se restringe a ciertos tipos de hábitat dentro de los parches de vegetación | 0 |
| 3) La permanencia de la población es dependiente de un hábitat primario | 1 |
| 4) La permanencia de la población no requiere de regímenes de perturbación particulares o está asociada a etapas transitorias en la sucesión | 0 |
| 5) La amplitud del intervalo altitudinal que ocupa el taxón es menor a 200 m | 3 |
| Suma | 5/9 |
| Criterio C. Vulnerabilidad biológica intrínseca | |
| C-1. Demografía | |
| 1) El número total de individuos se estima entre 501-5,000 | 2 |
| 2) Existen observaciones de reclutamiento en algunas poblaciones | 2 |
| 3) Atributos demográficos:
a) No hay evidencia de denso-dependencia en la reproducción b) No hay clonalidad c) Si hay evidencia de decrecimiento de las poblaciones en el país d) Si hay evidencia de una varianza muy grande en la fecundidad e) El taxón es dioico f) La floración es sincrónica o gregaria g) El taxón produce propágulos abundantes |
0
1 1 1 1 1 0 |
| C-2. Genética | |
| 1) Cantidad de variación genética molecular | Sin datos |
| 2) Estructura genética molecular | Sin datos |
| 3) Variación molecular | Sin datos |
| 4) Existe alta diferenciación morfológica entre poblaciones | 1 |
| C-3. Interacciones bióticas especializadas | |
| 1) Es muy factible que el taxón requiera una “nodriza” para su establecimiento | 1 |
| 2) El taxón no requiere un hospedero o forofito específico | 0 |
| 3) El taxón no requiere un polinizador específico | 0 |
| 4) El taxón no tiene un dispersor específico | 0 |
| 5) El taxón no presenta mirmecofilia obligada | 0 |
| 6) No hay evidencia de dependencia estricta de la micorriza | 0 |
| 7) El taxón sufre una afectación importante por depredadores y patógenos | 1 |
| Suma | 12/23 |
| Subtotal Índice | 1.718 |
| II. Índice de impacto antropogénico | |
| Criterios/subcriterios | Puntaje |
| Criterio D. Impacto de la actividad humana | |
| 1) El taxón es perjudicado por el disturbio en su hábitat | 1 |
| 2) El impacto del disturbio es fuerte y afecta a todas las poblaciones | 3 |
| 3) Existe evidencia que indica un deterioro en la calidad y extensión del hábitat como efecto de cambios globales (aumento del nivel del mar) y se prevé un cambio drástico en el uso del suelo | 1 |
| 4) El impacto del uso (extracción) sobre el taxón es fuerte en algunas poblaciones | 2 |
| 5) El taxón ha sido cultivado y propagado ex situ | -1 |
| Suma | 6/10 |
| Subtotal Índice | 0.6 |
| Total | 2.312 |
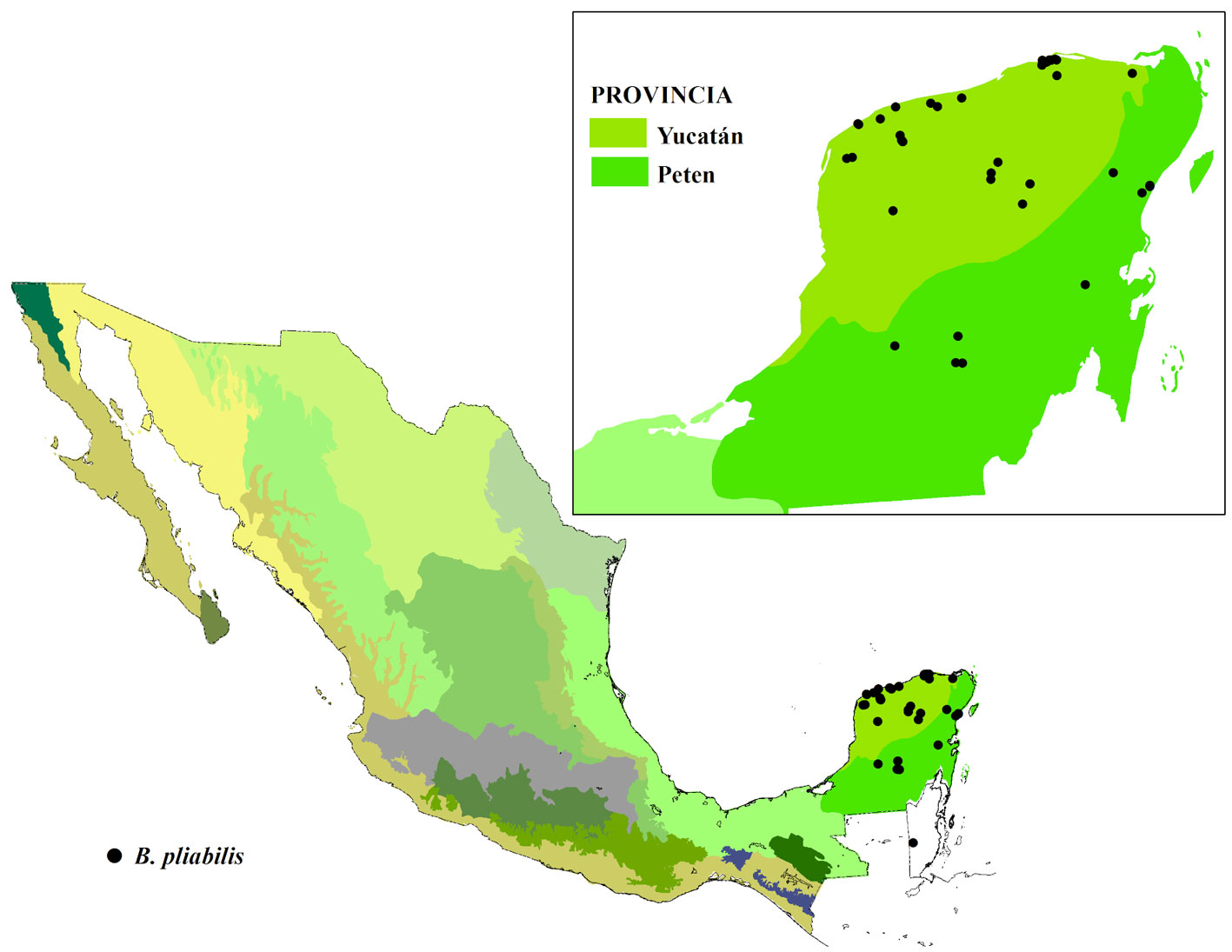
Tabla 3
Distancias (km) entre poblaciones de Beaucarnea pliabilis de las localidades Chiquilá (CHI), Dzemul (DZE), Felipe Carrillo Puerto (FCP), sierra Papacal (SP), Río Lagartos (RL) y Xmabén (XMA).
| CHI | DZE | FCP | SP | RL | XMA | |
| CHI | 0.0 | 199.7 | 212.1 | 251.2 | 84.4 | 308.9 |
| DZE | 199.7 | 0.0 | 233.4 | 51.9 | 121.1 | 134.4 |
| FCP | 212.1 | 233.4 | 0.0 | 258.3 | 221.9 | 134.4 |
| SP | 251.2 | 51.9 | 258.3 | 0.0 | 173.0 | 226.1 |
| RL | 84.4 | 121.1 | 221.9 | 173.0 | 0.0 | 282.9 |
| XMA | 308.9 | 229.7 | 134.4 | 226.1 | 282.9 | 0.0 |
En cuanto a la representatividad de la distribución de B. pliabilis en México, la especie es endémica del país, por lo que las poblaciones forman parte de una distribución periférica o extralimital. Se le asigna un valor de 0 al subcriterio A-4 (tabla 2). Al sumar los valores de impacto de los subcriterios, obtenemos que para el criterio A, suman 7 de un máximo de 11.
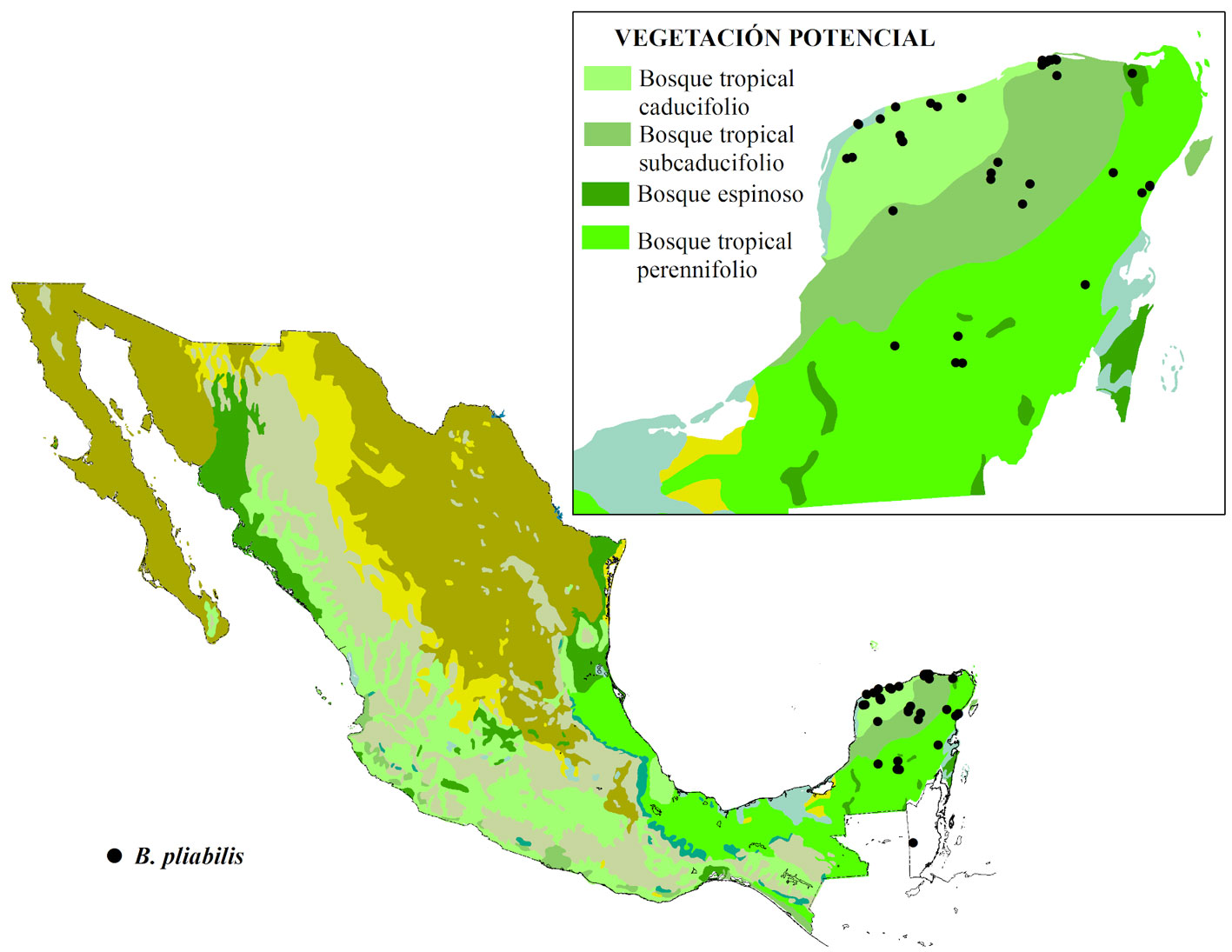
Criterio B. Características del hábitat. Subcriterio B-1), ¿en cuántos tipos de vegetación se presenta? La especie se puede encontrar en 3 tipos de vegetación potencial reconocidas por Rzedowski (1990), en los bosques tropical caducifolio, tropical subperennifolio y en el bosque espinoso de la península de Yucatán (fig. 3); estos tipos de vegetación representan una extensión potencial de 4.6%, 0.15% y 4.6%, respectivamente, con respecto al territorio nacional. Históricamente, la distribución de B. pliabilis abarcaba también el bosque tropical subcaducifolio, pero éste ha sido transformado a coberturas de uso agropecuario y urbano. Se le asigna un valor de 1 al subcriterio B-1 (tabla 2).
Subcriterio B-2), ¿el taxón tiene un hábitat especializado? Miranda (1959) señaló que era frecuente encontrar a esta especie en 2 variantes de la selva baja decidua (renombrada como selva baja caducifolia en 1963 por este autor), en la selva baja decidua con cactáceas candelabriformes que se extendía en una franja de 10 a 15 km y paralela a la costa, desde el sur de Telchac Puerto hasta Sisal, y en la selva baja decidua con Pseudophoenix sargentii H. Wendl. ex Sarg. que se extendía paralela a la costa, cerca de Puerto Juárez, Quintana Roo y cerca de El Cuyo, Yucatán. En la década pasada, se señaló su presencia de modo preferente en la asociación “guayacán” y de modo dominante en la asociación “despeinada” de selva mediana subcaducifolia, donde comparten la dominancia con especies como el Guaiacum sanctum L., Lysiloma latisiliqua A. Gray ex Sauvalle y Metopium brownei (Jacq.) Urb. (Martínez y Galindo-Leal, 2002).
Las selvas bajas inundables también han sido reportadas como hábitat de B. pliabilis. En una matriz de selva baja inundable de Celestún, Yucatán, se han encontrado individuos de B. pliabilis en altillos con selva baja caducifolia, donde comparten el hábitat con Plumeria obtusa L., Nopalea gaumeri Britton et Rose y Sabal yapa C. Wright ex Becc., y en entre las localidades Sierra Papacal y Chuburná Puerto. En Yucatán se han reportado en parches de selva baja caducifolia localizadas en medio de pastizales y ciperáceas inundables, donde comparte el hábitat con otras especies endémicas como Furcraea cahum Trel. y Nopalea gaumeri Britton et Rose (Hernández-Sandoval et al., 2012). También, se ha registrado de modo notable en la asociación mixta de la vegetación de “Bajos” de Calakmul (Martínez y Galindo, 2002).
Las poblaciones se encuentran en sitios con alto porcentaje de pedregosidad, exclusivamente de roca caliza, en suelos escasos de tipo litosol y de rendzina principalmente, y en paisajes con cierta homogeneidad morfogenética y ambiental (Bautista et al., 2005; Inifap-Conabio, 1995) (tabla 4). Los sitios se encuentran en climas secos muy cálidos (BS0) con precipitación anual promedio de 550 mm, en los semi secos muy cálidos (BS1) con precipitación anual promedio de 650 mm, y en los cálidos subhúmedos (Aw0, Aw1) con precipitación anual promedio entre 1,000 y 1,300 mm (tabla 4). La temperatura promedio en todos los sitios oscila entre 24.5 y los 26 °C. Con base en la diversidad de climas, asociaciones vegetales y hábitats donde ha sido reportada B. pliabilis, se considera que no tiene un hábitat especializado y se le asigna un valor de 0 al subcriterio B-2.
Subcriterio B-3), ¿la permanencia de la población es dependiente de un hábitat primario? La especie fue registrada en las selvas de la península de Yucatán, actualmente ya no se encuentra en las localidades reportadas en las colectas de Schott 892 (MO), Lundell 8128 (MO), Gaumer 23520 (MO), Goldman 1901 (MO), Miranda 8234 (MEXU) y Matuda 37487 (MEXU); los remanentes de poblaciones aún existentes sólo se encuentran en los parches de selva aún conservados. De acuerdo con datos históricos, las poblaciones eran más abundantes en sitios conservados (Miranda, 1959), por lo que el número poblacional encontrado, escasez de plántulas y juveniles y ausencia de estructuras reproductivas en los muestreos, indican la dependencia de un hábitat primario, valor 1 punto.
Subcriterio B-4), ¿la permanencia de la población requiere de regímenes de perturbación particulares o está asociada a etapas transitorias en la sucesión? Las poblaciones evaluadas en este trabajo son remanentes de poblaciones alguna vez más abundantes, donde permanecen individuos en parches de vegetación secundaria arbórea y arbustiva de selva baja caducifolia, selva mediana subcaducifolia y de selva mediana subperennifolia, donde comparten hábitat con otras especies endémicas (tabla 5). No se cuenta con información que indique una asociación con regímenes de perturbación transitorios, valor 0 puntos (tabla 2).
Tabla 4
Características fisiográficas y climáticas de los sitios de estudio.
| SITIO | Altitud (msnm) | Tipo de suelo
FAO |
Geomorfología del terreno | Tipo de clima
S. Köeppen modificado |
| Chiquilá | 6 | Luvisol crómico | Planicies residuales acumulativas susceptibles de inundación controladas estructuralmente | Aw0 |
| Dzemul | 7 | Litosol | Planicie estructural baja denudativa | BS1 |
| Felipe Carrillo Puerto | 31 | Rendzina | Planicie estructural baja fito estable | Aw1 |
| Rio Lagartos | 5 | Litosol | Planicie estructural baja denudativa | BS1 |
| Sierra Papacal | 6 | Litosol | Planicie estructural baja denudativa | BS0 |
| Xmabén | 93 | Rendzina | Lomeríos de elevaciones bajas menores de 200 m snm y planicies interiores | Aw0 |
Tabla 5
Tipo de cobertura vegetal y especies presentes en las 6 poblaciones remanentes de Beaucarnea pliabilis caracterizadas. *= Especies endémicas
| Tabla 5
Continuación |
|||
| Sitio | Vegetación secundaria | Especies presentes | Familias presentes |
| Sitio | Vegetación secundaria | Especies presentes | Familias presentes |
| Chiquilá | Arbórea de selva baja mediana subcaducifolia subperennifolia | Manilkara zapota (L.) van Royen.
Sabal yapa C. Wright. ex Becc. Chamaedorea seifrizii Burret Coccoloba spicata Lundell Lysiloma latisiliquum (L.) Benth Bursera simaruba (L.) Sarg. *Hampea trilobata Standl. |
Arecaceae
Burseraceae Fabaceae Malvaceae Polygonaceae Sapotaceae |
| Dzemul | Arbustiva de selva baja caducifolia | Pithecellobium dulce (Roxb.) Benth.
Agave angustifolia Haw. var. angustifolia Pilosocereus gaumeri (Britton et Rose) Backeb *Nopalea gaumeri Britton et Rose Guaiacum sanctum L. Plumeria rubra L. Euphorbia sp. Bromelia karatas L. Ipomoea carnea Jacq. ssp. carnea Gymnopodium floribundum Rolfe *Pterocereus gaumeri (Britton et Rose) Th. MacDoug. et Miranda |
Agavaceae
Apocynaceae Bromeliaceae Cactaceae Convolvulaceae Euphorbiaceae Fabaceae Polygonaceae Zygophyllaceae |
| Felipe Carrillo Puerto | Arbórea de selva mediana subperennifolia | Caesalpinia gaumeri (Britton et Rose) Grenm.
Bursera simaruba (L.) Sarg. *Lonchocarpus xuul Lundell Manilkara zapota (L.) van Royen. Pouteria sp. *Alseis yucatanensis Standl. Pithecellobium sp. Pseudobombax ellipticum (Kunth) Dugand. Pilocarpus racemosus Vahl. Erythrina standleyana Krukoff Gymnanthes lucida Swartz. Laetia thamnia L. Astronium graveolens Jacq. *Sebastiania adenophora Pax et K. Hoffm. Piper amalago L. Melicoccus oliviformis Kunth Gymnopodium floribundum Rolfe Malpighia emarginata DC. Asemnantha pubescens Hook. f. *Thouinia paucidentata Radlk. Cordia gerascanthus L. Lysiloma latisiliquum (L.) Benth. Metopium brownei (Jacq.) Urb. Vitex gaumeri Greenm. Bonellia flammea (Millsp. Ex Mez) B. Ståhl et Källersjö |
Anacardiaceae
Boraginaceae Burseraceae Euphorbiaceae Fabaceae Lamiaceae Malpighiaceae Malvaceae Piperaceae Polygonaceae Rubiaceae Rubiaceae Rutaceae Salicaceae Sapindaceae Sapotaceae Theophrastaceae |
| Río Lagartos | Arbustiva de selva baja caducifolia | Pithecellobium dulce (Roxb.) Benth
Agave angustifolia Haw. var. angustifolia Guaiacum sanctum L. Euphorbia sp. *Caesalpinia yucatanensis (Britton et Rose) Grenm. Stenocereus laevigatus (Salm-Dyck) Buxb. Pilosocereus gaumeri (Britton et Rose) Backeb Bursera simaruba (L.) Sarg. Malpighia glabra L. Bromelia karatas L. Aechmea bracteata (Sw.) Griseb. Tillandsia usneoides (L.) L. Tillandsia fasciculata Sw. Tillandsia elongata Kunth |
Agavaceae
Bromeliaceae Burseraceae Cactaceae Euphorbiaceae Fabaceae Malpighiaceae Zygophyllaceae |
| Sierra Papacal | Arbórea de selva baja caducifolia | Gymnopodium floribundum Rolfe
*Nopalea gaumeri Britton et Rose *Hampea trilobata Standl. *Ceiba schottii Britt. et Baker. Vachelia cornigera (L.) Seigler et Ebinger *Caesalpinia yucatanensis (Britton et Rose) Grenm. Caesalpinia gaumeri (Britton et Rose) Grenm. Agave angustifolia Haw. var. angustifolia Plumeria rubra L. Bursera simaruba (L.) Sarg. Malpighia glabra L. |
Agavaceae
Apocynaceae Burseraceae Cactaceae Fabaceae Malpighiaceae Malvaceae Polygonaceae |
| Xmabén | Arbórea de selva mediana subcaducifolia | Gymnopodium floribundum Rolfe
Plumeria obtusa L. *Randia aculeata L. *Coccoloba spicata Lundell *Neomillspaughia emarginata (H. Gross) S.F Blake. *Lonchocarpus xuul Lundell Tillandsia fasciculata Sw. Bromelia karatas L. Aechmea bracteata (Sw.) Griseb. Bursera simaruba (L.) Sarg. Chamaedorea seifrizii Burret |
Apocynaceae
Arecaceae Bromeliaceae Burseraceae Fabaceae Polygonaceae Rubiaceae |
Subcriterio 5), amplitud del intervalo altitudinal que ocupa el taxón, la especie se distribuye en la península de Yucatán, la cual es predominantemente plana, en la porción central y al sur puede alcanzar una elevación de hasta 380 m snm; la población de XMA es la que se encuentra a mayor altitud, en una zona de lomeríos menores a 200 m snm, valor 3 puntos (tabla 2; Lugo, 1999). Los valores de impacto para este criterio suman 5 puntos (5/9).
Criterio C. Vulnerabilidad biológica intrínseca. Subcriterio C-1.1), demografía. En los transectos de las 6 poblaciones muestreadas se encontró un total de 223 individuos de diferentes etapas de desarrollo (fig. 4), de los cuales 28% fueron adultos, 19% juveniles y 53% plántulas. En las poblaciones, excepto en CHI, se encontraron individuos de por lo menos 2 etapas de desarrollo, pero la proporción fue variable. La densidad varió de 0 a 118 plántulas/0.1ha, 0 a 43 juveniles/0.1ha y 0 a 18 adultos/0.1ha. El cálculo del número total de individuos que realizamos con base en los censos y registros de poblaciones es de 501-5,000 individuos, por lo que le asignamos a este subcriterio (C-1.1) el valor de 2 puntos (tabla 2).
El reclutamiento, tomando como evidencia la presencia de plántulas, se registró en 2 transectos, aunque la mayor densidad se registró en la población de SP (117 plántulas de un total de 118). También, la densidad de juveniles fue relativamente baja en todas las poblaciones, excepto para la población de FCP donde se registraron 32 individuos. Aunque, la densidad de adultos fue variable, 3 poblaciones (FCP, RL y XMB) presentaron una densidad similar (tabla 6). En la población de CHI estuvieron ausentes las plántulas y los adultos, y sólo se encontró un individuo de la etapa juvenil. Por lo tanto, consideramos para el subcriterio C-1.2 que hay reclutamiento en algunas poblaciones, lo que corresponde a un valor de 2 puntos (tabla 2).
En cuanto a los atributos demográficos, se consideraron las siguientes preguntas (tabla 2). a) ¿Hay evidencia de denso-dependencia en la reproducción? no se contó con evidencia de densodependencia en la reproducción, valor 0 puntos. b) ¿Hay clonalidad? la especie no tiene la capacidad de generar nuevos individuos independientes por medio de reproducción asexual, valor 1 punto. c) ¿Hay evidencia de decrecimiento de las poblaciones en el país? las observaciones históricas señalan poblaciones alguna vez más densas en la península de Yucatán (Miranda, 1959), patrón que se puede observar en los sitios más conservados como el de FCP, o en especies hermanas del género Beaucarnea que localmente, y en sitios conservados son abundantes (Castillo-Gómez, 2011; Hernández-Sandoval et al., 2012; Pérez-Farrera et al., 2012; Rubio Méndez et al., 2018), valor 1 punto. d) ¿Hay evidencia de una varianza muy grande en la fecundidad? de acuerdo con nuestras observaciones y experiencia en campo, la floración año con año es muy variable; en las ciudades de la península de Yucatán se han presentado años con floraciones masivas y años con floraciones escasas; en condiciones silvestres ha sido raro encontrar individuos en etapa reproductiva, tal es el caso de la presencia de un gran número de plántulas en la localidad de SP, donde las plántulas se encontraban cerca de un solo individuo adulto progenitor, valor 1. e) ¿El taxón es dioico, los individuos son dicógamos o autoincompatibles? la especie presenta sexos separados, inflorescencias con flores pistiladas o estaminadas (Hernández-Sandoval, 1993), valor 1 punto. f) ¿La floración es sincrónica o gregaria? las poblaciones silvestres florecen de abril a julio (Cabrera-Cano et al., 1982; López-Segovia, 1985), en la actualidad es raro encontrar individuos silvestres en floración, en las ciudades florecen de manera sincrónica, valor 1 punto; g) ¿El taxón produce pocos propágulos? los individuos producen de 1 a 6 inflorescencias, y cada individuo puede producir miles de frutos provistos por una sola semilla (Orellana, datos sin publicar), las cuales tienen una alta tasa de germinación (López-Segovia, 1985), valor 0 puntos.
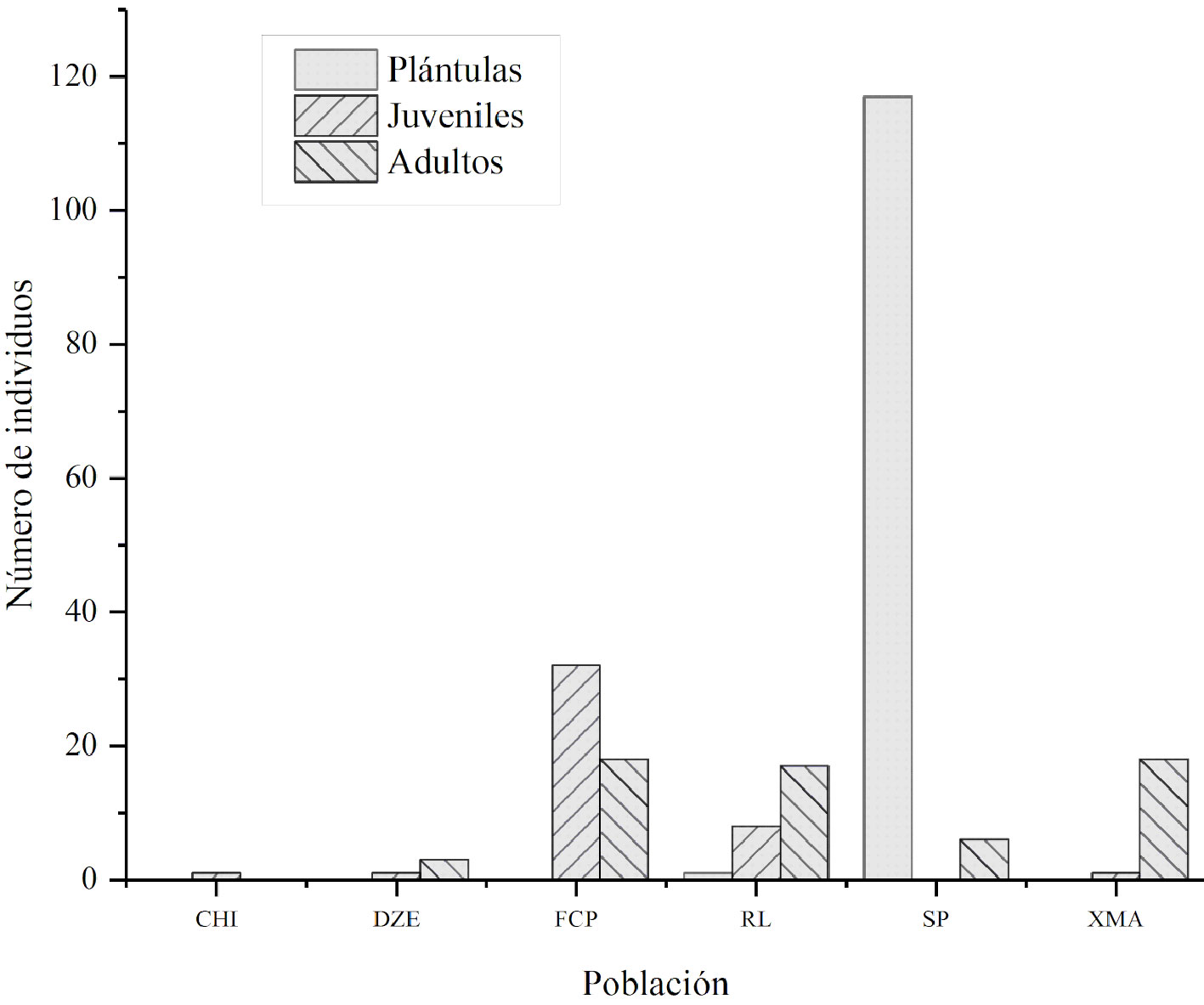
Tabla 6
Densidad (ind/ha) de Beaucarnea pliabilis por etapas de desarrollo.
| Localidad | Plántulas | Juveniles | Adultos |
| Chiquilá | 0 | 10 | 0 |
| Dzemul | 0 | 10 | 30 |
| Felipe Carrillo Puerto | 0 | 320 | 180 |
| Río Lagartos | 10 | 80 | 170 |
| Sierra Papacal | 1170 | 0 | 60 |
| Xmabén | 0 | 10 | 180 |
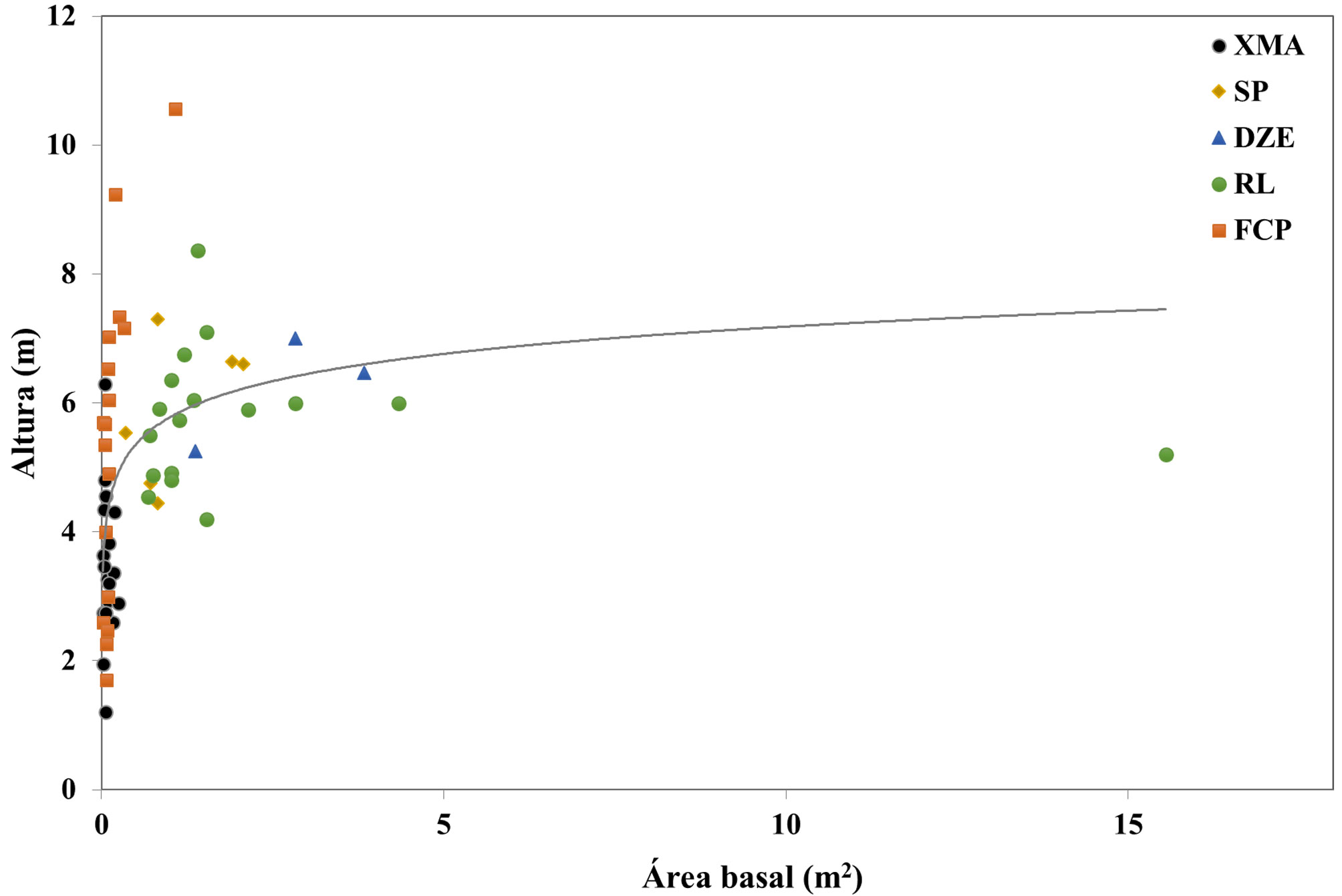
Subcriterio C-2. Genética. No se cuenta con datos genéticos para B. pliabilis, por lo que los subcriterios 1) cantidad de variación genética molecular, 2) estructura genética molecular y 3) variación molecular, recibieron un valor de 0 (tabla 2). En cuanto a la variabilidad morfológica entre poblaciones, se observaron diferencias entre poblaciones de las selvas bajas y las selvas medianas. En la población con mayor precipitación, en la selva mediana de FCP, se encontraron adultos con alturas máximas de hasta 10.5 m, mientras que las demás poblaciones no superan, en general, los 8 m. En el caso del área basal, esta fue mayor en las poblaciones de las selvas bajas caducifolias del norte de Yucatán, SP, DZE y RL, con valores entre 0.67 y 4.33 m2 e incluso un valor extremo en 15.5 m2, en comparación con la de las poblaciones de las selvas medianas, FCP y XMA, cuyos valores se ubicaron entre 0.02 y 1.0 m2 (fig. 5). Las poblaciones de las selvas medianas son más numerosas, sin embargo, presentan un área basal por hectárea menor al de las poblaciones de las selvas bajas caducifolias. Dada esta variabilidad entre las poblaciones, se le asignó el valor de 1 punto al criterio C-2.4 (tabla 2).
Subcriterio C-3. Interacciones bióticas especializadas. Subcriterio 1), ¿el taxón requiere una “nodriza” para su establecimiento? las observaciones en campo indican que las plántulas requieren en sus primeras etapas la sombra de otros árboles, como ocurre con otras especies del género, valor 1 punto (Cardel et al., 1997; Hernández-Sandoval et al., 2012). 2), ¿El taxón requiere un hospedero o forofito específico? la especie no requiere forofito, valor 0 puntos. 3), ¿El taxón requiere un polinizador específico? la polinización en la especie es cruzada y mediante vectores bióticos o abióticos como el viento, valor 0 puntos. 4), ¿El taxón tiene un dispersor específico? las semillas son dispersadas principalmente por el viento, valor 0 puntos. 5), ¿El taxón presenta mirmecofilia obligada? no, valor 0 puntos. 6), ¿El taxón presenta dependencia estricta de la micorriza? en Beaucarnea gracilis se ha encontrado asociación con micorrizas (Camargo-Ricalde et al., 2003), para B. pliabilis no contamos con esta información, pero en ninguno de los casos hay evidencia de que la dependencia sea estricta, valor 0 puntos. 7), ¿El taxón sufre una afectación importante por depredadores, patógenos? en las poblaciones silvestres se observaron individuos con daños en tronco y ramas (presentan oquedades y rupturas del tronco principal original), también se encontraron excretas de ganado en las poblaciones que colindan con ranchos ganaderos, y se ha observado depredación de plántulas por ganado, valor 1 punto. Los valores de impacto para este criterio suman 10 puntos (10/23, tabla 2).
Criterio D. Impacto de la actividad humana. Subcriterios D-1), ¿cómo afecta al taxón la alteración antrópica del hábitat? D-2) ¿Cuál es el nivel de impacto de las actividades humanas sobre el hábitat del taxón? D-3) ¿Existe evidencia que indique un deterioro en la calidad o extensión del hábitat como efecto de cambios globales o se prevé un cambio drástico en el uso del suelo? en la década de los noventa, las poblaciones analizadas, en un área de 100 m2, se encontraban en una matriz de parches de vegetación secundaria, de tipo agropecuario y de selva baja caducifolia; una década después, la selva fue reemplazada por la cobertura de tipo agropecuario (fig. 6). Conforme nos alejamos de las poblaciones muestreadas, a distancia de 1, 2 y 3 km, se registra una reducción en la superficie ocupada por la selva baja caducifolia y por la vegetación secundaria, en tanto que aumenta la superficie de la cobertura de uso agropecuario, se registran la presencia de las coberturas de uso urbano y zonas desprovistas de vegetación. También, se registran las coberturas manglar (por la cercanía de la población de la localidad de Río Lagartos al mar) y selva mediana subperennifolia a distancias de 2 y 3 km2. El incremento de la cobertura de uso agropecuario y la pérdida de selva baja caducifolia en las inmediaciones de las poblaciones muestran una tendencia hacia la pérdida de hábitat.
El impacto negativo de las actividades humanas en el área de distribución de B. pliabilis se ve reforzado por la presencia de vías de comunicación, asentamientos rurales y urbanos en las inmediaciones de sus poblaciones silvestres. Cinco de 6 poblaciones de B. pliabilis se encuentran a menos de 200 m de la carretera más cercana en línea recta; las poblaciones de DZE, SP y XMA son las más cercanas a alguna carretera, están a menos de 50 m; en tanto que las de RL y FCP están a menos de 116 y 177 m de la carretera más cercana, respectivamente (fig. 7a). La densidad de vías de comunicación (calles, terracería y carreteras) en un área de 100 m2 alrededor de las poblaciones silvestres muestreadas es relativamente alta, 31.7 m por m2, en tanto que la densidad en las superficies de 1, 2 y 3 km2, es entre 160 y 170.8 m por m2 (fig. 7c).
La cercanía a asentamientos rurales y urbanos también es un factor que contribuye a la pérdida de hábitat, sitios como DZE, FCP, RL, y XMA se encuentran a menos de 1 km de algún asentamiento (fig. 7b).
Con base en esta información podemos evaluar los subcriterios, D-1, la pérdida de cobertura vegetal de la península de Yucatán ha ocasionado la pérdida y/o reducido el tamaño de las poblaciones, las cuales son relativamente más abundantes en sitios mejor conservados como en las localidades de SP y FCP, valor 1 punto. Subcriterio D-2), el impacto de las actividades humanas es fuerte y afecta a todas las poblaciones (figs. 1, 6, 7), valor 3 puntos. Subcriterio D-3), en la tabla 1 podemos ver la reducción en las selvas que habita B. pliabilis (y un muy pequeño aumento en la selva baja caducifolia) del 2001 al 2016, y en la figura 6 los cambios en el uso de suelo, en fechas recientes. Lo anterior da sustento a considerar una fuerte pérdida de hábitat por cambio de uso de suelo debido a actividades como la ganadería, la agricultura comercial mecanizada, el crecimiento urbano y de infraestructura impulsados por el crecimiento demográfico y económico de la región, valor 1 punto.

En el subcriterio D-4) ¿cuál es el impacto del uso sobre el taxón? la especie tiene un alto valor ornamental, por lo que sus poblaciones silvestres han sufrido una extracción indiscriminada, hecho que condujo a su inclusión en la lista de especies amenazadas de la NOM-059 desde el año 1994, el impacto de uso es fuerte en algunas o moderado en todas las poblaciones, valor 2 puntos. 5) ¿La especie ha sido cultivada y propagada ex situ? su inclusión en la NOM-059 en 1994 promovió la creación de unidades de manejo de vida silvestre (UMA), aunque en el 2011 se reportaron hasta 34 UMA que propagaban la especie, muchas de estas no continúan a la fecha; no obstante, es frecuente encontrarla en viveros de las principales ciudades, valor -1 punto. Los valores de impacto para este criterio suman 6 puntos (6/10, tabla 2).
Finalmente, los criterios A, B, C del índice de rareza suman 1.718, y el criterio D del índice de impacto antropogénico tuvo un valor total de 0.6, dando una suma total del MER de 2.312 (tabla 2) lo cual ubica a la especie en la categoría de en peligro de extinción (P), por tener un valor igual o mayor a 2.

Discusión
La información recabada nos lleva a recategorizar a Beaucarnea pliabilis, de una especie en riesgo, a una especie en peligro de extinción. Desde la década de los 90’s se documentó que la pérdida de hábitat, la sobreexplotación y la extracción ilegal estaban poniendo en riesgo la supervivencia de esta especie de lento crecimiento y bajas tasas de reclutamiento, por lo que fue clasificada como especie amenazada NOM-059-ECOL-1994 (Diario Oficial de la Federación, 1994). Dos décadas después, se continúan perdiendo las selvas que son hábitat de esta especie (tabla 1) y las repercusiones de ello se ven reflejadas en la pérdida de sus poblaciones, en su baja densidad (tabla 6) y en la escasez de plántulas que indican la falta de reclutamiento (fig. 6). Aunado a lo anterior, la fragmentación de su hábitat está poniendo en riesgo la viabilidad a largo plazo de sus poblaciones, lo cual se ha visto reflejado en la valoración de los criterios del MER (tabla 2).
Los registros históricos de B. pliabilis indican un área de distribución que se restringe a la región biogeográfica península de Yucatán, y que coincide con 2 provincias biogeográficas (Conabio, 1997). Pero el impacto directo de la destrucción de las selvas de esta región ha causado la pérdida de las poblaciones de B. pliabilis al interior de estas provincias, particularmente de las poblaciones que albergaban las selvas baja caducifolia y mediana subcaducifolia (fig. 1). La pérdida de hábitat, además de causar extinciones locales en un plazo de tiempo relativamente corto, indirectamente contribuye a la extinción de especies en un plazo más largo al fragmentar el hábitat, facilitar las invasiones, mejorar el acceso a extractores ilegales de plantas, alterar las condiciones ambientales y al disminuir la reproducción cruzada con otras poblaciones (Brooks et al., 2008; Tillman et al., 1994). Estudios de poblaciones de B. pliabilis de los años 50´s y hasta de finales de los 90´s reportaban que la especie podía ser dominante en ciertos ambientes de la península (Martínez y Galindo-Leal, 2002; Miranda, 1959). Nuestros estudios demuestran que si bien en ciertos manchones muestreados su densidad puede ser comparable con la encontrada para otras especies del género que se encuentran en zonas protegidas (Cardel et al., 1997; Martorell y Ezcurra, 2002; Pérez-Farrera et al., 2012; Rubio-Méndez et al., 2018); estas poblaciones remanentes se ven interrumpidas por parches de uso de suelo de los tipos agropecuario y urbano, provocando su aislamiento y aumentando la distancia entre ellas. Actualmente, la distancia entre las poblaciones oscila entre 50 y 300 km (tabla 3).
La pérdida de conectividad entre las poblaciones tiene repercusiones en el éxito reproductivo de las especies, particularmente en especies dioicas, como B. pliabilis, donde la reproducción sexual depende del éxito de la polinización, debido a que no pueden autopolinizarse (Oster y Eriksson, 2007; Yu y Lu, 2011). Por lo tanto, poblaciones pequeñas con una proporción de sexos sesgada corren un mayor riesgo en ambientes fragmentados a sufrir una disminución en la disponibilidad de polen y consecuentemente en el éxito reproductivo (Oster y Eriksson, 2007). No contamos con datos de proporción de sexos en las poblaciones silvestres de B. pliabilis, pues durante los 2 años de muestreo no se observó la floración sincrónica, característica de esta especie. Sin embargo, la ciudad de Mérida cuenta con una población de alrededor de 2,500 plantas y en un muestreo de 100 individuos, realizado durante 2018, se contabilizó 52% machos y 48% hembras (De la Concha et al., 2017; Espadas- Manrique y Reyes-García, datos sin publicar). Esto coincide con lo reportado en campo para Beaucarnea inermis (Rubio-Méndez et al., 2018). Sin embargo, las condiciones de aislamiento entre remanentes de población y el bajo número de individuos, muchos de los cuales pueden no estar en edad reproductiva hace que difícilmente existan altas tasas de reproducción en B. pliabilis.
Aunque no se cuenta con información del flujo génico en ésta o en especies del género Beaucarnea, estudios en otras especies anemófilas que analizan la dispersión de polen y la polinización al interior y entre poblaciones, estiman distancias de dispersión máxima que oscilan entre 80-1,000 m (Smouse y Sork, 2004), 614.2 m (Jolivet et al., 2012) e incluso que la distancia promedio de dispersión puede ser de hasta 7599 m; encontrando que la frecuencia de polinización decrece a distancias mayores a 500-600 m (Slavov et al., 2009). Las poblaciones silvestres de B. pliabilis, se encuentran separadas por distancias muy por encima de las distancias de dispersión estimadas, y con poblaciones poco numerosas, por lo que su reproducción y permanencia puede verse limitada al flujo génico al interior de las poblaciones silvestres y al flujo de las poblaciones de B. pliabilis en las localidades rurales y urbanas.
Un rasgo sobresaliente que varía entre las especies y al interior de las poblaciones en las especies del género Beaucarnea es la base del tallo ensanchada. Las variaciones en el diámetro de la base ensanchada del tallo y en la altura han sido caracteres morfológicos que han contribuido a diferenciar individuos recolectados en sitios diferentes de la esta región como el Petén guatemalteco y Progreso, Yucatán; Lundell reportó en 1935 y en 1939 a las especies Dracaena petenensis (Lundell) Lundell (ensanchamiento base 70-90 cm, altura 6 a 12 m) y Beaucarnea ameliae Lundell (ensanchamiento base 20-25 cm, altura 4-8 m), respectivamente, como distintas de B. pliabilis, no obstante han sido reconocidas como sinónimos de esta especie. Las variaciones en las tallas se han relacionado con la edad de los individuos, con las características del ambiente, y con la dominancia de la población en el ecosistema (Pérez-Farrera et al., 2012). Las diferencias estadísticas del área basal y la altura entre las poblaciones analizadas en este trabajo se relacionan con las características ambientales de los sitios donde se distribuyen; por lo que se pueden diferenciar 2 grupos, las poblaciones que se encuentran en la selva baja caducifolia, con suelos tipo Litosol y climas semisecos (Bs0 y Bs1) y las poblaciones que se distribuyen en las selvas medianas subcaducifolia y subperennifolia con climas cálidos húmedos (Aw0 y Aw1) y suelos tipo Rendzinas (tabla 4). Las diferencias entre estos grupos muestran que las poblaciones de las zonas más secas presentan áreas basales más ensanchadas y menor altura que las poblaciones de los sitios más húmedos (fig. 5). La variación en altura en la población de XMA se debe a que se encuentra en un parche con una cobertura arbórea densa donde los individuos de esta especie crecen en forma de enredadera para alcanzar el dosel superior.
En conclusión, nuestro estudio, utilizando valoración de los criterios del MER, sustenta la necesidad de cambiar la clasificación de B. pliabilis de amenazada a en peligro de extinción. El cambio se sustenta principalmente en la disminución del hábitat y deterioro de la calidad de éste, así como las presiones a las que está expuesta al ser extraída con fines comerciales. Aunado a esto, la cualidad dioica de esta especie y la falta de floración anual amenazan su supervivencia. Nuestro estudio también resalta la necesidad de realizar más estudios en la especie, ya que se carecen de datos genéticos de las poblaciones y se cuenta con poca información ligada a su reproducción.
Agradecimientos
Al Sistema Nacional de Recursos Fitogenéticos para la Alimentación y la Agricultura (SINAREFI-SNICS-Sagarpa) por el apoyo financiero al proyecto con Folio Núm. SNICS. 11.04.2013.REC.GEN.AGR.44/A y a los integrantes de la Red Pata de Elefante. Al Centro de Investigación Científica de Yucatán, por proporcionar apoyo con recursos fiscales. Al personal de las reservas de la biosfera Ría Lagartos y Calakmul por el apoyo brindado, así como a Lilia Carrillo y Manuela Tamayo, por su apoyo en muestreos en campo.
Referencias
Bautista, F., Batllori-Sampedro, E., Palacio-Alponte, G., Ortíz-Pérez, M. y Castillo-González, M. (2005). Integración del conocimiento actual sobre los paisajes geomorfológicos de la península de Yucatán. En F. Bautista y G. Palacio-Alponte (Eds.), Caracterización y manejo de los suelos de la península de Yucatán: implicaciones agropecuarias, forestales y ambientales (pp. 33–58). Campeche: Universidad Autónoma de Campeche/ Universidad Autónoma de Yucatán/ Instituto Nacional de Ecología.
Brooks, B., Corey, N. S. y Bradshaw, J. A. (2008). Synergies among extinction drivers under global change. Trends in Ecology and Evolution, 23, 453–460. https://doi.org/10.1016/j.tree.2008.03.011
Cabrera-Cano, E. F., Sousa-Sánchez, M. y Téllez-Valdés, O. (1982). Imágenes de la flora Quintanarroense. Chetumal, Quintana Roo: Centro de Investigaciones de Quintana Roo.
Camargo-Ricalde, S., Dhillion, S. S. y Jiménez-González, C. (2003). Mycorrhizal perennials of the “matorral xerófilo” and the “selva baja caducifolia” communities in the semiarid Techuacán-Cuicatlán Valley, Mexico. Mycorrhiza, 13, 77–83. https://doi.org/10.1007/s00572-002-0203-8
Cardel, Y., Rico-Gray, V., García-Franco, J. y Thien, L. B. (1997). Ecological status of Beaucarnea gracilis, an endemic species of the semiarid Tehuacán Valley, México. Conservation Biology, 11, 367–374. https://www.jstor.org/stable/2387611
Carnevali, G., Tapia-Muñoz, J. L., Duno-de Stefan, R. y Ramírez-Morillo, I. (2010). Flora Ilustrada de la península de Yucatán: listado florístico. Mérida: Centro de Investigación Científica de Yucatán, A.C.
Castillo-Gómez, H. A. (2011). Estado actual de conservación de Beaucarnea inermis (S. Watson) Rose (Ruscaceae) en San Luis Potosí y Tamaulipas (Tesis). Universidad Autonóma de Querétaro. Querétaro, México.
CITES (Convención sobre el Comercio Internacional de Especies amenazadas de Fauna y Flora Silvestres). (2017). Appendix II. Disponible en: https://www.cites.org/eng/app/appendices.php
Conabio (Comisión Nacional para el Conocimiento y Uso de la Biodiversidad). (1997). “Provincias biogeográficas de México”. Escala 1:4 000 000. México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Cuevas, M. L., Garrido, A., Pérez, J. L. y González, D. I. (2010). Procesos de cambio de uso de suelo y degradación de la vegetación natural. En H. Cotler (Ed.), Las cuencas hidrográficas de México, diagnóstico y priorización (pp. 96–103). México D.F.: Semarnat/ INE/ Fundación G. Río Arronte I. A. P.
De la Concha, H., Roche-Cano, L. y García-Burgos, A. (2017). Inventario del arbolado urbano de la ciudad de Mérida. Mérida: Ayuntamiento de Mérida 2015-2018. Disponible en: http://www.merida.gob.mx/sustentable/contenidos/doc/inventario_arbolado_merida.pdf
Diario Oficial de la Federación. (1994). Norma Oficial Mexicana (NOM 059-ECOL-1994). (1994). Determina las especies y subespecies de flora y faunas silvestres terrestres y acuáticas en peligro de extinción, amenazadas, raras y las sujetas a protección especial, y que establece especificaciones para su protección. Instituto Nacional de Ecología. Diario Oficial de la Federación 16 de mayo de 1994. Tomo 488.
Durán, R., Trejo-Torres, J. C. e Ibarra-Manríquez, G. (1998). Endemic phytotaxa of the Yucatán Peninsula. Harvard Papers in Botany, 3, 263–314. http://www.jstor.org/stable/41761575
Espadas-Manrique, C., Durán, R. y Argaez, J. (2003). Phytogeographic analysis of taxa endemic to the Yucatán Peninsula using geographic information systems, the domain heuristic method and parsimony analysis of endemicity. Diversity and Distributions, 9, 313–330. https://doi.org/10.1046/j.1472-4642.2003.00034.x
Golubov, J., Mandujano, M., Arizaga, S., Martínez-Palacios, A. y Koleff, P. (2007). Inventarios y conservación de Agavaceae y Nolinaceae. En P. Colunga-García-Marín, L. Eguiarte, A. Larqué-Saavedra y D. Zizumbo-Villarreal (Eds.), En lo ancestral hay futuro: del tequila, los mezcales y otros agaves (pp. 133-151). Mérida: Centro de Investigación Científica de Yucatán/ Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/ Instituto Nacional de Ecología.
Hernández-Sandoval, L. (1993). Beaucarnea ¿Un género amenazado? Cactáceas y Suculentas Mexicanas, 38, 11–12.
Hernández-Sandoval, L., Osorio-Rosales, M. L., Orellana-Lanza, R., Martínez, M., Pérez-Farrera, M. A., Contreras-Hernández, A. et al. (2012). Manejo y conservación de las especies con valor comercial de pata de elefante (Beaucarnea). Universidad Autónoma de Querétaro. Querétaro, México.
Holmgren, P. K. y Holmgren, N. H. (2020). Index Herbariorum: a global directory of public herbaria and associated staff. New York Botanical Garden’s Virtual Herbarium. Recuperado: mayo 2020, de: http://sweetgum.nybg.org/science/ih/
INEGI (Instituto Nacional de Estadística Geografía e Informática). (2001). Uso del suelo y vegetación, escala 1:250000, serie II (continuo nacional), escala: 1:250000. Dirección General de Geografía. Instituto Nacional de Estadística y Geografía. Instituto Nacional de Estadística y Geografía (INEGI). Aguascalientes, Aguascalientes, México.
INEGI (Instituto Nacional de Estadística y Geografía) (2008). Unidades climáticas, conjunto de datos vectoriales escala 1:1 000 000. Instituto Nacional de Estadística y Geografía. Estados Unidos Mexicanos. https://www.inegi.org.mx/app/mapas/
INEGI (Instituto Nacional de Estadística Geografía e Informática) (2016). Conjunto de datos vectoriales de uso de suelo y vegetación escala 1:250 000, serie VI (capa unión), escala: 1:250000. Instituto Nacional de Estadística y Geografía. Aguascalientes, México.
Inifap (Instituto Nacional de Investigaciones Forestales y Agropecuarias)-Conabio (Comisión Nacional para el Conocimiento y Uso de la Biodiversidad). (1995). ‘Edafología’. Escalas 1:250000 y 1:1000000. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. México.
Janzen, D. H. (1988). Tropical dry forest: the most endangered major tropical ecosystem. En E. O. Wilson (Ed.), Biodiversity (pp. 130–137). Washington D.C.: National Academy Press.
Jolivet, C., Höltken, A. M., Liesebach, H., Steiner, W. y Degen, B. (2012). Mating patterns and pollen dispersal in four contrasting wild cherry populations (Prunus avium L.). European Journal Forest Research, 131,1055–1069. https://doi.org/10.1007/s10342-011-0576-3
López-Segovia, C. R. (1985). Ensayo de propagación de tres especies de plantas silvestres amenazadas o en peligro de extinción (Kuka Pseudophoenix sargentii Wendel, despeinada Beaucarnea pliabilis Rose, polmis Mammillaria gaumeri Britton y Rose) (Tesis). Centro de Investigación Científica de Yucatán. Mérida, Yuc.
Lugo, J. H. (1999). El relieve de la península de Yucatán. En A. García-de Fuentes, J. Córdoba y Ordoñez y P. Chico-Ponce de León (Eds.), Atlas de procesos territoriales de Yucatán (pp. 159–162). Mérida: Universidad Autónoma de Yucatán.
Lundell, C. L. (1935). Dracaena petenensis, sp. nov. Journal of the Washington Academy of Sciences, 25, 230.
Lundell, C. L. (1939). Studies of Mexican and Central American Plants-VIII. Bulletin of the Torrey Botanical Club, 66, 583–604. https://doi.org/10.2307/2480801
Martínez, E. y Galindo-Leal, C. (2002). La vegetación de Calakmul, Campeche, México: clasificación, descripción y distribución. Boletín de la Sociedad Botánica de México, 71, 7–32. . https://doi.org/10.17129/botsci.1660
Martorell, C. y Ezcurra, E. (2002). Rosette scrub occurrence and fog availability in arid mountains of Mexico. Journal of Vegetation Science, 13, 651–662. https://doi.org/10.1111/j.1654-1103.2002.tb02093.x
Miranda, F. (1959). Estudios acerca de la vegetación. En E. Beltrán (Ed.), Los recursos naturales del sureste y su aprovechamiento II (pp. 159–174). México D.F: Instituto Mexicano de Recursos Naturales Renovables.
Oster, M. y Eriksson, O. (2007). Sex ratio mediated pollen limitation in the dioecious herb Antennaria dioica. Ecoscience, 14, 387–398. https://doi.org/10.2980/1195-6860(2007)14[387:SRMPLI]2.0.CO;2
Pérez-Farrera, M. A., Hernández-Sandoval, L., López-Cruz, A., Espinosa-Jiménez, J. A., López, Marto S., Zenteno-Cruz, G. et al. (2012). Estructura, densidad poblacional y relaciones alométricas de Beaucarnea goldmanii Rose y Beaucarnea sanctomariana L. Hern. (Asparagaceae) en Chiapas y Oaxaca, México. Lacandonia, 6, 7–17.
Reyes-Santiago, S. J. (2009). Conservación y restauración de cactáceas y otras plantas suculentas mexicanas. Manual práctico. Zapopan, Jalisco: Conafor.
Rubio-Méndez, G., Castillo-Gómez, H. A., Hernández-Sandoval, L., Espinosa-Reyes, G. y De-Nova, J. A. (2018). Chronic disturbance affects the demography and population structure of Beaucarnea inermis, a threatened species endemic to Mexico. Tropical Conservation Science, 11, 1–12. https://doi.org/10.1177/1940082918779802
Rzedowski, J. (1990). Vegetación potencial. IV.8.2. Atlas Nacional de México. Vol II. Escala 1:4000000. México D.F.: Instituto de Geografía, UNAM.
Sánchez-Salas, J., Muro G., Estrada-Castillón, E. y Alba-Ávila, J. A. (2013). El MER: un instrumento para evaluar el riesgo de extinción de especies en México. Revista Chapingo Serie Zonas Áridas, 12, 0–35. https://doi.org/10.5154/r.rchsza.2012.06.037
Semarnat (Secretaría de Medio Ambiente y Recursos Naturales). (2010). Norma Oficial Mexicana NOM-059-SEMARNAT-2010. Protección ambiental-Especies nativas de México de flora y fauna silvestres- Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-Lista de especies en riesgo. Diario Oficial de la Federación, 30 de diciembre, segunda sección: 1–77.
Semarnat (Secretaría de Medio Ambiente y Recursos Naturales). (2016). Informe de la situación del medio ambiente en México. Compendio de estadísticas ambientales. indicadores clave, de desempeño ambiental y de crecimiento verde. Edición 2015. México D.F.: Semarnat.
Slavov, G. T., Leonardi, S., Burczyk, J., Adams, W. T., Strauss, S. H. y Difazio, S. P. (2009). Extensive pollen flow in two ecologically contrasting populations of Populus trichocarpa. Molecular Ecology, 18, 357–373. https://doi.org/10.1111/j.1365-294X.2008.04016.x
Smouse, P. y Sork, V. L. (2004). Measuring pollen flow in forest trees: an exposition of alternative approaches. Forest Ecology and Management, 197, 21–38. https://doi.org/10.1016/j.foreco.2004.05.049
Tambutti, M., Aldama, A., Sánchez, O., Medellín, R. y Soberón, J. (2001). La determinación del riesgo de extinción de especies silvestres en México. Gaceta Ecológica, 60, 11–21. https://www.redalyc.org/articulo.oa?id=53906101
Tillman, D., May, R. M., Lehman, C. L. y Nowak, M. A. (1994). Habitat destruction and the extinction debt. Nature, 371, 65–66. https://doi.org/10.1038/371065a0
Trejo, I. y Dirzo, R. (2000). Deforestation of seasonally dry tropical forest: a national and local analysis in Mexico. Biological Conservation, 94, 133–142. https://doi.org/10.1016/S0006-3207(99)00188-3
Yu, L. y Lu, J. (2011). Does landscape fragmentation influence sex ratio of dioecious plants? A case study of Pistacia chinensis in the Thousand-Island Lake region of China. Plos One, 6, e22903. https://doi.org/10.1371/journal.pone.0022903