Fabio Zabala-Forero a, * y Nicolás Urbina-Cardona b
a Fundación Proterra, Calle 45 #8-54, 110231 Bogotá D.C., Colombia
b Pontificia Universidad Javeriana, Facultad de Estudios Ambientales y Rurales, Departmento de Ecología y Territorio, Ak. 7 Núm. 40 – 62, 110231 Bogotá D.C., Colombia
*Autor para correspondencia: f.zabala.forero@gmail.com (F. Zabala-Forero)
Recibido: 23 marzo 2020; aceptado: 17 diciembre 2020
Resumen
El objetivo de este trabajo fue evaluar cambios en la diversidad taxonómica y funcional de anfibios en 9 coberturas vegetales en un paisaje altamente fragmentado en los Andes de Colombia. Se registraron 88 individuos de 11 especies de anfibios y la mayor riqueza se presentó en la zona interna del bosque. A partir de 6 rasgos funcionales, se clasificó el ensamblaje de anfibios en 4 grupos funcionales. La composición del ensamblaje de anfibios y la frecuencia de grupos funcionales varió por el efecto del tipo de cobertura vegetal y la temporada climática. En la zona interna del bosque, el índice de riqueza funcional ponderado por la abundancia de la comunidad fue mayor que en el resto de las coberturas vegetales, indicando que en este hábitat los anfibios abarcan un amplio espacio funcional y mejor potencial para explorar los recursos. Los cultivos de cacao y caña, por sus características estructurales permiten la dispersión de algunas especies de anfibios, mientras que los potreros y cultivos mixtos constituyen barreras para su movilidad. A partir de la distribución de las especies y grupos funcionales, se proponen acciones de manejo de los agroecosistemas para incrementar la calidad del hábitat y la conectividad de las poblaciones en el paisaje.
Palabras claves: Anuros; Bosque andino; Cultivos, Estructura del hábitat; Grupos funcionales; Rasgos funcionales; Riqueza funcional; Sistemas productivos
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Taxonomic and functional diversity responses to landscape transformation: relationship of amphibian assemblages with land use and land cover changes
Abstract
The aim of this work was to evaluate changes in the taxonomic and functional diversity of amphibians in 9 vegetation cover types in a highly fragmented landscape in the Colombian Andes. Eighty-eight individuals of 11 amphibian species were recorded, with the greatest richness occurring in the interior zone of the forest. Based on 6 functional traits, the amphibian assemblage was classified into 4 functional groups. The composition of the amphibian assemblage and the frequency of functional groups varied by the effect of the type of vegetation cover and the climatic season. In the interior zone of the forest, the index of functional richness weighted by total abundance at the community level was higher than in the rest of the vegetation cover, indicating that in this habitat amphibians occupy a wide functional space and better potential to explore resources. Cocoa and sugar cane crops, due to their structural characteristics, allow the dispersion of some amphibian species, while pastures and mixed crops constitute barriers to their mobility. Based on the distribution of species and functional groups, actions for the management of agro-ecosystems are proposed to increase the quality of habitat and the connectivity of populations in the landscape.
Keywords: Anurans; Andean Forest; Crops; Habitat structure; Functional groups; Functional traits; Functional richness; Production systems
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
El impacto de los cambios en el uso y cobertura del suelo sobre los ecosistemas alteran la distribución y abundancia de las especies animales, homogenizando las comunidades bióticas (Rudel et al., 2005; Watling et al., 2011). Para los ensamblajes de anfibios la reducción en la cobertura del dosel es uno de los principales factores de pérdida de diversidad de especies (Cortés-Gómez et al., 2013; Lara-Tufiño et al., 2019). El empobrecimiento de las comunidades se debe a que unas pocas especies colonizadoras de ambientes antropogénicos reemplazan a una gran cantidad de especies especialistas de bosque nativo que desaparecen, debido a la pérdida de hábitat (Mckinney y Lockwood, 1999; Suazo-Ortuño et al., 2018; Tabarelli et al., 2012). En paisajes transformados, la supervivencia de las especies depende del efecto de la matriz antropogénica sobre su dispersión, la disponibilidad de recursos y el ambiente abiótico, aspectos que interactúan en espacio y tiempo con la capacidad adaptativa y plástica de cada especie (Driscoll et al., 2013).
El tipo de uso del suelo y los cambios en las coberturas vegetales son factores determinantes de la diversidad taxonómica y funcional (DF) en paisajes tropicales modificados por actividades humanas (Díaz et al., 2006; Luck et al., 2013). En estos paisajes transformados se crean filtros ambientales como cambios microclimáticos, asociados al incremento de luz y viento, a los cuales las especies pueden ser vulnerables según el valor en sus rasgos funcionales de respuestas (González et al., 2016; Luck et al., 2012). Estos filtros se encuentran determinados por cambios en la estructura vegetal, y su capacidad de amortiguar cambios abruptos en la temperatura y humedad relativa en los hábitat de las especies (Scheffers et al., 2014, 2016). Las especies que no toleran las nuevas condiciones creadas por el uso antropogénico del suelo son extirpadas de los ensamblajes, afectando los procesos ecosistémicos en los que intervenían (Díaz et al., 2006). Por este motivo, no basta con tener un análisis tradicional basado en la composición y riqueza de especies (diversidad taxonómica), desconociendo la dimensión funcional de la diversidad, dado que las especies no se organizan en el ecosistema a partir de clasificaciones taxonómicas, sino a partir del valor y rango de sus rasgos funcionales (Blaum et al., 2011). Los rasgos funcionales son características morfológicas, fisiológicas y ecológicas (e.g., comportamental, dieta, formas de vida) de los individuos que influencian su desempeño a través de la reproducción, crecimiento, supervivencia y dispersión (Shipley et al., 2016). Estos rasgos resumen la interacción directa de las especies con el ambiente y de su papel en los procesos ecosistémicos, estableciendo una conexión con las dinámicas a nivel del paisaje (Mouchet et al., 2010). En este sentido, la DF es un análisis de la distribución del tipo de rasgos funcionales (morfológico, fisiológico, ecológico), así como de los rangos, valores y abundancia relativa que presenten estos rasgos entre los organismos y especies de una comunidad, influenciando el funcionamiento del ecosistema (Mason et al., 2005). Esta visión complementaria a la diversidad taxonómica de especies es clave para entender los efectos de la transformación de los ecosistemas en las comunidades bióticas dados los filtros ambientales que allí se presentan (Mayfield et al., 2010; McGill et al., 2006).
Los anfibios son un excelente modelo de estudio para medir los efectos de la transformación antropogénica de los paisajes sobre la DF, ésto a partir de sus respuestas morfológicas y fisiológicas ante los filtros ambientales naturales (Álvarez-Grzybowska et al., 2020) y antropogénicos (Nowakowski et al., 2017). En ese sentido, los rasgos funcionales, tales como piel altamente permeable, respiración pulmocutánea, bajas tasas metabólicas, baja movilidad, alta diversidad de modos reproductivos y requerimientos puntuales de microhábitat, ayudan a entender la respuesta de las especies ante el manejo de matrices antropogénicas (Dixo y Metzger, 2010; Ernst et al., 2006; Ribeiro et al., 2017) y su papel funcional en el ecosistema (Cortés-Gómez et al., 2015, 2016). Así, las especies de talla corporal pequeña son más afectadas por la transformación de sus hábitat boscosos dado que a menor relación superficie-volumen corporal, los anfibios presentan mayor pérdida de agua en sus cuerpos, principalmente en los ambientes presentes en cultivos, pastizales y bordes de bosques nativos (Pfeifer et al., 2017). Así mismo, los rasgos ecológicos como los modos reproductivos y el hábito de las especies son aspectos importantes para entender la sensibilidad de las especies ante la degradación del hábitat (Cortés-Gómez et al., 2016). En ese sentido, las especies que presentan desarrollo directo o huevos depositados en hojas sobre quebradas son más sensibles a la transformación del hábitat (Mendenhall et al., 2014), lo que se ve reflejado en que los ensamblajes en bosques maduros y conservados presenten mayor riqueza y dispersión funcional debido a un incremento en los modos reproductivos y a la amplitud en el valor de otros rasgos funcionales (Hernández-Ordóñez et al., 2019). Sin embargo, las especies que requieren cuerpos de agua para la ovoposición también pueden ser afectadas por la fragmentación o aislamiento del hábitat debido a que realizan migraciones entre ambientes de bosque nativo y los cuerpos de agua (Becker et al., 2010). Respecto al agrupamiento funcional, Trimble y Van Aarde (2014) encontraron que los grupos funcionales de anfibios de talla pequeña y hábito fosorial se ven más afectados por cambios en el uso del suelo, disminuyendo su abundancia en coberturas como cultivos y plantaciones. Otros estudios han identificado las relaciones que tienen las facetas de la diversidad funcional de los anfibios con la precipitación y la temperatura en áreas montañosas (Ochoa-Ochoa et al., 2019), con los filtros ambientales que diferencian ecosistemas naturales (Álvarez-Grzybowska et al., 2020), con la estructura del paisaje como la disponibilidad de hábitats acuáticos (Ribeiro et al., 2017), con las alteraciones del hábitat en paisajes fragmentados (Riemann et al., 2017), con el éxito de la restauración ecológica (Díaz-García et al., 2017), con los estadios sucesionales generados por el abandono de selvas (Hernández-Ordóñez et al., 2019) y con la interacción entre la sucesión ecológica del bosque seco y los disturbios naturales causados por el régimen de huracanes (Suazo-Ortuño et al., 2018).
Sin embargo, hasta el momento solamente el estudio de Álvarez-Grzybowska et al. (2020) ha comparado el cambio en la diversidad funcional de anfibios entre temporadas de lluvias y seca, por lo que se convierte en un marco de referencia para el presente estudio. Los autores encontraron que los valores en los índices de diversidad funcional no cambian entre temporadas, pero si hubo un recambio temporal en los grupos funcionales para el bosque de pino-encino. Estos resultados los atribuyen a que la similitud limitante es el principal proceso de estructuración de ensamblajes debido a las condiciones hídricas estables, en contraste con el bosque seco tropical, donde el filtrado ambiental mantiene una baja diversidad funcional (Álvarez-Grzybowska et al., 2020). Para el bosque de pino-encino también encontraron que en temporada de lluvias dominó el grupo funcional de anuros semiacuáticos de gran talla corporal, piel suave, huevos depositados en el agua, y membranas interdigitales para nadar; mientras que en época de secas dominó el grupo funcional de especies de talla corporal mediana con hábitos nocturnos y huevos depositados en agua (Álvarez-Grzybowska et al., 2020).
El presente estudio evalúa la diversidad taxonómica y DF de los ensamblajes de anfibios que habitan coberturas naturales y antropogénicas con diferente uso del suelo en una región de los Andes de Colombia. Siguiendo a Fauth et al. (1996), el ensamblaje se define como una subunidad de la comunidad compuesta por especies filogenéticamente cercanas y que hacen un uso similar de los recursos en espacio y tiempo; este concepto es el más apropiado para referirse a un grupo taxonómico presente en un determinado tiempo y espacio, y es complementario al concepto de grupo funcional (Stroud et al., 2015). Las preguntas de la presente investigación son: i) ¿cómo se configuran los gradientes ambientales y de estructura vegetal, entre coberturas naturales y antropogénicas con diferente uso del suelo? y ii) ¿cómo varía la composición de especies y la DF de los ensamblajes de anfibios entre esas coberturas naturales y antropogénicas? Se espera que las coberturas vegetales antropogénicas con menor complejidad estructural (potreros con diferente manejo) reflejen una simplificación en la diversidad taxonómica y funcional, mientras que los bosques nativos y cultivos mixtos y de cacao presenten ensamblajes de anfibios más complejos en términos de un incremento en la riqueza de especies, la riqueza funcional y frecuencias relativa de grupos funcionales. Se espera también una mayor disimilitud en la composición de los ensamblajes de anfibios entre coberturas naturales y antropogénicas. Finalmente, se espera que la riqueza funcional y de especies no varíen entre temporadas de lluvias y sequía dentro de cada cobertura vegetal, mientras que sí se espera un recambio temporal en los grupos funcionales.
Materiales y métodos
El estudio se realizó en el municipio de Falan, al norte del departamento del Tolima (5°08’43.00” N, 74°57’13.82” O), a los 960 m snm sobre la vertiente oriental de la Cordillera Central de Colombia. El promedio anual de temperatura es de 23 °C y la precipitación anual es de 2,179 mm (Alcaldía Municipal de Falan, 2009), perteneciendo al bosque muy húmedo pre montano según la clasificación de unidades ecológicas de Holdridge (Holdridge, 1967). En la región andina, el cambio de bosque nativo por pastos se dio desde la época colonial (1600-1800), el cacao y la caña de azúcar fueron introducidos entre 1800 y 1850 (Etter et al., 2008). En la región de estudio, la fragmentación de estos bosques andinos se dio durante la colonización cafetera en periodo comprendido entre 1900 y 1930 (Walker y Cárdenas, 2004). Actualmente, la comunidad vegetal de los bosques andinos remanentes presentan una dominancia de especies de árboles como Spondias mombin, Hirtella americana y Mouriri myrtilloides ligados a corrientes de aguas y cañadas, además de asociaciones vegetales de Amyro pinnatensis-Crotonetum glabellae y Coccolobo candolleanae-Maurietum birringae (Rangel et al., 1997). A partir de una salida de campo para el reconocimiento del terreno, se identificaron las coberturas vegetales más representativas de la región, las cuales se encuentran inmersas en un relieve escarpado con paisajes de lomeríos y con dominancia de relictos de bosque en las pendientes fuertes que generan cañadas (F. Zabala obs. personal., 2013).
Bosques
Fragmentos remanentes de bosque andino perturbados por entresaca de madera y el paso constante de personas que se abastecen de agua en estos lugares. Cabe resaltar que, debido a la alta tasa de transformación histórica del bosque en la región, en la actualidad no se encuentran fragmentos de bosque de más de 2 ha que presenten un área núcleo o de interior de bosque. En esta categoría se muestreó: a) la zona interna del bosque, desde los 20 metros de distancia del borde de bosque: el fragmento de 0.35 ha que presenta mayor cantidad de hábitat distante del borde físico, al tener un ancho de 70 m lineales y presenta especies con DAP considerables (e.g., Ceiba sp., con un DAP aproximado de 3.5 m). La zona interna de este bosque fue muestreado a partir de los 20 m de distancia con el borde físico, dado que desde esa distancia se ha reportato mayor homogeneidad en la estructura vegetal (Williams-Linera et al., 1998). Este fragmento está asociado a una represa artificial permanente; b) el borde físico de bosque con alta pendiente topográfica: se encuentra dentro de un terreno en forma de V por lo que presenta la mayor pendiente topográfica y se encuentra asociado a la ribera del río La Figueroa. El fragmento tiene un área aproximada de 0.6 ha y se muestreó desde los 0 m hasta los 20 m hacia el interior del bosque; c) el borde físico de bosque de forma lineal: fragmento de 1.5 ha con topografía plana. Se encuentra asociado a una cañada permanente y también se muestreó desde los 0 m hasta los 20 m hacia el interior del bosque.
Cultivos
Si bien el cultivo de caña de azúcar para producción panelera es el sistema más común en la región, existen otros cultivos con diferentes usos (e.g., consumo humano directo o uso agrícola) los cuales se incluyeron en el muestreo para abarcar la heterogeneidad de la matriz antropogénica. Esta categoría agrupo 3 tipos de cultivo: a) caña de azúcar (Saccharum officinarum), monocultivo con más de 20 años de sembrado, fertilizado con Triple 15 (15% de nitrógeno, 15% de potasio y 15% fófosforo) y cosechado cada 8 meses. El manejo específico que se le da a este cultivo es realizar la poda a las plantas y la hojarasca generada es acumulada en el suelo para mantener la humedad del suelo. Asociado a un cuerpo de agua lotico natural o cañada. b) Cacao (Theobroma cacao), se cultivó en el año 2009 y está asociado a plantas dispersas de Musa acuminata. Es fumigado a lo largo del año dependiendo de la presencia de plagas y también es fertilizado con Triple 15. En esta cobertura se deja acumular la hojarasca en el suelo con la misma finalidad del cultivo de caña. Asociado a un cuerpo de agua lotico natural o cañada. Y c) cultivo mixto, tiene frutales como Psidium guajaba, Citrus sp., y Persea americana, con una edad de 12 años. Esta cobertura no es cosechada masivamente y solo se aprovecha para el consumo de las personas de la finca y en algunas ocasiones para el forrajeo de los caballos. Asociado a un bebedero artificial para ganado.
Potreros
Predomina el pasto introducido Brachiaria decumbens con rotación periódica de ganado Cebú. Se realizan podas mensuales del pasto para aportar materia orgánica a los suelos por medio de la descomposición, al cortarlo y dejarlo sobre el sustrato. Algunos de los potreros de la región fueron inicialmente cultivos de guanábana (Annona muricata), sistema productivo altamente demandante de agroquímicos. Cada uno de los potreros seleccionados tuvo presencia del ganado durante la fase de muestreo. a) Potrero con árboles nativos: contiene árboles nativos dispersos que sirven de sombra para el ganado. En el año 2010 se utilizaba como cultivo de guanábana mezclado con árboles nativos dispersos. Tras la muerte de los árboles de guanábana, solo los árboles nativos quedaron en pie y se comenzó a utilizar como potrero; en este sitio, el pasto es más alto (cerca de 50 cm de altura) que en los demás potreros y está asociado a una represa artificial permanente; b) potrero con guanábanos muertos: se usó como cultivo de guanábana (Annona muricata), el cual fue abandonado en el año 2009 y en la actualidad, solo presenta árboles muertos de guanábana como único elemento que incrementa la estructura vegetal. En este sitio los pastos compiten con herbáceas nativas (Verbena sp.) producto de la sucesión natural; c) potrero sin árboles: el potrero se estableció en el año 2010 a partir de la deforestación del bosque nativo. Presenta alto grado de pisoteo por parte del ganado y se encuentra cerca de un cuerpo de agua de tipo lotico natural o cañada que tiene vegetación de Guadua angustifolia.
En el presente estudio se realizaron 5 muestreos de anfibios, de los cuales 3 representaron la temporada de sequía (entre los meses julio y agosto de 2013) y 2 la temporada de lluvias (entre septiembre y octubre de 2013). En cada cobertura vegetal se establecieron 6 transectos permanentes de 20 × 2 m, exceptuando la zona interna del bosque, el cual fue muestreado a partir de 5 transectos, debido a restricciones espaciales hacia el centroide del fragmento de 0.35 ha. La distancia mínima entre coberturas vegetales fue de 300 m y dentro de cada cobertura, la distancia mínima entre transectos fue de 10 m. En el caso de las coberturas de potreros y cultivos, adicionalmente, los transectos se ubicaron a 10 m de otros elementos del paisaje tales como cercas vivas y bordes de bosque para reducir el efecto del borde de cobertura arbórea sobre la matriz (Schneider-Maunoury et al., 2016).
Cada transecto fue muestreado durante 20 minutos por una persona usando el método de búsqueda visual y captura manual (Angulo et al., 2006), desde 0 hasta 2 m de altura desde el suelo, limitando el estudio al ensamblaje de anfibios de la porción baja del sotobosque (Urbina-Cardona y Reynoso, 2005). Durante cada salida al campo, cada transecto fue muestreando durante el día (entre las 6:00 y las 15:00 horas) y la noche (entre las 18:00 y 24:00 horas). Se realizó la identificación en campo usando guías, claves y descripciones taxonómicas de las especies (Gallego et al., 2008; Köhler, 2011; Lynch, 1999; Medina-Rangel et al., 2011). Todos los organismos fueron medidos y liberados en el sitio donde fueron capturados. Los individuos no fueron marcados debido a la baja tasa de recaptura que tiene la herpetofauna en los ambientes neotropicales (Cabrera-Guzmán y Reynoso, 2012; Moreno-Arias y Urbina-Cardona, 2013).
Para caracterizar el gradiente ambiental en las coberturas vegetales, se midieron 17 variables de la estructura de la vegetación y del ambiente a nivel de microhábitat o por transecto. Para cada transecto, en cada una de las 9 coberturas vegetales se midieron 6 variables estructurales siguiendo el protocolo propuesto por Urbina-Cardona et al. (2015): 1) la hojarasca, enterrando 3 veces una vara de punta afilada de metal y promediando el número total de hojas ensartadas en la punta de la vara; 2) el porcentaje de cobertura del dosel, utilizando un densiómetro (Lemmon, 1956); 3) la densidad del sotobosque, medida con una vara de 3.5 cm de diámetro y 2 m de alto, contando el número de contactos con las hojas, troncos y ramas; 4) el pH del suelo; 5) la pendiente topográfica, medida con un clinómetro, y 6) la distancia a los cuerpos de agua, utilizando la función “Go to” del GPS desde el cuerpo de agua más cercano a cada transecto.
A nivel del microhábitat, se midieron 11 variables donde se vio por primera vez cada individuo (para los 88). Se midió: 7) la temperatura del sustrato utilizando un termómetro laser. Con un anemómetro digital se midieron: 8) la temperatura ambiental, 9) humedad ambiental, 10) la velocidad del viento y 11) la presión barométrica. Utilizando un cuadrante de 0.5 × 0.5 m, se obtuvieron: 12) el porcentaje de cobertura herbácea, 13) la cobertura de hojarasca y 14) la cobertura de suelo desnudo. Con una regla graduada se midieron: 15) la altura de percha y 16) la profundidad de la hojarasca. Finalmente, se calculó 17) la luminosidad con un luxómetro.
De los organismos registrados en el presente estudio (n = 88), únicamente para 69 individuos fue posible tomar medidas corporales. La longitud rostro-cloacal y el ancho cefálico fueron obtenidas con un calibrador pie de rey de 0.01 mm de precisión; la biomasa con una pesa digital de alta precisión (0.01 gr).
Para explorar el gradiente ambiental y estructura entre las coberturas vegetales naturales y antropogénicas, se realizó un análisis de componentes principales utilizando los paquetes ade4 (Dray y Dufour, 2007) y ggplot2 (Wickham, 2016) en R versión 3.6.1 (R Development Core Team, 2021). Asímismo, se reporta la estadística descriptiva de las variables medidas a nivel de transecto para cada cobertura vegetal (tabla 1).
Se evaluó la riqueza esperada de especies utilizando el programa EstimateS 9.1 (Colwell, 2013). Para el paisaje de estudio se utilizaron los estimadores jackknife de 1 y 2 orden, debido a que suponen heterogeneidad en el hábitat entre las muestras y tienen desempeño eficiente con pequeñas muestras a escala local (Colwell y Coddington, 1994; Magurran, 2004). Para la riqueza en cada cobertura vegetal, se utilizó Chao 1 y 2, que suponen homogeneidad del hábitat en las muestras (Magurran, 2004).
Para determinar el efecto en la diversidad taxonómica, por parte del tipo de cobertura vegetal, la temporada climática y su interacción se utilizó un análisis multivariado de la varianza basado en permutaciones (rutina Permanova del programa PRIMER v6.1.14 y Permanova v1.0.4; Anderson et al., 2008; Clarke y Gorley, 2006). Con la abundancia de cada especie (transformada a raíz cuadrada) por transecto, se calculó una matriz de similitud de Bray-Curtis para determinar cambios en la composición del ensamblaje. Para determinar cambios en la riqueza de anfibios se calcularon matrices de distancias euclidianas. El diseño experimental incluyó el tipo de cobertura (con siete niveles: zona interna del bosque, borde lineal de bosque, borde pendiente de bosque, cacao, caña de azúcar, cultivo mixto y potrero con árboles nativos) y la temporada climática (lluvias o secas). Los factores e interacciones significativos (p perm < = 0.05) se evaluaron a partir de una prueba de t de Student realizando 9,999 permutaciones. Cuando fue posible realizar más de 100 permutaciones de los valores entre los transectos se reporta el valor de p permutada; y cuando las permutaciones posibles son menores a 100 se reporta el valor de p simulada de Monte Carlo (Anderson et al., 2008). Para determinar las especies responsables de la similitud en la composición (entre transectos) en una misma cobertura y disimilitud entre coberturas por temporada climática se utilizó la rutina SIMPER (PRIMER v6.1.14 y Permanova v1.0.4; Anderson et al., 2008).
A partir del protocolo de medición de rasgos funcionales para anfibios (Cortés-Gómez et al., 2016), se obtuvieron 4 rasgos funcionales que representan facetas de la historia natural de las especies (hábito diurno o nocturno, hábitat preferencial, tipo de forrajeo y modo reproductivo). Adicionalmente, se midieron en campo 2 rasgos funcionales (biomasa y volumen) que determinan el desempeño de los individuos desde su termorregulación y la regulación hídrica (Navas y Otani, 2007; Nowakowski et al., 2017). La tabla 2 provee una descripción del rasgo, su variación (atributo o estado del rasgo), las relaciones con los procesos ecosistémicos y la variación ambiental.
Para determinar el volumen, basado en la relación entre longitud rostro-cloaca y ancho cefálico (Valderrama-Vernaza et al., 2009), se utilizó la siguiente formula:
Volumen anfibio = (4π/3) × (longitud rostro-cloaca)/
2 × (ancho cefálico2)/2
A partir del valor promedio de los 6 rasgos funcionales por especie, se clasificaron a las especies de anuros utilizando el análisis de regresión-clasificación (rutina LINKTREE). Los rasgos continuos se transformaron a logaritmo en base 10 y los rasgos categóricos se transformaron a presencia-ausencia como variables “dummy”. Con esta base de datos se calculó una matriz de similitud de Gower entre especies. Se determinaron los grupos funcionales a partir de la validación estadística de la clasificación de especies por medio de los perfiles de similitud (rutina SIMPROF). Se utilizó la rutina Permanova para determinar si existen diferencias en la frecuencia relativa de los grupos funcionales entre las coberturas vegetales y temporadas, calculando una matriz de similitud de Bray Curtis. Estos análisis se realizaron en el programa PRIMER v6.1.14 y Permanova v1.0.4 (Anderson et al., 2008).
La DF se calculó a partir de índices de riqueza basados en la longitud de las ramas del árbol funcional, como una expresión del espacio funcional que ocupan las especies en cada ensamblaje (Schleuter et al., 2010). Utilizando la medida de distancia de Gower y el algoritmo UPGMA (mayor correlación cofenética) se calculó el índice de riqueza funcional (FDpg; Petchey y Gaston, 2002, 2006, 2007) y sus 2 variaciones (Gagic et al., 2015): el índice ponderado por el total de la abundancia de cada cobertura vegetal (FDw) y el índice ponderado con la abundancia total de la comunidad (FDwcomm). Los índices anteriores se calcularon utilizando el paquete fundiv (Gagic et al., 2015) y las gráficas de violines en ggplot2 (Wickham, 2016) en R versión 3.6.1 (R Development Core Team, 2021). Para determinar si los valores de los índices de riqueza funcional varían entre temporadas y coberturas vegetales se utilizó la rutina Permanova (programa PRIMER v6.1.14 y Permanova v1.0.4; Anderson et al., 2008), creando una matriz de distancias euclidianas para cada índice y bajo la configuración de los permanovas realizados para las variables de diversidad taxonómica y grupos funcionales.
Resultados
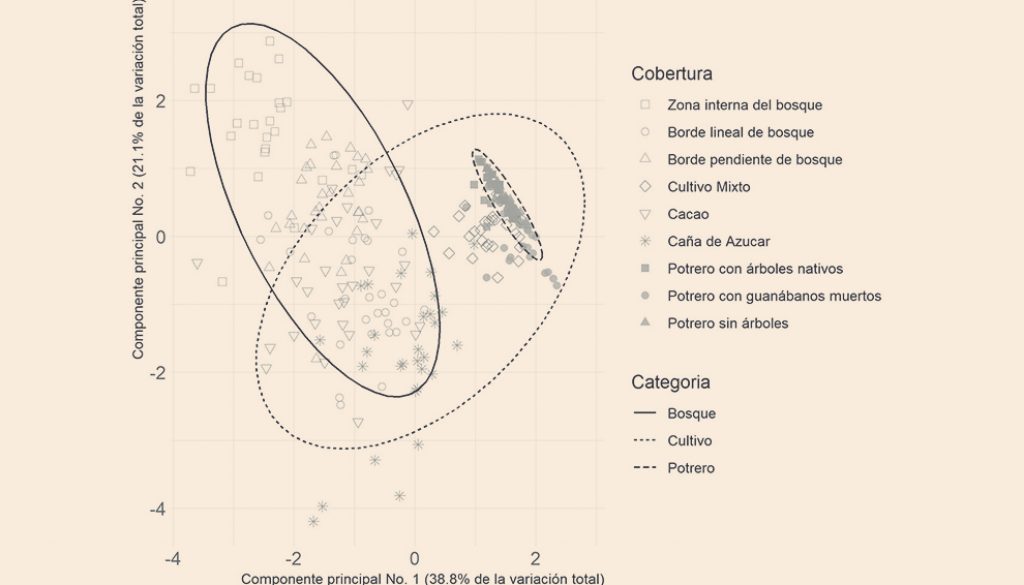
Al caracterizar las coberturas vegetales desde su clasificación amplia (bosques, cultivos y potreros) se evidenció que los boques se caracterizaron por presentar la mayor pendiente (49%), cobertura de dosel (92%) y pH del suelo (6.46), mientras que los cultivos presentan la mayor densidad de sotobosque y menor distancia a cuerpos de agua (tabla 1). Al evaluar cada una de las 9 coberturas vegetales, considerando su uso del suelo se pudo evidenciar que la zona interna del bosque es la cobertura que tiene la mayor pendiente (62%), cobertura de dosel (94%) y mayor cercanía a cuerpos de agua (19 metros). El cultivo de cacao es el sitio que tiene la mayor cantidad de hojarasca (2.3 hojas secas), mientras que el cultivo de caña tiene la mayor densidad de sotobosque (2.63 hojas secas) y es la cobertura que presenta mayor distancia a cuerpos de agua (81 metros). El cultivo mixto tiene características similares en términos de las variables ambientales a los potreros, pues presentó una baja cantidad de hojarasca (0.1 hojas secas) y densidad de sotobosque (0.1 toques) (tabla 1). En cuanto a la ordenación de las coberturas vegetales acorde con el gradiente ambiental, el análisis de componentes principales (fig. 1) permitió identificar que los potreros son muy homogéneos en su gradiente ambiental, seguido por los cultivos mixtos. Mientras que tanto los bosques como los cultivos de cacao y caña de azúcar presentan una alta variación ambiental y estructural.
Tabla 1
Caracterización del gradiente ambiental y de estructura vegetal presente en el mosaico de coberturas vegetales naturales y antropogénicas.
|
Variables |
Pendiente |
Cobertura de dosel |
Densidad de sotobosque |
pH |
Distancia a cuerpos de agua |
Hojarasca (número de hojas en el suelo) |
||||||||||||
|
Coberturas vegetales |
Media |
Rango |
DE |
Media |
Rango |
DE |
Media |
Rango |
DE |
Media |
Rango |
DE |
Media |
Rango |
DE |
Media |
Rango |
SD |
|
Bosque |
49.35 |
78.1-8.75 |
20.1 |
92.54 |
97.8-46.8 |
7.9 |
1.28 |
6-0 |
1.1 |
6.46 |
7.8-5.7 |
0.4 |
72.8 |
145-10 |
44.2 |
1.35 |
3.33-0 |
0.7 |
|
Zona interna del bosque |
62.35 |
78.1-40.4 |
13.9 |
94.09 |
97.8-87.1 |
2.1 |
0.92 |
3-0 |
1 |
6.66 |
7.2-6 |
0.4 |
19.8 |
31-10 |
7.3 |
1.75 |
3.33-0.67 |
0.7 |
|
Borde pendiente de bosque |
59.45 |
70-51 |
6.05 |
91.63 |
96.7-46.8 |
12.1 |
1.63 |
6-0 |
1.2 |
6.18 |
6.9-5.7 |
0.3 |
67.8 |
88-30 |
20.8 |
0.92 |
2-0 |
0.6 |
|
Borde lineal de bosque |
28.42 |
57.7-8.75 |
16.3 |
92.14 |
97.5-67.9 |
5.4 |
1.23 |
3-0 |
1 |
6.57 |
7.8-6 |
0.4 |
121.8 |
145-105 |
15.7 |
1.46 |
2.67-1 |
0.4 |
|
Cultivo |
29.01 |
53.2-12.3 |
11.2 |
47.94 |
82.2-1.6 |
21.5 |
1.44 |
8-0 |
1.7 |
5.91 |
6.8-5.2 |
0.3 |
68.4 |
101-27 |
20.5 |
1.24 |
7-0 |
1.2 |
|
Cacao |
39.69 |
53.2-23.1 |
9.6 |
60.79 |
82.2-27.6 |
14.7 |
1.6 |
4-0 |
1.4 |
6.03 |
6.5-5.4 |
0.2 |
61.8 |
97-27 |
25.4 |
2.3 |
3-0 |
1.4 |
|
Caña de azúcar |
21.75 |
36.4-12.3 |
9.46 |
55.59 |
73.3-22.6 |
13 |
2.63 |
8-0 |
1.9 |
5.84 |
6.8-5.3 |
0.4 |
81.2 |
101-58 |
16.7 |
1.33 |
0.67-0 |
0.6 |
|
Cultivo mixto |
25.59 |
32.5-21.3 |
4.2 |
27.44 |
77-1.6 |
19.2 |
0.1 |
1-0 |
0.3 |
5.87 |
6.3-5.2 |
0.3 |
62.2 |
76-47 |
10.9 |
0.1 |
7-0 |
0.2 |
|
Potrero |
34.42 |
53.2-12.3 |
10.5 |
1.25 |
14.3-0 |
2.5 |
0.07 |
2-0 |
0.3 |
6.04 |
6.8-5.3 |
0.3 |
90.2 |
133-47 |
30 |
0.04 |
0.1 |
0.1 |
|
Potrero con árboles nativos |
45.36 |
53.2-34.4 |
6.19 |
1.85 |
7.5-0 |
2.1 |
0.03 |
1-0 |
0.2 |
6.2 |
6.5-6 |
0.2 |
118 |
133-111 |
8.3 |
0.03 |
0.67-0 |
0.1 |
|
Potrero con árboles muertos |
29.55 |
44.5-12.3 |
9.91 |
1.52 |
14.3-0 |
3.5 |
0.17 |
2-0 |
0.5 |
5.97 |
6.8-5.3 |
0.3 |
102.2 |
119-92 |
9.2 |
0.06 |
0.67-0 |
0.2 |
|
Potrero |
28.34 |
34.4-23.1 |
4.14 |
0.37 |
6.8-0 |
1.3 |
0 |
0-0 |
0 |
5.96 |
6.4-5.6 |
0.2 |
50.3 |
58-47 |
3.7 |
0.02 |
0.33-0 |
0.1 |
Tabla 2
Listado de rasgos utilizados para el análisis de diversidad funcional. * Rasgos medidos a partir de valores categóricos.
|
Tipo de rasgo |
Rasgo |
Atributo |
Relacion con procesos en el ecosistema |
Respuesta a la variación ambiental |
|
Morfométrico |
Biomasa |
Valor del rasgo en gr. |
Relacionado con el reciclaje de nutrientes y flujo de energía a través de cadenas tróficas como depredador o presa |
Asociados a procesos de termorregulación y adquisición de agua |
|
Volumen |
Valor del rasgo en mm3 |
|||
|
Ecológico |
Hábito |
Diurno o nocturno* |
Rasgo relacionado con el flujo de energía a través de cadenas tróficas como depredador y presa |
Relacionado con el aporte en materia y energía diferencial en tiempo |
|
Hábitat preferencial |
Arborícola, fosorial o terrestre* |
Rasgo relacionado con el reciclaje de nutrientes y flujo de energía a través de cadenas tróficas como depredador y presa |
Relacionado con el balance de materia y energía diferencial en el espacio |
|
|
Tipo de forrajeo |
Estrategia de forrajeo* |
Rasgo relacionado con el reciclaje de nutrientes y flujo de energía a través de cadenas tróficas como depredador |
Relacionado con el flujo de materia y energía y balance energético para la consecución de presas |
|
|
Modo reproductivo |
Huevos depositados en el agua loticos * |
Rasgo relacionado con el flujo de energía a través de cadenas tróficas como depredador o presa |
Relacionado con el balance energético diferencial para la producción de descendientes |
|
|
Huevos en nidos de espuma en cuerpos de agua lenticos * |
||||
|
Desarrollo directo de huevos en ambientes terrestres o arbóreos * |
||||
|
Huevos llevados por adultos* |
Después de un esfuerzo de 176 horas/hombre se registraron 88 individuos en 11 especies (tabla 3). En las coberturas de potrero, solo se encontró un individuo de Leptodactylus fragilis utilizando el potrero arbolado, mientras que en el potrero con guanábanos muertos y el potrero sin árboles no se encontró ningún anfibio durante los muestreos (tabla 3). La representatividad del muestreo varió entre 60 a 75% para el total del área de estudio y para cada cobertura, los valores de representatividad oscilaron entre 70 y 80% (tabla 4). Sin embargo, no se encontraron diferencias significativas en la riqueza al considerar la variación entre los transectos por temporada (pseudo-F = 0.27; p perm = 0.6), por cobertura vegetal (pseudo-F = 1.65; p perm = 0.15), o en la interacción entre temporada y cobertura vegetal (pseudo-F = 0.52; p perm = 0.66) (tabla 5).
La composición de anfibios no varió por efecto de la temporada (pseudo-F = 1.94; p perm = 0.11), pero sí por efecto del tipo de cobertura vegetal (pseudo-F = 2.52; p perm = 0.001) y la interacción entre temporada y cobertura vegetal (pseudo-F = 2.01; p perm= 0.04) (tabla 5). Al realizar la prueba “post hoc” del Permanova se encontró que el cultivo de caña de azúcar fue diferente, durante la temporada seca, a la zona interna del bosque (t = 1.92; p perm = 0.01) y el borde físico de bosque con alta pendiente topográfica (t = 1.88; p Monte Carlo = 0.029). A su vez, el cultivo de cacao fue diferente a la zona interna del bosque (t = 1.90; p perm = 0.04), al borde de bosque lineal (t = 2.09; p Monte Carlo = 0.04), al cultivo de caña (t = 2.27; p Monte Carlo = 0.01), al cultivo mixto (t = 8.7; p Monte Carlo = 0.003) y al potrero arbolado (t = 8.71; p Monte Carlo = 0.004). Para la temporada de lluvias, las diferencias entre coberturas se simplificaron manteniendo solamente las diferencias entre la caña de azúcar con la zona interna del bosque (t = 1.69 p Monte Carlo = 0.04) y con el cultivo de cacao (t = 2.09; p Monte Carlo = 0.02). El análisis SIMPER indicó que, dadas sus dominancias, las especies que aportan en mayor medida a la disimilitud entre temporadas fueron Pristimantis taeniatus, Dendrobates truncatus, Bolitoglossa lozanoi y Rhinella sternosignata, con una contribución de 32, 25, 12 y 10%, respectivamente. La especie P. taeniatus dominó el ensamblaje de anfibios tanto para la temporada seca como de lluvias, pero D. truncatus fue dominante en sequía. A excepción de la caña de azúcar, en todas las coberturas vegetales las 2 especies dominantes fueron P. taeniatus y D. truncatus (tabla 3).
Diversidad funcional de anuros en diferentes usos del suelo
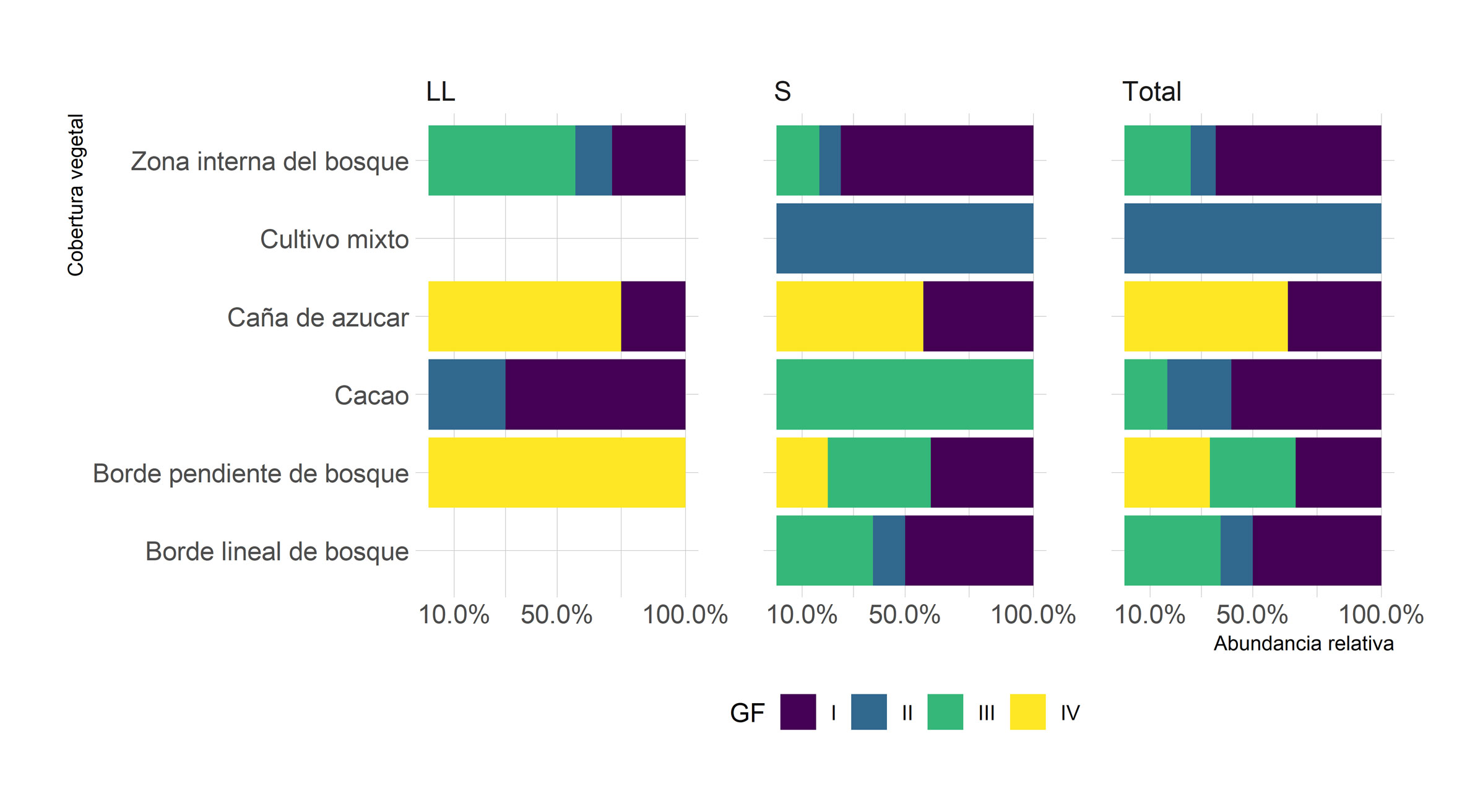
A partir de los rasgos funcionales medidos (tabla 2), las especies de anfibios se agruparon en cuatro grupos funcionales (fig. 2), de los cuales el grupo I presentó la mayor redundancia (número de especies dentro del grupo funcional) al representar 44% de las especies, seguido de los grupos III y IV, cada uno con 2 especies (fig. 2). El árbol de regresión y clasificación permitió identificar los rasgos que generan las divisiones binarias entre los grupos, así (fig. 2): la división A entre el grupo funcional IV y el resto de grupos se basó en cambios en los rasgos de hábitat (arborícola o terrestre) y la longitud rostro-cloacal de las especies, con un aporte a la disimilitud de 94% (R = 0.84); la siguiente división B entre el grupo III y los otros dos grupos (I y II) se dio por el hábito (diurno o nocturno) y la presencia de cuidado parental, con un aporte a la disimilitud del 67% (R = 1.0); la última división C se dio entre el grupo funcional I y II, debido a la longitud rostro-cloacal, el peso, el volumen y el modo reproductivo, con un aporte a la disimilitud de 33% (R = 1.0) (fig. 2). El grupo I, aunque es común a lo largo del gradiente de coberturas vegetales, presenta la mayor abundancia de individuos en los bosques; el grupo funcional III es abundante en bosques y se reduce en cultivos, donde es poco común. Para el caso de los demás grupos, tanto II y IV son más abundantes en cultivos (fig. 3). Los grupos funcionales más frecuentes en bosques fueron los que presentaron anuros nocturnos, terrestres, con biomasa entre 0.15 y 1.8 g y volumen entre 150 y 2,893 mm3 (grupo I), o anuros diurnos, terrestres que presentan cuidado parental, peso entre 0.39 y 1.86 g y volumen entre 1,017 y 2,444 mm3 (grupo III); mientras que los grupos más abundantes en cultivos fueron los anfibios nocturnos, con biomasas entre 2.5 y 6.9 g y volumen entre 3,131 y 13,513 mm3 (grupos funcionales II y IV). La frecuencia relativa de grupos funcionales no mostró diferencias significativas por temporada (pseudo-F = 2.02; p perm = 0.13), pero si fue diferente para las coberturas (pseudo-F = 2.91; p perm = 0.001) y en la interacción entre la temporada y la cobertura vegetal (pseudo-F = 3.23; p perm = 0.005). De todas las coberturas vegetales, solo el cultivo de cacao varió entre temporadas de lluvias y sequía (t = 3.27; p perm = 0.026). En la temporada de sequía, la caña de azúcar fue diferente a la zona interna del bosque (t = 1.96; p perm = 0.026), esta misma zona interna del bosque fue diferente al cultivo de cacao (t = 2.31; p Monte Carlo = 0.034) y el cultivo de cacao fue diferente a la caña de azúcar (t = 2.11; p Monte Carlo = 0.033). Mientras que, en la temporada de lluvias la caña de azúcar fue diferente del cultivo de cacao (t = 2.58; p Monte Carlo = 0.011) y de la zona interna del bosque (t = 2.02; p Monte Carlo = 0.04); y el cultivo de cacao fue diferente del borde de bosque lineal (t = 2.27; p Monte Carlo = 0.03) y de la zona interna del bosque (t = 2.33; p Monte Carlo = 0.022).
Tabla 3
Riqueza y abundancia de anuros por cobertura vegetal y temporada climática en los Andes de Colombia. GF = Código del grupo funcional al que pertenece cada especie (figs. 2, 3). Adicionalmente se presenta el volumen y biomasa promedio por especie.
|
|
|
Bosque |
Cultivo |
Potrero |
Total |
Volumen promedio (mm3) |
Biomasa promedio (gr) |
||||||||
|
Familia |
GF |
Zona interna del bosque |
Borde pendiente de bosque |
Borde lineal de bosque |
Cacao |
Caña de Azúcar |
Cultivo Mixto |
Potrero con árboles dispersos |
|||||||
|
Especie |
TH |
TS |
TH |
TS |
TS |
TH |
TS |
TH |
TS |
TS |
TH |
||||
|
Plethodontidae |
|
||||||||||||||
|
Bolitoglossa lozanoi |
IV |
3 |
4 |
7 |
4,081.8 |
2.7 |
|||||||||
|
Dendrobatidae |
|
||||||||||||||
|
Colostethus sp. |
III |
1 |
1 |
1,017.9 |
0.4 |
||||||||||
|
Dendrobates truncatus |
4 |
6 |
1 |
5 |
3 |
4 |
23 |
2,542.3 |
1.9 |
||||||
|
Hylidae |
|
||||||||||||||
|
Boana xerophylla |
IV |
1 |
1 |
2 |
13,513 |
7,0 |
|||||||||
|
Leptodactylidae |
|
||||||||||||||
|
Engystomops pustulosus |
I |
1 |
1 |
2 |
2,893.4 |
1,8 |
|||||||||
|
Leptodactylus cf fragilis |
N/A |
1 |
1 |
N/A |
N/A |
||||||||||
|
Ranidae |
|
||||||||||||||
|
Lithobates vaillanti |
N/A |
1 |
1 |
N/A |
N/A |
||||||||||
|
Craugastoridae |
|
||||||||||||||
|
Pristimantis gaigei |
I |
1 |
2 |
3 |
2,217.96 |
1.11 |
|||||||||
|
Pristimantis sp |
1 |
1 |
150.80 |
0.15 |
|||||||||||
|
Pristimantis taeniatus |
3 |
17 |
1 |
3 |
4 |
7 |
2 |
2 |
39 |
1,979.99 |
0.92 |
||||
|
Bufonidae |
|
||||||||||||||
|
Rhinella sternosignata |
II |
1 |
2 |
1 |
3 |
1 |
8 |
5,741.45 |
4.05 |
||||||
|
Abundancia total |
|
10 |
29 |
3 |
9 |
8 |
11 |
4 |
5 |
7 |
1 |
1 |
88 |
||
|
Riqueza total |
5 |
6 |
3 |
3 |
3 |
3 |
1 |
2 |
3 |
1 |
1 |
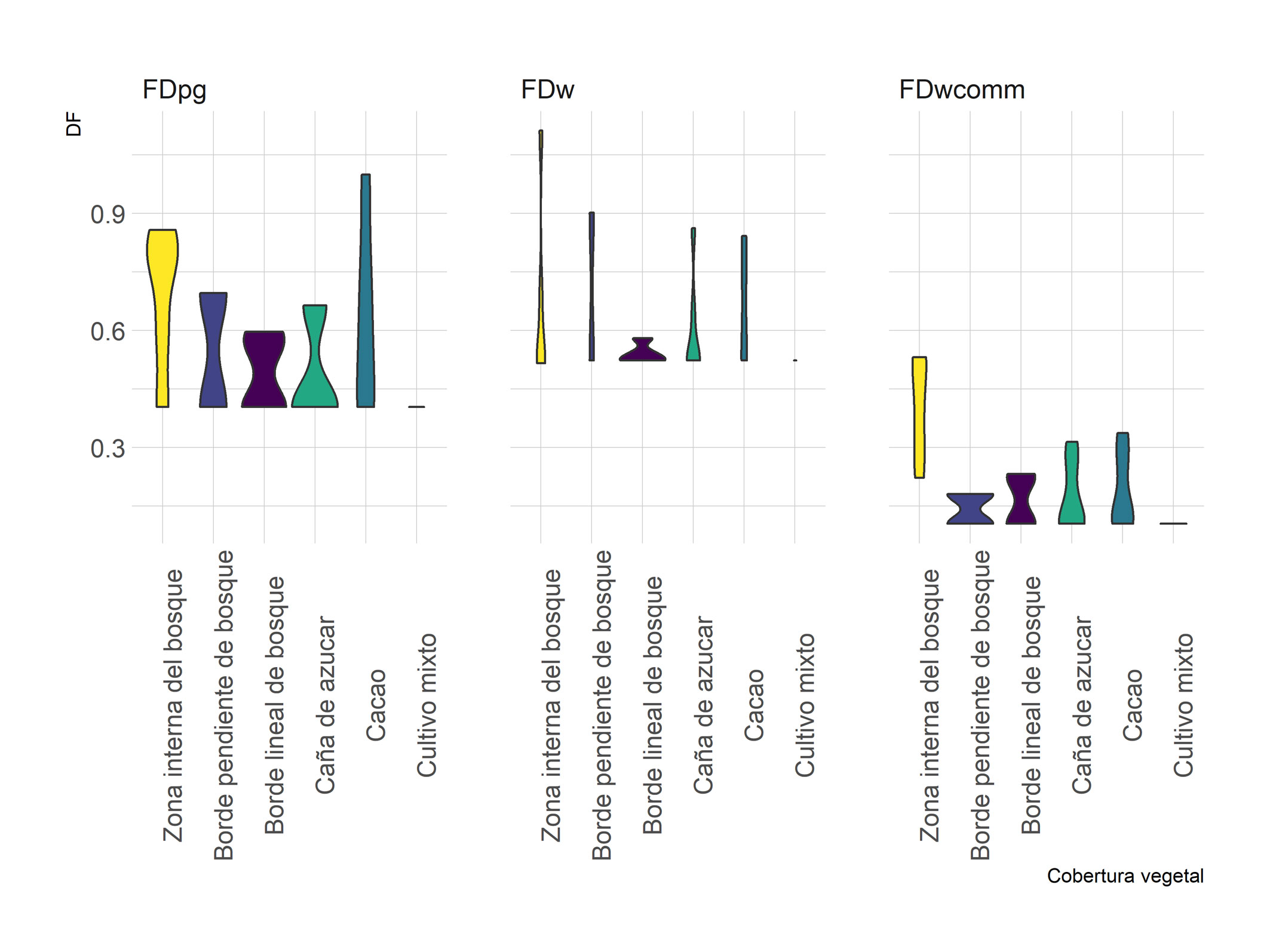
Las diferencias en la frecuencia relativa de grupos funcionales (número de especies dentro de cada grupo funcional por transecto) para la temporada de lluvias se presentaron entre cultivos de cacao con: borde lineal de bosque (t = 3.21; p Monte Carlo = 0.007) y caña de azúcar (t = 2.18; p Monte Carlo = 0.04). Durante la temporada de sequía se encontraron diferencias entre cultivos de cacao con la zona interna del bosque (t = 3.65; p Monte Carlo = 0.02) y caña de azúcar (t = 2.01; p Monte Carlo = 0.036), así como entre la zona interna del bosque con: cultivo mixto (t = 3.303; p Monte Carlo = 0.0314) y caña de azúcar (t = 2.37; p Monte Carlo = 0.012). Para el índice de DF basado en el dendrograma, los valores variaron entre 0.105 a 1.1.15, con los valores más altos por transecto para las coberturas de la zona interna del bosque (FDw = 1.11, FDpg = 0.85 y FDwcomm = 0.53), cultivo de cacao (FDpg = 1, FDw = 0.52, FDwcomm = 0.33) y borde pendiente de bosque para (FDw = 0.90, FDpg = 0.69, FDwcomm = 0.18) (fig. 4).
Tabla 4
Número de especies de anfibios observada (S obs.) y el valor de los estimadores de riqueza para cada cobertura vegetal muestreada y la totalidad del paisaje en los Andes de Colombia. N/A: Indica que no se calcularon los estimadores a ese nivel dado que, al sumar los datos de las coberturas a nivel de paisaje, no se cumple con los supuestos de homogeneidad ambiental para calcular Chao 1 y 2. Así mismo, no se calculó Jack 1 y 2 por cobertura vegetal dado que asume heterogeneidad en el hábitat. En el caso de los cultivos mixtos y potreros con árboles nativos el bajo número de especies no permitió el cálculo de ningún estimador.
|
Estimador |
Paisaje |
Zona interna del bosque |
Borde pendiente de bosque |
Borde lineal de bosque |
Cacao |
Caña de azúcar |
Cultivo mixto |
Potrero con árboles nativos |
|
Abundancia |
88 |
39 |
12 |
8 |
15 |
12 |
1 |
1 |
|
S obs. |
11 |
7 |
3 |
3 |
4 |
3 |
1 |
1 |
|
Jack 1 |
14,94 |
N/A |
N/A |
N/A |
N/A |
N/A |
N/A |
N/A |
|
Jack 2 |
16,91 |
N/A |
N/A |
N/A |
N/A |
N/A |
N/A |
N/A |
|
Chao 1 |
N/A |
9,92 |
3 |
3 |
4 |
3 |
N/A |
N/A |
|
Chao 2 |
N/A |
9,7 |
3 |
3,75 |
5,6 |
3,4 |
N/A |
N/A |
El análisis Permanova permitió identificar que el índice de riqueza funcional (FDpg) no varió entre temporadas (pseudo-F = 0.38; p perm = 0.52), coberturas vegetales (pseudo-F = 0.61; p perm = 0.66) o la interacción entre ambos factores (pseudo-F = 1.4; p perm = 0.23). El índice ponderado por el total de la abundancia de cada cobertura vegetal (FDw) tampoco presentó diferencias entre coberturas vegetales (pseudo-F = 0.08; p perm = 0.98) entre temporadas (pseudo-F = 0.22; p perm = 0.63) o en la interacción entre ambos factores (pseudo-F = 0.34; p perm = 0.75). Finalmente, el índice ponderado por la abundancia de la comunidad (FDwcomm) solamente presentó diferencias significativas para las coberturas (pseudo-F = 3.8; p perm = 0.009), en donde la zona interna del bosque fue diferente de todas las otras coberturas vegetales presentando diferencias significativas con el cultivo de cacao (t = 2,91; p perm = 0,014), el borde lineal de bosque (t = 4.65; p perm = 0.0008), el borde pendiente bosque (t = 3.7; p perm = 0.0019), el cultivo de caña de azúcar (t = 4.01; p perm = 0.0037) y el cultivo mixto (t = 3.65; p perm = 0.031) (fig. 4; tabla 5).
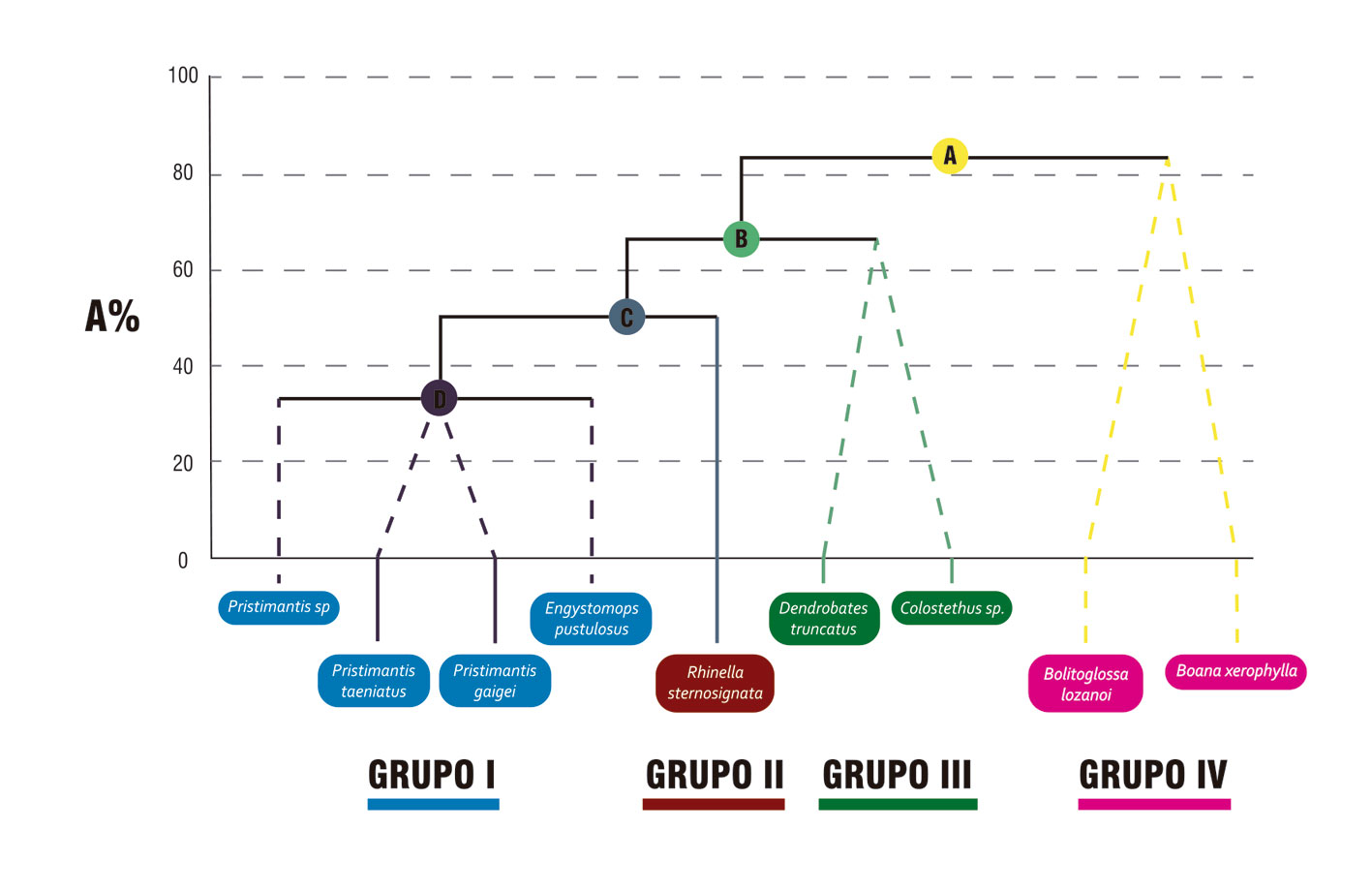
Tabla 5
Resultados de los Permanova para la diversidad taxonómica (riqueza y composición de especies) y funcional (índices de diversidad funcional y frecuencia relativa de grupos funcionales) de anuros que habitan en coberturas vegetales naturales y antropogénicas en los Andes de Colombia. FDpg = Índice de riqueza funcional de Petchey y Gaston (2006, 2007); FDw = índice ponderado por el total de la abundancia de cada cobertura vegetal y FDwcomm = índice ponderado con la abundancia total de la comunidad, propuestos por Gagic et al. (2015). ** indica la interacción entre la fuente de variación cobertura (CO) y temporada en la variable respuestas, mientras que en negritas se indican los valores de p significativos (probabilidad permutada < 0.05).
|
Fuente de variación |
GL |
SS |
MS |
Pseudo-F |
p (perm) |
Permutaciones |
Componente estimado de variación |
||
|
|
Estimado |
Raíz cuadrada |
|||||||
|
Riqueza de especies |
Cobertura (CO) |
6 |
2.2785 |
0.37976 |
1.6534 |
0.1524 |
9,943 |
0.022565 |
0.15022 |
|
Temporada (TE) |
1 |
0.062157 |
0.062157 |
0.27062 |
0.6054 |
9,836 |
0.0083826 |
0.091557 |
|
|
COxTE** |
3 |
0.3617 |
0.12057 |
0.52493 |
0.6619 |
9,956 |
0.021021 |
0.14499 |
|
|
Residuales |
46 |
10.565 |
0.22968 |
0.22968 |
0.47925 |
||||
|
Total |
56 |
14.035 |
|||||||
|
Composición de especies |
Cobertura (CO) |
6 |
43,576 |
7,262.7 |
25,229 |
0.0002 |
9,904 |
659.18 |
25,674 |
|
Temporada (TE) |
1 |
5,596.7 |
5,596.7 |
19,442 |
0.1144 |
9,958 |
136 |
11,662 |
|
|
COxTE** |
3 |
17,414 |
5,804.7 |
20,164 |
0.0443 |
9,940 |
563.7 |
23,742 |
|
|
Residuales |
46 |
1.32E+09 |
2,878.7 |
2,878.7 |
53,654 |
||||
|
Total |
56 |
1.95E+09 |
|||||||
|
Frecuencia relativa de grupos funcionales |
Cobertura (CO) |
5 |
33,110 |
6,622.1 |
2.9144 |
0.0011 |
9,921 |
749.81 |
27.383 |
|
Temporada (TE) |
1 |
4,688 |
4,688 |
2.0632 |
0.1307 |
9,960 |
200.09 |
14.145 |
|
|
COxTE** |
3 |
22,022 |
7,340.8 |
3.2307 |
0.0057 |
9,926 |
1,402 |
37.444 |
|
|
Residuales |
36 |
81,800 |
2,272.2 |
2,272.2 |
47.668 |
||||
|
Total |
45 |
1.36E+05 |
|||||||
|
Fdwcomm |
Cobertura (CO) |
5 |
0.088178 |
0.017636 |
3.8705 |
0.0095 |
9,956 |
0.0028875 |
0.053735 |
|
Temporada (TE) |
1 |
0.00050775 |
0.00050775 |
0.11144 |
0.7479 |
9,847 |
0.00038167 |
0.019536 |
|
|
COxTE** |
3 |
0.023852 |
0.0079506 |
1.7449 |
0.1748 |
9,948 |
0.0011693 |
0.034195 |
|
|
Residuales |
23 |
0.1048 |
0.0045564 |
0.0045564 |
0.067501 |
||||
|
Total |
32 |
0.2397 |
|||||||
|
FDw |
Cobertura (CO) |
5 |
0.010075 |
0.0020151 |
0.088163 |
0.9882 |
9,944 |
0.0046011 |
0.067832 |
|
Temporada (TE) |
1 |
0.0050459 |
0.0050459 |
0.22077 |
0.6324 |
9,832 |
0.001679 |
0.040975 |
|
|
COxTE** |
3 |
0.023653 |
0.0078843 |
0.34496 |
0.7567 |
9,958 |
0.0051578 |
0.071818 |
|
|
Residuales |
23 |
0.52569 |
0.022856 |
0.022856 |
0.15118 |
||||
|
Total |
32 |
0.5715 |
|||||||
|
Tabla 5. Continúa |
|||||||||
|
Fuente de variación |
GL |
SS |
MS |
Pseudo-F |
p (perm) |
Permutaciones |
Componente estimado de variación |
||
|
|
Estimado |
Raíz cuadrada |
|||||||
|
FDpg |
Cobertura (CO) |
5 |
0.075229 |
0.015046 |
0.61545 |
0.6611 |
9,952 |
0.0020754 |
0.045557 |
|
Temporada (TE) |
1 |
0.0094508 |
0.0094508 |
0.38659 |
0.5277 |
9,829 |
0.0014137 |
0.037599 |
|
|
COxTE** |
3 |
0.10518 |
0.03506 |
1.4341 |
0.2377 |
9,948 |
0.0036562 |
0.060466 |
|
|
Residuales |
23 |
0.56227 |
0.024447 |
0.024447 |
0.15635 |
||||
|
Total |
32 |
0.78663 |
Discusión
El ensamblaje de anfibios evaluados presentó cambios entre coberturas naturales y antropogénicas, y estos patrones variaron entre temporadas de lluvias y sequía. Debido al estado de degradación de todos los bosques nativos remanentes, solo el fragmento que (por su forma y tamaño) presentó una zona interna del bosque, con distancias mayores a 20 m de cualquier matriz antropogénica. Este tipo de cobertura vegetal fue el que presentó mayor cobertura de dosel y cercanía a cuerpos de agua, obteniendo mayores valores de riqueza de especies y en el índice de riqueza funcional ponderado por la abundancia de la comunidad. En contraste, en las coberturas vegetales con baja complejidad en la estructura vegetal (potreros con diferentes usos) no se encontraron anfibios.
La clasificación de especies a partir de sus características ecológicas ha sido un común denominador en los estudios de comunidades bióticas (Blaum et al., 2011). Sin embargo, para los anfibios estos estudios han sido poco desarrollados, lo que deriva en un bajo número de publicaciones sobre diversidad funcional (DF) en coberturas vegetales naturales y antropogénicas (Álvarez-Grzybowska et al., 2020; Díaz-García et al., 2017; Hernandez-Ordonez et al., 2019; Ochoa-Ochoa et al., 2019; Riemann et al., 2017; Suazo-Ortuño et al., 2018). La clasificación de los anfibios en grupos funcionales permite evidenciar las diferencias ecológicas de las especies, más allá de su clasificación taxonómica y refleja la respuesta de las especies a los cambios ambientales (Luck et al., 2012). Asimismo, en paisajes rurales la DF permite determinar el grado de importancia de diferentes agroecosistemas para la conservación de los anfibios (Murrieta-Galindo et al., 2013).
De las medidas de DF utilizadas, la frecuencia relativa de grupos funcionales por cobertura permite evidenciar especies con rasgos funcionales diferentes que existen en un mismo espacio y tiempo, complementando nichos y favoreciendo los procesos ecológicos (Mouillot et al., 2011). En el caso del grupo funcional III (que comprende a las especies diurnas, terrestres, de alta biomasa y que forrajean hormigas y termitas), este se complementa en el uso de los recursos (Díaz y Cabido, 2001), así como el flujo de energía y la productividad secundaria asociada a la biomasa con los grupos funcionales de especies nocturnas (grupo funcional I en bosques y grupos funcionales II y IV en cultivos; figs. 2, 3). En el presente estudio, la frecuencia relativa de grupos funcionales solamente varió entre temporadas de lluvias y sequía dentro del cultivo de cacao (tabla 5). Acorde con los patrones reportados por Álvarez-Grzybowska et al. (2020), es posible que la similitud limitante sea el proceso más común en el gradiente de coberturas naturales y antropogénicas evaluado; mientras que, en el cultivo de cacao, el filtrado ambiental sería el responsable del recambio total de especies y grupos funcionales entre temporadas climáticas (tabla 3). Sin embargo, en futuros estudios es importante relacionar los cambios en los grupos funcionales de los anfibios, en función de los cambios temporales en la composición de su dieta (Luría-Manzano y Ramírez-Bautista, 2019a).
De manera complementaria, los altos valores del índice ponderado con la abundancia total de la comunidad (FDwcomm) en la zona interna del bosque sugieren que, de todas las coberturas vegetales evaluadas, en este bosque los anfibios presentan un mayor espacio funcional, lo que se traduce en un mejor potencial para explorar los recursos (Mason et al., 2005). Es importante que en futuros estudios se explore la relación entre la riqueza funcional y las variables que hacen que la zona interna del bosque sea diferente del resto de coberturas vegetales (ej. cobertura de dosel y cercanía a cuerpos de agua; tabla 1). Para las demás coberturas muestreadas se tiene una reducción en la riqueza funcional lo cual puede tener un efecto en el aporte de los anfibios a los procesos ecológicos como la productividad faunística secundaria y los flujo de materia y energía, claves en ecosistemas a diferentes escalas de importancia (Burton y Likens, 1975).
En el caso del grupo funcional compuesto por B. lozanoi y B. xerophylla (figs. 2, 3), las cuales son especies nocturnas y arborícolas (grupo funcional IV), estas representaron solo 10% de la abundancia del ensamblaje de anfibios y tienen distribución restringida al borde de bosque con alta pendiente y el cultivo de caña. En otras coberturas como la zona interna del bosque y el cultivo de cacao, la baja abundancia puede tener serias implicaciones en la disponibilidad de biomasa, debido a que los anfibios que tienen modos reproductivos en cuerpos de agua, además de generar los vínculos de energía entre ecosistemas terrestres y acuáticos (Regester et al., 2008), también influyen en la productividad primaria, en los flujos biogeoquímicos y en la cadena trófica de los sistemas acuáticos y terrestres (Vitt y Caldwell, 2009; Whiles et al., 2006).
El presente estudio resalta la importancia de considerar la identidad funcional y los rasgos de respuesta de las especies en estudios de ensamblajes (Luck et al., 2012). El análisis de la DF desde la clasificación de grupos funcionales puede ayudar a generar información ecológica para el análisis de los efectos de la transformación en coberturas antrópicas y naturales (Álvarez-Grzybowska et al., 2020; Ernst et al., 2006). Sin embargo, aunque nuestros resultados permiten identificar que los grupos funcionales están reflejando diferencias entre tipos de coberturas vegetales, ésta medida de DF ha tenido desempeños bajos en otros análisis (Gagic et al., 2015). La clasificación de grupos funcionales ha sido criticada dado que puede simplificar la información de los rasgos funcionales, al omitir información importante relacionada con la variación intrapoblacional de los rasgos y al generar agrupamientos espurios que ignoran diferencias ecológicas intra e interespecíficas (Carmona et al., 2016). Morelli y Tryjanowski (2016) hacen un llamado a revisar los agrupamientos funcionales desde los rasgos medidos para evitar oscurecer información ecológica crucial relacionada a las interacciones entre las especies de un ensamblaje.
En el presente estudio, aunque las especies hayan sido clasificadas en grupos que a su interior asumen un papel funcional similar, no se puede generalizar que las especies de un mismo grupo funcional también respondan de la misma manera a los filtros ambientales, por lo cual la similaridad funcional entre especies no implica requerimientos ecológicos iguales (Chalcraft y Resetarits, 2003). Una pregunta emergente es ¿por qué, si el modo reproductivo determina el uso del hábitat (Crump, 2015), las especies con desarrollo directo, e.g., B. lozanoi, P. taeniatus y Pristimantis gaigei usan de forma diferente las coberturas vegetales? Este planteamiento resalta la importancia de integrar el enfoque de la ecología basada en rasgos funcionales con estudios herpetológicos sobre la estructura morfológica, patrones reproductivos (ej. tamaño y peso de la postura) y dimorfismo sexual a nivel de ensamblajes (Torres-Cervantes et al., 2019). Asímismo, se debe profundizar en estudios de eco fisiología de las poblaciones de anuros y salamandras para entender de manera más profunda los patrones de diversidad de anfibios bajo escenarios de cambio del paisaje (Navas y Otani, 2007; Nowakowski et al., 2017). Siguiendo esta propuesta, es necesario estudiar otros rasgos de respuesta a gradientes ambientales como los modos de respiración, donde B. lozanoi tiene respiración totalmente cutánea, mientras que P. taeniatus respira pulmonar y cutáneamente. Este tipo de diferencias pueden conferirle a las especies diferentes capacidades de respuesta a la transformación del hábitat desde el punto de vista de su ecofisiología (Navas y Otani, 2007). Las diferencias ecológicas en términos de los valores generados por los rasgos funcionales, permiten la clasificación en grupos para tener una idea de los filtros ambientales que se están generando directamente con el cambio en la cobertura y uso del suelo (Ockinger et al., 2010). Estudios como el de Flynn et al. (2009), destacan una reducción en la DF superior a la estimada conforme se intensifican los sistemas agrícolas, hallazgo consecuente con el trabajo de Ernst et al. (2006). En el presente estudio, 2 de las métricas de riqueza funcional (el índice de riqueza funcional FDpg y el índice ponderado por el total de la abundancia de cada cobertura vegetal FDw) no variaron entre coberturas vegetales. El índice ponderado con la abundancia total de la comunidad (FDwcomm) sí permitió resaltar la importancia de la zona interna del bosque. De manera complementaria, el análisis de grupos funcionales reflejó otras características no contempladas por las métricas de riqueza (funcional y de especies), resaltando el valor de conservación para los cultivos de caña y cacao, principalmente para las especies pertenecientes a los grupos funcionales I, II y III. En ese sentido, es necesario ampliar las métricas para el análisis de los ensamblajes, considerando no solo las facetas taxonómica y funcional de la diversidad, sino, involucrando la diversidad filogenética para entender como los factores ambientales generan filtros en hábitats transformados moldeando y estructurando a los ensamblajes de anfibios (Hernández-Ordóñez et al., 2019; Ribeiro et al., 2017).
Uso del hábitat y rasgos funcionales en los anfibios
Los anfibios tienen una estrecha relación con el ambiente, aunque responden de maneras diferentes a las características ambientales de los sitios perturbados (Cruz-Elizalde et al., 2016). Estas respuestas se dan según sus rasgos ecológicos y sus tolerancias ecofisiológicas (Urbina-Cardona et al., 2014), determinando la estructuración de los ensamblajes y los patrones de recambio de especies en paisajes fragmentados (Carvajal-Cogollo et al., 2019). Las diferencias en la configuración del paisaje y la complejidad estructural de la vegetación generan gradientes de variables ambientales que pueden afectar la disponibilidad de microhábitat para los anfibios, y en últimas configurar el hábitat para cada especie (Duarte et al., 2021). Por ejemplo, el cambio en la dominancia de P. taeniatus durante el periodo de lluvias en cultivos y en bosques en sequía, sugiere un cambio en el uso y preferencias del hábitat entre ambientes naturales y antropogénicos en respuesta a la calidad del hábitat estacional y a la temporada de reproducción. Este comportamiento puede ser una respuesta a la disponibilidad de agua y humedad, variables esenciales para el desarrollo de sus huevos (IUCN SSC Amphibian Specialist Group, 2018a). En el presente estudio, P. taeniatus presentó alta dominancia en todas las coberturas vegetales (naturales y antropogénicas), incluso representando 40% de los anfibios de los cultivos (siendo la única especie del género Pristimantis en utilizar esta cobertura), a pesar de tener un modo reproductivo de desarrollo directo, el cual requiere alta humedad disponible a nivel de microhábitat para la ovoposición (Luiz et al., 2009). Estudios previos en los Andes de Colombia, reportan que alrededor de 50% de las especies del género Pristimantis en los ensamblajes, tienen la capacidad de habitar potreros en estos paisajes de montaña (Isaacs-Cubides y Urbina-Cardona, 2011; Roach et al. 2020). Sin embargo, se debe tener en cuenta que muchas especies de anfibios requieren una capa gruesa de hojarasca en el suelo para su refugio, forrajeo y ovoposición (Cortés-Gómez et al., 2013; Hernández-Ordoñez et al., 2019). El manejo de cultivos que permita la acumulación de hojarasca en el suelo y evite la contaminación del suelo por agroquímicos, pueden ser estrategias útiles para incrementar la conectividad de poblaciones de anfibios en paisajes heterogéneos, frente a otras coberturas como el caso de los potreros. A pesar de que P. taeniatus es generalista en cuanto a su hábitat, dada su abundancia, peso y biomasa (tabla 3), puede ser muy importante en la contribución que hace a la diversidad funcional a nivel de paisaje y su influencia en el ecosistema. Precisamente, la hipótesis de proporción de masa corporal sugiere que las especies dominantes, dado el valor en sus rasgos funcionales, pueden tener mayor influencia en los procesos ecosistémicos (Sonkoly et al., 2019). La conservación de los anfibios en paisajes transformados no debe enfocarse solamente en las especies especialistas de bosque, sino también debe considerar las respuestas que pueden tener los individuos al borde del bosque remanente (Schneider-Maunoury et al., 2016).
En el caso de D. truncatus (Familia Dendrobatidae), especie endémica de Colombia, se reconoce como una especie tolerante a diferentes grados de perturbación (IUCN SSC Amphibian Specialist Group, 2018b) y contaminación (e.g., por glifosfato; Bernal et al., 2009). En el presente estudio se reporta como una especie dominante de cultivos de cacao y bosques, principalmente para la temporada seca, y con un aporte importante a la diversidad funcional (en el grupo funcional III; figs. 2, 3). Sin embargo, esta especie no es del todo generalista por su hábitat en la región de estudio, dado que no se reportó habitando cultivos mixtos, cultivos de caña, ni potreros (tabla 3). Esto respalda el hallazgo de Romero-Martínez y Lynch (2010), quienes encontraron la especie en bosques maduros y de Acosta-Galvis et al. (2006), quienes proponen que D. truncatus posiblemente se reproduce en charcas temporales (Castro y Lynch, 2013), cuyo modo reproductivo requiere de la capa de hojarasca en el suelo y cierto grado de cobertura (de dosel y sotobosque) (Grant et al., 2006).
El presente estudio describe ensamblajes de anfibios cuyas especies evaluadas en su estado de conservación por la UICN se encuentran en preocupación menor. La especie Boana xerophylla aún no ha sido evaluada en su riesgo de extinción y el presente estudio señala que es una especie con bajas abundancias, que está asociada a bosque nativo y que solo comparte el grupo funcional IV con la salamandra B. lozanoi. A pesar de que se conoce poco sobre la ecología y uso del hábitat de la salamandra B. lozanoi, esta especie había sido evaluada en estado vulnerable para Colombia (Rueda-Almonacid et al., 2004), pero en la actualización de la evaluación del riesgo de extinción de anfibios, pasó a ser de preocupación menor, aunque se sospecha que sus poblaciones continúan en declive (IUCN SSC Amphibian Specialist Group, 2019). Acosta-Galvis (2006) reportó a la especie como nocturna y arborícola, asociada a vegetación riparia, propia de los márgenes de los cuerpos de agua o al interior del bosque. Mientras, González (2010) reportó 86% de los individuos en el sotobosque del interior de bosque nativo. Sin embargo, en este estudio, la salamandra B. lozanoi usó de manera exclusiva y abundante el cultivo de caña (tabla 3), la cual a su vez, fue la que presentó mayor densidad de sotobosque (tabla 1). Una posible razón de su dominancia en el cultivo de caña puede ser en la abundancia del alimento, dado que, según Acosta-Galvis y Restrepo (2001), en muestras de contenido estomacal, la especie se alimentaba principalmente de hormigas (familia Formicidae), abundantes en los cultivos de caña por los azucares de la planta. Además, esta especie, aunque se asocia a la vegetación riparia (Rueda-Almonacid et al., 2004), no depende de los cuerpos de agua para su reproducción (modo reproductivo de desarrollo directo), rasgo que facilita utilizar coberturas como algunos cultivos con cierta estructura vegetal que le permita refugiarse de la acción directa del sol y el viento. Hay que considerar la variación ontogenética en la identidad de las especies, su dieta y tamaño corporal, dado que es en las interacciones bióticas (inter e intraespecíficas) donde se estructuran finalmente los ensamblajes (Blüthgen, 2010; Luría-Manzano y Ramírez-Bautista, 2019b).
La agroforestería es un sistema de uso del suelo que potencialmente evita la degradación de la tierra y aporta a la conservación de la biodiversidad (Rice y Greenberg, 2000). Existe gran diversidad de estrategias de manejo y posibilidades de arreglos espaciales, lo que determina el grado de heterogeneidad y calidad del hábitat para las especies nativas. En el presente estudio, se demuestra que no existe un único sistema productivo idóneo para conservar a toda la diversidad de anfibios de una región. La zona interna del bosque nativo presentó los valores más altos de diversidad funcional, por lo que se asume que el aporte de estas coberturas vegetales nativas de mayor tamaño es esencial para el mantenimiento de importantes procesos ecológicos. Asimismo, un sistema productivo que puede constituir hábitat para una especie de anfibio (e.g., el potrero con árboles nativos para Leptodactylus fragilis) puede ser, a su vez, una barrera para la dispersión de las poblaciones otras especies (e.g., Pristimantis gaigei).
En el presente estudio, el cultivo de cacao presentó mayor cantidad de hojarasca, incluso que las coberturas de bosque nativo (tabla 1), lo cual puede ser un elemento del paisaje importante para la ovoposición de los anuros con desarrollo directo (Urbina-Cardona y Reynoso, 2009). El cultivo de cacao puede ser una buena herramienta para la conservación de los anfibios pero es necesario mejorar sus prácticas de manejo de la siguiente forma (Rice y Greenberg, 2000): a) que no se incremente la deforestación de ecosistemas; b) que se establezca y maneje sombra diversificada y multiestratificada con especies de árboles y arbustos nativos; c) que se mantengan plantas epífitas en los árboles y arbustos; d) que se incremente la variedad de hojarasca para permitir diferentes estados de descomposición y gradientes de humedad en el suelo; e) que se mantengan fuentes de agua léntica y lótica; f) que se amorticen los efectos de borde manejando coberturas con alta estructura vegetal (áreas de restauración ecológica o cultivos de café o cacao con árboles nativos) en las zonas aledañas a los bosques nativos (Larrea, 2008).
El presente estudio demuestra que los cultivos tienen valores importantes de diversidad funcional y taxonómica, tanto el cultivo de cacao y como el de caña albergan especies nativas y cuyas abundancias son similares o más altas que las del bosque, como B. lozanoi y R. sternosignata (IUCN SSC Amphibian Specialist Group, 2020), las cuales usan estas coberturas que pueden ofrecer recursos importantes como microhábitats húmedos, refugio en la hojarasca y alimento. Los cultivos no remplazan en ningún momento a los bosques nativos, en especial al interior o área núcleo de esta cobertura remanente, la cual debe estar a más de 400 m del borde para amortiguar los efectos que pueden tener los sistemas productivos sobre las abundancias de los anfibios neotropicales de bosque nativo (Schneider-Maunoury et al., 2016). Los cultivos de cacao pueden proporcionar beneficios económicos y sociales a las comunidades locales de pobladores, a la vez que proveen hábitat de refugio y alimentación para los anfibios con condiciones ambientales y estructurales similares a las del bosque nativo. También, pueden proporcionar hábitat de paso, incrementando la conectividad entre hábitat óptimos para especies de diferentes grupos funcionales (Dendrobates truncatus – grupo funcional III; Pristimantis taeniatus – grupo funcional I; y Rhinella sternosignata – grupo funcional II). En contraste, los potreros y cultivos mixtos, por sus características ambientales (baja cantidad de hojarasca y baja densidad de sotobosque; tabla 1, fig. 1), se convierten en barreras para las poblaciones de anfibios, por lo tanto, hay que fomentar la generación de sistemas silvopastoriles con atributos y elementos (cercas vivas, árboles nativos inmersos en el sistema productivo, arreglos silviculturales, entre otros) que permitan la conectividad funcional y estructural del paisaje (Arroyo-Rodríguez et al., 2020; Melo et al., 2103).
Agradecimientos
Especialmente a la familia Concha Osbhar, por permitir la realización de este trabajo en la finca La Figueroa. A Pedro Benavides, Francisco Zanahoria y Marlene Ayala por el apoyo logístico durante la realización de este trabajo. A Andrés Giraldo y a Natalia Buriticá por su apoyo durante los muestreos de anfibios. A Víctor Fabio Luna y Julián Llano-Mejía por la asesoría en la identificación de las especies. Andrés Etter, Julio Mario Hoyos, Beatriz Salgado y Laura Aldana, quienes aportaron observaciones importantes a la versión preliminar de este manuscrito. Gracias infinitas y amor a María José Hernández. El presente manuscrito es la primera publicación del Semillero Javeriano en Ecología y Conservación de la Herpetofauna – SECAR.
Referencias
Acosta-Galvis, A. R. (2006). Taxonomía y evaluacón de la homología de los caracteres para las salamandras del género Bolitoglossa (Caudata: Plethodontidae) de Colombia. Universidad Nacional de Colombia. Bogotá, Colombia.
Acosta-Galvis, A. R. y Restrepo, A. E. (2001). Una nueva especie de Bolitoglossa (Caudata: Plethodontidae) de las selvas de magdalena medio en Colombia. Caldasia, 23, 467–473.
Acosta-Galvis, A. R., Huertas-Salgado, C. y Rada, M. (2006). Aproximación al conocimiento de los anfibios en una localidad del magdalena medio (Departamento de Caldas, Colombia). Revista de La Academia Colombiana de Ciencias Exactas, Fisicas y Naturales, 30, 291–303.
Alcaldía Municipal de Falan. (2009). Plan integral único municipio de Falan. Falan, Departamento del Tolima. Recuperado de: http://www.falan-tolima.gov.co/apc-aa-files/30323138366132633731623632373231/PLAN_INTEGRAL__NICO_DE_FALAN___Tolima_2009.pdf
Álvarez-Grzybowska, E., Urbina-Cardona, N., Córdova-Tapia, F. y García, A. (2020). Amphibian communities in two contrasting ecosystems: functional diversity and environmental filters. Biodiversity and Conservation, 29, 2457–2485. https://doi.org/10.1007/s10531-020-01984-w
Anderson, M. J., Gorley, R. N. y Clarke, K. R. (2008). PERMANOVA + for PRIMER: Guide to Software and Statistical Methods. PRIMER-E: Plymouth, UK.
Angulo, A., Rueda-Almonacid, J. V., Rodríguez-Mahecha, J. V. y La Marca, E. (Eds.). (2006). Técnicas para el inventario y muestreo de anfibios: una compilación. Técnicas de inventario y monitoreo para los anfibios de la región tropical andina. Conservación Internacional. (Serie Manu). Bogotá D.C.: Panamericana Formas e Impresos S.A.
Arroyo-Rodríguez, V., Fahrig, L., Tabarelli, M., Watling, J. I., Tischendorf, L., Benchimol, M. et al. (2020). Designing optimal human-modified landscapes for forest biodiversity conservation. Ecology Letters, 23, 1404–1420. https://doi.org/10.1111/ele.13535
Becker, C. G., Fonseca, C. R., Haddad, C. F. y Prado, P. I. (2010). Habitat split as a cause of local population declines of amphibians with aquatic larvae. Conservation Biology, 24, 287–294. https://doi.org/10.1111/j.1523-1739.2009.01324.x
Bernal, M. H., Solomon, K. R. y Carrasquilla, G. (2009). Toxicity of formulated glyphosate (glyphos) and cosmo-flux to larval colombian frogs 1. Laboratory microcosm acute toxicity. Journal of Toxicology and Environmental Health. Part A, 72, 966–973. https://doi.org/10.1080/15287390902929717
Blaum, N., Mosner, E., Schwager, M. y Jeltsch, F. (2011). How functional is functional? Ecological groupings in terrestrial animal ecology: towards an animal functional type approach. Biodiversity and Conservation, 20, 2333–2345. https://doi.org/10.1007/s10531-011-9995-1
Blüthgen, N. (2010). Why network analysis is often disconnected from community ecology: a critique and an ecologist’s guide. Basic and Applied Ecology, 11, 185–195. https://doi.org/10.1016/j.baae.2010.01.001
Burton, T. M. y Likens, G. E. (1975). Salamander populations and biomass in the Hubbard Brook Experimental Forest, New Hampshire salamander populations and biomass in the Hubbard Brook Experimental Forest, New Hampshire. Copeia, 1975, 541–546.
Cabrera-Guzmán, E. y Reynoso, V. H. (2012). Amphibian and reptile communities of rainforest fragments: minimum patch size to support high richness and abundance. Biodiversity and Conservation, 21, 3243–3265. https://doi.org/10.1007/s10531-012-0312-4
Carmona, C. P., de Bello, F., Mason, N. W. H. y Leps, J. (2016). Traits without borders: integrating functional diversity across scales. Trends in Ecology & Evolution, 31, 382–394. https://doi.org/10.1016/j.tree.2016.02.003
Carvajal-Cogollo, J. E., Bernal-González, V., Paternina-Hernandez, A., Muñóz-Ávila, J. A., Urbina-Cardona, J. N. y Vargas-Salinas, F. (2019). Uso del hábitat y reglas de ensamblaje: patrones y mecanismos. En F. Vargas-Salinas, J. A. Muñoz-Avila y M. E. Morales-Puentes (Coord.), Biología de los anfibios y reptiles en el bosque seco tropical del norte de Colombia (297–337pp). Tunja, Colombia: Editorial UPTC.
Castro, F. y Lynch, J. D. (2013). Dendrobates truncatus. Recuperado de: https://www.iucnredlist.org/es/species/55205/85886974#assessment-information
Chalcraft, D. R. y Resetarits, Jr., W. J. (2003). Predator identity and ecological impacts: functional redundacy. Ecology, 84, 2407–2418.
Clarke, K. R. y Gorley, R. N. (2006). Primer v6: User manual/tutorial. Plymouth, UK: PRIMER-E.
Colwell, R. K. (2013). EstimateS: statistical estimation of species richness and shared species from samples; version 9. Disponible en: http://viceroy.eeb.uconn.edu/estimates/
Colwell, R. K. y Coddington, J. A. (1994). Estimating terrestrial biodiversity through extrapolation. Philosophical Transactions: Biological Sciences, 345, 101–118.
Cortés-Gómez, A. M., Castro, F. y Urbina-Cardona, J. N. (2013). Small changes in vegetation structure create great changes in amphibian ensembles in the Colombian Pacific rainforest. Tropical Conservation Science, 6, 749–769. https://doi.org/10.1177/194008291300600604
Cortés-Gómez, Á. M., Ramírez-Pinilla, M. P. y Urbina-Cardona, N. (2016). Protocolo para la medición de rasgos funcionales en anfibios. En B. Salgado-Negret (Ed.), La ecología funcional como aproximación al estudio, manejo y conservación de la biodiversidad: protocolos y aplicaciones (pp. 126–179). Instituto de Investigación de Recursos Biológicos Alexander von Humboldt.
Cortés-Gómez, A. M., Ruiz-Agudelo, C. A., Valencia-Aguilar, A. y Ladle, R. J. (2015). Ecological functions of neotropical amphibians and reptiles: a review. Universitas Scientiarum, 20, 229–245. https://doi.org/10.11144/Javeriana.SC20-2.efna
Crump, M. L. (2015). Anuran reproductive modes: evolving perspectives. Journal of Herpetology, 49, 1–16. https://doi.org/10.1670/14-097
Cruz-Elizalde, R., Berriozabal-Islas, C., Hernández-Salinas, U., Martínez-Morales, M. A. y Ramírez-Bautista, A. (2016). Amphibian species richness and diversity in a modified tropical environment of central Mexico. Tropical Ecology, 57, 407–417.
Díaz, S. y Cabido, M. (2001). Vive la difference: plant functional diversity matters to ecosystem processes: plant functional diversity matters to ecosystem processes. Trends in Ecology & Evolution, 16, 646–655.
Díaz, S., Fargione, J., Chapin, F. S. y Tilman, D. (2006). Biodiversity loss threatens human well-being. Plos Biology, 4, 1300–1305. https://doi.org/10.1371/journal.pbio.0040277
Díaz-García, J. M., Pineda, E., López-Barrera, F. y Moreno, C. E. (2017). Amphibian species and functional diversity as indicators of restoration success in tropical montane forest. Biodiversity and Conservation, 26, 1–21. https://doi.org/10.1007/s10531-017-1372-2
Dixo, M. y Metzger, J. P. (2010). The matrix-tolerance hypothesis: an empirical test with frogs in the Atlantic Forest. Biodiversity and Conservation, 19, 3059–3071. https://doi.org/10.1007/s10531-010-9878-x
Dray, S. y Dufour, A. B. (2007). The {ade4} Package: Implementing the duality diagram for ecologists. Journal of Statistical Software, 22, 1–20. https://doi.org/10.18637/jss.v022.i04
Driscoll, D. A., Banks, S. C., Barton, P. S., Lindenmayer, D. B. y Smith, A. L. (2013). Conceptual domain of the matrix in fragmented landscapes. Trends in Ecology & Evolution, 28, 605–613. https://doi.org/10.1016/j.tree.2013.06.010
Duarte, L., Urbina-Cardona, N. y Saboyá-Acosta, L. (2021). Ensamblajes de anuros y su relación multiespacial con la heterogeneidad espacial en el Valle de los Frailejones del Parque Nacional Natural Chingaza. Caldasia, 43, 1. https://dx.doi.org/10.15446/caldasia.v43n1.84860
Ernst, R., Linsenmair, K. E. y Rödel, M. O. (2006). Diversity erosion beyond the species level: Dramatic loss of functional diversity after selective logging in two tropical amphibian communities. Biological Conservation, 133, 143–155. https://doi.org/10.1016/j.biocon.2006.05.028
Etter, A., McAlpine, C. y Possingham, H. (2008). Historical patterns and drivers of landscape change in Colombia since 1500: a regionalized spatial approach. Annals of the Association of American Geographers, 98, 2–23. https://doi.org/10.1080/00045600701733911
Flynn, D. F. B., Gogol-Prokurat, M., Nogeire, T., Molinari, N., Richers, B. T., Lin, B. B. et al. (2009). Loss of functional diversity under land use intensification across multiple taxa. Ecology Letters, 12, 22–33. https://doi.org/10.1111/j.1461-0248.2008.01255.x
Gagic, V., Bartomeus, I., Jonsson, T., Taylor, A., Winqvist, C., Fischer, C. et al. (2015). Functional identity and diversity of animals predict ecosystem functioning better than species-based indices. Proceedings of the Royal Society B: Biological Sciences, 282, 20142620. https://doi.org/10.1098/rspb.2014.2620
Gallego, O., Quevedo, A., Luna, V. y Figeroa, W. E. (2008). Falan, cuna de la vida: libro pedagógico de Educación Ambiental del municipio de Falan, Departamento del Tolima.Guía de Campo. Ibague, Colombia: Departamento del Tolima.
González, C. (2010). Diversidad de ensamblajes de anuros en un gradiente potrero-borde-interior de bosque en la Reserva Protectora y Productora Laguna de Pedro Palo (Tena, Cundinamarca). Bogotá: Pontificia Universidad Javeriana.
Grant, T., Frost, D. R., Caldwell, J. P., Gagliardo, R., Haddad, C. F. B., Kok, P. J. R. et al. (2006). Phylogenetic systematics of dart-poison frogs and their relatives (Amphibia: Athesphatanura: Dendrobatidae). Bulletin of the American Museum of Natural History, 299, 1–262. https://doi.org/dx.doi.org/10.1206/0003-0090(2006)299[1:PSODFA]2.0.CO;2
Hernández-Ordóñez, O., Santos, B. A., Pyron, R. A., Arroyo-Rodríguez, V., Urbina-Cardona, J. N., Martínez-Ramos, M. et al. (2019). Species sorting and mass effect along forest succession: Evidence from taxonomic, functional, and phylogenetic diversity of amphibian communities. Ecology and Evolution, 9, 5206–5218. https://doi.org/10.1002/ece3.
5110
Holdridge, L. R. (1967). Life zone ecology. Tropical Science Center. https://doi.org/Via 10.1046/j.1365-2699.1999.00329.x
Isaacs-Cubides, P. J. y Urbina-Cardona, J. N. (2011). Anthropogenic disturbance and edge effects on anuran assemblages inhabiting cloud forest fragments in Colombia. Natureza a Conservacao, 9, 39–46. https://doi.org/10.4322/natcon.2011.004
IUCN SSC Amphibian Specialist Group. (2018a). Pristimantis taeniatus. The IUCN Red List of Threatened Species 2018: e.T56991A3053810. Recuperada el 14 de diciembre de 2020. https://dx.doi.org/10.2305/IUCN.UK.2018-2.RLTS.T56991A3053810.en
IUCN SSC Amphibian Specialist Group. (2018b). Dendrobates truncatus. The IUCN Red List of Threatened Species 2018: e.T55205A85886974. Recuperada el 14 de diciembre de 2020. https://dx.doi.org/10.2305/IUCN.UK.2018-2.RLTS.T55205A85886974.en
IUCN SSC Amphibian Specialist Group. (2019). Bolitoglossa lozanoi. The IUCN Red List of Threatened Species 2019: e.T59175A49344446. Recuperada el 14 de diciembre de 2020. https://dx.doi.org/10.2305/IUCN.UK.2019-2.RLTS.T59175A49344446.en
IUCN SSC Amphibian Specialist Group. (2020). Rhinella sternosignata. The IUCN Red List of Threatened Species 2020: e.T54767A85883159. Recuperada el 14 de diciembre de 2020. https://dx.doi.org/10.2305/IUCN.UK.2020-3.RLTS.T54767A85883159
Kohler, G. (2011). Amphibians of Central America. Offenbach: Herpeton Verlag.
Lara-Tufiño J. D., Badillo-Saldaña, L. M., Hernández-Austria, R., Ramírez-Bautista, A. (2019). Effects of traditional agroecosystems and grazing areas on amphibian diversity in a region of central Mexico. PeerJ, 7, e6390. https://doi.org/10.7717/peerj.6390
Larrea, M. (2008). El cultivo de cacao nacional: un bosque generoso. Manual de campo para la implementación de prácticas amigables con la biodiversidad en cultivos de cacao nacional. Quito, Ecuador: Programa Nacional Biocomercio Sostenible del Ecuador (EcoCiencia / CORPEI), Programa de Facilitación del Biocomercio-UNCTAD.
Lemmon, P. (1956). A spherical densiometer for estimating forest overstory density. Forest Science, 2, 314–320.
Luck, G. W., Lavorel, S., Mcintyre, S. y Lumb, K. (2012). Improving the application of vertebrate trait-based frameworks to the study of ecosystem services. Journal of Animal Ecology, 81, 1065–1076. https://doi.org/10.1111/j.1365-2656.2012.01974.x
Luiz, W., Gindomar, V. y Santana, G. (2009). Diversity of reproductive modes in anurans communities in the Caatinga (dryland) of northeastern Brazil. Biodiversity Conservation, 18, 55–66. https://doi.org/10.1007/s10531-008-9434-0
Luría-Manzano, R. y Ramírez-Bautista, A. (2019a). Dietary composition and selection in the stream-breeding anuran assemblage from a tropical wet forest in eastern Mexico. Acta Oecologica, 98, 36-44. https://doi.org/10.1016/j.actao.
2019.06.003
Luría-Manzano, R. y Ramírez-Bautista, A. (2019b). Ontogenetic variation in the diet of the anuran community from a semi-arid environment in the southeastern Chihuahuan Desert. PeerJ, 7, e7908. https://doi.org/10.7717/peerj.7908
Lynch, J. D. (1999). Lista anotada y clave para las ranas (género Eleutherodactylus) chocoanas del Valle del Cauca, y apuntes sobre las especies de la Cordillera Occidental adyacente. Caldasia, 21, 184–202.
Magurran, A. E. (2004). Measuring biological diversity. Londres: Blackwell Publishing.
Mason, N. W. H., Mouillot, D., Lee, W. G. y Wilson, J. B. (2005). Functional richness, functional evenness and functional divergence: the primary components of functional diversity. Oikos, 111, 112–119.
Mayfield, M. M., Bonser, S. P., Morgan, J. W., Aubin, I., McNamara, S. y Vesk, P. A. (2010). What does species richness tell us about functional trait diversity? Predictions and evidence for responses of species and functional trait diversity to land-use change. Global Ecology and Biogeography, 19, 423–431. https://doi.org/10.1111/j.1466-8238.2010.00532.x
Mcgill, B. J., Enquist, B. J., Weiher, E. y Westoby, M. (2006). Rebuilding community ecology from functional traits. Trends in Ecology & Evolution, 21, 178–185. https://doi.org/10.1016/j.tree.2006.02.002
Mckinney, M. L. y Lockwood, J. L. (1999). Biotic homogenization: a few winners replacing many losers in the next mass extinction. Trends in Ecology & Evolution, 14, 450–453.
Medina-Rangel, G. F., Cárdenas-Arévalo, G. y Castaño-Mora, O. V. (2011). Anfibios y reptiles de los alrededores del complejo cenagoso de Zapatosa, departamento del Cesar, Colombia. En J. O. Rangel (Ed.), Colombia diversidad biótica. Publicación Especial No. 1. Bogotá D.C., Colombia: Grupo de Biodiversidad y Conservación, Instituto de Ciencias Naturales, Universidad Nacional de Colombia/ CORPOCESAR.
Melo, F. P., Arroyo-Rodríguez, V., Fahrig, L., Martínez-Ramos, M. y Tabarelli, M. (2013). On the hope for biodiversity-friendly tropical landscapes. Trends in ecology & evolution, 28, 462–468. https://doi.org/10.1016/j.tree.2013.01.001
Mendenhall, C. D., Frishkoff, L. O., Santos-Barrera, G., Pacheco, J., Mesfun, E., Mendoza-Quijano, F. et al. (2014). Countryside biogeography of Neotropical reptiles and amphibians. Ecology, 95, 856–870. https://doi.org/10.1890/12-2017.1
Morelli, F. y Tryjanowski, P. (2016). The dark side of the “redundancy hypothesis” and ecosystem assessment. Ecological Complexity, 28, 222–229. https://doi.org/10.
1016/j.ecocom.2016.07.005
Moreno-Arias, R. A. y Urbina-Cardona, J. N. (2013). Population dynamics of the Andean lizard Anolis heterodermus: fast-slow demographic strategies in fragmented scrubland landscapes. Biotropica, 45, 253–261. https://doi.org/10.1111/
j.1744-7429.2012.00903.x
Mouchet, M. A., Villéger, S., Mason, N. W. H. y Mouillot, D. (2010). Functional diversity measures: an overview of their redundancy and their ability to discriminate community assembly rules. Functional Ecology, 24, 867–876. https://doi.org/10.1111/j.1365-2435.2010.01695.x
Mouillot, D., Villéger, S., Scherer-Lorenzen, M. y Mason, N. W. H. (2011). Functional structure of biological communities predicts ecosystem multifunctionality. Plos One, 6, e17476. https://doi.org/10.1371/journal.pone.0017476
Murrieta-Galindo, R., González-Romero, A., López-Barrera, F. y Parra-Olea, G. (2013). Coffee agrosystems: an important refuge for amphibians in central Veracruz, Mexico. Agroforestry Systems, 87, 767–779. https://doi.org/10.1007/s10457-013-9595-z
Navas, C. A. y Otani, L. (2007). Physiology, environmental change, and anuran conservation. Phyllomedusa, 6, 83–103. https://doi.org/10.1242/jeb.01421
Nowakowski, A. J., Thompson, M. E., Donnelly, M. A. y Todd, B. D. (2017). Amphibian sensitivity to habitat modification is associated with population trends and species traits. Global Ecology and Biogeography, 26, 700–712. https://doi.org/10.1111/geb.12571
Ochoa-Ochoa, L. M., Mejía-Domínguez, N. R., Velasco, J. A., Marske, K. A. y Rahbek, C. (2019). Amphibian functional diversity is related to high annual precipitation and low precipitation seasonality in the New World. Global Ecology and Biogeography, 28, 1219–1229. https://doi.org/10.1111/geb.12926
Ockinger, E., Schweiger, O., Crist, T. O., Debinski, D. M., Krauss, J., Kuussaari, M. et al. (2010). Life-history traits predict species responses to habitat area and isolation: a cross-continental synthesis. Ecology Letters, 13, 969–979. https://doi.org/10.1111/j.1461-0248.2010.01487.x
Petchey, O. L. y Gaston, K. J. (2002). Extinction and the loss of functional diversity. Proceedings of the Royal Society, 269, 1721–1727. https://doi.org/10.1098/rspb.2002.2073
Petchey, O. L. y Gaston, K. J. (2006). Functional diversity: back to basics and looking forward. Ecology Letters, 9, 741–758. https://doi.org/10.1111/j.1461-0248.2006.00924.x
Petchey, O. L. y Gaston, K. J. (2007). Dendrograms and measuring functional diversity. Oikos, 116, 1422–1426. https://doi.org/10.1111/j.2007.0030-1299.15894.x
Pfeifer, M., Lefebvre, V., Peres, C. A., Banks-Leite, C., Wearn, O. R., Marsh, C. J. et al. (2017). Creation of forest edges has a global impact on forest vertebrates. Nature, 551, 187–191. https://doi.org/10.1038/nature24457
R Development Core Team. (2021). A language and environment for statistical computing. Vienna, Austria: ISBN 3-900051-07-0.
Rangel, J. O., Lowy, C. P. D. y Aguilar, P. M. (1997). Distribucion de los tipos de vegetación en las regiones. En J. O. Rangel (Ed.), Colombia diversidad biotica II (pp. 383–402). Bogotá, Colombia: Instituto de Ciencias Naturales-Universidad Nacional de Colombia.
Regester, K. J., Whiles, M. R. y Lips, K. R. (2008). Variation in the trophic basis of production and energy flow associated with emergence of larval salamander assemblages from forest ponds. Freshwater Biology, 53, 1754–1767. https://doi.org/10.1111/j.1365-2427.2008.02073.x
Ribeiro, J., Colli, G. R., Batista, R. y Soares, A. (2017). Landscape and local correlates with anuran taxonomic, functional and phylogenetic diversity in rice crops. Landscape Ecology, 32, 1599–1612. https://doi.org/10.1007/s10980-017-0525-8
Rice, R. A. y Greenberg, R. (2000). Cacao cultivation and the conservation of biological diversity. Ambio, 29, 167–173. https://doi.org/10.1579/0044-7447-29.3.167
Riemann, J. C., Ndriantsoa, S. H., Rödel, M. O. y Glos, J. (2017). Functional diversity in a fragmented landscape. Habitat alterations affect functional trait composition of frog assemblages in Madagascar. Global Ecology and Conservation, 10, 173–183. https://doi.org/10.1016/j.gecco.2017.03.005
Roach, N. S., Urbina-Cardona, N. y Lacher, Jr. T. E. (2020). Land cover drives amphibian diversity across steep elevational gradients in an isolated neotropical mountain range: Implications for community conservation. Global Ecology and Conservation, 22, e00968. https://doi.org/10.1016/j.gecco.2020.e00968
Romero-Martínez, H. J. y Lynch, J. D. (2010). Anfibios de los humedales del departamento de Córdoba. En J. O. Rangel (Ed.), Colombia diversidad biótica IX, Ciénagas del Córdoba: biodiversidad, ecología y manejo ambiental (pp. 349–360). Bogotá: Instituto de Ciencias Naturales-Universidad Nacional de Colombia.
Rudel, T. K., Coomes, O. T., Moran, E., Achard, F., Angelsen, A., Xu, J. y Lambin, E. (2005). Forest transitions: towards a global understanding of land use change. Global Environmental Change, 15, 23–31. https://doi.org/10.1016/j.gloenvcha.2004.11.001
Rueda-Almonacid, J. V., Lynch, J. D., Amézquita, A., Mendoza, C. L., Renjifo, J. M., Ruíz-, P. M. et al. (2004). Libro rojo de los anfibios de Colombia. Conservación Internacional Colombia, Instituto de Ciencias Naturales-Universidad Nacional de Colombia, Ministerio del Medio Ambiente.
Scheffers, B. R., Edwards, D. P., Diesmos, A., Williams, S. E. y Evans, T. A. (2014). Microhabitats reduce animal’s exposure to climate extremes. Global Change Biology, 20, 495–503. https://doi.org/10.1111/gcb.12439
Scheffers, B. R., Edwards, D. P., Macdonald, S. L., Senior, R. A., Andriamahohatra, L. R., Roslan, N. et al. (2016). Extreme thermal heterogeneity in structurally complex tropical rain forests. Biotropica, 49, 35–44. https://doi.org/10.1111/btp.12355
Schleuter, D., Daufresne, M., Massol, F. y Argillier, C. (2010). A user’s guide to functional diversity indices. Ecological Monographs, 80, 469–484. https://doi.org/10.1890/08-2225.1
Schneider-Maunoury, L., Lefebvre, V., Ewers, R. M., Medina-Rangel, G. F., Peres, C. A., Somarriba, E. et al. (2016). Abundance signals of amphibians and reptiles indicate strong edge effects in Neotropical fragmented forest landscapes. Biological Conservation, 200, 207–215. https://doi.org/10.1016/j.biocon.2016.06.011
Shipley, B., De Bello, F., Cornelissen, J. H. C., Laliberté, E., Laughlin, D. C. y Reich, P. B. (2016). Reinforcing loose foundation stones in trait-based plant ecology. Oecologia, 180, 923–931. https://doi.org/10.1007/s00442-016-3549-x
Sonkoly, J., Kelemen, A., Valkó, O., Deák, B., Kiss, R., Tóth, K. et al. (2019). Both mass ratio effects and community diversity drive biomass production in a grassland experiment. Scientific Reports, 9, 1–10.
https://doi.org/10.1038/s41598-018-37190-6
Stroud, J. T., Bush, M. R., Ladd, M. C., Nowicki, R. J., Shantz, A. A. y Sweatman, J. (2015). Is a community still a community? Reviewing definitions of key terms in community ecology. Ecology and Evolution, 5, 4757–4765. https://doi.org/10.1002/ece3.1651
Suazo-Ortuño, I., Benítez-Malvido, J., Marroquín-Páramo, J., Soto, Y., Siliceo, H. y Alvarado-Díaz, J. (2018). Resilience and vulnerability of herpetofaunal functional groups to natural and human disturbances in a tropical dry forest. Forest Ecology and Management, 426, 145–157. https://doi.org/10.1016/j.foreco.2017.09.041
Tabarelli, M., Peres, C. A. y Melo, F. P. (2012). The ‘few winners and many losers’ paradigm revisited: emerging prospects for tropical forest biodiversity. Biological Conservation, 155, 136–140. https://doi.org/10.1016/j.biocon.2012.06.020
Torres-Cervantes, R., Ramírez-Bautista, A., Berriozabal-Islas, C., Cruz-Elizalde, R. y Hernández-Salinas, U. (2019). Morphology and reproductive patterns of an assemblage of anurans from the Chihuahuan Desert Region, Mexico. Journal of Arid Environments, 165, 28–33. https://doi.org/10.1016/j.jaridenv.2019.03.004
Trimble, M. J. y Van Aarde, R. J. (2014). Amphibian and reptile communities and functional groups over a land-use gradient in a coastal tropical forest landscape of high richness and endemicity. Animal Conservation, 17, 441–453.
Urbina-Cardona, J. N., Bernal, E. A., Giraldo-Echeverry, N. y Echeverry-Alcendra, A. (2015). El monitoreo de herpetofauna en los procesos de restauración ecológica: indicadores y métodos. En M. Aguilar-Garavito y W. Ramírez (Eds.), Monitoreo a procesos de restauración ecológica, aplicado a ecosistemas terrestres (pp. 134–147). Bogotá: Instituto de Investigación de Recursos Biológicos Alexander von Humboldt.
Urbina-Cardona, J. N., Navas, C. A., González, I., Gómez-Martínez, M. J., Llano-Mejía, J., Medina-Rangel, G. F. et al. (2014). Determinantes de la distribución de los anfibios en el bosque seco tropical de Colombia: herramientas para su conservación. En C. Pizano y García (Eds.), El bosque seco tropical en Colombia II. Biodiversidad asociada al bosque seco (pp. 163–189). Bogotá: Instituto de Investigación de Recursos Biológicos Alexander von Humboldt.
Urbina-Cardona, J. N. y Reynoso, V. H. (2005). Recambio de anfibios y reptiles en el gradiente potrero-borde-interior en Los Tuxtlas, Veracruz, Mexico. En G. Halffter, J. Soberón, P. Koleff y A. Melic (Eds.), Sobre diversidad biológica: el significado de las diversidades alfa, beta y gamma (pp. 191–207). Zaragoza, España: Monografías Tercer Milenio, m3m.
Urbina-Cardona, J. N. y Reynoso, V. H. (2009). Uso del microhábitat por hembras grávidas de la rana de hojarasca Craugastor loki en la selva alta perennifolia de Los Tuxtlas, Veracruz, México. Revista Mexicana de Biodiversidad, 80, 571–573. http://dx.doi.org/10.22201/ib.20078706e.2009.002.630
Valderrama-Vernaza, M., Ramírez-Pinilla, M. P. y Serrano-Cardozo, V. H. (2009). Diet of the Andean frog Ranitomeya virolinensis (Athesphatanura : Dendrobatidae). Journal of Herpetology, 43, 114–123.
Vitt, L. J. y Caldwell, J. P. (2009). Herpetology (3rd ed.). Norman, Oklahoma: Elsevier.
Walker, R. y Cárdenas, E. (2004). Evaluación del estado de conservación de la fauna en el municipio de Murillo, Tolima. Boletín Científico. Universidad de Caldas. Disponible en: http://boletincientifico.ucaldas.edu.co/downloads/Revista8
_2.pdf
Watling, J. I., Nowakowski, A. J., Donnelly, M. A. y Orrock, J. L. (2011). Meta-analysis reveals the importance of matrix composition for animals in fragmented habitat. Global Ecology and Biogeography, 20, 209–217. https://doi.org/10.1111/j.1466-8238.2010.00586.x
Whiles, M. R., Lips, K. R., Pringle, C. M., Kilham, S. S., Bixby, R. J., Brenes, R. et al. (2006). The effects of amphibian population declines on the structure and function of Neotropical stream ecosystems. Frontiers in Ecology and the Environment, 4, 27–34. https://doi.org/10.1890/1540-9295(2006)004[0027:TEOAPD]2.0.CO;2
Wickham, H. (2016). ggplot2: Elegant graphics for data analysis. New York: Springer-Verlag Disponible en: https://ggplot2.tidyverse.org
Williams-Linera, G., Domínguez-Gastelu, V. y García-Zurita, M. E. (1998). Microenvironment and floristics of different edges in. Conservation Biology, 12, 1091–1102.