Mirely Guzmán-Torres * y Zenón Cano-Santana
Universidad Nacional Autónoma de México, Facultad de Ciencias, Departamento de Ecología y Recursos Naturales, Av. Universidad #3000, Ciudad Universitaria, Coyoacán, 04510 Ciudad de México, México
*Autor para correspondencia: mirelygt@ciencias.unam.mx (M. Guzmán-Torres)
Recibido: 22 octubre 2020; aceptado: 17 marzo 2021
Resumen
No existe un listado taxonómico que incluya a las especies de los 3 subórdenes de Phthiraptera (Anoplura, Amblycera e Ischnocera) presentes en México. Los listados más importantes han sido sobre piojos chupadores —en mamíferos— o masticadores —en aves y mamíferos. En este trabajo se presenta un listado actualizado de los piojos de México, incluyendo su distribución estatal, especificidad y registros de pediculosis humana. Se hizo una recopilación bibliográfica y como resultado, se registraron 443 especies y subespecies de piojos distribuidas en 16 familias y 123 géneros. Por lo tanto, añadimos 45 registros de piojos y 62 especies hospederas a los listados anteriores. Veracruz es el estado con mayor riqueza (79), seguido de Coahuila (73), Baja California (59) y San Luis Potosí (59). En 31 estados se registró la incidencia del piojo del cuerpo (Pediculus humanus humanus Linnaeus, 1758), en 18 del piojo de la cabeza (P. humanus capitis de Geer, 1778) y en 7 del piojo púbico (Pthirus pubis Linnaeus, 1758). La mayoría de las especies de piojos registrados en México, aparentemente, presentan una alta especificidad (monoxenos = 69.1%). Con esta revisión se concluye que se requieren más estudios sobre la taxonomía y ecología de Phthiraptera, pues pueden ayudar a implementar programas de conservación tanto para estos parásitos como para sus hospederos.
Palabras clave: Listado taxonómico; México; Ectoparásitos; Piojos chupadores; Piojos masticadores; Especificidad
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Updated list of lice (Insecta: Phthiraptera) from Mexico: distribution, richness, specificity and human pediculosis
Abstract
There is not a taxonomic list of species belonging to the 3 superorders of Phthiraptera (Anoplura, Amblycera, and Ischnocera) that occur in Mexico. The most important studies have focused on sucking —in mammals— or chewing lice —in birds and mammals. Here, we provide an updated list of lice from Mexico, including their distribution in the Mexican states, specificity, and records of human pediculosis. After carrying out a bibliographic search, we recorded 443 species and subspecies of lice grouped in 16 families and 123 genera. We, therefore, add to the previous lists, 45 records of lice, as well as 63 host species. Veracruz is the state with the highest species richness (79), followed by Coahuila (73), Baja California (59), and San Luis Potosí (59). The head louse (Pediculus humanus capitis De Geer, 1778), the body louse (P. humanus humanus Linnaeus, 1758), and the pubic louse (Pthirus pubis Linnaeus, 1758) were recorded in 18, 31, and 7 Mexican states, respectively. Most of the lice species recorded in Mexico appear to be highly specialized (monoxenous = 69.1%). In conclusion, more taxonomic and ecological studies of Phthiraptera are required since they can help to implement conservation programs both for them and for their hosts.
Keywords: Taxonomic list; Mexico; Ectoparasites; Sucking lice; Chewing lice; Specificity
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
Los piojos, insectos hemimetábolos del grupo Phthiraptera, son ectoparásitos obligados de aves y mamíferos que se alimentan de su sangre, pelo, plumas, piel o secreciones (Cano-Santana y Romero-Mata, 2016). Miden de 0.3 a 12 mm de largo, su cuerpo es aplanado dorsoventralmente, su abdomen se divide en 10 segmentos; tienen patas con artejos distales modificados que les ayudan a sujetarse de su hospedero, antenas cortas, ojos pequeños o ausentes y carecen de alas (Clayton et al., 2009; Durden y Lloyd, 2009).
Se reconocen 4 subórdenes dentro de Phthiraptera: Anoplura, Amblycera, Ischnocera y Rhyncophthirina (Galloway, 2018). Los últimos 3 son conocidos como piojos malófagos o masticadores y se caracterizan por tener piezas bucales en forma de mandíbulas robustas especializadas en masticar escamas epidérmicas, plumas y secreciones sebáceas (Rodríguez-Vivas, 2015). En México, existe el registro de piojos de Amblycera e Ischnocera (Sánchez-Montes et al., 2018). La mayoría de los Amblycera infectan aves y 3 familias (Boopiidae, Gyropidae y Trimenoponidae) a mamíferos, mientras que dentro de los Ischnocera, una familia infecta aves (Philopteridae) y la otra a mamíferos (Trichodectidae) (Galloway, 2018). Los anopluros o piojos chupadores solo parasitan mamíferos placentarios y tienen un aparato picador-chupador compuesto por 3 estiletes finos que utilizan para alimentarse directamente de los vasos sanguíneos de su hospedero y de algunos fluidos corporales (Durden y Lloyd, 2009; Rodríguez-Vivas, 2015).
Tanto los piojos chupadores como los masticadores poseen simbiontes bacterianos en su aparato digestivo que les ayudan en la descomposición de partículas difíciles de digerir o para obtener vitaminas y compuestos esenciales para su supervivencia, crecimiento, desarrollo y reproducción (Boyd y Reed, 2012). Según su grado de especificidad, los parásitos pueden ser monoxenos (1 especie hospedera), estenoxenos (hospederos del mismo género), oligoxenos (hospederos de la misma familia) o eurixenos (hospederos de diversas familias) (Gállego, 2007; Martinů et al., 2015). El grado de dependencia de las especies de piojos respecto a sus hospederos influye en el rango de distribución geográfica de estos últimos, lo que es más visible en las comunidades y ecosistemas locales, pues cuando las especies hospederas son migratorias o tienen gran capacidad de dispersión, su presencia en un ecosistema puede variar estacionalmente (Galloway, 2018).
La distribución de piojos en una población de hospederos generalmente es agregada y binomial negativa, pues solo un pequeño número de individuos transporta la mayor proporción de la población total de piojos, y la mayoría de los individuos no están infestados (Galloway, 2012). Se ha propuesto que si los piojos masticadores se encuentran en cantidades pequeñas no tienen efectos negativos e incluso pueden ser relativamente benignos para el hospedero (Clayton et al., 2009), pero en grandes cantidades pueden reducir su supervivencia y reproducción (McGavin, 2002). Hamilton y Zuk (1982) reportaron casos en los que las aves macho infestadas por piojos eran menos atractivas para las hembras. Además, dado que los piojos masticadores reducen la masa de plumas, éstos afectan la termorregulación de las aves, por lo que es necesario que aumenten su tasa de ingesta alimentaria (Booth et al., 1993). La pediculosis (i.e., infestación de piojos), por otra parte, provoca irritación, descamación, anemia, comezón, enrojecimiento cutáneo e incluso la muerte, pues son vectores de otros parásitos y de diversos patógenos bacterianos y virales (Bartlett y Anderson, 1989; Craig, 2011; Linn et al., 2001; Reeves et al., 2005).
Los piojos tienen importancia veterinaria, pues pueden infestar a aves de corral, ganado (vacas, caballos, cabras, ovejas y cerdos) y mascotas, resultando en pérdidas económicas, pues la irritación puede provocar la autolesión de los hospederos por frotación, y cuando la infestación es grave los animales tienen un bajo o nulo aumento de peso y una reducción en la producción de huevos, leche y lana, entre otros productos (Galloway, 2018). Los piojos también tienen importancia médica, ya que 2 especies y 2 subespecies parasitan al humano: Pediculus humanus humanus Linnaeus, 1758 (piojo del cuerpo), Pediculus humanus capitis de Geer, 1778 (piojo de la cabeza) y Pthirus pubis Linnaeus, 1758 (piojo púbico o ladilla) (Zúñiga y Caro, 2010). Estudios recientes han asociado a los piojos de la cabeza como vectores de agentes infecciosos, aunque su capacidad vectorial es más baja que la de P. humanus humanus (Angelakis et al., 2011; Diatta et al., 2014; Kim et al., 2017; Sangaré et al., 2014). Recientemente, en México se han reportado casos donde los piojos del cuerpo son vectores del tifus epidémico (Rickettsia prowazekii da Rocha-Lima, 1916), fiebre de las trincheras (Bartonella quintana Schmincke, 1917), fiebre recurrente (Borrelia recurrentis Lebert,1874) y la enfermedad de Brill Zinsser (Alcántara et al., 2009; Cortes y Gámez, 2008; Zúñiga y Caro, 2010). El piojo del cuerpo también ha sido asociado a la transmisión de la peste (Yersinia pestis Lehmann y Neumann, 1896) (Drali et al., 2015). Antes del desarrollo y uso de insecticidas, a mediados del siglo XX, murieron más personas por enfermedades transmitidas por piojos que por guerras, por lo que los piojos han sido y siguen siendo reguladores naturales de las poblaciones (Durden y Lloyd, 2009; McGavin, 2002).
En el mundo aún hay gran desconocimiento sobre la diversidad de Phthiraptera, por lo que un primer paso es conocer su diversidad local. En México, los principales trabajos de distribución de piojos son los de Sánchez-Montes et al. (2013, 2018), que en conjunto registran 386 especies. Sin embargo, estos trabajos no revisan los piojos parásitos de los humanos, ni los piojos chupadores asociados a animales domésticos. En este trabajo, se busca ofrecer un listado más completo y actualizado del orden Phthiraptera en México, así como de su distribución estatal y grado de especificidad. También se hace una revisión de los piojos que parasitan humanos y su distribución en el país.
Materiales y métodos
Se realizó una búsqueda en los buscadores Scopus, PubMed, ScienceDirect, Zoological record, Web of science, Semantic Scholar y TESIUNAM para encontrar las entidades federativas donde se reporta la incidencia de especies del orden Phthiraptera. Primero, una consulta fue estructurada usando los términos “Mexico” AND “Phthiraptera” OR “lice” OR “louse” OR “ectoparasite” dentro del título, resumen o palabras clave de los artículos. Con esta búsqueda encontramos que 2 artículos de investigación tenían incluidos la mayoría de los registros, pues uno es un listado de piojos chupadores (Sánchez-Montes et al., 2013) y el otro de piojos masticadores de México (Sánchez-Montes et al., 2018). También utilizamos las bases de datos de la presencia de Phthiraptera disponibles en GBIF.org. Finalmente, con los registros encontrados hasta el año 2020, se elaboró una base de datos en la que se registró: suborden, familia, especie, autoridad y año, sinónimo, hospedero, entidad federativa y referencia.
Para obtener la riqueza de piojos masticadores y chupadores del país, se contaron las especies y subespecies registradas en la base de datos. La mayoría de las especies se encuentran incluidas en los listados de Sánchez-Montes et al. (2013, 2018). No obstante, en el presente listado se añadieron registros no incluidos de especies y subespecies, de hospederos y de registros en las distintas entidades federativas, así como la referencia del registro original y la sinonimia de los piojos según lo establecido por Johnson et al. (2020) y trabajos taxonómicos recientes. Se añaden sinónimos para la corroboración de datos y evitar la repetición de registros. Para los hospederos, se indica el nombre científico actual, pues en algunos registros originales aparecen sinonimias.
Las adiciones de este trabajo al listado de Phthiraptera se indican con un asterisco, y se incluye la fuente de consulta del registro. Los subórdenes de Phthiraptera, incluyendo sus especies, se reportan en orden alfabético.
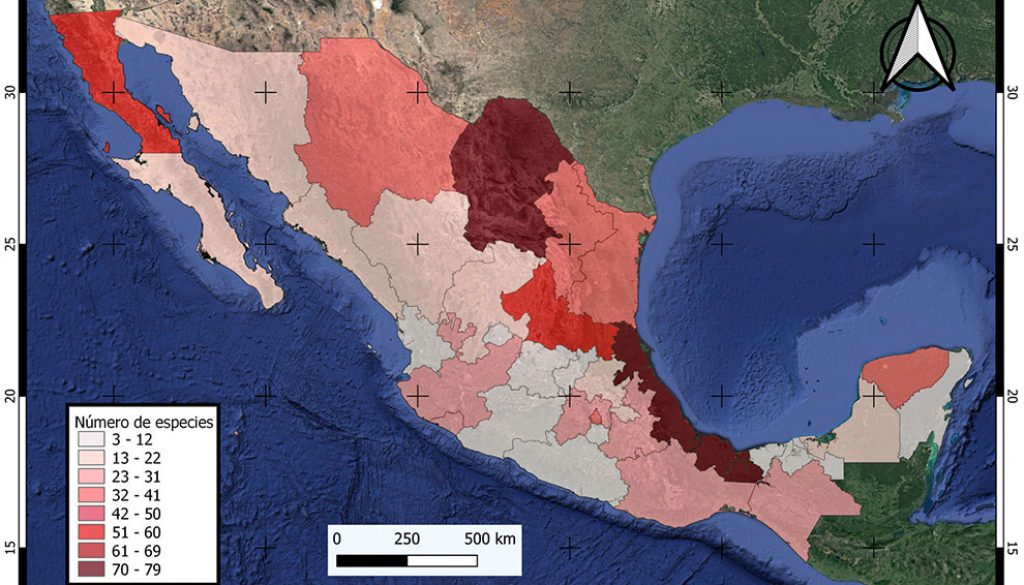
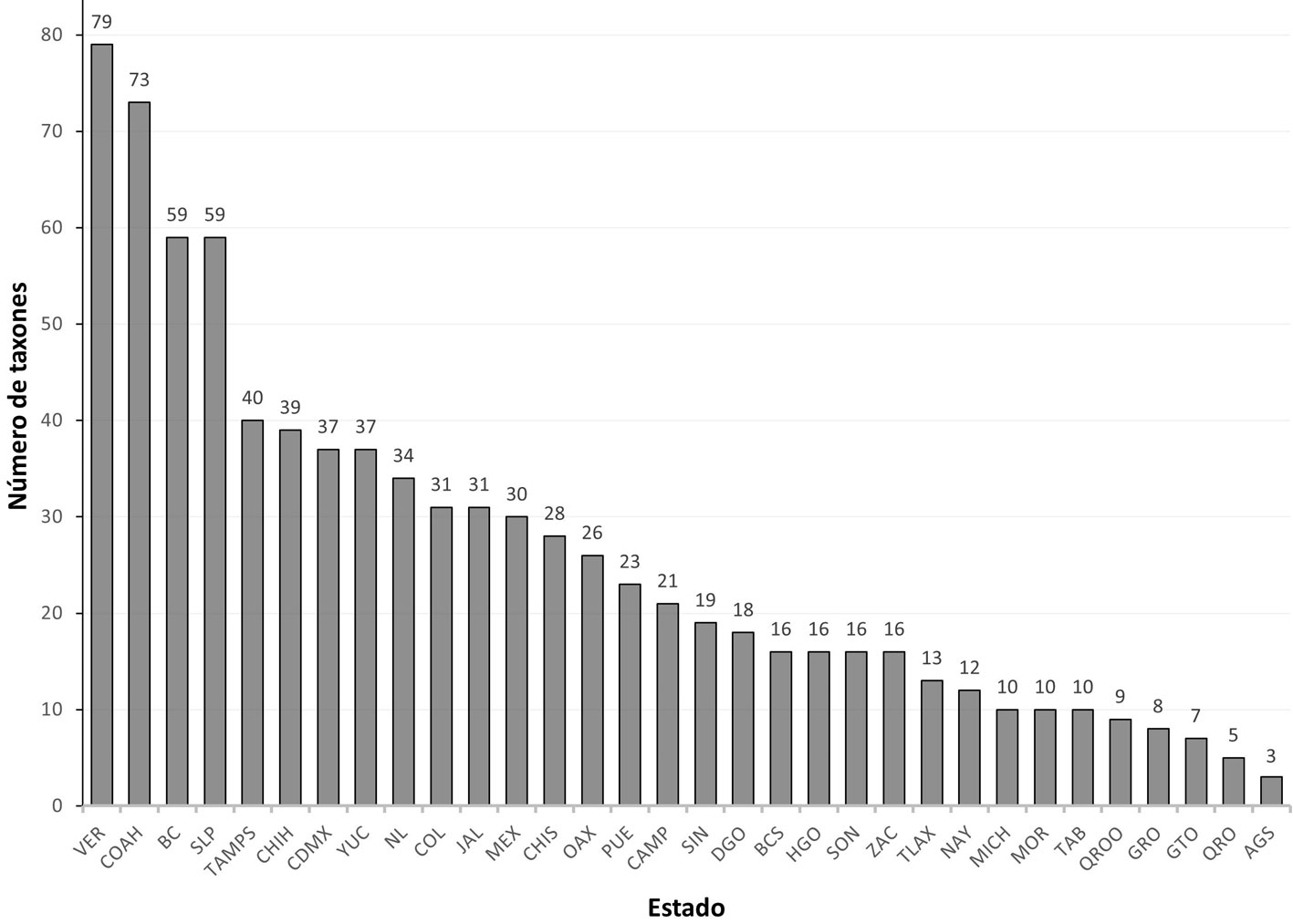
Las 32 entidades federativas de México se indican con las abreviaturas: AGS = Aguascalientes, BC = Baja California, BCS = Baja California Sur, CAMP = Campeche, CDMX = Ciudad de México, COAH = Coahuila, COL = Colima, CHIS = Chiapas, CHIH = Chihuahua, DGO = Durango, MEX = Estado de México, GTO = Guanajuato, GRO = Guerrero, HGO = Hidalgo, JAL = Jalisco, MICH = Michoacán, MOR = Morelos, NAY = Nayarit, NL = Nuevo León, OAX = Oaxaca, PUE = Puebla, QRO = Querétaro, QROO = Quintana Roo, SIN = Sinaloa, SLP = San Luis Potosí, SON = Sonora, TAB = Tabasco, TAMPS =Tamaulipas, TLAX = Tlaxcala, VER = Veracruz y ZAC = Zacatecas.
Para la clasificación de los piojos según su grado de especificidad, consideramos a las especies hospederas que se han registrado en el país, así como las categorías establecidas por Gállego (2007) y Martinů et al. (2015): monoxeno (hospederos de la misma especie aunque de distinta subespecie), estenoxeno (hospederos del mismo género), oligoxeno (hospederos de la misma familia) y eurixeno (hospederos de distinta familia). Se consideraron como asociaciones válidas cuando el registro original marcaba la asociación entre un piojo y un animal silvestre poco usual (Price et al., 2003).
Resultados
De acuerdo con los listados de Sánchez-Montes et al. (2013, 2018) y las especies aquí reportadas, en México se registran 443 especies y subespecies de piojos pertenecientes a 16 familias, 123 géneros y 3 subórdenes: Amblycera, Anoplura e Ischnocera. Los 32 estados de la república mexicana tienen registros de piojos (fig. 1), siendo los de mayor riqueza de especies Veracruz, Coahuila, San Luis Potosí y Baja California con 79, 73, 59 y 59 especies y subespecies, respectivamente (fig. 2).
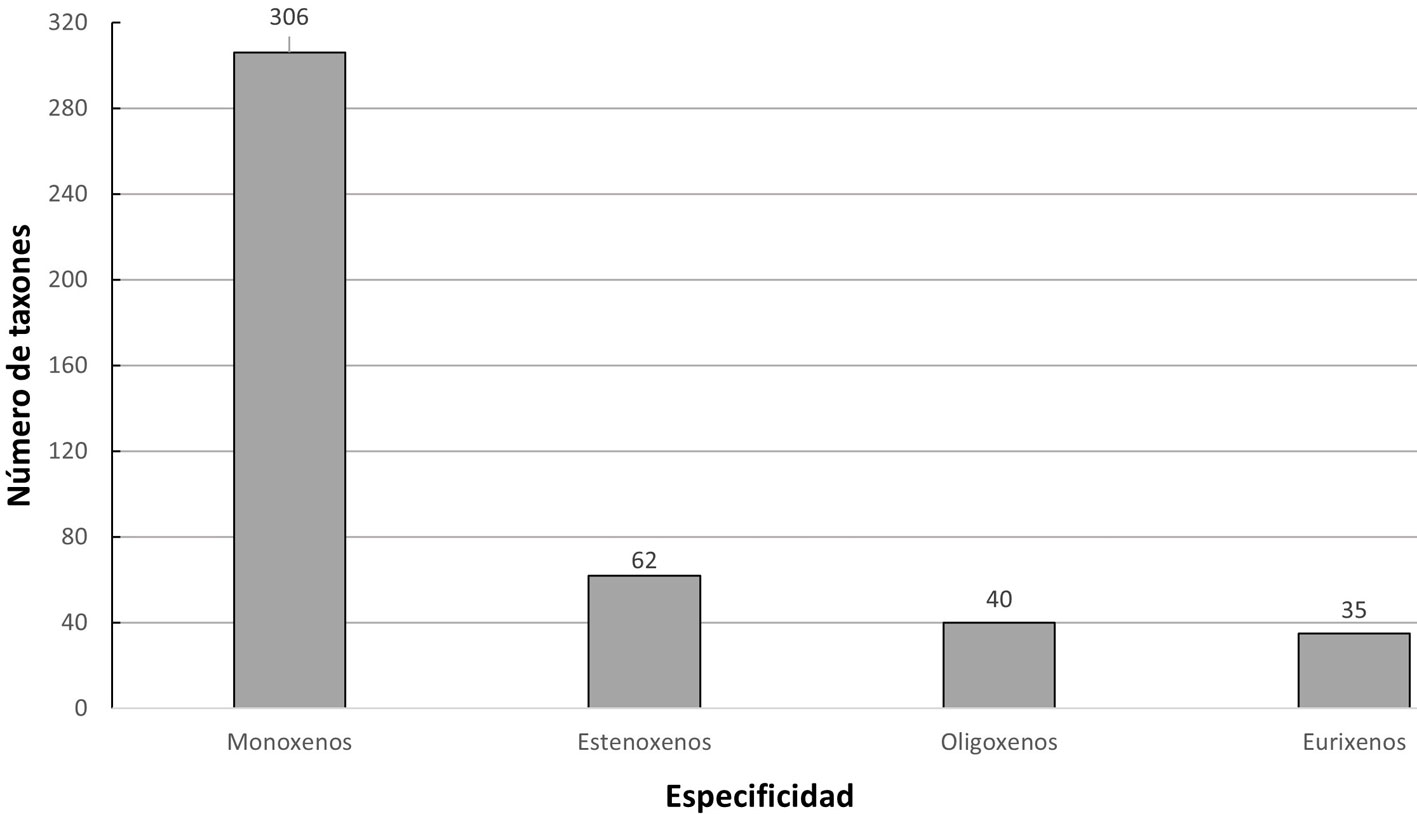
Para la clase Aves, se reportan 243 especies hospederas pertenecientes a 172 géneros, 64 familias y 20 órdenes, mientras que para la clase Mammalia se reportan 116 especies pertenecientes a 54 géneros, 19 familias y 5 órdenes: Artiodactyla, Carnivora, Perissodactyla, Primates y Rodentia. De acuerdo con los hospederos registrados en México para las 443 especies y subespecies de piojos, existen más piojos monoxenos (69.1%) y estenoxenos (14%), que oligoxenos (9%) y eurixenos (7.9%) (fig. 3).
Ninguna de las 3 especies parásitas propias de humanos tuvo registro en los 32 estados de México. El piojo del cuerpo, Pediculus humanus corporis, fue el que tuvo registros en más estados, con 31, seguido por el piojo de la cabeza (Pediculus humanus capitis), con menciones en 18 estados y el piojo púbico o “ladilla” (Pthirus pubis), reportado en solo 7 estados.
A continuación, se enlistan los taxones, localidades y hospederos no mencionados por Sánchez-Montes et al. (2013, 2018).
Adiciones al listado de Phthiraptera de México: piojo-entidad federativa-hospedero.
Suborden Amblycera Kellogg, 1896
Familia Boopiidae Mjöberg, 1910
Género Heterodoxus Le Souëf y Bullen, 1902
Heterodoxus spiniger Enderlein, 1909
Sinónimos: Heterodoxus armiferus (Paine, 1912), Menopon spiniger (Enderlein, 1909), M. spinigerum (Neumann, 1912).
Especificidad: eurixeno.
*CHIS (Baak-Baak et al., 2020),*GTO (Palacios-Pacheco et al., 2015): Canis lupus familiaris Linnaeus, 1758. COAH (Lozoya-Saldaña et al., 1986b): *Gallus gallus Linnaeus, 1758; *Meleagris gallopavo Linnaeus, 1758.
Nota: este piojo es parásito usual de cánidos y marsupiales (Price et al., 2003).
Familia Laemobothriidae Mjöberg, 1910
Género Laemobothrion Nitzsch, 1818
*Laemobothrion (Laemobothrion) glutinans Nitzsch, 1861
Sinónimos: Laemobothrion canalense (Eichler, 1942), L. delogramma (Kellogg y Paine, 1910), L. museihamburgi (Eichler, 1954).
Especificidad: monoxeno.
*COAH (PIPR, 2020): *Cathartes aura Linnaeus, 1758.
Laemobothrion (Laemobothrion) sp.
*NL (Ponce-García, 2012): *“pato”
Nota: anteriormente, solo se conocía la asociación de Laemobothrion con aves accipitriformes en México (Sánchez-Montes et al., 2018). Aunque Ponce-García (2012) no determinó la especie de pato, se considera nueva mención de hospedero para el género.
Familia Menoponidae Mjöberg, 1910
Género Austromenopon Bedford, 1939
*Austromenopon paululum Kellogg y Chapman, 1899
Sinónimos: Austromenopon fraterculae (Timmermann, 1954), A. piekarskii (Timmermann, 1963), Menopon paululum (Kellogg y Chapman, 1899).
Especificidad: monoxeno.
*COL (Palma, 2004): *Puffinus auricularis Townsend, 1890.
Género Colpocephalum Nitzsch, 1818
*Colpocephalum kelloggi Osborn, 1902
Sinónimo: Vulturigogus kelloggi (Osborn, 1902).
Especificidad: monoxeno.
*COAH (Grant et al., 2020): *Cathartes aura.
Colpocephalum pectinatum Osborn, 1902
Sinónimos: Colpocephalum ictiniae y Conciella pectinatum neotropicalis (Carriker, 1963).
Especificidad: oligoxeno.
BC (Bolaños-García et al., 2018): *Bubo virginianus Gmelin, 1788.
*Colpocephalum zerafae Ansari, 1955
Sinónimo: Colpocephalum zerafae biarmicus (Tendeiro, 1988).
Especificidad: monoxeno.
*COAH (PIPR, 2020): *Falco columbarius Linnaeus, 1758.
*Género Cuculiphilus Uchida, 1926
*Cuculiphilus (Falcophilus) alternatus Osborn, 1902
Sinónimos: Cuculiphilus (Falcophilus) coragypsis (Eichler, 1948), Menopon alternatus y Vulturiphilus alternatum (Osborn, 1902).
Especificidad: monoxeno.
*COAH (PIPR, 2020): *Cathartes aura.
Género Menacanthus Neumann, 1912
Menacanthus stramineus Nitzsch, 1818
Sinónimos: Liotheum stramineus (Nitzsch, 1818), Eomenacanthum biseriatus y Menopon biseriatum (Piaget, 1880), Pediculus meleagridis (Panzer, 1798), Zemiodes zumpti (Eichler, 1944).
Especificidad: oligoxeno.
*BCS, *CHIS, *HGO y OAX (Huerta-Jiménez, 2015): *Canis lupus familiaris. *CDMX (Alcalá, 2014c), HGO (Rodríguez-Ortega et al., 2018), *JAL (Linares et al., 2018), NL (Ponce-García, 2012): Meleagris gallopavo. COAH y NL (Ponce-García, 2012), OAX (Cruz et al., 2014), YUC (Caamal, 1982): *Gallus gallus. NL (Ponce-García, 2012), COAH (Lozoya-Saldaña et al., 1986b): *Columba livia Gmelin, 1789. *TAMPS (Ponce-García, 2012): “Ave de corral”.
Nota: M. stramineus es un piojo común en aves de corral (Price et al., 2003).
Menacanthus sp.
TAMPS (PIPR, 2020): *Crax rubra rubra Linnaeus, 1758.
Nota: el pavón norteño C. r. rubra es una nueva mención como especie hospedera para el género Menacanthus.
Género Menopon Nitzsch, 1818
Menopon gallinae Linnaeus, 1758
Sinónimos: Liotheum pallidum (Nitzsch, 1818), Menopon brevipes y M. subaequaleproductum (Piaget, 1885), M. longicephalum (Kellogg, 1896), M. lunanale (Eichler, 1947), M. productum y M. p. major (Piaget, 1880), Nirmus trigonocephalus (Olfers, 1816), Pediculus gallinae (Linnaeus, 1758).
Especificidad: eurixeno.
*BCS (Huerta-Jiménez, 2015): *Canis lupus familiaris. *CDMX (Alcalá, 2014d), *COAH (Lozoya-Saldaña et al., 1986b), *HGO (Rodríguez-Ortega et al., 2018), *JAL (Linares et al., 2018), NL (Ponce-García, 2012), OAX (Cruz et al., 2014), YUC (Caamal, 1982): Gallus gallus. COAH (Lozoya-Saldaña et al., 1986b): *Columba livia.
Nota: aunque es conocido como el piojo del cañón de las plumas de las gallinas, se ha visto parasitando frecuentemente a otras especies de aves (Price et al., 2003).
Género Myrsidea Waterston, 1915
*Myrsidea timmermanni Klockenhoff, 1974
Sinónimo: Myrsidea timmermanni mexicana (Klockenhoff, 1974).
Especificidad: monoxeno.
*NAY (Orrell, 2020): *Corvus ossifragus Wilson, 1812.
Myrsidea sp.
*COAH (PIPR, 2020): *Melozone fusca Swainson, 1827; *Sialia mexicana Swainson, 1832.
Género Piagetiella Neumann, 1906
*Piagetiella bursaepelecani Perry, 1876
Sinónimos: Menopon titan linearis (Kellogg, 1896), Trinoton bursaepelecani (Perry, 1876).
Especificidad: monoxeno.
*SIN (González-Quintero, 2011): *Pelecanus occidentalis californicus Ridgway, 1884.
Género Trinoton Nitzsch, 1818
Trinoton querquedulae Linnaeus, 1758
Sinónimos: Pediculus querquedulae (Linnaeus, 1758), Ricinus lari (de Geer, 1778), Trinoton gracile (Grube, 1851), T. lituratum (Burmeister, 1838), T. luridum (Burmeister, 1838), T. minus (Osborn, 1896), T. pygmaeum (Kolenati, 1846); T. nyrocae, T. querquedulae casarcae y T. q. mergi (Eichler, 1943); T. q. kuenzeli y T. q. ludwigfreundi (Eichler, 1954), T. spinosum (Piaget, 1880), T. verakopskeae (Eichler y Vasjukova, 1981).
Especificidad: oligoxeno.
*COAH (Aguirre-Uribe et al., 1988): *Anas americana Gmelin, 1789; *A. crecca carolinensis Gmelin, 1789; *A. clypeata Linnaeus, 1758; *Aythya valisineria Wilson, 1838; *Oxyura jamaicensis rubida Wilson, 1814.
Familia Ricinidae Neumann, 1890
Género Ricinus de Geer, 1778
*Ricinus carolynae Nelson, 1972
Especificidad: monoxeno.
*COAH (PIPR, 2020): *Spinus psaltria Say, 1822.
*Ricinus dendroicae Nelson, 1972
Especificidad: eurixeno.
*COAH (PIPR, 2020): *Contopus cooperi Nuttall, 1831; *Junco phaeonotus Wagler, 1831.
*Ricinus fringillae de Geer, 1778
Sinónimos: Nirmus fringillae (de Geer, 1778), Liotheum nitidissimum y Physostomum nitidissimum (Nitzsch, 1818); Ph. bombycillae (Denny, 1842), Ph. diffusus pallidus (Kellogg, 1896), Ph. hastatus (Osborn, 1902); Ph. intermedius y Ph. japonicus (Uchida, 1915), Ph. irascens (Burmeister, 1838), Ricinus accentor (Eichler, 1953), R. inexpectatus (Balat, 1966); R. fringillae aureolae, R. f. flammeae, R. f. flavirostris y R. japonicus rheinwaldi (Mey, 1982), R. medius (Uchida, 1926), R. subpallidus (Blagoveshtchensky, 1951), Ricinus uchidai (Fresca, 1924).
Especificidad: oligoxeno.
*CHIH (PIPR, 2020): *Zonotrichia leucophrys Forster, 1772. *COAH (PIPR, 2020): *Pooecetes gramineus Gmelin, 1789; *Melozone fusca.
Suborden Anoplura Leach, 1815
Familia Enderleinellidae Ewing, 1929
Género Enderleinellus Fahrenholz, 1912
Enderleinellus suturalis Osborn, 1891
Sinónimos: Cyclophthirus suturalis (Osborn, 1929), Enderleinellus suturalis occidentalis (Kellogg y Ferris, 1915), Haematopinus suturalis (Osborn, 1891).
Especificidad: estenoxeno.
CHIH (Ritzi, 2014): *Otospermophilus variegatus Erxleben, 1777; *Xerospermophilus spilosoma Bennett, 1833. *COAH (Orrell, 2020): sin hospedero reportado.
*Familia Haematopinidae Enderlein, 1904
*Género Haematopinus Leach, 1815
*Haematopinus asini Linnaeus, 1758
Sinónimos: Haematopinus asini burchellis (Webb, 1948); H. a. minor, H. a. elegans, H. elegans y H. minor (Fahrenholz, 1916), H. equi (Simmonds, 1865), H. a. colorata (Piaget, 1880), Pediculus asini (Linnaeus, 1758), P. macrocephalus (Burmeister, 1838).
Especificidad: monoxeno.
*GRO (Onofre-Barragán, 2015): *Equus asinus Linnaeus, 1758.
*Haematopinus eurysternus Denny, 1842
Sinónimos: Haematopinus brevipes (Fiedler y Stampa, 1956), H. palpebrae (Gretillat, 1957).
Especificidad: monoxeno.
*SON y *TAMS (Quintero, 2011): *Bos taurus Linnaeus, 1758.
*Haematopinus quadripertusus Fahrenholz, 1916
Sinónimos: Haematopinus palpebrae (Gretillat, 1957), H. parviprocursus (Fahrenholz, 1916).
Especificidad: monoxeno.
*SON (Quintero, 2011), *YUC (Rodríguez-Vivas et al., 2016): *Bos taurus.
*Haematopinus suis Linnaeus, 1758
Sinónimos: Haematopinus adventicus (Ewing, 1934); H. suis adventicus (Neumann, 1911); H. suis chinensis, H. s. sardinensis, H. s. germanus (Fahrenholz, 1939), H. irritans (Law, 1903), H. tuberculatus penicillatus (Piaget, 1885), Pediculus suis (Linnaeus, 1758), P. urius (Nitzsch, 1818).
Especificidad: eurixeno.
*CDMX (Alcalá, 2014a); COAH, *DGO, *NL, *TAMS y *ZAC (Ponce-García, 2012): *Sus scrofa scrofa Linnaeus, 1758. *COAH (Lozoya-Saldaña et al., 1986a): *Ovis aries Linnaeus, 1758. NL (Huerta-Jiménez, 2015): *Homo sapiens Linnaeus, 1758.
Nota: O. aries y H. sapiens son hospederos inusuales de H. suis, pues el cerdo (S. scrofa scrofa) es su hospedero típico (Acosta et al., 2019).
*Haematopinus tuberculatus Burmeister, 1839
Sinónimos: Haematopinus punctatus y Pediculus punctatus (Rudow, 1869), P. tuberculatus (Burmeister, 1839).
Especificidad: monoxeno.
*VER (Hernández-Velasco et al., 2020): *Bubalus bubalis Linnaeus, 1758.
Haematopinus sp.
*SIN (Zatarain et al., 2018): *Capra hircus Linnaeus, 1758.
Nota: Zatarin et al. (2018) no llegaron a determinar la especie; sin embargo, Sinaloa y C. hircus son nuevas menciones para el género Haematopinus.
Familia Hoplopleuridae Ewing, 1929
Género Hoplopleura Enderlein, 1904
Hoplopleura acanthopus Burmeister, 1839
Sinónimos: Haematopinus acanthopus, Pediculus acanthopus y Polyplax acanthopus (Burmeister, 1839), H. fahrenholzi (Eichler, 1950), H. acanthopus americanus (Kellogg y Ferris, 1915); H. a. edentulus y H. a. aequidentis (Fahrenholz, 1916); H. acanthopus silesica (Eichler, 1952), Polyplax villosa (Galli-Valerio, 1905).
Especificidad: monoxeno.
*CHIH (Ritzi, 2014): Microtus mexicanus Saussure, 1881.
Nota: Sánchez-Montes et al. (2013) reportan a M. mexicanus subsimus Goldman, 1938 como hospedero de este piojo en Nuevo León; sin embargo, actualmente este taxón no se reconoce como una subespecie válida (Roskov et al., 2020).
Hoplopleura emphereia Kim, 1965
Sinónimo: Hoplopleura ferrisi emphereia (Kim, 1965).
Especificidad: oligoxeno.
GRO (Sánchez-Montes, Guzmán-Cornejo, Ramírez-Corona et al., 2016): *Megadontomys thomasi Merriam, 1898; Peromyscus megalops Merriam, 1898. OAX (Sánchez-Montes, Guzmán-Cornejo, Ramírez-Corona et al., 2016): *P. aztecus Saussure, 1860; P. megalops.
Nota: Sánchez-Montes et al. (2013) reportan a P. megalops auritus Merriam, 1898 como hospedero en Guerrero, pero actualmente no se considera una subespecie válida (Roskov et al., 2020), por lo que no consideramos a P. megalops nuevo hospedero, aunque en Oaxaca es la primera vez que se reporta como parásito de P. megalops.
Hoplopleura ferrisi Cook y Beer, 1959
Sinónimo: Hoplopleura ferrisi ferrisi (Kim, 1965).
Especificidad: estenoxeno.
*CHIH (Ritzi, 2014): *Peromyscus boylii Baird, 1855; *P. nasutus Allen, 1891.
Hoplopleura hesperomydis Osborn, 1891
Sinónimos: Haematopinus hesperomydis (Osborn, 1891), Hoplopleura hesperomydis occidentalis (Kellogg y Ferris, 1915).
Especificidad: oligoxeno.
CHIH (Ritzi, 2014): *Peromyscus leucopus Rafinesque, 1818; *P. truei Shufeldt, 1885.
Hoplopleura hirsuta Ferris, 1916
Especificidad: oligoxeno.
CHIH (Ritzi, 2014): *Onychomys arenicola Mearns, 1896; *Sigmodon hispidus Say y Ord, 1825. NL (Ponce-García, 2012), SLP (Sánchez-Montes, Guzmán-Cornejo, Herrera-Montalvo et al., 2016): S. hispidus.
*Hoplopleura pacifica Ewing, 1924
Sinónimo: Hoplopleura pacificus (Ritzi, 2014).
Especificidad: monoxeno.
*CHIH (Ritzi, 2014): *Rattus rattus Linnaeus, 1758.
Hoplopleura reithrodontomyis Ferris, 1951
Sinónimo: Hoplopleura reithrodontomydis (Ferris, 1951).
Especificidad: oligoxeno.
*GRO (Sánchez-Montes, Guzmán-Cornejo, Ramírez-Corona et al., 2016): *Habromys schmidlyi Romo-Vázquez et al., 2005; *Reithrodontomys bakeri Bradley, 2004; *R. sumichrasti Saussure, 1861. *OAX (Sánchez-Montes, Guzmán-Cornejo, Ramírez-Corona et al., 2016): *R. mexicanus Saussure, 1860.
Hoplopleura sp.
NL (Ponce-García, 2012): *Cynomys mexicanus Merriam, 1892; Rattus rattus.
Nota: Ponce-García (2012) no determinó la especie; sin embargo, Cynomys mexicanus es un nuevo hospedero para el género Hoplopleura.
Familia Linognathidae Webb, 1946
Género Linognathus Enderlein, 1905
*Linognathus africanus Kellogg y Paine, 1911
Especificidad: eurixeno.
*COAH (González-Álvarez, 2020; Lozoya-Saldaña et al., 1986a): *Capra hircus. COAH (Lozoya-Saldaña et al., 1986a): *Bos taurus, *Canis lupus familiaris, *Meleagris gallopavo.
*Linognathus setosus von Olfers, 1816
Sinónimos: Haematopinus (Linognathus) piliferus, Haematopinus piliferus, Linognathus piliferus, Pediculus piliferus y Trichaulus piliferus (Burmeister, 1838), Haematopinus bicolor (Lucas, 1847), Pediculus flavidus (Nitzsch, 1864), P. isopus (Nitzsch, 1861), P. setosus (von Olfers, 1816).
Especificidad: monoxeno.
*COAH (Ueda, 2021): sin hospedero reportado. *NL (Ponce-García, 2012): *Capra hircus.
*Linognathus stenopsis Burmeister, 1838
Sinónimos: Haematopinus forficulus, H. rupicaprae y Linognathus rupicaprae (Rudow, 1869); H. stenopsis, Pediculus stenopsis y Trichaulus stenopsis (Burmeister, 1838), L. schistopygus y P. schistopyga (Nitzsch, 1864), P. hirci (von Olfers, 1816).
Especificidad: monoxeno.
*COAH (González-Álvarez, 2020; Lozoya-Saldaña et al., 1986a): *Capra hircus. *MEX (Huerta-Jiménez, 2015): sin hospedero reportado.
Linognathus vituli Linnaeus, 1758
Sinónimos: Haematopinus tenuirostris y Pediculus tenuirostris (Burmeister, 1838); H. vituli, Linognathella vituli, P. vituli (Linnaeus, 1758), P. bovis vituli (Linnaeus, 1764), P. oxyrrhynchus (Nitzsch, 1864), P. tenuirostris (Burmeister, 1838).
Especificidad: eurixeno.
*COAH (Lozoya-Saldaña et al., 1986a): *Capra hircus. *NL (Ruíz-Cancino y Coronado-Blanco, 2002): sin hospedero reportado.
Linognathus sp.
*SIN (Zatarain et al., 2018): Capra hircus.
Nota: Zatarain et al. (2018) no llegaron a determinar la especie; sin embargo, Sinaloa es considerada como nueva entidad federativa reportada para la distribución del género Linognathus.
*Familia Pecaroecidae Kéler, 1963
*Género Pecaroecus Babcock y Ewing, 1938
*Pecaroecus javalii Babcock y Ewing, 1938
Especificidad: monoxeno.
*CHIH (Ritzi, 2014): *Pecari tajacu Linnaeus, 1758.
*Familia Pediculidae Leach, 1817
*Género Pediculus (Linnaeus, 1758) y Linnaeus, 1758
*Pediculus humanus capitis de Geer, 1778
Sinónimos: Pediculus capitis (de Geer, 1778).
Especificidad: monoxeno.
*BCS, *CDMX, *CHIS, *COAH, *GRO, *JAL, *MEX, *MOR, *NL, *OAX, *SON, *TAB, *TAMS, *VER y *YUC (Valle-Barbosa et al., 2017); *HGO (Huerta-Jiménez, 2015); *PUE y *QROO (Ueda, 2021): *Homo sapiens.
*Pediculus humanus humanus Linnaeus, 1758
Sinónimos: Pediculus albidior y P. pubescens (Von Olfers, 1816); P. assimilis (Fahrenholz, 1919), P. cervicalis (Latreille, 1803), P. consobrinus (Piaget, 1880); P. capitis angustus, P. corporis marginatus y P. (Pediculus) humanus angustus (Fahrenholz, 1915); P. capitis maculatus, P. corporis angustus, P. friedenthali, P. humanus chinensis, P. humanus marginatus y P. oblongus (Fahrenholz, 1916); P. corporis nigritarum, P. humanus nigritarum y P. nigritarum (Fabricius, 1805); P. corporis y P. humanus corporis (de Geer, 1778), P. (Pediculus) humanus americanus (Ewing, 1926), P. (Parapediculus) pseudohumanus (Ewing, 1938), P. tabescentium (Alt, 1824), P. vestimenti (Nitzsch, 1818).
Especificidad: monoxeno.
*AGS, *BC, *BCS, *CAMP, *CDMX, *CHIH, *CHIS, *COAH, *COL, *DGO, *GTO, *GRO, *HGO, *JAL, *MEX, *MICH, *MOR, *NAY, *NL, *OAX, *PUE, *QRO, *SLP, *SIN, *SON, *TAB, *TAMS, *TLAX, *VER, *YUC y *ZAC (Alcántara et al., 2009; Ortíz-Mariotte, 1952): *Homo sapiens.
Familia Polyplacidae Fahrenholz, 1912
Género Fahrenholzia Kellogg y Ferris, 1915
Fahrenholzia boleni McDaniel, 1968
Especificidad: estenoxeno.
*CHIH (Ritzi, 2014): *Perognathus flavus Baird, 1855.
Fahrenholzia ehrlichi Johnson, 1962
Especificidad: oligoxeno.
*CHIH (Ritzi, 2014): Liomys irroratus Gray, 1868. JAL (Gómez-Rodríguez et al. 2015): *Liomys pictus Thomas, 1893. NL (Ponce-García, 2012): *Sigmodon hispidus.
Fahrenholzia texana Stojanovich y Pratt, 1961
Especificidad: estenoxeno.
*CHIH (Ritzi, 2014), *PUE (Barrientos, 2012): Liomys irroratus. *JAL (Gómez-Rodríguez et al. 2015): *Liomys pictus.
Género Linognathoides Cummings, 1914
Linognathoides laeviusculus Grube, 1851
Sinónimos: Enderleinellus laeviusculus, Haematopinus laeviusculus, Neohaematopinus laeviusculus, Pediculus laeviusculus y Polyplax laeviuscula (Grube, 1851); H. montanus y Linognathoides montanus (Osborn, 1896); H. columbianus y Polyplax columbiana (Osborn, 1900), Neohaematopinus laeviusculus bulgaricus (Touleshkov, 1957).
Especificidad: estenoxeno.
*CHIH (Ritzi, 2014): *Otospermophilus variegatus.
Linognathoides marmotae Ferris, 1923
Sinónimos: Neohaematopinus marmotae (Ferris, 1923), N. mathesoni (Rubin, 1946).
Especificidad: monoxeno.
*CDMX (Martínez-Flores, 2013): *Otospermophilus variegatus.
Género Neohaematopinus Mjöberg, 1910
Neohaematopinus neotomae Ferris, 1942
Especificidad: eurixeno.
*CHIH (Ritzi, 2014): *Dipodomys ordii Woodhouse, 1853; Neotoma micropus Baird, 1855. *GRO (Sánchez-Montes, Guzmán-Cornejo, Ramírez-Corona et al., 2016): *Neotoma mexicana Baird, 1855. NL (Ponce-García, 2012): *Rattus rattus.
*Neohaematopinus pacificus Kellogg & Ferris, 1915
Especificidad: monoxeno.
*BC (Brant, 2020): *Tamias obscurus obscurus Allen, 1890.
Neohaematopinus sciurinus Mjöberg, 1910
Sinónimos: Acanthopinus antennatus y Haematopinus antennatus (Osborn, 1891); Acanthopinus sciurinus (Mjöberg, 1910).
Especificidad: eurixeno.
*BC (Bolaños-García et al., 2018): *Bubo virginianus.
Nota: esta asociación es rara, pues este anopluro es propio de roedores (Price et al., 2003), por lo que esta especie de piojo puede ser producto de un traslado de presas al nido (Bolaños-García et al., 2018).
Neohaematopinus sp.
NL (Ponce-García, 2012): *Neotoma albigula Hartley, 1894.
Nota: aunque no llegó a determinarse la especie del piojo, podría tratarse de Neohaematopinus neotomae, pues el registro de este espécimen fue en la localidad “Doctor Arroyo” (Ponce-García, 2012), donde ya se ha reportado a dicha especie (Ramos-Casillas, 2003).
Género Polyplax Enderlein, 1904
Polyplax alaskensis Ewing, 1927
Sinónimo: Polyplax abscisa (Fahrenholz, 1938).
Especificidad: monoxeno.
*CHIH (Ritzi, 2014): Microtus mexicanus.
Sánchez-Montes et al. (2013) reportaron como hospederos a M. mexicanus mexicanus, M. m. phaeus, M. m. subsimus y M. m. fulviventer; todas sinónimos de M. mexicanus (Roskov et al., 2020).
Polyplax auricularis Kellogg y Ferris, 1915
Sinónimos: Polyplax auricularis californiae y P. painei (Fahrenholz, 1938).
Especificidad: oligoxeno.
*CHIH (Ritzi, 2014): *Onychomys leucogaster Wied-Neuwied, 1841; Peromyscus maniculatus Wagner, 1845; *P. nasutus, *P. truei. *GRO (Sánchez-Montes, Guzmán-Cornejo, Ramírez-Corona et al. 2016): P. beatae Thomas, 1903; *P. megalops.
Nota: aunque son nuevos los reportes de la presencia de Polyplax auricularis en Peromyscus maniculatus y en P. baetae en Chihuahua y Guerrero, respectivamente; no se consideran como nuevos hospederos, pues Sánchez-Montes et al. (2013) los reportaron como hospederos en otros estados.
*Polyplax serrata Burmeister, 1839
Sinónimos: Haematopinus serratus y Pediculus serratus (Burmeister, 1839), Polyplax affinis (Fahrenholz, 1938), P. serrata paxi (Eichler, 1952).
Especificidad: monoxeno.
*CDMX (Acevedo-Rodríguez, 1999): *Mus musculus Linnaeus, 1758.
Polyplax spinulosa Burmeister, 1839
Sinónimos: Haematopinus spinulosus y Pediculus spinulosus (Burmeister, 1839); Pediculus denticulatus (Nitzsch, 1864), Polyplax campylopteri (Zavaleta, 1945).
Especificidad: estenoxeno.
*CHIH (Ritzi, 2014), *YUC (Baak-Baak et al., 2018): Rattus rattus.
Polyplax sp.
YUC (Zavala-Velázquez et al., 2002): *Canis lupus familiaris.
Nota: la asociación del género Polyplax con C. lupus familiaris es considerada inusual, pues estas especies de piojo han sido registradas en asociaciones con roedores (Durden y Musser, 1994; Sánchez-Montes et al., 2013).
*Familia Pthiridae Ewing, 1929
*Género Pthirus Leach, 1815
*Pthirus pubis Linnaeus, 1758
Sinónimos: Pediculus ferus (von Olfers, 1816); P. pubis y Phthirus pubis (Linnaeus, 1758), Phthirus chavesi (Escomel y Velando, 1935), Pthirus inguinalis (Leach, 1815).
Especificidad: monoxeno.
*BCS (Huerta-Jiménez, 2015), *CDMX (Olivares-de Emparan et al., 2008), *COAH (Ueda, 2021), *JAL (Ponce-García, 2012), *MEX (Alarcón et al., 2001); *NL y *TAMS (Ruíz-Cancino y Coronado-Blanco, 2002): *Homo sapiens.
Suborden Ischnocera Kellogg, 1896
Familia Philopteridae Burmeister, 1838
Género Anaticola Clay, 1936
*Anaticola cairinensis Monteiro de Barros, 1933
Sinónimo: Esthiopterum cairinensis (Monteiro de Barros, 1933).
Especificidad: monoxeno.
SIN EDO (PIPR, 2020): *Cairina moschata Linnaeus, 1758.
*Anaticola crassicornis Scopoli, 1763
Sinónimos: Anaticola boetticheri (Eichler, 1980), A. crassicornis kirgizika (Kasiev, 1977), A. dafilensis (Carriker, 1956), A. hopkinsi (Eichler, 1954), A. waltraudae (Eichler y Vasjukova, 1980), A. zunkeri (Kéler, 1937), Columbicola ewingi (Qadri, 1935), Lipeurus depuratus (Nitzsch, 1866), L. gracilis (Giebel, 1874), L. penelopes (Muller, 1927), L. sordidus (Giebel, 1866), L. squalidus major (Piaget, 1880), Pediculus anatis (Schrank, 1781), P. crassicornis (Scopoli, 1763), Philopterus squalidus (Nitzsch, 1818), Ph. temporalis (Nitzsch, 1818).
Especificidad: oligoxeno.
*COAH (Aguirre-Uribe et al., 1988): *Anas americana, *A. crecca carolinensis, *A. clypeata, *Aythya valisineria, *Bucephala clangula americana Bonaparte, 1838; *Oxyura jamaicensis rubida.
Género Anatoecus Cummings, 1916a
Anatoecus dentatus Scopoli, 1763
Sinónimos: Pediculus dentatus y Philopterus dentatus (Scopoli, 1763).
Especificidad: oligoxeno.
*COAH (Aguirre-Uribe et al., 1988): *Anas americana, *A. crecca carolinensis, *A. clypeata, *Aythya valisineria.
*Anatoecus icterodes Nitzsch, 1818
Sinónimos: Philopterus icterodes (Nitzsch, 1818), Ornithobius icterodes (Aguirre-Uribe et al., 1988).
Especificidad: oligoxeno.
*COAH (Aguirre-Uribe et al., 1988): *Anas americana, *A. crecca carolinensis, *A. clypeata, *Aythya valisineria.
Género Austrophilopterus Ewing, 1929
Austrophilopterus cancellosus Carriker, 1903
Sinónimos: Docophorus cancellosus (Carriker, 1903); Austrophilopterus cancellosus cuvieri, A. c. incae, A. c. minor, A. c. similis y A. c. subsimilis (Carriker, 1950), A. cancellosus caurensis (Carriker y Diaz-Ungria, 1961), A. seminirmus (Eichler 1954).
Especificidad: monoxeno.
CHIS (Carriker, 1950): Ramphastos sulfuratus sulfuratus Lesson, 1830.
Nota: Sánchez-Montes et al. (2018) reportaron a esta especie como A. subsimilis Carriker, 1950 pero es considerada sinónima de A. cancellosus (Price y Weckstein, 2005).
*Austrophilopterus flavirostris Carriker 1950
Sinónimos: Austrophilopterus cancellosus flavirostris, A. c. castanotus, A. c. torquatus y A. torquatus (Carriker 1950).
Especificidad: monoxeno.
*CAMP (Carriker, 1950): *Pteroglossus torquatus torquatus Gmelin, 1788.
Nota: Sánchez-Montes et al. (2018) reportaron a esta especie como A. torquatus, considerada sinónima de A. flavirostris (Price y Weckstein, 2005).
*Austrophilopterus truncatus Piaget, 1888
Sinónimos: Docophorus truncatus (Piaget, 1888); Austrophilopterus minutus, A. m. minutus, A. m. sulcatus, A. spinosus spinosus, A. s. calorhynchus, A. s. microgaster, A. s. subspinosus y A. tenuicapitis (Carriker, 1950).
Especificidad: monoxeno.
*SLP (Carriker, 1954), VER (Carriker, 1950): Aulacorhynchus prasinus prasinus Gould, 1833.
Nota: Sánchez-Montes et al. (2018) reportaron a esta especie como A. minutus, pero según la revisión de Price y Weckstein (2005) sobre el género Austrophilopterus, los especímenes reportados por Carriker (1950, 1954) como A. minutus y A. minutus minutus son sinónimos de la especie A. truncatus.
Género Brueelia Kéler, 1936
*Brueelia benkmani Gustafsson y Bush, 2019a
Especificidad: monoxeno.
*COAH (Gustafsson y Bush, 2019a): *Pheucticus melanocephalus Swainson, 1827.
*Brueelia johnsoni Gustafsson et al., 2018
Especificidad: monoxeno.
*COAH (Gustafsson et al., 2018): *Poecile sclateri eidos Peters, 1827.
*Brueelia mexicana Gustafsson y Bush, 2019b
Especificidad: monoxeno.
*COAH (Gustafsson y Bush, 2019b): *Aphelocoma woodhouseii cyanotis Ridgway, 1887.
*Brueelia novemstriata Gustafsson y Bush, 2019a
Especificidad: estenoxeno.
*COAH (Gustafsson y Bush, 2019a): *Icterus wagleri wagleri Sclater, 1857; *I. parisorum Bonaparte, 1838.
*Brueelia thorini Gustafsson y Bush, 2019a
Especificidad: monoxeno.
*COAH (Gustafsson y Bush, 2019a): *Haemorhous mexicanus potosinus Griscom, 1928; H. m. frontalis Say, 1822.
Género Chelopistes Kéler, 1939
Chelopistes dendrortyx Carriker, 1945
Sinónimos: Trichodomedea dendrortyx dendrortyx y T. d. similis (Carriker, 1945), T. d. subsimilis (Carriker, 1967).
Especificidad: estenoxeno.
*MICH (PIPR, 2020): Dendrortyx macroura Jardine y Selby, 1828.
Chelopistes meleagridis Linnaeus, 1758
Sinónimos: Chelopistes stylifer (Nitzsch, 1818), Pediculus meleagridis (Linnaeus, 1758), Philopterus stylifer (Nitzsch, 1818), Rhopaloceras styliferum (Taschenberg, 1882).
Especificidad: oligoxeno.
COAH (Lozoya-Saldaña et al., 1986b), *HGO (Rodríguez-Ortega et al., 2018), OAX (Cruz et al., 2014), YUC (Caamal, 1982): *Gallus gallus. NL (Ponce-García, 2012), *TAMPS (PIPR, 2020): Meleagris gallopavo.
Género Columbicola Ewing, 1929
Columbicola columbae Linnaeus, 1758
Sinónimos: Columbicola columbae columbae y Pediculus columbae (Linnaeus, 1758); C. columbae juanfernandez (Eichler, 1952), Lipeurus antennatus (Giebel, 1874), Nirmus filiformis (Olfers, 1818), Phagopterus columbae (Freire y Duarte, 1944), Philopterus baculus (Nitzsch, 1818).
Especificidad: eurixeno.
*COAH (Lozoya-Saldaña et al., 1986b); *DGO, NL (Ponce-García, 2012): Columba livia.
Columbicola macrourae Wilson, 1941
Sinónimos: Columbicola pseudolipeurusque (Eichler, 1952), Esthiopterum macrourae (Wilson, 1941).
Especificidad: oligoxeno.
*COAH (PIPR, 2020): *Patagioenas fasciata Say, 1822.
Género Craspedorrhynchus Kéler, 1938
*Craspedorrhynchus americanus Emerson, 1960
Especificidad: monoxeno.
*COAH (PIPR, 2020): *Buteo jamaicensis Gmelin, 1788.
*Craspedorrhynchus candidus Rudow, 1870
Sinónimo: Docophorus candidus (Rudow, 1870).
Especificidad: monoxeno.
*VER (Orrell, 2020): *Leucopternis albicollis Latham, 1790.
Género Cuclotogaster Carriker, 1936
Cuclotogaster heterographus Nitzsch, 1866
Sinónimos: Cuclotogaster laticorpus (Carriker, 1936), Gallipeurus heterographus y Lipeurus heterographus (Nitzsch, 1866), Goniocotes burnetti (Packard., 1870), G. eynsfordii (Theobold, 1896), L. heterographus major (Piaget, 1880), L. pallidus (Giebel, 1874).
Especificidad: eurixeno.
COAH (Lozoya-Saldaña et al., 1986b), NL (Ponce-García, 2012): *Columba livia, *Gallus gallus. NL (Ponce-García, 2012): *Accipitridae, *Ovis aries. *TAMS (Ruíz-Cancino y Coronado-Blanco, 2002): sin hospedero reportado.
Nota: Ponce-García (2012) no menciona el género pero sí a la familia hospedera “Accipitridae”, que es nueva mención para C. heterographus. Este parásito es común en aves de corral (Price et al., 2003), por lo que su presencia en C. livia y O. aries puede ser por el contacto entre animales de granja.
Género Degeeriella Neumann, 1906
Degeeriella fulva Giebel, 1874
Sinónimos: Degeeriella borealis y D. genitalis (Carriker, 1956), D. giebeli (Hopkins, 1947); Kelerinirmus fusca y Nirmus fuscus (Nitzsch, 1861), N. angusta, N. fulva y N. flavida (Giebel, 1874).
Especificidad: oligoxeno.
*COAH (PIPR, 2020): *Buteo albonotatus Kaup, 1847; B. jamaicensis.
Género Discocorpus Carriker, 1936
Discocorpus mexicanus Carriker, 1954
Sinónimos: Discocorpus cephalosus mexicanus (Carriker, 1954), D. c. yucatanensis (Carriker, 1961).
Especificidad: estenoxeno.
*CAMP y *NAY (Grant et al., 2020): *Crypturellus cinnamomeus occidentalis Salvadori, 1895. *CHIS (Grant et al., 2020): *C. c. soconuscensis Brodkorb, 1939. *OAX (Grant et al., 2020): *C. boucardi boucardi Sclater, 1860. *TAMPS (Grant et al., 2020): C. cinnamomeus mexicanus Salvadori, 1895. *YUC (Orrell, 2020): *C. cinnamomeus sallaei Bonaparte, 1856.
Género Goniocotes Burmeister, 1838
Goniocotes gallinae de Geer, 1778
Sinónimos: Philopterus hologaster (Nitzsch, 1818), Ricinus gallinae (de Geer, 1778).
Especificidad: eurixeno.
*COAH (Lozoya-Saldaña et al., 1986b): *Columba livia, Gallus gallus.
Género Goniodes Nitzsch, 1818
*Goniodes dissimilis Denny, 1842
Sinónimo: Goniodes dissimilis bankiva (Piaget, 1880).
Especificidad: oligoxeno.
*COAH (Lozoya-Saldaña et al., 1986b), *YUC (Caamal, 1982): *Gallus gallus, *COAH (Lozoya-Saldaña et al., 1986b): *Meleagris gallopavo.
Goniodes gigas Taschenberg, 1879
Sinónimos: Goniocotes abdominalis (Piaget, 1880), G. hologaster (Denny, 1842), G. gigas (Taschenberg, 1879) y Stenocrotaphus gigas (Taschenberg, 1879).
Especificidad: eurixeno.
*COAH (Lozoya-Saldaña et al., 1986b): *Meleagris gallopavo. COAH (Lozoya-Saldaña et al., 1986b), *HGO (Zenteno, 1984), NL (Ponce-García, 2012): *Gallus gallus. NL (Ponce-García, 2012): *Columba sp., *Equus asinus.
Nota: E. asinus puede ser un hospedero accidental de G. gigas, pues es un parásito típico de aves (Price et al., 2003).
Goniodes sp.
NL (Ponce-García, 2012): *Capra hircus. *VER (Ponce-García, 2012): Gallus gallus.
Género Halipeurus Thompson, 1936
Halipeurus (Synnautes) pelagicus Denny, 1842
Sinónimos: Halipeurus pelagicus, Lipeurus pelagicus y Synnautes pelagicus (Denny, 1842); L. exiguus y L. languidus (Kellogg, 1902); L. procellariae (Denny, 1852), L. subangusticeps (Piaget, 1880), L. exiguus (Kellogg y Kuwana, 1902).
Especificidad: eurixeno.
BC (NHM, 2021): *Oceanodroma melania Bonaparte, 1854.
Género Lipeurus Nitzsch, 1818
Lipeurus caponis Linnaeus, 1758
Sinónimos: Lipeurus antennatus (Piaget, 1885), L. bakeri (Carriker, 1956), L. caponis borcherti (Eichler, 1953), L. dovei (McGregor, 1918), L. lineatus (McGregor, 1917); L. variabilis alpha, L. v. beta y L. v. gamma (Kellogg, 1908), L. v. formosanus (Sugimoto, 1929), Nirmus tesselatus (Denny, 1842), Pediculus caponis (Linnaeus, 1758).
Especificidad: eurixeno.
COAH, NL y *TAMPS (Ponce-García, 2012): *Columba sp. *DGO (Ponce-García, 2012): sin hospedero reportado. *HGO (Zenteno, 1984); NL y TAMPS (Ponce-García, 2012), *OAX (Cruz et al., 2014), YUC (Caamal, 1982): *Gallus gallus. NL (Ponce-García, 2012): *Patagioenas fasciata. NL (Ponce-García, 2012), OAX (Cruz et al., 2014): Meleagris gallopavo.
*Género Mulcticola Clay y Meinertzhagen, 1938
*Mulcticola sp.
*COAH (PIPR, 2020): *Antrostomus vociferus Wilson, 1812.
Género Oxylipeurus Mjöberg, 1910
Oxylipeurus chiniri Carriker, 1944
Sinónimos: Oxylipeurus chiniri chiniri, O. c. vetulae y O. c. variegatus (Carriker, 1944).
Especificidad: monoxeno.
*NL y *TAMPS (PIPR, 2020): Ortalis vetula Wagler, 1830.
Oxylipeurus corpulentus Clay, 1938
Especificidad: monoxeno.
*TAMPS (PIPR, 2020): Meleagris gallopavo.
Oxylipeurus globicerus Carriker, 1944
Especificidad: monoxeno.
*TAMPS (PIPR, 2020): Crax rubra rubra.
Oxylipeurus polytrapezius Burmeister, 1838
Sinónimo: Lipeurus polytrapezius (Burmeister, 1838).
Especificidad: monoxeno.
*TAMPS (PIPR, 2020): Meleagris gallopavo.
Género Paragoniocotes Cummings, 1916
*Paragoniocotes venezolanus Stafford, 1943
Sinónimo: Paragoniocotes venezolanus thectocercus (Carriker, 1950).
Especificidad: monoxeno.
*SIN (PIPR, 2020): *Aratinga canicularis Linnaeus, 1758.
Género Penenirmus Clay y Meinertzhagen, 1938
Penenirmus jungens Kellogg, 1896
Sinónimos: Docophorus jungens (Kellogg, 1896), Penenirmus villosus (Emerson y Johnson, 1961).
Especificidad: monoxeno.
*COAH (PIPR, 2020): Colaptes auratus cafer Gmelin, 1788.
Género Pectinopygus Mjöberg, 1910
Pectinopygus occidentalis Thompson, 1948
Sinónimo: Pectinopygus (Epipelicanus) occidentalis (Thompson, 1948).
Especificidad: monoxeno.
*SIN (González-Quintero, 2011): *Pelecanus occidentalis Linnaeus, 1766.
Género Philopterus Nitzsch, 1818
*Philopterus coarctatus Scopoli, 1763
Sinónimos: Docophorus fuscicollis y Philopterus fuscicollis (Burmeister, 1838); Pediculus coarctatus y Nirmus coactatus (Scopoli, 1763); P. collurionis (Schrank, 1803), P. lanii (Fabricius, 1798), Ph. magnus (Fedorenko, 1973).
Especificidad: monoxeno.
*COAH (PIPR, 2020): *Lanius ludovicianus Linnaeus, 1766.
Philopterus rufus Kellogg, 1899
Sinónimo: Docophorus rufus (Kellogg, 1899).
Especificidad: estenoxeno.
*COAH (PIPR, 2020): *Myiarchus cinerascens Lawrence, 1851.
Philopterus sp.
COAH (PIPR, 2020): *Cardinalis sinuatus Bonaparte, 1838; *Phainopepla nitens Swainson, 1838; *Pheucticus melanocephalus, *Oreoscoptes montanus Townsend, 1837.
Nota: las especies hospederas son nuevas menciones para el género Philopterus. Para Coahuila anteriormente ya se había registrado la presencia de Philopterus rufus (PIPR, 2020).
Género Physconelloides Ewing, 1927
Physconelloides zenaidurae McGregor, 1917
Sinónimos: Goniodes zenaidurae (McGregor, 1917), Physconelloides auritae (Tendeiro, 1987), Ph. rubripes (Carriker, 1963); Ph. piotrowskii y Ph. rubripes longulus (Tendeiro, 1980).
Especificidad: oligoxeno.
*MEX (Nieves-García, 2008), *NL (Ponce-García, 2012): *Columba livia.
Género Pterocotes Ewing, 1929
Pterocotes aberrans Carriker, 1903
Sinónimos: Goniodes aberrans (Carriker, 1903), Pterocotes aberrans colombianus y P. a. mexicanus (Carriker, 1944), P. a. tinami (Carriker, 1963).
Especificidad: monoxeno.
*CAMP (Grant et al., 2020): Tinamus major percautus van Tyne, 1935. *OAX (Grant et al., 2020): *T. m. robustus Sclater y Salvin, 1868.
Género Quadraceps Clay y Meinertzhagen, 1939
Quadraceps ravus Kellogg, 1899
Sinónimos: Nirmus furvus ravus y N. ravus (Kellogg, 1899), Degeeriella subfuscus (Blagoveshtchensky, 1948).
Especificidad: monoxeno.
*BC (Gross y Oboyski, 2021): Actitis macularius Linnaeus, 1766.
Género Strigiphilus Mjöberg, 1910
*Strigiphilus aitkeni Clay, 1966
Especificidad: monoxeno.
*MEX (de Oliveira et al., 2011): *Tyto alba Scopoli, 1769.
Familia Trichodectidae Kellogg, 1896
Género Bovicola Ewing, 1929
Bovicola (Bovicola) bovis Linnaeus, 1758
Sinónimos: Bovicola bovis y Pediculus bovis (Linnaeus, 1758); P. tauri (Linnaeus, 1761) y Trichodectes scalaris (Nitzsch, 1818).
Especificidad: oligoxeno.
*CDMX (Alcalá, 2014b) y *DGO (Ponce-García, 2012): Bos taurus.
Bovicola (Bovicola) caprae Gurlt, 1843
Sinónimos: Damalinia caprae (Gurlt, 1843), Trichodectes caprae (Gurlt, 1843), T. climacius (Giebel, 1861), T. climax (Nitzsch, 1861), T. climax truncatus (Piaget, 1880), T. mambricus (Rudow, 1866), T. peregrinus (Taschenberg, 1882), T. solidus (Rudow, 1866).
Especificidad: eurixeno
NL (Ponce-García, 2012), *SIN (Zatarain et al., 2018): Capra hircus.
Nota: nueva mención de C. hircus como hospedero en Nuevo León.
Bovicola (Bovicola) limbatus Gervais, 1844
Sinónimos: Bovicola sachtlebeni y B. wernecki (Kéler, 1937), B. madagascariensis (Mjöberg, 1910), B. painei (Kellogg y Nakayama, 1914), Trichodectes climax major (Piaget, 1885), T. limbatus (Gervais, 1844), T. madagascariensis (Mjoberg, 1910), T. painei (Kellogg y Nakayama, 1914).
Especificidad: eurixeno.
*COAH (Lozoya-Saldaña et al., 1986b): *Gallus gallus.
Nota: aunque el hospedero común de este piojo es la cabra, Capra hircus (Price et al. 2003), aquí se le consideró como eurixeno debido a que Hopkins y Clay (1952) registraron a las especies sinónimas Bovicola painei y Bovicola madagascariensis parasitando al ave Corvus corax. En otro trabajo previo, Kellogg y Nakayama (1914) reportaron su asociación con C. corax y Haematopus bachmani Audubon, 1838 en Baja California.
Bovicola (Bovicola) ovis Schrank, 1781
Sinónimos: Pediculus ovis (Schrank, 1781), P. ovisarietis (Schrank, 1803), P. sphaerocephalus (Olfers, 1816), Trichodectes sphaerocephalus (Nitzsch, 1818).
Especificidad: monoxeno.
*CDMX (Alcalá et al., 2016),*MEX (Salgado, 1989): Ovis aries.
Nota: en ambos trabajos B. (B.) ovis es reportado como “Damalinia ovis”, pero según las características e imágenes reportadas, el piojo es de la especie B. (B.) ovis.
*Género Felicola Ewing, 1929
*Felicola (Felicola) subrostratus Burmeister, 1838
Sinónimo: Felicola rostratus (Bedford, 1932); F. subrostratus y Trichodectes subrostratus (Burmeister, 1838).
Especificidad: monoxeno.
*YUC (Baak-Baak et al., 2020): *Felis catus Linnaeus, 1758.
*Felicola (Lorisicola) felis Werneck, 1934
Sinónimo: Trichodectes felis (Werneck, 1934).
Especificidad: monoxeno.
*JAL (Guzmán-Cornejo et al., 2020): *Leopardus pardalis Linnaeus, 1758.
Género Geomydoecus Ewing, 1929
Geomydoecus (Geomydoecus) fulvescens Price y Emerson, 1971
Especificidad: monoxeno.
*ZAC (Mueller, 2020): Cratogeomys fulvescens Merriam, 1895.
Geomydoecus (Geomydoecus) mcgregori Price y Emerson, 1971
Especificidad: oligoxeno.
*SON (Mueller, 2020): Cratogeomys fumosus Merriam, 1892.
Geomydoecus (Geomydoecus) perotensis irolonis Price y Emerson, 1971
Especificidad: estenoxeno.
HGO y MEX (Light, 2005): *Cratogeomys fumosus.
Geomydoecus (Geomydoecus) polydentatus angustirostris Price y Hellenthal, 1989
Especificidad: monoxeno.
*SON (Mueller, 2020): Cratogeomys fumosus angustirostris Merriam, 1903.
Geomydoecus (Geomydoecus) polydentatus polydentatus Price y Emerson, 1971
Sinónimo: Geomydoecus polydentatus (Price y Emerson, 1971).
Especificidad: oligoxeno.
*QRO (Popinga et al., 2019): Cratogeomys fumosus.
Geomydoecus (Geomydoecus) telli Price y Hellenthal, 1988
Especificidad: eurixeno.
*BC (Bolaños-García et al., 2018): *Bubo virginianus.
Nota: esta asociación es rara, pues los piojos del género Geomydoecus parasitan principalmente a roedores (Sánchez-Montes et al., 2018), por lo que esta observación puede ser producto del traslado de presas roedores al nido (Bolaños-García et al., 2018).
Geomydoecus (Geomydoecus) traubi Price y Emerson, 1971
Especificidad: estenoxeno.
MEX (Light, 2005): Cratogeomys planiceps Merriam, 1895.
Nota: Sánchez-Montes et al. (2018) reportan a C. merriami como hospedero para esta entidad; sin embargo, la especie Pappogeomys tylorhinus planiceps Price y Emerson, 1989 es sinónima de C. planiceps, y no de C. merriami (Roskov et al., 2020).
Género Neotrichodectes Ewing, 1929
Neotrichodectes (Nasuicola) pallidus Piaget, 1880
Sinónimos: Nasuicola pallidus y Trichodectes pallidus (Piaget, 1880), T. nasuatis (Osborn, 1902).
Especificidad: monoxeno.
*JAL (Guzmán-Cornejo, 2020): Nasua narica Linnaeus, 1766.
Género Trichodectes Nitzsch, 1818
Trichodectes canis De Geer, 1778
Sinónimos: Ricinus canis (De Geer, 1778), Trichodectes floridanus (McGregor, 1917), T. latifrons (Fahrenholz, 1919), T. latus (Nitzsch, 1818), T. octopunctatus (Denny, 1852), T. riveti (Neumann, 1913).
Especificidad: eurixeno.
*COAH (Ueda, 2021): *Capra hircus. NL (Ponce-García, 2012): *Bassariscus astutus Lichtenstein, 1830. *OAX (Huerta-Jiménez, 2015): *Equus caballus Linnaeus, 1758; *Bos taurus. OAX (Huerta-Jiménez, 2015), *YUC (Peniche-Lara et al., 2018): Canis lupus familiaris.
Género Tricholipeurus Bedford, 1929
Tricholipeurus lipeuroides Megnin, 1884
Sinónimos: Eutrichophilus mazama (Stobbe, 1913), E. mexicanus (Mjoberg, 1910), Trichodectes lipeuroides (Megnin, 1884), Tricholipeurus virginianus (Peters, 1930).
Especificidad: monoxeno.
*VER (Estrada-Souza, 2020): *Odocoileus virginianus veraecrucis Goldman y Kellogg, 1940.
*Género Werneckiella Eichler, 1940
*Werneckiella equi Denny, 1842
Sinónimos: Bovicola hemioni (Blagoveshtchensky, 1967); B. (Werneckiella) equi y Trichodectes equi (Denny, 1842); B. (Werneckiella) trampel (Eichler, 1954); T. parumpilosus tarsatus (Piaget, 1880); T. pilosus (Giebel, 1874), T. pubescens (Neumann, 1905), T. vestitus (Railliet, 1895).
Especificidad: estenoxeno.
*NL (Ponce-García, 2012): *Equus caballus, *Equus asinus.
Discusión
Nuestros resultados, utilizando la clasificación de Johnson et al. (2020) y trabajos taxonómicos recientes (e.g., Price y Weckstein, 2005), aumentan los registros reportados por Sánchez-Montes et al. (2013, 2018) de 386 a 443 especies y subespecies de piojos en México. Esta riqueza representa 8.33% (5,316 especies y subespecies) del total de especies en todo el mundo (Galloway, 2018). La única superfamilia ausente en los registros es Rhyncophthirina, pues sus 3 especies descritas parasitan animales distribuidos en África e India (elefantes, jabalí del desierto y cerdo del río Rojo; Galloway, 2018).
En el mundo hay 575 especies de Anoplura, 1,525 de Amblycera y 3,213 de Ischnocera (Galloway, 2018). En este trabajo y en los listados de Sánchez-Montes et al. (2013, 2018), se tienen registradas para México 60 especies de piojos pertenecientes a Anoplura (10.4% del total mundial), 88 a Amblycera (5.8%) y 295 a Ischnocera (9.2%). Para la superfamilia Anoplura añadimos en el listado a 5 familias, 5 géneros y 15 especies de piojos chupadores, así como 26 especies de hospederos. Para la superfamilia Amblycera, se añadió a la lista un nuevo género (Cuculiphilus) y 10 especies, además de 15 especies de aves hospederas. Finalmente, para Ischnocera se añaden a la lista 3 géneros y 20 especies, así como 20 especies y 14 subespecies hospederas.
Respecto a los mamíferos hospederos reportados en los listados de Sánchez-Montes et al. (2013, 2018), aquí se añaden 2 órdenes reportados en literatura (Perissodactyla y Primates), así como 6 familias (Felidae, Tayassuidae, Suidae, Equidae, Procyonidae y Hominidae), 14 géneros y 25 especies. Para la clase Aves, añadimos al listado 3 familias (Caprimulgidae, Paridae y Tytonidae), 18 géneros y 37 especies. Esta riqueza de aves hospederas, más las 206 especies reportadas por Sánchez-Montes et al. (2018), representan 21.13% de la fauna aviar del país, la cual está estimada en 1,150 especies (Navarro-Sigüenza et al., 2014). Por otra parte, las 116 especies de mamíferos representan 20.6%, de las 564 especies de mamíferos marinos y terrestres de México reportadas por Sánchez-Cordero et al. (2014) en el país.
Los piojos chupadores y masticadores están asociados con especies de 5 órdenes de mamíferos en México: Artiodactyla, Perissodactyla, Primates, Carnivora y Rodentia. Éste último, junto con los Passeriformes (clase Aves), fueron los órdenes con mayor número de especies hospederas, con 96 y 83, respectivamente. La superfamilia Anoplura es la que tiene la mayor diversidad de roedores hospederos (76) y ésto concuerda con que, a nivel mundial, alrededor de 60% de los Anoplura parasitan roedores (Durden y Lloyd, 2009). Según los registros reportados en este trabajo, los piojos Anoplura infestan a 4 familias de roedores: Cricetidae, Heteromyidae, Muridae y Sciuridae; mientras que los masticadores a 3: Caviidae, Erethizontidae y Geomyidae.
Los resultados relacionados al grado de especificidad indican que muy pocas especies son eurixenas (7.9%), pero el porcentaje real podría ser más bajo pues, aunque sus hospederos son de distinta familia, en la mayoría de los casos eran ecológicamente similares. Por ejemplo, Ricinus dendroicae parasita a aves paseriformes que presentan un nicho ecológico similar (Price et al., 2003). Solo aquellos piojos comúnmente asociados a animales domésticos, como Trichodectes canis y Linognathus africanus, tuvieron a aves y mamíferos como hospederos, lo que puede ser resultado de contaminación accidental o foresis. Este tipo de relación es relativamente común en piojos masticadores y puede ayudar a estudiar su capacidad de dispersión, estructura poblacional y evolución (Bueter et al., 2009; Sychra et al., 2014; Martinů et al., 2015). La alta especificidad de los piojos (monoxenos = 69.1%) puede deberse a la coevolución con sus hospederos a través de miles o millones de años, un ejemplo de ello son la forma y tamaño de los artejos distales modificados de sus patas (Durden y Musser, 1994; Galloway, 2018; Light et al., 2008).
Las especies monoxenas y estenoxenas son las más susceptibles a extinguirse o extirparse a medida que las poblaciones de aves y mamíferos disminuyen en respuesta al deterioro ambiental (Galloway y Lamb, 2015; Rózsa, 1992). En este listado se tiene el registro del piojo monoxeno Pectinopygus occidentalis como parásito del pelícano café (Pelecanus occidentalis), ave bajo la categoría de “amenazada” según la NOM-059-SEMARNAT-2010. La extinción de ectoparásitos afecta a nivel comunitario (Rózsa, 1992), por lo que es necesario considerar la conservación de los parásitos en beneficio de la biodiversidad mexicana.
Aunque es sabido que las 3 especies de piojos parásitos del humano son cosmopolitas (Drali et al., 2015), nuestros resultados indican que el piojo del cuerpo es el de mayor incidencia, con registros en 31 estados, seguido del piojo de la cabeza (18) y del piojo púbico (Pthirus pubis), con solo 7 registros. Cada año se reportan epidemias de P. h. capitis en escuelas de diversos estados del país (Zúñiga y Caro, 2010), pero se desconoce la prevalencia (i.e., proporción de la población hospedera infestada) e intensidad de las 3 especies (Valle-Barbosa et al., 2017). Nuestros resultados pueden deberse a un sesgo de las autoridades de salud a llevar un registro más minucioso de los brotes de P. h. humanus por su asociación con otras enfermedades, como el tifus. La ausencia de notificación obligatoria de pediculosis capitis y pthiriasis puede ocasionar el subregistro de P. h. capitis y P. pubis.
Finalmente, nuestros resultados muestran que un gran número de especies de piojos reportados en México parasitan a especies animales con importancia veterinaria y económica. Estos animales son más susceptibles a sufrir una infestación grave por piojos debido a la cercanía, estrés, mala nutrición y a los cambios de temperatura (Galloway, 2018). Esto puede ocasionar pérdidas económicas considerables, relacionadas a la baja en la producción y a daños inmuebles (Craig, 2011).
Agradecimientos
Agradecemos el apoyo técnico de Paulina Corona-Tejeda, Estefanía Oaxaca e Iván Castellanos-Vargas. Agradecemos también la asesoría del editor asociado durante todo el proceso de revisión y edición del manuscrito.
Referencias
Acevedo-Rodríguez, A. (1999). Estudio comparativo de dos desparasitantes administrados por vía oral para la erradicación de endo y ectoparásitos en el ratón albino (Mus musculus cepa CFW) (Tesis). Facultad de Química, Universidad Nacional Autónoma de México. Ciudad de México.
Acosta, D. B., Ruiz, M. y Sánchez, J. P. (2019). First molecular detection of Mycoplasma suis in the pig louse Haematopinus suis (Phthiraptera: Anoplura) from Argentina. Acta Tropica, 194, 165–168. https://doi.org/10.1016/j.actatropica.2019.04.007
Aguirre-Uribe, L. A., Guerrero-Rodríguez, E., Lozoya-Saldaña, A. y Carrera-Lopez, J. (1988). Malófagos asociados a aves migratorias en el estado de Coahuila. Agraria Revista Científica UAAAN, 4, 73–82.
Alarcón, H., Hinostroza, D. y Santamaría, V. (2001). Pediculosis pubis, presentación de un caso. Revista del Centro Dermatológico Pascua, 10, 130–134.
Alcalá, Y. (2014a). Piojo chupador (Haematopinus suis) sobre la piel de cerdo (Sus scrofa). Colección de Laminillas digitales. Departamento de Parasitología, Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México. Recuperado el 20 febrero, 2019 de: http://datosabiertos.unam.mx/FMVZ:PARM:158276
Alcalá, Y. (2014b). Piojo masticador (Damalinia bovis) sobre la piel de bovino (Bos taurus). Colección de Laminillas digitales. Departamento de Parasitología, Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México. Recuperado el 20 febrero, 2019 de: http://datosabiertos.unam.mx/FMVZ:PARM:158273
Alcalá, Y. (2014c). Piojo masticador (Menacanthus stramineus) sobre la piel y plumas de gallina (Gallus gallus). Colección de Laminillas digitales. Departamento de Parasitología, Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México. Recuperado el 27 enero, 2021 de: http://datosabiertos.unam.mx/FMVZ:PARM:158271
Alcalá, Y. (2014d). Piojo masticador (Menopon gallinae) en cañón de las plumas de gallina (Gallus gallus). Colección de Laminillas digitales. Departamento de Parasitología, Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México. Recuperado el 26 enero, 2021 de: http://datosabiertos.unam.mx/FMVZ:PARM:158217
Alcalá, Y., Figueroa, J. A., Cuéllar, J.A., Alberti, A.B. y Posadas, E. (2016). Caso 001-16, Bitácora de Diagnóstico de Servicio a Centros del Departamento de Parasitología de la FMVZ de la UNAM. Base de datos sobre registros de parásitos de rumiantes en México. Recuperado de l9 enero, 2021 de: https://parasitosderumiantes.com.mx/Busqueda/DetalleRegistro/18899
Alcántara, V., Rolain, J. M., Eduardo, A. G., Raul, M. J. y Raoult, D. (2009). Molecular detection of Bartonella quintana in human body lice from Mexico City. Clinical Microbiological and Infection, 15, 93–94. https://doi.org/10.1111/j.1469-0691.2008.02176.x
Angelakis, E., Diatta, G., Abdissa, A., Trape, J. F., Mediannikov, O., Richet, H. et al. (2011). Altitude-dependent Bartonella quintana genotype C in head lice, Ethiopia. Emerging Infectious Diseases, 17, 2357–2359. https://doi.org/10.3201/eid1712.110453
Baak-Baak, C. M., García-Rejón, J. E., Tzuc-Dzul, J., Núñez-Corea, D., Arana-Guardia, R., Cetina-Trejo, R. et al. (2020). Four species of under-reported parasitic arthropods in Mexico and their potential role as vectors of pathogens. Journal of Parasitology, 106, 835–842. https://doi.org/10.1645/20-58
Baak-Baak, C. M., Osorio-Pinelo, O. E., Cigarroa-Toledo, N., Guzmán-Cornejo, C., Hernández-Betancourt, S. F., Panti-May, J. A. et al. (2018). Mites and lice of peri-domestic rodents captured at a Mayan community of Yucatán State, México. Southwestern Entomologist, 43, 911–918. https://doi.org/10.3958/059.043.0409
Barrientos, M. A. (2012). Prevalencia y determinación de ectoparásitos en murciélagos (Chiroptera) y roedores (Rodentia) en dos localidades de la Mixteca poblana: Santo Domingo Tonahuixtla y Teotlalco Puebla, México (Tesis). Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México, Ciudad de México.
Bartlett, C. M. y Anderson, R. A. (1989). Mallophagan vectors and the avian filarioids: new subspecies of Pelicitus fuliceatrae (Nematoda: Filarioidea) in sympatric North American hosts, with development, epizootiology, and parthenogenesis of the parasite in Fulica americana (Aves). Canadian Journal of Zoology, 67, 2821–2833. https://doi.org/10.1139/z89-398
Bolaños-García, R., Rodríguez-Estrella, R. y Guzmán-Cornejo, C. (2018). Ectoparasites associated with a Great Horned Owl nesting (Aves: Strigidae) population in fragmented landscape of Baja California peninsula, Mexico. Acta Zoológica Mexicana (n.s.), 34, 1–15. https://doi.org/10.21829/azm.2018.3412142
Booth, D. T., Clayton, D. H. y Block, B. A. (1993). Experimental demonstration of the energetic cost of parasitism in free-ranging hosts. Proceedings of the Royal Society of London B, 253, 125–129. https://doi.org/10.1098/rspb.1993.0091
Boyd, B. M. y Reed, D. L. (2012). Taxonomy of lice and their endosymbiotic bacteria in the post-genomic era. Clinical Microbiology and Infection, 18, 324–331. https://doi.org/10.1111/j.1469-0691.2012.03782.x
Brant, S. (2020). MSB Parasite Collection (Arctos). Version 32.46. Museum of Southwestern Biology. Datos de ocurrencia. Recuperado el 24 enero, 2021 de: https://www.gbif.org. https://doi.org/10.15468/ou1lf2
Bueter, C. L., Weckstein, J., Johnson, K., Bates, J. M. y Gordon, C. E. (2009). Comparative Phylogenetic Histories of two louse genera Found on Catharus thrushes and other birds. The Journal of Parasitology, 95, 295–307 https://doi.org/10.1645/ge-1642.1
Caamal, D. (1982). Estudio de ectoparásitos en gallinas explotadas a nivel familiar en el municipio de Sudzal, Yucatán (Tesis). Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México, Ciudad de México.
Cano-Santana, Z. y Romero-Mata, A. (2016). Piojos (Phthiraptera). En Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/Secretaría del Medio Ambiente del Distrito Federal, La biodiversidad en la Ciudad de México, Vol II. (pp. 297–300), México D.F.: CONABIO/SEDEMA.
Carriker, M. A. Jr. (1950). Studies in Neotropical Mallophaga VI. Suborder “Ischnocera”. Family “Philopteridae”. Revista Brasileira de Biologia, 10, 163–188.
Carriker, M. A. Jr. (1954). Report on a collection of Mallophaga, largely Mexican (Part I). The Florida Entomologist, 37,
139–146, 191–207. https://doi.org/10.2307/3492979
Clayton, D. H., Adams, R. J. y Bush, S. E. (2009). Phthiraptera, the chewing lice. En C. T. Atkinson, N. J. Thomas y D. B. Hunter (Eds.), Parasitic diseases of wild Birds (Edited) (pp. 513–526). Iowa: Wiley-Blackwell Publishing.
Cortes, M. y Gámez, R. (2008). Tifus epidémico en Nuevo León: presentación del primer caso clínico pediátrico. Revista de Enfermedades Infecciosas en Pediatría, 22, 56–59.
Craig, M. (2011). Louse infestation (pediculosis) in pet animals. Campanion Animal, 16, 49–53. https://doi.org/10.
1111/j.2044-3862.2010.00027.x
Cruz, M. I., Figueroa, C. J. A., Quintero, M. M. T. y Alcalá, C. Y. (2014). Ectoparásitos de aves en explotaciones de traspatio (Gallus gallus domesticus y Meleagris gallopavo) de una región del sur de México. Revista Ibero-Latinoamericana de Parasitología, 72, 185–189.
de Oliveira, J. B., de Santos, T., Vaughan, C. y Santiago, H. (2011). External parasites of raptors (Falconiformes and Strigiformes): identification in an ex situ population from Mexico. Revista de Biología Tropical, 59, 1257–1264.
Diatta, G., Mediannikov, O., Sokhna, C., Bassene, H., Socolovschi, C., Ratmanov, P. et al. (2014). Prevalence of Bartonella quintana in patients with fever and head lice from rural areas of Sine-Saloum, Senegal. The American Journal of Tropical Medicine and Hygiene, 91, 291–293. https://doi.org/10.4269/ajtmh.13-0685
Drali, R., Shako, J. C., Davoust, B., Diatta, G. y Raoult, D. (2015). A new clade of african body and head lice infected by Bartonella quintana and Yersinia pestis, Democratic Republic of the Congo. The American Journal of Tropical Medicine and Hygiene, 93, 990–993. https://doi.org/10.4269/ajtmh.14-0686
Durden, L. A. y Lloyd, J. E. (2009). Lice (Phthiraptera). En G. R Mullen y L. A. Durden (Eds.), Medical and Veterinary Entomology, 2nd Ed. (pp. 59–82). San Diego, California: Academic Press/ Elsevier Science.
Durden, L. A. y Musser, G. G. (1994). The sucking lice (Insecta: Anoplura) of the world: a taxonomic checklist with records of mammalian hosts and geographical distributions. Bulletin of the American Museum of Natural History, 218, 1–90.
Estrada-Souza, I. M., Sánchez-Montes, S., Romero-Salas, D., Cruz-Romero, A., Aguilar-Domínguez, M., Pérez-Brígido, C. D. et al. (2020). Integrative taxonomic description of the chewing louse Tricholipeurus lipeuroides infesting Odocoileus virginianus veraecrucis white-tailed deer in Veracruz, Mexico. Parasitology Research, 119, 3203-3209. https://doi.org/10.1007/s00436-020-06855-5
Gállego, J. B. (2007). Manual de parasitología: morfología y biología de los parásitos de interés sanitario. Barcelona: Universidad de Barcelona.
Galloway, T. D. (2012). Ectoparasites of rabbits and hares (Lagomorpha: Leporidae) in Manitoba, Canada, with observations on age-specific dispersal in Haemodipsus setoni (Phthiraptera: Anoplura: Polyplacidae). Canadian Entomologist, 144, 439–456. https://doi.org/10.4039/tce.2012.44
Galloway, T. D. (2018). Biodiversity of ectoparasites: lice (Phthiraptera) and fleas (Siphonaptera). Insect Biodiversity, 457–482. https://doi.org/10.1002/9781118945582.ch17
Galloway, T. D. y Lamb, R. J. (2015). Abundance and stability of populations of a chewing louse, Mulcticola macrocephalus (Kellogg) (Phthiraptera: Philopteridae), on common nighthawks, Chordeiles minor (Forster) (Aves: Caprimulgiformes: Caprimulgidae) in Manitoba, Canada. Canadian Entomologist, 147, 723–731. https://doi.org/10.4039/tce.2014.85
Gómez-Ródríguez, R. A., Gutiérrez-Granados, G., Montiel-Parra, G., Rodríguez-Moreno, A. y Sánchez-Cordero, V. (2015). Diversity and coexistence of ectoparasites in small rodents in a tropical dry forest. Biotropica, 47, 484–490. https://doi.org/10.1111/btp.12229
González-Álvarez, V. H. (2020). Presence of two lice species (Insecta: Phthiraptera) in a goat (Capra hircus) from La Comarca Lagunera, Mexico: a case report. International Journal for Research in Applied Sciences and Biotechnology, 7, 152–155. https://doi.org/10.31033/ijrasb.7.5.22
González-Quintero, C. (2011). Ectoparásitos de pelícanos (Pelecanus occidentalis) de la región de Mazatlán, Sinaloa, México (Tesis). Facultad de Ciencias, Universidad Nacional Autónoma de México, Ciudad de México.
Grant, S., Webbink, K., Turcatel, M. y Shuman, R. (2020). Field Museum of Natural History (Zoology) Insect, Arachnid and Myriapod Collection. Versión 12.31. Field Museum. Datos de ocurrencia. Recuperado el 24 enero, 2021 de: https://www.gbif.org. https://doi.org/10.15468/0ywfpc
Gross, J. y Oboyski, P. (2021). Essig Museum of Entomology. Version 121.167. Berkeley Natural History Museums. Datos de ocurrencia. Recuperado el 24 enero, 2021 de: https://www.gbif.org https://doi.org/10.15468/0saucj
Gustafsson, D. R. y Bush, S. E. (2019a). Brueelia (Phthiraptera: Ischnocera: Philopteridae) of North American Nine-Primaried Oscines (Aves: Passeriformes: Passerida) with Descriptions of Nine New Species. Journal of Parasitology, 105, 858–873. https://doi.org/10.1645/19-82
Gustafsson, D. R. y Bush, S. E. (2019b). The Genus Brueelia (Phthiraptera: Ischnocera: Philopteridae) of North American Jays and Allies (Aves: Passeriformes: Corvidae), with descriptions of five new species. The Journal of Parasitology, 105, 893–903. https://doi.org/10.1645/19-93
Gustafsson, D. R., Chu, X., Bush, S. E. y Zou, F. (2018). Ten new species of Brueelia Kéler, 1936 (Phthiraptera: Ischnocera: Philopteridae) from nuthatches (Aves: Passeriformes: Sittidae), tits and chickadees (Paridae), and goldcrests (Regulidae). Acta Parasitologica, 63, 527–557. https://doi.org/10.1515/ap-2018-0063
Guzmán-Cornejo, C., Herrera-Mares, A., Ugalde-Medina, A., López-Pérez, A. M., Del Castillo-Martínez, L., Acosta-Gutiérrez, R. et al. (2020). Arthropods associated with Mammals. Their importance as part of the richness in a biosphere reserve in Mexico, Journal of Medical Entomo-
logy, 57, 780–787. https://doi.org/10.1093/jme/tjz237
Hamilton, W. D. y Zuk, M. (1982). Heritable true fitness and bright birds: a role for parasites? Science, 218, 384–387. https://doi.org/10.1126/science.712323
Hernández-Velasco, A., Sánchez-Montes, S., Romero-Salas, D., Cruz-Romero, A., Jiménez-Hernández, J. A., Becker, I. et al. (2020). First record of natural infection with Anaplasma marginale in sucking lice infesting the water buffalo (Bubalus bubalis) in Mexico. Parasitology Research, 119, 3853–3856. https://doi.org/10.1007/s00436-020-06772-7
Hopkins, G. H. E. y Clay, T. (1952). A check list of the genera and species of Mallophaga. Londres: British Museum of Natural History.
Huerta-Jiménez, H. (2015). Actualización de la Colección de Artrópodos con importancia médica (CAIM). Laboratorio de Entomología, InDRE. Colección CAIM. Instituto Nacional de Diagnóstico y Referencia Epidemiológicos. Bases de datos SNIB-CONABIO, proyectos HA006 CC011 y G011. México D.F.
Johnson, K. P., Smith, V. S., Hopkins, H. y Eades, D. C. (2020). SF Psocodea: Psocodea species file (versión 5.0, Junio 2018). En Y. Roskov, G. Ower, T. Orrell, D. Nicolson, N. Bailly, P. M. Kirk et al. (Eds.), Species 2000 & ITIS Catalogue of Life, 2020-12-01. Recuperado el 8 de enero, 2021 de: www.catalogueoflife.org Species 2000: Naturalis, Leiden, The Netherlands.
Kellogg, V. L. y Nakayama, S. (1914). A new Trichodectes from Baja California. Psyche, 21, 90–92. https://doi.org/10.1155/1914/56086
Kim, J. H., Previte, D. J., Yoon, K. S., Murenzi, E., Koehler, J. E., Pittendrigh, B. R. et al. (2017). Comparison of the proliferation and excretion of Bartonella quintana between body and head lice following oral challenge. Insect Molecular Biology, 26, 266–276. https://doi.org/10.1111/imb.12292
Light, J. E. (2005). Host-parasite cophylogeny and rates of evolution in two rodent-louse assemblages (Tesis doctoral). University of Michigan. Ann Arbor, Michigan.
Light, J. E., Allen, J. M., Long, L. M., Carter, T. E., Barrow, L., Suren, G. et al. (2008). Geographic distributions and origins of human head lice (Pediculus humanus capitis) based on mitochondrial data. Journal of Parasitology, 94, 1275–1281. https://doi.org/10.1645/ge-1618.1
Linares, G. I. G., Castillo, C. A. D., Santos, C. J., Cabriales, J. J. y Hernández, V. X. (2018). Estudio epidemiológico de ectoparásitos en gallinas de postura comercial en Jalisco y Nuevo León, México. Reunión Nacional de Investigación Pecuaria Memoria, 1, 20–22.
Linn, M. L., Gardner, J., Warrilow, D., Darnell, G. A., McMahon, C. R., Field, I. et al. (2001). Arbovirus of marine mammals: a new alphavirus isolated from the elephant seal louse, Lepidophthirus macrorhini. Journal of Virology, 75, 4103–4109. https://doi.org/10.1128/jvi.75.9.4103-4109.2001
Lozoya-Saldaña, A., Quinones-Luna, S., Aguirre-Uribe, L. A. y Guerrero-Rodríguez, E. (1986a). Distribución y abundancia de los piojos malófagos y anopluros del ganado ovino y caprino en la región de Saltillo, Coahuila, México. Folia Entomológica Mexicana, 69, 117–125.
Lozoya-Saldaña, A., Quinones-Luna, S., Aguirre-Uribe, L. A. y Guerrero-Rodríguez, E. (1986b). Malófagos de las aves domésticas en 4 municipios del sureste del estado de Coahuila. Agraria, Revista Científica UAAAN, 2, 203–221.
Martínez-Flores, A. (2013). El ardillón (Otospermophilus variegatus) y sus ectoparásitos en la Reserva Ecológica del Pedregal de San Ángel (REPSA), UNAM (Tesis). Facultad de Ciencias, Universidad Nacional Autónoma de México, Ciudad de México.
Martinů, J., Sychra, O., Literák, I., Čapek, M., Gustafsson, D. L. y Štefka, J. (2015). Host generalists and specialists emerging side by side: an analysis of evolutionary patterns in the cosmopolitan chewing louse genus Menacanthus. International Journal for Parasitology, 45, 63–73. https://doi.org/10.1016/j.ijpara.2014.09.001
McGavin, G. C. (2002). Entomología esencial. Ariel Ciencia: Barcelona.
Mueller, B. D., Cokendolpher, J. C. y Enríquez, T. (2020). Biological type specimens in the Collections of Texas Tech University, Lubbock, Texas, USA; with a History of these Collections at the Museum of Texas Tech University. Museum of Texas Tech University, 74, 1–83.
Natural History Museum (NHM). (2021). Natural History Museum (London) Collection Specimens. Datos de ocurrencia. Recuperado el 22 enero, 2021 de: https://www.gbif.org https://doi.org/10.5519/0002965
Navarro-Sigüenza, A. G., Rebón-Gallardo, M. F., Gordillo-Martínez, A., Townsend-Peterson, A., Berlanga-García, H. y Sánchez-González, L. A. (2014). Biodiversidad de aves en México. Revista Mexicana de Biodiversidad, 85 (Suple.), 476–495. https://doi.org/10.7550/rmb.41882
Nieves-García, E. U. (2008). Frecuencia y distribución anatómica de ectoparásitos del orden Mallophaga en palomas (Columba livia) del Centro de Enseñanza Agropecuaria de la Facultad de Estudios Superiores Cuautitlán (Tesis). Facultad de Estudios Superiores Cuautitlán, UNAM, Estado de México.
Olivares-de, P., Carral-Santander, C. y Ustariz-González, O. (2008). Phthiriasis palpebral. Reporte de un caso. Revista Mexicana Oftalmológica, 8, 188–191.
Onofre-Barragán, B. (2015). Estudio preliminar de artrópodos de importancia veterinaria en el Carmen, municipio de Xochistlahuaca, Guerrero, México. Boletín de la Sociedad Mexicana de Entomología (n.s.), 1, 118–121.
Orrell, T. (2020). NMNH Extant Specimen Records. Version 1.39. National Museum of Natural History, Smithsonian Institution. Recuperado el 30 marzo, 2020 de: https://www.gbif.org https://doi.org/10.15468/hnhrg3
Ortíz-Mariotte, C. (1952). Campaña Nacional contra el tifo en México. Boletín de la Oficina Sanitaria. Recuperado el 24 febrero, 2019 de: http://iris.paho.org/xmlui/bitstream/handle/123456789/14684/v34n3p236.pdf?sequence =1
Palacios-Pacheco, R. I., Moreno-Ríos, M., Prieto-Avella, E., Arriola-Mosqueda, L. A., Lezama-Gutiérrez, R., Corona-Barrera, E. et al. (2015). Virulencia de Metharhizium anisopliae (Metschnikoff) Sorokin y Beauveria bassiana (Balsamo) Vuillemin sobre adultos de Heterodoxus spiniger (Enderlein). Entomología Mexicana, 2, 278–282.
Palma, R. (2004). Austromenopon paululum (Kellogg & Chapman, 1899), AI.021549. Insects Collections Online. Te Papa Collections Online. Recuperado el 20 enero, 2021 de: https://collections.tepapa.govt.nz/object/835255
Peniche-Lara, G., Jimenez-Delgadillo, B., Muñoz-Zanzi, C., Cárdenas-Marrufo, M., Pérez-Osorio, C. y Arias-León, J. (2018). Presence of Rickettsia species in a marginalized area of Yucatán, Mexico. Journal of Tropical Medicine, 2, 1–4. https://doi.org/10.1155/2018/7675828
Price, R. D. y Weckstein, J. D. (2005). The genus Austrophilopterus Ewing (Phthiraptera: Philopteridae) from toucans, toucanets, and araçaris (Piciformes: Ramphastidae). Zootaxa, 918, 1–18. https://doi.org/10.11646/zootaxa.918.1.1
Price, R. D., Hellenthal, R. A., Palma, R. L., Johnson, K. P. y Clayton, D. H. (2003). The chewing lice: world checklist and biological overview. Illinois Natural History Survey Special Publication, 24, 1–501.
Price Institute of Parasite Research (PIPR). (2020). Price Institute of Parasite Research, School of Biological Sciences, University of Utah. Datos de ocurrencia. Recuperado el 21 enero, 2021 de: https://www.gbif.org https://doi.org/10.15468/s68bn8
Ponce-García, G. (2012). Computarización de la Colección de insectos y ácaros de importancia médica de la Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León. Colección IAIM. Facultad de Ciencias Biológicas. Universidad Nacional Autónoma de Nuevo León. Bases de datos SNIB-Conabio, proyecto CC008. México, D. F. https://doi.org/10.15468/sma9a5
Popinga, A., Demastes, J. W., Spradling, T. A., Hafner D. J. y Hafner, M. S. (2019). Host-parasite associations of the Cratogeomys fumosus species group and their chewing lice, Geomydoecus. Therya, 10, 81–89. https://doi.org/10.12933/therya-19-739
Quintero, M. T. (2011). Epidemiología de ftirápteros (piojos) en rumiantes. En R. H. Quiroz, C. J. A. Figueroa, V. F. Ibarra y A. M. E. López (Eds.), Epidemiología de enfermedades parasitarias en animales domésticos (pp. 396–402). México D.F.: Facultad de Medicina Veterinaria y Zootecnia, UNAM.
Ramos-Casillas, F. (2003). Detección de Rickettsia typhi (Rickettsiales: Rickettsiadea) en roedores y vectores en el Noreste de México (Tesis de maestría). Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León, San Nicolás de los Garza, Nuevo León.
Reeves, W. K., Nelder M. P. y Korecki, K. A. (2005). Bartonella and Rickettsia in fleas and lice from mammals in South Carolina, U.S.A. Journal of Vector Ecology, 30, 310–315.
Ritzi, C. M. (2014). A review of mammalian ectoparasites from the Northern Chihuahuan Desert. En C. A. Hoyt y J. Karges (Eds.), Proceedings of the Sixth Symposium on the Natural Resources of the Chihuahuan Desert Region (pp. 151–184). Chihuahuan Desert Research Institute, Fort Davis, Texas, EUA.
Rodríguez-Ortega, L. T., Equihua-Martínez, A., Nieto-Aquino, R., Pro-Martínez, M. y Rodríguez-Ortega, A. (2018). Infestación de piojos (Phthiraptera) en gallinas, gallos y pollos (Gallus gallus domesticus, Linnaeus). Folia Entomológica Mexicana (n. s.), 4, 80–84.
Rodríguez-Vivas, R. I., Ojeda-Chi, M., Trinidad-Martínez, I., Rosado-Aguilar, J. A. y Quintero-Martinez, M. A. (2016). Infestación de bovinos con Haematopinus quadripertusus en Yucatán, México. Bioagrociencias, 9, 23–32.
Roskov, Y., Ower, G., Orrell, T., Nicolson, D., Bailly, N., Kirk, P. M. et al. (Eds.) (2020). Species 2000 & ITIS Catalogue of Life, 2020-12-01. Recuperado el 8 de enero, 2021 de: www.catalogueoflife.org Species 2000: Naturalis, Leiden, The Netherlands.
Rózsa, L. (1992). Points in question–endangered parasite species. International Journal of Parasitology, 22, 265–266. https://doi.org/10.1016/s0020-7519(05)80002-5
Ruíz-Cancino, E. y Coronado-Blanco, J. M. (2002). Orden Anoplura. En E. Ruiz-Cancino y J. M. Coronado-Blanco (Eds.). Artrópodos terrestres de los estados de Tamaulipas y Nuevo León, México (pp. 91–92). Tamaulipas, México: Universidad Autónoma de Tamaulipas.
Salgado, J. H. (1989). Efecto de la flumetrina (Bayticol) en presentación Pour-on sobre tres ectoparásitos de los ovinos (Otobius megnini, Damalinia ovis y Melophagus ovinus) (Tesis). Facultad de Estudios Superiores Cuautitlán, UNAM, Estado de México.
Sánchez-Cordero, V., Botello, F., Flores-Martínez, J. J., Gómez-Rodríguez, R. A., Guevara, L., Gutiérrez-Granados, G. et al. (2014). Biodiversidad de Chordata (Mammalia) en México. Revista Mexicana de Biodiversidad, 85 (Suple.), 495–504. https://doi.org/10.7550/rmb.31688
Sánchez-Montes, S., Colunga-Salas, P., Álvarez-Castillo, L., Guzmán-Cornejo, C. y Montiel-Parra, G. (2018). Chewing lice (Insecta: Phthiraptera) associated with vertebrates in Mexico. Zootaxa, 4372, 1–109. https://doi.org/10.11646/zootaxa.4372.1.1
Sánchez-Montes, S., Guzmán-Cornejo, C., Herrera-Montalvo, G., Richman, A. D., Flores-Martínez, J. J., García-Ruiz, G. F. et al. (2016). First record of Bartonella vinsonii in the sucking louse Hoplopleura hirsuta collected from hispid cotton rats, Sigmodon hispidus, in Mexico. Southwestern Entomologist, 41, 1031–1036. https://doi.org/10.3958/059.041.0403
Sánchez-Montes, S., Guzmán-Cornejo, C., León-Paniagua, L. y Rivas, G. (2013). A checklist of sucking lice (Insecta: Phthiraptera: Anoplura) associated with Mexican wild mammals, including geographical records and a host-parasite list. Zootaxa, 3722, 183–203. https://doi.org/10.11646/zootaxa.3722.2.4
Sánchez-Montes, S., Guzmán-Cornejo, C., Ramírez-Corona, F. y León-Paniagua, L. (2016). Anoplurans (Insecta: Psocodea: Anoplura) associated with rodents distributed in the neotropical region of Mexico. Revista Mexicana de Biodiversidad, 87, 427–435. https://doi.org/10.1016/j.rmb.2016.03.006
Sangaré, A. K., Boutellis, A., Drali, R., Socolovschi, C., Barker, S. C., Diatta, G. et al. (2014). Detection of Bartonella quintana in African body and head lice. The American Journal of Tropical Medicine and Hygiene, 91, 294–301. https://doi.org/10.4269/ajtmh.13-0707
Semarnat (Secretaría de Medio Ambiente y Recursos Naturales). (2010). Modificación del anexo Normativo III. Lista de Especies en Riesgo de la Norma Oficial Mexicana NOM-059-SEMARNAT-2010, “Protección Ambiental-Especies Nativas de México de Flora y Fauna Silvestres-Categorías de Riesgo y Especificaciones para su inclusión, exclusión o cambio-Lista de Especies en Riesgo”, Publicada en el Diario Oficial de la Federación el 30 de diciembre de 2010. Texto vigente publicado en el Diario Oficial de la Federación el 14 de noviembre de 2019.
Sychra, O., Najer, T., Kounek, F., Hung, N. M. y Tolstenkov, O. (2014). Myrsidea claytoni (Phthiraptera: Menoponidae) from Cymbirhynchus macrorhynchos (Passeriformes: Eurylaimidae): a case of natural host switching. The
Journal of Parasitology, 100, 280-283. https://doi.org/
10.1645/13-385.1
Ueda, K. (2021). iNaturalist Research-grade Observations. iNaturalist.org. Datos de ocurrencia. Recuperado el 26 enero, 2021 de: https://www.gbif.org https://doi.org/10.15468/ab3s5x
Valle-Barbosa, M. A., Muñoz-de la Torre, A., Vega-López, M. G., González-Pérez, G. J. y Flores-Villavicencio, M. E. (2017). La pediculosis en México: una historia que no concluye. Revista Médico-Científica de la Secretaría de Salud Jalisco, 4, 185–191.
Zatarain, D. E., Enríquez, V. I., Badilla, M. C. N., Castro, C. N., Barraza, T. C. L., Solís, C. J. D. et al. (2018). Identificación morfológica de piojos de cabras en Culiacán, Sinaloa. Reunión Nacional de Investigación Pecuaria Memoria, 4, 142–146.
Zavala-Velázquez, J. E., Zavala-Castro, J. E., Vado-Solís, I. Ruiz-Sosa, J. A., Morón, C. G., Bouyer, D. H. et al. (2002). Identification of Ctenocephalides felis fleas as a host of Rickettsia felis, the agent of a spotted fever rickettsiosis in Yucatán, Mexico. Vector-borne and Zoonotic Diseases, 2, 69–75. https://doi.org/10.1089/153036602321131869
Zenteno, R. (1984). Identificación de los ectoparásitos más frecuentes en gallinas criadas en libertad en el municipio de Zacualtipan, Hidalgo (Tesis). Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México, UNAM. Ciudad de México.
Zúñiga, I. R. y Caro, J. (2010). Pediculosis: una ectoparasitosis emergente en México. Revista de Enfermedades Infecciosas en Pediatría, 24, 57–63.