Norman Mercado-Silva a, Carlos Ramírez b, Nestor Rosales-Quintero a y Fernando Córdova-Tapia c
a Universidad Autónoma del Estado de Morelos, Centro de Investigación en Biodiversidad y Conservación, Av. Universidad Núm. 1001, Col. Chamilpa, 62209 Cuernavaca, Morelos, México
b Universidad Autónoma de Nuevo León, Facultad de Medicina Veterinaria y Zootecnia, Campus de Ciencias Agropecuarias, Av. Francisco Villa s/n, Ex Hacienda el Canadá, 66054 Ciudad General Escobedo, Nuevo León, México
c Universidad Nacional Autónoma de México, Instituto de Ciencias del Mar y Limnología, Laboratorio de Limnología, Circuito Exterior s/n, Ciudad Universitaria, Coyoacán, 04510 Ciudad de México, México
*Autor de correspondencia: fcordova@cmarl.unam.mx (F. Córdova-Tapia)
Recibido: 8 marzo 2023; aceptado: 20 febrero 2024
Resumen
La cuenca del Usumacinta en el sureste de México es una de las de mayor riqueza ictiofaunística en el país, pero también una de las menos estudiadas. En el presente trabajo se clasificaron todas las especies registradas en la zona de influencia de la Reserva de la Biosfera Montes Azules de acuerdo con sus atributos funcionales y se analizaron las comunidades de peces de 3 sitios contrastantes. Se registraron 7 especies nativas con combinaciones de atributos únicas y 4 conjuntos de especies con alta similitud funcional. Se detectó la presencia de especies exóticas, pero únicamente en el cauce principal del río Lacantún. La abundancia relativa de las especies se distribuyó en todo el espectro funcional, excepto en el arroyo Danta, donde 2 entidades funcionales fueron las dominantes. El sitio Lacantún tuvo la mayor riqueza tanto taxonómica como funcional, pero con una diversidad intermedia debido a la distribución de las abundancias relativas. La clasificación sugerida en el presente estudio puede utilizarse para analizar otras series de datos para entender mejor el funcionamiento ecológico de las comunidades y las diferencias entre sitios sujetos a procesos de antropización en la región.
Palabras clave: Diversidad funcional; Riqueza funcional; Especies exóticas; selva Lacandona; Reserva de la Biosfera Montes Azules
© 2024 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Characterization and use of functional attributes
of fish for the study of their communities
in the Lacantún River basin, Chiapas
Abstract
The Usumacinta River basin in southeastern Mexico has one of the country’s richest but least studied ichthyofaunas. This study presents a classification of functional traits for all fish species recorded in the area of influence of the Montes Azules Biosphere Reserve and a comparative analysis of the functional diversity among 3 contrasting sites. Seven native species, each with unique functional attribute combinations, and 4 sets of species with high functional similarity were identified. While exotic species were detected, they were found exclusively in the main channel of the Lacantún River. The relative abundance of species spanned the functional spectrum, except in the Danta stream, where 2 dominant functional entities were observed. The Lacantún site exhibited the highest taxonomic and functional richness, though with intermediate diversity attributed to the distribution of relative abundances. The functional classification proposed in this study can serve as a framework for analyzing other data series, facilitating a deeper understanding of ecological function across communities and for exploring variability among sites subject to differential anthropogenic impacts in the region.
Keywords: Functional diversity; Functional richness; Exotic species; Lacandona Rainforest; Montes Azules Biosphere Reserve
© 2024 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
En los últimos años la conceptualización de las especies desde una perspectiva funcional está cambiando la forma en la que se estudia la diversidad (Fukami, 2004). La diversidad funcional ha surgido como una propuesta para entender las relaciones entre la abundancia de las especies con respecto a los atributos funcionales que estas poseen (Rosenfeld, 2002). Estos atributos son características que determinan el desempeño de una especie en sus diferentes etapas ontogénicas y pueden estar relacionados con los procesos ecosistémicos (i.e., flujo de materia y energía), la estabilidad ecosistémica (i.e., resistencia y resiliencia), las interacciones biológicas (intraespecíficas e interespecíficas) y la contribución de la especie a la modificación del hábitat (Cadotte et al., 2011; Villéger et al., 2010). Así, la aproximación al estudio de las comunidades desde la perspectiva de la diversidad funcional permite incorporar las características funcionales de cada una de las especies dentro de la dinámica de los ecosistemas y es clave para entender la relación entre la diversidad (Cadotte et al., 2011; Mouchet et al., 2010; Tilman et al., 1997), la estructura de las comunidades y el funcionamiento de los ecosistemas (Córdova-Tapia y Zambrano, 2015; Naeem y Wright, 2003). Entender esta relación es clave para el estudio de los cuerpos de agua epicontinentales, sobre todo considerando la situación crítica en la que se encuentran tanto a nivel mundial como nacional.
Los cuerpos de agua epicontinentales son de los sistemas con mayor presión social, política y económica en el ámbito global, pues casi toda actividad humana está íntimamente ligada con el agua (Reid et al., 2019). En México, el estado de conservación de los sistemas epicontinentales es crítico ya que 70% de los cuerpos de agua tiene algún grado de contaminación (Conagua, 2018). Asimismo, 49% de los ríos y arroyos están catalogados con un alto o muy alto grado de alteración ecohidrológica (Garrido et al., 2010). Las especies de peces de agua dulce han recibido relativamente poca atención con fines de conservación (Lyons et al., 2020) pese a encontrarse entre las faunas más amenazadas en el contexto de cambio global. Una de las regiones de mayor riqueza de peces de agua dulce en México es la provincia del Usumacinta en el sureste de México (Rico et al., 2022); sin embargo, a pesar de ser tan diversa, es también de las menos estudiadas (Beltrán-López et al., 2023; Espinosa-Pérez et al., 2019).
La Reserva de la Biosfera Montes Azules (RBMA) es el área natural protegida con mayor extensión dentro de la selva Lacandona y el macizo de selva tropical mejor conservado de Mesoamérica (Ramírez et al., 2022). Es considerada un “hotspot” de biodiversidad con sitios de alta riqueza de especies y endemismo. La mayor parte del territorio que ocupa la selva Lacandona se localiza en la cuenca media del río Usumacinta, una zona que por su intrincada geología, fisiografía y edafología alberga la mayor diversidad de especies terrestres y acuáticas del país (Carabias et al., 2015). El principal río que atraviesa la selva Lacandona es el Lacantún, cuya subcuenca alberga ríos y arroyos en buen estado de conservación y contiene una de las ictiofaunas de agua dulce mejor conservadas del país (Ramírez et al., 2022).
En los ambientes acuáticos dentro y cercanos a la RBMA se han registrado al menos 72 especies de peces distribuidas en 52 géneros (Espinosa-Pérez et al., 2019; Ramírez et al., 2022; Ramírez-Martínez et al., 2015). En general, el estudio de los peces dulceacuícolas de la RBMA se ha enfocado a la descripción de especies y su distribución espacial. Aunque la información acerca del elenco sistemático que se puede encontrar en la RBMA es clave para evidenciar la importancia de su conservación, consideramos necesario ampliar esta información hacia un sentido más ecológico (Soria-Barreto y Rodiles-Hernández, 2008; Soria-Barreto et al., 2019). Esto permitirá obtener perspectivas más detalladas acerca de la estructura y dinámica de las comunidades de peces, el efecto que pueden tener las actividades humanas sobre los ecosistemas acuáticos y sobre el papel que juega la RBMA en su conservación. En este sentido, el análisis de la diversidad funcional es una herramienta para generar información ecológica de las comunidades de peces en ambientes poco estudiados (Córdova-Tapia y Zambrano, 2016).
Con el fin de fomentar el estudio de las comunidades de peces que habitan en los ríos y arroyos que atraviesan la RBMA desde la perspectiva de su ecología funcional, en el presente estudio aportamos información funcional para todas las especies de peces que han sido registradas en trabajos previos en la RBMA (72 especies) y utilizamos datos de 3 sitios contrastantes, dentro o en la zona de influencia de la RBMA, para proponer una forma sencilla y rápida de incorporar la diversidad funcional en el estudio de las comunidades de peces. Con ello, el objetivo es colaborar en la identificación de aspectos ecológicos que permitirán entender a las comunidades desde una perspectiva funcional y fomentar la aplicación del método en otras comunidades de peces en sistemas poco estudiados.
Materiales y métodos
Se integró un listado de las especies de peces reconocidas dentro de la RBMA y en la subcuenca del río Lacantún con base en los estudios publicados por Ramírez-Martínez et al., 2015, Espinosa-Pérez et al., 2019 y Ramírez et al., 2022 así como trabajos de campo realizados en 2022 y 2023. Cada una de las especies se clasificó según 4 atributos funcionales categóricos que reflejan aspectos clave de la ecología de los peces: 1) posición vertical en la columna de agua (columna de agua, bentos, columna y bentos), 2) alimentación (herbívora, omnívora o carnívora), 3) tipo de reproducción (huevo o vivípara) y 4) talla máxima (pequeña < 15 cm, mediana 15-30 cm, o grande > 30 cm). Descripciones detalladas de estos atributos y la definición de cada una de las categorías utilizadas pueden encontrarse en la literatura científica (Lyons et al., 1995; Mercado-Silva et al., 2002, 2006). Estos atributos, en su conjunto, pueden ser utilizados para identificar entidades funcionales (EF, especies con combinaciones únicas de atributos funcionales) (Ramírez-Ortiz et al., 2020). Además, se evaluó si las especies son nativas o exóticas en los sistemas acuáticos de la región. Todas las especies fueron clasificadas utilizando bibliografía especializada (Anzueto-Calvo et al., 2013; Bussing, 1998; Córdova-Tapia y Zambrano, 2016; Deckert y Greenfield, 1987; Eccles, 1992; Froese y Pauly, 2023; González-Acosta y Rodiles-Hernández, 2013; Greenfield y Thomerson, 1997; IGFA, 2001; Kullander, 2003; Lovejoy y Collette, 2003; Lyons et al., 2020; Mercado-Silva, 2016; Mercado-Silva et al., 2002; Miller et al., 2009; Nico et al., 2006, 2017; Pease, 2010; Rican et al., 2016; Rodiles-Hernández et al., 2005; Ross et al., 2020; Ruiz-Cauich et al., 2016; Schmitter-Soto, 2017; Soria-Barreto y Rodiles-Hernández, 2008; Soria-Barreto et al., 2019; Thacker et al., 2006; Whitehead, 1985; Yamamoto y Tagawa, 2000).
Para realizar el análisis funcional se utilizaron los 4 atributos categóricos para construir una matriz de disimilitud de Gower (1971). Se eligió esta aproximación pues este coeficiente permite el uso de diferentes tipos de variables (numéricas, nominales y ordinarias) y les otorga el mismo peso. Posteriormente, se realizó un análisis de coordenadas principales (PCoA) utilizando como base la matriz de disimilitud funcional. Así, las especies que se encuentran en proximidad dentro del espacio funcional comparten una variedad de atributos, mientras que aquellas situadas a mayor distancia presentan diferencias en dichos atributos.
Para analizar las comunidades de peces se utilizaron datos de muestreos de campo de 3 ríos que presentan condiciones contrastantes. Los sitios, muestreados en mayo de 2017 fueron: el río Lacantún (latitud: 16.11041, longitud: -90.93975), arroyo José (latitud: 16.11606, longitud: -90.94008) y arroyo Danta (latitud: 16.15138, longitud: -90.89664). El río Lacantún (fig. 1A) es un río de grandes dimensiones (> 100 m de ancho) donde solo se lograron colectas en las orillas del sistema y hasta una profundidad máxima de 1.5 m (aproximadamente 30 m de la orilla, máximo) sobre fondos predominantemente rocosos y arenosos, en una zona en donde corridas con flujo turbulento y pequeñas pozas se combinan y donde hay vegetación acuática relativamente poco abundante y con aguas poco claras. El arroyo José (fig. 1B) es un arroyo que nace dentro de la RBMA, con un ancho máximo de 5 m, y profundidad máxima de 1.1 m en la temporada de muestreo, rodeado de selva y con densa cobertura vegetal, con troncos sobre sustratos de arena, grava, limo y pocas rocas, donde el agua es clara y hay una diversidad de hábitats (pozas, corridas y rápidos someros) relativamente alta. El arroyo Danta (fig. 1C) es un pequeño arroyo (ancho ~ 2 m) ubicado fuera de la RBMA, pero dentro de un parche de selva que le brinda una alta cobertura vegetal. El sitio presenta diversas pozas (de hasta 1.1 m de profundidad) con fondo suave cubierto por hojas caídas de los árboles, unidas por “hilos” de agua con baja velocidad y sustrato de grava y aguas generalmente claras pero teñidas por taninos. En cada sitio se llevaron a cabo esfuerzos de muestreo estandarizados de la comunidad de peces utilizando una red tipo chinchorro (3 m de ancho, 1.8 m de profundidad y 0.5 cm de luz de malla) y equipo de electropesca (modelo ETS-Electrofishing ABP-3) de acuerdo con los métodos definidos en Standard Methods for Sampling North American Freshwater Fishes (Bonar et al., 2009). En cada uno de los sitios se cubrieron todos los hábitats disponibles posibles (e.g., pozas, rápidos, corridas), durante el día (entre 9 y 17 hrs) y llevando a cabo una curva de acumulación de especies para asegurar la representatividad del esfuerzo. Todos los peces fueron cuantificados e identificados en campo y posteriormente liberados. Las abundancias relativas de las especies en cada sitio fueron calculadas tomando en consideración la abundancia total de individuos capturados en los esfuerzos de muestreo para el sitio y la proporción de individuos correspondientes para cada especie.
Para cada uno de los sitios se calculó la riqueza taxonómica, el índice de dominancia (D), la diversidad (Shannon H) y la equidad (J). Los análisis de diversidad funcional se realizaron utilizando la matriz de especies-atributos junto con la matriz de abundancia relativa-sitio. La riqueza funcional se calculó mediante el índice FRic, que determina la cantidad de espacio funcional ocupado por las especies de una comunidad independientemente de sus abundancias, ésto es, calcula el volumen cubierto por un conjunto de especies en proporción a todo el espacio funcional abarcado por los vértices más externos del conjunto completo de especies. La equidad funcional se calculó mediante el índice FEve, que determina la homogeneidad en la distribución de las abundancias relativas de las especies de una comunidad en el espacio funcional. La dispersión funcional se calculó mediante el índice FDis, que determina la distancia media de las especies al centroide de la comunidad ponderado por su abundancia relativa (Laliberté y Legendre, 2010; Villéger et al., 2008). Se utilizó la posición de cada especie en las 2 primeras coordenadas principales para generar una gráfica de burbujas e ilustrar la distribución de las abundancias relativas dentro del espacio funcional de cada comunidad. Los análisis fueron realizados en el software R mediante el paquete “FD” (Laliberté et al., 2014).
Resultados
De las 72 especies registradas en la RBMA y su área de influencia, 87% (63) de las especies son nativas de la región mientras que 13% (9) son especies exóticas (tabla 1). Con respecto a su posición en la columna de agua, 31% (22) están íntimamente asociadas al fondo, pues son de hábitos bentónicos y solo de manera ocasional se desplazan a niveles superiores de la columna de agua. Por el contrario, 46% (33) son especies pelágicas que se desplazan en la columna de agua y en la superficie. El 24% (17) de las especies tienen hábitos bento-pelágicos. En cuanto a los hábitos alimentarios, 39% (28) son especies carnívoras (preferentemente consumen insectos, moluscos o peces), 40% (29) son omnívoras y 21% (15) son herbívoras. El 85% (61) de las especies se reproducen a través de la puesta de huevos, mientras que 15% (11) son especies vivíparas. Con respecto a la talla máxima, 35% (25) de las especies corresponden a especies chicas (< 15 cm de longitud total, 25% (18) a especies de talla media (16-30 cm) y 40% (29) a especies de talla grande (> 30 cm).

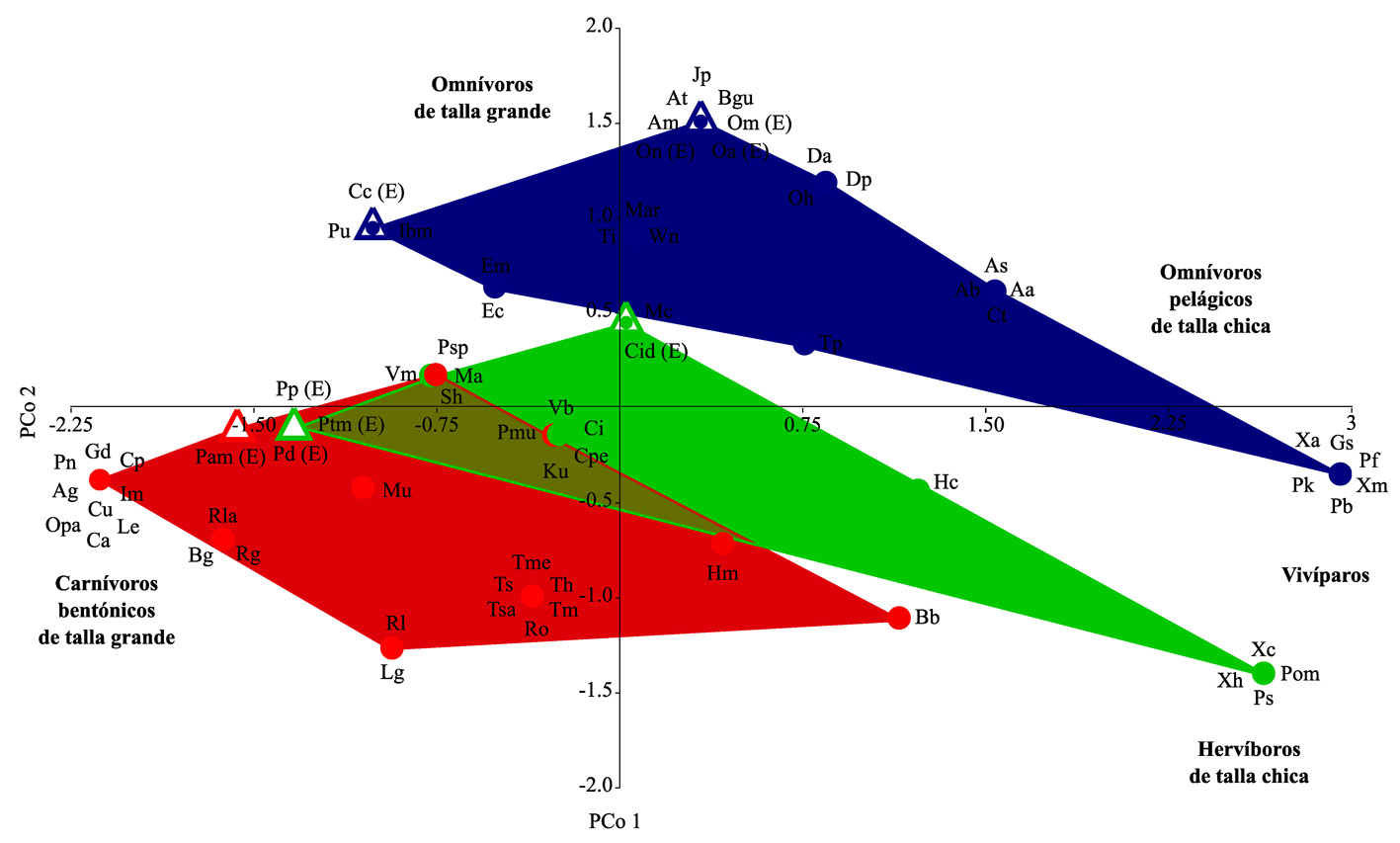
La ubicación de las especies en el espacio funcional muestra que 7 especies nativas representaron entidades funcionales (EF), es decir, que tienen una combinación única de atributos funcionales: Mayaheros urophthalmus (Mu), Vieja melanurus (Vm), Parachromis multifasciatus (Pmu), Hyporhamphus mexicanus (Hm), Thorichthys pasionis (Tp), Belonesox belizanus (Bb) y Hyphessobrycon compressus (Hc) (fig. 2). Asimismo, se detectaron 4 conjuntos de especies que se conformaron por 6 o más especies con los mismos atributos funcionales; el primero de éstos está representado por especies bentónicas, carnívoras de tallas grandes: Centropomus undecimalis (Cu), Centropomus parallelus (Cp), Aplodinotus grunniens (Ag), Potamarius nelsoni (Pn), Cathorops aguadulce (Ca), Gobiomorus dormitor (Gd), Lacantunia enigmatica (Le), Ictalurus meridionalis (Im) y Ophisternon aenigmaticum (Opa). El segundo conjunto corresponde a poecílidos con hábitos pelágicos, de talla chica y omnívoros: Xiphophorus maculatus (Xm), Xiphophorus alvarezi (Xa), Gambusia sexradiata (Gs), Phallichthys fairweatheri (Pf), Poecilia kykesis (Pk) y Pseudoxiphophorus bimaculatus (Pb). El tercero está representado por cíclidos con hábitos bentónicos y pelágicos, carnívoros y de tallas chicas: Trichromis salvini (Tsa), Rocio octofasciata (Ro), Thorichthys meeki (Tme), T. socolofi (Ts), T. helleri (Th) y T. maculipinnis (Tm). Finalmente, un cuarto conjunto estuvo conformado por especies omnívoras de tallas grandes, aquí se encuentran Joturus pichardi (Jp), Atractosteus tropicus (At), Agonostomus monticola (Am), Brycon guatemalensis (Bgu) y las 3 especies exóticas del género Oreochromis (Om, On y Oa).
En cuanto a la diversidad taxonómica, se observó que el sitio Lacantún presentó la mayor riqueza de especies (tabla 2). Sin embargo, en cuanto a los índices que consideran la distribución de las abundancias (diversidad de Shannon, dominancia y equidad), este sitio mostró valores intermedios, siendo el sitio José el que presentó los valores más altos. En cuanto a la diversidad funcional, se encontró que el sitio Lacantún tuvo el mayor número de entidades y riqueza funcionales. El arroyo José tuvo el valor más alto en equidad y dispersión funcionales, aspectos que consideran la distribución de las abundancias relativas dentro del espacio funcional. Finalmente, el sitio Danta presentó los menores valores en todos los indicadores analizados, excepto dominancia.
La representación de las especies presentes en cada uno de los sitios en el espacio funcional (fig. 3) muestra entidades funcionales (separadas por [ y ]) que estuvieron representadas en todos los sitios: [Pseudoxiphophorus bimaculatus (Pb)], [Xiphophorus hellerii (Xh) / Poecilia mexicana (Pom)], [Astyanax brevimanus (Ab) / Cynodonichthys tenuis (Ct)] y [Rhamdia guatemalensis (Rg)]. Adicionalmente, las funciones compartidas entre los sitios Lacantún y José corresponden a aquellas representadas por [Belonesox belizanus (Bb)], [Theraps irregularis (Ti)], [Chuco intermedium (Ci)] y [Trichromis salvini (Tsa) / Thorichthys helleri (Th)]. Los sitios José y Danta comparten la entidad funcional representada por [Ophisternon aenigmaticum (Opa)]. El sitio Lacantún fue el único en el que se detectó la presencia de las especies exóticas Pterygoplichthys pardalis (Pp) y Oreochromis aureus (Oa).
Considerando la abundancia relativa de las especies en conjunto con sus atributos funcionales, en los sitios Lacantún y José las abundancias relativas de las especies se encontraron distribuidas en todo el espectro funcional (fig. 4). En contraste, en el sitio Danta se observó un dominio por entidades funcionales representadas por las especies [Xiphophorus hellerii (Xh)] y [Pseudoxiphophorus bimaculatus (Pb)].
Discusión
Los estudios sobre la ecología funcional en los ecosistemas acuáticos han permitido una mejor comprensión sobre las respuestas que pueden tener los ensambles biológicos ante eventos de perturbación antropogénica, cambios de estado, y pueden ayudar a la construcción integrativa de estrategias de conservación (Córdova-Tapia y Mercado-Silva, 2019; Córdova-Tapia y Zambrano, 2015). Este tipo de estudios tiene como base la clasificación de las especies por medio de sus atributos funcionales. En este estudio se clasificaron funcionalmente las 72 especies que han sido registradas en la zona de influencia de la RBMA. Los atributos funcionales analizados en este trabajo han sido utilizados para la generación de índices biológicos de integridad (IBI) en diversas cuencas mexicanas (Mercado-Silva et al., 2006), por lo que la clasificación aquí presentada puede ser utilizada para dar seguimiento a la calidad ambiental de los ecosistemas de la región. Asimismo, esta misma clasificación funcional y aproximación analítica pueden ser utilizadas para analizar otras series de datos con el objetivo de identificar tendencias en el funcionamiento ecológico de las comunidades, sus dinámicas y para analizar las diferencias entre sitios expuestos a variados factores de manejo o afectación antropogénica.
Tabla 1
Listado taxonómico en orden alfabético y atributos funcionales de las especies de peces registradas en la Reserva de la Biosfera Montes Azules y su zona de influencia. Or: Origen (N: nativa, E: exótica); Po: posición (C: columna de agua, B: bentos, C/B: columna y bentos); Al: alimentación (H: herbívoro, O: omnívoro, C: carnívoro); Re: reproducción (H: huevo, V: vivíparo); Ta: talla máxima (CH: < 15 cm, M: 15-30 cm, G: > 30 cm); Ref: referencias (ver pie de tabla).
| Orden, familia, especie | Nombre común | Or | Po | Al | Re | Ta | Ref |
| Atheriniformes | |||||||
| Atherinopsidae | |||||||
| Atherinella alvarezi (Aa) | Plateadito de Tacotalpa | N | C | O | H | CH | [1,2] |
| Atherinella schultzi (As) | Plateadito de Chimalapa | N | C | O | H | CH | [1] |
| Batrachoidiformes | |||||||
| Batrachoididae | |||||||
| Batrachoides goldmani (Bg) | Sapo mexicano | N | B | C | H | M | [1] |
| Beloniformes | |||||||
| Belonidae | |||||||
| Strongylura hubbsi (Sh) | Agujón maya | N | C | C | H | G | [1,3] |
| Hemiramphidae | |||||||
| Hyporhamphus mexicanus (Hm) | Pajarito mexicano | N | C | C | H | CH | [1,4] |
| Characiformes | |||||||
| Characidae | |||||||
| Astyanax brevimanus (Ab) | Sardinita del Quiché | N | C | O | H | CH | [24, 26, 27] |
| Hyphessobrycon compressus (Hc) | Sardinita plateada | N | C | H | H | CH | [1,5] |
| Bryconidae | |||||||
| Brycon guatemalensis (Bgu) | Sardinita macabí | N | C | O | H | G | [1,5] |
| Clupeiformes | |||||||
| Clupeidae | |||||||
| Dorosoma anale (Da) | Sardina del Papaloapan | N | C | O | H | M | [1,5,8] |
| Dorosoma petenense (Dp) | Sardina maya | N | C | O | H | M | [2,5] |
| Cypriniformes | |||||||
| Cyprinidae | |||||||
| Ctenopharyngodon idella (Cid) | Carpa herbívora | E | C | H | H | G | [6,9] |
| Cyprinus carpio (Cc) | Carpa común | E | B | O | H | G | [6,9] |
| Catostomidae | |||||||
| Ictiobus meridionalis (Ibm) | Matalote meridional | N | B | O | H | G | [1] |
| Cyprinodontiformes | |||||||
| Rivulidae | |||||||
| Cynodonichthys tenuis (Ct) | Almirante de El Hule | N | C | O | H | CH | [1,7,28] |
| Poeciliidae | |||||||
| Belonesox belizanus (Bb) | Picudito | N | C | C | V | M | [1,5,7] |
| Gambusia sexradiata (Gs) | Guayacón del sureste | N | C | O | V | CH | [1,5] |
| Pseudoxiphophorus bimaculatus (Pb) | Guatopote manchado | N | C | O | V | CH | [6,7,9] |
| Phallichthys fairweatheri (Pf) | Topo | N | C | O | V | CH | [1,5,10] |
| Tabla 1. Continúa | |||||||
| Orden, familia, especie | Nombre común | Or | Po | Al | Re | Ta | Ref |
| Poecilia mexicana (Pom) | Topote del Atlántico | N | C | H | V | CH | [2,5,6,7] |
| Poecilia kykesis (Pk) | Topote | N | C | O | V | CH | [26] |
| Poecilia sphenops (Ps) | Topote mexicano | N | C | H | V | CH | [1,6] |
| Xenodexia ctenolepis (Xc) | Topo del Grijalva | N | C | H | V | CH | [1] |
| Xiphophorus alvarezi (Xa) | Espada de Comitán | N | C | O | V | CH | [28] |
| Xiphophorus hellerii (Xh) | Cola de espada | N | C | H | V | CH | [2,5,6] |
| Xiphophorus maculatus (Xm) | Espada sureña | N | C | O | V | CH | [1,7] |
| Elopiformes | |||||||
| Megalopidae | |||||||
| Megalops atlanticus (Ma) | Sábalo | N | C | C | H | G | [1,5] |
| Lepisosteiformes | |||||||
| Lepisosteidae | |||||||
| Atractosteus tropicus (At) | Pejelagarto | N | C | O | H | G | [1] |
| Perciformes | |||||||
| Centropomidae | |||||||
| Centropomus parallelus (Cp) | Chucumite | N | B | C | H | G | [1,5] |
| Centropomus undecimalis (Cu) | Robalo blanco | N | B | C | H | G | [1,5] |
| Gerreidae | |||||||
| Eugerres castroaguirrei (Ec) | Mojarra lacandona | N | B | O | H | M | [11] |
| Eugerres mexicanus (Em) | Mojarra mexicana | N | B | O | H | M | [11,12] |
| Sciaenidae | |||||||
| Aplodinotus grunniens (Ag) | Roncador de agua dulce | N | B | C | H | G | [5] |
| Mugilidae | |||||||
| Agonostomus monticola (Am) | Trucha de tierra caliente | N | C | O | H | G | [1,6,9] |
| Joturus pichardi (Jp) | Bobo | N | C | O | H | G | [28] |
| Mugil curema (Mc) | Lisa blanca | N | C | H | H | G | [1,5] |
| Cichlidae | |||||||
| Chuco intermedium (Ci) | Mojarra del Petén | N | C/B | H | H | M | [1,2, 25] |
| Cincelichthys pearsei (Cpe) | Mojarra zacatera | N | C/B | H | H | M | [1, 25] |
| Kihnichthys ufermanni (Ku) | Mojarra del Usumacinta | N | C/B | H | H | M | [1,16, 25] |
| Maskaheros argenteus (Mar) | Mojarra pozolera | N | C/B | O | H | M | [15, 25] |
| Mayaheros urophthalmus (Mu) | Mojarra del sureste | N | C/B | C | H | M | [7] |
| Oreochromis aureus (Oa) | Tilapia azul | E | C | O | H | G | [6,17] |
| Oreochromis niloticus (On) | Tilapia del Nilo | E | C | O | H | G | [6,18] |
| Oreochromis mossambicus (Om) | Tilapia de Mozambique | E | C | O | H | G | [6,17] |
| Oscura heterospila (Oh) | Mojara de Montecristo | N | C | O | H | M | [11,16,19] |
| Parachromis managuensis (Pam) | Mojarra de Managua | E | C/B | C | H | G | [1,13,14] |
| Parachromis multifasciatus (Pmu) | Mojarra del San Juan | N | C | C | H | M | [1,23,25] |
| Petenia splendida (Psp) | Tenguayaca | N | C | C | H | G | [1,5, 25] |
| Tabla 1. Continúa | |||||||
| Orden, familia, especie | Nombre común | Or | Po | Al | Re | Ta | Ref |
| Rheoheros lentiginosus (Rl) | Mojarra gachupina | N | B | C | H | CH | [1,2, 25] |
| Rocio octofasciata (Ro) | Mojarra castarrica | N | C/B | C | H | CH | [5,7] |
| Theraps irregularis (Ti) | Canchay | N | C/B | O | H | M | [1,11,17, 25] |
| Thorichthys helleri (Th) | Mojarra amarilla | N | C/B | C | H | CH | [5,7, 25] |
| Thorichthys maculipinnis (Tm) | Chescla | N | C/B | C | H | CH | [15] |
| Thorichthys pasionis (Tp) | Mojarra de la pasión | N | C/B | O | H | CH | [23, 26] |
| Thorichthys meeki (Tme) | Mojarra boca de fuego | N | C/B | C | H | CH | [23,25] |
| Thorichthys socolofi (Ts) | Mojarra del Misalá | N | C/B | C | H | CH | [1,2] |
| Trichromis salvini (Tsa) | Guapote tricolor | N | C/B | C | H | CH | [1,5, 25] |
| Vieja bifasciata (Vb) | Mojarra panza colorada | N | C/B | H | H | M | [1,2, 25] |
| Vieja melanurus (Vm) | Mojarra paleta | N | C/B | H | H | G | [4,15, 25] |
| Wajpamheros nourissati (Wn) | Mojarra de labios gruesos | N | C/B | O | H | M | [1,25] |
| Eleotridae | |||||||
| Gobiomorus dormitor (Gd) | Guavina bocona | N | B | C | H | G | [1,5,9] |
| Leptophilypnus guatemalensis (Lg) | Dormilón enano | N | B | C | H | CH | [19] |
| Siluriformes | |||||||
| Lacantuniidae | |||||||
| Lacantunia enigmatica (Le) | Bagre de Chiapas | N | B | C | H | G | [20] |
| Ictaluridae | |||||||
| Ictalurus meridionalis (Im) | Bagre azul del sureste | N | B | C | H | G | [1,5] |
| Ariidae | |||||||
| Cathorops aguadulce (Ca) | Bagre aguadulce | N | B | C | H | G | [1,5] |
| Potamarius nelsoni (Pn) | Bagre lacandón | N | B | C | H | G | [1,4] |
| Potamarius usumacintae (Pu) | Bagre del Usumacinta | N | B | O | H | G | [28] |
| Heptapteridae | |||||||
| Rhamdia guatemalensis (Rg) | Juil descolorido | N | B | C | H | M | [5,7] |
| Rhamdia laticauda (Rla) | Juil de Jamapa | N | B | C | H | M | [1,5,21] |
| Loricariidae | |||||||
| Pterygoplichthys disjunctivus (Pd) | Plecostoma rayado | E | B | H | H | G | [22] |
| Pterygoplichthys multiradiatus (Ptm) | Plecostoma del Orinoco | E | B | H | H | G | [17] |
| Pterygoplichthys pardalis (Pp) | Plecostoma del Amazonas | E | B | H | H | G | [17] |
| Synbranchiformes | |||||||
| Synbranchidae | |||||||
| Ophisternon aenigmaticum (Opa) | Anguila falsa | N | B | C | H | G | [5,7] |
1: Miller, 2009; 2: Pease, 2010; 3: Lovejoy y Collette, 2003; 4: Anzueto-Calvo et al., 2013; 5: Greenfield y Thomerson, 1997; 6: Mercado-Silva et al., 2002; 7: Córdova-Tapia y Zambrano, 2016; 8: Whitehead, 1985; 9: Mercado-Silva, 2016; 10: Ruiz-Cauich et al., 2016; 11: González-Acosta y Rodiles-Hernández, 2013; 12: Deckert y Greenfield, 1987; 13: IGFA, 2001; 14: Yamamoto y Tagawa, 2000; 15: Kullander, 2003; 16: Soria-Barreto y Rodiles-Hernández, 2008; 17: Nico et al., 2017; 18: Eccles, 1992; 19: Thacker et al., 2006; 20: Rodiles-Hernández et al., 2005; 21: Bussing, 1998; 22: Nico et al., 2006; 23: Rican et al., 2016; 24: Schimitter-Soto, 2017; 25: Soria-Barreto et al., 2019; 26: Froese y Pauly, 2023; 27: Lyons et al., 2020; 28: Ross et al., 2020.
Tabla 2
Comparación de los parámetros de las comunidades de peces en los 3 sitios de estudio de la subcuenca del río Lacantún.
| Sitio | Lacantún (S1) | José (S2) | Danta (S3) |
| Riqueza de especies | 13 | 11 | 6 |
| Diversidad (Shannon) (H) | 1.98 | 2.53 | 1.29 |
| Dominancia (D) | 0.19 | 0.09 | 0.36 |
| Equidad (J) | 0.73 | 0.93 | 0.66 |
| Entidades Funcionales | 11 | 10 | 5 |
| Riqueza funcional (FRic) | 6.36 | 3.11 | 0.28 |
| Equidad funcional (FEve) | 0.53 | 0.83 | 0.36 |
| Dispersión funcional (FDis) | 1.59 | 1.65 | 0.89 |
En este estudio se utilizaron valores categóricos para estimar los atributos funcionales, lo que ofreció ventajas metodológicas tanto en el tiempo como en la factibilidad de utilizar datos preexistentes. Sin embargo, actualmente existen otros métodos que permiten medir atributos funcionales de peces en una escala continua, lo que permite obtener un mayor detalle sobre las similitudes y diferencias (Córdova-Tapia et al., 2017; Soria-Barreto et al., 2019). Por ejemplo, los atributos ecomorfológicos que toman en cuenta la relación entre la forma, el desempeño y la ecología de los organismos, pueden ayudar a entender los patrones de distribución de las especies con base en la selección de hábitat, pero su aplicación requiere de la medición de atributos morfológicos y disección de los organismos in situ (Villéger et al., 2010). Aun así, los atributos analizados sirven como punto de partida para la exploración de otros que permitan ahondar en la comprensión de los ecosistemas en una región de alta diversidad y complejidad biológica.
Los resultados de nuestros análisis permiten derivar patrones funcionales entre las 3 comunidades de peces analizadas. Como era de esperarse, las menores dimensiones y simplicidad estructural del arroyo Danta influyó sobre la riqueza y diversidad observadas (Matthews, 1998). Este sitio resultó tener no solo la menor riqueza taxonómica sino una menor riqueza funcional. Esta comunidad resultó dominada por la abundancia de 3 poecílidos de origen nativo que son vivíparos, de tamaño pequeño, con tendencias herbívoras u omnívoras y con hábitos pelágicos. En este sitio la abundancia de pozas con alto contenido de materia orgánica (e.g., hojas caídas de la vegetación adyacente), pero con aguas relativamente claras genera hábitat para especies que tienen preferencia por sitios tranquilos, donde el perifiton y la materia orgánica gruesa pueden acumularse y servir de base para la red trófica. En este sitio, la presencia de Rhamdia guatemalensis (Rg) y Cynodonichthys tenuis (Ct) es evidencia de la presencia de recursos en zonas profundas de las pozas.
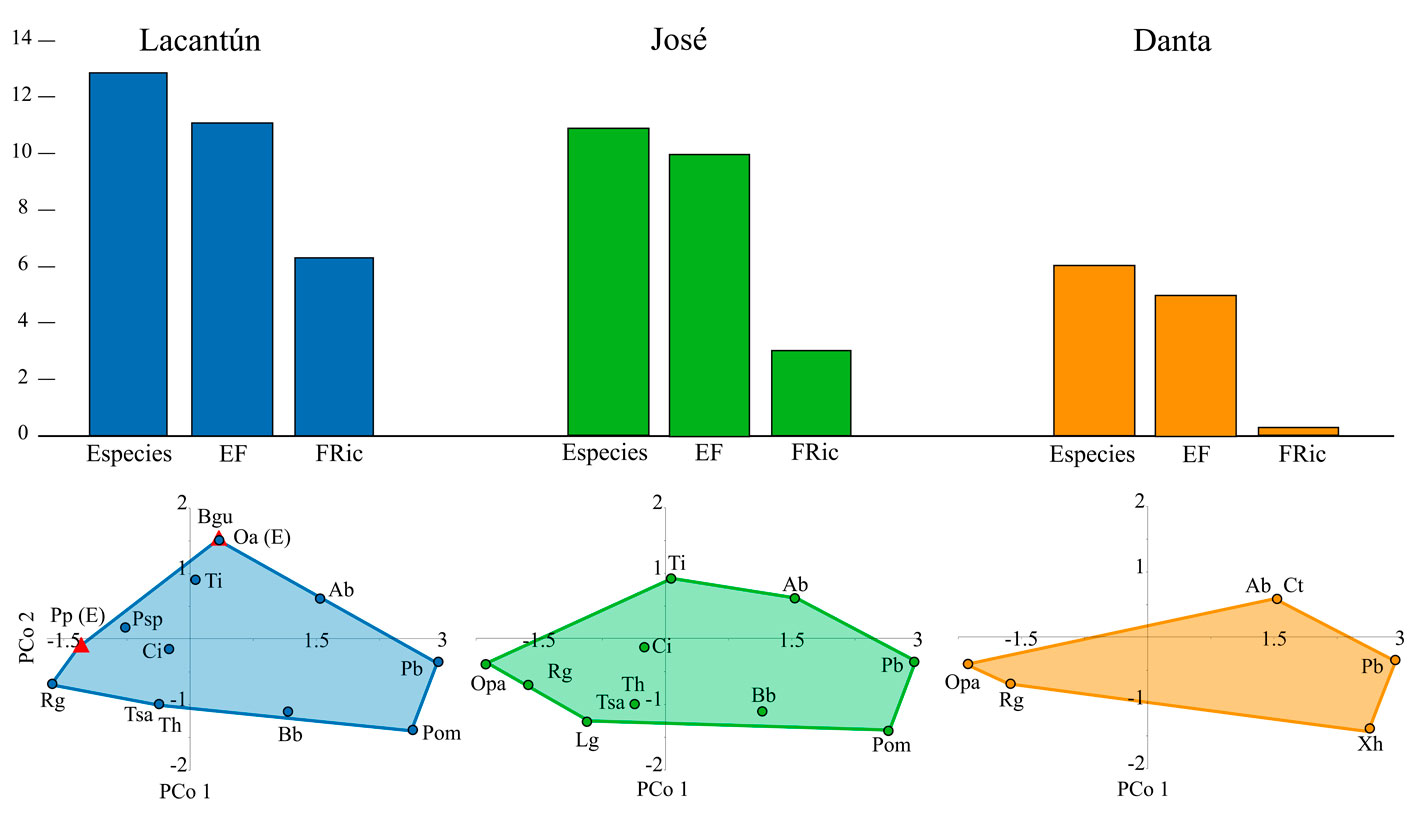
En contraste, el sitio de mayor dimensión, el río Lacantún, tuvo la mayor riqueza específica y funcional, y mostró una dominancia intermedia. Se presentaron aquí tanto especies nativas como exóticas, con variadas estrategias reproductivas y tendencias alimenticias que aprovechan la columna de agua como Astyanax brevimanus (Ab) y los ambientes bentónicos como Pterygoplichthys pardalis (Pp) o Rhamdia guatemalensis (Rg). El arroyo José, con dimensiones y riqueza funcional intermedias, mostró la mayor diversidad de los 3 sitios; ésto debido a que las abundancias están más homogéneamente distribuidas en la comunidad y existe poca dominancia. Cabe resaltar en este sitio la presencia de Belonesox belizanus (Bb), una especie nativa que es principalmente piscívora y uno de los depredadores más importantes en los arroyos del sistema. Además, no se detectó la presencia de especies exóticas.

Es importante reconocer que los contrastes funcionales entre las comunidades mencionadas en las líneas anteriores pueden tener fuerte influencia de la eficiencia y sesgo de los métodos utilizados en la obtención de muestras de las comunidades de peces (Bonar et al., 2011). Los métodos utilizados fueron altamente efectivos en los arroyos José y Danta donde se tuvo acceso a todos los sectores del ambiente acuático. Reconocemos que en el Lacantún, donde las dimensiones de río imposibilitaron el acceso a zonas profundas y alejadas de la orilla, las artes de pesca utilizadas fueron quizás poco efectivas en capturar especies que pueden utilizar estos hábitats. Esto puede haber resultado en una riqueza observada menor que la que realmente existe en el sitio. Pese a ello, el contraste en la diversidad funcional ofrece interesantes perspectivas sobre cómo se estructuran las comunidades y se identificaron diferencias funcionales importantes con los otros sitios estudiados. De manera similar, es importante apuntar que aunque la temporada del año puede no ser un factor en la estructura de estas comunidades (Larre-Campuzano et al., 2023), la diversidad funcional podría variar en muestreos obtenidos en diferentes periodos, por lo que estudios posteriores deben considerar la temporalidad en sus muestreos para contextualizar las inferencias que se pueden lograr a partir de los análisis funcionales (Rodiles-Hernández et al., 1999).
La clasificación de especies de acuerdo con sus atributos funcionales trasciende los límites taxonómicos. Sin embargo, los atributos funcionales pueden ser dependientes de la filogenia en el sentido de que con frecuencia, las especies de la misma familia o género tienden a compartir atributos comunes (Bellwood et al., 2002; Devictor et al., 2010; Dumay et al., 2004). Los resultados obtenidos mostraron esta relación entre la filogenia y los atributos funcionales dentro de las familias Poeciliidae (nativos, que se posicionan en la columna de agua, omnívoros-herbívoros, vivíparos y de tamaño chico) y Cichlidae (en general nativos, que habitan tanto la columna de agua como el bentos, son omnívoros-carnívoros, ovipositan y son de tamaño variable). Una excepción es el caso de Belonesox belizanus (Poeciliidae), una especie que comparte atributos funcionales con otros miembros de la familia Poeciliidae, pero que debido a su alimentación piscívora se diferencia del resto (Córdova-Tapia y Zambrano, 2016).
La riqueza funcional es un componente de la diversidad funcional que se encuentra altamente influenciado por las especies con combinaciones únicas de atributos, por lo tanto, la pérdida de una especie que se encuentra en los límites de la envoltura convexa reduce el tamaño del polígono y por lo tanto la riqueza funcional. Es por ésto que la introducción de especies exóticas con características únicas puede aumentar la riqueza funcional. En este caso, el aumento se puede observar en el río Lacantún, donde se detectó la presencia de Oreochromis aureus (Oa) y Pterygoplichthys pardalis (Pp). En contraste, la pérdida o ausencia de una especie que se encuentra dentro de los límites del polígono no tiene ningún efecto sobre el valor de la riqueza funcional, pero sí sobre otros componentes de la diversidad funcional (Córdova-Tapia y Zambrano, 2015). En este sentido, es importante relacionar los atributos funcionales con sus abundancias, pues como ocurre en el río Lacantún, las especies exóticas influyen mucho en la riqueza funcional, pero poco en la distribución de las abundancias como lo observado en los índices de equidad y dispersión funcional. Los datos muestran que las especies exóticas del género Pterygoplichthys ocupan un espacio funcional distinto del resto de las especies nativas, mientras que las especies de Oreochromis comparten atributos funcionales con otras nativas. Esta situación puede tener implicaciones en su establecimiento a largo plazo dentro de los ecosistemas (Colin et al., 2018). Por ello, se sugiere mantener un monitoreo y manejo continuo, con el fin de evaluar e impedir su dispersión dentro de la reserva.
Con respecto de los grupos de especies que comparten el mismo espacio funcional, es importante tener en cuenta que el nicho funcional de una especie depende de los procesos ecológicos, pero éstos se ven modificados por atributos demográficos y las respuestas a los factores ambientales (Violle et al., 2007). Además, 2 especies pueden tener las mismas características en algún aspecto funcional, pero pueden diferir en otras; por lo tanto, la redundancia se reduce entre las especies cuando se consideran varios atributos o funciones simultáneamente (Gamfeldt et al., 2008). Bajo esta suposición, siempre será posible separar 2 especies eligiendo un eje de nicho apropiado (Morin, 2011). Por lo tanto, sugerimos considerar los resultados del presente estudio como una medida de similitud funcional más que de redundancia funcional o de capacidad de sustitución funcional entre especies.
La propuesta metodológica que se presenta puede ser utilizada de manera sencilla, rápida y eficaz para analizar datos preexistentes y analizar tendencias ecológicas con el objetivo de avanzar la información más allá de los listados taxonómicos de peces. Además, permite identificar especies con funciones singulares en la comunidad, lo que es útil para dirigir esfuerzos de conservación o restauración conservando no solo especies, sino funciones en los ecosistemas. Esta aproximación resulta particularmente relevante en el contexto de zonas de alta diversidad, donde la información ecológica es escasa, como la selva Lacandona y la RBMA (Beltrán-López et al., 2023). Sugerimos como siguiente aproximación al estudio ecológico de la ictiofauna de esta región, analizar de manera detallada el efecto que los distintos procesos de antropización pueden estar generando en las comunidades locales.
Agradecimientos
Agradecemos el apoyo de Natura y Ecosistemas Mexicanos, A.C. y al equipo de trabajo que en campo laboró para la obtención de la información utilizada en el presente estudio. Al Conahcyt por el financiamiento recibido mediante el proyecto C-560/2023. FCT realizó una estancia posdoctoral en el CIByC (UAEMorelos), con el apoyo de una beca Conahcyt. NRQ colaboró en este trabajo como parte del Doctorado en Ciencias Naturales de la UAEMorelos. Agradecemos el apoyo brindado por Ruth Luna Soria y la Sociedad de los Párrafos Perdidos durante la preparación del manuscrito.
References
Anzueto-Calvo, M. J., Velázquez-Velázquez, E., Gómez-González, A. E., Quiñones R. M. y Joyce-Olson, B. (Eds.) (2013). Peces de la Reserva de la Biosfera Selva El Ocote. Chiapas, México. Tuxtla Gutiérrez, Chiapas: Universidad de Ciencias y Artes de Chiapas.
Bellwood, D. R., Wainwright, P. C., Fulton, C. J. y Hoey, A. (2002). Assembly rules and functional groups at global biogeographical scales. Functional Ecology, 16, 557–562.
Beltrán-López, R. G., García-Andrade, A. B. y Ornelas-García, C. P. (2023). Mexican freshwater fishes in the Anthropocene. En R. W. Jones, C. P. Ornelas-García, R. Pineda-López y F. Álvarez (Eds.), Mexican fauna in the Anthropocene (pp. 129–152). Cham, Suiza: Springer. https://doi.org/10.1007/978-3-031-17277-9
Bonar, S. A., Hubert, W. A. y Willis, D. W. (2009). Standard methods for sampling North American freshwater fishes. Bethesda: American Fisheries Society.
Bonar, S. A., Fehmi, J. S. y Mercado-Silva, N. (2011). An overview of sampling issues in species diversity and abundance surveys. En A. E. Magurran y B. J. McGill (Eds.), Biological diversity, frontiers in measurement and assessment (pp. 11–24). New York: Oxford University Press.
Bussing, W. A. (1998). Peces de las aguas continentales de Costa Rica. San José: Universidad de Costa Rica, Costa Rica.
Cadotte, M. W., Carscadden, K. y Mirotchnick, N. (2011). Beyond species: functional diversity and the maintenance of ecological processes and services. Journal of Applied Ecology, 48, 1079–1087. https://doi.org/10.1111/j.1365-2664.2011.02048.x
Carabias, J., De la Maza, J. y Cadena, R. (2015). Conservación y desarrollo sustentable en la selva Lacandona. Ciudad de México: Natura y Ecosistemas Mexicanos.
Colin, N., Villéger, S., Wilkes, M., De Sostoa, A. y Maceda-Veiga, A. (2018). Functional diversity measures revealed impacts of non-native species and habitat degradation on species-poor freshwater fish assemblages. Science of the Total Environment, 625, 861–871. https://doi.org/10.1016/j.scitotenv.2017.12.316
Conagua (Comisión Nacional del Agua). (2018). Estadísticas del agua en México, edición 2017. Ciudad de México: Secretaría del Medio Ambiente y Recursos Naturales.
Córdova-Tapia, F. y Zambrano, L. (2015). La diversidad funcional en la ecología de comunidades. Ecosistemas, 24, 78–87. https://doi.org/10.7818/ECOS.2015.24-3.10
Córdova-Tapia, F. y Zambrano, L. (2016). Fish functional groups in a tropical wetland of the Yucatán Peninsula, Mexico. Neotropical Ichthyology, 14, e150162. https://doi.org/10.1590/1982-0224-20150162
Córdova-Tapia, F., Hernández-Marroquín, V. y Zambrano, L. (2017). The role of environmental filtering in the functional structure of fish communities in tropical wetlands. Ecology of Freshwater Fish, 27, 519–631. https://doi.org/10.1111/eff.12366
Córdova-Tapia, F. y Mercado-Silva, N. (2019). Diversidad funcional de peces en ambientes antropizados. En C. P. Ornelas-García, F. Álvarez y A. Wegier (Eds.), Antropiza-
ción: primer análisis integral (pp. 109–123). Ciudad de México: IB-UNAM/ Conacyt.
Deckert, G. D. y Greenfield, D. W. (1987). A review of the western Atlantic species of the genera Diapterus and Eugerres (Pisces: Gerreidae). Copeia, 1, 182–194. https://doi.org/10.2307/1446051
Devictor, V., Mouillot, D., Meynard, C., Jiguet, F., Thuiller W. y Mouquet, N. (2010). Spatial mismatch and congruence between taxonomic, phylogenetic and functional diversity: the need for integrative conservation strategies in a changing world. Ecology Letters, 13, 1030–1040. https://doi.org/10.1111/j.1461-0248.2010.01493.x
Dumay, O., Tari, P. S., Tomasini, J. A. y Mouillot, D. (2004). Functional groups of lagoon fish species in Languedoc Roussillon, southern France. Journal of Fish Biology, 64, 970–983. https://doi.org/10.1111/j.1095-8649.2004.00365.x
Eccles, D. H. (1992). Field guide to the freshwater fishes of Tanzania. FAO species identification sheets for fishery purposes. Food and Agriculture Organization of the United Nations, Development Programme, Roma, Italia.
Espinosa-Pérez, H., Ramírez-Martínez, C., Martínez-Castro, A. y Lambarri-Martínez, C. (2019). Los peces del río Lacantún. Monterrey: Universidad Autónoma de Nuevo León/ Natura Ecosistemas Mexicanos.
Froese, R. y Pauly, D. (2023). FishBase. Disponible en: http://www.fishbase.org, fecha de última consulta: 22 de febrero de 2023.
Fukami, T. (2004). Community assembly along a species pool gradient: implications for multiple-scale patterns of species diversity. Population Ecology, 46, 137–147. https://doi.org/10.1007/s10144-004-0182-z
Gamfeldt, L., Hillebrand, H. y Jonsson, P. R. (2008). Multiple functions increase the importance of biodiversity for overall ecosystem functioning. Ecology, 89, 1223–1231. https://doi.org/10.1890/06-2091.1
Garrido, A., Pérez D. J. L. y Enríquez, C. (2010). Delimitación de zonas funcionales de las cuencas hidrográficas de México. En H. Cotler-Ávalos (Ed.), Las cuencas hidrográficas de México. Diagnóstico y priorización. Ciudad de México: Instituto Nacional de Ecología y Fundación Gonzalo Río Arronte.
Gower, J. C. (1971). A general coefficient of similarity and some of its properties. Biometrics, 27, 857–874. https://doi.org/10.2307/2528823
González-Acosta, A. F. y Rodiles-Hernández, R. (2013). New species of Eugerres from the Usumacinta Province, Mexico and Guatemala with a redescription of E. mexicanus (Steindachner, 1863) (Teleostei: Gerreidae). Neotropical Ichthyology, 11, 307–318. https://doi.org/10.1590/S1679-62252013000200009
Greenfield, D. W. y Thomerson, J. E. (1997). Fishes of the continental waters of Belize. Gainesville: University Press of Florida.
IGFA (The International Game Fish Association). (2001). Database of IGFA angling records until 2001. IGFA, Fort Lauderdale, Estados Unidos de América. https://igfa.org/
Kullander, S. O. (2003). Family cichlidae. En R. E. Reis, S. O. Kullander y C. J. Ferraris (Eds.), Check list of the freshwater fishes of South and Central America (pp. 605–654). Porto Alegre, Brasil: Edipucrs.
Laliberté, E. y Legendre, P. (2010). A distance-based framework for measuring functional diversity from multiple traits. Ecology, 91, 299–305. https://doi.org/10.1890/08-2244.1
Laliberté, E., Legendre, P., Shipley, B. y Laliberté, M. E. (2014). Package ‘FD’. Measuring functional diversity from multiple traits, and other tools for functional ecology. https://cran.r-project.org/web/packages/FD/FD.pdf
Larre-Campuzano, S., Mercado-Silva, N. y Matamoros, W. A. (2023). Variation in patterns of fish assemblage and their environmental correlates in a tropical river basin from the Gulf of Mexico slope. Neotropical Ichthyology, 21, e220098. https://doi.org/10.1590/1982-0224-2022-0098
Lovejoy, N. R. y Collette, B. B. (2003). Belonidae (Needlefishes). En R. E. Reis, S. O.
Kullander y C. J. Ferraris (Eds.), Checklist of the freshwater fishes of South and Central America (pp. 586–590). Porto Alegre, Brasil: Edipucrs.
Lyons, J., Navarro-Pérez, S., Cochran, P. A., Santana, E. y Guzmán-Arroyo, M. (1995). Index of biotic integrity based on fish assemblages for the conservation of streams and rivers in west-central Mexico. Conservation Biology, 9, 569–584. https://doi.org/10.1046/j.1523-1739.1995.09030569.x
Lyons, T. J., Máiz-Tomé, L., Tognelli, M., Daniels, A., Meredith, C., Bullock, R. et al. (2020). The status and distribution of freshwater fishes in Mexico. Cambridge, UK, Albuquerque, New Mexico: IUCN/ ABQ BioPark.
Matthews, W. J. (1998). Patterns in freshwater fish Ecology. New York: Springer.
Mercado-Silva, N., Lyons, J. D., Maldonado, G. S. y Nava, M. M. (2002). Validation of a fish-based index of biotic integrity for streams and rivers of central Mexico. Reviews in Fish Biology and Fisheries, 12, 179–191. https://doi.org/10.1023/A:1025099711746
Mercado-Silva, N., Lyons J. y Contreras-Balderas, S. (2006). Mexican fish-based indices of biotic integrity, their use in the conservation of freshwater resources. En M. L. Lozano-Vilano y A. J. Contreras-Balderas (Eds.), Studies of North American desert fishes in honor of E.P. (Phil) Pister, conservationist (pp. 138–150). Monterrey: Universidad Autónoma de Nuevo León.
Mercado-Silva, N. (2016). Gremios ecológicos de los peces del Estado de Querétaro. En R. W. Jones y V. Serrano-Cárdenas V. (Eds.), Historia natural de Querétaro (pp. 320–367). Querétaro: Universidad Autónoma de Querétaro.
Miller, R. R., Minckley, W. L. y Norris, S. M. (2009). Peces dulceacuícolas de México. Ciudad de México: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Morin, P. J. (2011). Community ecology. Chichester, Reino Unido: John Wiley & Sons.
Mouchet, M. A., Villéger, S., Mason, N. W. y Mouillot, D. (2010). Functional diversity measures: an overview of their redundancy and their ability to discriminate community assembly rules. Functional Ecology, 24, 867–876. https://doi.org/10.1111/j.1365-2435.2010.01695.x
Naeem, S. y Wright, J. P. (2003). Disentangling biodiversity effects on ecosystem functioning: deriving solutions to a seemingly insurmountable problem. Ecology Letters, 6, 567–579. https://doi.org/10.1046/j.1461-0248.2003.00471.x
Nico, L., Fuller, P., Cannister, M. y Neilson, M. (2006). Pterygoplichthys disjunctivus. USGS Nonindigenous Aquatic Species Database, Florida, Estados Unidos. https://nas.er.usgs.gov/
Nico, L., Cannister, M. y Neilson, M. (2017). Pterygoplichthys multiradiatus (Hancock, 1828). USGS Nonindigenous Aquatic Species Database, Florida, Estados Unidos. https://nas.er.usgs.gov/
Pease, A. A. (2010). Patterns in functional structure and diversity of stream fish assemblages related to environmental factors at multiple scales (Tesis doctoral). Texas A&M University, EUA.
Ramírez, C., Barba, R., Caspeta, J. M., Córdova-Tapia, F., Espinosa, H., Larre, S. et al. (2022). Biota acuática de la cuenca media del río Lacantún, Chiapas y la importancia del monitoreo de largo plazo. Revista Mexicana de Biodiversidad, 93, e934844. https://doi.org/10.22201/ib.20078706e.2022.93.4844
Ramírez-Martínez, C., Naranjo, E., Caspeta, J. M., Espinosa-Pérez, H. y Barba, R. (2015). Ecosistemas acuáticos. En J. Carabias, J. de La Maza y R. Cadena R. (Coords.), Conservación y desarrollo sustentable en la selva Lacandona. 25 años de actividades y experiencias (pp. 193–207). Ciudad de México: Natura Ecosistemas Mexicanos.
Ramírez-Ortiz, G., Reyes-Bonilla, H., Balart, E. F., Olivier, D., Huato-Soberanis, L., Micheli, F. et al. (2020). Reduced fish diversity despite increased fish biomass in a Gulf of California Marine Protected Area. PeerJ, 8, e8885. https://doi.org/10.7717/peerj.8885
Reid, A. J., Carlson, A. K., Creed, I. F., Eliason, E. J., Gell, P. A., Johnson, P. T. et al. (2019). Emerging threats and persistent conservation challenges for freshwater biodiversity.
Biological Reviews, 94, 849–873. https://doi.org/10.1111/brv.12480
Rican, O., Pialek, L., Dragova, K. y Novak, J. (2016). Diversity and evolution of the Middle American cichlid fishes (Teleostei: Cichlidae) with revised classification. Vertebrate Zoology, 66, 3–102. https://doi.org/10.3897/vz.66.e31534
Rico, C. N., Hoagstrom, C. W., Elías, D. J., Mcmahan, C. D. y Matamoros, W. A. (2022). Biotic regionalization of freshwater fishes in Northern Middle America highlights high beta diversity created by prominent biogeographic barriers. Frontiers of Biogeography, 14, e58095. https://doi.org/10.21425/F5FBG58095
Rodiles-Hernández, R., Díaz-Pardo E. y Lyons, J. (1999). Patterns in the species diversity and composition of the fish community of the Lacanja River, Chiapas, Mexico. Journal of Freshwater Ecology, 14, 455–468. https://doi.org/10.1080/02705060.1999.9663704
Rodiles-Hernández, R., González-Díaz, A. A. y Chan-Sala, C. (2005). Lista de peces continentales de Chiapas, México. Hidrobiológica, 15, 245–253.
Rosenfeld, J. S. (2002). Functional redundancy in ecology and conservation. Oikos, 98, 156–162. https://doi.org/10.1034/j.1600-0706.2002.980116.x
Ross, S. T., Kuhajda, B. R., Echelle, A. A., Tomelleri, J. R., Burr, B. M. y Warren, M. L. (2020). Freshwater fishes of North America, Volume 2: Characidae to Poeciliidae. Baltimore: Johns Hopkins University Press.
Ruiz-Cauich, L. E., Schmitter-Soto, J. J., Barba-Macías, E. y González-Solís, D. (2016). Stability vs. organization: potential of a trophic model for the management of shallow tropical streams. Food Webs, 6, 38–47. https://doi.org/10.1016/j.fooweb.2016.02.001
Schmitter-Soto, J. J. (2017) A revision of Astyanax (Characiformes: Characidae) in Central and North America, with the description of nine new species. Journal of Natural History, 51, 1331–1424. https://doi.org/10.1080/00222933.2017.1324050
Soria-Barreto, M. y Rodiles-Hernández, R. (2008). Spatial distribution of cichlids in Tzendales river, Biosphere Reserve Montes Azules, Chiapas, Mexico. Environmental Biology of Fishes, 83, 459–469. https://doi.org/10.1007/s10641-008-9368-0
Soria-Barreto, M., Rodiles-Hernández, R. y Winemiller, K. O. (2019). Trophic ecomorphology of cichlid fishes of selva Lacandona, Usumacinta, Mexico. Environmental Biology of Fishes, 102, 985–996. https://doi.org/10.1007/s10641-019-00884-5
Thacker, C. E., Pezold, F. y Suttkus, R. D. (2006). Redescription of the dwarf neotropical eleotrid genus Leptophilypnus (Teleostei: Gobioidei), including a new species and comments on Microphilypnus. Copeia, 3, 489–499. https://doi.org/10.1643/0045-8511(2006)2006[489:ROTDNE]2.0.CO;2
Tilman, D., Knops, J., Wedin, D., Reich, P., Ritchie, M. y Siemann, E. (1997). The influence of functional diversity and composition on ecosystem processes. Science, 277, 1300–1302. https://doi.org/10.1126/science.277.5330.1300
Villéger, S., Mason, N. W. H. y Mouillot, D. (2008) New multidimensional functional diversity indices for a multifaceted framework in functional ecology. Ecology, 89, 2290–2301. https://doi.org/10.1890/07-1206.1
Villéger, S., Miranda, J. R., Hernández, D. F. y Mouillot, D. (2010). Contrasting changes in taxonomic vs. functional diversity of tropical fish communities after habitat degradation. Ecological Applications, 20, 1512–1522. https://doi.org/10.1890/09-1310.1
Violle, C., Navas, M. L., Vile, D., Kazakou, E., Fortunel, C., Hummel, I. et al. (2007). Let the concept of trait be functional! Oikos, 116, 882–892. https://doi.org/10.1111/j.0030-1299.2007.15559.x
Whitehead, P. J. P. (1985). Clupeoid fishes of the world (Suborder Clupeoidei). An annotated and illustrated catalogue of the herrings, sardines, pilchards, sparts, anchovies and wolfherrings. Part 1 – Chirocentridae, Clupeidae and Pristigasteridae. FAO Fisheries Synopsis, 125. Vol. 7. Londres: British Museum (Natural History).
Yamamoto, M. N. y Tagawa, A. W. (2000). Hawai’i’s native and exotic freshwater animals. Honolulu: Mutual Publishing.