Ricardo Valencia-Vargas a y Luis H. Escalera-Vázquez b, *
a Universidad Michoacana de San Nicolás de Hidalgo, Instituto de Investigaciones sobre los Recursos Naturales, Programa de Maestría en Ciencias en Ecología Integrativa, Avenida Juanito Itzícuaro s/n, 58330 Morelia, Michoacán, México
b Universidad Michoacana de San Nicolás de Hidalgo, Facultad de Biología, Laboratorio de Biología Acuática, Edificio R planta baja, Ciudad Universitaria, Santiago Tapia # 403, Centro, 58000 Morelia, Michoacán, México
*Autor para correspondencia: lhescalera@gmail.com (L.H. Escalera-Vázquez)
Recibido: 12 noviembre 2019; aceptado: 21 agosto 2020
Resumen
La presencia y abundancia de anfibios está altamente relacionada con las características del hábitat y la dinámica estacional (lluvias y secas). En este estudio, se utilizó a la salamandra Ambystoma andersoni para determinar cambios en la abundancia relacionados con la dinámica ambiental en el lago de Zacapu, Michoacán, México. Se realizaron muestreos mensuales de individuos durante la temporada de lluvias (mayo-octubre) y secas (noviembre-abril) en 9 sitios agrupados en 3 zonas (este, centro y oeste) a lo largo de la estación de lluvias y secas; los parámetros fisicoquímicos —temperatura, oxígeno disuelto, pH— y heterogeneidad espacial —vegetación, sustrato— se registraron in situ. Los resultados mostraron diferencias significativas en la abundancia de A. andersoni de forma temporal (lluvias vs. secas) y espacial (zona). En general, el lago de Zacapu mostró poca variación estacional con base en las variables limnológicas obtenidas, resaltando diferencias significativas entre zonas considerando la temperatura y el pH. Sin embargo, hubo diferencias temporales y espaciales en la abundancia de A. andersoni, y se obtuvo una relación positiva con ambas variables. Estos resultados son útiles para proponer planes de manejo y conservación (por ejemplo, zonas prioritarias y pesquerías locales) de una especie de anfibio microendémica presente en una zona con alto impacto antrópico.
Palabras clave: Abundancia; Ambistomátidos; Anfibios; Heterogeneidad; Variables fisicoquímicas
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Abundance of the salamander Ambystoma andersoni in relation to seasonal dynamics and spatial heterogeneity in Zacapu Lake, Michoacán, Mexico
Abstract
The presence and abundance of amphibians is highly related to habitat characteristics and seasonal dynamics (rainy and dry seasons). In this study, Ambystoma andersoni was used to determine the relationship between the abundance and the environmental dynamics in Zacapu Lake, Michoacán, Mexico. Monthly samplings were performed in 9 sites grouped in 3 zones (east, centre, west) along the rainy and dry seasons. Physicochemical parameters —temperature, oxygen concentration and pH— and spatial heterogeneity —vegetation, substrate— were measured in situ. The results showed significant seasonal differences in the abundance of A. andersoni (rainy vs. dry) and spatially (zone). In general, Zacapu Lake showed a low seasonal difference regarding the limnological variables obtained, highlighting significant differences between zones in temperature and pH. However, temporal and spatial differences in the abundance of A. andersoni were present, and showed a positive relation with both variables. These results are useful to propose management and conservation plans (e.g., priority zones and local fisheries) of a microendemic species of amphibian occurring in an area with high anthropic impact.
Keywords: Abundance; Ambistomatids; Amphibians; Heterogeneity; Physicochemical variables
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
Uno de los principales paradigmas en ecología es la relación entre los cambios en la abundancia de las especies con la variación en tiempo y espacio de los recursos y factores ambientales (Begon et al., 2006). Dentro de estos estudios, se deben de considerar los factores bióticos como la depredación o la competencia y abióticos como la variación estacional y heterogeneidad espacial, las cuales influyen en las fluctuaciones poblacionales a corto y largo plazo, pero pueden mantener un patrón continuo y predecible (Juliano, 2007; Semlitsch et al., 1996). Por lo tanto, para comprender la dinámica en los cambios en la abundancia en estado natural, es necesario identificar los mecanismos que rigen las interacciones entre las variables ambientales y distintos atributos de la población, principalmente en especies con distribución geográfica restringida (microendémicas) (Zylstra et al., 2015).
De forma general, las variables fisicoquímicas y la estructura del hábitat están relacionadas a respuestas fisiológicas, ecológicas y de conducta en anfibios influyendo en aspectos como la abundancia, distribución local y selección del hábitat (Clipp y Anderson, 2014; Cole et al., 2014; Peterman y Semlitsch, 2013, 2014; Semlitsch et al., 1996). Para ambistomátidos, se reporta que las variables fisicoquímicas y la heterogeneidad espacial están altamente relacionadas con su distribución y abundancia, las cuales están condicionadas principalmente por altas variaciones en temperatura, altos niveles de oxígeno, presencia de vegetación sumergida y áreas poco antropizadas (Escalera-Vázquez et al., 2018; Lemos-Espinal et al., 2016, 2017; Shaffer, 1989; Whiteman et al., 1994). El determinar dichas relaciones aportará información relevante sobre procesos biológicos, y permitirá generar estrategias de conservación en zonas con un alto porcentaje de especies microendémicas (Cushman, 2006).
Para los anfibios, tanto las variables fisicoquímicas como biológicas, están altamente relacionadas con la selección de áreas de desove, la sobrevivencia de huevos, el crecimiento y desarrollo de las larvas, así como con el consumo de presas y niveles de estrés (Chambers, 2011; Freda, 1986; Pierce, 1985; Portnoy, 1990). Por otro lado, la introducción de especies exóticas de peces, puede generar competencia por las presas y modificar el ambiente mediante la resuspensión de sedimentos, afectando poblaciones nativas de ambistomas (Zambrano et al., 2010).
La salamandra Ambystoma andersoni es una especie microendémica del lago de Zacapu, Michoacán, México y está catalogada en riesgo por normas nacionales (NOM-059-2010) e internacionales (UICN, 2015); ha sido modelo de estudio en la caracterización de respuestas morfológicas e inmunológicas a infecciones parasitarias (Álvarez-Silva et al., 2014; Gómez-Rodríguez, 2013). Sin embargo, es poca la información sobre su relación con las características de su hábitat y la respuesta de su abundancia a fluctuaciones ambientales y la heterogeneidad espacial.
Con base en lo anterior, el objetivo del presente estudio es evaluar los factores relacionados con la abundancia de A. andersoni, así como la proporción sexual y estado de madurez de los individuos considerando los cambios estacionales y la heterogeneidad espacial del lago de Zacapu, Michoacán, México. Los resultados presentados tienen el potencial de ser utilizados en la generación de planes de manejo y conservación de una especie de anfibio microendémica presente en una zona con alto impacto antrópico.
Materiales y métodos
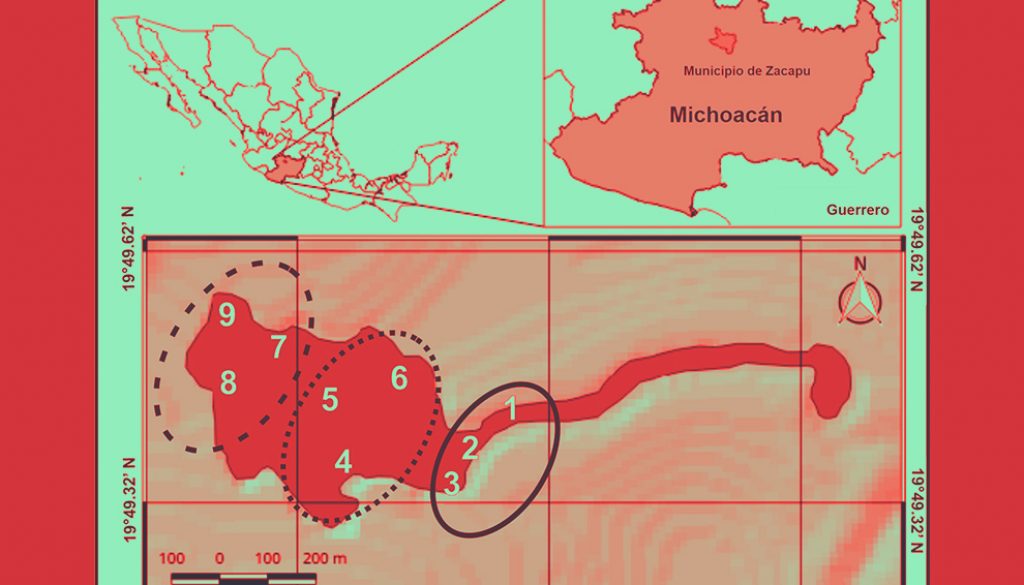
El lago de Zacapu es un cuerpo de agua exorréico ubicado al norte de la ciudad homónima (ca. 76,829 habitantes; INEGI, 2020) a 1,980 m snm (19°49’26” – 19°49’40” N, 101°46’45” – 101°47’25” O; fig. 1). Se encuentra en el Cinturón Volcánico Transmexicano y es parte de la subprovincia neovolcánica Tarasca, la cual se encuentra en la parte baja de la cuenca del río Lerma (Díaz-Argüero, 1997; RAMSAR, 2018). El espejo de agua presenta un área de 21,661 m2 y un volumen aproximado de 64,476.6 m3; una longitud de 634 m (dirección E-O) y un ancho de 414 m (dirección NO-SE); un perímetro de 2,173.68 m y una profundidad máxima de 16 m, con una media de 2.97 m. Las corrientes superficiales están altamente influenciadas por el manantial La Angostura, las cuales se dirigen hacia la zona este produciendo una circulación hacia la desembocadura en la zona noreste (Moncayo-Estrada, 1996). Por otro lado, las corrientes profundas presentan un desplazamiento hacia el este con una velocidad máxima de 13.6 cm s-1 y una mínima de 0.1 cm s-1 (Fernández y Miranda, 1998; Moncayo-Estrada, 1996). Este patrón en las corrientes también está relacionado con la morfología y con la ausencia de estratificación térmica, por lo que los movimientos hídricos del lago generan una tasa de renovación total de agua en aproximadamente 5 días (Ayala-Ramírez et al., 2007).
Con el objetivo de promover la agricultura, en 1886-1907 se desecó ca. 99% del área total del lago, lo que generó un cambio en la dinámica hídrica (Fernández y Miranda, 1998; Guzmán-Ávila, 1985; Moncayo-Estrada, 1996). La vegetación riparia dominante comprende especies arbóreas, macrófitas flotantes, emergentes y subacuáticas, las cuales pueden servir como sitios de refugio y oviposición. También dominan zonas de cultivo en las orillas del lago utilizados principalmente para autoconsumo y mercado local (Gómez-Rodríguez, 2013). Los suelos están conformados principalmente por arcilla (38%), limo (32%) y arena fina (30%) (Moncayo-Estrada, 1996).
Actualmente, la ribera sur y sureste del lago presentan asentamientos urbanos (ca. 50% del total), y se realizan diferentes actividades antrópicas como agricultura, urbanización, turístico-recreativas e industriales (Díaz-Argüero, 1997; Moncayo-Estrada, 1996; RAMSAR, 2018).
Se realizaron recolectas con ayuda de los pescadores locales durante la época de lluvias (mayo-junio 2018) y secas (noviembre-diciembre 2018) en 9 sitios, los cuales por la ubicación geográfica dentro del lago, 3 se clasificaron en la zona oeste, 3 en zona centro y 3 en la zona este (fig. 1). Los individuos de A. andersoni se capturaron con redes tipo agallera de 1.5 m de ancho × 50 m de largo y con una luz de malla de 5.08 cm; se utilizó una red por sitio a 2 – 5 m de la orilla durante 12 horas (19:00 – 7:00 horas). La abundancia de A. andersoni se obtuvo como el total obtenido por zona y se generó el promedio considerando cada uno de los muestreos. Una vez recolectados los organismos, se obtuvo la longitud hocico-cloaca (LHC), longitud de la cola (LC) y longitud total (LT), utilizando un vernier digital. Con base en la talla obtenida, los individuos se clasificaron como larva = LT < 3.35 cm; juvenil = LT > = 3.35 < 24.3 cm y adulto > = 24.3 cm, de acuerdo con Zambrano et al. (2015). La identificación de sexos se realizó de acuerdo con Krebs y Brandon (1984), utilizando el abultamiento de la región cloacal.
Simultáneamente al muestreo y captura de individuos, en cada uno de los sitios seleccionados se registraron —de 12:00-13:00 hr— las siguientes variables fisicoquímicas: conductividad específica (CE µS/cm), oxígeno disuelto (O2 mg/l), sólidos disueltos totales (SDT mg/l) y potencial hidrógeno (pH), utilizando una sonda multiparamétrica (YSI EXO2; YSI Inc., Yellow Springs, OH, EUA). La temperatura (°C) se obtuvo utilizando registradores de datos in situ tomando una lectura cada 30 minutos (HOBO Pendant® Temperature/Light 64K Data Logger). Cada una de estas variables se tomó en superficie (0.1-0.9 m) y profundidad (1.0-9.0 m) y la media de ambas mediciones se utilizó para realizar los análisis estadísticos. La profundidad máxima (PM) en cada sitio se obtuvo utilizando una cuerda graduada (cm).
Para la obtención de la heterogeneidad espacial, en cada sitio se consideró un área de 2,500 m2 (50 × 50 m), en la cual se utilizaron de manera alternada (cada 1 m2) cuadrantes de PVC de 1 m2, se registró in situ el tipo de vegetación dominante (riparia, emergente y subacuática), la presencia de refugios (raíces de árbol o rocas) y el tipo de sustrato no vegetal (azolve, roca, arena) utilizando una draga Ekman de 7 kg (BIRGE HYDRO BIOS; 5 muestras de sustrato por sitio). Para corroborar esta información, se tomaron 10 fotografías a cada cuadrante a una distancia en la que se obtuviera la totalidad del cuadrante (ca. 1.5 m) con una cámara réflex digital (Nikon D3200. Lente Nikkor AF-P 18-55mm f/3.5-5.6G VR) a un ángulo de 90° y posteriormente, los elementos presentes en cada fotografía fueron analizados en el programa ImageJ para obtener cada uno de los atributos estructurales (tipo de sustrato y vegetación dominante, presencia de refugios.) y el número total de éstos.
Para cada muestra y por sitio, se obtuvo el índice de heterogeneidad espacial (S), el cual se estimó basado en Winemiller et al. (2008) con la siguiente fórmula:
S = ∑ xi / N
donde, S = heterogeneidad espacial; xi = cada uno de los atributos estructurales y N = número total de atributos estructurales. Los valores cercanos a 0 indican menor complejidad y cercanos a 1, mayor complejidad; se obtuvo el promedio de los valores de cada uno de los 3 sitios de cada zona.
Para evaluar diferencias significativas en las abundancias de A. andersoni entre zonas y temporadas, se consideró la clasificación por tallas (larva, juvenil, adulto) y sexo de los individuos, y se realizaron análisis de varianza (Anova), siguiendo los supuestos de normalidad (Shapiro-Wilk´s) y homocedasticidad (Bartlett) tomando como nivel de significancia p < 0.05. Para determinar diferencias en abundancia por zonas, se realizaron modelos lineales generalizados (MLG) con distribución Poisson utilizando la función log. En caso de obtener diferencias significativas, se realizaron comparaciones pareadas de acuerdo con Hothorn et al. (2008).
Para analizar las diferencias limnológicas y de heterogeneidad espacial entre zonas y temporadas, se realizaron pruebas de normalidad (Shapiro-Wilk´s) y homocedasticidad (Bartlett) y en caso de pasar dichas pruebas, se realizaron Anovas paramétricas tomando como nivel de significancia p < 0.05. En los Anovas que se encontraron diferencias significativas, se realizaron comparaciones pareadas entre zonas (Tukey-Kramer, Honestly significant difference; HSD).
Para determinar de manera exploratoria la dinámica ambiental del lago de Zacapu, se utilizaron las variables fisicoquímicas que presentaron diferencias significativas y el índice de heterogeneidad espacial obtenido (ver análisis anteriores). Con dichas variables se generó un análisis de correlación múltiple para evitar colinealidad en el análisis de componentes principales (ACP) que se generó posteriormente y determinar si existen agrupaciones de muestras entre zonas y entre temporadas, así como las variables con mayor porcentaje de explicación en este análisis de ordenamiento. Dicho análisis permite simplificar la complejidad de espacios muestrales multidimensionales sin perder información de las diferentes variables utilizadas (e.g., variables fisicoquímicas).
Finalmente, se realizó una regresión múltiple de Poisson paso-a-paso-hacia-adelante (“forward stepwise”) utilizando un MLG para determinar la relación entre la abundancia de A. andersoni y las variables fisicoquímicas significativamente diferentes entre zonas. Para la comparación de modelos se utilizó un análisis de chi-cuadrada. Los análisis se realizaron utilizando como herramienta el programa R (R Core Team, 2014) y las librerías Vegan (Oksanen et al., 2019), MASS (Venables y Ripley, 2002) y Multcomp (Hothorn et al., 2008).
Resultados
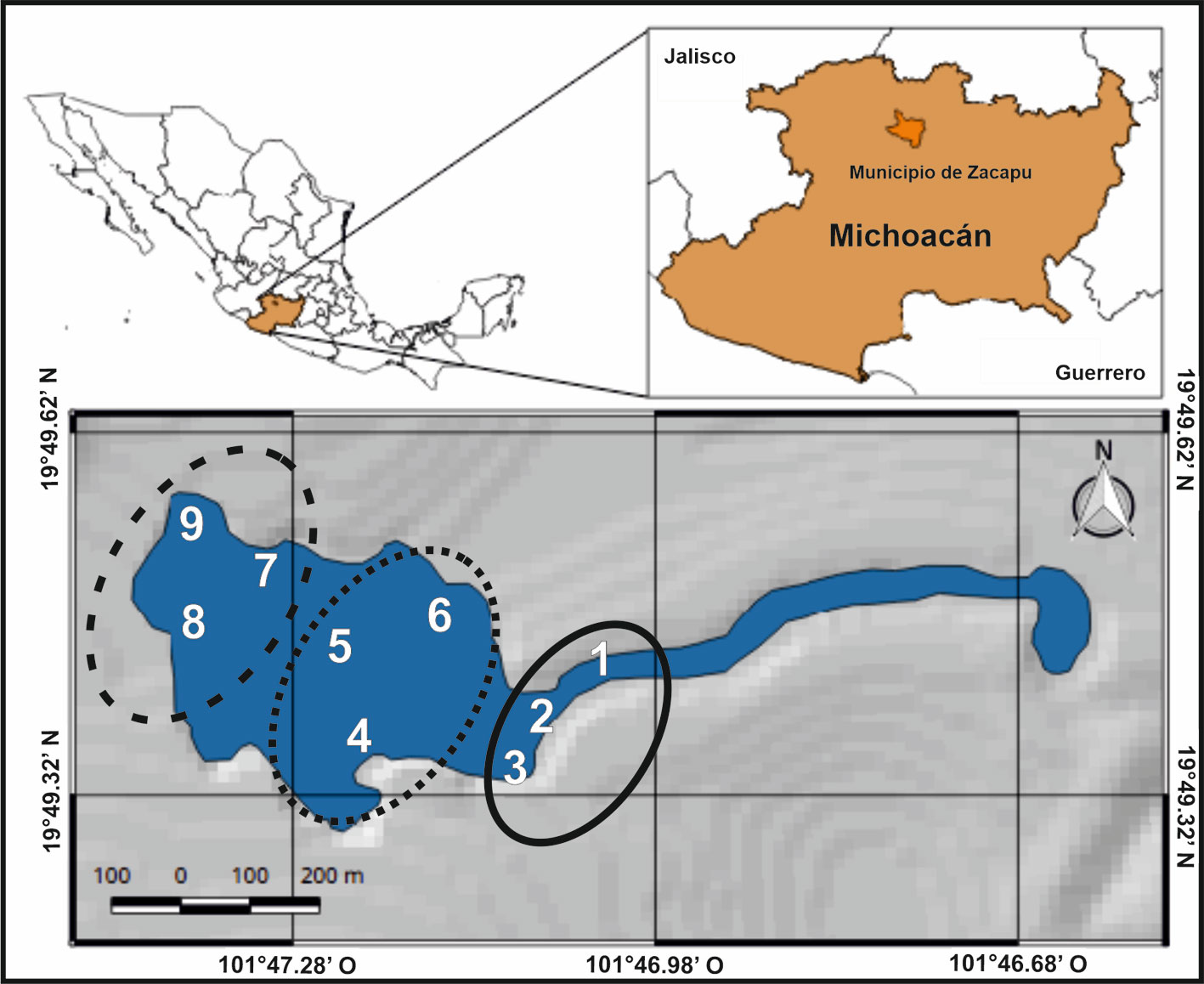
Considerando las 3 zonas muestreadas, se capturaron 136 individuos. El Anova de la abundancia de los individuos registrados mostró diferencias significativas en los machos en ambas temporadas (f = 6.63, p = 0.02) y en las hembras (f = 4.85, p = 0.04), mientras que los juveniles no mostraron diferencias significativas (f = 0.50, p = 0.48) (tabla 1). Con base en el MLG, la abundancia de A. andersoni presentó diferencias significativas entre zonas (p < 0.005). Las comparaciones pareadas mostraron diferencias significativas entre la zona centro y oeste (p < 0.005), y oeste y este (p < 0.005), mientras que la zona centro y este no presentaron diferencias significativas (p = 0.73).
Durante la temporada de lluvias (mayo-junio) se obtuvo una proporción sexual de 1.42:1 (machos : hembras) y 5 juveniles; mientras que durante la temporada de secas (noviembre-diciembre) se obtuvieron 43 individuos con una proporción sexual de 1:1.2 y 5 juveniles. La zona oeste registró la mayor abundancia de individuos en ambas temporadas y en todas las zonas se obtuvo la presencia de al menos un juvenil durante alguna temporada (fig. 2). Los datos morfométricos de machos y hembras en A. andersoni se ajustaron al modelo de distribución normal y homocedasticidad en ambas temporadas (Shapiro p < 0.05; Bartlett p < 0.05). Para la época de lluvias, el Anova no mostró diferencias significativas en LHC (f = 0.28, p = 0.59), machos: 115.29 ± 8.82 mm (N = 77) vs. hembras: 119.50 ± 11.76 mm (N = 54), ni en LT (f = 0.72, p = 0.87), machos: 221.68 ± 20.51 mm (N = 77) vs. hembras: 215.05 ± 22.40 mm (N = 54), pero cabe mencionar que la LHC en las hembras es mayor y la LT es mayor en los machos. Para la época de secas tampoco se obtuvieron diferencias significativas entre machos y hembras en LHC (f = 1.02, p = 0.32), machos: 119.22 ± 7.83 mm (N = 18) vs. hembras: 118.60 ± 6.4 mm (N = 23), ni en LT (f = 0.13, p = 0.71), machos: 226.3 ± 12.8 mm (N = 18) vs. hembras: 215.52 ± 11.7 mm (N = 23).
Tabla 1
Análisis de varianza (Anova) para la abundancia de los individuos registrados (machos, hembras, juveniles) por temporada (lluvias y secas). Valores en negritas representan diferencias significativas.
| Parámetro | Anova | ||||
| Df | Sum Sq | Mean Sq | F value | Pr
(>F) |
|
| Machos | 1 | 193.4 | 193.39 | 6.63 | 0.02 |
| Hembras | 1 | 53.39 | 53.39 | 4.85 | 0.04 |
| Juveniles | 1 | 0.50 | 0.50 | 0.50 | 0.48 |
Los resultados de temperatura obtenidos por los registradores de datos no presentaron un ajuste al modelo de normalidad (Shapiro w = 0.84, p = 0.008), ni homocedasticidad (Bartlett k = 4.96, p = 0.02) y con base en un Anova no paramétrico, no se obtuvieron diferencias significativas entre las zonas ni entre temporada; zona este (f = 5.6, p = 0.25), zona centro (f = 033, p = 0.67), zona oeste (f = 1.74, p = 0.41). Por otro lado, en la prueba de normalidad (Shapiro) para las variables fisicoquímicas para ambas temporadas, se obtuvo una diferencia significativa con relación al modelo entre zonas y por temporadas (p < 0.05), por lo que se realizó un análisis de varianza no paramétrico para dichas variables. PM no mostró diferencias significativas (k = 0.10, p = 0.74) tanto en temporada de lluvias, como de secas, mientras que las demás variables mostraron diferencias significativas (p < 0.05). El Anova no paramétrico mostró diferencias significativas en la mayoría de las variables durante la temporada de secas (CE, SDT, O2 y pH), mientras que en temporada de lluvias, solamente las variables To y pH mostraron diferencias significativas (p < 0.05). Las comparaciones pareadas no mostraron diferencias significativas entre las zonas este y centro en ambas temporadas (tabla 2). La heterogeneidad espacial presentó diferencias significativas (p > 0.005) y las comparaciones pareadas mostraron que la zona con mayor heterogeneidad fue la zona oeste (13 atributos presentes), la cual no presentó diferencias con la zona este (10 atributos presentes), pero sí con la zona centro (8 atributos presentes); la zona este y centro no presentaron diferencias significativas en las comparaciones pareadas (tabla 3).
Con base en el ACP, se obtuvo una variación explicada acumulada de 81% en el segundo componente (CP2). El O2 fue la variable con mayor contribución en el CP1, mientras que la profundidad total y la heterogeneidad espacial fueron las variables con mayor aporte en el CP2. Sin embargo, con base en el agrupamiento, no se observa una diferencia entre zonas y temporadas considerando las variables fisicoquímicas (fig. 3; tabla 4).
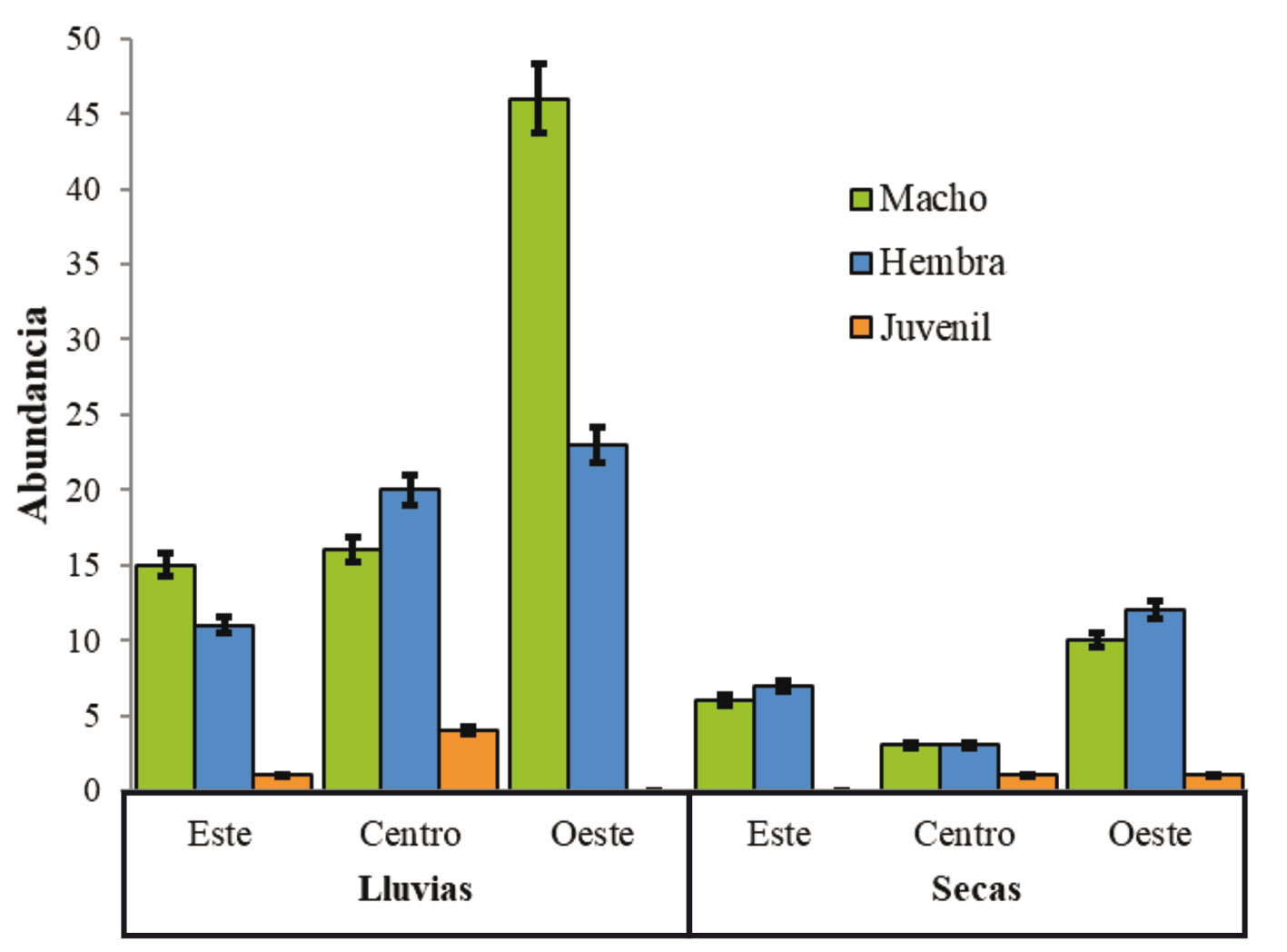
La regresión múltiple basada en el MLG con distribución Poisson para determinar la relación entre la abundancia de A. andersoni y las variables fisicoquímicas y la heterogeneidad espacial, mostró que el modelo que incluye todas las variables (AIC = 75.87) no fue significativamente diferente al modelo que solo incluye temperatura y heterogeneidad espacial (AIC = 75.33; p = 0.22). La relación obtenida fue positiva tanto para temperatura como para la heterogeneidad espacial (fig. 4).

Discusión
El principal factor que influye en la distribución, presencia y abundancia de especies es la relación de los factores ambientales con la historia de vida de las especies (Acevedo et al., 2011; Díaz et al., 2012; Domitrovic et al., 2013; Escalera-Vázquez y Zambrano, 2010; Torruco-González et al., 2018). Particularmente, para los ambistomátidos la estacionalidad, morfología, tipo y características fisicoquímicas del cuerpo de agua, son factores altamente relacionados con la presencia y abundancia de individuos y especies de este grupo de salamandras (Escalera-Vázquez et al., 2018; Hernández-Guzmán et al., 2019; Shaffer, 1989).
Nuestros resultados muestran diferencias en la abundancia de A. andersoni por temporada y por zona dentro del lago de Zacapu, particularmente una mayor abundancia en la zona oeste durante la temporada de lluvias. De igual forma, se presenta una diferencia en el radio sexual entre la temporada de lluvias y la temporada de secas, lo que sugiere que hay zonas específicas de reproducción dentro del cuerpo de agua y que en época de lluvias se conglomeran los individuos para reproducirse. Esto coincide con la historia de vida de las especies de Norteamérica (A. jeffersonianum, A. maculatum, A. annulatum), las cuales presentan una sincronización entre la temporada de lluvias con el inicio de la época de reproducción (Douglas, 1979; Homan et al., 2018; Kirk et al., 2019; Semlitsch et al., 2014; Semlitsch y Anderson, 2016). Cabe mencionar que, a diferencia de la especie utilizada en el presente estudio, las especies mencionadas requieren de metamorfosis para completar su ciclo de vida, por lo que la sincronía con procesos reproductivos está altamente relacionada con la presencia de cuerpos de agua. Por otro lado, A. andersoni es neoténica y no requiere de metamorfosis para completar su ciclo de vida, por lo que los resultados obtenidos en el presente estudio y su similitud con los ciclos reproductivos de otras especies de Ambystoma, sugiere que A. andersoni requiere de cambios ambientales sutiles (e.g., en la temperatura por la influencia de lluvias) (Sexton et al., 1990). Estos cambios pueden estar asociados a la abundancia de presas en el lago de Zacapu y a que la época reproductiva de A. andersoni coincide con la época reproductiva de invertebrados (Moncayo-Estrada, 1996; Tapia-Alcantar, 2015). De igual forma, la abundancia de las especies neoténicas del género Ambystoma están asociadas a ambientes lénticos, que generalmente presentan barreras biogeográficas de dispersión relacionado a una poca abundancia en áreas pequeñas (Lemos-Espinal et al., 2016; Rodríguez-Amador et al., 2013). Con base en esto, la abundancia total de A. andersoni encontrada en el presente estudio es similar a la encontrada para A. mexicanum, la cual habita en el lago de Xochimilco (Zambrano-González et al., 2003).
Tabla 2
Análisis de Varianza (Anova) de las variables fisicoquímicas To = temperatura (oC); CE = conductividad específica (µS/cm); O2 = oxígeno disuelto (mg/l); pH = potencial hidrógeno entre zonas (este, centro, oeste); temporadas (lluvias y secas) y comparaciones pareadas (Tukey-HSD). Variables en negritas representan diferencias significativas.
| Variables | Anova | TukeyHSD
(p < 0.05) |
||||
| Df | Sum Sq | Mean Sq | F value | P Value | ||
| Lluvias | ||||||
| To | 2 | 41.7 | 20.861 | 6.156 | 0.002 | O-E |
| CE | 2 | 1120 | 559.8 | 0.319 | 0.727 | – |
| SDT | 2 | 517 | 258.7 | 0.349 | 0.705 | – |
| O2 | 2 | 33 | 16.40 | 0.492 | 0.612 | – |
| pH | 2 | 4.28 | 2.1410 | 4.151 | 0.017 | O-E |
| Secas | ||||||
| To | 2 | 6.5 | 3.271 | 0.602 | 0.549 | – |
| CE | 2 | 331.5 | 165.75 | 17.61 | < 0.001 | O-C; O-E |
| STD | 2 | 107.9 | 53.94 | 13.41 | < 0.001 | O-C; O-E |
| O2 | 2 | 53.5 | 26.747 | 4.619 | 0.0114 | O-C |
| pH | 2 | 1.038 | 0.5189 | 10.6 | < 0.001 | O-C; O-E |
El comportamiento fisicoquímico y biológico de un lago está influenciado por las características que presenta como forma, tamaño y profundidad, por lo que fenómenos como la circulación de nutrientes, estratificación térmica, productividad y eutrofización responden a procesos hidrológicos estacionales, modificando temporalmente factores como el pH, temperatura, oxígeno disuelto, y conductividad, los cuales influyen en abundancia de los individuos de Ambystoma (Contreras et al., 2009; Freda, 1986; Kiesecker, 1996; Kirk et al., 2019; Lemos-Espinal et al., 2016, 2017).
Nuestros resultados muestran que, de manera general, el lago de Zacapu presenta poca variación limnológica por zona y por temporada con base en las variables fisicoquímicas, lo que sugiere que en términos ambientales todo el lago se mantiene estable a lo largo del tiempo. Aun cuando obtuvimos diferencias significativas en To y pH, estas diferencias están relacionadas a la variación dentro de cada sitio, aumentando la probabilidad de tener diferencias entre las muestras y entre sitios. La estabilidad del lago de Zacapu se puede explicar por la dinámica de corrientes influenciadas por la presencia de manantiales que mantienen un recambio de agua constante, las cuales promueven una homogenización de todo el cuerpo de agua, y que está influenciada principalmente por la profundidad y morfología (Moncayo-Estrada, 1996). Por otro lado, la variación en SDT y CE está asociada principalmente a la temporada de lluvias, que en conjunto con las corrientes y el ingreso del agua pluvial proveniente de la zona urbana (principalmente en la zona oeste), ocasionan un ingreso y resuspensión de sedimento en el cuerpo de agua (Ayala-Ramírez et al., 2007; Bhattrai et al., 2017; Margalef, 1983; Roselli et al., 2009).
Tabla 3
Índice de heterogeneidad por sitio basado en Winemiller (2008), mostrando la media (x) y la desviación estándar (DS) de cada zona. Las letras en superíndices denotan no-diferencia significativa.
| Zona | Sitio | Índice de heterogeneidad | x ± DS |
| Este | 1 | S = 0.55 | S = 0.37 ± 13.35 A,B |
| 2 | S = 0.22 | ||
| 3 | S = 0.33 | ||
| Centro | 4 | S = 0.22 | S = 0.26 ± 0.17 B |
| 5 | S = 0.11 | ||
| 6 | S = 0.44 | ||
| Oeste | 7 | S = 0.55 | S = 0.51 ± 0.06 A |
| 8 | S = 0.44 | ||
| 9 | S = 0.55 |
Con base en nuestros resultados, se obtuvo una diferencia significativa en la temperatura entre zonas en la época de lluvias y se obtuvo una mayor abundancia de machos en todos los sitios; ésto sugiere que los machos son los primeros en migrar a sitios de reproducción en respuesta a la disminución de la temperatura (Sexton et al., 1990). Cabe resaltar que, al considerar de manera general el comportamiento limnológico del lago de Zacapu (resultados obtenidos con los registradores in situ), éste presenta condiciones relativamente homogéneas y que los pequeños cambios en temperatura pueden ser activadores de migración a sitios con mayor heterogeneidad (e.g., a la zona oeste). Por otro lado, la menor abundancia de A. andersoni en el presente trabajo se obtuvo en la temporada de secas, por lo que nuestros resultados sugieren que puede haber una asociación de poca precipitación en dicha temporada, ya que se reduce el movimiento de las corrientes superficiales y de fondo, evitando que los individuos se agrupen para reproducirse, lo que promueve una menor probabilidad de captura, y por ende obtener una menor abundancia en zonas específicas (Douglas, 1979; Lemos-Espinal et al., 2016, 2017; Sexton et al., 1990).
Finalmente, la heterogeneidad espacial del hábitat promueve un incremento en la abundancia de diferentes especies del género Ambystoma (e.g., A. maculatum, A. rivulare, A. leorae, A. altamirani). Dicha heterogeneidad está altamente relacionada con la presencia de manantiales, cobertura vegetal, alta diversidad de especies vegetales subacuáticas y diversidad de sustrato (Contreras et al., 2009; Jenkins et al., 2006; Lemos-Espinal et al., 2016, 2017). Nuestros resultados mostraron una relación positiva entre la heterogeneidad espacial y la temperatura con la abundancia de A. andersoni. Este nivel de heterogeneidad espacial está relacionado principalmente a la presencia de vegetación sumergida y subacuática, lo que sugiere que estos sitios pueden estar relacionados a la presencia de recursos alimenticios, ser usados como sitios de refugio, reproducción y ovoposición; ya que los sitios espacialmente heterogéneos están relacionados con altas abundancias de ambystomátidos (Escalera-Vázquez et al., 2018; Huacuz-Elías, 2008; Montes-Calderón et al., 2011; Ruiz-Martínez et al., 2014; Shaffer, 1989). Lo anterior se demuestra en el presente estudio, ya que la mayor abundancia de individuos se obtuvo en la zona oeste, la cual presentó una heterogeneidad significativamente mayor en comparación con la zona centro y este, aunque esta última no presentó una diferencia estadísticamente diferente.
Tabla 4
Se muestra el ACP con base en variables fisicoquímicas y la heterogeneidad, considerando las zonas de muestreo en ambas temporadas. Valores en negritas corresponden a las variables con mayor contribución en los 2 componentes principales (CP). Los acrónimos corresponden a los utilizados en la tabla 2.
| Variables | CP1 | CP2 |
| PM | 0.40 | -0.64 |
| T° | -0.06 | -0.06 |
| CE | -0.01 | 0.0002 |
| O2 | -0.83 | -0.54 |
| pH | -0.05 | -0.05 |
| Heterogeneidad | -0.40 | 0.53 |
| Desviación estándar | 0.33 | 0.24 |
| Proporción de varianza | 0.52 | 0.30 |
| Proporción acumulada | 0.52 | 0.81 |
Los resultados presentados en esta investigación, muestran información relevante sobre la importancia de las características ambientales relacionadas a la presencia y abundancia de A. andersoni y generan información relevante, misma que puede ser utilizada para sugerir planes de manejo y conservación in situ. Un ejemplo de esto, es proponer zonas potenciales de conservación, calendarización de zonas pesca, así como técnicas de pesca de bajo impacto a la vegetación subacuática. Lo anterior, de manera directa promoverá el mantenimiento de especies de importancia comercial y cultural, así como los procesos ecológicos necesarios para mantener los servicios ecosistémicos y la biodiversidad acuática del lago de Zacapu.
Agradecimientos
A la Maestría en Ciencias en Ecología Integrativa del Instituto de Investigaciones sobre los Recursos Naturales; al proyecto Núm. 264235, otorgado por el Consejo Nacional de Ciencia y Tecnología (Conacyt), Convocatoria I0027-2015-01. Al Conacyt por el otorgamiento de la beca Núm. 619694 otorgada a RVV y a la unión de pescadores del lago de Zacapu por su apoyo durante los trabajos de campo. La recolecta de individuos se realizó con el permiso de colecta otorgado por la Secretaría del Medio Ambiente y Recursos Naturales (Semarnat) Núm. SGPA/DGVS/10398/17.
Referencias
Acevedo, P., Rea1, R. y Gortázar, C. (2011). Favorabilidad ecogeográfica para el corzo: distribución y abundancia. Pirineos. Revista de Ecología de Montaña, 166, 9–27. https://doi.org/10.3989/pirineos.2011.166001
Álvarez-Silva, L. O., Herrerías, Y., Huacuz-Elías, D. C. y Álvarez-Ramírez, M. A. (2014). Caracterización de la infección parasitaria en Ambystoma andersoni Krebs & Brandon, 1984 en la Laguna de Zacapu‚ Michoacán‚ México. II Simposio Colombiano de Patógenos y Huéspedes en Vida Silvestre, 10, 187–188.
Ayala-Ramírez, G. G., Ruiz -Sevilla, G. y Chacón-Torres, A. (2007). La laguna de Zacapu, Michoacán. En G. de La Lanza-Espino (Ed.), Las aguas interiores de México: conceptos y casos (pp. 268–284). Ciudad de México: AGT.
Bhattrai, B. D., Kwak, S., Choi, K. y Heo, W. (2017). Assessment of long-term physicochemical water quality variations by PCA technique in Lake Hwajinpo, South Korea. Journal of Environmental Protection, 8, 1636–1651. https://doi.org/10.4236/jep.2017.813101
Begon, M., Townsend, C. R. y Harper, J. L. (2006). Ecology: from individuals to ecosystems. Malden, Massachusetts: Blackwell Publishing.
Chambers, D. L. (2011). Increased conductivity affects corticosterone levels and prey consumption in larval amphibians. Journal of Herpetology, 45, 219–223. https://doi.org/10.1670/09-211.1
Clipp, H. y Anderson, J. (2014). Environmental and anthropogenic factors influencing salamanders in riparian forests: a review. Forests, 5, 2679–2702. https://doi.org/10.3390/f5112679
Cole, E. M., Bustamante, M. R., Almeida-Reinoso, D. y Funk, W. C. (2014). Spatial and temporal variation in population dynamics of Andean frogs: effects of forest disturbance and evidence for declines. Global Ecology and Conservation, 1, 60–70. https://doi.org/10.1016/j.gecco.2014.06.002
Contreras, V., Martínez-Meyer, E., Valiente, E. y Zambrano, L. (2009). Recent decline and potential distribution in the last remnant area of the microendemic Mexican axolotl (Ambystoma mexicanum). Biological Conservation, 142, 2881–2885. https://doi.org/10.1016/j.biocon.2009.07.008
Cushman, S. A. (2006). Effects of habitat loss and fragmentation on amphibians: a review and prospectus. Biological Conservation, 128, 231–240. https://doi.org/10.1016/j.biocon.2005.09.031
Díaz-Argüero, M. (1997). Diagnóstico del estado trófico de la laguna de Zacapu, Michoacán (Tesis de maestría). Escuela Nacional de Ciencias Biológicas. Instituto Politécnico Nacional. Ciudad de México, México.
Díaz, V., Sosa-Ramírez, J. y Pérez-Salicrup, D. R. (2012). Distribución y abundancia de las especies arbóreas y arbustivas en la sierra fría, Aguascalientes, México. Polibotánica, 34, 99–126
Domitrovic, Y. Z., Neiff, J. J. y Vallejos, S. V. (2013). Factores que regulan la distribution y abundancia del perifíton em ambientes lenticos. En A. Schwarzbold, A. L. Burliga y L. C. Torgan (Eds.), Ecologia do perifíton (pp.103–130). São Carlos: Rima.
Douglas, M. E. (1979). Migration and sexual selection in Ambystoma jeffersonianum. Canadian Journal of Zoology, 57, 2303–2310. https://doi.org/10.1139/z79-299
Escalera-Vázquez, L. H. y Zambrano, L. (2010). The effect of seasonal variation in abiotic factors on fish community structure in temporary and permanent pools in a tropical wetland. Freshwater Biology, 55, 2557–2569. https://doi.org/10.1111/j.1365-2427.2010.02486.x
Escalera-Vázquez, L. H., Hernández-Guzmán, R., Soto-Rojas, C. y Suazo-Ortuño, I. (2018). Predicting Ambystoma ordinarium habitat in Central México using species distribution models. Herpetologica, 74, 117–126. https://doi.org/10.1655/Herpetologica-D-16-00078.1
Fernández, G. A. y Miranda, A. V. (1998). Zacapu 450. Encuentro de un pueblo con su pasado. A 450 años de su congregación 1548–1998. Zacapu, Michoacán: H. Ayuntamiento de Zacapu.
Freda, J. (1986). The influence of acidic pond water on amphibians: a review. Water, Air and Soil Pollution, 30, 439–50.
Gómez-Rodríguez, J. (2013). Respuesta morfológica e inmuno-
lógica de Ambystoma andersoni en cuatro condiciones ambientales de la laguna de Zacapu, Michoacán (Tesis de maestría). Programa Institucional de Maestría en Ciencias Biológicas. Facultad de Biología. Universidad Michoacana de San Nicolás de Hidalgo. Morelia.
Guzmán-Ávila, J. N. (1985). La desecación de la ciénaga de Zacapu, orígenes y consecuencias. Tzintzun: Revista de Estudios Históricos, 6, 26–37.
Hernández-Guzmán, R., Escalera-Vázquez, L. H. y Suazo-Ortuño I. (2019). Predicting Ambystoma ordinarium distribution under different climate scenarios in Central Mexico. The Herpetological Journal, 29, 71–81. https://doi.org/10.33256/hj29.2.7181
Homan, R. N., Holgerson, M. A. y Biga, L. M. (2018). A long-term demographic study of a spotted salamander (Ambystoma maculatum) population in Central Ohio. Herpetologica, 74, 109–116. https://doi.org/10.1655/Herpetologica-D-17-00067.1
Hothorn, T., Bretz, F. y Westfall, P. (2008). Simultaneous inference in general parametric models. Biometrical Journal, 50, 346–363. https://doi.org/10.1002/bimj.200810425
Huacuz-Elías, D. C. (2008). Biología y conservación del género Ambystoma, en Michoacán, México (Tesis doctoral). Universidad de Salamanca, España.
INEGI (Instituto Nacional de Estadística y Geografía ). (2020). Censo de Población y Vivienda. Recuperado el 14 septiembre, 2020 de: http://cuentame.inegi.org.mx
Jenkins, C. L., McGarigal, K. y Timm, B. C. (2006). Orientation of movements and habitat selection in a spatially structured population of marbled salamanders (Ambystoma opacum). Journal of Herpetology, 40, 240–248.
Juliano, S. A. (2007). Population dynamics. Journal of the American Mosquito Control Association, 23, 265–275. https://doi.org/10.2987/8756-971X(2007)23[265:PD]2.0.CO;2
Kiesecker, J. (1996). pH-mediated predator-prey interactions between Ambystoma tigrinum and Pseudacris triseriata. Ecological Applications, 6, 1325–1331. https://doi.org/10.
2307/2269610
Kirk, M. A., Galatowitsch, M. L. y Wissinger, S. A. (2019). Seasonal differences in climate change explain a lack of multi-decadal shifts in population characteristics of a pond breeding salamander. Plos One, 14, e0222097. https://doi.org/10.1371/journal.pone.0222097
Krebs, S. L. y Brandon, R. A. (1984). A new species of salamander (Family Ambystomatidae) from Michoacán, México. Herpetologica, 40, 238–245.
Lemos-Espinal, J. A., Smith, G. R., Ruiz, Á. H. y Ayala, R. M. (2016). Stream use and population characteristics of the endangered salamander, Ambystoma altamirani, from the Arroyo Los Axolotes, State of Mexico, Mexico. The Southwestern Naturalist, 61, 28–32.
Lemos-Espinal, J. A., Smith, G. R., Zamora, A. B. E., WoolrichPiña, G. y Ayala, R. M. (2017). Natural history of the critically endangered salamander Ambystoma leorae (Caudata: Ambystomatidae) from the río Tonatzin, Mexico. Phyllomedusa: Journal of Herpetology, 16, 3. https://doi.org/10.11606/issn.2316-9079.v16i1p3-11
Margalef, R. (1983). Limnología. Barcelona. Omega.
Moncayo-Estrada, R. (1996). Estructura y función de la comunidad de peces de la laguna de Zacapu, Michoacán, México (Tesis de maestría). Centro Interdisciplinario de Ciencias Marinas, Instituto Politécnico Nacional. La Paz, Baja California Sur, México.
Montes-Calderón, M. A., Alvarado-Díaz, J. y Suazo-Ortuño, I. (2011). Abundancia, actividad espacial y crecimiento de
Ambystoma ordinarium Taylor 1940 (Caudata: Ambysto-
matidae) en Michoacán, México. Biológicas, 13, 50–53.
Oksanen, J., Blanchet, F. G., Kindt, R., Legendre, P., Minchin, P. R., O’Hara, R. B. et al. (2019). Vegan: community ecology package. R package version 2.07.
Peterman, W. E. y Semlitsch, R. D. (2013). Fine-scale habitat associations of a terrestrial Salamander: The role of environmental gradients and implications for population Dynamics. Plos One, 8, e62184. https://doi.org/10.1371/journal.pone.0062184
Peterman, W. E. y Semlitsch, R. D. (2014). Spatial variation in water loss predicts terrestrial salamander distribution and population dynamics. Oecologia, 176, 357–369. https://doi.org/10.1007/s00442-014-3041-4
Pierce, B. A. (1985). Acid tolerance in amphibians. BioScience, 35, 239–243. https://doi.org/10.2307/1310132
Portnoy, J. W. (1990). Breeding biology of the spotted salamander Ambystoma maculatum (Shaw) in acidic temporary ponds at Cape Cod, USA. Biological Conservation, 53, 61–75. https://doi.org/10.1016/0006-3207(90)90063-U
R Core Team (2014). R: a language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria.
RAMSAR (2018). Ficha Informativa de los Humedales de Ramsar (FIR). Conanp. Recuperado el 7 de junio, 2018 de: http://www.conanp.gob.mx/
Rodríguez-Amador, R., Monks, S. y Pulido-Flores, G. (2013). Primer reporte helmintológico de Ambystoma velasci Dugés, 1888 de Lago de Tecocomulco, Hidalgo, México. En G. Pulido-Flores y S. Monks (Eds.), Estudios científicos en el estado de Hidalgo y zonas aledañas, Volumen II (pp. 113–120). Lincoln, Nebraska: Zea Books. https://doi.org/10.13140/2.1.1153.1844
Roselli, L., Fabbrocini, A., Manzo, C. y D’Adamo, R. (2009). Hydrological heterogeneity, nutrient dynamics and water quality of a non-tidal lentic ecosystem (Lesina Lagoon, Italy). Estuarine, Coastal and Shelf Science, 84, 539–552. https://doi.org/10.1016/j.ecss.2009.07.023
Ruiz-Martínez, L., Alvarado-Díaz. J., Suazo-Ortuño, I. y Pérez-Munguía, R. (2014). Diet of Ambystoma ordinarium (Caudata: Ambystomatidae) in undisturbed and disturbed segments of a mountain stream in the trans-Mexican Volcanic Belt. Salamandra, 50, 63–70.
Semlitsch, R. D., Scott, D. E., Pechmann, J. H. K. y Gibbons, J. W. (1996). Structure and dynamics of an amphibian community: evidence from a 16-year study of a natural pond. En M. L. Cody y J. Smallwood (Eds.), Long-term studies of vertebrate communities (pp. 217–248). San Diego, California: Academic Press, Inc. https://doi.org/10.1016/B978-012178075-3/50010-6
Semlitsch, R. D., Anderson, T. L., Osbourn, M. S. y Ousterhout, B. H. (2014). Structure and dynamics of ringed salamander (Ambystoma annulatum) populations in Missouri. Herpetologica, 70,14–22. https://doi.org/10.1655/HERPETOLOGICA-D-13-00074
Semlitsch, R. D. y Anderson, T. L. (2016). Structure and dynamics of spotted salamander (Ambystoma maculatum) populations in Missouri. Herpetologica, 72,81–89. https://doi.org/10.1655/HERPETOLOGICA-D-15-00049
Sexton, O. J., Phillips, C. y Bramble, J. E. (1990). The effects of temperature and precipitation on the breeding migration of the spotted salamander (Ambystoma maculatum). Copeia, 1990, 781–787. https://doi.org/10.2307/1446443
Shaffer, H. B. (1989). Natural history, ecology and evolution of the Mexican “Axolotls”. Axolotl Newsletter, 18, 5–19.
Tapia-Alcantar, R. (2015). Dieta del Ambystoma andersoni endémico al ANP de el lago de Zacapu Michoacán, México (Tesis). Facultad de Biología, Universidad Michoacana de San Nicolás de Hidalgo. Morelia, Mich. México.
Torruco, D., González-Solis, A. y Torruco-González, A. D. (2018). Diversidad y distribución de peces y su relación con variables ambientales, en el sur del Golfo de México. Revista de Biología Tropical, 66, 438–456. http://dx.doi.org/10.15517/rbt.v66i1.26255
UICN (Unión Internacional para la Conservación de la Naturaleza). (2015). Species survival commission amphibian specialist group: Ambystoma andersoni. The IUCN Red List of Threatened Species. Recuperado el 5 de octubre, 2019 de: https://www.iucnredlist.org/species/59051/176772780
Venables, W. N. y Ripley, B. D. (2002). Modern applied statistics with S. New York: Springer.
Whiteman, H. H., Wissinger, S. A. y Bohonak, A. J. (1994). Seasonal movement patterns in a subalpine population of the tiger salamander, Ambystoma tigrinum nebulosum. Canadian Journal of Zoology, 72, 1780–1787. https://doi.org/10.1139/z94-241
Winemiller, K. O., López-Fernández, H., Taphorn, D. C., Nico, L. G. y Duque, A. B. (2008). Fish assemblages of the Casiquiare river, a corridor and zoogeographical filter for dispersal between the Orinoco and Amazon basins. Journal of Biogeography, 35, 1551–1563. https://doi.org/10.1111/j.1365-2699.2008.01917.x
Zambrano-González, L., Reynoso, V. H. y Herrera, G. (2003). Abundancia y estructura poblacional del axolotl (Ambystoma mexicanum) en los sistemas dulceacuícolas de Xochimilco y Chalco. Instituto de Biología, Universidad Nacional Autónoma de México. Informe final SNIBCONABIO proyecto No. AS004. México D.F.
Zambrano, L., Cortés, H. y Merlo-Galeazzi, A. (2015). Eat and be eaten: reciprocal predation between axolotls (Ambystoma mexicanum) and crayfish (Cambarellus montezumae) as they grow in size. Marine and Freshwater Behaviour and Physiology, 48, 13–23. https://doi.org/10.1080/10236244.2014.970806
Zambrano, L., Valiente, E. y Vander-Zanden, M. J. (2010). Food web overlap among native axolotl (Ambystoma mexicanum) and two exotic fishes: carp (Cyprinus carpio) and tilapia (Oreochromis niloticus) in Xochimilco, Mexico City. Biological Invasions, 12, 3061–3069. https://doi.org/10.1007/s10530-010-9697-8
Zylstra, E. R., Steidl, R. J., Swann, D. E. y Ratzlaff, K. (2015). Hydrologic variability governs population dynamics of a vulnerable amphibian in an arid environment. Plos One, 10, e0125670. https://doi.org/10.1371/journal.pone.0125670