Distribución y parámetros entomológicos de Anopheles (Anopheles) calderoni (Diptera: Culicidae) de Colombia
Yadira Galeano-Castañeda a, Giovan F. Gómez a, b, Juan C. Hernández-Valencia a
y Margarita M. Correa a, *
a Grupo de Microbiología Molecular, Escuela de Microbiología, Universidad de Antioquia, calle 70 No. 52-21, Medellín, Colombia
b Grupo Investigación Ciencias Forenses y de la Salud, Tecnológico de Antioquia – Institución Universitaria, calle 78B No. 72A-220, Medellín, Colombia
*Autor para correspondencia: margarita.correao@udea.edu.co (M.M. Correa)
Resumen
Anopheles calderoni, considerado vector potencial de malaria, fue reportado en la última década en Colombia. Debido a su registro reciente y a la confusión con especies cercanas, se conoce poco sobre su distribución real e importancia epidemiológica. En este trabajo se determinó la distribución y parámetros entomológicos de A. calderoni en diversas localidades de Colombia. Se recolectaron especímenes de Anopheles en 10 departamentos de varias regiones de Colombia, entre 2009 y 2015. Se caracterizó la región ITS2 para los individuos recolectados y se realizó un análisis bioinformático para predecir su identificación taxonómica mediante una prueba molecular. Se determinó la infección natural por Plasmodium y se calcularon parámetros entomológicos. Se registraron especímenes de A. calderoni en 4 departamentos del oeste colombiano. La tasa de picadura más alta (14.7 picaduras por noche) se presentó en Tumaco, en el sureste de Colombia, donde se detectó un ejemplar infectado por Plasmodium falciparum. El análisis bioinformático produjo patrones de ITS2 que permiten diferenciar a A. calderoni. La presencia de esta especie en regiones con características ecológicas diversas, sugiere que tolera diferentes ambientes y su infección con parásitos Plasmodium, indica su posible papel como vector de importancia local.
Palabras clave:
Malaria; Vectores; ITS2; Infección natural; Plasmodium
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Distribution and entomological parameters of Anopheles (Anopheles) calderoni (Diptera: Culicidae) from Colombia
Abstract
Anopheles calderoni considered a potential malaria vector, was only reported in Colombia during the last decade. Due to its recent report and the confusion with closely related species, little is known about the actual distribution and epidemiological importance of this species. In this work, the distribution and entomological parameters of A. calderoni were determined in several localities in Colombia. Anopheles specimens were collected in 10 departments from various regions in Colombia between 2009 and 2015. We characterized the ITS2 region for the collected specimens and performed a bioinformatic analysis to predict its taxonomic identification using a molecular test. We also determined the natural infection by Plasmodium and calculated entomological parameters. A. calderoni was registered in 4 departments in west Colombia. The highest biting rate (14.7 bites per night) was detected in Tumaco, SW Colombia, where a specimen was found to be infected by Plasmodium falciparum. The bionformatic analysis generated an ITS2 pattern that allows differentiation of this species. The presence of A. calderoni in regions with ecological diverse characteristics suggests that this species tolerates varied environments, and its infection with Plasmodium parasites indicates its role as a vector of local importance.
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Keywords:
Malaria; Vectors; ITS2; Natural infection; Plasmodium
Introducción
Anopheles calderoni especie perteneciente a la serie Arribalzagia, se encuentra incluida en el grupo Punctimacula, el cual está compuesto por las siguientes especies morfológicamente similares en estado adulto: Anopheles (Anopheles) punctimacula, Anopheles (Anopheles) guarao y Anopheles (Anopheles) malefactor (Rubio-Palis y Moreno, 2003; Wilkerson, 1991). Anopheles calderoni se ha registrado en Ecuador (González et al., 2010), Venezuela (Rubio-Palis y Moreno, 2003) y Perú (Calderón et al., 1995; Cruz et al., 2004; Wilkerson, 1991), en este último, se encontró infectada con Plasmodium vivax (Kroeger y Alarcón, 1993). En Colombia, A. calderoni solo fue registrada en el 2010 (González et al., 2010) debido, en parte, a su errónea identificación taxonómica, ya que anteriormente había sido confundida y reportada como A. punctimacula, considerada como un vector de malaria a nivel local (Olano et al., 2001).
La evaluación de especímenes depositados en colecciones, sugiere que A. calderoni está presente en por lo menos 10 departamentos de Colombia, e incluso a altitudes mayores a las reportadas anteriormente para esta especie (González et al., 2010). Trabajos posteriores con especímenes recolectados en campo reportan a A. calderoni en varias localidades del occidente colombiano (Gómez et al., 2015; Orjuela et al., 2015; Rodríguez-Zabala et al., 2016). Las larvas de A. calderoni se detectan tanto en criaderos permanentes como en temporales, en criaderos artificiales de uso doméstico, en excavaciones, lagunas, estanques de peces, zanjas, arroyos y cultivos de palma (Conde et al., 2015; Naranjo-Díaz et al., 2014; Orjuela et al., 2015). Por ello, se supone que podría tener una distribución más amplia de la conocida actualmente.
Algunos estudios de comportamiento, en localidades del Departamento del Valle del Cauca, Colombia, muestran que A. calderoni presenta gran heterogeneidad en su actividad de picadura al humano (Lucumi et al., 2011). Esta especie se encontró naturalmente infectada por P. falciparum en localidades del municipio de Tumaco (Naranjo-Díaz et al., 2014) y en Boca Prieta con P. vivax VK210 y P . falciparum (Orjuela et al., 2015), ubicadas en el Departamento de Nariño, al sur occidente del país. En dicho estudio, A. calderoni fue la especie predominante (> 90%) en las localidades de municipios que reportaron índices parasitarios anuales -IPA (número de casos de malaria por cada mil habitantes de población en riesgo) de 29 y 59 (Orjuela et al., 2015). Por lo tanto, se ha sugerido que A. calderoni podría ser un vector de importancia local.
Los trabajos previos en Colombia han utilizado secuencias del gen mitocondrial citocromo oxidasa I (COI; Gómez et al., 2015; González et al., 2010; Orjuela et al., 2015) y el gen nuclear espaciador interno transcrito 2 (ITS2; Gómez et al., 2015) para la acertada identificación de las especies de la serie Arribalzagia. Aunque estos marcadores han sido de gran utilidad, es necesario la implementación de una técnica molecular sencilla y económica como la PCR-RFLP, que puede llevarse a cabo en el laboratorio para la correcta diferenciación de estas especies.
En el presente trabajo se analizaron especímenes de Anopheles recolectados en localidades ubicadas en 10 departamentos de Colombia con el fin de conocer la distribución actual de A. calderoni en regiones ecológicamente diversas del país. Además, se calcularon las tasas de picadura y de inoculación entomológica, y se determinó la infección natural por Plasmodium para lograr una aproximación a su importancia epidemiológica en las regiones donde se encuentra presente en Colombia. Además, se caracterizó la región ITS2 y se realizó un análisis bioinformático para el diseño de una prueba molecular que permita su diferenciación de las otras especies de la serie Arribalzagia presentes en Colombia.
Materiales y métodos
Los mosquitos Anopheles incluidos en este estudio fueron recolectados utilizando atrayente humano protegido. Se utilizó un protocolo y consentimiento informado aprobado por el Comité de Bioética de la Facultad Nacional de Salud Pública de la Universidad de Antioquia, Acta número 063. Las recolectas se hicieron durante 3 noches consecutivas en 2 puntos por localidad, entre las 18:00 y 24:00 hr, en intra y peridomicilio. Los ejemplares se recolectaron en localidades de los siguientes 10 departamentos de Colombia: Antioquia, Chocó, Valle del Cauca, Norte de Santander, Córdoba, La Guajira, Magdalena, Amazonas, Risaralda y Nariño; entre los años 2009 y 2015 (tabla 1, fig. 1A). Para obtener una distribución más completa de A. calderoni, se incluyen especímenes de trabajos previos del grupo (tabla 2). Las coordenadas de las localidades donde se encontró A. calderoni se posicionaron sobre el mapa de ecorregiones de la WWF (Olson et al., 2001), utilizando el Sofware ArcGIS 10.2 (ESRI, 2014).
Los organismos fueron identificados usando la clave morfológica de González y Carrejo (2009) y se confirmó la identidad de la especie por análisis de secuencias ITS2 y COI. Las secuencias de ITS2 se compararon con las reportadas para esta especie en GenBank y las de 5’COI en la base de datos Barcode of Life Data System -BOLD, lo que corroboró que los ejemplares analizados pertenecen realmente a A. calderoni.
Los ejemplares de A. calderoni fueron evaluados para determinar su infección natural por parásitos de Plasmodium spp. utilizando un ensayo inmunoenzimático (Enzyme-Linked ImmunoSorbent Assay- ELISA). Se analizaron mezclas de las cabezas y el tórax de hasta 5 mosquitos de A. calderoni de la misma localidad, usando anticuerpos monoclonales dirigidos a P. falciparum, P. vivax VK247 y P. vivax VK210, en platos separados (Gutiérrez et al., 2008). Los mosquitos positivos se confirmaron por una segunda ELISA y posteriormente se realizó una PCR anidada con cebadores específicos para el género Plasmodium (Gutiérrez et al., 2008, Singh et al., 1999).
Tabla 1
Especies de Anopheles encontradas cohabitando con Anopheles calderoni.
|
Departamento |
Municipio |
Especie |
n |
Total |
|
Nariño |
Tumaco |
A. albimanus |
495 |
1,078 |
|
A. punctimacula |
2 |
|||
|
A. calderoni |
581 |
|||
|
Francisco Pizarro |
A. albimanus |
121 |
179 |
|
|
A. calderoni |
58 |
|||
|
Risaralda |
Pereira |
A. albimanus |
114 |
153 |
|
A. triannulatus |
12 |
|||
|
A. neomaculipalpus |
1 |
|||
|
A. calderoni |
26 |
|||
|
Valle del Cauca |
Cartago |
A. calderoni |
17 |
17 |
|
Riofrío |
A. albimanus |
3 |
51 |
|
|
A. calderoni |
48 |
|||
|
Buga |
A. triannulatus |
32 |
111 |
|
|
A. calderoni |
79 |
|||
|
Dagua |
A. calderoni |
1 |
1 |
|
|
Chocó |
Atrato |
A. apicimacula |
3 |
242 |
|
A. nuneztovari |
86 |
|||
|
A. darlingi |
152 |
|||
|
A. calderoni |
1 |
|||
|
Istmina |
A. darlingi |
271 |
562 |
|
|
A. nuneztovari |
288 |
|||
|
A. malefactor |
1 |
|||
|
A. punctimacula |
1 |
|||
|
A. calderoni |
1 |
La tasa de picadura a humanos (TPH), que indica el promedio de picaduras de A. calderoni que recibe una persona en 1 noche, se calculó por periodo de captura tomando el total de mosquitos (nt) sobre el número de noches de capturas (nc) y el promedio de cebos humanos (xch) utilizados [TPH = nt/nc/xch]. La tasa de infección (TI) se expresó como el número de mosquitos infectados por parásitos Plasmodium (ni), sobre el número total de mosquitos (nt) capturados a nivel de municipio [TI = (ni/nt) ×100]. Los intervalos de confianza (IC, 95%) se calcularon bajo el supuesto de una distribución binomial utilizando el software EPIDAT, versión 3.1 (Hervada et al., 2004). La tasa de inoculación entomológica (TIE), que indica el número de picaduras infectivas que puede recibir una persona en el transcurso de 1 año, se calculó por municipio tomando el promedio de TPH multiplicada por 365 días y la tasa de infección [TIE = TPH × 365 × TI] (Gutiérrez et al., 2008; Naranjo-Díaz et al., 2013; Rosero et al., 2013).
Para confirmar molecularmente a los mosquitos identificados por morfología como A. calderoni, se extrajo ADN a partir del abdomen (Rosero et al., 2010). Se amplificó la región ITS2 siguiendo las condiciones previamente estandarizadas (Cienfuegos et al., 2008, 2011; Zapata et al., 2007). Adicionalmente, se amplificó y secuenció el fragmento 5’COI o región código de barras (González et al., 2010) en especímenes representativos de cada localidad para confirmar la asignación de especie dada por la región ITS2.
Con el fin de buscar estrategias para la diferenciación de A. calderoni de otras especies de la serie Arribalzagia, se caracterizó la región ITS2 en mosquitos de esta especie para el diseño de una prueba basada en una PCR-RFLP. Se analizó la secuencia ITS2 en organismos de varias localidades: Buga (n = 3), Riofrío (n = 3) y Cartago (n = 1) en el Departamento del Valle del Cauca; Pereira (n = 3) en el Departamento Risaralda y Tumaco (n = 5) en el Departamento Nariño. Se clonó, secuenció y analizó la ITS2 de estos especímenes. Las secuencias se editaron y anotaron en Geneious 6.0 (Kearse et al., 2008), y subsecuentemente se alinearon y compararon con las secuencias reportadas para A. calderoni de Colombia, HQ622618 y HQ622619 (González et al., 2010). Posteriormente, se determinó la variabilidad inter e intraespecímen. Finalmente, se realizó un análisis bioinformático, una restricción “in silico” de las secuencias ITS2, utilizando el programa NEBcutter V 2.0 (Vincze et al., 2003). Se usaron las enzimas disponibles en la plataforma para obtener información preliminar y determinar si A. calderoni producía patrones de restricción que permitieran diferenciarlo de otras especies de Anopheles.
Tabla 2
Localidades de procedencia de los especímenes analizados.
|
Tabla 2 Continuación |
|||||
|
Departamento |
Municipio |
Localidad |
Longitud (O) |
Latitud (N) |
Referencia |
|
Departamento |
Municipio |
Localidad |
Longitud (O) |
Latitud (N) |
Referencia |
|
Valle del Cauca |
Buga |
Laguna de Sonso |
76° 20’52.799” |
3° 52’33.6” |
Gómez et al., 2015 |
|
Valle del Cauca |
Riofrío |
El Jagual |
76° 17’16.453” |
4° 9’52.286” |
Gómez et al., 2015 |
|
Valle del Cauca |
Cartago |
Hacienda Limones |
75° 55’10.8” |
4° 42’54.4” |
Gómez et al., 2015 |
|
Valle del Cauca |
Dagua |
Ricaurte |
76° 41’6.299” |
3° 39’38.9” |
ET |
|
Risaralda |
Pereira |
La Carbonera |
75° 44’19.799” |
4° 46’58.6” |
Gómez et al., 2015 |
|
Nariño |
Tumaco |
Pindales |
78° 46’14.599” |
1° 48’24.9” |
Naranjo-Díaz et al., 2014 |
|
Nariño |
Francisco Pizarro |
La Playa – Salahondita |
78° 38’39.599” |
2° 0’42.6” |
ET |
|
Chocó |
Istmina |
San Antonio |
76° 41’24.799” |
5° 7’49.2” |
ET |
|
Chocó |
Atrato |
Arenal – Doña Josefa |
76° 36’53.3” |
5° 31’43.8” |
ET |
|
Antioquia |
Bagre |
La Capilla |
74° 42’56.3” |
7° 35’43.699” |
Gómez et al., 2015 |
|
Antioquia |
San Pedro de Urabá |
El Caño |
76° 19’7.604” |
8° 24’19.487” |
Gómez et al., 2015 |
|
Antioquia |
Turbo |
Yarumal |
76° 43’42.3” |
8° 9’3.7” |
Gómez et al., 2015 |
|
Antioquia |
Vigía del Fuerte |
San Antonio de Padua |
76° 40’35.662” |
6° 29’15.572” |
Naranjo-Díaz et al., 2014 |
|
Antioquia |
Zaragoza |
El Retiro |
74° 52’21.6” |
7° 24’51.3” |
Gómez et al., 2015 |
|
Norte de Santander |
Tibú |
Caño Victoria |
72° 39’24.765” |
8° 33’26.125” |
Gómez et al., 2015 |
|
Norte de Santander |
Zulia |
Santa Rosa |
72° 33’21.393” |
8° 15’53.409” |
Gómez et al., 2015 |
|
La Guajira |
Dibulla |
Dibulla rural |
73° 17’59.999” |
11° 16’1.2” |
Gómez et al., 2015 |
|
Magdalena |
Los Achiotes |
Los Achiotes |
73° 35’59.999” |
11° 15’0” |
Gómez et al., 2015 |
|
Amazonas |
Leticia |
Km 6 – Km 11 |
69° 55’58.8” |
S 4° 12’54” |
Gómez et al., 2015 |
|
Amazonas |
Tarapacá |
Nueva Unión |
69° 45’28.799” |
S 2° 53’45.6” |
Gómez et al., 2015 |
|
Antioquia |
Necoclí |
Pueblo Nuevo – Bellavista |
76° 47’2.4” |
8° 25’33.6” |
Gómez et al., 2015 |
|
Antioquia |
Arboletes |
La Arenosa |
76° 26’8.226” |
8° 33’36.208” |
ET |
|
Córdoba |
Montería |
Sierra Chiquita |
75° 55’41.474” |
8° 43’23.651” |
ET |
|
Antioquia |
San Carlos |
Guacharacal |
75° 40’8.799” |
8° 33’13.5” |
ET |
|
Córdoba |
Valencia |
Santa Fe de Pirú |
76° 14’49.199” |
8° 9’29.902” |
ET |
|
Antioquia |
Nechí |
Puerto Astilla |
74° 51’36.551” |
7° 57’16.262” |
ET |
|
Córdoba |
Moñitos |
Rio Cedro |
76° 5’59.999” |
9° 15’0” |
Gómez et al., 2015 |
|
Córdoba |
San Antero |
Bahía Cispatá |
75° 47’28.2” |
9° 17’37.702” |
ET |
|
Antioquia |
Mutatá |
La Secreta |
76° 28’51.527” |
7° 20’53.397” |
ET |
|
Antioquia |
Apartado |
La Victoria – Salsipuedes |
76° 34’34.799” |
7° 51’49.5” |
ET |
|
Antioquia |
Caucasia |
Cuturú – Puerto Triana |
74° 48’0.258” |
7° 44’39.594” |
ET |
|
Antioquia |
Cáceres |
Asturias – Campanario |
75° 19’20.3” |
7° 37’12.3” |
ET |
|
Córdoba |
Montelibano |
Puerto Anchica -Puerto Nuevo |
75° 49’58.599” |
7° 55’1.099” |
Gómez et al., 2015 |
|
Córdoba |
Puerto libertador |
Juan José |
75° 48’43.873” |
7° 43’50.606” |
Gómez et al., 2015 |
|
Córdoba |
Tierralta |
Tuis Tuis |
76° 5’57.138” |
8° 3’16.094” |
ET |
|
Córdoba |
Canalete |
El Limón – Buenos Aires de las Pavas |
76° 13’31.972” |
8° 46’45.21” |
ET |
|
Antioquia |
San Juan de Urabá |
La Mugrosa |
76° 34’54.9” |
8° 39’57.174” |
ET |
|
Antioquia |
Taraza |
Santa Clara – El Rayo |
75° 24’3.191” |
7° 35’35.735” |
ET |
|
Chocó |
Medio Atrato |
Puné – Tauchigado |
76° 44’18.499” |
5° 57’59.172” |
ET |
|
Valle del Cauca |
Buenaventura |
Zacarias – Córdoba |
76° 55’35.806” |
3° 52’6.114” |
Naranjo-Díaz et al., 2014 |
|
Chocó |
Medio San Juan |
Paimadó – San Miguel |
76° 51’48.389” |
4° 48’15.523” |
ET |
|
Córdoba |
Sahagun |
Trementino |
75° 27’35.499” |
8° 48’41.4” |
ET |
|
Córdoba |
Puerto Escondido |
EL Palmar |
76° 14’17” |
8° 57’25.7” |
ET |
Referencia: especímenes de trabajos previos del grupo; ET: especímenes específicos de este trabajo.
Resultados
En algunas localidades donde se detectó A. calderoni pueden encontrarse cohabitando otras especies del género Anopheles. Sin embargo, se observa que dependiendo de la localidad, departamento y ecorregión, las especies con las que cohabita varían (tabla 1, fig. 1B). En las localidades del Departamento de Nariño, A. calderoni es la especie dominante o la segunda en abundancia después de A. albimanus. Igualmente, en 2 de las localidades del Valle del Cauca (Buga y Riofrío), fue la especie más abundante durante el muestreo y en las otras 2 (Cartago y Dagua), solo se detectó A. calderoni, aunque poco abundante. En las localidades del Departamento de Chocó, se observa una mayor riqueza de especies; en éstas, A. calderoni se encuentra en bajo número, mientras que A. nuneztovari y A. darlingi, que son los vectores primarios de Colombia, son las que se registraron con mayor abundancia. En las localidades de los departamentos de Antioquia, Norte de Santander, Magdalena y Amazonas no se encontraron especímenes de A. calderoni, pero se detectaron otras de las especies de la serie Arribalzagia, incluyendo a: A. malefactor, A. neomaculipalpus, A. punctimacula, A. mattogrosensis y A. peryasuii.
De los 683 ejemplares de A. calderoni evaluados, solo se detectó 1 infectado con P. falciparum, recolectado en el municipio de Tumaco (11) (tabla 3). La tasa de infección para el período fue de 0.17 %. La tasa de picadura en humanos más alta, de 14.7 picaduras por persona por noche, se registró en el municipio de Tumaco para el mismo período en que fue capturado el mosquito infectado con P. falciparum. Se estimó que una persona puede recibir 3.1 picaduras de A. calderoni infectivas al año (tabla 3).
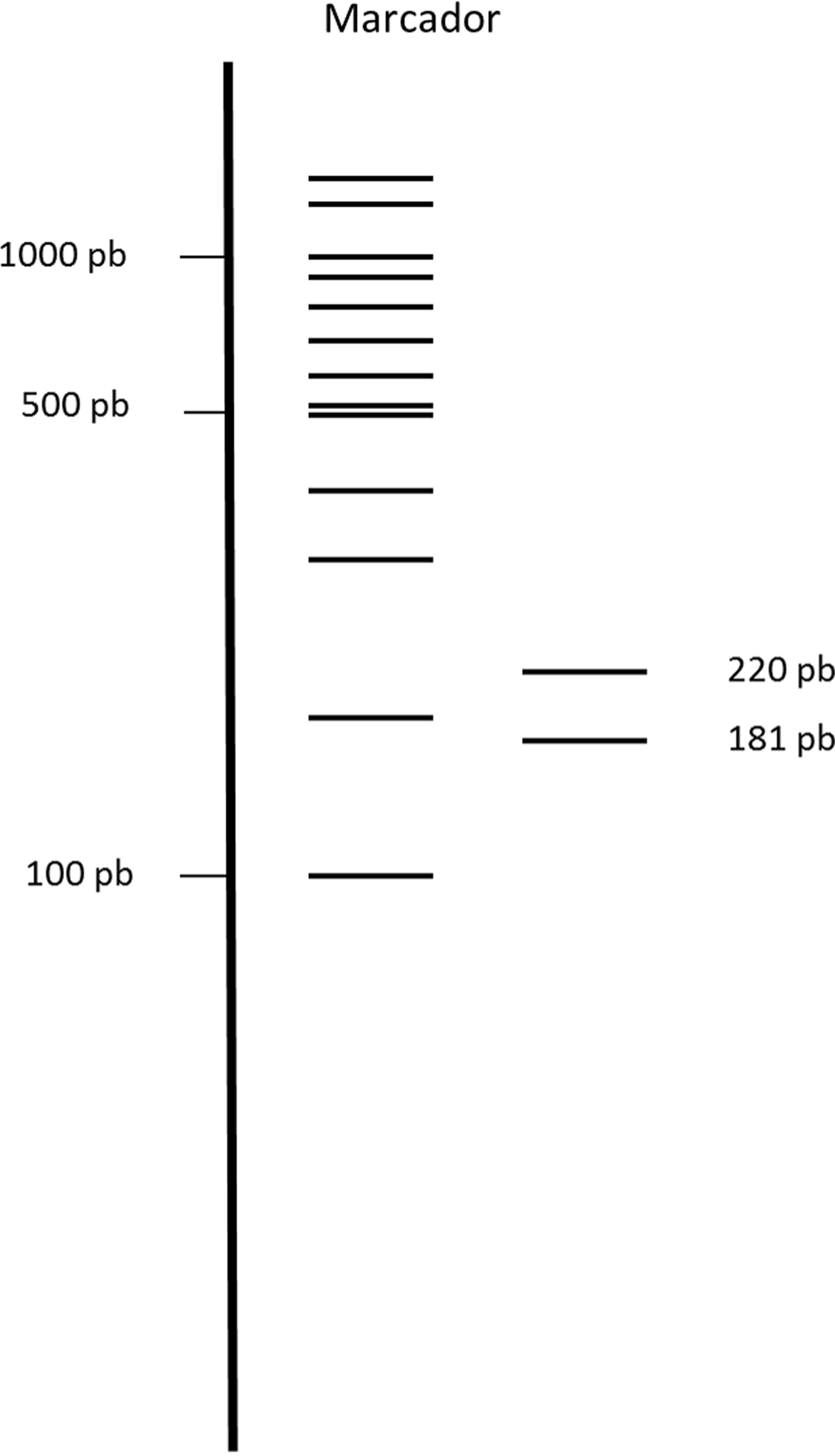
Se obtuvieron 38 secuencias ITS2 de A. calderoni, las cuales tuvieron un 99.6% de similitud con las reportadas para Colombia en GenBank (González et al., 2010). Las secuencias tuvieron una longitud de 357 pb. La composición nucleotídica promedio fue de 53.5% GC. Se encontraron 21 sustituciones nucleotídicas que constituyeron 20 sitios polimórficos y 13 variantes, lo que representa una baja variabilidad intragenómica (tabla 4). No se encontraron inserciones o deleciones. Los análisis bioinformáticos mostraron que la enzima AluI, frecuentemente utilizada para confirmación molecular de varias especies de Anopheles (Cienfuegos et al., 2008, 2011), no genera cortes en la secuencia ITS2 de esta especie. Sin embargo, se encontraron otras enzimas de restricción que producen patrones distinguibles que representan la región ITS2 de A. calderoni, como es la enzima HaeIII; ésta reconoce un sitio en la secuencia y genera un patrón de 2 bandas de 220 pb y 181 pb (fig. 2).
Tabla 3
Infección natural por Plasmodium y parámetros entomológicos registrados para Anopheles calderoni.
|
Departamento |
Municipio |
Núm. días/CH |
Año/mes de captura |
n |
TPH |
TI (IC) |
TIE anual |
|
Nariño |
Tumaco |
5/4 |
2009 junio |
3 |
0.1 |
0.17% |
3.1 |
|
Tumaco |
6/4 |
2009 octubre |
42 |
1.7 |
|||
|
Tumaco |
6/4.3 |
2010 enero |
90 |
3.5 |
|||
|
Tumaco |
6/4.5 |
2010 abril |
400 |
14.7 |
|||
|
Tumaco |
6/4 |
2015 agosto |
56 |
2.3 |
|||
|
Francisco Pizarro |
6/4 |
2015 agosto |
58 |
2.4 |
|
|
|
|
Risaralda |
Pereira |
4/2 |
2012 febrero |
26 |
3.3 |
|
|
|
Valle del Cauca |
Cartago |
4/2 |
2012 febrero |
17 |
2.1 |
||
|
Riofrío |
3/2 |
2012 febrero y marzo |
48 |
8 |
|||
|
Buga |
4/2 |
2012 marzo |
79 |
9.8 |
|||
|
Dagua |
6/4.3 |
2015 mayo |
1 |
0.04 |
|
|
|
|
Chocó |
Atrato |
6/4.5 |
2015 marzo |
1 |
0.04 |
||
|
Istmina |
6/4 |
2015 noviembre |
1 |
0.04 |
|
|
CH: Cebo humano (promedio); n: número de A. calderoni evaluados por infección natural; TPH: tasa de picadura en humanos por periodo de captura; TI: tasa de infección en Tumaco; IC: intervalo de confianza de la TI; a: ejemplar positivo para P. falciparum por ELISA y PCR anidada; TIE: tasa de inoculación entomológica anual para Tumaco.
Tabla 4
Caracterización de la región ITS2 en especímenes A. calderoni.
|
Código de los especímenes |
ITS2 |
% GC |
Transición |
Transversión |
|
BUG13 |
357 pb |
53.5 |
N/A |
N/A |
|
BUG476 |
357 pb |
53.8 |
A/G (95) |
N/A |
|
BUG467 |
357 pb |
53.5 |
T/C (171) |
N/A |
|
CAR7 |
357 pb |
53.4 |
N/A |
T/G (266) |
|
PER24 |
357 pb |
53.7 |
G/A (39), T/C (71),G/A (77), G/A (99), T/C (169), G/A (202), G/A (336) |
T/A (68), A/T (170), A/T (171), A/T (315), G/T (335) |
|
PER36 |
357 pb |
53.7 |
A/G (317) |
N/A |
|
PER66 |
357 pb |
53.5 |
N/A |
N/A |
|
RIO5 |
357 pb |
53.5 |
N/A |
G/T (266), A/T(297) |
|
RIO8 |
357 pb |
53.3 |
C/T (99) |
T/G (266) |
|
RIO21 |
357 pb |
53.2 |
N/A |
N/A |
|
T1807 |
357 pb |
53.5 |
N/A |
N/A |
|
T1815 |
357 pb |
53.5 |
N/A |
N/A |
|
T1973 |
357 pb |
53.5 |
N/A |
N/A |
|
T1965 |
357 pb |
53.4 |
N/A |
C/A (3) |
|
T2305 |
357 pb |
53.5 |
N/A |
N/A |
BUG: Buga, RIO: Riofrío, CAR: Cartago, PER: Pereira, T: Tumaco.
% GC: porcentaje de guanina y citosina.
Discusión
Este estudio provee información sobre la distribución reciente de A. calderoni en localidades de varios departamentos de Colombia, las cuales comprenden diversas ecorregiones. De los 10 departamentos muestreados, solo se detectó A. calderoni en 4, todos ellos ubicados al occidente del país. Chocó, Valle del Cauca, Risaralda y Nariño, que comprenden las ecorregiones de Manglares del Pacífico, Bosque montano, Bosque seco y Bosque húmedo (Encyclopedia of Earth, 2016). La presencia de A. calderoni en estas ecorregiones puede sugerir su capacidad de establecerse en condiciones ambientales heterogéneas.
Los resultados demuestran que A. calderoni está distribuida al occidente del país. No se detectó la especie en localidades al norte, noreste y sur de Colombia. Además, se encontró en mayor abundancia en la municipalidad de Tumaco, Nariño, al sur la Costa Pacífica, que corresponde a la ecorregión de Manglares del Pacífico. Un estudio anterior (Orjuela et al., 2015) indicó que las variables ambientales de precipitación y la humedad relativa explican la abundancia de la especie, sugiriendo estacionalidad en cuanto la presencia de A. calderoni (Orjuela et al., 2015), con mayor abundancia en temporada lluviosa (Naranjo-Díaz et al., 2014).
En la colección del Museo de Entomología de la Universidad del Valle (MUSENUV), se encuentran depositados especímenes de A. calderoni de las costas atlántica y pacífica de Colombia, e incluso del interior del país, como es del Departamento del Tolima (González et al., 2010), comprendiendo regiones con características ecológicas de bosque seco Valle del Cauca, bosque húmedo Magdalena-Urabá, la barrera desértica del Caribe y bosque montano Valle del Cauca. A diferencia de dicho estudio, en el presente trabajo, A. calderoni no se detectó en los muestreos llevados a cabo en los departamentos del norte, noreste, noroeste y sureste de Colombia. Esto puede tener varias explicaciones, como la diferencia temporal entre los muestreos de ambos trabajos, o la época del año en que se realizaron las recolectas, sobre todo si se considera la hipótesis de que A. calderoni es influenciada por la estacionalidad (Orjuela et al., 2015). En este estudio se corrobora la presencia de A. calderoni en varias localidades de la región pacífica. Además, se presenta un nuevo registro para la localidad Ricaurte, municipio de Dagua, en el Departamento del Valle del Cauca.
Es de notar que, aunque A. calderoni no se encontró en las localidades de los Departamentos de Antioquia, Norte de Santander, Magdalena y Amazonas, en éstos fueron encontradas otras especies de la serie Arribalzagia como A. malefactor, A. neomaculipalpus, A. punctimacula, A. mattogrosensis y A. peryasuii, las cuales pueden presentar problemas durante la identificación por morfología y confundirse con A. calderoni (Gómez et al., 2015). Por ello se realizó la caracterización de la región ITS2 en A. calderoni como una aproximación inicial, para buscar una estrategia que permita su diferenciación con las demás especies de la serie Arribalzagia. La región ITS2 ha sido previamente utilizada en una prueba molecular basada en una PCR-RFLP para diferenciar especies de Anopheles (Cienfuegos et al., 2008, 2011; Zapata et al., 2007). Esta prueba es relativamente sencilla de realizar en el laboratorio y tiene un costo moderado comparado con la secuenciación de ADN. La caracterización de la ITS2 en A. calderoni y la realización de un análisis de restricción “in silico” indicaron que la enzima HaeIII genera cortes en la región ITS2 de A. calderoni que producen patrones que permitirían diferenciar la especie. Se recomienda que en trabajos futuros se caracterice ITS2 para las demás especies de la serie presentes en Colombia para determinar los patrones de ITS2 de cada una de ellas, y así establecer una metodología que permita la diferenciación efectiva de especímenes recolectados en campo.
Adicionalmente, se encontró una baja variabilidad en la ITS2 en los insectos de A. calderoni. La conservación de la región ITS2, se ha atribuido al proceso de evolución concertada que homogeniza las diferentes copias de la ITS2 entre los ejemplares de una misma especie (Li y Wilkerson, 2007). La baja variabilidad en la región ITS2 de A. calderoni indica su utilidad como marcador en una prueba de identificación molecular de estas especies.
El análisis de la tasa de picadura y la estimación de la tasa de inoculación entomológica revelaron una alta preferencia de picadura al humano por parte de A. calderoni. Se estimó que una persona puede recibir 3.1 picaduras infectivas al año. Por su comportamiento antropofílico y el hallazgo de su infección natural por el parásito, se considera que A. calderoni es un vector potencial de malaria a nivel local, específicamente en el sureste del país (Conde et al., 2015; Naranjo-Díaz et al., 2014). Aunque la tasa de infección para A. calderoni reportada en este estudio es de 0.17%, es menor que la reportada para Perú (0.26%) (Cruz et al., 2004), pero es mayor a las reportadas para vectores primarios como A. nuneztovari (0.101%) y A. darlingi (0.087%) (Naranjo-Díaz et al., 2013). La tasa de picadura en humanos para A. calderoni varió ente las localidades (0.04 – 14.7 picaduras por noche),y la mayor tasa se registró para Tumaco en Nariño (14.7 picaduras por noche). Aunque esta tasa es considerada alta, se han reportado tasas de picadura aún más altas en el Departamento del Valle del Cauca (55.7 – 65.8 picaduras por noche) (Lucumi et al., 2011). Por ello, en caso de tratarse de un vector local, la presencia de A. calderoni supondría un alto riesgo de transmisión de la malaria. Por todo ello, se recomienda realizar estudios futuros que brinden información sobre la biología e importancia epidemiológica de A. calderoni con el fin de implementar intervenciones de control vectorial dirigidas.
Agradecimientos
Este trabajo se derivó de un proyecto financiado por el Departamento Administrativo de Ciencia, Tecnología e Innovación (Colciencias), código Núm. 596-2013 y recibió apoyo de la Estrategia para la Sostenibilidad de Grupos de Investigación, Universidad de Antioquia-UdeA 2016-2017, código Núm. ES84160123 y proyecto Programática de la Universidad de Antioquia, código Núm. 2015-7543. YGC es becaria de Colciencias. JCH estuvo bajo una beca de pasantía de Joven Investigador CODI-UdeA.
Referencias
Calderón, G., Fernández, R. y Valle, J. (1995). Especies de la fauna anofelina, su distribución y algunas consideraciones sobre su abundancia e infectividad en el Perú. Revista Peruana de Epidemiología, 8, 5–23.
Cienfuegos, A., Gómez, G., Córdoba, L., Luckhart, S., Conn, J. y Correa, M. (2008). Diseño y evaluación de metodologías basadas en PCR–RFLP de ITS2 para la identificación molecular de mosquitos Anopheles spp. (Diptera: Culicidae) de la costa pacífica de Colombia. Revista Biomedica (Mex), 19, 35–44.
Cienfuegos, A., Rosero, D., Naranjo, N., Luckhart, S., Conn, J. y Correa, M. (2011). Evaluation of a PCR-RFLP-ITS2 assay for discrimination of Anopheles species in northern and western Colombia. Acta Tropica, 118, 128–135.
Cruz, G., Valle, T. y Ruiz, M. (2004). Determinación de los hábitos de A. pseudopunctipennis y A. calderoni en dos localidades del valle de Chao. La Libertad, Perú. Revista Peruana de Medicina Experimental y Salud Pública, 21, 223–30.
Conde, M., Pareja, P., Orjuela, L., Ahumada, M., Durán, S., Jara, J. et al. (2015). Larval habitat characteristics of the main malaria vectors in the most endemic regions of Colombia: potential implications for larval control. Malaria Journal, 14, 476.
Encyclopedia of Earth. (2016). Recuperado 4 May 2016 de: https://eoearthlive.wordpress.com/view/article/51cbf3e67896bb431f6ae6a8/
ESRI. (2014). ArcGIS Desktop: Release 10.2 Redlands, CA: Environmental Systems Research Institute.
Gómez, G. F., Bickersmith, S. A., González, R., Conn, J. E. y Correa, M. M. (2015). Molecular taxonomy provides new insights into Anopheles species of the Neotropical Arribalzagia. Plos One, 10, e0119488.
González, R. y Carrejo, N. (2009). Introducción al estudio taxonómico de Anopheles de Colombia: claves y notas de distribución. Cali: Programa Editorial Universidad del Valle.
González, R., Carrejo, N., Wilkerson, R. C., Alarcón, J., Alarcón-Ormasa, J., Ruiz, F. et al. (2010). Confirmation of Anopheles (Anopheles) calderoni Wilkerson, 1991 (Diptera: Culicidae) in Colombia and Ecuador through molecular and morphological correlation with topotypic material. Memórias do Instituto Oswaldo Cruz Cruz, 105, 1001–1009.
Gutiérrez, L., Naranjo, N., Jaramillo, L., Muskus, C., Luckhart, S., Conn, J. et al. (2008). Natural infectivity of Anopheles species from the Pacific and Atlantic Regions of Colombia. Acta Tropica, 107, 99–105.
Hervada, V., Santiago, P., Vázquez, F. Castillo, S., Loyola, E. y Silva, A. (2004). Epidat 3.0 programa para análisis epidemiológico de datos tabulados. Revista Española de Salud Pública, 78, 277–80.
Kearse, M., Moir, R., Wilson, A., Stones-Havas, S., Cheung, M., Sturrock, S. et al. (2008). Geneious basic: an integrated and extendable desktop software platform for the organization and analysis of sequence data. Bioinformatics, 28, 1647–9.
Kroeger, A. y Alarcón, J. (1993). Malaria en Ecuador y Perú y estrategias alternativas de control. Quito: Abya-Yala.
Li, C. y Wilkerson, R. (2007). Intragenomic rDNA ITS2 variation in the neotropical Anopheles (Nyssorhynchus) albitarsis complex (Diptera: Culicidae). Journal of Heredity, 98, 51–9.
Lucumi, A., González, R. y Salas, Q. (2011). Actividad de picadura de Anopheles calderoni (Diptera: Culicidae) en dos localidades de Valle del Cauca, Colombia. Revista Colombiana de Entomología, 37, 256–261.
Naranjo-Díaz, N., Rosero, D., Rua, G., Luckhart, S. y Correa, M. (2013). Abundance, behavior and entomological inoculation rates of anthropophilic anophelines from a primary Colombian malaria endemic area. Parasites & Vectors, 6, 61.
Naranjo-Díaz, N., Altamiranda, M., Luckhart, S., Conn, J. E. y Correa, M. (2014). Malaria vectors in ecologically heterogeneous localities of the Colombian Pacific region. Plos One, 9, e103769.
Olano, V., Brochero, H., Sáenz, R., Quiñones y M. Molina, J. (2001). Mapas preliminares de la distribución de especies de Anopheles vectores de malaria en Colombia. Revista Biomedica, 21, 402– 408.
Olson, D., Dinerstein, E., Wikramanayake, E., Burgess, N., Powell, G., Underwood, E. et al. (2001). Terrestrial ecoregions of the world: a new map of life on earth. BioScience, 51, 933–938.
Orjuela, L., Ahumada, M., Ávila, I., Herrera, S., Beier, J. y Quiñones, M. (2015). Human biting activity, spatial-temporal distribution and malaria vector role of Anopheles calderoni in the southwest of Colombia. Malaria Journal, 14, 256.
Rodríguez-Zabala, J., González, R., Correa, M. M. y Gómez, G. (2016). Análisis morfométrico de dos poblaciones de Anopheles (Anopheles) calderoni (Diptera: Culicidae) del suroccidente colombiano. Revista Mexicana de Biodiversidad, 83, 966–971.
Rosero, D., Naranjo-Díaz, N., Álvarez, N., Cienfuegos, A. V., Torres, C., Luckhart, S. et al. (2013). Colombian Anopheles triannulatus (Diptera: Culicidae) naturally infected with Plasmodium spp. ISRN Parasitology, 2013, 927453.
Rosero, D., Gutiérrez, L., Cienfuegos, A., Jaramillo, L. y Correa, M. (2010). Optimización de un procedimiento de extracción de ADN para mosquitos anofelinos. Revista Colombiana de Entomología, 36, 260–263.
Rubio-Palis, Y. y Moreno, J. (2003). Primer registro de Anopheles (Anopheles) calderoni (Diptera: Culicidae) en Venezuela. Entomotropica. 18, 159–161.
Singh, B., Bobogare, A., Cox-Singh, J., Snounou, G., Abdullah, M. y Rahman, H. (1999). A genus- and species-specific nested polymerase chain reaction malaria detection assay for epidemiologic studies. American Journal of Tropical Medicine and Hygiene, 60, 687–682.
Vincze, T., Posfai, J. y Roberts, R. (2003). NEBcutter: a program to cleave DNA with restriction enzymes. Nucleic Acids Research, 31, 3688–91.
Wilkerson, R. (1991). Anopheles (Anopheles) calderoni n. sp., a malaria vector of the Arribalzagia series from Peru (Diptera: Culicidae). Mosquito Systematics, 23, 25–37.
Zapata, M., Cienfuegos, A., Quirós, O., Quiñones, M., Luckhart, S. y Correa, M. (2007). Discrimination of seven Anopheles species from San Pedro de Urabá, Antioquia, Colombia, by polymerase chain reaction-restriction fragment length polymorphism analysis of ITS2 sequences. American Journal of Tropical Medicine and Hygiene, 77, 67–72.



