Relación entre las características de la vegetación y las densidades de la ardilla de Perote
Sandra H. Montero-Bagatella⁎ ✉ , Alberto González-Romero, Sonia Gallina, Gerardo Sánchez-Rojas
Resumen
La ardilla de Perote (Xerospermophilus perotensis) es una especie endémica y en peligro de extinción; el cambio de uso de suelo ha sido la principal causa de la pérdida de su hábitat y ha ocasionado que la especie enfrente problemas de conservación. Algunos estudios señalan, que los roedores de pastizales pueden resistir algunas perturbaciones de su hábitat e incluso pueden obtener beneficios de estos cambios, por lo que nos planteamos evaluar la relación que existe entre la estructura de la vegetación y la densidad poblacional de la ardilla en 7 sitios del valle de Perote en Veracruz. Los resultados sugieren que la densidad de la ardilla está determinada por la altura y cobertura de la vegetación, las cuales proveen de protección de los depredadores, y a su vez, de los recursos alimenticios necesarios para su subsistencia. En algunos de los sitios trabajados, las densidades de la ardilla de Perote fueron apenas superiores a la mínima viable, por lo que es importante tomar las medidas necesarias para el manejo adecuado de su hábitat, ya que su condición de microendemismo le impide establecerse en otros ambientes.
Palabras clave
Ardillas terrestres; Endemismo; Especie amenazada; Cobertura vegetal; Pastizales
Relationship between vegetation characteristics and densities of the Perote ground squirrel
The Perote ground squirrel (Xerospermophilus perotensis ) is nationally and internationally classified as vulnerable to extinction. The loss of their habitat caused by the change in land use has been the main cause of their conservation problems. Some studies suggested that rodents in grasslands can resist some habitat disturbance and may even benefit from these changes. We evaluated the relationship between the structure of the vegetation and the density of the squirrel. Our results suggest that the presence of the squirrel is determined by the height and coverage of the vegetation, as they provide them protection from predators, but it should allow visibility to them and the necessary food resources for their subsistence. In some of the study sites, the Perote ground squirrel densities was barely the minimum viable, therefore it is important to take the necessary measures for the proper management of their habitat because their condition as a microendemic species avoids them to establishment in other habitat type.
© 2017 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Keywords:
Ground squirrel; Endemism; Threatened species; Vegetation coverage; Grasslands
Introducción
El valle de Perote se localiza en los estados de Veracruz y Puebla, forma parte de la Faja Volcánica Transversal, la cual destaca por ser un centro de diversificación, endemismo y transición biológica para una gran variedad de especies ( Gámez, Escalante, Rodríguez, Linaje y Morrone, 2012; Luna, Morrone y Espinosa, 2007 ) por lo que resulta un sitio de particular importancia del país ( Rzedowski, 2006 ). Sin embargo, las prácticas agrícolas, la ganadería, la deforestación, el desarrollo de caminos y la fauna introducida han originado severas transformaciones del valle, sobre todo en los pastizales que han sido convertidos en campos agrícolas y/o ganaderos ( Céspedes-Flores y Moreno-Sánchez, 2010; Challenger y Soberón, 2008 ), lo cual ha provocado impactos negativos para las especies y su hábitat ( Aguilar, Martínez y Arriaga, 2000; González-Gallina, Benítez-Baldillo, Rojas-Soto e Hidalgo-Mihart, 2013; Mendoza-Carreón, 2009; Valdez y Ceballos, 1997 ).
Los mamíferos, en particular los pequeños, han sido afectados por estas transformaciones; sin embargo, muchos de ellos carecen de protección legal ( González-Ruíz, Álvarez-Castañeda y Álvarez, 2005 ), ya sea por ser considerados poco carismáticos ( Ramos-Lara y Koprowski, 2014 ) o por la escasa información acerca de su historia natural, ecología, distribución y abundancia, incluso indocumentada antes de enfrentar problemas de conservación ( González-Ruíz et al., 2005; Mares, 1985 ). La ardilla endémica de Perote ( Xerospermophilus perotensis ) tiene un período de actividad que abarca desde finales de marzo a finales de octubre —los meses restantes hiberna—, presenta baja capacidad de dispersión y distribución restringida. Actualmente, es una de las especies de la zona que enfrenta severos problemas para persistir debido a las fuertes y constantes presiones antropogénicas, no solo por la desaparición de su hábitat, del cual se ha calculado que únicamente resta un 30% del original, consecuencia de la conversión de este a terrenos agrícolas ( Mendoza-Carreón, 2009; Sánchez-Cordero, Illoldi-Rangel, Linaje, Sarkar y Townsend, 2005 ), sino porque también algunos ejidatarios la consideran plaga en sus cultivos, lo que en conjunto ha causado un fuerte problema de conservación, que ha ocasionado que la especie se encuentre catalogada como en peligro de extinción en la IUCN y como amenazada en la NOM- 059- SEMARNAT- 2010 ( Álvarez-Castañeda, Castro-Arellano, Lacher y Vázquez, 2008; Castillo-Castillo, 2009; Montero-Bagatella y González-Romero, 2014; Semarnat, 2010; Valdez y Ceballos, 1997 ). La importancia ecológica de la especie radica en que las ardillas terrestres son consideradas especies clave, ya que influyen en las características físicas y biológicas del ecosistema que habitan, promoviendo la infiltración de agua, la dispersión de semillas y esporas; son grandes consumidores de semillas y plántulas y representan una importante fuente de proteína para otros vertebrados ( Valdez, 2003; Yensen y Sherman, 2003 ). Sin embargo, en ocasiones pueden llegar a considerarse como plagas, cuando sus poblaciones se elevan y causan daños a los cultivos ( Hoogland, 2007).
Algunos estudios han señalado que los roedores de pastizales pueden resistir a cierto tipo de perturbaciones en su hábitat e incluso pueden obtener beneficios de estos cambios, ya sea por el establecimiento y desarrollo de nuevas plantas o por el impedimento del crecimiento de leñosas; no obstante, si estas alteraciones se agravan, la abundancia, biomasa, riqueza y composición de las comunidades de roedores pueden cambiar radicalmente e incluso algunas especies podrían desaparecer ( Matlack, Kaufman y Kaufman, 2008 ). Debido a la estrecha relación de estos organismos con las plantas, es necesario el conocimiento de la estructura de la vegetación, ya que esta influye en la distribución y abundancia de sus poblaciones ( Rizo-Aguilar, Guerrero, Hidalgo-Mihart y González-Romero, 2014 ) y permite conocer el estado de conservación de los ecosistemas en los que habitan ( Ramos-Lara y Koprowski, 2014 ); por lo que, con dicha información se pueden establecer acciones en favor de la conservación de la especie de interés ( Rabinowitz, 1993 ). Por lo anterior, nos planteamos realizar una caracterización del hábitat de la ardilla endémica de Perote y conocer las variables de la vegetación que tienen más relación con la densidad poblacional de la especie. La información obtenida permitirá conocer los requerimientos ecológicos de la especie y brindará las herramientas necesarias para planear estrategias para su conservación.
Materiales y métodos
El estudio se realizó en el valle de Perote, ubicado en el municipio de Perote, Veracruz, México, situado entre 2 cadenas montañosas, la sierra Norte de Puebla y el Cofre de Perote ( Best y Ceballos, 1995; Gámez et al., 2012; Sánchez-Cordero et al., 2005 ). La altitud de la zona oscila entre 2,300 y 2,700 m snm; el clima es el más húmedo de los semiáridos con una temperatura media anual de 14 °C y precipitación anual de 500 mm ( Gerez-Fernández, 1985; Medina y Angulo, 1990 ). La vegetación que se presenta es diversa: bosque de pino-encino ( Pinus spp. y Quercus spp.), bosque de táscate ( Juniperus deppeana), matorrales (Yucca periculosa, Nolina parviflora), pastizales naturales (Scleropogon brevifolius, Erioneuron avenaceum) e inducidos (Muhlenbergia quadridentata, Aristida divaricata ) y vegetación halófila ( Bouteloua scorpioides, Atriplex linifolia) ( Delgadillo-Quezada, 2011; Gerez-Fernández, 1985 ).
Se eligieron 7 sitios del valle de Perote, los cuales tenían registros de la presencia de la ardilla endémica de Perote y se diferenciaron principalmente por el tiempo de uso agropecuario ( fig. 1 ). El pastizal natural gravoso (PNG) se localizó dentro de un derrame basáltico denominado «Malpaís» perteneciente al ejido de Totalco y el cual se conoce como Paistepec; fue el sitio con menor evidencia de manejo agropecuario. Dentro del sitio existía un continuo de pastos cortos, amacollados que no denotaban perturbación. El sitio pastizal pastoreado reciente (PPR) se ubicó a 200 m de la carretera Veracruz-México; el manejo agrícola presentó datos de 5 años atrás, por lo que ya existían pastos nativos y secundarios. Parte de este sitio fue reforestado con pinos, los cuales imposibilitaban cultivos futuros. Sin embargo, el paso del ganado ovicaprino era cotidiano, por lo que parte de la vegetación reforestada fue consumida por el ganado. El pastizal pastoreado antiguo (PPA) se situó aproximadamente a 500 m de la misma carretera y presentó rastros de actividades agrícolas de 12 años atrás; sin embargo, el arado se retomó de manera discontinua. Los pastos nativos fueron comunes en este sitio y la presencia del ganado también era cotidiana. El sitio pastizal natural arenoso (PNA), ubicado aproximadamente a 200 m de la carretera Perote-Amozoc, con predominio de pastos cortos (20 cm) y amacollados, por lo que el ambiente ya denotaba cierta recuperación. El pastoreo ovicaprino fue ocasional y no mostraba signos de manejos agrícolas recientes. El pastizal de terreno para la conservación (PTC), colindante con el área PNA es una zona de cultivo abandonada hace 20 años y reforestada en parte con pinos. Actualmente está destinada para la conservación, sin embargo el pastoreo se presentó ocasionalmente. El suelo de este sitio era irregular debido al manejo que se le daba contra la erosión; los pastos eran medianamente largos, amacollados y densos, también existían algunos arbustos. Los sitios de pastizal cercado antiguo (PCA) y pastizal cercado reciente (PCR) son propiedad de la empresa Granjas Carroll de México y están destinados para la conservación ambiental, presentan cercado eléctrico, alambrado de púas y vigilancia con el fin de evitar el pastoreo e intrusión de fauna doméstica. El PCA es una zona en la que desde hace 15 años no se presentan actividades agropecuarias; el cercado lo presenta desde hace más de 10 años lo que ha permitido la presencia de una sucesión de pastizal nativo, algunas suculentas y arbustos. El PCR no presenta prácticas agropecuarias desde hace 5 años y el cercado existe desde hace 3 años; presentó manchones de pastos cortos y abiertos y otros de pastos densos.
Figura 1
Localización de los sitios de estudio. Se muestran las principales localidades y caminos. 1 = pastizal natural gravoso (PNG), 2 = pastizal pastoreado reciente (PPR), 3 = pastizal pastoreado antiguo (PPA), 4 = pastizal natural arenoso (PNA), 5 = pastizal de terreno para la conservación (PTC), 6 = pastizal cercado antiguo (PCA), 7 = pastizal cercado reciente (PCR).
Para la captura de las ardillas, se utilizó la técnica de marcaje captura-recaptura, para lo que en cada sitio se establecieron 2 cuadrantes (1 ha) separados por 100 m. En cada uno de ellos se colocaron 36 trampas Sherman® (30×10×8 cm) separadas cada 20 m y formando una retícula. Las trampas fueron cebadas con una mezcla de hojuelas de avena y crema de cacahuate; estuvieron activas de 08:30 a 15:00 h ( Castillo-Castillo, 2009; Gurnell y Flowerdew, 2006 ) cubriendo el período de actividad de las ardillas ( Valdez y Ceballos, 1997 ). Cada cuadrante se trampeó mensualmente por 3 días consecutivos durante el período de actividad de las ardillas (marzo a octubre); los muestreos se iniciaron en junio del 2008 y finalizaron en junio del 2014. Los individuos capturados fueron identificados por medio de microchips magnéticos AVID, los cuales se insertaron en la base del cuello; posteriormente, los animales fueron sexados y pesados, se registró su edad y estado reproductivo ( Castillo-Castillo, 2009; Gurnell y Flowerdew, 2006 ) y finalmente, los organismos fueron liberados in situ ( Sikes, Gannon y The Animal Care and Use Committee of The American Society of Mammalogists, 2011 ). La densidad se obtuvo por medio del método de Lincoln-Peterson, modificado para muestras pequeñas ( Bailey, 1952; Roff, 1973 ). Debido a la discontinuidad de los valores de las densidades, en los análisis estadísticos solo se utilizó el valor máximo registrado en los sitios de estudio.
Para la caracterización de la vegetación, en cada área se delimitaron 5 cuadrantes de 10×10 m (100 m 2 ), posteriormente, cada uno se subdividió en una cuadrícula de 2×2 m (4 m 2 ) y 5 de estos espacios fueron elegidos aleatoriamente para cuantificar por especie vegetal, el número de individuos, la altura y el porcentaje de cobertura-abundancia por medio del índice de Braun-Blanquet, modificado por Van der Maarel (1979) . Se recolectaron y prepararon ejemplares de cada especie para su identificación y/o corroboración en el Herbario del Instituto de Ecología A.C. (XAL). Con el material ya identificado, se elaboró una base de datos, la cual fue utilizada para conocer la composición vegetal general de los sitios de estudio. Con esta información se elaboró un dendrograma de similitud utilizando la distancia euclidiana con datos de la presencia-ausencia de las especies vegetales de los sitios de trabajo con el fin de conocer si se trataban de ambientes similares o distintos ( McGarigal, Cushman y Stafford, 2000 ).
Se seleccionaron las 3 especies con los valores más altos de cobertura vegetal en los sitios trabajos, se les añadió la altura y la desviación estándar promedio, esta última permite conocer la variación de la altura de la vegetación presente en los sitios trabajados, debido a que es una medida utilizada para evaluar la heterogeneidad ambiental ( Zar, 1999).
Debido a que las variables utilizadas para describir el hábitat en los sitios dependen típicamente una de otra, se realizó un análisis de componentes principales (PCA) ( McGarigal et al., 2000; Pla, 1986 ). Se incluyeron las variables de la vegetación por sitio: altura, desviación estándar de la altura, cobertura y riqueza. Al análisis se añadieron las 3 primeras variables ya mencionadas para las familias Asteraceae, Poaceae, Caryophillaceae, Euphorbiaceae y Solanaceae, ya que son importantes para la ardilla de Perote al utilizarlas como refugio y/o alimento ( Castillo-Castillo, 2009; Hernández-Hernández, 2012 ). También se realizaron correlaciones de Spearman entre la cobertura, altura de la vegetación y la densidad de la ardilla. Los análisis fueron realizados utilizando el programa estadístico Past 3.10.
Resultados
Durante el período de estudio se capturaron un total de 758 ardillas, 291 hembras y 467 machos; los resultados de las densidades máximas y mínimas por sitio de estudio se muestran en la tabla 1.
Tabla 1
Densidades máximas y mínimas de la ardilla de Perote en los sitios de trabajo.
| Sitios | Máxima | Mínima |
| PNG | 30.8 | 3 |
| PPR | 51.8 | 10.1 |
| PPA | 37.4 | 7 |
| PNA | 24 | 6 |
| PTC | 18.8 | 5 |
| PCA | 20 | 1.5 |
| PCR | 28 | 3 |
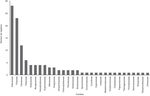
La riqueza vegetal total fue de 99 especies englobadas en 66 géneros y 26 familias ( fig. 2 ). La familia Asteraceae fue la que tuvo mayor número de especies (28), seguida por Poaceae con 24 y el tercer sitio fue ocupado por Cactaceae (12). Familias como Apocynaceae, Brassicaceae, entre otras solo estuvieron representadas por una especie.
Figura 2
Riqueza vegetal total de los sitios de trabajo.
Las riquezas de los sitios de estudio se muestran en la figura 3 , en la cual se observa un gradiente de antropización, siendo el sitio PNG el que tuvo menor grado de perturbación y la mayor riqueza (57 especies) de todos los sitios. A pesar de que los sitios PPR y PPA registraron el mismo número de especies (33), difirieron en cuanto al número de géneros y familias, por lo que el sitio PPA fue posicionado en el segundo lugar dentro de la figura. Los sitios PCA y PCR mostraron desigualdad en cuanto a su riqueza, siendo el PCA el que tuvo los valores superiores. Los sitios PCR y PTC estuvieron representados por los mismos valores de riqueza. El sitio PPG fue el de menor riqueza con solo 10 especies de 6 familias.
Figura 3
Composición vegetal de los sitios de estudio.
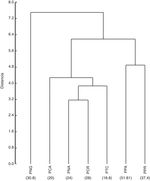
El dendrograma de similitud obtuvo un coeficiente de correlación de 0.98 y la formación de 3 grupos. La primera agrupación la formaron los sitios PPA y PPR, los cuales tuvieron las densidades más altas de la ardilla de Perote con 51.8 y 37.4 ind/ha respectivamente. El segundo grupo lo conformó un subgrupo con las áreas PNA y PCR presentando densidades superiores a 20 ind/ha, este, a su vez, presenta otro subgrupo con el sitio PTC, el cual tuvo la densidad más baja del estudio con 18.8 ind/ha. Estos 2 subgrupos se unieron con el sitio PCA, el cual tuvo una densidad de 20 ind/ha. El tercer y último grupo solo lo integró el sitio PNG con la tercera densidad más alta de este estudio, 30.8 ind/ha ( fig. 4).
Figura 4
Dendrograma de similitud de los sitios de estudio. Se muestran en paréntesis las densidades máximas de X. perotensis.
En lo que respecta al resultado del PCA, la varianza explicada de los 3 primeros ejes fue de 92.89% ( tabla 2 ). El primer componente se asoció positivamente con la riqueza y tuvo una relación negativa con la desviación estándar de la altura de los sitios y de las poáceas. El segundo componente tuvo una asociación positiva con la altura de Asteraceae y Poaceae, así como con la desviación estándar de las asteráceas. El tercer componente tuvo asociación positiva con la altura y con la variación (desviación estándar) de la altura de la vegetación de los sitios de trabajo, así como de la desviación estándar de la altura de las poáceas.
Tabla 2
Resultados del análisis de componentes principales con respecto a la caracterización de las especies vegetales de las localidades de estudio. Se presenta la varianza explicada y acumulada por cada componente y el peso de contribución de cada variable. Se señalan en negritas los valores más altos.
| CP 1 | CP 2 | CP 3 | |
| Eigenvalores | 505.307 | 107.636 | 62.912 |
| Varianza explicada | 69.457 | 14.795 | 8.6475 |
| Riqueza | 0.72886 | 0.064696 | 0.37953 |
| Altura promedio de la vegetación de los sitios | −0.12927 | 0.34783 | 0.41085 |
| DS de la altura de la vegetación de los sitios | −0.32529 | −0.074349 | 0.54768 |
| Cobertura sitio | −0.0064523 | −0.019272 | −0.01337 |
| Altura Asteraceae | −0.036296 | 0.60876 | −0.0012105 |
| Desviación estándar altura Asteraceae | 0.027513 | 0.34975 | −0.033569 |
| Cobertura Asteraceae | 0.01805 | −0.073563 | −0.077206 |
| Altura Caryophyllaceae | 0.31512 | 0.043242 | 0.36089 |
| Desviación estándar Caryophyllaceae | 0.1089 | −0.035992 | 0.1859 |
| Cobertura Caryophyllaceae | −0.056028 | 0.13655 | 0.035121 |
| Altura Poaceae | −0.27941 | 0.48107 | 0.030146 |
| Desviación estándar Poaceae | −0.38838 | −0.31142 | 0.43273 |
| Cobertura Poaceae | −0.0055766 | 0.13792 | −0.089479 |
| Altura Solanaceae | −0.0049074 | 0.0071438 | −0.036768 |
| Desviación estándar Solanaceae | 0.0014722 | −0.0021431 | 0.01103 |
| Cobertura Solanaceae | 0.014722 | −0.021431 | 0.1103 |
| Altura Euphorbiaceae | −0.0037285 | 0.0080622 | 0.022165 |
| Desviación estándar altura Euphorbiaceae | 0.016302 | −0.016222 | −0.059366 |
| Cobertura Euphorbiaceae | 0.0057025 | 0.0227 | 0.0087197 |
Dentro de la representación del PCA se aprecian 3 agrupaciones de los sitios de estudio, la primera constituida por los sitios PTC, PNA, PCR y PCA, en donde las densidades de la ardilla de Perote fueron similares ( tabla 1 ). La segunda agrupación se integró por los sitios PPR y PPA, áreas con las densidades más altas 51.8 y 37.4 ind/ha respectivamente. El tercer conjunto solo lo integró PNG, con una densidad de 30.8 ind/ha ( fig. 5).
Figura 5
Análisis de componentes principales. Alt sitio: altura promedio de la vegetación de los sitios; Aster_alt: altura Asteraceae; Aster_cob: cobertura Asteraceae; Aster_Ds: desviación estándar altura, Asteraceae; Cary_alt: altura Caryophillaceae; Cob_Cary: cobertura Caryophyllaceae; Cob_Eup: cobertura Euphorbiaceae; Cob_sit: cobertura sitio; Cob_sol: cobertura Solanaceae; DS_al_sit: desviación estándar de la altura de la vegetación de los sitios; DS_Cary: desviación estándar Caryophyllaceae; Ds_Eup: desviación estándar altura Euphorbiaceae; DS_sol: desviación estándar Solanaceae; Eup_alt: altura Euphorbiaceae; Poa_alt: altura Poaceae; Poa_Cob: cobertura Poaceae; Poa_DS: desviación estándar Poaceae; Sol_alt:altura Solanaceae. Se muestran en paréntesis las densidades máximas de X. perotensis.
Las variables que explican una mayor relación dentro del PCA fueron la riqueza, la cual estuvo más asociada con los sitios PPA, PPR y PNG. La altura promedio y la desviación estándar de la vegetación de los sitios, junto con la altura y desviación estándar de las poáceas también tuvieron un peso importante dentro del análisis, en particular con la primera agrupación del PCA antes mencionada. La altura y desviación estándar de las asteráceas también estuvo altamente relacionada con los sitios PCA, PCR, PPR y PPA.
Los resultados de las 3 especies vegetales que tuvieron mayor cobertura en los sitios de trabajo se muestran en la tabla 3 . Las especies con mayor cobertura fueron los pastos B. scorpioides, Aristida havardii y Jarava ichu; papavaráceas como Argemone platyceras y cariofiláceas como Arenaria lycopodioides. Los sitios PNG y PNA fueron dominados por poáceas, contrastando con los demás sitios en donde las asteráceas, cariofiláceas, boragináceas y cactáceas también dominaron con su cobertura. La especie más común fue J. ichu , ya que dominó en su cobertura en 6 de los 9 sitios de trabajo, así como presentó los promedios de alturas y desviaciones estándar mayores. Los resultados de las correlaciones no mostraron una fuerte relación estadística entre la altura, r = -0.4 y cobertura r = -0.3 de la vegetación y las densidades de X. perotensis.
Tabla 3
Especies vegetales con las coberturas más altas en los sitios de estudio. Se muestra su cobertura, altura y desviación estándar promedio.
| Sitios | Familia | Especies | Cobertura | Altura (cm) | DS altura (cm) |
| PNG | Poaceae | Aristida havardii | 5 | 8 | 3 |
| PNG | Poaceae | Sclerepogon brevifolius | 5 | 12 | 3 |
| PNG | Poaceae | Jarava ichu | 5 | 13 | 4 |
| PPR | Poaceae | Jarava ichu | 5 | 13 | 4 |
| PPR | Asteraceae | Bidens anthemoides | 5 | 14 | 3 |
| PPR | Brassicaceae | Brassica campestris | 5 | 17 | 2 |
| PPA | Asteraceae | Parthenium bipinnatifidum | 5 | 15 | 4 |
| PPA | Boraginaceae | Heliotropium confertifolium | 5 | 14 | 5 |
| PPA | Poaceae | Aristida divaricata | 5 | 16 | 3 |
| PNA | Poaceae | Jarava ichu | 6 | 48 | 18 |
| PNA | Poaceae | Arenaria lycopodioides | 7 | 9 | 1 |
| PNA | Poaceae | Aristida havardii | 7 | 15 | 1 |
| PTC | Poaceae | Jarava ichu | 8 | 40 | 9 |
| PTC | Caryophyllaceae | Arenaria lycopodioides | 9 | 4 | 1 |
| PTC | Papavaraceae | Argemone platyceras | 9 | 15 | 2 |
| PCA | Poaceae | Jarava ichu | 5 | 39 | 8 |
| PCA | Caryophyllaceae | Arenaria lycopodioides | 6 | 11 | 1 |
| PCA | Poaceae | Bouteloua scorpioides | 6 | 27 | 4 |
| PCR | Poaceae | Bouteloua scorpioides | 5 | 25 | 0 |
| PCR | Poaceae | Jarava ichu | 6 | 63 | 17 |
| PCR | Poaceae | Aristida havardii | 8 | 26 | 2 |
Discusión
Los resultados sobre la vegetación del hábitat de la ardilla de Perote revelaron una riqueza importante en los sitios de estudio, los cuales estuvieron dominados principalmente por las familias Asteraceae, Poaceae, Euphorbiaceae, Convulvulaceae y Solanaceae, coincidiendo con lo señalado por Rzedowski (2006) , como familias distintivas de pastizales. Esta riqueza es el resultado de la ubicación que presenta el valle de Perote, la cual brinda de condiciones únicas que permiten el desarrollo de diversos organismos ( Gámez et al., 2012 ). Los sitios que presentaron mayor riqueza vegetal fueron los de menor grado de transformación antropogénica y los sitios más alterados presentaron menor riqueza, lo cual pudo deberse a que las especies oportunistas e introducidas aprovecharon los disturbios ambientales para lograr su establecimiento, remplazando a las plantas nativas ( Collins y Barber, 1986; Pasch y Koprowski, 2011; Sánchez-Ken, Zita y Mendoza, 2012 ).
Los resultados sugieren que una altura de 20 cm y una cobertura de la vegetación poco extendida puede determinar la presencia de la ardilla de Perote, ya que estas pueden beneficiarse de ellas utilizándolas como refugio ( Castillo-Castillo, 2009; Hernández-Hernández, 2012 ), ante posibles depredadores como Crotalus spp., Buteo jamaicensis, Falco mexicanus, Mustela frenata y Canis familiaris ( Best y Ceballos, 1995; Castillo-Castillo, 2009; García-Domínguez y Priego-Hernández, 2014; Montero-Bagatella y González-Romero, 2014 ).
Estudios como los de Murie y Michener (1984), Yensen y Sherman (2003), Fehmi, Russo y Bartolome (2005) , Hannon, Jenkins, Crabtree y Swanson (2006) y Bylo, Koper y Molloy (2014) han demostrado que las ardillas terrestres prefieren los pastos cortos, debido a que permiten avistar a los depredadores, una libre entrada a las madrigueras y una comunicación visual con sus congéneres. Los resultados obtenidos, permiten inferir que la estructura de la vegetación influyó sobre las densidades de la ardilla de Perote, ya que en sitios como PNG, PPR y PPA la altura promedio de la vegetación no rebasó los 20 cm y las densidades de la ardilla fueron las más altas. En sitios como PNA, PCA y PCR donde las densidades de la ardilla fueron menores, los promedios de las alturas de vegetación fueron mayores a los 20 cm, incluso las variaciones de altura llegaron a ser superiores a dicho nivel; aunque el sitio PTC tuvo una altura inferior a los 20 cm su desviación estándar fue de 19 cm. Estos resultados pueden deberse a que estos últimos sitios ya no están expuestos a pastoreos o disturbios inducidos, lo que ha permitido que la vegetación desarrolle alturas y coberturas mayores. Trabajos como los de Humphrey (1962) y Pasch y Koprowski (2011) mencionan que una forma natural de inhibir el establecimiento de arbustos y pastos altos es por medio de los incendios naturales, típicos de pastizales, que permiten a los organismos de talla pequeña como las ardillas, el tener visibilidad ante los depredadores y vías de escape libres. También impiden que los organismos recorran grandes distancias cuando se dispersan ( Greene, Anthony, Marr y Morgan, 2009 ) o estén en búsqueda de alimento, ya que las cenizas fertilizan el suelo y promueven el crecimiento de plantas con flores y pastos nuevos, que son más nutritivos, digeribles y apetecibles que los pastos desarrollados ( Lohr, Yensen, Munger y Novak, 2013; Pasch y Koprowski, 2011 ). Sin embargo, si los incendios son recurrentes e intensos como ocurrió en las áreas PNA y PTC, la recuperación del sistema podría tardar más de un año y el establecimiento de organismos podría atrasarse aún más, por lo que dicha práctica implica extremo cuidado en su aplicación ( Humphrey, 1962).
Otra manera de promover la heterogeneidad vegetal y los pastos cortos es a través del pastoreo ( Fehmi et al., 2005; Gerez-Fernández, 1985; Hoffman, Milessi, Huber, Lammina y Dittami, 2003; Huntly, 1991 ). Años atrás, el berrendo ( Antilocapra americana ) era un herbívoro natural que cumplía tales funciones, tras su exterminio hace más de 400 años ( Gerez-Fernández, 1985), el ganado caprino (Capra hircus ) sería el más adecuado para sustituirlo, ya que son organismos resistentes a las sequías y a la ausencia de alimento ( Rzedowski, 2006). No obstante, Collins y Barber (1986) y Huntly (1991) señalaron que el manejo pecuario en zonas naturales debe hacerse con cautela debido a que el sobrepastoreo es una alteración más intensa que los incendios, ya que impide el desarrollo y la reproducción de las especies más nutritivas y apreciadas, propiciando el crecimiento de plantas que el ganado no consume y fomentando la erosión del suelo, lo que puede afectar negativamente las densidades de los herbívoros nativos, y por lo tanto, eliminarse los beneficios que proveen al ecosistema ( Best y Ceballos, 1995; Stoddart, Smith y Box, 1975 ).
Algunos estudios han demostrado que en pastizales donde habitan grandes herbívoros ( Coppock, Ellis, Detling y Dyer,1983 ) o ganado vacuno (Derner, Detling y Antolin, 2006 ); esciúridos, tales como los perritos de las praderas presentaron densidades más altas que en zonas en donde estos no habitaban. Fehmi et al. (2005) explican que este fenómeno se debe a que no existe competencia por los recursos alimentarios entre el ganado y los esciúridos, sino que esta ocurre entre los pequeños mamíferos. En nuestro estudio, el pastoreo y la agricultura existió en diferentes tiempos e intensidades en todos los sitios de trabajo, actualmente únicamente los sitios PTC, PCA y PCR han sido destinados para la conservación y solo los 2 últimos sitios presentan barreras físicas para exclusión del ganado, mientras que las demás áreas continúan sirviendo de paso ganadero. Si las actividades agropecuarias tuvieran un manejo adecuado, podrían convertirse en una oportunidad para la conservación de la ardilla de Perote como lo sugirieron García-Domínguez et al. (2014) , apoyados por las observaciones de la especie en terrenos agrícolas por Mendoza-Carreón (2009) , al indicar una asociación positiva entre el pastoreo ligero y la ardilla de Perote. Sin embargo, la mayoría de las tierras de los sitios trabajados son ejidales, por lo que su tenencia y uso es incierto, dejando un futuro inseguro para las especies nativas ( Valdez, Guzmán-Aranda, Abarca, Tarango-Arámbula y Clemente-Sánchez, 2006 ).
Todas las perturbaciones del hábitat de la ardilla pudieron alterar la distribución de los recursos y la calidad del hábitat, por lo que la presencia, conducta y distribución de estos animales también pudo modificarse ( Castillo-Castillo y González-Romero, 2010; Van Horne, 1983; Rizo-Aguilar et al., 2014 ). Dentro de la distribución de los recursos alimentarios, se tuvieron especies como B. scorpioides y S. brevifolius , las cuales forman parte de la dieta de la ardilla ( Hernández-Hernández, 2012 ) y fueron abundantes en el área PNG, no obstante que su contenido nutricional es bajo comparado con Erigeron pubescens (Hernández-Hernández, 2012 ), el cual tiene altos valores nutricionales pero fue poco abundante e incluso ausente en los sitios PNA, PCA y PCR. Con tal oferta de recursos, la ardilla de Perote se alimentará de las especies a las cuales tiene acceso y/o sean más abundantes, en lugar de elegir a las que tengan mejor calidad como lo mencionó Hernández-Hernández (2012) ; sin embargo, estos recursos pueden determinar las abundancias de las especies como lo reportaron Greene et al. (2009) en su estudio, al encontrar una asterácea, Artemisia spp. que determina la presencia de ardillas terrestres, ya que le proveen de alimento, agua y protección contra depredadores.
Exceptuando al sitio PTC, la densidad de X. perotensis fue superior a lo propuesto por Yensen y Sherman (2003) como densidad mínima viable para ardillas terrestres de 20 ind/ha. Áreas como las PPR y PPA estuvieron cercanas a duplicar la densidad mínima viable, lo cual pudo ser producto de las condiciones que existían como los pastos cortos y la presencia de suficientes recursos para su desarrollo ( Castillo-Castillo y González-Romero, 2010; Montero-Bagatella y González-Romero, 2014; Van Horne, 1983 ). Al analizar las densidades poblacionales, es importante recordar que el estudio se realizó en diferentes años, siendo 2008 el de densidades más altas; en los años subsecuentes, estas disminuyeron en áreas cercanas o a lo reportado en años anteriores, evidenciando descensos poblacionales a causa de los disturbios ambientales, presiones antrópicas y cambios en la disponibilidad de los recursos, que han mermado la presencia y establecimiento de la especie ( Montero-Bagatella y González-Romero, 2014 ). El sitio que no ha sufrido de drásticas transformaciones, por ser menos accesible y cercano al desarrollo humano fue el sitio PNG, de modo que la vegetación que presenta puede considerarse como la más natural u original del valle de Perote ( Delgadillo-Quezada, 2011 ). La presencia de 30 especies vegetales exclusivas de este sitio, asteráceas, cactáceas y poáceas principalmente, influyó en que los resultados del dendrograma y del PCA lo diferenciaran de las demás áreas; además, fue el sitio con mayor riqueza vegetal y tuvo la tercera densidad más alta del estudio, por lo que manifestó características adecuadas para la persistencia de la especie.
Considerando la altura y cobertura de la vegetación de los sitios trabajados, planteamos que los más adecuados para el desarrollo de la ardilla de Perote fueron las áreas PNG, PPR y PPA, en los cuales la especie pudo obtener los recursos de protección, avistamiento a depredadores y alimento necesario. En dichos sitios se podría promover la presencia de la especie, ya que los individuos han resistido continuos disturbios naturales e inducidos, los cuales han reducido su restringida área de distribución y provocando descensos poblacionales ( Mendoza-Carreón, 2009; Montero-Bagatella y González-Romero, 2014; Ochoa, Gasca, Ceballos y Eguiarte, 2012; Sánchez-Cordero et al ., 2005 ). Estos resultados incrementan el conocimiento acerca de la ecología de la especie y en estudios futuros se podrían considerar otras variables como el tipo de suelo, pedregosidad, la cantidad de alimento disponible o el número de depredadores, con el fin de conocer si existe una relación entre estas variables y la densidad ( Greene et al., 2009; Lohr et al., 2013 ). Además, la información presentada puede utilizarse para generar estrategias para la conservación del hábitat de la ardilla, que junto con acciones locales y gubernamentales podrían ayudar no solo a conservar a la especie, sino a otros endemismos de flora y fauna ( Gámez et al., 2012; González-Ruíz et al., 2005; Valdez, Guzmán-Aranda, Abarca, Tarango-Arámbula y Clemente-Sánchez, 2006 ).
Agradecimientos
SHMB agradece al Consejo Nacional de Ciencia y Tecnología la beca otorgada (Núm. 233712). A C. Castillo-Castillo, G. Delgadillo y A. González-Gallina por proporcionarnos sus datos de campo para complementar el estudio. A Pedro Franco e Israel Acosta por su ayuda en la colecta e identificación de ejemplares de la vegetación. Al Herbario XAL por las facilidades brindadas para la realización de este estudio y a todas las personas que amablemente ayudaron en el trabajo de campo. Agradecemos a A. Sandoval por su apoyo en SIG y a L. García-Feria por sus oportunos comentarios para el escrito. Los autores agradecen a la Dirección General de Vida Silvestre por los permisos otorgados (SGPA/DGVS/05833/08 y SGPA/DGVS/03369/15) y a Granjas Carroll de México, S. de R.L, de C.V especialmente a los Ings. Tito Tablada, Héctor Flores y Noemí Rosas.
Referencias
Aguilar, C., Martínez E. y Arriaga L. 2000. Deforestación y fragmentación de ecosistemas: ¿qué tan grave es el problema en México?. Biodiversitas. 30: 7-11.
Álvarez-Castañeda, S. T., Castro-Arellano I., Lacher S. T, y Vázquez E. 2008. Spermophilus perotensis. The IUCN Red List of Threatened Species. Version 2014. 2. http://www.iucnredlist.org
Bailey, N. 1952. Improvements in the interpretation of recapture data. Journal of Animal Ecology. 21:120-17.
Best, T. y Ceballos G. 1995. Spermophilus perotensis. Mammalian Species. 507:1-3.
Castillo-Castillo, C. 2009. Densidad, estructura poblacional y hábitat de la ardilla endémica de Perote (Spermophilus perotensis Merriam, 1893). Tesis. Instituto de Ecología, A. C. México. 90 p.
Challenger, A., y Soberón J. 2008. Los ecosistemas terrestres, en Capital natural de México, vol. I: Conocimiento actual de la biodiversidad. Comisión nacional para el conocimiento y uso de la biodiversidad. México. 87-108.
Céspedes-Flores, S. E. y Moreno-Sánchez E. 2010. Estimación del valor de la pérdida de recurso forestal y su relación con la reforestación en las entidades federativas de México. Investigación ambiental. Ciencia y política pública. 2: 5-12.
Coppock, D. L., Ellis. J. E., Detling J. K., y Dyer M. I. 1983. Plant-Herbivore Interactions in a North American Mixed-Grass Prairie II. Responses of Bison to Modification of Vegetation by Prairie Dogs. Oecologia. 56:10-15.
Delgadillo-Quezada, G. 2011. Distribución, selección de hábitat y densidad de la liebre torda (Lepus callotis, Wrangler, 1830) en el Valle de Perote. Tesis. Instituto de Ecología, A. C. Xalapa, Ver. México. 95 p.
Derner, J. D., Detling J. K. y Antolin M. F. 2006. Are livestock weight gains affected by Black-Tailed Prairie Dogs?. Frontiers in Ecology and the Environment. 4 (9): 459-464.
Gámez, N., Escalante T., Rodríguez G., Linaje M. y Morrone J. 2012. Caracterización biogeográfica de la Faja Volcánica Transmexicana y análisis de los patrones de distribución de su mastofauna. Revista Mexicana de Biodiversidad. 83:258-272.
Gerez-Fernández, P. 1985. Uso del suelo durante cuatrocientos años y cambio fisionómico en la zona semiárida Poblano-Veracruzana, México. Biótica, 10 (2): 123-144.
Greene, E., Anthony, R. G., Marr, V. y Morgan R. 2009. Abundance and hábitat associations of Washington Ground Squirrels in the Columbian Basin, Oregon. The American Midland Naturalist. 162: 29-42.
Hernández-Hernández, J. C. 2012. Variación estacional y calidad de la dieta de la ardilla terrestre Xerospermophilus perotensis, Merriam 1893, en la localidad el Frijol Colorado, municipio de Perote, Veracruz. Tesis. Instituto de Neuroetología. Universidad Veracruzana. México. 61 p.
García-Domínguez, J. A., Rojas-Soto O. R., Galindo-González J. R., González-Romero, A., Pineda-López, M, R. y Noa-Carrazana J. C. 2014. Present and future potencial distribution of the endemic Perote Ground Squirrel Xerospermophilus perotensis under different climate changes scenarios Mammalia. 78: 507-521.
García-Domínguez, J.A y Priego-Hernández E. 2014. Predation record a Perote ground squirrel (Xerospermophilus perotensis) by a prairie falcon (Falco mexicanus) Mammalia. 79: 232-236.
González-Gallina, A., Benítez-Baldillo G., Rojas-Soto O. R. e Hidalgo-Mihart M. G. 2013. The small, the forgotten and the dead: highway impact on vertebrates and its implications for migitation strategies. Biological Conservation. 22: 325-342.
González-Ruíz, N., Álvarez-Castañeda S. T. y Álvarez S. 2005. Distribution, taxonomy and conservation status of the Perote mouse Peromyscus bullatus (Rodentia: Muridae) in Mexico. Biodiversity and Conservation. 14: 3423-3436.
Gurnell, J., y Flowerdew J. R. 2006. Live trapping small mammals: a practical guide. Cuarta edición. The Mammal Society. Inglaterra. 48 p.
Hoogland, J. 2007. Conservation of prairie dogs. En: Wolff, J. y P. Sherman (Eds). Rodent societies, an ecological and evolutionary perspective. The University of Chicago Press. Chicago. EU. p. 472- 4776.
Humphrey, R. 1962. Range ecology. The Ronald Press. Company. EU. 234 pp.
Huntly, N. 1991. Herbivores and the dynamics of communities and ecosystems. Annual Review of Ecology and Systematics. 22: 477-503.
Lohr, K., Yensen E., Munger J. C. y Novak, S. J. Relationship between habitat characteristics and densities of Southern Idaho ground squirrels. The Journal of Wildlife Management. 983-993.
Luna, I., Morrone J. J. y Espinosa D. 2007. Biodiversidad de la Faja Volcánica Transmexicana. Comisión Nacional para la Biodiversidad. Instituto de Biología, Universidad Nacional Autónoma de México. México. 514 p.
Mares, M. A. 1985. Conservation in South America: problems, consequences, and solutions. Science. 233: 734-739.
Matlack, R. S, Kaufman, D., W. y Kaufman, G. A. 2008. Influence of woody vegetation on small mammals in tallgrass prairie. The American Midland Naturalist: 160: 7-19.
McGarigal, K., Cushman S. y Stafford S. 2000. Multivariate statistics for wildlife and ecology research. Springer. EU.383 p.
Medina, M. y Angulo M. 1990. Atlas climático del Municipio de Perote (Estado de Veracruz). Instituto de Ecología, A. C. México.
Mendoza-Carreón, G. 2009. Distribución y relaciones filogenéticas del moto (Spermophilus perotensis). Tesis. Instituto de Ecología, A. C. Xalapa, Ver., México. 76 p.
Montero-Bagatella, S. H. y González-Romero A. 2014. Análisis demográfico de una especie en estado crítico: la ardilla de Perote. Therya. 5 (3): 737-750.
Ochoa A., Gasca J., Ceballos G. y Eguiarte L. 2012. Spatiotemporal population genetics of the endangered Perote ground squirrel (Xerospermophilus perotensis) in a fragmented landscape. Journal of Mammalogy. 93:1061-1074.
Pasch, B. y Koprowski J. L. 2011. Impacts of fire supression on space use by Mexican fox squirrels. Journal of Mammalogy. 92 (1): 227-234.
Pla, L. 1986. Análisis multivariado: método de componentes principales. Secretaría General de los Estados Americanos. Programa de Desarrollo Científico y Tecnológico. EU. 94 p.
Rabinowitz, A. 1993. Wildlife Field Research and Conservation Training Manual. Paul- Art Press Inc. EU. 281 p.
Rizo-Aguilar, A., Guerrero J. A., Hidalgo-Mihart M. G. y González-Romero A. 2015. Relationship between the abundance of the Endangered volcano rabbit Romerolagus diazi and vegetation structure in the Sierra Chichinautzin mountain range, Mexico. Oryx. 49 (2): 360-365.
Roff, D. 1973. On the accuracy of same mark-recapture estimator. Oecology. 12:15-34.
Rzedowski, J. 2006. Vegetación de México. 1ra. Edición digital, Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. México.
Sánchez-Cordero, V., P. Illoldi-Rangel., M. Linaje., S. Sarkar. y Townsend A. 2005. Deforestation and extant distribution of Mexican endemic mammals. Biological Conservation. 126:465-473.
Sánchez-Ken, J., Zita G. y Mendoza M. 2012. Catálogo de las gramíneas malezas nativas e introducidas de México. Consejo Nacional Consultivo Fitosanitario. Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. Asociación Mexicana de la Ciencia de la Maleza ASOMECIMA, A.C. p. 433.
Secretaría del Medio Ambiente y Recursos Naturales (SEMARNAT). 2010. Norma Oficial Mexicana NOM-059-SEMARNAT-2001, Protección ambiental-especies nativas de México de flora y fauna silvestre- Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio- Lista de especies en riesgo. Diario Oficial de la Nación (Segunda sección). México. 85 p.
Sikes, R. S., Gannon W. L., y The Animal Care and Use Committee of The American Society of Mammalogists. 2011. Guidelines of The American Society of Mammalogists for the use of Wild Mammals in Research. Journal of Mammalogy 92:235-253.
Stoddart, L., Smith, A. y Box T. 1975. Range management. Mc Graw Hill. Tercera edición. Nueva York. EU. 532 p.
Valdez, M. y Ceballos G. 1997. Conservation of endemic mammals of Mexico: the Perote ground squirrel (Spermophilus perotensis). Journal of Mammalogy. 78: 74-82.
Valdez, M. 2003. Las ardillas de México. Biodiversitas. 51: 1-7.
Maarel, Van Der E. 1979. Transformation of cover-abundance values in phytosociology and effects on community similarity. Vegetation 38:143-156.
Valdez, R., Guzmán-Aranda J. C., Abarca., F. J., Tarango-Arámbula L. A. y Clemente-Sánchez F. 2006. Wildlife Conservation and Management in Mexico. Wildlife Society Bulletin. 34: 270-282.
Van Horne, B. 1983. Density as a misleading indicator of habitat quality. Journal of Wildlife Management. 47: 893-901.
Yensen, E. y Sherman P. W. 2003. Ground squirrels: Spermophilus and Amnospermophilus species. In Wild Mammals of North America: Biology, Management and Conservation (Feldhamer G. A., Thomson B. C y Chapman J. A, eds). p. 211-231. Segunda Edición. The Johns Hopkins University Press. Baltimore, Maryland, E.U.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.
*
Autor para correspondencia.
Copyright © 2017 Universidad Nacional Autónoma de México, Instituto de Biología.