Araceli López-Puebla * y Rubén Pineda-López
Universidad Autónoma de Querétaro, Facultad de Ciencias Naturales, Av. de las Ciencias s/n, 76230 Juriquilla, Querétaro, México
*Autor para correspondencia: a.lopp7@gmail.com (A. López-Puebla)
Recibido: 20 marzo 2020; aceptado: 16 diciembre 2020
Resumen
La paloma de collar turca, el perico monje argentino, el estornino pinto y el mirlo dorso canela se registraron por primera vez hace una década en la ciudad de Querétaro. En otros países, las 3 primeras especies son consideradas invasoras y causan problemas socioeconómicos y ecológicos. A fin de dar seguimiento a estas especies, en el presente estudio se analizó la abundancia y ocupación de las 4 especies mencionadas, su preferencia de hábitat y su coexistencia con aves locales en áreas verdes de la ciudad de Querétaro. Se hizo un muestreo estacional de la avifauna en 19 áreas verdes de la ciudad y se midieron 13 variables ambientales. Se encontró que la paloma de collar turca y el perico monje argentino han aumentado sus poblaciones y ocupación a 10 años de sus primeros registros, mientras que el mirlo dorso canela y el estornino pinto parecen tener poblaciones estables. Las principales características seleccionadas de las áreas verdes por estas especies son el tamaño, la diversidad de coberturas y la complejidad. Se presentó poca coexistencia con aves locales y no se registraron agresiones interespecíficas. Al encontrarse una importante cantidad de nidos de perico monje argentino en la ciudad, se sugiere controlar su crecimiento poblacional.
Palabras clave: Streptopelia decaocto; Myiopsitta monachus; Turdus rufopalliatus; Sturnus vulgaris; Abundancia; Ocupación; Especies invasoras
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Habitat preference of exotic birds and their co-occurrence with local birds in green areas of Queretaro City
Abstract
In Queretaro City, four exotic bird species were recorded for the first time a decade ago: the Eurasian Collared-Dove, the Monk Parakeet, the European Starling and the Rufous-backed Robin. In other countries, the first 3 species represent socioeconomic and ecological problems, and are considered invasive species. The present study analyzed the abundance and occupancy of these 4 species, their habitat preference and co-occurrence with local birds in green areas of Queretaro City. A seasonal avifauna inventory was conducted in 19 green spaces in the city and 13 environmental variables were measured. After 10 years from the first records, it was found that the Eurasian Collared-Dove and the Monk Parakeet have increased their populations and occupancy, whereas the Rufous-backed Robin and the European Starling currently seem to have stable populations. The most important selected characteristics of greenspaces are the size, coverage diversity and complexity. The exotic birds presented low co-occurrence with local birds and any interspecific aggression was recorded. Given the high number of Monk Parakeet’s nests found, we suggest that their removal could help control its population growth.
Keywords: Streptopelia decaocto; Myiopsitta monachus; Turdus rufopalliatus; Sturnus vulgari; Abundance; Occupancy; Invasive species
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
El aumento en la introducción de especies va de la mano con el imparable crecimiento poblacional humano y su desarrollo urbano. Por ello, en los últimos años el estudio de las invasiones biológicas ha tomado mayor interés entre la comunidad científica (Elton, 1958; Richardson y Pyšek, 2008). La introducción de especies puede tener efectos socioeconómicos y ecológicos en los sitios receptores, ya que éstas se pueden convertir en especies invasoras (Pimentel et al., 2005; Richardson et al., 2000). Para mitigar tales efectos es necesario estudiar la biología de las especies introducidas, y llevar a cabo estudios en los sitios de nueva ocupación, a fin de conocer las interacciones ecológicas que han desarrollado. Entre las especies invasoras uno de los grupos más estudiados es el de las aves, para las cuales se ha propuesto que su éxito invasor se debe principalmente al oportunismo ecológico, es decir, que las aves invasoras son capaces de explotar recursos que las aves nativas no usan (Beissinger y Osborne, 1982; MacGregor-Fors et al., 2011; Sol et al., 2012; Zuria et al., 2012).
Las ciudades son un punto clave en el estudio de las especies invasoras, pues muchas especies exóticas se benefician de las zonas urbanas por ser islas térmicas, fuentes seguras de alimento todo el año, áreas con escasos depredadores naturales y por presentar una alta disponibilidad de sitios para anidar (Chace y Walsh, 2006; Evans et al., 2009), aun cuando las ciudades significan hábitats fragmentados con disturbios constantes y contaminación de suelo, agua y aire (Shanahan et al., 2014). La urbanización tiende a favorecer a aves granívoras y omnívoras, además de aquellas que anidan en huecos, por lo que la composición vegetal y la estructura de las zonas urbanas son características importantes para el establecimiento de especies invasoras (Chace y Walsh, 2006). En la ciudad de Querétaro la paloma de collar turca (Streptopelia decaocto), el perico monje argentino (Myiopsitta monachus), el mirlo dorso canela (Turdus rufopalliatus) y el estornino pinto (Sturnus vulgaris) son especies exóticas de reciente introducción con potencial invasor. Los primeros registros en Querétaro del estornino pinto y del mirlo dorso canela se documentaron en el 2009 y en el 2011 se registró a la paloma de collar turca y al perico monje argentino (Pineda-López y Malagamba-Rubio, 2009, 2011).
Se sabe que estas especies interactúan con especies de aves locales que pueden verse afectadas por competencia, desplazamiento o agresión interespecífica como la paloma de alas blancas, la tortolita canela, el mirlo primavera, el gorrión doméstico y el carpintero cheje (Chablé-Santos et al., 2012; Ingold, 1996; Macgregor-Fors et al., 2011). Después del 2011 se han realizado pocas observaciones sistemáticas de estas especies en Querétaro (Pineda-López et al., 2013), por lo que los objetivos de este estudio fueron analizar las preferencias de hábitat de la paloma de collar turca, el perico monje argentino, el mirlo dorso canela y el estornino pinto, así como su ocupación y abundancia en áreas verdes de la ciudad de Querétaro e identificar coexistencias con las especies de aves locales. Esperamos inicialmente que las especies estudiadas estuvieran relacionadas con diferente intensidad a la cobertura vegetal de las áreas verdes urbanas, y que co-ocurrieran con especies que favorecieran su establecimiento, como el carpintero cheje con el estornino pinto, o que no co-ocurrieran con posibles especies competidoras, como la paloma de alas blancas con la paloma de collar turca.
Materiales y métodos
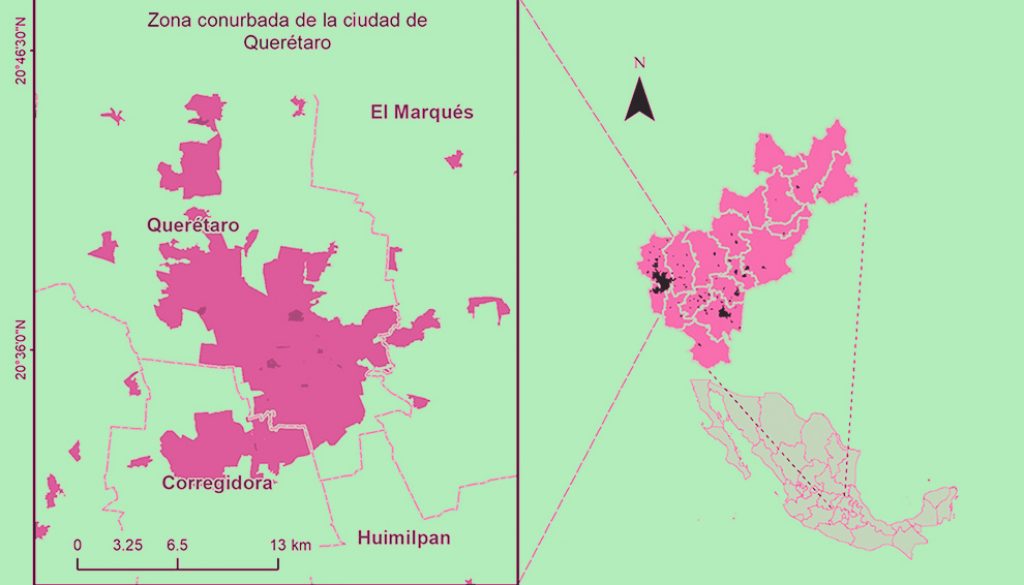
El muestreo de poblaciones de aves se llevó a cabo con observaciones directas en puntos de conteo fijos de 50 m de radio, ubicados cada 100 m en 19 áreas verdes (unidades de muestreo, de aquí en adelante) dentro de la zona urbana de Querétaro (fig. 1). Estas unidades de muestreo se escogieron debido a que las especies de aves exóticas suelen establecerse primero en áreas urbanas para después colonizar otras zonas, además de que se favorecen con la vegetación no nativa (Camacho-Cervantes y Schondube, 2018). El tamaño de las unidades de muestreo fue variable: las más pequeñas contaron con un solo punto de conteo, mientras que las más grandes contaron con hasta 23 puntos de conteo. Se ubicaron un total de 100 puntos de conteo en las 19 unidades de muestreo, las cuales incluyen áreas verdes en escuelas, parques públicos, un panteón y zonas residenciales (tabla 1). En estas unidades se ha documentado la presencia de las aves exóticas en estudios anteriores y con registros ocasionales no publicados (Malagamba-Rubio et al., 2013; Pineda-López y Malagamba-Rubio, 2009, 2011; Pineda-López et al., 2013).
El muestreo se realizó de enero a diciembre del 2018 para incluir las 4 estaciones del año, visitando todas las unidades por triplicado en cada estación durante las primeras 4 horas a partir de la salida del sol. Se registraron todos los individuos de cada especie detectados visualmente en cada punto de conteo durante 5 minutos con ayuda de binoculares Vortex 10 × 32 mm (Fuller y Langslow, 1984). La identificación a nivel de especie se realizó con ayuda de la guía de campo Sibley (Sibley, 2016). Además, se registraron las conductas agresivas interespecíficas. En caso de alguna agresión, se agregaron 5 minutos de observación para documentar mejor dicha conducta.
La abundancia y la ocupación se analizaron por cada estación del año. Se consideró para cada estación el número máximo de individuos observados en alguna de las 3 repeticiones en cada punto (Johnson, 2008) y, posteriormente, se obtuvo la abundancia por unidad de muestreo sumando las abundancias máximas de puntos no contiguos (únicamente para la abundancia), lo que permitió evitar en lo posible el conteo doble de un mismo individuo. La ocupación se consideró como la cantidad de unidades de muestreo en donde se registró a cada especie.
Las variables ambientales que se midieron fueron: la cobertura arbórea (CA), arbustiva (Ca), de pasto (CP), de pasto sintético (CPS), de zonas impermeables (CZI, como pavimento, concreto y edificios) y de suelo desnudo (CSD); además la altura arbórea máxima (AMA), la densidad foliar máxima (DFM), el diámetro máximo a la altura del pecho (DAP), el área (A), el perímetro (P), el índice de forma (SHAPE) y la distancia al borde urbano (DBU) de cada unidad de muestreo. Las coberturas, áreas, perímetros y distancias al borde urbano se obtuvieron mediante el programa QGIS versión 3.10 (QGIS Development Team, 2020). En el caso de la distancia al borde urbano, se utilizó la herramienta de medición de distancia de dicho programa; la densidad foliar máxima se obtuvo con un densiómetro esférico cóncavo, el valor obtenido por la cuadrícula se multiplicó por 1.04 y restado a 100. El índice de forma se obtuvo multiplicando 0.25 por el valor del perímetro y dividiéndolo entre la raíz cuadrada del área (McGarigal, 2015).
Para analizar los cambios estacionales, se sumaron las abundancias de aves exóticas de cada unidad de muestreo, lo que permitió obtener el total por estación. Posteriormente, los datos se acomodaron en una tabla de contingencia y se aplicó una prueba de chi cuadrada (Brown y Rothery, 1993; Zar, 2010). Los cambios en la ocupación se analizaron con la misma prueba, utilizando la cantidad de unidades de muestreo con registro de las especies estudiadas.
Para identificar la preferencia de hábitat de acuerdo con las características de las unidades de muestreo, se redujeron las variables ambientales mediante un análisis multivariado de componentes principales (PCA) con una matriz de correlación (Wold et al., 1987). Posteriormente, mediante un análisis de correspondencia canónica (CCA), se evaluó la relación entre las condiciones ambientales de las unidades de muestreo y la ocupación de las especies (Legendre y Legendre, 1998). Se realizaron 2 CCA para cada temporada, el primero con valores de presencia-ausencia y el segundo con valores de abundancia. Se determinó la significancia de cada CCA con una prueba de 999 permutaciones y se estimó la fracción de variación explicada obteniendo el valor de R2 ajustado (Borcard et al., 2018). Se seleccionó el CCA con mayor porcentaje de variación explicada y se extrajo la posición de las especies respecto a los 2 primeros ejes canónicos del CCA seleccionado (puntajes, de aquí en adelante). Se realizó un agrupamiento jerárquico con el método de Ward utilizando dichos puntajes, y posteriormente se determinó el número de grupos con base en el índice de Calinski-Harabasz (Borcard et al., 2018). La preferencia de hábitat y la coexistencia entre especies locales y exóticas se estimaron mediante dicho CCA. Los análisis estadísticos fueron realizados utilizando el programa Past 3.19 (Hammer et al., 2001) y el paquete Vegan (Oksanen et al., 2017) para R 3.5.2.
Tabla 1
Tamaño, cantidad de puntos de conteo y ubicación de las unidades de muestreo en la ciudad de Querétaro.
|
Unidad de muestreo |
Tamaño (ha) |
Puntos de conteo |
Coordenadas geográficas |
|
Álamos |
1.80 |
2 |
20°36’30.86”N, 100°23’2”O |
|
Alcanfores |
5.87 |
7 |
20°36’6”N, 100°24’22”O |
|
Alfalfares |
19.69 |
8 |
20°37’25”N, 100°27’2”O |
|
Bicentenario |
29.18 |
12 |
20°43’57.22”N, 100°27’6.21”O |
|
Bosques del Acueducto |
0.36 |
1 |
20°35’40.35”N, 100°22’33.35”O |
|
Carretas |
3.57 |
4 |
20°35’26”N, 100°22’17”O |
|
Cerro de las Campanas |
4.04 |
3 |
20°35’36.08”N, 100°24’37.01”O |
|
C.U UAQ |
28.70 |
15 |
20°35’29.45”N, 100°24’36.29”O |
|
Inst. Queretano San Javier |
9.24 |
6 |
20°35’55.07”N, 100°22’59.85”O |
|
Italia |
2.17 |
2 |
20°35’19.92”N, 100°25’2.05”O |
|
Jardín Zenea |
0.48 |
1 |
20°35’34.09”N, 100°23’31.46”O |
|
Jardines de la Hacienda |
1.49 |
2 |
20°34’13”N, 100°24’47”O |
|
Jardines de Querétaro |
0.20 |
1 |
20°35’46.26”N, 100°22’51”O |
|
Las Plazas |
0.07 |
1 |
20°34’18.99”N, 100°25’3.55”O |
|
Panteón mpal. de Querétaro |
8.45 |
6 |
20°34’45”N, 100°23’29”O |
|
Parque Querétaro 2000 |
56.59 |
23 |
20°37’6.83”N, 100°23’50.28”O |
|
Pie de la Cuesta |
0.19 |
1 |
20°37’49.32”N, 100°24’28.29”O |
|
Tejeda |
3.74 |
4 |
20°32’34.59”N, 100°25’11.91”O |
|
Wenceslao |
0.22 |
1 |
20°34’59.19”N, 100°23’21.34”O |
Resultados
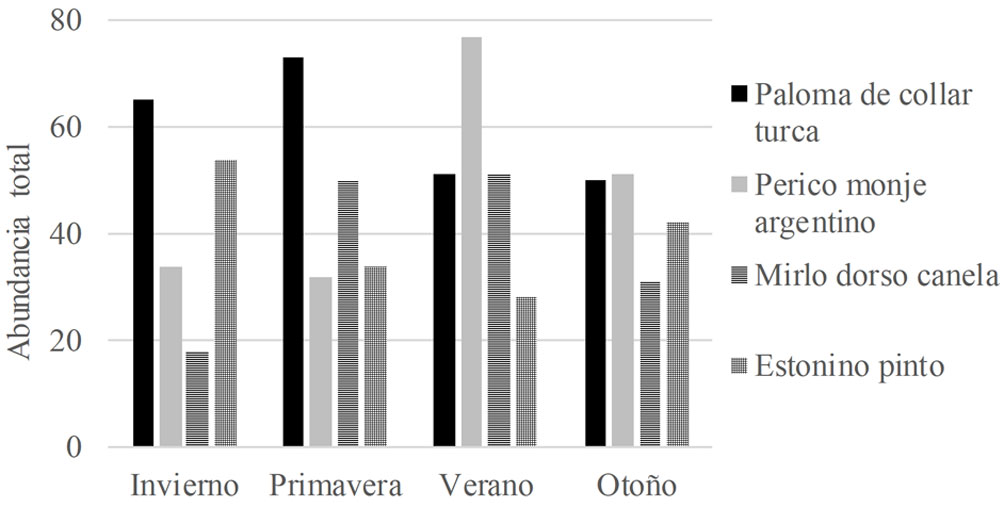
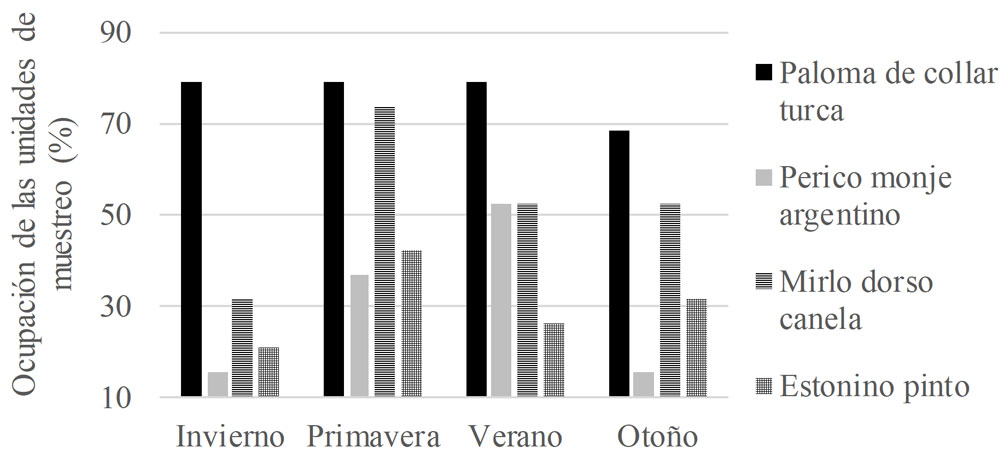
A lo largo del año de muestreo, se registró un total de 71 especies de aves (tabla S1, material suplementario). Al considerar a las especies que son objeto del presente estudio, la más abundante fue el perico monje argentino seguido por la paloma de collar turca. Las abundancias máximas observadas fueron, para la paloma de collar turca, 73 individuos en primavera, para el perico monje argentino, 77 en verano, para el mirlo dorso canela, 51 en verano, y para el estornino pinto, 54 en invierno (fig. 2). La abundancia total de las especies muestreadas presentó diferencias durante las estaciones (chi cuadrada: 57.569, g.l: 9, p < 0.0001) y estas se presentaron agrupadas. A nivel de punto de conteo, el perico monje argentino presentó agrupaciones de hasta 32 individuos durante el otoño, la paloma de collar turca de 15 individuos en primavera, el mirlo dorso canela de 9 individuos en otoño y el estornino pinto de hasta 16 individuos en invierno. Por otro lado, las especies no presentaron diferencias estacionales en su ocupación (chi cuadrada: 6.6779, g.l: 9, p 0.67062). La paloma de collar turca fue la especie con mayor ocupación en la ciudad de Querétaro, con presencia en 79% de las unidades de muestreo durante la mayor parte del año
(fig. 3).
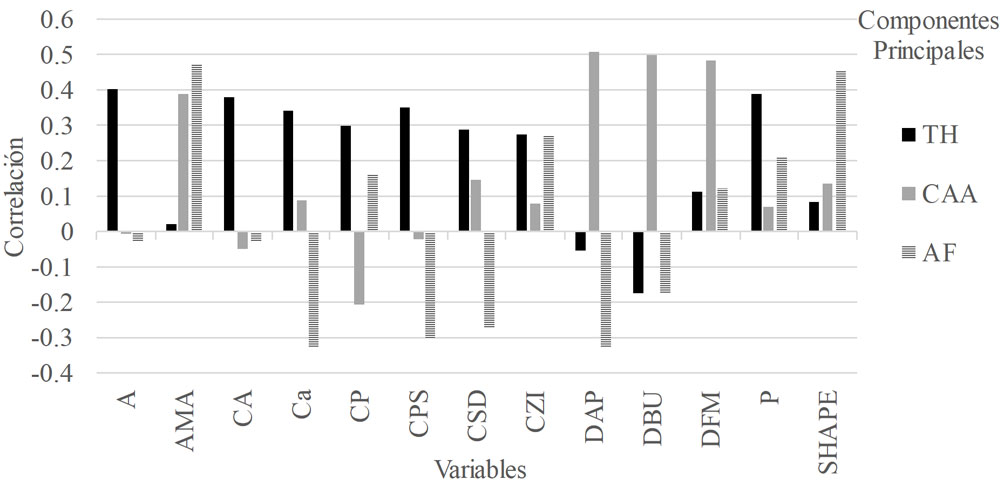
Se obtuvieron 3 componentes principales que agrupan una varianza total de 70.4% (fig. 4). El primero está formado por las variables A, P, CA, CPS, Ca, CP y CZI, que presentan 45.1% de la varianza. Este grupo de variables fue denominado tamaño-heterogeneidad (TH), ya que refleja la asociación del área de las unidades de muestreo con la diversidad de coberturas. El segundo está conformado por las variables DAP, DBU, DFM y AMA, que agrupan 13.7% de la varianza y se denominó complejidad arbórea-antigüedad (CAA) porque agrupa árboles altos, de gran densidad foliar y un DAP mayor, que se ubican principalmente en parques más céntricos y antiguos. El tercero agrupa las variables AMA y SHAPE con valores positivos, y Ca, DAP, CPS y CSD con valores negativos, integra 11.6% de la varianza y se nombró altura-forma (AF).
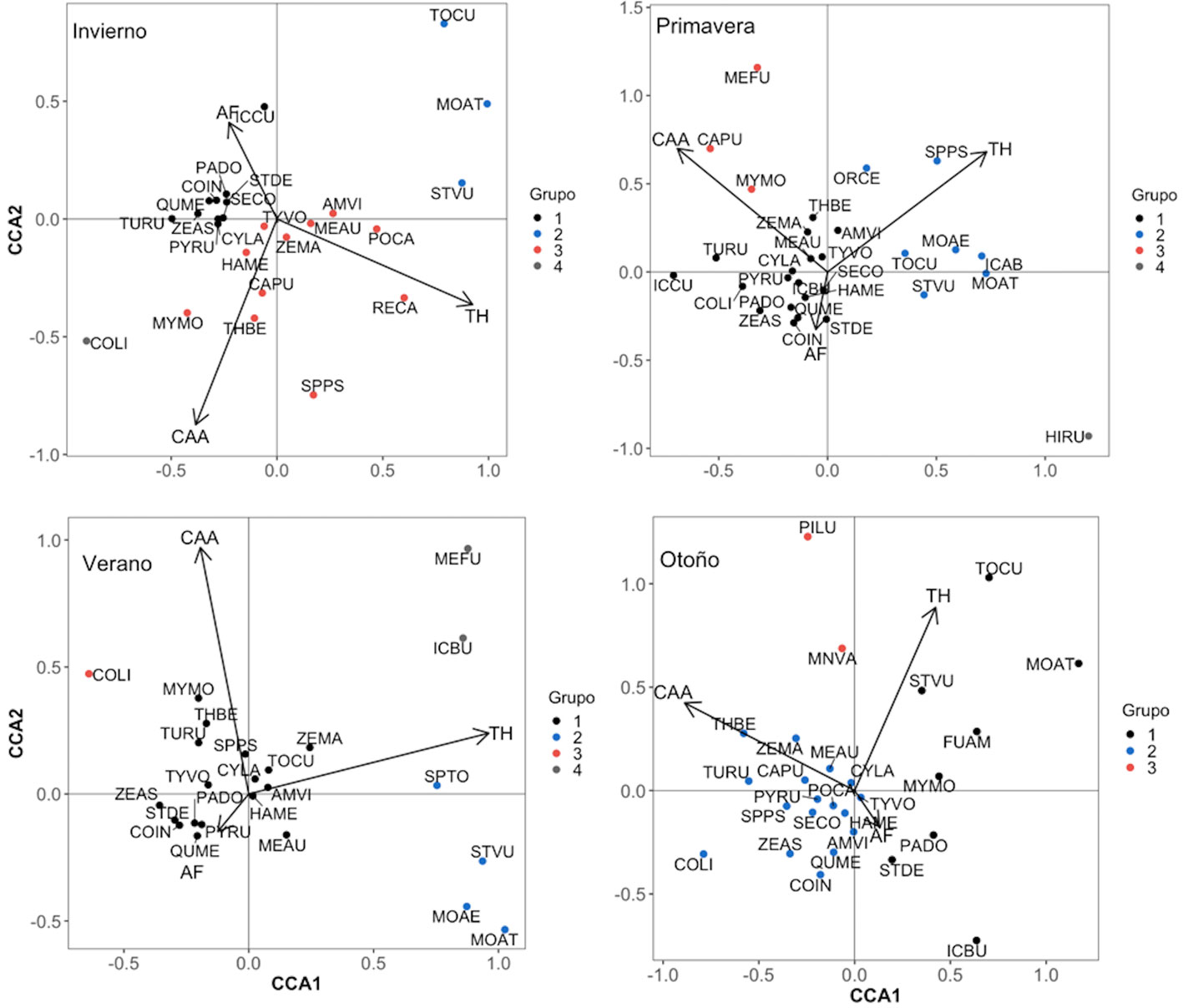
Después de realizar los CCA con valores de presencia-ausencia y abundancia, el valor ajustado de R2 fue mayor para los datos de presencia-ausencia (tabla 2), por lo que se utilizó esta matriz binaria para explicar la preferencia de hábitat y la coexistencia. Los resultados del CCA (fig. 5) indicaron que la paloma de collar turca presentó preferencia por sitios de forma irregular con poca diversidad de coberturas y árboles altos de bajo DAP (componente AF) y por sitios cercanos al borde urbano y poca complejidad arbórea (componente CAA) durante primavera y otoño. La mayor parte del año, el perico monje argentino mostró preferencia por sitios con gran complejidad arbórea y alejados del borde urbano (componente CAA), y durante el otoño por sitios grandes y heterogéneos (componente TH). El mirlo dorso canela mostró preferencia de hábitat constante durante el año de muestreo hacia sitios alejados del borde urbano, con forma irregular y no muy grandes con gran complejidad arbórea (componentes AF y CAA). La mayor parte del año, el estornino pinto mantuvo su preferencia de hábitat hacia sitios alejados del centro de la ciudad, en áreas verdes donde usualmente el estrato arbóreo es joven, por lo que es poco denso, de baja altura y bajo DAP (componente CAA), y mostró una preferencia por áreas verdes con gran extensión y variedad de estratos vegetales (componente TH) durante verano y otoño.
La paloma de collar turca presentó coexistencia durante casi todo el año con otras 2 especies de columbiformes: la tortolita cola larga Columbina inca y la paloma de alas blancas Zenaida asiatica, además del zanate mayor Quiscalus mexicanus y el gorrión común Passer domesticus (fig. 5). El perico monje argentino tuvo coexistencia en su ocupación con pocas especies locales y en cada estación estas especies fueron diferentes, por lo que no se observó un patrón de coexistencia. El mirlo dorso canela presentó coexistencia con pocas especies locales, únicamente con el saltapared cola larga Thryomanes bewickii coexistió durante verano y otoño, y el papamoscas cardenalito Pyrocephalus rubinus en primavera y otoño (fig. 5). El estornino pinto mantuvo coexistencia con el tordo cabeza café Molothrus ater y con el tordo ojos rojos M. aeneus (fig. 5).
Discusión
A una década de sus primeros reportes, la abundancia y la ocupación de las especies estudiadas han incrementado en las áreas verdes de la ciudad de Querétaro, especialmente para la paloma de collar turca. En uno de los últimos estudios que se realizó sobre especies invasoras en áreas verdes de la ciudad de Querétaro (Pineda-López et al., 2013), la paloma de collar turca solo se registró en 12% de los sitios muestreados y no se observó durante el verano y el otoño, mientras que en el presente estudio se registró en 79% de los sitios a lo largo de todo el año. Además, en el mismo estudio, el perico monje argentino no fue registrado, mientras que los resultados actuales muestran su presencia de manera abundante durante todo el año. Esto puede ser explicado por la alimentación generalista y la gran adaptación de la paloma de collar turca a ambientes urbanos (Bendjoudi et al., 2015; Camacho-Cervantes y Schondube, 2018; Romagosa, 2012); para el perico monje argentino, por su plasticidad conductual que le permite colonizar diferentes rangos geográficos y sus estrategias reproductivas como los nidos comunales que aumentan su tasa de sobrevivencia (Blackburn et al., 2009). La mayor abundancia observada de la paloma de collar turca coincidió con su temporada de reproducción en primavera (Romagosa, 2012), cuando se pudieron confirmar 4 nidos de paloma sobre eucaliptos y fresnos.
Tabla 2
Análisis de significancia del CCA usando valores de presencia-ausencia y abundancia.
|
Variables de respuesta |
Valor |
Invierno |
Primavera |
Verano |
Otoño |
|
Presencia- ausencia |
F |
2.80 |
2.06 |
2.41 |
2.23 |
|
p |
0.001 |
0.001 |
0.001 |
0.004 |
|
|
R2 ajustado |
0.23 |
0.15 |
0.19 |
0.17 |
|
|
Abundancia |
F |
1.93 |
1.78 |
1.84 |
1.75 |
|
p |
0.039 |
0.008 |
0.049 |
0.046 |
|
|
R2 ajustado |
0.14 |
0.12 |
0.13 |
0.11 |
La variación en la ocupación del perico monje argentino puede ser debida a la variación de disponibilidad de alimento entre estaciones, ya que es una especie con alimentación generalista (Aramburú, 1997; Ramírez-Albores y Aramburú, 2017; Tinajero y Rodríguez-Estrella, 2015). En este estudio se le observó alimentarse de vainas de huizache (Acacia sp.) y frutos de guayaba (Psidium guajava) que ocurren en diferentes meses del año (Malda-Barrera et al., 2016). Los huizaches son una especie nativa abundante en las zonas externas de la ciudad, lo cual facilitaría que el perico monje argentino se desplace fuera de la zona urbana para invadir áreas rurales y naturales. Por ello, es importante el monitoreo de sus poblaciones y considerar acciones para evitar su propagación (MacGregor-Fors et al., 2011).
El mirlo dorso canela fue registrado durante todo el año, a diferencia de lo reportado en el estado de Hidalgo donde presentó amplias diferencias de abundancia a lo largo del año y sin registros durante el invierno (Pacheco, 2017). Esta especie presentó su mayor abundancia y ocupación en su temporada de reproducción durante primavera y verano (Carbó-Ramírez et al., 2015; Pineda-López y Malagamba-Rubio, 2009), cuando se observaron individuos jóvenes. Las fluctuaciones de abundancia y ocupación de la especie pueden ser debido a la detectabilidad, ya que durante la temporada reproductiva se encuentra más activa y es más fácil detectarla visual y auditivamente (Iknayan et al., 2014).
La ocupación del estornino pinto fue más extensa durante su temporada de reproducción en primavera, que es cuando las bandadas se separan para buscar pareja (Álvarez-Romero et al., 2008; Kaufman, 1996). Por otro lado, su mayor abundancia puede estar relacionada con la llegada a la ciudad de individuos jóvenes durante el otoño, cuando se pueden dispersar mayores distancias (Cabe, 1993; Kessel, 1953).
La paloma de collar turca mostró preferencia durante la mayor parte del año por sitios con árboles altos y además en primavera y otoño hacia sitios periurbanos con baja complejidad arbórea. En un estudio similar en áreas urbanas de España, se determinó que la presencia de árboles en áreas verdes es importante para la paloma y prefiere sitios en la zona periurbana (Bermúdez-Cavero, 2020). Sería importante considerar otras variables como el tránsito humano y vehicular, el cambio de recursos disponibles en cada sitio, la temperatura y otro tipo de uso de suelo como el residencial, comercial, industrial y recreativo como se ha hecho en otros estudios (Bermúdez-Cavero, 2020; MacGregor-Fors y Schondube, 2011).
La preferencia de hábitat del perico monje argentino hacia sitios con árboles de gran DAP, altura y densidad foliar, que son características que podrían facilitar la construcción de sus nidos compartidos, coincide con lo observado en otros países como Italia y Argentina (Di Santo et al., 2017; Romero et al., 2015); sin embargo, en otras ciudades como Durango, este perico parece no seleccionar los árboles de mayor altura (Rodríguez-Matutino et al., 2018). La preferencia del mirlo dorso canela por la complejidad arbórea concuerda con lo descrito anteriormente por otros autores (Jackman y Scott, 1975; Pacheco, 2017; Pineda-López et al., 2013), por lo que la presencia de árboles de gran altura, densidad foliar y DAP son importantes para la especie, sobre todo durante su temporada de anidación porque les confiere protección. La preferencia de hábitat del estornino pinto por sitios extensos y con variedad de coberturas coincide con lo observado en otros estudios, donde la presencia de pasto y árboles son importantes para su alimentación y nidificación (Feare, 1984; Kessel, 1953).
La paloma de collar turca compartió sitios con otras especies tolerantes al ambiente urbano como la paloma de alas blancas, la tortolita cola larga, el gorrión común y el zanate mayor (Carbó-Ramírez y Zuria, 2011). Si bien existen registros de interacciones negativas entre la paloma de collar turca y la de alas blancas (Bonter et al., 2010; Pineda-López y Malagamba-Rubio, 2011; Romagosa, 2012), en este estudio no se registraron comportamientos agresivos hacia otras especies, lo que sugiere únicamente coexistencia entre especies por preferencia de hábitats similares. Debido a que es una especie altamente urbana, es posible que esté explotando recursos alternativos disponibles en lugar de competir con las aves locales, como se observó en Jalisco (Camacho-Cervantes y Schondube, 2018) y en EUA (Green et al., 2020; Koenig, 2020).
La baja coexistencia del perico monje argentino con otras especies ya ha sido registrada anteriormente en EUA, donde se sugiere que la especie tiene baja influencia en la comunidad de aves, así como en algunos estados mexicanos (Appelt et al., 2016; Muñoz-Jiménez y Álcantara-Carbajal, 2017). Durante la temporada de mayor ocupación del mirlo dorso canela, este co-ocurrió especialmente con el papamoscas cardenalito y el colibrí pico ancho, que son especies bastante comunes en las áreas verdes de la ciudad (Malagamba-Rubio et al., 2013).
La coexistencia del estornino pinto con el tordo cabeza café y el tordo ojos rojos no es inusual, ya que son especies con la que suele compartir su espacio de alimentación (Sauer et al., 2017). Por otro lado, no se encontró coexistencia del estornino pinto con otras especies con las que se han reportado agresiones, como el gorrión doméstico, la golondrina tijereta, el mirlo dorso canela y el carpintero cheje (Álvarez-Romero et al., 2008; Pérez-Arteaga y Monterrubio-Rico, 2016), posiblemente porque estas especies locales tienen distinta preferencia de hábitat o porque existe un desplazamiento de estas especies por parte del estornino. Cabe señalar que durante el otoño se observaron agrupaciones de estorninos en algunas unidades de muestreo donde también estaba presente el carpintero cheje sin registrar agresiones interespecíficas, sin embargo, el análisis no mostró estas coexistencias como estadísticamente significativas.
En conclusión, la paloma de collar turca y el perico monje argentino presentan una abundancia y ocupación amplia en áreas verdes a casi 10 años de sus primeros registros para la ciudad de Querétaro, por lo que se sugiere considerar a estas especies en un crecimiento poblacional evidente. De continuar con esta tendencia de crecimiento, en algunos años serán aún más abundantes y en el caso del perico monje argentino, es muy probable que cause daños en la estructura urbana y se disperse hacia zonas periurbanas y rurales, donde podría causar daños a cultivos y convertirse en una especie plaga, por lo que se reitera la propuesta de controlar sus poblaciones (MacGregor-Fors et al., 2011). Por su parte, el mirlo dorso canela y el estornino pinto no muestran evidencia de crecimiento poblacional, por lo que posiblemente ambas especies mantienen poblaciones estables. Las especies estudiadas presentan preferencias ambientales diferentes que varían a través del año. La coexistencia de estas especies se presentó de manera irregular durante el año con especies comunes en el medio urbano y, en el caso de la paloma de collar turca y el estornino pinto, con especies locales de gremios similares.
Agradecimientos
Al Conacyt por la beca nacional para maestría otorgada a A. López-Puebla. A Raúl Rubalcava Medina y Joaquín Antuna Abaid por su apoyo para realizar el muestreo. Un especial agradecimiento a los revisores anónimos por sus valiosos comentarios y sugerencias para mejorar sustancialmente este manuscrito. A Robert Jones por su apoyo en la revisión del abstract. A Remedios Nava por su valiosa aportación en el análisis e interpretación de los resultados y la obtención de figuras.
Referencias
Álvarez-Romero, J. G., Medellín, R. A., Oliveras de Ita, A., Gomez de Silva, H. y Sánchez, O. (2008). Animales exóticos en México: una amenaza para la biodiversidad. México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/ Instituto de Ecología-UNAM/ Secretaría de Medio Ambiente y Recursos Naturales.
Appelt, C. W., Ward, L. C., Bender, C., Fasenella, J., Van Vossen, B. J. y Knight, L. (2016). Examining potential relationships between exotic monk parakeets (Myiopsitta monachus) and avian communities in an urban environment. The Wilson Journal of Ornithology, 128, 556–566. https://doi.org/10.1676/1559-4491-128.3.556
Aramburú, R. M. (1997). Ecología alimentaria de la cotorra (Myiopsitta monachus monachus) en la provincia de Buenos Aires, Argentina (Aves Psittacidae). Physis. Sección C, 53, 29–32.
Beissinger, S. R. y Osborne, D. R. (1982). Effects of urbanization on avian community organization. Condor, 84, 75–83. https://doi.org/10.1134/S1067413614050154
Bendjoudi, D., Voisin, J. F., Doumandji, S., Merabet, A., Benyounes, N. y Chenchouni, H. (2015). Rapid increase in numbers and change of land-use in two expanding Columbidae species (Columba palumbus and Streptopelia decaocto) in Algeria. Avian Research, 6, 1–9. https://doi.org/10.1186/s40657-015-0027-9
Bermúdez-Cavero, A. O. (2020). Ecología y selección de hábitat de la tórtola común (Streptopelia turtur Linnaeus , 1758 ) y tórtola turca (Streptopelia decaocto Frivaldszky , 1838 ) en el este de España (Tesis de doctorado). Instituto Cavanilles de Biodiversidad y Biología Evolutiva. Universitad de Valencia. Valencia, España.
Blackburn, T. M., Lockwood, J. L. y Cassey, P. (2009). Avian invasions: the ecology and evolution of exotic birds (Vol. 1). Oxford: Oxford University Press.
Bonter, D. N., Zuckerberg, B. y Dickinson, J. L. (2010). Invasive birds in a novel landscape: Habitat associations and effects on established species. Ecography, 33, 494–502. https://doi.org/10.1111/j.1600-0587.2009.06017.x
Borcard, D., Gillet, F. y Legendre, P. (2018). Numerical Ecology with R. New York: Springer.
Brown, D. N. y Rothery, P. (1993). Models in biology: mathematics, statistics and computing. Nueva York: John Wiley and Sons.
Cabe, P. (1993). European starling (Sturnus vulgaris). Recuperado el 5 mayo, 2018 de: Birds of North America. Cornell Lab of Ornithology, Ithaca, NY, EUA. Disponible: https://doi.org/10.2173/bow.eursta.01
Camacho-Cervantes, M. y Schondube, J. E. (2018). Habitat use by the invasive exotic Eurasian Collared-Dove (Streptopelia decaocto) and native dove species in the Chamela-Cuixmala region of West Mexico. The Wilson Journal of Ornithology, 130, 902. https://doi.org/10.1676/1559-4491.130.4.902
Carbó-Ramírez, P., González-Arrieta, R. A. y Zuria, I. (2015). Breeding biology of the Rufous-backed Robin (Turdus rufopalliatus ) in an urban area outside its original distribution range . The Wilson Journal of Ornithology, 127, 515–521. https://doi.org/10.1676/14-056.1
Carbó-Ramírez, P. y Zuria, I. (2011). The value of small urban greenspaces for birds in a Mexican city. Landscape and Urban Planning, 100, 213–222. https://doi.org/10.1016/j.landurbplan.2010.12.008
Chablé-Santos, J., Gómez-Uc, E. y Hernández-Betancourt, S. (2012). Registros reproductivos de la paloma de collar (Streptopelia decaocto) en Yucatán, México. Huitzil, 13, 1–5. https://doi.org/10.28947/hrmo.2012.13.1.140
Chace, J. F. y Walsh, J. J. (2006). Urban effects on native avifauna: a review. Landscape and Urban Planning, 74, 46–69. https://doi.org/10.1016/j.landurbplan.2004.08.007
Di Santo, M., Bologna, M. A. y Battisti, C. (2017). Nest tree selection in a crowded introduced population of Monk Parakeet (Myiopsitta monachus) in Rome (central Italy): evidence for selectivity. Zoology and Ecology, 27, 196–201. https://doi.org/10.1080/21658005.2017.1366293
Elton, C. S. (1958). The ecology of invasions by animals and plants. London: Springer-Sciencie+Business Media.
Evans, K. L., Hatchwell, B. J., Parnell, M. y Gaston, K. J. (2009). A conceptual framework for the colonisation of urban areas: the blackbird Turdus merula as a case study. Biological Reviews, 85, 643–667. https://doi.org/10.1111/j.1469-185X.2010.00121.x
Feare, C. (1984). The Starling. Oxford: O. U. Press.
Fuller, R. J. y Langslow, D. R. (1984). Estimating numbers of birds by point counts: How long should counts last? Bird Study, 31, 195–202.
Green, A. W., Sofaer, H. R., Otis, D. L. y Van Lanen, N. J. (2020). Co-occurrence and occupancy of mourning doves and Eurasian Collared-Doves. The Journal of Wildlife Management, 84, 775–785.
Hammer, Ø., Harper, D. y Ryan, P. (2001). PAST: Paleontological statistics software package for education and data analysis.
Iknayan, K. J., Tingley, M. W., Furnas, B. J. y Beissinger, S. R. (2014). Detecting diversity: emerging methods to estimate species diversity. Trends in Ecology and Evolution, 29, 97–106. https://doi.org/10.1016/j.tree.2013.10.012
Ingold, D. J. (1996). Delayed nesting decreases reproductive success in northern flickers: implications for competition with European Starlings. Journal of Field Ornithology, 67, 321–326.
Jackman, S. M. y Scott, J. M. (1975). Literature review of twenty three selected forest birds of the Pacific Northwest. Southern Oregon: US Forest Service, Pacific Northwest Region.
Johnson, D. H. (2008). In defense of indices: the case of bird surveys. The Journal of Wildlife Management, 72, 857–868.
Kaufman, K. (1996). Lives of North American birds. New York: H. M. Company.
Kessel, B. (1953). Distribution and migration of the European Starling in North America. The Condor, 55, 49–67.
Koenig, W. D. (2020). What are the competitive effects of invasive species? Forty years of the Eurasian collared-dove in North America. Biological Invasions, 22, 3645–3652.
Legendre, P. y Legendre, L. (1998). Numerical Ecology (2da. Ed.). Oxford: Elsevier.
MacGregor-Fors, I., Calderón-Parra, R., Meléndez-Herrada, A., López-López, S. y Schondube, J. E. (2011). Pretty, but dangerous! Records of non-native Monk Parakeets (Myiopsitta monachus) in Mexico. Revista Mexicana de Biodiversidad, 82, 1053–1056. https://doi.org/10.1080/03949370.2014.905981
MacGregor-Fors, I. y Schondube, J. E. (2011). Gray vs. green urbanization: relative importance of urban features for urban bird communities. Basic and Applied Ecology, 12, 372–381. https://doi.org/10.1016/j.baae.2011.04.003
Malagamba-Rubio, A., MacGregor-Fors, I. y Pineda-López, R. (2013). Comunidades de aves en áreas verdes de la ciudad de Santiago de Querétaro, México. Ornitologia Neotropical, 24, 371–386.
Malda-Barrera, G., Romero-Valencia, E. y González-Hernández, A. (2016). Plantas y arbustos de la Ciudad de Querétaro. Querétaro: Universidad Autónoma de Querétaro.
McGarigal, K. (2015). Fragstats help. Massachusetts: University of Massachusetts.
Muñoz-Jiménez, J. L. y Álcantara-Carbajal, J. L. (2017). La cotorra argentina (Myiopsitta monachus) en el Colegio de Postgraduados : ¿una especie invasiva? Huitzil, 18, 38–52.
Oksanen, J., Blanchet, F. G., Friendly, M., Kindt, R., Legendre, P., McGlinn, D. et al. (2017). Vegan: community ecology package. R package version 2.5.4. Ruperada de: https://cran.r-project.org/package=vegan
Pacheco, A. L. (2017). Presencia, uso de hábitat, biología reproductiva y conducta del mirlo dorso canela Turdus rufopalliatus en el estado de Hidalgo y su relación con la urbanización (Tesis de maestría). Instituto de Ciencias Básicas e Ingeniería, Universidad Autónoma del Estado de Hidalgo. Hidalgo, México.
Pérez-Arteaga, A. y Monterrubio-Rico, T. C. (2016). Vista de confirmación de presencia de Sturnus vulgaris (Aves: Passeriformes) en Michoacán y Guanajuato, México. Biológicas, 18, 45–49.
Pimentel, D., Zuniga, R. y Morrison, D. (2005). Update on the environmental and economic costs associated with alien-invasive species in the United States. Ecological Economics, 52, 273–288.
Pineda-López, R. y Malagamba-Rubio, A. (2009). Primeros registros de presencia y reproducción del mirlo dorso rufo (Turdus rufopalliatus) en la ciudad de Querétaro, Querétaro, México. Huitzil, 10, 66–70. https://doi.org/10.28947/hrmo.2009.10.2.94
Pineda-López, R. y Malagamba-Rubio, A. (2011). Nuevos registros de aves exóticas en la ciudad de Querétaro, México. Huitzil, 12, 22–27. https://doi.org/10.28947/hrmo.2011.12.2.127
Pineda-López, R., Malagamba Rubio, A., Arce-Acosta, I. y Ojeda-Orranti, J. A. (2013). Detección de aves exóticas en parques urbanos del centro de México. Huitzil, 14, 56–67. https://doi.org/https://doi.org/10.28947/hrmo.2013.14.1.174
QGIS Development Team. (2020). QGIS development team. Open Source Geospatial Foundation Project. Recuperada de: http://www.qgis.org
Ramírez-Albores, J. y Aramburú, R. M. (2017). De Suramérica para México, la invasión de la cotorra argentina (Myopsitta monachus Boddaert, 1783). Revista Biodiversidad Neotropical, 7, 86–97. https://doi.org/http://dx.doi.org/10.18636/bioneotropical.v7i1.345
Richardson, D. M. y Pyšek, P. (2008). Fifty years of invasion ecology the legacy of Charles Elton. Diversity and Distributions, 14, 161–168. https://doi.org/http://www.jstor.org/stable/20171963
Richardson, D. M., Pyšek, P., Rejmánek, M., Barbour, M. G., Dane Panetta, F. y West, C. J. (2000). Naturalization and invasion of alien plants: concepts and definitions. Diversity and Distributions, 6, 93–107. https://doi.org/10.1046/j.1472-4642.2000.00083.x
Rodríguez-Matutino, J. A., Fernández-García, J. A., Viggers-Carrasco, M. G., Gómez-Espinosa, A., Ríos-Gurrola, M. G., Arenivas-Villa, D. E. et al. (2018). Distribución de la cotorra argentina (Myiopsitta monachus) en la ciudad de Durango, México. Acta Zoológica Mexicana, 34, 1–5. https://doi.org/10.21829/azm.2018.3412151
Romagosa, C. M. (2012). Eurasian Collared-dove (Streptopelia decaocto). Recuperado el 25 abril, 2018 de: https://birds.org/Species-Account/bna/species/eucdov
Romero, I. P., Codesido, M. y Bilenca, D. N. (2015). Nest building by Monk Parakeets Myiopsitta monachus in urban parks in Buenos Aires, Argentina: are tree species used randomly? Ardeola, 62, 323. https://doi.org/10.13157/arla.62.2.2015.323
Sauer, J. R., Niven, D. K., Hines, J. E., Ziolkowski, Jr. D. J., Pardieck, K. L., Fallon, J. E. et al. (2017). The North American breeding bird survey, results and analysis 1966-2015. Version 2.07. 2017. Laurel, MD, EUA: USDI, Geological Survey, Patuxent Wildlife Research Center.
Shanahan, D. F., Strohbach, M. W., Warren, P. S. y Fuller, R. A. (2014). The challenges of urban living. In Oxford University Press (Ed.), Avian urban ecology. Behavioural and physiological adaptations. Londres.
Sibley, D. A. (2016). The Sibley field guide to birds of Western North America. New York: Knof, Ed.
Sol, D., Bartomeus, I. y Griffin, A. S. (2012). The paradox of invasion in birds: competitive superiority or ecological opportunism? Oecologia, 169, 553–564. https://doi.org/10.1007/s00442-011-2203-x
Tinajero, R. y Rodríguez-Estrella, R. (2015). Cotorra argentina (Myiopsitta monachus), especie anidando con éxito en el sur de la Península de Baja California. Acta Zoológica Mexicana, 31, 190–197. https://doi.org/10.21829/azm.2015.312540
Wold, S., Esbensen, K. y Geladi, P. (1987). Principal component analysis. Chemometrics and Intelligent Laboratory Systems, 2, 37–52.
Zar, J. H. (2010). Bioestatistical analysis. 5a Ed. New Jersey: Pearson Prentice Hall.
Zuria, I., Carbó-Ramírez, P. y Gómez-Aíza, L. (2012). La ecología urbana aplicada al estudio de las aves. Herreriana, 1, 3–6.