R. Carlos Almazán-Núñez *, Edson A. Alvarez-Alvarez, Pablo Sierra-Morales, Rosalba Rodríguez-Godínez, Diana C. Ruíz-Reyes, Miguel. Á. Peñaloza-Montaño, Rosa I. Salazar-Miranda, Marisaby Morales-Martínez, Ana I. López-Flores, J. Israel Gómez-Mendoza, Diana K. Poblete-López y Antonio Estrada-Ramírez
Laboratorio Integral de Fauna Silvestre (área Ornitología), Facultad de Ciencias Químico-Biológicas, Universidad Autónoma de Guerrero,
Av. Lázaro Cárdenas s/n, Ciudad Universitaria Sur, 39090 Chilpancingo de los Bravo, Guerrero, México
*Autor de correspondencia: rcarlos.almazan@gmail.com (R.C. Almazán-Núñez)
Recibido: 8 enero 2020; aceptado: 4 junio 2020
Resumen
Este estudio describe la diversidad alfa y beta de la avifauna en bosque mesófilo de montaña y bosque tropical subcaducifolio en un gradiente altitudinal que oscila de los 600-2,200 m, en la sierra de Atoyac, Guerrero. Las especies se registraron mediante observaciones e identificación vocal en 126 transectos lineales. Se comparó la diversidad alfa entre bosques mediante métodos de rarefacción-extrapolación, así como el número de especies residentes y endémicas entre intervalos altitudinales. Se evaluó la diversidad beta para la avifauna residente entre bosques e intervalos altitudinales. Las especies de aves se categorizaron por su tipo de dieta, estacionalidad, endemismo y estatus de conservación. Se registraron 206 especies de aves. El bosque mesófilo de montaña tuvo mayores valores de riqueza taxonómica, endemismo y especies en riesgo. El número de especies mostró un aumento en las zonas intermedias del gradiente, no así el endemismo. El recambio y anidamiento fueron menores entre tipos de vegetación y aumentaron en los intervalos altitudinales. Los insectívoros e insectívoro-frugívoros fueron los mejor representados en ambos bosques. La riqueza taxonómica en la sierra de Atoyac incrementó un 28%, lo que resalta la importancia de mantener estrategias de monitoreo en ambientes biodiversos del trópico mexicano.
Palabras clave: Bosque mesófilo de montaña; Bosque tropical subcaducifolio; Riqueza de especies; Recambio de especies; Endemismo; Sierra Madre del Sur
© 2020 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Alpha and beta bird diversity in humid and semi-humid tropical forests of the sierra de Atoyac, a priority region for conservation of southern Mexico
Abstract
This study describes the alpha and beta diversity of the avifauna present in the cloud forest and semideciduous forest along an elevational gradient ranging from 600-2,200 m in the sierra de Atoyac, Guerrero. Bird species records were obtained through sightings and vocal identification in 126 linear transects. Alpha diversity among both forests was compared using rarefaction-extrapolation methods, as well as the number of resident species and endemics between altitudinal intervals. Beta diversity for the resident avifauna among forests and altitudinal intervals was compared. Bird species were categorized according to their type of diet, seasonality, endemism, and conservation status. We recorded 206 bird species. The cloud forest had the highest values of taxonomic richness, as well as the highest proportion of endemic birds and at-risk species. The number of species showed an increase in the medium part of the gradient, but not the endemism. Turnover and nestedness values were lowest among vegetation types and increased when altitudinal intervals were compared. The types of diet best represented in both forests were insectivorous and insectivorous-frugivorous. Bird taxonomic richness of the sierra de Atoyac increased by 28%, which highlights the importance to maintain monitoring strategies in highly biodiverse environments of the Mexican tropics.
Keywords: Cloud forest; Semideciduous forest; Species richness; Species turnover; Endemism; Sierra Madre del Sur
© 2020 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
Los bosques mesófilos de montaña (BMM) y los bosques tropicales subcaducifolios (BTS) del Pacífico mexicano poseen una alta complejidad estructural debido a las condiciones ambientales de calor y humedad en las que se desarrollan (Challenger y Soberón, 2008). Además de estas características, su distribución en gradientes altitudinales favorece una gran diversidad biológica (Challenger, 1998; Challenger y Soberón, 2008; Rzedowski, 2006). Esta distribución está confinada principalmente a cañadas húmedas y semihúmedas, así como a laderas protegidas que promueven una condición de aislamiento geográfico que ha favorecido la evolución de taxones de distribución restringida (Gual-Díaz y Rendón-Correa, 2017; Gutiérrez-Báez et al., 2017; Palacios-Wassenaar et al., 2018; Ruiz-Jiménez et al., 2012). Particularmente, en la sierra Madre del Sur (SMS), estos 2 tipos de vegetación se distribuyen por debajo de los 1,300 m de altitud, aunque el BMM llega a desarrollarse hasta los 2,000 m (Diego-Pérez et al., 2001). La importante biodiversidad y los altos niveles de endemismo que presentan estos bosques a lo largo de la SMS, es resultado de la combinación de condiciones orográficas y climáticas (Espinosa et al., 2016). Desde el punto de vista orográfico, la SMS cuenta con un macizo montañoso muy antiguo formado por plegamientos que datan del Paleozoico al Cenozoico (Velasco-de León et al., 2016). Por otra parte, en esta región existen gradientes climáticos que promueven la formación de microambientes, además de que la SMS presenta la precipitación anual más alta del país (Hernández-Cerda et al., 2016). Así, tanto los bosques mesófilos como los tropicales subcaducifolios que se distribuyen en las montañas de la SMS han originado que varias especies de aves de origen neotropical como algunos trepatroncos (Dendrocolaptes sheffleri; Navarro-Sigüenza et al., 2020), colibríes (Phaethornis mexicanus, Lampornis margaritae, Lamprolaima occidentalis; Arbeláez-Cortés y Navarro-Sigüenza, 2013; Cortés-Rodríguez et al., 2008; Zamudio-Beltrán y Hernández-Baños, 2018), tucanes (Aulacorhynchus wagleri; Puebla-Olivares et al., 2008) y rascadores (Arremon kuhenerii; Navarro-Sigüenza et al., 2013) desarrollen un alto grado de especialización a estos bosques tropicales y a las condiciones de humedad que allí prevalecen. Aunado a ello, la poca conectividad que muestran varias poblaciones de aves en estos bosques dentro de la SMS, ha promovido la evolución de numerosos taxones endémicos (e.g., Chlorospingus albifrons, Cyanocorax speciosa, Cyrtonyx sallei; Navarro-Sigüenza y Peterson, 2004; Ornelas et al., 2013; Peterson y Navarro-Sigüenza, 2000), que a su vez incrementan la biodiversidad en la región.
Los BTS y BMM albergan una alta diversidad avifaunística a nivel nacional (240 y 551 especies, respectivamente; Escalante et al., 1993; Navarro-Sigüenza et al., 2014). De manera particular, a lo largo de la SMS en Guerrero existen algunos estudios que resaltan la importancia de estos bosques por su gran diversidad de especies (Navarro, 1992; Sierra-Morales et al., 2018). Sin embargo, el ritmo acelerado al que estos bosques están desapareciendo por causas antropogénicas, es una de las múltiples razones para promover el estudio del estado actual que guardan las comunidades de aves en estos ecosistemas altamente biodiversos. Por ejemplo, la vegetación primaria de los BTS y BMM en Guerrero ha sido modificada en aproximadamente 28% y 19%, respectivamente (Semarnat, 2013). Esto evidencia la potencial reducción en las condiciones de idoneidad ambiental para varias especies de aves que allí se distribuyen (Almazán-Núñez et al., 2018; Sierra-Morales et al., 2016). Así, varios procesos ecológicos en los que participan, como la polinización, dispersión de semillas y control de plagas también se ven alterados (Şekercioğlu et al., 2004). Adicionalmente a estas modificaciones, los efectos de reducción de áreas de distribución por cambio climático, se espera incrementen en los ecosistemas de mayor humedad debido a la disminución de precipitación (Ponce-Reyes et al., 2012; Rojas-Soto et al., 2012). Por ende, es de gran importancia realizar estudios biológicos y ecológicos para diagnosticar la condición actual de la biota en estos bosques. Esto es particularmente cierto para una de las entidades del país con alta riqueza biológica como lo es Guerrero, que paradójicamente ostenta uno de los últimos lugares a nivel nacional en áreas para la protección y conservación de sus ecosistemas (Conanp, 2019; Koleff y Moreno, 2006).
El objetivo de este estudio fue analizar la riqueza y composición taxonómica de las aves presentes en fragmentos de BTS y BMM en un gradiente altitudinal de la sierra de Atoyac, ubicada en la sierra Madre del Sur de Guerrero. Se evaluó la completitud de los inventarios para cada tipo de vegetación y se analizó la riqueza total de especies, endemismo y diversidad beta de aves residentes a lo largo del gradiente altitudinal en el que se distribuyen los fragmentos de BTS y BMM del área de estudio. Se describió también el tipo de dieta, estacionalidad, endemismo y estatus de conservación de la avifauna presente. Finalmente, se discute acerca de las prioridades de conservación de la sierra de Atoyac desde el punto de vista del conocimiento y representación taxonómica de su avifauna, considerada como prioritaria para la conservación a nivel nacional e internacional.
Materiales y métodos
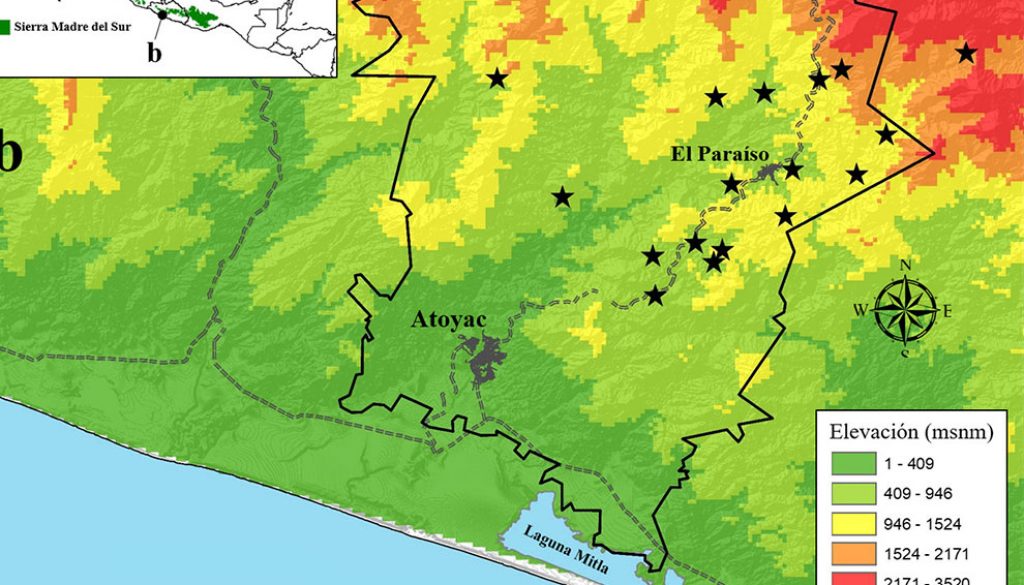
El estudio se llevó a cabo en la sierra de Atoyac, ubicada dentro del municipio de Atoyac de Álvarez, Guerrero, en el suroccidente de México (17°32’28.65”-17°3’31.36” N, 100°30’14.17”-100°17’46.84” O; fig. 1). El área de estudio presenta un régimen de precipitación bien marcado a lo largo del año, con una época de lluvias en los meses de mayo a octubre y de secas de noviembre a abril. La precipitación oscila entre 800-2,000 mm (Vidal-Zepeda, 1990). Los climas dominantes que se encuentran en la zona son cálido subhúmedo, cálido húmedo y templado subhúmedo, y presenta una temperatura media anual de 22 °C (García, 2004). La orografía es muy accidentada con pendientes que alcanzan los 45° y elevaciones de hasta 3,500 m snm (fig. 1). El área de estudio presenta distintos tipos de vegetación como el bosque mesófilo de montaña, bosque tropical subcaducifolio (ambos generalmente asociados a cafetales), bosque de pino, bosque de encino, bosques mixtos de pino-encino y encino-pino, vegetación secundaria, así como áreas agrícolas y potreros de uso ganadero (INEGI, 2016). Tanto el BMM como el BTS, son tipos de vegetación con características tropicales que se distribuyen en sectores de laderas hondonadas y barrancas donde la exposición de luz y la presencia de corrientes de agua generan condiciones de mayor humedad que en las áreas cercanas (Palacios-Wasenaar et al., 2018). Sin embargo, en el bosque mesófilo las condiciones de humedad son todavía mayores debido a las altas precipitaciones que suelen registrarse y a la constante inmersión de nubes (Challenger y Soberón, 2008; Gual-Díaz y González-Medrano, 2014, Rzedowski, 2006). Además, este bosque presenta elementos arbustivos y herbáceos predominantemente tropicales, pero sostiene especies arbóreas de afinidad neártica (Hamilton et al., 1995).
El muestreo se realizó de manera efectiva en 17 meses transcurridos entre febrero del 2017 y julio del 2019, considerando fragmentos de BMM y BTS (433.3 km2 y 182 km2, respectivamente; INEGI, 2016). En total se invirtieron 63 días de trabajo de campo, 40 en BMM y 23 en BTS. Se realizaron transectos lineales de forma aleatoria en cada tipo de vegetación cuya longitud generalmente fue de 2.5 km. Esta distancia recorrida se debió principalmente al tamaño de los parches de bosque y a la accesibilidad de los mismos. El muestreo contempló los horarios de mayor actividad de las aves, desde el amanecer hasta las 11:00 h, y por la tarde de 16:00 a 18:30 h. Se recorrieron en total 126 transectos a lo largo del área de estudio, lo que equivale a 315 km, de los cuales 200 km se recorrieron en el BMM y 115 km en el BTS. Los transectos eran recorridos si las condiciones climáticas eran adecuadas para la observación de las aves. Todos los transectos fueron realizados por un máximo de 3 personas. Se utilizaron binoculares (8 × 42 y 10 × 50) y guías de campo para identificar a las especies (Howell y Webb, 1995; Peterson y Chalif, 1989; Sibley, 2000). El orden sistemático a nivel específico siguió la propuesta taxonómica de Navarro-Sigüenza y Peterson (2004) basado en el concepto filogenético-evolutivo de especie. Este enfoque utiliza como criterio para designar los límites de especies el reconocimiento de caracteres únicos (autapomorfías) o combinaciones únicas para identificar y delimitar a las unidades evolutivas o linajes (McKitrick y Zink, 1988). Así, este criterio es más relevante en términos de la conservación de la avifauna ya que, de acuerdo con este criterio, las especies intrínsecamente sufren una disminución en sus áreas de distribución al reconocerlas como poblaciones alopátricamente diferenciadas (Rojas-Soto et al., 2010). A nivel supraespecífico, se siguieron los lineamientos de la American Ornithological Society (Chesser et al., 2019).
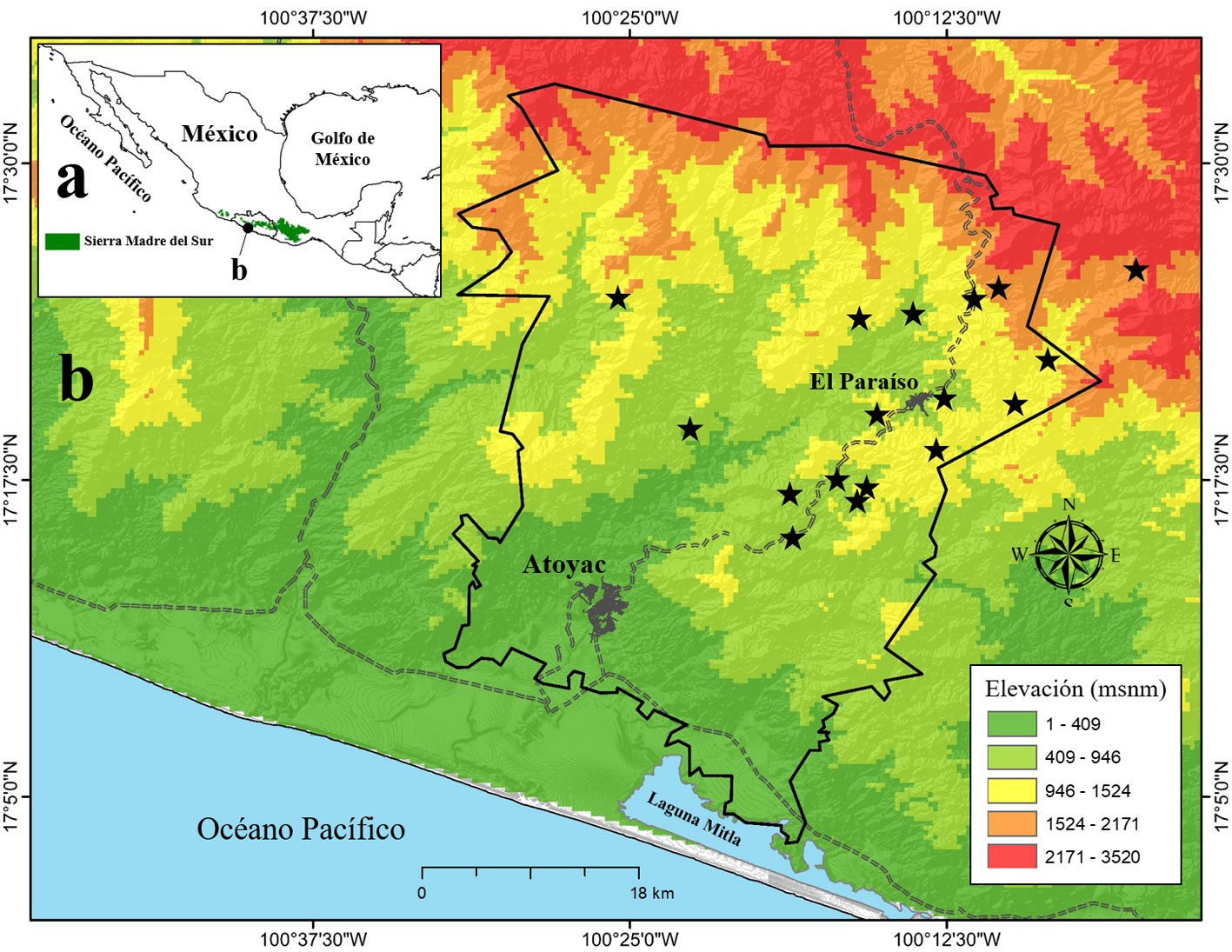
Se obtuvo el número potencial de especies para cada tipo de vegetación con base en el estimador de cobertura basado en incidencia (ICE), utilizando como unidad de esfuerzo el número de días de muestreo en el programa EstimateS 9.1 (Colwell, 2013). ICE basa su estimación en la cobertura de muestra, i.e., proporción de la riqueza representada en un conjunto de muestras de incidencia replicada (Gotelli y Colwell, 2011), por lo que es insensible al tamaño de muestra (Hortal et al., 2006). Se comparó la riqueza de especies de aves entre tipos de vegetación obteniendo las curvas de rarefacción-extrapolación de los datos observados con base en la cobertura de muestra en el programa iNEXT (Chao et al., 2016). Se calculó el primer orden de diversidad (q = 0) que corresponde a la riqueza de especies (números de Hill; Jost, 2006). Estos valores se compararon con intervalos de confianza del 84%, los cuales presentan mayor robustez en pruebas de significancia con un α = 0.05 (MacGregor-Fors y Payton, 2013).
Se comparó la riqueza total de especies y el endemismo de aves considerando los 2 tipos de vegetación en el gradiente altitudinal (600 a 2,200 m de altitud). Para realizar este análisis y asegurar una mejor distribución de las localidades en cada uno de los intervalos de altitud, las localidades de muestreo se agruparon en intervalos de 200 m: 600-700 m, 800-900 m, 1,000-1,100 m, 1,200-1,400 y > 1,700 m. Este último intervalo incluye sitios de muestreo a 1,700 y 2,200 m de altitud. Así, se obtuvo un total de 3 localidades por cada intervalo altitudinal. Para evaluar el efecto de los intervalos altitudinales en la riqueza de especies residentes y número de especies endémicas, se ejecutó un modelo lineal generalizado (GLM por sus siglas en inglés) con distribución de error tipo Gamma. Cuando hubo diferencias significativas se aplicó una prueba de comparaciones múltiples de Scott-Knott (Scott y Knott, 1974). Se utilizó esta prueba debido a que no presenta problemas de superposición entre grupos en comparación con otros procedimientos de comparación múltiple (Jelihovschi et al., 2014). Estos análisis se realizaron con las librerías “Stats” y “ScottKnott” (Jelihovschi et al., 2014) usando la función ‘SK’ en R 3.6.1 (R Development Core Team, 2019).
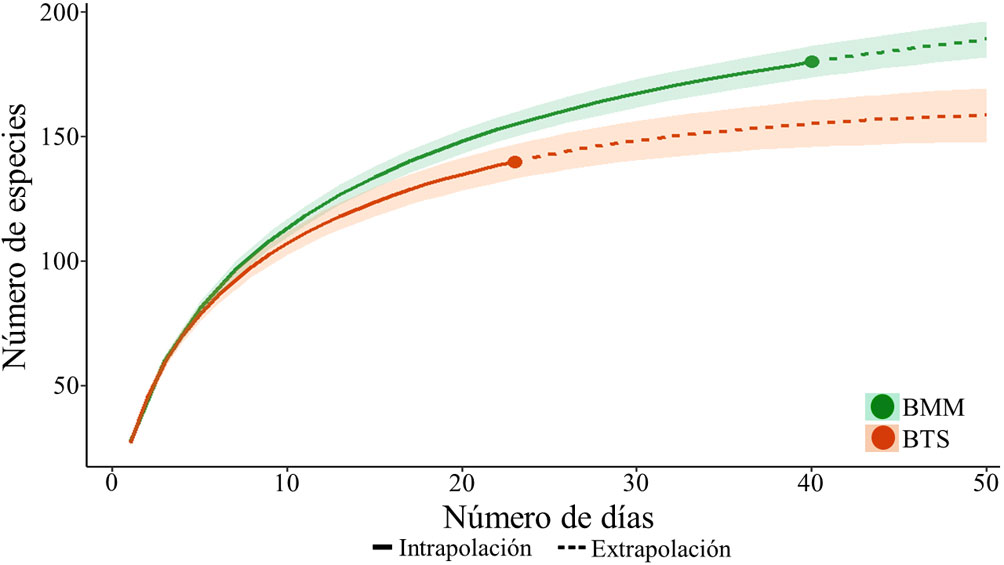
Se calculó la diversidad beta de aves residentes entre tipos de vegetación e intervalos altitudinales con el índice de disimilitud de Sørensen (βSOR; Baselga, 2010; Baselga y Orme, 2012). Debido a que la diversidad beta (βSOR) es el resultado del reemplazo de especies entre sitios (recambio) y la pérdida de especies de un sitio a otro (anidamiento), se calcularon sus 2 componentes: recambio espacial (βSIM) y anidamiento de especies (βNES) para los tipos de vegetación y los intervalos de altitud (Baselga, 2010). Para este análisis se excluyeron a las especies migratorias, debido a que los muestreos en los pisos altitudinales y los tipos de vegetación se realizaron en diferentes momentos del año. Estos análisis se ejecutaron con la librería “betapart” (Baselga y Orme, 2012) en R 3.6.1 (R Development Core Team, 2019).
Se asignaron categorías de tipo de dieta (i.e., frugívoros, granívoros, insectívoros, nectarívoros, omnívoros), mediante observaciones directas en campo y literatura especializada (del Hoyo et al., 2018; González-Salazar et al., 2014). También se incluyeron categorías con las 2 principales dietas mixtas (e.g., insectívoro-frugívoros y granívoro-frugívoros), cuando se observó este comportamiento durante los muestreos. Las especies de aves se categorizaron de acuerdo a su estacionalidad: 1) residentes permanentes, especies que se encuentran en México durante todo el año; 2) migratorias de invierno, especies que llegan a México durante el otoño-invierno, arribando de sus sitios de anidación, y parten en primavera, 3) migratorias de verano, especies que se encuentran en un área durante el verano y anidan en México durante la primavera (Howell y Webb, 1995). Para asignar las categorías de endemismo de las aves del área de estudio, se utilizó la propuesta de Peterson y Navarro-Sigüenza (2000), quienes con base en el concepto filogenético/evolutivo de especie categorizan a las especies de aves de acuerdo a su endemismo al oeste de México: 1) endémica a las montañas, 2) tierras bajas y, 3) zonas internas del sur. Se utilizó esta propuesta debido a que varias poblaciones distribuidas en la sierra de Atoyac representan linajes diferenciados, que bajo la taxonomía tradicional basada en el concepto biológico de especie son subestimados. Por último, el estatus de conservación se basó en la NOM-059-SEMARNAT-2010 (Semarnat, 2010) y la lista roja de la Unión Internacional para la Conservación de la Naturaleza (UICN, 2020).
Resultados
En total se registraron 206 especies, distribuidas en 41 familias y 18 órdenes en el área de estudio (apéndice). De este total, el BMM presentó mayor riqueza de especies de aves (180 especies) comparado con el BTS (140 especies; fig. 2). Con base en el estimador ICE, se obtuvo 83% y 85% del total de la riqueza específica esperada para el tiempo y el espacio muestreados en el BTS y BMM, respectivamente. Los datos extrapolados en ambos tipos de vegetación mostraron una tendencia asintótica (fig. 2).

Por otro lado, la mayor riqueza de especies fue significativamente más alta en el intervalo de 1,200-1,400 m de elevación en comparación con el resto del gradiente altitudinal (F = 7.82, p = 0.01; fig. 3a). Para el endemismo, aunque la tendencia fue similar al patrón observado de la riqueza, no existió un efecto significativo de los intervalos altitudinales (F = 1.67, p = 0.24, fig. 3b).
El valor de la diversidad beta total (βSOR) de aves entre tipos de vegetación fue de 0.25. Sin embargo, cuando la diversidad beta es dividida, los componentes de recambio (βSIM) y anidamiento (βNES) entre tipos de vegetación mostraron valores bajos (βSIM = 0.14 y βNES = 0.11). La βSOR promedio de aves entre intervalos altitudinales fue de 0.39, mientras que los valores promedio de recambio y anidamiento aumentaron en comparación con los valores obtenidos entre los tipos de vegetación (βSIM promedio = 0.26, βNES promedio = 0.15; tabla 1). El intervalo de altitud de 1,200-1,400 m fue el que presentó el mayor número de especies únicas (un total de 35 especies), por lo que su aporte al βSIM y βNES fue en promedio de 0.16 y 0.22, respectivamente. El análisis de clasificación a lo largo del gradiente altitudinal mostró 2 agrupaciones principales: la primera incluyó únicamente a sitios de BMM (> 1,700 m) y la segunda agrupación fue formada por los 4 intervalos altitudinales restantes. Este segundo grupo tuvo a su vez 2 subgrupos: el primero conformado por 2 intervalos de altitud con presencia de BMM (1,000-1,100 m y 1,200-1,400 m) y el segundo subgrupo se formó por otros 2 intervalos altitudinales de BTS (600-700 m y 800-900 m; fig. 4).
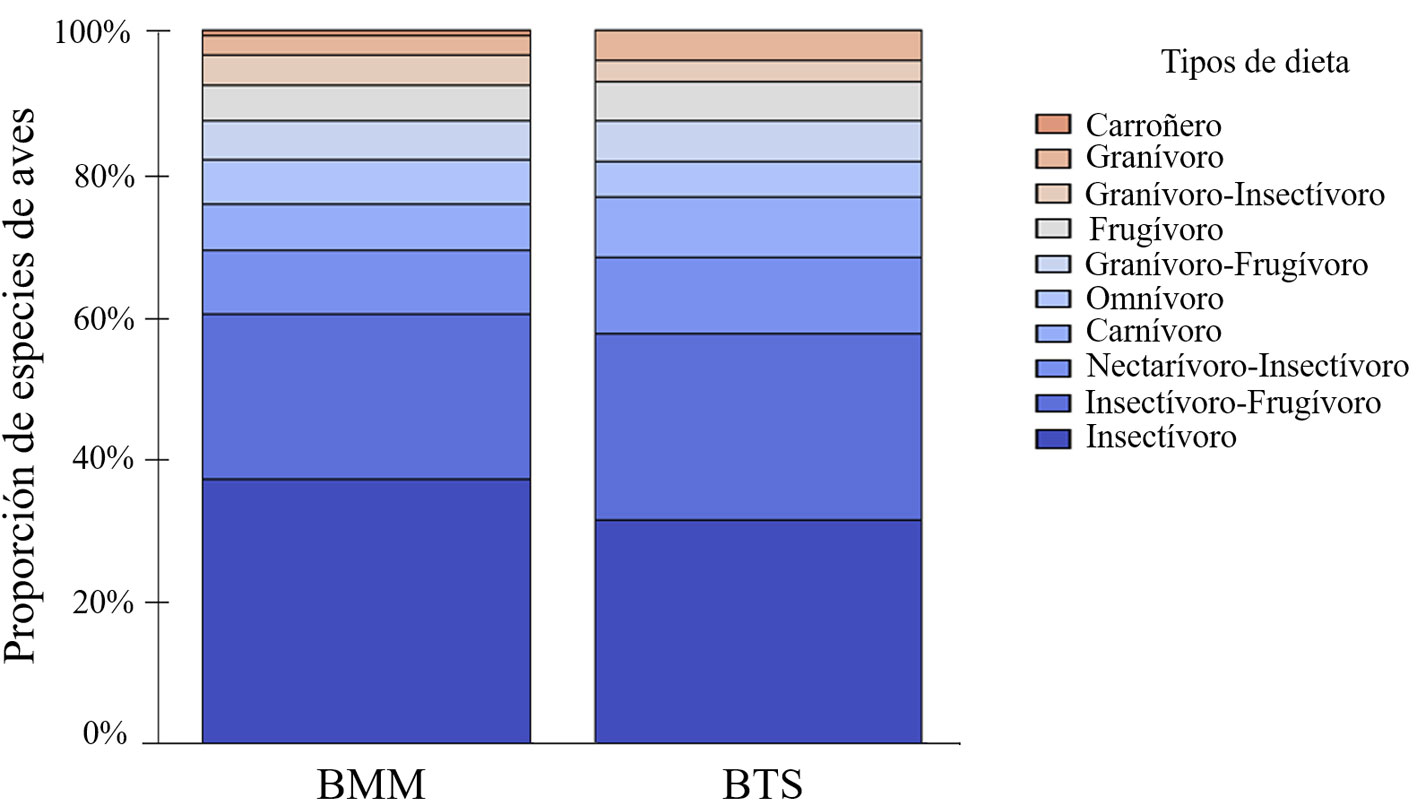
Los tipos de dieta mejor representados en los BMM y BTS fueron la insectívora (37% y 32%, respectivamente) e insectívoro-frugívora (23% y 26%, respectivamente; fig. 5). Otros grupos de aves como los nectarívoro-insectívoros (8.7% y 10.5%) y carnívoros (6.5% y 8.4%) también estuvieron bien representados en los BMM y BTS, respectivamente.
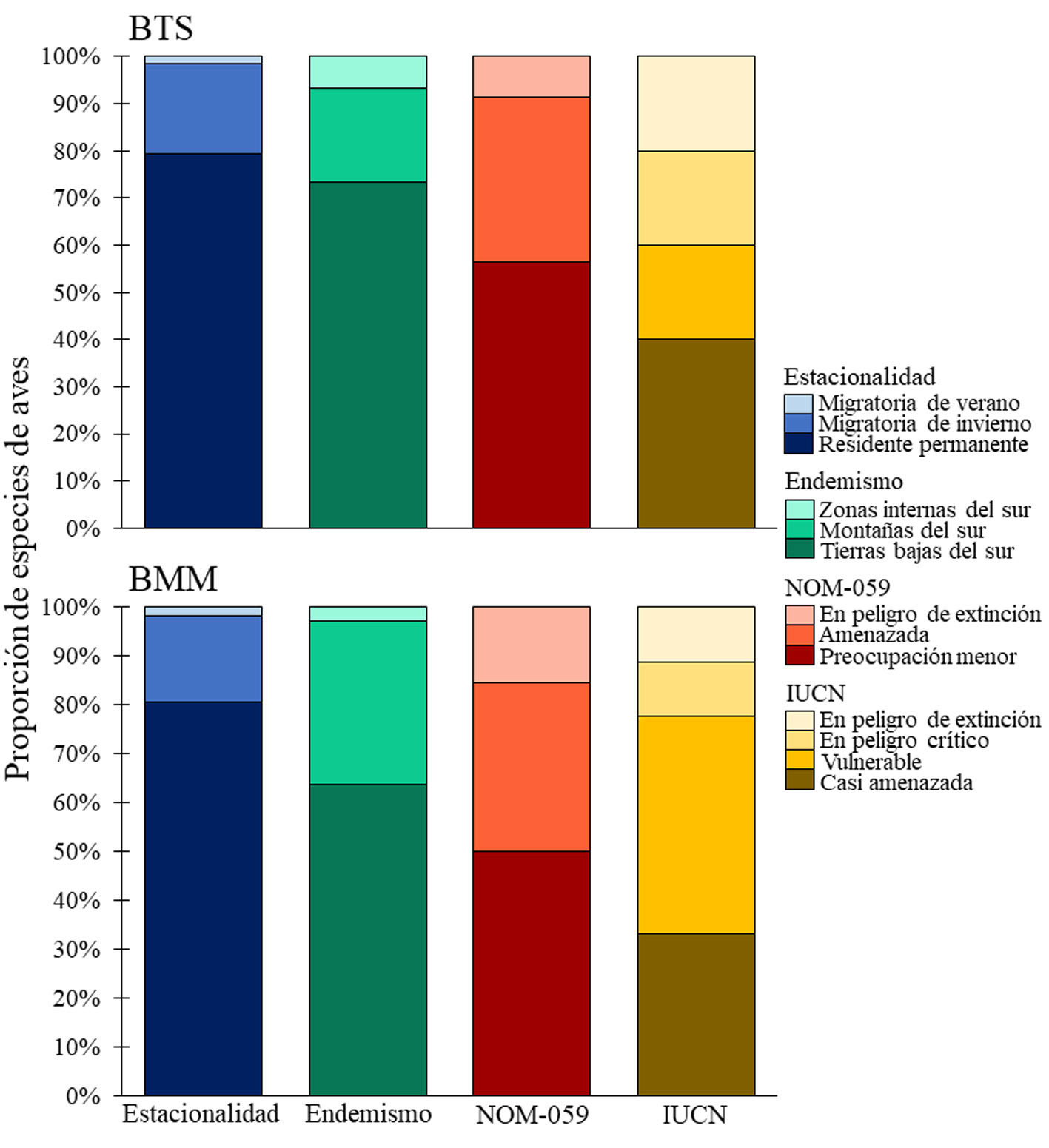
Del total de especies registradas, 162 especies son residentes permanentes y 44 migratorias (apéndice). La proporción de aves residentes permanentes, migratorias de invierno y de verano fue muy similar en ambos tipos de vegetación (fig. 6). Un total de 39 especies es endémico del oeste de México (apéndice), 24 lo son de las tierras bajas del sur, 12 de las montañas del sur y 3 de las zonas internas del sur. Ambos tipos de vegetación mostraron mayor proporción de aves endémicas de las tierras bajas del sur (fig. 6), mientras que la afinidad del endemismo a las montañas del sur aumentó en el BMM, en el BTS hubo mayor proporción de aves endémicas de las zonas internas del sur. Por otro lado, 42 especies de aves se encontraron en alguna categoría de riesgo de acuerdo con la NOM-059-SEMARNAT-2010 y lista roja de la UICN (apéndice). De acuerdo con la NOM-059, el BMM tuvo mayor proporción de aves en peligro de extinción (15%) y el BTS mayor proporción de aves sujetas a protección especial (57%). Además, del total de aves consideradas por la UICN para el BTS y BMM, entre 60% y 67%, respectivamente, se encuentran en las categorías de vulnerables, en peligro crítico y en peligro de extinción (fig. 6).
Tabla 1
Valores de recambio taxonómico (βSIM; abajo de la diagonal) y disimilitud resultante de la anidación (βNES; arriba de la diagonal) en los intervalos altitudinales de bosques tropicales húmedos y semihúmedos en la sierra de Atoyac, Guerrero.
| 600-700 m | 800-900 m | 1,000-1,100 m | 1,200-1,400 m | > 1,700 m | |
| 600-700m | 0.08 | 0.03 | 0.19 | 0.11 | |
| 800-900m | 0.14 | 0.12 | 0.1 | 0.18 | |
| 1,000-1,100m | 0.26 | 0.18 | 0.23 | 0.09 | |
| 1,200-1,400m | 0.14 | 0.19 | 0.11 | 0.34 | |
| > 1,700m | 0.5 | 0.42 | 0.5 | 0.21 |
Discusión
La riqueza de especies obtenida para el área de estudio fue alta, comparativamente representa más de la tercera parte de la avifauna del estado de Guerrero (38%, 549 especies; Navarro, 1998; Sierra-Morales et al., 2019) y de la provincia biogeográfica de la sierra Madre del Sur (33%, 622 especies; Navarro-Sigüenza et al., 2016). Esta riqueza es resultado de una combinación de distintos elementos tanto históricos como ecológicos. Desde el punto de vista histórico, la sierra de Atoyac está enclavada dentro de la SMS, un sistema montañoso muy antiguo que data del Paleozoico al Cenozoico formado a partir de distintos eventos tectónicos que derivaron en plegamientos y propiciaron una orografía muy accidentada (Santamaría-Díaz, 2016; Velasco-de León et al., 2016). Adicionalmente, los eventos paleoclimáticos por medio de las fluctuaciones climáticas ocurridas principalmente durante el Pleistoceno en las regiones tropicales del sur de México, incrementaron la diversidad biológica en esta región (Espinosa et al., 2008). Estos procesos históricos han originado taxones con una larga historia de diversificación en aislamiento y que, en combinación con factores ecológicos como el clima y la estructura de los tipos de vegetación han potencializado la diversidad de especies de aves en esta región (Navarro-Sigüenza et al., 2016). Así, por ejemplo, han evolucionado formas que le dan identidad a esta región como el colibrí coqueta cresta corta (Lophornis brachylophus), una especie microendémica a la sierra de Atoyac (Banks, 1990) y el rascador gorra castaña (Arremon kuehnerii), una población diferenciada que se encuentra restringida en las montañas húmedas del centro de Guerrero (Navarro-Sigüenza et al., 2013). Existen otras formas cuya distribución incluye una buena parte de los bosques montañosos húmedos de la sierra Madre del Sur, como el colibrí guerrerense (Eupherusa poliocerca), la chara garganta blanca (Cyanolyca mirabilis) y el vencejo carablanca (Cypseloides storeri). Esfuerzos previos han resaltado la importancia biológica de la sierra de Atoyac en grupos como las bromelias (Pulido-Esparza et al., 2004), anfibios y reptiles (Flores-Villela y Ochoa-Ochoa, 2016), aves (Aid et al., 1997; Navarro, 1992) y mamíferos (Monteagudo y León-Paniagua, 2002; Santos-Moreno y Alfaro, 2016). Los resultados obtenidos en este estudio se tradujeron en un incremento de 21% en la riqueza de aves (206 especies) de acuerdo con un estudio previo realizado por Navarro (1992) para esta misma sierra (162 especies). Este aumento en el número de especies denota la importante biodiversidad de aves que albergan el BMM y BTS, pero también la necesidad de mantener estrategias de monitoreo de la diversidad biológica a largo plazo en regiones prioritarias
Tanto la riqueza total de aves, como las endémicas, mostraron un mayor número de especies en elevaciones intermedias, específicamente en los 1,200-1,400 m, el cual disminuyó en el intervalo de altitud más alto. Este patrón de mayor riqueza en zonas intermedias a lo largo de gradientes altitudinales coincide con lo reportado en estudios previos sobre aves (Kattan y Franco, 2004; Jaime-Escalante et al., 2016) y mamíferos (McCain, 2004, 2005). En ambientes tropicales, diversos estudios a lo largo de gradientes altitudinales han evidenciado que la riqueza de especies está asociada con la precipitación y la productividad, las cuales con frecuencia demuestran relaciones en forma de joroba (Rosenzweig, 1995; McCain, 2005). En la región de estudio, estas zonas intermedias coinciden con la presencia de bosque mesófilo de montaña, un tipo de vegetación que presenta alta humedad en comparación con los BTS y que se logra desarrollar bajo precipitaciones por arriba de los 3,000 mm (Gual-Díaz y González-Medrano, 2014). Así, es probable que la riqueza de especies de aves esté respondiendo a esta productividad. Por otra parte, el mayor número de especies encontradas en las zonas intermedias del gradiente apoya la hipótesis de dominio medio (Colwell y Lees, 2000). Esta hipótesis establece que, debido a constricciones geométricas a lo largo de las montañas, el mayor número de especies se encontrará en las zonas de altitud intermedia. Al igual que la riqueza, el endemismo incrementó en zonas intermedias con presencia de bosque mesófilo, aunque sin efectos significativos de los intervalos altitudinales. En este contexto, los BMM son reconocidos por los altos niveles de endemismo que presentan debido a las condiciones climáticas tan particulares y al aislamiento geográfico natural en el que se desarrollan (Hernández-Baños et al., 1995; Watson y Peterson, 1999). Ejemplo de evolución in situ en los BMM es el complejo Chlorospingus flavopectus, mismo que a lo largo de su área de distribución en este tipo de vegetación muestra una alta diferenciación en sus poblaciones mediada por procesos de especiación (Bonaccorso et al., 2008).
Los resultados del recambio y el anidamiento entre tipos de vegetación fueron bajos. El hecho de que ambos bosques se distribuyan de forma contigua en elevaciones intermedias (de 700 a 1,300 msnm) a lo largo de gradientes altitudinales confiere que las comunidades bióticas que allí se distribuyen tengan cierto grado de similitud en su composición (Navarro, 1992). Aunque existen ciertas discrepancias en los niveles de humedad en los que se desarrollan ambos tipos de vegetación, en general, las características ambientales (e.g., ubicación en cañadas y laderas protegidas), de ambos bosques permiten que varias especies de aves neotropicales se adecúen a tales condiciones (Navarro-Sigüenza et al., 2014; Stotz et al., 1996). Por mencionar algunos ejemplos, especies de las familias Trochilidae, Trogonidae y Thraupidae están presentes en su gran mayoría en ambos tipos de vegetación. De particular interés son las especies endémicas como Lophornis brachylophus cuya distribución abarca ambos bosques (Sierra-Morales et al., 2016), así como linajes bien diferenciados que constituirían nuevas especies, e.g., Dendrocolaptes sheffleri (Navarro-Sigüenza et al., 2020).
El mayor recambio de especies se observó en el intervalo de > 1,700 m de altitud. En este intervalo se observó a la mayoría de especies con afinidad neártica que se distribuyen en ambos tipos de vegetación, tales como Glaucidium gnoma, Dryobates villosus, Cyanocitta stelleri, Cardellina rubra, C. rubrifrons y Diglossa baritula (Ramírez-Bastida et al., 2015). Los BMM que se desarrollan en las partes altas de un gradiente altitudinal difieren de aquellos ubicados en altitudes más bajas debido a que varios elementos principalmente arbóreos son también de origen neártico (Hamilton et al., 1995). Así, las condiciones estructurales de estos bosques tienden a diferir en comparación con los ubicados en altitudes inferiores. Por ejemplo, los BMM por arriba de los 2,000 m de altitud llegan a desarrollarse en colindancia con bosques de Abies, por lo que es posible que incluso en las partes altas se presenten también heladas y como consecuencia una disminución en la temperatura (Gual-Díaz y González-Medrano, 2014). Estas condiciones climáticas y estructurales del bosque a lo largo de un gradiente altitudinal, suelen ser determinantes en la distribución de las especies (McCain y Grytnes, 2010; Navarro, 1992; Watson y Peterson, 1999). El intervalo altitudinal de 1,200-1,400 m además de presentar la mayor riqueza, también mostró el mayor número de especies únicas, razón por la cual tuvo los valores más altos de anidamiento.
De acuerdo con la dieta principal de las especies en ambos tipos de bosque, los insectívoros e insectívoro-frugívoros fueron los mejor representados, resultado que concuerda con lo observado en otros bosques tropicales húmedos a lo largo de Mesoamérica (Eisermann y Schulz, 2005; Rueda-Hernández et al., 2015). La mayoría de estas especies pertenecen a la familia Tyrannidae, la cual está ampliamente distribuida en América y cuyas especies suelen tener comportamientos gregarios que favorecen su detección (Barden, 1941; Fitzpatrick, 2004; Howell y Webb, 1995; Pomara et al., 2007; Thiollay, 2003). Estas especies cumplen funciones sumamente importantes en los ecosistemas, ya que regulan altas densidades poblacionales de insectos (Şekercioğlu et al., 2004). A su vez, varias de estas especies complementan su dieta con frutos y dispersan sus semillas, contribuyendo a la restauración pasiva de estos bosques tropicales húmedos (Hernández-Ladrón de Guevara et al., 2012). Adicionalmente, los bosques tropicales húmedos y semihúmedos del área de estudio están en su mayoría asociados a cafetales, por lo que mantienen condiciones estructurales y de composición similares a la de bosques primarios (Alvarez-Alvarez et al., 2020; González-Zamora et al., 2016). Esto ha permitido la presencia mayoritaria de ciertos grupos de insectívoros dependientes del sotobosque (e.g., Basileuterus belli, Dromococcyx phasianellus, Henicorhina leucophrys, Thryophilus pleurostictus) y una disminución de omnívoros y granívoros (e.g., Calocitta formosa, Columbina inca, Pitangus sulphuratus, Sporophila torqueola) que generalmente se favorecen de las modificaciones a la vegetación natural (Tejeda-Cruz y Gordon, 2008; Tejeda-Cruz y Sutherland, 2004).
El número de especies endémicas representó la quinta parte del total de la avifauna del área de estudio. Este número es alto y obedece principalmente a que la sierra de Atoyac se ubica en una de las zonas de más alto endemismo en México (Luna-Vega et al., 2016). Esto a su vez ha promovido una prolongada historia de aislamiento para las poblaciones que se distribuyen en este complejo sistema montañoso (Peterson y Navarro-Sigüenza, 2000). Dado que la sierra Madre del Sur tiene mayor influencia por los trópicos (Hernández-Cerda et al., 2016), era de esperarse que los endemismos del área de estudio resultaran ser de las tierras bajas. Por otra parte, resalta el hecho de que para el BMM se encontró un mayor número de especies de aves en peligro de extinción por la NOM-059, así como vulnerables, en peligro crítico y de extinción por la UICN. Por consiguiente, si bien el BMM y BTS están entre los ecosistemas más afectados por los cambios en el uso del suelo y la fragmentación (Semarnat, 2013), el cambio climático pudiera incidir de manera más pronunciada en la disminución de las poblaciones de aves del BMM debido a la disminución de los regímenes de precipitación y humedad (Ponce-Reyes et al., 2012; Rojas-Soto et al., 2012). No obstante, el hecho de que en este estudio se utilizó una propuesta taxonómica diferente a la utilizada por la NOM-059 y la UICN para la categorización de las especies en riesgo, es posible que el número de especies bajo alguna categoría esté subestimado (Rojas-Soto et al., 2010). Así también, podrían existir algunas discrepancias entre la asignación de riesgo actual y la que potencialmente tendrían debido a la disminución de las áreas de distribución que presentan las poblaciones diferenciadas de la SMS.
La sierra de Atoyac es una región prioritaria para la conservación de la biodiversidad (Arriaga et al., 2000). Desde la perspectiva de las aves, la importancia de esta región ha trascendido en esquemas de conservación a nivel nacional (AICAs; Arizmendi y Márquez, 2000), e internacional (Alliance for Zero Extinction, 2020; BirdLife International, 2020; Sttatersfield et al., 1998). Además de su elevada riqueza de especies, el área de estudio muestra un gran número de especies endémicas y alto recambio taxonómico a lo largo de su gradiente altitudinal, mismo que ya ha sido reconocido previamente tanto en aves, como en otros grupos biológicos (Flores-Villela y Ochoa-Ochoa, 2016; Monteagudo y León-Paniagua, 2002; Navarro, 1992). Toda esta plétora de recursos biológicos es resultado de su heterogeneidad espacial, debido a su compleja historia geológica, climas y tipos de vegetación como los bosques mesófilos, bosques tropicales subcaducifolios y otros bosques de coníferas y latifoliadas. Adicionalmente, la sierra de Atoyac alberga poblaciones únicas que le dan identidad a esta región como Lophornis brachylophus, y otras formas que se mantienen aisladas en las montañas de la sierra Madre del Sur de Guerrero como Eupherusa poliocerca, Arremon kuehnerii, Dendrocolaptes sheffleri y Cyanolyca mirabilis (Navarro-Sigüenza et al., 2013, 2020). Además de la diversidad taxonómica y de los endemismos que le dan identidad a esta región, la avifauna del área de estudio muestra una diversidad en los tipos de dieta que eventualmente favorecen procesos ecológicos que derivan en importantes servicios ecosistémicos para el área de estudio (Şekercioğlu et al., 2004). El papel funcional de las aves en la región de estudio las promueve como enlaces móviles a nivel genético (mediante la dispersión de semillas y polinización), y de regulación poblacional (por el control de plagas por insectívoros y carnívoros; Lundberg y Morberg, 2003). Sin embargo, a pesar de esta importancia biológica, la sierra de Atoyac presenta una alta demanda de sus recursos forestales, que han originado áreas con distintos niveles de perturbación y sucesión secundaria (Alvarez-Alvarez et al., 2020; Semarnat, 2013). Este aprovechamiento maderable generalmente es irregular y pone en riesgo la permanencia a largo plazo de las poblaciones particularmente restringidas a las montañas de esta región. Aunado a esto, los efectos potenciales del cambio climático traen consigo reducciones en los regímenes de precipitación y humedad, por lo que los ecosistemas tropicales húmedos y las especies que los habitan son altamente afectados (Jiménez-García y Peterson, 2019; Ponce-Reyes et al., 2012; Rojas-Soto et al., 2012). Los resultados de este estudio constituyen un importante marco de referencia en la implementación de estrategias que puedan ser efectivas para la conservación de una avifauna tan biodiversa, así como de sus hábitats en la sierra de Atoyac, una región considerada como prioritaria para la conservación a nivel nacional y global.
Agradecimientos
Al apoyo financiero de la American Bird Conservancy (#1917D), en particular a Amy Upgren y Philip Tanimoto por su apoyo en la consecución de este proyecto. A la Facultad de Ciencias Químico-Biológicas de la Universidad Autónoma de Guerrero por otorgar las facilidades para realizar esta investigación. Dos revisores anónimos hicieron mejoras sustanciales a una primera versión de este manuscrito. A los estudiantes de Biología de la Universidad Autónoma de Guerrero que brindaron asistencia durante el trabajo de campo, así como a los habitantes de las comunidades en el área de estudio quienes brindaron su hospitalidad, guía en los recorridos y ofrecieron su conocimiento sobre los recursos naturales de la región.
Apéndice. Composición de aves en fragmentos de bosques tropicales húmedos de montaña en una región prioritaria para la conservación del sur-occidente de México. Estacionalidad (EST): residente permanente (Rp), migratoria de invierno (Mi) y verano (Mv). Endemismo (END): tierras bajas del sur (Tb), montañas del sur (Ms), zonas internas del sur (Zi). NOM-059: sujetas a preocupación menor (Pr), amenazadas (A), en peligro de extinción (P). UICN: casi amenazada (Ca), vulnerable (Vu), peligro crítico (Pc), peligro de extinción (Pe). Bosques tropicales húmedos de montaña: bosque tropical subcaducifolio (BTS), bosque mesófilo de montaña (BMM). Los registros adicionales a la sierra de Atoyac se muestran con un asterisco (*).
| Apéndice
Continuación |
||||||
| Taxón | EST | END | NOM | UICN | BTS | BMM |
| Taxón | EST | END | NOM | UICN | BTS | BMM |
| Tinamiformes | ||||||
| Tinamidae | ||||||
| Crypturellus occidentalis | Rp | Pr | X | X | ||
| Galliformes | ||||||
| Cracidae | ||||||
| Ortalis poliocephala | Rp | Tb | X | X | ||
| Penelope purpurascens* | Rp | A | X | X | ||
| Crax rubra* | Rp | A | Vu | X | ||
| Odontophoridae | ||||||
| Dendrortyx macroura | Rp | A | X | |||
| Colinus coyolcos* | Rp | Tb | Ca | X | X | |
| Cyrtonyx sallei* | Rp | Ms | Pr | Ca | X | |
| Columbiformes | ||||||
| Columbidae | ||||||
| Patagioenas flavirostris* | Rp | X | X | |||
| Patagioenas fasciata | Rp | X | ||||
| Columbina inca | Rp | X | X | |||
| Columbina passerina* | Rp | X | X | |||
| Geotrygon montana* | Rp | X | ||||
| Leptotila verreauxi | Rp | X | X | |||
| Zentrygon albifacies | Rp | A | X | X | ||
| Zenaida macroura* | Rp | X | X | |||
| Cuculiformes | ||||||
| Cuculidae | ||||||
| Crotophaga sulcirostris | Rp | X | X | |||
| Dromococcyx phasianellus | Rp | X | X | |||
| Piaya mexicana | Rp | Tb | X | X | ||
| Caprimulgiformes | ||||||
| Caprimulgidae | ||||||
| Chordeiles minor* | Mv | X | ||||
| Nyctidromus albicollis | Rp | X | X | |||
| Antrostomus arizonae | Rp | X | ||||
| Nyctibiiformes | ||||||
| Nyctibiidae | ||||||
| Nyctibius jamaicensis | Rp | X | ||||
| Apodiformes | ||||||
| Apodidae | ||||||
| Streptoprocne zonaris* | Rp | X | X | |||
| Streptoprocne semicollaris* | Rp | Ms | Pr | X | X | |
| Chaetura vauxi | Rp | X | ||||
| Trochilidae | ||||||
| Phaetornis mexicanus | Rp | Tb | X | X | ||
| Lophornis brachylophus | Rp | Tb | P | Pc | X | X |
| Eugenes fulgens | Rp | X | ||||
| Heliomaster longirostris | Rp | Pr | X | X | ||
| Heliomaster constantii* | Rp | X | X | |||
| Lamprolaima rhami | Rp | A | X | |||
| Tilmatura dupontii | Rp | A | X | X | ||
| Archilochus alexandri* | Mi | X | X | |||
| Chlorostilbon auriceps | Rp | Tb | X | X | ||
| Campylopterus hemileucurus | Rp | X | X | |||
| Eupherusa poliocerca | Rp | Ms | A | Vu | X | X |
| Amazilia beryllina | Rp | X | X | |||
| Amazilia rutila | Rp | X | X | |||
| Amazilia violiceps* | Rp | X | X | |||
| Amazilia viridifrons* | Rp | Zi | A | X | ||
| Hylocharis leucotis | Rp | X | ||||
| Charadriiformes | ||||||
| Scolopacidae | ||||||
| Actitis macularius | Mi | X | ||||
| Pelecaniformes | ||||||
| Ardeidae | ||||||
| Bubulcus ibis* | Rp | X | ||||
| Cathartiformes | ||||||
| Cathartidae | ||||||
| Sarcoramphus papa | Rp | P | X | |||
| Accipitriformes | ||||||
| Accipitridae | ||||||
| Accipiter striatus* | Mi | Pr | X | X | ||
| Accipiter cooperi* | Mi | Pr | X | |||
| Accipiter gentilis* | Rp | A | X | |||
| Buteogallus anthracinus | Rp | Pr | X | X | ||
| Buteo plagiatus* | Rp | X | ||||
| Buteo nitidus* | Rp | X | ||||
| Buteo brachyurus* | Rp | X | ||||
| Buteo albonotatus* | Rp | Pr | X | X | ||
| Buteo jamaicensis | Mi | X | X | |||
| Strigiformes | ||||||
| Tytonidae | ||||||
| Tyto alba* | Rp | X | ||||
| Strigidae | ||||||
| Glaucidium gnoma* | Rp | X | ||||
| Glaucidium griscomi* | Rp | Zi | A | X | ||
| Glaucidium brasilianum | Rp | X | X | |||
| Trogoniformes | ||||||
| Trogonidae | ||||||
| Trogon citreolus* | Rp | Tb | X | X | ||
| Trogon mexicanus | Rp | X | X | |||
| Trogon collaris | Rp | Pr | X | X | ||
| Coraciiformes | ||||||
| Momotidae | ||||||
| Momotus mexicanus | Rp | X | X | |||
| Alcedinidae | ||||||
| Chloroceryle americana | Rp | X | X | |||
| Piciformes | ||||||
| Ramphastidae | ||||||
| Aulacorhynchus wagleri | Rp | Ms | Pr | X | X | |
| Picidae | ||||||
| Melanerpes formicivorus | Rp | X | X | |||
| Melanerpes chrysogenys | Rp | Tb | X | X | ||
| Sphyrapicus varius* | Mi | X | ||||
| Dryobates scalaris* | Rp | X | X | |||
| Dryobates jardinii | Rp | X | ||||
| Dryobates fumigatus | Rp | X | ||||
| Colaptes auricularis | Rp | Ms | X | X | ||
| Dryocopus lineatus | Rp | X | ||||
| Campephilus guatemalensis | Rp | Pr | X | X | ||
| Falconiformes | ||||||
| Falconidae | ||||||
| Herpetotheres cachinnans* | Rp | X | X | |||
| Falco sparverius | Mi | X | ||||
| Falco rufigularis | Rp | X | ||||
| Psittaciformes | ||||||
| Psittacidae | ||||||
| Eupsittula canicularis | Rp | Pr | X | X | ||
| Amazona finschi* | Rp | Tb | P | Pe | X | X |
| Passeriformes | ||||||
| Furnariidae | ||||||
| Sittasomus griseicapillus | Rp | X | X | |||
| Dendrocolaptes sheffleri | Rp | Pr | X | |||
| Xiphorhynchus flavigaster | Rp | X | ||||
| Lepidocolaptes leucogaster* | Rp | X | ||||
| Lepidocolaptes souleyetii | Rp | X | X | |||
| Lepidocolaptes affinis | Rp | X | X | |||
| Anabacerthia variegaticeps | Rp | X | ||||
| Clibanornis rubiginosus | Rp | A | X | X | ||
| Tityridae | ||||||
| Tityra griseiceps | Rp | Tb | X | X | ||
| Pachyramphus albiventris | Rp | Tb | X | X | ||
| Tyrannidae | ||||||
| Rhynchocyclus brevirostris | Rp | X | X | |||
| Camptostoma imberbe | Rp | X | X | |||
| Myiopagis viridicata | Rp | X | ||||
| Attila pacificus* | Rp | Tb | X | |||
| Myiarchus tuberculifer | Rp | X | X | |||
| Myiarchus nuttingi* | Rp | X | ||||
| Myiarchus tyrannulus* | Rp | X | ||||
| Pitangus sulphuratus | Rp | X | X | |||
| Megarynchus pitangua | Rp | X | X | |||
| Myiozetetes similis | Rp | X | X | |||
| Myiodynastes luteiventris | Mv | X | X | |||
| Tyrannus melancholicus | Rp | X | X | |||
| Tyrannus vociferans* | Rp | X | X | |||
| Tyrannus crassirostris* | Rp | Tb | X | |||
| Tyrannus verticalis* | Mi | X | X | |||
| Mitrephanes phaeocercus | Rp | X | X | |||
| Contopus cooperi* | Mi | Ca | X | X | ||
| Contopus pertinax | Rp | X | X | |||
| Contopus sordidulus* | Mv | X | ||||
| Empidonax traillii* | Mi | X | ||||
| Empidonax albigularis* | Mi | X | ||||
| Empidonax hammondii | Mi | X | ||||
| Empidonax affinis | Rp | X | X | |||
| Empidonax difficilis | Mi | X | X | |||
| Empidonax fulvifrons | Rp | X | ||||
| Sayornis nigricans* | Rp | X | X | |||
| Vireonidae | ||||||
| Vireolanius melitophrys* | Rp | X | ||||
| Vireo hypochryseus | Rp | Tb | X | X | ||
| Vireo brevipennis* | Rp | Zi | X | |||
| Vireo swainsonii | Rp | X | X | |||
| Vireo flavoviridis* | Mv | X | ||||
| Corvidae | ||||||
| Cyanolyca mirabilis | Rp | Ms | P | Vu | X | |
| Calocitta formosa | Rp | X | X | |||
| Cyanocorax speciosa | Rp | Tb | X | X | ||
| Cyanocitta coronata | Rp | X | ||||
| Aphelocoma sumichrasti* | Rp | Ms | Vu | X | ||
| Hirundinidae | ||||||
| Stelgidopteryx serripennis | Rp | X | X | |||
| Hirundo rustica* | Rp | X | X | |||
| Troglodytidae | ||||||
| Salpinctes obsoletus* | Rp | X | ||||
| Troglodytes brunneicollis | Mi | X | ||||
| Pheugopedius felix | Rp | Tb | X | X | ||
| Thryophilus sinaloa | Rp | Tb | X | X | ||
| Thryophilus pleurostictus* | Rp | X | ||||
| Henicorhina leucophrys | Rp | X | ||||
| Polioptilidae | ||||||
| Polioptila caerulea* | Mi | X | X | |||
| Regulidae | ||||||
| Regulus calendula | Mi | X | ||||
| Turdidae | ||||||
| Sialia sialis | Rp | X | ||||
| Myadestes occidentalis | Rp | Pr | X | X | ||
| Catharus aurantiirostris | Rp | X | ||||
| Catharus occidentalis | Rp | X | X | |||
| Catharus frantzii | Rp | A | X | |||
| Catharus ustulatus | Mi | X | X | |||
| Catharus guttatus | Mi | X | ||||
| Turdus assimilis | Rp | X | X | |||
| Turdus rufopalliatus | Rp | Tb | X | X | ||
| Mimidae | ||||||
| Melanotis caerulescens | Rp | X | ||||
| Ptiliogonatidae | ||||||
| Ptiliogonys cinereus | Rp | X | X | |||
| Fringillidae | ||||||
| Euphonia godmani* | Rp | Tb | X | X | ||
| Euphonia elegantissima | Rp | X | ||||
| Coccothraustes abeillei | Rp | X | ||||
| Spinus notatus | Rp | X | X | |||
| Spinus psaltria* | Rp | X | ||||
| Passerellidae | ||||||
| Chlorospingus albifrons | Rp | Ms | X | |||
| Arremon brunneinucha | Rp | X | ||||
| Aimophila rufescens | Rp | X | X | |||
| Aimophila ruficeps* | Rp | X | X | |||
| Pipilo nigrescens | Rp | Ms | X | |||
| Atlapetes pileatus | Rp | X | ||||
| Icteriidae | ||||||
| Icteria virens | Mi | X | ||||
| Icteridae | ||||||
| Cassiculus melanicterus | Rp | Tb | X | X | ||
| Icterus wagleri* | Rp | X | X | |||
| Icterus fuertesi* | Mi | X | ||||
| Icterus pustulatus* | Rp | Tb | X | X | ||
| Icterus gularis* | Rp | X | ||||
| Icterus dickeyae | Rp | Ms | X | X | ||
| Icterus galbula* | Mi | X | X | |||
| Molothrus aeneus | Rp | X | X | |||
| Molothrus ater* | Rp | X | ||||
| Quiscalus mexicanus* | Rp | X | X | |||
| Parulidae | ||||||
| Mniotilta varia | Mi | X | X | |||
| Oreothlypis superciliosa | Rp | X | ||||
| Leiothlypis crissalis | Mi | X | ||||
| Leiothlypis ruficapilla | Mi | X | X | |||
| Leiothlypis virginiae* | Mi | X | ||||
| Setophaga ruticilla* | Mi | X | ||||
| Setophaga nigrilora | Rp | Tb | X | |||
| Setophaga magnolia* | Mi | X | ||||
| Setophaga erithachorides | Mi | X | X | |||
| Setophaga auduboni | Mi | X | X | |||
| Setophaga graciae* | Rp | X | ||||
| Setophaga nigrescens* | Mi | X | ||||
| Setophaga townsendi* | Mi | X | X | |||
| Setophaga occidentalis | Mi | X | X | |||
| Setophaga virens* | Mi | X | X | |||
| Basileuterus lachrymosus | Rp | X | ||||
| Basileuterus rufifrons | Rp | X | X | |||
| Basileuterus belli | Rp | X | ||||
| Basileuterus culicivorus | Rp | X | X | |||
| Cardellina pusilla | Mi | X | X | |||
| Cardellina rubrifrons* | Mi | X | ||||
| Cardellina rubra | Rp | X | ||||
| Myioborus pictus* | Rp | X | X | |||
| Myioborus miniatus | Rp | X | X | |||
| Cardinalidae | ||||||
| Piranga hepatica | Rp | X | ||||
| Piranga rubra | Mi | X | X | |||
| Piranga ludoviciana | Mi | X | X | |||
| Piranga bidentata | Rp | Ms | X | |||
| Piranga leucoptera | Rp | X | X | |||
| Piranga erythrocephala* | Rp | Ms | X | X | ||
| Pheucticus ludovicianus | Mi | X | ||||
| Passerina caerulea* | Rp | X | X | |||
| Passerina versicolor | Mi | X | ||||
| Passerina ciris | Mi | Pr | X | |||
| Thraupidae | ||||||
| Diglossa baritula | Rp | X | ||||
| Volatinia jacarina | Rp | X | ||||
| Cyanerpes cyaneus | Rp | X | X | |||
| Sporophila torqueola | Rp | Tb | X | X | ||
| Saltator atriceps | Rp | X | X | |||
| Saltator vigorsii | Rp | Tb | X | X |
Referencias
Aid, C. S., Carter, M. F. y Perterson, A. T. (1997). Protected areas of western Mexico: status, management, and needs. Brighton, England: Colorado bird observatory.
Almazán-Núñez, R. C., Alvarez-Alvarez, E. A., Ruiz-Gutiérrez, F., Almazán-Juárez, A., Sierra-Morales, P. y Toribio-Jiménez, S. (2018). Biological survey a cloud forest in southwestern Mexico: plants, amphibians, reptiles, birds, and mammals. Biota Neotropica, 18, 1–10. https://doi.org/10.1590/1676-0611-bn-2017-0444
Alliance for Zero Extinction. (2020). Alliance for zero extinction. Recuperado el 02 enero, 2020 de: https://zeroextinction.org/
Alvarez-Alvarez, E. A., Almazán-Núñez, R. C., González-García, F., Brito-Millán, M., Méndez-Bahena, A. y García-Ibáñez, S. (2020). Shade coffee plantations maintain woody plant diversity and structure in a cloud forest landscape of southern Mexico. Journal of Forestry Research, 31. https://doi.org/10.1007/s11676-020-01143-5
Arbeláez-Cortés, E. y Navarro-Sigüenza, A. G. (2013). Molecular evidence of the taxonomic status of western Mexican populations of Phaethornis (Aves: Trochilidae). Zootaxa, 3716, 81–97. https://doi.org/10.11646/zootaxa.3716.1.7
Arizmendi, M. C. y Márquez, L. V. (2000). Áreas de importancia para la conservación de las aves en México, AICAs. México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Arriaga, L. C., Espinoza-Rodríguez, J. M., Aguilar-Zúñiga, C., Martínez-Romero, E., Gómez-Mendoza, L. y Loza, E. L. (2000). Regiones terrestres prioritarias. México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Banks, C. (1990). Taxonomic status of the Coquette hummingbird of Guerrero, Mexico. Auk, 107, 191–192.
Barden, A. A. (1941). Distributional of the families of birds. The Auk, 58, 543–557.
Baselga, A. (2010). Partitioning the turnover and nestedness components of beta diversity. Global Ecology and Biogeography, 19, 134–143. https://doi.org/10.1111/j.1466-8238.2009.00490.x
Baselga, A. y Orme, C. D. L. (2012). Betapart: an R package for the study of beta diversity. Methods in Ecology and Evolution, 3, 808–812. https://doi.org/10.1111/j.2041-210X.2012.00224.x
Birdlife International (2020). Birdlife International. Recuperado el 02 enero, 2020 de: http://www.birdlife.org/
Bonaccorso, E., Navarro-Sigüenza, A. G., Sánchez-González, L. A., Peterson, A. T. y García-Moreno, J. (2008). Genetic differentiation of the Chlorospingus ophthalmicus complex in Mexico and Central America. Journal of Avian Biology, 39, 311–321. https://doi.org/10.1111/j.0908-8857.2008.04233.x
Challenger, A. (1998). Utilización y conservación de los ecosistemas terrestres de México: pasado, presente y futuro. México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/ Instituto de Biología-Universidad Nacional Autónoma de México/ Agrupación sierra Madre.
Challenger, A. y Soberón, J. (2008). Los ecosistemas terrestres. En J. Soberón, G. Halffter y J. Llorente-Bousquets (Comps.), Capital natural de México. Vol I: conocimiento actual de la biodiversidad (pp. 87–108). México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Chao, A., Ma, K. H. y Hsieh, T. C. (2016). iNEXT (iNterpolation and EXTrapolation) online. Program and User’s Guide. Disponible en: https://chao.shinyapps.io/iNEXTOnline/
Chesser, R. T., Burns, K. J., Cicero, C., Dunn, J. L., Kratter, A. W., Lovette, I. J. et al. (2019). Check-list of North American birds (online). Chicago: American Ornithological Society.
Colwell, R. K. (2013). EstimateS: statistical estimation of species richness and shared species from samples. Version 9.1. Disponible en: http://viceroy.eeb.uconn.edu/estimates
Colwell, R. K. y Lees, D. C. (2000). The mid-domain effect: geometric constraints on the geography of species richness. Trends in Ecology & Evolution, 15, 70–76. https://doi.org/10.1016/S0169-5347(99)01767-X
Conanp (Comisión Nacional de Áreas Naturales Protegidas). (2019). Áreas naturales protegidas federales y Áreas destinadas voluntariamente a la conservación de México. Recuperado el 02 enero, 2020 de: https://www.gob.mx/conanp
Cortés-Rodríguez, N., Hernández-Baños, B. E., Navarro-Sigüenza, A. G., Townsend, P. A. y García-Moreno, J. (2008). Phylogeography and population genetics of the Amethyst-throated Hummingbird (Lampornis amethystinus). Molecular Phylogenetics and Evolution, 48, 1–11. https://doi.org/10.1016/j.ympev.2008.02.005
del Hoyo, J., Elliott, A., Sargatal, J., Christie, D. A. y de Juana, E. (2018). Handbook of the birds of the world alive. Barcelona: Lynx Edicions.
Diego-Pérez, N., Peralta-Gómez, S. y Ludlow-Wiechers, B. (2001). El jilguero: bosque mesófilo de montaña. En N. Diego-Pérez y R. M. Fonseca (Eds.), Estudios florísticos de Guerrero Nº 11 (pp. 1–12). México D.F.: Facultad de Ciencias, Universidad Nacional Autónoma de México.
Eisermann, K. y Schulz, U. (2005). Birds of a high-altitude cloud forest in Alta Verapaz, Guatemala. Revista de Biología Tropical, 53, 577–594. https://doi.org/10.15517/RBT.V53I3-4.14672
Escalante, P. P., Navarro-Sigüenza, A. G. y Peterson, A. T. (1993). Un análisis geográfico, ecológico e histórico de la diversidad de aves terrestres de México. En T. P. Ramamoorthy, R. Bye, A. Lot y J. Fa (Comps.), Diversidad biológica de México: orígenes y distribución (pp. 279–304). México D.F.: Universidad Nacional Autónoma de México.
Espinosa, D. O., Ocegueda-Cruz, S., Aguilar, C. Z., Flores-Villela, O. y Llorente-Bousquets, J. (2008). El conocimiento biogeográfico de las especies y su regionalización natural. En J. Soberón, G. Halffter y J. Llorente-Bousquets (Comps.), Capital natural de México, vol. 1: conocimiento actual de la biodiversidad (pp. 33–65). México D. F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad
Espinosa, D. O., Ocegueda-Cruz, S. y Luna-Vega I. (2016). Introducción al estudio de la biodiversidad de la sierra Madre del Sur: una visión general. En I. Luna-Vega, D. Espinosa y R. Contreras-Medina (Eds.), Biodiversidad de la sierra Madre del Sur: una síntesis preliminar (pp. 23–36). Ciudad de México: Universidad Nacional Autónoma de México.
Fitzpatrick, J. W. (2004). Family Tyrannidae (tyrant-flycatchers). En J. del Hoyo, A. Elliott y D. A. Christie (Eds.), Handbook of the birds of the world (pp. 172–462). Barcelona: Lynx Edicions.
Flores-Villela, O. y Ochoa-Ochoa, L. (2016). Estado de conocimiento y conservación de la herpetofauna de la sierra Madre del Sur. En I. Luna-Vega, D. Espinosa y R. Contreras-Medina (Eds.), Biodiversidad de la sierra Madre del Sur: una síntesis preliminar (pp. 367–380). Ciudad de México: Universidad Nacional Autónoma de México.
García, E. (2004). Modificaciones al sistema de clasificación climática de Köpen. México D.F.: Instituto de Geografía, Universidad Nacional Autónoma de México.
González-Salazar, C., Martínez-Meyer, E. y López-Santiago, G. (2014). A hierarchical classification of trophic guilds for North American birds and mammals. Revista Mexicana de Biodiversidad, 85, 931–941. https://doi.org/10.7550/rmb.38023
González-Zamora, A., Esperón-Rodríguez, M. y Barradas, V. L. (2016). Mountain cloud forest and grown-shade coffee plantations: a comparison of tree biodiversity in central Veracruz, Mexico. Forest Systems, 25, e055. https://doi.org/10.5424/fs/2016251-07538
Gotelli, N. J. y Colwell, R. K. (2011). Estimating species richness. En A. E. Magurran y B. J. McGill (Eds.), Biological diversity: frontiers in measurement and assessment (pp. 39–54). New York: Oxford University Press.
Gual-Díaz, M. y González-Medrano, F. (2014). Los bosques mesófilos de montaña en México. En M. Gual-Díaz y A. Rendón-Correa (Comps.), Bosques mesófilos de montaña de México: diversidad, ecología y manejo (pp. 27–68). México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Gual-Díaz, M. y Rendón-Correa, A. (2017). Los bosques mesófilos de montaña de México. Agroproductividad, 10, 3–9.
Gutiérrez-Báez, C., Folan, W. J., Folan, L., Gallegos, S. y Zamora-Crescencio, P. (2017). Estructura y composición florística de la selva mediana subcaducifolia de Imí, Campeche, México. Foresta Veracruzana, 19, 1–8.
Hamilton, L. S., Juvik, J. O. y Scatena, F. N. (1995). Tropical montane cloud forest. New York: Springer-Verlag.
Hernández-Baños, B. E., Peterson, A. T., Navarro-Sigüenza, A. G. y Escalante-Pliego, B. P. (1995). Bird faunas of the humid montane forest of Mesoamerica: biogeographic patterns and priorities for conservation. Bird Conservation International, 5, 251–277. https://doi.org/10.1017/S0959270900001039
Hernández-Cerda, M. G., Azpra-Romero, E. y Aguilar-Zamora, V. (2016). Condiciones climáticas de la sierra Madre del Sur. En I. Luna-Vega, D. Espinosa y R. Contreras-Medina (Eds.), Biodiversidad de la sierra Madre del Sur: una síntesis preliminar (pp. 91–116). Ciudad de México: Universidad Nacional Autónoma de México
Hernández-Ladrón de Guevara, I., Roja-Soto, O. R., López-Barrera, F., Puebla-Olivares, F. y Díaz-Castelazo, C. (2012). Dispersión de semillas por aves en un paisaje de bosque mesófilo en el centro de Veracruz, México: su papel en la restauración pasiva. Revista Chilena de Historia Natural, 85, 89–100. http://dx.doi.org/10.4067/S0716-078X2012000100007
Hortal, J., Borges, P. A. V. y Gaspar, C. (2006). Evaluating the performance of species richness estimators: sensitivity to sample grain size. Journal of Animal Ecology, 75, 274–287. https://doi.org/10.1111/j.1365-2656.2006.01048.x
Howell, S. N. G. y Webb, S. (1995). A guide to the birds of Mexico and Northern Central America. New York: Oxford University Press.
INEGI (Instituto Nacional de Estadística y Geografía). (2016). Conjunto nacional de uso de suelo y vegetación. Escala 1:250 000, serie VI. Instituto Nacional de Estadística y Geografía, México. Recuperado el 02 enero, 2020 de: https://www.inegi.org.mx/
Jaime-Escalante, N. D., Figueroa-Esquivel, E. M., Villaseñor-Gómez, J. F., Jacobo-Sapien, E. A. y Puebla-Olivares, F. (2016). Distribución altitudinal de la riqueza y composición de “ensamblajes” de aves en una zona montañosa al sur de Nayarit, México. Revista de Biología Tropical, 64, 1537–1551. http://dx.doi.org/10.15517/rbt.v64i4.20255
Jelihovschi, E. G., Faria, J. C. y Allaman, I. B. (2014). ScottKnott: a package for performing the Scott-Knott clustering algorithm in R. Tendencias em Matemática Aplicada e Computacional, 15, 3–17. https://doi.org/10.5540/tema.2014.015.01.0003
Jiménez-García, D. y Peterson, A. T. (2019). Climate change impact on endangered cloud forest tree species in Mexico. Revista Mexicana de Biodiversidad, 90, e902781. http://dx.doi.org/10.22201/ib.20078706e.2019.90.2781
Jost, L. (2006). Entropy and diversity. Oikos, 113, 363–375. https://doi.org/10.1111/j.2006.0030-1299.14714.x
Kattan, G. H. y Franco, P. (2004). Bird diversity along elevational gradients in the Andes of Colombia: area and mass effects. Global Ecology and Biogeography, 13, 451–458. https://doi.org/10.1111/j.1466-822X.2004.00117.x
Koleff, P. y Moreno, E. (2006). Áreas protegidas de México y representación de la riqueza. En J. Llorente-Bousquets y J. J. Morrone (Eds.), Regionalización biogeográfica en Iberoamérica y tópicos afines (pp. 351–373). México D.F.: Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo, Universidad Nacional Autónoma de México/ Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Luna-Vega, I., Espinosa D. y Contreras-Medina, R. (2016). Biodiversidad de la sierra Madre del Sur: una síntesis preliminar. Ciudad de México: Universidad Nacional Autónoma de México.
Lundberg, J. y Morberg, F. (2003). Mobile link organisms and ecosystem functioning: implications for ecosystem resilience and management. Ecosystems, 6, 0087–0098. https://doi.org/10.1007/s10021-002-0150-4
MacGregor-Fors, I. y Payton, M. E. (2013). Contrasting diversity values: statistical inferences based on overlapping confidence intervals. Plos One, 8, e56794. http://dx.doi.org/10.1371/journal.pone.0056794
McCain, C. M. (2004). The mid-domain effect applied to elevational gradients: species richness of small mammals in Costa Rica. Journal of Biogeography, 31, 19–31. https://doi.org/10.1046/j.0305-0270.2003.00992.x
McCain, C. M. (2005). Elevational gradients in diversity of small mammals. Ecology, 86, 366–372. https://doi.org/10.1890/03-3147
McCain, C. M. y Grytnes, J. A. (2010). Elevational gradients in species richness. En Encyclopedia of life sciences. Chichester, UK: John Wiley & Sons. https://doi.org/10.1002/9780470015902.a0022548
McKitrick, M. y Zink, R. M. (1988). Species concepts in Ornithology. Condor, 90, 1–14.
Monteagudo, S. D. y León-Paniagua, L. (2002). Estudio comparativo de los patrones de riqueza altitudinal de especies en mastofaunas de áreas montañosas mexicanas. Revista Mexicana de Mastozoología, 6, 60–82. http://dx.doi.org/10.22201/ie.20074484e.2002.6.1.106
Navarro, A. G. S. (1992). Altitudinal distribution of birds in the sierra Madre del Sur, Guerrero, Mexico. Condor, 94, 29–39.
Navarro, A. G. S. (1998). Distribución geográfica y ecológica de la avifauna del estado de Guerrero, México (Tesis doctoral). Facultad de Ciencias, Universidad Nacional Autónoma de México, México D.F.
Navarro-Sigüenza, A. G., Almazán-Núñez, R. C., Sánchez-Ramos, L. E., Rebón-Gallardo, M. F. y Arbeláez-Cortés, E. (2020). Relict humid tropical forest in Mexico promotes differentiation in barred woodcreepers Dendrocolaptes (Aves: Furnariidae). Zootaxa, 4780, 307–323. http://dx.doi.org/10.11646/zootaxa.4780.2.5
Navarro-Sigüenza, A. G., Blancas-Calva, E., Almazán-Núñez, R. C., Hernández-Baños, B. E., García-Trejo, E. A. y Peterson, A. T. (2016). Diversidad y endemismo de las aves de la sierra Madre del Sur. En I. Luna-Vega, D. Espinosa y R. Contreras-Medina (Eds.), Biodiversidad de la sierra Madre del Sur: una síntesis preliminar (pp. 381–411). Ciudad de México: Universidad Nacional Autónoma de México.
Navarro-Sigüenza, A. G., García-Hernández, A. T. y Peterson, A. T. (2013). A new species of Brush-Finch (Arremon: Emberizidae) from western Mexico. The Wilson Journal of Ornithology, 125, 443–453. https://doi.org/10.1676/12-136.1
Navarro-Sigüenza, A. G., Gómez-de Silva, H., Gual-Díaz, M., Sánchez-González, L. A. y Pérez-Villafaña, M. (2014). La importancia de las aves del bosque mesófilo de montaña de México. En M. Gual-Díaz y A. Rendón-Correa (Comps.), Bosques mesófilos de montaña de México: diversidad, ecología y manejo (pp. 279–299). México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Navarro-Sigüenza, A. G. y Peterson, A. T. (2004). An alternative species taxonomy of the birds of Mexico. Biota Neotropica, 4, 1–32. http://dx.doi.org/10.1590/S1676-06032004000200013
Ornelas, J. F., Sosa, V., Soltis, D. E., Daza, J. M., González, C., Soltis, P. S. et al. (2013). Comparative phylogeographic analyses illustrate the complex evolutionary history of threatened cloud forests of northern Mesoamerica. Plos One, 8, e56283. https://doi.org/10.1371/journal.pone.0056283
Palacios-Wassenaar, O. M., Castillo-Campos, G., Vázquez-Torres, S. M. y Medina-Abreo, M. E. (2018). Estructura y diversidad de plantas leñosas de la selva mediana subcaducifolia en el centro de Veracruz, México. Acta Botanica Mexicana, 124, 85–104. https://doi.org/10.21829/abm124.2018.1279
Peterson, A. T. y R. Chalif. (1989). Guía de aves de México. México D.F.: Diana.
Peterson, A. T. y Navarro-Sigüenza, A. G. (2000). Western Mexico: a significant centre of avian endemism and challenge for conservation action. Cotinga, 14, 42–46.
Pomara, L. Y., Cooper, R. J. y Petit, L. J. (2007). Modeling the flocking propensity of passerine birds in two Neotropical habitats. Oecologia, 153, 121–133. https://doi.org/10.1007/s00442-007-0701-7
Ponce-Reyes, R., Reynoso-Rosales, V. H., Watson, J. E. M., VanDerWal, J., Fuller, R. A., Pressey, R. L. et al. (2012). Vulnerability of cloud forest reserves in Mexico to climate change. Nature Climate Change, 2, 448–452. https://doi.org/10.1038/nclimate1453
Puebla-Olivares, F., Bonaccorso, E., de los Monteros, A. E., Ornland, K. E., Llorente-Bousquets, J. E., Peterson, A.T. et al. (2008). Speciation in Emerald Toucanet (Aulacorhynchus prasinus) complex. The Auk, 125, 39–50. https://doi.org/10.1525/auk.2008.125.1.39
Pulido-Esparza, V. A., López-Ferrari, A. R. y Espejo-Serna, A. (2004). Flora bromeliológica del estado de Guerrero, México: riqueza y distribución (parte A). Boletín de la Sociedad Botánica de México, 75, 55–104. https://doi.org/10.17129/botsci.1693
Ramírez-Bastida, P., Vázquez, L. y Navarro-Sigüenza, A. G. (2015). Aves de los encinares mexicanos: riqueza específica, endemismo y relaciones faunísticas. En S. Romero-Rangel, E. Rojas-Zenteno y L. E. Rubio-Licona (Eds.), Encinos de México (Quercus, Fagaceae) 100 especies. (pp. 91–128). Ciudad de México: Facultad de Estudios Superiores Iztacala, Universidad Nacional Autónoma de México.
R Development Core Team. (2019). R: a language and environment for statistical computing. Vienna, Austria: R Foundation for Statistical Computing. Disponible en: http://www.R-project.org
Rojas-Soto, O. R., Navarro-Sigüenza, A. G. y de los Monteros, A. E. (2010). Systematics and bird conservation policies: the importance of species limits. Bird Conservation International, 20, 176–185. https://doi.org/10.1017/S0959270909990268
Rojas-Soto, O., Sosa, V. y Ornelas, J. F. (2012). Forecasting cloud forest in eastern and southern Mexico: conservation insights under future climate change scenarios. Biodiversity and Conservation, 21, 2671–2690. https://doi.org/10.1007/s10531-012-0327-x
Rosenzweig, M. L. (1995). Species diversity in space and time. Cambridge: Cambridge University Press.
Rueda-Hernandez, R., MacGregor-Fors, I. y Renton, K. (2015). Shifts in resident bird communities associated with cloud forest patch size in Central Veracruz, Mexico. Avian Conservation and Ecology, 10, 2. https://doi.org/10.5751/ACE-00751-100202
Ruiz-Jiménez, C. A., Téllez-Valdés, O. y Luna-Vega, I. (2012). Clasificación de los bosques mesófilos de montaña de México: afinidades de la flora. Revista Mexicana de Biodiversidad, 83, 1110–1144. http://dx.doi.org/10.22201/ib.20078706e.2012.4.1012
Rzedowski, J. (2006). Vegetación de México. México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Santamaría-Díaz, A. (2016). Aspectos geológicos de la sierra Madre del Sur. En I. Luna-Vega, D. Espinosa y R. Contreras-Medina (Eds.), Biodiversidad de la sierra Madre del Sur: una síntesis preliminar (pp. 39−66). Ciudad de México: Universidad Nacional Autónoma de México.
Santos-Moreno, A. y Alfaro, A. M. (2016). Murciélagos de la sierra Madre del Sur. En I. Luna-Vega, D. Espinosa y R. Contreras-Medina (Eds.), Biodiversidad de la sierra Madre del Sur: una síntesis preliminar (pp. 413–428). Ciudad de México D.F.: Universidad Nacional Autónoma de México.
Scott, A. J. y Knott M. (1974). A cluster analysis method for grouping means in the analysis of variance. Biometrics, 30, 507–512.
Şekercioğlu, Ç. H., Daily, G. C. y Ehrlich, P. R. (2004). Ecosystem consequences of bird declines. Proceedings of the National Academy of Sciences of the United States of America, 101, 18042–18047. https://doi.org/10.1073/pnas.0408049101
Semarnat (Secretaría del Medio Ambiente y Recursos Naturales). (2010). Norma Oficial Mexicana NOM-059-SEMARNAT-2010. Protección ambiental-Especies nativas de México de flora y fauna silvestres-Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-Lista de especies en riesgo. Diario Oficial de la Federación. 30 de diciembre de 2010. México D.F. Recuperado el 02 enero, 2020 de: http://biblioteca.semarnat.gob.mx/janium/Documentos/Ciga/agenda/DOFsr/DO2454.pdf
Semarnat (Secretaría del Medio Ambiente y Recursos Naturales). (2013). Inventario estatal forestal y de suelos del estado de Guerrero. México D.F.: Secretaría del Medio Ambiente y Recursos Naturales/ Comisión Nacional Forestal.
Sibley, D. A. (2000). The Sibley guide to birds. New York: Alfred A. Knopf.
Sierra-Morales, P., Almazán-Núñez, R. C., Beltrán-Sánchez, E., Ríos-Muñoz, C. A. y Arizmendi, M. C. (2016). Distribución geográfica y hábitat de la familia Trochilidae (Aves) en el estado de Guerrero, México. Revista de Biología Tropical, 64, 363–376. http://dx.doi.org/10.15517/rbt.v64i1.18003
Sierra-Morales, P., Almazán-Núñez, R. C., Meléndez-Herrada, A., García-Vega, S., Peñaloza-Montaño, M., Alvarez-Alvarez, E. A. et al. (2019). Nuevos registros e información sobresaliente sobre la distribución de algunas aves del estado de Guerrero, México. Huitzil, 20, e-520. https://doi.org/10.28947/hrmo.2019.20.2.421
Sierra-Morales, P., Alvarez-Alvarez, E. A., Almazán-Núñez, R. C., Jiménez-Hernández, J. y Méndez-Bahena, A. (2018). Avifauna de los Pueblos Santos de la sierra Madre del Sur de Guerrero: análisis de la riqueza y recambio taxonómico entre tipos de vegetación. Acta Zoológica Mexicana, 34, 1–14. https://doi.org/10.21829/azm.2018.3411179
Sttatersfield, A. J., Crosby, M. J., Long, A. J. y Wege, D. C. (1998). Endemic bird areas of the world: priorities for biodiversity conservation. Cambridge: BirdLife International.
Stotz, D. F., Fitpatrick, J. W., Parker III, T. A. y Moskovits, D. M. (1996). Neotropical birds: ecology and conservation. Chicago: University of Chicago Press.
Tejeda-Cruz, C. y Gordon, C. E. (2008). Aves. En R. H. Manson, V. Hernández-Ortiz, S. Gallina y K. Mehltreter (Eds.), Agroecosistemas cafetaleros de Veracruz: biodiversidad, manejo y conservación (pp. 149–160). México D.F.: Instituto de Ecología A. C./ Instituto Nacional de Ecología.
Tejeda-Cruz, C. y Sutherland, W. J. (2004). Bird responses to shade coffee production. Animal Conservation, 7, 169–179. https://doi.org/10.1017/S1367943004001258
Thiollay, J. M. (2003). Comparative foraging behavior between solitary and flocking insectivores in a Neotropical forest: does vulnerability matter? Ornitologia Neotropical, 14, 47–65.
UICN (Unión Internacional para la Conservación de la Naturaleza). (2020). The IUCN red list of threatened species. Version 2019-3. Recuperado el 02 enero, 2020 de: https://www.iucnredlist.org
Velasco-de León, P., Arellano-Gil, J., Ortíz-Martínez, E. L., Lozano-Carmona, D. E., Domínguez-Trejo, I., Canales-García, I. et al. (2016). Paleontología y geología de la sierra Madre del Sur. En I. Luna-Vega, D. Espinosa y R. Contreras-Medina (Eds.), Biodiversidad de la sierra Madre del Sur: una síntesis preliminar (pp. 67–90). Ciudad de México: Universidad Nacional Autónoma de México.
Vidal-Zepeda, R. (1990). ‘Precipitación media anual’ en Precipitación. Escala 1: 4000000. Catálogo de metadatos geográficos. México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. Recuperado el 02 enero, 2020 de: https://www.gob.mx/conabio
Watson, D. M. y Peterson, A. T. (1999). Determinants of diversity in a naturally fragmented landscape: humid montane forest avifaunas of Mesoamerica. Ecography, 22, 582–589. https://doi.org/10.1111/j.1600-0587.1999.tb01288.x
Zamudio-Beltrán, L. E. y Hernández-Baños, B. E. (2018). Genetic and morphometric divergence in the Garnet-Throated Hummingbird Lamprolaima rhami (Aves: Trochilidae). PeerJ, 6, e5733. https://doi.org/10.7717/peerj.5733