Calixto Cadenas-Madrigal a, *, Ena Edith Mata-Zayas a, León David Olivera-Gómez a, Johannes Cornelis van der Wal b y Stefan Louis Arriaga-Weiss a
a Universidad Juárez Autónoma de Tabasco, División Académica de Ciencias Biológicas, Entronque Bosques de Saloya, Km 0.5 Carr. Villahermosa-Cárdenas, 86000 Villahermosa, Tabasco, México
b El Colegio de la Frontera Sur, Campus Villahermosa, Carretera a Reforma Km 15.5 s/n Ra, Guineo 2da. Sección, 86280 Villahermosa, Tabasco, México
*Autor para correspondencia: biolcadenasmadrigal@gmail.com (C. Cadenas-Madrigal)
Recibido: 3 enero 2022; aceptado: 24 agosto 2023
Resumen
El sureste de México ha sufrido una gran transformación del paisaje, en parte por la presencia de sistemas de aprovechamiento forestal. Describimos comunidades de avifauna en monocultivos de eucalipto y hule en Huimanguillo, Tabasco, y evaluamos la influencia estructural de estos monocultivos en las aves. Se establecieron 118 puntos de conteo de aves (6 réplicas) y parcelas para evaluar la vegetación. En los 708 puntos se observaron 4,699 individuos de 148 especies de aves; la mayor riqueza y abundancia se presentó en eucalipto. El Anosim mostró diferencias significativas entre hule y eucalipto. El Simper indicó que Psilorhinus morio y Eupsittula nana aportaron mayores porcentajes de disimilitud. La estructura de vegetación difirió estadísticamente entre sitios, particularmente las variables arbóreas en plantaciones con respecto a sus matrices circundantes. Los modelos lineales generalizados (GLM) indicaron que la estructura de sotobosque y el tipo de plantación influyen sobre la diversidad de aves. Los monocultivos de eucalipto en Huimanguillo sustentan una comunidad de aves más rica que la del hule. El eucalipto parece formar parte fundamental del hábitat invernal para aves migratorias en esta región. El sotobosque en sistemas agroforestales es un elemento esencial para las aves en paisajes dominados por actividades antrópicas.
Palabras clave: Aves; Plantaciones; Eucalipto; Hule
© 2023 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Avifauna in commercial agroforestry monocultures in Huimanguillo, Tabasco, Mexico
Abstract
The southeast of Mexico has undergone a great landscape transformation, partly due to the presence of forest harvesting systems. We describe bird communities in eucalyptus and rubber tree monocultures in Huimanguillo, Tabasco, and evaluate the structural influence of these monocultures on bird communities. We sampled 118 bird count points (with 6 replicates) and established vegetation plots for assessment. Across the 708 survey points, 4,699 individuals of 148 bird species were observed. The highest richness and abundance of birds were found in eucalyptus. The ANOSIM showed significant differences between rubber tree and eucalyptus sites. SIMPER analysis indicated that Psilorhinus morio and Eupsittula nana contributed the highest percentages of dissimilarity. The vegetation structure differed statistically between sites, particularly regarding tree variables within plantations compared to their surrounding matrices. Generalized linear models (GLM) indicated that bird diversity is influenced by understory structure and plantation type. In Huimanguillo, eucalyptus monocultures support a richer bird community than the rubber tree one. The eucalyptus seems to play a vital role as a winter habitat for migratory birds in this region. The presence of understory in agroforestry systems is an essential element for birds in landscapes dominated by anthropic activities.
Keywords: Birds; Plantations; Eucalyptus; Rubber tree
© 2023 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
Los trópicos han sufrido una amplia transformación ambiental causada por la deforestación y pérdida de ecosistemas naturales, dando lugar a sistemas de producción agrícola, ganadera y forestal (Ahrends et al., 2015; FAO, 2018, 2019; Mang y Brodie, 2015; Warren-Thomas et al., 2015; Zhang et al., 2019). Este cambio, así como la intensificación de las actividades antrópicas a nivel local y de paisaje, conducen a la pérdida de la diversidad biológica y funcional de las comunidades (Şekercioğlu, 2012).
Durante las últimas décadas, los ecosistemas en México han tenido una rápida conversión a paisajes antrópicos (González-Valdivia et al., 2012), tanto, que en las regiones tropicales cálido-húmedas son comunes las matrices de paisaje compuestas por pastizales, remanentes de selva, áreas agrícolas y degradadas, entre otros (González-Valdivia et al., 2014; Van der Wal et al., 2012). Recientemente, se ha agregado un elemento a este mosaico: los monocultivos forestales comerciales (MFC) a gran escala (Nájera-Coronado, 2015; Rojo-Martínez et al., 2011).
Los MFC son un tipo de agroecosistema constituido por líneas homogéneas de cultivos de tipo arbóreo, sin contar con elementos de sombra (Ollinaho y Kröger, 2021; Torquebiau, 2000). De acuerdo con la Conafor (2010, 2014), la mayor parte de los MFC se distribuyen en la vertiente del golfo de México, destacando los maderables y comerciales como eucalipto, hule, teca y melina. La explotación de los MFC en los últimos 30 años ha llevado a la degradación y/o pérdida de ecosistemas naturales, así como una transformación de los paisajes ya antrópicos, por ejemplo, pastizales (Foroughbakhch et al., 2017). Tabasco, en el sureste de México, ha experimentado una enorme transformación por MFC impulsada por empresas privadas para obtener productos maderables y no maderables, aprovechando las condiciones edáficas y climáticas favorables (Rojo-Martínez et al., 2011; Zavala-Cruz, 2019), de tal manera que esta transformación repercute en la calidad e integridad de los ecosistemas y biodiversidad a nivel local (Sernapam, 2015).
En este contexto, la fauna adaptada a ambientes abiertos puede verse afectada por la homogeneización del paisaje (e.g., forestación con especies exóticas; Brazeiro et al., 2018). Se conoce que la homogeneización está constituida por componentes genéticos, taxonómicos y funcionales (Devictor et al., 2008; Olden, 2006). A escala de paisaje, la homogeneización constituye el aumento de especies similares a través del tiempo en el espacio (Lecoq et al., 2021), generalmente reemplazando especies nativas con exóticas (Olden, 2006). En este sentido, entre los vertebrados, las aves son conocidas por su susceptibilidad a la alteración de la estructura del hábitat (Şekercioğlu, 2006). Por ello, el estudio de la estructura de sus comunidades resulta vital para evaluar perturbación e identificar regiones alteradas o que necesiten protección (Arriaga-Weiss et al., 2008; González-Valdivia et al., 2014); además, a través del entendimiento de sus relaciones con la vegetación, puede ayudar a comprender e identificar los elementos más importantes del paisaje a considerar en estrategias de conservación (Calviño-Cancela, 2013; Calviño-Cancela et al., 2012; Chettri et al., 2005).
A pesar de esto, el papel de los MFC como parte del hábitat para las aves ha sido poco evaluado (Brockerhoff et al., 2008, 2013; Law et al., 2014). En México, este conocimiento es igualmente pobre (Ceccon y Martínez-Ramos, 1999; Martínez-Ruiz et al., 2006) y en Tabasco es prácticamente nulo. Dado que la estructura del paisaje es uno de los principales atributos que modifican la riqueza de especies en vertebrados y que existen ciertas variables que afectan el comportamiento y residencia de aves en determinados ambientes (Chettri et al., 2005; Nájera y Simonetti, 2010; St. Pierre y Kovalenko, 2014; van der Wal et al., 2012), hipotetizamos en este estudio que los MFC no ofrecen suficientes recursos debido a la prácticas de monocultivo que reducen la complejidad estructural y por ende, reducen su utilización por las aves (Calviño-Cancela, 2013; Calviño-Cancela et al., 2012). Por tanto, el objetivo de este estudio fue caracterizar la composición y estructura de las comunidades de aves en MFC de eucalipto, de hule y de sus matrices circundantes, además de determinar la influencia de la estructura vegetal de los sitios sobre las comunidades.
Materiales y métodos
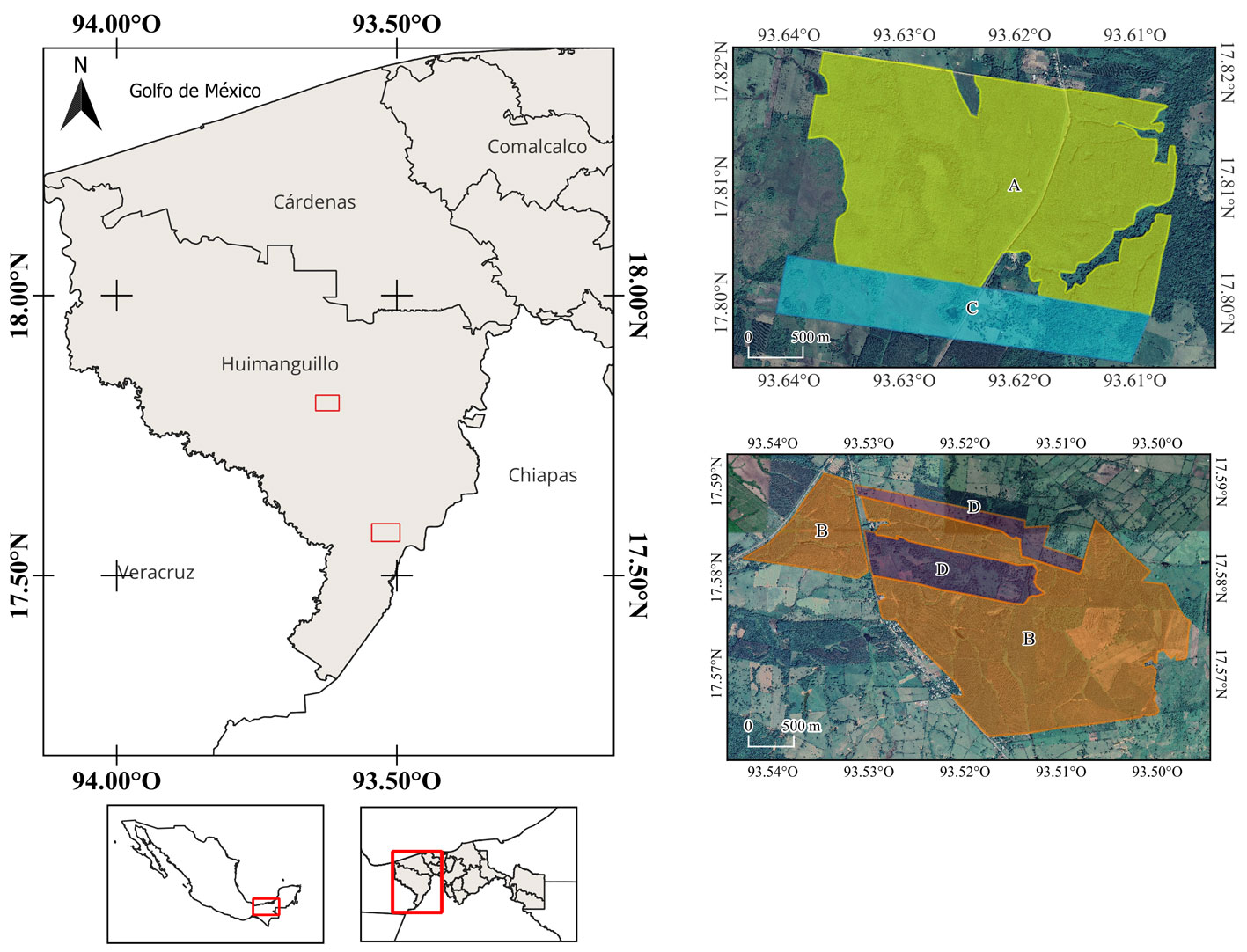
El estudio se llevó a cabo en el municipio de Huimanguillo, ubicado al oeste de Tabasco (17°50’06” N, 93°23’26” O) (INEGI, 2017). Fisiográficamente, el área de estudio se caracteriza por una serie de lomeríos bajos (20-50 m snm, Palma-López et al., 2011) dominados por suelos ultisoles (Meléndez-Nava, 2019). El clima de la región es cálido húmedo con abundantes lluvias durante el verano (ca. 2,343 mm anuales; INEGI, 2000). Los paisajes dominantes del municipio son los pastizales y sabanas, que juntos ocupan 2,254.23 km2, es decir, más de 3 quintas partes de la superficie municipal (INEGI, 2000). La sabana y pastizales están dominados por gramíneas (principalmente especies como: Adropogon bicornis, Digitaria leucites, Imperata sp., Orthoclada laxa, Paspalum plicatulum y P. pectinatum) con arbustos y árboles aislados como: Byrsonima crassifolia, Bursera simaruba, Coccoloba barbadensis, entre otros (Meléndez-Nava, 2019; Rzedowski, 2006).
La región comprende un paisaje dominado por actividades antrópicas, incluyendo campos agrícolas, cultivos anuales, matrices pecuarias y numerosos MFC, destacando principalmente cítricos (Citrus spp.), palma africana (Eleaeis guineensis), hule (Hevea brasiliensis) y eucalipto (Eucalyptus spp.). Particularmente, los MFC de hule y eucalipto se han expandido ampliamente (Nájera-Coronado, 2015), con una extensión que alcanza más de 14,000 ha de eucalipto y más de 3,500 ha de hule en todo el municipio (Palma-López et al., 2011), dejando solo 21.7% (806.9 km2) de vegetación natural (particularmente selvas; INEGI, 2000).
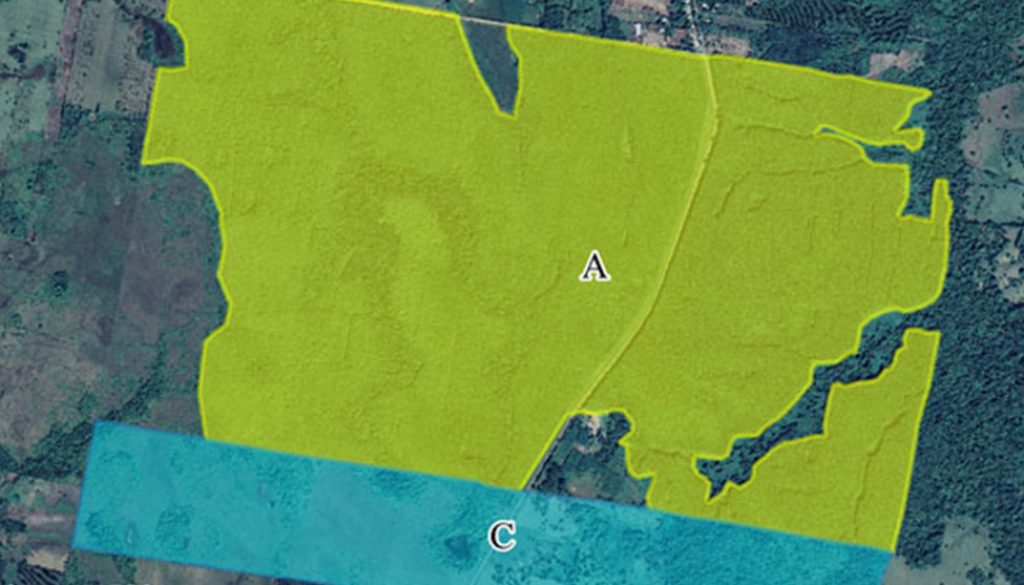
Los MFC se seleccionaron a través de la revisión de imágenes satelitales y recorridos de campo en la región. Una vez identificadas las plantaciones de hule (H. brasiliensis) y eucalipto (Eucalyptus spp.), así como las matrices circundantes a estas plantaciones, se solicitó el acceso a las empresas y los propietarios de los predios. La selección final de los sitios se determinó por los accesos permitidos para el muestreo. Los MFC de hule seleccionados (17°45’28” N, 93°42’34” O) se caracterizan por sotobosque herbáceo mínimo (carente normalmente debido al manejo), altura arbórea estimada de 20 m y una extensión que supera las 400 ha. Los MFC de eucalipto (17°34’35” N, 93°30’19” O) se caracterizan por tener sotobosque herbáceo y con presencia de actividad ganadera (Ollinaho y Kröger, 2021; Torquebiau, 2000), atravesados por una serie de cuerpos de agua lóticos y una altura arbórea uniforme que va de 7 a 15 m. Los 2 monocultivos se ubicaron en la zona de lomeríos al oeste del municipio (fig. 1).
Muestreo de aves. Se utilizó el método de conteo por puntos de radio fijo, por ser una de las técnicas más sencillas y adecuadas para censar aves neotropicales, además de que es efectiva y eficiente para el muestreo en agroecosistemas forestales (Bibby et al., 2002; Cuming y Henry, 2019; Felton et al., 2011; Lynch, 1995). Se establecieron 47 puntos de muestreo en el monocultivo de hule, 37 en monocultivo de eucalipto y 17 en cada una de las matrices circundantes; éstos estuvieron separados por 250 m entre ellos y 100 m del borde (Lynch, 1995; Ralph et al., 1996). El radio de observación fue de 30 m y la duración de los conteos fue de 8 min (Bonthoux y Balent, 2012). Los censos (visuales y auditivos) fueron diurnos, entre las 06:00 y 10:00 horas, alternándose para una mejor obtención de riqueza (Field et al., 2002); se evitaron los días con precipitación o con vientos fuertes (Bibby et al., 2002).
Los puntos de muestreo se replicaron 6 veces en el periodo de diciembre 2019 a noviembre 2020. Este periodo abarcó las 3 temporadas climáticas consideradas en la región: lluvias, secas y nortes (Aceves-Navarro y Rivera-Hernández, 2019). La temporada seca transcurre de finales de febrero hasta principios de junio, la temporada de lluvias de mediados de junio a mediados de septiembre, y la de nortes de septiembre a mediados de febrero con alta humedad relativa, disminución de temperatura y días nublados, y es la temporada con mayor precipitación anual (Aceves-Navarro y Rivera-Hernández, 2019).
Para la identificación de las especies se utilizaron binoculares 10 × 50 y las guías de identificación de Howell y Webb (1995) y de Kaufman (2005). Para las especies detectadas de forma auditiva, se utilizó la colección de sonidos de Boesman (2006) y la base en línea de Xeno-Canto (2019). La clasificación de las aves por gremio alimenticio se basó en Wilman et al. (2016) y van der Wal et al. (2012). La clasificación de las especies se basó en la checklist de la American Ornithological Society (Chesser et al., 2022), mientras que los nombres comunes en la propuesta de Berlanga-García et al. (2019).
Caracterización del hábitat. Se tomaron en cuenta 6 variables de vegetación: número de árboles, cobertura arbórea, altura arbórea, cobertura de sotobosque (herbáceo-arbustivo), altura de sotobosque y diámetro a la altura de pecho (área basal). Estas variables se tomaron en los puntos de conteo para las aves, mediante la técnica de parcelas propuesta por Mostacedo y Fredericksen (2000) y Bautista et al. (2004). La dimensión de las parcelas fue de 60 × 60 m (3,600 m2), con el objetivo de abarcar la totalidad de área de los puntos de muestreo de aves. Dentro de cada parcela se contabilizaron todos los árboles y se estimó su altura mediante un clinómetro electrónico. En el caso de los monocultivos, dada la homogeneidad de los elementos, se tomaron 4 muestras, obteniendo un promedio de altura por parcela. La cobertura del dosel y sotobosque (herbáceo arbustivo 0-3 m) se obtuvo con ayuda de un densiómetro cóncavo y gris, respectivamente, siguiendo el procedimiento antes mencionado en 4 puntos y obteniendo una media por parcela (Higgins et al., 2012).
Se analizó la normalidad de los datos con las pruebas de Kolmogorov-Smirnov (corrección Lilliefors) y Shapiro-Wilk (Zar, 2014). Para evaluar las diferencias entre riqueza, abundancia y diversidad, así como las variables de vegetación entre ambientes, se aplicó un Anova de una vía y pruebas post-hoc de Tukey, así como la prueba no paramétrica de Kruskal-Wallis y post-hoc de Mann-Whitnney, cuando no se pudo probar la normalidad. Todos los análisis se realizaron con el programa PAST© 4.03 (Hammer et al., 2020).
La diversidad α de las comunidades se estimó mediante números de Hill (Chao et al., 2014), que representa el número efectivo de especies dentro de una comunidad o ensamblaje específico (Jost, 2006, 2007; Jost y González-Oreja, 2012; Moreno et al., 2011): 0Dα = riqueza de especies, 1Dα = número de especies abundantes y 2Dα = número de especies dominantes (Jost, 2007). Los valores de 1Dα y 2Dα se calcularon mediante la conversión de los valores de los índices de entropía de Shannon-Wiener y dominancia de Simpson (Jost y González-Oreja, 2012), respectivamente, estimados en PAST© v. 4.03 (Hammer et al., 2020) y, posteriormente, transformados mediante las ecuaciones propuestas por Jost (2006) y Moreno et al. (2011). Para evaluar el esfuerzo de muestreo, se utilizó un estimador de cobertura basado en abundancia, Chao1 mediante el software EstimateS 9.1.0 (Chao et al., 2014; Colwell, 2013). Con el programa PAST© v.4.03 (Hammer et al., 2020) se obtuvieron los índices de equidad de Pielou y dominancia de Berger-Parker, los cuales nos permiten complementar la descripción y estructura de las comunidades estudiadas (Moreno, 2001). La equidad se refiere, básicamente, a la uniformidad en abundancias de las especies que componen una comunidad (Jost, 2010; Tuomisto, 2012), es decir, una proporción de la riqueza observada respecto a la máxima riqueza esperada (Moreno, 2001). Mientras que la dominancia es un parámetro inverso a la definición de equidad mencionada, por tanto, considera el peso de las especies con mayor abundancia como más importante (Moreno, 2001).
Tabla 1
Valor de los índices ecológicos de las comunidades de aves encontradas en Huimanguillo. Ab = Número de individuos; SObs y 0Dα = riqueza de especies; 1Dα = número efectivo de especies comunes; 2Dα = número efectivo de especies dominantes; J’= equidad de Pielou, D = dominancia de Berger-Parker.
| Sitio | Puntos | Hrs Obs | Ab | SObs | SChao1 | Rep. (%) | 0Dα | 1Dα | 2Dα | J’ | D |
| Eucalipto | 222 | 29.6 | 1,588 | 103 | 117.6 | 87.6 | 103 | 47.2 | 30.9 | 0.83 | 0.09 |
| Hule | 282 | 37.6 | 1,024 | 68 | 76.7 | 88.7 | 68 | 30.7 | 14.8 | 0.81 | 0.22 |
| M.E. | 102 | 13.6 | 1,198 | 113 | 128.8 | 87.7 | 113 | 58.2 | 37.7 | 0.86 | 0.08 |
| M.H. | 102 | 13.6 | 889 | 89 | 95.5 | 93.2 | 89 | 44.5 | 26.8 | 0.85 | 0.09 |
| Total | 708 | 94.4 | 4,699 | 148 | 152.4 | 97.1 | 148 | 64.2 | 38.7 | 0.83 | 0.09 |
Se realizó un análisis de escalonamiento multidimensional no métrico (nMDS, López-González e Hidalgo-Sánchez, 2010), el cual permitió visualizar gráficamente las diferencias entre las comunidades de aves; adicionalmente, se calculó el índice de similitud de Jaccard para corroborar diferencias entre comunidades de los sitios estudiados. Este se define como J = a / (a + b + c) (Moreno, 2001). Anosim evaluó estas diferencias y, posteriormente, se utilizó el Simper para identificar las especies que contribuyen a estas discrepancias. Estos análisis también se emplearon para evaluar la abundancia de los gremios alimenticios. Las pruebas se realizaron en el programa PAST© v.4.03 (Hammer et al., 2020).
La matriz de correlaciones indicó que la cobertura de dosel arbóreo, la altura de los árboles y el área basal estuvieron correlacionadas. Por tanto, con la finalidad de reducir variables de vegetación conservando la varianza total de los datos, se aplicó un análisis de componentes principales (PCA) (Bro y Smilde, 2014; Lozares-Colina y López-Roldán, 1991).
Para determinar la influencia de las variables de vegetación sobre las comunidades de aves, se utilizaron modelos lineales generalizados (GLM) con el paquete Stats (R Core Team, 2018). Los modelos se ajustaron teniendo en cuenta la devianza y los grados de libertad, observando si existía sobre dispersión (Crawley, 2007; Sakate y Kashid, 2016). La devianza constituye una medida de bondad de ajuste de los modelos que consiste en: -2 veces la diferencia del logaritmo de la máxima verosimilitud de un modelo saturado comparado con el modelo de interés (Myers et al., 2010; Myers y Montgomery, 1997). Los modelos se reajustaron utilizando la familia de distribución cuasi Poisson eliminando paso a paso las variables no significativas. Posteriormente se aplicaron Anovas y pruebas de χ2 para obtener la significancia de las variables.
Resultados
Se registraron 4,699 individuos correspondientes a 148 especies, 32 familias y 15 órdenes. Las familias más representativas fueron Parulidae, Tyrannidae, Psittacidae y Corvidae (apéndice). Los índices de Berger-Parker (d = 0.094) y equidad de Pielou (J’ = 0.83) indican que las comunidades son diversas y no hay especies dominantes. A nivel de gremios, las aves insectívoras dominaron en los 4 elementos, siendo los insectívoros de follaje los más destacados en riqueza de especies y abundancia (apéndice). Las especies generalistas aportaron una mayor cantidad de individuos, seguidos por las aves de áreas semiabiertas y las de áreas abiertas, en total estos 3 grupos aportaron 76.4% del total de individuos. Solo 4.7% de la abundancia correspondió a especialistas de bosque.
El número efectivo de especies fue 1Dα = 64.2 y 2Dα = 38.7. De acuerdo con el estimador Chao1, todos los elementos tuvieron un porcentaje de representatividad de riqueza superior a 87% (tabla 1). De las 148 especies, 52 corresponden a migratorios invernales (35.1%, n = 1,649 individuos), 8 especies fueron transitorias y 2 migratorias de verano.
La matriz circundante al monocultivo de eucalipto fue el elemento que presentó mayor riqueza de especies (n = 113). El monocultivo de eucalipto registró mayor número de individuos (n = 1,588). Entre los elementos, se encontraron diferencias significativas en cuanto a riqueza de especies (F = 12.69, p < 0.001); el monocultivo de hule tuvo una menor riqueza y abundancia que los elementos restantes; estas diferencias fueron significativas (KW: H = 30.49, p < 0.0001) (fig. 2). Los 4 elementos estudiados no mostraron diferencias estadísticas en cuanto a equidad (KW: H = 4.447, p = 0.21); sin embargo, se encontraron diferencias en dominancia (KW: H = 16.54, p = 0.0008); la prueba post hoc por pares de Mann-Whitney mostró que el monocultivo de hule es distinto a los otros elementos (p < 0.02) y que no existen diferencias estadísticas en dominancia entre los 3 elementos restantes.
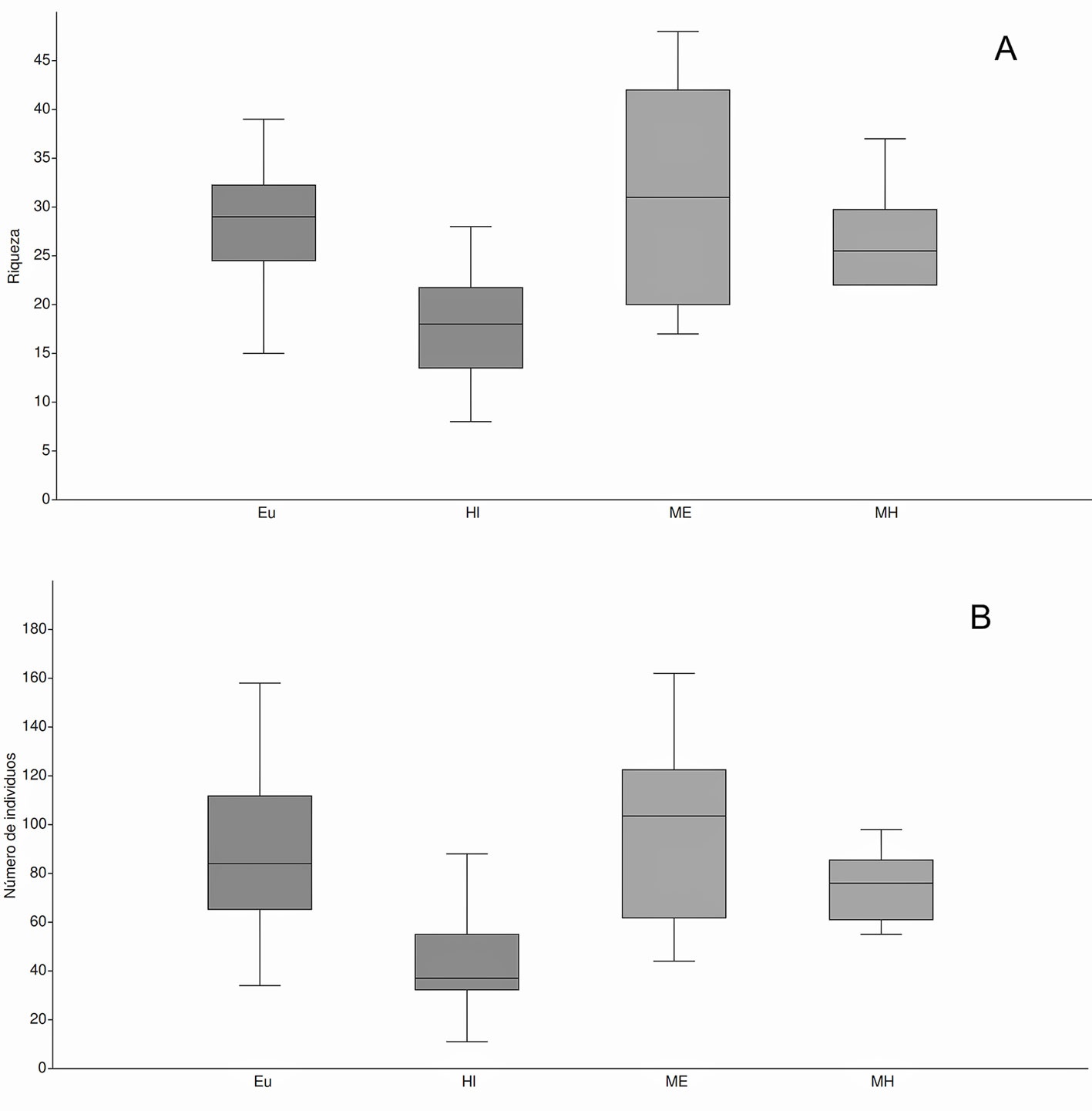
La diversidad verdadera 1Dα fue mayor en el elemento de matriz circundante del eucalipto y menor en los monocultivos de hule (KW: H = 32.91, p < 0.05). El análisis por pares de elementos estudiados indicó que el hule tuvo un número efectivo de especies comunes q1 significativamente menor que los otros hábitats. El monocultivo de eucalipto también tuvo diferencias significativas con su matriz circundante (W = 55, p = 0.026). No se observaron diferencias significativas entre los otros elementos estudiados.
De la misma forma, existen diferencias estadísticas entre número efectivo de especies dominantes (2Dα, KW: H = 43.94, p < 0.001), la mayor es en la matriz circundante al eucalipto y menor en los monocultivos de hule. Las pruebas post hoc de Mann-Whitney indicaron que únicamente los elementos de matriz del hule con monocultivo de eucalipto no mostraron diferencias significativas en este parámetro (W = 151, p = 0.007).
Con base en el índice de similitud de Jaccard, los elementos de monocultivo de eucalipto y su respectiva matriz circundante mostraron comunidades de aves muy similares (J = 0.67), mientras que, por el contrario, el monocultivo del hule fue el elemento más disímil en su composición de especies con los otros ambientes (fig. 3a). Estos resultados concuerdan con el análisis de escalonamiento multidimensional no métrico (fig. 3b).
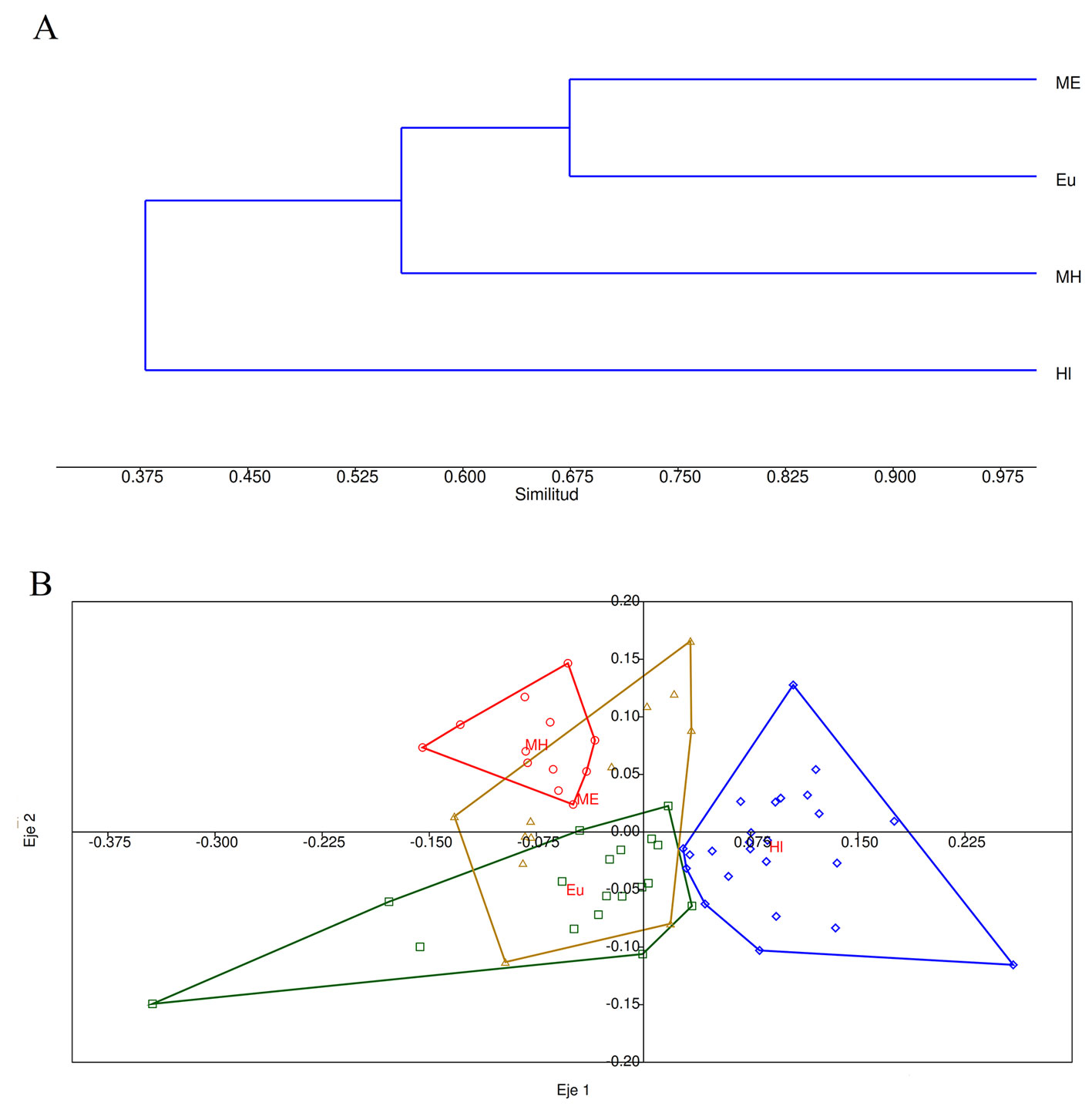
El Anosim de una vía con distancia de Bray-Curtis indicó que existen diferencias significativas entre los sitios de muestreo (R = 0.54, p = 0.0001). La comparación entre pares con el procedimiento secuencial de Bonferroni corregido indicó que estas diferencias son significativas (p < 0.0002). La comparación a través de Simper entre los monocultivos indicó que Psilorhinus morio es la especie que aporta mayor porcentaje de disimilitud (7.69%) seguida de Eupsittula nana (7.14%). De la misma forma, E. nana contribuyó con el mayor porcentaje de disimilitud entre el eucalipto y su matriz (7.3%). Mientras que para el monocultivo de hule y su matriz, P. morio y Sporophila morelleti contribuyeron con 14.37% de la disimilitud.
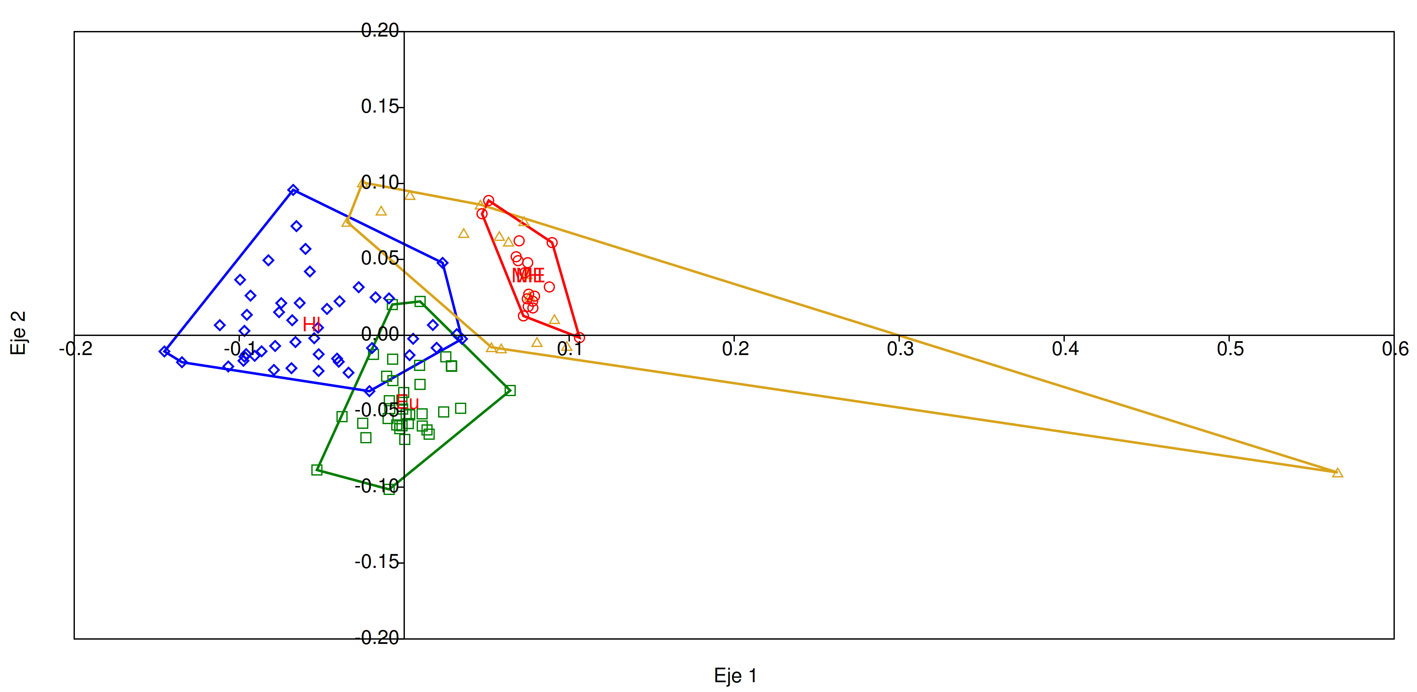
El número de árboles fue mayor en los monocultivos en comparación con sus matrices circundantes (KW: H = 96.32, p < 0.001); acorde a esto, también se encontraron diferencias en cobertura de dosel de las plantaciones con respecto a sus matrices. Cabe destacar, que en eucalipto vs matriz estas diferencias no fueron tan marcadas (W = 210, p = 0.052). En cuanto al sotobosque herbáceo-arbustivo, el monocultivo de hule presentó una altura significativamente menor, sin embargo, la cobertura de esta variable no mostró diferencias entre los elementos del paisaje. El nMDS muestra como las matrices son similares, mientras que los monocultivos tienen una estructura propia característica (fig. 4).
Relación estructura de la vegetación-avifauna. El análisis PCA reveló que la variabilidad en la altura arbórea, cobertura de dosel arbóreo y el área basal puede ser descrita mediante un eje principal: PC1. Este componente explicó más de 86% de la variación en los datos correspondientes. Teniendo ésto en cuenta, los modelos lineales generalizados (GLM) permitieron explorar la influencia de 5 variables de la estructura de la vegetación (PC1, número de árboles, cobertura de sotobosque herbáceo-arbustivo, altura de sotobosque herbáceo-arbustivo, DAP) y el factor “sitio” (tipo de elemento de paisaje), sobre las principales variables de las comunidades de aves.
Los GLM construidos con estos 5 factores indicaron que la altura del sotobosque herbáceo-arbustivo y el sitio son las variables con mayor influencia sobre 5 de las 6 variables de composición y estructura de la avifauna. Cabe mencionar que además de la altura de sotobosque y el sitio, la riqueza de aves también se ve influida fuertemente por el eje PC1; la cobertura del sotobosque también tiene un efecto significativo sobre la abundancia de aves. Por último, la estructura de la vegetación no tuvo influencia sobre la equidad (tabla 2).
Discusión
La diversidad de aves en plantaciones forestales comerciales en Huimanguillo fue de 148 especies, lo que corresponde a 29.9% del total de 495 especies reportadas para Tabasco (Arriaga-Weiss et al., 2019). Esta riqueza de especies y abundancia de aves es similar a las reportadas en Sudamérica para monocultivos en paisajes pecuarios (Marsden et al., 2001; Phifer et al., 2016). Las 53 especies migratorias registradas en este estudio (35.8%) representan más de la mitad de las reportadas para el estado (Arriaga-Weiss et al., 2019) y 11.2% del total de migratorias a nivel nacional (Navarro-Sigüenza et al., 2014). Aunque es un alto porcentaje para monocultivos, concuerda con lo reportado por Bennett et al. (2018) en Centroamérica para monocultivos y otros agroecosistemas.
Entre los 2 tipos de monocultivo evaluados, el hule exhibió la menor riqueza y abundancia de aves. A nivel global, ambos sistemas han sido evidenciados como perjudiciales para la biodiversidad (Ahrends et al., 2015; Castaño-Villa et al., 2019; He y Martin, 2015; Warren-Thomas et al., 2015; Zhang et al., 2019), particularmente para aves en regiones tropicales (Dias et al., 2013; Cid y Caviedes-Vidal, 2014). En Asia, la mayor parte de los estudios son comparaciones entre hábitat nativo y nuevos monocultivos, sin embargo, la riqueza en Huimanguillo es similar a las 67 especies reportadas por Kadir et al. (2018) y las 58 de Sreekar et al. (2016), a pesar de no tener cercanía a ambientes nativos. En América Latina existen escasos estudios en plantaciones de hule. Cuéllar et al. (2014) reportan solo 573 individuos, pero un número elevado de especies, 86; sin embargo, esta riqueza involucra monocultivos, plantaciones mixtas y con regeneración secundaria. En general, en todas las regiones tropicales, la diversidad y abundancia de aves disminuye desde los ecosistemas nativos hasta los monocultivos (Ayat y Tata, 2015; Beukema et al., 2007; Prabowoo et al., 2016), o visto de otro modo, la cercanía a elementos nativos suele aumentar la diversidad de especies de aves (Godoi et al., 2017; Sreekar et al., 2016). A diferencia de Kadir et al. (2018) y Peh et al. (2006), la comunidad de aves en plantación de hule en Huimanguillo es muy distinta a la de la matriz circundante; ésto podría ser causado por la edad misma de las plantaciones o la poca conectividad entre otros elementos del paisaje (Castaño-Villa et al., 2019).
Por otra parte, los monocultivos de eucalipto presentaron la mayor abundancia de aves y la segunda mayor riqueza, solo menor a su propia matriz circundante. De acuerdo con Cid y Caviedes-Vidal (2014), las plantaciones exóticas pueden tener una alta riqueza de especies, pero con menores abundancias. Los resultados obtenidos en monocultivos de eucalipto en Huimanguillo no se ajustan a estos supuestos. A nivel global, los monocultivos de eucalipto han sido catalogados como “desiertos verdes” (Bremer y Farley, 2010; Calviño-Cancela, 2013; De la Hera, 2013); las 103 especies registradas en este estudio superan ampliamente lo reportado para otras regiones en España (Calviño-Cancela [2013], 0Da = 45; Calviño-Cancela y Newman [2015], 0Dα = 33; Goded et al. [2019], 0Dα = 19), Portugal (Proenҫa et al. [2010], 0Dα = 11), Etiopía (Kiros et al. [2018], 0Dα = 15), Brasil (Dias et al. [2013], 0Dα = 54; Lopes et al. [2015], 0Dα = 32-35), Argentina (Phifer et al. [2016], 0Dα = 28) y Chile (Fontúrbel et al. [2016], 0Dα = 19). De la misma forma, estos estudios en su mayor parte comparan elementos nativos que han sido reemplazados por estas plantaciones, por lo que denotan efectos negativos de su expansión sobre la diversidad de aves (Castaño-Villa et al., 2019; Marsden et al., 2001)
Tabla 2
Valores de significancia (*) para los GLM entre las variables de vegetación y los valores de diversidad y abundancia de las aves en los elementos muestreados. PC1 = Incluye la cobertura del dosel, altura arbórea y área basal; No. Ar = número de árboles, CbSt = cobertura de sotobosque herbáceo-arbustivo, AlSt = altura de sotobosque, DAP = diámetro a altura de pecho. Variables taxonómicas: Ab = abundancia, 0Da = riqueza de especies; 1Da = número efectivo de especies comunes; 2Da = número efectivo de especies dominantes, D = dominancia de Berger-Parker, J’ = equidad de Pielou.
| Variables | Familia | Estructura de la vegetación | |||||
| PC1 | No. Ar | CbSt | AlSt | DAP | Sitio | ||
| Ab | Quassipoisson | χ2 = 981.62,
p = 0.72 |
χ2 = 930.02, p = 0.02 * | χ2 = 982.8,
p = 0.001 ** |
χ2 = 1634.3,
p < 0.001 *** |
χ2 = 980.07,
p = 0.68 |
χ2 = 1078.48,
p < 0.001*** |
| 0Da | Quassipoisson | χ2 = 248.57,
p < 0.001*** |
χ2 = 244.93, p = 0.15 | χ2 = 287.68,
p = 0.08 |
χ2 = 292.91,
p < 0.001 *** |
χ2 = 248.54,
p = 0.89 |
χ2 = 186.52,
p < 0.001 *** |
| 1Da | Quassipoisson | χ2 = 210.56,
p = 0.39 |
χ2 = 166.82, p = 0.39 | χ2 = 169.25,
p = 0.04 * |
χ2 = 175.45,
p < 0.001 *** |
χ2 = 167.94,
p = 0.35 |
χ2 = 211.7,
p < 0.001 *** |
| 2Da | Quassipoisson | χ2 = 183.71,
p = 0.005 ** |
χ2 = 169.13, p = 0.85 | χ2 = 169.19,
p = 0.30 |
χ2 = 195.45,
p < 0.001 *** |
χ2 = 167.44,
p = 0.29 |
χ2 = 170.79,
p = 0.03 * |
| D | Gaussiana | χ2 = 1.7,
p = 0.88 |
χ2 = 1.54,
p = 0.31 |
χ2 = 1.58,
p = 0.80 |
χ2 = 1.58,
p = 0.003 ** |
χ2 = 1.56,
p = 0.29 |
χ2 = 1.70,
p < 0.001 *** |
| J’ | Gaussiana | χ2 = 0.66,
p = 0.42 |
χ2 = 0.64,
p = 0.28 |
χ2 = 0.65,
p = 0.30 |
χ2 = 0.65,
p = 0.47 |
χ2 = 0.64,
p = 0.43 |
χ2 = 0.66,
p = 0.60 |
El número efectivo de especies comunes (1Dα) y dominantes (2Dα) fue distinto entre los sitios analizados. Estos valores son superiores a otras plantaciones agroforestales en Sudamérica, en las cuales reportan menos de 10 especies efectivas comunes y dominantes (Iezzi et al., 2018; Phifer et al., 2016); de forma comparativa y obteniendo los valores a través de la fórmula Exp (H’), se puede observar que Phifer et al. (2016) en paisajes similares a Huimanguillo, obtuvieron entre 5.3 a 7.6 veces menos especies efectivas comunes en plantaciones agroforestales, mientras que en sus matrices circundantes, Huimanguillo fue entre 2.6 a 3.4 veces mayor en 1Dα.
En el caso de las matrices circundantes, los resultados destacaron en cuestiones de riqueza y abundancia de aves. La matriz circundante al monocultivo de hule (MH) fue donde se obtuvo la menor abundancia de aves, mientras que por el contrario la matriz circundante al monocultivo de eucalipto (ME) registró la segunda mayor abundancia y la mayor riqueza de aves en general. Considerando que MH estuvo dominada por pastizales pecuarios, hipotéticamente presentaría bajas diversidades de aves debido a la menor complejidad y sotobosque compuesto en su mayor parte por pastos (Godoi et al., 2017; Sáenz et al., 2006).
Los resultados de los GLM indican relaciones positivas entre el tipo de sitio y las comunidades de aves, así como también la influencia particular del sotobosque sobre la riqueza, diversidad y abundancia de aves. Las plantaciones de eucalipto de Huimanguillo presentaron gran densidad de árboles y con una buena cobertura de sotobosque (en algunas zonas incrementada por la presencia de vegetación riparia), pero con individuos de menor DAP (Bas-López et al., 2018). Esto parece favorecer a las aves que suelen alimentarse en estratos bajos (Cid y Caviedes-Vidal, 2014; Vergara y Simonetti, 2004), como a las especies migratorias.
Por el contrario, en una evaluación global sobre cómo afectan las plantaciones forestales a la diversidad de aves, se considera que la presencia de sotobosque y su manejo reducido no es benéfico para la avifauna a escala local. En dicha evaluación, encontraron que las variables que afectan la abundancia, en orden de importancia son: propósito de la plantación, origen, tipo, edad, tamaño, presencia de sotobosque, manejo y conectividad paisajística; mientras que las que afectan la riqueza son: tamaño de plantación, edad, propósito, tipo, origen, conectividad, presencia de sotobosque y manejo (Castaño-Villa et al., 2019).
Otros factores que podrían afectar la diversidad de aves en la región son el sitio (configuración del paisaje), la temporada de muestreo, la florística y la presencia de cuerpos de agua al interior (Bas-López et al., 2018; Cid y Caviedes-Vidal, 2014; Hanane et al., 2019); de esta forma, la florística y la vegetación riparia dentro los monocultivos en Huimanguillo pueden estar influyendo en una escala local a las comunidades de aves. No se encontraron diferencias significativas en los números efectivos de especies en este estudio, considerando las temporadas de muestreo, pero es un factor a considerar (Cid y Caviedes-Vidal, 2014).
Los gremios insectívoros dominaron los sitios de muestreo. Sin embargo, en MFC de hule fue mayor la presencia de omnívoros. Al respecto, Prabowoo et al. (2016) sugirieron que la dispersión de semillas es una de las funciones que se alteran con la implantación de estos sistemas. Particularmente en Huimanguillo, ese supuesto no está del todo claro, ya que Psilorhinus morio fue la especie dominante (no se reportaron especies omnívoras que tuvieran una gran abundancia, además de ésta), mientras que las especies de psitácidos aportaron un gran número de individuos a la comunidad, es decir, éstos pueden estar desempeñando el papel de dispersores de semillas en este paisaje antrópico. El porcentaje de similitud denota justamente que estos grupos de aves aportan las diferencias entre monocultivos. Por otra parte, los insectívoros que se alimentan en suelo y sotobosque herbáceo-arbustivo, tuvieron mayores abundancias en plantaciones (Cid y Caviedes-Vidal, 2014), mientras que los granívoros en las matrices pecuarias (Phifer et al., 2016). De acuerdo con Cid y Caviedes-Vidal (2014), las insectívoras de follaje son más abundantes en hábitat nativo. En Huimanguillo, este grupo se representa de mejor manera en los MFC de eucalipto a través de las migratorias invernales (Bennett et al., 2018).
Implicaciones para la conservación. Es bien conocido que los agroecosistemas soportan una alta diversidad de aves (Bennett et al., 2018; Cadenas-Madrigal, 2013), especialmente en paisajes altamente modificados (Tanalgo et al., 2015). En Huimanguillo, como en otras regiones tropicales, los paisajes están dominados por actividades pecuarias y agrícolas, entonces ¿cómo afecta este proceso de forestación de áreas abiertas a la biodiversidad? Estudios como el de Vergara y Simonetti (2004) sostienen que los monocultivos afectan diferencialmente a las especies de aves de acuerdo con sus interacciones ecológicas y uso del hábitat. La implantación de sistemas de aprovechamiento agroforestal exóticos, como el hule y eucalipto, puede tener repercusiones si su expansión conlleva a la eliminación de hábitat nativo, de tal forma que estos sistemas dan mejores resultados en diversidad cuando se establecen en áreas muy degradadas (Bremer y Farley, 2010; Castaño-Villa et al., 2019), indicando que el tipo de plantación tiene un efecto sobre las comunidades de aves (Bremer y Farley, 2010). En Huimanguillo, ambas especies en los monocultivos son exóticas, por lo que pueden ofrecer pocos recursos y nichos ecológicos a las aves. Los monocultivos pequeños y con ciclos rotativos largos son más amigables para la biodiversidad (Castaño Villa et al., 2019), sin embargo, para los monocultivos de Huimanguillo ocurre lo contrario: las plantaciones de eucalipto, cuyo ciclo es de 4-5 años, parecen ofrecer mejores condiciones que un monocultivo de hule de más de 30 años, al menos para las migratorias (Bennett et al., 2018).
La estructura de la vegetación juega un papel determinante en la composición de las comunidades (Lecoq et al., 2021; Nájera y Simonetti, 2010; Pierre y Kovalenko, 2014), particularmente el sotobosque. El valor de estos monocultivos, con respecto a la conservación aumenta si son manejados, promoviendo la complejidad estructural y heterogeneidad del paisaje (Beukema et al., 2007; Brockerhoff et al., 2008; Lopes et al., 2015; Nájera y Simonetti, 2010; Sheldon et al., 2010). Estas prácticas en el manejo de las plantaciones y el mantenimiento de ciertos elementos al interior pueden resultar la diferencia para especies vulnerables, por ejemplo, fueron registradas 13 especies que se encuentran en alguna categoría de riesgo en la NOM-059-SEMARNAT-2010 y 3 en la lista roja de la Unión Internacional para la Conservación de la Naturaleza (IUCN, 2022). Entre éstas, se encuentran algunas especies como Pteroglossus torquatus, Psarocolius montezuma y aves semiacuáticas (apéndice), las cuales tienen requerimientos de vegetación muy particulares y que han logrado persistir en estos monocultivos dada su complejidad (Howell y Webb, 1995).
En contraparte, hay regiones donde la forestación afecta pastizales nativos, por tanto, el efecto es negativo sobre las aves (Brazeiro et al., 2018; Brokerhoff et al., 2008, 2013). Especialmente en plantaciones de hule, se recomienda el cese del uso de herbicidas, con la finalidad de promover el desarrollo de sotobosque (He y Martin, 2015). Otra alternativa es la implementación de cultivos mixtos, ya que una mayor florística incrementa los nichos y recursos disponibles para las aves nativas, a diferencia de los monocultivos (Carnol et al., 2014; Cuéllar et al., 2014; Felton et al., 2011).
Dado que aún hay poca información, resulta necesario llevar a cabo más estudios en la región que permitan conocer sobre las funciones a escala local de estas plantaciones. Por ejemplo, Calviño-Cancela y Newman (2015) analizaron las interacciones de las aves con los monocultivos de eucalipto, encontrando que éstos son los mayores recursos de flores para las aves especialistas. Adicionalmente, en etapas tempranas, estas plantaciones tienen el potencial de ofrecer un entorno propicio para las especies de sotobosque (Calviño-Cancela et al., 2012). Si estas plantaciones son abandonadas, pueden actuar como hábitats valiosos para las aves en el largo plazo (Fontúrbel et al., 2016).
Los monocultivos de hule sostienen una comunidad de aves muy distinta al resto de los sitios estudiados y comparativamente, albergaron una riqueza baja. Las plantaciones de eucalipto, por otra parte, proporcionan un buen hábitat, especialmente para las aves migratorias. La complejidad del sotobosque y el tipo de monocultivo, favorecen la diversidad de aves en Huimanguillo. Posiblemente, la presencia de elementos internos, como cuerpos de agua y vegetación riparia, así como la florística, podrían ser factores que considerar en estudios posteriores.
Agradecimientos
Al Consejo Nacional de Ciencia y Tecnología (Conacyt) por la beca otorgada durante los estudios de Maestría en Ciencias Ambientales (Núm. de apoyo: 744162). A la Universidad Juárez Autónoma de Tabasco (DACBiol) y al personal académico que hizo posible la realización de este estudio. A los propietarios de los predios y a las empresas Forestales Mexicanos S.A. de C.V. y Proteak S.A. de C.V., por permitirme el acceso a los monocultivos.
Apéndice. Inventario de las aves registradas en los 4 sitios estudiados en Huimanguillo, Tabasco. Las especies marcadas con ** son aquellas registradas únicamente con actividad de sobrevuelo (sin uso directo del hábitat) dentro de los puntos de censo y las marcadas con * representan aquellas que fueron observadas exclusivamente fuera del radio de interés, pero que se encontraron dentro de los monocultivos o de los hábitats de estudio. Sitios: Hl = plantaciones de hule, Eu = plantaciones de eucalipto, MH = matriz circundante al hule, ME = matriz circundante al eucalipto. Estacionalidad: R = residente, MI = migratorio invernal, MV = migratorio de verano y T = transitoria. Gremios alimenticios: Car = carroñero, FAr = frugívoro arbóreo, FSt = frugívoro de sotobosque, Gr = granívoro, IAe = insectívoro aéreo, ICt = insectívoro de cortezas, IF = insectívoro de follaje, IP = insectívoro de percha, ISt = insectívoro de sotobosque, Itr = insectívoro terrestre, IFA = insectívoro-frugívoro arbóreo, Nc = nectarívoro, Om = omnívoro, OA = organismos acuáticos, Ps = piscívoro, Rp = rapaz, H = herbívoro. IUCN Red List: LC = preocupación menor, NT = casi amenzado, EN = en peligro. NOM-059-SEMARNAT-2010: P = en peligro de extinción, Pr = sujeta a protección especial.
| Nombre común | Eu | Hl | ME | MH | Total | Est. | GrAl | IUCN RL | NOM-059 | |
| ANSERIFORMES | ||||||||||
| Anatidae | ||||||||||
| Dendrocygna autumnalis | 4 | 4 | R | H | LC | |||||
| Cairina moschata * | Pato real | 5 | 5 | R | OA | LC | P | |||
| GALLIFORMES | ||||||||||
| Cracidae | ||||||||||
| Ortalis vetula | Chachalaca oriental | 12 | 18 | 13 | 12 | 55 | R | FrA | LC | |
| CICONIIFORMES | ||||||||||
| Ciconiidae | ||||||||||
| Jabiru mycteria | 1 | 1 | R | Ps | LC | P | ||||
| Mycteria americana | Cigüeña americana | 6 | 6 | MI | Ps | LC | Pr | |||
| SULIFORMES | ||||||||||
| Anhingidae | ||||||||||
| Anhinga anhinga* | Aninga americana | 2 | 2 | R | Ps | LC |
| Apéndice. Continúa | ||||||||||
| Nombre común | Eu | Hl | ME | MH | Total | Est. | GrAl | IUCN RL | NOM-059 | |
| PELECANIFORMES | ||||||||||
| Ardeidae | ||||||||||
| Tigrisoma mexicanum * | Garza tigre mexicana | 1 | 1 | R | OA | LC | Pr | |||
| Ardea alba * | Garza blanca | 4 | 1 | 5 | R | OA | LC | |||
| Egretta caerulea * | Garza azul | 1 | 1 | MI | OA | LC | ||||
| Bubulcus ibis | Garza ganadera | 33 | 59 | 95 | 187 | R | Itr | LC | ||
| Butorides virescens* | Garcita verde | 1 | 1 | 2 | R | OA | LC | |||
| Threskiornithidae | ||||||||||
| Eudocimus albus** | Ibis blanco | 4 | 4 | MI | Ps | LC | ||||
| ACCIPITRIFORMES | ||||||||||
| Cathartidae | ||||||||||
| Coragyps atratus | Zopilote común | 6 | 2 | 10 | 18 | 36 | R | Car | LC | |
| Cathartes aura | Zopilote aura | 8 | 5 | 10 | 3 | 26 | R | Car | LC | |
| Cathartes burrovianus | Zopilote sabanero | 5 | 3 | 3 | 11 | R | Car | LC | Pr | |
| Accipitridae | ||||||||||
| Rupornis magnirostris | Aguililla caminera | 57 | 56 | 21 | 20 | 154 | R | Rp | LC | |
| Buteo plagiatus | Aguililla gris | 2 | 6 | 8 | R | Rp | LC | |||
| Buteo platypterus | Aguililla de alas anchas | 22 | 35 | 57 | MI | Rp | LC | Pr | ||
| GRUIFORMES | ||||||||||
| Rallidae | ||||||||||
| Laterallus ruber* | Polluela canela | 2 | 12 | 14 | R | OA | LC | |||
| Aramides cajaneus | Rascón de cuello gris | 1 | 1 | R | OA | LC | ||||
| CHARADRIIFORMES | ||||||||||
| Jacanidae | ||||||||||
| Jacana spinosa* | Jacana norteña | 1 | 1 | R | OA | LC | ||||
| Aramidae | ||||||||||
| Aramus guarauna | Carrao | 1 | 1 | R | OA | LC | A | |||
| COLUMBIFORMES | ||||||||||
| Columbidae | ||||||||||
| Patagioenas flavirostris | Paloma morada | 74 | 59 | 22 | 155 | R | FrA | LC | ||
| Columbina inca | Tortolita de cola larga | 9 | 2 | 2 | 13 | R | Gr | LC | ||
| Columbina passerina | Tortolita de pico rojo | 2 | 2 | 6 | 16 | 26 | R | Gr | LC | |
| Columbina minuta | Tortolita de pecho liso | 2 | 3 | 8 | 13 | R | Gr | LC | ||
| Columbina talpacoti | Tortolita canela | 5 | 12 | 2 | 19 | R | Gr | LC | ||
| Leptotila verreauxi | Paloma arroyera | 64 | 45 | 34 | 16 | 159 | R | Gr | LC | |
| Zenaida asiatica | Paloma de alas blancas | 1 | 13 | 14 | MI | Gr | LC | |||
| CUCULIFORMES | ||||||||||
| Cuculidae | ||||||||||
| Piaya cayana | Cuclillo canelo | 9 | 5 | 3 | 3 | 20 | R | IF | LC | |
| Coccyzus americanus | Cuclillo de pico amarillo | 1 | 1 | 2 | T | IF | LC | |||
| Crotophaga sulcirostris | Garrapatero pijuy | 28 | 28 | 9 | 65 | R | Itr | LC | ||
| CAPRIMULGIFORMES | ||||||||||
| Caprimulgidae | ||||||||||
| Chordeiles acutipennis | Chotacabras menor | 1 | 4 | 5 | MI | IAe | LC | |||
| Nyctidromus albicollis | Chotacabras pauraque | 4 | 2 | 6 | R | IAe | LC | |||
| Antrostomus carolinensis | Tapacaminos de Carolina | 1 | 1 | MI | IAe | LC | ||||
| Antrostomus vociferus | Tapacaminos cuerporruín norteño | 1 | 1 | MI | IAe | LC | ||||
| APODIFORMES | ||||||||||
| Trochilidae | ||||||||||
| Florisuga mellivora | Colibrí de capucha azul | 1 | 1 | R | Nc | LC | ||||
| Phaethornis striigularis | Colibrí ermitaño enano | 3 | 17 | 11 | 31 | R | Nc | LC | Pr | |
| Anthracothorax prevostii | Colibrí de garganta negra | 2 | 2 | 4 | MV | Nc | LC | |||
| Archilochus colubris | Colibrí de garganta rubí | 8 | 12 | 3 | 8 | 31 | MI | Nc | LC | |
| Amazilia tzacatl | Colibrí de cola canela | 8 | 24 | 5 | 5 | 42 | R | Nc | LC | |
| Amazilia yucatanensis | Colibrí de vientre canelo | 38 | 17 | 22 | 13 | 90 | R | Nc | LC | |
| TROGONIFORMES | ||||||||||
| Trogonidae | ||||||||||
| Trogon melanocephalus | Coa de cabeza negra | 25 | 14 | 9 | 3 | 51 | R | IFA | LC | |
| Trogon caligatus | Coa violácea norteña | 1 | 3 | 4 | R | FrA | LC | |||
| CORACIIFORMES | ||||||||||
| Momotidae | ||||||||||
| Momotus lessonii | Momoto de corona azul | 8 | 1 | 9 | R | IFA | LC | |||
| Alcedinidae | ||||||||||
| Megaceryle torquata** | Martín pescador de collar | 1 | 1 | 2 | R | Ps | LC | |||
| PICIFORMES | ||||||||||
| Ramphastidae | ||||||||||
| Pteroglossus torquatus | Tucancillo collarejo | 8 | 2 | 4 | 14 | R | FrA | LC | Pr | |
| Picidae | ||||||||||
| Melanerpes aurifrons | Carpintero chejé | 24 | 57 | 22 | 9 | 112 | R | ICt | LC | |
| Sphyrapicus varius | Carpintero moteado | 2 | 4 | 6 | MI | ICt | LC | |||
| Dryobates fumigatus | Carpintero café | 3 | 3 | R | ICt | LC | ||||
| Colaptes rubiginosus | Carpintero olivo | 14 | 1 | 15 | R | ICt | LC | |||
| Dryocopus lineatus | Carpintero lineado | 1 | 21 | 2 | 3 | 27 | R | ICt | LC | |
| FALCONIFORMES | ||||||||||
| Falconidae | ||||||||||
| Herpetotheres cachinnans | Halcón guaco | 2 | 3 | 1 | 6 | R | Rp | LC | ||
| Micrastur semitorquatus | Halcón selvático de collar | 1 | 1 | R | Rp | LC | Pr | |||
| Caracara plancus | Caracara quebrantahuesos | 1 | 5 | 14 | 20 | R | Rp | LC | ||
| Falco sparverius | Cernícalo americano | 1 | 3 | 4 | MI | Rp | LC | |||
| Falco rufigularis | Halcón murcielaguero | 1 | 1 | R | Rp | LC | ||||
| PSITTACIFORMES | ||||||||||
| Psittacidae | ||||||||||
| Eupsittula nana | Perico pecho sucio | 295 | 63 | 127 | 22 | 507 | R | FrA | LC | Pr |
| Pionus senilis | Loro de corona blanca | 3 | 3 | R | FrA | LC | A | |||
| Amazona albifrons | Loro de frente blanca | 43 | 51 | 50 | 17 | 161 | R | FrA | LC | Pr |
| Amazona autumnalis | Loro de cachetes amarillos | 97 | 76 | 110 | 30 | 313 | R | FrA | LC | |
| Amazona oratrix | Loro cabeza amarilla | 4 | 20 | 6 | 30 | R | FrA | EN | P | |
| PASSERIFORMES | ||||||||||
| Tyrannidae | ||||||||||
| Camptostoma imberbe | Mosquerito chillón | 1 | 4 | 5 | R | IP | LC | |||
| Myiopagis viridicata | Mosquerito verdoso | 2 | 2 | R | IP | LC | ||||
| Elaenia flavogaster | Mosquero elenia copetón | 3 | 1 | 3 | 7 | R | IP | LC | ||
| Poecilotriccus sylvia | Mosquerito espatulilla gris | 1 | 1 | 2 | R | ISt | LC | |||
| Todirostrum cinereum | Mosquerito espatulilla común | 4 | 4 | R | IP | LC | ||||
| Tolmomyias sulphurescens | Mosquerito de ojos blancos | 1 | 2 | 3 | R | IP | LC | |||
| Contopus cooperi | Papamoscas boreal | 1 | 3 | 4 | MI | IP | NT | |||
| Contopus virens | Papamoscas del este | 4 | 4 | T | IP | LC | ||||
| Contopus cinereus | Papamoscas tropical | 2 | 1 | 1 | 4 | R | IP | LC | ||
| Empidonax flaviventris | Papamoscas de vientre amarillo | 11 | 14 | 3 | 1 | 29 | MI | IP | LC | |
| Empidonax virescens | Papamoscas verdoso | 8 | 6 | 2 | 16 | T | IP | LC | ||
| Empidonax albigularis | Papamosca de garganta blanca | 8 | 1 | 2 | 11 | MI | IP | LC | ||
| Empidonax minimus | Papamoscas chico | 72 | 2 | 20 | 12 | 106 | MI | IP | LC | |
| Pyrocephalus rubinus | Papamoscas cardenalito | 5 | 5 | R | IP | LC | ||||
| Attila spadiceus* | Mosquero atila | 2 | 2 | 4 | R | IP | LC | |||
| Myiarchus tuberculifer | Papamoscas triste | 27 | 25 | 7 | 59 | R | IP | LC | ||
| Myiarchus crinitus | Papamoscas viajero | 18 | 19 | 10 | 2 | 49 | MI | IP | LC | |
| Myiarchus tyrannulus | Papamoscas gritón | 2 | 2 | 8 | 2 | 14 | R | IP | LC | |
| Pitangus sulphuratus | Luis bienteveo | 22 | 13 | 4 | 39 | R | IP | LC | ||
| Megarynchus pitangua | Luis de pico grueso | 13 | 7 | 4 | 24 | R | IP | LC | ||
| Myiozetetes similis | Luisito común | 23 | 2 | 26 | 16 | 67 | R | IP | LC | |
| Myiodynastes luteiventris | Papamoscas rayado común | 1 | 1 | 1 | 1 | 4 | MV | Om | LC | |
| Tyrannus melancholicus | Tirano pirirí | 7 | 15 | 35 | 57 | R | IP | LC | ||
| Tyrannus forficatus | Tirano tijereta rosado | 1 | 1 | MI | IP | LC | ||||
| Tyrannus savana | Tirano tijereta gris | 7 | 7 | R | IP | LC | ||||
| Tityridae | ||||||||||
| Tityra semifasciata | Titira puerquito | 6 | 15 | 19 | 8 | 48 | R | FrA | LC | |
| Tityra inquisitor | Titira de pico negro | 5 | 4 | 9 | R | FrA | LC | |||
| Pachyramphus aglaiae | Cabezón degollado | 8 | 4 | 6 | 18 | R | IF | LC | ||
| Pipridae | ||||||||||
| Ceratopipra mentalis | Saltarín de cabeza roja | 4 | 4 | R | FrA | LC | ||||
| Vireonidae | ||||||||||
| Vireo griseus | Vireo de ojos blancos | 71 | 11 | 7 | 89 | MI | ISt | LC | ||
| Vireo flavifrons | Vireo de garganta amarilla | 3 | 4 | 1 | 8 | MI | IF | LC | ||
| Vireo gilvus | Vireo gorjeador | 1 | 7 | 8 | MI | IF | LC | |||
| Vireo philadelphicus | Vireo de Filadelfia | 2 | 2 | MI | IF | LC | ||||
| Vireo olivaceus | Vireo de ojos rojos | 1 | 3 | 4 | T | IF | LC | |||
| Corvidae | ||||||||||
| Psilorhinus morio | Chara pea | 125 | 259 | 64 | 72 | 520 | R | Om | LC | |
| Hirundinidae | ||||||||||
| Progne subis | Golondrina azulnegra | 5 | 2 | 7 | T | IAe | LC | |||
| Tachycineta bicolor | Golondrina bicolor | 2 | 3 | 3 | 13 | 21 | MI | IAe | LC | |
| Stelgidopteryx serripennis | Golondrina de alas aserradas | 13 | 4 | 74 | 91 | R | IAe | LC | ||
| Troglodytidae | ||||||||||
| Troglodytes aedon* | Saltapared común | 4 | 5 | 9 | R | ISt | LC | |||
| Campylorhynchus zonatus | Matraca tropical | 3 | 8 | 2 | 13 | R | IF | LC | ||
| Pheugopedius maculipectus | Saltapared moteado | 56 | 92 | 17 | 24 | 189 | R | ISt | LC | |
| Polioptilidae | ||||||||||
| Polioptila caerulea | Perlita azulgris | 26 | 7 | 4 | 15 | 52 | R | IF | LC | |
| Turdidae | ||||||||||
| Catharus ustulatus | Zorzal de anteojos | 10 | 22 | 16 | 4 | 52 | MI | IFA | LC | |
| Hylocichla mustelina | Zorzal moteado | 28 | 24 | 6 | 58 | MI | ISt | LC | ||
| Turdus grayi | Mirlo café | 14 | 1 | 2 | 1 | 18 | R | Itr | LC | |
| Mimidae | ||||||||||
| Dumetella carolinensis | Maullador gris | 71 | 41 | 51 | 54 | 217 | MI | ISt | LC | |
| Parulidae | ||||||||||
| Seiurus aurocapilla | Chipe suelero | 29 | 14 | 3 | 46 | MI | ISt | LC | ||
| Helmitheros vermivorum | Chipe gusanero | 7 | 5 | 12 | MI | ISt | LC | |||
| Parkesia noveboracensis | Chipe charquero | 3 | 12 | 14 | 29 | MI | Itr | LC | ||
| Vermivora cyanoptera | Chipe de alas azules | 1 | 1 | 2 | MI | IF | LC | |||
| Mniotilta varia | Chipe trepador | 17 | 19 | 5 | 5 | 46 | MI | IF | LC | |
| Limnothlypis swainsonii | Chipe de corona café | 1 | 1 | 2 | MI | ISt | LC | |||
| Leiothlypis peregrina | Chipe peregrino | 6 | 5 | 1 | 12 | MI | IF | LC | ||
| Leiothlypis celata | Chipe oliváceo | 3 | 3 | MI | IF | LC | ||||
| Leiothlypis ruficapilla | Chipe de cabeza gris | 2 | 2 | MI | IF | LC | ||||
| Geothlypis tolmiei | Chipe de lores negros | 1 | 1 | MI | ISt | LC | ||||
| Geothlypis philadelphia | Chipe de pechera | 3 | 1 | 1 | 5 | T | ISt | LC | ||
| Geothlypis formosa | Chipe patilludo | 3 | 5 | 8 | MI | IF | LC | |||
| Geothlypis trichas | Mascarita común | 33 | 27 | 44 | 104 | MI | ISt | LC | ||
| Setophaga citrina | Chipe encapuchado | 20 | 15 | 2 | 4 | 41 | MI | IF | LC | |
| Setophaga ruticilla | Pavito migratorio | 59 | 54 | 14 | 11 | 138 | MI | IF | LC | |
| Setophaga americana | Chipe de pecho manchado | 69 | 17 | 10 | 2 | 98 | MI | IF | LC | |
| Setophaga magnolia | Chipe de magnolias | 62 | 45 | 22 | 11 | 140 | MI | IF | LC | |
| Setophaga fusca | Chipe de garganta naranja | 2 | 1 | 3 | T | IF | LC | |||
| Setophaga petechia | Chipe amarillo | 12 | 14 | 6 | 32 | MI | IF | LC | ||
| Setophaga pensylvanica | Chipe de flancos castaños | 10 | 10 | MI | IF | LC | ||||
| Setophaga dominica | Chipe de garganta amarilla | 1 | 1 | 2 | MI | IF | LC | |||
| Setophaga virens | Chipe de dorso verde | 70 | 27 | 7 | 7 | 111 | MI | IF | LC | |
| Basileuterus rufifrons | Chipe de gorra canela | 2 | 8 | 7 | 17 | R | ISt | LC | ||
| Cardellina canadensis | Chipe de collar | 1 | 1 | T | ISt | LC | ||||
| Cardellina pusilla | Chipe de corona negra | 2 | 2 | 4 | MI | IF | LC | |||
| Icteria virens | Chipe grande | 7 | 1 | 10 | 3 | 21 | MI | ISt | LC | |
| Thraupidae | ||||||||||
| Thraupis episcopus | Tangara azulgris | 1 | 1 | 2 | R | IFA | LC | |||
| Thraupis abbas | Tangara de alas amarillas | 1 | 5 | 6 | 12 | R | IFA | LC | ||
| Volatinia jacarina | Semillero brincador | 22 | 59 | 81 | R | Gr | LC | |||
| Sporophila morelleti | Semillero de collar | 11 | 57 | 82 | 150 | R | Gr | LC | ||
| Saltator atriceps | Saltador de cabeza negra | 4 | 2 | 13 | 19 | R | IFA | LC | ||
| Saltator maximus | Saltador de garganta ocre | 8 | 15 | 12 | 35 | R | IFA | LC | ||
| Emberizidae | ||||||||||
| Arremonops chloronotus | Rascador de dorso verde | 12 | 12 | 8 | 7 | 39 | R | IFA | LC | |
| Aimophila rufescens | Zacatonero canelo | 5 | 5 | R | ISt | LC | ||||
| Peucaea botterii | Zacatonero de Botteri | 2 | 2 | R | ISt | LC | ||||
| Cardinalidae | ||||||||||
| Piranga rubra | Piranga roja | 10 | 16 | 13 | 2 | 41 | MI | IF | LC | |
| Habia rubica | Piranga hormiguera de corona roja | 5 | 9 | 2 | 16 | R | IF | LC | ||
| Habia fuscicauda | Piranga hormiguera de garganta roja | 2 | 34 | 1 | 37 | R | ISt | LC | ||
| Pheucticus ludovicianus | Picogordo degollado | 7 | 5 | 12 | MI | IF | LC | |||
| Cyanocompsa parellina | Colorín azulnegro | 1 | 3 | 4 | R | FrS | LC | |||
| Passerina caerulea | Picogordo azul | 2 | 12 | 4 | 18 | MI | ISt | LC | ||
| Passerina cyanea | Colorín azul | 12 | 1 | 16 | 29 | MI | Gr | LC | ||
| Passerina ciris | Colorín de siete colores | 5 | 4 | 5 | 14 | MI | Gr | LC | Pr | |
| Icteridae | ||||||||||
| Sturnella magna | Pradero tortilla con chile | 21 | 21 | R | Itr | LC | ||||
| Dives dives | Tordo cantor | 84 | 36 | 8 | 128 | R | IFA | LC | ||
| Quiscalus mexicanus** | Zanate mayor | 48 | 13 | 74 | 77 | 212 | R | Om | LC | |
| Icterus spurius | Calandria castaña | 2 | 5 | 7 | MI | IF | LC | |||
| Icterus cucullatus | Calandria de dorso negro menor | 1 | 2 | 3 | R | IFA | LC | |||
| Icterus gularis | Calandria de dorso negro mayor | 18 | 1 | 20 | 8 | 47 | R | IFA | LC | |
| Icterus galbula | Calandria de Baltimore | 21 | 25 | 9 | 55 | MI | IFA | LC | ||
| Psarocolius montezuma | Oropéndola de Moctezuma | 64 | 34 | 60 | 18 | 176 | R | IFA | LC | Pr |
| Fringillidae | ||||||||||
| Euphonia affinis | Eufonia de garganta negra | 4 | 4 | 2 | 10 | R | FrA | LC | ||
| Euphonia hirundinacea | Eufonia de garganta amarilla | 2 | 4 | 6 | R | FrA | LC |
Referencias
Aceves-Navarro, L. A. y Rivera-Hernández, B. (2019). Clima. En A. Cruz-Angón, J. Cruz-Medina, J. Valero-Padilla, F. P. Rodríguez-Reynaga, E. D. Melgarejo, E. E. Mata-Zayas et al. (Eds.), La biodiversidad en Tabasco. Estudio de estado. Vol. I (pp. 61–68). Ciudad de México: Conabio.
Ahrends, A., Hollingsworth, P. M., Ziegler, A. D., Fox, J. M., Chen, H., Su, Y. et al. (2015). Current trends of rubber plantation expansion may threaten biodiversity and livelihoods. Global Environmental Change, 34, 48–58. https://doi.org/10.1016/j.gloenvcha.2015.06.002
Arriaga-Weiss, S. L., Calmé, S. y Kampichler, C. (2008). Bird communities in rainforest fragments: guild responses to habitat variables in Tabasco, Mexico. Biodiversity and Conservation, 17, 173–190. https://doi.org/10.1007/s10531-007-9238-7
Arriaga-Weiss, S. L., Trejo-Pérez, J. L. y Koller-González, J. M. (2019). Aves. En A. Cruz-Angón, J. Cruz-Medina, J. Valero-Padilla, F. P. Rodríguez-Reynaga, E. D. Melgarejo, E. E. Mata-Zayas et al. (Eds.), La biodiversidad en Tabasco. Estudio de estado. Vol. II (pp. 311–318). Ciudad de México: Conabio.
Ayat, A. y Tata, H. L. (2015). Diversity of birds across land use and habitat gradients in forest, rubber agroforest and rubber plantations of North Sumatra. Indonesian Journal of Forestry Research, 2, 103–120. https://doi.org/10.20886/ijfr.2015.2.2.103-120
Bas-López, S., Rivera, J. G. y Sobral, M. (2018). Biodiversidad en plantaciones de eucalipto y robledales del sur de Galicia: plantas y aves. Nova Acta Científica Compostelana (Bioloxía), 25, 71–81.
Bautista, F., Delfín, H., Palacio, J. L. y Delgado, M. C. (2004). Técnicas de muestreo para manejadores de recursos naturales. Ciudad de México: UNAM/ UAY/ Conacyt/ INECOL.
Bennett, R. E., Leuenberger, W., Bosarreyes-Leja, B. B., Sagone-Cáceres, A., Johnson, K. y Larkin, J. (2018). Conservation of Neotropical migratory birds in tropical hardwood and oil palm plantations. Plos One, 13, 1–18. e0210293. https://doi.org/10.1371/journal.pone.0210293
Berlanga-García, H., Gómez-de Silva, H., Vargas-Canales, V. M., Rodríguez-Contreras, V., Sánchez-González, L. A., Ortega-Álvarez, R. et al. (2019). Aves de México: lista actualizada de especies y nombres comunes. Ciudad de México: Conabio.
Beukema, H., Danielsen, F., Vincent, G., Hardiwinoto, S. y van Andel, J. (2007). Plant and bird diversity in rubber agroforests in the lowlands of Sumatra, Indonesia. Agroforestry Systems, 70, 217–242. https://doi.org/10.1007/s10457-007-9037-x
Bibby, C. J., Burgess, N. D., Hill, D. A. y Mustoe, S. H. (2002). Bird census techniques. London: Academic Press.
Boesman, P. (2006). Birds of Mexico – MP3 Sound Collection (1.0) [CD-ROM]. Merelbeke, Bélgica. BirdSound.nl, Holanda.
Bonthoux, S. y Balent, G. (2012). Point count duration: five minutes are usually sufficient to model the distribution of bird species and to study the structure of communities for a French landscape. Journal of Ornithology, 153, 491–504. https://doi.org/10.1007/s10336-011-0766-2
Brazeiro, A., Cravino, A., Fernández, P. y Haretche, F. (2018). Forestación en pastizales de Uruguay: Efectos sobre la diversidad de aves y mamíferos a escala de rodal y del paisaje. Ecosistemas, 27, 48–59. https://doi.org/10.7818/ECOS.1508
Bremer, L. L. y Farley, K. A. (2010). Does plantation forestry restore biodiversity or create green deserts? A synthesis of the effects of land use transitions on plant species richness. Biodiversity and Conservation, 19, 3893–3915. https://doi.org/10.1007/s10531-010-9936-4
Bro, R. y Smilde, A. K. (2014). Principal component analysis. Analytical Methods, 6, 2812–2832. https://doi.org/10.1039/C3AY41907J
Brockerhoff, E. G., Jactel, H., Parrotta, J. A. y Ferraz, S. F. V. (2013). Role of eucalypt and other planted forests in biodiversity conservation and the provision of biodiversity-related ecosystem services. Forest Ecology and Management, 301, 43–50. https://doi.org/10.1016/j.foreco.2012.09.018
Brockerhoff, E. G., Jactel, H., Parrotta, J. A., Quine, C. P. y Sayer, J. (2008). Plantation forests and biodiversity: oxymoron or opportunity? Biodiversity and Conservation, 17, 925–951. https://doi.org/10.1007/s10531-008-9380-x
Cadenas-Madrigal, C. (2013). Uso de hábitat por aves migratorias en 4 ambientes en Huimanguillo, Tabasco (Tesis). DACBiol, Universidad Juárez Autónoma de Tabasco. Tabasco, México.
Calviño-Cancela, M. (2013). Effectiveness of eucalypt plantations as a surrogate habitat for birds. Forest Ecology and Management, 310, 392–399. https://doi.org/10.1016/j.foreco.2013.09.014
Calviño-Cancela, M., Rubido-Bará, M. y van Etten, E. J. B. (2012). Do eucalypt plantations provide habitat for native forest biodiversity? Forest Ecology and Management, 270, 153–172. https://doi.org/10.1016/j.foreco.2012.01.019
Calviño-Cancela, M. y Neumann, M. (2015). Ecological integration of eucalypts in Europe: Interactions with flowers-visiting birds. Forest Ecology and Management, 358, 174–179. https://doi.org/10.1016/j.foreco.2015.09.011
Carnol, M., Baeten, L., Branquart, E., Grégoire, J. C., Heughebaert, A., Muys, B. et al. (2014). Ecosystem services of mixed species forest stands and monocultures: comparing practitioners’ and scientists’ perceptions with formal scientific knowledge. Forestry, 87, 639–653. https://doi.org/10.1093/forestry/cpu024
Castaño-Villa, G. J., Estevez, J. V., Guevara, G., Bohada-Murillo, M. y Fontúrbel, F. E. (2019). Differential effects of forestry plantations on bird diversity: A global assessment. Forest Ecology and Management, 440, 202–207. https://doi.org/10.1016/j.foreco.2019.03.025
Ceccon, E. y Martínez-Ramos, M. (1999). Aspectos ambientales referentes al establecimiento de plantaciones de eucalipto de gran escala en áreas tropicales: aplicación al caso de México. Interciencia, 24, 352–359.
Chao, A., Gotelli, N. J., Hsieh, T. C., Sander, E. L., Ma, K. M., Colwell, R. K. et al. (2014). Rarefaction and extrapolation with Hill numbers: a framework for sampling and estimation in diversity studies. Ecological Monographs, 84, 45–67. https://doi.org/10.1890/13-0133.1
Chesser, R. T., Billerman, S. M., Burns, K. J., Cicero, C., Dunn, J. L., Hernández-Baños, B. E. et al. (2022). Check-list of North American Birds (online). American Ornithological Society. Última consulta el 20 diciembre, 2021 de: https://checklist.americanornithology.org/taxa/
Chettri, N., Deb, C. D., Sharma, E. y Jackson, R. (2005). The relationship between bird communities and habitat. Mountain Research and Development, 25, 235–243. https://doi.org/10.1659/0276-4741(2005)025[0235:TRBBCA]2.0.CO;2
Cid, F. D. y Caviedes-Vidal, E. (2014). Differences in bird assemblages between native natural habitats and small-scale tree plantations in the semiarid Midwest of Argentina. The Wilson Journal of Ornithology, 126, 673–685. https://doi.org/10.1676/13-217.1
Colwell, R. K. (2013). Statistical estimation of species richness and shared species from samples (EstimateS®) ver. 9.1.0. University of Connecticut, USA.
Conafor (Comisión Nacional Forestal). (2010). Situación actual y perspectivas de las plantaciones forestales comerciales en México. Comisión Nacional Forestal, Colegio de Postgraduados. México.
Conafor (Comisión Nacional Forestal). (2014). Sistemas agroforestales maderables en México. Comisión Nacional Forestal. Jalisco, México.
Crawley, M. J. (2007). The R book. West Sussex, England: John Wiley & Sons, Ltd.
Cuéllar, A. S., Rodríguez-Díaz, C. A. y Rodríguez-León, C. H. (2014). Estructura de la comunidad de aves en diferentes sistemas de producción de caucho (Hevea brasiliensis) en Caquetá, Colombia. Revista Colombia Amazónica, 7, 73–88.
Cumming, G. S. y Henry, D. A. W. (2019). Point count outperform line transects when sampling birds along routes in South Africa protected areas. African Zoology, 54, 187–198. https://doi.org/10.1080/15627020.2019.1658540
De la Hera, I., Arizaga, J. y Galarza, A. (2013). Exotic tree plantations and avian conservation in northern Iberia: a view from a nest–box monitoring study. Animal Biodiversity and Conservation, 36, 153–163. https://doi.org/10.32800/abc.2013.36.0153
Devictor, V., Julliard, R., Clavel, J., Jiguet, F., Lee, A. y Couvet, D. (2008). Functional biotic homogenization of bird communities in disturbed landscapes. Global Ecology and Biogeography, 17, 252–261. https://doi.org/10.1111/j.1365-2699.2006.01572.x
Dias, R. A., Bastazini, V. A. G., Gonçalves, M. S. S., Bonow, F. C. y Müller, S. C. (2013). Shifts in composition of avian communities related to temperate-grassland afforestation in southeastern South America. Iheringia, Série Zoologia, Porto Alegre, 103, 12–19. https://doi.org/10.1590/S0073-47212013000100002
FAO (Food and Agriculture Organization of United Nations). (2018). El estado de los bosques del mundo: las vías forestales hacia el desarrollo sostenible. Roma, Italia.
FAO (Food and Agriculture Organization of United Nations). (2019). Planted forests. Última consulta el 28 mayo, 2019 de: http://www.fao.org/forestry/plantedforests/en/
Felton, A., Andersson, E., Ventorp, D. y Lindbladh, M. (2011). A comparison of avian diversity in spruce monocultures and spruce-birch polycultures in Southern Sweden. Silva Fennica, 45, 1143–1150. https://doi.org/10.14214/sf.92
Field, S. A., Tyre, A. J. y Possingham, H. P. (2002). Estimating bird species richness: How should repeat surveys be organized in the time? Austral Ecology, 27, 624–629. https://doi.org/10.1046/j.1442-9993.2002.01223.x
Fontúrbel, F. E., Candia, A. B. y Castaño-Villa, G. J. (2016). Are abandoned eucalyptus plantations avifauna-friendly? A case study in the Valvidian forest. Revista Mexicana de Biodiversidad, 87, 1402–1406. https://doi.org/10.1016/j.rmb.2016.09.011
Foroughbakhch, R., Carrillo-Parra, A., Hernández-Piñero, J. L. y Guzmán-Lucio, M. A. (2017). Growth and yield of an eucalyptus subtropical plantation in a Northeastern Mexico degraded land soil. Madera y Bosques, 23, 71–85. https://doi.org/10.21829/myb.2017.2331130
Godoi, M. N., Laps, R. R., Ribeiro, D. B., Aoki, C. y de Souza, F. L. (2017). Bird species richness, composition and abundance in pastures are affected by vegetation structure and distance from natural habitats: a single tree in pastures matters. Emu-Austral Ornithology, 118, 201–211. https://doi.org/10.1080/01584197.2017.1398591
González-Valdivia, N. A., Barba-Macías, E., Hernández-Daumás, S. y Ochoa-Gaona, S. (2014). Avifauna en sistemas silvopastoriles en el Corredor Biológico Mesoamericano, Tabasco, México. Revista de Biología Tropical, 62, 1031–1052. https://doi.org/10.15517/rbt.v62i3.11442
González-Valdivia, N. A., Arriaga-Weiss, S. L., Ochoa-Gaona, S., Ferguson, B. G., Kampichler, C. y Pozo, C. (2012). Ensambles de aves diurnas a través de un gradiente de perturbación en un paisaje en el sureste de México. Acta Zoológica Mexicana, 28, 237–269. https://doi.org/10.21829/azm.2012.282831
Hammer, Ǿ., Harper, D. A. T. y Ryan, P. D. (2020). PAST©: PAleontological STatistics software package for education and data analysis v.4.03. Natural History Museum, University of Oslo. Disponible en: https://www.nhm.uio.no/english/research/resources/past/
He, P. y Martin, K. (2015). Effects of rubber cultivation on diversity in the Mekong Region. CAB Reviews Perspectives in Agriculture Veterinary Science Nutrition and Natural Resources, 10, 1–7. https://doi.org/10.1079/PAVSNNR201510044
Higgins K. F., Jenkins, K. J., Clambey, G. K., Uresk, D. W., Naugle, D. E., Klaver, R. W. et al. (2012). Vegetation sampling and measurement. En N. J. Silvy (Ed.), The wildlife techniques manual: research (pp. 381–413). Baltimore, Maryland: John Hopkins University Press.
Howell, S. N. G. y Webb, S. (1995). A guide to the birds of Mexico and Northern Central America. Oxford: Oxford University Press.
Iezzi, M. E., Cruz, P., Varela, D., De Angelo, D. y Di Bitetti, M. S. (2018). Tree monocultures in a biodiversity hotspot: Impact of pine plantations on mammal and bird assemblages in the Atlantic Forest. Forest Ecology and Management, 424, 216–227. https://doi.org/10.1016/j.foreco.2018.04.049
INEGI (Instituto Nacional de Estadística y Geografía). (2000). Cuaderno Estadístico Municipal: Huimanguillo, Estado de Tabasco. México.
INEGI (Instituto Nacional de Estadística y Geografía). (2017). Anuario Estadístico y Geográfico de Tabasco 2017. México.
UICN (2022). The IUCN Red List of Threatened Species. Version 2022-2. Última consulta el 16 enero, 2023 de: https://www.iucnredlist.org
Jost, L. (2006). Entropy and diversity. Oikos, 113, 363–375. https://doi.org/10.1111/j.2006.0030-1299.14714.x
Jost, L. (2007). Partitioning diversity into independent alpha and beta components. Ecology, 88, 2427–2439. https://doi.org/10.1890/06-1736.1
Jost, L. (2010). The relation between evenness and diversity. Diversity, 2, 207–232 https://doi.org/10.3390/d2020207
Jost, L. y González-Oreja, J. A. (2012). Midiendo la diversidad biológica: más allá del índice de Shannon. Acta Zoológica Lilloana, 56, 3–14.
Kadir, R. A., Mohammad, M. I. y Zulkifli, S. Z. (2018). Assessment on bird conservation status found in rubber forest plantation by using IUCN and regional classification. Journal of Science and Mathematics Letters, 6, 47–60. https://doi.org/10.37134/jsml.vol6.5.2018
Kaufman, K. (2005). Guía de campo a las aves de Norteamérica. Nueva York: Houghton Mifflin.
Kiros, S., Afework, B. y Legese, K. (2018). A preliminary study on bird diversity and abundance from Wabe fragmented forests around Gubre subcity and Wolkite town, Southwestern Ethiopia. International Journal of Avian & Wildlife Biology, 3, 333–340. https://doi.org/10.15406/ijawb.2018.03.00116
Law, B. S., Chidel, M., Brassil, T., Turner, G. y Kathuria, A. (2014). Trends in bird diversity over 12 years in response to large-scale eucalypt plantation establishment: Implications for extensive carbon plantings. Forest Ecology and Management, 322, 58–68. http://dx.doi.org/10.1016/j.foreco.2014.02.032
Lecoq, L., Ernoult, A. y Mony, C. (2021). Past landscape structure drives the functional assemblages of plants and birds. Scientific Reports, 11, 3443. https://doi.org/10.1038/s41598-021-82851-8
Lopes, I. T., Gussoni, C. O. A., Demarchi, L. O., de Almeida, A. y Pizo, M. A. (2015). Diversity of understory birds in old stands of native and Eucalyptus plantations. Restoration Ecology, 23, 662–669. https://doi.org/10.1111/rec.12216
López-González, E. y Hidalgo-Sánchez, R. (2010). Escalamiento multidimensional no métrico. Un ejemplo con R empleando el algoritmo SMACOF. Estudios sobre Educación, 18, 9–35. https://doi.org/10.15581/004.18.4650
Lozares-Colina, C. y López-Roldán, P. (1991). El análisis de Componentes Principales: aplicación al análisis de datos secundarios. Papers: Revista de Sociología, 37, 31–63. https://doi.org/ http://dx.doi.org/10.5565/rev/papers/v37n0.1595
Lynch, J. F. (1995). Effects of point count duration, time-of-day, and aural stimuli on detectability of migratory and resident bird species in Quintana Roo, México. En C. J. Ralph, S. Droege y J. Sauer (Eds), Monitoring bird population trends by point counts (pp. 1–6). Albany, California: Department of Agriculture Forest Service General Technical Report PSW-GTR-149.
Mang, S. L. y Brodie, J. F. (2015). Impacts of non-oil tree plantations on biodiversity in Southeast Asia. Biodiversity and Conservation, 24, 3431–3447. https://doi.org/10.1007/s10531-015-1022-5
Marsden, S. T., Whiffin, M. y Galetti, M. (2001). Bird diversity and abundance in forest fragments and Eucalyptus plantations around an Atlantic Forest reserve, Brazil. Biodiversity and Conservation, 10, 737–751. https://doi.org/10.1023/A:1016669118956
Martínez-Ruiz, R., Azpíroz-Rivero, H. S., Rodríguez-de la O, J. L., Cetina-Alcalá, V. M. y Gutiérrez-Espinoza, M. A. (2006). Importancia de las plantaciones forestales de Eucalyptus. Ra Ximhai, 2, 815–846. http://dx.doi.org/10.35197/rx.02.03.
2006.13.rr
Meléndez-Nava, F. (2019). Las sabanas. En A. Cruz-Angón, J. Cruz-Medina, J. Valero-Padilla, F. P. Rodríguez-Reynaga, E. D. Melgarejo, E. E. Mata-Zayas et al. (Eds.), La biodiversidad en Tabasco. Estudio de Estado. Vol. II (pp. 133–136). Ciudad de México: Conabio.
Moreno, C. E. (2001). Métodos para medir biodiversidad. M&T-Manuales y Tesis SEA. Zaragoza, España.
Moreno, C. E., Barragán, F., Pineda, E. y Pavón, N. P. (2011). Reanálisis de la diversidad alfa: alternativas para interpretar y comparar información sobre comunidades ecológicas. Revista Mexicana de Biodiversidad, 82, 1249–1261. https://doi.org/10.22201/ib.20078706e.2011.4.745
Mostacedo, B. y Fredericksen, T. S. (2000). Manual de métodos básicos de muestreo y análisis en ecología vegetal. Santa Cruz, Bolivia: El País.
Myers, R. H. y Montgomery, D. C. (1997). A tutorial on generalized linear models. Journal of Quality Technology, 29, 274–291. https://doi.org/10.1080/00224065.1997.11979769
Myers, R. H., Montgomery, D. C., Vining, G. G. y Robinson, T. J. (2010). Generalized linear models: with applications in engineering and the sciences. New Jersey: John Wiley & Sons.
Nájera, A. y Simonetti, J. A. (2010). Enhancing avifauna in commercial plantations. Conservation Biology, 24, 319–324. https://doi.org/10.1111/j.1523-1739.2009.01350.x
Nájera-Coronado, M. (2015). La nueva planta forestal industrial de Huimanguillo, Tabasco y sus posibles repercusiones ambientales, económicas y sociales en la región. Villahermosa, Tabasco: SEP.
Navarro-Sigüenza, A. G., Rebón-Gallardo, M. F., Gordillo-Martínez, A., Peterson, A. T., Berlanga-García, H. y Sánchez-González, L. A. (2014). Biodiversidad de aves de México. Revista Mexicana de Biodiversidad, 85, 476–495. https://doi.org/10.7550/rmb.41882
Olden, J. D. (2006). Biotic homogenization: a new research agenda for conservation biogeography. Journal of Biogeography, 33, 2027–2039. https://doi.org/10.1111/j.1365-2699.2006.01572.x
Ollinaho, O. I. y Kröger, M. (2021). Agroforestry transitions: The good, the bad and the ugly. Journal of Rural Studies, 82, 210–221. https://doi.org/10.1016/j.jrurstud.2021.01.016
Palma-López, D. J., Vázquez-Navarrete, C. J., Mata-Zayas, E. E., López-Castañeda, A., Morales-Garduza, M. A., Chablé-Pascual, R. et al. (2011). Zonificación de ecosistemas y agroecosistemas susceptibles de recibir pagos por servicios ambientales en la Chontalpa, Tabasco. Villahermosa, Tabasco: Colegio de Postgraduados/ Sernapam/ Pemex.
Peh, K. S. H., Sodhi, N. J., de Jong, J., Şekercioğlu, C. H., Yap, C. A. M. y Lim, S. M. H. (2006). Conservation value of degraded habitats for forest birds in southern Peninsular Malaysia. Diversity and Distributions, 12, 572–581. https://doi.org/10.1111/j.1366-9516.2006.00257.x
Phifer, C. C., Knowlton, J. L., Webster, C. R., Flaspohler, D. J. y Licata, J. A. (2016). Bird community responses to afforested eucalyptus plantations in the Argentine pampas. Biodiversity and Conservation, 26, 3073–3101. https://doi.org/10.1007/s10531-016-1126-6
Prabowo, W. E., Darras, K., Clough, Y., Toledo-Hernandez, M., Arlettaz, R., Mulyani, Y. A. et al. (2016). Bird responses to lowland rainforest conversion in Sumatran smallholder landscapes, Indonesia. Plos One, 11, e0154876. https://doi.org/10.1371/journal.pone.0154876
Proenҫa, V. M., Pereira, H. M., Guilherme, J. y Vicente, L. (2010). Plant and bird diversity in natural forests and in native and exotic plantations in NW Portugal. Acta Ecológica, 36, 219–226. https://doi.org/10.1016/j.actao.2010.01.002
R Core Team. (2018). R: A language and environment for statistical computing. R Foundation for Statistical Computing. Vienna, Austria.
Ralph, C. J., Geupel, G. R., Pyle, P., Martin, T. E., DeSante, D. F. y Milá, B. (1996). Manual de métodos de campo para el monitoreo de aves terrestres. Gen. Tech. Rep. PSW-GTR-159. Albany, CA: U.S.D.A./ Pacific Southwest Research Station, Forest Service.
Rojo-Martínez, G. E., Martínez-Ruíz, R. y Mata, J. J. (2011). El cultivo del hule en México. México: UAIM/ Colegio de Postgraduados.
Rzedowski, J. (2006). Vegetación de México. México D.F.: Conabio.
Sáenz, J. C., Villatoro, F., Ibrahim, M., Fajardo, D. y Pérez, M. (2006). Relación entre las comunidades de aves y la vegetación en agropaisajes dominados por la ganadería en Costa Rica, Nicaragua y Colombia. Agroforestería en las Américas, 45, 37–48.
Şekercioğlu, C. H. (2006). Increasing awareness of avian ecological function. Trends in Ecology and Evolution, 21, 464–471. https://doi.org/10.1016/j.tree.2006.05.007
Şekercioğlu, C. H. (2012). Bird functional diversity and ecosystem services in tropical forests, agroforests and agricultural areas. Journal of Ornithology, 153, 153–161. https://doi.org/10.1007/s10336-012-0869-4
Sernapam (2015). Programa Estatal de Ordenamiento Ecológico 2013-2018. Tabasco: Gobierno del Estado de Tabasco/ Sernapam.
Sheldon, F. H., Styring, A. y Hosner, P. A. (2010). Bird species richness in a Bornean exotic tree plantation: a long-term perspective. Biological Conservation, 143, 399–407. https://doi.org/10.1016/j.biocon.2009.11.004
Sreekar, R., Huang, G., Yasuda, M., Quan, R. Q., Goodale, E., Corlett, R. T. et al. (2016). Effects of forests, roads and mistletoe on bird diversity in monoculture rubber plantations. Scientific Reports, 6, 21822. https://doi.org/10.1038/srep21822
St. Pierre, J. I. y Kovalenko, K. E. (2014). Effect of habitat complexity attributes on species richness. Ecosphere, 5, 22. https://doi.org/10.1890/ES13-00323.1
Tanalgo, K. C., Pineda, J. A. F., Agravante, M. E. y Amerol, Z. M. (2015). Bird diversity and structure in different land-use type in lowland South-Central Mindanao, Philippines. Tropical Life Sciences Research, 26, 85–103. https://doi.org/10.5281/zenodo.8187007
Torquebiau, E. F. (2000). A renewed perspective on agroforestry concepts and classification. Comptes Rendus de l’Académie des Sciences – Series III – Sciences de la Vie, 323, 1009–1017. https://doi.org/10.1016/S0764-4469(00)01239-7
Tuomisto, H. (2012). An updated consumer’s guide to evenness and related indices. Oikos, 121, 1203–1218. https://doi.org/10.1111/j.1600-0706.2011.19897.x
Van der Wal, H., Peña-Álvarez, B., Arriaga-Weiss, S. L. y Hernández-Daumás, S. (2012). Species, functional groups, and habitat preferences of birds in five agroforestry classes
in Tabasco, Mexico. The Wilson Journal of Ornithology, 124, 558–571. https://doi.org/10.1676/10-111.1
Warren-Thomas, E., Dolman, P. M. y Edwards, D. P. (2015). Increasing demand for natural rubber necessitates a robust sustainability initiative to mitigate impacts on Neotropical Biodiversity. Conservation Letters, 8, 230–241. https://doi.org/10.1111/conl.12170
Wilman, H., Belmaker, J., Simpson, J., de la Rosa, C., Rivadeneira, M. M. y Jetz, W. (2016). EltonTraits 1.0: Species level foraging attributes of the world’s birds and mammals. Ecological Archives, E095–178. https://doi.org/10.6084/m9.figshare.c.3306933.v1
Xeno-canto (2019). Fundación Xeno-canto; Naturalis Biodiversity Center. Última consulta el 06 julio, 2021 de: https://xeno-canto.org/explore/taxonomy?grp=birds
Zavala-Cruz, J. (2019). Uso del suelo. En A. Cruz-Angón, J. Cruz-Medina, J. Valero-Padilla, F. P. Rodríguez-Reynaga, E. D. Melgarejo, E. E. Mata-Zayas et al. (Eds.), La biodiversidad en Tabasco. Estudio de Estado. Vol. I (pp. 77–82). Ciudad de México: Conabio.
Zar, J. H. (2014). Biostatistical analysis. Edinburgh Gate, Harlow: Pearson Education Limited.
Zhang, J. Q., Corlett, R. T. y Zhai, D. (2019). After the rubber boom: good news and bad news for biodiversity in Xishuangbanna, Yunnan, China. Regional Environmental Change, 19, 1713–1724. https://doi.org/10.1007/s10113-019-01509-4