Carlos Ramírez a, Rafael Barba b, Juan Manuel Caspeta c, Fernando Córdova d, Héctor Espinosa e, Santiago Larre e, Edgar F. Mendoza-Franco f, Norman Mercado-Silva d, Eric Moreno g, Edna Naranjo-García h, Néstor Rosales-Quintero d, Guillermo Salgado-Maldonado i, José Luis Villalobos g, Xochitl G. Vital h y Fernando Álvarez g, *
a Universidad Autónoma de Nuevo León, Facultad de Medicina Veterinaria y Zootecnia, Campus de Ciencias Agropecuarias, Av. Francisco Villa s/n, Ex Hacienda el Canadá, 66054 Ciudad General Escobedo, Nuevo León, México
b Universidad Nacional Autónoma de México, Instituto de Biología, Colección Nacional de Insectos, Tercer Circuito, Ciudad Universitaria, Coyoacán, 04510 Ciudad de México, México
c Universidad Autónoma del Estado de Morelos, Facultad de Ciencias Biológicas y Centro de Investigaciones Biológicas, Laboratorio de Parasitología de Animales Silvestres, Av. Universidad Núm. 1001, Col. Chamilpa, 62209 Cuernavaca, Morelos, México
d Universidad Autónoma del Estado de Morelos, Centro de Investigación en Biodiversidad y Conservación, Av. Universidad Núm. 1001, Col. Chamilpa, 62209 Cuernavaca, Morelos, México
e Universidad Nacional Autónoma de México, Instituto de Biología, Colección Nacional de Peces, Tercer Circuito, Ciudad Universitaria, Coyoacán, 04510 Ciudad de México, México
f Universidad Autónoma de Campeche, Instituto de Ecología, Pesquerías y Oceanografía del Golfo de México, Avenida Héroe de Nacozari Núm. 480, 24029 San Francisco de Campeche, Campeche, México
g Universidad Nacional Autónoma de México, Instituto de Biología, Colección Nacional de Crustáceos, Tercer Circuito, Ciudad Universitaria, Coyoacán, 04510 Ciudad de México, México
h Universidad Nacional Autónoma de México, Instituto de Biología, Colección Nacional de Moluscos, Tercer Circuito, Ciudad Universitaria, Coyoacán, 04510 Ciudad de México, México
i Universidad Nacional Autónoma de México, Instituto de Biología, Colección Nacional de Helmintos, Tercer Circuito, Ciudad Universitaria, Coyoacán, 04510 Ciudad de México, México
*Autor para correspondencia: falvarez@ib.unam.mx (F. Álvarez)
Recibido: 8 noviembre 2021; aceptado: 25 enero 2022
Resumen
Se presenta un listado de especies acuáticas de 6 phyla (Platyhelminthes, Acanthocephala, Nematoda, Arthropoda, Mollusca, Chordata) muestreadas en la cuenca del río Lacantún, en la región conocida como “Selva Lacandona”, Chiapas, México. El listado representa 10 años de monitoreo (2010-2020) realizado en 13 estaciones permanentes ubicadas en una sección de 74 km del río Lacantún. Se registraron 236 especies, 220 (93.2%) nativas, 25 (10.6%) endémicas de la región y 16 (6.8%) introducidas. El número de especies por estación varió de 41 en el río Lacanjá a 112 en el río Tzendales. Se presentan 23 nuevos registros distribucionales y 123 nuevos registros de hospederos para platelmintos, acantocéfalos y nemátodos. El análisis del estatus de conservación muestra que la gran mayoría de las especies registradas carece de una evaluación. El incremento de especies registradas a través del tiempo muestra la importancia de los estudios de largo plazo. A pesar del deterioro de los ecosistemas acuáticos debido a altas tasas de deforestación en la región de Marqués de Comillas, la contaminación provocada por sistemas de producción agropecuarios no sustentables y la introducción de especies acuáticas invasoras, la mayor parte de las especies acuáticas estudiadas se ha mantenido en una condición saludable.
Palabras clave: Catálogo de especies; Lótico; Conservación; Selva Lacandona; Reserva de la Biosfera Montes Azules
© 2022 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Aquatic biota of the middle basin of the Lacantún River, Chiapas and the importance of long-term monitoring
Abstract
A list of aquatic species belonging to 6 phyla (Platyhelminthes, Acanthocephala, Nematoda, Arthropoda, Mollusca, Chordata) sampled in the basin of the Lacantún River, in the region known as “Selva Lacandona”, Chiapas, Mexico, is presented. The list represents a 10-year sampling program (2010-2020) conducted over a network of 13 permanent stations which covered a 74 km river section in the Lacantún River. A total of 236 species was registered, 220 (93.2%) are native, 25 (10.6%) endemic to the region and 16 (6.8%) introduced. The number of species per sampling station ranged from 41 in the Lacanjá River to 112 in the Lacantún River. Twenty-three new distribution records and 123 new host records for platyhelminths, acanthocephalans and nematodes are presented. The conservation status analysis shows that most of the recorded species lack a first assessment. The increment in the number of species recorded through time shows the importance of long-term studies. Despite the degradation of the aquatic ecosystems due to high deforestation rates in the Marqués de Comillas region, the pollution produced by the non-sustainable agricultural systems, and the introduction of invasive aquatic species, most of the studied aquatic species have maintained a healthy condition.
Keywords: Species catalogue; Lotic; Conservation; Lacandona Rainforest; Montes Azules Biosphere Reserve
© 2022 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
El registro de una especie en un lugar específico en un momento dado es la unidad de información esencial sobre la cual se construyen los inventarios de especies. La compilación de registros de especies ha servido para conocer la riqueza de diversas áreas geográficas o ecosistemas (Álvarez y Ojeda, 2019a; Villaseñor, 2016). Son la herramienta principal sobre la cual se basan otros estudios sobre la regionalización de la biota y el funcionamiento de la comunidad (Martínez-Meyer et al., 2014; Morrone, 2019). Así mismo, en ellos se ha basado la designación de áreas de conservación, permitiendo identificar “hotspots” de biodiversidad, además de clasificar grandes regiones geográficas (e.g., Mittermeier et al., 1997). Por otra parte, los inventarios bióticos que se realizan sistemáticamente a través del tiempo son ahora herramientas fundamentales para monitorear cambios en los patrones de distribución de las especies a diversas escalas espacio-temporales (Carabias et al., 2015; González-Contreras et al., 2015). Sin inventarios bióticos no se podrían calcular tasas de deterioro o de recuperación y sería muy difícil detectar especies introducidas y entender su impacto en las comunidades nativas. Desde la década de 1980, se ha formalizado el monitoreo de largo plazo de comunidades o ecosistemas para detectar cambios que no son perceptibles, por ejemplo, en estudios de corto plazo con duraciones de meses o de un año (Gosz, 1996). Existen cambios naturales o provocados por el hombre que pueden tardar en ocurrir o volverse apreciables en periodos de lustros o décadas (Alcocer-Durand y Bernal-Brooks, 2009) y el registro de la mayoría de las especies de un ecosistema también puede tardar varios años en conseguirse. De igual manera, existen procesos ecológicos cuya fenología es de tan larga duración que se requiere de una serie larga de observaciones en el tiempo para lograr su detección y estudio (Vander-Zanden y Vadeboncoeur, 2020).
Los inventarios bióticos deben estar respaldados por ejemplares de referencia depositados en colecciones biológicas reconocidas y deben estar consultables para realmente incidir en el manejo de las áreas naturales. De esta forma, es posible confirmar la identidad de las especies o bien rectificarla, hacer seguimientos en tallas promedio, épocas de reproducción y fecundidad, o en la aparición de nuevas enfermedades (Basanta et al., 2021; Krabbenhoft et al., 2014; Ortega et al., 2016). Los inventarios bióticos y los programas de monitoreo son conjuntos de registros que van describiendo los cambios en los ecosistemas y son la herramienta básica para determinar qué áreas contienen una mayor proporción del total de especies de la región.
Desde el 2005, Natura y Ecosistemas Mexicanos, S.C. (de aquí en adelante “Natura”) ha promovido la operación del “Programa de monitoreo de los ambientes acuáticos de la Selva Lacandona” para determinar el grado de deterioro y/o conservación que presentan la estructura y funcionamiento de los ecosistemas acuáticos que se localizan en esta importante región ecológica del país. La mayor parte del territorio que ocupa la Selva Lacandona se localiza en la cuenca media del río Usumacinta, una zona que por su intrincada geología, fisiografía y edafología alberga la mayor diversidad de especies terrestres y acuáticas del país (Carabias et al., 2015). El principal río que atraviesa la Selva Lacandona es el Lacantún, que se origina en la confluencia de los ríos Jataté y Santo Domingo, y tiene una escorrentía anual promedio de 696.8 m3/seg, con variaciones que fluctúan entre 138.6 y 1,325.5 m3/seg (Núñez y Meli, 2015). En la subcuenca del río Lacantún existen ríos y arroyos que, en su mayor parte, presentan un buen estado de conservación con una de las ictiofaunas de agua dulce mejor conservadas del país, además de especies acuáticas emblemáticas como la nutria de río (Lontra longicaudis), el cocodrilo (Crocodylus moreletii) y la tortuga blanca (Dermatemis mawii) (Ramírez-Martínez et al., 2015), aunque existen algunos otros con diferentes niveles de degradación. En su trayecto, el río Lacantún limita en su margen derecho con la región de Marqués de Comillas, una zona que se encuentra ocupada principalmente por población indígena tzeltal proveniente de los Altos de Chiapas y campesinos que migraron en la década de 1970 desde varios estados, principalmente Oaxaca, Guerrero, Michoacán y Veracruz, y en su margen izquierdo el río limita con la Reserva de la Biosfera de Montes Azules (RBMA), el área natural protegida con mayor extensión de la Selva Lacandona, la cual constituye el macizo de selva tropical mejor conservado, no solo de México sino de Mesoamérica, que es considerado un “hotspot” por la enorme biodiversidad que la habita. Debido a esta particular conformación ecológica y social que se presenta en la región, en el 2008 Natura impulsó el “Programa de monitoreo de los ambientes acuáticos de la Selva Lacandona” con el objetivo de describir la riqueza biológica que habita en el río Lacantún y sus tributarios. El resultado es una forma de evaluar el grado de conservación o deterioro, que permite emitir alertas tempranas en caso de que se detecten situaciones de alteración en la estructura y el funcionamiento de este tipo de ecosistema, y también es conducente a elaborar estrategias de implementación rápida que sean capaces de revertir las alteraciones identificadas.
El programa de monitoreo se encuentra integrado por 2 componentes principales: la determinación del grado de deterioro y la conservación de los ambientes acuáticos estudiados a través del estudio de bioindicadores (peces, helmintos parásitos de peces, moluscos acuáticos y crustáceos), y la realización de evaluaciones periódicas de calidad del agua para determinar la presencia y evolución de contaminates en los ecosistemas acuáticos estudiados (Álvarez-Porebsky et al., 2015; Ramírez-Martínez et al., 2015).
Dentro del programa de muestreo se incluyeron ríos y arroyos tributarios del cauce principal del Lacantún ubicados en la zona limítrofe sur de la RBMA, desde el sitio conocido como el Cañón del Colorado hasta la desembocadura del río Lacanjá, en donde se establecieron 13 estaciones de monitoreo, 7 localizadas dentro de la RBMA y 6 en las comunidades de López Mateos, Galacia, Playón de la Gloria y Boca de Chajul en el municipio Marqués de Comillas y Loma Bonita, Trece de Septiembre e Ixcán en el municipio Maravillas Tenejapa, en Chiapas.
El inicio del programa de monitoreo incluyó la realización periódica de muestreos de calidad del agua y el monitoreo de las poblaciones de moluscos acuáticos, al que se le fueron agregando el resto de los grupos biológicos estudiados conforme se incorporaron especialistas de distintas instituciones de investigación al grupo de trabajo. De esta manera, actualmente se cuenta con más de 10 años de muestreos en la red de estaciones de monitoreo establecidas en el río Lacantún y sus tributarios. En el presente estudio se describe el listado de especies acuáticas de 6 phyla a partir del cual se analiza la diversidad, distribución y permanencia de las especies como un índice de cambio o deterioro del ecosistema acuático.
La información generada durante este proyecto ha servido para describir 7 nuevas especies (Caspeta-Mandujano et al., 2021; Mendoza-Franco et al., 2013, 2018, 2019; Mendoza-Franco, Caspeta-Mandujano et al., 2015; Mendoza-Franco, Tapia et al., 2015), se han dirigido 10 tesis de licenciatura y posgrado, se han publicado 18 artículos y capítulos de libro, y 3 libros (Carabias et al., 2015; Espinosa-Pérez et al., 2019; Salgado-Maldonado et al., 2014). Sin embargo, hasta ahora no se tenía el listado completo de las especies acuáticas registradas. Cabe aclarar que los resultados sobre insectos acuáticos han sido tratados aparte en otras publicaciones (Castillo et al., 2018; Ramírez-Martínez et al., 2015).
Materiales y métodos
Durante el periodo 2010-2020 se realizaron más de 40 campañas en las que participaron investigadores, técnicos y estudiantes de licenciatura y posgrado, de 5 instituciones nacionales de educación superior e investigación, llevando a cabo la colecta, procesamiento e identificación taxonómica de todos los grupos biológicos estudiados.
La red de estaciones se estableció para tener representados: 1) sitios en el cauce principal del río Lacantún (5): río Ixcán, río Chajul, río Lacantún, río Tzendales y río Lacanjá; 2) arroyos y cuerpos de agua considerados como conservados dentro de la RBMA (4): arroyo San Pablo, arroyo José, arroyo Miranda y Humedal Lacanjá; 3) cuerpos de agua en la parte perturbada de la zona de estudio (4): arroyo Puerto Rico, arroyo Lagarto, arroyo Danta y arroyo Manzanares (tabla 1; fig. 1). En cada estación se realizaron colectas con diversos artes de pesca: chinchorro, equipo de electropesca, red de cuchara, tamices y colecta manual (Ramírez-Martínez et al., 2015). Se colectaron ejemplares de especies que no se pueden identificar en campo, que sirvieron para realizar disecciones en busca de helmintos parásitos o para toma de muestras de ADN (Caspeta-Mandujano et al., 2021); sin embargo, la gran mayoría de los organismos fueron identificados, contabilizados y liberados en el sitio de la colecta. Las muestras que se tomaron fueron conservadas de acuerdo con el protocolo apropiado para cada grupo de organismos (Ramírez-Martínez et al., 2015).
Todos los registros presentados corresponden a ejemplares depositados en colecciones biológicas reconocidas como sigue: CNHE, Colección Nacional de Helmintos; CNCR, Colección Nacional de Crustáceos; CNMO, Colección Nacional de Moluscos; y CNPE, Colección Nacional de Peces, todas pertenecientes al Instituto de Biología, Universidad Nacional Autónoma de México (UNAM) y BMNH, British Museum Natural History, en Londres, Reino Unido.
En el listado se incluyeron registros históricos que corresponden al área de estudio sin una localidad específica (10), estos registros se consideraron importantes por tratarse de colectas con más de 50 años y un registro reciente de colector anónimo, también dentro del área de estudio. Algunos organismos no se identificaron a nivel de especie y se reportan como “sp.” porque representan especies nuevas que se describirán en otros trabajos.
La curva acumulativa de especies se construyó tomando en cuenta como base los registros de moluscos de la CNMO. Sobre estos datos se añadieron registros de helmintos que se compilaron en varias publicaciones (Salgado-Maldonado, Caspeta-Mandujano, Moravec, Soto-Galera, Cabañas-Carranza et al., 2011; Salgado-Maldonado, Caspeta-Mandujano, Moravec, Soto-Galera, Rodiles-Hernández 2011; Salgado-Maldonado et al., 2014) y de peces (Espinosa-Pérez et al., 2019) y por último los registros derivados de este estudio de crustáceos y vertebrados.
Para cada especie del listado se revisó el patrón de distribución y su estatus de conservación, basándonos en la NOM-059-SEMARNAT-2010 actualizada en 2020 y en las evaluaciones disponibles de la UICN. Se considera a una especie nativa a aquella cuyo intervalo de distribución original comprende la cuenca del río Usumacinta; endémica, a aquella cuya área total de distribución se encuentra dentro de la cuenca media del río Lacantún o dentro del área de influencia de la RBMA. Las especies introducidas fueron aquellas cuyo intervalo de distribución geográfica original no abarcaba la cuenca media del río Lacantún.

Tabla 1
Localidades de muestreo en la cuenca media del río Lacantún: número de la estación, nombre la localidad, abreviatura, latitud N, longitud O y altitud en metros.
|
Estación |
Localidad |
Abrev. |
Latitud |
Longitud |
Altitud |
|
1 |
Río Ixcán |
IXC |
16.09314 |
-91.09199 |
173 |
|
2 |
Arroyo Puerto Rico |
PRC |
16.0795 |
-91.02090 |
167 |
|
3 |
Arroyo San Pablo |
SPB |
16.10301 |
-91.01468 |
161 |
|
4 |
Río Chajul |
CHJ |
16.09716 |
-90.95490 |
160 |
|
5 |
Río Lacantún |
LCT |
16.11041 |
-90.93975 |
159 |
|
6 |
Arroyo José |
JOS |
16.11606 |
-90.94008 |
157 |
|
7 |
Arroyo Miranda |
MIR |
16.13809 |
-90.92199 |
152 |
|
8 |
Arroyo Lagarto |
LAG |
16.12604 |
-90.90988 |
149 |
|
9 |
Arroyo Danta |
DNT |
16.15138 |
-90.89664 |
146 |
|
10 |
Arroyo Manzanares |
MNZ |
16.17085 |
-90.84375 |
138 |
|
11 |
Río Tzendales |
TZE |
16.29437 |
-90.88598 |
137 |
|
12 |
Río Lacanjá |
LCJ |
16.40726 |
-90.78357 |
134 |
|
13 |
Humedal Lacanjá |
HUM |
16.41002 |
-90.78046 |
129 |
Resultados
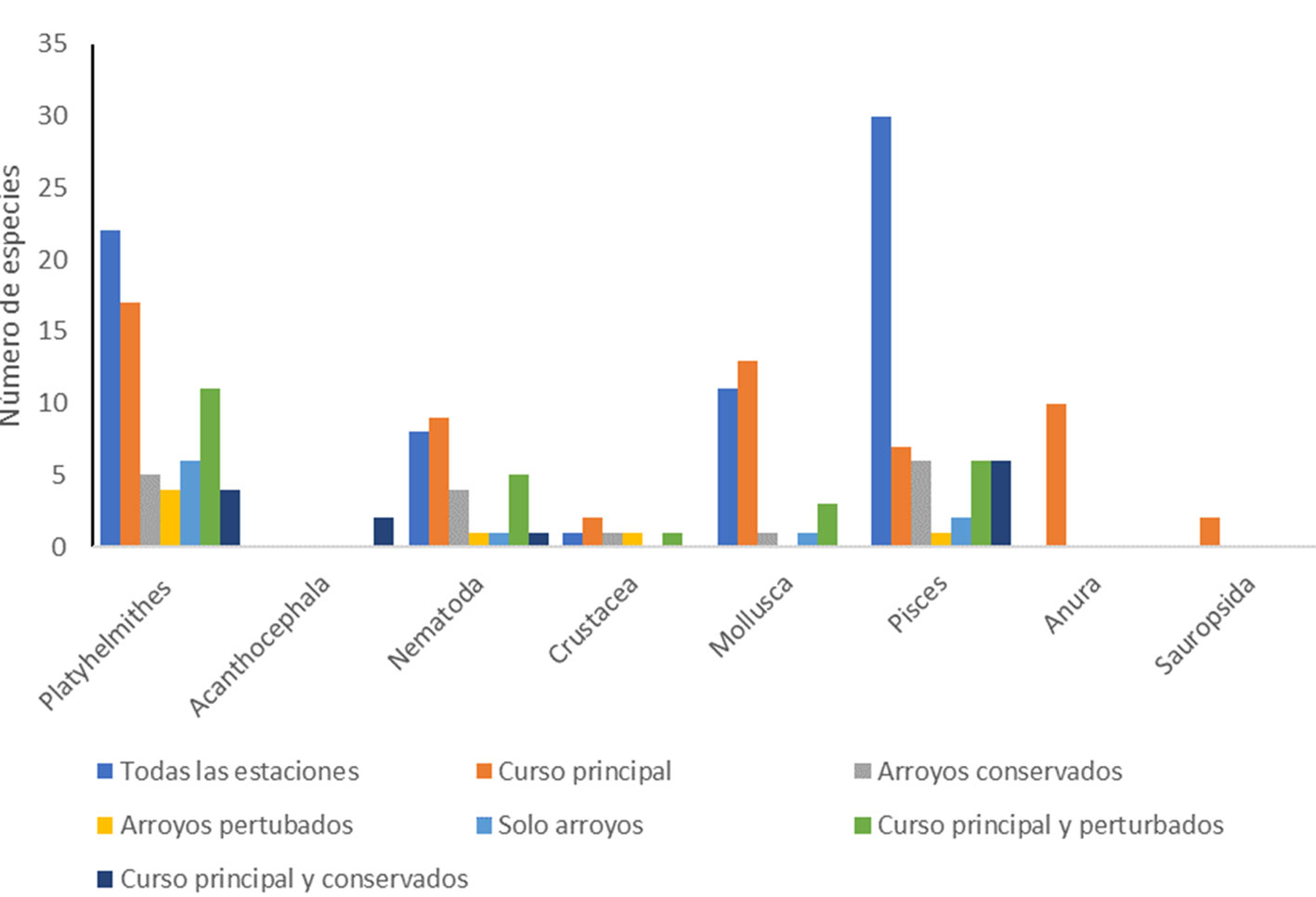
Se reportan 236 especies de 6 phyla, agrupadas en 10 clases, 27 órdenes, 79 familias y 164 géneros (tabla 2, apéndice). Del total de especies, 220 (93.2%) son nativas, 25 (10.6%) son endémicas de la región y 16 (6.8%) son introducidas. En total se presentan 919 registros en las 13 estaciones de muestreo que se componen, en orden decreciente, en: 38.8% Pisces, 30.9% Platyhelminthes, 13.6% Mollusca, 11.7% Nematoda, 2.2% Crustacea, 1.7% Anura, 0.6% Acanthocephala y 0.2% Sauropsida.
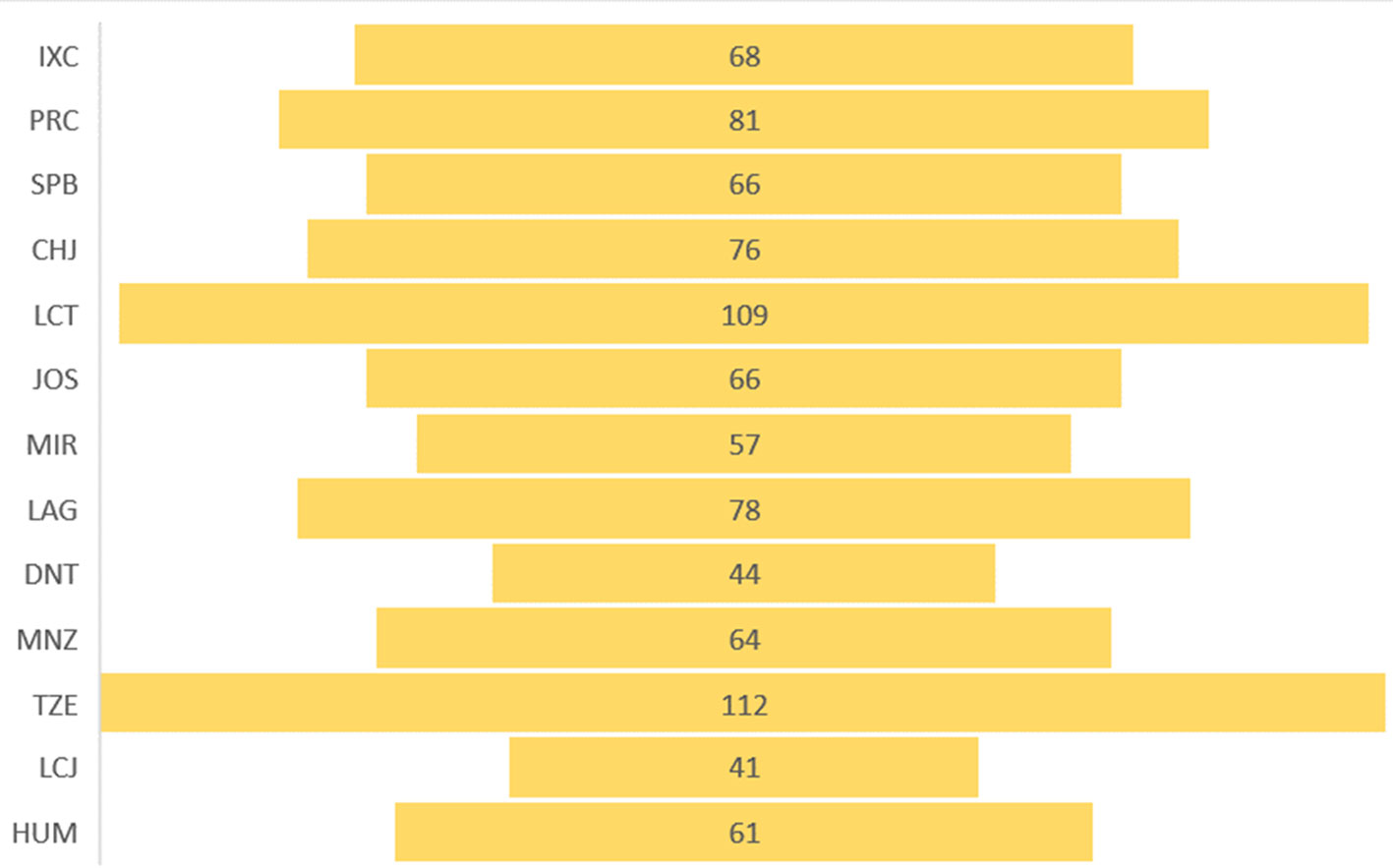
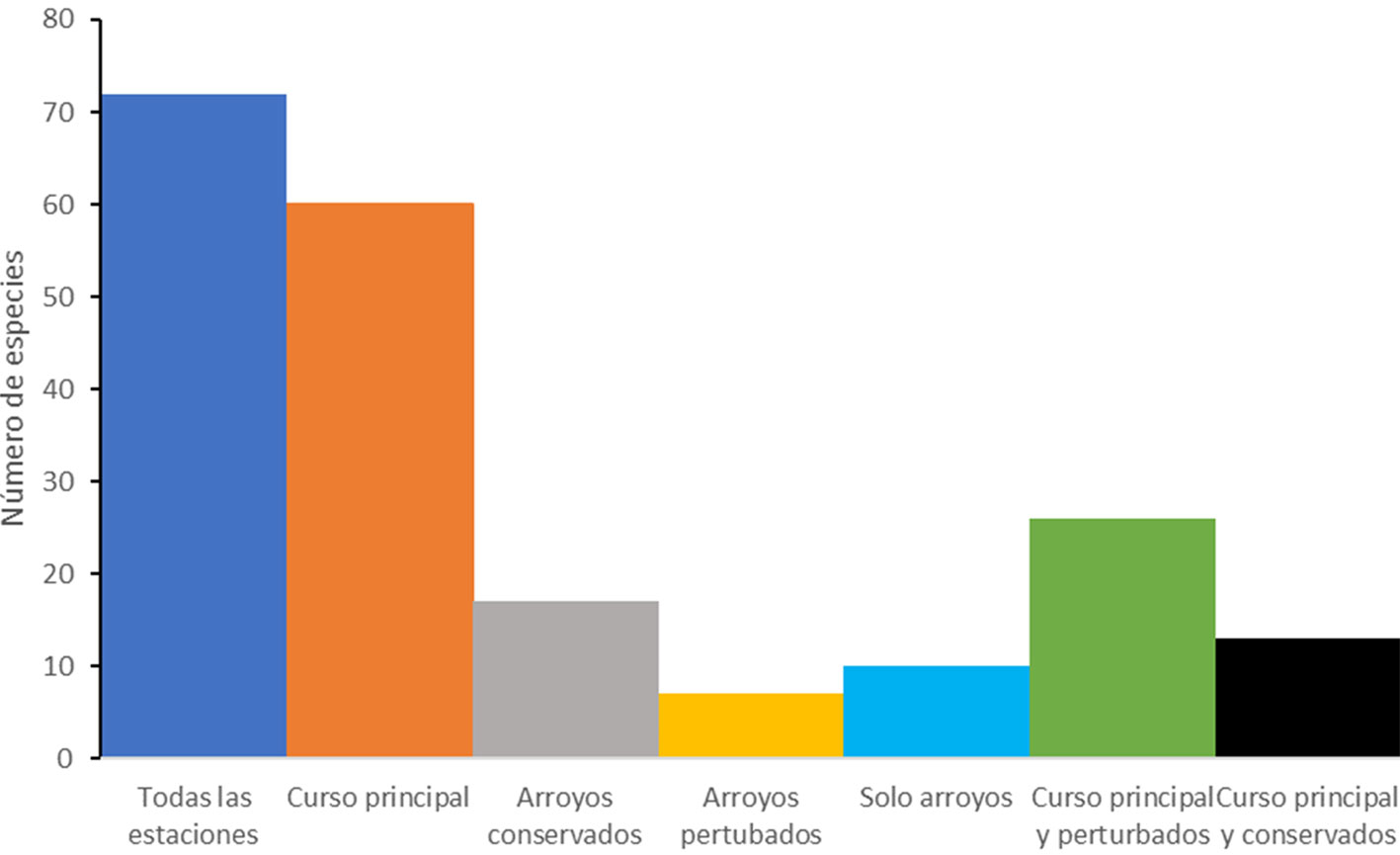
El promedio de especies registrado por localidad a lo largo de todo el programa de muestreo fue de 70.7, con un intervalo de 41 en el río Lacanjá a 112 en el río Tzendales (fig. 2). La mayoría de las especies (72) tuvieron una distribución que abarcó tanto el curso principal del Lacantún como los arroyos conservados y los perturbados. El segundo grupo más grande (60) se registró únicamente en el cauce principal del río Lacantún. El resto de las especies se encontró mostrando diversos patrones dependiendo del grupo (fig. 3), pero con más especies solamente en arroyos conservados (17) o compartiendo el cauce principal del Lacantún con arroyos perturbados (26) (fig. 4). Como era de esperarse, estos resultados muestran que debe considerarse tanto el cauce principal del Lacantún, como sus ríos y arroyos tributarios.
La curva acumulativa de especies muestra varios elementos importantes (fig. 5). El primero es que las prospecciones iniciales del río Lacantún que se realizaron del 2004 al 2010, registraron hasta 64 especies de los grupos que aquí se tratan. Durante el desarrollo del presente proyecto se incrementó el número de especies registradas de 118 en 2011 a 167 en 2020, y, finalmente, con la revisión hecha para este estudio se llegó a 236 (fig. 5).
La forma de la curva es difícil de interpretar pues sugiere que el incremento en el registro de especies continuará, aunque debido al alto número al que ya se ha llegado, esto parece poco probable. La compilación y actualización de la diversidad acuática en el área de estudio se ha llevado a cabo en diferentes etapas con diferentes intensidades de muestreo. La última fase del proyecto “biomonitoreo de sistemas acuáticos” se ha enfocado en grupos de especies poco conocidos y en la descripción de hallazgos previos, lo que puede explicar el salto de 167 a 236 especies que aquí se presenta.
Especies endémicas
Helmintos. Se registraron 11 especies endémicas de helmintos, platelmintos más nemátodos, todos parásitos de peces. Este nivel de endemismo no es particularmente alto, porque el río Lacantún alberga una muestra de las especies de helmintos que parasitan a los peces de la cuenca del río Usumacinta (Quiroz-Martínez y Salgado-Maldonado, 2013b; Salgado-Maldonado et al., 2014). Algunas de estas especies pueden señalarse actualmente como endémicas del río Lacantún; sin embargo, con los datos disponibles, estos señalamientos son únicamente tentativos.
Tabla 2
Número de especies, géneros, familias, órdenes y clases registrados por phylum en este estudio en la cuenca media del río Lacantún. Arthropoda incluye solamente crustáceos y Chordata a peces, anfibios y reptiles.
|
Phyla |
Clases |
Órdenes |
Familias |
Géneros |
Especies |
Nativas |
Endémicas |
Introducidas |
|
Platyhelminthes |
3 |
1 |
23 |
57 |
74 |
70 |
7 |
4 |
|
Acanthocephala |
1 |
1 |
1 |
2 |
2 |
2 |
– |
– |
|
Nematoda |
– |
– |
13 |
19 |
33 |
33 |
4 |
– |
|
Arthropoda Crustacea |
1 |
1 |
3 |
4 |
6 |
6 |
4 |
– |
|
Mollusca |
2 |
5 |
8 |
19 |
35 |
32 |
1 |
3 |
|
Chordata Pisces |
1 |
16 |
25 |
54 |
74 |
65 |
9 |
9 |
|
Amphibia |
1 |
1 |
4 |
7 |
10 |
10 |
– |
– |
|
Sauropsida |
1 |
2 |
2 |
2 |
2 |
2 |
– |
– |
|
Total 6 |
10 |
27 |
79 |
164 |
236 |
220 |
25 |
16 |
En general, las especies de helmintos muestran una especificidad hospedatoria que los refiere a la familia de sus hospederos y no a especies particulares de hospederos, de forma que su distribución geográfica se explica con la distribución geográfica de las familias de hospederos (Salgado-Maldonado, 2006, 2008). Por esta razón, el número de endemismos registrado en los helmintos de peces del río Lacantún es bajo. En efecto, las familias de peces que hemos examinado en el Lacantún son las familias de más amplia distribución en Centroamérica, incluyendo a los carácidos, cíclidos, heptaptéridos e incluso poecílidos. Lo cual explica que el registro helmintológico actual de los peces del río Lacantún esté constituído primordialmente por helmintos de amplia distribución en los peces Centroamericanos.
Un caso interesante son los helmintos del gérrido, Eugerres mexicanus (Actinopterygii: Gerreidae), que tiene una distribución restringida a la cuenca media del río Usumacinta, incluyendo el río Lacantún. Su registro helmintológico incluye a los monogéneos Aristocleidus lacantuni y A. mexicanus y al nemátodo Rhabdochona juliacarabiasi, y posiblemente exhibirán una distribución geográfica en concordancia con la distribución de su hospedero, limitada a la cuenca media del río Usumacinta, incluyendo el Lacantún. De la misma manera, la fauna de monogéneos reconocida en el agujón maya Strongylura hubbsi, incluyendo Ancyrocephalus chiapanensis y Paracolpenteron hubbsiensis, puede ser considerada endémica del Usumacinta, de acuerdo con la distribución geográfica restingida del hospedero.

El nemátodo Spinitectus tabascoensis parásito de ictalúridos, solo ha sido registrado en poblaciones de peces de esta familia y en cuerpos de agua de la cuenca del Usumacinta, incluyendo el río Lacantún, lo que podría indicar que es endémica de la cuenca del Usumacinta.
La mayoría de los géneros son monotípicos en el área, pero algunos destacan por la diversidad que han alcanzado en los peces del río Lacantún, por ejemplo: Rhabdochona (5 y 1 por identificar), Cucullanus (3 y 3 por identificar), Spinitectus (3) y Procamallanus (3) en los nemátodos, Genarchella (3) en los tremátodos y Cacatuocotyle (3) y Urocleidoides (3) en los monogéneos. La familia de helmintos con mayor número de géneros en los peces del río Lacantún resultó Allocreadiidae (Trematoda) con 5 géneros. A su vez, las familias de peces más ricas en helmintos fueron: Characidae (29), Cichlidae (17), Poeciliidae (12) y Heptapteridae (7). Las especies de peces más parasitadas fueron: Astyanax brevimanus (Characidae) con 24 especies de helmintos, Vieja intermedia y V. bifasciata (Cichlidae) con 8 y Rhamdia guatemalensis (Heptapteridae), Eugerres mexicanus (Gerridae) y Atherinella alvarezi (Atherinidae) con 7.
Crustáceos. Dentro de las especies endémicas de crustáceos destacan el langostino Macrobrachium vicconi y los cangrejos Potamocarcinus chajulensis y Odontothelphusa lacanjaensis, que teniendo áreas de distribución muy reducidas, se han encontrado en todos los muestreos realizados. Las 3 especies presentan desarrollo larval abreviado, es decir, de los huevos eclosionan prejuveniles o juveniles que ya no requieren de migraciones para buscar áreas adecuadas para el desarrollo larval, típicamente áreas con aguas salobres. El resultado es que estas especies tienen áreas de distribución reducidas que se mantienen en las mismas zonas a través del tiempo, mostrando así un alto nivel de endemismo (Álvarez y Villalobos, 1998; Román et al., 2000).
Peces. Entre los peces, Lacantunia enigmatica (Lacantuniidae) y Batrachoides goldmani (Batrachoididae), ambas endémicas de las cuencas del Grijalva y el Usumacinta, han sido colectadas ocasionalmente a lo largo de los periodos de muestreo. Potamarius nelsoni y P. usumacintae (Ariidae) son especies cuya presencia en aguas dulces solo se conoce para el río Usumacinta (Betancur y Willink, 2007), también han sido capturadas en los últimos 3 años. Las siguientes especies también registradas en este estudio: Leptophilypnus guatemalensis (Eleotridae), Wajpamheros nourissati (Cichlidae), Maskaheros argenteus (Cichlidae), Kihnichthys ufermanni (Cichlidae), Rheoheros lentiginosus (Cichlidae), Theraps irregularis (Cichlidae) y Xenodexia ctenolepis (Poeciliidae), son mencionadas por Miller et al. (2009) como endémicas o nativas para el sistema Grijalva-Usumacinta.
Anfibios y reptiles. Ninguna de las 12 especies de anfibios y reptiles que se registran en este estudio son endémicas de la región. Dentro de los anuros, la especie con el menor intervalo de distribución, del río Lacantún hasta Honduras, es el sapo Incilius campbelli y dentro de los reptiles son, la tortuga blanca Dermatemys mawii, desde el sur de México a Honduras, y el cocodrilo Crocodylus moreletti, de Tamaulipas, México a Guatemala.
Especies introducidas
Helmintos. La introducción de especies de peces no nativos o la dispersión de éstas a partir de puntos secundarios hacia el río Lacantún ha traído entre otras consecuencias la introducción de helmintos parásitos. En este listado únicamente registramos 4 especies de helmintos introducidas a los peces del río Lacantún, incluyendo los monogéneos Heteropriapulus sp. de los “plecos” o “peces diablo” Pterygoplichthys pardalis y los monogéneos del género Jainus, parásitos en las branquias de Astyanax brevimanus. Se documenta también la presencia de otras 2 especies invasoras de helmintos, las metacercarias de Centrocestus formosanus y el céstodo asiático, Schyzocotyle acheilognathi.
Moluscos. Las especies introducidas de moluscos son 3: los gasterópodos Tarebia granifera y Melanoides tuberculata y el bivalvo Corbicula fluminea, todos de origen asiático (Pace, 1973). De éstas, las más abundantes son T. granifera y C. fluminea, mientras que Melanoides tuberculata es notablemente menos abundante.
Peces. Entre los peces se cuentan 9 especies introducidas. Las tilapias Oreochromis mossambicus, O. niloticus y O. aureus, además del guapote Parachromis managuensis, que arribaron como producto de su utilización en la acuicultura o el acuarismo (Ramírez-Martínez et al., 2015). Las especies de loricáridos Pterygoplichthys disjunctivus, P. pardalis y P. multiradiatus arribaron como producto del acuarismo y las carpas Ctenopharyngodon idella y Cyprinus carpio fueron introducidas para el control de vegetación acuática.
Especies de amplia distribución
Crustáceos. Dentro de los crustáceos se registraron 2 especies de langostinos que son de muy amplia distribución a lo largo de la costa Atlántica de América: Macrobrachium carcinus y M. heterochirus. La primera se distribuye de Florida, EUA, hasta el sur de Brasil, incluyendo las Antillas; mientras que la segunda de Veracruz, México a Sao Paulo, Brasil. Ambas especies pueden penetrar decenas de kilómetros tierra adentro a partir de las desembocaduras de ríos y alcanzar altitudes cerca de los 1,000 m, por lo que su presencia en el río Lacantún no es sorprendente (Mejía-Ortiz y Álvarez, 2010).
Moluscos. Los gasterópodos más ampliamente distribuidos son: Gundlachia radiata, presente desde sur de EUA, América Central, algunas zonas de Las Antillas hasta el norte de Sudamérica (Barbosa-dos Santos, 2003); Pomacea flagellata que se distribuye desde Tamaulipas, México, hasta el sistema hidrológico del río Magdalena, Colombia (Cowie y Thiengo, 2003); Cochliopina francesae, de los Pantanos de Centla, Tabasco, México a Guatemala (Goodrich y van der Schalie, 1937; Ortiz-Lezama et al., 2009; Trinidad-Ocaña et al., 2018); C. infundibulum, de la cuenca baja del Usumacinta en Tabasco, México a la región del Petén, Guatemala (Goodrich y van der Schalie, 1937; Thompson, 2011; von Martens, 1890-1901) y Drepanotrema lucidum, de Pantanos de Centla, Tabasco a Yucatán, Belice, Guatemala y Nicaragua (Bequaert y Clench, 1936; Paraense, 2000; Rangel-Ruiz y Gamboa-Aguilar, 2000; Thompson, 2011). En cuanto a los bivalvos uniónidos: Anodontites cylindracea se distribuye desde San Luis Potosí, Veracruz, Tabasco y Chiapas, México a Guatemala (Graf y Cummings, 2021); Delphinonaias largillierti de Tabasco, Yucatán y Chiapas, México a Belice, Guatemala y Honduras; (Graf y Cummings, 2021); Psoronaias crocodilorum desde Pantanos de Centla, Tabasco a Guatemala (Arévalo-de la Cruz et al., 2015; Graf y Cummings, 2007a, b); P. semigranosa se encuentra desde Texas, EUA, a Tamaulipas, San Luis Potosí, Querétaro, Veracruz, Tabasco, Chiapas y Guatemala (Graf y Cummings, 2021) y Megalonaias nervosa (se encuentra desde Minnesota, EUA a Guatemala (Pfeiffer et al., 2018).
Peces. En el grupo de los peces, destaca la mención de especies que requieren de la conectividad longitudinal del río. Especies como el peje lagarto Atractosteus tropicus (Lepisosteidae) y el sábalo Megalops atlanticus (Megalopidae), relativamente comunes en aguas costeras y las partes bajas del Usumacinta, llegan a ascender estos ríos y se presentan ocasionalmente dentro de la zona de estudio.
Anfibios y reptiles. Dentro de este grupo nuestros resultados muestran a Rhinella marina, el sapo gigante neotropical, distribuido originalmente en Centro y Sudamérica, pero ahora ampliamente introducido a todo el gran Caribe y a islas del Pacífico sur; asimismo, las ranas Agalychnis callidryas (sur de México a Colombia), Dendropsophus ebraccatus y D. microcephalus (de México a Ecuador y a Brasil, respectivamente), Trachycephalus typhonius (de México a Argentina) y Lithobates vaillanti (de México a Ecuador), tienen muy amplias distribuciones.
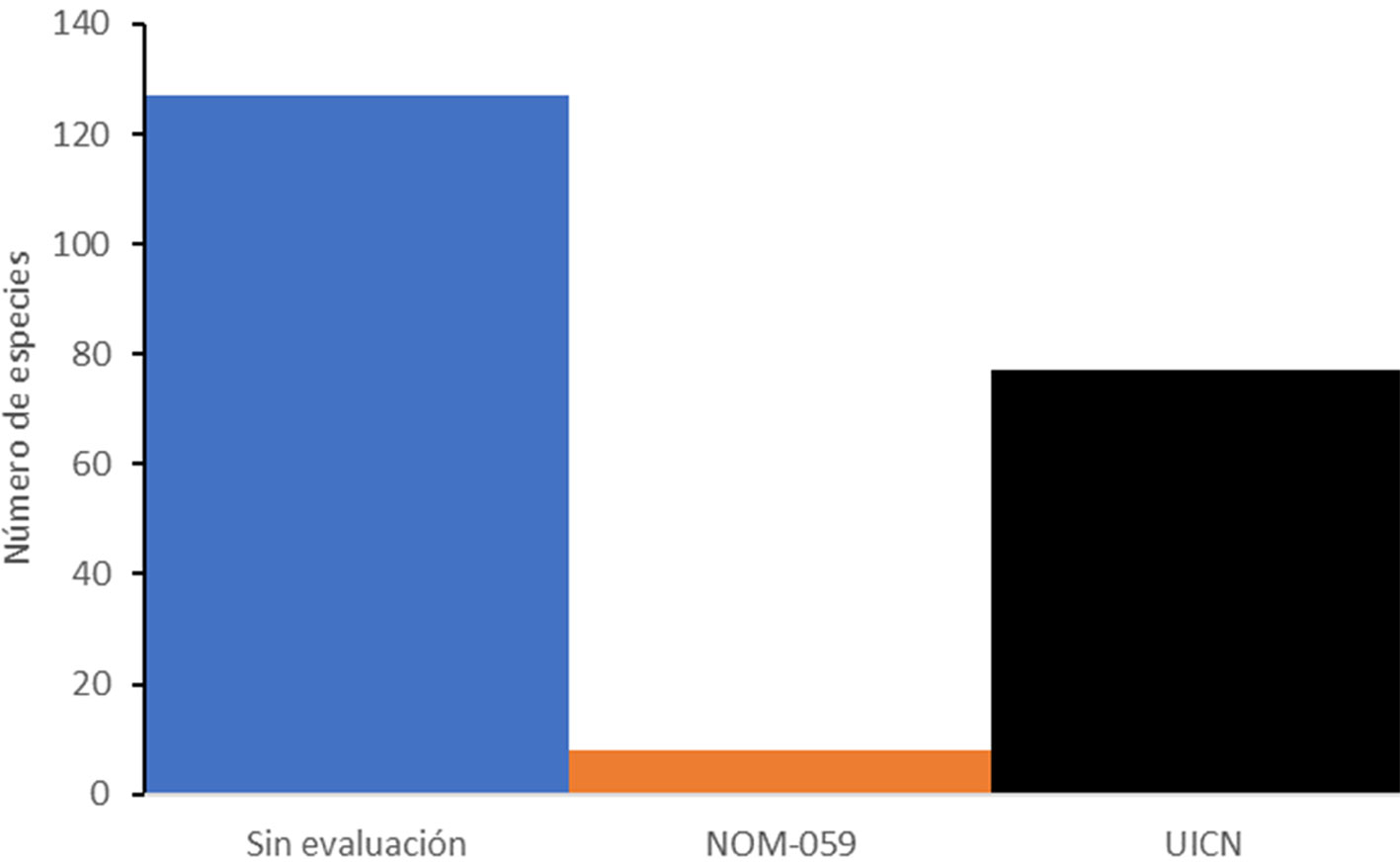
Con respecto al estatus de conservación, se consideraron 129 especies (crustáceos, moluscos, peces, anfibios y reptiles), pues los helmintos no se han tomado en cuenta en las evaluaciones de conservación. De las 129 especies, solamente 8 están en la NOM-059- SEMARNAT-2010. El primero es un molusco, el mejillón Megalonaias nervosa (Lea, 1834), categorizado como en peligro de extinción (como Megalonaias nickliniana (Lea, 1834), ver discusión). También están 4 peces: Lacantunia enigmatica Rodiles-Hernández, Hendrickson y Lundberg, 2005, categorizado como en peligro de extinción; Potamarius nelsoni (Evermann y Goldsborough, 1902), bajo protección especial; Rhamdia guatemalensis (Günther, 1864), bajo protección especial y Thorichthys socolofi (Miller y Taylor, 1984), como especie amenazada. Le sigue la rana Rhinophrynus dorsalis Duméril y Bibron, 1841, bajo protección especial; la tortuga Dermatemys mawii Gray, 1847, en peligro de extinción y el cocodrilo Crocodylus moreletii Duméril y Bibron, 1851, bajo protección especial. En contraste, 77 (60%) de las 127 especies consideradas tienen una evaluación por parte de la UICN. De éstas, 17 se clasifican con datos insuficientes (DD), 57 de menor preocupación (LC), 1 vulnerable (VU): Lacantunia enigmatica y 1 en crítico peligro de extinción (CR): Dermatemys mawii.
Discusión
En varias regiones de México se han llevado a cabo programas de muestreo de largo plazo, algunos que empezaron de manera ocasional y se fueron formalizando y otros que han tenido como objetivo desde el principio el describir los cambios en la biota a través de periodos multianuales. Similares al estudio “Monitoreo de los ambientes acuáticos de la cuenca media del río Lacantún”, que aquí presentamos, están los estudios hechos en Cuatro Ciénegas, Coahuila (Álvarez y Ojeda, 2019b), en la laguna de Alchichica, Puebla (Alcocer, 2019) o en Los Tuxtlas, Veracruz (Reynoso et al., 2017), todas áreas de gran diversidad e importancia. En todos estos estudios destaca que la visión general de la importancia y diversidad real de los ecosistemas solamente puede obtenerse a través de observaciones de largo plazo. Las fluctuaciones naturales de las poblaciones, un reemplazo continuo de especies y la variabilidad en los métodos y esfuerzos de muestreo, impiden que las estimaciones de la diversidad en grandes ecosistemas puedan conseguirse con muestreos ocasionales o con una cobertura temporal corta.
Helmintos. Una alta diversidad de helmintos parásitos refleja un ecosistema bien conservado que mantiene tanto hospederos finales como intermediarios y paraténicos. Los datos aquí aportados confirman que el río Lacantún es un “hotspot” de diversidad de helmintos parásitos de peces dulceacuícolas (Quiroz-Martínez y Salgado-Maldonado, 2013a, b; Salgado-Maldonado et al., 2014). El presente trabajo enlista 107 especies en los peces del río Lacantún, que comparativamente con otras cuencas (Atoyac 9, Ayuquila 15, Lerma 20, Tehuantepec 21, Pánuco 23, Balsas 28, Papaloapan 49, cuerpos de agua de la península de Yucatán 51; Quiroz-Martínez y Salgado-Maldonado, 2013a, b; Salgado-Maldonado, 2006), es la máxima diversidad reconocida en los cuerpos de agua dulce de México, que se explica por la alta diversidad de peces.
Crustáceos. Las especies registradas de crustáceos son las esperadas en el área de estudio (Álvarez et al., 2011). El conjunto de langostinos, endémicos y de amplia distribución, los cangrejos de agua dulce y un acocil, endémicos de la región, son las especies que se esperaría encontrar. Un aspecto relevante es que todas estas especies, salvo los langostinos de amplia distribución, han estado presentes en bajas densidades en todos los muestreos sugiriendo que son poblaciones estables.
Moluscos. Los nuevos registros de gasterópodos para el país son: Aroapyrgus cf. conchensensis, Cochliopina dulcensis, Cochliopina hinkleyi y Pachychilus (Potamanax) sargi. Todas estas especies forman parte de la fauna malacológica de Guatemala. Contrastan los registros de Aroapyrgus pasionensis, Cochliopina hinkleyi y Planorbella trivolvis que se encuentran, hasta ahora, únicamente en el río Tzendales; Psoronaias martensi y P. percompressa solamente se han hallado en el río Lacanjá; mientras que Cochliopina dulcensis, descrita del río Dulce, Guatemala (Marshall, 1920), se encuentra en el arroyo Lagarto, en el río Tzendales y en el río Lacanjá. Por otra parte, el hábitat de las especies del género Cochliopina en los arroyos está restringido a una angosta zona ligeramente arriba de la línea del oleaje (Morrison, 1946); tal patrón lo encontramos de forma notoria en el litoral del río Tzendales. La presencia de Pachychilus sargi con unos cuantos ejemplares en el río Ixcán, es posiblemente un efecto de arrastre o sugiere que habitó el río en otro tiempo, ya que no se encontraron ejemplares vivos ni en concha en ninguna otra estación de muestreo.
La pequeña especie pateliforme Gundlachia radiata se distribuye ampliamente en todas las esteaciones de muestreo, excepto en el río Chajul. Gundlachia radiata habita cuerpos de agua lénticos, con poca corriente, no contaminados, sobre o debajo de hojas en descomposición, o sobre tallos o ramas (Barbosa-dos Santos, 2003). Las familias más diversas en este sistema comprenden a los bivalvos Unionidae (13 spp.) y a los gasterópodos Cochliopidae (7) y Planorbidae (6); a nivel nacional, las familias Cochliopidae y Planorbidae han sido reconocidas como las más diversas (Czaja et al., 2020).
La especie Megalonaias nickliniana (Lea, 1834) se ha categorizado como en peligro de extinción desde 1976 por la Convention on International Trade in Endangered Species (CITES, Appendix 1) y por el United States Fish and Wildlife Service (USFWS). Hasta antes de 2018, se asumía que el género Megalonaias constaba de 2 especies: M. nervosa (Rafinesque, 1820) y M. nickliniana. Pfeiffer et al. (2018) analizaron 40 poblaciones de Megalonaias de Minnesota a Guatemala que mostraron diferencias menores a 1% en el CO1 y el ITS1 no mostró variación. Se concluyó que Megalonaias nickliniana es un sinónimo junior de Megalonaias nervosa. Por tanto, el género es monotípico y esta almeja no se encuentra en riesgo de extinción.
El género Megalonaias es particular dentro de la subfamilia Ambleminae por poseer un ámbito de distribución muy amplio, otros ambleminos poseen ámbitos de distribución restringida y por ser huésped-generalista, ya que sus larvas pueden desarrollarse en varios géneros de peces de varias familias, al contrario de otros ambleminos que utilizan una sola especie o especies emparentadas cercanamente. Además, su larva se puede enquistar en las agallas de los peces y posee una cuerda larvaria, estrategias que comparte con otros linajes de almejas generalistas (Unioninae, Hiriidae) (Pfeiffer et al., 2018).
En México, Megalonaias nervosa (como Megalonaias nickliniana – Unio nicklinianus) ha sido registrada en Tamaulipas y Tabasco; además de otros registros con el rótulo: “México”, con localidades en el río Usumacinta en Guatemala (Graf y Cumming, 2021).
Nuestros resultados muestran que la cuenca media del río Lacantún es un sitio altamente diverso (32 especies), hasta ahora el más diverso de México si se contrasta con la riqueza calculada a nivel de estado de los más diversos, como Tabasco (con 35 especies), San Luis Potosí, Coahuila (ambos con 32 especies) y Veracruz (con 28 species; Czaja et al., 2020). Al comparar el número de moluscos dulceacuícolas habitantes del río Lacantún con la diversidad en otras regiones del mundo, nuestra fauna (32 especies, sin incluir las introducidas) está por debajo de la diversidad del río Tombigee-Alabama, de la cuenca de la bahía de Mobile, EUA, con “110-118” especies, pero por encima del río del bosque de las tierras bajas al oeste de Guinea y la Costa de Marfil que contienen 28 especies (Strong et al., 2008).
Peces. La cuenca del Usumacinta es una de las de mayor diversidad íctica en el país. En su porción mexicana, el Usumacinta alberga 172 especies en un área aproximada de 307,000 km2 (Soria-Barreto et al., 2018). A ello hay que añadir las varias especies que podrían ocurrir en Guatemala y Belice. Además de ser una cuenca rica en especies, existen posibilidades de aumentar la riqueza de la cuenca con base en nuevos estudios taxonómicos y sistemáticos (Soria-Barreto et al., 2018).
Aunque la cuenca del Usumacinta está sometida a fuertes alteraciones producto de la contaminación y el cambio del uso de suelo, es importante destacar que aún no ha sido fuertemente afectada en su porción mexicana por la alteración hidrológica, producto de la construcción de infraestructura hidráulica (e.g., grandes presas). Esto permite la permanencia de flujos relativamente naturales que ayudan a la conectividad longitudinal del ecosistema y posibilita la presencia de taxones marinos con hábitos migratorios, como algunos miembros de las familias Centropomidae, Megalopidae y Mugilidae.
Espinosa-Pérez et al. (2019) registraron 71 especies de peces en el río Lacantún, lo que contrasta con las 78 que aquí se reportan (tabla 2, apéndice). Si consideramos que en México hay unas 505 especies de peces dulceacuícolas (Espinosa-Pérez, 2014), entonces la subcuenca del río Lacantún tiene 15.4% de la diversidad total, dentro de la cual destaca la gran riqueza de Cichlidae y Poeciliidae, las familias más características del a ictiofauna mesoamericana.
Anfibios y reptiles. Se asume que la diversidad de anfibios y reptiles acuáticos en el área es mucho mayor a lo aquí reportado, puesto que las estaciones de muestreo no fueron las ideales para el registro de estos grupos. De igual manera muchas de estas especies pueden utilizar los cuerpos de agua por periodos diferentes y, por lo tanto, puede ser difícil encontrarlos directamente con especies totalmente acuáticas. Ramírez et al. (2015) reportaron 28 especies de ranas para la RBMA, mientras que en nuestro estudio solamente se registraron 12, la mayoría de amplia distribución y sin consideraciones importantes sobre su estado de conservación; asimismo, registraron 7 especies de tortugas, algunas de las cuales se encuentran en pozas o pantanos, que no formaron parte de nuestra red de estaciones. Como resultados de este estudio, destacan la tortuga blanca y el cocodrilo mexicano como 2 especies con áreas de distribución restringidas y que se categorizan como en peligro de extinción la primera y como protegida la segunda.
Especies introducidas
Helmintos. La fauna invasiva de monogéneos en los peces del Lacantún debe ser mayor, puesto que las tilapias africanas y las carpas asiáticas son abundantes en la zona. La introducción de monogéneos de las tilapias a los peces nativos ha sido documentada en otros cuerpos de agua del país, por ejemplo el Lago de Catemaco, Veracruz (Jiménez-García et al., 2001; Salgado-Maldonado y Rubio-Godoy, 2014). La fauna de monogéneos introducidos con las carpas asiáticas en otras partes del mundo es muy diversa, sin embargo, para México no se ha documentado.
Las formas adultas de C. formosanus son parásitos de aves ictiófagas. El único registro de adultos en México es en una garza, Butorides striatus de Morelos (Scholz et al., 2001). Se asume que esta especie invasora procede del Medio Oriente y se ha introducido y dispersado en México junto a su hospedero intermediario, el caracol invasor Melanoides tuberculata (Thiaridae) que es el único hospedero intermediario registrado experimentalmente y en ambientes naturales en México (Scholz et al., 2001). Sin embargo, en el sureste asiático, específicamente en Tailandia, se ha registrado a otro tiárido Tarebia granifera como hospedero intermediario frecuente para esta especie (Dechruksa et al., 2007; Veeravechsukij et al., 2018). De forma que el registro de T. granifera en la cuenca media del río Lacantún en el presente trabajo sugiere que éste pudiera ser otro hospedero intermediario para C. formosanus. Este caracol supera en la amplitud de su distribución y en abundancia en el Lacantún a M. tuberculata. La presencia de estos tiáridos en el río Lacantún explica el registro de las metacercarias de C. formosanus en los peces de estos ambientes. La extensión de la distribución espacial en el Lacantún y abundancia de T. granifera, comparativamente con la de M. tuberculata, sugiere que la presencia de C. formosanus en México, sus rutas de inmigración o introducción y de dispersión, necesitan de mayores datos empíricos para interpretar la amplia distribución y presencia de estas metacercarias invasoras presentes en la ictiofauna dulceacuícola del país (Salgado-Maldonado, 2006).
El céstodo asiático, S. acheilognathi, es la especie de helminto parásito de peces dulceacuícolas más exitosa en todo el mundo, considerando la amplitud actual de su distribución geográfica y el número de especies de peces en que se ha registrado (Kuchta et al., 2018). Es una especie que produce patología de importancia en sus peces hospederos, principalmente en crías y en peces de tallas pequeñas (Salgado-Maldonado y Pineda-López, 2003). La repetida introducción de carpas asiáticas con fines de acuicultura a incontables cuerpos de agua de México, ha favorecido su amplia dispersión en el país (Salgado-Maldonado y Pineda-López, 2003). La presencia de S. acheilognathi en los peces del río Lacantún, y en general en los cuerpos de agua de Chiapas, se conoce desde hace más de 30 años (Velázquez-Velázquez et al., 2016). La magnitud de esta invasión ha sido documentada en la cuenca endorreica del San Cristóbal, en Profundulidae, peces endémicos y originarios de Centroamérica, con relación a la introducción de carpas en criaderos hace más de 50 años (Velázquez-Velázquez et al., 2016).
Moluscos. Tres especies muy invasivas de moluscos ya ampliamente distribuidas en México han sido registradas en la cuenca media del Lacantún: el bivalvo Corbicula fluminea y los gasterópodos Tarebia granifera y Melanoides tuberculata. En mayo de 2008 se dio el primer avistamiento de T. granifera en el playón del río Lacantún, frente al pueblo “Adolfo López Mateos” y en el arroyo Lagarto en la misma campaña. Coincidentemente, en mayo de 2008 hallaron a T. granifera en la cuenca baja del sistema hidrológico Grijalva-Usumacinta en la laguna Tintal, municipio de Centla, Tabasco (Rangel-Ruiz et al., 2011). Corbicula fluminea fue localizada en un brazo del río Lacantún frente al pueblo Playón de la Gloria en mayo de 2009. Barba-Macías y Trinidad-Ocaña (2017) registraron a la misma especie en 40 humedales del sistema hidrológico Grijalva-Usumacinta en Tabasco y Chiapas. En contraste, Melanoides tuberculata fue registrada con escasos ejemplares en el río Ixcán en enero de 2017, y en abril del mismo año, en el arroyo Lagarto, con pocos ejemplares también. Esta especie había sido registrada en la cuenca del río Grijalva, Villahermosa, en octubre de 1987 (Contreras-Arquieta et al., 1995).
Se ha comentado ampliamente sobre los efectos de estas especies en ambientes fuera de su ámbito de distribución: desplazamiento de especies nativas, pérdida de la diversidad a nivel global y aclaramiento de la turbidez del agua con cambios en las comunidades de la microbiota (Naranjo-García y Olivera-Carrasco, 2014). En este sistema fluvial se ha observado un posible cambio de hábitos, ya que el bivalvo C. fluminea está siendo utilizado como alimento de algún animal en los arroyos Manzanares y Lagarto, donde se han hallado restos de conchas con muestras de depredación. Lo mismo se ha observado en otros países, como en Brasil, donde 2 aves acuáticas están cambiando sus hábitos de alimentación con la presencia de C. fluminea (Sazima y D’Angelo, 2013) y en Texas, donde en los 50 años de la presencia de C. fluminea, las tortugas hembra Graptemys versa cambiaron su tipo de alimentación, antes variada, a basada casi exclusivamente en esta almeja; lo opuesto ocurre con los machos que no han modificado su dieta (Lindeman, 2006).
Peces. Los ciprínidos Ctenopharyngodon idella y Cyprinus carpio, y 3 especies de pez diablo del género Pterygoplichthys son capaces de reducir la diversidad y causar grandes daños a la biota nativa desplazando especies raras o endémicas (Barrientos et al., 2018; Morales-Hernández y Rodiles-Hernández, 2000). Todas ellas tienen una amplia distribución en las aguas continentales de México.
Las especies de cíclidos no nativos de la cuenca, probablemente iniciaron su invasión del Usumacinta en la década de 1980, como producto de esfuerzos gubernamentales para la diseminación de ejemplares para el desarrollo acuícola. Los loricáridos quizás comenzaron su dispersión en la década de 1990, producto probablemente del acuarismo (Wakida-Kusunoki y Amador-del Ángel, 2008; Wakida-Kusunoki et al., 2007). Específicamente, este último grupo ha tenido efectos importantes sobre la estabilidad de las orillas de río y juega parte, cada vez más importante, de interacciones con la fauna nativa (Gaitán et al., 2020).
La carpa Ctenopharyngodon idella se registró por primera vez, formalmente, en 1996 en el Lacantún, pero testimonios de pescadores sugieren que apareció en la zona en 1987 (Morales-Román y Rodiles Hernández, 2000). Por su parte, Cyprinus carpio parece ser más abundante en aguas abajo del área de estudio que aquí se cubre, en donde se presenta solo ocasionalmente (Mendoza-Carranza et al., 2018).
Estatus de conservación
Es claro que muchos grupos biológicos en México requieren de evaluaciones actualizadas de su estado de conservación. Aunque se cuenta con la metodología establecida por la autoridad ambiental (Sánchez et al., 2007), es frecuente que no se cuente con los datos mínimos para realizar las evaluaciones. Con los datos aquí presentados será posible realizar evaluaciones que ayuden a orientar los esfuerzos hacia ciertos grupos y localidades.
Es notable que se tengan 77 especies evaluadas con el protocolo de la UICN, versus solamente 8 en la NOM-059-SEMARNAT-2010 (fig. 6). Por ejemplo, 3 especies de crustáceos, endémicos de la región, el langostino Macrobrachium vicconi y los cangrejos Odontothelphusa lacanjaensis y Potamocarcinus chajulensis, calificarían por lo menos como especies amenazadas por su distribución restringida. Otras especies dentro de este listado pueden ahora ser evaluadas para asignarles un estatus de riesgo para que la región pueda contar con protección adicional por contener una variedad de especies amenazadas.
Importancia del monitoreo de largo plazo
Debido a muchas limitantes, como el financiamiento continuo, la formación de un grupo de trabajo que se mantenga a través de los años, el seguimiento de un protocolo estandarizado de muestreo y recolección de datos, o bien, que el ecosistema que se estudia conserve su integridad para poder seguir siendo estudiado, es que los monitoreos de largo plazo son igualmente raros como valiosos (Sutter et al., 2015). El definir claramente y desde un inicio los objetivos y alcances del proyecto de monitoreo, es de la mayor importancia, puesto que la inversión de tiempo y esfuerzo no se puede recuperar en caso de detectar deficiencias en el planteamiento original.
El “Programa de monitoreo de los ambientes acuáticos de la Selva Lacandona” que aquí se reporta, se ha llevado a cabo por más de 10 años con, básicamente, el mismo equipo de trabajo y con financiamiento continuo. Los resultados muestran que la cuenca media del río Lacantún es un “hotspot” de diversidad acuática, que el recambio de especies a través del periodo de monitoreo ha sido intenso, pues su número se sigue incrementando con el mismo protocolo de muestreo. Se aprecia también que las especies introducidas aún no han tenido un impacto visible sobre las especies nativas; sin embargo, ya son notorios los debilitamientos y erosión de las orillas del río en algunas secciones debido a las madrigueras de los peces diablo, o a los tapetes del caracol Tarebia granifera y a la acumulación de conchas de la almeja Corbicula fluminea en varios tributarios del Lacantún.
Pero más allá de la acumulación de datos, un programa de monitoreo de largo plazo debe servir para implementar acciones sobre la conservación del ecosistema y para darle seguimiento a éstas, para definir políticas públicas ligadas al uso sustentable y para establecer redes de monitoreo en diversos ecosistemas (Haase et al., 2018). El caso particular del “Programa de monitoreo de los ambientes acuáticos de la Selva Lacandona” es una oportunidad única para continuar generando datos sobre el comportamiento de la diversidad acuática en, probablemente, el sitio más biodiverso de México.
Agradecimientos
A la Dra. Julia Carabias, sin cuyo apoyo e interés este estudio no se habría llevado a cabo. A Natura y Ecosistemas Mexicanos, A.C. Alianza WWW – Fundación Carlos Slim por el apoyo recibido a través de los años para este proyecto. Al Instituto de Biología de la UNAM y al Centro de Investigación en Biodiversidad y Conservación de la Universidad Autónoma del Estado de Morelos, por su apoyo en diversas ocasiones para la realización de trabajo de campo. Edna Naranjo agradece a Gil Méndez, Arzu Rivera García y Lina Romero Salas, su ayuda en el trabajo de campo. Norman Mercado Silva agradece a Gabriel Cordero Martínez por el apoyo en el trabajo de campo.
Apéndice. Listado de especies acuáticas de la subcuenca del río Lacantún, Chiapas. Abreviaturas de las colecciones biológicas en donde están depositados los ejemplares: BMNH, British Museum Natural History, London; CNCR, Colección Nacional de Crustáceos, Instituto de Biología, UNAM; CNHE, Colección Nacional de Helmintos, Instituto de Biología, UNAM; CNMO, Colección Nacional de Moluscos, Instituto de Biología, UNAM; CNPE, Colección Nacional de Peces, Instituto de Biología, UNAM. Con respecto a los helmintos parásitos (Platyhelminthes, Nematoda y Acanthocephala) de peces, se incluye el hospedero y el órgano que parasitan. En los registros documentados en publicaciones previas, se señalan las referencias de las que proceden. Se distingue mediante un asterisco (*) a los taxones que se registran por primera vez y con 2 (**), a los nuevos registros de hospedero que se documentan en este trabajo para helmintos del río Lacantún. Abreviaturas de las localidades de colecta: IXC, Ixcán; PRC, arroyo Puerto Rico; SPB, arroyo San Pablo; CHJ, Chajul; LCT, río Lacantún, JOS, San José; MIR, Miranda; LAG, Lagartos; DNT, arroyo Danta; MNZ, arroyo Manzanares; TZE, Tzendales; LCJ, río Lacanjá; HUM, humedal Lacanjá. Estatus de conservación según la NOM-059-SEMARNAT-2010 actualizada al 2020: A, amenazada; Pr, protección especial; P, en peligro de extinción. Estatus de conservación según la UICN: DD, sin datos; LC, preocupación menor; NT, casi amenazada.
Phylum Platyhelminthes
Clase Trematoda
Tremátodos adultos
Familia Allocreadidae Looss, 1902
Allocreadium cf. ictaluri Pearse, 1924
CNHE. Hospedero: Ictalurus meridionalis (intestino). Localidad: LCT. Nativa. Referencia: Salgado-Maldonado et al. (2014).
Allocreadium cf. mexicanum Osorio-Sarabia, Pérez y Salgado-Maldonado, 1986
CNHE. Hospedero: Atherinella alvarezi (intestino). Localidad: SPB. Nativa. Referencias: Salgado-Maldonado et al. (2014).
Auriculostoma astyanacea Scholz, Aguirre-Macedo y Choudhury, 2004
CNHE. Hospederos: Astyanax brevimanus (intestino). Localidades: IXC, PRC, SPB, CHJ, JOS, MIR, MNZ, DNT, LCT, LAG, TZE. Nativa. Referencia: Salgado-Maldonado et al. (2011a).
Auriculostoma lobata Hernández-Mena, Lynggaard, Mendoza-Garfías y Pérez-Ponce de León, 2016
CNHE. Hospedero: Brycon guatemalensis (intestino). Localidades: IXC, MNZ, LAG. Nativa. Referencia: Hernández-Mena et al. (2016).
*Crepidostomum sp.
CNHE. Hospedero: **Eugerres mexicanus (intestino) (registrado por Salgado-Maldonado et al. (2014) como Allocreadidae gen. sp.). Localidad: LCT. Nativa. Referencia: Salgado-Maldonado et al. (2014).
Paracreptotrematoides heterandriae (Salgado-Maldonado, Caspeta-Mandujano y Vázquez, 2012)
CNHE. Hospederos: Pseudoxiphophorus bimaculatus (intestino). Localidades: SPB, JOS, DNT. Nativa. Referencia: Salgado-Maldonado et al. (2014).
*Pseudoparacreptotrema agonostomi (Salgado-Maldonado, Cabañas-Carranza y Caspeta-Mandujano, 1998)
CNHE. Hospederos: **Rhamdia guatemalensis, **R. laticauda (intestino). Localidad: PRC. Nativa. Referencia: Salgado-Maldonado et al. (1998).
*Pseudoparacreptotrema cf. macroacetabulata Pérez-Ponce de León, Pinacho-Pinacho, Mendoza-Garfias, Choudhury y García-Varela, 2006
CNHE. Hospederos: Astyanax brevimanus, **Hyphessobrycon compressus (intestino). Localidades: DNT, LAG, TZE. Nativa. Referencia: este estudio.
Wallinea chavarriai Choudhury, Hartvigsen y Brooks, 2002
CNHE. Hospederos: Astyanax aeneus, Brycon guatemalensis. Localidades: IXC, PRC, SPB, CHJ, MIR, JOS, MNZ, LCT, DNT, LAG, TZE, LCJ. Nativa. Referencia: Salgado-Maldonado et al. (2014).
Familia Apocreadidae Skrjabin, 1942
Crassicutis cichlasomae Manter, 1936
CNHE. Hospederos: Chuco intermedium, Cincelichthys pearsei, Maskaheros argenteus, Mayaheros urophthalmus, **Parachromis multifasciatus, **P. managuensis, Petenia splendida, Rheoheros lentiginosus, **Rocio octofasciata, Thorichthys helleri, **T. maculipinnis, T. meeki, **T. passioni, **Trichromis salvini, Vieja melanurus, **Wajpamherops nourisati (intestino). Localidades: IXC, PRC, SPB, MIR, JOS, MNZ, LAG, TZE, LCT, HUM. Nativa. Referencias: Salgado-Maldonado et al. (2011a, 2011b, 2014).
Homalometron pallidum Stafford, 1905
CNHE. Hospederos: Chuco intermedium, Thorchthy helleri (intestino). Localidad: CHJ. Nativa. Referencia: Salgado-Maldonado et al. (2014).
*Familia Callodistomidae Poche, 1926
*Prothenystera obesa (Diesing, 1850) Travassos, 1922
CNHE. Hospedero: Astyanax brevimanus (vesícula biliar). Localidades: PRC, SPB, DNT, MIR, LAG, CHJ, TZE. Nativa. Referencia: Salgado-Maldonado et al. (2011a).
Familia Cryptogonimidae Ward, 1917
Acanthostomum minimum (Stunkard, 1938)
CNHE. Hospederos: Cathorops aguadulce, Potamarius usumacintae, **Rhamdia guatemalensis, R. laticauda (intestino). Localidades: IXC, PRC, SPB, JOS, DNT, CHJ, LCT, LCJ. Nativa. Referencia: Salgado-Maldonado et al. (2011a).
*Allacanthochasmus sp.
CNHE. Hospedero: Cathorops aguadulce (intestino). Localidad: TZE. Nativa. Referencias: este estudio.
Campechetrema herrerai Lamothe-Argumedo, Salgado-Maldonado y Pineda-López, 1997
CNHE. Hospederos: **P. multifasciatus (intestino). Localidad: TZE. Nativa. Referencias: Lamothe-Argumedo et al. (1997), Salgado-Maldonado et al. (2011a, 2014).
Oligogonotylus manteri Watson, 1976
CNHE. Hospederos: Mayaheros urophthalmus, Vieja melanurus (intestino). Localidad: CHJ. Nativa. Referencia: Salgado-Maldonado et al. (2011a).
Tabascotrema verai Lamothe-Argumedo y Pineda-López, 1990
CNHE. Hospederos: Petenia splendida, **Thorichthys helleri (intestino). Localidades: IXC, MIR, MNZ, LAG, LCT, TZE, HUM. Nativa. Referencias: Lamothe-Argumedo y Pineda-López (1990), Salgado-Maldonado et al. (2011b).
Familia Derogenidae Nicoll, 1910
Genarchella astyanactis Watson, 1976
CNHE. Hospederos: Astyanax aeneus, **Hyphessobrycon compressus (intestino). Localidades: PRC, MIR, CHJ, LCT. Nativa. Referencias: Salgado-Maldonado et al. (2011b, 2014).
Genarchella isabellae Lamothe-Argumedo, 1977
CNHE. Hospederos: Chuco intermedium, Mayaheros urophthalmus, **Ophisternon aenigmaticum, Petenia splendida, **Rhamdia guatemalensis, Rheoheros lentiginosus, Thorichthys helleri, Trichromis salvini, Vieja bifasciata, V. melanurus (intestino). Localidades: DNT, LAG, LCT, TZE. Nativa. Referencias: Salgado-Maldonado et al. (2011a, 2011b, 2014).
Genarchella tropica Manter, 1936
CNHE. Hospederos: **Atherinella alvarezi, Gobiomorus dormitor, **Leptophylipnus guatemalesis, Rhamdia guatemalensis (intestino). Localidades: PRC, JOS, SPB, MNZ, MIR, TZE. Nativa. Referencias: Salgado-Maldonado et al. (2011b, 2014).
Familia Gorgoderidae Looss, 1901
Phyllodistomum inecoli Razo-Mendivil, Pérez-Ponce de León y Rubio-Godoy, 2013
CNHE. Hospederos: Pseudoxiphophorus bimaculatus, **Xiphophorus helleri (vejiga urinaria). Localidades: PRC, JOS, SPB, MNZ, DNT, CHJ. Nativa. Referencia: Razo-Mendivil et al. (2013)
*Phyllodistomum sp.
CNHE. Hospederos: Mayaheros urophthalmus, Theraps irregularis, **Chuco intermedium, **Petenia splendida, Thorichthys meeki, T. socolofi, Vieja melanurus (intestino). Localidades: DNT, LCT, TZE, HUM. Nativa. Referencias: Salgado-Maldonado et al. (2011a, 2011b, 2014).
Familia Haploporidae Nicoll, 1914
Haploporus sp.
CNHE. Hospedero: Cathorops aguadulce (intestino). Localidad: LCT. Nativa. Referencia: este estudio.
Saccocoeloides sp.
Hospedero: Pseudoxiphophorus bimaculatus (intestino). Localidades: CHJ, DNT, LAG, MIR, PRC, SPB, TZE. Nativa. Referencia: Salgado-Maldonado et al. (2011a).
Familia Macroderoidea McMullen, 1937
Magnivitellinum simplex Kloss, 1966
CNHE. Hospedero: Astyanax brevimanus (ciegos intestinales). Localidades: MIR, PRC. Nativa. Referencias: Salgado-Maldonado et al. (2011a, 2011b, 2014).
Familia Microscaphidiidae Looss, 1900
Octangiodes ujati Pineda-López y Andrade-Salas, 1989
CNHE. Hospederos: Chuco intermedium, Cincelichthys pearsei, **Mayaheros urophthalmus, **Rheoheros lentiginosus, **Theraps irregularis, **Trichromis salvini, Vieja bifasciata, **V. melanurus (intestino). Localidades: IXC, JOS, SPB, LAG, LCT, TZE, HUM. Nativa. Referencias: Salgado-Maldonado et al. (2011b, 2014).
Familia Proterodiplostomidae Dubois, 1936
Croccodilicola pseudostoma Poche, 1926
CNHE. Hospederos: Rhamdia guatemalensis, R. laticauda (intestino). Localidades: IXC, PRC, LAG, TZE. Nativa. Referencia: Salgado-Maldonado (2006).
Familia incertae sedis
*Polylekithum sp. a
CNHE. Hospederos: **Atherinella alvarezi, **Atherinella schulzi (intestino). Localidades: IXC, PRC, SPB, MIR, JOS, LAG, MNZ, LCT, TZE. Nativa. Referencia: este estudio.
*Polylekithum sp. b
CNHE. Hospederos: Strongylura hubbsi (intestino). Localidad: LCT. Nativa. Referencia: este estudio.
Metacercarias (Larvas)
Familia Clinostomidae Lühe, 1901
Clinostomum sp. a
Hospederos: **Astyanax brevimanus, **Thorichthys meeki, **T. pasionis, **Rhamdia laticauda, **Chuco intermedium (celoma, mesenterios). Localidades: PRC, JOS, LAG, HUM. Nativa. Referencias: Salgado-Maldonado et al. (2011a, 2011b).
Clinostomum sp. b
Hospederos: Chuco intermedium, Cincelychthys pearsei, **Petenia splendida, **Rhamdia laticauda, **Thorichthys meeki, **Vieja melanurus. Localidades: PRC, HUM. Nativa. Referencias: Salgado-Maldonado et al. (2011b, 2014).
Familia Criptogonimidae Ward, 1917
Acanthostomum minimum Stunkard, 1938
Hospederos: Dorosoma petenense, Pseudoxiphophorus bimaculatus, Xiphophorus helleri (intestino, quistes bajo las escamas). Localidades: PRC, DNT, JOS, MNZ, SPB. Nativa. Referencias: Salgado-Maldonado et al. (2011a, 2011b, 2014).
Criptogonimidae gen. sp.
Hospederos: Cathorops aguadulce, **Thorichthys passionis, **Vieja melanurus (intestino). Localidad: LCT. Nativa. Referencia: Salgado-Maldonado et al. (2014).
Familia Diplostomidae Poirier, 1886
Diplostomum sp.
Hospederos: Chuco intermedium, Rhamdia guatemalensis, R. laticauda, **Strongylura hubbsi, Thorichthys helleri, Wajpamheros nourissati (ojos, mesenterio, intestino). Localidad: LCT. Nativa. Referencias: Salgado-Maldonado et al. (2011a, 2011b, 2014).
Diplostomidae gen. sp.
Hospedero: **Strongylura hubbsi. Localidad: IXC. Nativa. Referencia: este estudio.
Posthodiplostomum minimum McCallum, 1921
Hospederos: Astyanax brevimanus, Belonesox belizanus, Chuco intermedium, Cincelichthys pearsei **Hyphessobrycon compressus, **Mayaheros urophthalmus, Petenia splendida, Poecilia mexicana, P. reticulata, P. sphenops, Rhamdia guatemalensis, **Thorichthys helleri, Trichromis salvini, Xenodexia ctenolepis (mesenterio, intestino, hígado, músculo). Localidades: IXC, DNT, LAG, LCT, TZE, HUM. Nativa. Referencias: Salgado-Maldonado et al. (2011a, 2011b, 2014).
Tylodelphys sp.
Hospederos: Astyanax brevimanus, **Atherinella alvarezi, **Brycon guatemalensis, Chuco intermedium, **Hyphessobrycon compressus, Ictalurus meridionalis, Lacantunia enigmatica, **Poecilia kykesis, **Petenia splendida, Rhamdia guatemalensis, **Phallicthys fairweatheri, **Pseudoxiphophorus bimaculatus, **Thorichthys helleri, **T. pasionis, **T. meeki, **T. socolofi (mesenterio, gónadas, intestino). Localidades: IXC, PRC, CHJ, MNZ, MIR, JOS, LAG, SPB, TZE, LCJ, HUM. Nativa. Referencias: Salgado-Maldonado et al. (2011a, 2011b, 2014).
Uvulifer cf. ambloplitis (Huges, 1927)
Hospederos: Astyanax brevimanus, Brycon guatemalensis, Poecilia mexicana, Pseudoxiphophorus bimaculatus, **Rocio octofasciata, Trichromis salvini, **Xiphophorus hellerii (piel). Localidades: IXC, PRC, DNT, MIR, JOS, LAG, LCT. Nativa. Referencias: Salgado-Maldonado et al. (2011a, 2011b, 2014).
Familia Heterophydae Odhner, 1914
Ascocotyle tenuicolis Price, 1935
CNHE. Hospedero: Astyanax brevimanus (corazón). Localidad: MIR. Nativa. Referencia: Salgado-Maldonado et al. (2011).
Centrocestus formosanus Nishigori, 1924
CNHE. Hospederos: Astyanax brevimanus, Atherinella alvarezi, **Rocio octofasciata, **Thorichthys meeki. Localidades: IXC, SPB, MIR, LCT, HUM. Introducida. Referencias: Salgado-Maldonado et al. (2011a, 2011b, 2014).
Familia Opisthorchiidae Looss, 1899
*Cladocystis trifolium (Braun, 1901)
CNHE. Hospedero: **Cincelichthys pearsei (branquias). Localidad: LCT. Nativa.
Referencia: este estudio.
Familia Proterodiplostomidae Dubois, 1936
Proterodiplostomidae gen. sp.
CNHE. Hospederos: Pseudoxiphophorus bimaculatus, Thorichthys helleri, Xiphophorus hellerii (celoma, hígado). Localidad: MNZ. Nativa. Referencias: Salgado-Maldonado et al. (2011a, 2011b).
Clase Monogenea
Familia Dactilogyridae Bychowsky, 1933
*Ameloblastella chavarriai (Price, 1938)
CNHE. Hospedero: Rhamdia guatemalensis (branquias). Localidades: PRC, CHJ, DNT, LAG, SPB, LCT, TZE. Nativa. Referencia: Kritsky et al. (2000).
Ancyrocephalus chiapanensis Mendoza-Franco, Caspeta-Mandujano y Ramírez-Martínez, 2018
CNHE 10730, 10731. Hospedero: Strongylura hubbsi (branquias). Localidades: LAG, TZE. Nativa. Referencia: Mendoza-Franco et al. (2018).
Aphanoblastella travassossi (Price, 1938)
CNHE. Hospederos: Rhamdia guatemalensis, R. laticauda (branquias). Localidades: PRC, TZE. Nativa. Referencias: Kritsky et al. (2000), Salgado-Maldonado et al. (2014).
Aristocleidus lacantuni Mendoza-Franco, Tapia y Caspeta-Mandujano, 2015
CNHE 9875, 9876. Hospedero: Eugerres mexicanus (branquias). Localidad: LCT. Endémica. Referencia: Mendoza-Franco et al. (2015a).
Aristocleidus mexicanus Mendoza-Franco, Tapia y Caspeta-Mandujano, 2015
CNHE 9872-9874. Hospedero: Eugerres mexicanus (branquias). Localidad: LCT. Endémica. Referencia: Mendoza-Franco et al. (2015a).
Cacatuocotyle chajuli Mendoza-Franco, Caspeta-Mandujano y Salgado-Maldonado, 2012
CNHE 8268-8276. Hospedero: Astyanax brevimanus (ano). Localidades: IXC, PRC, SPB, JOS, MIR, LAG, LCT, CHJ, TZE, LCJ, HUM. Endémica. Referencias: Mendoza-Franco et al. (2012), Salgado-Maldonado et al. (2014).
Cacatuocotyle exigum Mendoza-Franco, Caspeta-Mandujano y Salgado-Maldonado, 2012
CNHE 8277-8279. Hospedero: Astyanax brevimanus (branquias). Localidades: IXC, PRC, SPB, JOS, DNT, MZN, MIR, LAG, CHJ, TZE. Endémica. Referencias: Mendoza-Franco et al. (2012), Salgado-Maldonado et al. (2014).
Cacatuocotyle sp.
CNHE 8277-8279. Hospedero: Astyanax brevimanus (branquias). Localidades: IXC, PRC, SPB, JOS, DNT, MZN, MIR, LAG, CHJ, TZE. Endémica. Referencias: Mendoza-Franco et al. (2012), Salgado-Maldonado et al. (2014).
Characithecium costaricensis (Price y Bussing, 1967)
CNHE. Hospedero: Astyanax brevimanus (branquias). Localidades: IXC, PRC, SPB, JOS, DNT, MZN, MIR, LAG, CHJ, LCT, TZE. Nativa. Referencia: Salgado-Maldonado et al. (2014).
Diapharocleidus machacae Mendoza-Franco, Caspeta-Mandujano y Ramírez-Martínez, 2018
CNHE 10924, 10925. Hospedero: Brycon guatemalensis. Localidad: LCT. Endémica. Referencia: Mendoza-Franco et al. (2018).
Diapharocleidus kabatai (Molnar, Hanek y Fernando, 1974)
CNHE. Hospedero: Astyanax brevimanus (branquias). Localidades: IXC, JOS, MIR, TZE. Nativa. Referencia: Salgado-Maldonado et al. (2014).
*Diplectanum sp.
CNHE. Hospedero: **Eugerres mexicanus (branquias). Localidad: LCT. Nativa. Referencia: este estudio.
*Heteropriapulus sp.
CNHE. Hospedero: Pterygoplichthys pardalis (branquias). Localidad: HUM. Introducida. Referencia: Mendoza-Franco et al. (2012).
Jainus sp.
CNHE. Hospedero: Astyanax brevimanus (branquias). Localidad: PRC. Introducida. Referencia: Salgado-Maldonado et al. (2014).
Palombitrema heteroancistrium (Price y Bussing, 1968)
CNHE. Hospedero: Astyanax brevimanus (branquias). Localidades: IXC, MIR, LCT, CHJ, TZE. Nativa. Referencia: Salgado-Maldonado et al. (2014).
Paracolpenteron hubbsiensis Mendoza-Franco, Caspeta-Mandujano y Ramírez-Martínez, 2018
CNHE 10728, 10729. Hospedero: Strongylura hubbsi (branquias). Localidades: LAG, TZE. Endémica. Referencia: Mendoza-Franco et al. (2018).
*Salsuginus neotropicalis Mendoza-Franco y Vidal-Martínez, 2001
CNHE. Hospedero: Belonesox belizanus (branquias). Localidad: TZE. Nativa. Referencia: Mendoza-Franco y Vidal-Martínez (2001).
*Sciadichleithrum meeki Mendoza-Franco, Scholz y Vidal-Martínez, 1997
CNHE. Hospederos: Cincelichthys pearsei, Petenia splendida, **Thorichthys meeki (branquias). Localidad: LCT. Nativa. Referencias: Salgado-Maldonado et al. (2011b, 2014).
Urocelidoides strombicirrus (Price y Bussing, 1967)
Hospedero: Astyanax brevimanus (branquias). Localidades: IXC, CHJ, DNT, LAG, MNZ, MIR, PRC, JOS, SPB, CHJ, LCT, LCJ, TZE, HUM. Nativa. Referencias: Salgado-Maldonado et al. (2011b, 2014).
Urocleidoides vaginoclaustroides Mendoza-Franco, Caspeta-Mandujano, Salgado-Maldonado y Matamoros, 2015
CNHE 9857-9860. Hospedero: Pseudoxiphophorus bimaculatus (branquias). Localidad: JOS. Nativa. Referencias: Salgado-Maldonado et al. (2014), Mendoza-Franco et al. (2015).
Urocelidoides vaginoclaustrum Jogunoori, Kritsky y Venkatanarasaiah, 2015
CNHE 9861. Hospedero: Xiphophorus hellerii (branquias). Localidad: DNT. Nativa. Referencias: Salgado-Maldonado et al. (2014), Mendoza-Franco et al. (2015b).
Familia Gyrodactylidae (Van Beneden y Hesse, 1863)
Anacanthocotyle anacanthocotyle Kritsky y Fritts, 1970
CNHE. Hospedero: Astyanax brevimanus (branquias). Localidades: PRC, SPB, DNT, LAG, LCT, CHJ, TZE. Nativa. Referencia: Salgado-Maldonado et al. (2014).
Gyrodactylus neotropicalis Kritsky y Fritts, 1970
CNHE. Hospedero: Astyanax brevimanus (branquias). Localidades: IXC, PRC. Nativa. Referencia: Salgado-Maldonado et al. (2014).
*Gyrodactylus sp.
CNHE. Hospederos: Astyanax aeneus, Gobiomorus dormitor, Poecilia mexicana. Localidades: IXC, PRC, LCT, TZE. Nativa. Referencia: Salgado-Maldonado et al. (2014).
Monogenea gen. sp.
CNHE. Hospedero: Phallicthys fairweatheri. Localidades: IXC, PRC, TZE, HUM. Nativa. Referencia: este estudio.
Clase Cestoda
Subclase Eucestoda
Orden Cyclophyllidea
Familia Botriocephallidae Blanchard, 1849
Schyzocotyle acheilognathi Yamaguti, 1934
CNHE. Hospederos: Astyanax brevimanus, Atherinella alvarezi, **Belonesox belizanus, Brycon guatemalensis, Chuco intermedium, Leptophylipnus guatemalesis, **Parachromis multifasciatus, **Petenia splendida, Poecilia mexicana, Strongylura hubbsi, Rheoheros lentiginosus (intestino). Localidades: SPB, MIR, LAG, LCT, TZE, LCJ. Introducida. Referencias: Salgado-Maldonado et al. (2011a, 2011b, 2014).
Familia Proteocephallidae La Rue, 1911
Corallobotrium lamothei García-Prieto, 1990
CNHE. Hospedero: Ictalurus meridionalis. Localidades: LCT, TZE. Nativa. Referencia: Salgado-Maldonado et al. (2014).
Proteocephalus brooksi García-Prieto, Rodríguez y Pérez Ponce de León, 1996
CNHE. Hospederos: Cathorops aguadulce, **Ictalurus meridionalis, Rhamdia guatemalensis (intestino). Localidad: LCT. Nativa. Referencia: Salgado-Maldonado et al. (2014).
Proteocephalus singularis La Rue, 1911
CNHE. Hospedero: Atractosteus tropicus (intestino). Localidad: LCT. Nativa. Referencia: Salgado-Maldonado et al. (2014).
Proteocephalus sp.
CNHE. Hospedero: Brycon guatemalensis (intestino). Localidad: LCT. Nativa. Referencia: Salgado-Maldonado et al. (2014).
Metacéstodos (Larvas)
Familia Gryporhynchidae (Spassky y Spasskaya, 1973)
*Glossocercus auritus (Rudolphi, 1819)
CNHE. Hospederos: Carlhubbsia kidderi, Poecilia mexicana. Localidad: HUM. Nativa. Referencia: Salgado-Maldonado et al. (2011b).
Valipora mutabilis Linton, 1927
CNHE. Hospederos: **Astyanax brevimanus, Atherinella alvarezi, **Poecilia mexicana, **Pseudoxiphophorus bimaculatus, **Thorichthys meeki, **T. socolofi, **Vieja melanurus (hígado). Localidades: MZN, TZE, HUM. Nativa. Referencias: Salgado-Maldonado et al. (2011b, 2014).
Phylum Acanthocephala
Clase Archiacanthocephala
Orden Oligacanthorhynchida
Familia Neoechinorhynchidae Ward, 1917
Gracilisentis gracilisentis Van Cleave, 1913
CNHE. Hospederos: Dorosoma anale, D. petenense (intestino). Localidades: LCT, LCJ, HUM. Nativa. Referencias: Salgado-Maldonado et al. (2011b, 2014).
Neoechinorhynchus golvani Salgado-Maldonado, 1978
CNHE. Hospederos: Mayaheros urophthalmus, Thorichthys helleri, **T. meeki, **T. socolofi, Vieja bifasciata. Localidades: LCT, LCJ, HUM. Nativa. Referencias: Salgado-Maldonado et al. (2011b, 2014).
Phylum Nematoda
Familia Atractidae Railliet, 1912
Atractis vidali González-Solís y Moravec, 2002
CNHE. Hospederos: Chuco intermedium, **Trichromis salvini, **Vieja bifasciata, **V. melanurus, Wajpamheros nourissati (intestino). Localidades: IXC, JOS, SPB, PRC, LAG, TZE. Nativa. Referencias: Salgado-Maldonado et al. (2011b, 2014).
Orientatractis chiapasensis González-Solís y Moravec, 2004
CNHE. Hospederos: Chuco intermedium, **Thorichthys helleri (intestino). Localidades: JOS, LCT. Endémica. Referencias: Caspeta-Mandujano (2010), Salgado-Maldonado et al. (2011b, 2014).
Familia Camallanidae Railliet y Henry, 1915
Procamallanus neocaballeroi Caballero-Deloya, 1977
CNHE. Hospederos: Astyanax brevimanus, Vieja bifasciata (intestino). Localidad: LCJ. Nativa. Referencias: Caspeta-Mandujano (2010), Salgado-Maldonado et al. (2014).
Procamallanus rebacae Andrade-Salas, Pineda-López y García-Magaña, 1994
CNHE. Hospederos: Atractosteus tropicus, Chuco intermedium, **Cincelichthys pearsei, Mayaheros urophthalmus, **Petenia splendida, Rhamdia laticauda, **Rheoheros lentiginosus, Thorichthys helleri, T. meeki, **T. pasionis, **T. socolofi, **T. maculipinnis, **Trichomis salvini, **Vieja bifasciata, **V. melanurus, Wajpamherops nourissati. Localidades: IXC, PRC, SPB, LAG, MZN, MIR, LCT, CHJ, TZE, LCJ, HUM. Nativa. Referencias: Caspeta-Mandujano (2010), Salgado-Maldonado et al. (2011b, 2014).
Familia Capillariidae Railliet, 1915
*Gibsonnema ophisterni Moravec, Salgado-Maldonado y Aguilar-Aguilar, 2002
CNHE. Hospedero: Ophisternon aenigmaticum (intestino) Localidad: PRC. Nativa. Referencia: Moravec et al. (2002).
Familia Cosmocercidae Railliet, 1916
Raillietnema kritscheri Moravec, Salgado-Maldonado y Pineda-López, 1993
CNHE. Hospederos: Chuco intermedium, Cincelichthys pearsei, Thorichthys helleri, **Trichromis salvini, **Vieja bifasciata, Wajpamherops nourissati (intestine). Localidades: MZN, LCT, TZE. Nativa. Referencias: Caspeta-Mandujano (2010), Salgado-Maldonado et al. (2011a, 2011b, 2014).
Familia Cucullanidae Cobbold, 1864
Cucullanus angeli Cabañas-Carranza, Caspeta-Mandujano y Salgado-Maldonado, 1999
CNHE. Hospedero: Chuco intermedium (intestino). Localidad: SPB. Nativa. Referencias: Caspeta-Mandujano (2010), Salgado-Maldonado et al. (2014).
Cucullanus caballeroi Petter, 1977
Hospedero: Gobiomorus dormitor (intestino). Localidad: LCT. Nativa. Referencia: Salgado-Maldonado et al. (2011a).
Cucullanus mexicanus Caspeta-Mandujano, Moravec y Aguilar-Aguilar, 2000
CNHE. Hospederos: Gobiomorus dormitor, Rhamdia guatemalensis, R. laticauda, **Rheoheros lentiginosus (intestino). Localidades: PRC, DNT, MNZ, LCT. Nativa. Referencias: Caspeta-Mandujano (2010), Salgado-Maldonado et al. (2014).
Cucullanus sp. 1
CNHE. Hospederos: Centropomus sp., Vieja bifasciata (intestino). Localidad: LCT. Nativa. Referencias: Caspeta-Mandujano et al. (2011), Salgado-Maldonado et al. (2011a, 2014).
Cucullanus sp. 2
CNHE. Hospederos: Cincelichthys pearsei, **Potamarius nelsoni, Rhamdia laticauda, Theraps irregularis (intestino). Localidad: LCT. Nativa. Referencia: Salgado-Maldonado et al. (2014).
Cucullanus sp. 3
CNHE. Hospedero: Gobiomorus dormitor (intestino). Localidad: LCT. Nativa. Referencia: Este estudio.
Neocucullanus neocucullanus Travassos, Artigas y Pereira, 1928
CNHE. Hospederos: Astyanax brevimanus, Brycon guatemalensis (intestino). Localidades: MIR, LAG, LCT. Nativa. Referencias: Caspeta-Mandujano (2010), Salgado-Maldonado et al. (2011b, 2014).
Familia Cystidicolidae Skrjabin, 1946
Spinitectus mexicanus Caspeta-Mandujano, Moravec y Salgado-Maldonado, 2000
CNHE. Hospedero: Pseudoxiphophorus bimaculatus (intestino). Localidades: PRC, JOS, SPB, DNT. Nativa. Referencias: Caspeta-Mandujano (2010), Salgado-Maldonado et al. (2011b, 2014).
Spinitectus osorioi Choudhury y Pérez-Ponce de León, 2001
CNHE. Hospederos: Atherinella alvarezi, Eugerres mexicanus (estómago, intestino). Localidades: IXC, JOS, SPB, MZN, MIR, LAG, CHJ, LCT, TZE, LCJ. Nativa. Referencias: Caspeta-Mandujano (2010), Caspeta-Mandujano et al. (2021), Salgado-Maldonado et al. (2011, 2014).
Spinitectus tabascoensis Moravec, García-Magaña y Salgado-Maldonado, 2002
CNHE. Hospederos: Cathorops aguadulce, Ictalurus meridionalis, Potamarius usumacintae (intestino). Localidades: LCT, TZE, LCJ. Endémica. Referencias: Caspeta-Mandujano (2010), Salgado-Maldonado et al. (2011a, 2014).
Familia Daniconematidae Moravec y Kϕie, 1987
Mexiconema cichlasomae Moravec, Vidal y Salgado-Maldonado, 1992
CNHE. Hospederos: Rheoheros lentiginosus, Thorichthys helleri, **T. socolofi, Wajpamherops nourissati (intestino). Localidad: HUM. Endémica. Referencias: Caspeta-Mandujano (2010), Salgado-Maldonado et al. (2011a, 2014).
Familia Rhabdochonidae Travassos, Artigas y Pereira, 1928
Rhabdochona acuminata Molin, 1860
CNHE. Hospederos: Atherinella alvarezi, Brycon guatemalensis, **Cathorops aguadulce, **Rhamdia laticauda, **Theraps irregularis, **Trichromis salvini (intestino). Localidad: LCT. Nativa. Referencias: Caspeta-Mandujano (2010), Salgado-Maldonado et al. (2011a, 2014).
Rhabdochona juliacarabiasae Caspeta-Mandujano, Salinas-Ocampo, Suárez-Rodríguez, Ramírez-Martínez y Matamoros, 2021
CNHE 8052-8054. Hospedero: Eugerres mexicanus (intestino). Localidad: LCT. Endémica. Referencia: Caspeta-Mandujano et al. (2021).
Rhabdochona kidderi Pearse, 1936
CNHE. Hospederos: Cathorops aguadulce, Chuco intermedium, Cincelichthys pearsei, Gobiomorus dormitor, Ictalurus meridionalis, Ictiobus meridionalis, Maskaheros argenteus, Ophisternon aenigmaticum, **Parachromis multifasciatus, Petenia splendida, Rheoheros lentiginosus, Rhamdia guatemalensis, **Rocio octofasciata, **Theraps irregularis, Thorichthys helleri, **T. pasionis, Trichromis salvini, Vieja bifasciata, **V. melanurus, Wajpamherops nourissati (intestino). Localidades: IXC, PRC, JOS, SPB, MNZ, MIR, LAG, LCT, CHJ, TZE, HUM. Nativa. Referencias: Caspeta-Mandujano (2010), Salgado-Maldonado et al. (2011a, 2011b, 2014).
Rhabdochona mexicana Caspeta-Mandujano, Moravec y Salgado-Maldonado, 2000
CNHE. Hospedero: Astyanax brevimanus (intestino). Localidades: IXC, PRC, JOS, CHJ, TZE. Nativa. Referencias: Caspeta-Mandujano (2010), Salgado-Maldonado et al. (2011b, 2014).
Megachona sp.
CNHE. Hospedero: Strongylura hubbsi (intestino). Localidad: LAG. Nativa. Referencia: Este estudio.
Rhabdochonidae gen. sp.
CNHE. Hospedero: Astyanax brevimanus (intestino). Localidad: TZE. Nativa. Referencias: Este estudio.
Larvas
Familia Acuariidae Railliet, Henry y Sisoff, 1912
*Acuariidae gen. sp.
CNHE. Hospedero: Astyanax brevimanus. Localidad: TZE. Nativa. Referencias: Caspeta-Mandujano (2010), Salgado-Maldonado et al. (2014).
Familia Anisakidae Railliet y Henry, 1912
Contracaecum sp.
CNHE. Hospederos: Astyanax brevimanus, Atractosteus tropicus, Atherinella alvarezi, **Batrachoides goldmani, Brycon guatemalensis, Chuco intermedium, **Cincelichthys pearsei, Dorosoma petenense, Gobiomorus dormitor, **Hyphesobrycon compressus, Ictalurus meridionalis, Lacantunia enigmatica, Mayaheros urophthalmus, Ophisternon aenigmaticum, Parachromis managuensis, **P. multifasciatus, Petenia splendida, Rhamdia guatemalensis, Rivulus tenuis, **Strongylura hubbsi, Theraps irregularis, Thorichthys helleri, **T. meeki, **T. pasionis, Xiphophorus helleri (celoma, mesenterio, estómago, hígado, grasa, intestino). Localidades: PRC, MNZ, MIR, JOS, SPB, LCT, TZE, LCJ, HUM. Nativa. Referencias: Caspeta-Mandujano (2010), Salgado-Maldonado et al. (2011a, 2011b, 2014).
*Hysterothylacium sp.
CNHE. Hospederos: **Poecilia mexicana, **Rhamdia laticauda. Localidades: JOS. Nativa. Referencia: este estudio.
Familia Camallanidae Railliet y Henry, 1915
Procamallanus sp.
CNHE. Hospederos: **Batrachoides goldmani, **Belonesox belizanus, **Cynodonichthys tenuis. Localidades: LAG, LCT. Nativa. Referencias: Caspeta-Mandujano (2010), Salgado-Maldonado et al. (2011a, 2014).
*Serpinema trispinosum (Leidy, 1852)
CNHE. Hospederos: **Astyanax brevimanus, **Gambusia sexradiata, **Ophisternon aenigmaticum, **Petenia splendida. Localidad: HUM. Nativa. Referencias: este estudio.
Familia Cystidicolidae Skrjabin, 1946
Spinitectus sp.
Hospedero: Astyanax brevimanus (intestino). Localidad: CHJ. Nativa. Referencia: Salgado-Maldonado et al. (2011a).
Familia Gnathostomatidae Railliet, 1895
Gnathostoma sp.
Hospedero: Rhamdia guatemalensis (intestino). Localidad: LCT. Nativa. Referencia: Salgado-Maldonado et al. (2011a).
Spiroxys sp.
CNHE. Hospederos: Astyanax brevimanus, Atherinella alvarezi, **Belonesox belizanus, Brycon guatemalensis, Chuco intermedium, **Eugerres mexicanus, **Gambusia sexradiata, Hyphesobrycon compressus, Maskaheros argenteus, Mayaheros urophthalmus, Petenia splendida, Rhamdia guatemalensis, Vieja bifasciata, **Xiphophorus maculatus (intestino, mesenterio, estómago). Localidades: IXC, DNT, LAG, MNZ, MIR, PRC, JOS, SPB, CHJ, TZE, LCJ. Nativa. Referencias: Caspeta-Mandujano (2010), Salgado-Maldonado et al. (2011a, 2011b, 2014).
Familia Catlanidae Lane, 1914
Falcaustra sp.
CNHE. Hospederos: Rhamdia guatemalensis, **Thorichthys meeki (vejiga natatoria). Localidades: MNZ, LCJ, HUM. Nativa. Referencia: Caspeta-Mandujano (2010).
Familia Rhabdochonidae Skrabin, 1946
Rhabdochona sp.
CNHE. Hospederos: Cathorops aguadulce, Potamarius usumacintae, Strongylura hubbsi (intestino). Localidad: LCT. Nativa. Referencias: Caspeta-Mandujano (2010), Salgado-Maldonado et al. (2011a, 2011b, 2014).
Superphylum Arthropoda
Phylum Mandibulata
Subphylum Pancrustacea
Infraphylum Multicrustacea
Clase Malacostraca
Superorden Eucarida
Orden Decapoda
Infraorden Caridea
Familia Palaemonidae Rafinesque, 1815
Macrobrachium carcinus (Linnaeus, 1758)
CNCR 34881. Localidad: TZE. Nativa. LC (UICN). Referencia: Álvarez et al. (2011).
Macrobrachium heterochirus (Wiegmann, 1836)
CNCR 34822. Localidad: TZE. Nativa. LC (UICN). Referencia: Álvarez et al. (2011).
Macrobrachium vicconi Román, Ortega y Mejía, 2000
CNCR 34456, 34504, 34505, 34509, 34510, 34512-34515, 34823, 34825-34830, 34882-34884, 34886, 35398-35403. Localidades: IXC, PRC, SPB, DNT, JOS, LCT, LAG, MZN, MIR, TZE. Endémica. LC (UICN). Referencias: Román et al. (2000), Álvarez et al. (2011).
Infraorden Astacidea
Familia Cambaridae Hobb, 1942
*Procambarus pilosimanus (Ortmann, 1906)
CNCR 35365, 35366. Localidad: GLC. Endémica. LC (UICN). Referencias: Álvarez et al. (2011, 2021).
Infraorden Brachyura
Familia Pseudothelphusidae Ortmann, 1893
Odontothelphusa lacanjaensis Alvarez y Villalobos, 1998
CNCR 34457, 34503, 34506, 34511, 34516, 34517, 34820, 34826, 34879, 34880, 34885, 34887, 35395-35397. Localidades: DNT, JOS, MZN, SPB. Endémica. DD (UICN). Referencia: Alvarez y Villalobos (1998).
Potamocarcinus chajulensis Alvarez y Villalobos, 1998
CNCR 34457, 34507, 34508, 34517, 34819, 34821, 34824, 34888, 35391-35394. Localidades: PRC, TZE, LCJ. Endémica. DD (UICN). Referencia: Alvarez y Villalobos (1998).
Phylum Mollusca
Clase Bivalvia
Subclase Palaeoheterodonta
Orden Unionida
Superfamilia Unionoidea
Familia Unionidae Rafinesque, 1820
Anodonta lurulenta (Morelet, 1849)
BMNH 93-2-4-2003. Localidades: río Usumacinta, sin especificar. Endémica. Referencias: Morelet (1849), Mussel Project (2021), Graf y Cummings (2007a).
Anodontites cylindracea (Lea, 1838)
BMNH 1965146. Localidad: cuerpo de agua cercano a Palenque (Morelet, 1851). Nativa. Referencias: Morelet (1851), Mussel Project (2021), Graf y Cummings (2007a).
Delphinonaias largillierti (Philippi, 1847) [como Delphinonaias delphinulus (Morelet, 1849)]
CNMO 3287, 3291, 5582; BMNH 93-2-4-1588. Localidades: LCT, TZE. Nativa. Referencias: este estudio, Mussel Project (2021), Graf y Cummings (2007b).
Delphinonaias planivalvis (Morelet, 1851)
BMNH 93-2-4-2025. Localidad: cercano al río Usumacinta, sin más datos. Nativa. Referencias: Morelet (1851), Mussel Project (2021), Graf y Cummings (2007b).
Megalonaias nervosa (Rafinesque, 1820) [como Megalonaias nickliniana (Lea, 1834)]
BMNH 93-2-4-2035. Localidades: río Usumacinta, Petén, Guatemala. Nativa. P (NOM-059). Referencias: Morelet (1851), Mussel Project (2021), Graf y Cummings (2007a).
Nephronaias calamitarum (Morelet, 1849)
BMNH 93-2-4-2010. Localidad: río Baluntié cercano a Palenque. Nativa. Referencias: Morelet (1849), Bequaert (1957), Mussel Project (2021), Graf y Cummings (2007b).
Sphenonaias microdon (von Martens, 1887)
CNMO 2857, 3281, 3283, 7816. Localidad: LCT. Nativa. Referencias: este estudio, von Martens (1890-1901), Mussel Project (2021), Graf y Cummings (2007a).
*Psoronaias crocodilorum (Morelet, 1849)
CNMO 3282, 3286, 3288, 3300, 3342, 3578, 3997, 4036, 4037, 4450, 4456, 4461, 4954, 4966, 5092, 5095, 5101, 5609, 5609, 5913, 6296, 6323, 6324, 6326, 6420, 6497, 6510, 6696, 6825, 6965, 7645, 7782, 7817, 7956; BMNH 1893-2-4-2030. Nuevo registro: MEX. Localidades: PRC, JOS, MIR, LAG, CHJ, LCT, LCJ, TZE. Nativa. Referencias: este estudio, Morelet (1849), Mussel Project (2021), Graf y Cummings (2007a).
Psoronaias martensi Frierson, 1927
CNMO 2614. Localidad: LCJ. Nativa. Referencias: von Martens (1890-1901), Graf y Cummings (2007b).
Psoronaias morini (Morelet, 1851)
BMNH 93-2-4-2026. Localidad: río Usumacinta. Nativa. Referencias: Morelet (1851), Mussel Project (2021), Graf y Cummings (2007a).
Psoronaias ostreata (Morelet, 1849)
BMNH 94-3-22-2. Localidades: río Usumacinta, Guatemala. Nativa. Referencias: Morelet (1849), Mussel Project (2021), Graf y Cummings (2007b).
Psoronaias percompressa (von Martens, 1887)
CNMO 2613. Localidades: LCT, LCJ. Nativa. Referencias: Mussel Project (2021), Graf y Cummings (2007a).
Psoronaias semigranosa (Philippi, 1843)
BMNH 94-3-22-1, 93-2-4-2033. Localidades: río Usumacinta. Nativa. Referencias: Morelet (1849), Bequaert (1957), Mussel Project (2021), Graf y Cummings (2007b).
Pachynaias spheniopsis (Morelet, 1849)
BMNH 93-2-4-2028. Localidades: cuenca alta del río Usumacinta. Nativa. Referencias: Morelet (1849), Mussel Project (2021), Graf y Cummings (2007b).
Subclase Heterodonta
Orden Venerida
Superfamilia Cyrenoidea
Familia Cyrenidae Gray, 1840
*Corbicula fluminea (O. F. Müller, 1774)
CNMO 3984, 4970, 5607, 5751, 5903, 5906, 5910, 5924, 5925, 6313, 6317, 6319, 6321, 6504, 6513, 6516, 6524, 6525, 6796, 7603, 7610, 7732, 7449, 7750, 7778, 7818. Nuevo registro: LCT. Localidades: JOS, LAG, MZN, MIR, PRC, CHJ, LCT, TZE. Introducida. LC (UICN). Referencias: este estudio, Naranjo-García y Olivera-Carrasco (2014), Ramírez-Martínez et al. (2015).
Clase Gastropoda
Subclase Heterobranchia
Superorden Hygrophila
Superfamilia Lymnaeoidea
Familia Lymnaeidae Rafinesque, 1815
*Pseudosuccinea columella (Say, 1817)
CNMO 3936. Nuevo registro: LCT. Localidades: LAG. Nativa. LC (UICN). Referencias: este estudio.
Familia Planorbidae Rafinesque, 1815
Subfamilia Ancylinae Rafinesque, 1815
Gundlachia radiata (Guilding, 1828)
CNMO 3570, 5581, 5590, 5601, 5746, 5749, 5759, 5881, 5894, 5917, 5918, 5932, 6507, 7273, 7445, 7448, 7450-7452, 7488, 7476, 7597, 7598, 7600, 7609, 7624, 7727, 7731. Localidades: IXC, JOS, DNT, MZN, MIR, SPB, PRC, CHJ, LAG, LCT, TZE. Nativa. Referencias: este estudio, Bequaert (1957), Ramírez-Martínez et al. (2015).
Subfamilia Planorbinae Rafinesque, 1815
Biomphalaria havanensis (L. Pfeiffer, 1839)
CNMO 3334, 6263. Localidades: TZE, HUM. Nativa. LC (UICN). Referencias: este estudio, Bequaert (1957), Ramírez-Martínez et al. (2015).
Biomphalaria subprona (von Martens, 1899)
CNMO 3572, 5633, 5893, 5921, 7458, 7570, 7774. Localidades: IXC, PRC, MNZ, LAG, CHJ, TZE, HUM. Nativa. Referencias: este estudio, Bequaert (1957), Ramírez-Martínez et al. (2015).
Drepanotrema anatinum (d’Orbigny, 1835)
CNMO 3297, 3650, 3846, 3879, 5908. Localidades: MNZ, CHJ, LAG, TZE. Nativa. Referencias: este estudio, Ramírez-Martínez et al. (2015).
Drepanotrema lucidum (L. Pfeiffer, 1839)
CNMO 3387, 3848, 5807, 6343. Localidades: SPB, CHJ, TZE. Nativa. Referencias: este estudio, Ramírez-Martínez et al. (2015).
Planorbella trivolvis (Say, 1817)
CNMO 7758. Localidad: TZE. Nativa. Referencias: este estudio, Ramírez-Martínez et al. (2015).
Subclase Caenogastropoda
Orden Architaenioglossa
Superfamilia Ampullarioidea
Familia Ampullariidae Gray, 1824
Pomacea flagellata (Say, 1827)
CNMO 3418, 3542, 3988, 3996, 4041, 4466, 4468, 5600, 5617, 5737, 5911, 5912, 5932, 6211, 6277, 6322, 6538, 7444, 7611, 7612. Localidades: DNT, JOS, CHJ, MNZ, MIR, PRC, LAG, LCJ, HUM. Nativa. Referencias: este estudio, Bequaert (1957), Ramírez-Martínez et al. (2015).
Orden Littorinimorpha
Superfamilia Truncatelloidea
Familia Cochliopidae Tryon, 1866
Aroapyrgus cf. conchensensis (B. Walker, 1919)
CNMO 3418, 3542, 3988, 3996, 4041, 4466, 4468, 5600, 5617, 5737, 5911, 5912, 5932, 6211, 6277, 6322, 6538, 7444, 7611, 7612. Localidades: MNZ, MIR, PRC, LAG, JOS, DNT, CHJ, LCJ, TZE, HUM. Nativa. Referencia: este estudio.
Aroapyrgus clenchi (Goodrich y Van der Schalie, 1937)
CNMO 3591, 4887, 5889, 5897, 6290, 6500, 7272, 7625, 7763. Localidades: IXC, CHJ, JOS, MNZ, MIR, LCT, TZE, LCJ. Nativa. Referencias: este estudio, Ramírez-Martínez et al. (2015).
Aroapyrgus pasionensis (Goodrich y Van der Schalie, 1937)
CNMO 4050. Localidad: TZE. Nativa. Referencias: este estudio, Ramírez-Martínez et al. (2015).
Cochliopina infundibulum (von Martens, 1899)
CNMO 3526, 3589, 5586, 6299, 6808, 7270, 7461, 7465, 7595, 7619, 7747, 7752, 7771, 7775. Localidades: JOS, MIR, SPB, LCT, TZE, LCJ, HUM. Nativa. Referencias: este estudio, Ramírez-Martínez et al. (2015).
Cochliopina dulcensis (W. B. Marshall, 1920)
CNMO 3585, 5584, 5761, 5884, 6308, 6307, 6495, 6503, 7269, 7465, 7617, 7754, 7759. Localidades: LAG, LCJ, TZE. Nativa. Referencias: este estudio, Ramírez-Martínez et al. (2015).
Cochliopina francesae (Goodrich y Van der Schalie, 1937)
CNMO 3530, 3590, 5771, 5763, 6300, 6518, 6798, 6801, 7268, 7466, 7478, 7594, 7614, 7748, 7751, 7772. Localidades: LAG, LCJ, TZE. Nativa. Referencias: este estudio, Ramírez-Martínez et al. (2015).
Cochliopina hinkleyi (Pilsbry, 1920)
CNMO 7757. Localidad: TZE. Nativa. Referencia: este estudio.
Orden no asignado
Superfamilia Cerithioidea
Familia Pachychilidae P. Fischer y Crosse, 1892
Pachychilus cf. glaphyrus (Morelet, 1849)
CNMO 6252. Localidades: SPB, TZE. Nativa. Referencia: este estudio.
Pachychilus indiorum (Morelet, 1849)
CNMO 3533, 3573, 3579, 3986, 3990, 4018, 4031, 4043, 4462, 4467, 4826, 4861, 4962, 5774, 5805, 5900, 5930, 5977, 6264, 6278, 6288, 6302, 6314, 6316, 6318, 6514, 6515, 6533, 6537, 7446, 7729, 7733, 7734, 7741, 7778. Localidades: IXC, CHJ, DNT, MNZ, SPB, PRC, JOS, TZE, LCJ. Nativa. Referencias: este estudio, Bequaert (1957), Ramírez-Martínez et al. (2015).
Pachychilus sargi (Crosse y Fischer, 1875)
CNMO 4465. Localidad: IXC. Nativa. Referencias: este estudio, Ramírez-Martínez et al. (2015).
Familia Thiaridae Gill, 1871 (1823)
Tarebia granifera (Lamarck, 1816)
CNMO 3242, 4039, 4464, 4471, 4890, 4870, 5582, 5747, 5926, 6033, 6266, 6279, 6517, 6527, 6528, 7725, 7749, 7780. Localidades: IXC, CHJ, JOS, MNZ, SPB, LCT, TZE. Introducida. LC (UICN). Referencias: este estudio, Naranjo-García y Olivera-Carrasco (2014), Ramírez-Martínez et al. (2015), Naranjo-García y Castillo-Rodríguez (2017).
Melanoides tuberculata (O. F. Müller, 1774)
CNMO 3552, 6253, 6273, 6528, 7606. Localidades: IXC, CHJ, JOS, MNZ, SPB, LCT, TZE. Introducida. LC (UICN). Referencias: este estudio, Naranjo-García y Olivera-Carrasco (2014), Ramírez-Martínez et al. (2015), Naranjo-García y Castillo-Rodríguez (2017).
Phylum Chordata
Subphylum Vertebrata
Superclase Pisces
Clase Osteichthyes
Orden Lepisosteiformes
Familia Lepisosteidae Bonaparte, 1835
Atractosteus tropicus (Gill, 1863)
CNPE 19927, 20940. Localidades: MIR, HUM. Nativa. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
División Teleostei
Orden Elopiformes
Familia Megalopidae Jordan y Gilbert, 1883
Megalops atlanticus (Valenciennes, 1847)
Localidades: LCT, CHJ. Nativa. DD (UICN). Referencia: Lozano-Vilano et al. (2007).
Orden Clupeiformes
Familia Clupeidae Cuvier, 1816
Dorosoma anale (Meek, 1904)
CNPE 19646, 19673, 21128. Localidades: IXC, MIR, LCT, HUM. Nativa. Referencia: Whitehead (1985).
Dorosoma petenense (Günther, 1867)
CNPE 19922, 19962, 22392, 22438. Localidades: PRC, CHJ, LCT, HUM. Nativa. Referencia: Whitehead (1985).
Orden Cypriniformes
Familia Cyprinidae Rafinesque, 1815
Ctenopharyngodon idella (Valenciennes, 1844)
Localidad: LCJ. Introducida. Referencias: Velázquez-Velázquez et al. (2016), Espinosa-Pérez et al. (2019).
Cyprinus carpio Linnaeus, 1758
Localidades: IXC, CHJ, LCT, LCJ. Introducida. Referencias: Velázquez-Velázquez et al. (2016), Sori-Barreto et al. (2018), Espinosa-Pérez et al. (2019).
Familia Catostomidae Agassiz, 1850
Ictiobus meridionalis (Günther, 1868)
CNPE 20170. Localidades: SPB, MIR, LCT. Nativa. DD (UICN). Referencias: Lozano-Vilano et al. (2007), Velázquez-Velázquez et al. (2016).
Orden Characiformes
Familia Characidae Latreille, 1825
Astyanax brevimanus (Günther, 1860)
CNPE 18477, 18482, 18501, 18506, 18552, 18559, 18564, 18568, 18571, 18576, 18980. Localidades: IXC, PRC, SPB, MIR, LAG, JOS, DNT, MNZ, TZE, LCT, CHJ, LCJ, HUM. Nativa. LC (UICN). Referencias: Schmitter-Soto (2017), Mercado-Silva et al. (2020).
Hyphessobrycon compressus (Meek, 1904)
CNPE 18483, 18553, 18560, 18642, 18664, 18669, 18686, 18688, 19017, 18981. Localidades: IXC, SPB, LAG, JOS, PRC, CHJ, MIR, DNT, MNZ, LCT, TZE, LCJ, HUM. Nativa. LC (UICN). Referencias: Espinosa-Pérez et al. (2019), Mercado-Silva et al. (2020).
Familia Bryconidae Eigenmann, 1912
Brycon guatemalensis (Regan, 1908)
CNPE 18469, 18476, 18484, 18494, 18500, 18505, 18587, 19018. Localidades: IXC, PRC, JOS, SPB, CHJ, MIR, LAG, LCT, MNZ, TZE. Nativa. LC (UICN). Referencia: Lozano-Vilano et al. (2007).
Orden Siluriformes
Familia Loricariidae Rafinesque, 1815
Pterygoplichthys multiradiatus (Hancock, 1828)
CNPE 18473, 18498, 19614. Localidades: IXC, CHJ, TZE. Introducida. Referencia: Espinosa-Pérez et al. (2019).
Pterygoplichthys pardalis (Castelnau, 1855)
CNPE 19928, 20318, 20331, 20435. Localidades: PRC, JOS, LCT, TZE. Introducida. Referencia: Espinosa-Pérez et al. (2019).
Pterygoplichthys disjunctivus (Weber, 1991)
CNPE 19664. Localidad: HUM. Introducida. Referencia: Espinosa-Pérez et al. (2019).
Familia Lacantuniidae Rodiles-Hernández, Hendrickson y Lundberg, 2005
Lacantunia enigmatica Rodiles-Hernández, Hendrickson y Lundberg, 2005
CNPE 18593, 19642. Localidad: HUM. Endémica. P (NOM-059), VU (UICN). Referencia: Rodiles-Hernández et al. (2005).
Familia Ariidae Bleeker, 1858
Cathorops aguadulce (Meek, 1904)
CNPE 18589, 20434, 22394. Localidades: IXC, LCT, CHJ, MIR. Nativa. Referencias: Velázquez-Velázquez et al. (2016), Espinosa-Pérez et al. (2019).
Potamarius nelsoni (Evermann y Goldsborough, 1902)
CNPE 18536, 18590, 19643. Localidades: CHJ, LCT. Endémica. Pr (NOM-059), LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Potamarius usumacintae (Betancur-R. y Willink, 2007)
CNPE 21075. Localidad: LCT. Nativa. DD (UICN). Referencia: Betancur-R. y Willink (2007).
Familia Ictaluridae Gill, 1861
Ictalurus meridionalis (Günther, 1864)
CNPE 19925, 20290, 22418. Localidades: MNZ, MIR, LCT. Nativa. Referencias: Rodiles-Hernández et al. (2010), Espinosa-Pérez et al. (2019).
Familia Heptapteridae Gill, 1861
Rhamdia guatemalensis (Günther, 1864)
CNPE 18507, 18656, 18681, 19025, 19586, 19666, 19949, 21079. Localidades: IXC, MNZ, DNT, JOS, LAG, PRC, CHJ, TZE, HUM. Nativa. Pr (NOM-059), LC (UICN). Referencia: Miller (1984).
Rhamdia laticauda (Kner, 1858)
CNPE 20478, 20484, 22397. Localidades: IXC, DNT, PRC, SPB, JOS, TZE. Nativa. LC (UICN). Referencia: Miller (1984).
Orden Batrachoidiformes
Familia Batrachoididae Jordan, 1896 (1835)
Batrachoides goldmani (Evermann y Goldsborough, 1902)
CNPE 21095, 19924. Localidades: PRC, MIR, LCT, LAG, TZE, LCJ. Endémica. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Orden Gobiiformes
Familia Eleotridae Bonaparte, 1835
Gobiomorus dormitor (Lacepède, 1800)
CNPE 20292. Localidades: LCT, TZE, LCJ. Nativa. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Leptophilypnus guatemalensis (Thacker y Pezold, 2006)
CNPE 18472, 18448, 18449, 18451, 18663, 18682, 18967, 19021, 19641. Localidades: IXC, PRC, SPB, DNT, LAG, CHJ, TZE, MNZ, JOS, LCT, LCJ. Endémica. DD (UICN). Referencia: Thacker et al. (2006).
Orden Mugiliformes
Familia Mugilidae Jarocki, 1822
Mugil curema (Valenciennes, 1836)
CNPE 18581. Localidad: TZE. Nativa. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Agonostomus monticola (Bancroft, 1834)
Localidades: IXC, PRC, LCT, JOS, LAG, MNZ, TZE. Nativa. Referencias: Lozano-Vilano et al. (2007), Velázquez-Velázquez et al. (2016), Espinosa-Pérez et al. (2019).
Joturus pichardi Poey, 1860
Localidades: no determinadas. Nativa. Referencias: Velázquez-Velázquez et al. (2016), Soria-Barreto et al. (2018).
Orden Cichliformes
Familia Cichlidae Bonaparte, 1835
Subfamilia Pseudocrenilabrinae Fowler, 1934
Oreochromis aureus (Steindachner, 1864)
CNPE 19031, 19657, 20279, 21090. Localidades: IXC, CHJ, SPB, LCT, TZE HUM. Introducida. Referencia: Espinosa-Pérez et al. (2019).
Oreochromis mossambicus (Peters, 1852)
CNPE 18480. Localidad: PRC. Introducida. Referencia: Espinosa-Pérez et al. (2019).
Oreochromis niloticus (Linnaeus, 1758)
Localidades: no determinadas. Introducida. LC (UICN). Referencias: Velázquez-Velázquez et al. (2016), Soria-Barreto et al. (2018), Espinosa-Pérez et al. (2019).
Subfamilia Cichlinae Bonaparte, 1835
Trichromis salvini (Günther, 1862)
CNPE 21248, 22348, 22356, 22372, 22436. Localidades: PRC, SPB, MIR, CHJ, LAG, MNZ, HUM. Nativa. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Maskaheros argenteus (Allgayer, 1991)
CNPE 19044, 19583, 20493. Localidades: IXC, HUM. Nativa. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Mayaheros urophthalmus (Günther, 1862)
CNPE 21134, 21105, 21147. Localidades: PRC, LAG, LCT, TZE, HUM. Nativa. LC (UICN). Referencia: Allgayer (1991).
Vieja bifasciata (Steindachner, 1864)
Localidades: IXC, LCT, HUM. Nativa. DD (UICN). Referencia: Espinosa-Pérez et al. (2019).
Vieja melanurus (Hubbs, 1935)
CNPE 18479, 18580, 20314, 20333, 21110, 20127. Localidades: IXC, PRC, LAG, LCJ, LCT, TZE, HUM. Nativa. Referencia: Espinosa-Pérez et al. (2019).
Petenia splendida (Günther, 1862)
CNPE 18478, 18503, 18532, 19010, 19038, 19599, 19671, 20310, 20460, 21122, 21096. Localidades: IXC, PRC, MIR, SPB, MNZ, LAG, CHJ, LCT, TZE, LCJ, HUM. Nativa. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Rocio octofasciata (Regan, 1903)
CNPE 20261, 19662, 20335, 20903. Localidades: JOS, MNZ, HUM. Nativa. LC (UICN). Referencia: Velázquez-Velázquez et al. (2016).
Chuco intermedium (Günther, 1862)
CNPE 21100, 21087, 22349, 22364, 22369, 22378, 22390, 22463. Localidades: IXC, CHJ, MNZ, SPB, PRC, JOS, LAG, LCT, TZE. Nativa. LC (UICN). Referencia: Soria-Barreto et al. (2018).
Rheoheros lentiginosus (Günther, 1862)
CNPE 18497, 18543, 18574, 18700, 18995, 19651, 22464. Localidades: IXC, CHJ, JOS, LAG, LCT, MIR, TZE. Nativa. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Theraps irregularis (Günther, 1862)
CNPE 18539, 18545, 18573, 21076, 22370. Localidades: IXC, CHJ, LAG, DNT, PRC, LCT, TZE. Nativa. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Wajpamheros nourissati (Allgayer, 1989)
CNPE 18524, 18652, 18660, 18991, 19026, 19043, 19617, 19667, 20329. Localidades: PRC, SPB, CHJ, LAG, MNZ, TZE, LCT, LCJ, HUM. Nativa. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Cincelichthys pearsei (Hubbs, 1936)
CNPE 18510. Localidades: LAG, CHJ, LCT, MNZ, TZE, HUM. Nativa. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Kihnichthys ufermanni (Allgayer, 2002)
CNPE 18525, 18531, 18540, 21106. Localidades: PRC, SPB, CHJ, LCT. Endémica. DD (UICN). Referencia: Espinosa-Pérez et al. (2019).
Oscura heterospila (Hubbs, 1936)
Localidad: TZE. Nativa. DD (UICN). Referencia: Soria-Barreto et al. (2018).
Parachromis managuensis (Günther, 1867)
CNPE 18544, 18591. Localidades: LAG, LCT. Introducida. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Parachromis multifasciatus (Heckel, 1840)
Localidades: LAG, LCT, MNZ, TZE. Nativa. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Thorichthys helleri (Steindachner, 1864)
CNPE 18475, 18487, 18492, 18509, 18515, 18668, 18691, 19029, 19039, 19622, 19672, 21112, 21103. Localidades: IXC, PRC, SPB, CHJ, LAG, JOS, MIR, MNZ, DNT, TZE, LCT, LCJ, HUM. Nativa. DD (UICN). Referencia: Espinosa-Pérez et al. (2019).
Thorichthys maculipinnis (Steindachner, 1864)
CNPE 20767. Localidad: HUM. Nativa. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Thorichthys meeki (Brind, 1918)
CNPE 20336, 20932, 21153. Localidad: HUM. Nativa. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Thorichthys pasionis (Rivas, 1962)
CNPE 20937, 21078. Localidad: HUM. Nativa. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Thorichthys socolofi (Miller y Taylor, 1984)
CNPE 20337. Localidad: HUM. Endémica. A (NOM-059), DD (UICN). Referencia: Espinosa-Pérez et al. (2019).
Orden Atheriniformes
Familia Atherinopsidae Fitzinger, 1873
Atherinella alvarezi (Díaz-Pardo, 1972)
CNPE 18471, 18474, 18486, 18493, 18499, 18504, 18561, 18567, 18578, 19640, 19675, 20919. Localidades: IXC, PRC, SPB, CHJ, MIR, LAG, MNZ, JOS, TZE, LCT, LCJ, HUM. Nativa. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Atherinella schultzi (Álvarez y Carranza, 1952)
Localidades: IXC, PRC, SPB, MIR, JOS, LAG, MNZ, LCT, TZE. Nativa. DD (UICN). Referencia: Espinosa-Pérez et al. (2019).
Orden Beloniformes
Familia Hemiramphidae Gill, 1859
Hyporhamphus mexicanus (Álvarez, 1959)
CNPE 20316, 22386, 22387. Localidades: LAG, LCT, TZE. Nativa. DD (UICN). Referencia: Espinosa-Pérez et al. (2019).
Familia Belonidae Bonaparte, 1835
Strongylura hubbsi (Collette, 1974)
CNPE 18485, 19020, 19035, 19594, 19626, 20886, 20845, 20925, 21077, 21084. Localidades: IXC, PRC, SPB, JOS, MNZ, TZE, MIR, LAG, CHJ, LCT, LCJ, HUM. Endémica. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Orden Cyprinodontiformes
Familia Cynolebiidae Hoedeman, 1961
Cynodonichthys tenuis (Meek, 1904)
CNPE 18966, 19006, 19015, 20856. Localidades: IXC, PRC, DNT, MNZ, LAG, CHJ. Nativa. DD (UICN). Referencia: Espinosa-Pérez et al. (2019).
Familia Poeciliidae Bonaparte, 1831
Belonesox belizanus (Kner, 1860)
CNPE 18547, 18649, 18665, 19024, 19040, 19621, 19650, 19670. Localidades: LAG, MIR, SPB, PRC, MNZ, TZE, LCT, JOS, HUM. Nativa. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Carlhubbsia kidderi (Hubbs, 1936)
Localidad: HUM. Nativa. DD (UICN). Referencia: Salgado-Maldonado et al. (2011b).
Gambusia sexradiata (Hubbs, 1936)
CNPE 18648, 18667, 18674, 18697, 19620, 19676, 19668, 19977, 20917, 20868. Localidades: PRC, MIR, LAG, TZE, JOS, CHJ, LCT, MNZ, LCJ, HUM. Nativa. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Pseudoxiphophorus bimaculatus (Heckel, 1848)
CNPE 18489, 18513, 18517, 18518, 18555, 19012, 19032. Localidades: IXC, PRC, SPB, DNT, JOS, MIR, LAG, MNZ, TZE. Nativa. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Phallichthys fairweatheri (Rosen y Bailey, 1959)
CNPE 19663, 19669. Localidades: JOS, MNZ, TZE, HUM. Nativa. DD (UICN). Referencia: Espinosa-Pérez et al. (2019).
Poecilia kykesis (Poeser, 2002)
CNPE 20926, 21102, 21150. Localidad: HUM. Nativa. LC (UICN). Referencia: Poeser (2002).
Poecilia mexicana (Steindachner, 1863)
CNPE-IBUNAM 18470, 18481, 18490, 18495, 18502, 18512, 18514, 18556, 18577, 18690, 19634, 19665, 19984, 20921. Localidades: IXC, PRC, SPB, CHJ, MIR, DNT, JOS, LAG, TZE, MNZ, LCT, LCJ, HUM. Nativa. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Poecilia sphenops (Valenciennes, 1846)
CNPE 20473. Localidades: IXC, CHJ, SPB, LCT, LAG, MNZ, PRC, TZE. Nativa. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Poeciliopsis sp.
Localidades: IXC, SPB. Nativa. Referencia: Soria-Barreto et al. (2018).
Xenodexia ctenolepis (Hubbs, 1950)
CNPE 18491, 18496, 18520, 19001, 19990. Localidades: IXC, SPB, PRC, CHJ, LAG, JOS. Endémica. DD (UICN). Referencia: Espinosa-Pérez et al. (2019).
Xiphophorus alvarezi Rosen, 1960
CNPE 22381, 22406, 22434, 22460. Localidades: DNT, PRC, SPB, JOS. Nativa. LC (UICN). Referencia: Soria-Barreto et al. (2018).
Xiphophorus hellerii (Heckel, 1848)
CNPE 18511, 18516, 18647, 21101, 22446. Localidades: IXC, PRC, DNT, SPB, JOS, LAG, MNZ, CHJ, MIR, TZE. Nativa. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Xiphophorus maculatus (Günther, 1866)
CNPE 18985, 19573, 19950, 19956, 20935. Localidades: LAG, JOS, MNZ, TZE, HUM. Nativa. DD (UICN). Referencia: Espinosa-Pérez et al. (2019).
Orden Synbranchiformes
Familia Synbranchidae Bonaparte, 1835
Ophisternon aenigmaticum (Rosen y Greenwood, 1976)
CNPE 18970, 18988, 18982, 19638, 19964, 20912, 21136. Localidades: IXC, PRC, SPB, LAG, LCT, CHJ, DNT, JOS, LCJ, MNZ, TZE, HUM. Nativa. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Orden Perciformes
Familia Centropomidae Poey, 1867
Centropomus undecimalis (Bloch, 1792)
CNPE 19022. Localidades: MNZ, LCT. Nativa. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Centropomus parallelus (Poey, 1860)
Localidades: no determinadas. Nativa. LC (UICN). Referencias: Velázquez-Velázquez et al. (2016), Espinosa-Pérez et al. (2019).
Familia Gerreidae Bleeker, 1859
Eugerres mexicanus (Steindachner, 1863)
CNPE 18550, 18579, 18662, 19645, 20438. Localidades: IXC, PRC, SPB, LAG, MIR, CHJ, LCT, TZE, LCJ. Endémica. LC (UICN). Referencia: Espinosa-Pérez et al. (2019).
Eugerres castroaguirrei (González Acosta y Rodiles Hernández, 2013)
Vida Libre, Localidad: LCT. Nativa. Referencia: Espinosa-Pérez et al. (2019).
Orden Acanthuriformes
Familia Sciaenidae Cuvier, 1829
Aplodinotus grunniens (Rafinesque, 1819)
Localidad: DNT. Nativa. LC (UICN). Referencias: Lozano-Vilano et al. (2007), Velázquez-Velázquez et al. (2016).
Superclase Tetrapoda
Clase Amphibia
Orden Anura
Familia Bufonidae Gray, 1825
Incilius campbelli (Mendelson, 1994)
Localidades: CHJ, TZE. Nativa. NT (UICN). Referencia: Ramírez et al. (2015).
Rhinella marina Linnaeus, 1758
Localidad: CHJ. Nativa. LC (UICN). Referencia: Ramírez et al. (2015).
Familia Hylidae
Agalychnis callidryas (Cope, 1862)
Localidades: CHJ, TZE. Nativa. LC (UICN). Referencia: Ramírez et al. (2015).
Dendropsophus ebraccatus (Cope, 1874)
Localidades: CHJ, TZE. Nativa. LC (UICN). Referencia: Ramírez et al. (2015).
Dendrosophus microcephalus (Cope, 1886)
Localidad: CHJ. Nativa. LC (UICN). Referencia: Ramírez et al. (2015).
Smilisca baudinii Duméril y Bibron, 1841
Localidades: CHJ, TZE. Nativa. LC (UICN). Referencia: Ramírez et al. (2015).
Tlalocohyla picta (Günther, 1901)
Localidad: CHJ. Nativa. LC (UICN). Referencia: Ramírez et al. (2015).
Trachycephalus typhonius (Linnaeus, 1758)
Localidades: CHJ, TZE. Nativa. LC (UICN). Referencia: Ramírez et al. (2015).
Familia Ranidae Rafinesque, 1814
Lithobates vaillanti (Brocchi, 1877)
Localidad: TZE. Nativa. LC (UICN). Referencia: Ramírez et al. (2015).
Familia Rhinophrynidae Günther, 1859
Rhinophrynus dorsalis Duméril y Bibron, 1841
Localidades: CHJ, TZE. Nativa. Pr (NOM-059), LC (UICN).
Referencia: Ramírez et al. (2015).
Clase Sauropsida
Orden Testudines
Familia Dermatemydidae Gray, 1870
Dermatemys mawii Gray, 1847
Localidad: TZE. Nativa. P (NOM-059), CR (UICN). Referencia: Ramírez et al. (2015).
Orden Crocodilia
Familia Crocodylidae Cuvier, 1807
Crocodylus moreletii Duméril y Bibron, 1851
Localidad: LCT. Nativa. Pr (NOM-059), LC (UICN). Referencia: Ramírez et al. (2015).
Referencias
Alcocer, J. (Ed.). (2019). Lago Alchichica una joya de biodiversidad. México D.F.: Universidad Nacional Autónoma de México, Facultad de Estudios Superiores Iztacala/ Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Alcocer-Durand, J. y Bernal-Brooks, F. W. (2009). Investigación ecológica a largo plazo en cuerpos acuáticos epicontinentales. Revista Digital Universitaria, 10, 1–14.
Allgayer, R. (1991). Vieja argentea (Pisces, Teleostei, Cichlidae) Une espèce nouvelle d’Amérique centrale. Revue Française des Cichlidophiles, 114, 2–15.
Álvarez, F. y Ojeda, M. (Eds.). (2019a). Animal diversity and biogeography of the Cuatro Ciénegas Basin. Cham, Switzerland: Springer Nature Switzerland. https://doi.org/10.1007/978-3-030-11262-2
Álvarez, F. y Ojeda, M. (2019b). Chapter 1. The fauna of the Cuatro Ciénegas Basin, a unique assemblage of species, habitats, and evolutionary hiistories. En F. Álvarez y M. Ojeda (Eds.), Animal diversity and biogeography of the Cuatro Ciénegas Basin (pp. 1–10). Cham, Switzerland: Springer Nature Switzerland. https://doi.org/10.1007/978-3-030-11262-2_1
Álvarez, F., Torres, E. y Villalobos, J. L. (2021). New species of crayfish of the genus Procambarus, and notes on Procambarus pilosimanus (Decapoda: Cambaridae) from Chiapas, Mexico. Revista Mexicana de Biodiversidad, 92, e923833. https://doi.org/10.22201/ib.20078706e.2021.92.3833
Álvarez, F. y Villalobos, J. L. (1998). Six new species of fresh-water crabs (Brachyura: Pseudothelphusidae) from Chiapas, Mexico. Journal of Crustacean Biology, 18, 187–198.
Álvarez, F., Villalobos, J. L., Elías-Gutiérrez, M. y Rivera, G. (2011). Crustáceos dulceacuícolas y terrestres de Chiapas. En F. Alvarez (Ed.), Chiapas: estudios sobre su diversidad biológica. México D.F.: Instituto de Biología, Universidad Nacional Autónoma de México/ Litográfica Dorantes, S.A. de C.V.
Álvarez-Porebsky, P., Hernández-Garciadiego, L., Gómez-Ruiz, H. y Ramírez-Martínez, C. (2015). 4.2 Calidad del agua en la subcuenca del río Lacantún. En J. Carabias, J. De la Maza y R. Cadena (Coords.), Conservación y desarrollo sustentable en la Selva Lacandona. 25 años de actividades y experiencias (pp. 261–273). México D.F.: Natura/ Ecosistemas Mexicanos.
Arévalo-de la Cruz, J. A., Rangel-Ruiz, L. J., Gamboa-Aguilar, J., Montiel-Moreno, J., Arias-García, S., García-Morales, M. et al. (2015). Estructura de tallas de la almeja Psoronaias crocodilorum en la Reserva de la Biosfera Pantanos de Centla, México. Hidrobiológica, 25, 86–94.
Barba-Macías, E. y Trinidad-Ocaña, C. (2017). Nuevos registros de la almeja asiática invasora Corbicula fluminea (Bivalvia: Veneroida: Cyrenidae) en humedales de las cuencas Papaloapan, Grijalva y Usumacinta. Revista Mexicana de Biodiversidad, 88, 450–453. http://dx.doi.org/10.1016/j.rmb.2016.10.021
Barbosa-dos Santos, S. (2003). Estado atual do conhecimento dos ancilídeos na América do Sul (Mollusca: Gastropoda: Pulmonata: Basommatophora). Revista de Biología Tropical, 51 (Suppl. 3), 191–224.
Barrientos, C., Quintana, Y., Elías, D. J. y Rodiles-Hernández, R. (2018). Peces nativos y pesca artesanal en la cuencaUsumacinta, Guatemala. Revista Mexicana de Biodiversidad, 89 (Supl.), S118–S130. https://doi.org/10.22201/ib.20078706e.2018.4.2180
Basanta, D. M., Byrne, A. Q., Rosenblum, E. B., Povia-Scott, J. y Parra-Olea, G. (2021). Early presence of Batrachochytrium dendrobatidis in Mexico with a contemporary dominance of the global panzootic lineage. Molecular Ecology, 30, 424–437. https://doi.org/10.1111/mec.15733
Bequaert, J. C. (1957). Land and freshwater mollusks of the Selva Lacandona, Chiapas, Mexico. Bulletin: Museum of Comparative Zoology, Harvard, 116, 204–227.
Bequaert, J. C. y Clench, W. J. (1936). A second contribution to the molluscan fauna of Yucatan. Publications of the Carnegie Institution of Washington, 457, 61–75.
Betancur, R. R. y Willink, P. W. (2007). A new freshwater ariid (Otophysi: Siluriformes) from the Río Usumacinta Basin. Copeia, 2007, 818–828.
Carabias, J., de La Maza, J. y Cadena, R. (2015). Conservación y desarrollo sustentable en la Selva Lacandona. México D.F.: Natura y Ecosistemas Mexicanos.
Caspeta-Mandujano, J. M. (2010). Nemátodos parásitos de peces de agua dulce. México D.F.: AGT-Editor.
Caspeta-Mandujano, J. M., Salinas-Ocampo, J. C., Suárez-Rodríguez, R., Martínez-Ramírez, C. y Matamoros, W. A. (2021). Morphological and molecular evidence for a new rhabdochonid species, Rhabdochona (Nematoda: Rhabdochonidae), parasitizing Eugerres mexicanus (Perciformes: Gerreidae), from the Lacantún River in the Biosphere Reserve of Montes Azules, Chiapas, Mexico. Revista Mexicana de Biodiversidad, 92, e923266. https://doi.org/10.22201/ib.20078706e.2021.92.3266
Castillo, M. M., Barba-Álvarez, R. y Mayorga, A. (2018). Riqueza y diversidad de insectos acuáticos en la cuenca del río Usumacinta en México. Revista Mexicana de Biodiversidad, 89 (Supl.), S45–S64. https://doi.org/10.22201/ib.20078706e.2018.4.2177
Contreras-Arquieta, A., Guajardo-Martínez, G. y Contreras-Balderas, S. (1995). Descripción de caracol exógeno Thiara (Melanoides) tuberculata (Müller, 1774) (Gastropoda: Thiaridae) y su distribución en México. Publicaciones Biológicas–FCB/UANL, 81, 1–16.
Cowie, R. H. y Thiengo, S. C. (2003). The apple snails of the Americas (Mollusc: Gastropoda: Ampullariidae: Asolene, Filipponea, Marisa, Pomacea, Pomella): a nomenclatural and type catalog. Malacologia, 45, 41–100.
Czaja, A., Meza-Sánchez, I. G., Estrada-Rodríguez, J. L., Romero-Méndez, U., Sáenz-Mata, J., Ávila-Rodríguez, V. et al. (2020). The freshwater snails (Mollusca: Gastropoda) of Mexico: updated checklist, endemicity hotspots, threats and conservation status. Revista Mexicana de Biodiversidad, 91, e912909. https://doi.org/10.22201/ib.20078706e.2020.91.2909
Dechruksa, W., Duangduen, K., Ukong, S., Inkapatanakul, W. y Koonchornboon, T. (2007). Trematode infections of the freshwater snail family Thiaridae in the Khek river, Thailand. Southeast Asian Journal of Tropical Medical and Public Health, 38, 1016–1028.
Espinosa-Pérez, H. (2014). Biodiversidad de peces en México. Revista Mexicana de Biodiversidad, 85 (Supl.), S450–S459. https://doi.org.10.7550/rmb.32264
Espinosa-Pérez, H., Ramírez-Martínez, C., Martínez-Castro, A. y Lambarri-Martínez, C. (2019). Los peces del río Lacantún. Monterrey: Universidad Autónoma de Nuevo León/ Natura/ Ecosistemas Mexicanos A.C.
Gaitán, C. A., Fuentes-Montejo, C. E., García, M. J. y Romero-Guevara, J. C. (2020). An update of the invasive Pterygoplichthys Gill, 1858 (Actinopterygii, Loricariidae) in Guatemala: new records and notes on its interactions with the local fauna. Neotropical Biology and Conservation, 15, 285–300. https://doi.org/10.3897/neotropical.15.e53020
González-Contreras, C. G., Alcocer, J. y Oseguera, L. A. (2015). Clorofila a fitoplanctónica en el lago tropical Alchichica: un registro de largo plazo (1999-2010). Hidrobiológica, 25, 347–356.
Goodrich, C. y van der Schalie, H. (1937). Mollusca of Petén and north Alta Vera Paz, Guatemala. University of Michigan Museum of Zoology Miscellaneous Publications, 34, 1–50.
Gosz, J. R. (1996). International long-term ecological research: priorities and opportunities. Trends in Ecology and Evolution, 11, 444. https://doi.org/10.1016/0169-5347(96)20090-4
Graf, D. L. y Cummings, K. S. (2007a). Review of the systematics and global diversity of freshwater mussel species (Bivalvia: Unionoida). Journal of Molluscan Studies, 73, 291–314.
Graf, D. L. y Cummings, K. S. (2007b). The freshwater mussels (Unionoida) of the World (and other less consequential bivalves). MUSSEL Project Web Site, Recuperado el 12 de abril de 2021de http://www.mussel-project.net/
Graf, D. L. y Cummings, K. S. (2021). A ‘big data’ approach to global freshwater mussel diversity (Bivalvia: Unionoida), with an updated checklist of genera and species. Journal of Molluscan Studies, 87, 1–36. https://doi.org/10.1093/mollus/eyaa034
Haase, P., Tonkin, J. D., Stoll, S., Burkhard, B., Frenzel, M. y Geijzendorffer, I. R. (2018). The next generation of site-based long-term ecological monitoring: Linking essential biodiversity variables and ecosystem integrity. Science of The Total Environment, 613-614, 1376–1384. https://doi.org/10.1016/j.scitotenv.2017.08.111
Hernández-Mena, D. I., Lynggaard, C., Mendoza-Garfías, B. y Pérez-Ponce de León, G. (2016). A new species of Auriculostoma (Trematoda: Allocreadiidae) from the intestine of Brycon guatemalensis (Characiformes; Bryconidae) from the Usumacinta River Basin, Mexico, based on morphology and 28S rDNA sequences, with a key to species of the genus. Zootaxa, 4196, 261–277. https://doi.org/10.11646/zootaxa.4196.2.5
Jiménez-García, M. I., Vidal-Martínez, V. M. y López-Jiménez, S. (2001). Monogeneans in Introduced and Native Cichlids in México: Evidence for Transfer. Journal of Parasitology, 87, 907–909. http://dx.doi.org/10.1645/0022-3395(2001)087[0907:MIIANC]2.0.CO;2
Krabbenhoft, T. J., Platania, S. P. y Turner, T. F. (2014). Interannual variation in reproductive phenology in a riverine fish assemblage: implications for predicting the effects of climate change and altered flow regimes. Freshwater Biology, 59, 1744–1754. https://doi.org/10.1111/fwb.12379
Kritsky, D. C., Mendoza-Franco, E. F. y Scholz, T. (2000). Neotropical Monogenoidea. 36. Dactylogyrids from the gills of Rhamdia guatemalensis (Siluriformes: Pimelodidae) from cenotes of the Yucatan Peninsula, Mexico, with proposal of Ameloblastella gen. n. and Aphanoblastella gen. n. (Dactylogyridae: Ancyrocephalinae). Comparative Parasitology, 67, 76–84.
Kuchta, R., Choudhury, A. y Scholz, T. (2018). Asian fish tapeworm: the most successful invasive parasite in freshwaters. Trends in Parasitology, 34, 511–523. https://doi.org/10.1016/j.pt.2018.03.001
Lamothe-Argumedo, R. y Pineda-López, R. (1990). Dos géneros y especies nuevos de Tremátodos (Cryptogonomidae) parásitos de peces de agua dulce de Tabasco, México. Universidad y Ciencia, 7, 5–13.
Lamothe-Argumedo, R., Salgado-Maldonado, G. y Pineda-López, R. (1997). Campechetrema herrerai n. gen., n. sp. (Trematoda: Cryptogonimidae) from the intestine of Petenia splendida (Pisces: Cichlidae) from Campeche, Mexico. The Journal of Parasitology, 83, 137–139. https://doi.org/10.2307/3284331
Lindeman, P. V. (2006). Diet of the Texas map turtle (Graptemys versa): relationship to sexually dimorphic trophic morphology and changes over five decades as influenced by an invasive mollusk. Chelonian Conservation and Biology, 5, 25–31.
Lozano-Vilano, M. L., García-Ramírez, M. E., Contreras-Balderas, S. y Ramírez-Martínez, C. (2007). Diversity and conservation status of the ichthyofauna of the Río Lacantún basin in the Biosphere Reserve Montes Azules, Chiapas, Mexico. Zootaxa, 1410, 43–53. https://doi.org/10.11646/zootaxa.1410.1.2
Marshall, W. B. (1920). New freshwater shells from Guatemala. Proceedings of the United States National Museum, 58, 301–302.
Martínez-Meyer, E., Sosa-Escalante, J. E. y Álvarez, F. (2014). El estudio de la biodiversidad en México: ¿una ruta con dirección? Revista Mexicana de Biodiversidad, 85 (Supl.), S1–S9. https://doi.org/10.7550/rmb.43248
Mejía-Ortiz, L. M. y Álvarez, F. (2010). Seasonal patterns in the distribution of three species of freshwater shrimp, Macrobrachium spp., along an altitudinal river gradient. Crustaceana, 83, 385–397. https://doi.org/10.1163/001121610X489368
Mendoza-Carranza, M., Arévalo-Frías, W., Espinoza-Tenorio, A., Hernández-Lazo, C. C., Álvarez-Merino, A. M. y Rodiles-Hernández, R. (2018). La importancia y diversidad de los recursos pesqueros del río Usumacinta, México. Revista Mexicana de Biodiversidad, 89 (Supl.), S131–S146. http://dx.doi.org/10.22201/ib.20078706e.2018.0.2182
Mendoza-Franco, E. F., Caspeta-Mandujano, J. M. y Ramírez-Martínez, C. (2018). New species of Paracolpenteron n. gen. and Ancyrocephalus (Monogenea, Dactylogyridae) inhabiting the urinary bladder and gills of the Maya needlefish Strongylura hubbsi (Beloniformes, Belonidae) from Chiapas, Mexico. Parasite, 25, 55. https://doi.org/10.1051/parasite/2018053
Mendoza-Franco, E. F., Caspeta-Mandujano, J. M. y Ramírez-Martínez, C. (2019). Diaphorocleidus machacae n. sp. (Monogenea) infecting the gill lamellae of Brycon guatemalensis (Characiformes: Bryconidae) from the Rio Lacantún Basin in Chiapas, Mexico. Acta Parasitologica, 64, 51–56. https://doi.org/10.2478/s11686-018-00007-7
Mendoza-Franco, E. F., Caspeta-Mandujano, J. M. y Salgado-Maldonado, G. (2012). Primer reporte de Heteropriapulus sp. (Platelmintos, Monogenoidea) infectando al pez diablo Pterygoplichthys pardalis (Siluriformes, Loricariidae) introducido en la cuenca del Río Lacantún de la Reserva de la Biosfera Montes Azules, Chiapas, México. Jaina, Universidad Autónoma de Campeche, 23, 1–6.
Mendoza-Franco, E. F., Caspeta-Mandujano, J. M. y Salgado-Maldonado, G. (2013). New species of Cacatuocotyle (Monogenoidea, Dactylogyridae) parasitizing the anus and the gill lamellae of Astyanax aeneus (Pisces, Ostariophysi: Characidae) from the Rio Lacantún basin in the Biosphere Reserve of Montes Azules, Chiapas, Mexico. Parasitology Research, 112, 199–205. https://doi.org/10.1007/s00436-012-3126-0
Mendoza-Franco, E. F., Caspeta-Mandujano, J. M., Salgado-Maldonado, G. y Matamoros W. A. (2015). Two new species of Urocleidoides Mizelle et Price, 1964 (Monogenoidea) from the gill lamellae of profundulids and poeciliids from Central America and southern Mexico. Folia Parasitologica, 62, 059. https://doi.org/10.14411/fp.2015.059
Mendoza-Franco, E. F., Tapia, M. y Caspeta-Mandujano, J. M. (2015). Two new species of Aristocleidus (Monogenea) from the gills of the Mexican mojarra Eugerres mexicanus (Perciformes, Gerreidae) from southwestern Mexico. Parasite, 22, 33. https://doi.org/10.1051/parasite/2015033
Mendoza-Franco, E. F. y Vidal-Martínez, V. M. (2001). Salsuginus neotropicalis n. sp. (Monogenea: Ancyrocephalinae) from the pike killifish Belonesox belizanus (Atheriniformes: Poeciliidae) from southeastern Mexico. Systematic Parasitology, 48, 41–45.
Mercado-Silva, N., Ornelas-García, C. P., Gidmark, N. J., Simons, A. M. y Schmitter-Soto, J. J. (2020). Characidae: Characins. En B. M. Burr y M. L. Warren Jr. (Eds.), Diversity of North American freshwater fishes: Natural History, Ecology & Conservation (pp. 1–22). Baltimore, Maryland: The Johns Hopkins University Press.
Miller, R. R. (1984). Rhamdia reddelli, n. sp. the first blind pimelodid catfish from Middle America, with a key to the Mexican species. Transactions of the San Diego Society of Natural History, 20, 135–143.
Miller, R. R., Minckley, W. L. y Norris, S. R. (2009). Peces dulceacuícolas de México. México D.F.: Comisión Nacional para el Uso y Conocimiento de la Biodiversidad.
Mittermeier, R. A., Robles, G. P. y Mittermeier, C. G. (1997). Megadiversity: Earth’s biologically wealthiest nations. México D.F.: CEMEX.
Morales-Hernández, R. y Rodiles-Hernández, R. (2000). Implicaciones de Ctenopharyngodon idella en la comunidad de peces del río Lacanjá, Chiapas. Hidrobiológica, 10, 13–24.
Moravec, F., Salgado-Maldonado, G. y Aguilar-Aguilar, R. (2002). Two new nematodes, Paraseuratoides ophisterni gen. et sp. n. (Quimperiidae) and Philometra ophisterni sp. n. (Philometridae), from the swamp-eel Ophisternon aenigmaticum in Mexico. Folia Parasitologica, 49, 109–117. https://doi.org/10.14411/fp.2002.021
Morelet, A. (1849). Testacea Novissima, Insulae Cubanae et Americae Centralis. Chez J. B. Baillière, Librairie de L’Académie Nationale de Médicine, Paris.
Morelet, A. (1851). Testacea Novissima, Insulae Cubanae et Americae Centralis. Pars II. Chez J. B. Baillière, Librairie de L’Académie Nationale de Médicine, Paris.
Morrison, J. P. E. (1946). The nonmarine mollusks of San José Island, with notes on those of Pedro González Island, Pearl Islands, Panamá. Smithsonian Miscellaneous Collections, 106, 1–49.
Morrone, J. J. (2019). Regionalización biogeográfica y evolución biótica de México: encrucijada de la biodiversidad del Nuevo Mundo. Revista Mexicana de Biodiversidad, 90, e902980. https://doi.org/10.22201/ib.20078706e.2019.90.2980
Mussel Project. Recuperado el 12 de abril de 2021 de: http://www.mussel-project.net/
Naranjo-García, E. y Castillo-Rodríguez, Z. G. (2017). First inventory of the introduced and invasive mollusks in Mexico. The Nautilus, 131, 107–126.
Naranjo-García, E. y Olivera-Carrasco, M. T. (2014). Moluscos dulceacuícolas introducidos e invasores. En R. Mendoza y P. Koleff (Coords.), Especies acuáticas invasoras en México. México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad
Núñez, J. M. y Meli, P. (2015). Dinámica hidrológica de la subcuenca del río Lacantún. En J. Carabias, J. De la Maza y R. Cadena (Coords.), Conservación y desarrollo sustentable en la Selva Lacandona. 25 años de actividades y experiencias. México D.F.: Natura y Ecosistemas Mexicanos.
Ortega, L., Celentan, E., Delgado, E. y Defeo, O. (2016). Climate change influences on abundance, individual size and body abnormalities in a sandy beach clam. Marine Ecology Progress Series, 545, 203–213. https://doi.org/10.3354/meps11643
Ortiz-Lezama, O. M., Rangel-Ruiz, L. J. y Gamboa-Aguilar, J. (2009). Diversidad de moluscos bentónicos en la Reserva de la Biosfera Pantanos de Centla. Kuxulkab’. Revista de Divulgación, División Académica de Ciencias Biológicas, 15, 29–36.
Pace, G. L. (1973). The freshwater snails of Taiwan (Formosa). Malacological Review, 6, 1–117.
Paraense, W. L. (2000). A bird’s eye view of Central American planorbid Mollusca. Malacological Review, 33/34, 1–22.
Pfeiffer, J. P., Sharpe, A. E., Johnson, N. A., Emery, K. F. y Page, L. M. (2018). Molecular phylogeny of the Nearctic and Mesoamerican freshwater mussel genus Megalonaias. Hydrobiologia, 811, 139–151.
Poeser, F. N. (2002). Poecilia kykesis nom. nov., a new name for Mollienesia petenensis Günther, 1866, and redescription, revalidation and the designation of a lectotype for Poecilia petenensis Günther, 1866 (Teleostei: Poeciliidae). Contributions to Zoology, 70, 243–246.
Quiroz-Martínez, B. y Salgado-Maldonado, G. (2013a). Patterns of distribution of the helminth parasites of freshwater fishes of Mexico. Plos One, 8, e54787. https://doi.org/10.1371/journal.pone.0054787
Quiroz-Martínez, B. y Salgado-Maldonado, G. (2013b). Taxonomic distinctness and richness of helminth parasite assemblages of freshwater fishes in Mexican hydrological basins. Plos One, 8, e74419. https://doi.org/10.1371/journal.pone.0074419
Ramírez, A., León-Pérez, R. y Noriega, D. (2015). 2.8 Anfibios y reptiles de la subcuenca del Lacantún. En J. Carabias, J. De la Maza y R. Cadena, R. (Coords.), Conservación y desarrollo sustentable en la Selva Lacandona. 25 años de actividades y experiencias. México D.F.: Natura/ Ecosistemas Mexicanos.
Ramírez-Martínez, C., Naranjo, E., Caspeta, J. M., Espinosa-Pérez, H. y Barba, R. (2015). Ecosistemas acuáticos. En J. Carabias, J. De la Maza y R. Cadena (Coords.), Conservación y desarrollo sustentable en la Selva Lacandona. 25 años de actividades y experiencias. México D.F.: Natura/ Ecosistemas Mexicanos.
Rangel-Ruiz, L. J. y Gamboa-Aguilar, J. (2000). Gasterópodos epicontinentales de la Reserva de la Biosfera Pantanos de Centla, Tabasco. Universidad y Ciencia, 15, 129–140.
Rangel-Ruiz, L. J., Gamboa-Aguilar, J., García-Morales, M. y Ortiz-Lezama, O. M. (2011). Tarebia granifera (Lamarck, 1822) en la región hidrológica Grijalva-Usumacinta en Tabasco, México. Acta Zoológica Mexicana, 27, 103–114. https://doi.org/10.21829/azm.2011.271737
Razo-Mendivil, U., Pérez-Ponce de León, G. y Rubio-Godoy, M. (2013). Integrative taxonomy identifies a new species of Phyllodistomum (Digenea: Gorgoderidae) from the twospot livebearer, Heterandria bimaculata (Teleostei: Poeciliidae), in Central Veracruz, Mexico. Parasitology Research, 112, 4137–4150. https://doi.org/10.1007/s00436-013-3605-y
Reynoso, V. H., Coates, R. I. y Vázquez-Cruz, M. L. (2017). Avances y perspectivas en la investigación de los bosques tropicales y sus alrededores: la región de Los Tuxtlas. Ciudad de México: Instituto de Biología, Universidad Nacional Autónoma de México.
Rodiles-Hernández, R., Hendrickson, D. A., Lundberg, J. G. y Humphries, J. M. (2005). Lacantunia enigmatica (Teleostei: Siluriformes) a new and phylogenetically puzzling freshwater fish from Mesoamerica. Zootaxa, 1000, 1–24. https://doi.org/10.11646/zootaxa.1000.1.1
Rodiles-Hernández, R., Lundberg, J. G. y Sullivan, J. P. (2010). Taxonomic discrimination and identification of extant blue catfishes (Siluriformes: Ictaluridae: Ictalurus furcatus Group). Proceedings of the Academy of Natural Sciences of Philadelphia, 159, 67–82. https://doi.org/10.1635/053.159.0105
Román, R., Ortega, A. L. y Mejía, L. M. (2000). Macrobrachium vicconi, new species, a fresh-water shrimp from a rain forest in southeast Mexico, and comparison with congeners (Decapoda: Palaemonidae). Journal of Crustacean Biology, 20, 186–194.
Salgado-Maldonado, G. (2006). Checklist of helminth parasites of freshwater fishes from Mexico. Zootaxa, 1324, 1–357. https://doi.org/10.11646/zootaxa.1324.1.1
Salgado-Maldonado, G. (2008). Helminth parasites of freshwater fish from Central America. Zootaxa, 1915, 29–53. https://doi.org/ 10.11646/zootaxa.1915.1.2
Salgado-Maldonado, G., Cabañas-Carranza, G. y Caspeta-Mandujano, J. M. (1998). Creptotrema agonostomi n. sp. (Trematoda: Allocreadiidae) from the intestine of freshwater fish of México. The Journal of Parasitology, 84, 431–434. http://pbidi.unam.mx:8080/login?url=https://www.jstor.org/stable/3284506
Salgado-Maldonado, G., Caspeta-Mandujano, J. M., Moravec, F., Soto-Galera, E., Cabañas-Carranza, G. y Rodiles-Hernández, R. (2011). Helmintos parásitos de peces de agua dulce de Chiapas. En F. Álvarez (Ed.), Chiapas: estudios sobre su diversidad biológica. México, D.F.: Instituto de Biología. UNAM.
Salgado-Maldonado, G., Caspeta-Mandujano, J. M., Moravec, F., Soto-Galera, E., Rodiles-Hernández, R., Cabañas-Carranza, G. et al. (2011). Helminth parasites of freshwater fish in Chiapas, Mexico. Parasitology Research, 108, 31–59. https://doi.org/10.1007/s00436-010-2035-3
Salgado-Maldonado, G., Caspeta-Mandujano, J. M., Ramírez-Martínez, C., Lozano-Vilano, L., García-Ramírez, M. E. y Mendoza-Franco, E. F. (2014). Helmintos parásitos de los peces del río Lacantún en la reserva de la Biosfera Montes Azules, Chiapas. Monterrey: Universidad Autónoma de Nuevo León-Natura/y Ecosistemas Mexicanos, A. C.
Salgado-Maldonado, G. y Pineda-López, R. (2003). The Asian fish tapeworm Bothriocephalus acheilognathi: a potential threat to native freshwater fish species in Mexico. Biological Invasions, 5, 261–268. http://dx.doi.org/10.1023/A:1026189331093
Salgado-Maldonado, G. y Rubio-Godoy, M. (2014). Helmintos parásitos de peces de agua dulce introducidos. En R. Mendoza y P. Koleff (Eds.), Especies acuáticas invasoras en México. México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Sánchez, O., Medellín, R. Aldama, A., Goettsch, B., Soberón, J. y Tambutti, M. (2007). Método de evaluación del riesgo de extinción de las especies silvestres en México (MER). México D.F.: Semarnat/ INE/ Instituto de Ecología, UNAM/ Conabio.
Sazima, I. y D’Angelo, G. B. (2013). The Asian invasive freshwater clam Corbicula fluminea as prey of two native waterbirds in South-Eastern Brazil. Folia Malacologica, 24, 293–295.
Schmitter-Soto, J. J. (2017). A revision of Astyanax (Characiformes: Characidae) in Central and North America, with the description of nine new species. Journal of Natural History, 51, 1331–1424. https://doi.org/10.1080/00222933.2017.1324050
Scholz, T., Aguirre-Macedo, M. L. y Salgado-Maldonado, G. (2001). Trematodes of the family Heterophyidae (Digenea) in Mexico: a review of species and new host and geographical records. Journal of Natural History, 35, 1733–1772. https://doi.org/10.1080/00222930152667087
Soria-Barreto, M., González-Díaz, A. A., Castillo-Domínguez, A., Álvarez-Pliego, N. y Rodiles-Hernández, R. (2018). Diversidad íctica en la cuenca del Usumacinta, México. Revista Mexicana de Biodiversidad, 89 (Supl.), S100–S117. https://doi.org/10.22201/ib.20078706e.2018.4.2462
Strong, E. E., Gargominy, O., Ponder, W. F. y Bouchet, P. (2008). Global diversity of gastropods (Gastropoda: Mollusca) in freshwater. Hydrobiologia, 595, 149–166.
Sutter, R. D., Wainscott, S. B., Boetsch, J. R., Palmer, C. G. y Rugg, D. J. (2015). Practical guidance for integrating data management into long-term ecological monitoring projects. Wildlife Society Bulletin, 39, 451–463. https://doi.org/10.1002/wsb.548
Thacker, C. E., Pezold, F. y Suttkus, R. D. (2006). Redescription of the dwarf Neotropical eleotrid genus Leptophilypnus (Teleostei: Gobioidei), including a new species and comments on Microphilypnus. Copeia, 3, 489–499. https://doi.org/10.2307/4098713
Thompson, F. G. (2011). The land and freshwater snails of Mexico and Central America. Bulletin of the Florida Museum of Natural History, 50, 1–299.
Trinidad-Ocaña, C., Juárez-Flores, J., Sánchez, A. J. y Barba-Macías, E. (2018). Diversidad de moluscos y crustáceos acuáticos en tres zonas en la cuenca del río Usumacinta, México. Revista Mexicana de Biodiversidad, 89 (Supl.), S65–S78. https://doi.org/10.22201/ib.20078706e.2018.4.2387
Vander-Zanden, M. J. y Vadeboncoeur, Y. (2020). Putting the lake back together 20 years later: what in the benthos have we learned about habitat linkages in lakes? Inland Waters, 10, 305–321. https://doi.org/10.1080/20442041.2020.1712953
Veeravechsukij, N., Namchote, S., Neiber, M. T., Glaubrecht, M., y Krailas, D. (2018). Exploring the evolutionary potential of parasites: larval stages of pathogen digenetic trematodes in their thiarid snail host Tarebia granifera in Thailand. Zoosystematics and Evolution, 94, 425–460. https://doi.org/10.3897/zse. 94.28793
Velázquez-Velázquez, E., López-Vila, J. M., Gómez-González, A. E., Romero-Berny, E. I., Lievano-Trujillo, J. L. y Matamoros, W. A. (2016). Checklist of the continental fishes of the state of Chiapas, Mexico, and their distribution. Zookeys, 632, 99–120. https://doi.org/10.3897/zookeys.632.9747
Villaseñor, J. L. (2016) Checklist of the native vascular plants of Mexico. Revista Mexicana de Biodiversidad, 87, 559–902. http://dx.doi.org/10.1016/j.rmb.2016.06.017
von Martens, E. (1890-1901). Biología Centrali Americana, land and freshwater Mollusca. London: Taylor and Francis.
Wakida-Kusunoki, A. T. y Amador-del Ángel, E. (2008). Nuevos registros de los plecos Pterygoplichthys pardalis (Castelnau, 1855) y P. disjunctivus (Weber, 1991) (Siluriformes: Loricariidae) en el sureste de México. Hidrobiológica, 18, 251–256.
Wakida-Kusunoki, A. T., Ruiz-Carus, R. y Amador-del Ángel, E. (2007). Amazon sailfin catfish, Pterygoplychthys pardalis (Castelnau, 1855) (Loricariidae), another exotic species established in southeastern Mexico. The Southwestern Naturalist, 52, 141–144.
Whitehead, P. J. P. (1985). FAO species catalogue. Vol. 7. Clupeoid fishes of the world (Suborder Clupeoidei). An annotated and illustrated catalogue of the herrings, sardines, pilchards, sparts, anchovies and wolfherrings. Part 1 – Chirocentridae, Clupeidae and Pristigasteridae. FAO Fisheries Synopsis 125, 7, 1–303.




