Estructura y diversidad arbórea de bosques tropicales caducifolios secundarios en la Reserva de la Biósfera Sierra de Huautla, Morelos
Leonardo Beltrán-Rodríguez (a)(*), Juan Ignacio Valdez-Hernández(a), Mario Luna-Cavazos(b),
Angélica Romero-Manzanares(b), Elizandro Pineda-Herrera(c), Belinda Maldonado-Almanza(d),
Ma. Amparo Borja-de la Rosa(e) y José Blancas-Vázquez(d)
a Postgrado en Ciencias Forestales, Colegio de Postgraduados Campus Montecillo, Km. 36.5 Carretera México-Texcoco, Col. Montecillo, 56230, Texcoco, Estado de México, México
b Postgrado en Botánica, Colegio de Postgraduados Campus Montecillo, Km. 36.5 Carretera México-Texcoco, Col. Montecillo, 56230 Texcoco, Estado de México, México
c División de Ciencias Ambientales, Instituto Potosino de Investigación Científica y Tecnológica A.C., Camino a la Presa San José Núm. 2055, Col. Lomas 4ª. Secc., 78216, San Luis Potosí, San Luis Potosí, México
d Centro de Investigación en Biodiversidad y Conservación, Universidad Autónoma del Estado de Morelos, Av. Universidad 1001, Col. Chamilpa, 62209, Cuernavaca, Morelos, México
e Laboratorio de Anatomía y Tecnología de la Madera, División de Ciencias Forestales, Universidad Autónoma Chapingo, Km 38.5 Carretera México-Texcoco, 56230, Texcoco, Estado de México, México
*Autor para correspondencia: beltran.leonardo@colpos.mx; leonbeltranrodriguez@gmail.com (L. Beltrán-Rodríguez)
Resumen
Se estudió la recuperación en riqueza, composición, estructura y diversidad arbórea en 3 condiciones de bosque tropical caducifolio secundario con diferente tiempo de abandono (C35, C45 y C65 años) en el sureste del estado de Morelos. En cada condición se establecieron 3 unidades de muestreo de 50 × 50 m (2,500 m2) y se midieron a todos los individuos ≥ 2.5 cm de diámetro normal (DN). En total se registraron 2,791 individuos, pertenecientes a 79 especies, 53 géneros y 30 familias. Fabaceae fue la familia con el mayor número de especies e individuos. C45 presentó la mayor riqueza de especies (57), seguida de C35 (48) y C65 (43). Las condiciones fueron diferentes (p < 0.0001) en área basal, altura total, DN y cobertura de copa. Las especies con mayores índices relativos de valor de importancia (IVIR) y de valor forestal (IVFR) fueron Pachycereus grandis (IVIR = 22.6, IVFR = 28.7), Amphipterygium adstringens (IVIR = 20.9, IVFR = 17.0), Lysiloma divaricatum (IVIR = 11.2, IVFR = 18.9) y Quercus glaucoides (IVIR = 10.5, IVFR = 13.1). Se encontraron diferencias altamente significativas (p < 0.001) entre condiciones de abandono para la heterogeneidad (Shannon-Wiener: H´), y valores significativamente (p < 0.05) mayores en C65 para el recíproco de Simpson (1/D), así como en C35 y C45 para los índices de Margalef (DMG) y α de Fisher (S). La semejanza florística (Sorensen: Is) fue máxima entre condiciones con menor tiempo de abandono (72%) y mínima con la condición de mayor tiempo (54%). El procedimiento de permutación de respuesta múltiple indicó diferencias significativas (p < 0.05) en la composición de especies entre condiciones tempranas (C35 y C45) y tardías (C65). Estos resultados explican el proceso de la sucesión secundaria en los bosques tropicales caducifolios del área de estudio y dan elementos para efectuar una mejor planificación de las actividades conducentes a su conservación.
Palabras clave:
Índices de importancia ecológica y forestal; Dinámica forestal; Sucesión secundaria; Resiliencia; Histéresis; Semejanza florística
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Structure and tree diversity of secondary dry tropical forests in the Sierra de Huautla Biosphere Reserve, Morelos
Abstract
The recovery in richness, composition, structure and tree diversity was studied in three conditions of secondary tropical deciduous forest with different time of abandonment (C35, C45 and C65 years) in the southeast of the state of Morelos. In each condition, three plots of 50 × 50 m (2,500 m2) were established and all individuals ≥ 2.5 cm of normal diameter (ND) were measured. In total, 2,791 individuals belonging to 79 species, 53 genera and 30 families were registered. Fabaceae was the family with the largest number of species and individuals. C45 had the highest species richness (57), followed by C35 (48) and C65 (43). The conditions were different (p < 0.0001) in basal area, total height, ND and crown coverage. The species with the highest relative value of importance (IVIR) and forest value (IVFR) were Pachycereus grandis (IVIR = 22.6, IVFR = 28.7), Amphipterygium adstringens (IVIR = 20.9, IVFR = 17.0), Lysiloma divaricatum (IVIR =11.2, IVFR = 18.9) and Quercus glaucoides (IVIR = 10.5, IVFR = 13.1). High significant differences (p < 0.001) between abandonment conditions were found for heterogeneity (Shannon-Wiener: H’), and highest significant values (p < 0.05) for Simpson reciprocal index (1/D) in C65, as well as to Margalef (DMG) and Fisher’s α (S) indexes in C35 and C45. The floristic similarity (Sorensen: Is) was highest among conditions with less time of abandonment (72%) and minimum with the condition of greater time (54%). The multiple response permutation procedure indicated significant differences (p < 0.05) in the species composition between early (C35 and C45) and late (C65) conditions. These results explain the process of secondary succession in the tropical deciduous forests of the study area and provide elements for improve planning of the activities leading to its conservation.
Keywords:
Ecological and forest importance indexes; Forest dynamics; Secondary succession; Resilience; Hysteresis; Floristic similarity
Los bosques tropicales caducifolios (BTC) sensu Rzedowski (2006) son los ecosistemas con las mayores tasas de cambio de uso de suelo (Dirzo et al., 2011; Hansen et al., 2013; Murphy y Lugo, 1986), principalmente debido a la expansión agrícola, ganadera y recientemente a proyectos urbanos y megaturísticos (Chazdon et al., 2007; Sánchez-Azofeita y Portillo-Quintero, 2011); debido a ello se consideran el tipo de vegetación tropical más amenazado a nivel global (Banda et al., 2016; Janzen, 1988; Miles et al., 2006). En consecuencia, el paisaje de los BTC se ha modificado a fragmentos de bosque primario rodeados de un paisaje de bosques secundarios, cada uno con diferentes historiales de manejo y fases de sucesión (Chazdon, 2014; Maza-Villalobos et al., 2011).
Estudios clásicos planteaban que la sucesión forestal era el cambio de la composición de especies y la fisonomía de la vegetación en un sitio a través del tiempo, siendo este proceso predecible y unidireccional hacia la formación de comunidades clímax (Clements, 1916; Spurr, 1952). Sin embargo, recientemente se ha demostrado que existe una débil relación entre las tasas observadas de recuperación estructural (área basal, densidad de tallos, altura y riqueza) y de aquéllas observadas por medio del estudio de cronosecuencias (Norden et al., 2015); incluso entre bosques cercanos con condiciones ambientales e historias de perturbación similares (Arroyo-Rodríguez et al., 2015; Chazdon, 2013; Chazdon et al., 2007).
Con el enfoque propuesto por Westoby et al. (1989), cualquier comunidad vegetal bajo la teoría sucesional moderna considera estados estables alternativos, transiciones y umbrales de cambio. Parámetros de cambio de las comunidades como la estabilidad (inercia, equilibrio), elasticidad (resiliencia, capacidad de recuperación o retorno del sistema después del efecto del disturbio), la trayectoria (multidirección de cambio de estado) y la velocidad (tiempo) de transformación de las comunidades vegetales, están influenciados por la histéresis (el historial de la frecuencia, tipo e intensidad de disturbios), lo que genera diversas sendas de alteración y recuperación del hábitat y sus recursos (Romero-Manzanares y García-Moya, 2002).
La dinámica sucesional de los bosques tropicales en México se ha estudiado particularmente en bosques húmedos (Chazdon et al., 2007; Gómez-Pompa y Vázquez-Yanes, 1985; Martínez-Ramos y García-Orth, 2007); en tanto que avances sustanciales sobre el entendimiento de los procesos y mecanismos de recuperación de los bosques tropicales caducifolios secundarios (BTCs) comenzaron a surgir en la última década (Derroire, Balvanera et al., 2016; Derroire, Tigabu et al., 2016; Lebrija-Trejos et al., 2010; Quesada et al., 2009). Se ha demostrado que la radiación solar, temperatura y variación en la disponibilidad hídrica del suelo son los principales factores físicos que afectan la resiliencia de los BTCs y direccionan la trayectoria de la sucesión (Lebrija-Trejos et al., 2008, 2010, 2011). Ante estas restricciones ambientales, las especies leñosas en este ecosistema tienen como estrategia formar una alta cantidad de rebrotes (Ceccon et al., 2006; Vieira y Scariot, 2006) y establecer interacciones positivas como la facilitación para sobrevivir (Derroire, Tigabu et al., 2016; Maza-Villalobos et al., 2011).
Diversos estudios en BTCs de México (González-Valdivia et al., 2012; Leirana-Alcocer et al., 2009; Sánchez-Velásquez et al., 2002) y Latinoamérica (Coehlo et al., 2016; Kennard, 2002; Leiva et al., 2009; Ruiz et al., 2005) han mostrado que, conforme se recuperan los bosques a lo largo del tiempo, hay un incremento en el área basal, cobertura, altura y diámetro normal, aun cuando la densidad se estabiliza en etapas tempranas de la sucesión (Leiva et al., 2009; Lebrija-Trejos et al., 2010). De hecho, algunos BTCs han mostrado ser resilientes ante disturbios mayores como la cosecha de madera, producción de carbón, agricultura itinerante y ganadería (Lebrija-Trejos et al., 2010; Molina y Lugo, 2006; Romero-Duque et al., 2007).
También se ha probado en estos ecosistemas que la riqueza y diversidad arbórea incrementan, mientras la semejanza en la composición de especies decrece con la edad de abandono (Derroire, Balvanera et al., 2016; Lebrija-Trejos et al., 2010; Leirana-Alcocer et al., 2009). En consecuencia, la resiliencia de los BTCs se expresa en una rápida capacidad de recuperación de atributos como la riqueza, estructura y diversidad arbórea en las primeras etapas de la sucesión (Derroire, Balvanera et al., 2016; Lebrija-Trejos et al., 2008, 2010), en tanto que la conformación de los ensambles florísticos es más sensible a los disturbios de cada comunidad vegetal (Kennard, 2002; Maza-Villalobos et al., 2011; Ruiz et al., 2005).
De acuerdo con la Comisión Nacional Forestal (2012), actualmente el 54% de los BTC de México son secundarios. El BTC del estado de Morelos es uno de los más afectados en el país, debido a que el 60% de la vegetación original ha sido removida a una tasa anual de 1.4% (Trejo y Dirzo, 2002). Existen algunos relictos de BTC primario en diferentes regiones del estado, pero la mayor proporción se concentra en la zona sur, particularmente en la Reserva de la Biósfera Sierra de Huautla —REBIOSH— (Boyás et al., 2001; Contreras-MacBeath et al., 2006). No obstante, por más de 100 años, las actividades humanas en la REBIOSH han modificado estos bosques, convirtiéndolos en un mosaico de paisajes agrícolas y forestales con diferentes etapas serales (Martínez-Garza et al., 2011). La magnitud de los efectos de la fragmentación del BTC sobre la riqueza, estructura y diversidad florística ha sido poco atendida en el estado de Morelos (Arias-Medellín et al., 2014; De la O-Toris et al., 2012; Martínez-Garza et al., 2011).
A partir de lo anterior, se propone que el análisis de la sucesión forestal en el BTC del sur de Morelos permitiría desarrollar conocimiento sobre los ritmos y trayectorias de la recuperación estructural y florística ante diferentes tipos de disturbio humano y tiempos de abandono. De esta manera, el conocimiento de los ensambles ecológicos y la diversidad en los estados alternativos del BTC, ayudará a generar los planes de conservación más apropiados para cada caso dentro de la REBIOSH. Esta información será útil para el desarrollo de programas de manejo forestal sostenible, a fin de conducir la estructura y composición de estos bosques secundarios hacia fases deseadas de la dinámica sucesional.
El análisis propuesto, presentado como un estudio de caso, mide la recuperación natural del BTCs varias décadas después de haber cesado la perturbación causada por actividades humanas continuas durante 70 años. El objetivo fue evaluar el efecto de diferentes tiempos de abandono sobre la riqueza, composición, estructura y diversidad en tres condiciones de BTCs. La hipótesis plantea que el BTC de la REBIOSH es resiliente y que conforme transcurre el tiempo, tiene la capacidad natural de recuperar su estructura, con una menor densidad, pero mayor área basal, cobertura, altura, diámetro normal, y riqueza y diversidad.
Materiales y métodos
La región comprende diferentes intervalos altitudinales (650 a 1,790 m), y de acuerdo con García (2004) presenta un clima (Aw0’’(w)(i’)g), cálido subhúmedo, el más seco de los subhúmedos, régimen de lluvias de verano y sequía intraestival, marcada época seca en el invierno y una corta en el verano, porcentaje de lluvia invernal menor al 5% de la anual, oscilación de las temperaturas medias mensuales entre 7 y 14 ºC, y marcha de temperatura tipo Ganges (el mes más caliente del año es anterior a junio). La temperatura media anual es de 22.7 ºC y la precipitación total anual de 863 mm, 90% registrada entre mayo y octubre (Servicio Meteorológico Nacional, 2010).
El uso de suelo incluye tierras agrícolas de temporal (13%) situadas en planicies y dispersas a manera de mosaicos, macizos continuos de BTCs con diferente tiempo de abandono (31%) y fragmentos de vegetación relativamente intactos (56%), ubicados en laderas y lomas (Martínez-Garza et al., 2011). De acuerdo con Dorado et al. (2005) y siguiendo la clasificación de la vegetación de México propuesta por Rzedowski (2006), los bosques tropicales que cubren el área son: bosque espinoso, bosque tropical subcaducifolio y bosque tropical caducifolio; dominando éste último en más del 90% de la región. La flora vascular de El Limón se estima en 456 especies, 266 géneros y 76 familias (González y López, 2008).
Algunas de la áreas de uso común de estos bosques (55 ha) fueron desmontadas hace más de 60 años (~1950) para realizar actividades de agricultura, ganadería extensiva (incluye ganado vacuno, bovino, equino y porcino) y elaboración de carbón (Arias-Medellín et al., 2014; Palma, com. pers.); mientras que en otras continúa la extracción de madera para leña y postes (Monroy-Ortiz, 1997) así como el aprovechamiento de productos forestales no maderables (PFNM).
Se seleccionaron 3 condiciones de BTCs con diferente tiempo de abandono (años a partir de la perturbación) e histéresis: a) 35 años (C35), agricultura de temporal por 60 años, último ciclo de cultivo en 1980, perturbación constante por ganadería extensiva y recolección de leña, postes y PFNM; b) 45 años (C45), uso agrícola por 30 años, última cosecha en 1970, excluido mediante cercado desde 1990 para el establecimiento de Unidades de Manejo para la Conservación de la Vida Silvestre y c) 65 años (C65), aprovechamiento maderable para elaboración de carbón por 25 años, última corta en 1950, eventualmente se recolectan postes para cercado y leña.
De acuerdo con la propuesta de López-Toledo et al. (2012), en cada condición se establecieron 3 unidades de muestreo (UM) de 50 × 50 m (0.25 ha) cada una (9 UM en total). Las UM se dividieron en 25 sub-unidades de 10 x 10 m (100 m2) (modificado de Valdez-Hernández, 2002), en las que se midieron todos los individuos arbóreos y arborescentes con diámetro ≥ 2.5 cm (Carreón-Santos y Valdez-Hernández, 2014; López-Toledo et al., 2012), incluyendo cactáceas columnares.
Se registró la identidad taxonómica, diámetro normal -DN- (cm, diámetro del tallo medido a 1.30 m de altura desde la base del suelo), altura total (m, altura del árbol desde el nivel del suelo hasta el ápice más alto) y cobertura de copa (m2) en cada individuo. Se colectó también material botánico en cada condición que se determinó en el herbario CHAPA del Colegio de Postgraduados. La nomenclatura taxonómica se consultó en el sitio Tropicos del Missouri Botanical Garden (http://www.tropicos.org).
Se elaboraron curvas especies-área para las 3 condiciones, que representaron gráficamente la riqueza acumulada de especies (abundancia observada) por tiempo de abandono en una superficie determinada (Colwell et al., 2004). Para conocer la riqueza esperada por condición, se utilizaron estimadores no paramétricos (ACE, Chao1, Chao2, Jack1, Bootstrap) mediante 100 aleatorizaciones con reemplazo. Los valores generados fueron exportados a una hoja de cálculo donde se graficaron y compararon las curvas, eligiendo las que se ajustaron con mayor precisión al parámetro Sest (riqueza de especies). Para su elaboración se utilizó el programa EstimateS ver. 9.1.0 (Colwell, 2013).
Se diseñó un nuevo método para evaluar la formación natural de estratos (verticales y horizontales) sin la influencia de categorizaciones alométricas a priori, a fin de explicar el tipo de distribución que siguen los individuos en estas comunidades vegetales y su ubicación real a ciertas clases de tamaño de acuerdo a sus dimensiones biológicas. Para esto, se conjuntaron los datos de las 3 UM por condición de estudio y se elaboraron curvas de acumulación del número de individuos por altura total y DN, con el objeto de identificar puntos de inflexión, los cuales fueron determinantes para establecer los límites de los estratos verticales y de las categorías diamétricas.
De acuerdo con la tendencia de las curvas acumuladas por tiempo de abandono, se ajustaron diversos modelos de tipo polinómico bajo el criterio de una bondad de ajuste aceptable (R2 ≥ 0.70). A partir de la estructura de la ecuación generada para cada curva, se procedió a obtener la primera y segunda derivada. El valor obtenido proporcionó la coordenada X del punto de inflexión de cada modelo, el cual se ubicó gráficamente y se proyectó para su intersección con la curva, obteniendo así la coordenada Y. Los cálculos se procesaron con el programa Maplesoft (2015).
Para jerarquizar la dominancia de especies por condición en el plano horizontal se calculó el índice de valor de importancia relativo (IVIR), a través de la sumatoria de la densidad relativa (DR), dominancia relativa (DomR) y frecuencia relativa (FR) (Curtis y McIntosh, 1951; Mueller-Dombois y Ellenberg, 2002); mientras que para ponderar la estructura bidimensional (plano horizontal y vertical) se utilizó el índice de valor forestal relativo, calculado por la adición del diámetro normal relativo (DnR), altura total relativa (AtR) y cobertura de copa relativa (CcR) (IVFR) (Corella et al., 2001).
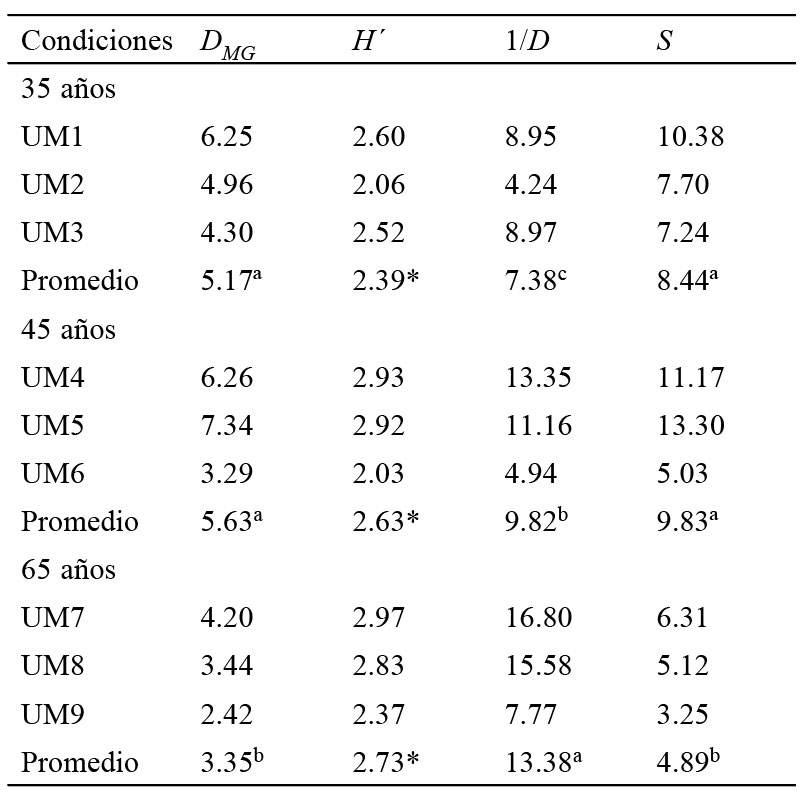
Para estimar las métricas de diversidad entre las condiciones con diferente tiempo de abandono se utilizaron diversos índices que son complementarios entre sí. La riqueza de especies arbóreas se calculó mediante el índice de Margalef (DMG) (Margalef, 1972; Moreno, 2001), la heterogeneidad de especies con índices de diversidad α: Shannon-Wiener (H´), recíproco de Simpson (1/D) y α de Fisher (S) (Fisher et al., 1943; Magurran y McGill, 2014; Moreno, 2001); en tanto la semejanza en la composición arbórea se determinó con el coeficiente de Sorensen (Is) (Magurran y McGill, 2014). El cálculo de los descriptores de la diversidad α se realizó con el programa Species diversity and richness Versión 4.1.2 (Seavy y Henderson, 2006).
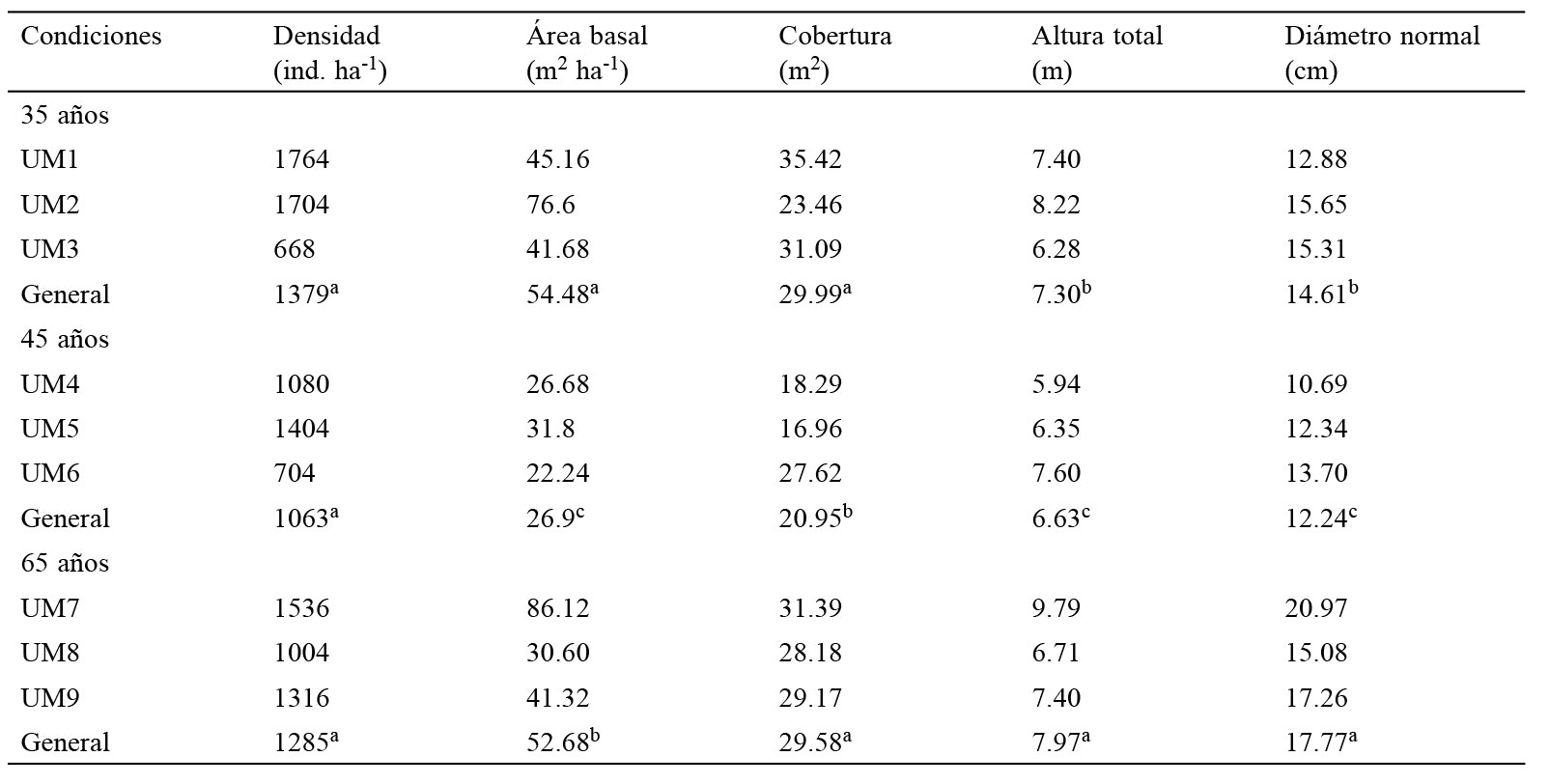
Los atributos estructurales de densidad (ind. ha-1), área basal (m2 ha-1), cobertura de copa (m2), altura total y DN promedio se analizaron con una prueba de Shapiro-Wilks para determinar si se ajustaban a una distribución normal; ninguna variable mostró este comportamiento. Por lo tanto, se aplicó una prueba no paramétrica por bloques aleatorizados de Friedman (en donde cada condición representó un tratamiento y cada UM una repetición) para probar diferencias en los atributos estructurales de la vegetación por UM y tiempo de abandono. Se obtuvo la comparación de rangos promedio para saber cuáles tratamientos eran estadísticamente diferentes. El mismo análisis se llevó a cabo para determinar si el tiempo de abandono afecta la riqueza acumulada en cada condición. En ambos casos se utilizó el paquete estadístico InfoStat versión 2008 (Di Rienzo et al., 2008).
Para determinar la existencia de diferencias significativas en el índice de Shannon-Wiener (H´) entre UM y condiciones, se emplearon pruebas pareadas con el procedimiento de t modificada por Hutcheson (1970); el cual ha sido utilizado para otros bosques tropicales secundarios de México (Carreón-Santos y Valdez-Hernández, 2014; López-Toledo et al., 2012). Las diferencias significativas para los índices de Margalef (DMG), recíproco de Simpson (1/D) y α de Fisher (S) se obtuvieron a través de un Anova no paramétrico con una prueba de comparación de rangos promedio (Friedman, p < 0.05), bajo la hipótesis nula de igualdad entre condiciones (Di Rienzo et al., 2008).
La semejanza en la composición arbórea entre condiciones se calculó con el coeficiente de Sorensen (Mueller-Dombois y Ellenberg, 2002), mientras que para determinar diferencias estadísticas en la composición se aplicó el procedimiento de permutación de respuesta múltiple (MRPP, por sus siglas en inglés; McCune y Grace, 2002), bajo la hipótesis nula de igualdad en la composición arbórea; el cálculo se hizo con el programa PC-ORD versión 6.0 (McCune y Mefford, 2011). El estadístico T de este análisis indica la diferencia entre condiciones evaluadas, mientras este valor sea más negativo la diferencia entre condiciones será mayor (Lesica et al., 1991).
Resultados
La abundancia total de árboles en las tres condiciones de abandono fue de 2,791 individuos. En C35 se registró la mayor cantidad de árboles por hectárea, pero no hubo diferencias significativas entre condiciones (tabla 1). Se encontraron diferencias altamente significativas (p < 0.0001) entre tiempos de abandono para área basal, altura y diámetro normal (tabla 1). C35 presentó los valores más altos en área basal y cobertura de copa, mientras que C65 la mayor altura total y diámetro normal (tabla 1).
Los árboles en los BTCs estudiados midieron en promedio 7.4 ± 4 m de altura total, con baja densidad de individuos superiores a 15 m (< 80 ind. ha-1) y 2 estratos diferenciados (tabla 1, fig. 2). Las especies estructuralmente más importantes del estrato inferior en las 3 condiciones fueron: Randia echinocarpa DC. y Euphorbia schlechtendalii Boiss; mientras que en el estrato superior dominaron: Ceiba parvifolia Rose y Celtis caudata Planch. Algunos árboles alcanzaron alturas ≥ 20 m, tales como: Ficus cotinifolia Kunth, Conzattia multiflora (C35); Ficus insipida Willd., Lysiloma divaricatum (C45); Ficus trigonata L. y Lysiloma acapulcense (C65).
Los árboles en C35 tuvieron una altura total promedio de 7.5 ± 3.9 m y 2 estratos verticales definidos por el punto de inflexión de la curva: inferior (1.4 – 6 m, 38% del total de individuos) y superior (≥ 6.1 – 26.7 m, 62%). En C45 la altura total promedio fue 6.4 ± 3.8 m con 2 estratos: inferior (1.1 – 9 m, 78%) y superior (≥ 9.1 – 25 m, 22%); en tanto que, C65 presentó una altura total promedio de 8.1 ± 3.9 m y 2 estratos: inferior (0.90 – 7 m, 47%) y superior (≥ 7.1 m – 27.5, 53%) (fig. 2).
La figura 3 presenta la distribución diamétrica de los árboles por condición de abandono. El DN promedio en las
El ensamble de especies con mayores valores de importancia estructural fue consistente en C35 y C45, pero mostró variación en C65 (tabla 2). De acuerdo con los IVIR e IVFR, las especies P. grandis, Amphipterygium adstringens (Schltdl.) Standl., L. divaricatum, C. multiflora, Quercus glaucoides M. Martens & Galeotti y F. trigonata fueron las más importantes, jerarquizándolas de forma
Atributos estructurales de la vegetación arbórea por UM y tiempo de abandono en El Limón, Morelos. Rangos promedio seguidos por letras diferentes dentro de columnas indican diferencias significativas entre condiciones (Friedman, p < 0.0001).
 distinta. C35 presentó los valores más altos de complejidad estructural, mientras que C45 y C65 mostraron la mayor cantidad de especies exclusivas (tabla 2).
distinta. C35 presentó los valores más altos de complejidad estructural, mientras que C45 y C65 mostraron la mayor cantidad de especies exclusivas (tabla 2).Se encontraron diferencias altamente significativas (p < 0.001) entre condiciones de abandono para la heterogeneidad
La semejanza en la composición arbórea fue menor a medida que incrementa el tiempo de abandono (63% para C35-C65 y 54% para C45-C65), pero mayor entre C35 y C45 (72%). C35 y C45 concentran el 28% de la riqueza exclusiva del área y se diferencian florísticamente de C65, la cual contiene a su vez el 14% de dicha riqueza. El MRPP indicó diferencias significativas (p < 0.05) en la composición arbórea entre C35-C65 y C45-C65 (tabla 4).
Discusión
Riqueza y composición arbórea durante la sucesión secundaria. La riqueza y composición de las 3 condiciones analizadas en El Limón, Morelos, fue semejante a otros trabajos realizados en bosques primarios de Michoacán (Martínez-Cruz et al., 2013; Méndez-Toribio et al., 2014; Zacarías-Eslava et al., 2011) y Guerrero (Pineda-García et al., 2007); mientras que la riqueza incluso fue mayor a la encontrada en lugares poco alterados de Morelos (Martínez-Garza et al., 2011; Trejo, 1998). Estos bosques registraron una riqueza promedio de 55 especies y dominancia de Fabaceae, Burseraceae, Anacardiaceae y Rubiaceae, cuyos géneros más abundantes fueron Acacia, Lysiloma, Mimosa, Bursera amphipterygium, Cyrtocarpa y Randia, respectivamente.
De manera general se sabe que existe mayor riqueza pero menor semejanza florística entre sitios con la edad, debido a la lenta recuperación en la composición de especies en el BTCs (Derroire, Balvanera et al., 2016; Leirana-Alcocer et al., 2009). Resultados similares han sido registrados en otros bosques neotropicales (Chazdon et al., 2007; Finegan, 1996), sugiriendo que los ensambles ecológicos sucesionales tardarán en parecerse a los de un bosque primario (Coehlo et al., 2016; Lebrija-Trejos et al., 2010). Nuestros datos coinciden con este planteamiento, debido a que la mayor semejanza florística se presentó entre las condiciones con menor tiempo de abandono (C35 y C45), y la composición de éstas fue diferente con aquella de mayor tiempo (C65).
En cambio, la riqueza de especies en general y de especies exclusivas en particular tuvo un comportamiento diferente a lo esperado de acuerdo a lo registrado en otros bosques sucesionales (Kennard, 2002; Maza-Villalobos et al., 2011; Ruiz et al., 2005), debido a que también fue mayor en las condiciones con 35 y 45 años de abandono. La exclusión y moderada perturbación del BTCs en C45 explica la rapidez para alcanzar una elevada riqueza florística, debido a que por más de 25 años ha estado aislado del efecto humano y forma parte de la matriz forestal proveedora de propágulos, lo que ha promovido la dinámica de repoblación natural (Ceccon et al., 2006; Derroire, Tigabu et al., 2016; van Breugel et al., 2007; Vieira y Scariot, 2006).
La riqueza esperada mediante estimadores no paramétricos en las 3 condiciones alcanzó también su máximo en C45, confirmando la suposición de que fue la condición mejor desarrollada florísticamente. Tendencias
Especies con mayores valores de importancia por índice estructural y especies exclusivas por condición de estudio en El Limón, Morelos.
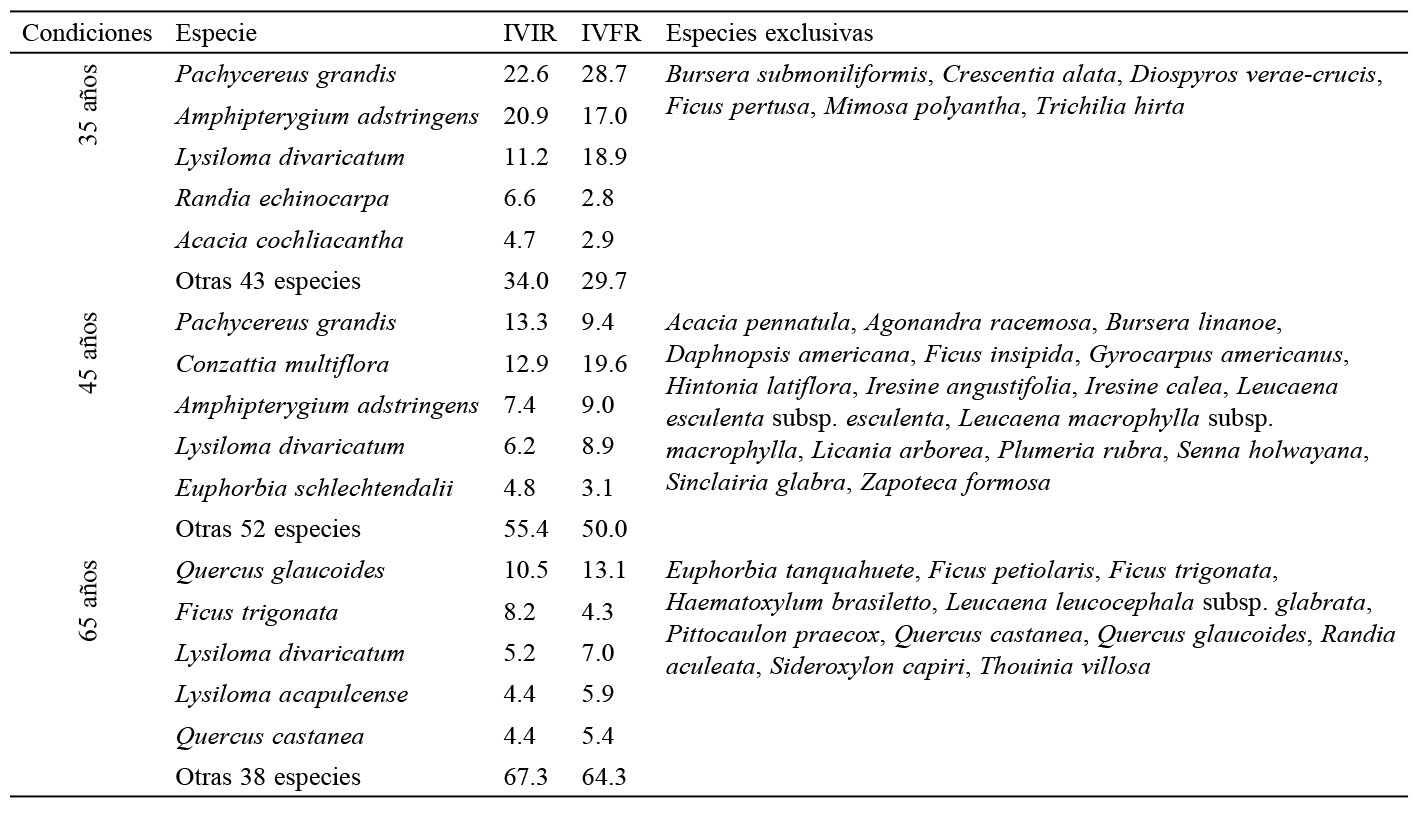 Tabla 3
Tabla 3Índices de diversidad por tiempo de abandono en El Limón, Morelos, México. DMG = Margalef, 1/D = recíproco de Simpson y S = alfa de Fisher. Rangos promedio seguidos por letras diferentes dentro de columnas indican diferencias significativas (Friedman, p < 0.05). H´= Shannon-Wiener, valores promedio seguidos por un * dentro de columnas indica diferencias significativas (t de Hutcheson, p < 0.001).
La baja riqueza específica registrada en C65 y la semejanza florística con C35 y C45, se explica debido a que la cosecha y quema para producción de carbón en C65 han generado una condición dominada (~50% del total de individuos) por 2 especies de encinos tropicales (Quercus glaucoides M. Martens & Galeotti y Quercus castanea Née) y una leguminosa, M. benthamii. Es sabido que los encinos presentan adaptación por rebrote ante el aprovechamiento o para sobrevivir al fuego en ambientes propensos a incendiarse (Peña-Ramírez y Bonfil, 2003), formando extensos manchones monoespecíficos. También, especies del género Mimosa dominan en los BTCs frecuentemente incendiados, y pueden pausar la sucesión e impedir la presencia de otras especies pioneras o tardías (Maass et al., 2002).
La composición arbórea en C65 se debe también al efecto de la perturbación y el tiempo de abandono
Prueba de diferencias en la composición arbórea entre condiciones con base en el procedimiento de permutación de respuesta múltiple (MRPP) en El Limón, Morelos. Significancia estadística: p < 0.05.
Recuperación estructural en la dinámica sucesional. Los BTCs evaluados presentaron también diferencias estructurales, debido tanto a los tipos de disturbio generados sobre su vegetación original como al tiempo de abandono durante la sucesión secundaria. Se ha demostrado que el valor de algunos parámetros estructurales como el área basal, cobertura, altura y diámetro normal incrementan con el tiempo de abandono, pero la densidad se estabiliza en etapas tempranas de la sucesión (Leiva et al., 2009; Lebrija-Trejos et al., 2010). Esto coincide con lo encontrado en los BTCs de El Limón, donde la densidad, el área basal y la cobertura fueron mayores en C35. La situación estructural de C35 se explica por la cubierta forestal desmontada y quemada para actividades agrícolas, y por el aprovechamiento de árboles para leña y postes, lo que promueve la incorporación de especies secundarias polifurcadas como A. cochliacantha y A. farnesiana, así como el rebrote en individuos de Randia echinocarpa DC., favoreciendo un incremento en biomasa tanto por el número de tallos como por la cantidad y extensión de las copas.
La capacidad de multiplicación de los tallos en las plantas leñosas del BTCs ha sido señalada con anterioridad (Kennard, 2002) y podría ser utilizada en C35 como un mecanismo natural para orientar prácticas silvícolas con fines de recuperación florística y estructural. La importancia de llevar a cabo estas acciones reside en que la estabilidad de C35 podría verse afectada debido a los efectos negativos de la ganadería sobre la estructura y riqueza arbórea (González-Valdivia et al., 2012; Leirana-Alcocer et al., 2009; Sánchez-Velásquez et al., 2002) y en consecuencia, presentar sucesión retenida (Chazdon et al., 2007, 2013; Finegan 1996) y requerir de un mayor plazo de tiempo para recuperarse.
Considerando otras variables estructurales como el diámetro y la altura, C35 resulta ser una condición estructuralmente joven en El Limón, Morelos. La alta densidad de tallos delgados (tan solo el 7% del total de individuos tienen diámetros ≥ 25cm), así como el porte bajo de los árboles (aproximadamente el 40% es menor a 6m de altura) confirman este planteamiento. Esto concuerda con estudios previos realizados en unidades de muestreo permanentes para restauración ecológica en la misma localidad de estudio, donde la densidad y el área basal en los bosques recientemente perturbados (252 ind. ha-1; 6.18 m2 ha-1) son menores que en los poco alterados (905 ind. ha-1; 12.41 m2 ha-1) (Martínez-Garza et al., 2011).
Con base en los tiempos de abandono, se esperaría entonces una secuencia de desarrollo estructural entre C35 y C45, pero nuestros datos confirman lo contrario. El BTCs de C45 presenta los menores valores en densidad, área basal, cobertura, altura y DN; situación que se explica por la presencia de bosques cerrados generados por la exclusión, donde el sotobosque es denso y compite por espacio de crecimiento y recursos con las especies arbóreas (Ceccon et al., 2006; van Breugel et al., 2007); comportamiento propio de áreas sujetas a protección y conservación (Ceballos et al., 2010; Janzen, 1988).
El BTCs mejor desarrollado estructuralmente en el Limón, Morelos, fue C65. La flora arbórea que lo compone presentó los mayores promedios en altura y DN, valores altos en área basal y cobertura, así como 2 estratos verticales y 3 categorías diamétricas. De hecho, la riqueza y estructura en C65 fue similar a la registrada para un bosque maduro de la misma localidad (Trejo, 1998), sugiriendo que C65 representa una fase avanzada de la sucesión y que el tiempo de abandono en este BTCs evidencia la respuesta resiliente al post-disturbio.
Los índices estructurales (IVIR e IVFR) mostraron que Pachycereus grandis Rose, A. adstringens y C. multiflora fueron las especies más importantes en las condiciones con menor tiempo de abandono (C35 y C45), lo que concuerda con estudios previos en diferentes regiones del país (Almazán-Núñez et al., 2012; Méndez-Toribio et al., 2014; Romero-Duque et al., 2007). En cambio, especies propias de bosques maduros (Lott y Atkinson, 2010; Trejo, 2010) de los géneros Ficus y Lysiloma fueron las más importantes en la condición con mayor tiempo de abandono (C65), presentando valores estructurales semejantes a los reportados en BTCs de Jalisco (Sánchez-Velásquez et al., 2002), Guerrero (Almazán-Núñez et al., 2012) y Michoacán (Martínez-Cruz et al., 2013). Esto sugiere que la dominancia estructural y la composición florística dependen de la etapa sucesional.
Parámetros de diversidad entre condiciones de abandono. La diversidad presentó también diferencias entre condiciones. De acuerdo con los índices Shannon-Wiener (H´) y recíproco de Simpson (1/D), la diversidad es mayor en C65. De hecho, la diversidad registrada en las 3 condiciones de abandono fue mayor que la observada en bosques sucesionales tempranos de Guerrero (H´ = 1.9-2.4, D = 0.09-0.12, Almazán-Núñez et al., 2012), Yucatán (D = 9.0-12.34, Leirana-Alcocer et al., 2009) y Michoacán (H´ = 1.27-1.38, Martínez-Cruz et al., 2013; D = 0.12, Zacarías-Eslava et al., 2011). Pero menor a la encontrada en otros BTC maduros a nivel nacional (H´ = 2.96-4.17, 1/D = 9.97-49.28, Trejo y Dirzo, 2002) y en Morelos (H´=3.63, 1/D=21.57 Trejo, 1998). Estos resultados apoyan que la diversidad arbórea incrementa con el tiempo de abandono.
La semejanza arbórea de los BTCs en El Limón, Morelos, fue relativamente alta (72%) entre las condiciones con menor tiempo de abandono. Con base en el valor del estadístico T de la prueba de diferencias basada en el procedimiento de permutación de respuesta múltiple, se acepta la hipótesis de que la composición arbórea es diferente entre condiciones de acuerdo con el tiempo de abandono, y se demuestra que las condiciones post-disturbio tempranas (C35 y C45) son florísticamente diferentes a la condición post-disturbio tardía (C65). Este hallazgo señala la relevancia de los BTCs de C35 y C45 para la conservación de la riqueza y composición arbórea en el Limón, y apoya la predicción de una alta tasa de recambio de especies entre sitios (Banda et al., 2016; Trejo y Dirzo, 2002), particularmente en aquellos con mayor tiempo de abandono (C65). Esta situación podría deberse a variaciones en las condiciones ambientales (Balvanera et al., 2002) e historial de perturbación (Molina y Lugo, 2006) entre condiciones.
Resiliencia de los BTCs de El Limón. De acuerdo con la teoría sucesional aplicada a los BTCs, la recuperación de la composición de especies es más lenta que la recuperación de la riqueza, estructura y diversidad arbórea (Derroire, Balvanera et al., 2016; Lebrija-Trejos et al., 2008, 2010). Por el contrario, en este estudio se observó tanto en las curvas especie-área como en los índices estructurales (IVIR e IVFR) y de diversidad (H´ e 1/D) calculados, que existe una recuperación paulatina en el número total de especies (riqueza), de especies exclusivas (composición) y de dominancia-equidad (diversidad) por tiempo de abandono durante la dinámica sucesional. Es posible que este reemplazo de especies entre condiciones se explique por mecanismos como la facilitación, como se ha visto en los pastizales abandonados de Chamela, Jalisco (Maza-Villalobos et al., 2011). No obstante, debido a los diferentes tipos de disturbio en cada condición a través del tiempo, estrategias como la inhibición que generan dominancia de un grupo de especies, podría ser un mecanismo alternativo durante la sucesión, como ocurre en C35 y C65.
No se registró una secuencia de desarrollo estructural de acuerdo al tiempo de abandono en los BTCs de El Limón, Morelos. En lugar de presentarse un aumento de los atributos estructurales con la edad sucesional, se observó un comportamiento dinámico que inició con una sensible disminución en densidad, área basal, altura total, cobertura y diámetro normal (C45), seguido de un incremento de estas variables en la etapa más avanzada de la sucesión (C65). Esto hace suponer que la edad de abandono no necesariamente es la variable más importante para predecir el comportamiento de recuperación estructural durante la sucesión (Chazdon et al., 2007; Lebrija-Trejos et al., 2010); por lo cual debería considerarse la evaluación de variables ambientales que se presuponen determinantes del procesos sucesional (Derroire, Balvanera et al., 2016; Lebrija-Trejos et al., 2011; Leiva et al., 2009; Maza-Villalobos et al., 2011).
Aparentemente, la menor complejidad estructural y de riqueza de los BTCs (Ceccon et al., 2006; Vieira y Sacariot, 2006) asociada a ciertas características funcionales (altas tasas de producción de biomasa durante la sucesión; Poorter et al., 2016), favorece que estos bosques muestren mayor resilencia (Derroire, Balvanera et al., 2016; Janzen, 1988) y se recuperen a una tasa sensiblemente más rápida en comparación con otros bosques tropicales (Drew et al., 2009; Finegan, 1996; Letcher y Chazdon, 2009). En términos de la sucesión natural, esto posibilitaría la recuperación de su riqueza, estructura y diversidad arbórea en plazos menores a 80 años (Kennard, 2002; Molina y Lugo, 2006; Ruiz et al., 2005).
En áreas naturales protegidas como la REBIOSH el conocimiento generado en este estudio sobre la dinámica sucesional (diferentes ritmos y trayectorias de recuperación estructural y florística) tiene importancia para la conservación de la diversidad arbórea, más aun cuando el BTC es un ecosistema económicamente importante y bajo manejo en la región (Martínez-Garza et al., 2011; Monroy-Ortíz, 1997). Se recomienda que el diseño y ejecución de los planes de manejo y conservación del BTC en el área de estudio deben considerar la presencia de diferentes comunidades vegetales sucesionales inmersas en el BTC debido a que en función de la histéresis y del tiempo de abandono postdisturbio la resiliencia en cada comunidad será diferencial, y por lo tanto, también diferirá la respuesta de los parámetros ecológicos.
Agradecimientos
Los autores agradecen a la población y autoridades del Ejido El Limón de Cuauchichinola por el apoyo e información proporcionados para este documento. El primer autor agradece al Consejo Nacional de Ciencia y Tecnología (becario 265032), al Colegio de Postgraduados, a la Red Temática “Productos Forestales No Maderables: Aportes desde la Etnobiología para su Aprovechamiento Sostenible” (Proyecto Conacyt # 271837) y al proyecto “Estrategias Ecológicas y Culturales de los Pueblos Tradicionales para enfrentar la incertidumbre en la disponibilidad de Recursos Vegetales” (PROMEP-UAEMOR-PTC-342), por los recursos destinados al trabajo de campo. Se agradece también a la M. en C. Ernestina Cedillo Portugal (Herbario Preparatoria Agrícola Chapingo) y al M. en C. Gabriel Flores Franco (Herbario HUMO) por el apoyo en la identificación de material botánico de su especialidad. Finalmente, se agradecen los comentarios de los revisores y la editora a cargo, mismos que mejoraron la calidad del manuscrito.
Referencias
Arias-Medellín, L., Flores-Palacios, A. y Martínez-Garza, C. (2014). Cacti community structure in a Tropical Mexican Dry Forest under chronic disturbance. Botanical Sciences, 92, 405–415.
Arroyo-Rodríguez, V., Melo, F., Martínez-Ramos, M., Bongers, F., Chazdon, R., Meave, J. et al. (2015). Multiple successional pathways in human-modified tropical landscapes: new insights from forest succession, forest fragmentation and landscape ecology research. Biological Reviews, 92, 326–340.
Balvanera, P., Lott, E., Segura, G., Siebe, C. e Islas, A. (2002). Patterns of β-diversity in a Mexican tropical dry forest. Journal of Vegetation Science, 13, 145–158.
Banda, K., Delgado-Salinas, A., Dexter, D., Linares-Palomino, R., Oliveira-Filho, A. et al. (2016). Plant diversity patterns in neotropical dry forests and their conservation implications. Science, 353, 1383–1387.
Boyás, J., Cervantes, M., Javelly, J., Linares, M., Solares, F., Soto, R. et al. (2001). Diagnóstico Forestal del Estado de Morelos. Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias. Campo Experimental Zacatepec, Morelos. Recuperado el 09 agosto, 2016 de: http://biblioteca.inifap.gob.mx:8080/xmlui/bitstream/handle/123456789/3008/forestal5.pdf?sequence=1
Carreón-Santos, R. y Valdez-Hernández, J. (2014). Estructura y diversidad arbórea de la vegetación secundaria derivada de una selva mediana subperennifolia en Quintana Roo. Revista Chapingo Serie Ciencias Forestales y del Ambiente, 20, 119–130.
Ceballos, G., Martínez, L., García, A., Espinoza, E., Bezaury J. y Dirzo, R. (2010). Diversidad, amenazas y áreas prioritarias para la conservación de las Selvas Secas del Pacífico de México. México D.F.: Fondo de Cultura Económica, Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Ceccon, E., Huante, P. y Rincón, E. (2006). Abiotic factors influencing tropical dry forests regeneration. Brazilian Archives of Biology and Technology, 49, 305–312.
Clements, F. (1916). Plant succession: an analysis of the development of vegetation. Washington D.C.: Carnegie Institution of Washington Publication.
Coehlo, P., Ferreira, P., de Paiva, E., Apgaua, M., Gini, B., de Oliveira, G. et al. (2016). Tree succession across a seasonally dry tropical forest and forest-savanna ecotone in northern Minas Gerais, Brazil. Journal of Plant Ecology, 10, 859–868.
Colwell, R., Xuan-Mao, C. y Chang, J. (2004). Interpolating, Extrapolating, and Comparing incidence-based species accumulation curves. Ecology, 85, 2717–2727.
Colwell, R. (2013). EstimateS: statistical estimation of species richness and shared species from samples. Version 9.1.0. Recuperado el 12 abril, 2016 de: http://purl.oclc.org/estimates
Conabio (Comisión Nacional para el Conocimiento y Uso de la Biodiversidad). (1997). Provincias biogeográficas de México. Escala 1: 4000000. Catálogo de metadatos geográfico. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad, México. Recuperado el 19 mayo, 2016 de: http://www.conabio.gob.mx/informacion/metadata/gis/rbiog4mgw.xml?_httpcache=yes&_xsl=/db/metadata/xsl/fgdc_html.xsl&_indent=no
Comisión Nacional Forestal. (2012). Inventario Nacional Forestal y de Suelos. Informe 2004-2009. Secretaría de Medio Ambiente y Recursos Naturales. Jalisco, México. Recuperado el 03 agosto, 2016 de: http://www.cnf.gob.mx:8090/snif/portal/infys/temas/resultados-2004-2009
Contreras-MacBeath, T., Jaramillo-Monroy, F. y Boyás, J. (2006). La diversidad biológica en Morelos. Estudio del Estado. Morelos, México: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad, Universidad Autónoma del Estado de Morelos.
Corella, J., Valdez-Hernández, J., Cetina, V., González, F., Trinidad, A. y Aguirre, J. (2001). Estructura forestal de un bosque de mangles en el noreste del estado de Tabasco, México. Ciencia Forestal en México, 26, 73–102.
Crowther, T., Glick, H., Covey, K., Bettigole, C., Maynard, D., Thomas, S. et al. (2015). Mapping tree density at a global scale. Nature, 525, 201–205.
Curtis, J. y McIntosh, R. (1951). An upland forest continuum in the pariré-forest border region of Wisconsin. Ecology, 32, 476–496.
Chazdon, R. (2013). Tropical forest regeneration. En S. Levin (Eds.), Encyclopedia of biodiversity (pp. 277–286). Waltham, USA: Academic Press.
Chazdon, R. (2014). Second growth: the promise of tropical forest regeneration in an age of deforestation. Chicago: The University of Chicago Press.
Chazdon, R., Letcher, S., van Breugel, M., Martínez-Ramos, M., Bongers, F. y Finegan, B. (2007). Rates of change in tree communities of secondary Neotropical forests following major disturbances. Philosophical Transactions of the Royal Society Series B, 362, 273–289.
De la O-Toris, J., Maldonado, B. y Martínez-Garza, C. (2012). Efecto de la perturbación en la comunidad de herbáceas nativas y ruderales de una selva estacional mexicana. Botanical Sciences, 90, 469–480.
Derroire, G., Balvanera, P., Castellanos-Castro, C., Decocq, G., Kennard, D., Lebrija-Trejos, E. et al. (2016). Resilience of tropical dry forests – a meta-analysis of changes in species diversity and composition during secondary succession. Oikos, 125, 1386–1397.
Derroire, G., Tigabu, M., Odén, P. y Healey, J. (2016). The effects of established trees on woody regeneration during secondary succession in tropical dry forests. Biotropica, 48, 290–300.
Di Rienzo, J., Casanoves, F., Balzarini, M., Gonzalez, L., Tablada, M. y Robledo, C. (2008). InfoStat versión 2013. Grupo InfoStat, FCA. Universidad Nacional de Córdoba, Argentina. Recuperado el 20 mayo, 2016 de: http://www.infostat.com.ar
Dirzo, R., Young, H., Mooney, H. y Ceballos, G. 2011. Seasonally dry tropical forest. Ecology and conservation. Washington, DC: Island Press.
Dorado, O., Arias, D., Maldonado, B., Sorani, V., Ramírez, R. y Leyva, E. (2005). Plan de conservación y manejo de la Reserva de la Biosfera Sierra de Huautla. Cuernavaca, Morelos: Secretaría de Medio Ambiente y Recursos Naturales, Comisión Nacional de Áreas Naturales Protegidas.
Drew, A., Boley, J., Zhao, Y., Johnston, M. y Wadsworth, F. (2009). Sixty-two years of change in subtropical wet forest structure and composition at El Verde, Puerto Rico. Interciencia, 34, 34–40.
Finegan, B. (1996). Pattern and process in Neotropical secondary rain forests: the first 100 years of succession. Trends in Ecology & Evolution, 11, 119–124.
Fisher, R., Corbet, A. y Williams, C. (1943). The relation between the number of species and the number of individuals in a random sample of an animal population. Journal of Animal Ecology, 12, 42–58.
García, E. (2004). Modificaciones al sistema de clasificación climática de Köppen (para adaptarlo a las condiciones de la República Mexicana). México D.F.: Instituto de Geografía, Universidad Nacional Autónoma de México.
Gómez-Pompa, A. y Vázquez-Yanes, C. (1985). Estudios sobre la regeneración de selvas en regiones cálido húmedas de México. En A. Gómez-Pompa y S. del Amo (Eds.), Investigaciones sobre la regeneración de selvas altas en Veracruz, México (pp. 1–25). Xalapa: Instituto Nacional de Investigaciones sobre Recursos Bióticos.
González, B. y López, L. (2008). Flora del pastizal tropical de la selva baja caducifolia (Tesis). Departamento de Zootecnia, Universidad Autónoma Chapingo. Estado de México, México.
González-Valdivia, N., Ochoa-Gaona, S., Ferguson, B., Pozo, C., Kampichler C. y Pérez-Hernández, I. (2012). Análisis comparativo de la estructura, diversidad y composición de comunidades arbóreas de un paisaje agropecuario en Tabasco, México. Revista Mexicana de Biodiversidad, 83, 83–99.
Hansen, M., Potapov, P., Moore, R., Hancher, M., Turubanova, S., Tyukavina, A. et al. (2013). High-Resolution Global Maps of 21st-Century Forest Cover Change. Science, 342, 850–853.
Hutcheson, K. (1970). A test for comparing diversities based on the Shannon formula. Journal of Theoretical Biology, 29, 151–154.
Janzen, D. (1988). Management of habitat fragments in a tropical dry forest: growth. Annals of the Missouri Botanical Garden, 75, 105–116.
Kennard, D. (2002). Secondary forest succession in a tropical dry forest: patterns of development across a 50-year chronosequence in lowland Bolivia. Journal of Tropical Ecology, 18, 53–66.
Lebrija-Trejos, E., Bongers, F. Pérez-García, A. y Meave, J. (2008). Successional change and resilience of a very dry tropical deciduous forest following shifting agriculture. Biotropica, 40, 422–431.
Lebrija-Trejos, E., Meave, J., Poorter, L., Pérez-García, E. y Bongers, F. (2010). Pathways, mechanisms and predictability of vegetation change during tropical dry forest succession. Perspectives in Plant Ecology, Evolution and Systematics, 12, 267–275.
Lebrija-Trejos, E., Pérez-García, A., Meave, J., Poorter, L. y Bongers, F. (2011). Environmental changes during secondary succession in a tropical dry forest in Mexico. Journal of Tropical Ecology, 27, 477–489.
Leirana-Alcocer, J., Hernández-Betancourt, S., Salinas-Peba, L. y Guerrero-González, L. (2009). Cambios en la estructura y composición de la vegetación relacionados con los años de abandono de tierras agropecuarias en la Selva Baja Caducifolia Espinosa de la Reserva de Dzilam, Yucatán. Polibotánica, 27, 53–70.
Leiva, J., Rocha, O., Mata, R. y Gutiérrez-Soto, M. (2009). Cronología de la regeneración del bosque tropical seco en Santa Rosa, Guanacaste, Costa Rica. II. La vegetación en relación con el suelo. Revista de Biología Tropical, 57, 817-836.
Lesica, P., McCune, B., Cooper, S. y Hong, W. (1991). Differences in lichen and bryophyte communities between old-growth and managed second-growth forests in the Swan Valley, Montana. Canadian Journal of Botany, 69, 1745-1755.
Letcher, S. y Chazdon, R. (2009). Rapid recovery of biomass, species richness, and species composition in a forest chronosequence in Northeastern Costa Rica. Biotropica, 41, 608–617.
Loot, E. y Atkinson, T. (2010). Diversidad florística. En G. Ceballos, L. Martínez, A. García, E. Espinoza, J. Bezaury y R. Dirzo (Eds.), Diversidad, amenazas y áreas prioritarias para la conservación de las selvas secas del Pacífico de México (pp. 63–76). México D.F.: Fondo de Cultura Económica, Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
López-Toledo, J., Valdez-Hernández, J., Pérez-Farrera, M. y Cetina-Alcalá, V. (2012). Composición y estructura arbórea de un bosque tropical estacionalmente seco en la Reserva de la Biósfera la Sepultura, Chiapas. Revista Mexicana de Ciencias Forestales, 3, 43–56.
Maass, J., Jaramillo, V., Martínez-Yrízar, A., García-Oliva, F., Pérez-Jiménez, A. y Sarukhán, J. (2002). Aspectos funcionales del ecosistema de selva baja caducifolia en Chamela, Jalisco. En F. Noguera, J. Vega, A. García y M. Quesada (Eds.), Historia natural de Chamela (pp. 526–541). México D.F.: Instituto de Biología, Universidad Nacional Autónoma de México.
Magurran, A. y McGill, B. (2014). Biological diversity: frontiers in measurement and assessment. New York: Oxford University Press.
Maplesoft. (2015). A division of Waterloo Maple Inc. Maplesoft™, Cybernet Systems Co. Ltd. in Japan. 615 Kumpf Drive. Waterloo, Canadá. Recuperado el 02 agosto, 2016 de: http://www.maplesoft.com/products/Maple/
Margalef, R. (1972). Evolution and measurement of species diversity. Taxon, 21, 213–251.
Martínez-Cruz, J., Méndez-Toribio, M., Cortés-Flores, J., Coba-Pérez, P., Cornejo-Tenorio, G. y Ibarra-Manríquez, G. (2013). Estructura y diversidad de los bosques estacionales desaparecidos por la construcción de la presa Gral. Francisco J. Múgica, en la depresión del Balsas, Michoacán, México. Revista Mexicana de Biodiversidad, 84, 1216–1234.
Martínez-Garza, C., Osorio-Beristain, M., Valenzuela-Galván, D. y Nicolás-Medina, A. (2011). Intra and inter-annual variation in seed rain in a secondary dry tropical forest excluded from chronic disturbance. Forest Ecology and Management, 262, 2207–2218.
Martínez-Ramos, M. y García-Orth, X. (2007). Sucesión ecológica y restauración de selvas húmedas. Boletín de la Sociedad Botánica de México, 80, 69–84.
Maza-Villalobos, S., Balvanera, P. y Martínez-Ramos, M. (2011). Early regeneration of tropical dry forest from abandoned pastures: contrasting chronosequence and dynamic approaches. Biotropica, 43, 666–675.
McCune, B. y Grace, J. (2002). Analysis of ecological communities. Gleneden Beach, Oregon: MjM Software Design.
McCune, B. y Mefford, M. (2011). PC-ORD. Multivariate analysis of ecological data, Version 6. Gleneden Beach, Oregon: MjM Software Design.
Méndez-Toribio M., Martínez-Cruz, J., Cortés-Flores, J., Rendón-Sandoval, F. y Ibarra-Manríquez, G. (2014). Composición, estructura y diversidad de la comunidad arbórea del bosque tropical caducifolio en Tziritzícuaro, Depresión del Balsas, Michoacán, México. Revista Mexicana de Biodiversidad, 85, 1117–1128.
Miles, L., Newton, A., DeFries, R., Ravilious, C., May, I., Blyth, S. et al. (2006). A global overview of the conservation status of tropical dry forests. Journal of Biogeography, 33, 491–505.
Molina, S. y Lugo, A. (2006). Recovery of a subtropical dry forest after abandonment of different land uses. Biotropica, 38, 354–364.
Monroy-Ortíz, C. (1997). La leña como recurso energético, implicaciones ecológicas y etnobotánicas (Tesis de Maestría). Facultad de Ciencias, Universidad Nacional Autónoma de México. México D.F.
Moreno, C. (2001). Métodos para medir la biodiversidad. M&T–Manuales y Tesis SEA, Vol.1. Zaragoza, España: CYTED, ORCYT-UNESCO, Sociedad Entomológica Aragonesa.
Mueller-Dombois, D. y Ellenberg, H. (2002). Aims and methods of vegetation ecology. Caldwell, New Jersey: The Blackburn Press.
Murphy, P. y Lugo, A. (1986). Ecology of tropical dry forest. Annual Review of Ecology and Systematics, 17, 67–88.
Norden, N., Angarita, H., Bongers, F., Martínez-Ramos, M., Granzow-de la Cerda, I., van Breugelf, M. et al. (2015). Successional dynamics in Neotropical forests are as uncertain as they are predictable. PNAS, 112, 8013–8018.
Peña-Ramírez, V. y Bonfil, C. (2003). Efecto del fuego en la estructura poblacional y la regeneración de dos especies de encinos (Quercus liebmanii Oerst. y Quercus magnoliifolia Née) en la región de la Montaña (Guerrero), México. Boletín de la Sociedad Botánica de México, 72, 5–20.
Pineda-García, F., Arredondo-Amezcua, L. y Ibarra-Manríquez, G. (2007). Riqueza y diversidad de especies leñosas del bosque tropical caducifolio El Tarimo, Cuenca del Balsas, Guerrero. Revista Mexicana de Biodiversidad, 78, 129–139.
Poorter, L., Bongers, F., Mitchell, A., Almeyda, A., Balvanera, P., Becknell, J. et al. (2016). Biomass resilience of Neotropical secondary forests. Nature, 530, 211–214.
Quesada, M, Sánchez-Azofeita, G., Alvarez-Añorve, M., Stoner, K., Avila-Cabadilla, L., Calvo-Alvarado, J. et al. (2009). Succession and management of tropical dry forests in the Americas: review and new perspectives. Forest Ecology and Management, 258, 1014–1024.
Romero-Duque, L, Jaramillo, V. y Pérez-Jiménez, A. (2007). Structure and diversity of secondary tropical dry forests in Mexico, differing in their prior land-use history. Forest Ecology and Management, 253, 38–47.
Romero-Manzanares, A. y García-Moya, E. (2002). Estabilidad y elasticidad de la composición florística de los piñonares de San Luis Potosí, México. Agrociencia, 36, 243–254
Ruiz, G., Fandiño, M. y Chazdon, R. (2005). Vegetation structure, composition, and species richness across a 56-year chronosequence of dry tropical forest on Providencia Island, Colombia. Biotropica, 37, 520–530.
Rzedowski, J. (2006). Vegetación de México. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. Recuperado el 08 febrero, 2016 de: http://www.biodiversidad.gob.mx/publicaciones/librosDig/pdf/VegetacionMx_Cont.pdf
Sánchez-Azofeita, G. y Portillo-Quintero, C. (2011). Extent and drivers of change of neotropical seasonally dry tropical forests. En R. Dirzo, H. Young, H. Mooney y G. Ceballos (Eds.), Seasonally dry tropical forest. Ecology and Conservation (pp. 3–22). Washington, DC: Island Press.
Sánchez-Velásquez, L., Hernández, G., Carranza, M., Pineda, Ma., Cuevas, R. y Aragón, F. (2002). Estructura arbórea del bosque tropical caducifolio usado para la ganadería extensiva en el norte de la Sierra de Manantlán, México. Antagonismo de usos. Polibotánica, 13, 25–46.
Seaby, R. y Henderson, P. (2006). Species diversity and richness. Version 4.1.2. Pisces Conservation Ltd. Lymington, England. Recuperado el 09 agosto, 2016 de: http://www.pisces-conservation.com/softdiversity.html
Servicio Meteorológico Nacional. (2010). Normales climatológicas de la estación El Limón, periodo 1951-2010. Comisión Nacional del Agua. Recuperado el 17 julio, 2016 de: http://smn1.conagua.gob.mx/index.php?option=com_content&view=article&id=42&Itemid=75
Sheil, D. y Burslem, D. (2003). Disturbing hypotheses in tropical forests. Trends in Ecology & Evolution, 18, 18–26.
Slik, J., Arroyo-Rodríguez, V., Shin-Ichiro, A., Alvarez-Loayza, P., Alves, L., Ashton, P. et al. (2015). An estimate of the number of tropical tree species. Proceedings of the National Academy of Sciences, 112, 7472–7477.
Spurr, S. (1952). Origin of the concept of forest succession. Ecology, 33, 426–427.
Trejo, I. (1998). Distribución y diversidad de selvas bajas de México: relaciones con el clima y el suelo (Tesis Doctoral). Facultad de Ciencias, Universidad Nacional Autónoma de México. México D.F.
Trejo, I. (2010). Las selvas secas del Pacífico mexicano. En G. Ceballos, L. Martínez, A. García, E. Espinoza, J. Bezaury y R. Dirzo (Eds.), Diversidad, amenazas y áreas prioritarias para la conservación de las selvas secas del Pacífico de México (pp. 41–52). México D.F.: Fondo de Cultura Económica, Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Trejo, I. y Dirzo, R. (2002). Floristic diversity of Mexican seasonally dry tropical forests. Biodiversity and Conservation, 11, 2063–2084.
Valdez-Hernández, J. (2002). Aprovechamiento forestal de manglares en el estado de Nayarit, costa Pacífica de México. Madera y Bosques, 8, 129–145.
van Breugel, M., Bongers, F. y Martínez-Ramos, M. (2007). Species dynamics during early secondary forest succession: recruitment, mortality and species turnover. Biotropica, 35, 610–619.
Vieira, D. y Scariot, A. (2006). Principles of natural regeneration of tropical dry forests for restoration. Restoration Ecology, 14, 11–20.
Wahabu, S., Fosu-Mensah, B. y Nyame, F. (2015). Impact of charcoal production on physical and chemical properties of soil in the Central Gonja District of the Northern Region, Ghana. Environment and Natural Resources Research, 5, 11–18.
Westoby, M., Walker, B. y Noy-Meir, I. (1989). Opportunistic management for rangelands not at equilibrium. Journal of Range Management, 42, 266–274.
Zacarías-Eslava, L., Cornejo-Tenorio, G., Cortés-Flores, J., González-Castañeda, N. y Ibarra-Manríquez, G. (2011). Composición, estructura y diversidad del cerro El Águila, Michoacán, México. Revista Mexicana de Biodiversidad, 82, 854–869.