Aspectos poblacionales del burgao Cittarium pica (Gastropoda: Tegulidae) en el litoral rocoso de Santa Marta, Magdalena, Colombia
Carlos Andrés Daza-Guerra a, Neis José Martínez-Hernández b, * y Juan Carlos Narváez- Barandica c
a Universidad Nacional de Colombia, Sede Caribe, Instituto de Estudios en Ciencias del Mar-Cecimar, Invemar, Calle 25 # 2-55, El Rodadero, Santa Marta, Colombia
b Grupo de Investigación Biodiversidad del Caribe colombiano, Programa de Biología, Facultad de Ciencias Básicas, Universidad del Atlántico, Ciudadela Universitaria, Km 7-Vía Puerto Colombia. Barranquilla, Colombia
c Grupo de Investigación Biodiversidad y Ecología Aplicada (GIBEA), Programa de Ingeniería Pesquera, Facultad de Ingeniería, Universidad del Magdalena, Carrera 32 Núm. 22-08, Santa Marta, Colombia
*Autor para correspondencia: neyjosemartinez@gmail.com (N. J. Martínez Hernández)
Resumen
Se evaluaron algunos aspectos poblacionales de Cittarium pica y su relación con variables ambientales y características de cobertura del sustrato en litorales rocosos en 3 estaciones (Bahía Concha = B.C, Bonito Gordo = B.G y Taganga = TAG) en Santa Marta, Magdalena, Colombia. El área de estudio presentó una abundancia de 3,821 individuos y una densidad de 2.65 (± 4.76) Ind/m2. Se estimó que cada individuo aporta 0.0482 g/Ind de biomasa al siguiente nivel trófico, para un total de 0.1279 g/m2. En el área de estudio predominaron los individuos de tallas pequeñas (98.09%), seguido por tallas medianas (1.83%) y por último tallas grandes (0.08%). Al tener en cuenta los individuos recapturados, se observó que la población de C. pica se comporta como una población abierta. Los parámetros de crecimiento de Von Bertalanffy estimaron una longitud asintótica (L∞) de 94.14 mm y un coeficiente de crecimiento (K) de 0.32/año, mientras el crecimiento observado fue de 0.1094 mm/día. Se estimó una tasa de mortalidad total (Z) de 1.71/año y una tasa de explotación (E) de 0.65. Se demostró una fuerte sobreexplotación de C. pica en los litorales rocosos de Santa Marta, Colombia.
Palabras clave:
Cittarium pica; Densidad; Estructura de tallas; Tamaño poblacional; Crecimiento; Mortalidad; Biomasa
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Population aspects of burgao Cittarium pica (Gastropoda: Tegulidae) in the rocky shore of Santa Marta, Magdalena, Colombia
Abstract
Several population aspects of Cittarium pica and their relationship with environmental variables and substratum coverage characteristics were assessed in rocky littorals in 3 stations (Bahía Concha = B.C, Bonito Gordo = B.G and Taganga = TAG) at Santa Marta, Magdalena, Colombia. The study area presented an abundance of 3,821 individuals, and a density of 2.65 (± 4.76) Ind/m2. It was estimated that each individual provides 0.0482 g/Ind of biomass to the next trophic level, providing a total of 0.1279 g/m2. Small size individuals predominated (98.09%), followed by medium size individuals (1.83%), and large size individuals (0.08%). Considering the recaptured individuals, it was observed that the C. pica population in the study area behaved as an open population. Von Bertalanffy growth parameters estimated an asymptotic length (L∞) of 94.14 mm, and a growth coefficient (K) of 0.32 mm/year, whereas the observed growth was 0.1094 mm/day. Total mortality rate (Z) was estimated in 1.71/year, and exploitation rate (E) in 0.65. A strong C. pica overexploitation was proved in the rocky littorals of Santa Marta, Colombia.
Keywords:
Cittarium pica; Density; Size structure; Population size; Growth; Mortality; Biomass
Introducción
El burgao Cittarium pica (Linnaeus, 1758), es un gasterópodo que se distribuye en la región centro-septentrional del Gran Caribe, desde los cayos de Florida y las Antillas Mayores hasta la costa norte de Suramérica, habita comúnmente el mesolitoral e infralitoral superior de los litorales rocosos (Robertson, 2003). En Colombia, C. pica ha sido reportado desde el Urabá Chocoano hasta la península de La Guajira y en las islas de San Andrés y Providencia (Osorno-Arango y Díaz-Merlano, 2006; Osorno-Arango et al., 2012). La carne de C. pica se aprovecha con fines alimenticios, mientras que la concha es empleada para la elaboración de artesanías y obtención de nácar (Osorno-Arango, 2005); centrándose su captura en ejemplares de tallas grandes (megadesovadores), lo que pone en peligro la capacidad de renovación poblacional de la especie (Osorno-Arango et al., 2009). Es así, como el aprovechamiento de C. pica ha llevado a una reducción considerable de las poblaciones en varios sectores del mar Caribe colombiano (Robertson, 2003; Schmidt et al., 2002); donde ha sido categorizada como especie vulnerable en el Libro Rojo de Invertebrados Marinos de Colombia (Gracia y Díaz-Merlano, 2002).
Los estudios sobre la dinámica poblacional de esta especie en el Caribe colombiano son fundamentales debido a su importancia socioeconómica, además de que puede constituir un eslabón importante en el flujo energético de la red trófica de los litorales rocosos del medio marino; lo cual se ve reflejado al ser uno de los mayores consumidores de biomasa algal (Mclean, 1967). A su vez, C. pica sirve como fuente de alimento a gasterópodos (Plicopurpura patula), cefalópodos (Octopus vulgaris), peces (Diodon hystrix, Halichoeres radiatus y Epinephelus adscensionis) y aves (Haematopus ostralegus) (Randall, 1964). Otro punto importante de C. pica es su contribución a la supervivencia del cangrejo ermitaño (Coenobita clypeatus) y de algunos epibiontes que encuentran en su concha protección o un sustrato donde crecer (Osorno-Arango, 2005; Osorno-Arango y Sanjuan, 2009; Randall, 1964).
Entre los principales estudios sobre la dinámica poblacional de C. pica en el mar Caribe, se destaca el desarrollado en las Islas Vírgenes y Puerto Rico, donde determinaron tamaños entre 25 y 77 mm y, un crecimiento de 1-1.48 mm por mes (Randall, 1964). Posteriormente, en los Cayos Exuma en Bahamas se estimó una tasa de mortalidad natural (M) en 1.05/año y se observaron mayores tasas de crecimiento en lugares con baja densidad de C. pica (K = 0.3648 y L∞ = 96.60 mm) (Debrot, 1990a, b). Estos mismos autores también determinaron que en litorales rocosos expuestos al oleaje, C. pica presenta una mayor densidad, pero con menores tasas de supervivencia y de crecimiento, así como un menor tamaño de la concha. Por otro lado, en Costa Rica documentaron que la densidad de C. pica en sitios donde no se aprovecha es 3 veces mayor comparado con donde sí lo hacen; aunque sin observar diferencias en los parámetros de crecimiento entre esos sitios (Schmidt et al., 2002). En el caso del Caribe colombiano, se destacan los estudios sobre densidades poblacionales en los litorales rocosos de la parte continental (Osorno-Arango, 2005) e insular (Osorno-Arango et al., 2012). Las bajas densidades poblaciones y la mayor abundancia de animales pequeños, fueron fundamentales para proponer un plan de investigación para su conservación en Colombia (Osorno-Arango et al., 2009); en el cual se promueven estudios sobre el conocimiento bioecológico de C. pica en Colombia, como el tamaño poblacional, reclutamiento, mortalidad, biomasa y crecimiento en zonas de amortiguación de parques naturales.
Teniendo en cuenta lo anterior, en el presente trabajo se evaluaron algunos aspectos poblacionales de C. pica y su relación con variables ambientales, así como características de cobertura del sustrato en los litorales rocosos de 3 sectores en Santa Marta (Taganga, Bonito Gordo y Bahía Concha), Colombia.
Materiales y métodos
El presente estudio se realizó en 3 litorales rocosos (estaciones) de las playas de Santa Marta: Taganga (TAG), Bonito Gordo (B.G) y Bahía Concha (B.C) (fig. 1). Debido a la entrada al mar de las estribaciones de la Sierra Nevada de Santa Marta (SNSM), el área presenta frecuentemente fondos rocosos y parches de formaciones arrecifales (Bartels-, 1970). En su fondo marino poco profundo, también se pueden observar praderas de fanerógamas marinas, compuestas principalmente por Thalassia testudinum (Ardila et al., 1997). En general, en este sector se presentan 2 épocas climáticas: una seca, acompañada de vientos alisios del norte (diciembre-abril) y una época lluviosa, acompañada de alisios del sur (agosto-octubre) (Andrade, 2001).
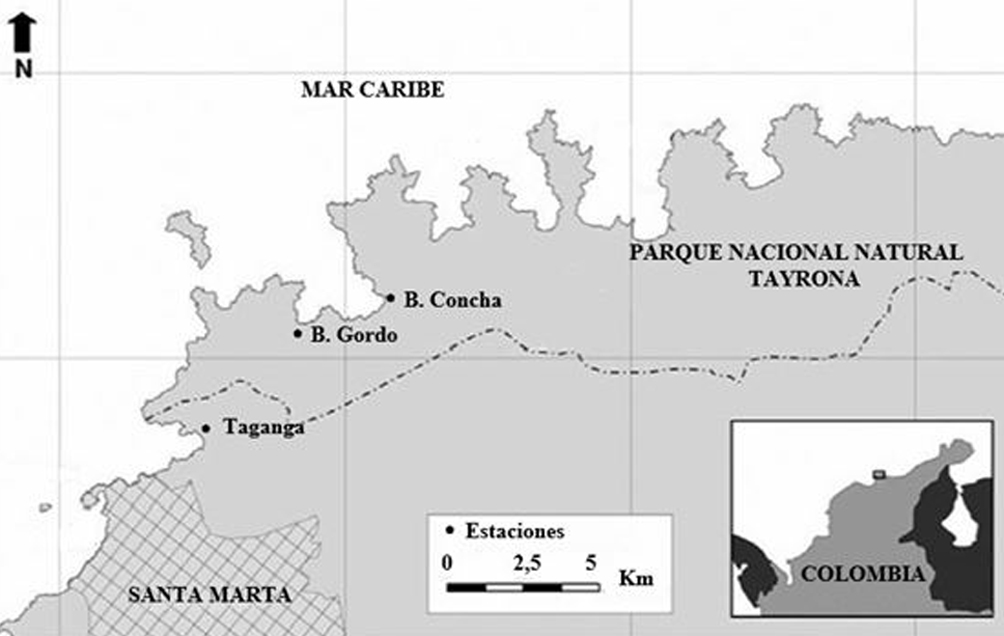
La estación TAG forma parte de la zona amortiguadora del Parque Nacional Natural Tayrona (PNNT) en su límite sur, se encuentra ubicada entre los 11°16’01.13” N, 74°11’01.13” O. Registra una temperatura promedio anual de 28 °C y precipitación promedio anual de 578 mm. Se caracteriza por presentar un litoral rocoso en forma de acantilado consolidado y estable (Invemar, 2005), con playas estrechas de arena y grava conformada por fragmentos de origen litogénicos y carbonato de calcio de origen coralino.
La estación B.G se encuentra localizada a 11°17’50.86” N, 74°10’08.01” O; mientras que la estación B.C está a 11°18’00” N, y 74°09’00” O. Son estaciones contiguas dentro del PNNT, que comparten condiciones geomorfológicas y ambientales, tales como zonas de estribaciones monta-ñosas, constituidas por rocas ígneas (basalto, mica blanca y negra), consolidadas y fragmentadas (Almanza et al., 2004). Ambas estaciones presentan 2 sectores rocosos, uno oriental y otro occidental, separados por una playa de arena. Las 3 estaciones están influidas por las descargas de la pluma del río Magdalena, las escorrentías de los cerros circundantes, por desagües de la ciénaga Grande de Santa Marta (CGSM) y la actividad del oleaje sobre el sustrato. Las condiciones climáticas son similares a la estación TAG, debido a su cercana localización en el área del PNNT.
En cada estación (B.C, B.G y TAG), se realizaron muestreos mensuales, desde mayo hasta diciembre de 2015, lo que dio un total de 8 muestreos por cada lugar. Por estación, se realizaron 2 transectos lineales de 30 m en la zona intermareal del litoral rocoso, paralelo a la línea de costa. A lo largo de éste, se colocó un cuadrante de 1 m2, intercala do a la derecha y a la izquierda del transecto lineal, para un total de 30 cuadrantes por transectos (Osorno-Arango, 2005). Los muestreos se realizaron entre las 6:00 pm y las 12:00 am, debido a que C. pica es una especie nocturna (Randall, 1964). En cada muestreo se realizaron conteos de individuos dentro de los cuadrantes, con lo que se determinó la abundancia en número de individuos (No. Ind) y la densidad poblacional en Ind/m2. La densidad calculada por transecto y estaciones fue comparada usando intervalos de confianza de 95%, y realizando una comparación visual basada en la superposición de los intervalos de confianza para establecer si existen diferencias significativas (Cumming et al., 2007). Las densidades estimadas fueron categorizadas de acuerdo a una clasificación de las poblaciones según Osorno-Arango (2005) de la siguiente manera: a) escaso, densidad promedio total por estación ≤ 0.13 Ind/m2; b) intermedio, densidad promedio total por estación entre > 0.13 y 10 Ind/m2, y c) abundante, densidad promedio total por estación > 10 Ind/m2.
Con el propósito de determinar diferencias de las densidades entre meses y estaciones, se realizó un análisis de varianza no paramétrica de Kruskal-Wallis en el programa PAST versión 2.17c.
Adicionalmente, se midió el diámetro de la base de la concha, desde la punta más extrema del labio pasando por la mitad del ombligo (Debrot, 1990a, b) para determinar la estructura de tallas de la población. Esta medida ha sido empleada por muchos autores para el estudio de esta especie (Osorno-Arango, 2005). Las tallas se agruparon en 3 grupos: 1) tallas pequeñas: < 41.3 mm, 2) tallas medianas: entre 41.3 mm y 73.3 mm, y 3) tallas grandes: > 73.3 mm; metodología propuesta por Castell (1987), Debrot (1990a), Robertson (2003) y Osorno-Arango y Díaz-Merlano (2006).
Para cada individuo capturado en este estudio se empleó la metodología “captura-marcaje-recaptura” para cuantificar el tamaño poblacional de C. pica. Se marcaron los individuos con un código conformado por una letra indicando el número de muestreo y el número de captura, mediante una placa de plástico fijada con un pegamento epóxico, lejos del borde de la parte lateral en la última vuelta corporal de la concha. Con los individuos capturados (Cap) y recapturados (Rec) se realizó una matriz de Trellis (Leslie y Chitty, 1951). Esta matriz se empleó para calcular el tamaño poblacional de C. pica con los estimadores de Petersen y Jolly-Seber (J. S) descritos en Krebs (1999), Henderson (2003) y Lemos et al. (2005). Las estimaciones se hicieron en el programa MARK (White y Burnham, 1999). Para ver si los estimadores se ajustaban a los datos observados, se aplicó una prueba de contingencia de Chi cuadrado en el programa PAST versión 2.17c.
Las medidas recolectadas se agruparon en marcas de clase de 3 mm y mediante el programa FISAT II. Empleando el método ELEFAN I (Pauly y David, 1981; Pauly, 1984), se determinaron los parámetros óptimos de crecimiento tales como la longitud asintótica L∞ y la constante de crecimiento K. También se calculó el índice de bondad de ajuste (Rn), el cual se basa en la inclusión del mayor número de puntos máximos o suma de máximos explicada (SME) y en la suma de todos los puntajes máximos ajustados en la curva o suma de máximos disponibles (SMD). De este modo, la razón SME/SMD se convierte en una forma de bondad de ajuste (Sparre y Venema, 1992). Adicionalmente, se calculó el índice de crecimiento phi prima (Ø’) mediante la ecuación propuesta por Pauly y Munro (1984) para poder realizar comparaciones con otros autores, ya que esta se considera una medida de similitud del patrón de crecimiento:
Ø’= Log10(K) + 2Log10(L∞)
Adicional a lo anterior, se calculó el crecimiento observado para cada individuo recapturado, para lo cual se dividió la diferencia de la talla de la primera captura y la última recaptura entre el número de días transcurridos y posteriormente, se promedió para estimar el crecimiento observado por estaciones.
Se estimó la mortalidad total (Z) a partir de una curva de captura linealizada basada en datos de la composición por tallas (Pauly, 1983; Ricker, 1975) con la siguiente ecuación:
Ln(Ni/ ΔTi)= a + b * t’i
donde Ni: número de individuos capturados pertenecientes a la clase de longitud i; t’i: edad relativa de la clase i, la edad es estimada a partir de los datos de tallas, mediante la fórmula inversa de Von Bertalanffi; Δti: tiempo medio requerido por individuo para su crecimiento a través de la clase i.
La mortalidad natural (M) se calculó con la fórmula empírica de Pauly (1980), empleando el valor de la temperatura promedio anual de 27.5 °C (Invemar, 2015):
Log(M)= −0.0066 −0.279 * Log(L∞) + 0.6543 * Log(K) + 0.4634 * Log(T)
donde Log (M): logaritmo decimal de la tasa instantánea de mortalidad natural; Log (T): logaritmo decimal de la temperatura en °C.
La mortalidad por pesca (F) se estimó con la diferencia entre la mortalidad natural (M) y total (Z), conforme a la siguiente fórmula de Appeldoorn (1984) y Sainsbury (1982):
F = Z – M
La tasa de explotación (E) a partir de los valores de (F) y (Z) se estimó (E) mediante la ecuación de Sparre y Venema (1992):
E = F/Z
Para la biomasa, se tomaron las medidas de diámetro de la concha a 25 individuos (Convenio Núm. 025-2015) y se procedió a sacar el material blando de las cochas y su posterior calcinación a 500 °C durante 2 h en una mufla. A las muestras procesadas se les tomó el peso seco y se correlacionaron con el diámetro de la cocha mediante una curva de regresión que se ajustó a un modelo potencial (Y = 3*10-6*X3.0799; R2 = 0.9733; p < 0.05). A partir de la ecuación ajustada, se calculó la biomasa para el total de individuos de C. pica muestreados por transecto, muestreo y estación. Con el fin de determinar las diferencias entre muestras, transectos y estaciones, se hicieron análisis de varianza no paramétrico de Kruskal-Wallis en el programa PAST versión 2.17c.
En cada transecto se determinó la cobertura de algas (C.A) y la cobertura rocosa (C.R) con la ayuda de un cuadrante de 1 m2, dividido en cuadrículas de 10 × 10 cm. En este caso se contaron el número intersecciones de roca y algas por cada cuadrícula en cada cuadrante. La temperatura (T = °C), salinidad (sal = ppm) (dilución de 5 ml de agua de mar por 25 ml de agua destilada) y pH se determinaron con el multiparámetro Extech EC500 (± 1°C, ± 1 ppm ± 0.01 pH), y el oxígeno disuelto (O.D = mg/L) con un multiparámetro Extech DO600 (± 0.4 ppm); mientras que la velocidad del viento (V.V = km/h), se determinó con el anemómetro Extech 45 158 (± 1.4 km/h). Estas variables fueron estandarizadas y se excluyó la cobertura rocosa (C.R) debido a su alta colinealidad con C.A (R = -1). Las variables bióticas fueron densidad, biomasa (g/m2) y promedio de biomasa (g/Nº Ind), las cuales fueron transformadas a Log n(x+1) para cambiar la magnitud de la distancia entre los valores de las variables sin afectar la estructura de los datos y se excluyó la abundancia debido a su alta colinealidad con la densidad (R > 0.9). Para relacionar las variables ambientales con las variables bióticas de la población de C. pica por cada estación, se aplicó la rutina BioENV (Biological-environmental) (Primer 5.0) (Clarke y Ainsworth, 1993; Clarke y Warwick, 1994). Este análisis calcula una serie de coeficientes de correlación armónica de Spearman entre la matriz de similaridad biótica creada en la ordenación y las matrices ambientales derivadas de la combinación secuencial de las variables medidas. El coeficiente máximo obtenido de todas las posibles combinaciones, indica que esa es la que mejor explica el esquema biológico obtenido en el ordenamiento y clasificación (Clarke y Ainsworth, 1993).
Resultados
En el área de estudio se muestrearon en total 3,821 individuos de C. pica, de los cuales 2,215 fueron de Bonito Gordo, 1,137 en Bahía Concha y 469 en Taganga. Con respecto a la densidad, se registró un promedio de 2.65 Ind/m2, valor catalogado dentro de la “categoría intermedio”. Los meses con valor mayor fueron agosto (3.76 Ind/m2) y julio (3.33 Ind/m2), mientras que las menores densidades se presentaron en mayo (0.76 Ind/m2) y diciembre (2.31 Ind/m2). La densidad encontrada en mayo, al ser tan baja, presentó diferencias significativas (p < 0.05) con el resto de muestreos de acuerdo con la prueba de Kruskal-Wallis (fig. 2).
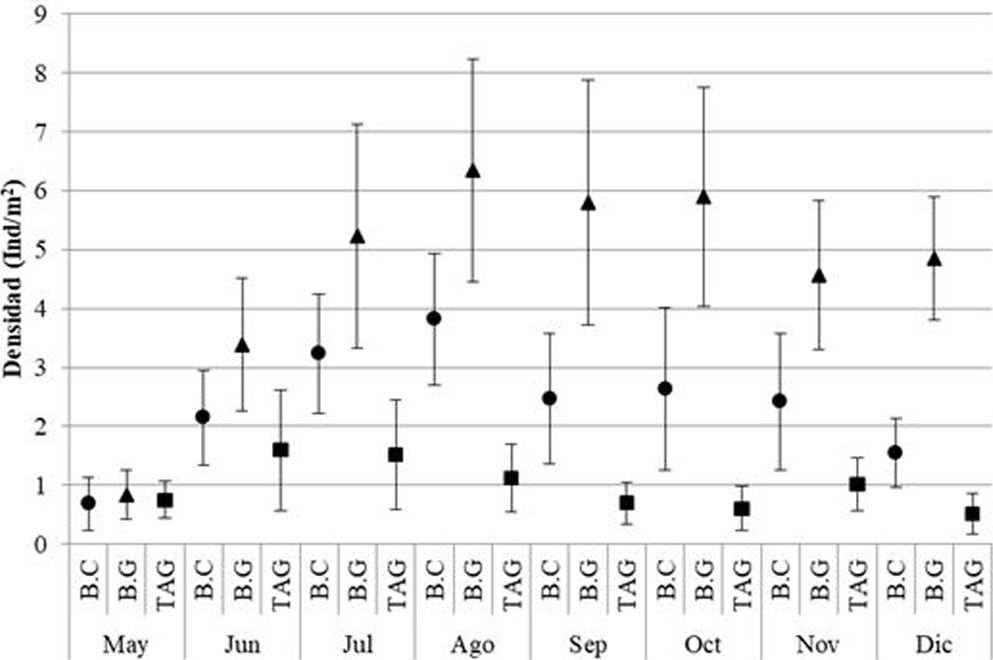
La estación que presentó mayor densidad total fue B.G con 4.61 Ind/m2, seguida por B.C con 2.37 Ind/m2 y por último TAG con una densidad 0.98 Ind/m2. Aunque se determinó que todas las estaciones están catalogadas como densidades intermedias, las 3 estaciones difirieron significativamente en las densidades (Anova de Kruskal-Wallis: H = 88.16; p < 0.05). En mayo se presentaron los menores valores de densidad para B.C (0.68 Ind/m2) y B.G (0.83 Ind/m2) y los mayores en agosto para B.C (3.82 Ind/m2) y B.G (6.35 Ind/m2). En el caso de la estación TAG, se registró el valor menor en diciembre (0.52 Ind/m2) y el mayor en junio (1.60 Ind/m2). Los muestreos de mayo y junio por estaciones no presentaron diferencias significativas entre ellas, mientras que septiembre y diciembre sí presentaron diferencias entre sí (Anova de Kruskal-Wallis: H = 55.88; p < 0.05).
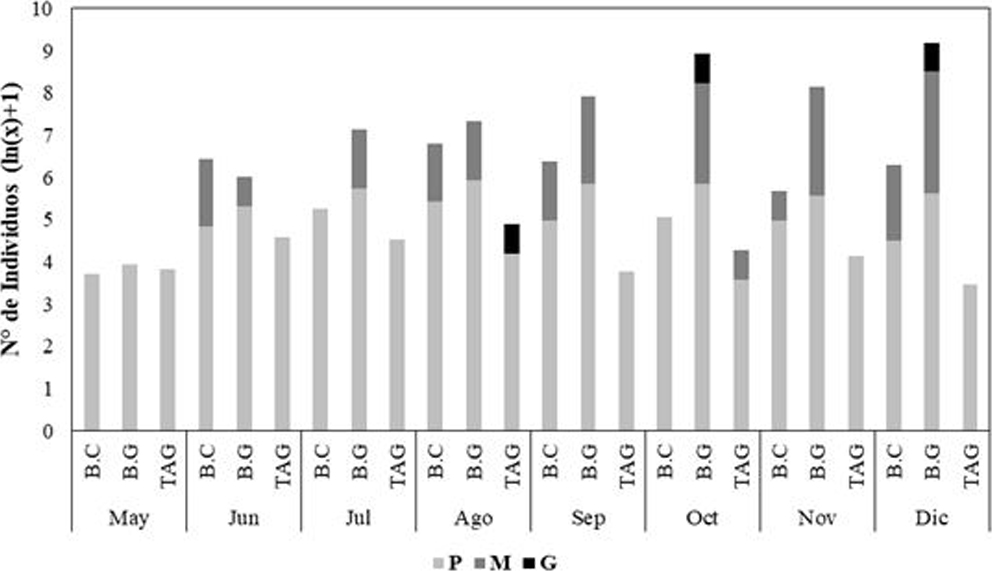
En el área de estudio, la talla máxima fue de 89.95 mm y la mínima de 3.38 mm, con una talla media de 19.19 (± 8.57 mm). Al categorizar las tallas para el área de estudio, se encontró que predominan los individuos de talla pequeña (98.09%), mediana (1.83%) y por último los grandes, con solo 0.08%. En mayo, el 100% de individuos pertenecían a tallas pequeñas; mientras que en diciembre se presentó el porcentaje más bajo (94.47%). Con respecto a los individuos de talla mediana, no se presentaron capturas en mayo, mientras que en diciembre se presentó el mayor porcentaje (5.29%). Los 3 individuos de talla grande medidos en el presente estudio fueron capturados en agosto, octubre y diciembre, respectivamente.
Se observó que entre las 3 estaciones se presentaron diferencias en los tamaños de los caracoles (Anova de Kruskal-Wallis: H = 93.6; p < 0.05). En general, predominaron los individuos de talla pequeña, presentándose mayor frecuencia de estos en TAG (99.57%) y en menor frecuencia en B.G (97.52%). Los individuos de talla mediana son más frecuentes en B.G (2.39%) y fueron más escasos en TAG (0.21%). El mayor número de individuos de talla grande se presentó en B.G con 2 individuos (0.09%), seguido por TAG con 1 (0.21%), mientras B.C no presentó ningún individuo en esta categoría. Desde el punto de vista temporal, también se observó una variación en el tamaño de los caracoles (Anova de Kruskal-Wallis: H = 266.4; p < 0.05). Se determinó que durante los muestreos de mayo, julio y octubre sólo se observaron individuos pequeños en B.C. En TAG, durante los muestreos de mayo, junio, julio, agosto, noviembre y diciembre, la totalidad de individuos capturados fueron de talla pequeña, mientras para B.G sólo fue en mayo. Para las estaciones de B.C y B.G, el mayor porcentaje de individuos medianos se presentó en diciembre con 5.32% y 5.84% respectivamente, mientras que en TAG se presentaron en septiembre (2.78%), mes en el cual solo se capturo 1 ejemplar de talla mediana en esta estación. Los individuos de talla grande fueron muy escasos, presentándose 3 individuos: 2 en B.G (1 en octubre = 0.28% y 1 en diciembre = 0.34%.), en TAG el individuo
de talla grande se presentó en agosto (1.49%) (fig. 3).
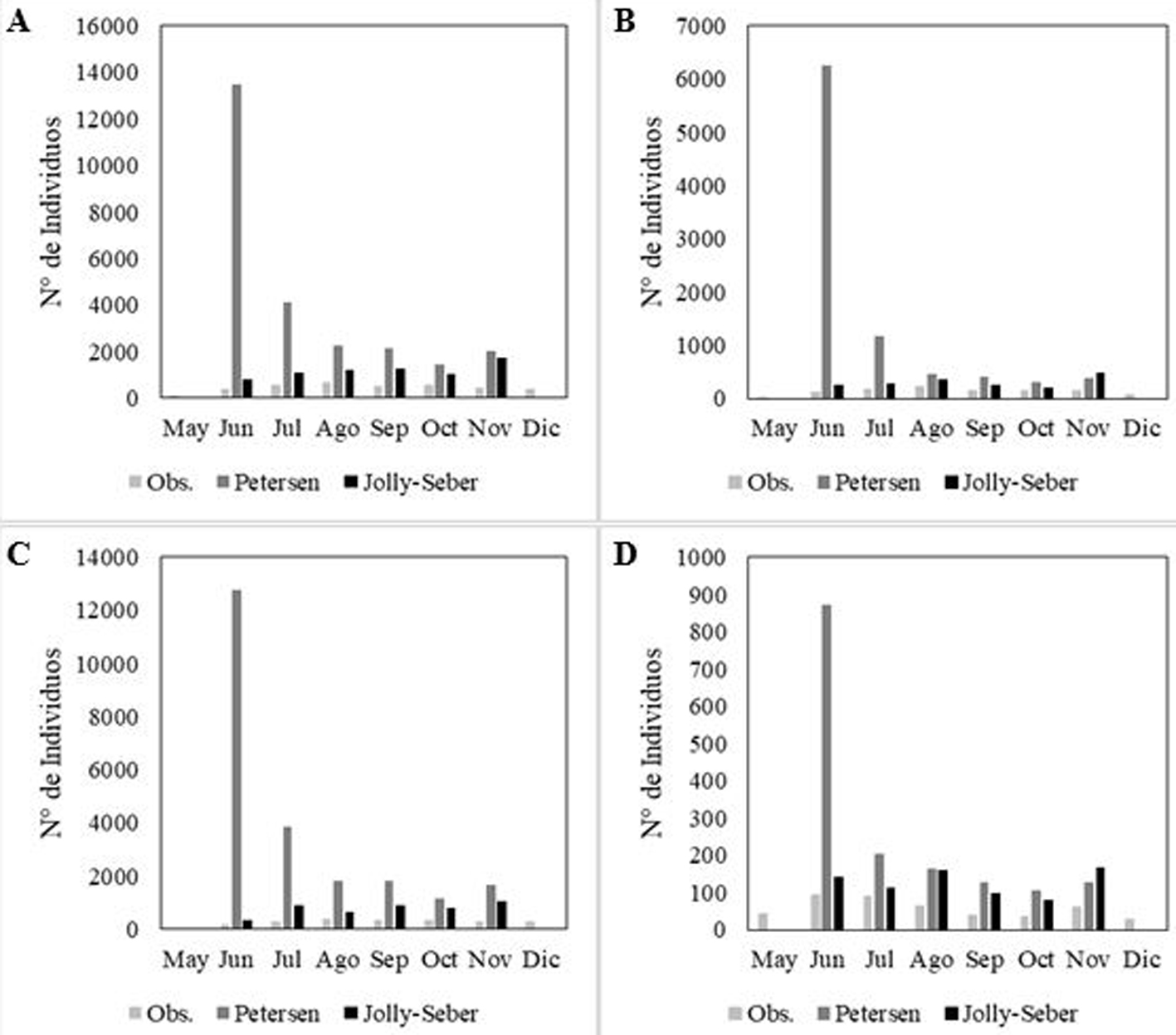
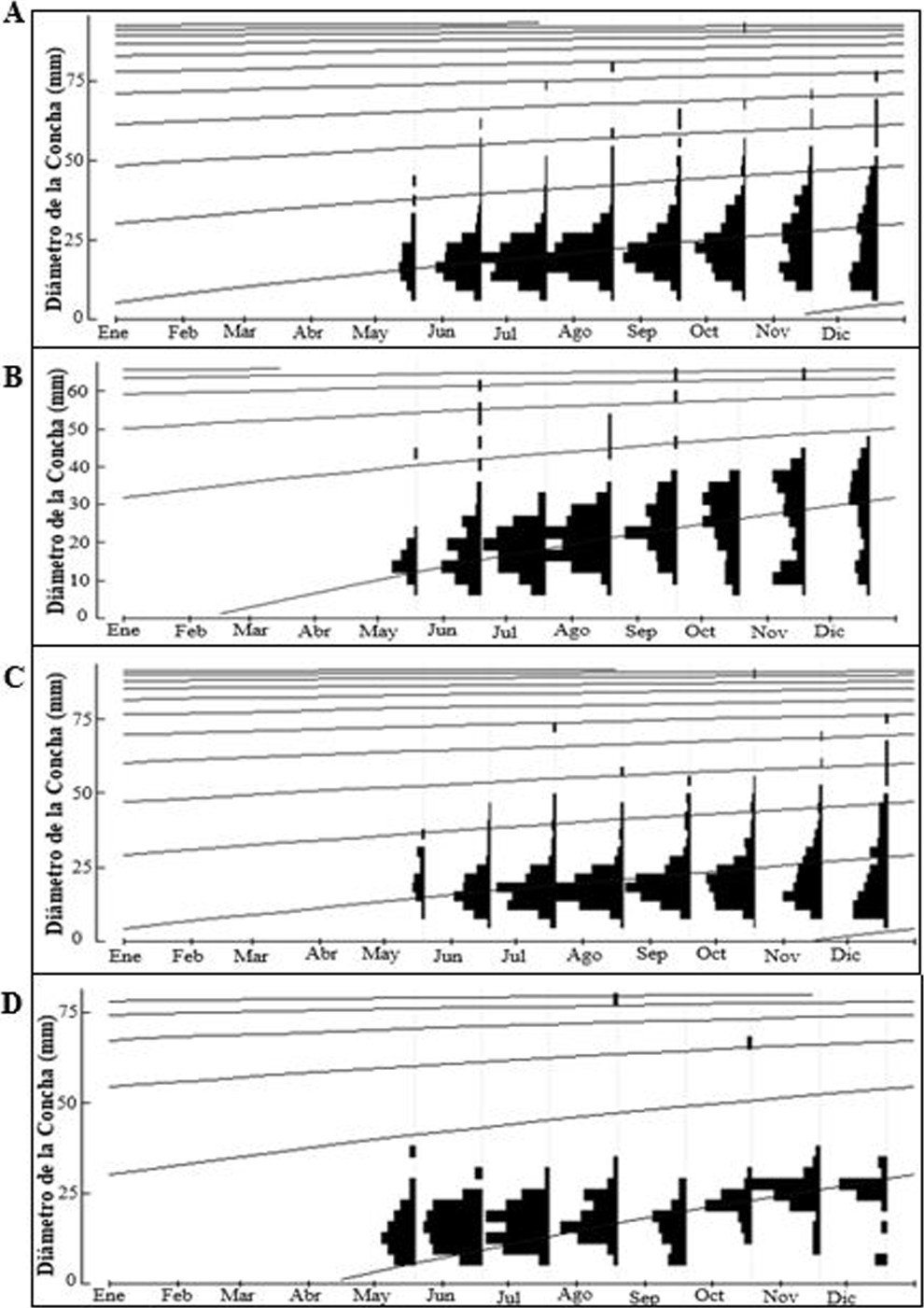
De los 3,821 individuos muestreados en el área de estudio, se recapturaron 800 individuos en 1 o varias ocasiones. La estación B.G presentó la mayor cantidad de individuos recapturados (356), seguido por B.C (324) y por último TAG (120). Mediante una prueba de Chi cuadrada, se determinó que los datos observados se ajustaron a los tamaños poblacionales estimados con Jolly-Seber, tanto para el área de estudio como para las estaciones de muestreo (figs. 4A-D).
Para el área de estudio se estimó una longitud asintótica (L∞) de 94.14 mm (fig. 5A), con base en la talla más grande (89.95 mm). Se estimó un coeficiente de crecimiento (K) de 0.32/año y el indicador de bondad de ajuste (Rn) de 0.336; así como un índice de desempeño de crecimiento (Ø’) de 3.47. En la estación B.C (fig. 5B) se presentó la L∞ más baja (67.79 mm), pero el K más alto (0.71/año), con un Rn de 0.315 y un Ø’ de 3.51. La estación B.G (fig. 5C) presentó la L∞ más alta (94.9 mm), pero el K más bajo (0.32/año), con un Rn de 0.362 y un Ø’ de 3.47. Por último, para la estación TAG (fig. 5D) se estimó una L∞ de 82.68 mm, con un K de 0.62/año y un Rn de 0.701 y un Ø’ de 3.63.
Para el crecimiento directo con los datos observados de C. pica para el área de estudio, se determinó un incremento de 0.1094 mm/día. Para la estación B.G se presentó el crecimiento observado más alto de 0.1130 mm/día, mientras que para B.C el crecimiento fue de 0.1126 mm/día; sin presentar diferencias significativas entre ambas estaciones. La estación TAG presentó el crecimiento observado más bajo (0.0913 mm/día), pero sin presentar diferencias significativas con los resultados de B.C.
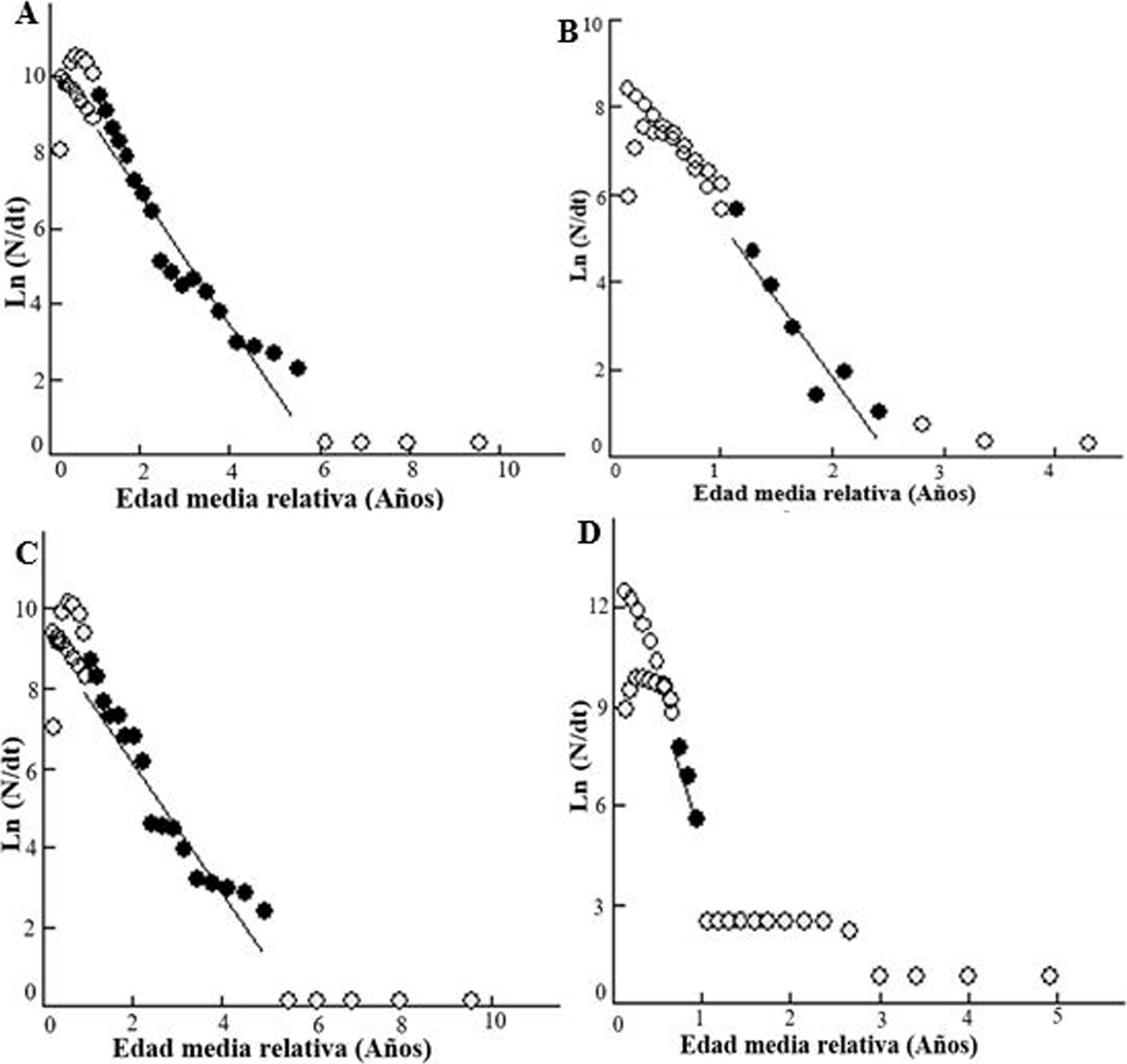
Las curvas de tallas convertidas a edad relativa de la distribución de frecuencia del diámetro de la concha de C. pica para el área de estudio y para las estaciones de muestreos, fueron utilizadas para determinar la mortalidad (fig. 6). Para el área de estudio se estimó una mortalidad total (Z) de 1.71/año, una mortalidad natural (M) de 0.61/año y una mortalidad por captura (F) de 1.10/año, con una tasa de explotación (E) de 0.65 (fig. 6A). En la estación B.C se estimaron las siguientes tasas de mortalidad: Z = 3.58/año, M = 1.13/año y F = 2.45/ año con una E = 0.68 (fig. 6B). Las tasas de mortalidad más bajas se estimaron en la estación B.G, con Z = 1.70/año, M = 0.61/año y F = 1.09/año, observándose la E (0.64) con el valor más bajo entre las estaciones (fig. 6C). Mientras en TAG, se presentaron las más altas, las cuales fueron Z = 10.70/año, M = 0.98/año y F = 9.72/año y un alto valor de E = 0.9 (fig. 6D).
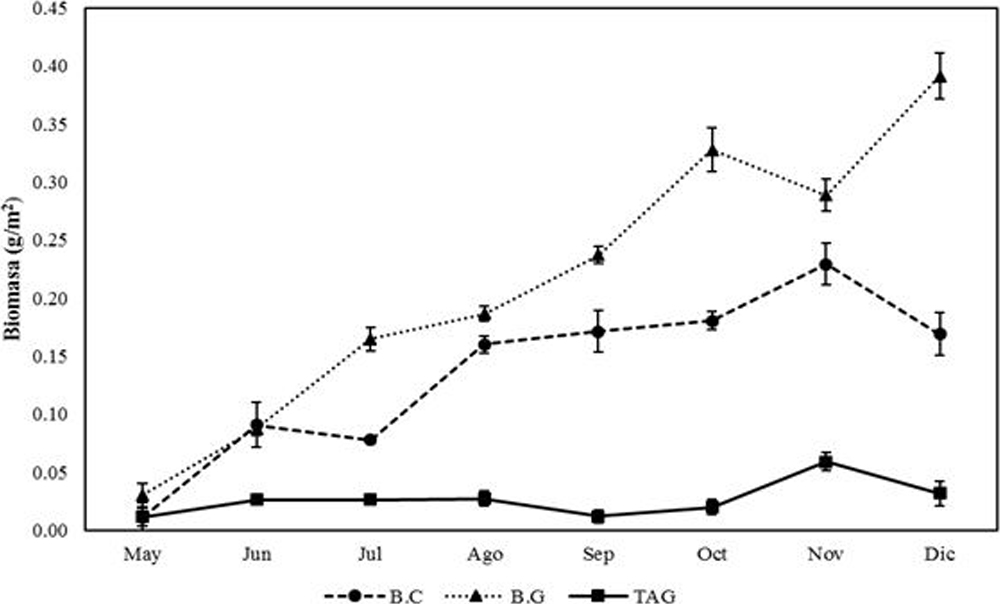
En toda el área de estudio el aporte de biomasa fue de 0.1279 g/m2. Se observó que esta aumentó a través de cada muestreo. El valor menor se presentó en mayo (0.018 g/m2) y el mayor en diciembre (0.197 g/m2), presentando diferencias significativas entre ellos. La mayor biomasa se estimó en la estación B.G (0.2142 g/m2), seguido por B.C (0.1363 g/m2) y por último TAG (0.0332 g/m2); presentándose diferencias significativas entre éstas.
En mayo las 3 estaciones presentaron los valores más bajos de densidad con 0.011 g/m2 en B.C, 0.030 g/m2 en B.G y 0.012 g/m2 en TAG; mientras que los mayores valores para B.C (0.229 g/m2) y TAG (0.059 g/m2) se presentaron en noviembre y B.G (0.391 g/m2), y en diciembre. B.C y B.G no presentaron diferencias significativas entre mayo y junio, mientras que en los demás muestreos se presentaron diferencias entre las 3 estaciones (fig. 7).
El valor mayor de la cobertura de algas (C.A) se presentó en B.G durante diciembre (40.16%) y el menor durante mayo (4.63%) y octubre (15.41%), en B.C y TAG respectivamente. El oxígeno disuelto (O.D) presentó el valor mayor en noviembre (6.15 mg/L) en B.G, y los menores en mayo (3.40 mg/L) para B.C y en diciembre (3.96 mg/L) para TAG. En el caso de velocidad del viento (VV), el valor más alto se registró en agosto en B.G (19.24 km/h), y los menores en mayo (0.94 km/h), octubre (1.15 km/h) y diciembre (2.16 km/h), para B.C, B.G y TAG respectivamente (tabla 1). La temperatura (T) presentó los valores más altos en mayo (33.15 °C) y noviembre (30.95 °C), en TAG y B.C respectivamente; mientras que el valor menor fue registrado en diciembre (26.05 °C) para B.G. Los mayores valores de salinidad (SAL) se registraron en agosto (7.55 ppm) en B.C, julio (7.48 ppm) en B.G, y junio (7.45 ppm) en TAG, y los menores en noviembre (6.29 ppm) para B.C, y octubre (6.15 ppm y 6.70 ppm) para B.G y TAG respectivamente. Por otro lado, el pH presentó el máximo valor en junio (8.42) y el menor en mayo (6.39) para B.C; mientras en B.G la escala de valores osciló entre 6.67 (mayo) y 8.30 (diciembre), y en TAG entre 8.36 (noviembre) y 7.57 (mayo) (tabla 1).
Tabla 1
Variación de las variables abióticas durante los meses de muestreos en las 3 estaciones. Se indican los promedios y el intervalo de confianza entre paréntesis. Abreviaturas: cobertura de algas (C.A), temperatura (T), salinidad (SAL), oxígeno disuelto (O.D.), velocidad del viento (V.V).
|
Mes |
Estación |
C.A(%) |
T(°C) |
SAL(ppm) |
pH |
O.D(mg/l) |
V.V(km/h) |
|
May |
B.C |
4.62(±2.36) |
28.65(±0.04) |
7.43(±0.06) |
6.39(±0.09) |
3.39(±0.22) |
0.94(±0.56) |
|
B.G |
29.05(±7.92) |
28.58(±0.17) |
7.16(±0.17) |
6.66(±0.07) |
4.09(±0.12) |
9.82(±1.37) |
|
|
TAG |
39.71(±8.21) |
27.5(±0.29) |
7.34(±0.16) |
7.56(±0.7) |
5(±1.1) |
11.15(±4.93) |
|
|
Jun |
B.C |
13.55(±5.97) |
28.9(±1.38) |
7.7(±0.44) |
8.41(±0.12) |
4.76(±1.5) |
11.08(±4.99) |
|
B.G |
21(±7.71) |
30.11(±1.01) |
7.23(±0.27) |
8.18(±0.05) |
4.99(±0.36) |
6.54(±3.19) |
|
|
TAG |
28.45(±7.76) |
31.61(±1.49) |
7.48(±0.19) |
8.2(±0.07) |
4.84(±0.41) |
6.37(±2.25) |
|
|
Jul |
B.C |
17.24(±5.87) |
29.76(±1.33) |
7.32(±0.32) |
7.98(±0.08) |
4.57(±0.31) |
5.42(±2.35) |
|
B.G |
27.36(±7.53) |
28.28(±0.54) |
7.48(±0.3) |
8.08(±0.04) |
4.62(±0.2) |
10.66(±4.22) |
|
|
TAG |
30.47(±8.08) |
31(±1.18) |
7.37(±0.3) |
8.08(±0.31) |
5.24(±0.66) |
4.31(±1) |
|
|
Ago |
B.C |
16.31(±5.78) |
29.78(±1.43) |
7.55(±0.54) |
8.14(±0.08) |
4.26(±0.47) |
9.18(±6.92) |
|
B.G |
30.86(±8.5) |
30.63(±2.1) |
7.2(±0.32) |
8.07(±0.05) |
4.43(±0.33) |
19.24(±12.59) |
|
|
TAG |
32.61(±8.48) |
32.13(±0.48) |
6.82(±0.34) |
8.22(±0.07) |
5.94(±0.87) |
9.37(±4.71) |
|
|
Sep |
B.C |
12.16(±4.87) |
29.28(±0.43) |
6.53(±0.17) |
8.13(±0.06) |
4.03(±0.38) |
2.23(±3.47) |
|
B.G |
30.92(±7.62) |
29.75(±0.33) |
6.45(±0.16) |
8.16(±0.09) |
4.25(±0.68) |
6.55(±5.99) |
|
|
TAG |
25.96(±8) |
32.26(±0.6) |
6.74(±0.23) |
8.29(±0.09) |
4.78(±0.62) |
3.87(±3.8) |
|
|
Oct |
B.C |
16.39(±7.27) |
30.3(±1.26) |
6.66(±0.38) |
8.14(±0.04) |
3.83(±0.15) |
1.43(±1.18) |
|
B.G |
11.11(±4.43) |
29.88(±1.34) |
6.15(±0.26) |
8.2(±0.03) |
4.36(±0.31) |
1.15(±1.44) |
|
|
TAG |
15.41(±6.99) |
33.15(±1.4) |
6.69(±0.32) |
8.1(±0.41) |
4.2(±0.37) |
2.15(±1.55) |
|
|
Nov |
B.C |
6.23(±3.09) |
30.95(±2.01) |
6.29(±0.72) |
8.21(±0.04) |
3.46(±0.15) |
10.83(±6.43) |
|
B.G |
20.14(±5.89) |
29(±0.5) |
6.75(±0.42) |
8.2(±0.02) |
3.42(±0.19) |
12.36(±4.47) |
|
|
TAG |
20.41(±7.52) |
31.08(±0.97) |
6.75(±0.91) |
8.35(±0.02) |
4.15(±0.35) |
8.72(±5.78) |
|
|
Dic |
B.C |
17.92(±6.18) |
28.31(±0.98) |
6.8(±0.33) |
8.23(±0.05) |
3.56(±0.3) |
7.3(±3.51) |
|
B.G |
40.16(±8.53) |
26.05(±0.44) |
6.97(±0.04) |
8.3(±0.05) |
3.62(±0.24) |
3.05(±2.57) |
|
|
TAG |
27.75(±7.93) |
28.78(±0.76) |
7.16(±0.22) |
8.34(±0.03) |
3.96(±0.27) |
11.91(±2.37) |
Con la rutina BIOENV, se determinó que existe una relación significativa entre las variables ambientales medidas y las variables bióticas tomadas para C. pica, esta relación fue mayor en la estación TAG (Rho = 0.951; p = 0.001), seguido por B.G (Rho = 0.463; p = 0.003), y por último B.C (Rho = 0.386; p =0.003). Se tuvieron en cuenta las 3 mejores combinaciones de las 6 variables ambientales, según la escala de correlación de Spearman se determinó que una sola variable (pH, rs = 0.175) presentó la mejor correlación con la variación de las variables bióticas para TAG. En el caso de B.G, se determinó que la mejor combinación de variables fueron T, pH y O.D (rs = 0.674) y, por último, para B.C fueron pH y V.V (rs = 0.637) (tabla 2).
Tabla 2
Análisis de BIOENV entre el componente biótico y el abiótico en las estaciones de muestreo. Abreviaturas: número de variables (N. Var), variables seleccionadas (Var. Sel)
|
Estaciones |
N. Var |
Correlación |
Var. Sel. |
|
B.C |
2 |
0.637 |
pH, VV |
|
2 |
0.607 |
T, pH |
|
|
3 |
0.582 |
T, pH, VV |
|
|
B.G |
3 |
0.674 |
T, pH, O.D |
|
4 |
0.669 |
C.A, T, pH, O.D |
|
|
2 |
0.651 |
pH, O.D |
|
|
TAG |
1 |
0.175 |
pH |
|
1 |
0.134 |
Sal |
|
|
2 |
0.117 |
C.A, Sal |
Discusión
Las densidades estimadas para el área de estudio y para cada estación en particular son similares a las estimadas para litorales rocosos donde se realiza la explotación de este recurso, tanto en la parte continental como insular de Colombia, así como en el “gran Caribe” (Osorno-Arango, 2005; Osorno-Arango et al., 2009; Schmidt et al., 2002). Se observó que la densidad promedio de C. pica es intermedia, indicando un alto grado de explotación de este recurso (cf. Osorno-Arango, 2005). La baja densidad en TAG coincide con lo descrito por Osorno-Arango (2005) en lugares adyacentes a esta zona, los cuales se encuentran muy cerca de un asentamiento urbano culturalmente pesquero y, que practican frecuente e intensamente la recolecta de C. pica o “burgao” (Osorno-Arango, 2005). En estaciones resguardadas del oleaje como B.C y TAG, las densidades son aún más bajas, lo cual podría ser debido a una alta mortalidad de los individuos de talla pequeña como consecuencia de la desecación (Debrot, 1990b), sumado a una mayor intensidad de extracción del recurso (Osorno-Arango y Díaz, 2006). Por otro lado, las mayores densidades en B.G se pueden atribuir al difícil acceso a la zona y, por consiguiente, a una menor intensidad de extracción, así como al alto grado de exposición al oleaje al que están sometidos los caracoles en esta estación (Debrot, 1990b).
La menor densidad en el área de estudio en mayo, puede deberse a que durante este mes se presenta un pico en la extracción de C. pica, el cual corresponde a una de las temporadas en que se practica con mayor intensidad la explotación de este recurso para el Caribe colombiano (Osorno-Arango, 2005). Lo anterior a su vez coincide con el decrecimiento en la intensidad y dirección de los vientos y, a la menor frecuencia de las marejadas (Giraldo, 1994), facilitando el acceso al ecosistema de litoral rocoso y por ende, a la captura de esta especie. La disminución de la densidad en diciembre se puede atribuir a la dificultad de capturar el caracol, debido al inicio de la época seca y la incursión de los vientos alisios del noreste, aumentando así el nivel y la fuerza del oleaje (Andrade, 2000), lo cual dificulta el acceso al litoral rocoso de esta área. Las mayores densidades en julio, agosto, septiembre y octubre, pueden deberse a que en los litorales rocosos de Santa Marta se han detectado los desoves en la mayoría de estos meses (Osorno-Arango, 2005; Osorno-Arango y Díaz, 2006), lo cual aumenta la probabilidad de capturar los individuos de C. pica en esta época del año.
Las tasas de mortalidad natural (M), para el área de estudio y las estaciones difieren de las reportadas en estudios previos para zonas con climas tropicales. Por ejemplo, son superiores a las estimadas por Debrot (1990a) (0.67 y 0.84/año) en las Bahamas, e inferiores a la estimada por Schmidt et al. (2002) (1.47/año) en Costa Rica, lo cual puede deberse a la emigración de C. pica a lugares pocos accesibles durante su crecimiento y la tendencia a ocultarse en grietas. Lo anterior dificulta su captura, comportamiento que puede afectar la eficiencia del muestreo y así sobre-estimar la mortalidad natural (M) (Schmidt et al., 2002). La tasa de explotación (E) en el área de estudio y en las estaciones fue superior a 0.5 (50%), lo que indica sobreexplotación de la especie (Gulland, 1971). En el caso de TAG, la tasa de explotación (E) es elevada y se puede explicar por qué se presenta la menor densidad poblacional y abundancia, indicando una alta sobreexplotación de C. pica en esta área.
La sobreexplotación estimada para C. pica se ve reflejada en la estructura de tallas de la población, donde predominan individuos de talla pequeña; lo cual se debe a que la explotación de este recurso se centra principalmente en individuos de talla grande (cf. Osorno-Arango y Díaz-Merlano, 2006). Así mismo, los individuos de talla mediana también son extraídos, debido a que su carne es más suave (Osorno-Arango et al., 2009). El 99.69% de los ejemplares capturados en el área de estudio, no superaban la talla media de madurez sexual (TMM), estimada para el PNNT en 58.64 mm (Osorno-Arango, 2005; Osorno-Arango y Díaz, 2009), lo que supone un peligro para la capacidad de renovación poblacional de la especie. Es posible que los individuos en el área de estudio presenten una reducción de la TMM, debido a la presión selectiva realizada por los pescadores sobre los ejemplares de talla grande, lo que puede afectar el tamaño efectivo de la población, como ocurre en el caso de las langostas (Chubb, 1994; Naranjo, 2012); razón por la cual se sugiere realizar estudios sobre la dinámica de la biología reproductiva de esta especie en la zona.
El predominio de individuos de talla pequeña entre julio-octubre en toda el área de estudio, como en cada una de las estaciones B.C y B.G, se debe a la presencia de diferentes picos en el desove y posterior evento de reclutamiento de C. pica (Osorno-Arango, 2005; Osorno-Arango y Díaz, 2009). En TAG, el mayor número de individuos de talla pequeña en junio se presenta por las diferencias en los ciclos reproductivos de C. pica en áreas o estaciones diferentes, lo cual también puede atribuirse a variaciones locales de las condiciones ambientales, como por ejemplo disponibilidad de alimento, diferencias en el pH y en la temperatura (Villalejo et al., 1996).
La mayor biomasa en B.G, puede deberse a que esta estación presenta una de las mayores coberturas de algas, principal alimento de C. pica e importantes para su crecimiento y desarrollo. A su vez, las algas le brindan refugio y camuflaje, con alta probabilidad de minimizar su depredación. Adicionalmente, presentó la tasa de explotación (E) más baja, lo cual permite la presencia de ejemplares de tallas medianas y grandes. La menor biomasa en TAG, se debe a que además de presentar baja densidad, predominan individuos de talla pequeña. La mayor biomasa en diciembre para toda el área de estudio, concuerda con el muestreo en el cual se contabilizaron más individuos con tamaño superiores a 36.68 mm, a pesar de que en ese mes se presentó una de las menores densidades. Las mayores biomasas en B.G, B.C y TAG en diciembre, octubre y noviembre respectivamente, se deben a la mayor presencia de individuos en los intervalos de talla superior y no a las abundancias generales de C. pica, ya que estos muestreos no coinciden con las densidades más altas de la especie estudiada para cada estación. Este comportamiento puede explicarse debido a la relación potencial entre la biomasa y el diámetro de la concha observada en el presente estudio, donde los individuos pequeños presentan un crecimiento del diámetro más acelerado que el incremento de peso. En el caso de los ejemplares medianos ocurre un comportamiento contrario y, por último, en tallas grandes el crecimiento tanto de diámetro, como el aumento en peso, son similares (Osorno-Arango, 2005), lo cual estaría indicado un crecimiento de tipo alométrico (Huxley, 1993).
El crecimiento estimado mediante la fórmula de Von Bertalanffy para el área de estudio y B.G presentó una constante de crecimiento (K) similar a las estimadas por Debrot (1990a) (K = 0.30-0.36), pero muy por encima a los obtenidos por Randall (1964) (K = 0.14-0.25) y Schmidt (2002) (K = 0.19-0.20), lo cual estaría indicando un crecimiento lento. Caso contrario, las estaciones B.C y TAG, presentan una (K) muy grande, indicando un crecimiento acelerado, lo cual se puede atribuir a una longitud asintótica más baja (L∞). La disminución de la longitud asintótica (L∞) y el crecimiento acelerado en estas estaciones con alto grado de sobre-explotación, podría ser un mecanismo de defensa de la especie para alcanzar más rápido su talla de madurez sexual (TMM). Adicionalmente, con la ecuación de Von Bertalanffy se logró determinar que en el área de estudio los individuos de C. pica tardan aproximadamente 3 años en alcanzar la TMM.
Además, estas variaciones en las constantes de crecimiento pueden deberse a la densidad del organismo y al grado de exposición al oleaje (Debrot, 1990b). Mientras B.C y TAG se encuentran resguardadas del oleaje y presentaron densidades menores de C. pica, B.G es una estación muy expuesta y con mayor densidad, por lo cual el estrés generado por el oleaje, sumado a la competencia por alimento, podrían estar afectando el crecimiento de C. pica en dicha estación (Debrot, 1990b). Estos resultados coinciden con los obtenidos por Debrot (1990b), quien estimó una constante de crecimiento (K = 0.659/año) en litorales rocosos resguardados del impacto de las olas, valor que fue menor en lugares expuestos. Al analizar los valores de bondad de ajuste (Ø’) para el área de estudio y las estaciones de muestreo, se observó que son muy similares al estimado por Schmidt et al. (2002), el cual está entre 3.31 y 3.48.
Teniendo en cuenta los estimadores de tamaño poblacional, C. pica se comporta como una población abierta. Sin embargo, su biología puede permitir considerarla como una población cerrada debido a que sus larvas planctónicas tienen una duración de 2.5 a 5 días (Bell, 1992) y por lo tanto, no logran tener una alta dispersión y en consecuencia, un alto autoreclutamiento durante los eventos reproductivos. Narváez et al. (2015) apoyan esta hipótesis porque definieron a la población de C. pica en el PNNT como una población diferenciada genéticamente del resto de los litorales rocosos. Al parecer, la ausencia de su hábitat entre los límites del PNNT y el de los litorales rocosos más próximos (La Guajira y Bolívar), junto con la presencia del río Magdalena pueden estar causando un aislamiento en la conectividad genética de las poblaciones.
Entre las combinaciones de variables ambientales que mejor explican el comportamiento de los factores bióticos, está el pH. Esta relación puede deberse a que el pH ácido dificulta la captación de iones carbonatos y puede deteriorar la concha de los gasterópodos principalmente en estadios juveniles, además de afectar su fisiología (Byrne, 2011; Campos y Díaz, 2007). En este caso, al debilitarse la concha que es su principal estructura de protección, el organismo queda más vulnerable a la depredación. En la estación TAG, los valores de pH pueden estar explicando en gran medida la variación de la densidad y la biomasa, como consecuencia a la cercanía de asentamientos urbanos, lo cual conlleva a la influencia de residuos o sustancias al medio marino que pueden estar disminuyendo el pH y en consecuencia, la abundancia de C. pica. En B.G, la variable que más incide en el comportamiento de los datos es la temperatura (T), donde se registraron valores entre 26 °C y 34 °C, lo cual según lo descrito por algunos autores es un condicionante importante en la distribución de C. pica (Flores y Cáceres, 1984; Robertson, 2003). En el caso del oxígeno disuelto (O.D) en esta estación, esta relación se presenta debido a la abundante cobertura algal en la zona, lo cual genera mayor desprendimiento de oxígeno durante la fotosíntesis; adicionalmente, el alto grado de exposición al oleaje aumenta los niveles de oxígeno por la mayor turbulencia del agua (Álvarez-Cadena et al., 2007). Por último, B.C al encontrarse resguardada del oleaje, la relación entre la V.V y la intensidad de la marea podría no ser proporcional; por lo cual se sugiere que otras variables estén explicando la relación entre V.V con las variables bióticas en esta estación.
Se puede concluir que C. pica presenta una fuerte sobre-explotación en el sector de Santa Marta, como lo evidencia el dominio de individuos de talla pequeña, bajos valores en la densidad, biomasa e individuos recapturados durante los muestreos. Todo lo anterior genera una necesidad mayor para que se desarrollen estrategias para la conservación de esta especie. Una propuesta es lograr que sitios como B.G sean intangibles a la pesca de C. pica, puesto que este estudio mostró tener las densidades más altas y los organismos de mayor tamaño en comparación con las demás estaciones. Esto se debió a que B.G se caracterizó por estar alejado de los asentamientos urbanos, por ser de difícil acceso y tener un fuerte oleaje, lo cual dificulta la pesca de este caracol. Adicionalmente, se recomienda desarrollar campañas de sensibilización a las comunidades locales para lograr un aprovechamiento sostenible de este recurso.
Agradecimientos
Los autores agradecen a Rubén Daza y Julieth Guerra por su apoyo en este proyecto, a Álvaro Peña por su hospitalidad durante la fase de campo, a Yudy Cardona, Rafael Núñez, Hernando Beltrán, Kevin Caballero, Luis Ortiz, Jesús Benjumea y Alexis Rubiolo por su ayuda en las jornadas de muestreo. Esta investigación contó con el apoyo logístico del proyecto “Estudio Piloto del Efecto de Desborde en Áreas Marinas Protegidas (AMP) del Caribe de Colombia”, ejecutado por la Universidad del Magdalena en convenio con Patrimonio Natural (Convenio Núm. 025-2015). Finalmente, se agradece a los funcionarios de la Territorial Caribe de Parques Nacionales Naturales por permitirnos llevar a cabo los muestreos dentro del PNN Tayrona. C.A. Daza-Guerra es estudiante de Maestría en Ciencias-Biología, Línea Biología Marina.
Referencias
Almanza, L., Bolívar, F., Borrero, S., Caiafa, I., De las Salas, K., Luque, M. et al. (2004). Estudio preliminar de la comunidad macrobentónica del mesolitoral rocoso de Bahía Concha (Parque Nacional Natural Tayrona, Magdalena, Colombia) en agosto del 2002. Acta Biológica Colombiana, 9, 3–9.
Álvarez-Cadena, J. N., Ordóñez-López, U., Valdés-Lozano, D., Almaral-Mendívil, A. R. y Uicab-Sabido, A. (2007). Estudio anual del zooplancton: composición, abundancia, biomasa e hidrología del norte de Quintana Roo, mar Caribe de México. Revista Mexicana de Biodiversidad, 78, 421–430.
Andrade, C. (2000). Circulation and variability of the Colombian Basin in the Caribbean Sea (Tesis doctoral). University of Wales, Cardiff, Gales.
Andrade, C. (2001). Las corrientes superficiales en la cuenca de Colombia observadas con boyas de deriva. Revista de la Academia Colombiana de Ciencias, 25, 321–335.
Appeldoorn, R. S. (1984). The effect of size on mortality of small, juvenile conchs (Strombus gigas Linne and S. costatus Gmelin). Journal of Shellfish Research, 4, 37–43.
Ardila, N., Von Schiller, D., Moreno, S., Alonso, D. y Ospina, G. (1997). Peces epibentónicos asociados a Thalassia testudinum, en la bahía de Taganga, Magdalena, Caribe colombiano. En A. Santos y L. Nieto (Eds.), IV Simposio Colombiano de Ictiología. Resúmenes de Conferencias y Exposiciones. Agosto, 1997. Universidad del Magdalena, Santa Marta.
Bartels, G. (1970). Geomorphologische höhenstufen der Sierra Nevada de Santa Marta (Kolumbien). Giessener Geographische Schriften, 21, 1–56.
Bell, L. (1992). Reproduction and larval development of the West Indian topshell, Cittarium pica (Trochidae), in the Bahamas. Bulletin of Marine Science, 51, 250–266.
Byrne, M. (2011). Impact of ocean warming and ocean acidification on marine invertebrate life history stages: vulnerabilities and potential for persistence in a changing ocean. Oceanography and Marine Biology: An Annual Review, 49, 1–42.
Campos, B. y Díaz, P. (2007). Distribución y abundancia de larvas de Moluscos, gasterópodos y bivalvos en fiordos y canales del sur de Chile. Ciencia y Tecnología del Mar, 30, 115–132.
Castell, L. (1987). Algunos aspectos de la biología y ecología de Cittarium pica (L.), “Quigua” (Prosobranchia, en el Parque Nacional Archipiélago de los Roques (Tesis). Universidad Central de Venezuela, Caracas.
Chubb, C. (1994). Reproductive biology: issues for management. En B. Phillips, J. Cobb y J. Kittaka (Eds.), Biology and management of lobsters (pp. 181–212). Londres: Blackwell Scientifics Publications.
Clarke, K. y Ainsworth, M. (1993). A method of linking multivariate community structure to environmental variables. Marine Ecology Progress Series, 92, 205–219.
Clarke, K. y Warwick, R. (1994). Change in marine communities: an approach to statistical analysis and interpretation. Plymouth: Plymouth marine laboratory.
Cumming, G., Fidler, F. y Vaux, D. (2007). Error bars in experimental biology. The Journal of Cell Biology, 177, 7–11.
Debrot, A. (1990a). Temporal aspects of population dynamics and dispersal behavior of the West Indian Top Shell, Cittarium Pica (L.), at selected sites in the Exuma Cays, Bahamas. Bulletin of Marine Science, 47, 431–437.
Debrot, A. (1990b). Survival, growth, and fecundity of the West Indian top shell, Cittarium pica (Linnaeus), in various rocky intertidal habitats of the Exuma Cays, Bahamas. The Veliger, 33, 363–361.
Flores, G. y Cáceres, R. (1984). Cittarium pica (Linnaeus, 1758) (Achaeogastropoda: Trochidae) en las aguas costeras de Venezuela. Boletín del Instituto Oceanográfico de Venezuela, 20, 57–62.
Giraldo, L. (1994). Estado actual del conocimiento de la oceanografía física del Caribe y Pacífico colombiano. Memorias del taller: Expertos sobre el estado el conocimiento y lineamientos para una Estrategia Nacional de Biodiversidad en los sistemas marinos y costeros: recopilación de los documentos básicos informativos sobre Biodiversidad Costera y Marina en Colombia. Minca, Magdalena (pp. 269–278). Santafé de Bogotá: CCO, ENB y COLCIENCIAS.
Gracia, A. y Díaz-Merlano, J. (2002). Cittarium pica. En N. Ardila, G. Navas y J. Reyes (Eds.), Libro Rojo de Invertebrados Marinos de Colombia (pp. 69–70). Bogotá: INVEMAR, Ministerio del Medio Ambiente.
Gulland, J. A. (1971). The fish resources of the ocean. Fishing news. West Byfleet, Surrey: Fishing News Ltd.
Henderson, P. (2003). Practical methods in ecology. Londres: Blackwell.
Huxley, J. (1993). Problems of relative growth. Baltimore: Johns Hopkins University Press.
Invemar (Instituto de Investigaciones Marinas y Costeras). (2005). Informe del Estado de los Ambientes Marinos y Costeros en Colombia. Año 2004. Bogotá: Panamericana Formas e Impreso.
Invemar (Instituto de Investigaciones Marinas y Costeras). (2015). Cambio climático en Colombia. Boletín Informativo Cambio Climático, 6.
Krebs, C. (1999). Ecological methodology. Menlo Park: Addison Welsey Longman.
Lemos, J., Rojas, R. y Zúñiga, J. (2005). Técnicas para el estudio de poblaciones de fauna silvestre. Querétaro: Universidad Na-
cional Autónoma de Querétaro/ Instituto de Ecología, A. C.
Leslie, P. y Chitty, D. (1951). The estimation of population parameters from data obtained by means of the capture-recapture method. I. The maximum likelihood equations for estimating the death rate. Biometrika, 38, 269–292.
Manrique, N., Bejarano, S. y Garzón, J. (2006). Crecimiento del abanico de mar Gorgonia ventalina (Linnaeus, 1758) (Cnidaria: Gorgoniidae) en el área de Santa Marta, Caribe colombiano. Boletín de Investigaciones Marinas y Costeras, 35, 77–90.
Mclean, R. (1967). Measurements of beachrock erosion by some tropical marine gastropods. Bulletin of Marine Science, 17, 551–556.
Naranjo, H. (2012). Patrón reproductivo y talla media de madurez sexual de hembras de la langosta Panulirus gracilis (Decapoda: Palinuridae) en Playa Lagarto, Guanacaste, Costa Rica. Revista de Biología Tropical, 60, 1783–1793.
Narváez, J., Orozco, G., Aguirre, J., Muñoz, E., Quintero, J., Mendoza, R. et al. (2015). Evaluar el efecto de desborde de Cittarium pica, Lutjanus synagris y Mugil liza y la conectividad genética de Lutjanus synagris y Mugil liza en las áreas marinas protegidas de la territorial Caribe con criterios genéticos y ecológicos. Informe final. Proyecto de investigación en el marco del convenio Núm. 025-2012: Santa Marta, Colombia: Patrimonio Natural/ Universidad del Magdalena.
Osorno-Arango, A. (2005). Bioecología de la ‘cigua’ o ‘burgao’ Cittarium pica (Linnaeus, 1758) (Mollusca: Gastropoda: Trochidae) en la costa continental del Caribe colombiano. Santa Marta (Tesis). Bogotá: Fundación Universidad de Bogotá Jorge Tadeo Lozano.
Osorno-Arango, A. y Díaz-Merlano, J. (2006). Explotación, usos y estado actual de la cigua o burgao Cittarium pica (Mollusca: Gastropoda: Trochidae) en la costa continental del Caribe colombiano. Boletín de Investigaciones Marinas y Costeras, 35, 133–148.
Osorno-Arango, A. y Díaz, M. (2009). Aspectos reproductivos del burgao Cittarium pica en los litorales rocosos de Santa Marta y Parque Nacional Natural Tayrona, Caribe colombiano, con énfasis en su conservación y aprovechamiento sostenible. En A. Osorno-Arango, D. Gil y L. Gómez. Plan de investigación para la conservación de Cittarium pica (Linnaeus, 1758) (pp. 55–59). Santa Marta: INVEMAR.
Osorno-Arango, A., Gil, D. y Gómez, L. (2009). Plan de investigación para la conservación de Cittarium pica (Linnaeus, 1758). Santa Marta: INVEMAR.
Osorno-Arango, A., Gil-Agudelo, D., Murcia, G. y Posada, S. (2012). Caracterización y estado de las poblaciones de Wilks (Cittarium pica Linnaeus, 1758) en el archipiélago de San Andrés, Providencia y Santa Catalina. En CORALINA-INVEMAR (Eds.). Atlas de la Reserva de Biósfera Seaflower. Archipiélago de San Andrés, Providencia y Santa Catalina. Santa Marta, Colombia: Serie de Publicaciones Especiales de INVEMAR Núm. 28.
Osorno-Arango, A. y Sanjuan, A. (2009). Epibiontes, fauna y flora acompañante de Cittarium pica (Mollusca: Gastropoda: Trochidae) (Linnaeus, 1758) en el litoral rocoso del Caribe colombiano. En A. Osorno-Arango, D. Gil y L. Gómez. Plan de investigación para la conservación de Cittarium pica (Linnaeus, 1758) (pp. 51–53). Santa Marta: INVEMAR.
Pauly, D. (1980). On the interrelationships between natural mortality, growth parameters, and mean environmental temperature in 175 fish stocks. Journal du Conseil / Conseil Permanent International pour l’Exploration de la Mer, 39, 175–192.
Pauly, D. (1983). Algunos métodos simples para la evaluación de recursos pesqueros tropicales. Roma: FAO Documento Técnico de Pesca.
Pauly, D. (1984). Fish population dynamics in tropical water: a manual for use with programable calculator. Studies and Reviews, 8. Manila, Philipinas: ICLARM.
Pauly, D. y David, N. (1981). ELEFANT I, a BASIC program for the objective extraction of growth parameters from length frequency data. Mecreforschung, 28, 205–211.
Pauly, D. y Munro, L. (1984). Once more on growth comparison in fish and vertebrates. Fishbyte, 2, 1–21.
Randall, H. (1964). A study of the growth and other aspects of the biology of the West Indian Top Shell Cittarium pica (Linnaeus). Bulletin of Marine Science, 14, 424–443.
Ricker, W. (1975). Computation and interpretation of biological statistics of fish population. Journal of the Fisheries Research Board of Canada, 191, 1–382.
Robertson, R. (2003). The edible West Indian “whelk” Cittarium pica (Gastropoda: Trochidae): natural history with new observations. Proceedings of the Academy of Natural Sciences of Philadelphia, 153, 27–47.
Sainsbury, K. (1982). Population dynamics and fishery management of the paua, Haliotis iris. I. Population structure, growth, reproduction, and mortality. New Zealand Journal of Marine and Freshwater Research, 16, 147–161.
Schmidt, S., Wolff, M. y Vargas, J. (2002). Population ecology and fishery of Cittarium pica. Revista de Biología Tropical, 50, 3–4.
Sparre, P. y Venema, S. (1992). Introduction to tropical fish stock assessment, Part 1 Manual. Roma: FAO Fisheries Technical Paper.
Villalejo, M., García, G., Ochoa, R. y Gasca, A. (1996). Ciclo reproductivo de la almeja chocolata Megapitaria squalida (Sowerby, 1835) (Bivalvia: Veneridae) en Bahía Concepción, Baja California Sur, México. Boletín Científico INPA, 4, 29–39.
White, G. y Burnham K. (1999). Program MARK: survival estimation from populations of marked animals. Bird Study, 46, 120–138.



