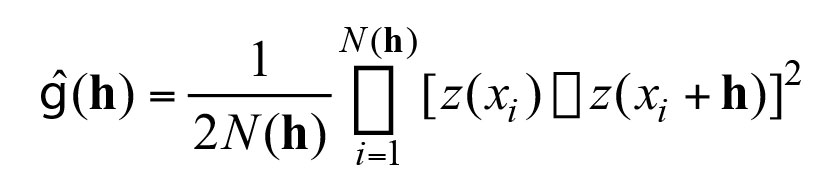Estructura de tallas y distribución espacial de los camarones de profundidad Glyphocrangon longleyi y Glyphocrangon neglecta (Caridea: Glyphocrangonidae) en el Caribe colombiano
Carlos Pacheco a, *, Jorge Páramo a y Adolfo Gracia b
a Grupo de Investigación Ciencia y Tecnología Tropical, Universidad del Magdalena, Cra. 32 Núm. 22-08, Avenida del Ferrocarril, Santa Marta, Colombia
b Laboratorio de Ecología Pesquera de Crustáceos, Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México, Apartado postal 70-305, 04510 Ciudad de México, México
*Autor para correspondencia: carlospachecovz@gmail.com (C. Pacheco)
Resumen
Se aporta información de Glyphocrangon longleyi y Glyphocrangon neglecta recolectadas en el Caribe colombiano. Se realizaron 4 campañas de investigación (agosto y diciembre del 2009 y marzo y mayo 2010) entre 100 y 550 metros de profundidad. Mediante redes de arrastre se recolectaron 269 individuos de G. longleyi entre 54.41 y 123.77 mm de longitud total, (82.54 ± 15.41 mm LT) y 11.34-32.84 mm de longitud del cefalotórax (19.27 ± 5.16 mm LC). Para G. neglecta se registraron 493 individuos con un rango de 57.84 y 119.09 mm LT (71.97 ± 8.00 mm) y de 12.24 y 30.93 mm LC (15.70 ± 2.40 mm). La proporción sexual de G. longleyi fue de 6:3 hembras: machos, mientras que para G. neglecta fue 15:1. Los valores altos de biomasa para G. longleyi estuvieron distribuidos en la zona sur, entre el golfo de Morrosquillo y Cartagena, mientras que los valores altos de biomasa para G. neglecta estuvieron distribuidos en la zona norte, hacia el norte de Santa Marta. Las 2 especies muestran un patrón de distribución geográfico y batimétrico distinto indicativo del aprovechamiento diferencial del gradiente de condiciones ambientales.
Palabras clave:
Decápodos; Estructura de tallas; Proporción sexual; Biomasa
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Size structure and spatial distribution of deep-sea shrimps Glyphocrangon longleyi and Glyphocrangon neglecta (Caridea: Glyphocrangonidae) in the Colombian Caribbean
Abstract
Data on the biology of G. longleyi and G. neglecta collected in the Colombian Caribbean is provided. Four research cruises were developed (August and December 2009, and March and May 2010) in a 100-550 m depth range using trawl nets. Two hundred and sixty-nine organisms of G. longleyi showed a 54.41 – 123.77 mm Total Length range, with a mean of 82.54 ± 15.41 mm LT. Cephalotoracic length varied between 11.34 – 32.84 mm and registered a mean of 19.27 ± 5.16 mm. Size range of 493 organisms of G. neglecta was found between 57.84 – 119.09 mm LT with a 71.97 ± 8.00 mm mean and a 12.24 – 30.93 mm LC range (15.70 ± 2.40 mm mean). Sex ratio was 6:3 females/male for G. longleyi whereas in G. neglecta was 15:1. The higher values of biomass for G. longleyi were distributed in the southern area, in front of the Gulf of Morrosquillo and Cartagena, while the higher biomass values for G. neglecta were distributed in the northern zone, toward north of Santa Marta. Both species showed a distinct geographic and depth distribution pattern that suggest a differential use of the environmental conditions.
Keywords:
Decapods; Size composition; Sex ratio; Biomass
Introducción
La familia Glyphocrangonidae está representada únicamente por el género Glyphocrangon (Milne-Edwards, 1881). Hasta 1984 había 38 especies de camarones de este género válidamente descritas (Chace, 1984), pero actualmente se ha registrado un total de 89 especies en todo el mundo (De Grave y Fransen, 2011; Komai, 2011). En el Atlántico se conocen 12 especies de este género (Holthuis, 1971). La información sobre la biología de estos camarones de profundidad es muy limitada (Quiroga y Soto, 1997), debido principalmente al elevado costo para realizar muestreos en aguas profundas.
Existen 4 especies de la familia Glyphocrangonidae que se encuentran en la zona de pesca del Pacífico centro-oriental y presentan cierto interés pesquero debido a las tallas relativamente grandes a pesar de ser camarones de aguas profundas. Algunas especies de la familia Glyphocrangonidae son capturadas junto con otras especies de camarones de aguas profundas con tallas comerciales como los de la familia Pandalidae (Fischer et al., 1995). Sin embargo, ninguna especie de Glyphocrangonidae tiene importancia comercial (Holthuis, 1980).
Las especies de este género son exclusivamente habitantes de aguas profundas que se encuentran en zonas tropicales y cálidas de los océanos Atlántico, Índico y Pacífico y habitan desde el talud continental a las llanuras abisales (200 a 6,500 m) (Gore, 1985; Holthuis, 1971; Kensley et al., 1987; Komai, 2004a, b, 2006, 2007, 2011). Se ha reportado la presencia de algunas especies del género Glyphocrangon en el mar Caribe, entre las cuales se encuentra Glyphocrangon longleyi y Glyphocrangon neglecta. G. longleyi se distribuye en la costa este de Florida, las Bahamas y todo el golfo de México hasta Santa Lucía, Yucatán y Colombia entre los 300 y 837 m de profundidad, principalmente entre 300 y 638 m (Holthuis, 1971). G. neglecta es una de las especies más pequeñas del género y se distribuye desde Panamá hasta Surinam entre los 365 y 1,090 m de profundidad, con mayor presencia entre 365 y 730 m de profundidad (Holthuis, 1971). Con el propósito de contribuir a su información biológica, en el presente estudio se describen las estructuras de tallas, relaciones morfométricas, distribución batimétrica y estructura espacial de los camarones de profundidad G. longleyi y G. neglecta en el mar Caribe colombiano (MCC).
Materiales y métodos
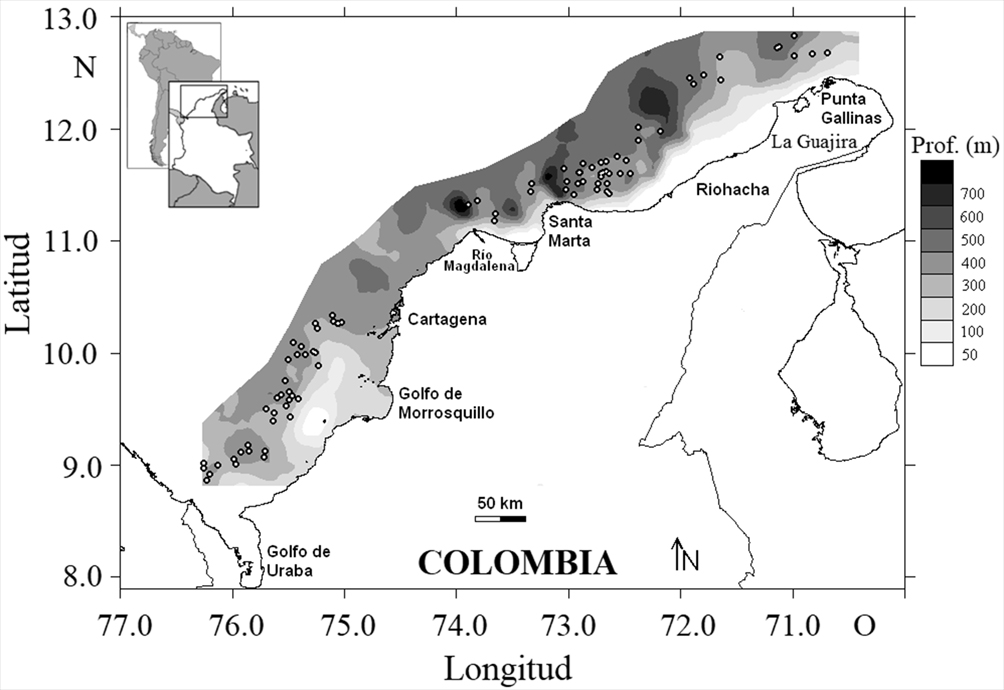
El material fue obtenido en el MCC con pesca de arrastre en profundidades entre 100 y 550 m (ordenados en estratos de profundidad de 100 m) con un mínimo de 2 lances por estrato. Los muestreos se realizaron en agosto y diciembre del 2009 y marzo y mayo del 2010 en 87 estaciones (fig. 1), con el barco camaronero comercial “Tee Claude” usando una red de arrastre con tamaño de malla al final del copo de 44.5 mm de nudo a nudo. Los fondos propicios para el arrastre fueron determinados usando una ecosonda comercial FURUNO FCV 1150 con un transductor de frecuencia de 28 kHz. La duración de cada arrastre fue de 30 minutos, la distancia arrastrada por la red y la velocidad del barco (2.5 nudos en promedio) fue estimada con un GPS Garmin MAP 76CSx, la abertura de la red fue 11.58 m. La captura de cada arrastre se convirtió en biomasa (kg/km2), mediante el área barrida que se estimó a partir de la abertura de la red y la velocidad del barco (Gunderson, 1993; King, 2007). Debido a las irregularidades del fondo no fue posible colectar muestras entre Cartagena y la desembocadura del río Magdalena.
En cada estación se registró el peso total, número y sexo de los individuos por especie. Todos los especímenes fueron medidos desde la punta del rostro hasta la punta del telson (longitud total, LT), la longitud del cefalotórax (LC) desde el borde posterior del receptáculo del ojo hasta el borde posterior del cefalotórax, utilizando calibradores digitales con precisión de 0.01 mm. El peso total individual (PT) se tomó con precisión de 0.1 g. Las diferencias en la distribución de frecuencias de las tallas entre hembras y machos se evaluaron usando la prueba no paramétrica Kruskal-Wallis (Gotelli y Ellison, 2004). El coeficiente de correlación (r) se empleó para las relaciones lineales. La prueba de t-student fue utilizada para comprobar la hipótesis de isometría (b = 3 para las relaciones LT vs. PT).
La estructura de tallas se comparó en 2 zonas determinadas: zona norte desde la desembocadura del río Magdalena 11°06’ N, 74°50’ O hasta Punta Gallinas “12°27’ N, 71°40’ O, y la zona sur desde el golfo de Urabá 08°23’ N, 77°06’ O hasta la desembocadura del río Magdalena 11°06’ N, 74°50’ O. Para el análisis se utilizó la prueba de Kruskal-Wallis con el fin de comprobar diferencias significativas de las tallas entre las zonas geográficas norte y sur y las diferencias significativas entre los estratos de profundidad (Gotelli y Ellison, 2004).
Se determinó la relación longitud-peso mediante el ajuste de la ecuación potencial (PT = a LTb) y mediante transformación logarítmica ln PT = ln a+b ln LT, donde PT es el peso total en g, LT es la longitud total en mm, (a) el intercepto (factor de condición o coeficiente de crecimiento inicial) y (b) el coeficiente de alometría (Ferreira et al., 2008) (b > 3 alometría positiva, el individuo tiene más peso que la longitud que presenta; b < 3 alometría negativa, el individuo es menos pesado que la longitud que tiene; b = 3 isometría, el individuo crece a la misma tasa en todas las dimensiones). Como medida de bondad de ajuste se utilizó el coeficiente de determinación R2. También se estimó un intervalo de confianza del 95% para (b) y se llevó a cabo una prueba t-student para determinar si los camarones presentaban crecimiento isométrico (H0: β = 3, α = 0.05).
Para evaluar las diferencias en las relaciones lineales entre los sexos, se efectuó un análisis de covarianza (Ancova) de una vía (Zar, 2009). La relación LC vs. LT se determinó mediante un modelo lineal: (Y = a+bX), donde (Y = LT) y (X = cada variable independiente), siendo a y b los parámetros de la ecuación, lo que permite estimar la longitud total a una longitud de cefalotórax dada (King, 2007). Para evaluar las diferencias entre los sexos en las relaciones, se efectuó un análisis de covarianza (Ancova) de una vía, una vez que los supuestos de homocedasticidad de las pendientes (paralelismo) fueron encontrados con los datos transformados en logaritmo (Zar, 2009). Los análisis estadísticos se realizaron con el software STATISTICA v8.
Se utilizó el método de frecuencia acumulada para determinar asociaciones entre la biomasa de G. longleyi y G. neglecta y la profundidad (Perry y Smith, 1994). Primero, se calculó una distribución de frecuencia acumulada (DFA) para la profundidad, f (t), luego se ponderó la DFA de la profundidad con la biomasa, g (t). La comparación de la DFA de la profundidad, f (t), con la DFA ponderada con la biomasa, g (t), provee evidencia si la población está asociada con la variable ambiental. Si la población está distribuida al azar en relación con la profundidad, las dos curvas se acumularán similarmente y las dos curvas no serán significativamente diferentes. Por el contrario, si la población está asociada con la profundidad, la pendiente de la DFA ponderada debe estar separada de la DFA de la profundidad (Páramo et al., 2003). Con el fin de determinar la significancia estadística (P) de la diferencia entre las curvas, se calcula la máxima diferencia absoluta vertical entre las curvas y su probabilidad bajo la hipótesis de una relación al azar entre las DFAs se evaluó mediante 2,000 aleatorizaciones de remuestreo de Monte Carlo.
La distribución espacial de la biomasa se realizó usando modelación geoestadística (Páramo y Roa, 2003; Rivoirard et al., 2000), utilizando como variable regionalizada la biomasa por estación de G. longleyi y G. neglecta (kg/km2). El variograma experimental es definido como la varianza de las diferencias entre los valores que están separados h unidades:
donde es la semivarianza, h es un vector de distancia y dirección, N(h) es el número de pares de observaciones a una distancia h y una dirección dada, z(xi) es la biomasa (kg/km2) de G. longleyi y G. neglecta para el ith dato. El modelo de variograma gausiano fue el más apropiado para explicar los variogramas experimentales de acuerdo al criterio de minimización de mínimos cuadrados ponderados (Cressie, 1993). Finalmente, se utilizó kriging puntual ordinario para reproducir el proceso estocástico en el área de estudio, i.e. la biomasa media en el área de distribución espacial (Isaaks y Srivastava, 1989). Para estimar la varianza de la biomasa media se aplicó el método intrínseco de la geoestadística, en el cual la varianza depende de la geometría del área de la distribución espacial, el diseño de muestreo, y la estructura del variograma (Petitgas y Lafont, 1997; Rivoirard et al., 2000). El análisis espacial se realizó en el software R (geoR library) (Ribeiro y Diggle, 2001).
Resultados
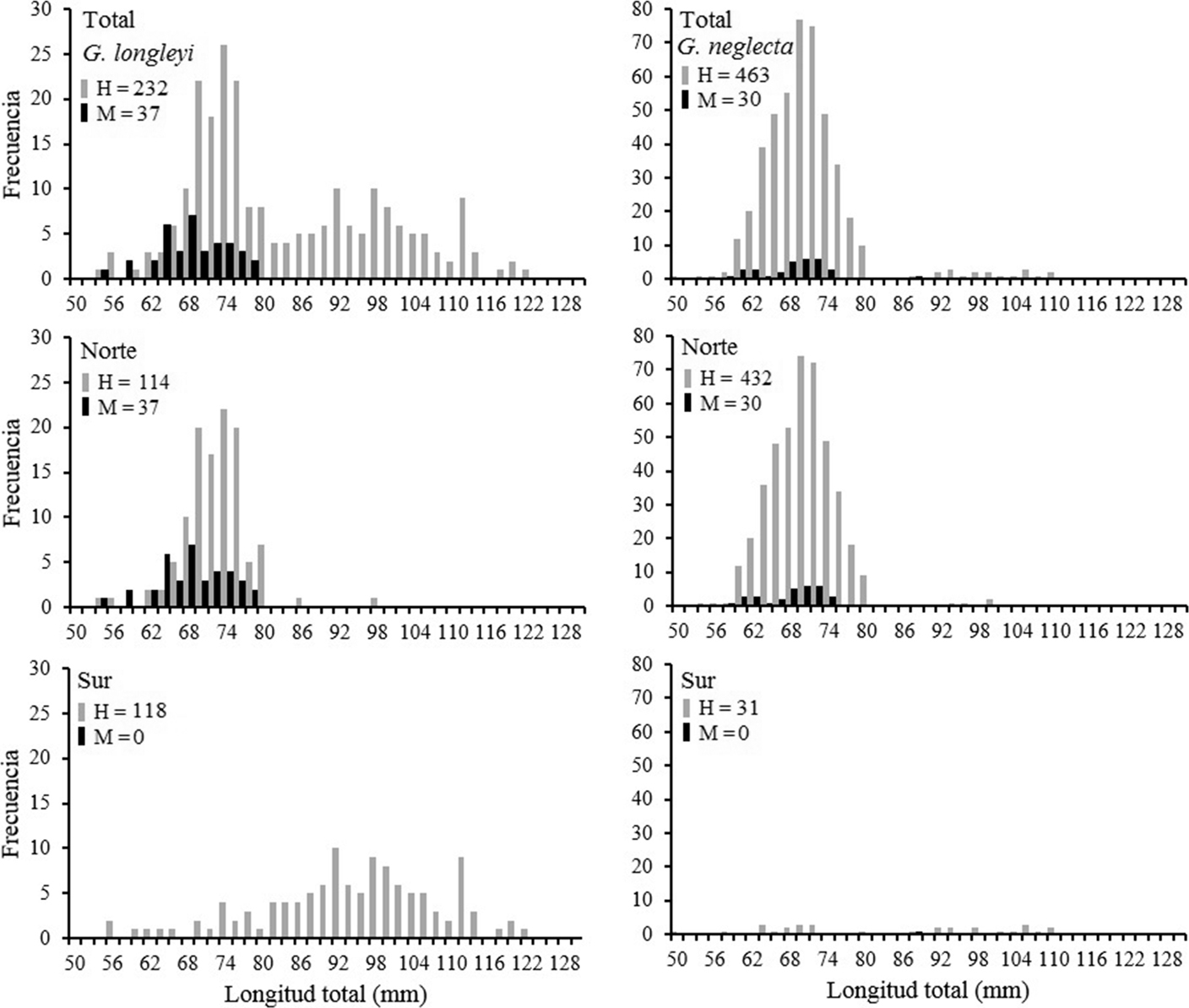
Las hembras presentaron tallas significativamente mayores que los machos en ambas especies de camarones de profundidad (tabla 1). Se encontró un total de 269 individuos de G. longleyi, donde se midieron 232 hembras con tallas de longitud total (LT) entre 54.93 y 123.77 mm (talla media 84.65 ± 15.43 mm) y de cefalotórax (LC) entre 11.64 y 32.84 mm (talla media 20.00 ± 5.17 mm). Los machos fueron menos abundantes (n = 37) que las hembras con un intervalo de tallas entre 54.41 y 78.76 mm (talla media 69.31 ± 5.53 mm) LT, y LC entre 11.34 y 17.24 mm (talla media 14.71 ± 1.23 mm). Para G. neglecta se encontraron 493 individuos, donde se midieron 463 hembras con tallas de LT entre 57.84 y 119.09 mm (talla media 72.19 ± 8.10 mm) y LC que oscilaron entre 12.24 y 30.93 mm (talla media 15.77 ± 2.44 mm), mientras que para los machos (n = 30) se registraron tallas de LT entre 58.65 y 80.50 mm (talla media 68.53 ± 5.28) y LC entre 12.45 y 17.86 mm (talla media 14.59 ± 1.31 mm). La distribución de frecuencia de tallas mostró diferencias estadísticamente significativas entre hembras y machos en ambas especies de camarones de profundidad (tabla 1; fig. 2) donde se evidencia dimorfismo sexual.
Tabla 1
Estadística descriptiva de la estructura de tallas (longitud total y longitud cefalotórax) en hembras (H) y machos (M) de los camarones G. longleyi y G. neglecta del Caribe colombiano.
|
Longitud total (mm) |
Longitud cefalotórax (mm) |
||||||||||||
|
Especie |
Sexo |
Min. |
Max. |
Media |
Desv. Est. |
H |
p |
Min. |
Max. |
Media |
Desv. Est. |
H |
p |
|
G. longleyi |
H |
54.93 |
123.77 |
84.65 |
15.43 |
38.91 |
0.00 |
11.64 |
32.84 |
20.00 |
5.17 |
47.97 |
0.00 |
|
M |
54.41 |
78.76 |
69.31 |
5.53 |
11.34 |
17.24 |
14.71 |
1.23 |
|||||
|
G. neglecta |
H |
57.84 |
119.09 |
72.19 |
8.1 |
3.84 |
0.01 |
12.24 |
30.93 |
15.77 |
2.44 |
8.70 |
0.00 |
|
M |
58.65 |
80.5 |
68.53 |
5.28 |
12.45 |
17.86 |
14.59 |
1.31 |
Se observaron diferencias significativas entre los pesos (g) de machos y hembras de los camarones de aguas profundas (p < 0.01) (tabla 2). La estructura de pesos para las hembras de G. longleyi varió entre 0.70 y 24.20 gramos (peso medio 6.31 ± 5.06 g) y para los machos entre 1 y 3.50 g (peso medio 2.02 ± 0.64 g), mientras que para G. neglecta la estructura de pesos de las hembras osciló entre 1.20 y 19.10 g (peso medio 2.94 ± 2.06 g) y para los machos entre 1.20 y 2.90 g (peso medio 2.01 ± 0.43 g).
Tabla 2
Estadística descriptiva del peso total en hembras (H) y machos (M) de los camarones G. longleyi y G. neglecta del Caribe colombiano.
|
Peso total (g) |
|||||||
|
Especie |
Sexo |
Min. |
Max. |
Media |
Desv. Est. |
H |
p |
|
G. longleyi |
H |
0.7 |
24.2 |
6.31 |
5.06 |
59.65 |
0.00 |
|
M |
1.00 |
3.5 |
2.02 |
0.64 |
|||
|
G. neglecta |
H |
1.2 |
19.1 |
2.94 |
2.06 |
14.06 |
0.01 |
|
M |
1.2 |
2.9 |
2.01 |
0.43 |
La mayor abundancia de individuos de G. longleyi se evidenció en la zona norte, donde la talla promedio fue de 72.48 mm (LT) y la talla promedio para la zona sur estuvo en 95.31 mm (LT), respectivamente (Fig. 2). En G. neglecta también se presentó mayor abundancia de individuos en la zona norte, donde la talla promedio fue de 70.94 mm (LT) y la talla promedio en la zona sur estuvo en 87.19 mm (LT). En las hembras de ambas especies de camarones aguas profundas se presentaron diferencias significativas entre las tallas por zonas (p < 0.01) (fig. 2).
La estructura de tallas para las hembras de ambas especies mostraron las tallas (LT) más grandes en el estrato IV (400-499 m). En este mismo estrato se encontraron los machos de G. longleyi, mientras que los machos de G. neglecta se encontraron en el estrato V (500-550 m) (fig. 3). Para G. longleyi la frecuencia de individuos más alta se encontró en el estrato IV, pero en el estrato V sólo hay presencia de hembras con un número bajo de individuos. Por el contrario, para G. neglecta se registró la frecuencia de individuos más alta en el estrato V, mientras que en el estrato IV sólo hubo presencia de hembras.
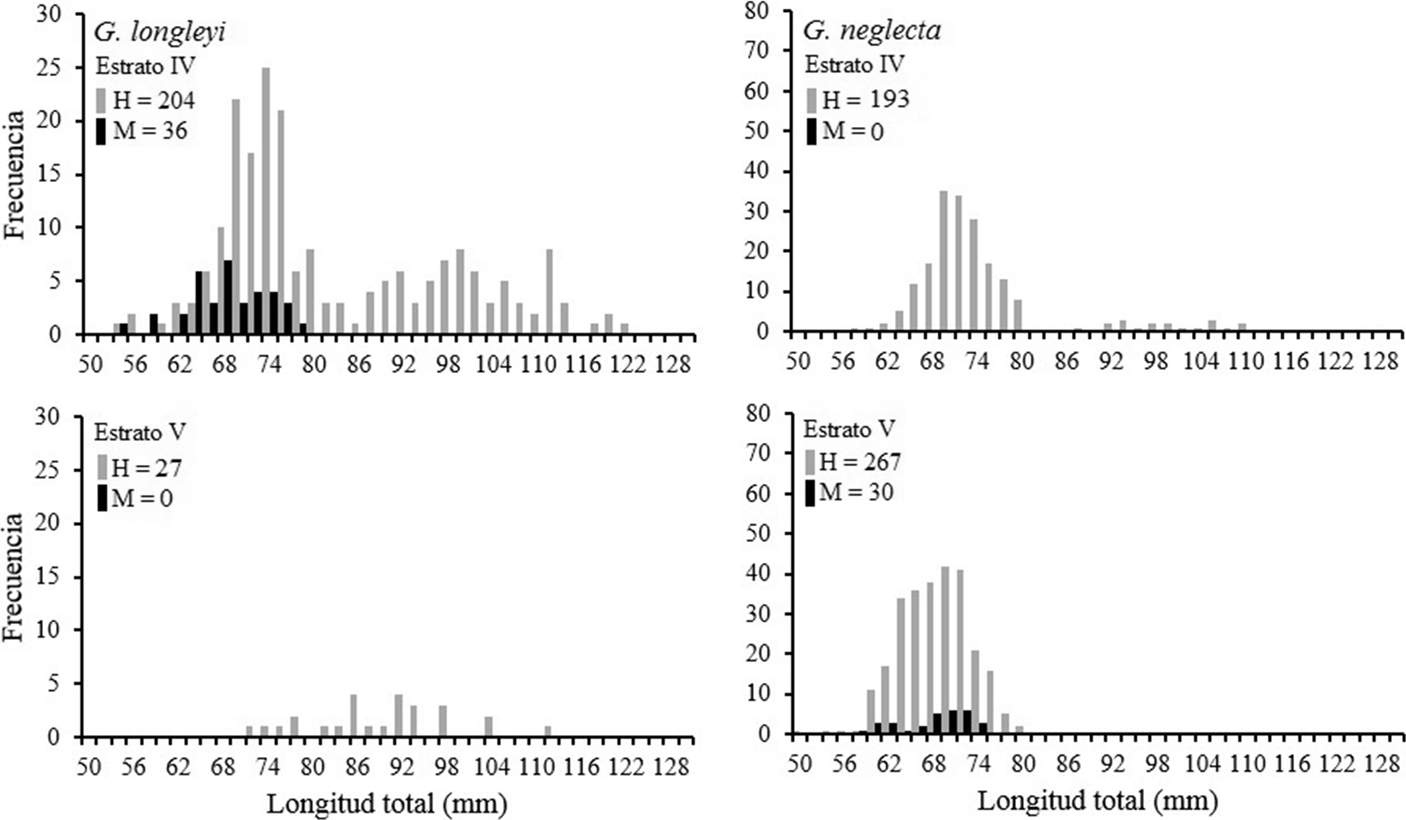
En las hembras de ambas especies de camarones de profundidad se evidenció diferencias significativas entre los estratos de profundidad (p < 0.01), mientras que los machos no presentaron diferencias significativas. En los estratos de profundidad I (100-199 m), II (200-299 m) no hubo presencia de camarones de profundidad, mientras que en el estrato III (300-399 m), sólo hubo presencia de 5 individuos, por esta razón no se realizaron análisis estadísticos.
La relación talla-peso mostró diferencias significativas en las hembras de G. longleyi y G. neglecta con respecto al valor de referencia b = 3 (p < 0.05), evidenciando un crecimiento de tipo alométrico positivo (b > 3), donde el peso (PT) incrementa a mayor proporción que la talla (LT), mientras que machos de G. longleyi presentaron isometría (b = 3) (p > 0.05) y los machos de G. neglecta mostraron crecimiento alométrico significativamente negativo (b < 3) (p < 0.05). Se encontraron diferencias estadísticamente significativas entre las pendientes de las curvas de crecimiento para hembras y machos de ambas especies de camarones de profundidad (p-Ancova < 0.05) (tabla 3; fig. 4). Las relaciones morfométricas entre la LC vs. LT mostraron coeficientes de determinación altos (r2 > 0.75) (tabla 4; fig. 4). El Ancova mostró que no hay diferencias estadísticamente significativas entre el paralelismo de las pendientes de las curvas de crecimiento para hembras y machos de ambos camarones de profundidad de la relación lineal (p-Ancova > 0.05) (tabla 4).
Tabla 3
Parámetros de la relación LT vs. PT en hembras y machos de los camarones G. longleyi y G. neglecta del Caribe colombiano.
|
LT vs. PT |
|||||||||
|
Especie |
Sexo |
a |
a (IC 95%) |
B |
b (IC 95%) |
r2 |
t – test |
F |
p |
|
(b) |
(Ancova) |
(Ancova) |
|||||||
|
G. longleyi |
H |
0.00 |
0.00 – 0.00 |
3.95 |
3.83 – 4.07 |
0.95 |
0.00 |
32.6 |
< 0.01 |
|
M |
0.00 |
0.00 – 0.00 |
3.55 |
2.94 – 4.16 |
0.79 |
0.08 |
|||
|
G. neglecta |
H |
0.00 |
0.00 – 0.00 |
3.73 |
3.58 – 3.88 |
0.85 |
0.00 |
13.45 |
< 0.01 |
|
M |
0.00 |
0.00 – 0.00 |
2.52 |
2.08 – 2.96 |
0.82 |
0.03 |
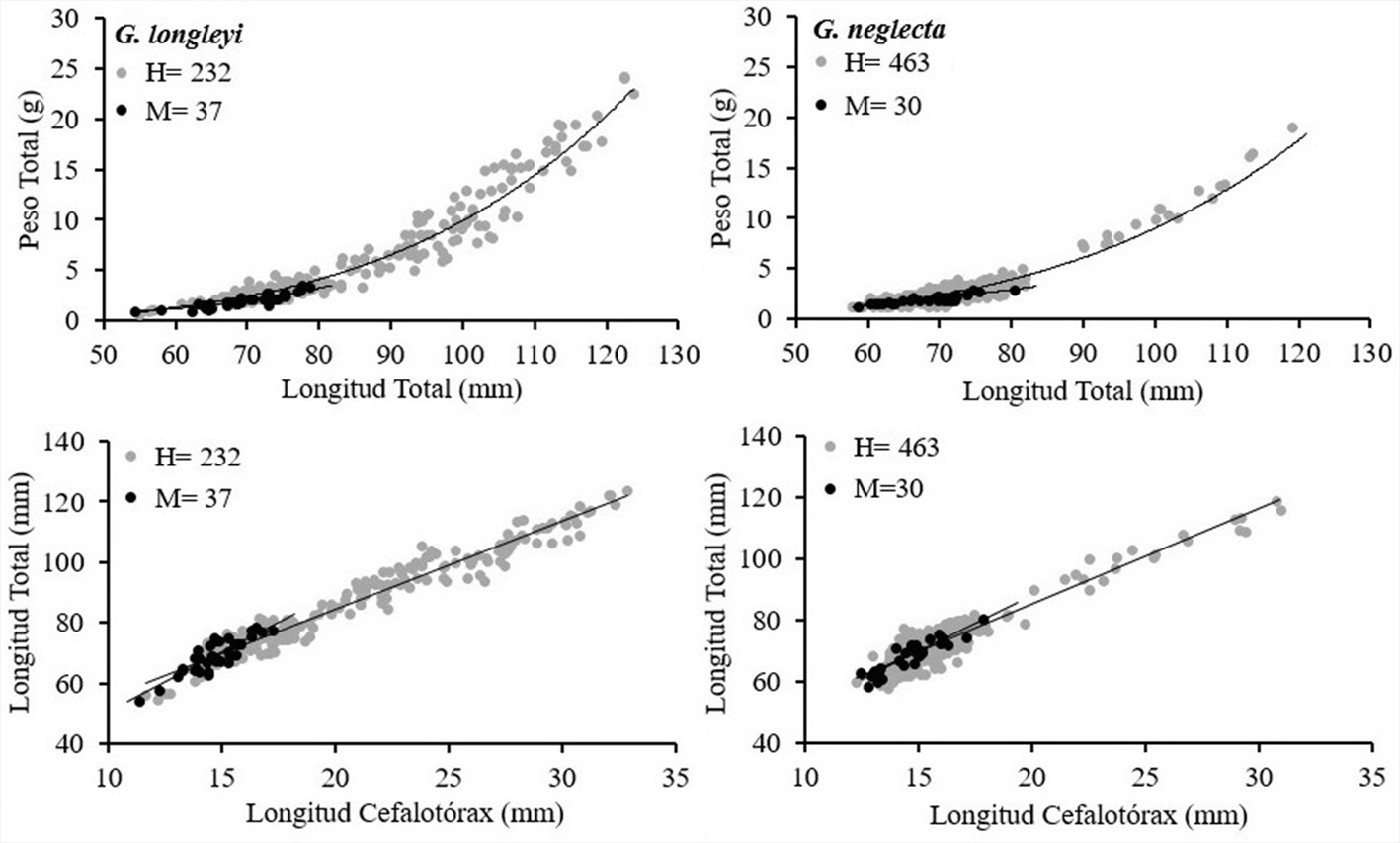
Tabla 4
Parámetros de la relación LC vs. LT y los intervalos de confianza (95%) en hembras y machos de los camarones G. longleyi y G. neglecta del Caribe colombiano.
|
LC vs. LT |
||||||||
|
Especie |
Sexo |
a |
a (IC 95%) |
b |
b (IC 95%) |
r2 |
F |
p |
|
(Ancova) |
(Ancova) |
|||||||
|
G. longleyi |
H |
26.39 |
24.66 – 28.12 |
2.91 |
2.83 – 3.00 |
0.95 |
1.85 |
0.18 |
|
M |
11.86 |
0.52 – 23.20 |
3.90 |
3.14 – 4.67 |
0.75 |
|||
|
G. neglecta |
H |
23.02 |
21.36 – 24.69 |
3.12 |
3.01 – 3.22 |
0.88 |
0.13 |
0.72 |
|
M |
15.25 |
5.69 – 24.80 |
3.65 |
3.00 – 4.30 |
0.82 |
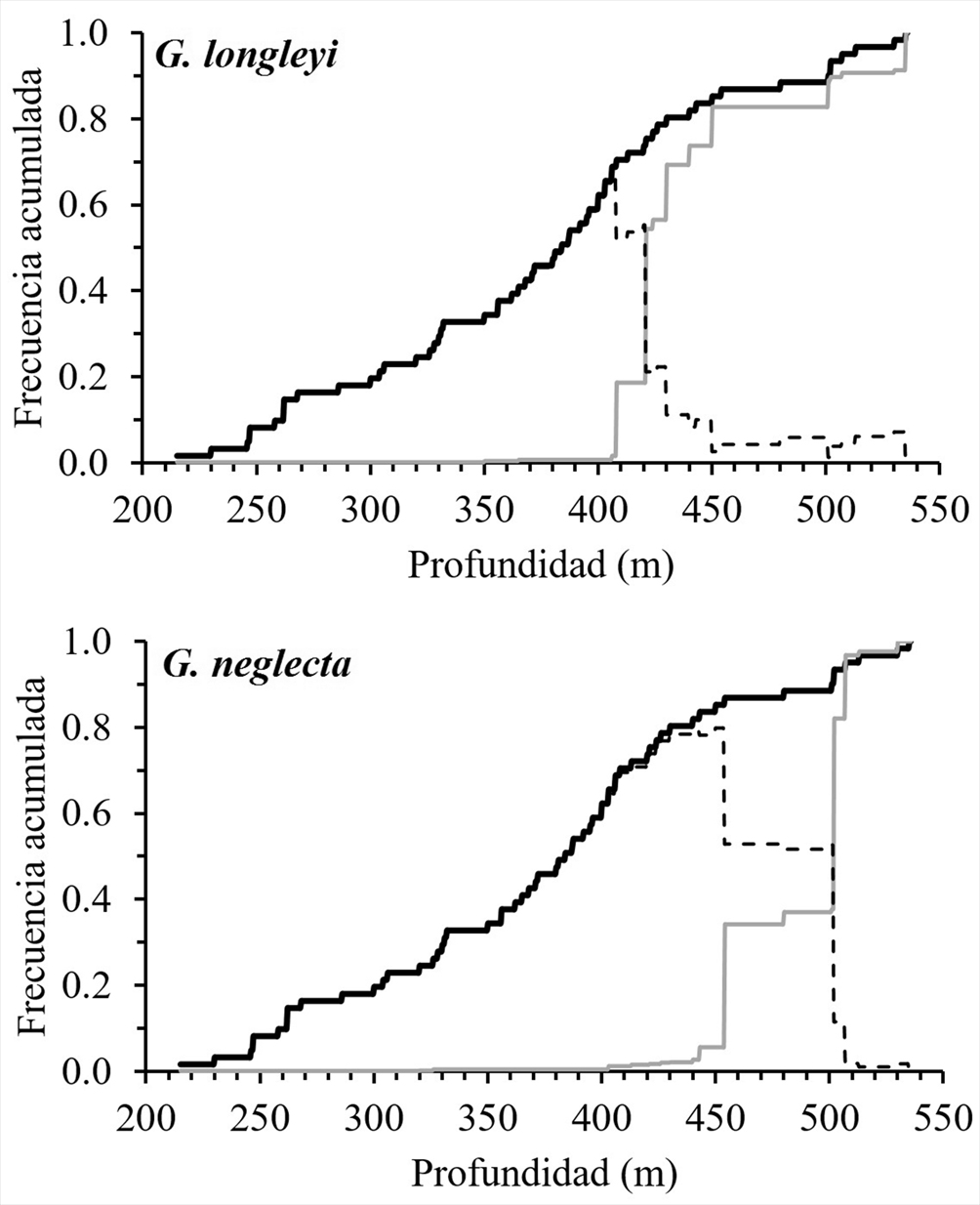
La asociación entre la biomasa de G. longleyi y G. neglecta con la profundidad muestra asociaciones significativas (p < 0.01). Las altas biomasas de G. longleyi se encontraron entre 356 y 420 m, pero con mayores biomasas entre 406 y 407 m. En G. neglecta las altas biomasas se encontraron un poco más profundas, entre 387 y 453.5 m, pero con mayores biomasas entre 450 y 453.5 m (fig. 5).
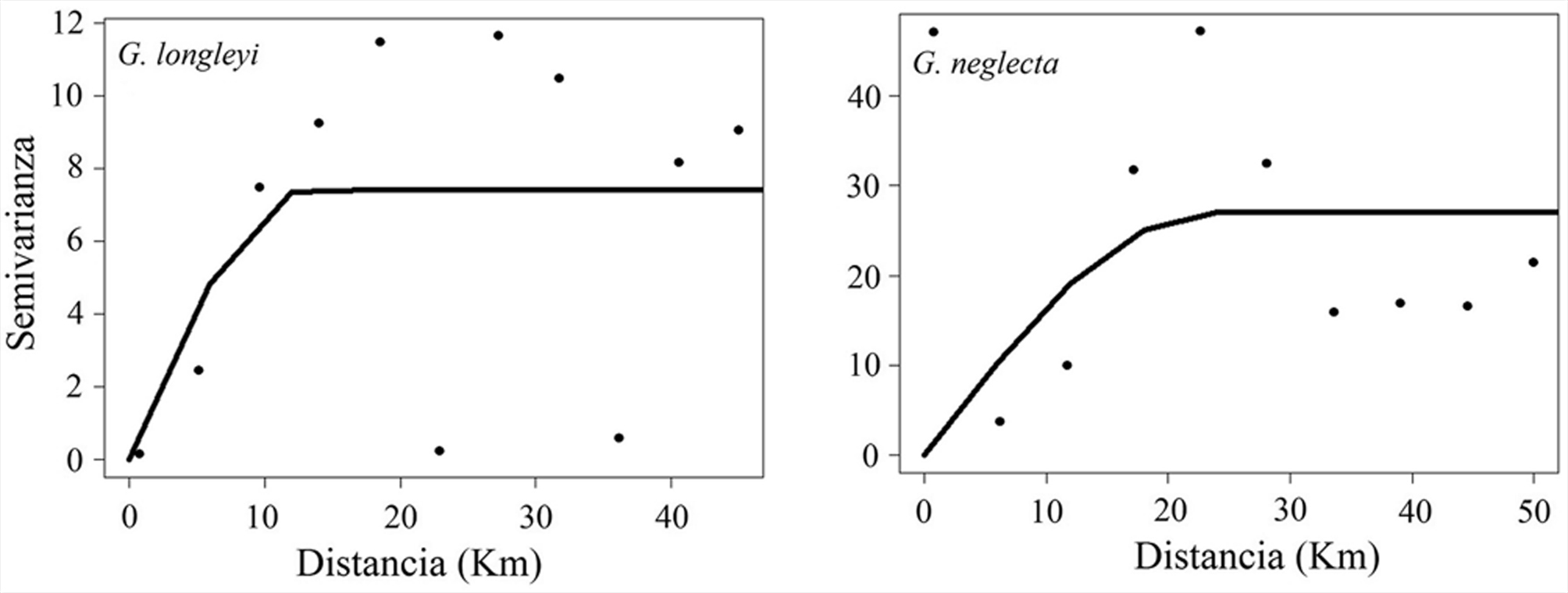
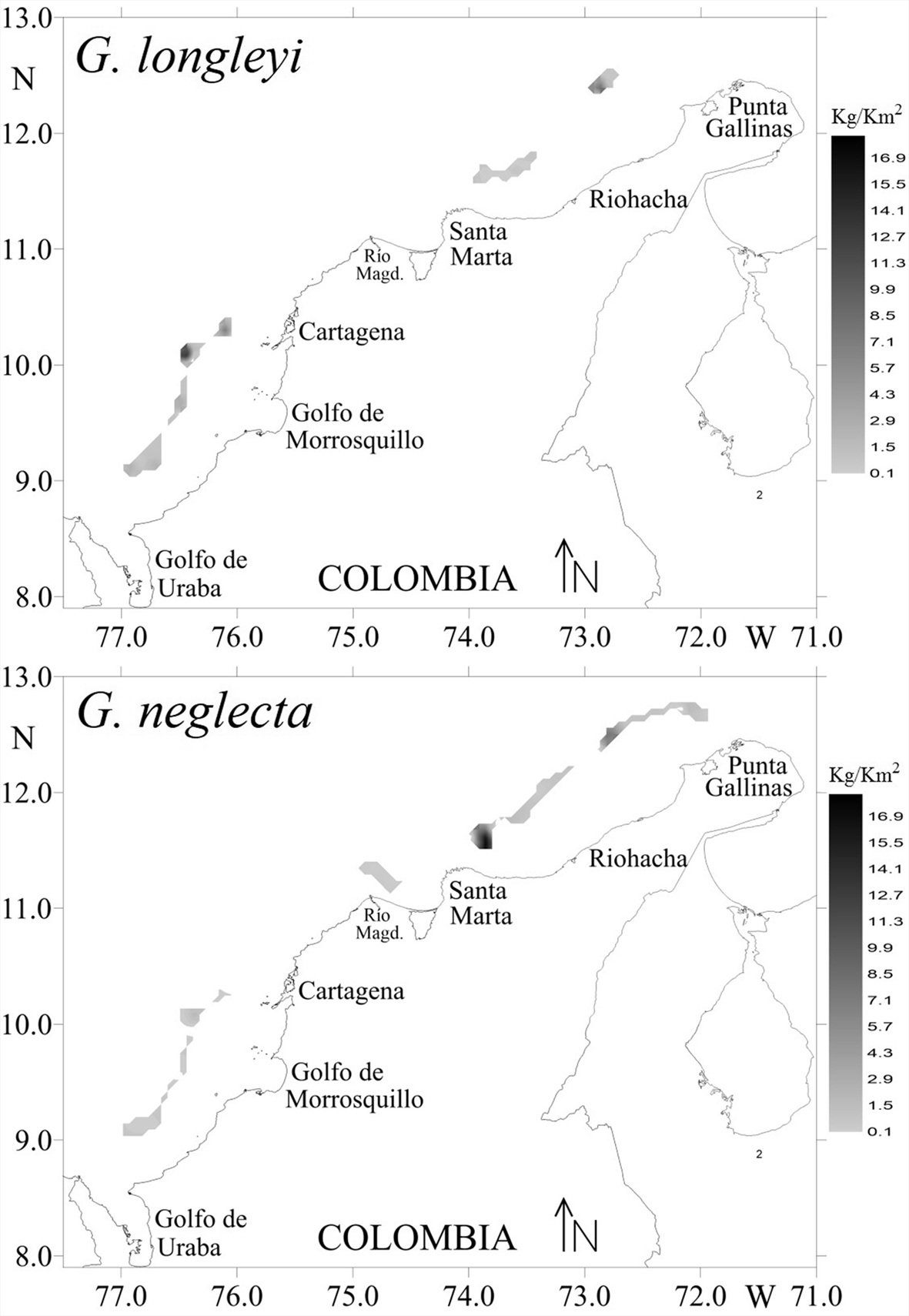
La estructura espacial de G. longleyi y G. neglecta se estudió con un variograma experimental omnidireccional (fig. 6), al cual se ajustó un modelo de variograma gausiano. El variograma para G. longleyi mostró un componente nugget de 0.00, sill = 7.42 y un rango de autocorrelación de la agregación de 10.50 km, es decir, el rango de correlación de los parches de agragación de alta biomasa. Los valores altos de biomasa para G. longleyi estuvieron distribuidos en la zona sur, principalmente al norte del golfo de Urabá y Cartagena (fig. 7). La biomasa media en la zona norte fue menor (1.23 kg/km2) que en la zona sur (2.27 kg/km2), resultando en una biomasa de 2,319.34 kg (CV = 10.11) en la zona norte y 4,366.00 kg (CV = 6.26) en la zona sur. El variograma para G. neglecta mostró un 12.68% de la varianza total (nugget como porcentaje del sill) (nugget = 3.45; sill = 23.78) (fig. 6). El rango de autocorrelación de la agregación fue 19.97 km, es decir, el rango de correlación de los parches de agregación de alta biomasa. Los valores altos de biomasa para G. neglecta estuvieron distribuidos en la zona norte, principalmente al norte de Santa Marta (fig. 7). La biomasa media en la zona norte fue mayor (2.22 kg/km2) que en la zona sur (0.52 kg/km2), resultando en una biomasa de 9,291.09 kg (CV = 9.64) en la zona norte y 1,025.40 kg (CV = 16.40) en la zona sur.
Discusión
La mayor parte de la información de camarones de profundidad de la familia Glyphocrangonidae en el área del golfo de México y el Caribe se limita a registros de presencia, distribución batimétrica y talla de los organismos (Felder et al., 2009; Holthuis, 1971). Escasos estudios como el realizado por Vázquez-Bader y Gracia (2013) en el sur del golfo de México aportan información sobre la distribución geográfica y batimétrica, abundancia y estructura de tallas en diferentes períodos climáticos por varios años consecutivos que permitan comparar los resultados obtenidos en este trabajo en un contexto temporal y espacial amplio.
Tanto G. longleyi como G. neglecta presentaron dimorfismo sexual con mayor talla para las hembras, que es un fenómeno común en los crustáceos (Páramo y Núñez, 2015). Con respecto a la estructura de tallas, G. longleyi presentó un intervalo más amplio que G. neglecta, lo cual es congruente con lo señalado por Holthuis (1971) quien cataloga a esta última como una de las especies más pequeñas de la familia Glyphocrangonidae.
Las tallas máximas de LC en ambos sexos de G. longleyi (hembras: 32.84 mm; machos: 17.24 mm) son similares a las reportadas en el MCC (Campos et al., 2005), la talla media (hembras: 20.00 mm LC; machos: 14.71 mm LC) está dentro del rango de la talla media registrado en el golfo de México, donde también hubo una alta relación de hembras a machos (Vázquez-Bader y Gracia, 2013). Sin embargo, los individuos reportados en el golfo de México fueron capturados en un intervalo de profundidades mayor (300-1,200 m) al muestreado en este estudio, lo cual seguramente incluye todo el intervalo de tallas de G. longleyi.
En G. neglecta, la talla máxima de LC de hembras y machos (hembras: 30.93 mm; machos: 17.86 mm) fue superior a la reportada en el MCC y está dentro del rango de la reportada en el Atlántico en un intervalo de profundidad mayor (365-1,090 m) al explorado en este trabajo (Campos et al., 2005; Holthuis, 1971).
No existen registros de dimorfismo sexual en talla para ninguna de las 2 especies, evidenciándose en el presente estudio mayor talla para las hembras, fenómeno común entre los crustáceos (Páramo y Núñez, 2015).
En las hembras de ambas especies de camarones se determinó un crecimiento alométrico positivo, mientras que los machos de G. longleyi presentaron crecimiento de tipo isométrico y el crecimiento de los machos de G. neglecta fue de tipo alométrico negativo. Glyphocrangon alata en el norte de Chile mostró un crecimiento alométrico negativo (Quiroga y Soto, 1997), lo cual coincide con los machos de G. neglecta en el Caribe colombiano. En el norte de Chile, Quiroga y Soto (1997) señalan que las hembras de G. alata mostraron un crecimiento isométrico; sin embargo, no existe información disponible en la literatura con lo cual comparar el comportamiento de los machos.
Ambas especies de camarón de profundidad se distribuyeron en las 2 zonas definidas (norte y sur), aunque presentaron diferencias en la distribución por sexo, estructura de tallas y biomasa. Las hembras de G. longleyi y G. neglecta se encontraron en toda el área de estudio, mientras que los machos solo se registraron en la zona norte. En esta zona donde coincidieron ambos sexos de las 2 especies, la estructura de tallas de hembra y machos de G. longleyi y G. neglecta presentó un intervalo similar (52-80 mm de LT), además, se recolectaron camarones de talla pequeña. En contraste, en la zona sur la composición de tallas estuvo básicamente representada por hembras grandes en ambas especies. Este patrón de distribución diferencial por sexo y talla sugiere que la zona norte puede constituir un área de reproducción y reclutamiento, mientras que en la zona sur ocurre una segregación espacial de sexos debido a un patrón migratorio tal vez relacionado con el desove. Este planteamiento no es posible de confirmar dado que no se registraron hembras ovígeras de estos camarones de profundidad. Vázquez-Bader y Gracia (2013) señalan que las hembras ovígeras de G. longleyi se presentan en primavera, verano y otoño en un rango de profundidad de 800 a 1,200 m, mientras que para G. neglecta no hay información disponible sobre la distribución de hembras ovígeras. Considerando el amplio período reproductivo de G. longleyi, llama la atención que no se hayan registrado hembras ovígeras en el Caribe colombiano; lo cual puede deberse a que el muestreo no se extendió a profundidades mayores de 550 m donde las hembras ovígeras se distribuyen preferencialmente.
Con respecto a la distribución batimétrica, cerca del 90% de las hembras y el total de los machos de G. longleyi se registraron en el estrato IV (400-499 m de profundidad), mientras que en el estrato V (500-550 m) solo se presentó un número reducido de hembras. El máximo de abundancia registrado en el estrato IV se ubica dentro del rango de profundidad de mayor concentración de organismos (300-638 m) reportado por Holthuis (1971) y cercano al señalado (500-599 m) por Vázquez-Bader y Gracia (2013) para G. longleyi. Las tallas de las hembras presentaron diferencias significativas ente estos estratos. Un comportamiento similar se reportó para las hembras de G. longleyi en el golfo de México donde se encontraron diferencias significativas en los estratos de profundidad de 400-499 y 600-699 m (Vázquez-Bader y Gracia, 2013); sin embargo, en el presente estudio no se exploró este último estrato. Es interesante resaltar que en el estrato IV estuvo representado todo el espectro de tallas de hembras y machos de G. longleyi con la diferencia mencionada anteriormente de que las hembras de tallas grandes solo se presentaron en el sur. Esto sugiere que el conjunto de la población de G. longleyi tiende a distribuirse preferencialmente en profundidades de 400-500 m, donde posiblemente se lleve a cabo el apareamiento en la zona norte y también una segregación de sexos en la zona sur. La mayor presencia de tallas pequeñas en la zona norte puede ser un indicador de que el reclutamiento ocurra principalmente en esta área.
En el caso de G. neglecta se presentó un comportamiento similar al de G. longleyi en la distribución por zonas, ya que en el área norte se registraron ambos sexos, que constituyeron el 94% de los organismos recolectados y en la zona sur solo se observaron hembras de tallas altas en menor número. Sin embargo, la abundancia fue mayor en el estrato V donde coexistieron hembras y machos en el estrato más profundo (500-550m) con 61% de los organismos capturados, opuesto a lo registrado en G. longleyi que fue más abundante en el estrato más somero. Esto concuerda con el rango amplio de distribución batimétrica reportado para G. neglecta (365 a 1,090 m) con un intervalo de profundidad óptimo ligeramente más profundo (365-730 m) que el de G. longleyi (Holthuis, 1971). Por otro lado, la estructura de tallas en estos estratos, aunque presentó un rango similar (60-80 mm de LT) fue significativamente diferente en el caso de las hembras y la segregación por sexos ocurrió el estrato más somero. La coexistencia de sexos en el estrato más profundo, particularmente en la zona norte donde G. neglecta presenta mayor abundancia sugiere que el proceso reproductivo pueda ocurrir en esta área. En esta especie no se detectaron organismos de tallas pequeñas indicadoras de reclutamiento.
Las 2 especies de camarón de profundidad coinciden en el área norte como posible área de reproducción; sin embargo, presentan un comportamiento distinto en la distribución y segregación por sexo respecto a la profundidad, con lo cual pueden utilizar diferencialmente los recursos en el gradiente batimétrico. Una distribución espacial y batimétrica diferencial de las especies de la familia Glyphocrangonidae ha sido reportada en el Atlántico y golfo de México por Holthuis (1971) y Vázquez-Bader y Gracia (2013).
El área noreste del Caribe colombiano está influenciada por los vientos alisios del noreste, los cuales causan un transporte Ekman hacia afuera de la costa, soplando en una dirección sur-oeste, casi paralelos a la costa(Páramo et al., 2003, 2009, 2011); los vientos alisios son responsables de la surgencia que incrementa la productividad en el área de La Guajira (Andrade et al., 2003; Páramo et al., 2003, 2009, 2011). Por esta razón, las mayores agregaciones de G. neglecta se encontraron en el noreste del Caribe colombiano, donde la oceanografía local está modulada por la surgencia estacional de alta productividad (Páramo et al., 2009, 2011). Las mayores biomasas de G. longleyi en la zona sur se distribuyeron entre Cartagena y el golfo de Morrosquillo, donde existe una gran extensión de arrecifes de coral de profundidad que caracteriza el área como altamente productiva, con condiciones de hábitat apropiadas para G. longleyi (López-Victoria y Díaz, 2000). Finalmente, se necesita más información biológica para comprender mejor los parámetros del ciclo de vida de estas especies, tales como crecimiento, épocas de desove, reclutamiento, mortalidad, áreas de desove, áreas de crianza y biodiversidad asociada. Esta información puede ayudar a desarrollar estrategias de protección y conservación del ecosistema en el Caribe colombiano.
Agradecimientos
Este trabajo es una contribución del grupo de investigación Ciencias y Tecnología Pesquera Tropical (CITEPT) de la Universidad del Magdalena (Colombia). Agradecemos a la tripulación del barco “Tee Claude” y al Capitán José Guillén. El trabajo fue patrocinado por COLCIENCIAS (Código 1117-452-21288), la Universidad del Magdalena, el Instituto Colombiano de Desarrollo Rural (INCODER) a través de la Subgerencia de Pesca y Acuicultura, la Autoridad Nacional de Acuicultura y Pesca (AUNAP) convenio Núm. 790.
Referencias
Andrade, C. A., Barton, E. D. y Mooers, C. H. N. K. (2003). Evidence for an eastward flow along the Central and South American Caribbean Coastal. Journal of Geophysical Research, 108, 1–11.
Campos, N., Navas, G., Bermúdez, A. y Cruz, N. (2005). Los crustáceos decápodos de la franja superior del talud continental (300-500 m) del MCC. Monografías II de la Fauna de Colombia, Instituto de Ciencias Naturales, Universidad Nacional de Colombia, sede Bogotá, Colombia.
Chace, F. A. Jr. (1984). The caridean shrimps (Crustacea: Decapoda) of the ‘’Albatross’’ Philippine Expedition, 1907-1910, Part 2: Families Glyphocrangonidae and Crangonidae. Smithsonian Contributions to Zoology, 397, 1–25.
Cressie, N. A. C. (1993). Statistics for spatial data. New York: Wiley-Blackwell.
De Grave, S. y Fransen, C. H. J. M. (2011). The recent species of the Dendrobranchiate, Stenopodidean, Procarididean and Caridean shrimps (Crustacea: Decapoda). Zoologische Mededelingen, 85, 195–589.
Felder, D. L., Álvarez, F., Goy, J. W. y Lemaitre, R. (2009). Decapoda (Crustacea) of the Gulf of Mexico, with comments on the Amphionidacea. En D. L. Felder y D. K. Camp (Eds.), Gulf of Mexico. Origin, waters, and biota, Volume 1, Biodiversity (pp. 1019–1104). College Station: Texas A&M University Press.
Ferreira, S., Sousa, R., Delgado, J., Carvalho, D. y Chada, T. (2008). Weight-length relationships for demersal fish species caught off the Madeira archipelago (eastern-central Atlantic). Journal of Applied Ichthyology, 24, 93–95.
Fischer, W., Krupp, F., Schnelder, W., Sommer, C., Carpenter, K. E. y Niem, V. H. (1995). Guía FAO para la identificación de especies para los fines de la pesca, Volumen I. Pacífico centro-oriental, Plantas e invertebrados. Fráncfort: FAO/ Instituto de Investigación Senckenberg.
Gore, R. H. (1985). Some rare species of abyssobenthic shrimp (families Crangonidae, Glyphocrangonidae and Nematocarcinidae) from the Venezuela Basin, Caribbean Sea (Decapoda: Caridea). Crustaceana, 48, 269–285.
Gotelli, N. J. y Ellison, A. M. (2004). A primer of ecological statistics. Sunderland, Massachusetts: Sinauer Associates.
Gunderson, D. R. (1993). Surveys of fisheries resources. New York: John Wiley & Sons.
Holthuis, L. B. (1971). The Atlantic shrimps of the deep-sea genus Glyphocrangon A. Milne Edwards, 1881. Biological results of the University of Miami deep-sea expeditions, 75. Bulletin of Marine Science, 21, 267–373.
Holthuis, L. B. (1980). FAO species catalogue; shrimps and prawns of the world. An annotated catalogue of species of interest to fisheries, Volumen I. Leiden: FAO Fisheries Synopsis, Rijksmuseum van Natuurlijke Historie.
Isaaks, E. H. y Srivastava, R. M. (1989). Applied geostatistics. Oxford: Oxford University Press.
Kensley, B., Tranter, H. A. y Griffin, D. J. G. (1987). Deep-water decapod Crustacea from eastern Australia (Penaeidea and Caridea). Records of the Australian Museum, 39, 263–33l.
King, M. (2007). Fisheries biology, assessment and management. Oxford: Wiley-Blackwell.
Komai, T. (2004a). Deep-sea shrimps of the genus Glyphocrangon A. Milne-Edwards (Crustacea: Decapoda: Caridea: Glyphocrangonidae) from off southeastern coast of Brazil collected during the REVIZEE Program. Arquivos do Museu Nacional, Rio de Janeiro, 62, 31–44.
Komai, T. (2004b). A review of the Indo-West Pacific species of the genus Glyphocrangon A. Milne Edwards, 1881 (excluding the G. caeca Wood-Mason, 1891 species group) (Crustacea: Decapoda: Caridea: Glyphocrangonidae). En B. Marshall y B. Richer de Forges (Eds.), Tropical deep sea benthos. Paris, Volumen 23. Memoires du Museum National d’Histoire Naturelle, 191, 375–610.
Komai, T. (2006). Revision of the Glyphocrangon caeca species group (Crustacea: Decapoda: Glyphocrangonidae). En B. Richer de Forges y J. Justine (Eds.), Tropical deep-sea benthos. Paris, Volumen 24. Mémoires du Muséum National d’Histoire Naturelle, 193, 243–264.
Komai, T. (2007). A new species of Glyphocrangon (Crustacea: Decapoda: Caridea: Glyphocrangonidae) from the Austral Islands, French Polynesia. Zoosystema, 29, 565–573.
Komai, T. (2011). A new species of the deep-sea shrimp genus Glyphocrangon A. Milne-Edwards (Crustacea: Decapoda: Caridea: Glyphocrangonidae) from the southeastern Atlantic off southern Africa. African Natural History, 6, 83–90.
López-Victoria, M. y Díaz, J. M. (2000). Morfología y estructura de las formaciones coralinas del archipiélago de San Bernardo, Caribe Colombiano. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 24, 219–230.
Páramo, J., Correa, M. y Núñez, S. (2011). Evidencias de desacople físico-biológico en el sistema de surgencia en La Guajira, Caribe colombiano. Revista de Biología Marina y Oceanografía, 46, 421–430.
Páramo, J., Guillot, L., Benavides, S., Rodríguez, A. y Sánchez, C. (2009). Aspectos poblacionales y ecológicos de peces demersales de la zona norte del Caribe colombiano en relación con el hábitat: una herramienta para identificar Áreas Marinas Protegidas (AMPs) para el manejo pesquero. Caldasia, 31, 123–144.
Páramo, J. y Núñez, S. (2015). Estructura de tallas, talla media de madurez sexual y razón sexual de camarones de aguas profundas de importancia comercial en el Caribe colombiano. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 39, 408–415.
Páramo, J., Quiñones, R. A., Ramírez, A. y Wiff, R. (2003). Relationship between biomass density of small pelagic and environmental factors in the Colombian Caribbean Sea: an analysis based on hydroacustic information. Aquatic Living Resources, 16, 239–245.
Páramo, J. y Roa, R. (2003). Acoustic-geostatistical assessment and habitat-abundance relations of small pelagic fish from the Colombian Caribbean. Fisheries Research, 60, 309–319.
Perry, R. I. y Smith, S. J. (1994). Identifying habitat associations of marine fishes using survey data: an application in the Northwest Atlantic. Canadian Journal of Fisheries and Aquatic Sciences, 51, 589–602.
Petitgas, P. y Lafont, T. (1997). EVA 2: Estimation variance. Version 2: a geostatistical software on Windows 95 for the precision of fish stock assessment surveys. Copenhagen, Denmark: International Council for the Exploration Sea CM-1997/Y: 22.
Quiroga, J. E. y Soto, M. R. (1997). Relaciones biométricas y fecundidad de Glyphocrangon alata (Faxon, 1893) en la zona norte de Chile (21°19’S; 70°20’W). Investigaciones Marinas, Valparaíso, 25, 281–285.
Ribeiro, P. J. y Diggle, P. J. (2001). geoR: a package for geostatistical analysis. R News, 1, 14–18.
Rivoirard, J., Simmonds, J., Foote, K. G., Fernandes, P. y Bez, N. (2000). Geostatistics for estimating fish abundance. London: Wiley-Blackwell.
Vázquez-Bader, A. R. y Gracia, A. (2013). Crangonidae and Glyphocrangonidae (Decapoda; Caridea) of the Southern Gulf of Mexico. Zootaxa, 3669, 367–383.
Zar, J. H. (2009). Biostatistical analysis. New York: Prentice Hall.