Laura C. Sanchez a, *, Julián M. Alonso b y Adriana S. Manzano a, c
a Facultad de Ciencia y Tecnología, Universidad Autónoma de Entre Ríos, Tratado del Pilar 314, 3105 Diamante, Entre Ríos, Argentina
b Administración de Parques Nacionales, Intendencia del Parque Nacional Pre Delta, 3 de Febrero 394, 3105 Diamante, Entre Ríos, Argentina
c Centro de Investigación Científica y Transferencia Tecnológica a la Producción, España 149, 3105 Diamante, Entre Ríos, Argentina
*Autor para correspondencia: lauracecilias@gmail.com (L.C. Sanchez)
Recibido: 26 septiembre 2019; aceptado: 15 abril 2020
Resumen
El objetivo de este trabajo fue caracterizar las comunidades de anuros del Parque Nacional Islas de Santa Fe. Se efectuaron 9 campañas desde septiembre 2018 a marzo 2019. Se utilizaron 3 métodos de registro: trampas de caída, búsqueda de larvas e inspecciones nocturnas. Se analizó la eficiencia de muestreo mediante curvas de acumulación de especies utilizando 4 estimadores: ACE, ICE, jackknife 1 y Chao 2. Para determinar el modelo de distribución de abundancias de las especies, se realizaron pruebas de bondad de ajuste χ². Se calcularon la riqueza, diversidad real y equitatividad de las comunidades. Se registraron 14 especies de anuros, 9 de las cuales constituyen registros nuevos para el parque. La eficiencia de muestreo sobrepasó en 94% a todos los estimadores. Las especies más abundantes fueron: Leptodactylus latrans, Elachistocleis bicolor, Dendropsophus nanus, Boana punctata, Boana pulchella y Lysapsus limellum. Los datos se ajustaron al modelo de distribución logarítmico normal. La diversidad real total fue D = 7.94, mientras que la equitatividad fue J = 0.79. La diversidad real hallada fue inferior a la registrada en el Parque Nacional Pre-Delta, un humedal templado de características similares. Estos aportes son de utilidad para poner en marcha planes de acción para la conservación de anfibios del área.
Palabras clave: Riqueza; Composición taxonómica; Distribución de abundancias; Diversidad real; Equitatividad; Conservación de anfibios
© 2020 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Characterization of the anuran communities of the Santa Fe Islands National Park, Argentina
Abstract
The aim of this work was to characterize the anuran communities of the Santa Fe Islands National Park. There were 9 campaigns from September 2018 to March 2019 and 3 collecting methods were used: pitfall traps, surveys for tadpoles, and active nocturnal searches. Sample efficiency was analyzed by means of species accumulation curves using 4 estimators: ACE, ICE, Jackknife 1 and Chao 2. To determine the model of species abundance distribution, goodness-of-fit tests χ² were performed. The richness, true diversity and the evenness of the communities were calculated. There were 14 species of anurans recorded, 9 of which constitute new records for the park. Sampling efficiency exceeded 94% in all estimators. The most abundant species were: Leptodactylus latrans, Elachistocleis bicolor, Dendropsophus nanus, Boana punctata, Boana pulchella and Lysapsus limellum. The data was fitted to the normal logarithmic distribution model. The total true diversity was D = 7.94 while evenness was J = 0.79. The true diversity found was lower than what was recorded in Pre-Delta National Park, a temperate wetland of similar characteristics. These contributions are useful to start action plans for the conservation of amphibians in the area.
Keywords: Richness; Taxonomic composition; Distribution of abundances; True diversity; Evenness; Conservation of amphibians
© 2020 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
América del Sur presenta una gran diversidad de paisajes y ambientes. Destacan las montañas, llanuras, bosques, selvas, desiertos, donde se encuentran los ríos y humedales fluviales más grandes del mundo. Un ejemplo lo constituye el extenso sistema Pantanal-Paraguay-Paraná, que representa un inmenso reservorio continental de agua. Los humedales se encuentran entre los ecosistemas más productivos del planeta, mitigan las inundaciones y sequías, retienen sedimentos y nutrientes; mantienen una altísima biodiversidad, controlan la erosión y proveen a las comunidades costeras de transporte y recursos alimenticios como la pesca (Peteán y Cappato, 2005). En la porción inferior de la cuenca del río Paraná, se encuentra su delta, el cual es un macrosistema ecológico que forma un mosaico de humedales, y que comienza al sur de la ciudad de Diamante (Entre Ríos). El río Paraná se extiende a lo largo de aproximadamente 300 km, entre las latitudes de 32°5’ S, 34°29’ S en Argentina (Malvárez, 1999). Es de destacar, que desde octubre de 2015, esta zona de humedales de origen fluvial, asociados a la llanura de inundación del río Paraná, no solo en su tramo inferior sino también en parte de su tramo medio, ha sido categorizada internacionalmente como sitio Ramsar “Delta del Paraná” (sitio Núm. 2255).
Los sitios Ramsar se designan por contener tipos de humedales representativos, raros o únicos, o bien, por considerarse áreas de importancia internacional para la conservación de la diversidad biológica (Secretaría de la Convención de Ramsar, 2010). Dos parques nacionales se encuentran incluidos dentro del delta del río Paraná: el Parque Nacional Islas de Santa Fe (PNISF) y el Parque Nacional Pre-Delta (PNPD); ambos tienen como fin preservar los humedales de la porción superior de este delta. En total, la superficie del delta protegida de forma efectiva a través de parques nacionales es del orden de 1% (Kandus et al., 2011).
El PNISF fue creado en noviembre de 2010 mediante la ley nacional Núm. 26.648, y se localiza al sudeste de la provincia de Santa Fe, Argentina. El mismo se encuentra en etapa de formación, razón por la cual aún no admite visitas y depende administrativamente del PNPD, el cual se localiza a 26 km aguas arriba sobre el río Paraná, en la ciudad costera de Diamante, Entre Ríos. Desde el PNPD se programan las actividades de control y vigilancia que el Cuerpo de Guardaparques Nacionales desarrolla diariamente en el PNISF. Al ser un área protegida creada recientemente, se han realizado pocas investigaciones en el lugar, tendientes a evaluar la biodiversidad presente en ella. Hasta la fecha, los estudios se han focalizado en el análisis de la vegetación (Aceñolaza, Zamboni et al., 2008; Franceschi et al., 1985), inventarios ornitológicos (Fandiño, 2011) y de micromamíferos (Vadell y Gómez-Villafañe, 2016; Vadell et al., 2011). Se desconocen investigaciones destinadas a caracterizar específicamente a las comunidades de anfibios protegidas por el PNISF. No obstante, en estudios efectuados con otros fines, específicamente en la isla Campo El Rico, se registró la presencia de 6 especies de anuros: Dendropsophus nanus, Boana pulchella, Scinax nasicus, Leptodactylus latrans, Rhinella fernandezae y Rhinella diptycha (Ghirardi et al., 2014). Por otro lado, en el PNPD, que alberga unidades ambientales similares a las del PNISF se ha constatado la presencia de 23 especies pertenecientes a este grupo taxonómico, distribuidas en 5 familias y 12 géneros, siendo las especies dominantes en razón de su abundancia: R. fernandezae, D. nanus, Dendropsophus sanborni, B. pulchella, Scinax squalirostris, L. latrans y Elachistocleis bicolor (Sanchez, 2011; Sanchez y Manzano, 2005; Sanchez et al., 2007, 2009, 2013). Los reportes mencionados hacen pensar que la riqueza de especies de anfibios del PNISF sería considerablemente más elevada de lo conocido hasta el momento. A mayor escala, considerando toda la región superior del complejo deltaico del río Paraná (definida entre la diagonal Paraná-Santa Fe como límite norte y Puerto Gaboto (Santa Fe) – Arroyo Las Ceibas (Entre Ríos) como límite sur), se ha sugerido la presencia de 30 especies de anfibios, con base en revisiones bibliográficas principalmente, y a la consulta de colecciones herpetológicas de referencia (Aceñolaza, Manzano et al., 2008).
Si bien, recientemente se presentó un plan de manejo para el sitio Ramsar Delta del Paraná (Giacosa et al., 2019), resulta evidente la ausencia de muestreos sistemáticos tendientes a la recolección de información ecológica sobre anuros en el PNISF. El conocimiento de los atributos de las comunidades de anfibios es fundamental para valorar el patrimonio natural del citado parque nacional y especialmente como herramienta a la hora de implementar un plan de gestión para el área protegida y de tomar decisiones correctas orientadas a la conservación biológica. En este contexto, el presente trabajo tiene como objetivo general describir las comunidades de anfibios del Parque Nacional Islas de Santa Fe, y como objetivos específicos analizar la riqueza y la composición taxonómica de las comunidades de anfibios anuros presentes, así como estimar la abundancia de las especies registradas.
Materiales y métodos
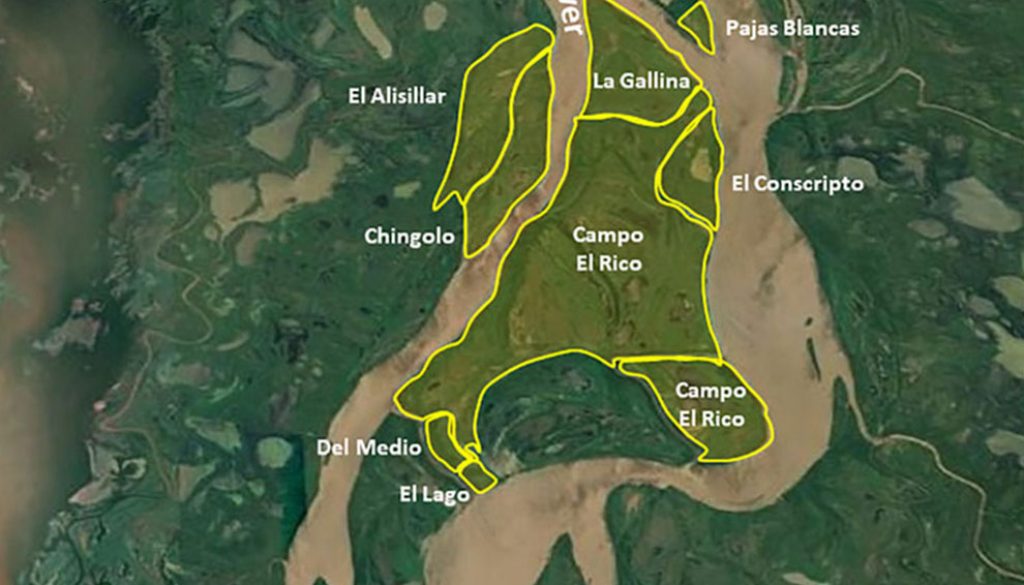
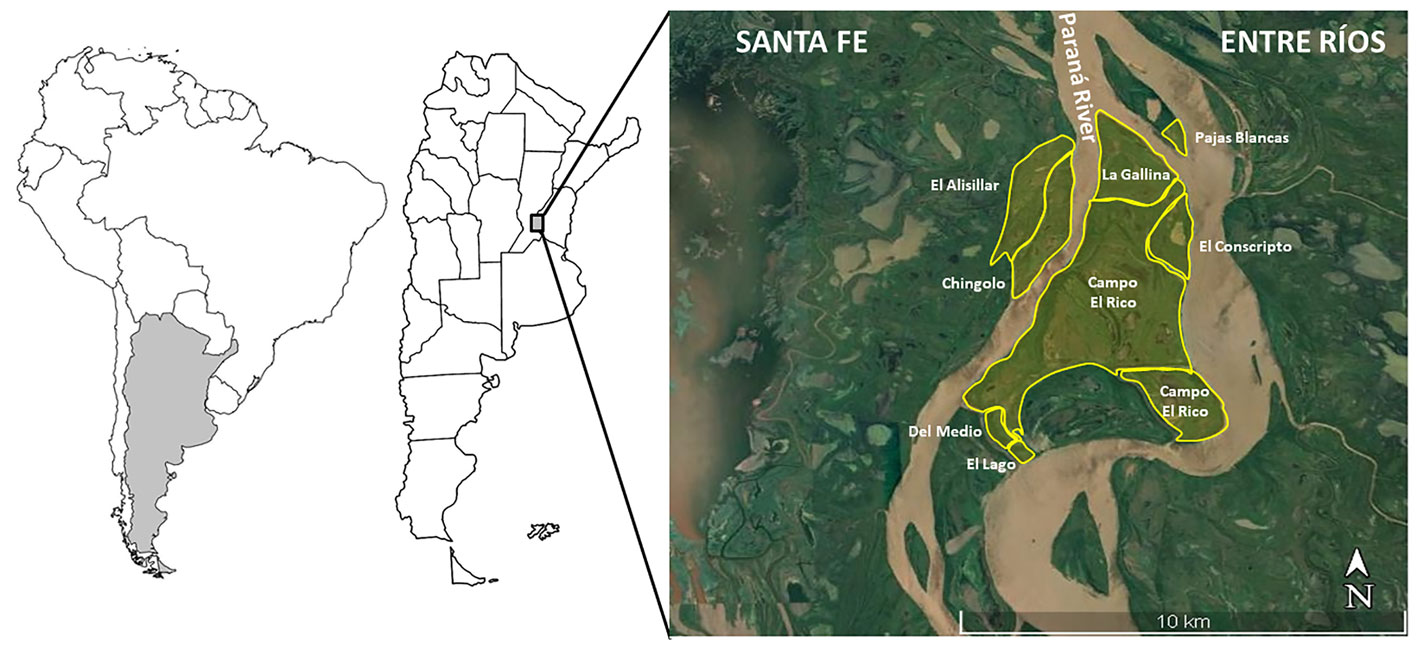
El PNISF se localiza al sureste de la provincia de Santa Fe, Argentina (32º16’44.87” S, 60º43’12” O) y se emplaza en la ecoregión Delta e Islas del Paraná (Burkart et al., 1999). El PNISF es una reserva natural que posee una superficie de 4,096 ha. Está conformada por 8 islas: Campo El Rico, La Gallina, El Conscripto, Mabel o Chingolo, El Lago, Del Medio, El Alisillar y Pajas Blancas (fig. 1; Rinaldi, 2010). Las 3 primeras islas fueron las que se utilizaron para el muestreo y constituyen aproximadamente 75% de la superficie del PNISF. Los arroyos, lagunas, bañados, bosques ribereños y el gran río Paraná son los elementos que caracterizan el patrón de paisaje del área protegida (Bó y Malvárez, 1999). El área presenta vegetación típica de bosque fluvial de galería (Bó, 2006), caracterizada por albergar bosques de albardones marginales (e.g., Salix humboldtiana y Tessaria integrifolia), así como vegetación arbustiva/herbácea (e.g., Baccharis dracunculifolia y Panicum prionitis) y acuática (e.g., Eichhornia azurea y Ludwigia peploides) (Aceñolaza, Zamboni et al., 2008). El área de estudio pertenece zoogeográficamente a la subregión Guayano-Brasileña. Específicamente corresponde al dominio subtropical, distrito Mesopotámico, con fuerte influencia del dominio Pampásico (Ringuelet, 1961). Climáticamente, la zona de estudio posee un régimen templado/cálido con una precipitación media anual de 995 mm, distribuida en 73% entre octubre-abril y una temperatura media anual de 19 ºC; los meses más cálidos son de septiembre a marzo (24 °C temperatura promedio) y los más fríos de abril a agosto (10 °C) (Rojas y Saluso, 1987). El patrón hidrológico responde a un régimen pulsátil anual de inundación (Junk et al., 1989). El período de aguas bajas se produce en agosto-septiembre y el pulso de inundación frecuentemente ocurre hacia fines del verano (Rojas y Saluso, 1987).
Los muestreos se efectuaron desde mediados de septiembre de 2018 hasta mediados de marzo de 2019, es decir, durante la temporada primavera-verano, la cual es coincidente con la actividad reproductiva de los anuros en esta región (Peltzer y Lajmanovich, 2007; Sanchez et al., 2009).
En cada una de las islas seleccionadas se utilizaron 2 métodos para registrar anfibios: trampas de caída y muestreo de larvas (Greenberg et al., 1994; Parris, 1999; U.S. EPA, 2002). Adicionalmente, en la isla Campo El Rico, donde se localiza la seccional del guardaparques, se pudieron efectuar inspecciones nocturnas, las cuales son una combinación de inspección por encuentros visuales (Crump y Scott, 1994) y transectos auditivos (Zimmerman, 1994), siguiendo la técnica de Peltzer et al. (2003).
En cada isla se ubicaron 3 conjuntos de trampas de caída consistentes en 4 baldes de 20 l de capacidad (1 central y 3 periféricos) unidos por 3 cercas, según el método propuesto por Corn (1994). Se dispusieron de manera sistemática, cada 100 m aproximadamente, de acuerdo con Sanchez et al. (2007). Cada recipiente plástico de 20 l contuvo 2 cm³ de agua y una esponja de gomaespuma de 5 × 10 cm en el fondo a fin de proveer humedad a los animales capturados en el caso de que el agua se secase (Greenberg et al., 1994; Sanchez, 2011). Los muestreos se realizaron cada 20 días durante los 6 meses de primavera y verano. En cada uno de ellos las trampas fueron abiertas y se dejaron actuar por 4 días, al término de los cuales fueron revisadas para constatar la presencia de anfibios. Posteriormente, se cerraron hasta el siguiente muestreo. Las capturas de anuros fueron estandarizadas de acuerdo al esfuerzo de muestreo (i.e., anuros/trampa) siguiendo el criterio de Fitzgerald et al. (1999) y Martori et al. (2005).
Cada 20 días se realizaron inspecciones diurnas por las islas seleccionadas recorriendo lagunas y madrejones con el fin de buscar larvas. Para el registro de las mismas, se utilizó el método de muestreo con red (U.S. EPA, 2002). El tamaño de la red fue de 30 × 32 cm, con poros de 1 mm2 en su malla. Se empleó un transecto de 100 m de largo, con estaciones de copeo cada 10 m a lo largo de la orilla de los cuerpos de agua inspeccionados. En cada estación se efectuaron 5 barridas girando en el lugar. El punto de inicio y la dirección de desplazamiento constituyeron los factores al azar (Heyer et al., 1994). Aquellas larvas que no pudieron ser identificadas en el campo fueron sacrificadas y fijadas, acorde a las directrices de ASIH et al. (2004) para su posterior determinación taxonómica, la cual se realizó bajo lupa binocular, siguiendo las descripciones proporcionadas por diversos autores para las especies de la región (Kehr y Williams, 1990; Kolenc et al., 2008; Schulze et al., 2015; Lavilla, 1990; Vera-Candioti, 2007).
Los machos de la mayoría de las especies de anuros vocalizan en cuerpos de agua para atraer a las hembras y/o establecer territorios y cada especie posee una vocalización distintiva (Straneck et al., 1993). Con el objetivo de registrar especies a través del canto en la isla Campo El Rico, cada 20 días se realizaron búsquedas recorriendo cuerpos de agua isleños (lagunas, madrejones, charcas) entre el crepúsculo vespertino (19:00 h) y la media noche (00:00 h), demorando al menos 1 hora en cada sitio. Las vocalizaciones escuchadas por especie fueron clasificadas mediante un índice de abundancia siguiendo el criterio de la U.S. EPA (2002), que determina las siguientes categorías: 0 = ningún individuo cantando; 1 = individuos cantando que no se superponen; 2 = los cantos se superponen, pero los individuos son aun distinguibles; 3 = numerosos individuos pueden ser oídos, hay superposición y el coro es constante. Durante estas mismas inspecciones nocturnas se aplicó un método de clasificación cualitativo para los encuentros visuales por especie y se establecieron las siguientes categorías: 1 = 1 a 3 individuos pudieron ser visualizados; 2 = 4 a 10 individuos visualizados; 3 = más de 10 individuos visualizados, siguiendo a Sanchez et al. (2013).
Varios autores recomiendan utilizar distintas técnicas de muestreo, ya que la combinación de éstas aumenta la probabilidad de obtener una representación precisa de los anfibios presentes (Lajmanovich y Peltzer, 2001; Parris, 1999; Peltzer et al., 2003; U.S. EPA, 2002). Es de destacar que por tratarse del primer relevamiento sistemático de la diversidad de anfibios presente en el PNISF, se incorporaron ejemplares testigo a la Colección Herpetológica del Centro de Investigación Científica y Transferencia Tecnológica a la Producción, Diamante, Entre Ríos (CICYTTP-CONICET; acrónimo DIAM). Al respecto, se contó con el permiso de colecta científica APN-CRCE 48, con fecha 26/07/18, otorgado por la Administración de Parques Nacionales de la República Argentina.
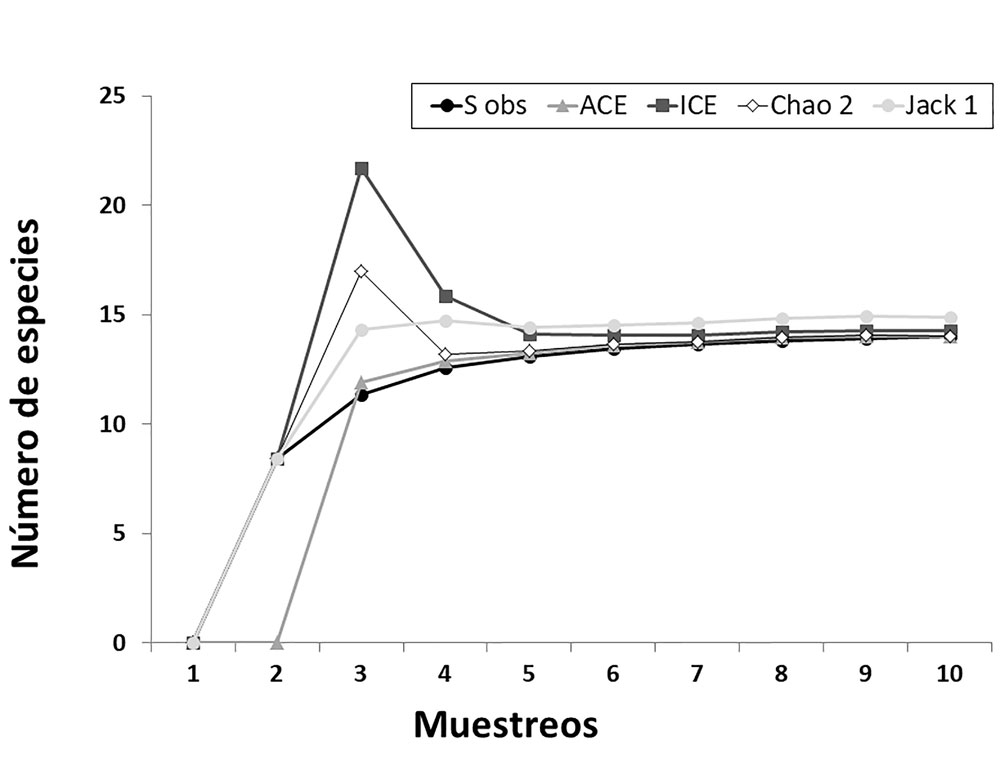
Dada la imposibilidad de efectuar inspecciones nocturnas en todas las islas seleccionadas, lo cual generó un esfuerzo de muestreo mayor en una de ellas por sobre las otras, los análisis realizados abordaron la información de los 3 sitios en su conjunto, sin implementar comparaciones entre ellos. Se identificó taxonómicamente a cada individuo registrado siguiendo la nomenclatura propuesta por Frost (2019), y se evaluó la riqueza específica (S), la cual se define como el número total de especies presentes (Moreno, 2001). Asimismo, con el fin de analizar qué tan completo ha sido realizado el muestreo y calcular el número de especies potenciales capturables con la metodología utilizada, se estimaron curvas de acumulación de especies empleando el programa EstimateS 9.1 (Colwell, 2013). El mismo analiza los datos provenientes de un sistema de muestreo estandarizado, aleatoriza toda la información (se realizaron 1,000 iteraciones) y realiza cálculos del número de especies observado y esperado, para lo cual utiliza estimadores y considera las desviaciones estándar provenientes del proceso de aleatorización (Villarreal et al., 2006). Se utilizaron 4 estimadores: ACE (Abundance-based Coverage Estimator), ICE (Incidence based Coverage Estimator), jackknife 1 y Chao 2, todos no paramétricos. ACE se basa principalmente en el número de especies de un muestreo que sólo están representadas por 1 o 2 individuos, ICE y jackknife 1 se basan en el número de especies que se registraron en una muestra, mientras que Chao 2 en el número de especies que se registraron en 2 muestras (Gotelli y Colwell, 2011). Si bien no hay un consenso en cuanto a cuáles son los más adecuados, diversos autores proponen que Chao 2 y jackknife 1 están entre los estimadores menos sesgados para muestras pequeñas (Colwell y Coddington, 1994; King y Porter, 2005; Walther y Morand, 1998).
Con el fin de evaluar la abundancia de las especies de anuros, se consideraron 3 categorías de edad: adultos, individuos juveniles y larvas registradas con los 3 tipos de metodologías empleadas (trampas de caída, inspecciones nocturnas y búsqueda de larvas). En particular, la abundancia de anuros registrada durante las inspecciones nocturnas fue estimada mediante la suma de los valores de las categorías auditivas y visuales determinados para cada especie. Se supone que estas sumas de valores están correlacionadas con la abundancia de las poblaciones de anfibios (Pope et al., 2000; Sanchez, 2011).
Los modelos de distribución de abundancia de especies se han utilizado para evaluar el grado de disturbio del hábitat y la etapa sucesional en la que se encuentra (Aguirre-Calderón et al., 2008). Para conocer el modelo al cual se ajustan los datos registrados, se realizaron pruebas de bondad de ajuste con una prueba de Chi cuadrada (χ²). Los modelos de distribución probados fueron: a) la serie geométrica, b) la serie logarítmica, c) la serie logarítmica normal y d) la vara quebrada, para lo cual se usó el programa PAST (Hammer et al., 2001). Se utilizó un alfa = 0.05 como nivel de confianza.
A partir del índice de Shannon y Weaver (1949), se obtuvo el exponencial de la entropía de Shannon como D = e HShannon (Jost, 2006; Jost y González-Oreja, 2012). El índice de Shannon es una medida de la entropía que está presente en un sistema, o de la incertidumbre asociada con el resultado de un proceso; por ello, el índice de Shannon es una medida razonable de la complejidad biológica, pero no es la diversidad per se (Jost y González-Oreja, 2012). El valor D, en cambio, es el número equivalente de especies igualmente comunes de una comunidad, llamado número efectivo de especies por MacArthur (1965) y es una medida correcta de su diversidad, por lo que también ha sido llamado diversidad real (Jost, 2006, 2018; Jost y González-Oreja, 2012; Moreno et al., 2011). Asimismo, se evaluó la equidad por medio del índice de Shannon (J) (Magurran, 1988). Se utilizó el método de rarefacción propuesto por Sanders (1968) y corregido por Hurlbert (1971) y Simberloff (1972). De esta manera, se obtuvieron curvas de rarefacción para el número efectivo de especies (D) y la equitatividad (J) con el programa EcoSim versión 7.0 (Gotelli y Entsminger, 2010). El mismo modelo calcula el promedio y la varianza de estos parámetros a través de un muestreo al azar por el método Monte Carlo, mediante el cual se generaron 10,000 aleatorizaciones. De esta manera, se pueden estimar probabilísticamente D y J (Gotelli y Colwell, 2001). Los resultados fueron obtenidos para 13 clases de abundancia.
Resultados
Durante el desarrollo del presente trabajo se registraron 14 especies de anuros. Las mismas estuvieron representadas por 9 géneros pertenecientes a 4 familias. Boana raniceps, D. sanborni, Ololygon berthae, Scinax acuminatus, Trachycephalus typhonius y Leptodactylus podicipinus, solo fueron halladas durante las inspecciones nocturnas. Por otro lado, en las trampas de caída se capturaron principalmente especies de hábitos terrestres (tabla 1).
Las especies de las cuales no había citas previas para el PNISF fueron 9: Boana punctata, B. raniceps, D. sanborni, Lysapsus limellum, O. berthae, S. acuminatus, T. typhonius, L. podicipinus y E. bicolor.
La familia Hylidae fue la mejor representada al exhibir 10 especies (71.43%). Leptodactylidae estuvo compuesta por 2 especies, lo cual constituyó 14.29% de las registradas. Por su parte, Bufonidae y Microhylidae presentaron la menor representatividad al estar conformadas cada una de ellas por una única especie (7.14%) (tabla 1).
La curva de acumulación de especies a lo largo del tiempo de muestreo, así como las curvas confeccionadas con los 4 estimadores empleados, presentaron un comportamiento asintótico y convergente (fig. 2). Los estimadores empleados para evaluar la eficiencia de muestreo indican que la riqueza de especies observada estuvo muy cerca de la esperada, reflejando un porcentaje de eficiencia que sobrepasó 94% en todos los casos (tabla 2).
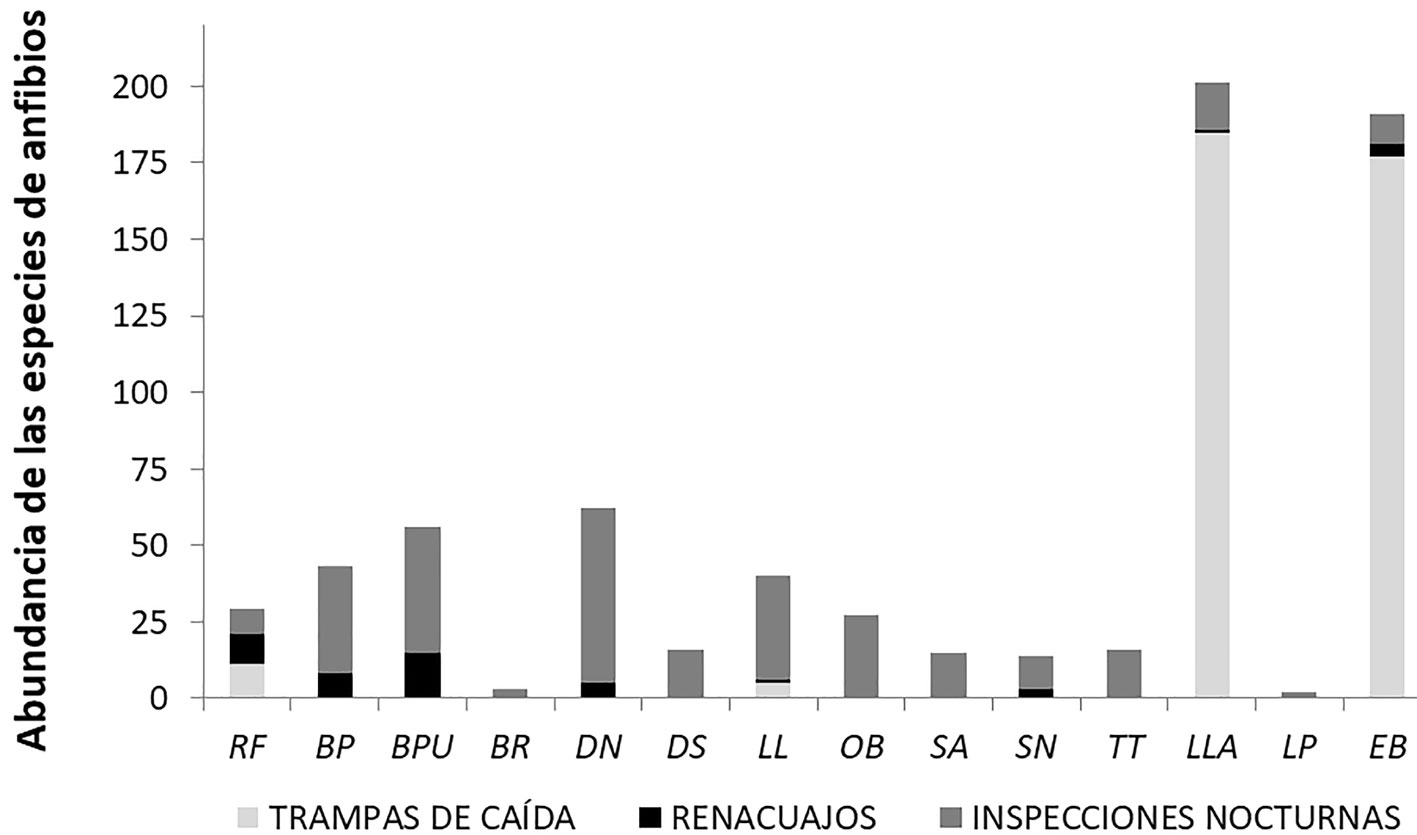
Durante el periodo inspeccionado se registró una abundancia estimada de 715 anfibios anuros entre adultos de ambos sexos, individuos juveniles y larvas (fig. 3). Las especies más numerosas fueron: L. latrans (201), E. bicolor (191), D. nanus (62), B. punctata (56), B. pulchella (43) y L. limellum (40). Aquellas especies con menor abundancia resultaron ser L. podicipinus (2) y B. raniceps (3). Por su parte, R. fernandezae, D. sanborni, O. berthae, S. acuminatus, S. nasicus y T. typhonius, mostraron valores intermedios de abundancia. Los datos recolectados se ajustaron al modelo de distribución de abundancia de las especies logarítmico normal (χ² = 1.097, p = 0.2948).
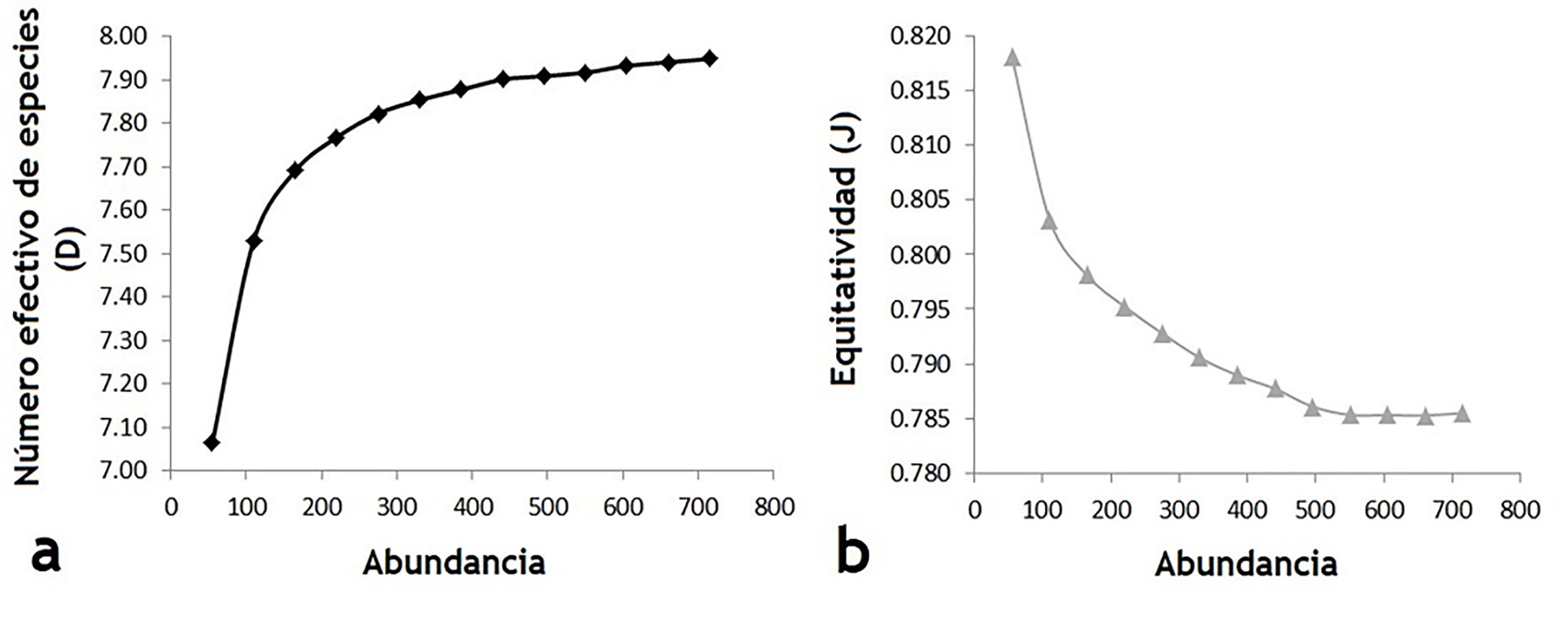
Como se mencionó, la riqueza observada durante el período evaluado fue de 14 especies. Al considerar las abundancias relativas de dichas especies se obtuvo para el área de estudio en su totalidad una diversidad real o número efectivo de especies D = 7.94 y una equitatividad J = 0.79. Asimismo, los resultados de D y J fueron calculados para los siguientes intervalos de abundancia: 55, 110, 165, 220, 275, 330, 385, 440, 495, 550, 605, 660 y 715. Las curvas de rarefacción resultantes presentaron un comportamiento asintótico, estabilizándose ambas curvas en los valores de D y J previamente citados (fig. 4).
Tabla 1
Anfibios anuros registrados en el Parque Nacional Islas de Santa Fe con las 3 metodologías empleadas. Numeración de los ejemplares testigo recolectados y depositados en la colección del CICYTTP-CONICET: Adultos DIAM, Larvas DIAM-L.
|
Trampas de caída |
Renacuajos |
Inspecciones nocturnas |
Material CICYTTP |
||
|
Registro visual |
Registro auditivo |
||||
|
Bufonidae |
|||||
|
Rhinella fernandezae |
X |
X |
X |
X |
DIAM 504 / DIAM-L-31 |
|
Hylidae |
|||||
|
Boana pulchella |
X |
X |
X |
DIAM 508 / DIAM-L-25 y 27 |
|
|
B. punctata |
X |
X |
X |
DIAM 513 / DIAM-L-26, 28, 29 y 30 |
|
|
B. raniceps |
X |
||||
|
Dendropsophus nanus |
X |
X |
X |
DIAM 510 / DIAM-L-35 y 36 |
|
|
D. sanborni |
X |
X |
DIAM 501 |
||
|
Lysapsus limellum |
X |
X |
X |
X |
DIAM-L-039 |
|
Ololygon berthae |
X |
X |
DIAM 500 y 509 |
||
|
Scinax acuminatus |
X |
X |
DIAM 505 y 506 |
||
|
S. nasicus |
X |
X |
X |
DIAM 507 / DIAM-L-37 |
|
|
Trachycephalus typhonius |
X |
X |
DIAM 502 |
||
|
Leptodactylidae |
|||||
|
Leptodactylus latrans |
X |
X |
X |
X |
DIAM 503 / DIAM-L-33 |
|
L. podicipinus |
X |
X |
DIAM 522 |
||
|
Microhylidae |
|||||
|
Elachistocleis bicolor |
X |
X |
X |
X |
DIAM 511, 512, 523 y 524 / DIAM-L-32 |
|
Riqueza (s) |
14 |
Tabla 2
Eficiencia de muestro. Se exhibe el número de especies observadas, el de especies esperadas, y el porcentaje de eficiencia de muestreo con cada estimador utilizado. ACE, ICE, jackknife 1 y Chao 2, estimadores no paramétricos.
|
Especies observadas |
Especies esperadas |
Porcentaje de eficiencia (%) |
||||||
|
ACE |
ICE |
jackknife 1 |
Chao 2 |
ACE |
ICE |
jackknife 1 |
Chao 2 |
|
|
14 |
14.00 |
14.28 |
14.89 |
14.00 |
100.00 |
98.04 |
94.02 |
100.00 |
Discusión
Hasta la fecha, se encuentran citadas para el delta superior del río Paraná 30 especies de anfibios, de las cuales, en el PNISF se registraron mediante el presente trabajo a 14 de ellas (46.7%) (Aceñolaza, Manzano et al., 2008; Sanchez et al., 2007, 2009). Si comparamos la riqueza de especies del PNISF con la hallada en el PNPD (N = 23), el Parque Nacional santafecino alberga 60.9% de las especies presentes en el Pre-Delta (Sanchez y Manzano, 2005; Sanchez et al., 2007, 2009, 2013). Las curvas de acumulación de especies y el cálculo de la eficiencia de muestreo indican que probablemente falta hallar algunas especies en el área de estudio.
Específicamente, en el PNISF, las curvas de acumulación mostraron un comportamiento asintótico, en donde la riqueza de especies observada estuvo muy cerca de la esperada con los estimadores empleados. En todos los casos, el porcentaje de eficiencia sobrepasó 94%. En este sentido, Villarreal et al. (2006) afirman que al obtener valores mayores a 85% de las especies esperadas, el muestreo realizado se considera eficaz. En este punto, conviene tener presente que el tamaño y la composición de un inventario biológico en un lugar determinado se modifica con el tiempo (Adler y Lauenroth, 2003). Esto se debe a que las especies pueden ampliar o reducir su distribución en función de cambios en el ambiente, o variar su fenología en relación a las condiciones de un año determinado, pudiendo no ser detectables todos los años (Jiménez-Valverde y Hortal, 2003). Asimismo, las especies faltantes en los muestreos pueden ser localmente raras o estar representadas por individuos errantes, en proceso de dispersión, procedentes de poblaciones estables cercanas a la zona estudiada (Moreno y Halffter, 2000). En este sentido, los pulsos de inundación característicos de este tipo de humedales pueden contribuir también con el ingreso o pérdida de especies en las islas del PNISF.
La variabilidad temporal se constituye como una compleja función dependiente de las entradas y salidas de energía y materiales, y de las oportunidades combinatorias de las poblaciones en las islas para ajustar su distribución y abundancia (Neiff, 1999). Estos factores explican por qué los inventarios biológicos difícilmente llegan a completarse (Jiménez-Valverde y Hortal, 2003). Al respecto, se cuenta con un registro previo de R. diptycha en la isla Campo El Rico, realizado por Ghirardi et al. (2014). Podríamos sumar también a Leptodactylus chaquensis, especie de la cual un ejemplar juvenil (DIAM 051) se encuentra depositado en la colección herpetológica del CICYTTP-CONICET, proveniente de la misma isla; un tercer registro para Campo El Rico procede igualmente de esta colección de referencia. Se trata de 2 individuos ingresados como Physalaemus biligonigerius (DIAM 050); no obstante, su pequeño tamaño y la presencia de glándulas lumbares del mismo color que el patrón de coloración dorsal, hacen suponer que se trata de ejemplares de Physalaemus santafecinus. Estas 3 especies constituyen un claro ejemplo de lo recién expuesto. Durante los meses que duró el muestreo realizado, ninguna de ellas fue vista ni oída y tampoco fue capturada por las trampas de caída, a pesar de ser especies de hábitos terrestres susceptibles de caer en ellas. Es importante destacar el hallazgo en este trabajo de L. podicipinus dentro del territorio del PNISF, la cual no se encuentra en la lista de las 23 especies registradas en el PNPD (Sanchez y Manzano, 2005; Sanchez et al., 2007, 2009, 2013). Dado que estos 2 parques constituyen las únicas áreas nacionales protegidas incluidas dentro del sitio Ramsar Delta del Paraná, la observación de L. podicipinus toma relevancia (Kandus et al., 2011). Si bien esta especie no se encuentra en ninguna categoría de amenaza, su presencia incrementa a 24 la riqueza global de anfibios del citado sitio Ramsar que se halla protegida de forma efectiva por el sistema de parques nacionales (Vaira et al., 2012; Sanchez et al., 2013).
Al analizar la composición de las familias, una explicación para que los hílidos constituyan la familia con mayor riqueza se basa en los requerimientos de hábitat arborícolas de la mayoría de ellos (Gallardo, 1980; Sanchez et al., 2013). En este sentido, el PNISF presenta vegetación típica de bosque fluvial en galería, con elementos estructurales complejos, albergando bosques de albardones marginales, así como vegetación arbustiva/herbácea. Por otra parte, Bufonidae y Microhylidae estuvieron representadas, cada una, por una sola especie, resultado que podría estar influenciado por la baja representatividad de los diferentes taxones pertenecientes a estas familias en el área biogeográfica donde se realizó el estudio (Sanchez, 2011). La estimación de abundancias arrojó resultados consistentes. De las especies dominantes (L. latrans, E. bicolor, D. nanus, B. punctata, B. pulchella y L. limellum) la mayoría son hílidos. Todas ellas se encuentran también entre las especies más numerosas registradas en el PNPD, un humedal templado de características similares (Sanchez et al., 2007, 2013).
Un hecho llamativo resulta ser la particular escasez de leptodatílidos de hábitos cavadores. Sólo se registró a L. podicipinus y en muy baja abundancia, mientras que a 26 Km de distancia, río arriba, en el PNPD, se encuentran Leptodactylus gracilis, Leptodactylus latinasus y Leptodactylus mystacinus, con frecuencias elevadas de registro y abundancia (Sanchez, 2011; Sanchez y Manzano, 2005; Sanchez et al., 2007, 2009, 2013). El comportamiento reproductivo particular de estas especies de leptodactílidos puede estar dificultando el reclutamiento de nuevos individuos en las islas del PNISF debido a la presencia de cerdos cimarrones (Sus scrofa). En particular, en L. gracilis, L. latinasus y L. mystacinus, el macho construye cuevas en la tierra húmeda cerca de cuerpos de agua. En ellas se produce el amplexo y la hembra deposita los huevos contenidos por nidos de espuma (Fernández y Fernández, 1921; Lavilla y Rougés, 1992). Cuando la lluvia inunda las cuevas, los pequeños renacuajos son liberados a la charca vecina (Gallardo, 1958).
Leptodactylus podicipinus no construye cuevas, pero los huevos son depositados en nidos de espuma en el interior de pequeñas cuencas ubicadas al borde de lagunas en zonas anegadizas. El desarrollo embrionario, eclosión y primeros estadios larvales pueden llevarse a cabo en las cavidades donde se produjo la puesta o en el agua, dependiendo del momento en que las lluvias inunden el nido y arrastren su contenido hacia cuerpos de agua mayores (Lavilla y Rougés, 1992; Prado et al., 2002). Durante el presente trabajo, pudimos constatar la presencia de grupos de cerdos cimarrones en el PNISF; son animales omnívoros, considerados una amenaza para los ecosistemas de humedales, donde destruyen la vegetación y los suelos debido a su hábito de hozar la tierra en busca de alimento (Navas, 1987; Ramírez-Chávez et al., 2011). Al respecto, en la zona de estudio hemos podido observar a los cerdos hocicar dando vuelta la tierra en las orillas de los madrejones. La periferia de los cuerpos de agua es la zona donde los leptodactílidos cavadores construyen sus cuevas y depositan sus huevos, y este hábito de los cerdos podría conducir a la eliminación de puestas enteras de huevos antes de que los mismos, o los renacuajos que de ellos eclosionan, lleguen a alcanzar el agua. Otras especies cavadoras, como el bufónido R. fernandezae, no se verían tan afectadas por la actividad de los cerdos, ya que sus huevos son depositados en cordones gelatinosos sobre el fondo del cuerpo de agua, y el desarrollo embrionario y la eclosión se llevan a cabo en el agua (Lavilla y Rougés, 1992). Al terminar la metamorfosis, cada individuo construye una pequeña cueva junto a la charca en la cual vivió como larva, para luego ir alejándose gradualmente de ella, construyendo nuevas cuevas y a mayores distancias del agua, a medida que aumenta su crecimiento (Gallardo, 1969; Sanchez y Busch, 2008). De esta manera, el efecto del cerdo al hallar una cueva de R. fernandezae es sobre un único animal, ya que las cuevas son individuales. Por el contrario, el impacto de encontrar una cueva de alguno de los leptodactílidos mencionados es la pérdida de un nido de espuma completo con aproximadamente 150 huevos en L. gracilis, 370 en L. latinasus y entre 160 y 630 huevos en L. mystacinus (Fernández y Fernández, 1921; Gallardo, 1958; Oliveira-Filho y Giaretta, 2008).
En cuanto a la distribución de abundancias de las especies, la serie normal logarítmica fue el modelo que mejor describió la situación registrada en el PNISF. Esto sugiere que los ambientes localizados dentro del Parque Nacional poseen comunidades que se encuentran en un equilibrio dinámico (Moreno, 2001), en donde la variación al azar de un gran número de procesos que regulan la ecología de la comunidad, da como resultado la distribución normal del número de individuos por especie (Magurran, 1988; Moreno, 2001). Las comunidades de anfibios reflejarían una situación próxima al clímax, en donde la exclusión competitiva permite una mayor dominancia de ciertas especies (Connell, 1978).
Finalmente, en relación a los parámetros de diversidad real de especies, el PNISF presentó un número efectivo de especies inferior al registrado en el P. N. Pre-Delta, estimado en 10.49 (H = 2.35) para la zona isleña y 10.91 (H = 2.39) para la región continental (Sanchez, 2011; Sanchez et al., 2013). Dado que el valor de D se calcula a partir de H, el cual depende de la riqueza y de la equitatividad (Begon et al., 2006), y siendo esta última muy similar en ambas áreas protegidas (0.79 en PNISF, y dentro del PNPD 0.79 en islas y 0.78 en continente), la diferencia observada en D es explicada por el número de especies registrado en cada parque nacional (14 en PNISF y 23 en PNPD), el cual muestra una divergencia de 9 especies (Sanchez et al., 2013). Las posibles causas que podrían explicar el reducido valor de riqueza observado en el PNISF fueron previamente discutidas.
Se espera que estos aportes al conocimiento de la composición taxonómica, abundancia de cada especie y diversidad de anfibios presentes en el PNISF sean útiles para la Administración de Parques Nacionales (APN), constituyéndose en una herramienta básica a la hora de poner en marcha planes de acción para la conservación de este grupo taxonómico en el área protegida. No obstante, se sugiere ampliar las investigaciones en la zona de estudio, tanto temporal, como espacialmente, resaltando la necesidad de que la APN articule los medios para habilitar un esfuerzo de muestreo equitativo entre las distintas islas, a fin de poder analizar comparativamente los diferentes sectores del PNISF.
Agradecimientos
Este trabajo no hubiese sido posible sin la colaboración de la APN y del personal del PNISF, en especial del guardaparques M. Almeida, quien nos recibió amablemente en la seccional y colaboró con la logística de los muestreos. Contamos con el permiso de investigación y recolección APN-CRCE 48 con fecha 26/07/18. Agradecemos también a la mastozoóloga M. Maroli por su ayuda en la desinfección de trampas de caída con captura accidental de roedores. V. Cabral, M. Cogno, P. Garabaya, J. Grimaldi, L. Quintana y A. Yossen, participaron desinteresadamente ayudando en los trabajos de campo. De igual manera, agradecemos a M. F. Vera Candioti por su valiosa asistencia en la identificación de larvas de anuros. Los dos revisores anónimos y el editor de la revista ayudaron a mejorar considerablemente el manuscrito con sus sugerencias y correcciones. Mariana Agterberg y Stephanie De Simone colaboraron en la redacción del resumen en inglés. Por último, agradecemos a la Universidad Autónoma de Entre Ríos por el financiamiento del proyecto PIDIN-UADER “Caracterización de las comunidades de anfibios anuros del Parque Nacional Islas de Santa Fe (Argentina): creando una base de datos para la conservación de la anfibiofauna”.
Referencias
Aceñolaza, F. G., Manzano, A., Rodríguez, E., Sanchez, L. C., Ronchi, A. L., Gimenez, E. et al. (2008). Biodiversidad de la región superior del complejo deltaico del río Paraná. En F. G. Aceñolaza (Ed.), Temas de la biodiversidad del litoral fluvial argentino III (pp. 127–152). Tucumán: INSUGEO.
Aceñolaza, F. G., Zamboni, L. P., Sione, W. y Kalesnik, F. (2008). Caracterización de la región superior del complejo litoral del río Paraná: grandes unidades de ambiente. En F. G. Aceñolaza (Ed.), Temas de la biodiversidad del litoral fluvial argentino III (pp. 293–308). Tucumán: INSUGEO.
Adler, P. B. y Lauenroth, W. K. (2003). The power of time: spatiotemporal scaling of species diversity. Ecology Letters, 6, 749–756. https://doi.org/10.1046/j.1461-0248.2003.00497.x
Aguirre-Calderón, O. A., Corral-Rivas, J., Vargas-Larreta, B. y Jiménez-Pérez, J. (2008). Evaluación de modelos de diversidad-abundancia del estrato arbóreo en un bosque de niebla. Revista Fitotecnia Mexicana, 31, 281–289.
ASIH, HL y SSAR (American Society of Ichthyologists and Herpetologists, The Herpetologists’ League, y Society for the Study of Amphibians and Reptiles). (2004). Guidelines for use of live amphibians and reptiles in field and laboratory research. Recuperado el 01 de septiembre 2018, de: https://asih.org/sites/default/files/documents/resources/guidelinesherpsresearch2004.pdf
Begon, M., Townsend, C. R. y Harper, J. L. (2006). Ecology: from individuals to ecosystems. Oxford: Blackwell Publishing.
Bó, R. F. (2006). Situación ambiental en la Ecorregión Delta e Islas del Paraná. En A. Brown, U. Martínez Ortiz, M. Acerbi y J. Corchera (Eds.), La situación ambiental Argentina 2005 (pp. 131–143). Buenos Aires: Fundación Vida Silvestre Argentina.
Bó, R. F. y Malvárez, A. I. (1999). Las inundaciones y la biodiversidad en humedales. Un análisis del efecto de eventos extremos sobre la fauna silvestre. En A. I. Malvárez (Ed.), Tópicos sobre humedales subtropicales y templados de Sudamérica (pp. 147–168). Montevideo: Oficina Regional de Ciencia y Tecnología de la UNESCO para América Latina y el Caribe.
Burkart, R., Bárbaro, N., Sánchez, R. O. y Gómez, D. A. (1999). Eco-regiones de la Argentina. Buenos Aires: APN-Prodia.
Colwell, R. K. (2013). EstimateS: statistical estimation of species richness and shared species from samples. Version 9.1: http://purl.oclc.org/estimates.
Colwell, R. K. y Coddington, J. A. (1994). Estimating terrestrial biodiversity through extrapolation. Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences, 345, 101–118. https://doi.org/10.1098/rstb.1994.0091
Connell, J. H. (1978). Diversity in tropical rain forests and coral reefs. Science, 199, 1302–1310. https://doi.org/10.1126/science.199.4335.1302
Corn, P. S. (1994). Straight-line drift fences and pitfall traps. En W. R. Heyer, M. A. Donnelly, R. W. McDiarmid, L. C. Hayek y M. S. Foster (Eds.), Measuring and monitoring biological diversity: standard methods for amphibians (pp. 109–117). Washington D.C.: Smithsonian Institution Press.
Crump, M. L. y Scott, N. J. (1994). Visual encounter surveys. En W. R. Heyer, M. A. Donnelly, R. W. McDiarmid, L. C. Hayek y M. S. Foster (Eds.), Measuring and monitoring biological diversity: standard methods for amphibians (pp. 84–92). Washington D.C: Smithsonian Institution Press.
Fandiño, B. (2011). Patrones de diversidad de aves en Santa Fe y efectividad de las áreas protegidas en su conservación (Tesis doctoral). Facultad de Bioquímica y Ciencias Biológicas, Universidad Nacional del Litoral. Santa Fe, Argentina.
Fernández, K. y Fernández, M. (1921). Sobre la biología y reproducción de algunos batracios argentinos I. Cystignathidae. Anales de la Sociedad Científica Argentina, 91, 97–139.
Fitzgerald, L. A., Cruz, F. B. y Perotti, G. (1999). Phenology of a lizard assemblage in the Dry Chaco of Argentina. Journal of Herpetology, 33, 526–535. https://doi.org/10.2307/1565568
Franceschi, E. A., Prado, D. E. y Lewis J. P. (1985). Comunidades vegetales y mapa de vegetación de la reserva El Rico e islas aledañas (Provincia de Santa Fe, República Argentina). Rosario: Servicio de Publicaciones de la Universidad Nacional de Rosario.
Frost, D. R. (2019). Amphibian species of the world 6.0, an online reference. American Museum of Natural History, New York. Recuperado el 30 de agosto 2019, de: http://research.amnh.org/herpetology/amphibia/index.html
Gallardo, J. M. (1958). Observaciones biológicas sobre Leptodactylus prognathus Boulenger. Ciencia e Investigación, 14, 460–465.
Gallardo, J. M. (1969). La distribución de las subespecies de Bufo granulosus Spix: su fidelidad a los sistemas hidrográficos sudamericanos. Ciencia e Investigación, 25, 406–416.
Gallardo, J. M. (1980). Estudio ecológico sobre los anfibios y reptiles del noreste de la provincia de Buenos Aires (Argentina). I Reunión Iberoamericana de Zoología de Vertebrados La Rábida, 1977, 331–349.
Ghirardi, R., Levy, M. G., López, J. A., Steciow, M. M. y Perotti, M. G. (2014). Batrachochytrium dendrobatidis infecting anurans in a protected area from Santa Fe Province, Argentina. Cuadernos de Herpetología, 28, 29–31.
Giacosa, B. R., Andelman, M., Balderrama, D. M. y Matarasso, M. (2019). Plan de manejo del sitio Ramsar Delta del Paraná. Buenos Aires: Fundación para la Conservación y el Uso Sustentable de los Humedales.
Gotelli, N. J. y Colwell, K. (2001). Quantifying biodiversity: procedures and pitfalls in the measurement and comparison of species richness. Ecology Letters, 4, 379–391. https://doi.org/10.1046/j.1461-0248.2001.00230.x
Gotelli, N. J. y Colwell, R. K. (2011). Estimating species richness. En A. R. Magurran y B. J. McGill (Eds.), Biological diversity: frontiers in measurement and assessment (pp. 39–54). Oxford: Oxford University Press.
Gotelli, N. J. y Entsminger, G. L. (2010). EcoSim: null models software for Ecology. Version 7.0: http://www.garyentsminger.com/ecosim/index.html
Greenberg, C. H., Neary, D. G. y Harris, L. D. (1994). A comparison of herpetofaunal sampling effectiveness of pitfall, single-ended, and double-ended funnel traps used with drift fences. Journal of Herpetology, 28, 319–324. https://doi.org/10.2307/1564530
Hammer, Ø., Harper, D. A. T. y Ryan, P. D. (2001). PAST: Paleontological statistics software package for education and data analysis. Palaeontologia electronica, 4, 9.
Heyer, W. R., Donnelly, M. A., McDiarmid, R. W., Hayek, L. C. y Foster, M. S. (1994). Measuring and monitoring biological diversity: standard methods for amphibians. Washington DC: Smithsonian Institution Press.
Hurlbert, S. H. (1971). The non-concept of species diversity: a critique and alternative parameters. Ecology, 52, 577–586. https://doi.org/10.2307/1934145
Jiménez-Valverde, A. y Hortal, J. (2003). Las curvas de acumulación de especies y la necesidad de evaluar la calidad de los inventarios biológicos. Revista Ibérica de Aracnología, 8, 151–161.
Jost, L. (2006). Entropy and diversity. Oikos, 113, 363–375.
Jost, L. (2018). ¿Qué entendemos por diversidad? El camino hacia la cuantificación. Mètode Science Studies Journal, 98, 39–45.
Jost, L. y González-Oreja, J. A. (2012). Midiendo la diversidad biológica: más allá del índice de Shannon. Acta Zoológica Lilloana, 56, 3–14.
Junk, W. J., Bayley, P. B. y Sparks, R. E. (1989). The flood pulse concept in river floodplain systems. Canadian Special Publication in Fisheries and Aquatic Sciences, 106, 110–127.
Kandus, P., Minotti, P. y Borro, M. (2011). Contribuciones al conocimiento de los humedales del Delta del Río Paraná: herramientas para la evaluación de la sustentabilidad ambiental. San Martín: Ediciones Universidad Nacional de Gral. San Martín.
Kehr, A. I. y Williams, J. D. (1990). Larvas de anuros de la República Argentina. Cuadernos de Herpetología, Serie Monografías, 2, 1–44.
King, J. R. y Porter, S. D. (2005). Evaluation of sampling methods y species richness estimators for ants in upland ecosystems in Florida. Environmental Entomology, 34, 1566–1578. https://doi.org/10.1603/0046-225x-34.6.1566
Kolenc, F., Borteiro, C., Alcalde, L., Baldo, D., Cardozo, D. y Faivovich, J. (2008). Comparative larval morphology of eight species of Hypsiboas Wagler (Amphibia, Anura, Hylidae) from Argentina and Uruguay, with a review of the larvae of this genus. Zootaxa, 1927, 1–66. https://doi.org/10.11646/zootaxa.1927.1.1
Lajmanovich, R. C. y Peltzer, P. M. (2001). Evaluación de la diversidad de anfibios de un remanente forestal del valle aluvial del río Paraná (Entre Ríos – Argentina). Boletín de la Asociación Herpetológica Española, 12, 12–17.
Lavilla, E. O. (1990). The tadpole of Hyla nana (Anura: Hylidae). Journal of Herpetology, 24, 207–209. https://doi.org/10.2307/1564233
Lavilla, E. O. y Rougés, M. (1992). Reproducción y desarrollo de anuros argentinos. Serie de Divulgación de la Asociación Herpetológica Argentina, 5, 1–66.
MacArthur, R. H. (1965). Patterns of species diversity. Biological Review, 40, 510–533.
Magurran, A. E. (1988). Ecological diversity and its measurements. Princeton: Princeton University Press.
Malvárez, A. I. (1999). El delta del río Paraná como mosaico de humedales. En A. I. Malvárez (Ed.), Tópicos sobre humedales subtropicales y templados de Sudamérica (pp. 35–53). Montevideo: Oficina Regional de Ciencia y Tecnología de la UNESCO para América Latina y el Caribe.
Martori, M., Aún, L., Birri, A. y Rozzi Giménez, C. (2005). Reproducción comparada de tres especies de anuros sintópicos de una localidad del sudeste de Córdoba. Cuadernos de Herpetología, 18, 43–59.
Moreno, C. E. (2001). Métodos para medir la biodiversidad. Zaragoza: M&T-Manuales y Tesis SEA.
Moreno, C. E. y Halffter, G. (2000). Assessing the completeness of bat biodiversity inventories using species accumulation curves. Journal of Applied Ecology, 37, 149–158. https://doi.org/10.1046/j.1365-2664.2000.00483.x
Moreno, C. E., Barragán, F., Pineda, E. y Pavón, N. P. (2011). Reanálisis de la diversidad alfa: alternativas para interpretar y comparar información sobre comunidades ecológicas. Revista Mexicana de Biodiversidad, 82, 1249–1261. https://doi.org/10.22201/ib.20078706e.2011.4.745
Navas, J. R. (1987). Los vertebrados exóticos introducidos en la Argentina. Revista del Museo Argentino de Ciencias Naturales “Bernardino Rivadavia”, 14, 7–38.
Neiff, J. J. (1999). El régimen de pulsos en ríos y grandes humedales de Sudamérica. En A. I. Malvárez (Ed.), Tópicos sobre humedales subtropicales y templados de Sudamérica (pp. 99–103). Montevideo: Oficina Regional de Ciencia y Tecnología de la UNESCO para América Latina y el Caribe.
Oliveira Filho, J. y Giaretta, A. A. (2008). Reproductive behavior of Leptodactylus mystacinus (Anura, Leptodactylidae) with notes on courtship call of other Leptodactylus species. Iheringia, Série Zoologia, 98, 508–515. https://doi.org/10.1590/s0073-47212008000400015
Parris, K. M. (1999). Review: amphibian surveys in forests and woodlands. Contemporary Herpetology, 1999, 1–16. https://doi.org/10.17161/ch.vi1.11931
Peltzer, P. M. y Lajmanovich, R. C. (2007). Amphibians. En M. H. Iriondo, J. C. Paggi y M. J. Parma (Eds.), The middle Paraná River: limnology of a subtropical wetland (pp. 327–340). New York: Springer Berlin Heidelberg. https://doi.org/10.1007/978-3-540-70624-3_13
Peltzer, P. M., Lajmanovich, R. C. y Beltzer, A. H. (2003). The effects of habitat fragmentation on amphibian species richness in the floodplain of the middle Parana River. Herpetological Journal, 13, 95–98.
Peteán, J. y Cappato, J. (2005). Humedales fluviales de América del Sur: hacia un manejo sustentable. Santa Fe: Proteger Ediciones.
Pope, S. E., Fahrig, L. y Merriam, H. G. (2000). Landscape complementation and metapopulation effects on leopard frog populations. Ecology, 81, 2498–2508. https://doi.org/10.1890/0012-9658(2000)081[2498:lcameo]2.0.co;2
Prado, C. P. A., Uetanabaro, M. y Haddad, C. F. B. (2002). Description of a new reproductive mode in Leptodactylus (Anura, Leptodactylidae), with a review of the reproductive specialization toward terrestriality in the genus. Copeia, 2002, 1128–1133. https://doi.org/10.1643/0045-8511(2002)002[1128:doanrm]2.0.co;2
Ramírez-Chaves, H. E., Ortega-Rincón, M., Pérez, W. A. y Marín, D. (2011). Historia de las especies de mamíferos exóticos en Colombia. Boletín Científico, Centro de Museos, Museo de Historia Natural, 15, 139–156.
Rinaldi, S. (2010). Parque Nacional “Islas de Santa Fe”, una realidad. Econcejo, 29, 15–17.
Ringuelet, R. A. (1961). Rasgos fundamentales de la zoogeografía de la Argentina. Physis, 22, 151–170.
Rojas, A. E. y Saluso, J. H. (1987). Informe climático de la Provincia de Entre Ríos. Publicación Técnica Nº 14. Paraná: EEA-Paraná.
Sanchez, L. C. (2011). Alteraciones de la dinámica y biología reproductiva de anuros (Amphibia, Anura) producidos por el avance de la frontera agrícola en ambientes naturales del delta superior del río Paraná (Tesis doctoral). Facultad de Bioquímica y Ciencias Biológicas, Universidad Nacional del Litoral. Santa Fe, Argentina.
Sanchez, L. C. y Busch, M. (2008). Population traits of the burrowing toad Rhinella fernandezae (Gallardo, 1957) (Anura, Bufonidae). Brazilian Journal of Biology, 68, 137–140. https://doi.org/10.1590/s1519-69842008000100019
Sanchez, L. C. y Manzano, A. S. (2005). Actualización de la lista de anfibios del Parque Nacional Pre-Delta, provincia de Entre Ríos. En F. G. Aceñolaza (Ed.), Temas de la biodiversidad del litoral fluvial argentino II (pp. 383–388). Tucumán: INSUGEO.
Sanchez, L. C., Peltzer, P. M. y Lajmanovich, R. C. (2009). Structure of wetland-breeding anuran assemblages from the southern section of the Paraná River, Argentina. Herpetological Journal, 19, 173–184.
Sanchez, L. C., Peltzer, P. M., Lajmanovich, R. C., Manzano, A. S., Junges, C. M. y Attademo, A. M. (2013). Reproductive activity of anurans in a dominant agricultural landscape from central-eastern Argentina. Revista Mexicana de Biodiversidad, 84, 912–926. https://doi.org/10.7550/rmb.32842
Sanchez, L. C., Peltzer, P. M., Manzano, A. S. y Lajmanovich, R. C. (2007). Dinámica de un ensamble de anuros en un humedal del tramo inferior del río Paraná, Argentina. Interciencia, 32, 463–470.
Sanders, H. L. (1968). Marine benthic diversity: a comparative study. The American Naturalist, 102, 243–282. https://doi.org/10.1086/282541
Schulze, A., Jansen, M. y Köhler, G. (2015). Tadpole diversity of Bolivia’s lowland anuran communities: molecular identification, morphological characterization, and ecological assignment. Zootaxa, 4016, 1–111. https://doi.org/10.11646/zootaxa.4016.1.1
Secretaría de la Convención de Ramsar (2010). Designación de sitios Ramsar: marco estratégico y lineamientos para el desarrollo futuro de la Lista de Humedales de Importancia Internacional. Manuales Ramsar para el uso racional de los humedales 17. Gland: Secretaría de la Convención de Ramsar.
Shannon, C. E. y Weaver, W. (1949). The mathematical theory of communications. Urbana: University of Illinois Press.
Simberloff, D. S. (1972). Properties of the rarefaction diversity measurement. The American Naturalist, 106, 414–418. https://doi.org/10.1086/282781
Straneck, R., Olmedo, E. V. y Carrizo, G. R. (1993). Catálogo de voces de anfibios argentinos, Parte I. Buenos Aires: Ediciones L.O.L.A.
U.S. EPA. (2002). Methods for evaluating wetland condition: using amphibians in bioassessments of wetlands. Washington D.C.: Office of Water, U.S. Environmental Protection Agency.
Vadell, M. V., Bellomo, C., San Martín, A., Padula, P. y Gómez Villafañe, I. (2011). Hantavirus ecology in rodent populations in three protected areas of Argentina. Tropical Medicine and International Health, 16, 1342–1352. https://doi.org/10.1111/j.1365-3156.2011.02838.x
Vadell, M. V. y Gómez Villafañe, I. E. (2016). Environmental variables associated with Hantavirus reservoirs and other small rodent species in two National Parks in the Paraná Delta, Argentina: implications for disease prevention. EcoHealth, 13, 248–260. https://doi.org/10.1007/s10393-016-1127-7
Vaira, M., Akmentins, M., Attademo, M., Baldo, D., Barrasso, D., Barrionuevo, S. et al. (2012). Categorización del estado de conservación de los anfibios de la República Argentina. Cuadernos de Herpetología, 26, 131–159.
Vera Candioti, M. F. (2007) Anatomy of anuran tadpoles from lentic water bodies: systematic relevance and correlation with feeding habits. Zootaxa, 1600, 1–175.
Villarreal, H., Álvarez, M., Córdoba, S., Escobar, F., Fagua, G., Gast, F. et al. (2006). Manual de métodos para el desarrollo de inventarios de biodiversidad. Bogotá: Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. https://doi.org/10.21068/d100818oc
Walther, B. A. y Morand, S. (1998). Comparative performance of species richness estimation methods. Parasitology, 116, 395–405. https://doi.org/10.1017/s0031182097002230
Zimmerman, B. L. (1994). Audio strip transects. En W. R. Heyer, M. A. Donnelly, R. W. McDiarmid, L. C. Hayek, y M. S. Foster (Eds.), Measuring and monitoring biological diversity: standard methods for amphibians (pp. 92–97.). Washington D.C.: Smithsonian Institution Press.