Joana J. Baños-Baños a, *, Carolina Bojórquez-Sánchez b, Magdalena E. Bergés-Tiznado b, Federico Páez-Osuna c y Yassir E. Torres-Rojas d
a Universidad Autónoma de Campeche, Facultad de Ciencias Químico Biológicas, Av. Agustín Melgar s/n, Buenavista, 24039 Campeche, Campeche, México
b Universidad Politécnica de Sinaloa, Unidad Académica de Ingeniería en Tecnología Ambiental, Carretera Municipal Libre Mazatlán-Higueras Km. 3, 82199 Mazatlán, Sinaloa, México
c Universidad Nacional Autónoma de México, Instituto de Ciencias del Mar y Limnología, Unidad Académica Mazatlán, Apartado postal 811, 82000 Mazatlán, Sinaloa, México
d Universidad Autónoma de Campeche, Instituto de Ecología, Pesquerías y Oceanografía del Golfo de México, Campus 6, Av. Héroe de Nacozari Núm. 480, 24029 Campeche, Campeche, México
*Autor para correspondencia: al053670@uacam.mx (J.J. Baños-Baños)
Recibido: 15 octubre 2021; aceptado: 24 agosto 2022
Resumen
El objetivo del estudio fue analizar las concentraciones de zinc y cobre en músculo (n = 14) e hígado (n = 72) de Rhizoprionodon terraenovae, especie de tiburón de mayor captura y consumo en el litoral de Campeche, México. De acuerdo con la longitud total (LT), los organismos analizados fueron adultos (LT = 89.8 ± 13.7 cm), quienes presentaron las mayores concentraciones (mg/kg de peso húmedo) de oligoelementos en hígado: zinc (16.23 ± 8.45) > cobre (2.32 ± 0.84); mientras que en músculo: zinc (6.48 ± 2.89) > cobre (0.39 ± 0.14). No se encontraron diferencias significativas en las concentraciones de oligoelementos por tejido entre sexos, ni una correlación significativa con la LT de los organismos. Ambos metales se correlacionaron positivamente en cada tejido. Se registró una biodisminución de 0.22 mg/kg en cobre y 9.58 mg/kg en zinc en el hígado del año 2015 al 2019, probablemente por incremento de metalotioneínas. Las concentraciones de ambos oligoelementos en músculo estuvieron por debajo de los límites máximos establecidos por normas internacionales. En conclusión, los niveles de zinc y cobre, actualmente, no implican riesgos para la salud de R. terraenovae (hígado), ni para la de la sociedad en caso de consumo (músculo).
Palabras clave: Golfo de México; Contaminación marina; Biodisminución; Bioacumulación; Elasmobranquios
© 2023 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Concentration of trace elements (Copper and Zinc) in muscle and liver of the Atlantic sharpnose shark (Rhizoprionodon terraenovae), captured off the coast of Campeche, Mexico
Abstract
The aim of this study was to analyze the concentrations of zinc and copper in the muscle (n = 14) and liver (n = 72) of Rhizoprionodon terraenovae, a shark species with the highest capture and consumption rate in the coast of Campeche, México. According to the total length (TL), the organisms analyzed were adults (TL= 89.8 ± 13.7 cm). The highest concentrations (mg/kg of wet weight) of trace elements were in liver: zinc (16.23 ± 8.45) > copper (2.32 ± 0.84); while in muscle: zinc (6.48 ± 2.89) > copper (0.39 ± 0.14). No significant differences were found in concentrations of trace elements by tissue between sexes, nor a significant correlation with the TL of the organisms. Both metals were positively correlated in each tissue. A biodiminution of 0.22 mg/kg in copper and 9.58 mg/kg in zinc was registered in the liver from 2015 to 2019, probably due to an increase of metallothioneins. The concentrations of both trace elements in muscle were below the maximum limits established by International Standards. In conclusion, the levels of zinc and copper currently do not imply risks for the health of R. terraenovae (liver), nor its consumption (muscle) for society.
Keywords: Gulf of Mexico; Marine pollution; Biodiminution; Bioaccumulation; Elasmobranchs
© 2023 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
El golfo de México integra una compleja combinación de hábitats que son críticos para una multitud de formas de vida, incluyendo recursos de importancia comercial (Torruco-Gómez et al., 2010). Entre éstos, destaca la pesquería de elasmobranquios, siendo el estado de Campeche el segundo de mayor importancia a nivel nacional en cuanto a volúmenes de captura, resaltando la presencia del cazón picudo del Atlántico (Rhizoprionodon terraenovae) con más de 50% de la producción en el estado (Martínez-Cruz et al., 2016; Viana-Morayta, 2019).
El cazón R. terraenovae se presenta en las costas de Campeche durante todo el año con fines reproductivos y alimenticios (Flores-Hernández et al., 2010; Martínez-Cruz et al., 2016; Viana-Morayta et al., 2020), siendo capturado principalmente por la pesquería artesanal de la región, donde gran parte es dirigida a consumo directo local y otra parte es distribuido a nivel nacional (Viana-Morayta et al., 2020). Además de las actividades pesqueras, en el golfo de México se realizan otras que son consideradas como fuentes de contaminación para el ecosistema marino (e.g., agricultura, actividades petroleras, la urbanización y el turismo), debido a que pueden acarrear desechos altamente tóxicos, algunos de los cuales tienen la capacidad de acumularse a lo largo de la cadena alimenticia (Toledo-Ocampo, 2005; Vélez-Alavez, 2009).
Entre los contaminantes que destacan están los metales pesados y metaloides, son sustancias con gran estabilidad química respecto a los diferentes procesos de degradación, que pueden cambiar de estado o combinarse con otras sustancias, y en algunos casos dan lugar a formas más tóxicas del metal, por lo que los seres vivos no pueden metabolizar, acumulándose así en los tejidos y órganos (Cota-Soto y Jiménez-Bravo, 2017). Algunos de estos metales pueden ser el cobre (Cu) y zinc (Zn), que si bien son clasificados como esenciales, se ha registrado que pueden ser altamente tóxicos si sobrepasan los niveles requeridos (Figueroa-Careaga, 2019; Moreno-Sierra et al., 2016), además tienen la capacidad de interactuar con el metabolismo de otros oligoelementos (FAO, 2019), dañando de esta manera la salud de la biota marina a nivel fisiológico, celular y de conducta (Soto-Jiménez, 2011), y posteriormente, afectando la salud de los humanos al ingerirlos.
De acuerdo con Nauen (1983), los límites máximos (LM) para las concentraciones de metales en peces y productos pesqueros varían dependiendo la región, encontrando LM desde 10.0 (Chile) hasta 30 mg/kg (Nueva Gales del Sur, Australia del Sur y Nueva Zelanda) de peso húmedo (ph) para Cu; mientras que para Zn puede ser de 40 (Nueva Gales del Sur, y Nueva Zelanda) hasta 150 mg/kg (Australia). Sin embargo, en México no existen estudios de referencias que nos permitan conocer los niveles actuales de Zn y Cu con relación a productos de la pesca, complicando el establecimiento de normas nacionales con relación a estos elementos.
Las concentraciones de elementos traza en un organismo dependen del comportamiento trófico de la especie, del metabolismo y de los procesos de detoxificación del mismo organismo (Figueroa-Careaga, 2019), por lo que se pueden encontrar distintas concentraciones de metales en un mismo ambiente marino (Adel et al., 2017). En el caso específico de R. terraenovae, su principal fuente de alimento son los teleósteos, como chac-chí (Haemulon plumierii), sardinela redonda (Sardinella aurita), arenque falso (Harengula clupeola) y rubia (Lutjanus synagris), representando en conjunto 90.8% de la dieta total de R. terraenovae (Adams et al., 2003; Haman et al., 2012; Viana-Morayta, 2019), por lo cual algunos autores lo han clasificado como un mesodepredador en las costas de Campeche, que por su estrategia trófica (depredador generalista), al realizar movimientos verticales en las columnas de agua donde se distribuyen los metales, la alta diversidad de ingesta de alimentos y a la frecuencia de alimentación (Núñez-Nogeira et al., 1988; Viana-Morayta et al., 2020), está altamente expuesto a la acumulación de ciertos metales pesados. A pesar de ser R. terraenovae una especie de importancia comercial, a la fecha son nulos los estudios realizados sobre esta línea de investigación, por ende, se desconocen los niveles de concentración en sus tejidos (hígado), así como, el posible efecto en los consumidores (músculo).
Ante la actual situación surge el interés de conocer la calidad (libres de contaminantes) de los productos marinos que consume la sociedad en la región, así como los posibles efectos que pueden generar en la salud humana. En este contexto, los objetivos de este estudio fueron: determinar las concentraciones de cobre (Cu) y zinc (Zn) presentes en el hígado y músculo del cazón picudo del Atlántico (R. terreaenovae) capturado en el litoral de Campeche, México, y evaluar las posibles diferencias intraespecíficas (sexo y año) en la concentración de los mismos elementos, para posteriormente, compararlos con las normas gubernamentales internacionales y evaluar los posibles riesgos de su consumo para la salud humana. Este es el primer estudio realizado con relación a las concentraciones de Cu y Zn en R. terreaenovae, considerado de alta importancia ecológica y económica en el golfo de México.
Materiales y métodos
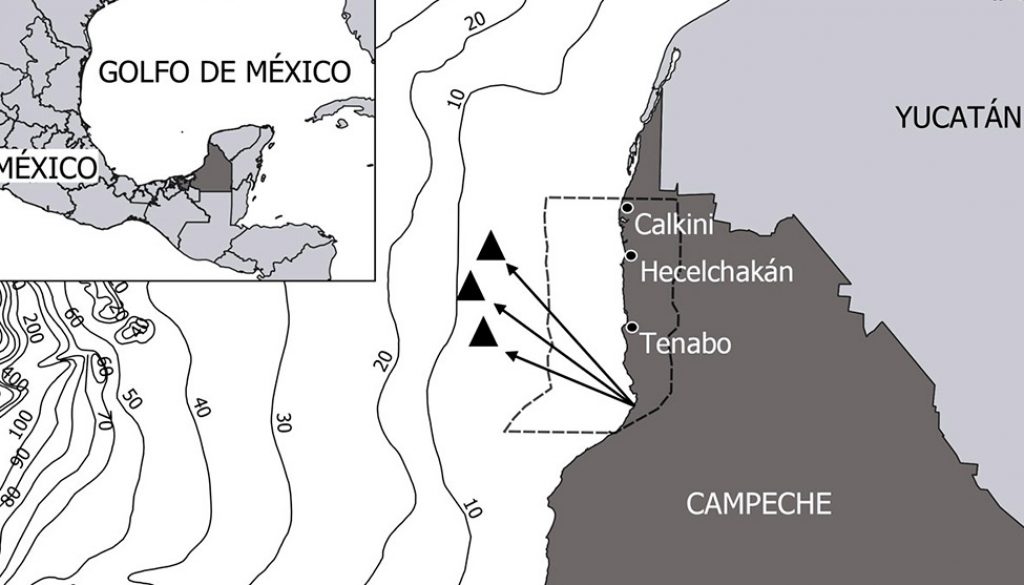
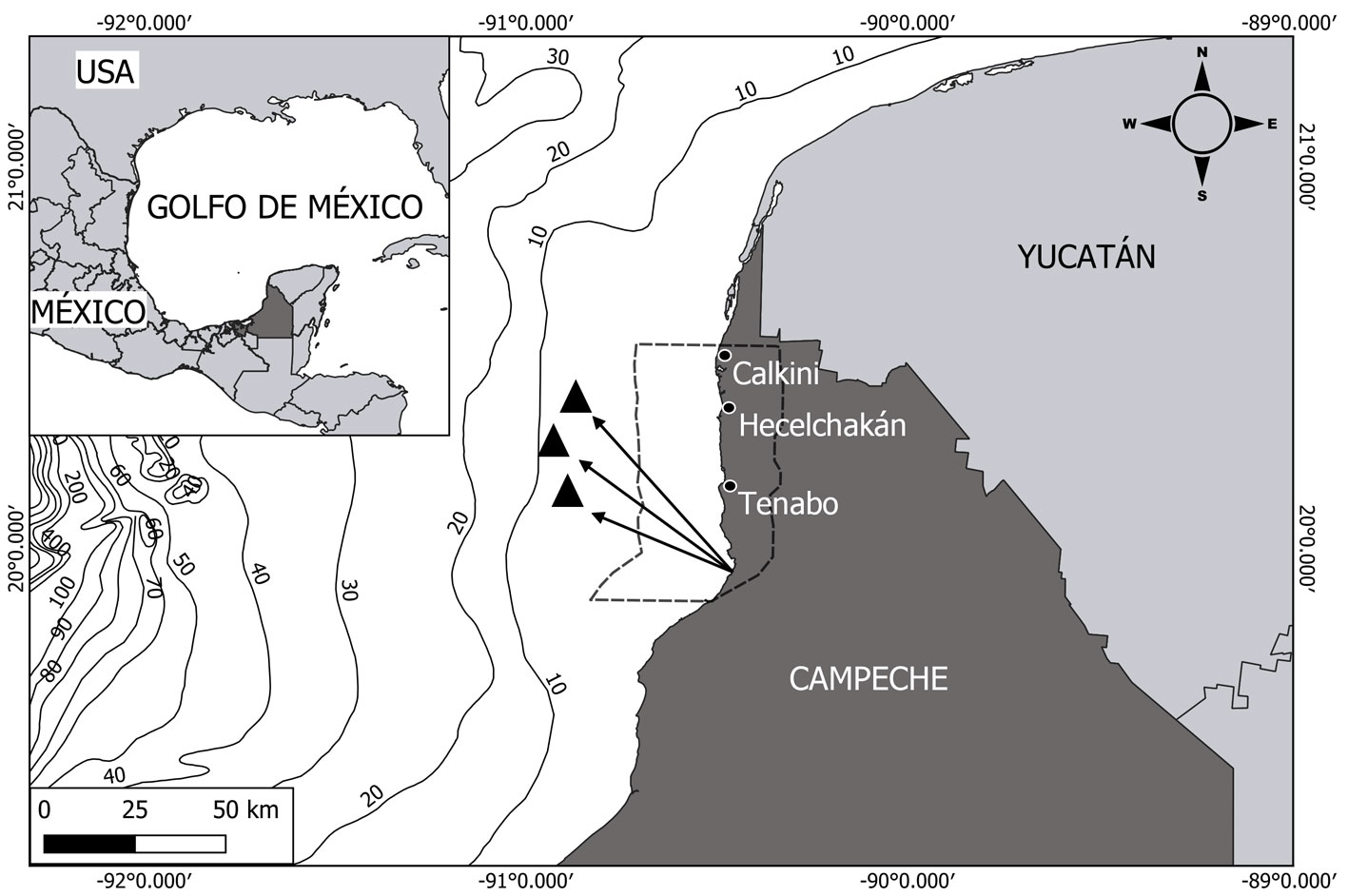
Se muestrearon un total de 72 individuos de R. terraenovae provenientes de los desembarcos de la flota artesanal durante 2015, 2016, 2017 y 2019, en el litoral de Campeche (fig. 1). Los individuos seleccionados fueron adultos (> 75 cm de TL; García-Álvarez, 2014; Viana-Morayta et al., 2020) debido a que son los que más se consumen en la región y que de acuerdo con la bibliografía, puede presentar mayores niveles de oligoelementos metálicos (Márquez et al., 1998; Martínez-Cruz et al., 2016; Olsson et al., 1990). Cada organismo se identificó y se clasificó por año. Se registró la longitud total (LT) en centímetros (cm) y se determinó el sexo (presencia o ausencia del cláspers).
Se analizó un total de 72 hígados y 14 músculos, de los cuales se tomaron aproximadamente 25 a 40 g por muestra. De los hígados, 22 fueron de hembras y 50 de machos, se obtuvieron 21 hígados en 2015, 18 en 2016, 11 en 2017 y 22 en 2019. De los músculos, 3 fueron de hembras y 11 de machos, los 14 músculos fueron recolectados en 2019. Todas las muestras fueron almacenadas a -22 ºC en el laboratorio de Ecología Trófica en el Instituto EPOMEX de la Universidad Autónoma de Campeche.
Las muestras se secaron a 50 °C por 72 horas en un horno de secado (Horno Digital 70L LUZEREN®), luego fueron homogeneizadas y se calculó el porcentaje de humedad de acuerdo con la Norma Oficial Mexicana NOM-116-SSA1-1994. De acuerdo a Bergés-Tiznado et al. (2015) y Moreno-Sierra et al. (2016), las muestras molidas de hígados (0.250 ± 0.006 g) fueron digeridas en vasos de digestión de teflón (60 mL, Savillex) con 4 mL de ácido nítrico (HNO3, grado metal traza al 69-70%, J.T. Baker) y 2 mL de peróxido de hidrógeno (H2O2, al 30%, Fagalab). Los vasos cerrados se dejaron en predigestión por 24 h, pasado el tiempo, se digirieron a una temperatura de 110-120 ºC durante 3 h. Para músculo solo se añadió 5 mL de HNO3 y se siguió el mismo proceso. Los digeridos se aforaron a 20 mL con agua Milli-Q y se colocaron en frascos de polietileno. Este proceso de digestión se realizó por duplicado.
Las muestras fueron analizadas por espectrofotometría de absorción atómica (EAA) acoplado a un horno de grafito para para Cu y flama para Zn (Varian SpectrAA 220). Para asegurar la calidad en la técnica, además de los blancos, se empleó un material de referencia de hígado de pez DOLT-5 (NRC-CNRC). Se realizó la validación de las técnicas analíticas (tabla 1). Todas las concentraciones se expresan en mg/kg con base en peso húmedo (ph).
Se realizó un análisis exploratorio a los datos de normalidad y homocedasticidad (Kolmogorov-Smirnov, Shapiro-Wilk W). Debido a que los datos no cumplieron con los supuestos de normalidad para hígado (K-SZn = p < 0.01, W = 0.79, p = 0.00; K-SCu = p < 0.01, W = 0.44, p = 0.00) y músculo (K-SZn = p < 0.05, W = 0.76, p = 0.00; K-SCu = p < 0.01, W = 0.87, p = 0.00), se utilizó estadística no paramétrica mediante el paquete STATISTICA 7, aplicando la prueba de U Mann-Whitney para realizar las comparaciones de las concentraciones por tejidos y sexos, mientras que, para las concentraciones de cada tejido entre años se aplicó la prueba de Kruskal-Wallis, y por último se aplicó la prueba de correlación Spearman (R) para conocer la presencia o ausencia de una asociación entre la concentración del metal con la LT, y entre concentraciones de los metales en el tejido (Hill y Lewicki, 2007).
Resultados
Del total de organismos muestreados (n = 72), el promedio general de longitud total (LT, cm) fue de 89.8 ± 13.7 cm. Entre años, el promedio de la LT de los organismos del 2019 fue significativamente menor (H = 10.61, p = 0.014) con respecto a los organismos del 2016 (tabla 2). Con relación al sexo, se observó diferencia significativa (U = 3.00 p = 0.037) en el promedio de la LT entre machos (87.1 ± 7.3) y hembras (97.9 ± 6.9) del 2017, (tabla 2). En cuanto a los porcentajes de humedad, el músculo presentó mayor contenido de humedad (80.5 ± 3.1%) que el hígado (33.3 ± 13.3%).
De manera general para ambos tejidos, el patrón de concentración de los metales analizados fue Zn > Cu. En el hígado, se presentaron las mayores concentraciones de ambos metales (tabla 3), donde Cu presentó valores de 1.08 a 6.05 mg/kg, mientras que la concentración de Zn fue de 7.70 a 53.11 mg/kg. En cuanto al músculo, las concentraciones mínimas y máximas de Cu fueron de 0.20 y 0.75 mg/kg respectivamente, y la concentración de Zn fue significativamente mayor que la de Cu (U = 0.00, p ˂ 0.05) presentando una concentración mínima de 4.16 y máxima de 12.62 mg/kg.
Se encontraron diferencias significativas (H = 23.52, p ˂ 0.05) entre las concentraciones de los metales por años de muestreo en el tejido hepático (tabla 3). Se observó que del 2015 al 2019, los metales tuvieron una biodisminución de 0.22 mg/kg en Cu y 9.58 mg/kg en Zn.
El patrón de concentración de metales (mg/kg, de peso húmedo) respecto al sexo en el hígado fue mayor en hembras (2.81 ± 2.33 de Cu y 16.84 ± 7.09 de Zn) que en machos (2.09 ± 0.67 de Cu y 16.04 ± 9.01 de Zn); mientras que en el músculo fue mayor en machos (0.39 ± 0.15 de Cu y 6.55 ± 3.26 de Zn) que en hembras (0.36 ± 0.08 de Cu y 6.22 ± 0.97 de Zn), sin embargo, no se encontraron diferencias significativas (p > 0.05). De igual manera, las concentraciones de los metales en los tejidos entre machos y hembras por año de muestreo no presentaron diferencias significativas (p > 0.05).
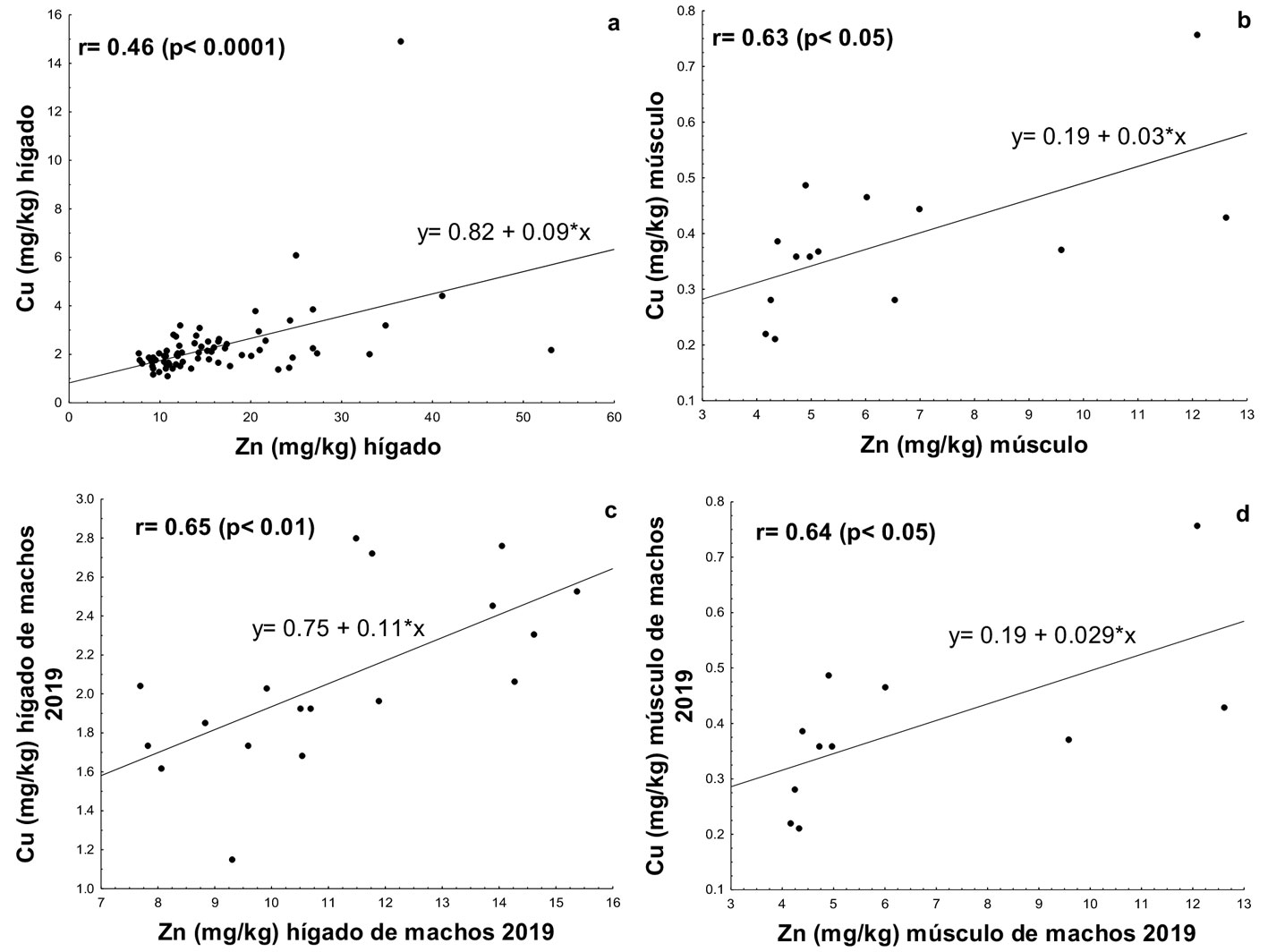
No se encontraron correlaciones significativas entre los niveles de Cu y Zn con respecto a la LT. Sin embargo, si se encontró una correlación positiva y significativa entre Cu y Zn en el hígado (p ˂ 0.05, r = 0.46; fig. 2a) y en el músculo (r = 0.63; p ˂ 0.05; fig. 2b), así como en las concentraciones de Cu y Zn en el hígado (r = 0.65, p ˂ 0.05; fig. 2c) y músculo (r = 0.64, p ˂ 0.05; fig. 2d) de los machos en el año 2019.
Tabla 1
Validación de la técnica analítica (promedio ± DE).
| Metal | DOLT-5
(mg/kg) |
Valor encontrado (mg/kg) | Porcentaje recuperado (%) | Límite de detección | Coeficiente de variación (%) |
| Cu | 35.0 ± 2.4 | 36.4 ± 3.4 | 103.9 ± 9.7 | 0.45 μg/L | 1.9 |
| Zn | 105.3±5.4 | 96.7 ± 6.8 | 91.8 ± 6.4 | 0.02 mg/L | 1.8 |
Nota: los datos son expresados en facción de masa (mg/kg ± desviación estándar), peso seco.
Tabla 2
Biometrías por sexo y año de muestreo de los organismos de R. terraenovae capturados en las costas de Campeche.
| Año | n | LT (cm) | Promedio | |
| Min | Max | (±DE) | ||
| 2015 | ||||
| Macho | 13 | 77.5 | 102 | 91.9 ± 7.5 |
| Hembra | 8 | 87 | 106 | 96.4 ± 5.8 |
| Total | 21 | 77.5 | 106 | 93.6 ± 7.1a,b |
| 2016 | ||||
| Macho | 12 | 77 | 103 | 93.6 ± 7.3 |
| Hembra | 6 | 88 | 103 | 96.2 ± 5.7 |
| Total | 18 | 77 | 103 | 94.4 ±6.7b |
| 2017 | ||||
| Macho | 7 | 77 | 97 | 87.1 ± 7.31 |
| Hembra | 4 | 87.5 | 102 | 97.9 ± 6.92 |
| Total | 11 | 77 | 102 | 91.0 ± 8.7a,b |
| 2019 | ||||
| Macho | 18 | 58 | 130 | 85.5 ± 20.0 |
| Hembra | 4 | 57 | 84 | 65.5 ± 12.4 |
| Total | 22 | 57 | 130 | 81.9 ± 20.3a |
DE = Desviación estándar, n = tamaño de muestra, distinto número en superíndice indica diferencia significativa (p ˂ 0.05) de la LT entre sexos por año, distinta letra en superíndice significa diferencias significativas (p ˂ 0.05) del promedio total de LT entre años de muestreo.
Para la concentración de Cu, las agencias gubernamentales de Australia, Chile e India tienen establecido un límite máximo de 10.0 mg/kg de Cu en músculo. En este estudio las concentraciones determinadas estuvieron por debajo de las establecidas por estas agencias con una concentración promedio de 0.39 mg/kg. Para el Zn las agencias gubernamentales de Australia y Chile establecen un límite máximo (LM) de concentración en el músculo de 150 y 100 mg/kg, respectivamente; mientras que Australia del sur y Nueva Zelanda (ambos con un límite máximo de 40 mg/kg de Zn en músculo, peso húmedo), así como India (límite máximo de 50 mg/kg de Zn en músculo, peso húmedo), establecen LM menores. En el presente estudio la concentración de Zn que se encontró en el músculo de R. terraenovae fue menor (6.48 mg/kg de Zn) en comparación con los LM antes mencionados.
Discusión
El tiburón R. terraenovae se caracteriza por tener un rápido crecimiento y madurar a una edad relativamente temprana (Martínez-Cruz et al., 2016). En el presente estudio se consideró un estado adulto a una LT mínima de 75 cm, talla en la que reporta que alcanza la madurez sexual (García-Álvarez, 2014; Viana-Morayta et al., 2020). Para la región, diversos autores han determinado que la madurez sexual ocurre a partir de 79.35 cm (LT) en machos y 81.05 cm en las hembras (Martínez-Cruz et al., 2016), por lo tanto, la mayoría de los organismos del presente estudio eran sexualmente maduros, ya que las hembras presentaron un promedio de LT de 91 cm, mientras que la LT promedio de los machos fue de 89.3 cm.
La marcada diferencia entre sexos del año 2017 puede radicar en la temporada de muestreo (Moreno-Sierra et al., 2016). Al respecto, Viana-Morayta (2019) reporta que las LT de R. terraenovae, varían por temporadas de muestreo. Por otra parte, siendo la costa de Campeche una zona de reproducción y crianza para R. terraenovae, las hembras podrían posiblemente presentar mayor LT por cuestiones reproductivas, influyendo en las diferencias significativas de la LT entre sexos.
En el presente estudio las concentraciones de Cu y de Zn estuvieron presentes tanto en hígado como en músculo. Ambos metales son considerados comunes en organismos marinos que se alimentan de presas presentes en toda la columna de agua (Adel et al., 2017), observando mayores concentraciones de Zn respecto al Cu en ambos tejidos de estudio (tabla 3). Al comparar las concentraciones de Zn y Cu, FAO (2019) afirma que el Cu es especialmente sensible a altas dosis de Zn, ya que una alta ingesta de este metal afecta los índices de estado de Cu, lo que significa que las altas concentraciones determinadas de Zn interactuaron con el metabolismo del Cu, y por ello se encontraron correlacionadas las concentraciones de Zn y Cu en el hígado y músculo de los organismos (figs. 2a, b).
Tabla 3
Concentración de metales basado en peso húmedo (Cu y Zn) en los diferentes tejidos por año de muestreo y sexo de los organismos de R. terraenovae capturados en las costas de Campeche.
| Tejido | n | Cu (mg/kg) | Zn (mg/kg) | Cu promedio
(mg/kg) |
Zn promedio
(mg/kg) |
||
| Año/sexo | Min | Max | Min | Max | |||
| Hígado | |||||||
| 2015 | 21 | 1.08 | 4.40 | 10.86 | 53.11 | 2.25 ± 0.88 | 20.57 ± 10.49b |
| 2016 | 18 | 1.27 | 3.06 | 9.15 | 36.59 | 2.70 ± 2.98 | 17.33 ± 7.97b |
| 2017 | 11 | 1.39 | 6.05 | 9.19 | 34.92 | 2.39 ± 1.46 | 16.68 ± 8.07a,b |
| 2019 | 22 | 1.15 | 2.80 | 7.70 | 15.38 | 2.03 ± 0.42 | 10.99 ± 2.29a |
| Músculo | |||||||
| 2019 | 14 | 0.20 | 0.75 | 4.16 | 12.62 | 0.39 ± 0.14 | 6.48 ± 2.89 |
| Total hígado | 72 | 1.08 | 6.05 | 7.70 | 53.11 | 2.32 ± 0.841 | 16.23 ± 8.452 |
| Macho | 50 | 1.08 | 4.39 | 7.70 | 36.59 | 2.09 ± 0.67 | 16.04 ± 9.01 |
| Hembra | 22 | 1.27 | 6.05 | 9.15 | 53.11 | 2.81 ± 2.33 | 16.84 ± 7.09 |
| Total músculo | 14 | 0.20 | 0.75 | 4.16 | 12.62 | 0.39 ± 0.141 | 6.48 ± 2.892 |
| Macho | 11 | 0.20 | 0.75 | 4.16 | 12.62 | 0.39 ± 0.15 | 6.55 ± 3.26 |
| Hembra | 3 | 0.28 | 0.44 | 5.13 | 6.99 | 0.36 ± 0.08 | 6.22 ± 0.97 |
Distinta letra de superíndice muestra diferencias significativas (p ˂ 0.05) en las concentraciones del elemento entre los años de muestreo por tejido; distinto número de superíndice significa diferencias significativas (p ˂ 0.05) entre los niveles de concentración total de Cu y Zn por tejido; DE = desviación estándar; n = tamaño de muestra.
Dado que R. terraenovae ingiere una amplia gama de alimentos y con una alta frecuencia, puede ser considerada una especie altamente expuesta a Zn y Cu (Núñez-Nogeira et al., 1988). Lo anterior basado en el hecho de que, al ser una especie de cuerpo pequeño, la demanda energética no disminuye como ocurre en especies de mayor tamaño del mismo orden que ocupan el mismo hábitat (Viana-Morayta, 2019), al requerir una actividad de forrajeo relativamente constante a base de teleósteos realizando desplazamientos por las columnas de agua dónde se distribuyen los metales (Núñez-Nogeira et al., 1988).
Haman et al. (2012) encontró resultados similares para R. terraenovae, este autor reportó concentraciones significativamente altas de vitamina A y Zn debido a la gran porción de teleósteos en la dieta. Adel et al. (2017) atribuyen que las concentraciones de Zn y Cu varían debido al comportamiento trófico de los tiburones, ya que el Cu tiende a ser mayor en especies que se alimentan de micronecton, como lo es la dieta del tiburón lechoso (Rhizoprionodon acutus), con una concentración de 1.10 mg/kg de Cu en músculo, en comparación con las especies piscívoras como lo es R. terraenovae, a la cual Viana-Morayta et al. (2020) reportan como especie ictiófaga que se alimenta de la fauna demersal, obteniendo una concentración promedio de 0.39 mg/kg de Cu en músculo en este estudio.
El Zn también suele encontrarse en mayores concentraciones que el Cu debido a que en los organismos este metal actúa como precursor de diversas actividades enzimáticas, más de 300 proteínas dependen del Zn y es el segundo metal por el cual las metalotioneínas (MT) tienen afinidad, por lo que el Zn puede ser transferido de las MT a otras proteínas (Moreno-Sierra et al., 2016; Ong y Gan, 2017). Este metal es un componente en varios factores de transcripción que implican procesos celulares, tales como la transducción de la señal, la transcripción y la replicación del ADN y ARN (Moreno-Sierra et al., 2016). Aunque en menor medida, las MT también muestran afinidad por el Cu, participando en la donación de Cu a otras proteínas (Roesijadi, 1992).
El tejido hepático presentó las mayores concentraciones de Zn y Cu (tabla 3), dichos resultados se han reflejado en estudios realizados por diferentes autores como Figueroa-Careaga (2019) y Vega-Barba (2018), lo que demuestra que los tejidos metabólicamente activos tienden a acumular metales en cantidades más altas. El hígado es el principal órgano encargado de desarrollar funciones como la captación, el almacenamiento, la desintoxicación y la eliminación de los metales exógenos (Moreno-Sierra et al., 2016). En éste se sintetizan principalmente las MT, las cuales son útiles en la homeostasis o regulación de la disponibilidad de oligoelementos esenciales tales como Zn y Cu a los sitios intracelulares específicos, además de desintoxicar o proteger de las altas concentraciones de metales pesados por medio de la absorción en las células, por el secuestro dentro de las células o por la exportación de los metales fuera de las células hepáticas (Adel et al., 2017; Moreno-Sierra et al., 2016).
El músculo fue el tejido que presentó las concentraciones más bajas de ambos metales (tabla 3), aunque en este tejido al igual que en el tejido hepático, el metal con mayor concentración fue el Zn. En este estudio R. terraenovae presentó mayor concentración de Zn en músculo (6.48 ± 2.89 mg/kg, peso húmedo) comparado con las concentraciones determinadas en otras especies estudiadas por Adel et al. (2017) y Ong y Gan (2017), donde reportan para R. acutus concentraciones de 4.38 a 2.15 mg/kg de Zn (peso húmedo), seguido del cazón bironche (Rhizoprionodon longurio) con 3.30 mg/kg de Zn, y por último, la especie con menor concentración de Zn fue el tiburón rabo manchado (Carcharhinus sorrah) con 2.77mg/kg (tabla 4).
Al comparar los resultados del presente estudio con otros llevados a cabo en el mismo género, la concentración de Cu encontrada en el músculo (0.39 ± 0.14 mg/kg peso húmedo) de R. terraenovae que es una especie ictiófaga con una dieta basada en teleósteos (Viana-Morayta et al., 2020), fue mayor a la concentración reportada por Adel et al. (2017) para la especie R. longurio (0.23 mg/kg, peso húmedo) la cual se alimenta principalmente de cefalópodos (Osuna-Peralta et al., 2014), pero menor a la concentración de Cu presente en el músculo de R. acutus (1.10 mg/kg, peso húmedo), cuya dieta está basada igualmente en teleósteos, pero con una gran proporción de organismos bentónicos (crustáceos, moluscos; Ba-A et al., 2013). Dichas diferencias de concentraciones reportadas pueden deberse a las diferentes porciones de Cu que ingiere cada especie de acuerdo a la dieta (tabla 4).
Se observó que del 2015 al 2019, los metales tuvieron una biodisminución de 0.22 mg/kg en Cu y 9.58 mg/kg en Zn en el tejido hepático (tabla 3), por lo que pudo existir un incremento en la síntesis de MT ayudando a la desintoxicación de metales pesados en los tejidos de los organismos (Adel et al., 2017); además, obtener este resultado no es completamente inesperado, ya que la contaminación ocurre cuando la absorción de los oligoelementos llega a exceder la excreción de los mismos (Powell y Powell, 2001).
Tabla 4
Estudios previos de las concentraciones promedio de Cu y Zn determinadas en el músculo de elasmobranquios de la familia Carcharhinidae. Las concentraciones se encuentran en mg/kg (peso húmedo).
| Especie | Cu | Zn | Región | Referencia |
| R. longurio | 0.23 | 3.30 | Mazatlán, golfo de California | Frías-Espericueta et al., 2014 |
| R. acutus | 0.48 | 2.15 | Kuala Terengganu, Malasia | Ong y Gan, 2017 |
| C. sorrah | – | 2.77 | ||
| R. acutus | 1.10 | 4.38 | Golfo Pérsico | Adel et al., 2017 |
| R. longurio | 0.23 | 3.30 | ||
| R. terraenovae | 0.39 | 6.48 | Litoral de Campeche, golfo de México | Presente estudio |
Las diferencias significativas (p ˂ 0.05) de las concentraciones de Zn en el hígado de los años 2015 y 2016 con el 2019 (tabla 3), puede deberse a factores intrínsecos como la movilidad, la edad del individuo, la reproducción y la talla (Mora-Carrillo, 2015; Powell y Powell, 2001), ya que para los años 2015 y 2016 se reportan las tallas más grandes de los organismos y una mayor concentración de ambos elementos, mientras que en el 2019 se registran tallas más pequeñas con menores concentraciones. También podrían estar influyendo factores ambientales como la marea, el viento, descarga de ríos, estacionalidad, temperatura del agua, pH y salinidad (Mora-Carrillo 2015; Powell y Powell, 2001), ya que al ser R. terraenovae una especie pelágico demersal realiza movimientos verticales dentro de la columna de agua en un ambiente caracterizado por cambios perpetuos en las condiciones del agua (Viana-Morayta et al., 2020).
La correlación positiva y significativa (p ˂ 0.05) encontrada entre la concentración de los metales en el hígado y músculo de los machos del 2019 (fig. 2c, d), pero no en los tejidos de las hembras puede deberse a las distintas porciones de elementos esenciales que ingiere cada sexo de acuerdo a la dieta, ya que si bien, la principal fuente de alimento para R. terraenovae son los teleósteos que aportan una alta porción de vitamina A y Zn al organismo (Adel et al., 2017; Viana-Morayta et al., 2020), los machos, a diferencia de las hembras, consumen batoideos (Viana-Morayta, 2019), los cuales podrían encontrarse aportando concentraciones de Cu, esto posiblemente para no competir por alimento en la utilización de espacios (Adel et al., 2017; Martínez-Cruz et al., 2016).
La importancia de almacenamiento de metales en los tejidos para cada sexo, puede ser un factor relevante e influyente en que las hembras hayan presentado mayores concentraciones de ambos metales en el hígado y los machos en el músculo, ya que tomando en cuenta que en este estudio todos los organismos fueron adultos (> 75 cm de LT), posiblemente la mayoría fueron sexualmente maduros, por lo que requieren mayores concentraciones de estos elementos esenciales por factores de reproductividad.
En este sentido, cabe la probabilidad de que después de que el tejido hepático metabolice los metales para después enviarlos a los tejidos donde serán acumulados, las hembras se encuentren almacenándolos en mayor concentración en las gónadas a diferencia de los machos, los cuales los almacenen posiblemente en el músculo (Márquez et al., 1998), razón por la cual se determinaron mayores concentraciones de los metales en el tejido muscular de los machos. Esta diferencia radica especialmente en que los tiburones sexualmente maduros necesitan fortalecer sus gónadas para el proceso de reproducción, sin embargo, es el proceso de ovogénesis el que hace que las gónadas de las hembras tengan mayor Zn y Cu (Olsson et al., 1990). En este contexto, el uso de hábitat por cuestiones de reproducción, puede estar influyendo en que se hayan determinado mayores concentraciones de ambos metales en el hígado de las hembras en comparación con los machos, puesto que las hembras se acercan a las costas con la finalidad de dar a luz a las crías pudiendo estar más expuestas a mayores concentraciones de metales que se encuentran en las columnas de agua al momento de desplazarse (Martínez-Cruz et al., 2016).
Las concentraciones determinadas de Cu (2.81 mg/kg) y Zn (16.84 mg/kg) en el hígado de las hembras fueron mayores a las reportadas por Frías-Espericueta et al. (2014) en hembras de la especie R. longurio (0.43 mg/kg de Cu y 12.56 mg/kg de Zn), esta diferencia puede deberse al periodo de dar a luz a las crías, ya que, después del parto, parece presentarse una transferencia de metales a los hígados de los embriones para otorgarles una mayor tasa de crecimiento, presentando así una dilución de metales en el hígado.
El Zn en el hígado tiene una gran demanda fisiológica del organismo debido a que es utilizado como componente estructural y para la realización de los procesos enzimáticos conforme el organismo está en desarrollo y madura (Figueroa-Careaga, 2019), pero en este estudio, en ninguno de los tejidos los oligoelementos se correlacionaron significativamente (p > 0.05) con la LT de los organismos; es decir, la concentración de estos metales no se vio afectada por la LT, esto probablemente se debe a que todos los organismos ya eran adultos (LT = 89.8 ± 13.7 cm) por lo que ya han concluido la etapa de desarrollo y presentan un rango similar de la LT. Sin embargo, esto puede deberse también a que los peces tienen la capacidad de regular total o parcialmente al menos los elementos esenciales como lo son el Cu y el Zn (Powell y Powell, 2001).
No hay estudios que reporten las concentraciones de metales en los tejidos del cazón picudo del Atlántico (R. terraenovae) en el litoral de Campeche, así mismo no existe información sobre los límites máximos de las concentraciones de Cu y Zn analizadas en las normas de México, la OMS y la UE. Esta falta de información, puede deberse a que estos metales son considerados esenciales, por lo que siempre están presentes en el organismo. En este contexto, se recomienda establecer límites máximos también para elementos esenciales, ya que en altas concentraciones pueden ocasionar daños al organismo.
Existen agencias gubernamentales internacionales que tienen normas establecidas para los límites máximos permitidos en el músculo de peces con base en el peso húmedo. Para la concentración de Cu las agencias gubernamentales de Australia, Chile e India tienen establecido un límite máximo de 10.0 mg/kg de Cu en músculo. En este estudio, las concentraciones determinadas estuvieron por debajo de las establecidas por estas agencias con una concentración promedio de 0.39 mg/kg peso húmedo, la concentración baja de Cu puede deberse a la dieta de los organismos o bien, a la poca capacidad que tienen los tejidos musculares de almacenar metales esenciales. Otro factor que pudo influir en el resultado de la concentración de este metal es que el número de músculos estudiados (n = 14) fue escaso y todos pertenecían al 2019, por lo que se sugiere realizar un estudio con un número mayor de músculos y obtener muestras de diferentes años para evaluar si hay mayor presencia o una variación en el tiempo de la concentración de Cu en el músculo.
Las agencias gubernamentales de Australia y Chile establecen límites máximos de la concentración de Zn en el músculo de 150 y 100 mg/kg peso húmedo, respectivamente, y, aunque por otra parte Australia del sur y Nueva Zelanda (ambos con límite máximo 40 mg/kg de Zn en músculo, peso húmedo), así como la India (límite máximo de 50 mg/kg de Zn en músculo, peso húmedo) tienen límites máximos menos tolerables, la concentración de Zn que se presentó en el músculo de R. terraenovae en este estudio (6.48 mg/kg de Zn, peso húmedo) fue menor en comparación con las establecidas por estas agencias. Este resultado en el músculo puede deberse a que este metal tiene mayor concentración en los tejidos hepáticos debido a su función como componente estructural y en procesos enzimáticos (Figueroa-Careaga, 2019).
En conclusión, las concentraciones de Cu y de Zn encontradas en el músculo están por debajo de los límites máximos establecidos por las normas gubernamentales internacionales, lo que nos indica que no hay indicios de que exista un problema con la salud de los organismos y/o de los consumidores con relación a estos 2 oligoelementos. Por otra parte, el presente estudio sirve de referencia como indicador de los valores que pueden presentar mesodepredadores como R. terraenovae, los cuales son de gran utilidad para desarrollar normas nacionales en corto plazo.
Agradecimientos
YETR agradece a PRODEP/SEP por el financiamiento del proyecto titulado “Variación temporal y hábitos alimenticios del cazón Rhizoprionodon terraenovae en las costas de Campeche, México” DSA/103.5/15/2017. MEBT agradece al programa de Ciencia Básica-Conacyt 2016, en su modalidad de “Apoyo a iniciativas de Investigador Joven”, del proyecto con número de registro 288665. Los autores agradecen a Humberto Bojórquez-Leyva por su asesoramiento en el trabajo de laboratorio y análisis químico.
Referencias
Adams, D. H., McMichael, R. H. y Henderson, G. E. (2003). Mercury levels in marine and estuarine fishes of Florida 1989-2001, 2nd Ed. Florida Marine Research Institute Technical Report TR-9. St. Petersburg, FL: Florida Fish and Wildlife Conservation Commission.
Adel, M., Mohammadmoradi, K. y Ley-Quiñonez, C. P. (2017). Trace element concentrations in muscle tissue of milk shark (Rhizoprionodon acutus) from the Persian Gulf. Environmental Science and Pollution Research, 24, 5933–5937. https://doi.org/10.1007/s11356-016-8358-6
Ba, A., Diop, M.S., Diatta, Y., Justine, D. y Ba, C.T. (2013). Diet of the milk shark, Rhizoprionodon acutus (Rüppel, 1837) (Chondrichthyes: Carcharhinidae), from the Senegalese coast. Journal of Applied Ichthyology, 29, 789–795. https://doi.org/10.1111/jai.12156
Bergés-Tiznado, M. E., Márquez-Farías, F., Lara-Mendoza, R. E., Torres-Rojas, Y. E., Galván-Magaña, F., Bojórquez-Leyva, H. et al. (2015). Mercury and selenium in muscle and target organs of Scalloped Hammerhead shark Sphyrna lewini of the SE Gulf of California: Dietary intake, molar ratios, loads and human health risks. Archives of Environmental Contamination and Toxicology, 69, 440–452. https://doi.org/10.1007/s00244-015-0226-8
Cota-Soto, R. y Jiménez-Bravo, L. A. (2017). Distribución y niveles de metales pesados (Cd y Zn) en tejidos de la sierra del Pacífico Scomberomorus sierra de la Bahía de Mazatlán, Sinaloa (Tesis). Facultad de Ciencias del Mar, Universidad Autónoma de Sinaloa. Sinaloa, México.
FAO (Organización de las Naciones Unidas para la Alimentación y la Agricultura). (2019). Papel del zinc en los procesos metabólicos humanos. Recuperado el 05 febrero, 2020 de: http://www.fao.org/3/y2809e/y2809e0m.htm#TopOfPage
Figueroa-Careaga, A.B. (2019). Determinación de Cd, Cu, Pb y Zn en hígado y músculo del tiburón Galeus piperatus del norte del Golfo de California (Tesis). Unidad Académica de Ingeniería en Tecnología Ambiental, Universidad Politécnica de Sinaloa. Mazatlán, Sinaloa.
Flores-Hernández, D., Markaida, U., Pérez-Jiménez J. C. y Ramos-Miranda, J. (2010). Uso de la biodiversidad: las pesquerías. En G. J. Villalobos-Zapata y J. Mendoza-Vega (Coord.). La biodiversidad en Campeche: estudio de estado (pp. 520–535). Ciudad de México: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/ Gobierno del Estado de Campeche/ Universidad Autónoma de Campeche/ El Colegio de la Frontera Sur.
Frías-Espericueta, M. G., Cárdenas-Nava, N. G., Márquez-Farías, J. F., Osuna-López, J. I., Muy-Ángel, M. D., Rubio-Carrasco, W. et al. (2014). Cadmium, Copper, Lead and Zinc concentrations in female and embryonic Pacific sharpnose shark (Rhizoprionodon longurio) tissues. Bulletin of Environmental Contamination and Toxicology, 93, 532–535. https://doi.org/10.1007/s00128-014-1360-0
García-Álvarez, A. M. (2014). Uso de recursos tróficos por Rhizoprionodon terraenovae y Sphyrna tiburo, en el suroeste del golfo de México (Tesis de maestría). Facultad de Ciencias Biológicas y Agropecuarias, Universidad Veracruzana. Tuxpan, Veracruz.
Haman, K. H., Norton, T. M., Thomas, A. C., Dove, A. D. M. y Tseng, F. (2012). Baseline health parameters and species comparisons among free-ranging Atlantic sharpnose (Rhizoprionodon terraenovae), bonnethead (Sphyrna tiburo), and spiny dogfish (Squalus acanthias) sharks in Georgia, Florida, and Washington, USA. Journal of Wildlife Diseases, 48, 295–306. https://doi.org/10.7589/0090-3558-48.2.295
Hill, T. y Lewicki, P. (2007). Métodos y aplicaciones de estadísticas. Tulsa, OK: StatSoft.
Márquez, M., Vodopivez, C., Casaux, R. y Curtosi, A. (1998). Metal (Fe, Zn, Mn and Cu) levels in the Antarctic fish Notothenia coriiceps. Polar Biology, 20, 404–408. https://doi.org/10.1007/s003000050321
Martínez-Cruz, L. E., Zea-de la Cruz, H., Oviedo-Pérez, J. L., Morales-Parra, L. G. y Balan-Che, L. I. (2016). Aspectos biológicos pesqueros del cazón tutzún Rhizoprionodon terraenovae, en las costas de Campeche, México. Ciencia Pesquera, 24, 23–35.
Mora-Carrillo, J. P. (2015). Concentración de Cd, Cu, Pb y Zn en juveniles de tiburón martillo Sphyrna lewini capturado en el suroeste del golfo de California; variación con talla y peso, y del contenido estomacal (Tesis de maestría). Universidad nacional Autónoma de México, Posgrado en Ciencias del Mar y Limnología-Unidad Académica Mazatlán (Química acuática). México D.F.
Moreno-Sierra, D., Bergés-Tiznado, M. E., Márquez-Farías, F., Torres-Rojas, Y. E., Ruelas-Inzunza, J. R. y Páez-Osuna, F. (2016). Trace metals in target tissues and stomach contents of the top predator sailfish Istiophorus platypterus from the Eastern Pacific: concentrations and contrasting behavior of biomagnification. Environmental Science and Pollution Research, 23, 23791–23803. https://doi.org/10.1007/s11356-016-7551-y
Nauen, C.E. (1983). Compilation of legal limits for hazardous substances in fish and fishery products. FAO Fisheries Circular (764). Recuperado el 29 enero, 2023 de: http://www.fao.org/docrep/014/q5114e.pdf
Núñez-Nogeira, G., Bautista-Ordóñez, J. y Rosiles-Martínez, R. (1998). Concentración y distribución de mercurio en tejidos del cazón (Rhizoprionodon terraenovae) en el golfo de México. Laboratorio de Toxicología, Departamento de Nutrición y Bioquímica, Facultad de Medicina Veterinaria y Zootecnia de la Universidad Nacional Autónoma de México, México D.F.
Olsson, P. E., Zafarullah, M., Foster, R., Hamor, T. y Gedamu, L. (1990). Developmental regulation of metallothionein mRNA, Zinc and Copper levels in rainbow trout, Salmo gairdneri. European Journal of Biochemistry, 193, 229–235. https://doi.org/10.1111/j.1432-1033.1990.tb19327.x
Ong, M. C. y Gan, S. L. (2017). Assessment of metallic trace elements in the muscles and fins of four landed elasmobranchs from Kuala Terengganu Waters, Malaysia. Marine Pollution Bulletin, 124, 1001–1005. https://doi.org/10.1016/j.marpolbul.2017.08.019
Osuna-Peralta, Y. R., Voltolina, D., Morán-Angulo, R. E. y Márquez-Farías, J. F. (2014). Stomach contents of the Pacific sharpnose shark, Rhizoprionodon longurio (Carcharhiniformes, Carcharhinidae) in the southeastern Gulf of California. Latin American Journal of Aquatic Research, 42, 438-444. https://doi.org/10.3856/vol42-issue3-fulltext-5
Powell, J. H. y Powell, R. E. (2001). Trace elements in fish overlying subaqueous tailings in the tropical west Pacific. Environmental Management and Planning Services, 125, 81–104. https://doi.org/10.1023/A:1005211832691
Roesijadi, G. (1992). Metallothioneins in metal regulation and toxicity in aquatic animals. Aquatic Toxicology, 22, 81–113. https://doi.org/10.1016/0166-445X(92)90026-J
Soto-Jiménez, M. F. (2011). Transferencia de elementos traza en tramas tróficas acuáticas. Hidrobiológica, 21, 239–248.
Toledo-Ocampo, A. (2005). Marco conceptual: caracterización ambiental del golfo de México. En A. V. Botello, J. Rendón-von Osten, G. Gold-Bouchot y C. Agraz-Hernández (Eds.), Golfo de México contaminación e impacto ambiental: diagnóstico y tendencias (pp. 25–52). México D.F.: Universidad Autónoma de Campeche/ Universidad Nacional Autónoma de México/ Instituto Nacional de Ecología.
Torruco-Gómez, D. y González-Solís, A. (2010). El sistema arrecifal de Campeche: una visión comparativa. En G. J. Villalobos-Zapata y J. Mendoza-Vega (Coord.). La biodiversidad en Campeche: estudio de estado (pp. 136–140). México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/ Gobierno del Estado de Campeche/ Universidad Autónoma de Campeche/ El Colegio de la Frontera Sur.
Vega-Barba, C. (2018). Elementos potencialmente tóxicos en el tiburón piloto Carcharhinus falciformis y sus presas en la costa sur de Jalisco (Tesis de maestría). Instituto Politécnico Nacional-Centro interdisciplinario de Ciencias Marinas. La Paz, B.C.S.
Vélez-Alavez, M. (2009). Indicadores de estrés oxidativo relacionados con la presencia de elementos traza (plomo, cadmio, mercurio y arsénico), en diferentes tejidos de tiburón mako (Isurus oxyrinchus) (Tesis de maestría). Centro de Investigaciones Biológicas del Noroeste, S.C. La Paz, B.C.S., México.
Viana-Morayta, J. E. (2019). Nicho trófico de elasmobranquios capturados en el litoral de Campeche, México (Tesis de maestría). Universidad Autónoma de Campeche- Facultad de Ciencias Químico Biológicas. Campeche, México.
Viana-Morayta, J. E., Torres-Rojas, Y. E. y Camalich-Carpizo, J. (2020). Diet shifts of Rhizoprionodon terraenovae from the southern Gulf of Mexico: possible scenario by temperature changes. Latin American Journal of Aquatic Research, 48, 406–420. https://doi.org/10.3856/vol48-issue3-fulltext-2433