Conducta alimentaria del tepezcuintle (Cuniculus paca) en dos sitios con distinto uso del suelo en la selva Lacandona, Chiapas, México
Yuriana Martínez-Ceceñas a, *, Yann Hénaut b, Eduardo J. Naranjo a y Arturo Carrillo-Reyes c
a El Colegio de la Frontera Sur, Carretera Panamericana y Periférico Sur s/n, 29290 San Cristóbal de Las Casas, Chiapas, México
b El Colegio de la Frontera Sur, Avenida Centenario Km 5.5, 77014 Chetumal, Quintana Roo, México
c Universidad de Ciencias y Artes de Chiapas, Libramiento Norte Poniente 47, Caleras Maciel, 29000 Tuxtla Gutiérrez, Chiapas, México
*Autor para correspondencia: limbizkit_07_yr@hotmail.com (Y. Martínez-Ceceñas)
Recibido: 4 marzo 2019; aceptado: 17 febrero 2020
Resumen
La transformación del hábitat puede influir en los hábitos alimenticios de mamíferos como el tepezcuintle, Cuniculus paca. Los objetivos del estudio fueron: 1) evaluar el efecto de la actividad humana en el consumo de alimento del tepezcuintle en la selva Lacandona de Chiapas, México, 2) documentar los hábitos alimentarios de este roedor y 3) analizar posibles diferencias en las estrategias de búsqueda y consumo de alimento entre los individuos de tepezcuintle en el área de estudio. De enero a junio 2016, se caracterizaron y monitorearon sitios de alimentación (comederos) del tepezcuintle bajo árboles de Pouteria sapota, Brosimum alicastrum y Attalea butyracea en un ambiente perturbado y uno conservado. Se determinó la frecuencia de visita, horario de consumo y conducta alimentaria de los tepezcuintles y se evaluó el efecto de las características de los comederos y de los individuos en el consumo de alimento. Se obtuvieron 1,743 registros de visitas de tepezcuintles y se describieron las conductas: neutral, evasiva, agonística y sexual. Se demostró que la actividad humana y el tipo de alimento tienen un efecto en el consumo del mismo, por lo que este roedor presenta estrategias complejas de búsqueda y consumo de alimento que le permiten aprovechar los recursos, la coexistencia con competidores y la evasión de depredadores.
Palabras clave: Hábitos alimenticios; Frugívoro; Oportunista
© 2020 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Feeding behavior of lowland paca (Cuniculus paca) in two sites with different land use in the Lancandona Rainforest, Chiapas, Mexico
Abstract
Habitat transformation may influence the feeding habits of mammals such as the lowland paca, Cuniculus paca. The objectives of this study were: 1) to evaluate the effect of human activity on paca foraging habits, 2) to document the foraging habits of this rodent, and 3) to analyze potential differences in the foraging behavior among paca individuals in the study area. From January to June 2016, feeding sites (feeders) of pacas under Pouteria sapota, Brosimum alicastrum, and Attalea butyracea trees were characterized and monitored in disturbed and conserved sites. The frequency of visits, foraging schedule and feeding behavior of pacas were recorded, and the effect of individual pacas and feeder characteristics on food consumption were evaluated. We obtained 1,743 records of paca visits and described its neutral, evasive, agonistic and sexual behaviors. We found that human activity and food types affect food consumption. Therefore, this rodent shows diverse foraging behaviors allowing it to take advantage of available resources, coexist with competitors, and avoid predation.
Keywords: Feeding habits; Frugivore; Opportunistic
© 2020 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
Existen múltiples factores que intervienen en el comportamiento alimentario de la fauna silvestre, como los horarios de actividad (Kronfeld y Dayan, 2003; Lambert et al., 2009), la presencia de competidores y depredadores (Lima, 1998; Schooley et al., 1996) y la disponibilidad del alimento (Ríos y Pérez-Torres, 2015). Las transformaciones en el hábitat de estas especies a causa de las actividades antrópicas como la agricultura, ganadería extensiva y la cacería furtiva, tienen efectos diversos en la abundancia, riqueza y distribución de las poblaciones de muchas especies (Naranjo, 2008). Así mismo, estos factores también influyen en las interacciones con otras especies y en última instancia, en la dinámica del bosque. Muchos mamíferos pueden modificar sus patrones conductuales para adaptarse y sobrevivir, por ejemplo, ocupar nuevos hábitats, modificar sus horarios de actividad y su dieta, entre otros (Sih, 2013).
Para mamíferos como el tepezcuintle, Cuniculus paca, aún no se conoce con precisión el efecto de la fragmentación de las selvas en sus poblaciones. Al ser oportunista, este roedor puede ser tolerante a los cambios en el hábitat y mantener poblaciones viables en pequeños fragmentos de selva que se encuentran entre áreas de cultivos y acahuales (Emmons, 1997; Gallina et al., 2012; Smythe, 1991). Sin embargo, no está exento de ser afectado por la fragmentación y pérdida de hábitat como consecuencia de las actividades humanas (Gallina et al., 2012; Zucaratto et al., 2010).
Los estudios referentes a la alimentación del tepezcuintle son escasos y se han enfocado en documentar la dieta y las semejanzas de ésta con la de otros roedores (Beck-King et al., 1999; Dubost y Henry, 2006; Gallina, 1981). También se han desarrollado otros estudios de tepezcuintles en vida silvestre respecto al uso de hábitat, la caracterización de sus refugios y sus patrones de actividad (Figueroa-de León et al., 2016a; Huanca et al., 2011; Michalski y Norris, 2011; Muñoz et al., 2002; Parroquín et al., 2010). En estos trabajos se ha determinado que algunos recursos del hábitat tales como cuerpos de agua y la vegetación arbórea son esenciales para la permanencia de este roedor (Aquino et al., 2012; Figueroa-de León et al., 2016b). Los cuerpos de agua representan rutas de escape ante el ataque de depredadores y cazadores e intervienen también en el éxito reproductivo de la especie, así como en su papel como dispersora de semillas al defecar en el agua (Parroquín et al., 2010; Sabatini y Paranhos, 2001). La presencia de vegetación arbórea y troncos tirados permite el establecimiento de madrigueras e incrementa la disponibilidad de alimento de este mamífero (Figueroa-de León et al., 2016a).
Por otra parte, los tepezcuintles en vida silvestre suelen tolerar poco a otros congéneres. Las hembras adultas pueden agredir a jóvenes de uno u otro sexo, mientras que los machos adultos atacan a los machos más jóvenes tratando de defender un territorio (Smythe, 1970). Sin embargo, en el medio silvestre se tiene poco conocimiento sobre el comportamiento alimentario del tepezcuintle, sus interacciones intra e interespecíficas, su respuesta a las actividades humanas y a las transformaciones del hábitat. Los objetivos del presente estudio, por lo tanto, consistieron en: 1) evaluar el efecto de la presencia y actividad humana en el consumo de alimento del tepezcuintle en la selva Lacandona de Chiapas, México, 2) documentar sus hábitos alimentarios y 3) comprobar si existen diferencias entre las estrategias de búsqueda y consumo observadas para las hembras, machos y crías de tepezcuintle.
Materiales y métodos
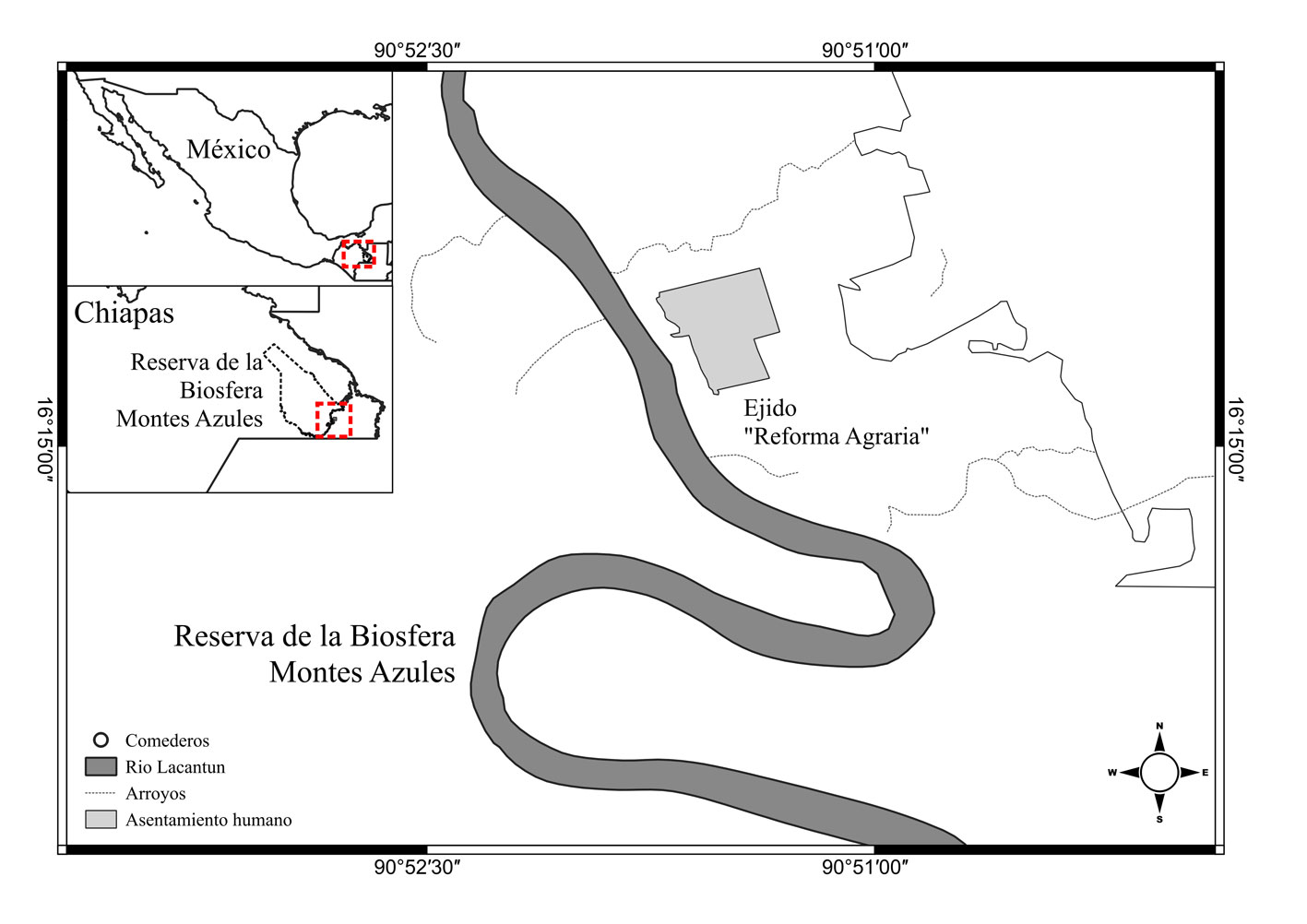
El área de estudio se ubicó al sureste de la Reserva de la Biosfera Montes Azules (REBIMA) y en el ejido aledaño Reforma Agraria (RA), en la selva Lacandona, Chiapas, México (fig. 1). La REBIMA (331,200 ha; “S1” en adelante) se caracteriza por ser un área con escasa actividad humana en su porción sureste, por lo que se le consideró como un sitio sin actividad humana sostenida. Se encuentra en el sur de la selva Lacandona y tiene un gradiente altitudinal que va desde los 200 m snm en el río Lacantún, hasta los 1 500 m snm en la región norte. La temperatura media anual oscila entre 24° y 26 °C, la precipitación media anual es de 2,200 mm y la vegetación característica es la selva alta perennifolia en diversos estadíos sucesionales, encontrándose también zonas inundables y acahuales (Instituto Nacional de Ecología, 2000). El ejido Reforma Agraria (“S2” en adelante) por su parte, se caracteriza por tener una actividad humana sostenida. Este ejido cuenta con una superficie de 2,881 ha, existiendo una reserva comunitaria de 1,463 ha de selva alta y mediana perennifolias, 172 ha de cultivos anuales entre los que destacan el maíz y el frijol, y 768 ha de potreros (García y González, 2015). Se ubica en la cuenca del río Lacantún, el cual representa una barrera natural que lo divide de la REBIMA y lo surcan, de oeste a este, 2 arroyos principales: el Venado hacia el norte y el Remolino hacia el sur (García y González, 2015).
Entre enero y junio de 2016 se realizaron 6 visitas a S2 y 5 a la S1, cada 28 días aproximadamente. En cada sitio se estableció un área de ancho de 50 × 3,000 m a lo largo del río Lacantún, donde se realizó una búsqueda intensiva de comederos de tepezcuintle en febrero, abril y junio. Para fines de este estudio, se consideraron como comederos a aquellos sitios donde se encontraron frutos transportados, amontonados y que presentaban mordidas recientes de tepezcuintle (marcas de incisivos > 4 mm; Beck-King et al., 1999), así como las áreas bajo las copas de los árboles presentes en ambos sitios como el mamey (Pouteria sapota), ramón (Brosimum alicastrum) y corozo (Attalea butyracea), cuyos frutos pudieran ser potencialmente consumidos por el tepezcuintle.
Los comederos se caracterizaron mediante atributos como: tipo de comedero (bajo enredaderas, bajo raíces de árboles en pie, bajo el árbol que tira el fruto, bajo construcciones humanas), especie, estado de maduración y cantidad de frutos, cobertura del dosel, distancias al árbol que estaba fructificando, al agua y a actividades humanas (caminos, potreros, asentamientos humanos; ver apéndice). En cada comedero se establecieron 1-2 cámaras trampa Cuddeback Black Flash E3, las cuales se programaron para estar activas las 24 horas del día registrando videos de 30 segundos de duración con intervalos de 15 segundos entre capturas. Se revisaron cada 28 días aproximadamente y su permanencia en el comedero dependió de la continuidad de las visitas de tepezcuintles.
Se identificaron los individuos de tepezcuintle que visitaron los comederos a partir de marcas distintivas tales como: arcos cigomáticos protuberantes en los machos (M), reducidos en las hembras (H); mamas dilatadas en las hembras lactantes y cicatrices visibles. Los individuos identificados fueron ordenados de acuerdo a su sexo. Las crías (C) fueron asignadas a una categoría distinta por la dificultad en la distinción del sexo. En los casos de presencia de 2 o más individuos se utilizaron las siguientes categorías: hembra con cría (HC), hembra con macho (HM) y macho con cría (MC). Aquellos videos en los que no fue posible identificar a los individuos no fueron tomados en cuenta para los análisis. El comportamiento del tepezcuintle ante la presencia de otros individuos se describió de manera general, ya fueran conespecíficos o de otras especies. Las conductas fueron: neutral, evasiva, agonística y sexual. La primera hizo referencia a la ausencia de una reacción aparente ante la presencia de otros individuos de su misma especie. Evasiva consistió en que, ante la presencia de otro individuo, uno de ellos evitaba el encuentro con el otro. La conducta agonística se refirió a cuando uno de los individuos atacaba a otro.
La sexual se registró cuando un macho intentaba montar una hembra.
En cada video obtenido se observó si había consumo de frutos, sexo del individuo o parejas de ellos (i.e., M, H, HC) y hora de visita al comedero. Los horarios de consumo de alimento se categorizaron en: amanecer, que comprendió desde una hora antes y hasta una hora después de la salida del sol (5:00 a 7:00 h); atardecer, una hora antes y después de la puesta de sol (18:00 a 20:30 h); noche, desde el término del atardecer hasta antes del amanecer (20:31 a 4:59 hrs), y día, en el que se tomaron en cuenta todas las horas que no se encontraron en las categorías anteriores. Los atributos de los comederos se consideraron como variables para determinar diferencias en la frecuencia de visitas a los comederos o en los hábitos alimenticios del tepezcuintle entre sitios (apéndice). Para describir dichos hábitos se estimó la frecuencia de visita a los comederos para cada categoría de individuos (H, M, C, HC, HM y MC) en cada sitio (S1 y S2). A partir de las frecuencias obtenidas se estimó la proporción de cada sexo y pares de ellos respecto a cada una de las variables estimadas para los comederos y los horarios de actividad, separándolas de igual manera por sitio utilizando el software IBM SPSS 21 (Statistical Package of Social Sciences Statistics, 2012).
Para evaluar el efecto de la actividad humana en la frecuencia de visitas a los comederos por parte de los tepezcuintes y la variación de las estrategias de alimentación entre sexos, se construyeron modelos lineales generalizados (GLM), donde se analizaron de manera simultánea los horarios de actividad, el sitio, los sexos y pares de individuos, el tipo de fruto y la distancia del comedero respecto al agua. Posteriormente, se discriminaron estas variables con la selección por pasos para obtener los mejores modelos (Crawley, 2005). En todos los casos se adoptó una distribución binominal logística con logaritmo como función de enlace. Los modelos con el mejor ajuste a los datos se eligieron de acuerdo al criterio de información de Akaike (AIC). Los datos de la pareja MC (n = 3) no fueron tomados en cuenta para los GLM debido al reducido tamaño de muestra. Para la construcción de los GLM se utilizó la plataforma R Studio 3.3.1 (R Core Team, 2016). Además, se realizó un análisis de escalamiento multidimensional para caracterizar a cada sexo y grupo de individuos de acuerdo a cada variable (i.e., tipo de comedero, alimento), separándolos por sitio utilizando el programa STATISTICA 7 (StatSoft, 2008).
Resultados
Se obtuvo un total de 1,743 registros de visitas de tepezcuintles, 599 (34.4%) en S1 y 1,144 (65.6%) en S2. De los 1,743 registros, 584 correspondieron a hembras (H), 262 a machos (M), 593 a crías (C), 48 a hembras con crías (HC), 25 a hembras con machos (HM) y 3 de machos con crías (MC; tabla 1). Se descartaron 228 registros de tepezcuintles cuyo sexo y edad no fue posible determinar. En S1 se registraron 177 visitas de H, 179 de M y 77 de C. Asimismo, se registraron 26 visitas de HC, 14 de HM y 1 de MC (tabla 1). De estas visitas, solo 37.9% de H, 41.9% de M, 23.4% de C, 34.6% de HC y 64.3% de HM se registraron alimentándose. En S2 se registraron 407 visitas de H, 83 de M y 516 de C. Además, se registraron 22 visitas de HC, 11 de HM y 2 de MC (tabla 1). De estas visitas, 50.1% de H, 48.1% de M, 30.2% de C, 63.6% de HC, 18.2% de HM y 100% de MC con cría se observaron alimentándose. Los encuentros con otras especies solo se registraron en S2, uno de un macho con Philander opossum (tlacuache 4 ojos) y otro de una hembra con Didelphis sp. (tlacuache común). En el primer caso P. opossum evadió al tepezcuintle macho que se encontraba consumiendo P. sapota, pues al percatarse de su presencia se alejó del comedero. En el segundo caso, la hembra de tepezcuintle reaccionó ante la presencia de Didelphis sp. y se retiró del comedero.
Tabla 1
Registro de visitas de tepezcuintles (Cuniculus paca) a los comederos en la selva Lacandona, Chiapas, México en el periodo enero-junio de 2016.
|
Individuos |
Ejido Reforma Agraria |
REBIMA* |
Total |
||
|
Consumo |
Sin consumo |
Consumo |
Sin consumo |
||
|
Hembras |
204 |
203 |
67 |
110 |
584 |
|
Machos |
40 |
43 |
75 |
104 |
262 |
|
Crías |
156 |
360 |
18 |
59 |
593 |
|
Hembras con crías |
14 |
8 |
9 |
17 |
48 |
|
Hembras con machos |
2 |
9 |
9 |
5 |
25 |
|
Machos con crías |
2 |
0 |
0 |
1 |
3 |
|
Total |
418 |
623 |
178 |
296 |
1,515 |
*Reserva de la Biosfera Montes Azules
De los 74 videos donde se registró algún tipo de conducta entre conespecíficos, la neutra fue la más frecuente (89.2%) con 66 registros. De éstos, 36 fueron en S1 , 25 correspondieron a HC y 11 de HM. En S2 se obtuvieron 30 registros, 22 de HC y 8 de HM. La conducta evasiva tuvo una frecuencia de 5.4% con 2 registros para cada sitio y se observó solo en MC. En cuanto a la conducta agonística, solo se registró en una ocasión (1.3%) en S1, donde el macho expulsó del comedero a la cría. La conducta sexual se registró en 3 ocasiones (4%), 2 en S2 y 1en S1 (fig. 2; tabla 2).
La mayor frecuencia de visitas de los tepezcuintles a los comederos se dio durante la noche. Sin embargo, en S1 las H y M registraron algunas visitas al amanecer y al atardecer, pero la mayoría se dieron en la noche con 83.3% y 88%, respectivamente. Las C presentaron visitas al atardecer y en la noche en proporciones semejantes, y a diferencia de las C de S2, éstas no presentaron actividad al amanecer (fig. 3A). Las HC presentaron actividad al atardecer y en la noche. En S2 las H se registró principalmente en la noche, mientras que los M y las C visitaron los comederos al atardecer además de la noche (fig. 3B). Para ambos sitios, se registró el consumo de P. sapota, B. alicastrum y A. butyracea por parte del tepezcuintle.
Cabe destacar que en S1 se encontró un comedero de plántulas de P. sapota, es decir, que los cotiledones adheridos a la planta fueron consumidos por el tepezcuintle y no el fruto como tal. En S1 (fig. 3C), los comederos de P. sapota fueron los más frecuentados por parte de H y M (68.7 y 50.7%, respectivamente). Las C frecuentaron más los comederos de A. butyracea (88.9%). Todos los individuos visitaron los comederos de plántulas de P. sapota. Sin embargo, los M lo hicieron con mayor frecuencia (42.7%) seguidos de las H y C (16.4 y 5.6%, respectivamente). Las HC visitaron los comederos de P. sapota, B. alicastrum y plántulas de P. sapota siendo este último el que presentó mayor frecuencia de visitas. Las HM solo se registraron en comederos de P. sapota y plántulas de este árbol, siendo los primeros los que mostraron mayor porporción. En S2 (fig. 3D), los comederos de P. sapota fueron los más frecuentados (> 65% en todos los casos) seguidos por los de A. butyracea (9-25%) y en menor proporción los de B. alicastrum (8%). Para este sitio, solo se registró el consumo de B. alicastrum por parte de las H. Los M y C solo consumieron P. sapota y A. butyracea. Las HC se registraron en comederos de A. butyracea y P. sapota, mientras que las HM y MC solo se registraron en comederos de P. sapota.
Se registraron comederos a una distancia entre 0 y 80 m del cuerpo de agua más cercano en línea recta. Sin embargo, en S2 no se registraron comederos dentro del intervalo de 20 a 60 m del agua. Independientemente del consumo de frutos, tanto en S1 como en S2 los comederos a 0-20 m del agua fueron visitados con mayor frecuencia por todos los individuos (fig. 3D, F). Aquellos comederos a 60-80 m del agua, fueron los segundos más frecuentados cuando se registró el consumo de frutos en ambos sitios a excepción las C de S1. En S1, los comederos que presentaron mayor frecuencia de visitas por parte de H y M fueron aquellos bajo los árboles que tiraban el fruto, mientras que las C visitaron más los comederos bajo enredaderas. El registro de HC se presentó con mayor frecuencia en los comederos bajo árboles que tiraban el fruto. Las HM solo se registraron bajo árboles que tiraban el fruto. En el S2, los comederos bajo raíces de árboles en pie fueron visitados con mayor frecuencia por las H, mientras que los M y C frecuentaron más los comederos bajo construcciones humanas. Las HC visitaron con mayor frecuencia los comederos bajo árboles que tiraban el fruto. Por otra parte, solo se detectaron visitas de HC, en los comederos bajo raíces de árboles en pie, mientras que los MC solo se registraron en comederos bajo construcciones humanas.
Tabla 2
Registro de conductas observadas de tepezcuintles (Cuniculus paca) en los comederos en la selva Lacandona, Chiapas, México en el periodo enero-junio 2016.
|
Conductas |
Consumo de alimento |
Ejido Reforma Agraria * |
REBIMA |
||||
|
♀ y C |
♀ y ♂ |
♂ y C |
♀ y C |
♀ y ♂ |
♂ y C |
||
|
Neutra |
Si |
14 |
1 |
0 |
9 |
7 |
0 |
|
No |
8 |
7 |
0 |
16 |
4 |
0 |
|
|
Total |
22 |
8 |
0 |
25 |
11 |
0 |
|
|
Evasiva |
Si |
0 |
0 |
2 |
0 |
0 |
2 |
|
No |
0 |
0 |
0 |
0 |
0 |
0 |
|
|
Total |
0 |
0 |
2 |
0 |
0 |
2 |
|
|
Agonística |
Si |
0 |
0 |
0 |
0 |
0 |
0 |
|
No |
0 |
0 |
0 |
0 |
0 |
1 |
|
|
Total |
0 |
0 |
0 |
0 |
0 |
1 |
|
|
Sexual |
Si |
0 |
1 |
0 |
0 |
0 |
0 |
|
No |
0 |
1 |
0 |
0 |
1 |
0 |
|
|
Total |
0 |
2 |
0 |
0 |
1 |
0 |
* Reserva de la Biosfera Montes Azules

En cuanto a la caracterización de individuos respecto al consumo de alimentos, en S1 las H visitaron aquellos comederos bajo raíces de árboles en pie o entre troncos tirados de P. sapota. Las C presentaron actividad al atardecer en comederos bajo enredaderas y aquellos de A. butyracea. Los M visitaron los comederos al amanecer bajo árboles que tiraban frutos y a una distancia entre 10 y 20 m de árboles que tiraban frutos. Las HC visitaron comederos a una distancia de entre 0 y 10 m de árboles que tiraban frutos. Las HM visitaron los comederos por la noche (fig. 4A). En S2, las H se caracterizaron por alimentarse en la noche y principalmente en los comederos de B. alicastrum. Las C por su parte, se alimentaron al atardecer y al amanecer en comederos de P. sapota. Además, las C procuraron mantenerse en comederos cercanos al agua y a los árboles que tiraban frutos. Los M se distinguieron por alimentarse al atardecer en comederos bajo construcciones humanas y cercanas a los árboles que tiraban frutos. Las HC se caracterizaron por alimentarse principalmente al amanecer y en los comederos de A. butyracea. Las HM visitaron al amanecer los comederos de B. alicastrum. Los machos con cría visitaron comederos de P. sapota al atardecer y los que se encontraron bajo construcciones humanas (fig. 4B).
Los 2 sitios de estudio resultaron tener una asociación significativa con el consumo de alimento de H, HC y HM de tepezcuintles (tabla 3). El tipo de alimento fue la variable incluida en todos los mejores modelos de acuerdo al AIC que se asoció significativamente al consumo de alimento. Sin embargo, el sitio también se asoció significativamente en 4 de los 5 grupos analizados (tabla 4). En S1 el tipo de alimento se asoció significativamente al consumo de frutos en todos los individuos excepto en las H (tabla 5). Para S2, la variable que se asoció significativamente al consumo de frutos por parte de M, H y C, fue el tipo de alimento. Para M y C, el tipo de comedero también presentó un efecto en el consumo. En el caso de HC y HM, ninguna variable mostró tener un efecto significativo en el consumo de alimento (tabla 5).
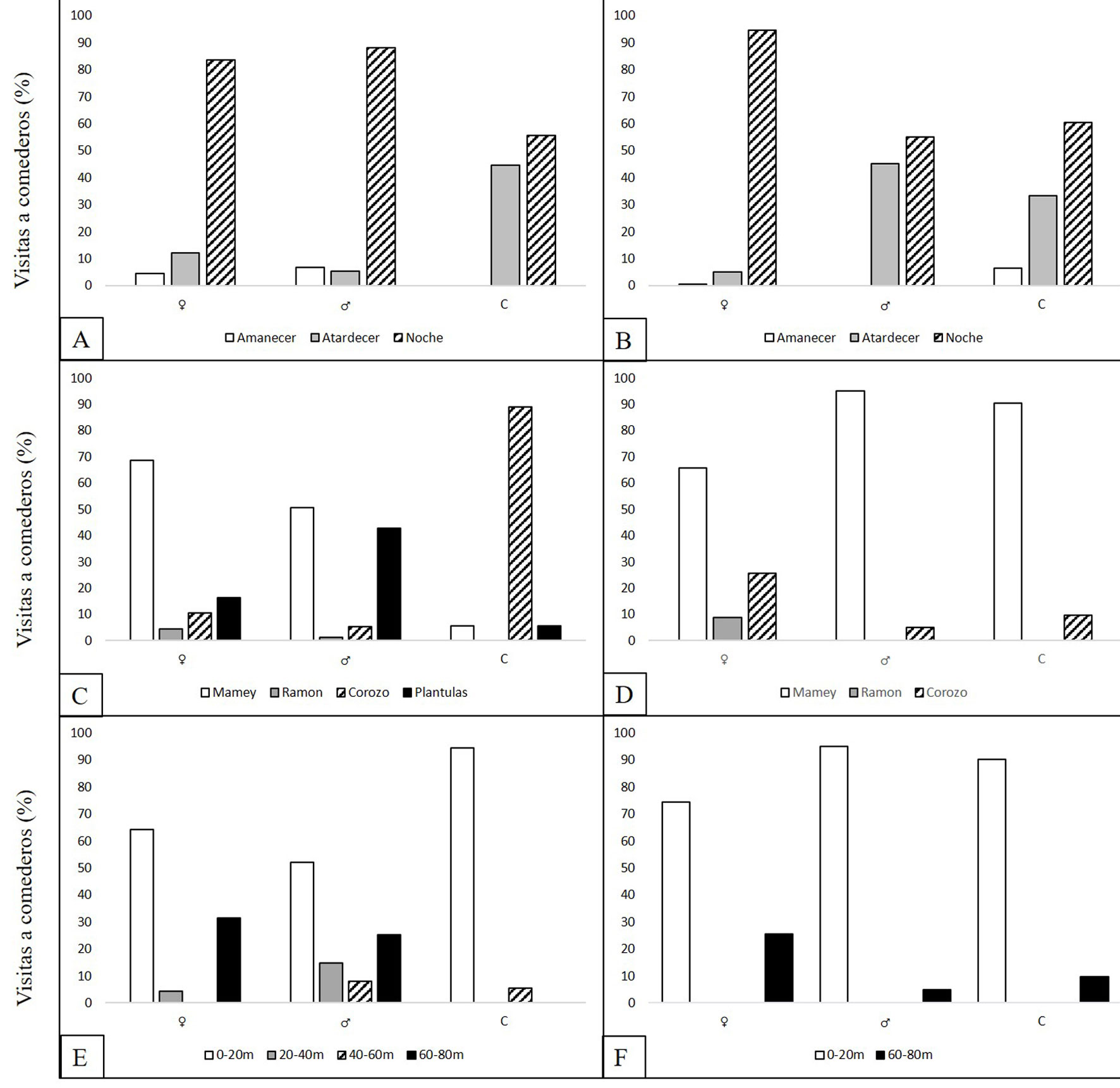
Tabla 3
Efecto del sitio en el consumo de alimento por parte de tepezcuintles (Cuniculus paca) en la selva Lacandona, Chiapas, México, en el periodo enero-junio 2016, estimado mediante el Modelo Lineal Generalizado.
|
Categoría |
N |
Coeficiente |
p |
AIC |
|
Hembras |
584 |
-0.5007 |
0.0065 |
803.04 |
|
Machos |
262 |
-0.2546 |
0.34 |
362.38 |
|
Crías |
593 |
-0.3509 |
0.22 |
720.18 |
|
Hembra con cría |
48 |
-1.1956 |
0.0482 |
66.383 |
|
Hembra con macho |
25 |
2.0919 |
0.0294 |
32.68 |
Tabla 4
Selección de los Modelos Lineales Generalizados construidos por distintos conjuntos de variables significativamente asociadas al consumo de alimento de acuerdo a las categorías de los tepezcuintles (Cuniculus paca) en la selva Lacandona, Chiapas, México en el periodo enero-junio 2016.
|
Sexo |
N |
Modelo |
F |
p |
AIC* |
|
Hembras |
584 |
Sitio + horario de actividad + alimento + distancia al agua |
757.84 |
||
|
Horario de actividad |
7.54 |
0.0062 |
|||
|
Distancia al agua |
14.76 |
0.0001 |
|||
|
Alimento |
15.21 |
0.0001 |
|||
|
Sitio |
15.7 |
8.31E-05 |
|||
|
Machos |
262 |
Sitio + tipo de comedero + alimento |
338.81 |
||
|
Alimento |
1.66 |
0.1983 |
|||
|
Sitio |
4 |
0.0462 |
|||
|
Tipo de comedero |
15.49 |
0.0001 |
|||
|
Crías |
593 |
Sitio + horario de actividad + tipo de comedero + alimento |
593.72 |
||
|
Alimento |
6.92 |
0.0087 |
|||
|
Horario de actividad |
9.26 |
0.0024 |
|||
|
Sitio |
19.03 |
1.52E-05 |
|||
|
Tipo de comedero |
80.3 |
< 2.2e-16 |
|||
|
Hembras con cría |
48 |
Sitio + alimento |
54.72 |
||
|
Sitio |
12.11 |
0.0011 |
|||
|
Alimento |
12.61 |
0.0009 |
|||
|
Hembras con macho |
25 |
Alimento + distancia al agua |
30.59 |
||
|
Alimento |
3.73 |
0.0661 |
|||
|
|
Distancia al agua |
7.51 |
0.0119 |
|
*Criterio de información de Akaike
Tabla 5
Selección de los Modelos Lineales Generalizados compuestos por distintos conjuntos de variables significativamente asociadas al consumo de alimento de los tepezcuintles (Cuniculus paca) por sitio en el periodo enero-junio 2016 en la selva Lacandona, Chiapas, México.
|
Tabla 5 Continuación |
||||||
|
Sexo |
Sitio |
N |
Modelo |
F |
p |
AIC* |
|
Sexo |
Sitio |
N |
Modelo |
F |
p |
AIC* |
|
Hembras |
Ejido |
407 |
Horario de actividad + alimento + distancia al agua |
514.91 |
||
|
Alimento |
4.73 |
0.0301 |
||||
|
Distancia al agua |
6.63 |
0.0103 |
||||
|
Horario de actividad |
12.03 |
0.0005 |
||||
|
REBIMA |
177 |
Ninguna variable resulto tener un efecto significativo. |
– |
– |
– |
|
|
Machos |
Ejido |
83 |
Tipo de comedero + alimento |
89.39 |
||
|
Alimento |
16.16 |
0.0001 |
||||
|
Tipo de comedero |
29.37 |
6.14E-07 |
||||
|
REBIMA |
179 |
Tipo de comedero + alimento |
228.5 |
|||
|
Alimento |
3.03 |
0.0832 |
||||
|
Tipo de comedero |
9.56 |
0.0023 |
||||
|
Crías |
Ejido |
516 |
Horario de actividad + tipo de comedero + alimento |
506.95 |
||
|
Alimento |
8.58 |
0.0035 |
||||
|
Horario de actividad |
8.69 |
0.0033 |
||||
|
Tipo de comedero |
79.02 |
<2.2e-16 |
||||
|
REBIMA |
77 |
Alimento + distancia al agua |
83.27 |
|||
|
Alimento |
3.37 |
0.0701 |
||||
|
Distancia al agua |
5.39 |
0.0229 |
||||
|
Hembra con cría |
Ejido |
22 |
Ninguna variable resulto tener un efecto significativo. |
– |
– |
– |
|
REBIMA |
26 |
Alimento |
23.75 |
|||
|
Alimento |
16.75 |
0.0004 |
||||
|
Hembra con macho |
Ejido |
11 |
Ninguna variable resulto tener un efecto significativo. |
– |
– |
– |
|
REBIMA |
14 |
Alimento + distancia al agua |
15.53 |
|||
|
Distancia al agua |
7.8 |
0.0174 |
||||
|
|
Alimento |
8.95 |
0.0122 |
* Criterio de información de Akaike
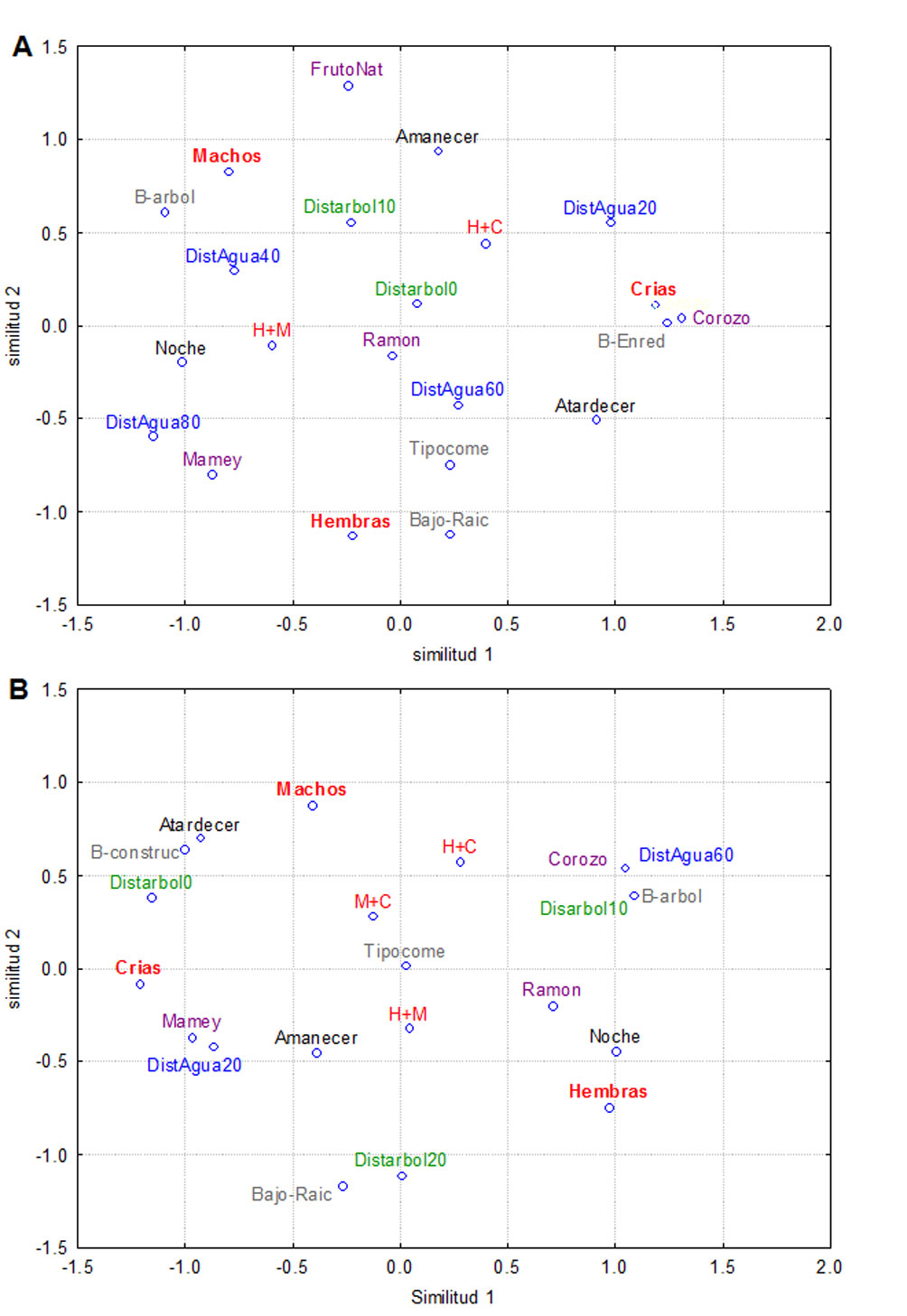
Figura 4. Análisis de escalamiento multidimensional donde se registró consumo de alimento por tepezcuintles (Cuniculus paca) en la selva Lacandona, Chiapas en el periodo enero-junio 2016. Para el análisis de la Reserva de la Biosfera de Montes Azules (A), se eliminaron las variables distancia de los comederos al árbol 20-40 m, comederos bajo construcciones humanas y encuentros de machos con crías. Para el ejido Reforma Agraria (B), se eliminaron las variables la distancia de los comederos al agua de 20-40 m y de 40-60 m; los comederos que se encontraban bajo raíces y aquellos que eran de plántulas de P. sapota. Letras negras = horarios de actividad, grises = tipos de comedero, morado = especie de fruto, rojos = categorías de individuos, azules = distancia al agua, verdes = distancia al árbol que tira el fruto (apéndice).
Discusión
La diferencia entre sitios en el número de registros obtenidos (S1 = 599, S2 = 1,147) pudo deberse a que en S2 los fragmentos de selva son muy reducidos y la movilidad de los tepezcuintles pudo limitarse a esas áreas. Además, este estudio se realizó durante la estación seca, por lo que la cobertura vegetal fue menos densa que en lluvias, lo que aumentó la probabilidad de foto captura (Gallina et al., 2012). Sin embargo, estas diferencias no necesariamente reflejan una mayor actividad o número de individuos de un sitio sobre otro. En cuanto a individuos, el que las hembras hayan presentado mayor frecuencia de visitas a los comederos posiblemente se debió a que centraron su actividad en el núcleo de su ámbito hogareño, donde normalmente encuentran alimento (Beck-King et al., 1999). Otra explicación posible es la proporción de sexos que presentan los tepezcuintles (2♀:1♂; Wallace et al., 2010), ya que pudo haber influido en el número de registros obtenidos.
En S1, el número de registros de M y H fue similar, mientras que las C presentaron la menor frecuencia de visitas. Esto posiblemente se explica por presencia de depredadores como Panthera onca (jaguar) y Leopardus pardalis (ocelote) en los comederos, lo cual limitaría el consumo de alimento por parte de las C ya que son más propensas a la depredación, tal y como se ha observado con las crías de Dasyprocta leporina (guaqueque alazán o brasileño) y D. punctata (sereque; Silvius y Fragoso, 2003; Smythe, 1970). En S2, las C aparecieron con mayor frecuencia respecto a S1, lo que pudo deberse a que uno de los comederos donde se registró un gran número de visitas también fue utilizado como madriguera (entre las raíces de M. indica), y cerca de este lugar se encontraron 2 comederos más (≤ 50 m). Esto sugiere que las crías pudieron visitar varios comederos y utilizarlos para descansar tal como se ha observado con crías de D. punctata (Smythe, 1970; Wallace et al., 2010). La superposición de la dieta del tepezcuintle con otras especies como los marsupiales o los dasipróctidos podría explicar los registros de P. opossum y Didelphis sp. en los comederos (Santos y Pérez, 2013; Pérez, 1992). El comportamiento del tepezcuintle ante la presencia de estos individuos es común, ya que P. opossum se retira ante la presencia de estos roedores, mientras que los tepezcuintles suelen huir cuando se sienten amenazados o asustados (Muñoz et al., 2002; Smythe, 1970).
En S1 no se registraron encuentros de tepezcuintles con otras especies, no obstante, se observó el consumo de frutos por parte de D. punctata en los mismos sitios que el tepezcuintle, lo cual sugiere una competencia indirecta por los recursos, aunque se han reportado diferencias en la cantidad de alimento consumido, así como en el horario de actividad (Muñoz et al., 2002; Santos y Pérez, 2013; Smythe, 1970). Asimismo, el tepezcuintle invierte mayor tiempo en la búsqueda y consumo de alimento y evita lugares donde se encuentra D. punctata (Santos y Pérez, 2013; Smythe, 1970), permitiendo así que la competencia por los recursos sea reducida y permita su coexistencia.
Aunque el tepezcuintle se considera nocturno y solitario, en ocasiones se le ha observado en parejas o hembras acompañadas de sus crías (Emmons, 1997; Pérez, 1992), tal como se observó en este estudio. En un comedero se llegaron a registrar 2 o 3 individuos, aunque no se observó el consumo de alimento. No obstante, en los encuentros MC se observó una conducta agonística del M hacia la C, posiblemente porque el M tiende a ser territorial y puede mostrar poca tolerancia hacia otros individuos jóvenes (Smythe, 1991). Esto se contrapone a lo observado en poblaciones de Dasyprocta sp., donde los machos pueden ser tolerantes a la presencia de hembras y juveniles pero no a la de otros machos (Smythe, 1970). Sin embargo, en estudios de tepezcuintle realizados en cautiverio se ha observado que si el M no es agresivo, se pueden mantener grupos familiares e incluso pueden proteger a las C dejándolas que tomen su alimento o lo consuman primero (Sabatini y Paranhos, 2001). En cuanto al comportamiento sexual, estudios realizados en cautiverio han descrito que el macho hace varios intentos de monta antes de lograr la cópula con la hembra (Matamoros, 1980; Sabatini y Paranhos , 2001). Para ello el macho se levanta en sus patas traseras llevando el cuerpo hacia adelante e intenta copular con la hembra, lo cual coincide con lo observado en este estudio. Lo anterior sugiere que los comederos pueden ser un punto de encuentro de machos y hembras, aunque esto solo se registró en un par de ocasiones.
Nuestros datos muestran que los tepezcuintles visitaron los comederos predominantemente en la noche, como lo sugirió Smythe (1991), aunque también mostraron actividad al atardecer y amanecer, registrándose visitas de 19:00 a 7:00 h que coincide con los intervalos de horarios observados en otros estudios (Michalski y Norris, 2011; Muñoz et al., 2002; Santos y Pérez, 2013; Zucaratto et al., 2010). Los horarios de actividad del tepezcuintle observados en este estudio podrían estar relacionados con la disminución de la competencia inter e intraespecífica por los recursos. En el primer caso, Dubost y Henry (2006) reportaron que otros caviomorfos como Dasyprocta sp. y el acuchí rojo (Myoprocta acouchy) aunque utilizan distintos hábitats, compiten con el tepezcuintle por los recursos. La partición temporal también puede deberse a la presencia de depredadores, por lo que las presas disminuyen el tiempo de consumo o se alimentan en sitios más seguros (Kronfeld y Dayan, 2003). Las diferencias en los horarios de actividad entre los individuos de tepezcuintle pueden deberse a que utilizaron distintos recursos o a la susceptibilidad que tienen a la depredación (Kronfeld y Dayan, 2003). Las C probablemente evitaron los comederos en la noche por la presencia de depredadores como L. pardalis que pueden acecharlas, por lo que optan por alimentarse al atardecer o al amanecer. De hecho, Santos y Pérez (2013) observaron una relación inversa entre la presencia del tepezcuintle y sus depredadores.
Los comederos de P. sapota fueron los más frecuentados por los tepezcuintles seguidos de los de A. butyracea y B. alicastrum, respectivamente, lo que posiblemente se debió a la temporada de fructificación y a la recompensa del alimento. P. sapota pudo representar un recurso importante debido al alto contenido de carbohidratos y por ende, una recompensa inmediata tal y como se observó en el trabajo de Camargo y Mendoza (2016). En este estudio se observó la fructificación de P. sapota durante todo el periodo de muestreo, lo que también pudo influir en la frecuencia de visitas.
El tipo de alimento influyó en el consumo, debido posiblemente a que es seleccionado dependiendo del tiempo invertido para su manipulación, el aporte energético y nutricional que otorga a los tepezcuintles y la disponibilidad del mismo (fenología de las plantas). Las C utilizaron con mayor frecuencia sus manos, en comparación con los adultos, para sujetar los alimentos y no se observó que éstas pudieran romper semillas de P. sapota o A. butyracea para consumirlas. Lo anterior se traduce en mayor tiempo en la manipulación del alimento. Las H por su parte, visitaron con mayor frecuencia los comederos de B. alicastrum donde no se realizó un acarreo sino que consumieron inmediatamente los frutos. Lo anterior probablemente se debió a que se trató de un alimento poco redituable y de menor tamaño, ya que se ha observado en otros roedores que solo acarrean y almacenan aquellos alimentos, principalmente semillas, que representan un mayor aporte energético (Wang y Yang, 2015).
En S1, M y H aumentaron su frecuencia de visitas a los comederos de A. butyracea, pero no realizaron un consumo. Esto pudo deberse a patrullajes, los cuales permitirían la familiarización con el medio y en su caso, realizar el marcaje de territorio tal y como se ha observado con otros roedores (Aliaga-Rossel et al., 2008). Además, el estado del fruto en descomposición pudo influir en la baja frecuencia de consumo, pues en cautiverio se ha observado que los tepezcuintles prefieren frutos frescos y con altos contenidos de grasa (Laska et al., 2003). Las C visitaron más los comederos de P. sapota pero no consumieron el fruto, probablemente debido a su falta de experiencia en la manipulación de los frutos y en la dificultad para digerir las semillas y frutos inmaduros de P. sapota; se ha observado en otros roedores que los juveniles no pueden aprovechar alimentos que los adultos ingieren, ya que son más vulnerables a metabolitos secundarios (Sabatini y Paranhos, 2001). Es importante mencionar que en este estudio se registró el consumo de cotiledones de P. sapota, los cuales aún se encontraban adheridos a las plántulas lo que sugiere que el tepezcuintle también aprovecha estas estructuras ante la escasez de frutos.
En ambos sitios, el tepezcuintle frecuentó más aquellos comederos que se encontraron cercanos al agua, independientemente del consumo de frutos. Esto pudo deberse a que éstos utilizan los cuerpos de agua como ruta de escape ante los depredadores naturales y los cazadores (Aquino et al., 2012; Figueroa-de León, 2016a; Huanca et al., 2011). Además, el tepezcuintle requiere del agua para realizar otras actividades como defecar, orinar e hidratarse (Matamoros, 1980; Muñoz et al., 2002; Sabatini y Paranhos, 2001). Sin embargo, como lo menciona Emmons (1997), en ocasiones se puede observar a los tepezcuintles alejados del agua, hasta 80 m en este estudio.
En S1, los tepezcuintles adultos visitaron con mayor frecuencia aquellos comederos bajo árboles que tiraban frutos, aunque estos comederos no estuvieran bajo alguna estructura específica, ni cobertura vegetal que les brindara protección ante los depredadores. En poblaciones de D. leporina en Brasil, se observó que los sitios de alimentación se encontraban siempre cerca de refugios como troncos tirados (Silvius y Fragoso, 2003). En S2, los tepezcuintles visitaron con mayor frecuencia los comederos que les brindaban cierta protección bajo raíces de árboles en pie o bajo construcciones humanas, ya que los depredadores naturales son escasos en este sitio
En este estudio, observamos que los tepezcuintles utilizan diferentes conductas al alimentarse. Al no ser animales sociales, al momento de consumir alimento, éstos deben ajustar sus conductas de tal manera que les permita el mayor tiempo de consumo en los sitios más rentables, ya que la vigilancia antidepredatoria reduce la eficiencia en la búsqueda y consumo de alimento (Byrne y Chamberlain, 2012). Se ha observado que los dasipróctidos utilizan áreas de su ámbito hogareño que parecían marginales cuando la disponibilidad de frutos aumenta y generalmente cerca de sus refugios (Dubost et al., 2005; Silvius y Fragoso, 2003; Wallace et al., 2010).
En conclusión, se demostró que la actividad humana y el tipo de alimento en el área de estudio tuvieron un efecto en la frecuencia de consumo por parte de los tepezcuintles. Estos roedores no son exclusivamente solitarios al alimentarse, ya que se observaron parejas e incluso hasta 3 individuos visitando los comederos. Asimismo, cuentan con distintos comportamientos alimentarios que les permitirían reducir la competencia intra e intraespecífica por el alimento. Finalmente, es importante llevar a cabo estudios más detallados sobre hábitos alimenticios del tepezcuintle en vida silvestre, principalmente en aquellos sitios donde la fragmentación del hábitat y las actividades humanas son acentuadas. Será importante analizar la manera en que los tepezcuintles utilizan su territorio durante la búsqueda y consumo de alimento y su relación con la fenología de las plantas, la presencia de competidores y depredadores. Dichos estudios aportarán información útil para un manejo integral de la especie y su hábitat que aseguren la supervivencia de sus poblaciones en sitios fuera de las áreas naturales protegidas.
Agradecimientos
Al Consejo Nacional de Ciencia y Tecnología por la beca otorgada a la primera autora. A la dirección de la Reserva de la Biosfera Montes Azules y a la Comisión Nacional de Áreas Naturales Protegidas por el permiso otorgado para ingresar al área protegida. Gracias al ejido Reforma Agraria y a sus guías de campo: Benjamín Hernández, David Hernández, Sergio y Celedonio Chan, y especialmente a Avril Figueroa de León por su apoyo.
Apéndice. Atributos estimados en comederos de tepezcuintle (Cuniculus paca) bajo árboles de Pouteria sapota, Brosimum alicastrum y Attalea butyracea en la selva Lacandona, Chiapas, México en el periodo enero-junio 2016.
|
Variables |
Categorías |
Descripción |
|
Especie registrada |
Especie vegetal del fruto que se encuentra en el comedero |
|
|
Estado de fruto |
1. Inmaduro |
No está en su punto óptimo para ser consumido. |
|
2. Maduro |
En el estado ideal para ser consumido. |
|
|
3. Podrido |
Ya paso su estado de madurez y presenta un estado de putrefacción. |
|
|
Cantidad de fruto |
1.Escaso |
Apenas se encuentra un par de frutos en el sitio y han sido manipulados por el tepezcuintle; |
|
2.Medio |
Producción de fruto estándar o “normal” en cada ciclo y dependiendo de la especie vegetal a la cual se haga referencia |
|
|
3.Abundante |
La planta tiene una producción de frutos mayor a como se ha observado en años anteriores o incluso en comparación con otros árboles de la misma especie que estén fructificando al mismo tiempo |
|
|
Tipo de comedero |
1. Bajo enredaderas |
Protegidos con lianas y bejucos y eran de difícil acceso. |
|
2. Bajo raíces de árboles en pie |
Las raíces son numerosas y le brindan protección al roedor permitiéndole comer entre estas estructuras. |
|
|
3. Bajo construcciones humanas |
El comedero fue establecido bajo estructuras de edificaciones humanas, por ejemplo bajo estufas de leña. |
|
|
4. Bajo árboles que tiran frutos |
Se refiere al área bajo la copa del árbol y cuyos frutos son consumidos en el mismo sitio donde caen. |
|
|
Cobertura del dosel |
% de cobertura |
Se tomaron 4 medidas a partir del centro del comedero a 3m hacia los 4 extremos del mismo utilizando un densitómetro. De dichas medidas se sacó un promedio y se multiplicó por 1.04. El resultado se le restó a 100 para sacar un porcentaje de cobertura (Byrne y Chamberlain, 2012). |
|
Distancia al árbol tirando |
m |
Se estimó la distancia en línea recta al árbol que estaba tirando el fruto. |
|
Distancia al agua |
m |
Se estimó la distancia perpendicular al cuerpo de agua más cercano al comedero. |
|
Distancia a actividades humanas |
m |
Se estimó la distancia perpendicular a actividades humanas (potreros, parcelas, asentamientos humanos o caminos). |
Referencias
Aliaga-Rossel, E., Kays, R. y Fragoso, J. (2008). Home-range use by the central American agouti (Dasyprocta punctata) on Barro Colorado Island, Panama. Journal of Tropical Ecology, 24, 367–374. https://doi.org/10.1017/S0266467408005129
Aquino, R., Meléndez, G., Pezo, E. y Gil, D. (2012). Tipos y formas de ambientes de dormir de majás (Cuniculus paca) en la cuenca alta del río Itaya. Revista Peruana de Biología, 19, 27–34. https://doi.org/10.15381/rpb.v19i1.800
Beck-King, H., Helversen, O. y Beck-King, R. (1999). Home range, population density, and food resources of Agouti paca (Rodentia: Agoutidae) in Costa Rica: a study using alternative methods. Biotropica, 31, 675–685. https://doi.org/10.1111/j.1744-7429.1999.tb00417.x
Byrne, M. y Chamberlain, M. (2012). Using first-passage time to link behaviour and habitat in foraging paths of a terrestrial predator, the racoon. Animal Behaviour, 84, 593–601. https://doi.org/10.1016/j.anbehav.2012.06.012
Camargo, A. y Mendoza, E. (2016). Interactions between terrestrial mammals and the fruits of two neotropical rainforest tree species. Acta Oecologica, 73, 45–52. https://doi.org/10.1016/j.actao.2016.02.005
Crawley, M. (2005). Statistics. An introduction using R. Chichester, West Sussex, England. John Wiley & Sons
Dubost, G. y Henry, O. (2006). Comparison of diets of the acouchy, agouti and paca, the three largest terrestrial rodents of French Guianan forests. Journal of Tropical Ecology, 22, 641–651. https://doi.org/10.1017/s0266467406003440
Dubost, G., Henry, O. y Comizzoli, P. (2005). Seasonality of reproduction in the three largest terrestrial rodents of French Guiana forest. Mammalian Biology, 70, 93–109. https://doi.org/10.1016/j.mambio.2004.09.001
Emmons, H. (1997). Paca. Agouti paca. En H. Emmons (Ed), Neotropical rainforest mammals. A field guide (pp. 224–225) Chicago: University of Chicago Press.
Figueroa-de León, A., Naranjo, E. J., Perales, H., Santos-Moreno, A. y Lorenzo, C. (2016a). Cavity occupancy by lowland paca (Cuniculus paca) in the Lacandon Rainforest, Chiapas, Mexico. Tropical Conservation Science, 9, 246–263. https://doi.org/10.1177/194008291600900113
Figueroa-de León, A., Naranjo, E. J., Perales, H., Santos-Moreno, A. y Lorenzo, C. (2016b). Availability and characterization of cavities used by pacas (Cuniculus paca) in the Lacandon Rainforest, Chiapas, Mexico. Revista Mexicana de Biodiversidad, 87, 1062–1068. https://doi.org/10.1016/j.rmb.2016.07.009
Gallina, S. (1981). Contribución al conocimiento de los hábitos alimenticios del tepezcuintle (Agouti paca Lin.) en Lacanjá-Chansayab, Chiapas. En P. Reyes-Castillo (Ed.), Estudios ecológicos en el trópico mexicano (pp. 58–67). México D.F.: Instituto de Ecología, A.C.
Gallina, S., Pérez-Torres, J. y Guzmán-Aguirre, C. (2012). Use of the paca, Cuniculus paca (Rodentia : Agoutidae) in the Sierra de Tabasco State Park, Mexico. Revista de Biología Tropical, 60, 1345–1355. https://doi.org/10.15517/rbt.v60i3.1812
García, A. B. y González, O. (2015). Uso y conservación del territorio. En J. Cruz-Morales (Eds.), Una entrada a la selva: ejido Reforma Agraria, Marqués de Comillas, Chiapas (pp. 4–5). México D.F.: Universidad Autónoma de Chapingo.
Huanca, G., Herrera, J. C. y Noss, A. J. (2011). Densidad poblacional y uso de hábitat del jochi pintado (Cuniculus paca) en la zona norte de la unidad de conservación Amboró-Carrasco. Ecología en Bolivia, 46, 4–13.
Instituto Nacional de Ecología. (2000). Programa de Manejo Reserva de la Biosfera de Montes Azules México. México D.F.: Instituto Nacional de Ecología, Semarnap.
Kronfeld, N. y Dayan, T. (2003). Partitioning of time as an ecological resource. Annual Review of Ecology, Evolution, and Systematics, 34, 153–181. https://doi.org/10.1146/annurev.ecolsys.34.011802.132435
Lambert, T. D., Kays, R. W., Jansen, P. A., Aliaga-Rossel, E. y Wikelski, M. (2009). Nocturnal activity by the primarily diurnal Central American agouti (Dasyprocta punctata) in relation to environmental conditions, resource abundance and predation risk. Journal of Tropical Ecology, 25, 211–215. https://doi.org/10.1017/s0266467408005804
Laska, M., Luna-Baltazar, J. M. y Rodríguez-Luna, E. (2003). Food preferences and nutrient composition in captive pacas, Agouti paca (Rodentia, Dasyproctidae). Mammalian Biology – Zeitschrift für Säugetierkunde, 68, 31–41. https://doi.org/10.1078/1616-5047-00059
Lima, S. L. (1998). Stress and decision making under the risk of preation: recent developments from behavioral reproductive, and ecological perspectives. Advances in the Study of Behavior, 27, 215–257. https://doi.org/10.1016/s0065-3454(08)60366-6
Matamoros, Y. (1980). Contribucion al estudio de la biologia del tepezcuintle (Cuniculus paca) en cauitverio (Tesis). Facultad de Ciencias, Escuela de Biolgía, Universidad de Costa Rica. San José.
Michalski, F. y Norris, D. (2011). Activity pattern of Cuniculus paca (Rodentia: Cuniculidae) in relation to lunar illumination and other abiotic variables in the southern Brazilian Amazon. Zoologia, 28, 701–708. https://doi.org/10.1590/s1984-46702011000600002
Muñoz, J., Betancur, O. y Duque, M. (2002). Patrones de hábitat y de acividad nocturna de Agouti paca en el Parque Nacional Natural Utría (Chocó, Colombia). Actualidades Biológicas, 24, 75–85.
Naranjo, E. J. (2008). Uso y conservación de mamíferos en la selva Lacandona, Chiapas, México. En C. Lorenzo, E. Espinoza y J. Ortega (Eds.), Avances en el estudio de los mamíferos de México (pp. 675–692), México D.F.: Asociación Mexicana de Mastozoología.
Parroquín, J., Gallina, S., Aguirre, G. y Pérez-Torres, J. (2010). El tepezcuintle: estrategias para su aprovechamiento con base en la evaluación de su población y hábiat en el ejido Loma de Oro, Uxpanapa, Veracruz, México. En M. Guerra-Roa, S. Calmé, S. Gallina-Tessaro y E. J. Naranjo (Eds.), Uso y manejo de fauna silvestre en el norte de Mesoamerica (pp. 137–160). México D. F.: Secretaría de Educación de Veracruz, Gobierno del Estado de Veracruz.
Pérez, E. (1992). Agouti paca. Mammalian Species, 404, 1–7. https://doi.org/10.2307/3504102
R Core Team (2016). A languaje and environment for statistical computing. Vienna, Austria: R Fundation for Statistical Computing.
Ríos, M. y Pérez-Torres, J. (2015). Dieta de las especies dominantes del ensamblaje de murcielagos frugívoros en un bosque seco tropical (Colombia). Mastozoología Neotropical, 22, 103–111.
Sabatini, V. y Paranhos, M. (2001). Etograma da paca (Agouti paca, Linnaeus, 1766) em cativeiro. Revista de Etologia, 3, 3–14.
Santos, A. y Pérez, G. (2013). Abundancia de tepezcuintle (Cuniculus paca) y relación de su presencia con la de competidores y depredadores en una selva tropical. Therya, 4, 89–98. https://doi.org/10.12933/therya-13-97
Schooley, R. L., Sharpe, P. B. y Van Horne, B. (1996). Can shrub cover increase predation risk for a desert rodent? Canadian Journal of Zoology, 74, 157–163. https://doi.org/10.1139/z96-020
Sih, A. (2013). Understanding variation in behavioural responses to human-induced rapid environmental change: a conceptual overview. Animal Behaviour, 85, 1077–1088. https://doi.org/10.1016/j.anbehav.2013.02.017
Silvius, K. y Fragoso, J. (2003). Red-rumped Agouti (Dasyprocta leporina) home range use in a Amazon Forest: implications of the aggregated distribution of forest trees. Biotropica, 35, 74–83. https://doi.org/10.1111/j.1744-7429.2003.tb00264.x
Smythe, N. (1970). Ecology and behavior of the agouti (Dasyprocta punctata) and related species on Barro Colorado Island, Panama (Tesis doctoral). University of Maryland. EUA.
Smythe, N. (1991). Dasyprocta punctata y Agouti paca (guatusa, cherenga, agouti, tepeizcuinte, paca). En D. Janzen (Ed.), Historia natural de Costa Rica (pp. 477–499) San José, Costa Rica: Editorial de la Universidad de Costa Rica.
Statistical Package for Social Sciences. (2012) . IBM SPSS Statistics.
StatSoft, I. (2008). STATISTICA (Data analysis software system).
Wallace, R., Aliaga-Rossel, E., Viscarra, M. E. y Siles, T. (2010). Cuniculidae, Dasyproctidae, Dinomyidae y Myocastoridae. En R. Wallace (Ed.), Distribución, ecología y conservación de los mamíferos medianos y grandes de Bolivia (pp. 731–761) Santa Cruz de la Sierra: Centro de Ecología.
Wang, B. y Yang, X. (2015). Seed removal by scatter-hoarding rodents: the effects of tannin and nutrient concentration. Behavioural Processes, 113, 94–98. https://doi.org/10.1016/j.beproc.2015.01.012
Zucaratto, R., Carrara, R. y Siqueira, B. (2010). Dieta da paca (Cuniculus paca) usando métodos indiretos numa área de cultura agrícola na Floresta Atlántica brasileira. Biotemas, 23, 235–239. https://doi.org/10.5007/2175-7925.2010v23n1p235



