Yury Glebskiy, Daniel Dorantes-Villalobos y Zenón Cano-Santana *
Laboratorio de Interacciones y Procesos Ecológicos, Departamento de Ecología y Recursos Naturales, Facultad de Ciencias, Universidad Nacional Autónoma de México, Circuito Exterior s/n, Coyoacán, 04510 Ciudad de México, México
*Autor para correspondencia: zcs@ciencias.unam.mx (Z. Cano-Santana)
Recibido: 5 noviembre 2019; aceptado: 30 abril 2020
Resumen
La reproducción requiere grandes cantidades de energía, por lo que muchos organismos buscan las temporadas idóneas para realizarla. Por ejemplo, se espera que cada población del conejo castellano, Sylvilagus floridanus, ajuste su ciclo de vida para reproducirse en la temporada del año más adecuada, la cual puede variar dependiendo de las condiciones del sitio donde cada una vive. El objetivo de este estudio fue conocer en qué momento del año se reproduce esta especie de conejo en el matorral xerófilo del Pedregal de San Ángel, Ciudad de México, con base en un análisis de variación estacional de la abundancia y tamaño de sus excretas. Se hicieron muestreos mensuales de abundancia de heces en sitios establecidos por 4 años, y durante el primer año, también se registró el tamaño de las excretas. Se analizaron los datos usando una prueba de χ2. Se registró que las pastillas fecales pequeñas se concentran en septiembre y que los mayores valores de abundancia se registraron entre octubre y diciembre. Los datos sugieren que el periodo reproductivo sucede en agosto, que es un mes de mayor disponibilidad de alimento. Los datos obtenidos no coinciden con la temporada reproductiva que registra esta especie en otras localidades.
Palabras clave: Tamaño poblacional; Matorral xerófilo; Pedregal de San Ángel; REPSA
© 2020 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Reproductive period of the eastern cottontail, Sylvilagus floridanus, in a lava field in México City through the analysis of the seasonal variation of the abundance and size of its feces
Abstract
Reproduction requires large amounts of energy, so many organisms look for the ideal season to carry out this process. For example, each population of the Eastern Cottontail, Sylvilagus floridanus, is expected to adjust its life cycle to reproduce in the most suitable season of the year, which may vary depending on the particular conditions of the site where each one lives. The objective of this study was to determine at what time of the year this rabbit reproduces in the xerophilous scrub of the Pedregal of San Ángel, México City, based on an analysis of seasonal variation of the abundance and size of its feces. Monthly systematic sampling of abundance of feces was made at established sites for 4 years and, during the first year, the size of excreta was also recorded. Data was analyzed using a χ2 test. It was recorded that small fecal pellets are concentrated in September and that the highest abundance values were recorded between October and December. The data suggest that the reproductive period occurs in August, which is a month of greater food availability. The data obtained do not coincide with the reproductive season recorded by this species in other locations.
Keywords: Population size; Xerophilous shrub; Pedregal de San Ángel; REPSA
© 2020 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
La reproducción en los mamíferos es un proceso que requiere de una gran inversión energética para completarse de forma exitosa (Bronson, 2009). En los ecosistemas con alta estacionalidad, se espera que la desigual disponibilidad de recursos a lo largo del año afecte el momento del año adecuado para que ocurra el nacimiento y la crianza (Bronson, 2009). Para compensar esta dificultad energética muchos mamíferos desarrollaron a lo largo de su historia evolutiva sistemas de reproducción estacional, que les permite reproducirse durante los periodos de mayor abundancia de recursos, tanto para la madre gestante como para las crías (Bronson, 1985, 2009).
Un ejemplo de una especie con este sistema de reproducción es el conejo castellano [Sylvilagus floridanus (J. A. Allen)], un lagomorfo lepórido de muy amplia distribución en Norteamérica (Conaway et al., 1974; Chapman et al., 1980). La biología reproductiva de esta especie ha sido ampliamente estudiada en EUA y se ha encontrado que su época reproductiva varía de acuerdo con la latitud y altitud, pues las poblaciones del norte y de mayor elevación tienen un periodo reproductivo más corto debido a la falta de alimento en invierno (Bond et al., 2004; Conaway et al., 1974; Chapman et al., 1980). También se ha visto que este mismo efecto se da en otras especies de lagomorfos en las zonas desérticas, donde los conejos se reproducen durante la época de lluvias (Powers, 1970; Sowls, 1957), aunque los reportes sobre S. floridanus en ambientes secos son escasos (Cervantes y Vázquez, 2008).
La obtención de datos de la biología y ecología de mamíferos a partir del muestreo y análisis de sus heces tiene las ventajas de no recurrir a la captura y mantenimiento en cautiverio a la fauna silvestre, la cual puede sufrir estrés durante la captura y manipulación. El muestreo de heces es relativamente sencillo y permite conocer la abundancia de una población y de sus fluctuaciones estacionales de manera objetiva (Osbahr, 2010). A partir del análisis de sus heces, se han estudiado diversos aspectos de la ecología de S. floridanus: su distribución (Dorantes-Villalobos, 2017; Trent y Rongstad, 1974), factores que afectan su abundancia (Glebskiy, 2016; Glebskiy et al., 2018; Wainright, 1969) y su dieta (Dalke y Sime, 1941; Glebskiy, 2019). Este tipo de estudios sobre las heces se han realizado para conocer, por ejemplo, el tamaño poblacional de la liebre americana, Lepus americanus Erxleben (Homyack et al., 2006), la distribución del mapache Procyon lotor (Linnaeus) (Hoffmann y Gottschang, 1977) y la distribución, abundancia y dieta del coyote Canis latrans Say (Kays et al., 2008), con muy buena precisión.
A pesar de que S. floridanus está distribuido en gran parte de México, hay pocos estudios sobre la biología reproductiva de esta especie en los ecosistemas mexicanos (Chapman et al., 1980). A la fecha, solo existe el reporte de Cervantes y Vázquez (2008) sobre el periodo reproductivo de los conejos en diversos ecosistemas del municipio de Ixtacuixtla, Tlaxcala, el cual registra una mayor cantidad de hembras preñadas en la primavera y en la época de lluvias. Por otra parte, la temporada reproductiva de este conejo en los ecosistemas de la Ciudad de México no ha sido estudiada, entre las que se haya la Reserva Ecológica del Pedregal de San Ángel (REPSA), en Ciudad Universitaria, a pesar de que en este ecosistema de matorral xerófilo, el conejo castellano tiene gran importancia como modulador de la comunidad vegetal y del ciclo de nutrientes (Cano-Santana, 1994a; Glebskiy, 2019). Por lo anterior, el objetivo de este estudio fue determinar la época reproductiva de S. floridanus dentro de un ecosistema árido de la Ciudad de México, a partir del análisis de la abundancia y tamaño de sus heces. Se espera que durante la temporada de lluvias, cuando hay una mayor disponibilidad de recursos alimentarios (Cano-Santana, 1994b), haya un incremento en la frecuencia en la que se detecten heces de pequeño tamaño pertenecientes a individuos jóvenes (Rueda et al., 2008), tal como lo encontraron Cervantes y Vázquez (2008) en Ixtacuixtla, Tlaxcala.
Materiales y métodos
El estudio se llevó a cabo en la REPSA, un campo de lava originado en el año 280 ± 35 (Siebe, 2009) que se encuentra en la Ciudad de México (19˚19’ N, 99˚11’ O, 2,310 m snm). Tiene una temperatura media anual de 15.6 ˚C y una precipitación media anual de 833 mm (REPSA, 2019). Su clima es templado subhúmedo con lluvias en verano y una estacionalidad marcada, con una temporada seca de noviembre a abril y una lluviosa de mayo a octubre, y la zona sostiene una vegetación de tipo matorral xerófilo (Rzedowski, 1954). La REPSA se encuentra inmersa dentro de la mancha urbana de la Ciudad de México y se encuentra altamente fragmentada (Zambrano et al., 2016), a pesar de lo cual mantiene una población importante de S. floridanus (el único lagomorfo allí existente; Hortelano-Moncada et al., 2009) en sus 3 zonas núcleo y algunas áreas de amortiguamiento (Dorantes-Villalobos, 2017). En este trabajo no se contempló el efecto de la presión antropogénica sobre el periodo reproductivo del conejo castellano, ya que éste se llevó a cabo en zonas muy conservadas de la REPSA.
Sylvilagus floridanus es un conejo de pardo a grisáceo y el vientre y la base de la cola son blancos; el adulto mide 33.5 a 48.5 cm de largo y pesa de 0.9 a 1.8 kg que pueden tener 35 gazapos por año (Chapman et al., 1980; Lorenzo y Cervantes, 2005). Olcott y Barry (2000), con base en datos de medidas del cráneo, encontraron que hay una variación significativa en su tamaño corporal en 3 regiones geográficas ubicadas entre Canadá y el norte de México, y encontraron que en la región que va del suroeste de EUA al norte de México, la talla de los conejos castellanos es mayor en los sitios con un verano más frío y húmedo, en zonas de mayor altitud y donde el invierno registra baja variabilidad en precipitación. Se distribuye en bosques tropicales, bosques templados, matorrales xerófilos y áreas perturbadas por la agricultura y actividades humanas, en altitudes desde 0 hasta los 3,200 m (Lorenzo y Cervantes, 2005). Se alimenta de una gran variedad de plantas y de prácticamente todas sus estructuras, que incluye hojas, tallos, raíces y frutos (Chapman et al., 1980; Hudson et al., 2005). Este animal constituye una presa para muchos carnívoros de medianos a grandes, como los zorros, coyotes, perros y aves rapaces (Chapman et al., 1980; Granados-Pérez, 2008; Lorenzo y Cervantes, 2005).
Se llevaron a cabo 2 periodos de muestreo de la abundancia de heces con un método parecido al que aplicaron Rueda et al. (2008). En un primer periodo se seleccionaron 24 cuadros permanentes de 50 × 50 cm distribuidos equitativamente en 4 parcelas de 10 × 10 m dentro de la zona núcleo poniente separadas entre sí por al menos 50 m localizadas en áreas que mantenían una alta actividad y abundancia de conejos, según datos de Dorantes-Villalobos (2017). En estos cuadros se contaron semanalmente, durante 1 año —del 1 de junio de 2014 al 27 de mayo de 2015— todas las excretas; después de ser contadas, fueron retiradas de los cuadros para garantizar que las que se acumularan en éstos fueran frescas y depositadas recientemente. Con este método se pretendía reconocer la temporada del año en la que el depósito de heces fuera más alto, cuando la abundancia de conejos se incrementase por la adición de juveniles (Fa et al., 1992; Farías-González, 2011; Palomares, 2001). En este muestreo, las heces colectadas en la última semana de cada mes, entre agosto y mayo, fueron llevadas al laboratorio para medir su longitud. Esto con el fin de detectar cómo cambia la frecuencia de heces de distinto tamaño a lo largo del año, considerando que el tamaño de las heces está directamente relacionado con la talla del conejo, de modo que los juveniles depositarían las excretas más pequeñas (Rueda et al., 2008; Simonetti y Fuentes, 1982). Para probar si el periodo reproductivo (ésto es, la temporada de mayor abundancia de heces) se mantenía constante a través de los años, se llevó a cabo un segundo periodo de muestreo de 3 años consecutivos, en el cual se contaron mensualmente, de noviembre de 2016 a mayo de 2019, las heces en 10 cuadros permanentes del mismo tamaño, distribuidas en un área de 70 × 70 m con alta actividad y abundancia de conejos castellanos dentro de la zona núcleo poniente. En este segundo periodo se redujo el número de cuadros debido a la gran cantidad de trabajo que se requería para ello. El número de muestras y el tamaño de la unidad de muestreo se ajustaron, tomando en consideración la alta densidad de heces y el pequeño tamaño de éstas, así como la uniformidad en su abundancia en los sitios seleccionados (Mueller-Dombois y Ellenberg, 1974).
Es muy probable que la detección de heces no sea afectada por el tipo de hábitat o la estación del año, pues se muestreó directamente sobre el piso en sitios planos, que son los que mantienen alta actividad de conejos y bajo la vegetación (Glebskiy et al., 2019). Por otra parte, las heces mantienen su integridad física aún con lluvia (Z. Cano-Santana, obs. pers.). Glebskiy (2016) realizó ensayos de campo que permitieron calcular que las heces mantienen 50% de su peso por 246 días.
Para cada uno de los 4 años de muestreo (acotados entre junio y mayo del año siguiente), se utilizó una prueba de χ2 para determinar si hay diferencias en el número de pastillas colectadas cada mes, bajo la hipótesis nula de equidistribución de la frecuencia de tamaños de heces a lo largo del año. En caso de haber diferencias significativas, se compararon todos los meses del año entre sí usando pruebas pareadas de χ2 con la corrección de Bonferroni (Sokal y Rohlf, 2011). Los conteos semanales del primer año de muestreo se acumularon por mes para poder hacer comparables los datos entre años.
Para determinar si había una relación entre la frecuencia a la que se encontraban heces de distinto diámetro y la fecha de muestreo (meses), éstas se agruparon en 5 categorías de tamaño. Se aplicó una prueba de χ2, para lo cual se calcularon las frecuencias esperadas con una tabla de contingencia de 10 (fechas) × 5 (categorías de tamaño) con los datos obtenidos el primer año de muestreo. En caso de encontrar una relación significativa, se aplicaba una prueba de residuos estandarizados (Siegel y Castellan, 1995). El número de clases (k) fue determinado por el menor valor del número de heces colectado en alguna fecha particular (que fue mayo de 2015, con n = 43 heces) y con la aplicación de la fórmula de Sturges (Scott, 2009): k = (1 + 1.322 log10 n) = 6.4, pero éste se ajustó a 5 debido a que en muchas fechas de muestreo, algunas de las clases registraron valores de frecuencia de 0, lo cual afectaba la efectividad de la aplicación de la prueba de χ2 (Siegel y Castellan, 1995).
Resultados
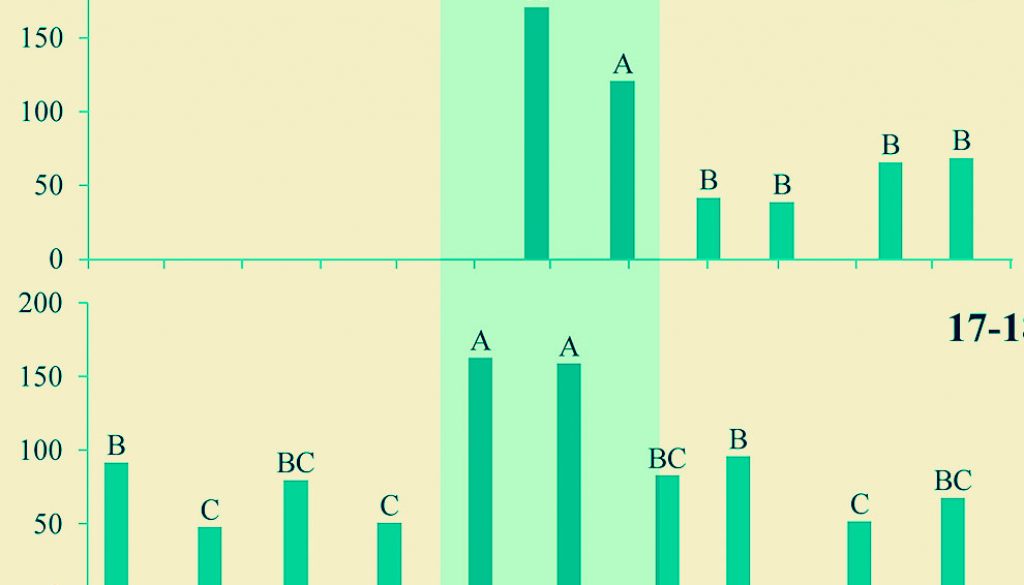
En los 4 años de muestreo, se encontró que la frecuencia a la que se acumulan las heces en los cuadros de estudio permanentes depende significativamente de la fecha (en todos los casos: p < 0.0001). En todos los años se registró alta producción de excretas entre los meses de octubre y diciembre, aunque en la temporada 2014-2015 también se registró alta cantidad de excretas en junio (fig. 1).
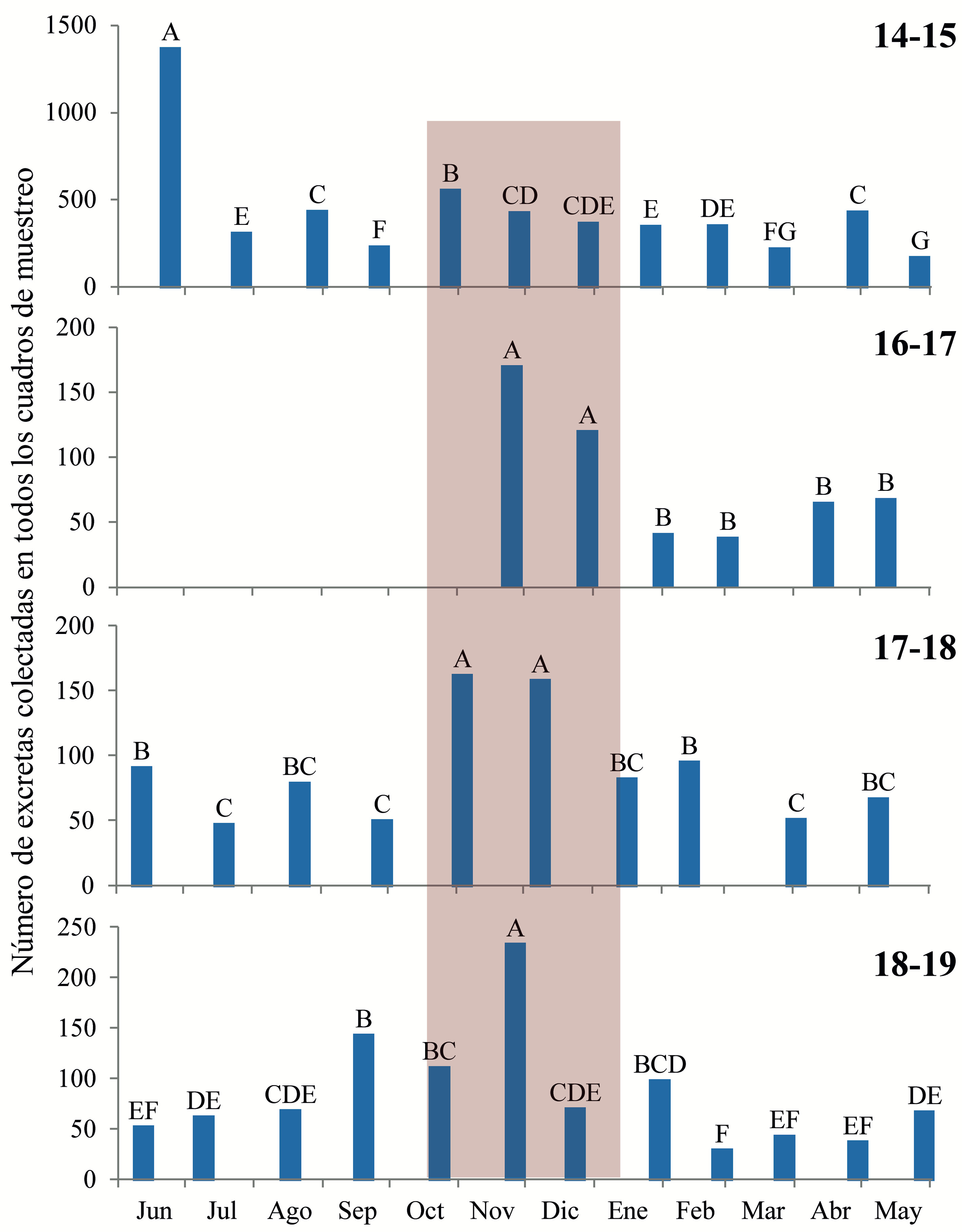
Por otra parte, las heces de los conejos midieron entre 4.2 y 12.0 mm de largo (n = 760). Se encontró que la frecuencia a la que se registran pastillas fecales de distinto diámetro depende significativamente de la fecha de muestreo (χ2 = 137.92, g.l. = 36, p < 0.001; fig. 2). En agosto se registró una frecuencia de heces de la tercera categoría de tamaños (7.32-8.88 mm) más alta que la esperada y una frecuencia de la quinta (> 10.44 mm) más baja que la esperada; en tanto que, en septiembre, se registraron unas frecuencias de excretas de las 2 categorías de tamaño más pequeñas (esto es, < 7.32 mm), así como de la quinta, más altas que las esperadas, mientras que en enero se registra una frecuencia de heces de la segunda categoría de tamaño (5.76-7.32 mm) más baja que la esperada (pruebas de residuos estandarizados).
Discusión
Rueda et al. (2008) sugieren que las excretas de tamaño pequeño pueden ser utilizadas para detectar la actividad de conejos de talla pequeña. Dado lo anterior, la detección de excretas de pequeño tamaño (< 7.32 mm) en septiembre sugiere que en ese mes hubo una mayor cantidad de conejos pequeños, lo cual puede estar asociado a un importante periodo de reproducción en las semanas previas. Al considerar que la gestación de S. floridanus es de 28 días y que salen de su madriguera 15 días después de haber nacido (Chapman et al., 1980), se puede sugerir que entre julio y agosto se da el periodo reproductivo, en el sentido de que en agosto-septiembre nacen los gazapos, a finales de septiembre empiezan a salir de las madrigueras, y entre octubre y diciembre, ya son conejos juveniles que ocasionan el aumento de la cantidad de excretas que se observa de manera sistemática año con año (fig. 1). El comportamiento reproductivo del conejo se relaciona bien con la disponibilidad de alimento, ya que los meses de agosto, septiembre y octubre es cuando se registra una mayor cantidad de biomasa de plantas herbáceas (fig. 3; Cano-Santana, 1994b), las cuales aportan 75.2% de la dieta de para la especie y éstos son los meses donde los conejos pasan por los periodos más susceptibles del ciclo de vida: gestación, lactancia y las primeras semanas de vida de los gazapos (Hudson et al., 2005) (fig. 3). Al mismo tiempo, esto explicaría la disminución de la cantidad de excretas después del pico de abundancia, ya que a partir de noviembre se registran muy pocas lluvias en la zona de estudio lo cual provoca un decaimiento en la disponibilidad de alimento (REPSA, 2019) (fig. 3). No obstante, también podría contribuir la mortalidad asociada al arribo de 2 especies de aves que potencialmente pueden atacar a los conejos: el aguilucho pálido, Circus cyaneus (Linnaeus) y el gavilán palomero, Accipiter cooperii (Bonaparte) (Falconiformes: Accipitridae) (Chávez y Gurrola, 2009), aunque ésto requiere corroboración con datos de campo. Esta estrecha relación entre la disponibilidad de alimento y la abundancia de conejos, ha sido registrada para otras especies del género Sylvilagus, así como para el conejo europeo Oryctolagus cuniculus (Linnaeus) (Dalke y Sime, 1941; Lombardi et al., 2003).
La alta densidad de excretas detectada en junio de 2014 es la excepción a la norma explicada anteriormente. Esto pudo ser debido al registro de una explosión poblacional que experimentó esta especie de conejos en 2013 en la localidad (G. Gil y Z. Cano-Santana, obss. perss.), lo cual fue inferido por la gran cantidad de excretas depositadas en el piso de la REPSA en ese año. En un muestreo realizado en junio de 2013, se registraron 300.1 ± e.e. 56.1 heces/m2 (rango: 0-1375 heces/m2, n = 30) en una parcela de 0.25 ha de la zona núcleo poniente (ZNP; Z. Cano-Santana, datos no publ.). Este depósito masivo de heces no se mantuvo en años subsiguientes, pues al parecer, la población disminuyó en marzo-mayo de 2014, cuando se registró una densidad de heces de 120.5 ± 16.7 m-2 en la ZNP (Glebskiy, 2016).
Un factor adicional que puede explicar la gran abundancia de heces en el periodo octubre-diciembre sería la disponibilidad de alimento, pero, tal como se observa en la figura 3, a partir de octubre se detecta una disminución de la biomasa aérea de plantas herbáceas en la REPSA, por lo cual ese incremento en densidad de heces debe estar relacionado con la abundancia de conejos (Cano-Santana, 1994b). No obstante, es deseable el diseño de estudios que analicen el efecto separado del tamaño poblacional y de la disponibilidad de alimento sobre la tasa de defecación de los conejos.
Estudios previos reportan una gran variación en las épocas reproductivas del conejo castellano (Bond et al., 2004; Conaway et al., 1974; Chapman et al., 1980; Powers, 1970; Trent y Rongstad, 1974; Wainright, 1969), pero éstos se realizaron en EUA y hay muy pocos estudios en México sobre este aspecto. El estudio de la población más cercano a la REPSA es el de Cervantes y Vázquez (2008) en Ixtacuixtla, Tlaxcala, en el que se reporta que la mayor actividad reproductiva de S. floridanus se da de febrero a julio, lo que contrasta con este estudio, que sugiere que ocurre de julio a agosto. Esto resulta congruente si se toma en cuenta que el ecosistema de la REPSA es altamente estacional y la cantidad de las plantas herbáceas que pueden servir como alimento para el conejo es muy baja en la primavera (fig. 3; Cano-Santana, 1994b; Rzedowski, 1954). Cano-Santana (1994b) reporta que la biomasa de estas plantas es de 5 a 7 veces mayor de agosto a octubre que de abril a mayo y ésta empieza a disminuir rápidamente en noviembre. Por lo anterior, en la REPSA, los conejos tienen una ventana corta de tiempo (julio-octubre) para su reproducción en condiciones óptimas. Esto es consistente con lo que reportan Conaway et al. (1974) y con lo que revisan Chapman et al. (1980), en el sentido de que esta especie de conejo se reproduce durante intervalos más cortos en latitudes más altas (donde la alimentación es escasa en invierno debido al frío). La diferencia que se observa es que en el ecosistema del Pedregal de San Ángel, probablemente el factor de restricción es la sequía que provoca un decaimiento de la vegetación durante esta parte del año (fig. 3; Cano-Santana, 1994b). Resultados parecidos se han reportado con otras especies de lagomorfos en México, donde se ve que la actividad reproductiva se concentra en los meses de mayor precipitación y por tanto, en la disponibilidad de alimento (Portales et al., 2004; Rioja et al., 2011; Vázquez et al., 2007). No obstante, debido al método utilizado, no se puede descartar la existencia de otros eventos reproductivos de menor importancia a lo largo del año, pero de existir éstos no tienen un impacto notable en la estructura de la población, ya sea por ser de menor envergadura o porque no se llega a completar el proceso reproductivo de forma exitosa; un aspecto que debe ser estudiado en el futuro.
Hacen falta muchos estudios sobre la biología y ecología de este conejo en México, ya que los periodos reproductivos y otras características de la especie pueden variar considerablemente de acuerdo al ecosistema en que vive. En particular, sería deseable entender el impacto que tiene la urbanización y la fragmentación del ecosistema del Pedregal de San Ángel (Zambrano et al., 2016) sobre la dinámica poblacional y la actividad de esta especie. No obstante, es posible que los factores antrópicos no estén afectando los datos obtenidos, puesto que se seleccionaron sitios altamente conservados dentro de la zona de ecosistema natural de matorral xerófilo más extensa que tiene la REPSA: la zona núcleo poniente (94.9 ha; Peralta y Prado, 2009).

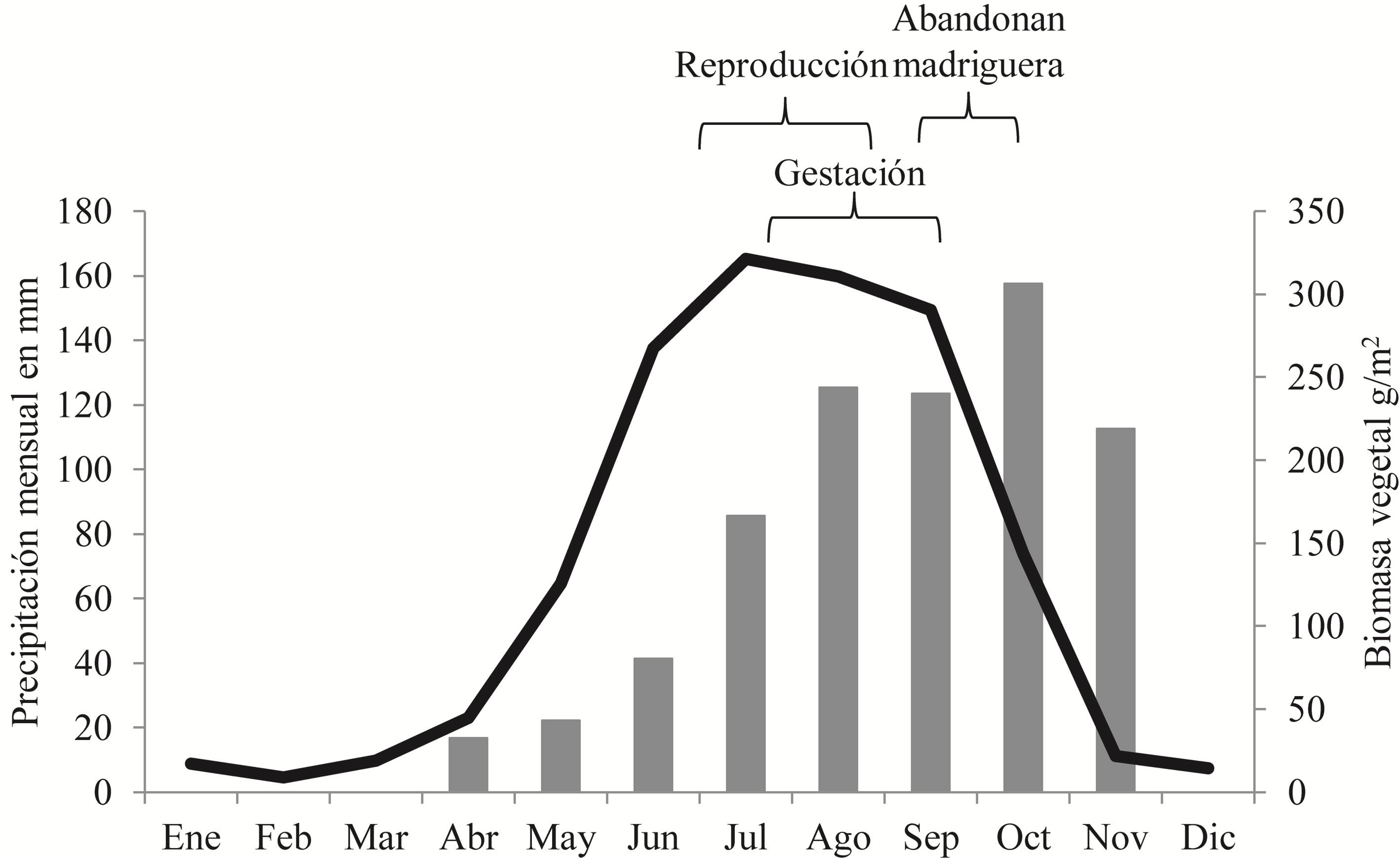
A pesar de que el método utilizado no se basa en la colecta de ejemplares (Cervantes y Vázquez, 2008; Conaway et al., 1974), éste resultó ser útil para determinar el periodo reproductivo. Los resultados muestran el mismo patrón a lo largo de 4 años de monitoreo y concuerdan bien las estimaciones de los tamaños poblacionales, las mediciones de los tamaños de las excretas, las condiciones ambientales adecuadas registradas para la reproducción (Cano-Santana, 1994b) y las observaciones de la actividad estacional de los conejos en el campo, ya que se ha observado una mayor actividad de conejos durante julio y agosto, cuando es común que éstos salgan a los caminos y sitios abiertos poco aptos para el forrajeo (Y. Glebskiy, obs. pers.), lo que sugiere que se trata de una temporada de cortejo.
Se recomienda el uso del monitoreo de heces cuando se trata de especies raras o que tienen algún estatus de protección, que hacen inconveniente la colecta de especímenes. Esta técnica también es muy útil cuando las especies son muy tímidas o tienen un tamaño poblacional pequeño (Nasi y van Vliet, 2011).
Se concluye que los conejos en la REPSA tienen un periodo reproductivo muy marcado a mediados de la época de lluvias, diferente a los reportados para otras poblaciones y que su reproducción es muy probablemente controlada por la disponibilidad de alimento.
Agradecimientos
A Iván Castellanos-Vargas, por el apoyo técnico a este proyecto, así como la revisión crítica al manuscrito. Al equipo de trabajo de la Secretaría Ejecutiva de la REPSA por los permisos y ayuda otorgados. Se agradece a dos revisores anónimos y al editor por sus valiosos comentarios. Este trabajo fue financiado por PAPIIT-UNAM, proyectos: IN222816 “Ecología de Sylvilagus floridanus (Lagomopha: Leporidae) en la Reserva Ecológica de Ciudad Universitaria, D.F.”, otorgado a ZC-S, e IV200117 “Análisis ecosocial de una reserva urbana para la sustentabilidad en el campus de Ciudad Universitaria”, otorgado a Luis Zambrano, ZC-S y Alicia Castillo. Se agradece al Conacyt por la beca de posgrado 620249 otorgada a YG.
Referencias
Bond, B. T., Bowman, J. L., Leopold, B. D., Burger, L. W. Jr., Godwin, K. D. y Class, C. M. (2004). Demographics, morphometrics, and reproductive characteristics of eastern cottontails (Sylvilagus floridanus) in Mississippi. Journal of the Mississippi Academy of Sciences, 49, 220–224.
Bronson, F. H. (1985). Mammalian reproduction: an ecological perspective. Biology of Reproduction, 32, 1–26. https://doi.org/10.1095/biolreprod32.1.1
Bronson, F. H. (2009). Climate change and seasonal reproduction in mammals. Philosophical Transactions of the Royal Society B: Biological Sciences, 364, 3331–3340. https://doi.org/10.1098/rstb.2009.0140
Cano-Santana, Z. (1994a). La reserva del Pedregal como ecosistema: estructura trófica. En A. Rojo (Comp.), Reserva Ecológica “El Pedregal” de San Ángel: ecología, historia natural y manejo (pp. 149–158). México D.F.: Universidad Nacional Autónoma de México.
Cano-Santana, Z. (1994b). Flujo de energía a través de Sphenarium purpurascens (Orthoptera: Acrididae) y productividad primaria neta aérea en una comunidad xerófila (Tesis doctoral). Centro de Ecología, Universidad Nacional Autónoma de México. México D.F.
Cervantes, F. A. y Vázquez, J. (2008). Conejos silvestres (Sylvilagus: Leporidae) del municipio de Ixtacuixtla, Tlaxcala, México. En C. Lorenzo, E. Espinoza, J. Ortega (Eds.), Avances en el estudio de los mamíferos de México II (pp. 89–102). San Cristóbal de las Casas, Chiapas: Asociación Mexicana de Mastozoología, A.C.
Chapman, J. A., Hockman, J. G. y Ojeda, C. M. (1980). Sylvilagus floridanus. Mammalian Species, 136, 1–8. https://doi.org/10.2307/3504055
Chávez, C. N. y Gurrola, M. A. (2009). Avifauna. En A. Lot y Z. Cano-Santana (Eds.), Biodiversidad del ecosistema del Pedregal de San Ángel (pp. 261–275). México D.F.: Universidad Nacional Autónoma de México.
Conaway, C. H., Sadler, K. C. y Hazelwood, D. H. (1974). Geographic variation in litter size and onset of breeding in cottontails. Journal of Wildlife Management, 38, 473–481. https://doi.org/10.2307/3800878
Dalke, P. D. y Sime, P. R. (1941). Food habits of the eastern and New England cottontails. Journal of Wildlife Management, 5, 216–228. https://doi.org/10.2307/3795589
Dorantes-Villalobos, D. (2017). Abundancia y distribución de Sylvilagus floridanus en Ciudad Universitaria, Cd. Mx. (México): una evaluación a través del estudio de sus pastillas fecales (Tesis). Facultad de Ciencias, Universidad Autónoma de México. Ciudad de México.
Fa, J. E., Romero, F. J. y López-Paniagua, J. (1992). Habitat use by parapatric rabbits in a Mexican high-altitude grassland system. Journal of Applied Ecology, 29, 357–370. https://doi.org/10.2307/2404505
Farías-González, V. (2011). Conceptos ecológicos, métodos y técnicas para la conservación de conejos y liebres. En Ó. Sánchez, P. Zamorano, E. Peters y H. Moya (Eds.), Temas sobre conservación de vertebrados silvestres en México (pp. 229–248). México D.F.: Instituto Nacional de Ecología, Secretaría de Medio Ambiente y Recursos Naturales.
Glebskiy, Y. (2016). Factores que afectan la distribución y abundancia del conejo castellano (Sylvilagus floridanus) en la Reserva del Pedregal de San Ángel, D.F. (México) (Tesis). Facultad de Ciencias, Universidad Autónoma de México. Ciudad de México.
Glebskiy, Y. (2019). Efecto del conejo castellano (Sylvilagus floridanus) sobre la comunidad vegetal del Pedregal de San Ángel (Tesis de maestría). Facultad de Ciencias, Universidad Nacional Autónoma de México. Ciudad de México.
Glebskiy, Y., Castellanos-Vargas, I. Dorantes-Villalobos, D. y Cano-Santana, Z. (2018). Role of predators, terrain ruggedness and plant composition for the abundance of the eastern cottontail rabbit (Sylvilagus floridanus). Southwestern Naturalist, 63, 59–63. https://doi.org/10.1894/0038-4909.63.59
Granados-Pérez, Y. (2008). Ecología de mamíferos silvestres y ferales de la Reserva Ecológica “El Pedregal”: hacia una propuesta de manejo (Tesis de maestría). Instituto de Biología, Universidad Nacional Autónoma de México. Ciudad de México.
Hoffmann, C. O. y Gottschang, J. L. (1977). Numbers, distribution, and movements of a raccoon population in a suburban residential community. Journal of Mammalogy, 58, 623–636. https://doi.org/10.2307/1380010
Homyack, J. A., Harrison, D. J., Litvaitis, J. A. y Krohn, W. B. (2006). Quantifying densities of snowshoe hares in Maine using pellet plots. Wildlife Society Bulletin, 34, 74–80. https://doi.org/10.2193/0091-7648(2006)34[74:QDOSHI]2.0.CO;2
Hortelano-Moncada, Y., Cervantes, F. A. y Trejo-Ortiz, A. (2009). Mamíferos silvestres de la Reserva Ecológica del Pedregal de San Ángel en Ciudad Universitaria, Universidad Nacional Autónoma de México, México D.F. Revista Mexicana de Biodiversidad, 80, 507–520. http://dx.doi.org/10.22201/ib.20078706e.2009.002.614
Hudson, R., Rodríguez-Martínez, L., Distel, H., Cordero, C., Altbäcker, V. y Martínez-Gómez, M. (2005). A comparison between vegetation and diets records from wet and dry season in the cottontail rabbit Sylvilagus floridanus at Ixtacuixtla, Central Mexico. Acta Theriologica, 50, 377–389. https://doi.org/10.1007/BF03192633
Kays, R. W., Gompper, M. E. y Ray, J. C. (2008). Landscape ecology of eastern coyotes based on large-scale estimates of abundance. Ecological Applications, 18, 1014–1027. https://doi.org/10.1890/07-0298.1
Lombardi, L., Fernández, N., Moreno, S. y Villafuerte, R. (2003). Habitat-related differences in rabbit (Oryctolagus cuniculus) abundance, distribution, and activity. Journal of Mammalogy, 84, 26–36. https://doi.org/10.1644/1545-1542(2003)084<0026:HRDIRO>2.0.CO;2
Lorenzo, C. y Cervantes, F. A. (2005). Conejo Sylvilagus floridanus (J. A. Allen, 1890). En G. Ceballos y G. Olivia (Eds.), Los mamíferos silvestres de México (pp. 843–845). México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Mueller-Dombois, D. y Ellenberg, D. (1974). Aims and methods of vegetation ecology. Nueva York: Wiley.
Nasi, R. y van Vliet, N. (2011). Measuring the abundance of wildlife populations in Central African logging concessions. Unasylva, 62, 49–55.
Olcott, S. P. y Barry, R. E. (2000). Environmental correlates of geographic variation in body size of the eastern cottontail (Sylvilagus floridanus). Journal of Mammalogy, 81, 986–998. https://doi.org/10.1644/1545-542(2000)081<0986:ECOGVI>2.0.CO;2
Osbahr, K. (2010). Evaluación de la tasa de defecación y del uso de letrinas en la guagua loba (Dinomys branickii Rodentia: Dinomyidae). Revista UDCA Actualidad & Divulgación Científica, 13, 57–66. https://doi.org/10.31910/rudca.v13.n1.2010.709
Palomares, F. (2001). Comparison of 3 methods to estimate rabbit abundance in a Mediterranean environment. Wildlife Society Bulletin, 29, 578–585.
Peralta, A. y Prado, J. (2009). Los límites y la cartografía. En A. Lot y Z. Cano-Santana (Eds.), Biodiversidad del ecosistema del Pedregal de San Ángel (pp. 27–42). México D.F.: Universidad Nacional Autónoma de México.
Portales, G. L., Hernández, L., Cervantes, F. A. y Laundré, J. W. (2004). Reproduction of Black-tailed jackrabbits (Lagomorpha: Lepus californicus) in relation to environmental factors in the Chihuahuan Desert, México. The Southwestern Naturalist, 49, 359–366. https://doi.org/10.1894/0038-4909(2004)049<0359:ROBJLL>2.0.CO;2
Powers, R. A. (1970). The reproductive biology of the mountain cottontail rabbit in Oregon (Tesis doctoral). Oregon State University, USA.
REPSA (Reserva Ecológica del Pedregal de San Ángel). (2019). Ficha descriptiva REPSA. Secretaría Ejecutiva de la REPSA, Universidad Nacional Autónoma de México, Ciudad de México. Recuperado el 13 de marzo, 2019 de: http://www.repsa.unam.mx/index.php/objetivos/caracteristicas/ficha-descriptiva
Rioja, T., Lorenzo, C., Naranjo, E., Scott, L. y Carrillo-Reyes, A. (2011). Breeding and parental care in the endangered Tehuantepec jackrabbit (Lepus flavigularis). Western North American Naturalist, 71, 56–66. https://doi.org/10.3398/064.071.0109
Rueda, M., Rebollo, S. y Bravo, L. G. (2008). Age and season determine European rabbit habitat use in Mediterranean ecosystems. Acta Oecologica, 34, 266–273. https://doi.org/10.1016/j.actao.2008.03.007
Rzedowski, J. (1954). Vegetación del Pedregal de San Ángel. Anales de la Escuela Nacional de Ciencias Biológicas, Instituto Politécnico Nacional, México, 8, 59–129.
Scott, D. W. (2009). Sturges’ rule. Wiley Interdisciplinary Reviews: Computational Statistics, 1, 303–306. https://doi.org/10.1002/wics.35
Siebe, C. (2009). La erupción del volcán Xitle y las lavas del Pedregal hace 1670 +/- 35 años AP y sus implicaciones. En A. Lot y Z. Cano-Santana, Z. (Eds.), Biodiversidad del ecosistema del Pedregal de San Ángel (pp. 43–49). México D.F.: Universidad Nacional Autónoma de México.
Siegel, S. y Castellan, N. J. (1995). Estadística no paramétrica aplicada a las ciencias de la conducta. Cuarta edición. México D.F.: Editorial Trillas.
Simonetti, J. A. y Fuentes, E. R. (1982). Microhabitat use by European rabbits (Oryctolagus cuniculus) in central Chile: are adults and juvenile patterns the same? Oecologia, 54, 55–57. https://doi.org/10.1007/BF00541107
SMN (Sistema Meteorológico Nacional). (2020). Información climatológica de la estación Santa Úrsula Coapa, Ciudad de México. Datos para el periodo 1951-2010. Recuperado el 15 de enero, 2020 de: https://smn.conagua.gob.mx/es/informacion-climatologica-por-estado?estado=df
Sokal, R. R. y Rohlf, F. J. (2011). Biometry. The principles and practice of statistics in biological research. Nueva York: W.H. Freeman & Company.
Sowls, L.K. (1957). Reproduction in the Audubon cottontail in Arizona. Journal of Mammalogy, 38, 234–243. https://doi.org/10.2307/1376315
Trent, T. T. y Rongstad, O. J. (1974). Home range and survival of cottontail rabbits in southwestern Wisconsin. The Journal of Wildlife Management, 38, 459–472. https://doi.org/10.2307/3800877
Vázquez, J., Martínez, J. M., Hudson, R., Rodríguez-Martínez, L. y Martínez-Gómez, M. (2007). Seasonal reproduction in Mexican cottontail rabbits Sylvilagus cunicularius in La Malinche National Park, central Mexico. Acta Theriologica, 52, 361–369. https://doi.org/10.1007/BF03194234
Wainright, L. C. (1969). A literature review on cottontail reproduction. Special Report 19. Denver: Colorado Department of Game, Fish and Parks.
Zambrano, L., Rodríguez-Palacios, S., Pérez-Escobedo, M., Gil-Alarcón, G., Camarena, P. y Lot, A. (2016). La Reserva Ecológica del Pedregal de San Ángel. Atlas de riesgos. Ciudad de México: Universidad Nacional Autónoma de México.