Producción y calidad de conidios de cepas de entomopatógenos del género Metarhizium anisopliae, aislados en zonas agrícolas del Estado de México
Erik Alcantara-Vargas a, Josefa Espitia-López b, Paul Misael Garza-Lópezb
y Alejandro Angel-Cuapio c, *
a División de Ingeniería Ambiental, Tecnológico de Estudios Superiores del Oriente del Estado de México, Paraje de San Isidro s/n, Barrio de Tecamachalco, 56400 Los Reyes Acaquilpan, Estado de México, México
b Área Académica de Ciencias Agrícolas y Forestales, Instituto de Ciencias Agropecuarias, Universidad Autónoma del Estado de Hidalgo, Rancho Universitario, Av. Universidad Km 1, Ex-Hda. de Aquetzalpa, 43600 Tulancingo de Bravo, Hidalgo, México
c División de Ingeniería Química y Bioquímica, Tecnológico de Estudios Superiores de Ecatepec, Av. Tecnológico s/n, Valle de Anáhuac, sección Fuentes, 55210 Ecatepec de Morelos, Estado de México, México
*Autor para correspondencia: rafaelangel@tese.edu.mx (A. Ángel-Cuapio)
Recibido: 17 enero 2019; aceptado: 24 febrero 2020
Resumen
En la naturaleza, los hongos entomopatógenos pueden eliminar o reducir las plagas agrícolas y constituyen, además el grupo de mayor importancia del control biológico, los géneros sobresalientes en la industria son: Metarhizium, Beauveria, Isaria y Lecanicillium. Los objetivos de este estudio fueron aislar hongos nativos de Metarhizium anisopliae de suelo agrícola del oriente del estado de México, así como evaluar la producción, calidad e infectividad de los conidios obtenidos en comparación a un producto comercial. Se realizó un diseño experimental completamente al azar con 3 repeticiones por muestra, a los que se les midió: producción de conidios, viabilidad, germinación e infectividad. La producción máxima de conidios fue de 9 × 108 conidios g de arroz (Oryza sativa) seco inicial (conidios gasi-1). Esto representó 1.4 veces más el orden de magnitud que con el producto comercial. En todos los aislados, el porcentaje de germinación fue > 80% y la viabilidad de los conidios fue ≈ 50%. En los parámetros de infectividad no se encontraron diferencias significativas (p > 0.05) respecto al producto comercial META-SIN®. Este método puede ser una alternativa para la obtención de aislados productores de conidios con infectividad deseable, competitivos con productos comerciales.
Palabras clave: Metarhizium anisopliae; Producción de conidios; Cultivo en estado sólido; Calidad de conidios; Aislamiento; Tenebrio molitor
© 2020 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Conidia production and quality of entomopathogenic strains of the genus Metarhizium anisopliae, isolated in agricultural zones of the State of México
Abstract
In nature, entomopathogenic fungi are capable of eliminating or reducing agricultural pests and also, they are the most important group for biological control; the main genera used in the industry are: Metarhizium, Beauveria, Isaria and Lecanicillium. The aims of this study were to isolate native strains belonging to Metarhizium anisopliae from agricultural soil in eastern State of México, as well as to evaluate the production, quality and infectivity of conidia obtained in comparison to a commercial product. A completely randomized experimental design was carried out with 3 replicates per sample, where conidia production, viability, germination and infectivity, were measured. The maximum production of conidia was 9 × 108 conidia g of initial dry rice (Oryza sativa) (conidia gidr-1). This represented 1.4 times the order of magnitude than with the commercial product. In all isolates, germination was > 80% and conidia viability was ≈ 50%. Regarding the infectivity parameters, no significant difference was found (p > 0.05) with respect to the commercial product META-SIN®. This method can be an alternative to obtain conidia producing isolates with desirable infectivity.
Keywords: Metarhizium anisopliae; Conidia production; Solid state culture; Quality of conidia; Isolation; Tenebrio molitor
© 2020 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
Un problema de contaminación ambiental resulta del uso descontrolado de pesticidas químicos; éste tiene su origen desde que dichos productos comenzaron a producirse a mediados de los años treinta, provocando con ello diferentes efectos perjudiciales no sólo en el suelo, aire, agua, y la salud humana, sino también sobre el producto sobre el cual se aplican. Al respecto, los entomopatógenos tienen potencialidad para reemplazar, o al menos complementar los tratamientos con insecticidas químicos y pueden utilizarse tal como se encuentran en la naturaleza (Glare, 2004; Miranda-Hernández et al., 2017). Los hongos entomopatógenos tienen potencial como agentes controladores de insectos considerados como plaga en el sector agrícola; entre los géneros más importantes están Metarhizium, Beauveria, Isaria (Paecilomyces) y Lecanicillium (Verticillium), microorganismos que producen unidades infectivas denominadas conidios. La literatura especializada ha reportado procedimientos de cultivo en estado sólido que conllevan la mejoría en el rendimiento y esporulación de hongos entomopatógenos (Jackson et al., 2010; Seiber et al., 2014).
La búsqueda y evaluación de aislamientos nativos de hongos entomopatógenos adaptados a las condiciones locales es una de las actividades a considerar dentro del desarrollo de un micoinsecticida (Ruiz Sánchez et al., 2013). Los aislados fúngicos obtenidos en campo a partir de insectos micosados posiblemente presentan un sin número de genotipos, los cuales pueden variar en virulencia, esta versatilidad puede ser regulada a través de la obtención de cultivos monocolonia formados por una espora, lo cual disminuye la variabilidad genotípica y mantiene las características requeridas para la selección y/o mejoramiento de los hongos (Ayala-Zermeño et al., 2005; Toriello et al., 2008). Lo anterior implica obtener aislamientos nativos que permiten por su adaptación a las condiciones de la región, mayores potencialidades de uso por sus características de tolerancia o resistencia a los ambientes asociados a la región en donde fueron aisladas (Toriello et al., 2008).
Actualmente, es necesario elaborar alternativas para el control biológico de plagas agrícolas, en particular en aquellas que presentan un impacto nulo en el medio ambiente, de ahí que los hongos entomopatógenos ofrezcan una gran eficacia como agentes de control de diferentes plagas ya que actúan por contacto. Existen investigaciones relacionadas con el aislamiento de hongos entomopatógenos en zonas agrícolas de México, como por ejemplo, se ha analizado la virulencia de cepas de Isaria fumosorosea aisladas en zonas citrícolas de Nuevo León (Gandarilla-Pacheco et al., 2018). Por otro lado, se ha estudiado el aislamiento de Metarhizium anisopliae, Beauveria bassiana y Paecilomyces sp. en cultivos de maíz en Morelos (Hernández-Velázquez et al., 2011). De manera análoga, los hongos predominantes encontrados en suelos agrícolas de otros estados como Michoacán, Colima, Nayarit, Veracruz, Jalisco y Sinaloa, han sido Metarhizium anisopliae y Beauveria bassiana (Molina-Ochoa et al., 2003). En cuanto a los suelos agrícolas de la región del oriente del estado de México, no se han llevado a cabo investigaciones con relación al aislamiento de hongos entomopatógenos. El objetivo de esta investigación fue aislar hongos nativos de Metarhizium en suelo agrícola del oriente del estado de México, así como evaluar la producción y calidad de los conidios obtenidos.
Cabe señalar que la calidad de un agente de control biológico se define como un conjunto de propiedades inherentes de la cepa asociadas a la capacidad para funcionar después de su liberación en campo (Castillo-Minjarez et al., 2019; Loera-Corral et al., 2016). Cada lote debe estar sujeto a las pruebas de control de calidad. Los parámetros esenciales que deben verificarse son la viabilidad, germinación e infectividad, entre otros (García-Ortiz et al., 2015; Miranda-Hernández et al., 2014; Tlecuitl-Beristain et al., 2010). La mala calidad conduce a una eficacia inadecuada, esto es desfavorable para el productor y los usuarios; el control del producto solo debería ser necesario para confirmar que el este sea de calidad alta y consistente (Ravensberg, 2011). La hipótesis que se planteó fue que los hongos del género Metarhizium aislados de suelo agrícola del Estado de México tienen una producción de conidios con calidad similar a los obtenidos por una cepa comercial, debido a que los micoinsecticidas tienen un efecto positivo al reducir poblaciones de insectos considerados plaga sin deteriorar el medio ambiente y la salud humana.
Materiales y métodos
Las muestras se recolectaron de parcelas de cultivo en 5 municipios diferentes del Estado de México, los productos que se cultivan y su ubicación se presentan en la tabla 1. Para el muestreo se seleccionaron 5 puntos al azar de cada una de las zonas agrícolas evaluadas (Zimmermann, 1986). Las muestras de suelo se almacenaron en bolsas negras de polietileno para evitar la exposición directa a la luz; se recolectó aproximadamente 0.5 kg de suelo de 0 a 20 cm de profundidad, para lo cual se rodeó el área agrícola y se ubicó la misma a través de GPS; todas las muestras se conservaron en refrigeración a 4 °C hasta su procesamiento (Zimmermann, 1986).
El aislamiento de los hongos entomopatógenos se realizó mediante la técnica de trampeo, la cual consistió en recolectas de suelo que se tamizaron a partir de la propuesta de Zimmermann (1986), para lo cual se tomaron submuestras de 60 g que se colocaron en vasos de plástico con una capacidad de 250 ml; en cada vaso se realizaron 15 perforaciones para favorecer la aireación; además el suelo se humedeció con 7 ml de agua destilada y se colocaron 10 larvas de Tenebrio molitor (Coleoptera: Tenebrionidae) adquiridos de la empresa Petmmal S.A. de C.V; finalmente, se incubaron a 28 °C durante 7 días. Cada 24 h los vasos se giraron 180 ° para que las larvas estuviesen en mayor interacción con la muestra de suelo; en el séptimo día de incubación, las larvas muertas se colocaron en cámaras húmedas (cajas Petri con papel filtro estéril húmedo) e incubados a 28 °C por 7 días, con la finalidad de promover el crecimiento del hongo. Los hongos se desarrollaron sobre la superficie de las larvas, cada uno se aisló y propagó por estría en cajas Petri con medio ADS (agar dextrosa Sabouraud) (BPBioxon ® Becton Dicknson de México S.A. de C.V. Cuautitlán Izcalli), previamente esterilizado en autoclave a 120 °C, 15 psi durante 15 min. (Carrillo-Benítez et al, 2013; Zimmermann, 1986), el medio de cultivo fue preparado de acuerdo con las especificaciones del fabricante (65 g L-1).
Se obtuvieron cultivos monocolonia a partir de una espora, realizado de la siguiente manera: del insecto micosado se tomó una asada de conidios y se sembró en cajas Petri de 90 × 15 mm con medio ADS , y se adicionó desoxicolato de sodio al 0.05% (Sigma-Aldrich, Auckalnd, New Zealand) que es un inhibidor de crecimiento que facilitó la obtención de colonias aisladas; se monitoreo el cultivo a partir de las 12 h de incubación, con un objetivo 40× se localizó un conidio germinado que fue cortado en un cuadro de agar en un área de 2 mm2 aproximadamente, el fragmento cortado fue colocado en medio ADS e incubado durante 10 d a 28 ºC (Montesinos-Matías et al., 2011). De este cultivo, colonias independientes se propagaron por estría en cajas Petri y matraces Erlenmeyer con 20 ml y 50 ml de medio ADS, respectivamente, que se utilizaron para su conservación y estudios posteriores.
Tabla 1
Claves para cada aislado y localización geográfica de los municipios muestreados.
|
Municipio |
Localidad |
Coordenadas geográficas |
Cultivo |
Clave |
|
Amecameca |
Amecameca de Juárez |
19°07’17.24” N, 98°46’36.94” O |
Ebo |
Ame-2.1 |
|
Texcoco |
San Bernardino |
19°28’34.23” N, 98°53’19.40” O |
Avena |
Tex-3.1 |
|
Tenango |
San Mateo Tepopula |
19°09’33.61” N, 98°51’53.07” O |
Trigo |
Ten-2.1 |
|
Chiconcuac |
Barrio San Pedro |
19°32’49.26” N, 98°53’49.92” O |
Maíz |
Chi-3.1 |
|
Chalco |
San Gregorio Cuautzingo |
19°15’57” N, 98°51’28.37” O |
Maíz |
Cha-3.1 |
Las claves asignadas a los aislados se determinaron con las 3 primeras letras del municipio seguida de un número en forma ascendente después de la clave y separados (clave y número) por un guion; el número indica la cantidad de aislados obtenidos por cada municipio (Estefes-Chávez, 2015). La descripción corresponde a cultivos plurispóricos que se obtuvieron a partir de suelo e insectos. Finalmente, para los cultivos monospóricos se obtuvieron a partir de los cultivos plurispóricos, se designó la nomenclatura ya establecida, con la salvedad de adicionar después del dígito, un punto y un decimal, que hacen referencia al número de cultivos monospóricos obtenidos de cada cultivo plurispórico.
Los hongos aislados se conservaron con el método de agua desionizada estéril (López-Lastra et al., 2002). Para cada aislado se utilizaron cultivos esporulados en cajas Petri; además, en condiciones asépticas se cortaron pequeños bloques de aproximadamente 5 mm2 y se colocaron dentro de viales de vidrio de 15 × 1.5 cm con tapa de rosca, que contenían 4 ml de agua desionizada estéril y los viales se conservaron a 4 °C. Los experimentos posteriores de producción de conidios se iniciaron tomando un vial de conservación; y se transfirieron asépticamente los bloques de inóculo en cajas Petri con medio ADS. Se realizó la propagación en matraces Erlenmeyer de 250 ml con 50 ml de medio ADS, previamente esterilizado en autoclave a 120 °C, 15 psi durante 15 min. Las cajas y los matraces se incubaron a 28 °C durante 10 días. Posteriormente se llevaron a cabo los experimentos.
La identificación morfológica se realizó a partir de observaciones con un microscopio estereoscópico (Velab VE-S1) y un microscopio óptico (OLYMPUS B X 50). Asimismo, se capturaron imágenes y medidas de los conidios utilizando el programa Image-Pro plus 6.3; se obtuvieron al menos 30 mediciones de los conidios para cada aislado. Por otro lado, se realizó un análisis de aspectos morfológicos a nivel microscópico, es decir, formas, colores y dimensiones de los conidios. A nivel macroscópico, se analizaron caracteres como la forma y coloración (Humber, 2012); en esta misma línea, se realizaron observaciones a un producto comercial compuesto de conidios de Metarhizium anisopliae (META-SIN, Agrobionsa, México).
Para la producción de conidios en cultivo sólido, se pesaron 50 g de arroz precocido de la marca (Verde Valle®); la materia sólida fue colocada en bolsas de polipapel de 18 × 25 cm con capacidad para 0.5 kg. Posteriormente, se esterilizó a 121 °C, 15 psi durante 15 min. En condiciones asépticas el medio sólido se inoculó con 5 ml de una suspensión de conidios con una concentración de 5 × 107 conidios ml-1, considerando un inóculo inicial de 1 × 106 conidios por gramo de arroz seco inicial (conidios gasi-1), se ajustó la humedad inicial al 40% de humedad inicial, se mezcló manualmente cada bolsa y se incubó a 28 °C durante 15 días (Angel-Cuapio et al., 2015; Méndez-González et al., 2018). Cada 2 días se realizó un mezclado para lograr un crecimiento uniforme de los hongos; para los 6 aislados estudiados se recurrió a la misma metodología.
Para estimar la producción de conidios se utilizaron 3 bolsas para cada hongo, de cada bolsa, 50 gasi se transfirieron a un vaso de precipitado de 500 ml en el cual se adicionaron 150 ml de Tween 80 al 0.05% para realizar la extracción de conidios en una parrilla de agitación durante 10 min. Los extractos se filtraron a través de una gasa estéril de 10 × 10 cm para eliminar los sólidos y obtener las suspensiones de conidios. Los conidios se contaron en cámara de Neubauer (Marienfield, Lauda-Königshofen, Alemania), con un microscopio de luz (BOECO) utilizando un lente objetivo de 40× (Angel-Cuapio et al., 2015). Lo valores de producción se reportan como conidios por gramo de arroz seco inicial (C, conidios gasi-1).
Para determinar el porcentaje de germinación,se prepararon cajas Petri con medio ADS, posteriormente se estandarizaron suspensiones de conidios a una concentración final de 1 × 106 conidios ml-1 de donde se tomaron 50 µL y se adicionaron sobre la superficie del medio ADS; con una varilla de vidrio se distribuyó el inóculo y las cajas se incubaron a 28 °C durante 12 h. S e realizó el conteo de 200 conidios registrando los conidios germinados y los no germinados, utilizando un microscopio (BOECO) con objetivo 40×. Se consideró un conidio germinado aquel que presentó la longitud del tubo germinativo de 2 veces el diámetro del conidio (Ibrahim et al., 2002; Samuels et al., 1989). Para cada aislado se realizó la prueba por triplicado.
Para determinar la viabilidad se utilizaron conidios cosechados a 15 días de cultivo, se estandarizaron suspensiones de conidios de cada aislado a una concentración de 1 × 104 conidios ml-1 y se adicionaron 30 µL (300 conidios) de cada suspensión a una caja Petri con medio ADS. Las cajas se incubaron a 28 ºC y se realizó el conteo de unidades formadoras de colonias (UFC) a las 48 h de cultivo utilizando un microscopio (BOECO) con objetivo 40× (Miranda-Hernández et al., 2014). Para cada aislado se realizó la prueba por triplicado.
Para las pruebas de infectividad (bioensayos) se utilizaron larvas de Tenebrio molitor (Coleoptera: Tenebrionidae), el cultivo fue obtenido de la empresa PETMMAL. Cada aislado se evaluó de forma independiente a través del siguiente procedimiento: en 7 cajas Petri (5 para larvas infectadas y 2 como testigos negativos) se colocaron 10 larvas por caja, el proceso de infección se realizó por inmersión durante 10 segundos en suspensiones estandarizadas a una concentración de 1 × conidios ml-1 en un volumen total de 30 ml. Para los controles negativos, las larvas se sumergieron durante 10 segundos en una solución de Tween 80, al 0.05% estéril. A todas las unidades experimentales se les agregó alimento a base de salvado de trigo y avena (relación 1:1) para evitar la muerte de las larvas por inanición. Posteriormente, se incubó a 28 °C con fotoperiodo 12:12 h luz-oscuridad y cada 24 h las larvas muertas se colocaron en una cámara húmeda (cajas Petri con papel filtro estéril húmedo) y se incubaron a 28 °C, con la finalidad de promover el crecimiento del hongo y confirmar la muerte de las larvas por micosis; el monitoreo se hizo durante 15 días.
Para estimar el tiempo en que apareció la primera larva muerta (to), el tiempo letal 50, que es el tiempo en que se alcanza 50% de mortalidad (TL50) y el porcentaje de sobrevivencia (Sf), se utilizó el modelo de decaimiento descrito por Rodríguez-Gómez et al. (2009); que desarrolla la solución de una ecuación diferencial de primer orden con el tiempo de retardo indicado:
Y = (100-S) *e-k(t-t0) + S, para t > t0
donde Y es el porcentaje de sobrevivencia (%) al tiempo t, k es la tasa específica de muerte (d-1), to es el tiempo para el primer muerto (d) y S es la sobrevivencia estimada asintótica (%).
En el estudio de hongos entomopatógenos es común evaluar su efectividad biológica, la cual es el resultado que se obtiene al aplicar un insumo en el control o erradicación de una plaga que afecta a los cultivos, lo anterior considerando que el insumo es una sustancia destinada para prevenir, matar o controlar una plaga del campo, en la producción, almacenamiento, transporte o comercialización de productos agrícolas. La fórmula que se utiliza para determinar dicha efectividad es la de Abbott (1925):
% EB = ((Tt-Ti) / Tt)*100
Donde % EB es la efectividad biológica de un micoinsecticida expresada en porcentaje (%), Tt es el número de individuos en el tratamiento testigo y Ti es el número de individuos en el tratamiento i.
Para los hongos entomopatógenos estudiados, se realizó un diseño experimental completamente al azar con 3 repeticiones por muestra, a los que se les midió la producción de conidios, la viabilidad y la germinación e infectividad; los resultados obtenidos se analizaron mediante el método Andeva de una vía con la prueba de Tukey para la comparación de medias (p < 0.05). Los análisis se realizaron con el software SPSS (SPSS, Chicago, IL).
Resultados
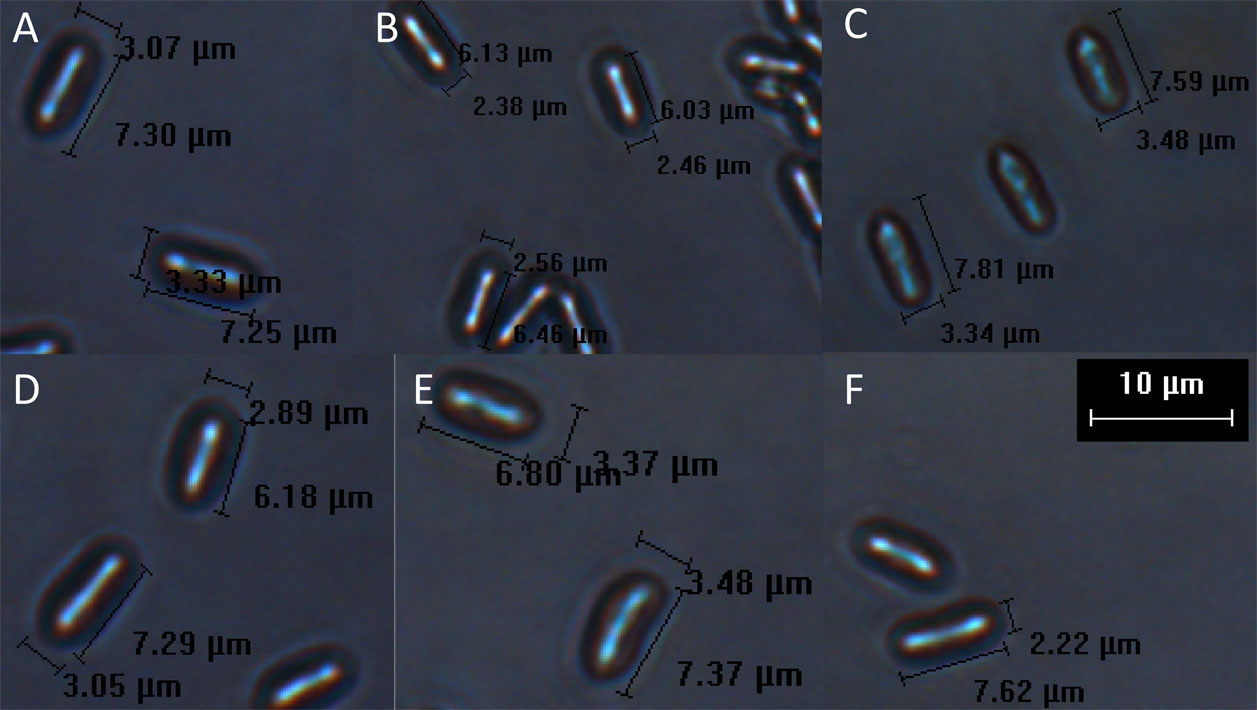
De cada muestra de suelo agrícola se seleccionó y aisló solamente un hongo, por lo que se obtuvieron 5 hongos entomopatógenos en total, cuyas claves de cada aislado y localización geográfica de las zonas agrícolas muestreadas se presentan en la tabla 1. La identificación morfológica de los aislados se realizó considerando las estructuras de los conidios (fig. 1). Los aislamientos encontrados presentaron colonias verdes con aspecto polvoroso, micelio septado con conidióforos, de los que salían cadenas de conidios, cilíndricos, con sombra de color verde, con un tamaño menor a 9 μm (tabla 2), tales características han sido asociadas al hongo entomopatógeno Metarhizium anisopliae (Metschnikoff) Sorokin (Humber, 2012).
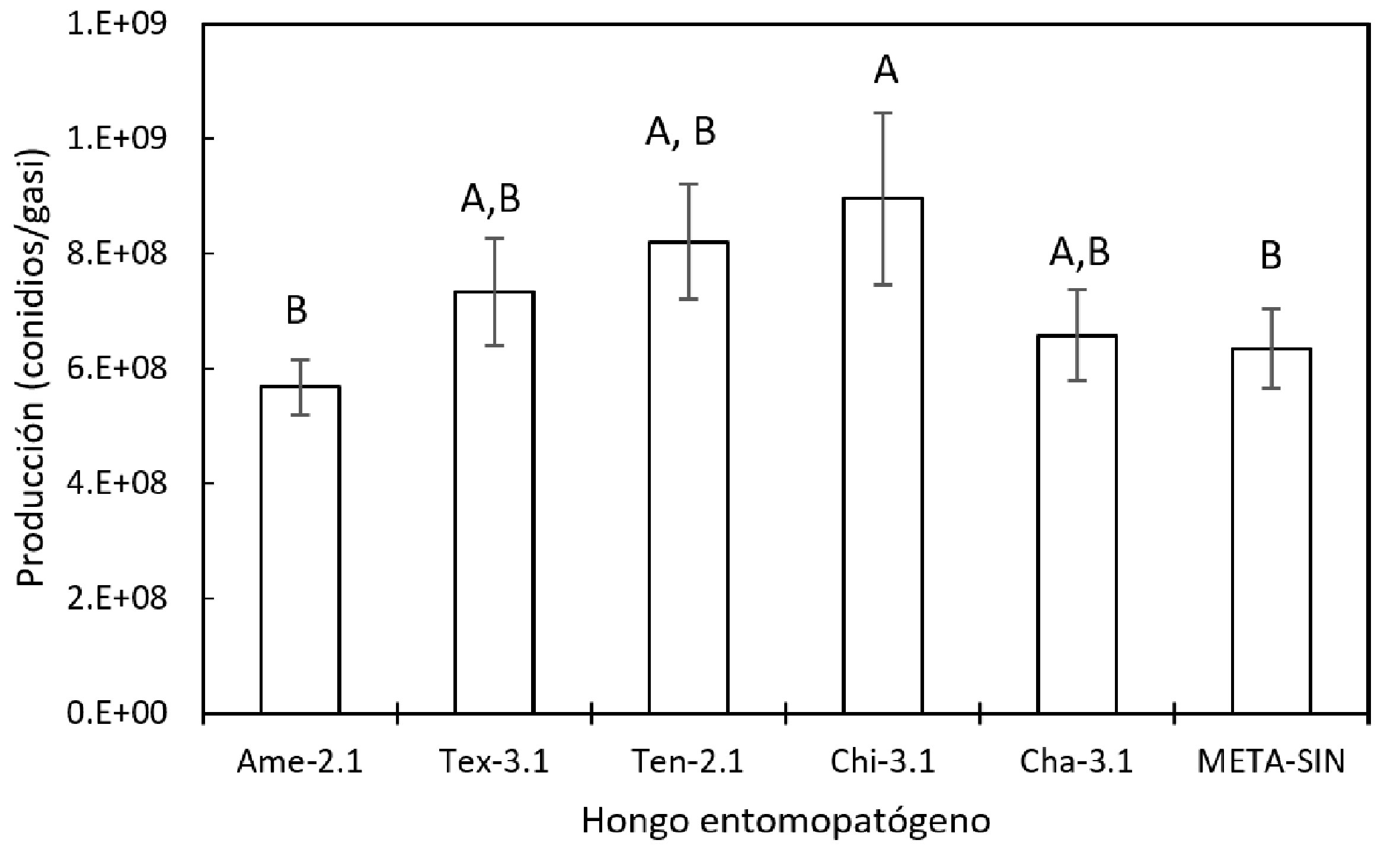
La producción mayor de conidios fue con el aislado Chi-3.1, con producción promedio de C ≈ 9 × 108 conidios gasi-1 (fig. 2) y no se encontró diferencia significativa (p > 0.05) con los aislados Tex-3.1, Ten-2.1 y Cha-3.1.
El incremento en la producción representó 29% respecto a la obtenida por un producto comercial META-SIN (6.4 × 108 conidios gasi-1), asimismo, los aislados Ame-2.1, Tex-3.1, Ten-2.1 y Cha-3.1 alcanzaron una producción promedio de C ≈ 6.9 × 108 conidios gasi-1 y no se encontró diferencia significativa (p > 0.05) entre los aislados y la producción obtenida por el producto comercial.
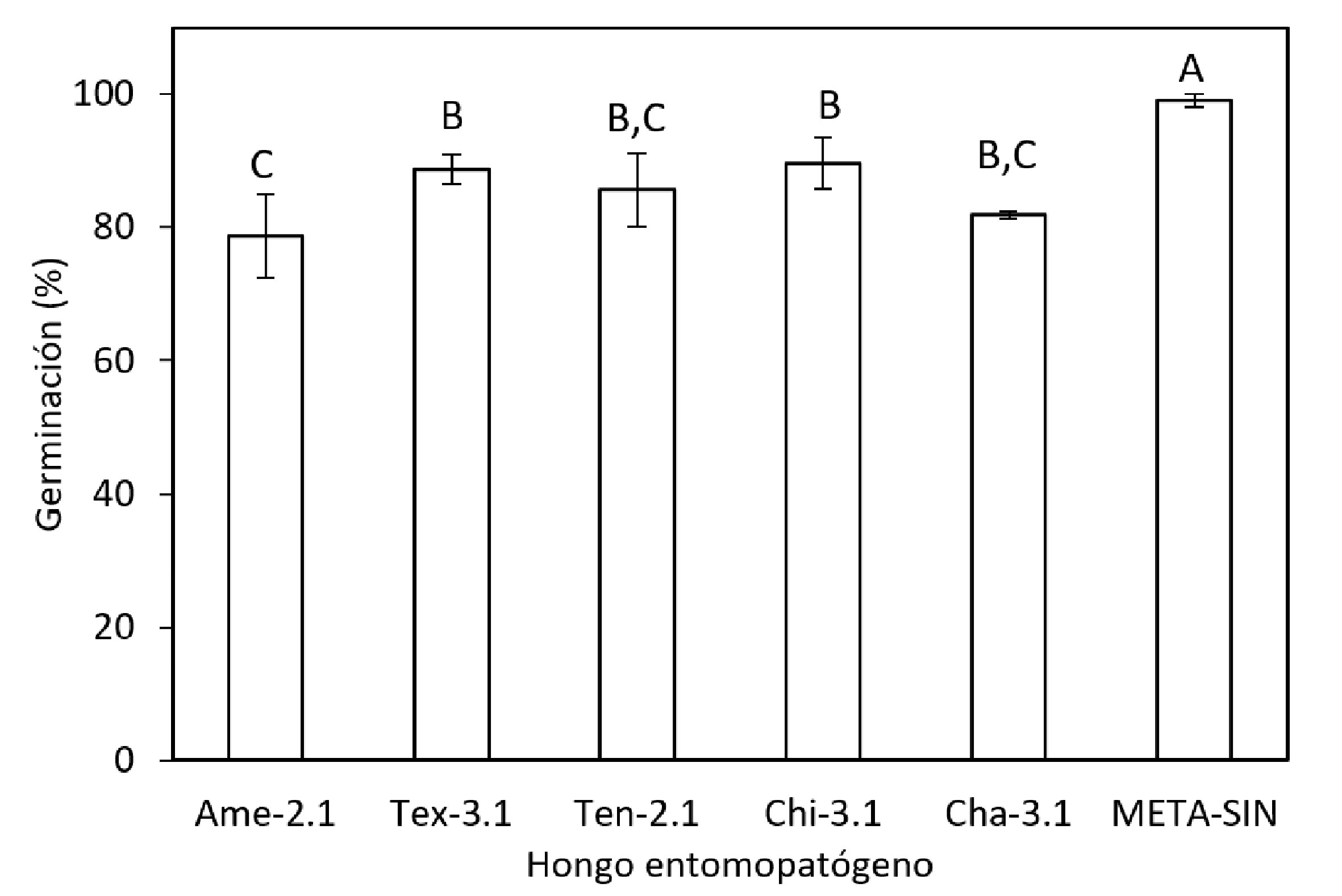
El valor más alto de germinación (G) que se alcanzó con el producto comercial META-SIN fue ≈ 99% (fig. 3), que fue estadísticamente diferente (p < 0.05) a los aislados Ame-2.1, Tex-3.1, Ten-2.1, Chi-3.1 y Cha-3.1. Los aislados Tex-3.1, Ten-2.1, Chi-3.1 y Cha-3.1 no presentaron diferencia significativa (p > 0.05), con una disminución en la germinación de 13% respecto al obtenido por un producto comercial (G ≈ 99%). De manera análoga, para los aislados Ame-2.1, Ten-2.1 y Cha-3.1 1 no se encontró diferencia significativa (p > 0.05), con una disminución de 18%.
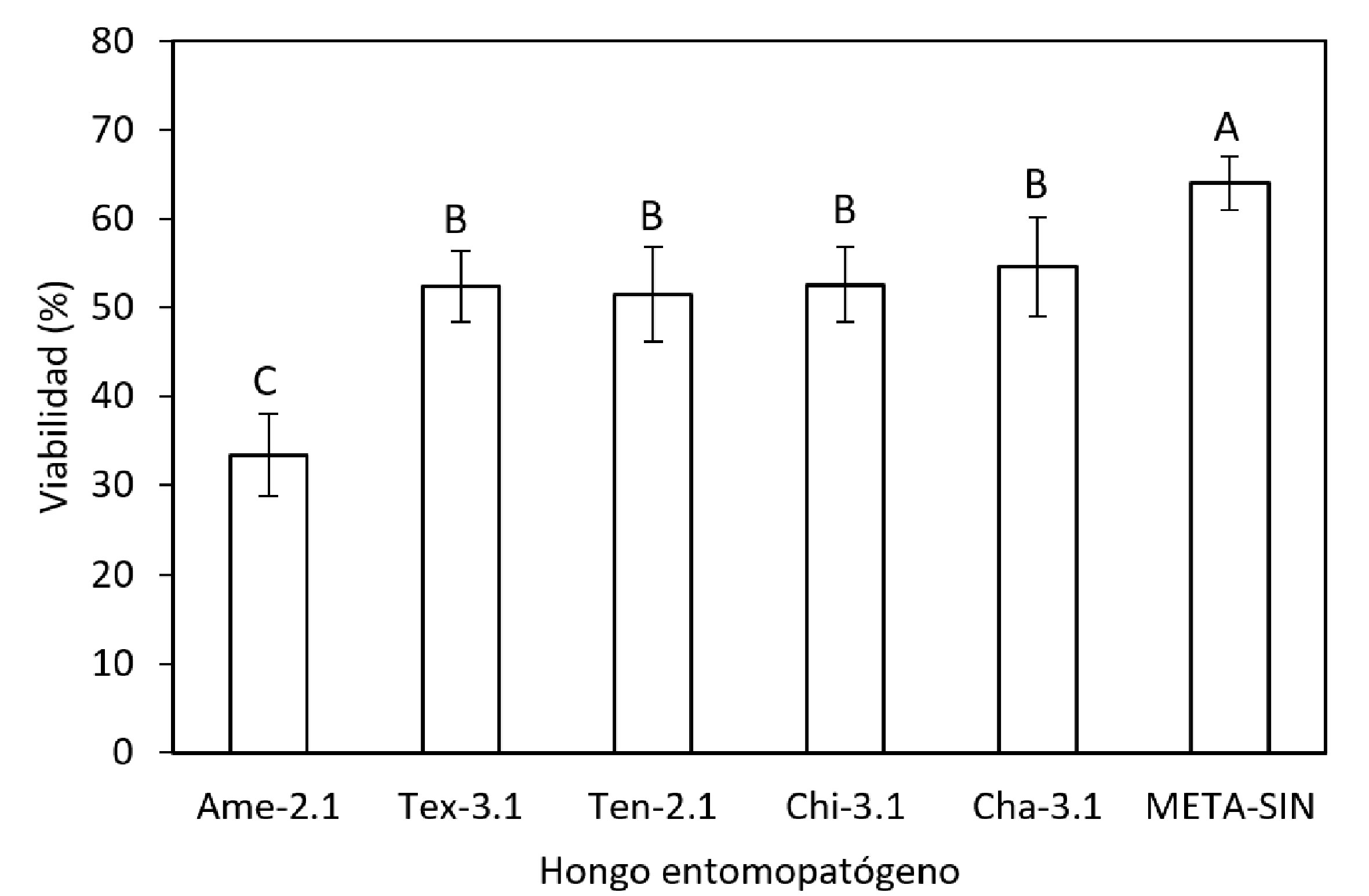
Sobre la viabilidad, se encontró un valor aproximado del V ≈ 64% para el producto comercial META-SIN, estadísticamente diferente (p < 0.05) a los aislados Ame-2.1, Tex-3.1, Ten-2.1, Chi-3.1 y Cha-3.1. Los aislados Tex-3.1, Ten-2.1, Chi-3.1 y Cha-3.1, no presentaron diferencia significativa (p > 0.05), con una disminución de 18% respecto al obtenido por un producto comercial (V ≈ 64%) (fig. 4). Así mismo, el aislado Ame-2.1 alcanzó una viabilidad de V ≈ 33.46%, siendo estadísticamente diferente (p < 0.05) a los otros hongos, con una disminución de 48%.
Tabla 2
Tamaño de los conidios de hongos entomopatógenos aislados en zonas agrícolas del Estado de México.
|
Aislado |
Diámetro (µm) |
Longitud (µm) |
||||
|
Tex-3.1 |
2.33 |
± |
0.09 |
5.23 |
± |
0.21 |
|
Chi-3.1 |
2.17 |
± |
0.04 |
5.59 |
± |
0.08 |
|
Ten-2.1 |
2.27 |
± |
0.13 |
5.31 |
± |
0.13 |
|
Ame-2.1 |
2.38 |
± |
0.20 |
5.66 |
± |
0.30 |
|
Cha-3.1 |
3.41 |
± |
0.12 |
6.97 |
± |
0.49 |
|
META-SIN * |
2.35 |
± |
0.09 |
5.59 |
± |
0.22 |
* Producto comercial a base de conidios de Metarhizium anisopliae.
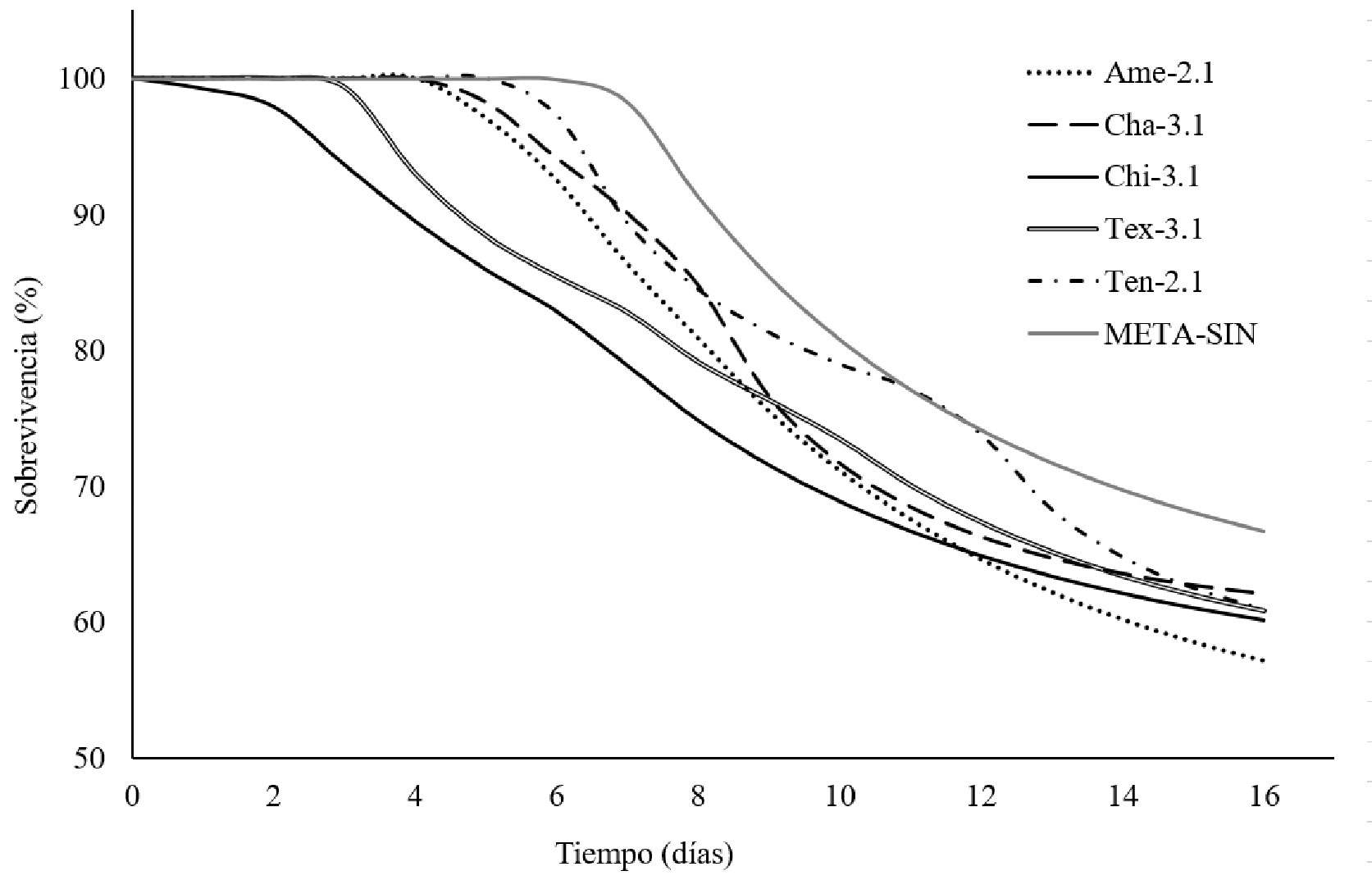
Sobre la infectividad (bioensayo), se encontró que el aislado Chi-3.1 presentó un tiempo de t0 ≈ 2.58 días, que es el valor más bajo estadísticamente diferente (p < 0.05) en comparación con el producto comercial. Sin embargo, para los aislados Ame-2.1, Tex-3.1 y Cha-3.1, no se encontró diferencia estadísticamente significativa (p > 0.05) respecto con el t0 obtenido para META-SIN (fig. 5). Por otro lado, para los 5 aislados no se encontró diferencia estadística significativa (p > 0.05) en los parámetros, k y Sf en comparación con META-SIN. En ese sentido, no se pudo estimar el TL50 (tiempo letal 50, tiempo en que tarda para matar 50% de la población), debido a que no murió más de 50% de las larvas infectadas a la concentración de conidios estudiada, por lo que se recomienda evaluar otras concentraciones y estimar la concentración letal 50 (CL50).
Discusión
La identificación morfológica de los aislados fue desarrollada con base en las claves descritas por Humber (2012). En este sentido, las características morfológicas para el género Metarhizium son: conidióforos densamente entrelazados, conidios ovoides de color verde, formados en cadenas paralelas largas o cortas, los conidióforos son ramificados, con forma de candelabro y entrelazados. El tamaño de los conidios depende del tipo de especie, es decir, para M. anisopliae los conidios suelen medir menos 9 μm; para M. majus los conidios tienen una longitud mayor a 11 μm y para M. acridum entre 7 y 11 μm. De ahí que, en esta investigación se encontró que los conidios obtenidos de cada aislado están relacionados con el hongo entomopatógeno M. anisopliae, lo que coincide con las características similares presentes en el producto comercial META-SIN, que es elaborado a partir de conidios de M. anisopliae. Como parte complementaria y poniéndolo en perspectiva, se recomienda hacer la identificación molecular de los aislados mediante el análisis de las secuencias de la región ITS del ADNr (Tlecuitl-Beristain et al., 2010), así como realizar un análisis “in silico” utilizando la base de datos del NCBI, Genbank de las secuencias nucleotídicas que codifican para el factor de elongación 5´1α y para β-tubulina, las cuales serán utilizadas como iniciadores para la identificación.
La finalidad de obtener nuevos aislados permite conocer al hongo Metarhizium anisopliae en algunas zonas del Estado de México, en donde se desempeña como regulador de poblaciones de insectos; cabe señalar que este hongo entomopatógeno se produce mediante técnicas de cultivo en soporte sólido (Lizardi-Jiménez y Hernández-Martínez, 2017), además es uno de los más utilizados a nivel industrial y aplicado como agente de control biológico en todo el mundo, de ahí la importancia de producir sus conidios en grandes cantidades. Recientemente Angel-Cuapio (2015), reportó una producción de conidios de 2.7 × 108 conidios gasi-1, en cultivos sobre arroz realizados en frascos de vidrio para M. anisopliae. Por su parte, Van Breukelen et al. (2011), documentaron una producción de conidios de M. anisopliae de 3.4 × 109 conidios g arroz-1 en cultivo sólido utilizando columnas de vidrio y arroz como sustrato. De forma análoga, Dorta et al. (1996) informaron sobre una producción de conidios de 2.3 × 1010 conidios g arroz-1 en cultivos de M. anisopliae, utilizando botellas de vidrio como unidad experimental y salvado de arroz como sustrato. También, Arzumanov et al. (2005) dieron a conocer resultados similares en cultivo sobre soporte sólido usando arroz como sustrato en reactores de columna, se encontró que Metarhizium anisopliae creció exclusivamente sobre los granos de arroz con una producción de 3.5 × 109 conidios por gramo de materia seca. Recientemente, Méndez-González et al. (2018) reportaron la producción de conidios de Metarhizium anisopliae sobre arroz utilizando biorreactores de columna empacada y bolsas de plástico, a 9 días de cultivo se alcanzó una producción de 6.8 × 108 conidios por gramo de materia seca y 5.6 × 108 conidios por gramo de materia seca, respectivamente. La técnica propuesta para la producción de conidios en esta investigación resulta interesante, debido a que el rendimiento alcanzado se ubica en el promedio de los valores reportados por los autores antes mencionados, más aún se alcanzó una producción de 9 × 108 conidios g arroz-1 con el aislado Chi-3.1, que representó un incremento del rendimiento de 1.4 veces en comparación con el producto comercial (6.4 × 108 conidios g arroz-1).
Otro punto por analizar es la calidad de los conidios obtenidos, para determinar la viabilidad, germinación e infectividad que permiten predecir la eficiencia de las células infectivas. La germinación es la formación del tubo germinativo a partir de un conidio, se realiza como un indicador de la capacidad y velocidad de los conidios para emitir un tubo germinativo in vivo y poder penetrar potencialmente la cutícula del insecto objetivo. Se considera un conidio germinado, cuando el tamaño del tubo germinativo es mayor al ancho del conidio (Ibrahim et al., 2002). Dicho lo anterior, se encontraron valores superiores a 80% de germinación en los conidios producidos para los 5 aislados de Metarhizium anisopliae, que fueron 1.11 veces menores al obtenido con el producto comercial META-SIN®. Con respecto a la viabilidad, la medida de la cantidad de conidios que tienen la capacidad de desarrollar unidades formadoras de colonias (UFC), expresada en porcentaje (Angel-Cuapio, 2015); se encontraron valores de viabilidad similares (V ≈ 50%) que fueron 1.28 veces menores al obtenido por el producto comercial (V ≈ 64%), concordando con los valores reportados por Méndez-González et al. (2018). No obstante los valores de germinación y viabilidad obtenidos en las cepas aisladas, éstos se consideran adecuados para la elaboración de bioplaguicidas basados en hongos entomopatógenos, de acuerdo con los estándares internacionales (Jenkins y Grzywacs, 2000; Jenkins et al., 1998), hay que mencionar, además que la germinación es un factor determinante de la virulencia que puede ser afectado por las condiciones nutricionales (Fragues et al., 2001).

La infectividad de los conidios producidos fue analizada mediante técnicas de bioensayo utilizando larvas de Tenebrio molitor, insecto considerado plaga en granos almacenados, y también utilizado comúnmente como insecto huésped, modelo para estudios con hongos patógenos de insectos (Damborsky et al., 1999). Los aislados nativos de Metarhizium anisopliae resultaron ser más infectivos que la cepa comercial estudiada, el aislado Ame-2.1 alcanzó la mortalidad más alta correspondiente a 43% con una eficiencia biológica de 60% en comparación con el producto comercial con una mortalidad de 34% y una eficiencia biológica de 60%. En la figura 6 se muestran las etapas típicas de infección de M. anisopliae sobre larvas de T. molitor. En conclusión, los aislados de M. anisopliae, por ser cepas nativas adaptadas a las condiciones ambientales de la región, son potencialmente los candidatos idóneos para el desarrollo de bioplaguicidas a base de hongos entomopatógenos para el control biológico de plagas agrícolas en los municipios estudiados del Estado de México.
Agradecimientos
Al TecNM por el financiamiento, al Tecnológico de Estudios Superiores de Ecatepec, al Instituto de Ciencias Agropecuarias de la Universidad Autónoma del Estado de Hidalgo y a la empresa AAC BIOLAB.
Referencias
Abbott, W. S. (1925). A method of computing the effectiveness of an insecticide. Journal of Economic Entomology, 18, 265–267. https://doi.org/10.1093/jee/18.2.265a
Angel-Cuapio, R. A. (2015). Uso del lirio acuático como texturizante en la producción de conidios de hongos entomopatógenos en cultivo en soporte sólido (Tesis doctoral). Departamento de Biotecnología, Universidad Autónoma Metropolitana-Iztapalapa. México D.F. https://doi.org/10.24275/uami.6m311p316
Angel-Cuapio, A., Figueroa-Montero, A., Favela-Torres, E., Viniegra-González, G., Perraud-Gaime, I. y Loera, O. (2015). Critical values of porosity in rice cultures of Isaria fumosorosea by adding water hyacinth: effect on conidial yields and quality. Applied Biochemistry and Biotechnology, 177, 446–457. https://doi.org/10.1007/s12010-015-1754-4
Arzumanov, T., Jenkins, N. y Roussos, S. (2005). Effect of aeration and substrate moisture content on sporulation of Metarhizium anisopliae var. acridum. Process Biochemistry, 40, 1037–1042. https://doi.org/10.1016/j.procbio.2004.03.013
Ayala-Zermeño, M. A., Mier, T., Sánchez Robles, J. y Toriello, C. (2005). Intraspecific variability of Lecanicillium lecanii (=Verticillium lecanii): effect of temperature on growth. Revista Mexicana de Micología, 20, 93–97.
Carrillo-Benítez, M. G., Guzmán-Franco, A. W., Alatorre-Rosas, R. y Enríquez-Vara, J. N. (2013). Diversity and genetic population structure of fungal pathogens infecting white grub larvae in agricultural soils. Microbial Ecology, 65, 437–449. https://doi.org/10.1007/s00248-012-0124-9
Castillo-Mijarez, J. M., Garza-López, P. M., Barrios-González, J. y Loera, O. (2019). Free conidia of entomopathogenic fungi modify quality traits by changing glutathione levels after an oxidant stimulus. Biological Control, 137, 104011. https://doi.org/10.1016/j.biocontrol.2019.104011
Damborsky, M., Sandrigo-Ybran, T., Bar, M. E. y Oscherov, E. (1999). Ciclo de vida de Tenebrio molitor en condiciones experimentales. Comunicaciones Científicas y Tecnológicas, 6, 35–38.
Dorta, B., Ertola, R. J. y Arcas, J. (1996). Characterization of growth and sporulation of Metarhizium anisopliae in solid-substrate fermentation. Enzyme and Microbial Technology, 19, 434–439. https://doi.org/10.1016/s0141-0229(96)00017-8
Estefes-Chávez, A. (2015). Evaluación de la producción y calidad de hongos entomopatógenos aislados de 5 delegaciones agrícolas del Distrito Federal (Tesis de Especialidad). Departamento de Biotecnología, Universidad Autónoma Metropolitana-Iztapalapa. México D.F. https://doi.org/10.20937/rica.2018.34.esp02.06
Fragues, J., Smits, N., Vidal, C., Vey, A., Vega, F., Mercadier, G. et al. (2001). Effect of liquid culture media on morphology, growth, propagule production and pathogenic activity of hyphomycete, Metarhizium flavoviride. Mycopathologia, 154, 127–138. https://doi.org/10.1023/a:1016068102003
Gandarilla-Pacheco, F. L., Elías-Santos, M. E., Flores-González, M. S., Luna-Santillana, E. D. y Quintero-Zapata, I. (2018). Virulencia de blastosporas de Isaria fumosorosea nativas del noroeste de México sobre Anastrepha ludens (Diptera: Tephritidae). Revista Colombiana de Entomología, 44, 187–192. https://doi.org/10.25100/socolen.v44i2.7316
García-Ortiz, N., Tlecuitl-Beristain, S., Favela-Torres, E. y Loera, O. (2015). Production and quality of conidia by Metarhizium anisopliae var. lepidiotum: critical oxygen level and period of mycelium competence. Applied Microbiology and Biotechnology, 99, 2783–2791. https://doi.org/10.1007/s00253-014-6225-2
Glare, T. R. (2004). Biotechnological potential of entomopathogenic fungi. En D. K. Arora (Ed.), Fungal biotechnology in agricultural, food, and environmental applications (pp. 79–90). New York: Marcel Dekker Inc. https://doi.org/10.1201/9780203913369.ch7
Hernández-Velázquez, V. M., Cervantes-Espindola, Z., Villalobos, F. J., García, L. L. y Peña-Chora, G. (2011). Aislamiento de hongos entomopatógenos en suelo y sobre gallinas ciegas (Coleoptera: Melolonthidae) en agroecosistemas de maíz. Acta Zoológica Mexicana, 27, 591–599. https://doi.org/10.21829/azm.2011.273777
Humber, R. A. (2012). Identification of entomopathogenic fungi. En L. A. Lacey (Ed.), Manual of techniques in insect pathology (pp. 151–186). Londres: Academic Press. https://doi.org/10.1016/B978-0-12-386899-2.00006-3
Ibrahim, L., Butt, T. M. y Jenkinson, P. (2002). Effect of artificial culture media on germination, growth, virulence and surface properties of the entomopathogenic hyphomycete Metarhizium anisopliae. Mycological Research, 106, 705–715. https://doi.org/10.1017/s0953756202006044
Jackson, M. A., Dunlap, C. A. y Jaronski, S. T. (2010). Ecological considerations in producing and formulating fungal entomopathogens for use in insect biocontrol. BioControl, 55, 129–145. https://doi.org/10.1007/s10526-009-9240-y
Jenkins, N. E. y Grzywacz, D. (2000). Quality control of fungal and viral biocontrol agents-assurance of product performance. Biocontrol Science and Technology, 10, 753–777. https://doi.org/10.1080/09583150020011717
Jenkins, N. E., Heviefo, G., Langewald, J., Cherry, A. J. y Lomer, C. J. (1998). Development of mass production technology for aerial conidia for use as mycopesticides. Biocontrol News and Information, 19, 21N–32N.
Lizardi-Jiménez, M. A. y Hernández-Martínez, R. (2017). Solid state fermentation (SSF): diversity of applications to valorize waste and biomass. 3 Biotech, 7, 44. https://doi.org/10.1007/s13205-017-0692-y
Loera-Corral, O., Porcayo-Loza, J., Montesinos-Matías, R. y Favela-Torres, E. (2016). Production of conidia by the fungus Metarhizium anisopliae using solid-state fermentation. En T. R. Glare y M. E. Moran-Diez (Ed.), Microbial-based biopesticides: methods and protocols, methods in molecular biology (pp. 61–69). New York: Springer. https://doi.org/10.1007/978-1-4939-6367-6_6
López-Lastra, C. C., Hajek, A. E. y Humber, R. A. (2002). Comparing methods of preservation for cultures of entomopathogenic fungi. Canadian Journal Botany, 80, 1126–1130. https://doi.org/10.1139/b02-090
Méndez-González, F., Loera, O. y Favela-Torres, E. (2018). Conidia production of Metarhizium anisopliae in bags and packed column bioreactors. Current Biotechnology, 7, 65–69. https://doi.org/10.2174/2211550105666160926123350
Miranda-Hernández, F., Angel-Cuapio, A. y Loera, O. (2017). Production of fungal spores for biological control. En A. Pandey, S. Negi y C. R. Soccol (Eds.), Current developments in biotechnology and bioengineering (pp. 757–779). Amsterdam: Academic Press. https://doi.org/10.1016/b978-0-444-63662-1.00033-6
Miranda-Hernández, F., Saucedo-Castañeda, G., Alatorre-Rosas, R. y Loera, O. (2014). Oxygen-rich culture conditions enhance the conidial infectivity and the quality of two strains of Isaria fumosorosea for potentially improved biocontrol processes. Pest Management Science, 70, 661–666. https://doi.org/10.1002/ps.3605
Molina-Ochoa, J., Lezama-Guetiérrez, R., González-Ramírez, M., López-Edwars, M., Rodríguez-Vega, M. A. y Arceo-Palacios, F. (2003). Pathogens and parasitic nematodes associated with populations of fall armyworm (Lepidoptera: Noctuidae) larvae in Mexico. Florida Entomologist, 86, 244–253. https://doi.org/10.1653/0015-4040(2003)086[0244:papnaw]2.0.co;2
Montesinos-Matías, R., Viniegra-González, G., Alatorre-Rosas, R. y Loera, O. (2011). Relationship between virulence and enzymatic profiles in the cuticle of Tenebrio molitor by 2-deoxy-d-glucose-resistant mutants of Beauveria bassiana (Bals.) Vuill. World Journal of Microbiology and Biotechnology, 27, 2095–2102. https://doi.org/10.1007/s11274-011-0672-z
Ravensberg, W. J. (2011). A roadmap to the successful development and commercialization of microbial pest control products for control of arthropods. Springer Science & Business Media. Países Bajos: Springer. https://doi.org/10.1007/978-94-007-0437-4_7
Rodríguez-Gómez, D., Loera, O., Saucedo-Castañeda, G. y Viniegra-González, G. (2009). Substrate influence on physiology and virulence of Beauveria bassiana acting on larvae and adults of Tenebrio molitor. World Journal of Microbiology and Biotechnology, 25, 513–518. https://doi.org/10.1007/s11274-008-9917-x
Ruiz-Sánchez, E., Chan-Cupul, W., Cristóbal-Alejo, J., Tun-Suárez, J. M., Pérez-Gutiérrez, A. y Lara-Reyna, J. (2013). Virulence of monosporic isolates of Isaria fumosorosea on immatures of Bemisia tabaci. Revista Mexicana de Ciencias Agrícolas, 4, 381–392. https://doi.org/10.29312/remexca.v4i3.1200
Samuels, K. D. Z., Heale, J. B. y Liwellyn, M. (1989). Characteristics relating to the pathogenicity of Metarhizium anisopliae toward Nilaparvate lugen. Journal of Invertebrate Pathology, 53, 25–31. https://doi.org/10.1016/0022-2011(89)90070-0
Seiber, J. N., Coats, J., Duke, S. O. y Gross, A. D. (2014). Biopesticides: state of the art and future opportunities. Journal of Agricultural and Food Chemistry, 62, 11613–11619. https://doi.org/10.1021/jf504252n
Tlecuitl-Beristain, S., Viniegra-González, G., Díaz-Godínez, G. y Loera, O. (2010). Medium selection and effect of higher oxygen concentration pulses on Metarhizium anisopliae var. lepidiotum conidial production and quality. Mycopathologia, 169, 387–394. https://doi.org/10.1007/s11046-009-9268-7
Toriello, C., Montoya-Sansón, E., Zavala-Ramírez, M., Navarro-Barranco, H., Basilio-Hernández, D., Hernández-Velázquez, V. et al. (2008). Virulence and thermotolerance of monospore cultures of Metarhizium anisopliae var. anisopliae isolated from spittlebugs (Hemiptera: Cercopidae). Revista Mexicana de Micología, 28, 57–66.
Van Breukelen, F. R., Haemers, S., Wijffels, R. H. y Rinzema, A. (2011). Bioreactor and substrate selection for solid-state cultivation of the malaria mosquito control agent Metarhizium anisopliae. Process Biochemistry, 46, 751–757. https://doi.org/10.1016/j.procbio.2010.11.023
Zimmermann, G. (1986). The Galleria bait method for detection of entomopathogenic fungi in soil. Journal of Applied Entomology, 102, 213–215. https://doi.org/10.1111/j.1439-0418.1986.tb00912.x