Alejandra Robles-Payán a, Héctor Reyes-Bonilla a y Carlos Cáceres-Martínez b, *
a Universidad Autónoma de Baja California Sur, Departamento Académico de Ciencias Marinas y Costeras, Carretera al sur Km 5. 5, Colonia El Mezquitito, 23080 La Paz, Baja California Sur, México
b Perlas del Cortez, Lateral a los Planes 161, Colonia Jardines del Sur, 23055 La Paz, Baja California Sur, México
*Autor para correspondencia: pteria25@gmail.com (C. Cáceres-Martínez)
Recibido: 19 junio 2020; aceptado: 22 febrero 2021
Resumen
Las comunidades coralinas han sido afectadas negativamente por el impacto de las perturbaciones naturales y las actividades turísticas, reflejándose en la disminución de la cobertura coralina; por ello, es necesario llevar a cabo esfuerzos de restauración para recuperar las funciones ecológicas y servicios ambientales que ofrecen. En este trabajo se evaluaron las tasas de supervivencia y crecimiento de 96 fragmentos de coral del género Pocillopora cultivados en viveros en la bahía de Pichilingue (Baja California Sur), en el periodo de enero de 2018 a febrero de 2019 y se creó un modelo para predecir la superficie arrecifal que estos corales pueden restaurar considerando su supervivencia y crecimiento. Los fragmentos tuvieron alta supervivencia (95%); las tasas de crecimiento fueron de 46.34 ± 2.35 mm/año en altura, 54.62 ± 3.34 mm/año en diámetro mayor, 57.90 ± 2.05 mm/año en diámetro menor y 7,516.22 mm3/año en volumen. Las tasas de supervivencia y crecimiento fueron altas comparadas con otros trabajos realizados en el Pacífico mexicano y Pacífico este tropical, lo que evidencia las buenas condiciones del sitio donde el vivero fue establecido para el desarrollo coralino. El modelo indica que la superficie arrecifal recuperada por los corales alcanzaría 342,826 cm2 en 15 años.
Palabras clave: Pocillopora; Restauración coralina; Cultivo de corales; Trasplantes; Vivero; Tasa de crecimiento; Tasa de supervivencia
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Coral growth and survival during the first gardening phase in La Paz, Baja California Sur, Mexico
Abstract
The negative impact of natural disturbances and tourism has degraded stony coral communities leading to a decrease in coral cover. It is necessary to carry out restoration efforts in order to recover the ecological functions and environmental services they offer. In this study the survival and growth rates were evaluated in 96 coral fragments of the genus Pocillopora cultivated at Pichilingue Bay (Baja California Sur), from January 2018 to February 2019 and a model was created to predict the reef surface that these corals could restore considering their survival and growth speed. The fragments showed high survival (95%); growth rates were 46.34 ± 2.35 mm/yr in height, 54.62 ± 3.34 mm/yr in larger diameter, 57.90 ± 2.05 mm/yr in smaller diameter and 7,516.22 mm3/yr in volume of the colony. Both survival and growth were high compared to other works carried out in the Mexican Pacific and the Eastern Tropical Pacific, which shows the good conditions of the site where the nursery was established for coral development. The model indicates that the reef surface recovered by the corals would reach 342,826 cm2 in 15 years.
Keywords: Pocillopora; Coral restoration; Coral gardening; Transplants; Nursery; Growth rate; Survival rate
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
Los arrecifes de coral son uno de los ecosistemas más productivos y con mayor diversidad biológica del planeta, juegan un papel vital participando en los ciclos biogeoquímicos y son hábitat para más del 25% de las especies marinas (Hoegh-Guldberg et al., 2007; Horoszowski-Fridman y Rinkevich, 2016; Plaisance et al., 2011). Además, brindan servicios ambientales de gran importancia como protección a las zonas costeras contra erosión, tormentas y huracanes, y proporcionan bienes a más de 500 millones de personas que utilizan los arrecifes de coral como fuentes directas e indirectas de alimentación y empleo proveniente de actividades turísticas y comercio (Horoszowski-Fridman y Rinkevich, 2016). A pesar de su relevancia ecológica, económica y social, las actividades antropogénicas como la contaminación, el turismo no regulado y la sobreexplotación de recursos marinos, han tenido un impacto negativo directo en las comunidades de coral en diversas partes del océano (Cortés y Reyes-Bonilla, 2017; Hoegh-Guldberg et al., 2007). Lo anterior, aunado a las perturbaciones naturales como la proliferación de enfermedades y depredadores y los eventos de blanqueamiento, y el conjunto de elementos negativos, se ve reflejado en una disminución de cobertura, pérdida de resiliencia, eventos de mortalidad masiva, bajo reclutamiento y cambios en la composición de especies (Rinkevich, 2015; Romero-Torres et al., 2020). En consecuencia, los arrecifes coralinos son unos de los ecosistemas que a nivel mundial presentan mayor estrés (Ellis et al., 2019).
Como respuesta a los efectos de estas perturbaciones, en las últimas décadas han aumentado los esfuerzos de protección mediante la designación de áreas naturales protegidas (Mellin et al., 2016), sin embargo, estas acciones han sido insuficientes ya que la gran mayoría de sitios con arrecifes aún no están bajo regímenes de protección y permanecen expuestos a usos humanos indebidos (Burke et al., 2011). El escenario descrito ha propiciado la búsqueda de alternativas que se sumen a la protección para mitigar el deterioro de estos ecosistemas y entre los principales enfoques se encuentra la restauración, proceso que busca ayudar a que un hábitat degradado pueda volver a un estado lo más cercano posible del original, con el objetivo de que sea autosuficiente y sea capaz de adaptarse a los cambios ambientales (Bayraktarov et al., 2020). En el caso de los arrecifes, uno de los enfoques más prometedores es la silvicultura marina o cultivo de corales, una técnica que consiste en 2 fases: en la primera se cultivan los fragmentos o colonias de coral en laboratorios o zonas marinas designadas (“viveros”) y en la segunda se trasplantan las colonias ya desarrolladas a sitios que han sufrido algún nivel de degradación (Horoszowski-Fridman y Rinkevich, 2016). La fase de vivero tiene como finalidad proteger a los fragmentos de coral durante las etapas de desarrollo tempranas, cuando éstos son más vulnerables ante las condiciones ambientales y con la intención de que sean trasplantados cuando tengan un mayor tamaño y las probabilidades de supervivencia sean mayores (Boström-Einarsson et al., 2020).
Las comunidades coralinas del Pacífico este tropical se caracterizan por ser pequeñas, estructuralmente simples, de distribución discontinua y con baja diversidad de especies (López-Pérez et al., 2012). En estos sistemas el género Pocillopora es considerado el principal constructor arrecifal y las especies dominantes son P. capitata, P. damicornis, P. verrucosa, P. elegans y P. meandrina (LaJeunesse et al., 2008), las cuales habitan desde las zonas superficiales hasta 8 m de profundidad y en conjunto, son responsables de más de 90% de la producción total de coral en la región (Cabral-Tena et al., 2018). Los corales presentes en el Pacífico este tropical han sufrido un continuo deterioro por fenómenos naturales como la oscilación sureña El Niño, huracanes y tormentas tropicales, y se espera que el cambio climático aumente la frecuencia e intensidad de estos eventos debido al ascenso en la temperatura superficial del mar (Calderón-Aguilera et al., 2007; Hoyos et al., 2006). Una de las regiones que se ha visto más impactada por esos agentes naturales es el golfo de California, donde existen comunidades coralinas y arrecifes en su parte suroeste; estos son pequeños, pero generan beneficios económicos importantes debido a que sustentan actividades turísticas como el buceo autónomo recreativo, así como la pesca comercial y de ornato (Olmos-Martínez et al., 2015; Reyes-Bonilla, 2003). Desafortunadamente, en paralelo con los cambios ambientales, el cada vez mayor uso extractivo contribuye gradualmente a la pérdida de la funcionalidad de estos ecosistemas (Cortés y Reyes-Bonilla, 2017; Enríquez-Andrade et al., 2005).
La aplicación de métodos de restauración coralina en el Pacífico mexicano puede ser una buena estrategia para conservar o recuperar las funciones ecológicas y servicios ecosistémicos de los arrecifes. Los trabajos de restauración en dicha región se han llevado a cabo en los estados de Colima, Nayarit y Guerrero (Figueroa-Camacho y Nava, 2015; Liñán-Cabello et al., 2010; Muñiz-Anguiano et al., 2017; Tortolero-Langarica et al., 2014, 2019), todos ellos utilizando especies del género Pocillopora, que son las de mejor potencial para fines de restauración en la región por su dominancia, rápido crecimiento y alta tasa de supervivencia (Tortolero-Langarica et al., 2014). El objetivo del presente estudio fue evaluar el éxito en el desarrollo de fragmentos de coral del género Pocillopora durante un experimento de cultivo enfocado a la restauración coralina, el cual se llevó a cabo a lo largo de un año en la bahía de Pichilingue, dentro de la bahía de La Paz, en el suroeste del golfo de California. Para este fin, se visitaron arrecifes cercanos para tomar fragmentos desprendidos naturalmente y estos fueron incubados en viveros donde se hizo la cuantificación de sus tasas de crecimiento (altura, diámetro y volumen colonial) y de supervivencia. Finalmente, a partir de esos parámetros se planteó un modelo que indicara cuál sería la cobertura de coral sobre el fondo que se espera alcanzar en el futuro inmediato a partir del ejercicio de restauración y que representa un resultado novedoso e importante. Los resultados de este trabajo sentarán las bases técnicas para un proyecto de recuperación arrecifal a gran escala en la bahía de La Paz.
Materiales y métodos
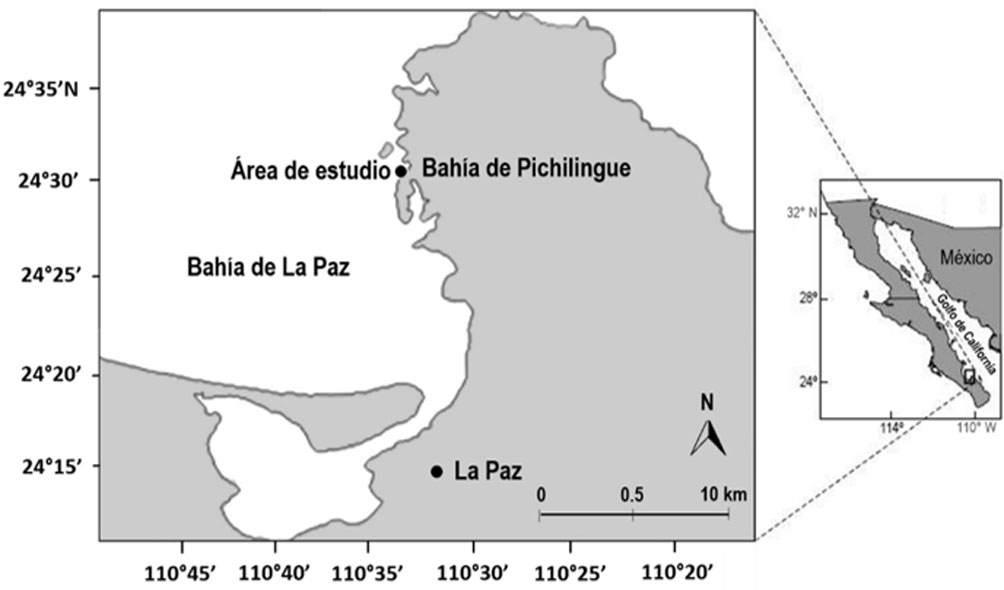
La bahía de La Paz se localiza en la parte suroriental de la península de Baja California (fig. 1) y el sitio de instalación de las estructuras de cultivo estaba en la punta suroeste de la bahía de Pichilingue.
La temperatura superficial del mar en la bahía de La Paz oscila entre 21 y 31°C a lo largo del año, alcanzando valores máximos entre julio y septiembre y mínimos entre enero y marzo (Martínez-Flores et al., 2006). El intervalo de clorofila-a en la zona presenta variaciones entre 0.26 y 2.41 mg/lt-1, con un pico en invierno y concentraciones muy bajas en verano (Cervantes-Duarte et al., 2004); en consecuencia, durante la temporada fría la transparencia del agua es menor a 3 m, aunque se eleva hasta más de 8 m en meses cálidos (Cervantes-Duarte et al., 2001). La salinidad superficial en la bahía de La Paz se encuentra entre 35.3 y 35.5 ups, siendo alta en invierno-primavera y baja en verano-otoño (Aceves-Medina et al., 2008).
El estudio comenzó con la recolecta de fragmentos coralinos del género Pocillopora, los cuales provinieron de una pequeña comunidad coralina que se desarrolla bordeando la costa de la punta norte de la misma bahía de Pichilingue. Las piezas estaban en buen estado de salud, a una profundidad de 2 a 3 m y su tamaño original era de entre 3-10 cm de altura. Los corales fueron recogidos del fondo, colocados en cubetas con agua de mar y trasladados en una embarcación al sitio de cultivo. Las estructuras de cultivo se ubicaron a una profundidad de 3-4 m y a una distancia de 10 m de la playa. Los fragmentos recolectados se colocaron de manera aleatoria en 2 estructuras formadas por tubos de PVC de 5 cm de diámetro (fig. 2A), fijas al sustrato por medio de 4 varillas de 0.8 m de largo cada una, que se enterraron en la arena con ayuda de un mazo. Todos los tubos tenían en su parte superior perforaciones de 1 a 2 cm de diámetro, espaciadas cada 10 cm, en las que se ensamblaron soportes de PVC, los cuales permitieron sujetar los fragmentos de coral empleando cinchos de plástico (fig. 2B). Para el estudio, se trabajó con un total de 96 fragmentos; en la primera estructura, que cuenta con 3 tubos horizontales, se colocaron 46 y en la segunda de 4 tubos horizontales, se colocaron 50. Cada uno de los ejemplares fue ubicado por medio de señalamientos en los soportes de cada sección, de manera que se pudiera seguir su desarrollo de manera individual. De forma mensual se llevaron a cabo actividades de mantenimiento que consistieron en retirar la acumulación de algas sobre las estructuras con ayuda de cepillos y espátulas.
Con el fin de evaluar el desarrollo de los fragmentos se realizaron visitas mensuales al sitio entre enero de 2018 a febrero de 2019, donde se determinó la condición de cada pieza observando signos de deterioro como presencia de algas, blanqueamiento y fragmentación. Además, se cuantificó la cantidad de fragmentos muertos, los cuales eran aquellos que presentaron crecimiento algal que cubría más del 60% de la rama coralina (fig. 3). Para evaluar el crecimiento, se tomaron medidas de altura, diámetro mayor y diámetro menor de cada pieza de Pocillopora con ayuda de un vernier graduado en milímetros. Se consideró como diámetro mayor la extensión máxima de la colonia proyectada sobre el fondo y el diámetro menor como aquel perpendicular al diámetro mayor. La altura se consideró como la distancia desde la base del fragmento, hasta la punta de la ramificación más alta (Tortolero-Langarica et al., 2014).
El crecimiento de cada individuo (“ramet”) se registró usando los valores de incremento en altura y diámetros de los fragmentos a través de los días de estudio, además por medio de la estimación del aumento de volumen en el tiempo. Esta variable representa el espacio físico ocupado por cada fragmento en cultivo y se calculó considerando cada coral como un cuerpo geométrico de forma aproximadamente rectangular (Shafir et al., 2006); bajo esa suposición, el volumen se calculó mediante la fórmula V= l 1 l 2 l 3, donde l representa cada medida del fragmento coralino: altura, diámetro mayor y diámetro menor. Cabe señalar que este procedimiento de estimación del volumen ha sido empleado frecuentemente en estudios de crecimiento coralino y en investigaciones sobre restauración coralina en el Pacífico mexicano (Mbije et al., 2010; Shafir y Rinkevich, 2010; Shafir et al., 2006; Tortolero-Langarica et al., 2019).


La tasa de crecimiento en altura y diámetro diaria se obtuvo mediante un modelo de regresión lineal simple, calculando la pendiente (equivalente a la tasa de crecimiento) y considerando como variable independiente los días de monitoreo transcurridos a partir de la colocación de las piezas (Zar, 2010). De manera análoga, la tasa de mortalidad se calculó como la pendiente de una regresión lineal entre el número de días de estudio (ordenada) y la cantidad de fragmentos vivos que se encontraron en cada visita (variable independiente; Zar, 2010). La significancia de dichas regresiones se comprobó con análisis de varianza (Piniak y Brown, 2008).
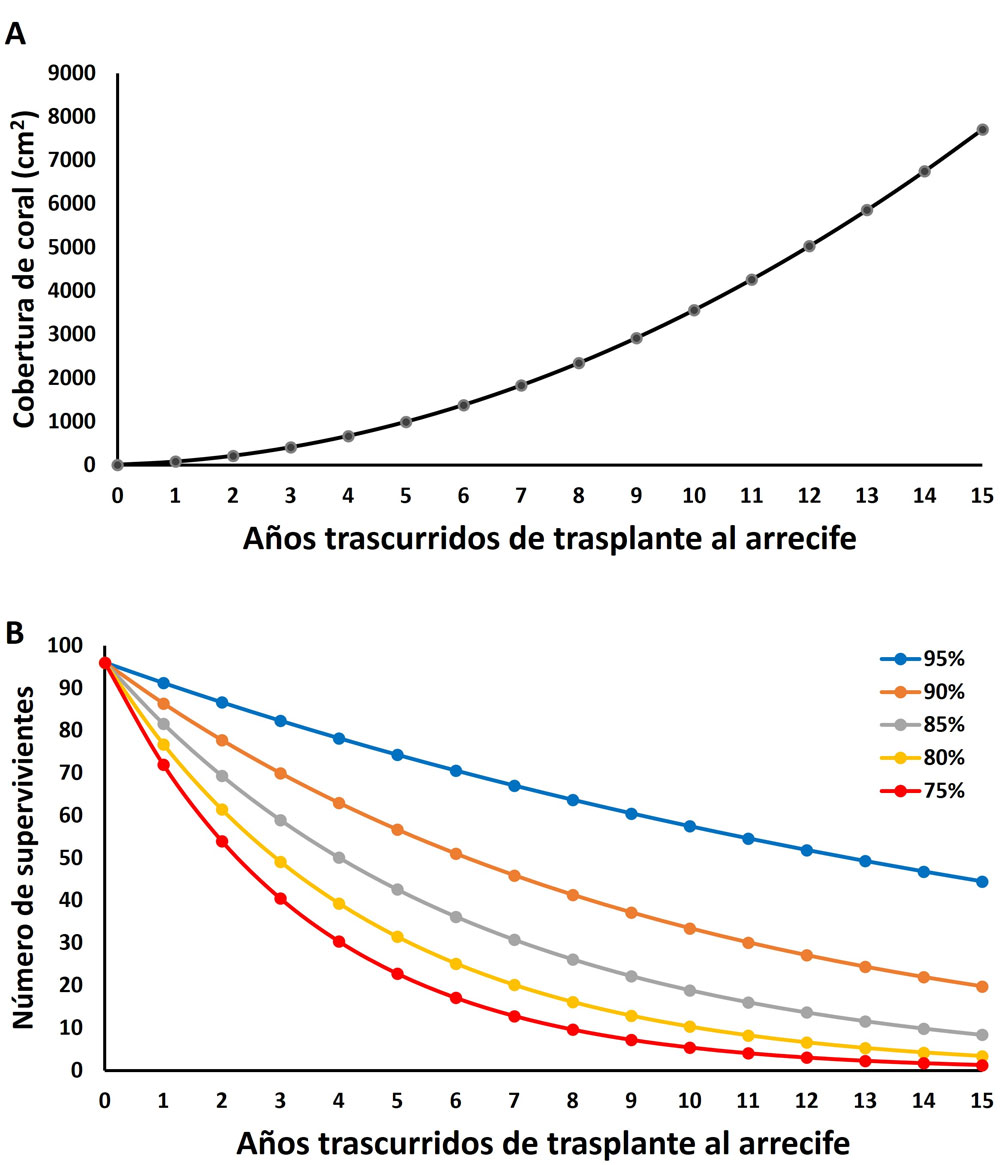
Finalmente, se plantearon modelos para estimar la cobertura de coral esperada cada año una vez que los fragmentos fueran trasplantados al arrecife, tomando en cuenta su velocidad de crecimiento y la mortalidad estimada. Primero se tomó el promedio de diámetro mayor y menor que tenían las 96 piezas individuales al inicio del experimento (45.2 × 23.3 mm) y a ese valor se le adicionó el correspondiente a la tasa anual de crecimiento estimada en el campo para cada dimensión, bajo la suposición que ésta se mantiene constante ya que se ha demostrado que para el género Pocillopora el cambio en tamaño varía localmente en menos de 15% (Medellín-Maldonado et al., 2016). Luego, por medio del producto de cada par de valores se calculó la cobertura anual del fragmento sobre el fondo; este proceso se repitió por un intervalo de 15 años. En paralelo, tomando en cuenta la cifra inicial de corales del experimento, se calculó el número de corales vivos por 15 años a partir de 5 escenarios de supervivencia anual: 95% (equivalente al valor estimado en el campo; ver Resultados) y otras 4 posibilidades que implican mayor mortalidad causada por algún agente natural o antropogénico (supervivencia de 90%, 85%, 80% y 75%). Una vez con estos insumos, para saber la cobertura de fondo que los corales restaurados ocuparían cada año, se multiplicó el número de organismos supervivientes por la superficie de fondo que ocupa cada uno en promedio.
Resultados
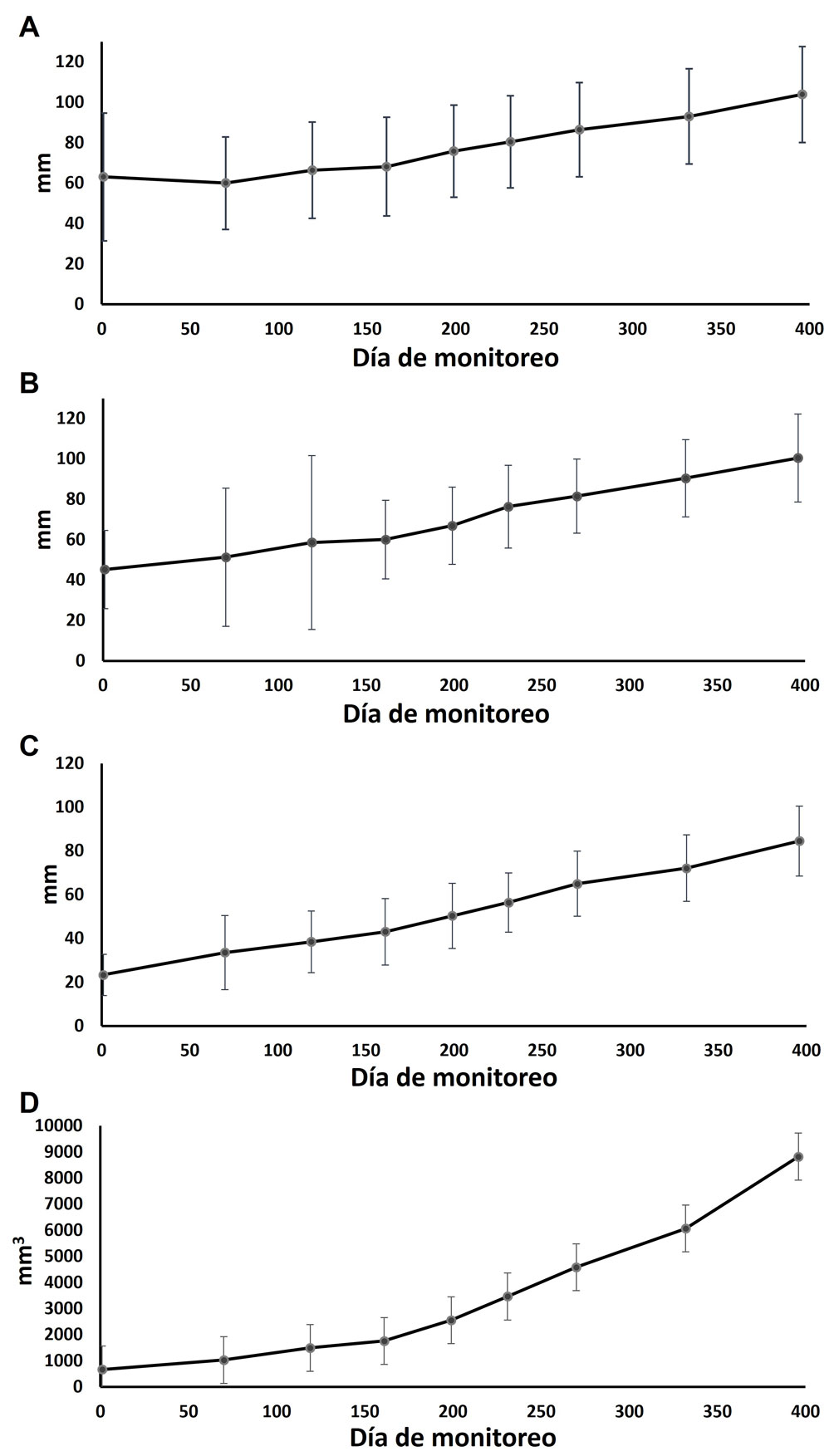
Los datos obtenidos después de 396 días de seguimiento muestran que la altura de los fragmentos al final del estudio fue de 103.88 ± 2.43 mm en promedio y error típico; ésto representa un incremento neto de 40.76 mm sobre la altura inicial, que fue de 63.12 ± 5.98 mm en promedio y se traduce a un aumento de 64% (fig. 4A). Por otro lado, se registró un diámetro mayor final de 100.48 ± 2.22 mm en promedio, equivalente a un aumento de 55.19 mm sobre los valores iniciales que fueron de 45.29 ± 3.66 mm (121% superior; fig. 4B). El diámetro menor fue de 84.52 ± 1.68 mm en promedio al final del estudio, incrementando 61.17 mm sobre la línea base (23.35 ± 1.77 mm; incremento de 262%; fig. 4C). Finalmente (fig. 4D), se registró un volumen final de 8,822.03 mm3, con un aumento total promedio de 8,104.60 mm3 que equivale a 1,221% respecto al valor inicial (667.43 mm3).
A partir de los datos anteriores, se calcularon las tasas de crecimiento que fueron de 0.13 ± 0.01 mm/día para la altura (r2 = 0.113, p < 0.001), 0.15 ± 0.01 mm/día para el diámetro mayor (r2 = 0.145, p = <0.001), 0.16 ± 0.01 mm/día (r2 = 0.155, p < 0.001) para el diámetro menor y 20.59 ± 0.94 mm3/día (r2 = 20.358, p < 0.001) para el volumen.
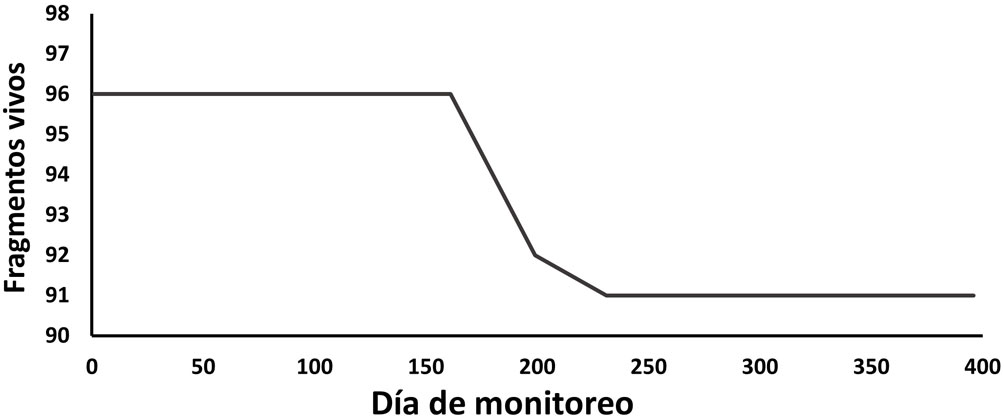
Al final del estudio, 95% de los fragmentos sobrevivió; 91 de 96 en total (fig. 5). La pérdida que se registró fue por el desprendimiento de 4 piezas (4%) y por la muerte de una (1%), asociada al crecimiento algal. La mortalidad se concentró entre los días 78-116 del estudio, que corresponde a los meses de junio-julio, mientras que el desprendimiento de fragmentos se registró entre los días 78-148, en julio-agosto. La tasa de mortalidad obtenida fue de 0.017 ± 1.34 organismos/día (r2 = 0.73, p = 0.003).
Con los datos anteriores, es posible estimar la superficie ocupada de fondo que un fragmento recuperado de coral puede ir alcanzando en el tiempo, suponiendo que su tasa de crecimiento horizontal se mantenga entre 0.15 y 0.16 mm/día en diámetro mayor y menor (fig. 6A) y adicionalmente se puede pronosticar cuantos fragmentos permanecerán vivos a futuro tomando en cuenta la supervivencia anual de 95% y de 4 escenarios donde los corales sufrieran mayores niveles de mortalidad (fig. 6B).
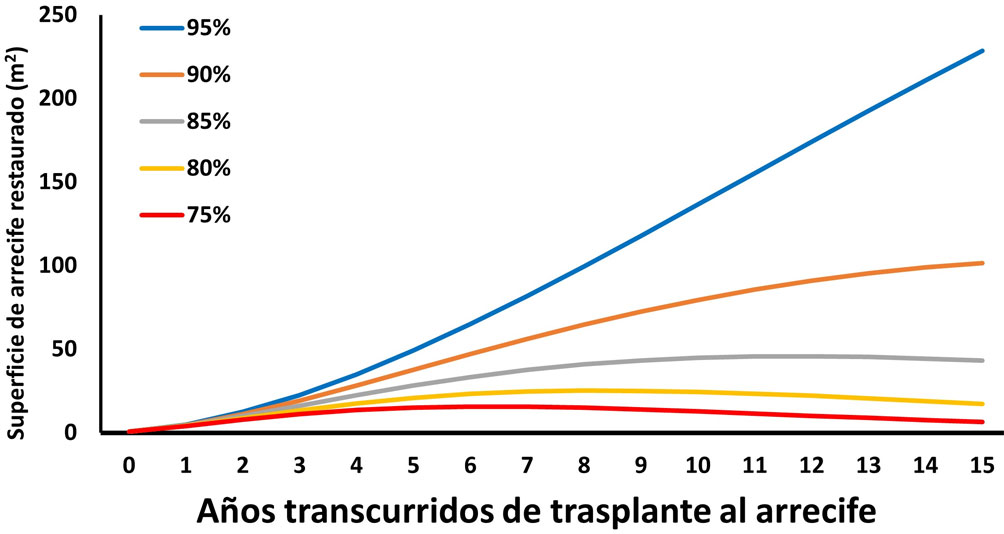
Al multiplicar el número de organismos que se espera sobrevivan cada año en el futuro por la superficie de fondo que ocupa cada uno en promedio (fig. 7), puede observarse que partiendo de un número de 96 fragmentos que al ser instalados en los viveros (año 0) en conjunto sumaban una superficie total de 1,015 cm2, la proyección a futuro considerando una supervivencia de 95% indica que en 5 años la cobertura sería de 73,968 cm2; ésta se elevaría a 204,717 cm2 en 10 años y llegaría a 342,826 cm2 en 15 años (casi 300 veces superior). Para los escenarios de supervivencia de 90% y 85%, la cobertura esperada 3 lustros en el futuro sería de 152,355 y 64,640 cm2, respectivamente (64 a 150 veces superior al valor inicial), y aún para los peores escenarios (supervivencia de 80% o 75%), se tendrían a 15 años coberturas de 9,888 a 26,035 cm2, mucho mayores a las originales. Estos resultados demuestran que un ejercicio de restauración basado en los corales contenidos en los viveros del presente experimento sería muy exitoso en el sentido de incrementar a largo plazo la cantidad de corales y por ello, la condición de los arrecifes que se tenga interés en recuperar.
Discusión
Las presiones continuas de las actividades antropogénicas sobre los arrecifes en el Pacífico mexicano han propiciado la pérdida de la cobertura coralina (Figueroa-Camacho y Nava, 2015), por ésto resulta cada vez más necesario tomar acciones para mantener y recuperar estos ecosistemas y los servicios que ofrecen mediante acciones de restauración. En este trabajo se adaptó una técnica común utilizada en todo el mundo, donde se cultivaron fragmentos de coral como primera fase de una técnica de restauración, obteniendo resultados favorables.
Las tasas de crecimiento coralino en altura obtenidas en el presente estudio fueron similares a lo reportado en otros trabajos realizados en el Pacífico mexicano. En el experimento se tuvieron valores de 0.13 ± 0.01 mm/día de altura, equivalente a 46.34 ± 2.35 mm/año (fig. 4A), mientras que para el mismo género Pocillopora, Tortolero-Langarica et al. (2019) registraron en el Parque Nacional Islas Marietas, Nayarit, aumentos ligeramente menores de 44.7 ± 1.07mm/año y Liñán-Cabello et al. (2010) reportaron en el arrecife de Carrizales, Colima, crecimientos promedio de 38.9 y 35.2 mm/año utilizando diferentes técnicas de restauración. En contraste, Muñiz-Anguiano et al. (2017) obtuvieron en el mismo arrecife de Carrizales valores de crecimiento en altura muy bajos de 9.7 y 9.3 mm/año en 2 sitios, situación que podría estar relacionada con una fuerte anomalía de temperatura que se presentó en la zona durante el tiempo de estudio y por la presencia de comunidades algales y bioerosionadores del coral.
En la bahía de La Paz, la temperatura es inferior a la del Pacífico central mexicano y del mismo modo, la transparencia del agua también es mucho menor dada la elevada producción primaria en la columna de agua (Fiedler y Talley, 2006; Pennington et al., 2006). En estudios de campo se ha visto que ambos factores tienen una influencia negativa en el crecimiento coralino en el sur del golfo de California, en relación con el resto del Pacífico mexicano, como lo demostraron Medellín-Maldonado et al. (2016) y Cabral-Tena et al. (2018). Tomando en cuenta ésto, se esperaría obtener promedios anuales de crecimiento coralino menores en La Paz, pero de hecho, las tasas registradas fueron superiores a las de sitios del sur del Pacífico mexicano (Liñán-Cabello et al., 2010; Tortolero-Langarica et al., 2019) o de algunos arrecifes del sur del Pacífico este tropical (tabla 1). Se sugiere que este resultado puede atribuirse a las condiciones del sitio de cultivo elegido en la bahía de Pichilingue (somero, con baja energía y alta iluminación), que son propicias para el crecimiento de los corales escleractinios (Sheppard et al., 2017). La elección del sitio para el desarrollo de los corales supone una de las principales ventajas de utilizar este método de restauración (Boström-Einarsson et al., 2020).
Por otra parte, para el diámetro mayor, en este estudio se registraron aumentos de 0.15 ± 0.01 mm/día (o 54.62 ± 3.34 mm/año), que implican 121% de mejora en relación con el tamaño coralino inicial (fig. 4B). Tortolero-Langarica et al. (2019) indican que los corales en Islas Marietas crecieron 35.3 ± 1.41 mm/año en esta dimensión; es decir, mucho menos de lo observado en La Paz. Respecto al diámetro menor, en Pichilingue, los corales pocillopóridos crecieron 0.16 ± 0.01 mm/día (o 57.90 ± 2.05 mm/año; fig. 4C), mientras que Tortolero-Langarica et al. (2019) refiere aumentos muy inferiores, de solo 29.4 ± 1.10 mm/año. Las tasas de crecimiento superiores obtenidas en este estudio podrían estar relacionadas con las características de la zona, pues el arrecife de las islas Marietas está expuesto a fuertes corrientes, mientras que el sitio de emplazamiento en Pichilingue es protegido, por lo que la dinámica del agua es baja y los corales reciben mayor penetración de luz que ayuda a una alta eficiencia fotosintética de las zooxantelas y a un mayor depósito de carbonatos y crecimiento coralino (Cabral-Tena et al., 2018). Finalmente, en relación con el volumen de las colonias, los fragmentos en este estudio mostraron valores de 20.59 ± 0.94 mm3/día (7,516.23 ± 343.1 mm3/año; fig. 4D), que son muy superiores a la tasa de crecimiento en volumen reportada por Tortolero-Langarica et al. (2019), de 4,760 ± 59.43 mm3/año. El mayor crecimiento que se presentó en este estudio podría estar relacionado con las condiciones de temperatura de los sitios durante el tiempo de estudio, en Pichilingue se alcanzaron temperaturas máximas durante el verano de 29°C, dentro del rango normal, mientras que Tortolero-Langarica et al. (2019) reportan que en las islas Marietas se alcanzaron temperaturas extremas (31°C). Durante condiciones de estrés térmico, los corales destinan gran parte de su energía a restaurar la homeostasis y por la falta de energía disponible la velocidad de crecimiento puede disminuir (Rodríguez-Troncoso et al., 2016). La alta tasa de crecimiento en volumen que muestran los corales del género Pocillopora cultivados son un indicativo de que su recolocación en el arrecife aumentará la rugosidad topográfica a las zonas donde sean trasplantados en Baja California Sur, lo cual es importante para su funcionalidad resultando en más espacios donde las especies asociadas pueden habitar o refugiarse, procesos de retención de alimento y resiliencia del ecosistema (Horoszowski-Fridman y Rinkevich, 2016).
Tabla 1
Tasas de crecimiento en altura reportadas en trabajos de campo y de restauración para el género Pocillopora en el Pacífico este tropical.
|
Localidad |
Tasa de crecimiento (mm/año) |
Referencia |
|
Panamá (campo) |
30-38 |
Glynn, 1977 |
|
Costa Rica (campo) |
29-34 |
Guzmán y Cortés, 1989 |
|
Colombia (campo) |
18 |
Prahl y Vargas-Ángel, 1990 |
|
Costa Rica (campo) |
38-47 |
Jiménez y Cortés, 2003 |
|
Panamá (campo) |
27 |
Manzello, 2010 |
|
México (campo) |
35 |
Tortolero-Langarica et al., 2017 |
|
Colombia (restauración) |
18.9 |
Lizcano-Sandoval et al., 2018 |
|
Colombia (restauración) |
26 |
Ishida-Castañeda et al., 2020 |
|
México (restauración) |
46.34 |
Este estudio |
El porcentaje de supervivencia en este trabajo fue considerado alto para un trabajo de restauración (95%; 91 de 96 corales; fig. 5), con una mortalidad de tan solo 1% asociada al crecimiento algal. Algo similar se reporta en el trabajo de Chou et al. (2017) en Singapur, donde se obtuvo una supervivencia de 99% atribuida a los esfuerzos de limpieza de las estructuras de cultivo para eliminar algas que pudieran sobrecrecer en los corales, actividades que también se realizaron mensualmente en las estructuras de Pichilingue. La pérdida de fragmentos por desprendimiento (4%) posiblemente fue por error humano en el momento de la fijación, ya que las piezas que se perdieron eran pequeñas (30-40 mm de altura), por lo que se recomienda tener más cuidado al sujetarlos o utilizar fragmentos de tamaño mayor a 50 mm al emplear esta técnica. En este sentido, Lizcano-Sandoval et al. (2018) exponen que los pocillopóridos más grandes tienen más probabilidades de sobrevivir a la depredación y el recubrimiento de algas porque una mayor superficie de tejido vivo ofrece una ventaja al exponerse a condiciones adversas, lo que coincide con Muñiz-Anguiano et al. (2017), que reportaron un tamaño óptimo para el cultivo de 80-150 mm, reforzando la recomendación de iniciar el cultivo de fragmentos con piezas de al menos 50 mm de altura no solamente por su fácil sujeción al sistema, también por sus mayores posibilidades de sobrevivir.
El porcentaje de supervivencia en el presente estudio fue semejante al presentado por Tortolero-Langarica et al. (2014) de 93% y superior al reportado en otros trabajos de restauración en el Pacífico mexicano y Pacífico este tropical: Guzmán (1991) anotó en Costa Rica una supervivencia de 79-83%, Liñán-Cabello et al. (2010) obtuvieron valores de 89% a 95% y Figueroa-Camacho y Nava (2015) y Muñiz-Anguiano et al. (2017) registraron niveles de supervivencia ligeramente menores, de 90%. Los principales factores que afectaron la supervivencia de los fragmentos en estos trabajos fueron evitados en Pichilingue, ya que las estructuras se situaron en una zona protegida donde no hay circulación de embarcaciones que pudieran golpear y desprender los corales, también se realizaron actividades de limpieza para remover el crecimiento de algas de la estructura, y el sitio de cultivo se encuentra alejado de las comunidades naturales disminuyendo la interacción de los fragmentos con depredadores.
La mayoría de los trabajos coinciden que es común registrar una mayor mortalidad de fragmentos durante la temporada fría (Liñán-Cabello et al., 2010; Mbije et al., 2010; Shaish et al., 2010), pues con el descenso de la temperatura aumenta la productividad y esto favorece el crecimiento algal, aumentando la competencia hacia los corales y además el frío puede provocar estrés en los organismos derivando en eventos de blanqueamiento (González-Espinosa y Donner, 2020; LaJeunesse et al., 2007). No fue el caso en este trabajo, donde la mortalidad ocurrió entre junio-julio y fue atribuida al crecimiento algal sobre fragmentos de tamaño pequeño. Por otra parte, Liñán-Cabello et al. (2010) resaltaron la importancia de prestar atención a los factores que reducen la supervivencia: la técnica utilizada, el nivel de manipulación durante el proceso y la condición de los fragmentos, por lo que en este estudio se seleccionaron cuidadosamente los fragmentos para evitar mortalidades tempranas y se procuró manipularlos lo menos posible al transportarlos y colocarlos en las estructuras.
A partir de las tasas de crecimiento horizontal y de supervivencia (fig. 6), se planteó un modelo teórico de aumento en la superficie a ser ocupada por los corales una vez reintegrados al arrecife, el cual ofrece información importante. La proyección (fig. 7) indica que con la tasa de supervivencia estimada en los viveros de Pichilingue, el incremento de cobertura coralina sería superior a 300% en un intervalo de 15 años y que incluso con valores superiores de mortalidad, la cobertura coralina mantendría niveles positivos; es decir, sería siempre superior a los valores originales. Este hallazgo implica que una vez instalados los fragmentos en el arrecife, podrían ser elementos importantes para aumentar la abundancia coralina local y por ende generar hábitat para múltiples especies y ofrecer una serie de servicios ambientales a la sociedad, incluyendo la mejora de la calidad del paisaje, el reciclamiento de nutrientes y la producción de juveniles de especies de importancia comercial.
Es importante anotar que estos resultados suponen que las colonias mantienen su integridad y no se fragmentan, pero incluso esta condición puede representar situaciones positivas debido a las estrategias de vida de los corales del género Pocillopora. Este tipo de organismos, de manera natural, tiene alta tasa de fragmentación (Baums et al., 2014) y se ha discutido que esa es una estrategia que las especies han empleado para aumentar su tamaño poblacional en el Pacífico oriental y en específico en el golfo de California (Aranceta-Garza et al., 2012; Enochs y Glynn, 2017). La razón de ello es que la pérdida de una rama no afecta demasiado el tamaño total o la probabilidad de supervivencia de un coral, mientras que al mismo tiempo esa pieza puede fijarse de manera natural al fondo y convertirse en corto plazo en una nueva colonia. De este modo, incluso podría argumentarse que la cobertura coralina resultante a largo plazo de un esfuerzo de restauración con las características aquí descritas, en realidad podría estar subestimada.
Los resultados de este trabajo aportan evidencia a favor de la factibilidad de conducir esfuerzos de restauración coralina en la sección sur de golfo de California, a pesar de las condiciones relativamente poco propicias para el desarrollo coralino. No obstante, considerando los altos costos que implican los esfuerzos de restauración y del seguimiento de su éxito en el tiempo (Bayraktarov et al., 2016), este tipo de iniciativas pueden iniciarse con apoyo federal, de organizaciones civiles o compañías privadas, pero luego mantenerse por medio de la acción ciudadana o mediante un enfoque de negocios destinado al turismo, por ejemplo, salidas de buceo recreativas financiadas por huéspedes o visitantes a una empresa para sembrar corales en una zona designada.
En conclusión, los resultados de la investigación mostraron que los fragmentos coralinos del género Pocillopora colocados en viveros en la bahía de Pichilingue presentaron tasas de crecimiento similares o superiores a las reportadas en otros trabajos conducidos en el Pacífico americano y que la tasa de mortalidad de las piezas fue de las más bajas reportadas en la literatura. Los buenos resultados alcanzados podrían estar relacionados con la adecuada selección del sitio de cultivo (alta iluminación, protección de las corrientes, oleaje e impacto de las embarcaciones y alejado de los depredadores). El modelo de cobertura coralina a futuro muestra que la alta tasa de supervivencia y crecimiento registrada en los corales parece garantizar el éxito del esfuerzo de restauración y gracias a ello, el aumento en la superficie de fondo cubierta por las colonias debe representar beneficios tanto ecológicos como sociales.
Agradecimientos
Agradecemos al programa Jóvenes Construyendo el Futuro por la beca otorgada a ARP, a la empresa Perlas del Cortez S. de R. L. M.I. y a la compañía Baja Ferries S. A. por aportar los fondos para el desarrollo del estudio.
Referencias
Aceves-Medina, G., Saldierna-Martínez, R., Hinojosa-Medina, A., Jiménez-Rosenberg, S. P., Hernández-Rivas, M. E. y Morales-Ávila, R. (2008). Vertical structure of larval fish assemblages during diel cycles in summer and winter in the southern part of bahía de La Paz, México. Estuarine, Coastal and Shelf Science, 76, 889–901. https://doi.org/10.1016/j.ecss.2007.08.016
Aranceta-Garza, F., Balart, E. F., Reyes-Bonilla, H. y Cruz-Hernández, P. (2012). Effect of tropical storms on sexual and asexual reproduction in coral Pocillopora verrucosa subpopulations in the Gulf of California. Coral Reefs, 31, 1157–1167. https://doi.org/10.1007/s00338-012-0941-9
Baums, I. B., Devlin-Durante, M., Laing, B. A., Feingold, J., Smith, T., Bruckner, A. et al. (2014). Marginal coral populations: the densest known aggregation of Pocillopora in the Galápagos Archipelago is of asexual origin. Frontiers in Marine Science, 1, 59. https://doi.org/10.3389/fmars.2014.00059
Bayraktarov, E., Banaszak, A., Maya, P. H. M., Kleypas, J., Arias-Gonzalez, J. E., Blanco, M. et al. (2020). Coral reef restoration efforts in Latin American countries and territories. Plos One, 15, e0228477. https://doi.org/10.1371/journal.pone.0228477
Bayraktarov, E., Saunders, M. I., Abdullah, S., Mills, M., Beher, J., Possingham, H. P. et al. (2016). The cost and feasibility of marine coastal restoration. Ecological Applications, 26, 1055–1074. https://doi.org/10.1890/15–1077
Boström-Einarsson, L., Babcock, R. C., Bayraktarov, E., Ceccarelli, D., Cook, N., Ferse, S. C. et al. (2020). Coral restoration – A systematic review of current methods, successes, failures and future directions. Plos One, 15, e0226631. https://doi.org/10.1371/journal.pone.0226631
Burke, L., Reytar, K., Spalding, M. y Perry, A. (2011). Reefs at risk revisited. Washington D.C: World Resources Institute.
Cabral-Tena, R. A., López-Pérez, A., Reyes-Bonilla, H., Calderon-Aguilera, L. E., Norzagaray-López, C. O., Rodríguez-Zaragoza, F. A. et al. (2018). Calcification of coral assemblages in the eastern Pacific: reshuffling calcification scenarios under climate change. Ecological Indicators, 95, 726–734. https://doi.org/10.1016/j.ecolind.2018.08.021
Calderón-Aguilera, L. E., Reyes-Bonilla, H. y Carriquiry, J. D. (2007). El papel de los arrecifes coralinos en el flujo de carbono en el océano: estudios en el Pacífico mexicano. En G. Gaxiola-Castro y B. Hernández-de la Torre (Eds.), Carbono en ecosistemas acuáticos de México (pp. 215–226). México: Semarnat-INE-CICESE.
Cervantes-Duarte, R., Aguirre-Bahena, F., Reyes-Salinas, A. y Valdez-Holguin, J. E. (2001). Hydrological characterization of a coastal lagoon of Baja California Sur, México. Oceánides, 16, 93–105.
Cervantes-Duarte, R., Valdez-Holguín, J. E. y Reyes-Salinas, A. (2004). Comparación de reflectancia in situ 443/555 y 490/555 con clorofila a y materia suspendida total en bahía de La Paz, BCS, México. Hidrobiológica, 14, 11–17.
Chou, L. M., Toh, T. C. y Ng, C. S. L. (2017). Effectiveness of reef restoration in Singapore’s rapidly urbanizing coastal environment. International Journal of Environmental Science and Development, 8, 576–580. https://doi.org/10.18178/ijesd.2017.8.8.1018
Cortés, J. y Reyes-Bonilla, H. (2017). Human influences on Eastern Tropical Pacific coral communities and coral reefs. En P. W. Glynn, D. P. Manzello y I. C. Enochs (Eds.), Coral reefs of the Eastern Tropical Pacific: persistence and loss in a dynamic environment (pp. 549–563). Dordrecht: Springer.
Ellis, J. I., Jamil, T., Anlauf, H., Coker, D. J., Curdia, J., Hewitt, J. et al. (2019). Multiple stressor effects on coral reef ecosystems. Global Change Biology, 25, 4131–4146. https://doi.org/10.1111/gcb.14819
Enochs, I. C. y Glynn, P. W. (2017). Corallivory in the eastern Pacific. En P. W. Glynn, D. P. Manzello y I. C. Enochs (Eds.), Coral reefs of the Eastern Tropical Pacific: persistence and loss in a dynamic environment (pp. 315–337). Dordrecht: Springer.
Enríquez-Andrade, R., Anaya-Reyna, G., Barrera-Guevara, J. C., Carvajal-Moreno, M. A., Martínez-Delgado, M. E., Vaca-Rodríguez, J. et al. (2005). An analysis of critical areas for biodiversity conservation in the Gulf of California. Ocean and Coastal Management, 48, 31–50. https://doi.org/10.1016/j.ocecoaman.2004.11.002
Fiedler, P. C. y Talley, L. D. (2006). Hydrography of the eastern tropical Pacific: a review. Progress in Oceanography, 69, 143–180. https://doi.org/10.1016/j.pocean.2006.03.008
Figueroa-Camacho, A. G. F. y Nava, H. (2015). Rehabilitación de la cobertura de corales del género Pocillopora (Lamarck 1816) usando una técnica adaptada a hábitats rocosos sublitorales. Biológicas Revista de la DES Ciencias Biológico Agropecuarias, 17, 31–36.
Glynn, P. W. (1977). Coral growth in upwelling and nonupwelling areas off the Pacific coast of Panama. Journal of Marine Research, 35, 567–585.
González-Espinosa, P. C. y Donner, S. D. (2020). Predicting cold-water bleaching in corals: role of temperature, and potential integration of light exposure. Marine Ecology Progress Series, 642, 133–146. https://doi.org/10.3354/meps13336
Guzmán, H. M. (1991). Restoration of coral reefs in Pacific Costa Rica. Conservation Biology, 5, 189–194. https://doi.org/10.1111/j.1523-1739.1991.tb00123.x
Guzmán, H. M. y Cortés, J. (1989). Growth rates of eight species of scleractinian corals in the eastern Pacific (Costa Rica). Bulletin of Marine Science, 44, 1186–1194.
Hoegh-Guldberg, O., Mumby, P. J., Hooten, A. J., Steneck, R. S., Greenfield, P., Gomez, E. et al. (2007). Coral reefs under rapid climate change and ocean acidification. Science, 318, 1737–1742. https://doi.org/10.1126/science.1152509
Horoszowski-Fridman, Y. B. y Rinkevich, B. (2016). Restoration of the animal forests: harnessing silviculture biodiversity concepts for coral transplantation. En S. Rossi, L. Bramanti, A. Gori y C. Orejas (Eds.), Marine animal forests (pp. 1313–1335). Cham, Switzerland: Springer.
Hoyos, C. D., Agudelo, P. A., Webster, P. J. y Curry, J. A. (2006). Deconvolution of the factors contributing to the increase in global hurricane intensity. Science, 312, 94–97. https://doi.org/10.1126/science.1123560
Ishida-Castañeda, J., Pizarro, V., López-Victoria, M. y Zapata, F. A. (2020). Coral reef restoration in the Eastern Tropical Pacific: feasibility of the coral nursery approach. Restoration Ecology, 28, 22–28. https://doi.org/10.1111/rec.13047
Jiménez, C. y Cortés, J. (2003). Growth of seven species of scleractinian corals in an upwelling environment of the Eastern Pacific (golfo de Papagayo, Costa Rica). Bulletin of Marine Science, 72, 187–198.
LaJeunesse, T. C., Reyes-Bonilla, H. y Warner, M. E. (2007). Spring “bleaching” among Pocillopora in the Sea of Cortez, eastern Pacific. Coral Reefs, 26, 265–270. https://doi.org/10.1007/s00338-006-0189-3
LaJeunesse, T. C., Reyes-Bonilla, H., Warner, M. E., Wills, M., Schmidt, G. W. y Fitt, W. K. (2008). Specificity and stability in high latitude eastern Pacific coral-algal symbioses. Limnology and Oceanography, 53, 719–727. https://doi.org/10.4319/lo.2008.53.2.0719
Liñán-Cabello, M., Flores-Ramírez, L. A., Laurel-Sandoval, M. A., García, E., Soriano, O. y Delgadillo-Nuño, M. A. (2010). Acclimation in Pocillopora spp. during a coral restoration program in Carrizales Bay, Colima, Mexico. Marine and Freshwater Behavior and Physiology, 44, 61–72. https://doi.org/10.1080/10236244.2010.537440
Lizcano-Sandoval, L. D., Londoño-Cruz, E. y Zapata, F. A. (2018). Growth and survival of Pocillopora damicornis (Scleractinia: Pocilloporidae) coral fragments and their potential for coral reef restoration in the Tropical Eastern Pacific. Marine Biology Research, 14, 887–897. https://doi.org/10.1080/17451000.2018.1528011
López-Pérez, R. A., Calderón-Aguilera, L. E., Reyes-Bonilla, H., Carriquiry-Beltrán, J. D., Medina-Rosas, P., Cupul-Magaña, A. L. et al. (2012). Coral communities and reefs from Guerrero, Southern Mexican Pacific. Marine Ecology, 33, 407–416. https://doi.org/10.1111/j.1439-0485.2011.00505.x
Manzello, D. P. (2010). Coral growth with thermal stress and ocean acidification: lessons from the eastern tropical Pacific. Coral Reefs, 29, 749–758. https://doi.org/10.1007/s00338-010-0623-4
Martínez-Flores, G., Duarte, R. C. y González-Rodríguez, E. (2006). Caracterización de la temperatura superficial del mar y climatología de la bahía de la Paz, B. C. S., México. Oceánides, 21, 81–91. https://dx.doi.org/10.37543/oceanides.v21i1-2.27
Mbije, N. E. J., Spanier, E. y Rinkevich, B. (2010). Testing the first phase of the “gardening concept” as an applicable tool in restoring denuded reefs in Tanzania. Ecological Engineering, 36, 713–721. https://dx.doi.org/10.1016/j.ecoleng.2009.12.018
Medellín-Maldonado, F., Cabral-Tena, R. A., López-Pérez, A., Calderón-Aguilera, L. E., Norzagaray-López, C. O., Chapa-Balcorta, C. et al. (2016). Calcification of the main reef-building coral species on the Pacific coast of southern Mexico. Ciencias Marinas, 42, 209–225. https://doi.org/10.7773/cm.v42i3.2650
Mellin, C., MacNeil, M. A., Cheal, A. J., Emslie, M. J. y Caley, M. J. (2016). Marine protected areas increase resilience among coral reef communities. Ecology Letters, 19, 629–637. https://doi.org/10.1111/ele.12598
Muñiz-Anguiano, D., Verduzco-Zapata, M. y Liñán-Cabello, M. A. (2017). Factores asociados a la respuesta de Pocillopora spp. (Anthozoa: Scleractinia) durante un proceso de restauración en la costa del Pacífico mexicano. Revista de Biología Marina y Oceanografía, 52, 299–310. https://dx.doi.org/10.4067/S0718-19572017000200009
Olmos-Martínez, E., Arizpe-Covarrubias, O. A., Pérez, R. M. I. y Ortega-Rubio, A. (2015). Servicios ecosistémicos con potencial turístico del parque nacional Archipiélago Espíritu Santo, México. Teoría y Praxis, 11, 158–173.
Pennington, J. T., Mahoney, K. L., Kuwahara, V. S., Kolber, D. D., Calienes, R. y Chavez, F. P. (2006). Primary production in the eastern tropical Pacific: a review. Progress in Oceanography, 69, 285–317. https://doi.org/10.1016/j.pocean.2006.03.012
Piniak, G. A. y Brown, E. K. (2008). Growth and mortality of coral transplants (Pocillopora damicornis) along a range of sediment influence in Maui, Hawai‘i. Pacific Science, 62, 39–55. https://doi.org/10.2984/1534-6188(2008)62[39:GAMOCT]2.0.CO;2
Plaisance, L., Caley, M. J., Brainard, R. E. y Knowlton, N. (2011). The diversity of coral reefs: what are we missing? Plos One, 6, e25026. https://doi.org/10.1371/journal.pone.0025026
Prahl, H. V. y Vargas-Ángel, B. (1990). Tasa de crecimiento del coral Pocillopora damicornis en un arrecife costero del Pacífico colombiano. Universidad del Valle, Facultad de Ciencias. Revista de Ciencias de la Universidad del Valle, 2, 37–44.
Reyes-Bonilla, H. (2003). Coral reefs of the Pacific coast of Mexico. En J. Cortés (Ed.), Latin America coral reefs (pp. 331–350). Amsterdam: Elsevier.
Rinkevich, B. (2015). Climate change and active reef restoration – ways of constructing the “reefs of tomorrow”. Journal of Marine Science and Engineering, 3, 111–27. https://doi.org/10.3390/jmse3010111
Rodríguez-Troncoso, A. P., Carpizo-Ituarte, E. y Cupul-Magaña, A. L. (2016). Physiological response to high temperature in the Tropical Eastern Pacific coral Pocillopora verrucosa. Marine Ecology, 37, 1168–1175. https://doi.org/10.1111/maec.12392
Romero-Torres, M., Acosta, A., Palacio-Castro, A. M., Treml, E. A., Zapata, F. A., Paz-García, D. A. et al. (2020). Coral reef resilience to thermal stress in the Eastern Tropical Pacific. Global Change Biology, 26, 1–11. https://doi.org/10.1111/gcb.15126
Shafir, S., Van Rijn, J. y Rinkevich, B. (2006). Steps in the construction of underwater coral nursery, an essential component in reef restoration acts. Marine Biology, 149, 679–687. https://doi.org/10.1007/s00227-005-0236-6
Shafir, S. y Rinkevich, B. (2010). Integrated long-term mid-water coral nurseries: a management instrument evolving into a floating ecosystem. University of Mauritius Research Journal, 16, 365–386.
Shaish, L., Levi, G., Katzir, G. y Rinkevich, B. (2010). Coral reef restoration (Bolinao, the Philippines) in the face of frequent natural catastrophes. Restoration Ecology, 18, 285–299. https://doi.org/10.1111/j.1526-100X.2009.00647.x
Sheppard, C., Davy, S., Pilling, G. y Graham, N. (2017). The biology of coral reefs. Oxford University Press.
Tortolero-Langarica, J. J. A., Cupul-Magaña, A. L. y Rodríguez-Troncoso, A. P. (2014). Restoration of a degraded coral reef using a natural remediation process: a case study from a Central Mexican Pacific National Park. Ocean and Coastal Management, 96, 12–19. https://doi.org/10.1016/j.ocecoaman.2014.04.020
Tortolero-Langarica, J. A., Rodríguez-Troncoso, A. P., Cupul-Magaña, A. L., Alarcón-Ortega, L. C. y Santiago-Valentín, J. D. (2019). Accelerated recovery of calcium carbonate production in coral reefs using low-tech ecological restoration. Ecological Engineering, 128, 89–97. https://doi.org/10.1016/j.ecoleng.2019.01.002
Tortolero-Langarica, J. J. A., Rodríguez-Troncoso, A. P., Cupul-Magaña, A. L. y Carricart-Ganivet, J. P. (2017). Calcification and growth rate recovery of the reef-building Pocillopora species in the northeast tropical Pacific following an ENSO disturbance. PeerJ, 5, e3191. https://doi.org/10.7717/peerj.3191
Zar, J. H. (2010). Biostatistical analysis. New Jersey: Prentice-Hall.