Jhon César Neita-Moreno a, *, María Isabel Castro-Vargas a, Mario Gabriel Ibarra-Polesel b, Paola Pulido-Santacruz c
a Instituto de Investigación de Recursos Biológicos Alexander von Humboldt, Claustro de San Agustín, Carrera 8 # 15 – 08 Villa de Leyva, Boyacá, Colombia
b Universidad Nacional del Nordeste, Facultad de Ciencias Exactas y Naturales y Agrimensura, Av. Libertad Núm. 5470, Corrientes, Argentina
c Genética de la Conservación, Instituto de Investigación de Recursos Biológicos Alexander von Humboldt, Calle 28ª Núm. 15-09, Bogotá, Colombia
*Autor para correspondencia: jneita@humboldt.org.co (J.C. Neita-Moreno)
Recibido: 17 septiembre 2020; aceptado: 4 enero 2021
Resumen
Se describen la larva del tercer estadio y la pupa de Platycoelia puncticollis. Se presentan datos nuevos sobre la biología, genética y distribución de esta especie en Colombia y una clave para la identificación de las larvas del tercer estadio de las especies conocidas para el género Platycoelia Dejean (Coleoptera: Scarabaeidae). Se reporta, por primera vez para la especie, un fragmento de 658 pb del gen COI (código de barras de ADN) mitocondrial.
Palabras clave: Escarabajos; Morfología; Biología; Tercer instar; Clave de identificación
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Description of the immature stages of Platycoelia puncticollis (Scarabaeidae: Rutelinae: Anoplognathini), DNA barcode and a key for the third instar larvae of the genus
Abstract
The third instar larvae and the pupae of Platycoelia puncticollis are described. New data on the biology, genetics, and distribution of this species in Colombia are reported and a key to identification of third instar larvae of the known species of Platycoelia Dejean (Coleoptera: Scarabaeidae) is provided. A 658 bp fragment of the mitochondrial COI (DNA barcode) gene is reported for the first time for the species.
Keywords: Scarab beetle; Morphology; Biology; Third instar; Identification key
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
La tribu Anoplognathini se encuentra distribuida en Australia y América. En América, se distribuye desde el centro de México hasta el norte de Argentina e incluye 5 géneros: Hylamorpha Arrow, Brachysternus Guérin-Méneville, Aulocopalpus Guérin-Méneville, Phalangogonia Burmeister y Platycoelia Dejean (Smith, 2003). Solamente Platycoelia se encuentra en Colombia. Los adultos de Platycoelia, son nocturnos y muchas de las especies se distribuyen en elevaciones medias (1,000-2,500 m) de Colombia a Argentina (Smith, 2003). Ohaus (1908, 1909) reporta por primera vez la larva de Platycoelia para Loja, Ecuador (Paucar-Cabrera y Smith, 2002) y comenta que la larva de P. gaujoni Ohaus se encontraba debajo de troncos caídos y se alimentaba de materia orgánica en el suelo.
En Colombia se han reportado 24 de las 62 especies descritas para el género Platycoelia (Smith, 2003). Las larvas de Platycoelia se diferencian de las de otros géneros de la subfamilia Rutelinae por la siguiente combinación de caracteres: haptomerum de la epifaringe prominente, sin línea primaria y secundaria de heli basales, con heli apicales gruesos; lacinia con 3 unci fusionados en su base; área estridulatoria maxilar con 6-15 dientes recurvados postero-anteriormente, apicalmente agudos; 1 o más puntos sensoriales dorsales en el último artejo antenal (más de 1 en P. valida Burmeister = 12-14 puntos sensoriales); abertura anal ligeramente curvada (Neita-Moreno y Morón, 2017). Los estados inmaduros de la tribu han sido descritos tan solo para 6 especies, siendo Platycoelia el género con más estados inmaduros conocidos (tabla 1).
Nuestro objetivo fue describir la larva del tercer estadio y la pupa de Platycoelia puncticollis, presentar datos nuevos sobre la biología y distribución de esta especie, así como proporcionar, por primera vez, datos genéticos del género, todo para Colombia.
Materiales y métodos
Las larvas descritas en el presente artículo se recolectaron de manera oportunista en diferentes sitios en Colombia de 2016 a 2019, la mayoría se obtuvieron en los últimos 2 años, durante el desarrollo de los proyectos realizados por el Instituto Alexander von Humboldt, Colombia, en el marco del proyecto Boyacá Bio. Los ejemplares inmaduros se sacrificaron en agua hervida, reposada y posteriormente conservados en alcohol al 70%. Los adultos fueron conservados en alcohol al 96% y posteriormente montados e identificados en la Colección de Entomología del Instituto Alexander von Humboldt.
Para la extracción del ADN de la especie, se utilizó una metapata del espécimen IAvH-E-195428, que se conservó en etanol al 96% hasta su posterior procesamiento en el laboratorio de genética del Instituto Humboldt. El ADN se extrajo siguiendo el protocolo de Ivanova, Grainger et al. (2006) e Ivanova, de Waard et al. (2006). Un fragmento del gen mitocondrial citocromo oxidasa subunidad I (COI) se amplificó usando el siguiente conjunto de cebadores: Lep-F1 (5’- ATT CAA CCA ATC ATA AAG ATA TTG G -3 ‘) y Lep-R1 (5’- AAA CTT CTG GAT GTC CAA AAA ATC A -3’) (Hebert et al., 2004). Los productos de PCR se purificaron mediante el uso de las enzimas exonucleasa I (Exo I) y fosfatasa alcalina (SAP, por sus siglas en inglés) y posteriormente se enviaron a secuenciar por el método de Sanger, en la unidad de secuenciación de la Universidad de los Andes en Bogotá, Colombia. Las secuencias obtenidas fueron visualizadas, ensambladas y editadas con el programa Geneious v 10.2.3 (https://www.geneious.com; Kearse et al., 2012). Durante el proceso de edición se realizó la traducción a secuencias de aminoácidos para verificar la ausencia de codones de parada.
Tabla 1
Estados inmaduros descritos para la tribu Anoplognathini.
|
Especies |
Estados |
Publicación |
|
Saulostomus villosus (McQuillan) |
Larva |
Hardy (1976) -Australia |
|
Anoplognathus suturalis Boisduval |
Larva |
Mcquillan (1985) -Australia |
|
Platycoelia gaujoni Ohaus |
Larva |
Paucar y Smith (2002) -América |
|
P. lutescens Blanchard |
Larva |
Paucar y Smith (2002) -América |
|
P. valida Burmeister |
Larva y pupa |
Neita-Moreno et Morón (2017) -América |
|
P. puncticollis Ohaus |
Larva y pupa |
Este trabajo -América |
Se tomaron 5 larvas de tercer instar y dos pupas, una macho y una hembra, para realizar las descripciones e ilustraciones. Las mediciones de la cápsula cefálica, la longitud y amplitud de los espiráculos, y la longitud del cuerpo se presentaron sobre el promedio de las larvas. De las pupas, se tomaron la longitud y la amplitud total del cuerpo, presentando igualmente el promedio de las medidas. Estas mediciones están expresadas en milímetros.
Las observaciones e ilustraciones se realizaron con la ayuda de un estereomicroscopio Leica S8AP0. Los caracteres y la terminología utilizada en las descripciones se basan en los trabajos de Böving (1936, 1942), Ritcher (1948, 1966), Morón (1987, 1997), Ibarra-Polesel et al. (2017, 2020).
Los especímenes se depositaron en la Colección de Formas Inmaduras de la Colección de Entomología de Instituto de Investigaciones en Recursos Biológicos Alexander von Humboldt (IAvH-E).
Resultados
Clave para la determinación de larvas del tercer instar de Platycoelia Dejean.
1.Último artejo antenal con más de un punto sensorial dorsal ……………………………………………………………… 2
1’.Último artejo antenal con un solo punto sensorial dorsal ……………………………………………………………… 3
2.Último artejo antenal con 12-14 puntos sensoriales dorsales; meso y metaprescudo sin sedas cortas
espiniformes ……………………………………………………………… P. valida Burmeister
2´.Último artejo antenal con 6-7 puntos sensorial dorsal; meso y metaprescudo con sedas cortas
espiniformes ……………………………………………………………… P. puncticollis Ohaus
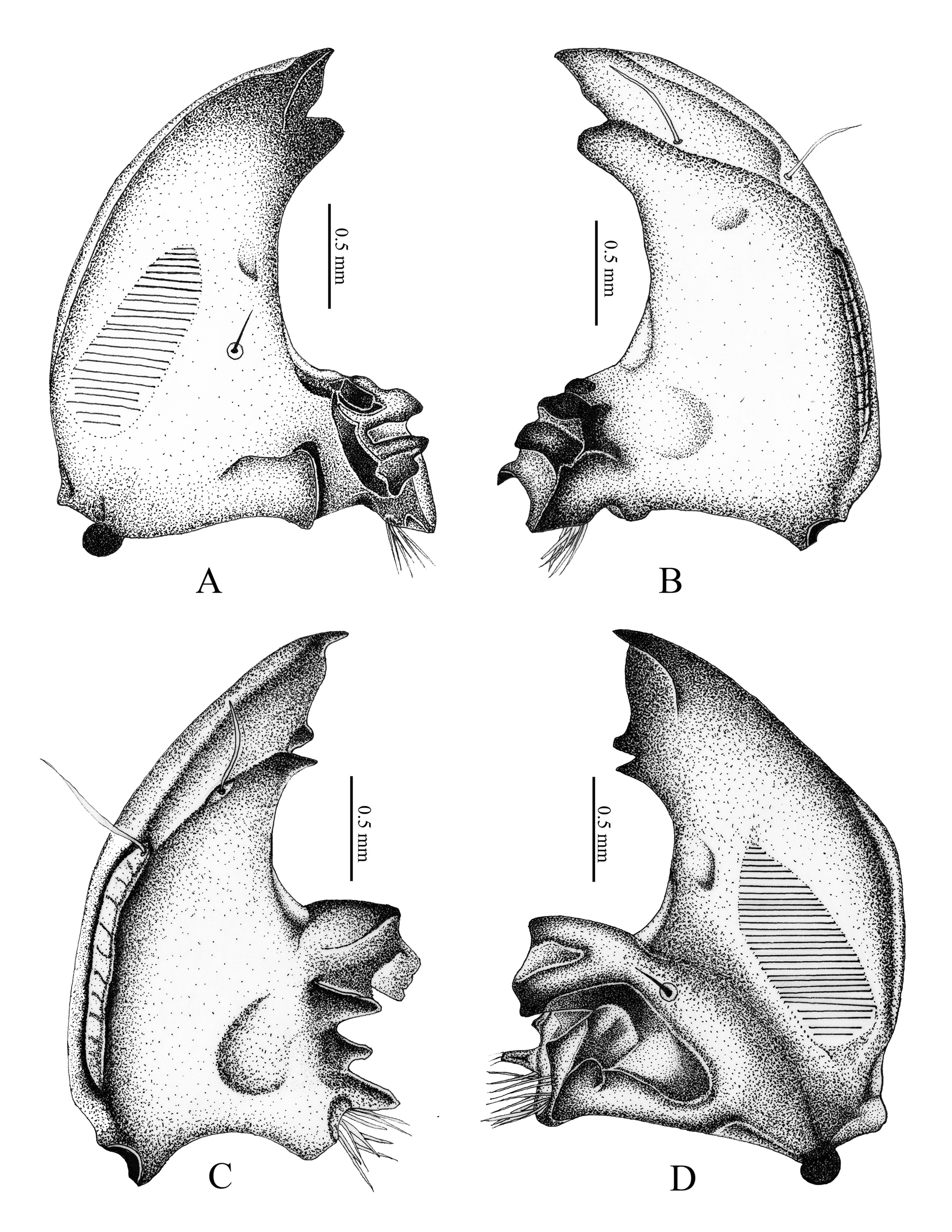
3.Epifaringe con la laeotorma más corta que la dexiotorma; mandíbula con 3 dientes incisivos; espiráculos abdominales redondeados ……………………………………………………………… P. guajoni Ohaus
3’.Epifaringe con la laeotorma más larga que la dexiotorma, expandiéndose hacía la chaetoparia; mandíbula con 2 dientes incisivos; espiráculos abdominales alargados ……………………………………………………………… P. lutescens Blanchard
Descripción
Estados inmaduros de Platycoelia uncticollis
(figs. 1-6)
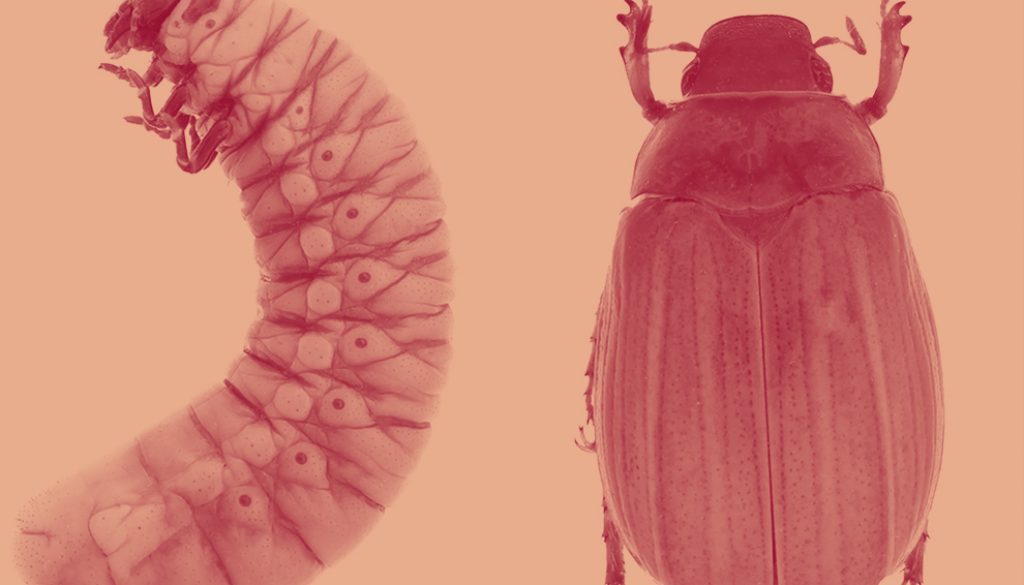
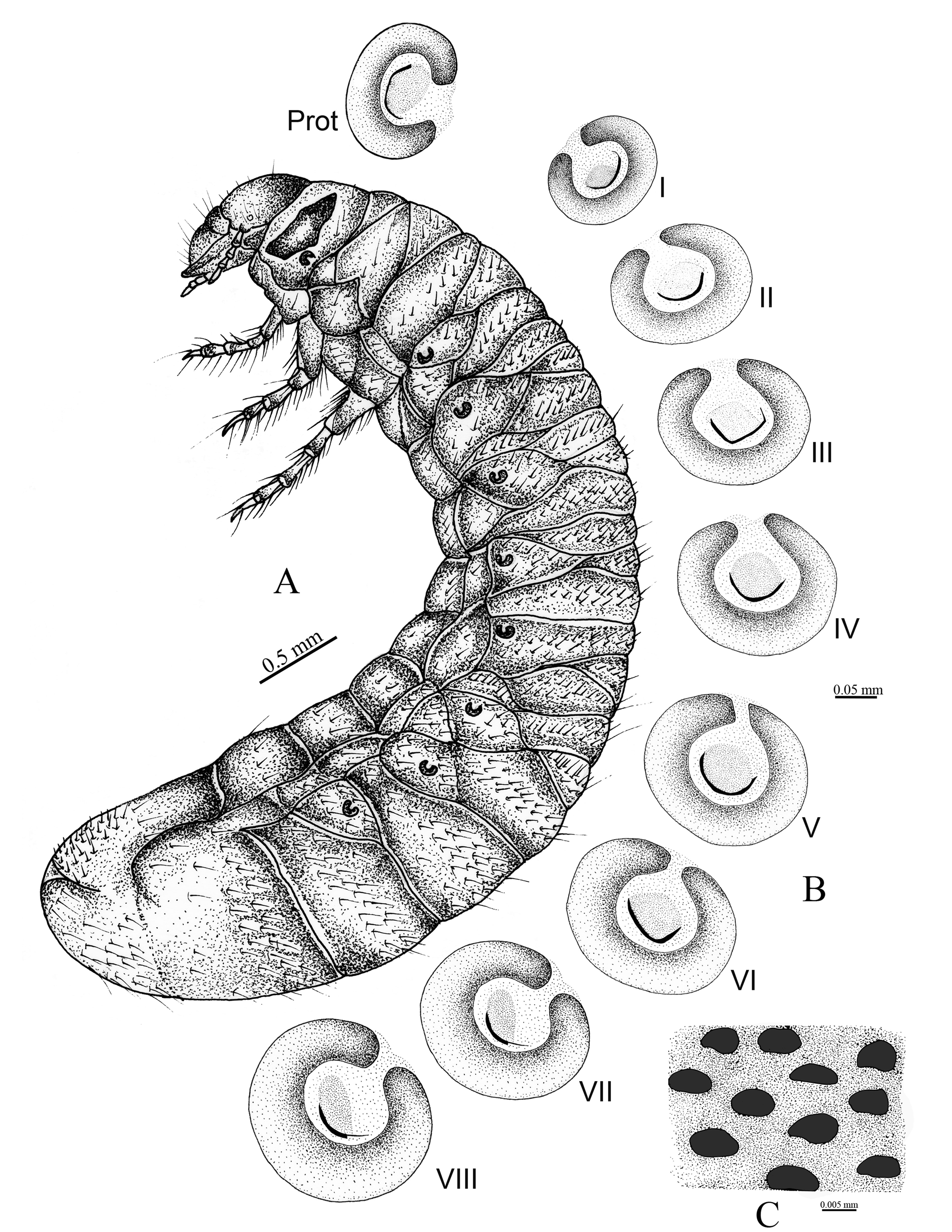
Larva de tercer instar (figs. 6A, 7E)
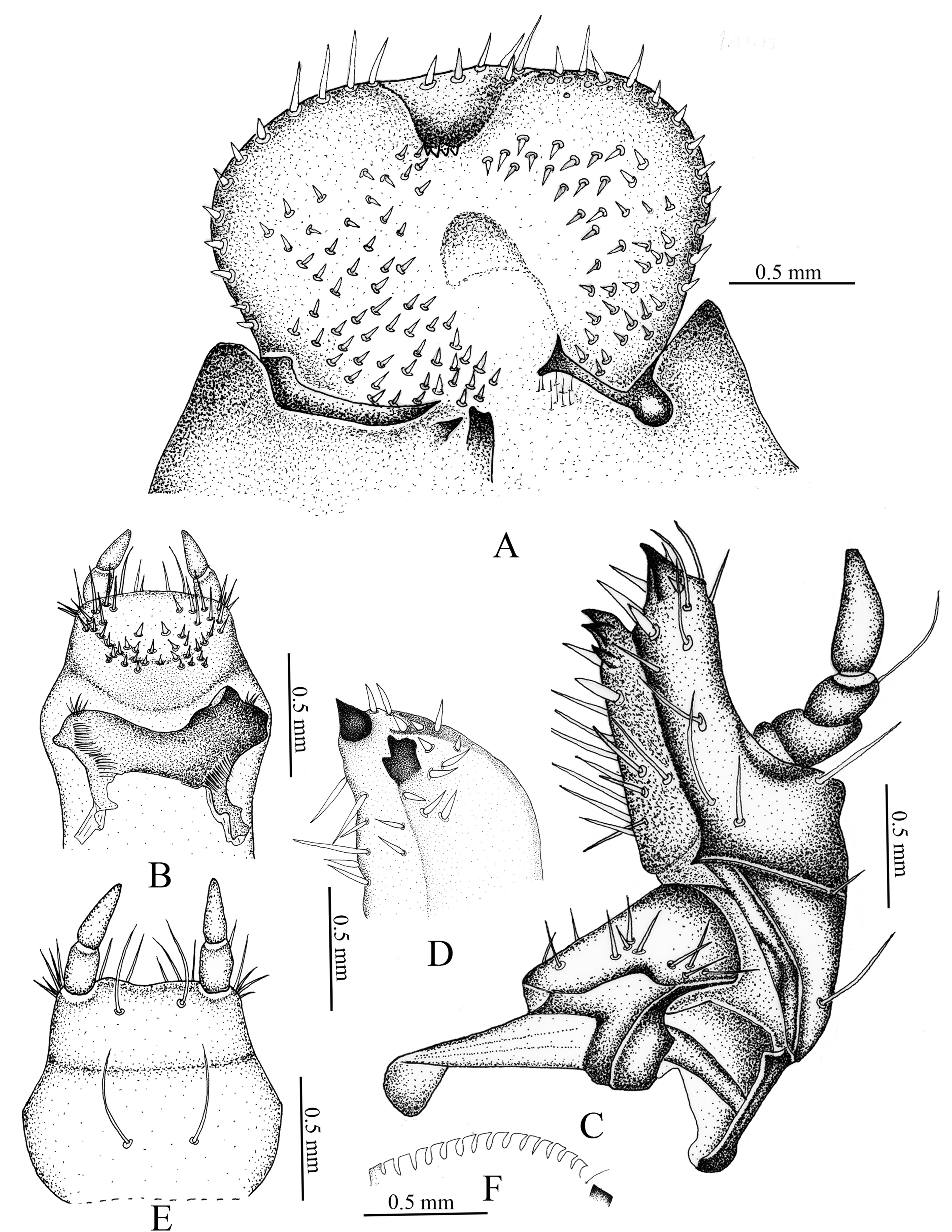
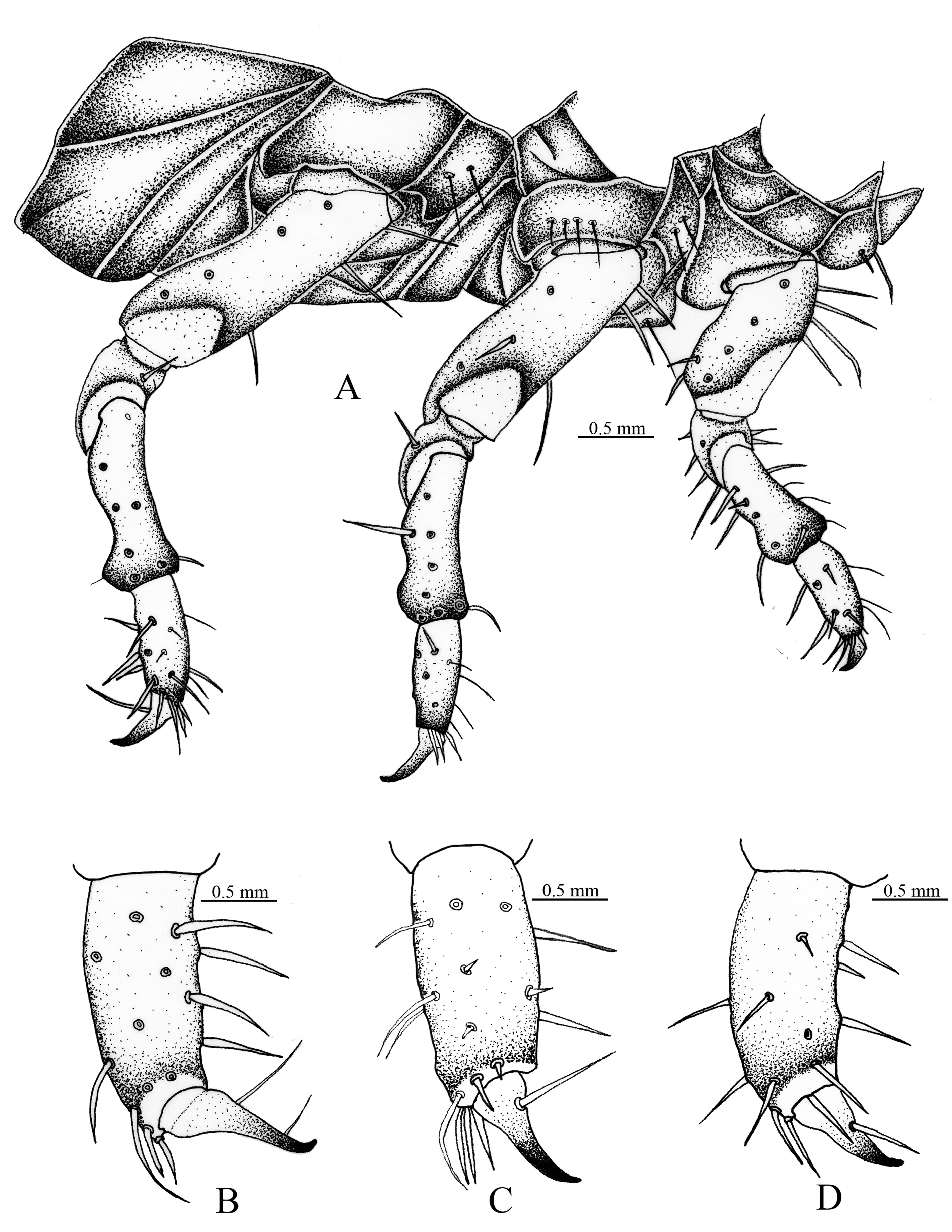
Cabeza (fig. 1A). Amplitud de la cápsula cefálica 4.44-4.23 mm. La cabeza de color negro, con la superficie del cráneo finamente punteada. Frente con 2 sedas dorsoepicraneales; 6 sedas epicraneales diminutas; 1 seda frontal posterior a cada lado; sedas frontales exteriores y anteriores ausentes; 1 seda en el ángulo frontal anterior en cada lado; 1 seda al lado de cada estemma; superficie con 10 sedas dispersas cortas, espiniformes. Estemata pigmentado y claramente desarrollado. Clípeo (fig. 1A). Con 1 seda lateral a cada lado y sin sedas centrales; postclípeo sin sedas. Labro (fig. 1A). Subtrapezoidal, con 2 sedas posteriores, 2 sedas centrales, 4 sedas laterales a cada lado, 2 sedas apicales delgadas y largas. Epifaringe (fig. 2A). Ligeramente asimétrica (1.61 mm de ancho por 1.12 mm de largo). Epizigum corto y amplio, de color pardo obscuro, haptomerum con 3-4 heli apicales amplios; plegmatia, proplegmatia y clithra ausentes; corypha con 6-8 sedas delgadas y largas. Acroparia con 16-18 sedas delgadas y largas; acanthoparia con 9-12 sedas cortas, espiniformes y recurvadas. Chaetoparia izquierda con 42 sedas cortas y gruesas, 43 sedas largas y delgadas; Chaetoparia derecha con 28 sedas cortas y gruesas, 35 sedas largas y delgadas. Dexiotoma larga y moderadamente amplia; pterotoma desarrollada y redondeada; laeotorma delgadas y dilatada apicalmente hacía el pedium; dexiotorma más larga de la laeotorma. Laephoba ausente. Haptolechus y margen interno de la laeotorma formado por 15 sedas delgadas y largas; haptolechus con 4 macrosensilas. Dexiophoba ausente; placa esclerosada corta con 4 sensilias; placa esclerosada delgas y apicalmente aguda. Crepis estrecho, ligeramente esclerozado y discontinuo mesalmente. Mandíbula izquierda (fig. 3A-C). Área incisiva con 3 dientes (S1, S2 y S3), el tercer diente (S3) separado por escotadura incisiva; área molar con 2 lóbulos amplios, convexo (M1-2), lóbulo distal (M1) desarrollado; escrobe con 5 sedas delgadas y largas; 4 sedas cortas y delgadas basolaterales; brustia formada por 20 sedas delgadas y moderadamente largas; acia elongada con 12 sedas en la base y el ápice; proceso ventral desarrollado con muchos asperitos. Área ventral con 38 líneas estridulatorias mandibular y 8 sedas dorsomolares. Área dorsal con 10 setas dorsomolares. Mandíbula derecha (fig. 3B-D). Área incisiva con 3 dientes (S1, S2 y S3), el tercer diente (S3), está separado por una escotadura incisiva; área molar con 2 lóbulos amplios, convexo (M1-3), lóbulo distal (M1) desarrollado; escrobe con 6 sedas delgadas y largas; 8 sedas cortas y delgadas basolaterales; calx desarrollado, truncado apicalmente; brustia formada por 14 sedas delgadas y largas; proceso ventral desarrollado, con asperitos. Área ventral con 35-36 líneas estridulatorias mandibulares y 9 sedas dorsomolares. Área dorsal con 1 seda dorsomolar. Maxilas (fig. 2C). Con 1 uncus en la galea; lacinia con 3 unci unidos en la base, rodeados por 9 heli. Área estridulatoria maxilar (fig. 2F) formada por 15 dientes amplios, truncados y en dirección postero-anterior, los 2 últimos dientes separados de los precedentes; proceso anterior presente. Labio (fig. 2B-E).
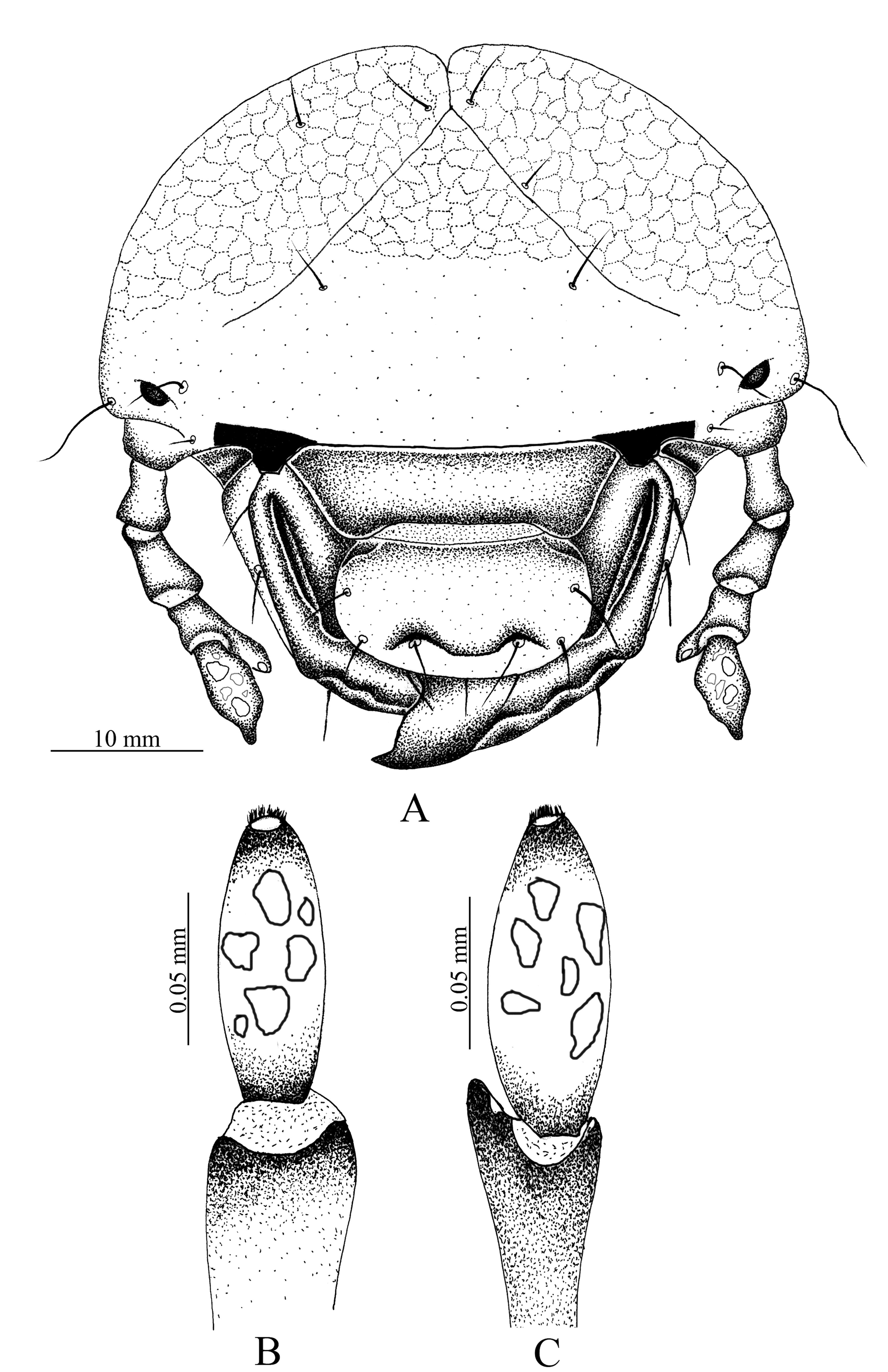
Escleroma hipofaríngeo asimétrico, con el lado derecho prominente y el izquierdo reducido; lóbulo lateral derecho con 21 sedas largas y delgadas; lóbulo lateral izquierdo 11 sedas delgadas y largas, 8 sedas cortas y delgadas. Glosa con 34 sedas delgadas y largas laterales y 40 sedas cortas y delgadas; 20 sedas cortas, espiniformes sobre una placa esclerosada en el centro. Antena (fig. 1B, C). Segundo antenómero 2 veces el largo del primero, tercer antenómero con proceso ventral apical soportando un punto sensorial. Último antenómero con 6-7 puntos sensoriales dorsales y 5-6 puntos sensoriales ventrales.
Tórax (fig. 4A). Pronoto con escleroma lateral corto a cada lado, de color amarillo claro, con 3 sedas delgadas y largas. Estigma respiratorio torácico (fig. 6B) más pequeño que los abdominales, 0.42 mm de ancho por 0.55 mm de largo; placa respiratoria de color amarillo rojizo, con forma de “C”; distancia entre lóbulos de placa respiratoria menor que el diámetro dorsoventral de la bulla; bulla redondeada y prominente. Orificios de las placas respiratorias de borde irregular; 32-39 orificios a través de la placa respiratoria (fig. 6C). Dorso del protórax con línea de 4 sedas delgadas y largas, 2 sedas delgadas y largas y 16 sedas cortas espiniformes; mesoprescudo con 2 sedas delgadas y cortas; mesoescutelo con 9 sedas cortas espiniformes; metaprescudo con 2 sedas delgadas y cortas, 17 sedas cortas espiniformes; metaescudo con 2 sedas delgadas y largas, 20 sedas delgadas y cortas y 16 cortas espiniformes; metaescutelo con 9 sedas cortas espiniformes. Patas (fig. 4B-D). Mesotarsungulo más pequeños que pro- y metatarsúngulos, todos los tarsúngulos alargados, con ápice agudo, con 1 seda basal interna y 1 seda prebasal externa.
Abdomen. Placas respiratorias de color marrón oscuro, regularmente recurvada en forma de “C”, la distancia entre los lóbulos de la placa respiratoria es menor que el diámetro dorsoventral de la bulla; bulla redondeada y prominente. Estigmas del segmento abdominal I más pequeños (0.57 mm de largo por 0.36 mm de ancho) que los estigmas de los II-VIII, los cuales incrementan progresivamente su tamaño (tabla 2). Primer segmento abdominal con una proporción de sedas delgadas y largas que se distribuyen a lo largo de las áreas presentes en él. Esta quetotaxia de distribuyen igualmente a lo largo de los otros segmentos abdominales (tabla 3).
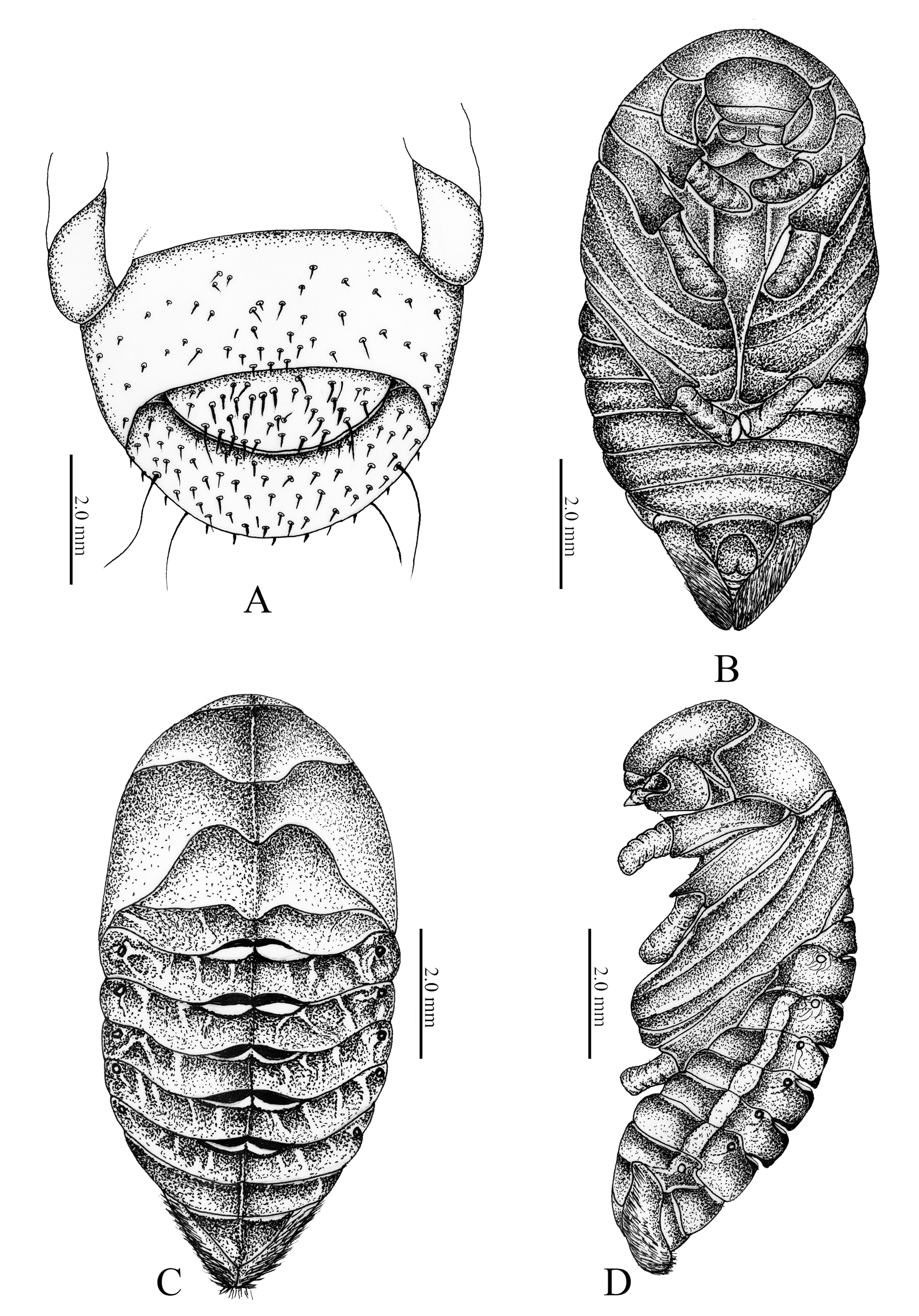
Ráster. Palidia ausente (fig. 5A); campus con 4 sedas delgadas y cortas; teges con 79 setas hamate y barbula con 16 sedas delgadas y largas. Abertura anal transversa.
Pupa
Hembra (23.3-24.01 mm de largo por 10.2-9.8 mm de ancho). Macho (21.3 mm de largo por 8.7 mm de ancho) (fig. 5B-D). Cabeza. Cobertura sedosa muy fina, fuertemente inclinada hacía bajo; piezas bucales claramente diferenciadas, frente convexa. Clípeo convexo con labro perpendicular a éste; canto ocular aparente; ojos hundidos, poco prominentes; tecae antenales engrosados, claramente visibles. Tórax. Pronoto convexo; meso y metanoto bien diferenciados; escutelo claramente visible, largo y agudo apicalmente; tecae elitrales más cortos que las tecae alares; tecae elitrales se proyectan hasta el segmento abdominal III, tecae alares hasta el segmento abdominal IV; proceso mesoesternal bien desarrollado. Abdomen. Segmentos III-X (vista ventral) bien definidos; segmentos VIII y IX fusionados. Segmentos I-X (vista dorsal) bien definidos, con órganos deioniformes en mitad de la base y ápice entre los segmentos I-II, II-III, III-IV, IV-V y V-VI. Lóbulos pleurales redondeados. Espiráculo I, elongado, con peritrema fino y cubierto por teca alar; espiráculos II-IV ovalados, prominentes con un peritrema fuertemente esclerosado; espiráculos V-VIII prominentes, no funcionales. Urogonfos ausentes, sin lóbulos laterales pleurales, ápice redondeado con cobertura de sedas finas, doradas; ámpula genital ligeramente pronunciada (macho).
Diagnosis
Las larvas de P. puncticollis se diferencian de las demás larvas del género y de otros Anoplognathini por la siguiente combinación de caracteres: último segmento antenal con 6-7 puntos sensoriales dorsales, mandíbulas con 3 dientes incisivos, espiráculos del segmento abdominal I más pequeños que los segmentos II-VIII, y meso y metaprescudo con sedas cortas espiniformes.
Código de barras de ADN. Se generó un fragmento de 658 bp del gen mitocondrial citocromo oxidasa subunidad I (COI) para la especie P. puncticollis (IAvH-E-195428). Los datos genéticos e información asociada se depositaron en la plataforma Barcode of Life Data System (BOLD; Ratnasingham y Hebert, 2007), con el número de identificación CBIHI198-18, y en GenBank con número de acceso MT999036.
Biología. Adultos de hábitos nocturnos, generalmente atraídos por las fuentes de luz. Vuelan entre las 7:00 PM a las 04:00 AM. La emergencia de adultos se presenta en la segunda temporada de lluvias del año (octubre-diciembre), con algunos especímenes que emergen hasta junio. Las larvas se desarrollan en el suelo de robledales (Quercus humboldtii Bonpland, 1805, Fagaceae), a una profundidad de 10 a 25 cm. Las larvas pupan en una celda (28.01-30.01 mm de largo), que elaboran con tierra entre 25 a 30 cm por debajo de la superficie. La pupa queda inmersa en la exuvia larval como en todo los otros Rutelinos (Neita y Morón, 2017). El hábitat de robledales es fundamental para los escarabajos Pleurosticti en zonas altoandinas, ya que constituyen un componente importante de la edafofauna, la cual contribuye en los procesos de descomposición de la materia orgánica depositada en el suelo, producto de los eventos de muerte de estos árboles.

Resumen taxonómico
Distribución: Colombia, Ecuador y Venezuela (Smith 2003).
Material estudiado. Inmaduros. 5 larvas de tercer instar, 2 exuvias larvas y 5 pupas. Colombia, Cundinamarca, San Francisco, Reserva la Nube, Vereda La Lajas, Hda. La Nube. 4º56’20.4” N, 74º14’48.4” O, WGS84, 2,561 m snm, en suelo de robledal Quercus humboldtii Bonpland, 1805 (Fagaceae), 13-16-nov-2016, J. C. Neita (IAvH-E-215861). Colombia, Boyacá, Arcabuco, Vda. Rupavita, campamento, bosque andino, 5°44’13.3” N, 73°24’49.6” O. WGS84, 2,759 m snm, capt. manual en suelo de bosque de Quercus humboldtii Bonpland, 1805 (Fagaceae), 16-18-oct-2018, M. I. Castro (IAvH-E-216144). Adultos (fig. 7E). Colombia, Boyacá, Arcabuco, Vda. Centro, Finca Campohermoso, cerca de Qda. La Colorada, bosque andino con predominio de Quercus humboldtii y Bromeliaceae, borde bosque 5.74645N, 73.42575O/WGS84, 2, 641 m, red de niebla nocturno, 16-oct-2016. K. Pérez y J. Lozano (IAvH-E-209100, IAvH-E-209101). Colombia, Boyacá. Arcabuco, Vda. Rupavita, campamento, bosque andino, 5°44’13.3” N, 73°24’49.6” O WGS84, 2,759 m snm, capt. manual 16-18-oct-2018, Equipo Boyacá Bio (IAvH-E-209102 y IAvH-E-209103). Colombia, Boyacá. Arcabuco, Vda. Rupavita, campamento, bosque andino, 5°44’13.3” N, 73°24’49.6” O. WGS84, 2,759 m snm, capt. manual, 16-18-oct-2018, A. Lopera, M. I. Castro (IAvH-E-209104, IAvH-E-209105, IAvH-E-209106, IAvH-E-209107, IAvH-E-209108).
Tabla 2
Medidas de espiráculos torácicos y abdominales del tercer estadio larval de P. puncticollis. Datos constituyen un promedio basado en 5 larvas revisadas.
|
Espiráculos |
Ancho (mm) |
Largo (mm) |
|
Protorácico |
0.394 |
0.295 |
|
Abdominal I |
0.351 |
0.254 |
|
Abdominal II |
0.435 |
0.344 |
|
Abdominal III |
0.448 |
0.359 |
|
Abdominal IV |
0.459 |
0.372 |
|
Abdominal V |
0.449 |
0.386 |
|
Abdominal VI |
0.458 |
0.404 |
|
Abdominal VII |
0.468 |
0.429 |
|
Abdominal VIII |
0.475 |
0.419 |
Tabla 3
Quetotaxia de segmentos torácicos y abdominales del tercer estadio larval de P. puncticollis.
|
Segmento |
Tergo |
Sedas largas |
Sedas delgadas y cortas |
Sedas cortas espiniformes |
|
Pronoto |
4 |
2 |
16 |
|
|
Mesonoto |
Prescudo Escudo Escutelo |
– 2 – |
2 2 – |
12 16 9 |
|
Metanoto |
Prescudo Escudo Escutelo |
– 2 – |
2 2 – |
17 33 9 |
|
Abdomen I |
Prescudo Escudo Escutelo Área espiracular Lóbulo pleural |
– – – – 2 |
2 – – 1 2 |
20 53 32 11 6 |
|
Abdomen II |
Prescudo Escudo Escutelo Área espiracular Lóbulo pleural |
– – – – 2 |
– – – – 2 |
29 83 39 17 5 |
|
Abdomen III |
Prescudo Escudo Escutelo Área espiracular Lóbulo pleural |
– – – – 2 |
– – – – 2 |
37 83 38 16 8 |
|
Tabla 3. Continúa |
||||
|
Segmento |
Tergo |
Sedas largas |
Sedas delgadas y cortas |
Sedas cortas espiniformes |
|
Abdomen IV |
Prescudo Escudo Escutelo Área espiracular Lóbulo pleural |
– – – – 2 |
– – – – 2 |
34 89 45 15 12 |
|
Abdomen V |
Prescudo Escudo Escutelo Área espiracular Lóbulo pleural |
– – – – 2 |
– – – – 2 |
37 86 38 17 11 |
|
Abdomen VI |
Prescudo Escudo Escutelo Área espiracular Lóbulo pleural |
– – – – 2 |
– – – – 1 |
35 63 56 17 11 |
|
Abdomen VII |
Prescudo Escudo Escutelo Área espiracular Lóbulo pleural |
– – – – 2 |
– – – – 1 |
– – – 15 15 |
|
Abdomen VIII |
Prescudo Escudo Escutelo Área espiracular Lóbulo pleural |
– – – – 2 |
– – – – 1 |
– – – 19 16 |
|
Abdomen IX + X |
– – |
– – |
221 257 |
Agradecimientos
El estudio fue financiado por el Proyecto Boyacá Bio, en Colaboración del Sistema Nacional de Regalías de Colombia, administrado por el Departamento Nacional de Planeación (DNP-20170000100009), ejecutado por la gobernación de Boyacá y operado por el Instituto de Investigación de Recursos Biológicos Alexander von Humboldt (Acuerdo de cooperación Núm.17170). Muchas gracias a Felipe Villegas por las fotos de los hábitats.
Referencias
Böving, A. G. (1936). Description of the larva of Plectris aliena Chapin and explanation of new terms applied to the epipharynx and raster. Proceedings of the Entomological Society of Washington, 38, 169–185.
Böving, A. G. (1942). Descriptions of the larvae of some West Indian Melolonthinae beetles and a key to the known larvae of the tribe. Proceedings of the United States National Museum, 92, 167–176.
Hardy, R. J. (1976). Observations on the pasture beetle, Saulostomus villosus Waterhouse (Scarabaeidae: Rutelinae). Journal of the Australian Entomological Society, 15, 281–284.
Hebert, P. D. N., Penton, E. H., Burns, J. M., Janzen, D. H. y Hallwachs, W. (2004). Ten species in one: DNA barcoding reveals cryptic species in the Neotropical skipper butterfly Astraptes fulgerator. Proceedings of the National Academy of Sciences, 101, 14812-14817. https://doi.org/10.1073/pnas.0406166101
Ibarra-Polesel, M. G., Neita-Moreno, J. C., Larrea, D. D. y Damborsky, M. P. (2017). Description of the larva and pupa of Neocorvicoana reticulata (Kirby, 1819) (Coleoptera: Scarabaeidae: Cetoniinae: Gymnetini). Zootaxa, 4358, 430–440. https://doi.org/10.11646/zootaxa.4358.3.2
Ibarra-Polesel, M. G., Neita-Moreno, J. C. y Ratcliffe, B. C. (2020). Description of the immature stages of Stenocrates agricola Dechambre & Hardy (Coleoptera: Scarabaeidae: Dynastinae: Cyclocephalini) with redescription of the adult and discussion of its tribal position. Anais da Academia Brasileira de Ciências, 92, e20190967. https://doi.org/10.1590/0001-3765202020190967
Ivanova, N., Grainger, C. y Hajibabaei, M. (2006). Glass fiber DNA extraction: a new inexpensive method for high throughput DNA isolation. (Informe técnico). Canadá: CCDB Advances.
Ivanova, N. V., deWaard, J. R. y Hebert, P. D. N. (2006). An inexpensive, automation-friendly protocol for recovering high quality DNA. Molecular Ecology Notes, 6, 998–1002.
Kearse, M., Moir, R., Wilson, A., Stones-Havas, S., Cheung, M., Sturrock, S. et al. (2012). Geneious basic: an integrated and extendable desktop software platform for the organization and analysis of sequence data. Bioinformatics, 28, 1647–1649.
Mcquillan, P. B. (1985). The identification of root-feeding cockchafer larvae (Coleoptera: Scarabaeidae) found in pastures in Tasmania. Australian Journal of Zoology, 33, 509–546.
Morón, M. A. (1987). Los estados inmaduros de Dynastes hyllus Chevrolat (Coleoptera:Melolonthidae: Dynastinae) con ob-
servaciones sobre su biología y crecimientoalométrico del adulto. Folia Entomológica Mexicana, 72, 33–74.
Morón, M. A. (1997). Familia Melolonthidae (subfamilias Rutelinae, Dynastinae, Cetoniinae, Trichiinae, Valginae y Melolonthinae). En M.A. Morón, B.C. Ratcliffe y C. Deloya (Eds.) Atlas de los escarabajos de México. Coleoptera: Lamellicornia. Volumen 1 Familia Melolonthidae (pp. 1–8). Ciudad de México: Conabio/ Sociedad Mexicana de Entomología.
Neita-Moreno, J. C. y Morón, M. A. (2017). Description of immature stages of Platycoelia valida Burmeister, 1844 (Coleoptera: Melolonthidae: Rutelinae: Anoplognathini). Revista Brasileira de Entomologia, 61, 359–364. http://dx.doi.org/10.1016/j.rbe.2017.07.002
Ohaus, F. (1908). Die Ruteliden meiner Sammelreisen in Südamerika (Col.). Deutsche Entomologische Zeitschrift, 1908, 383–408.
Ohaus, F. (1909). Bericht über eine entomologische Studienreise in Südamerika. Deutsche Entomologische Zeitung, 70, 87–99.
Paucar-Cabrera, A. y Smith, A. (2002). Larval description for the Neotropical genus Platycoelia (Coleoptera: Scarabaeidae: Rutelinae: Anoplognathini). The Coleopterists Bulletin, 56, 438–445.
Ratnasingham, S. y Hebert, P. D. N. (2007). BOLD: The Barcode of Life Data System (http://www.barcodinglife.org). Molecular Ecology Notes, 7, 355–364. http://dx.doi.org/10.1111/j.1471-8286.2007.01678.x
Ritcher, P. O. (1948). Description of the larvae of some Rutelinae beetles with keys to tribes and species. Annals of the Entomological Society of America, 41, 206–212.
Ritcher, P. O. (1966). White grubs and their allies. A study of North American scarabaeoid larvae. Corvallis, Oregon: Oregon State University.
Smith, A.B.T. (2003). A monographic revision of the genus Platycoelia Dejean (Coleoptera: Scarabaeidae: Rutelinae: Anoplognathini). Bulletin of the University of Nebraska State Museum, 15, 1–210.