María Laura Hernández a, * y Luis E. Acosta a, b
a Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET)- Universidad Nacional de Córdoba, Instituto de Diversidad y Ecología Animal (IDEA), Av. Vélez Sarsfiel 299, X5000JJC Córdoba, Argentina
b Universidad Nacional de Córdoba, Facultad de Ciencias Exactas, Físicas y Naturales, Av. Vélez Sarsfield 299, X5000JJC Córdoba, Argentina
*Autor para correspondencia: marialaura.hernandez@gmail.com (M.L. Hernández)
Recibido: 2 junio 2020; aceptado: 26 agosto 2020
Resumen
El notable dimorfismo sexual característico de la familia Gonyleptidae (Opiliones), así como la existencia de morfotipos discretos en machos respecto del tamaño corporal y la armadura, han merecido diversos análisis por varios autores, utilizando morfometría lineal. En este trabajo se propone la aplicación de técnicas de morfometría geométrica para analizar la variabilidad en tamaño centroide y conformación del escudo dorsal y coxa IV de machos del complejo Discocyrtus prospicuus (Gonyleptidae), a fin de evaluar la existencia de morfotipos discretos y la influencia del factor geográfico sobre dicha variabilidad. Asimismo, se apunta a caracterizar el dimorfismo sexual con base en los mismos caracteres. Se analizaron 113 individuos (58 machos y 55 hembras), provenientes de 11 localidades de 3 provincias argentinas. Los resultados muestran que el dimorfismo sexual afecta tanto al tamaño como la conformación de las 2 estructuras medidas (coxas IV y escudo dorsal), aunque ocurriendo en distinto sentido. Por su parte, los machos evidenciaron 2 subgrupos separados en cuanto a tamaño centroide de coxas y escudo, aunque con leves diferencias según el origen geográfico. Se describe por primera vez la existencia de subgrupos relacionados a tamaño centroide también para hembras. Estos resultados constituyen un avance en la comprensión de la ocurrencia de dimorfismos y las variaciones geográficas asociadas con esta variación.
Palabras clave: Morfotipos; Pecilandria; Tamaño centroide; Conformación; Escudo dorsal; Coxa IV
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Characterization of sexual dimorphism and recognition of dimorphic males in the Discocyrtus prospicuus complex (Arachnida: Opiliones: Gonyleptidae): a geometric morphometrics approach
Abstract
The remarkable sexual dimorphism, characteristic of the family Gonyleptidae (Opiliones), as well as the occurrence of discrete morphotypes in males with respect to body size and weaponry, have merited several analyses, by several authors, using linear morphometrics. In this work, we propose the application of geometric morphometrics techniques to analyze the morphometric variability in centroid size and shape of dorsal scutum and coxa IV of males of the Discocyrtus prospicuus complex (Gonyleptidae), in order to evaluate the existence of discrete morphotypes and the influence of the geographic factor on morphometric variability. Likewise, it is aimed to characterize the sexual dimorphism based on the same characters. One hundred-thirteen individuals (58 males and 55 females), from 11 localities in 3 Argentine provinces, were analyzed. Results show that sexual dimorphism affects both the size and the conformation of the 2 measured structures, although in a different direction in coxae and dorsal scutum. Meanwhile, males showed 2 separate subgroups with respect to the centroid size of coxae and scutum, although with slight differences depending on geographic origin. The occurrence of subgroups related to centroid size is also described for the first time for females. These results constitute an advance in the understanding of the occurrence of dimorphisms and the geographic variations associated with this variation.
Keywords: Morphotypes; Poecilandry; Centroid size; Shape; Dorsal scutum; Coxa IV
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
El dimorfismo sexual, es decir la presencia de variaciones morfológicas debido a una presión selectiva actuando de diferente manera en cada sexo, es una de las características más conspicuas en el reino animal que aún plantea interrogantes en diferentes organismos (Andersson, 1994; Delph, 2005; Lande, 1980). Para dar cuenta de este fenómeno, Darwin (1871) propuso el concepto de selección sexual, indicando que existen caracteres sexuales secundarios en los seres vivos, que se desarrollan y seleccionan sobre otros para alcanzar mayor éxito reproductivo. Los machos pueden usar los caracteres sexuales secundarios ya sea para llamar la atención de las hembras y así ser elegidos por éstas, o bien para los enfrentamientos con otros machos, previos a la cópula (Álvarez, 2017). El dimorfismo sexual en el tamaño corporal es un carácter que puede encontrarse influenciado por la selección sexual, la selección natural y por un crecimiento alométrico relativo al tamaño corporal (regla de Rensch) (Clutton-Brock, 2017). Según esta regla, el dimorfismo sexual en especies filogenéticamente relacionadas se acentúa con el aumento del tamaño corporal cuando el macho es el sexo de mayor tamaño, y disminuye con el aumento corporal cuando la hembra es mayor (Rensch, 1950, 1960).
La familia Gonyleptidae Sundevall, 1833 (Arachnida, Opiliones) tiene como característica más notable su marcado dimorfismo sexual, el cual se manifiesta principalmente en la pata IV, desde la coxa hasta el fémur, a veces también en patela y tibia. En los machos, este apéndice está provisto de una armadura (tubérculos, apófisis) más compleja y desarrollada, así como con mayor grosor, curvatura o longitud de cada artejo que las hembras, cuya morfología es mucho más simple (Kury y Pinto-da Rocha, 2007). Dicha armadura estaría directamente relacionada con estrategias reproductivas, ya que estos opiliones utilizan la pata IV para enfrentarse con otros machos por el recurso hembras, y con una armadura más fuerte, mayores son sus posibilidades de imponerse (Buzatto et al., 2014). Un fenómeno que ha llamado la atención en machos de Gonyleptidae es que la armadura muestra alometría positiva respecto del tamaño corporal (Acosta, 2002; Acosta et al., 2007; Buzatto et al., 2014). El término “alometría positiva” refiere a que en los individuos de mayor tamaño (dentro de una población), determinada estructura está proporcinalmente más desarrollada que en los individuos menores (si se mantuviera la misma proporción en el rango de tamaños hablaríamos de isometría). En estos machos, se detectó que tal alometría no tiene una distribución perfectamente continua, sino que es factible reconocer al menos 2 grupos discretos, es decir, diferentes morfotipos en los machos adultos de una misma especie (Buzatto et al., 2014). Este dimorfismo intrasexual observado en los machos adultos ha recibido el nombre de pecilandria (Regalin, 1997; Ringuelet, 1959). En cualquier caso, cabe cuestionarse si este fenómeno refleja realmente la existencia de morfotipos discretos, o si en cambio se trata de los 2 fenotipos más abundantes o más fácilmente identificables, en una distribución poblacional continua en dichos rasgos morfológicos. Los estudios realizados hasta el momento apoyarían la primera interpretación, es decir, la de morfotipos discretos (Buzzato et al., 2014; Painting et al., 2015). Este dimorfismo de machos ha sido largamente descrito e investigado en especies de coleópteros cuyos machos utilizan cuernos, mandíbulas y otras estructuras para entablar luchas por el acceso a las hembras (Emlen et al., 2007; Gotoh et al., 2014; Lavine y Miura, 2014; Lavine et al., 2015; Marlowe et al., 2015; McCullough et al., 2015; Vera-Cano et al., 2017).
Se estima que los costos de producir los caracteres sexuales secundarios en machos, como ornamentaciones o armadura, pueden ser muy altos, llevando a generar variaciones discretas, con machos más grandes y ornamentados y otros más pequeños y menos llamativos (Clutton-Brock, 2017; Gadgil, 1972; Petrie, 1992). En poblaciones de Gonyletpidae generalmente se identifican machos adultos grandes, con pata IV más desarrollada y/o armadura proporcionalmente más fuerte, con frecuencia llamados “machos α” o “majors”, y otros más pequeños, con armadura menos desarrollada, a veces incluso con apariencia decididamente feminiforme, los “machos β” o “minors” (Buzatto, 2012; Buzatto et al., 2014). Estas diferencias son a veces tan acentuadas que pueden llevar a confusiones taxonómicas (como creer erróneamente que los machos pequeños y grandes son diferentes especies) o incluso, dar la falsa idea de que los machos menores representarían una suerte de adultos de primer estadio capaces de mudar (Gnaspini et al., 2004). Si fuera cierta la supuesta existencia de 2 estadios adultos en Gonyleptidae, sería una excepción inédita en toda la Clase Arachnida.
En Gonyleptidae, cada morfotipo ha sido asociado a una estrategia reproductiva diferente: los machos α defienden un harén y/o la puesta de huevos, mientras los machos β son solitarios y aprovechan alguna distracción de los majors para inseminar hembras (Buzatto et al., 2014). En 2 opiliones neozelandeses del suborden Eupnoi, Pantopsalis cheliferoides (Colenso, 1882) y Forsteropsalis pureora Taylor, 2013 (Neopilionidae) se ha descrito incluso la existencia de trimorfismo (3 morfos discretos) en los machos, en este caso afectando las proporciones de largo y grosor de artejos en los quelíceros, que son los apéndices que usan para enfrentar a otros machos (Painting et al., 2015; Powell et al., 2020). Solo en este último trabajo, las mediciones fueron analizadas con morfometría geométrica, mientras en los restantes de dimorfismo en machos de opiliones, se usó morfometría lineal o tradicional.
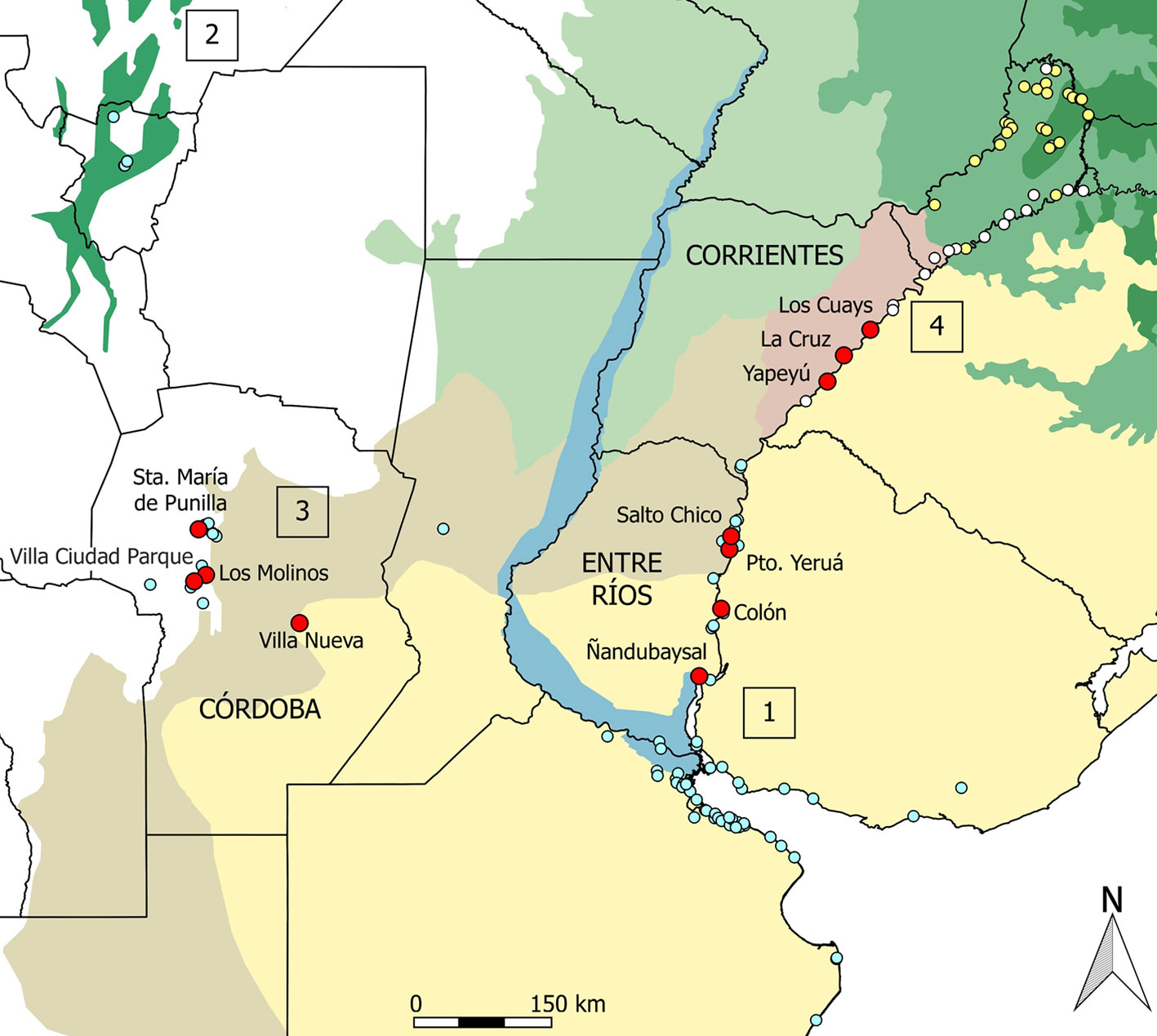
Por la complejidad y variaciones de la armadura del macho, el goniléptido Discocyrtus prospicuus (Holmberg, 1876) y sus formas afines representan un modelo muy adecuado para abordar estas cuestiones. Según el conocimiento actual, D. prospicuus (sensu stricto) se distingue por caracteres muy sutiles de al menos 2 especies nominales, D. bucki Mello-Leitão, 1935 y D. vegetus Canals, 1939, formando en conjunto lo que denominamos el complejo D. prospicuus (nombre basado en su especie más característica). Mientras D. vegetus fue considerada una especie válida por Ringuelet (1959), los ejemplares de Misiones que este autor refirió como D. prospicuus, fueron luego asignados a D. bucki por Acosta y Guerrero (2011). Observaciones inéditas muestran que la distribución de D. bucki se prolonga desde Misiones, a lo largo del río Uruguay, hasta los 29°43’ S en la provincia de Corrientes (fig. 1), con una aparente y sutil variación clinal N-S de algunos caracteres. A partir de las poblaciones de Entre Ríos hacia el sur, se detecta la morfología típica de D. prospicuus s.s.
Junto con D. dilatatus Sørensen, 1884 y D. testudineus (Holmberg, 1876), D. prospicuus s.s. es una de las 3 especies del género Discocyrtus Holmberg, 1878 que define los límites occidental y austral del extenso género, con mayoría de especies en el este de Brasil (Kury, 2003). Las 3 muestran una amplia distribución en el área opiliológica mesopotámica “sensu stricto” de Argentina, definida por Acosta (2002). Dicha área comprende las extensas planicies, húmedas y semihúmedas, situadas entre los ríos Paraná y Uruguay, así como una franja al oeste del primero; contiene, en conjunto, un mosaico de arbustales, bañados, pastizales y bosques en galería (Acosta, 2002). En el extremo nordeste de la mesopotamia (provincia de Misiones), la fisonomía es de selva subtropical y posee componentes opiliofaunísticos distintivos, siendo reconocida como un área diferente, el área misionera o paranense (Acosta, 2002). Según los registros conocidos hasta el momento (Acosta y Guerrero, 2011; obs. inéd.), el complejo D. proscipuus, tomado en conjunto, se concentra en Argentina en al menos 4 zonas, indicadas en figura 1. Las 3 primeras corresponden a lo que llamamos D. prospicuus s.s., en coincidencia con el concepto taxonómico adoptado por Acosta y Guerrero (2011). Estas zonas son: 1) un área principal rodeando el estuario del río de la Plata, el delta del río Paraná y la parte baja del río Uruguay, tanto del lado argentino (hasta Entre Ríos) como uruguayo, 2) un sector asociado a las Yungas en el NOA (= noroeste argentino, provincias de Tucumán, Salta y Jujuy), y 3) una zona central que abarca las planicies de la provincia de Córdoba, hasta las primeras estribaciones serranas. La zona 4) de este complejo de especies, se ubica en la provincia de Misiones, con la mencionada prolongación sobre el borde oriental de la vecina provincia de Corrientes, sector que contiene a D. vegetus y D. bucki (fig. 1). Sin abrir juicio sobre la identidad de las 3 especies nominales (sin dudas muy próximas), en este trabajo se estudian poblaciones asignadas a 2 entidades del mencionado complejo D. prospicuus.
A pesar de la compleja estructura que ofrecen los machos de Gonyleptidae, y su aparente variabilidad, no se ha aplicado hasta el momento la técnica de morfometría geométrica (MG) para abordar diversas problemáticas, como probar la existencia de esta variación y de posibles morfotipos discretos con diferentes tamaños centroide y conformación. Ésta es una herramienta matemática con fundamentos biológicos que ha demostrado ser muy efectiva para descomponer la variación resultante de la fisiología del individuo, de aquella más estable, propia de una población y producto principalmente de un componente genético (Dujardin, 2008). Debido a ésto, la MG ha logrado resolver exitosamente problemas taxonómicos, ha sido utilizada para identificar marcadores de hábitats, en estudios de estructuración poblacional, de dispersión y diferenciación sexual, en arácnidos e insectos entre otros grupos (Bechara y Liria, 2012; Carvalho et al., 2010; Crews y Hedin, 2006; Dujardin, 2008, 2011; Hernández et al., 2011, 2013, 2015, 2018, 2020; Pretorius, 2005; Sasakawa, 2016).
Si bien existen varias hipótesis que intentan explicar estas diferencias morfométricas, las investigaciones en Gonyleptidae, hasta el momento, han abordado el problema a través de medidas lineales de una o pocas dimensiones corporales (como largo del escudo, del fémur IV, quelíceros, etc.), o más frecuentemente de la covariación de tales caracteres (e.g., Buzzatto et al., 2014; Painting et al., 2015; Zatz et al., 2011). El único antecedente de uso de MG en Opiliones corresponde a otra familia (Powell et al., 2020). La medición de caracteres lineales deja de lado la geometría de la estructura corporal medida y no tiene en cuenta que dicha estructura puede sufrir cambios de manera diferente en cada punto anatómico de referencia. Como se dijo, no existen, de momento, estudios en Gonyleptidae que utilicen MG basada en puntos de referencia para intentar describir estas variaciones, aplicarlas en la delimitación de especies y explicar las causas de la variación.
El presente trabajo busca evaluar la potencialidad de la MG para determinar el dimorfismo sexual en el tamaño y la conformación de 2 caracteres: el escudo dorsal y la coxa IV de machos y hembras dentro del complejo D. prospicuus. También se procura evaluar la existencia de pecilandria a través de la variabilidad morfométrica del escudo dorsal y coxa IV de los machos, así como la influencia geográfica sobre la variabilidad morfométrica y el dimorfismo sexual. El desarrollo de la coxa IV es un carácter muy conspicuo, previamente usado en la identificación con medidas lineales de los 2 tipos de dimorfismo en machos de Opiliones (Buzatto et al., 2014). En cuanto al escudo, solamente se ha utilizado como referencia para estandarizar medidas lineales de la pata IV en el análisis de cambios alométricos (Willemart et al., 2009; Zatz et al., 2011). El contorno del escudo ha sido utilizado mayormente con enfoque taxonómico pero solo como un carácter cualitativo, identificándose diversas tipologías que contemplan las dimensiones relativas de carapax y mesotergo, curvaturas laterales de este último y el aspecto general (Kury y Medrano, 2016). Este es, por tanto, el primer intento de abordar esta estructura desde la MG.
Materiales y métodos
La identificación taxonómica de los ejemplares utilizados en los análisis fue realizada siguiendo los criterios de Acosta (1999), Acosta y Guerrero (2011), Capocasale (1966) y Ringuelet (1959). Este material, conservado en etanol 70%, forma parte de la colección aracnológica de la Cátedra de Diversidad Biológica II, Facultad de Ciencias Exactas, Físicas y Naturales, Universidad Nacional de Córdoba (CDA). Los ejemplares corresponden a 3 provincias argentinas (Entre Ríos, Córdoba y Corrientes), representativas, respectivamente, de los sectores 1, 3 y 4 según se definen más arriba y se muestran en la figura 1. Se trabajó con 113 individuos (58 machos y 55 hembras) de 11 localidades (4 localidades en Entre Ríos: n = 18♂♂ 21♀♀, 4 en Córdoba: n = 13♂♂ 24♀♀, 3 en Corrientes: n = 27♂♂ 10♀♀). El detalle de localidades (con coordenadas), número y sexo de los ejemplares examinados se presenta en el apéndice 1. Para los análisis de dimorfismo sexual se trabajó con la totalidad de machos y hembras como un único grupo, es decir sin identificar su procedencia. En los análisis para evaluar posible dimorfismo en machos se tuvo en cuenta el sector (Corrientes, Entre Ríos o Córdoba) a fin de poner a prueba si esta característica sufre modificaciones según el área geográfica.
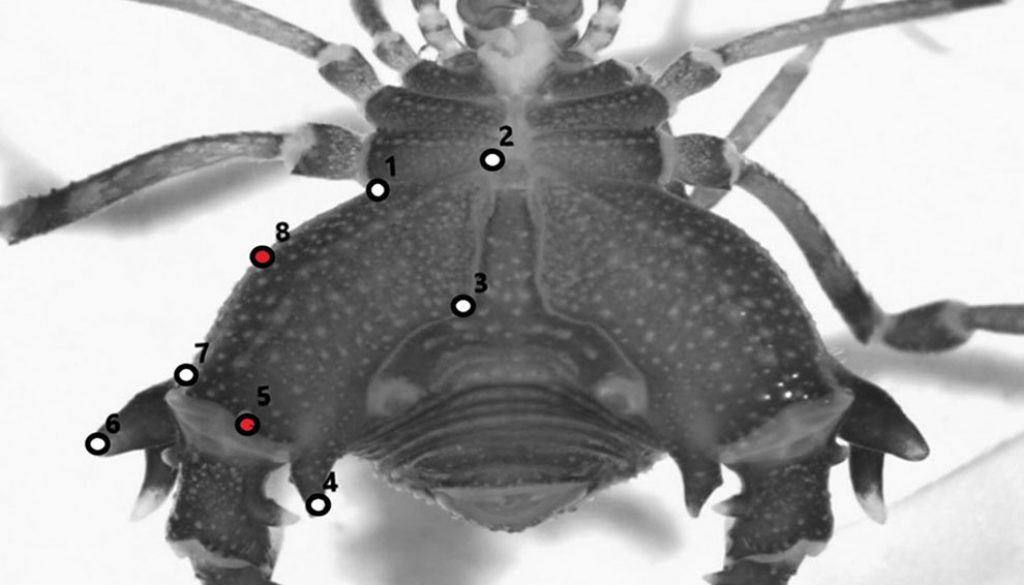
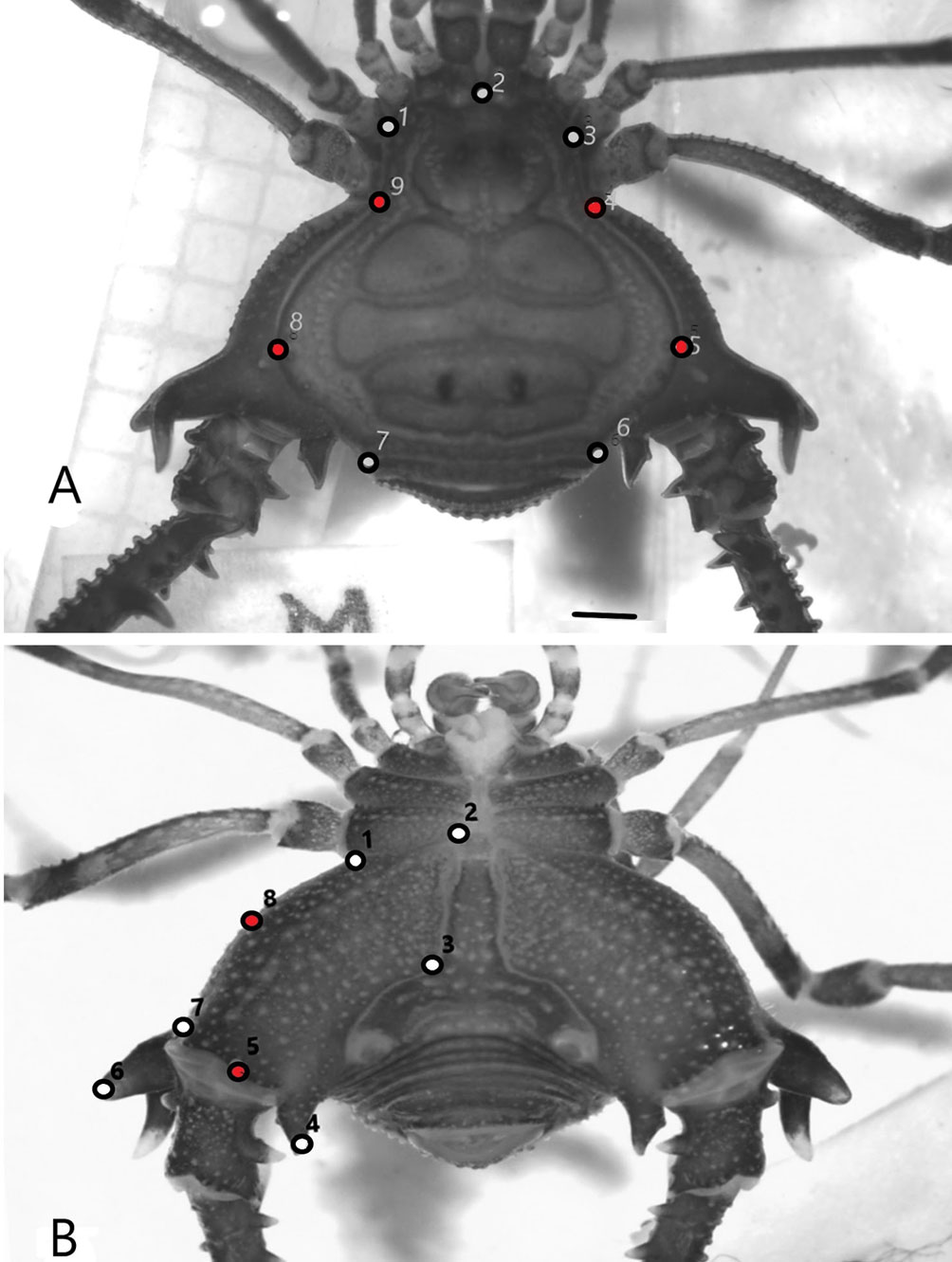
El mapa de localidades fue diseñado con el software QGIS 2.8.1 – Wien (Sistema de Información Geográfica de código abierto, https://qgis.org/), utilizando capas espaciales libremente disponibles en http://www.diva-gis.org/Data y https://www.worldwildlife.org/publications/terrestrial-ecoregions-of-the-world. Para los análisis morfométricos (de escudo y coxa IV), los ejemplares fueron colocados en una cápsula de Petri con etanol 70% cubriendo completamente su cuerpo. Cada ejemplar fue fotografiado por sus caras dorsal y ventral con ayuda de un estereomicroscopio Leica M5 (10X) equipado con cámara digital Leica EC3. Las fotografías fueron capturadas, procesadas y guardadas en formato .jpg utilizando el software Leica Application Suite (versión 3.4, http://www. leica-microsystems.com/education). Se seleccionaron 9 puntos de referencia tipo 2 y 3 (definidos según el nivel de precisión; Bookstein, 1991) para el escudo dorsal (fig. 2A) y 8 puntos de referencia tipo 2 para la coxa de la cuarta pata, en vista ventral (fig. 2B). Las variables de conformación fueron obtenidas por medio del análisis generalizado de Procrustes y la subsiguiente proyección de los residuos en el espacio euclidiano (Rohlf, 1999). Los componentes no uniformes y uniformes fueron usados como variables de conformación. Los componentes uniformes describen la variación global como estiramientos y compresión, y los componentes no uniformes corresponden a la variación local (Zelditch et al., 2004). Estos 2 componentes describen las diferencias en la conformación como desviaciones de la configuración de puntos de referencia promedio. Para comparaciones del tamaño del escudo y de las coxas se utilizó el estimador denominado tamaño centroide (CS, por sus siglas en inglés), derivado de las coordenadas. Éste es definido como la raíz cuadrada de la suma de las distancias al cuadrado entre el centro de la configuración de puntos de referencia y cada punto individual (Bookstein, 1991).
La varianza en la conformación de escudo dorsal y coxas IV se determinó utilizando el índice de disparidad métrica (MD). Este índice proporciona un valor único que mide la variabilidad en la conformación en una muestra y se basa en las distancias euclidianas de cada forma con respecto al consenso (Zelditch et al., 2004).
Dos diferentes paquetes de software fueron usados para la digitalización, análisis y obtención de resultados: el paquete CLIC version 97 (Dujardin y Slice, 2007) (https://xyom-clic.eu) y el reciente paquete morfométrico online, XYOM (https://xyom.io). La digitalización de puntos de referencia, el análisis generalizado de Procrustes y los análisis de tamaño centroide y conformación se realizaron con los apartados “digitization”, “characterization” y “miscellaneous” del paquete XYOM. Los análisis de alometría se realizaron con el módulo CLIC49. Se utilizó el análisis de función discriminante (DFA, por sus siglas en inglés) para comparaciones entre grupos de diferentes provincias. La significancia estadística de los análisis de tamaño y conformación fue evaluada usando un test no paramétrico basado en permutaciones (5,000 ciclos).
Resultados
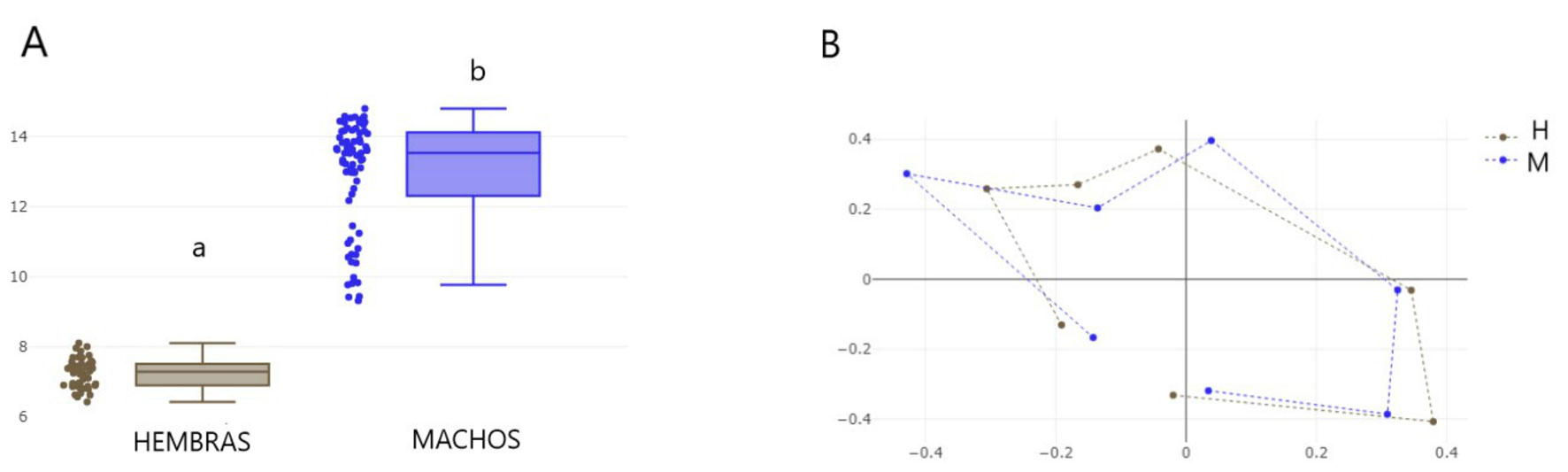
Los primeros análisis permitieron la caracterización del dimorfismo sexual. El tamaño centroide (CS) de la coxa IV resultó estadísticamente diferente entre sexos. Las hembras mostraron menor tamaño en sus coxas IV (mediana: 7.29, desviación estándar DS: 0.40) en relación a los machos (mediana: 12.94, desviación estándar: 1.57)
p < 0.0001 (fig. 3A). Además, en el grupo de los machos se observaron 2 subgrupos con diferentes tamaños, mientras que en las hembras se observa muy poca dispersión en los valores de CS de la coxa IV y ausencia de subgrupos como los observados en machos.
El análisis discriminante con las variables de conformación de la coxa IV mostró diferenciación significativa de los grupos de machos y hembras (p < 0.001, 1,000 permutaciones), con una distancia de Mahalanobis de 7.59. Los puntos de referencia de esta estructura muestran importantes movimientos entre machos y hembras, principalmente en los relacionados con el ancho de la coxa y con la presencia de apófisis en machos y que son prácticamente inexistentes en hembras (fig. 3B).
Con respecto al tamaño centroide del escudo dorsal, este parámetro resultó mayor en hembras (mediana: 12.95, desvío: 1.76) en relación a machos (mediana: 11.88, desvío: 1.53), p < 0.001 después de 1,000 permutaciones. El gráfico de cajas muestra que tanto en la distribución de machos como de hembras, se observan 2 grupos discretos bien diferenciados, con mayor y menor tamaño centroide (fig. 4A).
En cuanto a la conformación del escudo dorsal, el gráfico de objetos promedio muestra que los puntos de referencia con mayores cambios son los relacionados con el ancho máximo y posterior del escudo (a la altura de la apófisis coxal): 5 y 6, 7 y 8. En la región delimitada por esos puntos de referencia (fig. 2A), las hembras evidenciaron escudos mas angostos que los machos si se considera el ancho máximo, pero con mayor ancho posterior (fig. 4B). El análisis multivariado discriminante muestra diferencias significativas (p < 0.001, usando la corrección de Bonferroni) en la conformación del escudo de machos y hembras. La distancia de Mahalanobis entre grupos fue de 2.115.
En cuanto a los análisis de dimorfismo en machos y variación geográfica, los resultados muestran que el tamaño centroide de coxa IV resultó significativamente mayor en individuos de Corrientes (12.36) en relación con los de una área contigua, Entre Ríos (10.68, p < 0.001). El grupo de Córdoba, aunque levemente menor que Corrientes, no se diferencia significativamente de ninguno de los otros grupos (mediana: 11.57) (fig. 5A). En los grupos de Córdoba y Corrientes, se observan 2 subgrupos marcados en cuanto al tamaño centroide, evidenciando machos con coxas de mayor tamaño y otro con coxas menores dentro de estas provincias. El grupo de Entre Ríos no mostró una gran dispersión ni subgrupos marcados en cuanto a esta variable (fig. 5A).

Con respecto a la conformación de la coxa IV en machos, los primeros ejes del análisis DFA explican el 92% de la variación (51% y 41% para el primer y segundo factor, respectivamente). El mapa factorial muestra un solapamiento de los 3 grupos, y una ausencia de diferenciación significativa entre machos de los grupos de Corrientes, Entre Ríos y Córdoba. Las distancias de Mahalanobis, aunque no muestran diferencias significativas entre grupos, resultaron mayores entre los grupos de Córdoba y Entre Ríos (1.92) y menores entre los grupos de Corrientes y Entre Ríos (1.49) (fig. 6A). El efecto alométrico fue de 5% para las variables canónicas CV1 y 13% CV2. Eliminando el efecto alométrico las diferencias entre los machos de las 3 provincias resultaron significativamente diferentes (p < 0.05). La disparidad métrica (MD) resultó menor en el grupo de Corrientes (0.0029) diferenciándose significativamente de Córdoba (0.0046), quien muestra la mayor DM. Entre Ríos muestra un valor intermedio de DM, diferenciándose también de Córdoba y Corrientes con valores significativos (0.0036), (p < 0.005, 5,000 bootstraps).
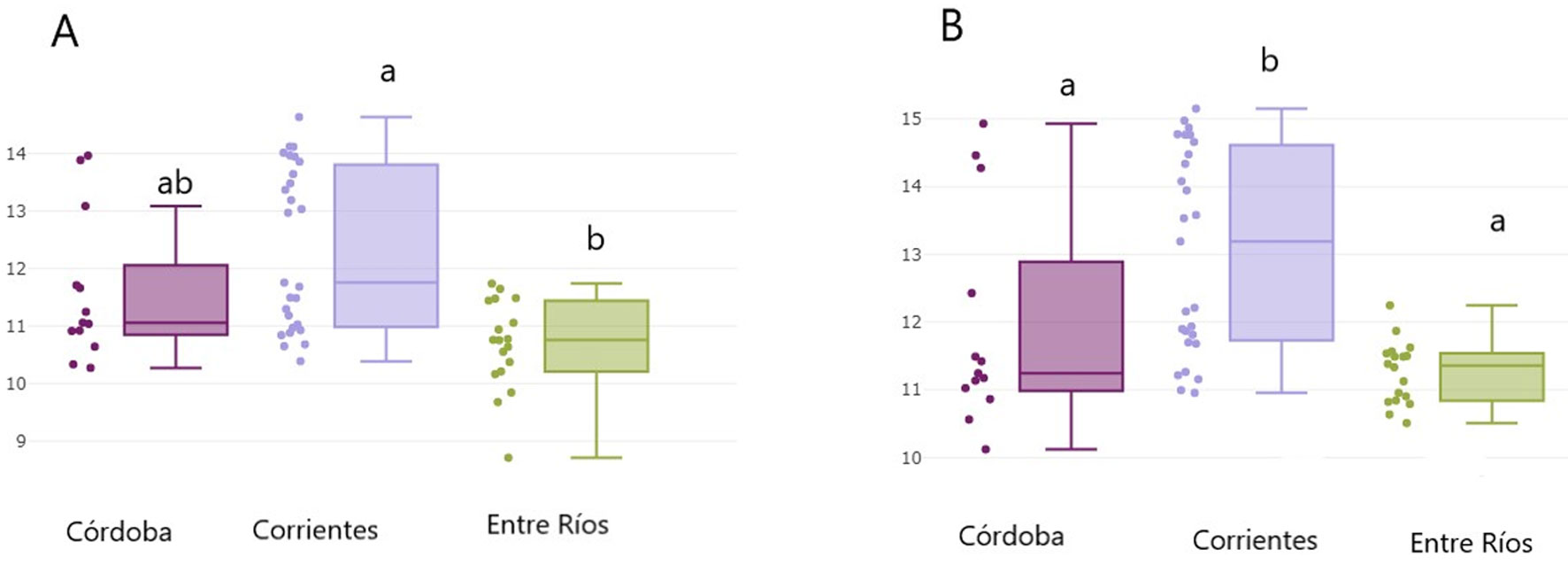

Al igual que sucede con la variable coxa IV, el grupo de Entre Ríos (mediana: 11.36) es el que muestra menor dispersión al analizar el tamaño centroide del escudo dorsal, sin diferenciación de subgrupos (fig. 5B). Córdoba presenta menor valor de mediana (11.24), y al igual que en el grupo de Corrientes (mediana: 13.19), se observan subgrupos discretos con mayores y menores valores de tamaño centroide del escudo dorsal. Las diferencias de CS resultaron estadísticamente significativas entre los grupos de Córdoba y Corrientes, y entre los de Corrientes y Entre Ríos (p < 0.05). Por su parte, Córdoba y Entre Ríos no difieren en el tamaño centroide del escudo dorsal (fig. 5B).
En cuanto a la conformación del escudo dorsal, los primeros factores discriminantes explican 94 % de la variación (64% y 30% para CV1 y CV2). El análisis discriminante no encuentra diferencias estadísticamente significativas entre los grupos de las 3 provincias para el escudo dorsal. (p < 0.05, 1000 ciclos). La menor distancia de Mahalanobis se da entre los grupos de Córdoba y Corrientes (0.884) mientras que Corrientes y Entre Ríos muestran la mayor distancia (1.65) (fig. 6B). El efecto alométrico es del 6%. Extrayendo el efecto alométrico, las diferencias entre grupos no resultaron estadísticamente significativas. La disparidad métrica no resultó significativamente diferente entre grupos (Córdoba 0.0109, Corrientes 0.0092, Entre Ríos 0.0108).
Discusión
Las diferencias entre machos y hembras son el resultado evolutivo de presiones selectivas actuando diferencialmente entre sexos. Las presiones selectivas pueden ser intra o intersexuales, aunque a veces presentan una función ecológica diferente, que es reducir el solapamiento de nichos y la competencia entre sexos (Pianka, 1982). En nuestros análisis se pudo observar un marcado dimorfismo sexual en el tamaño y la conformación de la coxa IV y del escudo dorsal, aunque en cada estructura este dimorfismo se mostró en distinto sentido. Las coxas IV revelaron menor tamaño centroide en hembras en relación a machos, mientras para el escudo dorsal las hembras fueron las que mostraron mayor CS. Estos resultados evidencian que las fuerzas de canalización (es decir, la capacidad de un genotipo de producir el mismo fenotipo a pesar de la variabilidad de su entorno) actúan de manera diferente en las 2 estructuras medidas en este trabajo. Observamos que la canalización es más fuerte en el escudo en comparación con las coxas IV. Estas últimas resultaron las estructuras con mayor variabilidad morfométrica, sobre todo en los machos; ellas son un elemento usado en los enfrentamientos con otros machos por los apareamientos con hembras. Por otro lado, el escudo es una estructura donde la evolución priorizaría un desarrollo más armónico a lo largo de su ciclo de vida, en comparación con las coxas IV, en las cuales la importancia de su desarrollo se relaciona al estadio adulto (para competencia de machos por luchas intrasexuales). Las diferencias en la dirección de desarrollo en coxas y escudo apoyan la hipótesis de canalización genética, como se ha sugerido también para mediciones morfométricas de cabeza y alas en insectos (Caro-Riaño, 2009; Dujardin, 2011; Hernández et al., 2011), y en experimentos de plasticidad fenotípica (Hallson y Bjӧrklund, 2012). Fairbairn (2005), mostró la existencia de una plasticidad diferencial en machos y hembras de Aquarius remigis (Say, 1832) (Hemiptera, Gerridae). Este tipo de plasticidad plantea una canalización adaptativa sobre los rasgos más estrechamente asociados con la aptitud reproductiva (por ejemplo, ancho del abdomen en hembras, longitud genital en machos, etc.) como una hipótesis alternativa a la regla de Rensch.
Por otro lado, los resultados aquí expuestos demuestran el dimorfismo en machos (pecilandria) para las 2 estructuras medidas, en al menos 2 de las 3 zonas geográficas estudiadas. En nuestros datos, los machos evidenciaron 2 subgrupos bien marcados en cuanto al tamaño centroide, tanto de las coxas IV como del escudo dorsal. Buzatto et al. (2014) encontraron que la selección sexual puede llevar a evitar el gasto en rasgos sexuales secundarios en algunos machos. De esta manera, la existencia de machos alfa y beta, con coxas de mayor y menor tamaño, o las diferencias en el tamaño de los escudos, pueden estar indicando habilidades diferentes para conseguir llegar a la hembra y finalmente aparearse (Gross, 1996; Shuster y Wade, 2003; Taborsky et al., 2008). El comportamiento de cópulas furtivas en machos pequeños fue registrado en Opiliones para Longiperna concolor (Mello-Leitão, 1923) (Gonyleptidae: Mitobatinae), donde parece ser parte de una táctica reproductiva alternativa a la defensa de los recursos que se da en los machos a (Zatz et al., 2011). De modo similar, Powell et al. (2020) lograron dilucidar un caso de trimorfismo en machos de Neopilionidae, utilizando morfometría geométrica de quelíceros, que en esta familia son los apéndices utilizados en los enfrentamientos entre machos. Según sus observaciones, cada morfotipo tendría una estrategia diferente en el uso de sus quelíceros durante las luchas entre machos (Powell et al., 2020).
Aunque el dimorfismo en machos se detectó en las poblaciones de Corrientes y Córdoba, no pudo observarse en los ejemplares de Entre Ríos, en donde la variabilidad fenotípica en los rasgos medidos resultó muy baja. Esta característica puede estar indicando diferencias geográficas dadas por el ambiente. Es posible que debido a una estrategia reproductiva o a una limitante ambiental (competencia, predación, variación fenotípica local dada por el ambiente) en los ejemplares de Entre Ríos, el dimorfismo de machos no sea evidente, o no sea una estrategia adaptativa preferida para esta región geográfica.
Para finalizar, los resultados mostraron que al analizar el escudo dorsal, las hembras también exhibieron subgrupos discretos con diferentes tamaños, algo que no se ha descripto previamente en hembras de Opiliones. El escudo dorsal es un indicador del tamaño corporal, por lo que los resultados estarían indicando diferencias de tamaño dentro del grupo de las hembras que podrían deberse a diferencias ambientales regionales. Un examen detallado evidencia que las hembras más pequeñas que se observan en los gráficos de tamaño centroide (fig. 4A), corresponden a ejemplares recolectados en Entre Ríos. Este resultado puede relacionarse con lo observado en machos de Entre Ríos (baja variabilidad en CS de coxa y escudo) y ausencia de dimorfismo. Esto sugiere diferencias regionales en Entre Ríos que impactan directamente en el tamaño de los ejemplares, tanto machos como hembras. Se sabe que el tamaño centroide es una variable altamente influenciada por el estado nutricional y por la temperatura (regla de Bergmann). Es posible que el tamaño en D. prospicuus de Entre Ríos tenga una influencia ambiental local, se trate de poblaciones que habrían sufrido un efecto fundador o presenten muy bajo movimiento dispersivo con poblaciones vecinas. En balance, los ejemplares de Corrientes (“D. bucki”) tienden a diferenciarse más acentuadamente de los de otras zonas (por lo general hacia el mayor tamaño), si bien no estamos en condiciones de abrir juicio sobre su posible conespecificidad con los otros grupos del complejo.
Por su parte, se analizan por primera vez los caracteres morfológicos y morfométricos en hembras de Opiliones, caracterizando su variación. En cuanto al uso de la técnica, los resultados permiten concluir que la aplicación de MG logró la identificación de morfotipos discretos en machos del complejo D. prospicuus. Se identificó por primera vez cómo ocurre la variación de las coxas IV y escudo dorsal, proponiendo una variabilidad diferencial en cada una de las estructuras medidas. Este trabajo demuestra que es posible dilucidar la complejidad morfológica presente en D. prospicuus (sensu lato) a través de MG, lo cual constituye un avance en la comprensión de la ocurrencia de dimorfismos y las variaciones geográficas asociadas con esta variación.
Agradecimientos
A J.P. Dujardin por la ayuda y sugerencias en lo referente a software y análisis morfométrico. Este trabajo fue parcialmente financiado por CONICET (Consejo Nacional de Investigaciones Científicas y Técnicas, Argentina, P.I.P. Res. D. 0111/2016) y SECYT-UNC (Secretaría de Ciencia y Tecnología de la Universidad Nacional de Córdoba, (Subsidio 2018-2021). MLH y LEA son investigadores de CONICET.
Apéndice 1. Número de ejemplares medidos y sitios de colecta de machos y hembras del complejo Discocyrtus prospicuus.
|
Provincia |
Localidad |
Coordenadas geográficas |
Núm. de machos |
Núm. de hembras |
Información del lote |
|
Corrientes |
Los Cuays, Puesto Prefectura Naval |
28°51.183’ S 56°18.218’ O |
10 |
– |
CDA 000.905 (L. Acosta, R. Gonzalez Ittig, L. Vaschetto coll., 26-ii-2012) |
|
La Cruz, Gruta del Agua Santa |
29°09.89’ S 56°37.528’ O |
10 |
– |
CDA 000.906 (L. Acosta, R. Gonzalez Ittig, L. Vaschetto coll., 26-ii-2012) |
|
|
Yapeyú |
29° 29.023’ S 56°49.552’ O |
7 |
10 |
CDA 000.907 (L. Acosta, R. Gonzalez Ittig, L. Vaschetto coll., 26-ii-2012) |
|
|
Entre Ríos |
Salto Chico, Concordia |
31°21.912’ S 57°59.777’ O |
3 |
5 |
CDA 000.902 (L. Acosta, G. Rubio coll., 9-xii-2010) |
|
Puerto Yeruá |
31°31.557’ S 58°1.048’ O |
6 |
4 |
CDA 000.903 (L. Acosta, G. Rubio coll., 9-xii-2010) |
|
|
Colón, 1-2 km S |
32°14.847’ S 58°7.049’ O |
5 |
10 |
CDA 000.897 (L.E. Acosta, M. García coll., 24–xi–2006) |
|
|
Ñandubaysal, Gualeguaychú |
33°4.055’ S 58°23.035’ O |
4 |
2 |
CDA 000.904 (L. Acosta, G. Rubio coll., 10-xii-2010) |
|
|
Córdoba |
Santa María de Punilla |
31°16.85’ S 64°28.22’ O |
2 |
13 |
CDA 000.901 (G. Rubio coll., 12-vii-2008) |
|
Villa Ciudad Parque |
31°54.84’ S 64°31.43’ O |
3 |
– |
CDA 000.900 (L. Acosta, M. García coll., 31-i-2008) |
|
|
Los Molinos, bosque junto al puente |
31°50.17’ S 64°22.87’ O |
5 |
– |
CDA 000.899 (L. Acosta, M. García, G. Rubio, J. Vergara coll., 18–xii–2008) |
|
|
Villa Nueva, próximo a puente |
32°25.34’ S 63°14.56’ O |
3 |
11 |
CDA 000.898 (L. Acosta, M. García, G. Rubio coll., 14-ii-2008) |
Referencias
Acosta, L. E. (1999). New synonyms in the genera Discocyrtus and Pachyloides (Opiliones, Gonyleptidae, Pachylinae). The Journal of Arachnology, 27, 465–469.
Acosta, L. E. (2002). Patrones zoogeográficos de los opiliones argentinos (Arachnida: Opiliones). Revista Ibérica de Aracnología, 6, 69–84.
Acosta, L. E. y Guerrero, E. L. (2011). Geographical distribution of Discocyrtus prospicuus (Arachnida: Opiliones: Gonyleptidae): Is there a pattern? Zootaxa, 3043, 1 – 24. http://dx.doi.org/10.11646/zootaxa.3043.1.1
Acosta, L. E., Pérez-González, A. y Tourinho, A. L. (2007). Methods for taxonomic study. En R., Pinto-da-Rocha, G. Machado y G. Giribet (eds.), Harvestmen: the biology of opiliones (pp. 494–505). Harvard University Press.
Álvarez, V. B. (2017). Competencia y elección entre sexos en animales. La Habana: Editorial Científico-Técnica.
Andersson, M. B. (1994). Sexual selection. Princeton University Press.
Bechara, W.Y. y Liria, J. (2012). Morfometría geométrica en cinco especies de Buthidae y Scorpionidae (Arachnida: Scorpiones)
de Venezuela. Revista Mexicana de Biodiversidad, 83, 421–431. http://dx.doi.org/10.22201/ib.20078706e.2012.2.954
Bookstein, F. (1991). Thin-plate splines and the atlas problem for biomedical images. En A. C. F. Colchester y D. J. Hawkes (Eds.), Information processing in medical imaging (pp. 326–342). Wye: Springer. http://dx.doi.org/10.1007/BFb0033763
Buzatto, A. B. (2012). The evolution of male dimorphism in arthropods (Tesis). Universidad of Western, Australia.
Buzatto, B. A., Tomkins, J. L., Simmons, L. W. y Machado, G. (2014). Correlated evolution of sexual dimorphism and male dimorphism in a clade of Neotropical harvestmen. Evolution, 68, 1671–1686. http://dx.doi.org/10.1111/evo.12395
Capocasale, R. (1966). Opiliones del Uruguay. Discocyrtus prospicuus Holmberg, el alotipo hembra de Pygophalangodus gemignanii uruguayensis Ringuelet (Gonyleptidae) y Metalibitia rosascostai sp. nov. (Cosmetidae). Bulletin du Muséum National D’Histoire Naturelle, 37, 631–644.
Caro-Riaño, H., Jaramillo, N. y Dujardin, J. P. (2009). Growth changes in Rhodnius pallescens under simulated domestic and sylvatic conditions. Infection, Genetics and Evolution, 9, 162–168. https://doi.org/10.1016/j.meegid.2008.10.009
Carvalho, L. S., Candiani, D. F., Bonaldo, A. B., Suesdek, L. y Silva, P. R. R. (2010). A new species of the sun-spider genus Mummucia (Arachnida: Solifugae: Mummucidae) from Piauí, northeastern Brazil. Zootaxa, 2690, 19–31. http://dx.doi.org/10.11646/zootaxa.2690.1.2
Clutton-Block, T. (2017). Reproductive competition and sexual selection. Philosophical Transactions of the Royal Society B, 372, 1471–2970. http://doi.org/10.1098/rstb.2016.0310
Crews, S. C. y Hedin, M. (2006). Studies of morphological and molecular phylogenetic divergence in spiders (Araneae: Homalonychus) from the American southwest, including divergence along the Baja California Peninsula. Molecular Phylogenetics and Evolution, 38, 470–487. https://doi.org/10.1016/j.ympev.2005.11.010
Darwin, C. (1871). The descent of man and selection in relation to sex. London: John Murray. http://dx.doi.org/10.5962/bhl.title.121292
Delph, L. F. (2005). Procesos que limitan y facilitan la evolución del dimorfismo sexual. The American Naturalist, 166, S1–S4.
Dujardin, J. P. (2008). Morphometrics applied to medical entomology. Infection, Genetics and Evolution, 8, 875–890. https://doi.org/10.1016/j.meegid.2008.07.011
Dujardin, J. P. (2011). Modern morphometrics of medically important insects. Genetics and Evolution of Infectious Disease, 473–501. https://doi.org/10.1016/B978-0-12-384890-1.00016-9
Dujardin, J. P. y Slice, D. (2007). Geometric morphometrics. Contributions to medical entomology. En M. Tibayrenc (Ed.), Encyclopedia of infectious diseases. Modern methodologies (pp. 435-447). Montpellier, France: Wiley & Sons.
Emlen, D. J., Lavine, L. C. y Ewen-Campen, B. (2007). On the origin and evolutionary diversification of beetle horns. Proceedinngs of the National Academy of Sciences, 104, 8661–8668. https://doi.org/10.1073/pnas.0701209104
Fairbairn, D. J. (2005). Allometry for sexual size dimorphism: testing two hypotheses for Rensch’s rule in the water strider Aquarius remigis. The American Naturalist, 166, 69–84. https://doi.org/10.1086/444600
Gadgil, M. (1972). Male dimorphism as a consequence of sexual selection. The American Naturalist, 106, 574–580. http://dx.doi.org/10.1086/282797
Gnaspini, P., Da Silva, M. B. y Pioker, F. C. (2004). The occurrence of two adult instars among Grassatores (Arachnida: Opiliones) —a new type of life-cycle in arachnids. Invertebrate, Reproduction & Development, 45, 29–39. https://doi.org/10.1080/07924259.2004.9652571
Gotoh, H., Miyakawa, H., Ishikawa, A., Ishikawa, Y., Sugime, Y. y Emlen, D. J. (2014). Developmental link between sex and nutrition; doublesex regulates sex-specific mandible growth via juvenile hormone signaling in stag beetles. Plos Genetics, 10, e1004098. https://doi.org/10.1371/journal.pgen.1004098
Gross, M. R. (1996). Alternative reproductive strategies and tactics: diversity within sexes. Trends in Ecology & Evolution, 11, 92–98. https://doi.org/10.1016/07(96)81050-0
Hallson, L. R. y Bjӧrklund, M. (2012). Selection in a fluctuating environment leads to decreased genetic variation and facilitates the evolution of phenotypic plasticity. Journal of Evolutionary Biology, 25, 1275–1290. https://doi.org/10.1111/j.1420-9101.2012.02512.x
Hernández, M. L., Abrahan, L., Dujardin, J. P., Gorla, D. E. y Catalá, S. (2011). Phenotypic variability and population structure of peridomestic Triatoma infestans in rural areas of arid Chaco (western Argentina): spatial influence of macro and microhabitats. Vector Borne and Zoonotic Disease, 11, 503–513. https://doi.org/10.1089/vbz.2009.0253
Hernández, M. L., Amelotti, I., Catalá, S. S. y Gorla, D.E. (2018). Does nutrition influence sexual dimorphism in Triatoma infestans (Hemiptera: Reduviidae) of natural habitats?. Revista de la Sociedad Entomológica Argentina, 77, 1–8. https://doi.org/10.25085/rsea.770101
Hernández, M. L., Dujardin, J .P., Gorla, D. E. y Catalá, S. S. (2013). Potential sources of Triatoma infestans reinfesting peridomicilies identified by morphological characterization in Los Llanos, La Rioja, Argentina. Memerias do Instituto Oswaldo Cruz, 107, 91–97. http://dx.doi.org/10.1590/S0074-02762013000100015
Hernández, M. L., Dujardin, J. P., Gorla, D. E. y Catalá, S. S. (2015). Can body traits, other than wings, witness the flight ability of Triatominae bugs, vectors of Chagas disease ?. Revista da Sociedade Brasileira de Medicina Tropical, 48, 682-691. https://doi.org/10.1590/0037-8682-0249-2015
Hernández, M. L., Espinoza, J., Bustamante-Gomez, M. y Gorla, D. E. (2020). Morphological changes associated with brachypterous Triatoma guasayana (Hemiptera, Reduviidae) and their relationship with flight. International Journal of Tropical Insect Science, 40, 413–421. https://doi.org/10.1007/s42690-019-00092-9
Kury, A. B. (2003). Annotated catalogue of the Laniatores of the New World (Arachnida, Opiliones). Revista Ibérica de Aracnología, 7, 5–337.
Kury, A. M. y Medrano, M. (2016). Review of terminology for the outline of dorsal scutum in Laniatores (Arachnida, Opiliones). Zootaxa, 4097, 130–134. https://doi.org/10.11646/zootaxa.4097.1.9
Kury, A. B. y Pinto-da Rocha, R. (2007). Gonyleptidae Sundevall, 1833. En R. Pinto-da Rocha, G. Machado y G. Giribet (Eds.), Harvestmen: the biology of opiliones (pp. 196–203). Harvard University Press.
Lande, R. (1980). Sexual dimorphism, sexual selection and adaptation in polygenic characters. Evolution, 34, 292–305. http://dx.doi.org/10.2307/2407393
Lavine, L., Gotoh, H., Brent, C. S., Dworkin, I. y Emlen, D. J. (2015). Exaggerated trait growth in insects. Annual Review of Entomology, 60, 453–472. http://dx.doi.org/10.1146/annurev-ento-010814-021045
Lavine, L. C. y Miura, T. (2014). Developmental link between sex and nutrition; doublesex regulates sex-specific mandible growth via juvenile hormone signaling in stag beetles. Plos Genetics, 10, e1004098. http://dx.doi.org/10.1371/journal.pgen.1004098
Marlowe, M. H., Murphy, C. A. y Chatzimanolis, S. (2015). Sexual dimorphism and allometry in the sphecophilous rove beetle Triacrus dilatus. PeerJ, 3, e1123. https://doi.org/10.7717/peerj.1123
McCullough, E. L., Ledger, K. J., O´Brien, D. M. y Emlen, D. J. (2015). Variation in the allometry of exaggerated rhinoceros beetle horns. Animal Behaviour, 109, 133–140. https://doi.org/10.1016/j.anbehav.2015.08.013
Painting, C., Probert, A., Townsend, D. y Holwell, G. I. (2015).Multiple exaggerated weapon morphs: a novel form of male polymorphism in harvestmen. Scientifics Reports, 5, 16368. https://doi.org/10.1038/srep16368
Petrie, M. (1992). Are all secondary sexual display structures positively allometric and, if so, why?. Animal Behaviour, 43, 173–175. http://dx.doi.org/10.1016/S0003-3472(05)80087-9
Pianka, E. R. (1982). Ecología evolutiva. Barcelona: Ediciones Omega, S.A.
Powell, E. C., Painting, C. J., Hickey, A. J. y Holwell, G. I. (2020). Defining an intrasexual male weapon polymorphism in a New Zealand harvestman (Opiliones: Neopilionidae) using traditional and geometric morphometrics. Biological Journal of the Linnean Society, 130, 395–409. https://doi.org/10.1093/biolinnean/blaa040
Pretorious, E. (2005). Using geometric morphometrics to investigate wing dimorphism in males and females of Hymenoptera –a case study based on the genus Tachysphex Kohl (Hymenoptera: Sphecidae: Larrinae). Australian Journal of Entomology, 44, 113–121.https://doi.org/10.1111/j.1440-6055.2005.00464.x
Regalin, R. (1997). Le Tituboea descritte da Baly in ‘Phytophaga Malayana’, 1865-1867 (Coleoptera Chrysomelidae). Bollettino della Società Entomologica Italiana, 129, 109–117.
Rensch, B. (1950). Die abhangigkeit der relativen sexual differenz von der korpengrösse. Bonner Zoologische Beitrage, 1, 58–69.
Rensch, B. (1960). Evolution above the species level. New York: Columbia University Press.
Ringuelet, R. A. (1959). Los arácnidos argentinos del Orden Opiliones. Revista del Museo Argentino de Ciencias Naturales, C. Zool., 5, 127–439.
Rohlf, F. J. (1999). Shape statistics: Procrustes superimpositions and tangent spaces. Journal of Classification, 16, 197–223. https://doi.org/10.1007/s003579900054
Sasakawa, K. (2016). Utility of geometric morphometrics for inferring feeding habit from mouthpart morphology in insects: tests with larval Carabidae (Insecta: Coleoptera). Biological Journal of the Linnean Society, 118, 394–409. https://doi.org/10.1111/bij.12727
Shuster, S. M. y Wade, M. J. (2003). Mating systems and strategies. New Jersey: Princeton University Press. http://dx.doi.org/10.1515/9780691206882
Taborsky, M., Oliveira, F. R. y Brockmann, H. J. (2008). The evolution of alternative reproductive tactics: concepts and questions. En R. Oliveira, M. Taborsky y H. J. Brockmann,(Eds.), Alternative reproductive tactics: an integrative approach (pp. 1–21). Cambridge: Cambridge University Press. https://doi.org/10.1017/CBO9780511542602.002
Vera-Cano, D. A., Álvarez, H. A. y Morón, M. A. (2017). Positive allometry of horns in the rhinoceros beetle Golofa xiximeca does not follow breaking-point patterns. Southwestern Entomologist, 42, 933–940. https://doi.org/10.3958/059.042.0412
Willemart, R. H., Osses, F., Chelini, M. C., Macías-Ordoñez, R. y Machado, G. (2009). Sexually dimorphic legs in a neotropical harvestman (Arachnida, Opiliones): Ornament or weapon?. Behavioural Processes, 80, 51–59. https://doi.org/10.1016/j.beproc.2008.09.006
Zatz, C., Werneck, R. M., Macías-Ordóñez, R. y Machado, G. (2011). Alternative mating tactics in dimorphic males of the harvestman Longiperna concolor (Arachnida: Opiliones). Behavioral Ecology Sociobiology, 65, 995–1005. https://doi.org/10.1007/s00265-010-1103-0
Zelditch, M. L., Swiderski, D. L., Sheets, H. D. y Fink, W. L. (2004). Geometric morphometrics for biologist: a primer. San Diego: Elsevier Academic Press.