Sandra Gisele Patiño-Espinosa a, Gilberto Acosta-González b, Pedro Luis Ardisson a, *
a Instituto Politécnico Nacional, Centro de Investigación y de Estudios Avanzados, Departamento de Recursos del Mar, Carretera antigua a Progreso km 6, Apartado postal 73- Cordemex, 97310 Mérida, Yucatán, México
b Centro de Investigación Científica de Yucatán A.C. Unidad de Ciencias del Agua, Calle 8, Núm. 39, Manzana 29, S.M. 64, 77500 Cancún, Quintana Roo, México
*Autor para correspondencia: pedro.ardisson@cinvestav.mx (P.L. Ardisson)
Recibido: 11 marzo 2021; aceptado: 01 julio 2021
Resumen
Las macroalgas dependen de sustratos específicos para su crecimiento y propagación. Esta relación es importante para comprender el funcionamiento de los arrecifes de coral. En México, sin embargo, los estudios sobre este tema son escasos. Así, en el presente estudio se determinó la diversidad de especies de macroalgas en el Parque Nacional Arrecifes de Xcalak (PNAX), en relación con el sustrato que colonizan. En julio del 2012, se seleccionaron 10 sitios de muestreo en 4 zonas del PNAX: canal de Zaragoza (C), laguna arrecifal 1 (LA1), laguna arrecifal 2 (LA2), y arrecife frontal (AF). Con ayuda de transectos y cuadrantes se recolectaron manualmente especímenes de 61 taxones de macroalgas (entre ellos un morfotipo), principalmente rodofitas, sobre 3 sustratos abióticos y 18 bióticos. De estos taxones, 17 especies constituyeron nuevos registros para el PNAX y 1 para la costa de Quintana Roo. La diversidad fue mayor en LA (3.89), seguido de AF (3.71), observando especies comunes entre ambas zonas. Las familias Halimedaceae, Udoteaceae y Anadyomenaceae se observaron creciendo sobre sustrato abiótico, mientras que las familias Halimedaceae y Dictyotaceae constituyeron sustrato para otras rodofitas. El número de macroalgas registrado en el PNAX representa 10.4% del total registrado para la costa de Quintana Roo.
Palabras clave: Chlorophyta; Ochrophyta; Rhodophyta; Diversidad de especies; Mar Caribe
© 2022 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Benthic macroalgae diversity in relation to substratum in the Xcalak Reefs National Park, Quintana Roo
Abstract
Macroalgae depend on specific substrata for their growth and propagation. This relationship is essential to understand the functioning of coral reefs. In Mexico, however, studies on this subject are scarce. Therefore, in the present study, the diversity of macroalgae species in the Xcalak Reefs National Park (PNAX) was determined in relation to the substrata they colonize. In July 2012, 10 sampling sites were selected in 4 zones of the PNAX: Zaragoza Canal (C), Lagoon Reef 1 (LA1), Lagoon Reef 2 (LA2), and Fore Reef (AF). With the help of transects and quadrants, specimens of 61 taxa of macroalgae (among them a morphotype) were collected manually, mainly Rhodophyta, on 3 abiotic and 18 biotic substrata. Of these taxa, 17 species were new records for the PNAX and 1 for the Quintana Roo’s coast. The diversity was higher in LA (3.89), followed by AF (3.71), observing common species between both zones. The families Halimedaceae, Udoteaceae, and Anadyomenaceae were observed growing on abiotic substrata, while the families Halimedaceae and Dictyotaceae constituted substrata for other Rhodophyta. The number of macroalgae registered in the PNAX represents 10.4% of the total registered for Quintana Roo’s coast.
Keywords: Chlorophyta; Ochrophyta; Rhodophyta; Species diversity; Caribbean Sea
© 2022 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
Las macroalgas bentónicas son un componente esencial en el ecosistema marino, juegan un papel importante en el equilibrio y mantenimiento de los arrecifes coralinos, brindan refugio a peces e invertebrados, modifican los fondos marinos al contribuir a fijar el sustrato por medio de sus rizoides, enriquecen el agua con oxígeno disuelto, y aportan macro y micronutrientes al medio circundante (Barrios et al., 2003; González-Gándara et al., 2007; Mateo-Cid et al., 2013; Santos et al., 2011). Así mismo, éstas son altamente sensibles a cambios ambientales y a la degradación del ambiente al depender de hábitats bentónicos específicos para su crecimiento y propagación (Pellizzari et al., 2014; Santos et al., 2011). Aparte de factores como la radiación luminosa y la temperatura del agua, las macroalgas dependen del sustrato para su desarrollo, ya sea abiótico (arena, roca, esqueleto de coral, restos de conchas de moluscos) o biótico (macroalgas y pastos marinos). El sobrecrecimiento de macroalgas bentónicas en la superficie de otras macroalgas constituye una asociación epifita (Hensley et al., 2013; Sahayaraj et al., 2014), la cual depende de la disponibilidad de sustrato adecuado, en términos de área basal, rugosidad y textura de la superficie, de la producción de sustancias alelopáticas, como el mucilago, y de la tasa de crecimiento del talo (Diez-García et al., 2013). La epibiosis en los hábitats marinos es tan frecuente como poco estudiada; específicamente, los estudios de epifitismo en macroalgas son escasos (Ramírez et al., 2011). Entre éstos podemos citar 2 de ellos realizados en Baja California, costa pacífica de México, involucrando a Padina concrescens (Ortuño-Aguirre y Riosmena-Rodríguez, 2007) y a Sargassum sinicola (Mateo-Cid et al., 2014); otro en Nayarit involucrando a Padina durvillei y a P. crispata (Álvarez-Álvarez et al., 2020); en Veracruz, costa del golfo de México, un estudio de revisión sobre trabajos previos realizados en el área sobre algas epífitas presentes en sustrato rocoso y arrecifal (Ramírez et al., 2011); y en Isla Mujeres, Quintana Roo, un censo de algas epífitas creciendo sobre algas hospederas desprendidas del sustrato rocoso por el oleaje (Quan-Young et al., 2006).
En los arrecifes de coral, las macroalgas son los mayores competidores por luz, nutrientes y sustrato (espacio) de los corales escleractinios. Cuando se reduce la tasa de herbivoría sobre las macroalgas, éstas son capaces de invadir a los corales, afectando la estructura y función de los arrecifes y ser las que dominen la cobertura bentónica de los mismos (Acosta-González et al., 2013; Hughes, 1994). Los arrecifes entran entonces en un proceso de cambio de fase que se caracteriza por la reducción en la cobertura coralina, la proliferación de macroalgas bentónicas y la disminución de la diversidad local de especies (Acosta-González et al., 2013; Arias-González et al., 2017; Ortegón-Aznar et al., 2013). La diversidad de macroalgas es un indicador que puede ser usado en programas de monitoreo, ya que los inventarios permiten detectar la desaparición de algunos taxones, la aparición de otros y los cambios en la composición y distribución de las especies (Pellizzari et al., 2014).
En el océano Atlántico occidental, tropical y subtropical, se tiene un registro aproximado de 1,553 especies de macroalgas bentónicas: 215 Ochrophyta (Pelagophyceae, Phaeophyceae y Xanthophyceae), 1,014 Rhodophyta y 324 Chlorophyta (Wynne, 2017). De esta diversidad, en Quintana Roo (mar Caribe oeste), se ha registrado un total de 587 especies, 68 Ochrophyta, 348 Rhodophyta, y 171 Chlorophyta (Cetz-Navarro et al., 2008; García-García et al., 2020). En esta región se han realizado varios estudios sobre composición de macroalgas (Cetz-Navarro et al., 2008; Dreckmann, 1998; Dreckmann et al., 1996; Mateo-Cid et al., 2006; Ortega et al., 2001; Quan-Young et al., 2006); sin embargo, en el sur de Quintana Roo, específicamente en Xcalak, solo se cuenta con registros florísticos de Huerta-Múzquiz y Garza-Barrientos (1980), Cetz-Navarro et al. (2008) y Conanp (2004) y, en el canal de Zaragoza, de Espinoza-Ávalos et al. (2009), quienes obtuvieron registros de vegetación sumergida desde la bahía de Chetumal hasta la zona de mezcla en el mar Caribe.
El objetivo de este trabajo fue determinar la diversidad alfa, beta y gama de especies de macroalgas bentónicas del sur del Parque Nacional Arrecifes de Xcalak, e identificar las clases de sustrato usadas para la colonización del ambiente bentónico.
Materiales y métodos
El área marina protegida del Parque Nacional Arrecifes de Xcalak (PNAX) constituye el sitio Ramsar 1320 y forma parte del Sistema Arrecifal Mesoamericano. Se localiza al sur del estado de Quintana Roo; sus límites norte y sur están definidos por los paralelos 18°30’00”N y 18°11’00”N, mientras que sus límites este y oeste están definidos por el mar Caribe en la isobata de 100 m y el umbral que define la zona federal marítimo terrestre, respectivamente (Camarena-Luhrs, 2003; Conanp, 2004).
El trabajo se realizó al sur del PNAX en donde se ubica el canal de Zaragoza (fig. 1), vía marítima artificial construida en el año de 1900 para permitir a las embarcaciones, particularmente militares, un paso directo a través de aguas nacionales desde el mar Caribe hacia la bahía de Chetumal (Romero, 2010). El arrecife de coral en el PNAX es de tipo marginal con 25 km de longitud. La zonificación de este arrecife consiste en laguna, frente, pendiente y terraza arrecifal, cada zona con características de complejidad, estructura, diversidad de corales y composición bentónica propias (Arias-González, 1998; Núñez-Lara et al., 2003).
La recolecta de macroalgas se realizó en julio de 2012. Se estableció una red de muestreo de 10 estaciones en 4 zonas: canal de Zaragoza (C) con 2 estaciones y profundidad promedio de 1.5 m; laguna arrecifal con 2 subzonas, laguna arrecifal 1 (LA1) con 2 estaciones localizadas cerca del margen de la costa y profundidad promedio de 0.75 m y laguna arrecifal 2 (LA2) con 4 estaciones y profundidad promedio de 2.5 m; y arrecife frontal (AF) con 2 estaciones y profundidad promedio de 12 m (fig. 1).
En cada estación se trazó un transecto de 20 m paralelo a la costa y en los metros 0, 10 y 20 se tomaron fotografías con ayuda de un cuadrante de 50 × 50 cm. En cada cuadrante se recolectaron manualmente las macroalgas con ayuda de una espátula (Riosmena-Rodríguez et al., 2005). Las muestras de macroalgas se colocaron en botes de polietileno y se fijaron para su preservación con formol al 4% diluido con agua de mar para ser transportadas al laboratorio para su identificación (Florez-Leiva et al., 2010).
Las macroalgas fueron identificadas a la menor categoría taxonómica posible, idealmente especie, con ayuda de literatura especializada (Humann, 1993; Littler y Littler, 1997, 2000; Littler et al., 1989). La revisión de sinonimia y nomenclatura se basó en Guiry y Guiry (2020). La identificación se apoyó en caracteres morfológicos y anatómicos, observados al microscopio a partir de cortes histológicos; estos se efectuaron en regiones del talo, longitudinales o transversales, dependiendo del desarrollo celular de cada grupo (Sánchez-Molina et al., 2007). El sustrato donde las macroalgas fueron recolectadas fue identificado y clasificado en abiótico (esqueletos de coral, roca, arena) y biótico (macroalgas).
Para evaluar la representatividad del muestro en términos de diversidad de especies, se analizó el esfuerzo de muestreo (n = 10 estaciones). Se realizó una curva de acumulación de especies (Chao 2). La curva se construyó con 9,999 aleatorizaciones con el programa EstimateS (v.9; Colwell, 2012; Colwell et al., 2012; Soberón y Llorente, 1993) y para determinar la existencia de diferencias entre lo observado y lo esperado, se aplicó una prueba de Chi2 (χ2).
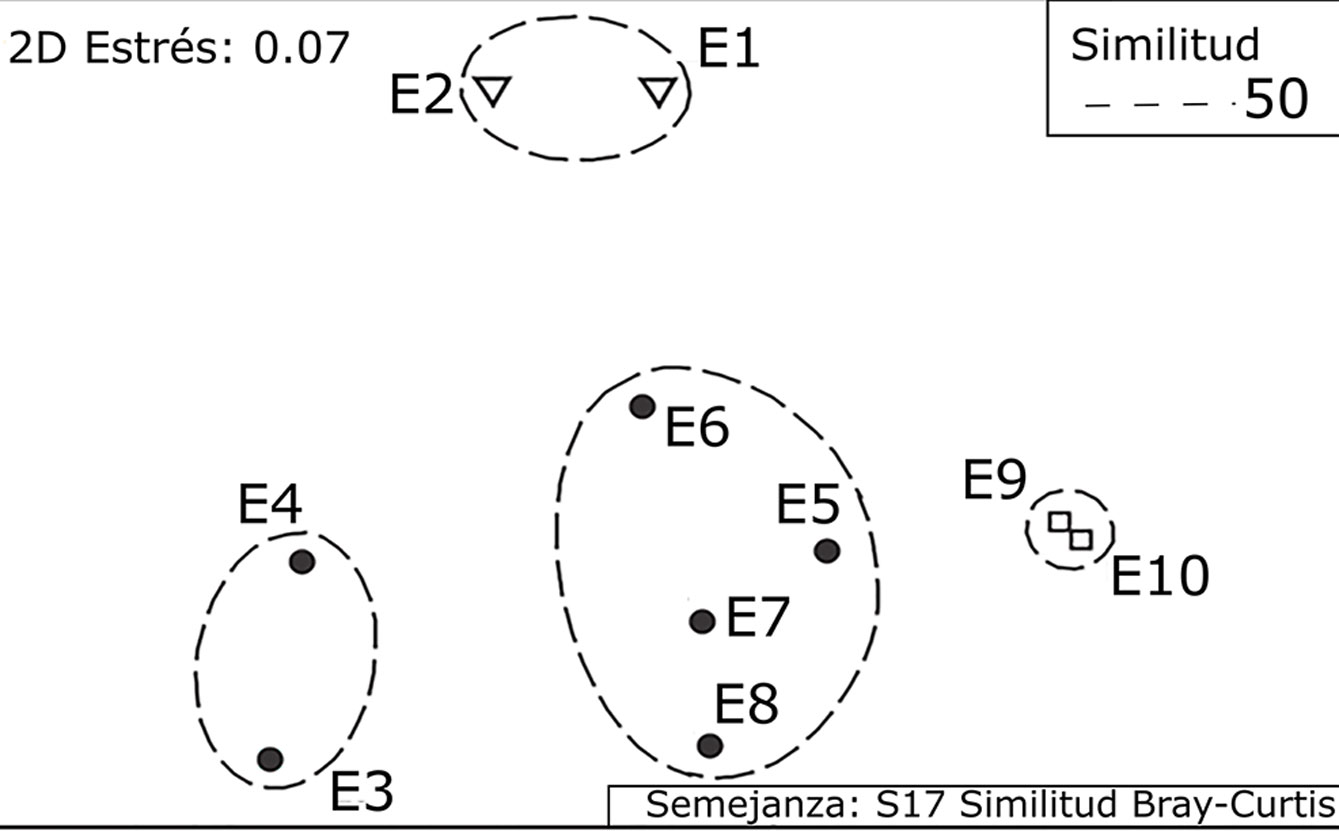
En las 4 zonas de muestreo se determinó la heterogeneidad del ambiente. Esto se realizó por medio de la cobertura relativa (CR) del sustrato bentónico en las 10 estaciones de muestreo, para lo cual se analizaron las fotografías de los cuadrantes por medio de una serie de 13 puntos distribuidos sistemáticamente sobre la fotografía. Se registraron 9 grupos estructurales (arena, esqueleto de coral, sustrato calcáreo, roca, pasto marino, macroalgas, coral vivo, gorgonias y esponjas); los puntos registrados por cada grupo fueron transformados en porcentaje de CR mediante la fórmula CR = (número de puntos por grupo/13 puntos) × 100 (Acosta-González et al., 2013). Para identificar los tipos de hábitat en el área de estudio, se realizó un análisis de agrupamiento empleando el algoritmo jerárquico, utilizando las coberturas de los diferentes grupos estructurales de cada sitio de muestreo (Boesch, 1977; Sneath y Sokal, 1973). La ordenación de los sitios se realizó mediante el análisis “escalamiento multidimensional no métrico” (MDS) (Clarke y Warwick, 2001; Kruskal y Wish, 1978). El MDS se basó en el cálculo del coeficiente de similitud/disimilitud entre muestras; en este caso, el coeficiente de similitud de Bray-Curtis (Bray y Curtis, 1957).
Se calculó el índice de Shannon (H’) como diversidad alfa (α), con logaritmo base 10 (decits/ind); la diversidad beta (β) se calculó con el índice de Whitaker para determinar el recambio de especies (Magurran, 2004). La diversidad gamma (γ) se determinó como el número total de especies para el conjunto de sitios muestreados que integran el área de muestreo (Halffter et al., 2005). El análisis de diversidad de especies se realizó mediante el programa R (v. 3.6.1).
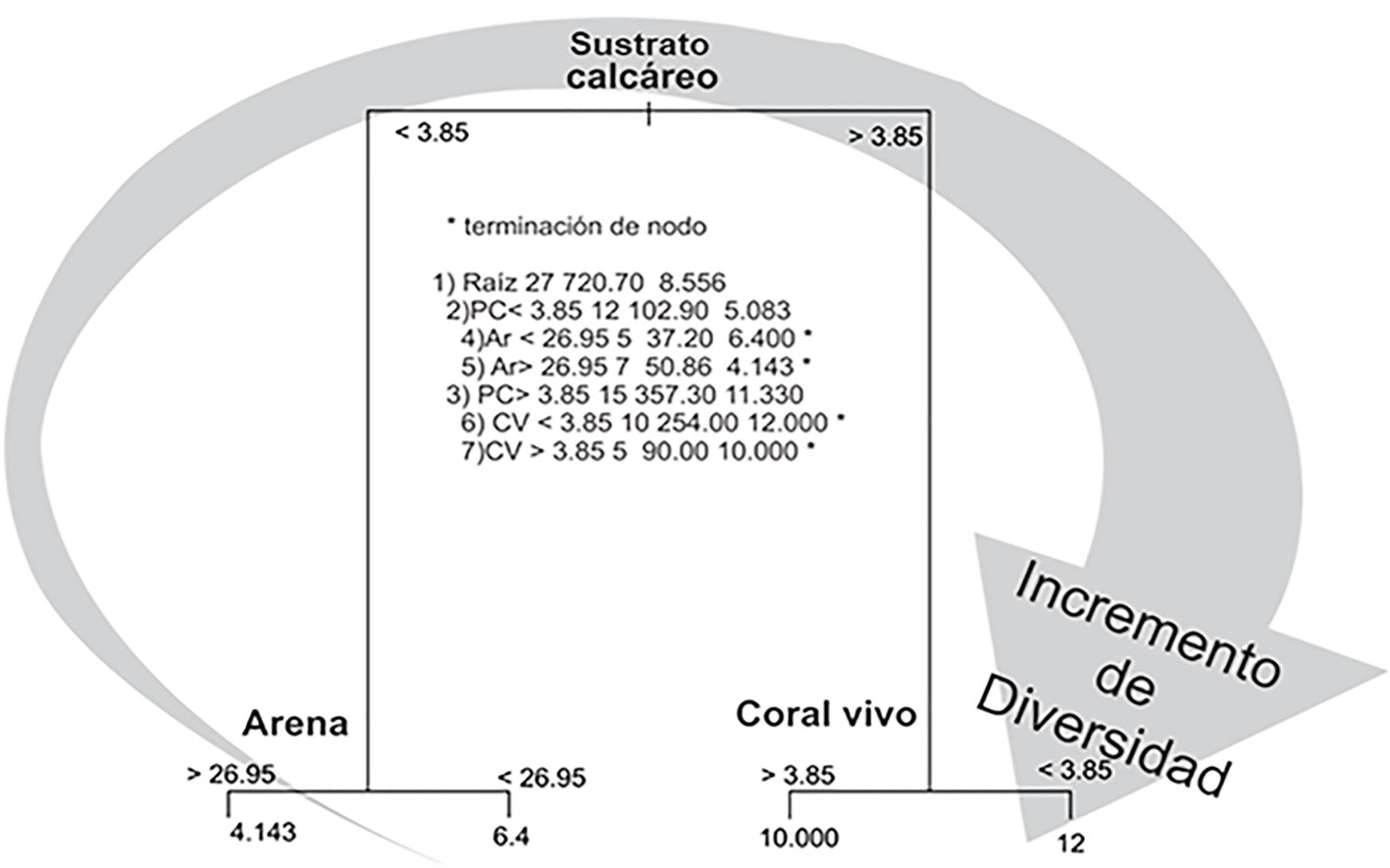
Para conocer las características de los hábitats bentónicos que influyen en la diversidad de macroalgas, se aplicó el análisis de árboles de regresión y clasificación (CART, por sus siglas en inglés) (Breiman et al., 1984; Pittman et al., 2007). Los CART son una técnica no paramétrica de clasificación que genera árboles binarios (los nodos padres se dividen en 2 nodos hijos) mediante particiones iterativas, lo cual es un proceso que se puede repetir tratando, a su vez, a cada nodo hijo como padre. El algoritmo encuentra los valores óptimos de corte entre todas las variables independientes para obtener una serie de divisiones binarias, de forma que la varianza se minimice dentro de cada nodo y se maximice entre nodos. Es posible, sin embargo, que existan variables que no se utilicen. Una vez obtenido el árbol que mejor clasifica los casos, sin límite de complejidad, el algoritmo lo poda o simplifica para evitar el sobreajuste de los datos (Olden y Jackson, 2002; Olden et al., 2008).
Resultados
Se obtuvieron registros de 61 taxones de macroalgas, 56 especies, 4 géneros y un morfotipo (diversidad gama), pertenecientes a 13 órdenes, 22 familias y 39 géneros. De ellas, 29 especies y un morfotipo fueron Rhodophyta (algas rojas), de las cuales 4 se identificaron hasta género, 22 Chlorophyta (algas verdes) y 9 Ochrophyta (algas pardas, Clase Phaeophyceae). Del total de estas especies, se obtuvieron 17 registros nuevos para el PNAX y 1 para Quintana Roo. Del total de la diversidad, 72.1% fue compartido entre el golfo de México, el Caribe mexicano (CMX) y el PNAX. El 21.3% se compartió entre el CMX y el PNAX, y el porcentaje restante (6.56%) correspondió a ejemplares que solo se identificaron hasta género (tabla 1).
El esfuerzo de muestreo fue de 94.6% de la riqueza de especies estimada para las cuatro zonas. El valor máximo esperado de riqueza fue de 69 especies y, de acuerdo con la prueba no paramétrica de Chao2, no hubo diferencias significativas entre lo observado y lo esperado (χ2= 6.3, gl = 9, p = 0.70) (fig. 2).
Con base en la cobertura relativa (%) de los 9 grupos estructurales, se diferenciaron las zonas u hábitats arrecifales: canal = C (sitios E1 y E2), laguna arrecifal 1 = LA1 (sitios E3 y E4), laguna arrecifal 2 = LA2 (sitios E5, E6, E7 y E8) y frente arrecifal = FA (sitios E9 y E10). El análisis MDS presentó un valor de estrés de 0.07 (fig. 3), indicando que 2 dimensiones fueron suficientes para una buena ordenación. En la zona C dominó la arena, en LA1 dominó el pasto marino. A proximidad de la cresta arrecifal, los grupos estructurales cambian y por ende el paisaje, dominando el sustrato calcáreo, pasto y macroalgas en LA2. En la zona FA también dominaron macroalgas, sustrato calcáreo y gorgonias. El ambiente bentónico fue más heterogéneo en LA2, siendo esta la zona más diversa en macroalgas, con 49 registros.
Se registraron roca, esqueleto de coral y arena como clases de sustrato abiótico y 9 especies de algas verdes, 6 pardas y 3 rojas como clases de sustrato biótico. Se reconoció que 23 especies crecen fijas a sustratos abióticos (esqueleto de coral, arena y roca), entre éstas se encuentran 15 especies de algas verdes, todas pertenecientes a las familias Halimedaceae, Udoteaceae y Anadyomenaceae, 5 especies de algas rojas y 3 especies de algas pardas (tabla 1). En las zonas LA2 y FA se obtuvieron las mayores frecuencias de estos sustratos. En cuanto a macroalgas epífitas, se encontraron 17 especies que solo crecen sobre otras macroalgas (sustrato biótico), de las cuales 14 registros fueron rojas (incluido el morfotipo), 2 verdes y 1 parda. El resto de las especies (21) crecen tanto en sustrato abiótico como biótico. La zona de FA obtuvo una mayor frecuencia de macroalgas epífitas y de especies que crecen en ambas clases de sustrato (tabla 1).
En las zonas C y LA1 se registraron sustratos bióticos del género Halimeda. En la zona C se registraron Halimeda copiosa Goreau y E.A.Graham, 1967, Halimeda monile (J.Ellis y Solander) J.V. Lamouroux, 1816, Halimeda opuntia (Linnaeus) J.V. Lamouroux, 1816, y en la zona LA1 se registraron Halimeda monile y Halimeda incrassata (J.Ellis) J.V. Lamouroux, 1816. En ambas zonas se registraron 2 tipos de sustrato abiótico (arena y roca). En la zona LA2 se registraron 12 sustratos, 3 abióticos y 9 bióticos. De las 9 clases de sustrato biótico, 4 fueron del género Halimeda, una Udotea y 4 algas pardas (tabla 1). En la zona FA se registraron 12 sustratos, 1 abiótico (esqueleto de coral) y 11 bióticos. De los sustratos bióticos, 5 fueron algas verdes (Halimeda [3 spp.], Udotea y Valonia), 3 algas pardas (Dictyopteris [1 sp.] y Dictyota [2 spp.]) y 3 rojas (Amphiroa, Ceratodictyon y Yuzurua). En este hábitat, el esqueleto de coral fue el sustrato abiótico preferido por 30 especies de macroalgas (tabla 1).
La Chlorophyta Dictyosphaeria ocellata (M. Howe) Olsen-Sotojkovich, 1985 y la Rhodophyta Jania capillacea Harvey, 1853 se registraron en las 4 zonas arrecifales, y tuvieron preferencia de sustrato por el género Halimeda (tabla 1). La especie Yuzurua poiteaui (J.V. Lamouroux) Martin-Lescanne, 2010 se registró en 3 de las zonas arrecifales (canal, LA2 y FA) y está relacionada con 2 sustratos abióticos y 5 bióticos. Amphiroa beauvoisii J.V. Lamouroux, 1816 se registró en 2 zonas (LA2 y FA) y se relacionó con 6 sustratos bióticos (principalmente del género Halimeda) y 1 sustrato abiótico (esqueleto de coral). En este estudio se evidenció que las algas verdes (género Halimeda) y pardas (género Dictyota) son más propensas a ser sustrato para otras macroalgas, principalmente para las rojas. Solo 3 especies de algas rojas (Amphiroa tribulus (J.Ellis y Solander) J.V. Lamouroux, 1816; Ceratodictyon planicaule (W.R. Taylor) M.J. Wynne, 2011, Yuzurua poiteaui) fueron sustrato para otras algas rojas. Las zonas arrecifales LA2 y FA registraron un mayor número de sustratos de macroalgas (biótico) usados por las epífitas.
La diversidad de Shannon (alfa) permitió determinar que la zona arrecifal más diversa fue LA2 (3.89 decits/ind), seguido de la zona FA (3.71 decits/ind). Las zonas arrecifales C y LA1 registraron una diversidad relativa más baja (2.40 decits/ind).
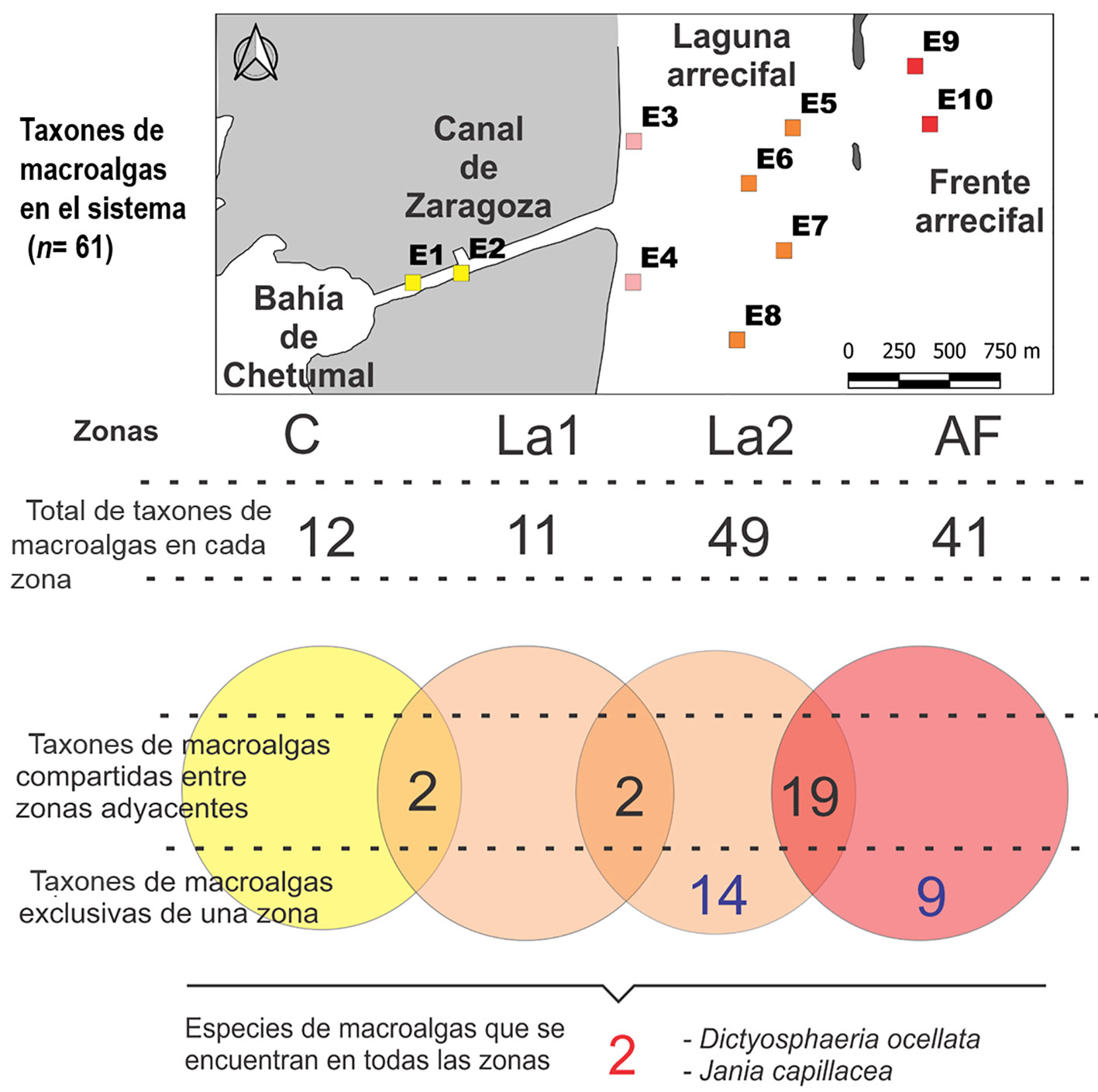
La diversidad β (índice de Whitaker) evidenció que el mayor recambio de especies se produjo entre las zonas arrecifales LA2 y FA (0.31). De los 61 registros, la mayor riqueza de especies se obtuvo en la zona LA2 (49 taxones) y la zona arrecifal FA (41 taxones), compartiendo 19 registros entre ellas. Catorce taxones fueron exclusivas de la zona arrecifal LA2 y 9 de la zona FA (fig. 4).
Se determinó que cuando se presenta un alto porcentaje de arena (> 26.9%), la diversidad de macroalgas es menor y cuando existe un porcentaje de cobertura de coral vivo menor a 3.85%, la cobertura de macroalgas fue mayor (análisis CART). El 56% de los sitios tuvieron valores altos de diversidad (fig. 5).
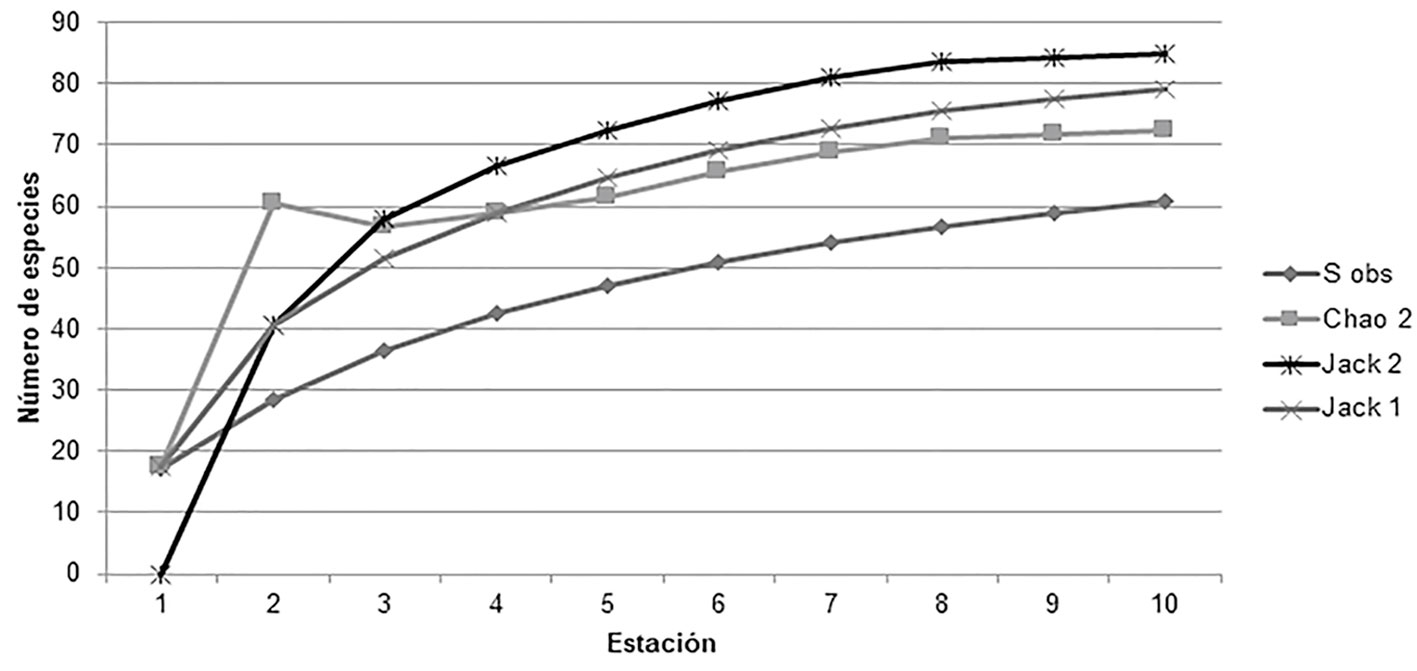
Tabla 1
Composición de especies de macroalgas en el PNAX, por zona (C= canal, LA1= laguna arrecifal 1, LA2= laguna arrecifal 2, FA= frente arrecifal) y relación con el sustrato.
|
Especie |
Registros por región |
C |
LA 1 |
LA2 |
FA |
||
|
Sustrato |
|||||||
|
Chlorophyta |
|||||||
|
Anadyomenaceae |
|||||||
|
Anadyomene stellata (Wulffen) C. Agardh, 1823 |
CMX |
PNAX |
R |
EC |
|||
|
Cladophoraceae |
|||||||
|
Chaetomorpha clavata Kützing, 1847 ** |
CMX |
Ho Ht |
|||||
|
Chaetomorpha aerea (Kützing) Kützing, 1849 |
CMX |
PNAX |
Hi |
EC |
|||
|
Cladophora serícea (Hudson) Kützing, 1843 ** |
GM |
CMX |
EC |
||||
|
Derbesiaceae |
|||||||
|
Derbesia marina (Lyngbye) Solier, 1846 ** |
CMX |
Ht |
Ho Ht |
||||
|
Dichotomosiphonaceae |
|||||||
|
Avrainvillea longicaulis (Kützing) G.Murray y Boodle, 1889 |
GM |
CMX |
PNAX |
A |
EC |
||
|
Halimedaceae |
|||||||
|
Halimeda copiosa Goreau y E.A.Graham, 1967 |
CMX |
PNAX |
A |
A |
|||
|
Halimeda discoidea Decaisne, 1842 |
GM |
CMX |
PNAX |
EC |
|||
|
Halimeda incrassata (J.Ellis) J.V.Lamouroux, 1816 |
GM |
CMX |
PNAX |
A |
EC A |
EC |
|
|
Halimeda monile (J.Ellis y Solander) J.V.Lamouroux, 1816 |
GM |
CMX |
PNAX |
A |
A |
||
|
Halimeda opuntia (Linnaeus) J.V.Lamouroux, 1816 |
GM |
CMX |
PNAX |
A |
R A |
EC |
|
|
Halimeda scabra M.A.Howe, 1905 |
GM |
CMX |
PNAX |
EC |
EC |
||
|
Halimeda tuna (J.Ellis y Solander) J.V.Lamouroux, 1816 |
GM |
CMX |
PNAX |
R EC A |
EC |
||
|
Udoteaceae |
|||||||
|
Udotea dixonii D.S.Littler y Littler, 1990 ** |
GM |
CMX |
EC |
||||
|
Udotea flabellum (J.Ellis y Solander) M.Howe, 1904 |
GM |
CMX |
PNAX |
R |
|||
|
Penicillus capitatus Lamarck, 1813 |
GM |
CMX |
PNAX |
A |
EC A |
EC |
|
|
Rhipocephalus phoenix (J.Ellis y Solander) Kützing, 1843 |
GM |
CMX |
PNAX |
A |
A |
EC |
|
|
Polyphsaeae |
|||||||
|
Acetabularia calyculus J.V.Lamouroux, 1824 ** |
CMX |
EC |
|||||
|
Parvocaulis polyphysoides (P.Crouan y H.Crouan) S.Berger, U.Fettweiss, S.Gleissberg, L.B.Liddle, U.Ritcher, H.Sawitzky y G.C.Zuccarello, 2003** |
CMX |
EC Ht |
|||||
|
Siphonocladaceae |
|||||||
|
Dictyosphaeria cavernosa (Forsskål) Børgesen, 1932 |
CMX |
PNAX |
R Hi |
Ht |
|||
|
Dictyosphaeria ocellata (M.Howe) Olsen-Sotojkovich, 1985 |
CMX |
PNAX |
R Hc Hm |
Hi |
Ho |
Ho Ht |
|
|
Tabla 1. Continúa |
|||||||
|
Especie |
Registros por región |
C |
LA 1 |
LA2 |
FA |
||
|
Sustrato |
|||||||
|
Valoniaceae |
|||||||
|
Valonia utricularis (Roth) C.Agardh, 1823 |
CMX |
PNAX |
R Hc Hm |
Hi Ho Ht |
EC |
||
|
Ochrophyta |
|||||||
|
Sargassaceae |
|||||||
|
Turbinaria turbinata (Linnaeus) Kuntze, 1898 |
GM |
CMX |
PNAX |
R EC A |
EC |
||
|
Dictyotaceae |
|||||||
|
Dictyopteris delicatula J.V.Lamouroux, 1809 |
GM |
CMX |
PNAX |
Ht |
EC |
||
|
Dictyopteris justii J.V.Lamouroux, 1809 |
GM |
CMX |
PNAX |
EC |
|||
|
Dictyota menstrualis (Hoyt) Schnetter, Hörning y Weber-Peukert, 1987 |
GM |
CMX |
PNAX |
R Ho Ht Lv |
At Ho Ht Ud |
||
|
Dictyota mertensii (C.Martius) Kützing, 1859 |
GM |
CMX |
PNAX |
Ht |
|||
|
Dictyota pinnatifida Kützing, 1859 |
GM |
CMX |
PNAX |
R Ht |
EC |
||
|
Lobophora variegata (J.V.Lamouroux) Womersley ex E.C.Oliveira, 1977 |
GM |
CMX |
PNAX |
EC Hi Hs Ht |
EC |
||
|
Padina sanctae-crucis Børgesen, 1914 |
GM |
CMX |
PNAX |
Hi |
EC A Ht |
||
|
Stypopodium zonale (J.V.Lamouroux) Papemfuss, 1940 |
GM |
CMX |
PNAX |
A |
|||
|
Rhodophyta |
|||||||
|
Ceramiaceae |
|||||||
|
Centroceras gasparrinii (Meneghini) Kützing 1849 *, ** |
GM |
EC Dmn Ht Lv |
Ud |
||||
|
Ceramium brevizonatum H.E.Petersen, 1918 ** |
GM |
CMX |
EC Dmn Ht |
EC Cp |
|||
|
Ceramium cimbricum H.E.Petersen, 1924 |
GM |
CMX |
PNAX |
Lv |
|||
|
Ceramium cimbricum f. flaccidum (H.E.Petersen) G.Furnari y Serio, 1996 |
GM |
CMX |
PNAX |
Lv |
|||
|
Ceramium cruciatum Collins&Hervey, 1917 ** |
GM |
CMX |
EC Lv |
Dp |
|||
|
Gayliella flaccida (Harvey ex Kützing) T.O.Cho y L.J. McIvor 2008 |
GM |
CMX |
PNAX |
Dmn |
|||
|
Champiaceae |
|||||||
|
Champia parvula (C.Agardh) Harvey, 1853 |
GM |
CMX |
PNAX |
EC |
|||
|
Corallinaceae |
|||||||
|
Amphiroa beauvoisii J.V.Lamouroux, 1816 ** |
GM |
CMX |
EC Hi Ho Ht Lv |
EC Dmr Ht |
|||
|
Amphiroa rigida J.V.Lamouroux, 1816 |
GM |
CMX |
PNAX |
Hs |
|||
|
Amphiroa tribulus (J.Ellis y Solander) J.V.Lamouroux, 1816 |
CMX |
PNAX |
EC |
||||
|
Hydrolithon sp. |
EC Ht |
EC |
|||||
|
Jania capillacea Harvey, 1853 |
GM |
CMX |
PNAX |
Hc |
Hm |
Ho Ht Lv |
Hs |
|
Jania pumila J.V.Lamouroux, 1816 ** |
GM |
CMX |
Ho |
Ho |
|||
|
Tabla 1. Continúa |
|||||||
|
Especie |
Registros por región |
C |
LA 1 |
LA2 |
FA |
||
|
Sustrato |
|||||||
|
Porolithon antillarum (Foslie y M. Howe) Foslie y M Howe 1909 ** |
GM |
CMX |
EC |
||||
|
Titanoderma sp. |
Dmr Hi Ho Ht Lv Tt |
Dp Dj Ho Ht |
|||||
|
Cystocloniaceae |
|||||||
|
Hypnea spinella (C.Agardh) Kützing, 1847 |
GM |
CMX |
PNAX |
Hc |
Ht |
||
|
Galaxauraceae |
|||||||
|
Dichotomaria obtusata (J.Ellis y Solander) Lamarck, 1816 ** |
GM |
CMX |
Hc |
Ht |
EC |
||
|
Gracilariaceae |
|||||||
|
Gracilaria cylindrica Børgesen, 1920 ** |
GM |
CMX |
Ht |
||||
|
Hapalidiaceae |
|||||||
|
Mesophyllum sp. |
Hi Hm |
EC Hi Ho Ht |
EC At |
||||
|
Lomentariaceae |
|||||||
|
Ceratodictyon planicaule (W.R.Taylor) M.J.Wynne, 2011 ** |
GM |
CMX |
EC Ho Ht |
||||
|
Peyssonneliaceae |
|||||||
|
Peyssonnelia sp. |
EC |
EC |
|||||
|
Rhodomelaceae |
|||||||
|
Herposiphonia bipinnata M.Howe, 1920 |
CMX |
PNAX |
Hc |
EC Dmn Uf |
EC |
||
|
Herposiphonia secunda (C.Agardh) Ambronn, 1880 |
GM |
CMX |
PNAX |
Dmn Lv |
Vu |
||
|
Herposiphonia tenella (C.Agardh) Ambronn, 1880 |
GM |
CMX |
PNAX |
Dmr Dmn Lv |
|||
|
Laurencia intricata J.V.Lamouroux, 1813 |
GM |
CMX |
PNAX |
Hc |
Ht |
Ho Ht |
|
|
Laurencia filiformis (C.Agardh) Montagne, 1845 ** |
CMX |
Ht |
|||||
|
Melanothamnus gorgoniae (Harvey) Diaz-Tapia y Maggs 2017 ** |
GM |
CMX |
Dmn |
||||
|
Wilsonosiphonia howei (Hollenberg) D.Bustamante, Won y T.O.Cho 2017 |
GM |
CMX |
PNAX |
R Ht Lv |
Yp |
||
|
Yuzurua poiteaui (J.V.Lamouroux) Martin-Lescanne, 2010 |
GM |
CMX |
PNAX |
Hc |
R EC Hi Ho Ht |
EC Ho Ht Ud |
|
|
Wrangeliaceae |
|||||||
|
Griffithsia globulifera Harvey ex Kützing, 1862 |
GM |
CMX |
PNAX |
EC |
|||
|
Total por zona |
44 |
56 |
40 |
12 |
11 |
49 |
41 |
*Nuevo registro para el Caribe mexicano; **Nuevo registro para PNAX. Registro por región: GM = golfo de México, CMX = Caribe mexicano, PNAX = Parque Nacional Arrecifes de Xcalak. Sustrato abiótico: R = roca, EC = esqueleto de coral, A = arena. Sustrato biótico: Hc = Halimeda copiosa, Hi = Halimeda incrassata, Hm = Halimeda monile, Ho = Halimeda opuntia, Hs = Halimeda scabra, Ht = Halimeda tuna, Ud = Udotea dixonii, Uf = Udotea flabellum, Vu = Valonia utricularis, Dj = Dictyopteris justii, Dmn = Dictyota menstrualis, Dmr = Dictyota mertensi, Dp = Dictyota pinnatifida, Lv = Lobophora variegata, Tt = Turbinaria turbinata, At = Amphiroa tribulus, Cp = Ceratodictyon planicaule, Yp = Yuzurua poiteaui.
Discusión
El primer estudio realizado en el área del PNAX fue realizado por Huerta-Múzquiz y Garza-Barrientos (1980), en el que reportaron 108 algas para Xcalak (53 rojas, 17 pardas y 38 verdes). De ese número, 24 especies, 8 rojas, 5 pardas y 11 verdes, son comunes a las reportadas en este estudio. Para el área de la Poza del PNAX, ubicada al norte del canal de Zaragoza (~ 4.5 km), la Conanp (2004) reportó 56 especies de macroalgas, de las cuales 38 especies fueron registradas en este estudio. En conjunto, los estudios de Huerta-Muzquiz y Garza-Barrientos (1980) y de la Conanp (2004), comparten con el presente estudio un total de 40 especies de algas, contribuyendo con 17 registros nuevos, 11 rojas y 6 verdes. Para el Caribe mexicano se tuvo un registro nuevo de alga roja, Centroceras gasparrinii (Meneghini) Kützing, la cual está reportada para el golfo de México y para la localidad de la bahía de Akumal en un estudio no publicado (García-García et al., 2020).
Cetz Navarro (2008), quien recolectó algas en la parte basal del tejido vivo de corales (Acropora palmata y Diploria strigosa) en la cresta arrecifal de Xcalak, reportó 4 nuevos registros para el área (no se comparten especies con este estudio). Del total de especies registradas para Quintana Roo, las reportadas aquí representan 10.4% de ellas. Por grupo, Ochrophyta representó 13.2%, Chlorophyta 12.9% y Rhodophyta 8.6% del total de especies bentónicas (Cetz-Navarro et al., 2008; García-García et al., 2020).
Las algas rojas estuvieron presentes en las 4 zonas del arrecife. Como un referente sobre este grupo de algas, en Cuba (mar Caribe) se han registrado 53 especies (Diez-García et al., 2013). En aguas mexicanas, en Isla Mujeres, se han registrado 152 especies (Mendoza-González y Mateo-Cid, 1992; Quan-Young et al., 2006) y en Cozumel 118 (Mateo-Cid et al., 2006). Sin embargo, en el plan de manejo del PNAX realizado por Conanp (2004), se reporta que las macroalgas verdes (40 spp.) constituyen el grupo dominante. Como aún no existen inventarios exhaustivos, lo anterior debe tomarse con cautela, ya que los datos enunciados pueden estar influenciados por la temporada climática o el esfuerzo diferencial de muestreo entre zonas de estudio (Briones-Fourzán y Lozano-Álvarez, 2001; Mateo-Cid et al., 2013).
Las familias Halimedaceae y Udoteaceae mostraron afinidad por la arena como sustrato en las zonas arrecifales C y LA1; sin embargo, conforme la profundidad se incrementa en dirección de la zona FA, las especies del género Halimeda crecen sobre esqueleto de coral. Las algas pardas se registraron principalmente sobre esqueleto de coral, roca, arena y sobre el género Halimeda. Mateo-Cid et al. (1996) registraron en el golfo de México, isla Verde, Veracruz, crecimiento de Halimeda en arena. En las costas de Brasil, se encontró que hay praderas de Halimeda incrassata que crecen en depósitos de arena (de Macêdo-Carneiro y de Morais, 2016); en el presente trabajo se registró que crecen sobre arena y esqueleto de coral. Los sustratos con superficie irregular como esqueleto de coral y roca favorecen el asentamiento de macroalgas. En aguas someras y con arena, el crecimiento de Halimeda y de Udotea se ve favorecido (González-Gándara et al., 2007), lo que fue registrado en el presente estudio. Estas macroalgas se caracterizan por ser cenocíticas, con estructura de fijación rizoidal filamentosa de forma masiva y compacta, que se adhiere a sustratos arenosos y, ocasionalmente, rocosos (Aguilar-Rosas et al., 2001).
La composición de especies de macroalgas en las 4 zonas arrecifales, sugiere que su presencia y distribución están determinadas por factores ambientales como el sustrato biótico y abiótico. Las especies epífitas de macroalgas registradas en este estudio (38), constituyen un número menor al publicado por otros trabajos en la misma área. Diez et al. (2013) reportaron en Cuba 102 especies de macroalgas epífitas y en el Caribe (Isla Mujeres) 96 especies (Quan-Young et al., 2006). Sin embargo, es mayor comparado con el trabajo de Mateo-Cid et al. (1996) en el golfo de México (isla Verde, Veracruz) en donde se registraron 29 macroalgas epífitas, la mayoría pertenecientes a algas rojas. Un resultado análogo se presentó en este estudio.
En la zona C se observó que las algas rojas se encontraron adheridas a Halimeda copiosa y en la zona LA2 se registraron en 4 sustratos como H. tuna, H. opuntia, Lobophora variegata y Dictyota menstrualis. En el estudio de Quan-Young et al. (2006) se registró que las rodofitas tienen preferencia por estas 2 últimas especies de Ochrophyta. El epifitismo en macroalgas puede tener beneficios para ambas partes; por ejemplo, participa en la red trófica, constituyen refugio para especies herbívoras o en etapa reproductiva de invertebrados y peces (Álvarez-Álvarez et al., 2020). Las epífitas funcionan como un obstáculo para el movimiento de las masas de agua, las cuales reciben el impacto del flujo reduciendo el riesgo de que el hospedero se desprenda de su sustrato (Anderson y Martone, 2014). La mayoría de las epífitas se encontraron creciendo sobre el talo de las macroalgas (sustrato), lo que puede estar ayudando que estas epífitas no se desprendan cuando las condiciones dinámicas cambian debido a eventos ciclónicos en las diferentes temporadas climáticas del año.
Mateo-Cid et al. (1996) mencionan que en temporada de secas (marzo-junio) encontraron el mayor número de macroalgas epífitas y que puede deberse a que las poblaciones de macroalgas, en esa temporada, se encontraban en senescencia, y por lo tanto, más susceptibles a ser colonizadas. Por otro lado, Mateo-Cid et al. (2006) registraron 118 especies de las cuales solo 4 de ellas (3%) estuvieron presentes durante todo el año, de lo que se deduce que el número y composición de macroalgas epífitas varía sobre una base estacional.
Las especies de Chlorophyta en aguas someras (zonas C y LA1) se registraron en arena y conforme la profundidad fue mayor (zonas LA2 y FA), en esqueleto de coral. Ochrophyta y Rhodophyta se presentaron en las zonas arrecifales LA2 y FA, creciendo tanto sobre sustrato abiótico como biótico. Las macroalgas epífitas mostraron afinidad por las macroalgas como sustrato (familias Halimedaceae y Dictyotaceae). Se observó una relación directa entre la heterogeneidad del sustrato y el número de especies de macroalgas presentes, así como con la presencia de macroalgas epífitas; sobre la base de esta característica del sustrato, la zona arrecifal LA2 fue el ambiente más propicio para el establecimiento de macroalgas epífitas.
Agradecimientos
Los permisos de muestreo fueron proporcionados por Sagarpa (PPF/DGOPA-179/14) y Conanp (F00.9.DPNAX.-290/14). Al personal de la estación de la Conanp de Xcalak, a Erika Vázquez por la ayuda en la identificación taxonómica de las especies de macroalgas, a Daniel Robledo por la facilitación de material bibliográfico, a Mauricio Rangel Loya por la ayuda en campo, a Marco Antonio May Kú por la revisión del manuscrito, y al Conacyt por la beca de maestría 373816, otorgada a Sandra Gisele Patiño-Espinosa.
Referencias
Acosta-González, G., Rodríguez-Zaragoza, F. A., Hernández-Landa, R. C. y Arias-González, J. E. (2013). Additive diversity partitioning of fish in a Caribbean coral reef undergoing shift transition. Plos One, 8, e65665. https://doi.org/10.1371/journal.pone.0065665
Aguilar-Rosas, L. E., Espinoza-Ávalos, J. y Aguilar-Rosas, R. (2001). Distribución de las especies de la familia Udoteaceae (Bryopsodales, Chlorophyta) de la península de Yucatán, México. Anales de la Escuela Nacional de Ciencias Biológicas, 47, 99–108.
Álvarez-Alvarez, J. E., Quíroz-González, N., Rodríguez-Muñoz, D. L. y Aguilar-Estrada, L. G. (2020). Algas epífitas en Padina durvillei y P. crispata (Dyctiotaceae, Phaeophyceae) en el Pacífico tropical mexicano. Acta Botanica Mexicana, 127, e1594. https://doi.org/10.21829/abm127.2020.1594
Anderson, L. M. y Martone, P. T. (2014). Biomechanical consequences of epiphytism in intertidal macroalgae. The Journal of Experimental Biology, 217, 1167–1174. https://doi.org/10.1242/jeb.088955
Arias-González, J. E. (1998). Trophic models of protected and unprotected coral reef ecosystems in the South of the Mexican Caribbean. Journal of Fish Biology, 53, 236–255. https://doi.org/10.1111/j.1095-8649.1998.tb01030.x
Arias-González, J. E., Fung T., Seymour, R. M., Garza-Pérez, J. R., Acosta-González, G., Bozec, Y. M. et al.(2017). A coral-algal phase shift in Mesoamerica not driven by changes in herbivorous fish abundance. Plos One, 12, e0174855. 359. https://doi.org/10.1371/journal.pone.0174855
Barrios, J., Sant, S., Méndez, E. y Ruiz, L. (2003). Macroalgas asociadas a arrecifes coralinos en el Parque Nacional Mochima, Venezuela. Saber, 15, 28–32.
Boesch, D. F. (1977). Application of numerical classification in ecological investigations of water pollution. Special scientific report 77. Gloucester Point, VA: Virginia Institute of Marine Science, William y Mary. http://dx.doi.org/doi:10.21220/m2-cc12-h671
Bray, R. J. y Curtis, J. T. (1957). An ordenation of the upland forest communities of Southern Wisconsin. Ecological Monograph, 27, 325–349. https://doi.org/10.2307/1942268
Breiman, L., Friedman, R. A., Olshen, R. A. y Stone, C. J. (1984). Classification and regression trees, Second Edition. Pacific Grove, California: Wadsworth.
Briones-Fourzán, P. y Lozano-Álvarez, E. (2001). The importance of Lobophora variegata (Phaeophyta: Dictyotales) as a habitat for small juveniles of Panulirus argus (Decapoda: Palinuridae) in a tropical reef lagoon. Bulletin of Marine Science, 68, 207–219.
Camarena-Luhrs, T. (2003). Ficha informativa de los humedales de Ramsar (FIR), Parque Nacional Arrecifal de Xcalak. Recuperado el 1 junio, 2018 de: https://rsis.ramsar.org/RISapp/files/RISrep/MX1353RIS.pdf
Cetz-Navarro, N. P., Espinoza-Ávalos, J., Sentíes-Granados, A. y Quan-Young, L. I. (2008). Nuevos registros de macroalgas para el Atlántico mexicano y riqueza florística del Caribe mexicano. Hidrobiologica, 18, 11–19.
Clarke, K. R. y Warwick, R. M. (2001). Changes in marine communities: an approach to statistical analysis and interpretation. En PRIMER-E. Recuperado el 21 junio, 2019 de: http://www.vliz.be/imis/imis.php?refid=117939
Colwell, R. K. (2012). EstimateS, version 9. Statistical Estimation of Species Richness and Shared Species from Samples (Software and User’s Guide). Recuperado el 21 junio, 2019 de: http://viceroy.eeb.uconn.edu/estimates/index.html
Colwell, R. K., Chao, A., Gotelli, N. J., Lin, S. Y., Mao, C. X., Chazdon, R. L. et al. (2012). Models and estimators linking individual-based and sample-based rarefaction, extrapolation and comparison of assemblages. Journal of Plant Ecology, 5, 3–21. https://doi.org/10.1093/jpe/rtr044
Conanp (Comisión Nacional de Áreas Nacionales Protegidaas). (2004). Programa de manejo Parque Nacional Arrecifes de Xcalak. México D. F.: Jaras Impresiones S.A. de C.V.
de Macêdo-Carneiro, P. B. y de Morais, J. O. (2016). Carbonate sediment production in the equatorial continental shelf of South America: Quantifying Halimeda incrassata (Chlorophyta) contributions. Journal of South American Earth Sciences, 72, 1–6. https://doi.org/10.1016/j.jsames.2016.07.011
Diez-García, Y. L., Capote, A. J., Suárez-Alfonso, A. M., Gómez-Luna, L. M. y Toyota-Fujii, M. (2013). Distribution of epiphytic macroalgae on the thalli of their hosts in Cuba. Acta Botanica Brasilica, 27, 815–826. https://doi.org/10.1590/S0102-33062013000400022
Dreckmann, K. M. (1998). Clasificación y nomenclatura de las macroalgas marinas bentónicas del Atlántico mexicano. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. México D.F.: Encuadernación Técnica Editorial S. A de C. V.
Dreckmann, K. M., Stout, I. y Sentíes, G. A. (1996). Lista actualizada de las algas marinas bentónicas de Puerto Morelos, Quintana Roo, Caribe Mexicano. Polibotánica, 3, 1–17.
Espinoza-Ávalos, J., Hernández-Arana, H., Álvarez-Legorreta, T., Quan-Young, L., Oliva-Rivera, J., Valdez-Hernández, M. et al. (2009). Vegetación acuática sumergida. En H. Espinoza-Ávalos, J, Islebe y H. Hernández-Arana, (Ed.). El sistema ecológico de la bahía de Chetumal/Corozal: costa occidental del mar Caribe (p. 252). Chetumal, Quintana Roo: El Colegio de la Frontera Sur.
Florez-Leiva, L., Gavio, B., Díaz-Ruiz, M., Camacho, O. y Díaz-Pulido, G. (2010). Recolección y preservación de macroalgas marinas: una guía para estudios ficológicos. Revista Intropica, 5, 97–103.
García-García, A. M. E., Cabrera-Becerril, E., Núñez-Reséndiz, M. L., Dreckmann, K. M. y Sentíes, A. (2020). Actualización taxonómica de las algas rojas (Rhodophyta) marinas bentónicas del Atlántico mexicano. Acta Botanica Mexicana, 127, e1677. https://doi.org/10.21829/abm127.2020.1677
González-Gandara, C., Cruz-Arellano, M., Domínguez-Barradas, C., Serrano-Solis, A. y Basañez-Muñoz, A. J. (2007). Macroalgas asociadas a cuatro hábitats del arrecife Tuxpan, Veracruz, México. Revista UDO Agrícola, 7, 252–257.
Guiry, M. D. y Guiry, M. G. (2020). AlgaeBase. World-Wide Electronic Publication. National University of Ireland, Galway. Recuperado el 7 mayo, 2021 de: https://www.algaebase.org
Halffter, G., Soberón, J., Koleff, P. y Melic, A. (2005). Sobre diversidad biológica: el significado de las diversidades alfa, beta y gamma. Vol. 4. Zaragoza, España: m3m Monografías Tercer Milenio.
Hensley, N. M., Elmasri, O. L., Slaughter, E. I., Kappus, S. y Fong, P. (2013). Two species of Halimeda, a calcifying genus of tropical macroalgae, are robust to epiphytism by cyanobacteria. Aquatic Ecology, 47, 433–440. https://doi.org/10.1007/s10452-013-9456-x
Huerta-Múzquiz, L. y Garza-Barrientos, M. A. (1980). Contribución al conocimiento de la flora marina de la zona sur del litoral de Quintana Roo, México. Anales de la Escuela Nacional de Ciencias Biológicas México, 23, 25–44.
Hughes, T. P. (1994). Catastrophes, phase shifts, and large-scale degradation of a Caribbean coral reef. Science, 265, 1547–1551. https://doi.org/10.1126/science.265.5178.1547
Humann, P. (1993). Reef coral identification Florida, Caribbean, Bahamas including marine plants. Florida, USA: New World publications.
Kruskal, J. B. y Wish, M. (1978). Multidimensional scaling. Sage University Paper series on Quantitative Application in the Social Sciences. Thousand Oaks, CA: Sage Publications Inc. http://dx.doi.org/10.4135/9781412985130
Littler, M. M. y Littler, D. S. (1997). An illustrated marine flora of the Pelican Cays, Belize. Bulletin of the Biological Society of Washington, 9, 1–149.
Littler, D. S. y Littler, M. M. (2000). Caribbean reef plants: an identification guide to the reef plants of the Caribbean, Bahamas, Florida and Gulf of Mexico. Washington D.C.: Offshore Graphics Icorporated.
Littler, D. S., Littler, M. M., Bucher, K. E. y Norris, J. N. (1989). Marine plants of the Caribbean. A field guide from Florida to Brazil. Washington D.C.: Smithsonian Institution Press.
Magurran, A. E. (2004). Measuring biological diversity. Malden, Massachusetts: Blackwell Publishing.
Mateo-Cid, L. E., Mendoza-González, A. C., Ávila-Ortiz, A. G. y Díaz-Martínez, S. D. (2013). Algas marinas bentónicas del litoral de Campeche, México. Acta Botanica Mexicana, 104, 53–92.
Mateo-Cid, L. E., Mendoza-González, A. C. y Galicia-Garcia, C. (1996). Algas marinas de Isla Verde, Veracruz, México. Acta Botanica Mexicana, 36, 59–75. https://doi.org/https://doi.org/10.21829/abm36.1996.762
Mateo-Cid, L. E., Mendoza-González, A. C. y Searles, R. B. (2006). A checklist and seasonal account of the deepwater Rhodophyta around Cozumel Island on the Caribbean coast of Mexico. Caribbean Journal of Science, 42, 39–52.
Mateo-Cid, L. E., Sánchez-Rodríguez, I. y Rodríguez-Montesinos, E. (2014). Algas epífitas de Sargassum sinicola Setchell y Gardner (Fucales, Phaeophyceae), en las islas Magdalena y Margarita en Baja California Sur, México. Revista de Investigaciones Marinas, 34, 31–44.
Mendoza-González, A. C. y Mateo-Cid, L. E. (1992). Algas Marinas Bentónicas de Isla Mujeres, Quintana Roo, México. Acta Botanica Mexicana, 19, 37–61. https://doi.org/10.21829/abm19.1992.646
Núñez-Lara, E., González-Salas, C., Ruiz-Zárate, M. A., Hernández-Landa, R. y Arias-González, J. E. (2003). Condition of coral reef ecosystems in central-southern Quintana Roo (Part 2: Reef fish communities). Atoll Research Bulletin, 496, 338–359. https://doi.org/10.5479/si.00775630.496.338
Olden, J. D. y Jackson, D. A. (2002). A comparison of statistical approaches for modelling fish species distributions. Freshwater Biology, 47, 1976–1995. https://doi.org/10.1046/j.1365-2427.2002.00945.x
Olden, J. D., Poff, N. L. y Bestgen, K. R. (2008). Trait synergisms and the rarity, extirpation, and extinction risk of desert fishes. Ecology, 89, 847–856. https://doi.org/10.1890/06-1864.1
Ortega, M. M., Godínez, J. L. y Garduño-Solorzano, G. (2001). Catalogo de algas bénticas de las costas mexicanas del Golfo de México y Mar Caribe. Cuadernos 34. México D.F.: Instituto de Biología, Universidad Nacional Autónoma de México.
Ortegón-Aznar, I., González-Vázquez, D., Tuz-Sulub, A. y Aguilar-Perera, A. (2013). Cambio de fase alga-coral en el Parque Nacional Arrecife Alacranes, México: una aproximación por grupos funcionales. Proceedings of the 65th Gulf and Caribbean Fisheries Institute, November 5-9, Santa Marta, Colombia.
Ortuño-Aguirre, C. y Riosmena-Rodríguez, R. (2007). Dinámica en el epifitismo de Padina concrescens (Dictyotales, Phaeophyta) en el suroeste de la Península de Baja California, México. Ciencias Marinas, 33, 311-317. https://doi.org/10.7773/cm.v33i3.1069
Pellizzari, F. M., Bernardi, J., Silva, E. M., Silva, M. C. y Yokoya, N. S. (2014). Benthic marine algae from the insular areas of Paraná, Brazil: new database to support the conservation of marine ecosystems. Biota Neotropica, 14, e20130011. https://doi.org/10.1590/1676-060320140615183049
Pittman, S. J., Christensen, J. D., Caldow, C., Menza, C. y Monaco, M. E. (2007). Predictive mapping of fish species richness across shallow-water seascapes in the Caribbean. Ecological Modelling, 204, 9–21. https://doi.org/10.1016/j.ecolmodel.2006.12.017
Quan-Young, L. I., Díaz-Martín, M. A. y Espinoza-Ávalos, J. (2006). Algas epífitas de Bajo Pepito, Isla Mujeres, Quintana Roo, México. Revista de Biología Tropical, 54, 317–328.
Ramírez, R. A., Blanco, P. R. y Okolodkov, Y. D. (2011). Diversidad de especies de algas epífitas marinas. En A. A. Cruz, E. M. Soto y H. P. Rodríguez (Eds.), La biodiversidad en Veracruz: estudio de estado (pp. 71–76). Veracruz, México: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/ Gobierno del Estado de Veracruz/ Universidad Veracruzana/ Instituto Nacional de Ecología, A.C.
Riosmena-Rodríguez, G. R., Hinojosa-Arango, J. M., López-Vivas, J. M., León-Cisneros, K. y Holguin-Acosta, E. (2005). Caracterización espacial y biogeográfica de las asociaciones de macroalgas de Bahía del Rincón, Baja California Sur, México. Revista de Biología Tropical, 53, 97–109.
Romero, M. R. (2010). La creación del estado treinta mexicano como consecuencia del proceso de fragmentacion geopolitica de la península de Yucatán: 1862-1974. Ketzalcalli, 2, 63–82.
Sahayaraj, K., Rajesh, S., Asha, A., Rathi, J. M. y Raja, P. (2014). Distribution and diversity assessment of the marine macroalgae at four southern districts of Tamil Nadu, India. Indian Journal of Geo-Marine Science, 43, 607–617.
Sánchez-Molina, I., González-Ceballos, J., Zetina-Moguel, C. y Casanova-Cetz, R. (2007). Análisis de la biodiversidad de algas marinas situadas entre Uaymitún y Chuburná, Yucatán. Ingeniería, 11, 43–51.
Santos, R. G., Martins, A. S., Farias, J. N., Horta, P. A., Pinheiro, H. T., Torezani, E. et al. (2011). Coastal habitat degradation and green sea turtle diets in Southeastern Brazil. Marine Pollution Bulletin, 62, 1297–1302. https://doi.org/10.1016/j.marpolbul.2011.03.004
Sneath, P. H. A. y Sokal, R. R. (1973). Numerical Taxonomy: the principles and practice of numerical classification. En A Series of books in biology. San Francisco, California: Freeman and Co.
Soberón, M. y Llorente, B. (1993). The use of species accumulation functions for the prediction of species richness. Conservation Biology, 7, 480–488. https://doi.org/10.1046/j.1523-1739.1993.07030480.x
Wynne, M. J. (2017). A checklist of benthic marine algae of the tropical and subtropical Western Atlantic: fourth revision. Nova Hedwigia Beiheft, 145, 7–202.




