Ariana Romero-Mata a, *, Marcela Pérez-Escobedo b y Zenón Cano-Santana a
a Universidad Nacional Autónoma de México, Facultad de Ciencias, Departamento de Ecología y Recursos Naturales, Laboratorio de Interacciones y Procesos Ecológicos, Circuito Exterior s/n, Ciudad Universitaria, Coyoacán, 04510 Ciudad de México, México
b Universidad Nacional Autónoma de México, Secretaría Ejecutiva de la Reserva Ecológica del Pedregal de San Ángel, Circuito de la Investigación Científica, Edificio de Programas Universitarios, Ciudad Universitaria, Coyoacán, 04510 Ciudad de México, México
*Autor para correspondencia: arianaromero@ciencias.unam.mx (A. Romero-Mata)
Recibido: 27 septiembre 2020; aceptado: 22 agosto 2021
Resumen
Se compararon 5 atributos poblacionales del grillo arborícola Oecanthus fultoni (estructura, densidad, abundancia, proporción sexual y densidad de machos) en 2 localidades del centro de México con matorral xerófilo. Se contaron directamente los ejemplares posados sobre las plantas y los machos adultos mediante detección auditiva. En Zapotitlán Salinas, Puebla se muestrearon los grillos en el día y en el Pedregal de San Ángel, Ciudad de México en la noche. La especie estuvo presente durante todo el año en ambos sitios y registró 5 estadios ninfales. La población de Zapotitlán fue multivoltina y la del Pedregal univoltina. La densidad promedio de grillos fue más alta en el Pedregal (652.0 ± 0.2 ind./ha) que en Zapotitlán (50.4 ± 0.2 ind./ha); la proporción sexual fue 1 macho:1.2 hembras en Zapotitlán, mientras que en el Pedregal fue de 6.1:1. En Zapotitlán se registró una densidad de machos significativamente menor (83.41 ± 5.3 ind./ha) en comparación con la del Pedregal (153.75 ± 9.1 ind./ha); en ambas localidades la densidad de machos estuvo correlacionada negativamente con los valores de precipitación acumulada mensual. Nuestros resultados resaltan la importancia de la estacionalidad en las variaciones poblacionales de los grillos.
Palabras clave: Canto; Densidad; Proporción sexual; Reserva Ecológica del Pedregal de San Ángel; Zapotitlán Salinas
© 2022 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Spatio temporal variations of two Oecanthus fultoni (Orthoptera: Gryllidae) populations in Central Mexico
Abstract
We compared five population attributes of tree cricket Oecanthus fultoni Walker, 1962 (structure, density, abundance, sex ratio, and male density) in two localities of Central Mexico, with contrasting xerophytic scrub. The specimens were counted directly on plants and the adult males by aural detection. In Zapotitlán Salinas, Puebla the crickets were sampled in hours of the day, and in the Pedregal de San Ángel, Mexico City they were sampled in hours of the night. The species was present in both sites throughout the year and it recorded five nymphal instars; but the population of Zapotitlán was multivoltine and that of Pedregal was univoltine. The mean crickets density was higher in the Pedregal (652.0 ± 0.2 ind./ha) than in Zapotitlán 50.4 ± 0.2 ind./ha); sex ratio was 1:1.2 (males: females) in Zapotitlán; while in Pedregal it was 6.1:1. We recorded a significantly lower density of males in Zapotitlán (83.41 ± 5.3 ind./ha) than Pedregal (153.75 ± 9.1 ind./ha); in both localities males density showed negative and significant correlation with the monthly precipitation values. Our results support the importance of seasonality on the tree cricket population responses.
Keywords: Chirp; Density; Sex ratio; Pedregal de San Ángel Ecological Reserve; Zapotitlán Salinas
© 2022 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
La estructura de la población es una propiedad emergente que hace referencia a la clasificación de los individuos de una especie con base en una variable específica, como puede ser su tamaño, su edad o su sexo (Kingsolver, 1983). En el caso de las poblaciones de insectos, estas 2 últimas variables cobran importancia para describir la estructura demográfica de sus poblaciones, pues consideran la variación en el número de individuos reproductivos (tamaño efectivo) y la proporción sexual (Hewitt y Bultin, 1997; Schowalter, 2006). En el caso específico de los ortópteros, la estructura poblacional y su variación numérica temporal están determinadas por el voltinismo de cada especie, por las condiciones ambientales, la disponibilidad y el uso de los recursos de la localidad; así como por la densidad de los individuos y su patrón de distribución espacio-temporal (Brown, 1978). Por ejemplo, en ambientes subtropicales los grillos arborícolas (Gryllidae: Oecanthinae) son depredadores generalistas que se alimentan de las partes suaves de las plantas, así como de otros artrópodos, entre los que destacan: áfidos, cóccidos, lepidópteros, himenópteros y huevos de arañas (Essig, 1958; Fulton, 1915; Hanks y Denno, 1993; Willey y Adler, 1989), y cuando están presentes en grandes cantidades en áreas de cultivos, pueden generar daños que se hacen patentes cuando las hembras ovipositan en los tallos de las plantas (Costea et al., 2003; Demchack, 2002; Fontes et al., 1994; Fulton, 1915, 1925).
Hay algunos estudios sobre poblaciones de grillos arborícolas. Alexander (1968) describió el ciclo de vida y concluyó que el multivoltinismo es una respuesta condicionada a los hábitats tropicales con escaso recambio estacional. Por su parte, Wiegert et al. (1967) registraron 98 individuos de Oecanthus sp. en una parcela de 200 m2 de Conyza (ex Erigeron) canadensis (Asteraceae) en Carolina del Sur y 96 grillos en una parcela con la misma superficie, dominada con Heterotheca subaxillaris (Asteraceae) en la Reserva Savannah River Plant, Georgia. En esta misma tónica, Shure (1973), durante 3 meses de muestreo en el bosque Hutchenson Memorial en Nueva Jersey, encontró 28 individuos de Oecanthus sp. en una parcela de 1.21 ha dominada por Ambrosia artemisiifolia (Asteraceae) y Raphanus raphanistrum (Brassicaceae). Alexander e Hilliard (1969) hicieron un muestreo altitudinal durante 3 años en las Rocky Mountains en el norte de Colorado y registraron 678 especímenes de Oecanthus nigricornis quadripunctatus entre 1,661.2 y 2,042.2 m snm, donde la vegetación más baja era un pastizal y la más alta una pradera abierta con Pinus ponderosa y Pseudotsuga menziesii (Pinaceae). Otro ejemplo se registró en Hog Island, Virginia, donde Johnson (1996) estimó la densidad de Oecanthus fultoni sobre Myrica cerifera (Myricaceae) y encontró densidades de 0.3 a 8.6 ind./m2 en un matorral en desarrollo; mientras que en un borde con vegetación transicional, la densidad de estos insectos fue de 0.4 a 3.7 ind./m2. Este autor registró las densidades más altas en junio y julio, y las más bajas en agosto. Por otro lado, en Eslovaquia, la densidad poblacional de O. pellucens varió entre 0 a 4.25 ind./m2 en las asociaciones vegetales Dauco–Crepidetum rhoeadifoliae y Tanaceto–Artemisietum vulga-
ris (Fedor, 2001).
A pesar de su gran importancia en los ecosistemas terrestres (como herbívoros, depredadores y presas), los grillos arborícolas en México han sido poco estudiados en cuanto su estructura demográfica, densidad y distribución espacio-temporal. Considerando el vacío teórico que representan los estudios poblacionales de grillos arborícolas, el objetivo principal de este estudio fue conocer y comparar la estructura poblacional por edades, el patrón temporal de abundancia, la proporción sexual y la densidad de machos de Oecanthus fultoni Walker, 1962 en 2 matorrales xerófilos del centro de México.
Materiales y métodos
Oecanthus fultoni Walker, 1962 (Gryllidae, Oecanthinae) es un grillo arborícola cuya coloración corporal es verde pálida con tonalidades anaranjadas en la parte superior de la cabeza; presenta marcas en los 2 primeros segmentos antenales basales que pueden ser redondas u ovaladas y la marca del primer segmento es más grande con relación a la del segundo (Walker, 1962). En estado ninfal se alimenta de flores, hojas y frutos jóvenes, en tanto que en estado adulto se alimenta de áfidos y orugas (Knopf, 1984). La especie se distribuye desde Canadá hasta Centroamérica (Essig, 1958). En los bosques boreales de Canadá y EUA presenta un comportamiento univoltino con 5 estadios ninfales, mientras que en el sur es multivoltina, por lo que sus poblaciones registran traslape generacional (Alexander, 1968; Fulton, 1915).
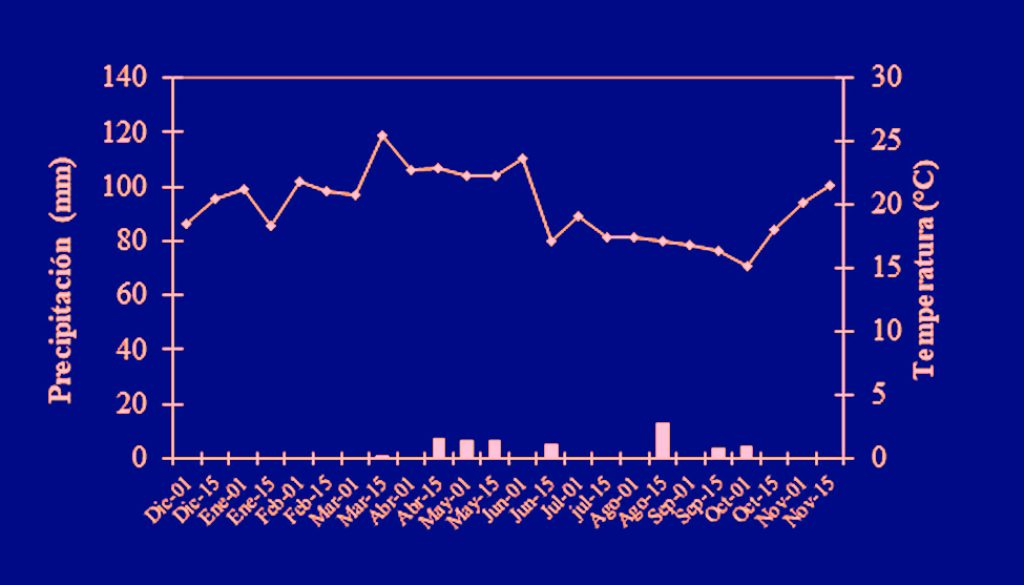
El trabajo de campo se llevó a cabo entre diciembre de 2004 y noviembre de 2005, en 2 sitios del centro de México cuya vegetación dominante es matorral xerófilo, con el fin de conocer la variación espacial en los rasgos poblacionales y la biología de este insecto: Zapotitlán Salinas (denominado en lo sucesivo como Zapotitlán), localizado en la parte suroccidental del valle de Tehuacán, Puebla (18°19’ N, 97°27’ O; 1,480 m snm), y la Reserva Ecológica del Pedregal de San Ángel de Ciudad Universitaria (que en lo sucesivo se le denominará Pedregal), localizada al centro-poniente de la Ciudad de México (19°17’ N, 99°11’ O; 2,250 m snm). Zapotitlán presenta un clima seco con lluvias en verano, una temperatura media anual de 21.2 °C y una precipitación de 380 mm (Arias et al., 2001; fig. 1a); mientras que el Pedregal presenta un clima templado subhúmedo con lluvias en verano, con una temperatura media anual de 16.1°C y precipitación anual de 835 mm (César-García, 2002; fig. 1b). La elección de los sitios fue hecha debido a que se había registrado la presencia de grillos de este género en ambas localidades, en Zapotitlán por Ponce-Wainer y Cueva del Castillo (2008) y en el Pedregal, por Cano-Santana y Oyama (1992). El objetivo de comparar los 2 sitios fue conocer la biología de los grillos, ya que las localidades estudiadas fueron diferentes entre sí.
En Zapotitlán se realizaron muestreos mensuales directos durante el día (7:00 a 18:00 h) para la búsqueda manual de grillos en las plantas de 3 parcelas de 50 × 100 m. En esta localidad, el hábitat de O. fultoni está muy restringido a la zona conocida como Barranca Grande, donde se detecta dominancia de “tabaquillo cimarrón”, Wigandia urens (Ruiz et Pavón) Kunth (Boraginaceae) y Acacia cochliacantha Willd. (Fabaceae). En el Pedregal, los muestreos se realizaron del mismo modo, pero durante la noche (18:00-22:30 h) y de manera bisemanal en 2 parcelas de 20 × 30 m, una ubicada en la Zona Núcleo Oriente y otra en la Zona Núcleo Poniente. En esta localidad, el muestreo se realizó en el horario nocturno debido a que se presenta una vegetación cerrada y mayor altura que en Zapotitlán, lo cual dificulta la búsqueda de grillos durante el día, mientras que por la noche, los micrositios que habita pueden ser detectados por la emisión de canto de los machos adultos, alrededor de los cuales suelen encontrarse hembras adultas y ninfas. Los resultados obtenidos en el Pedregal para la estructura poblacional y densidad se promediaron por mes, con el fin de ser comparable con los registros de Zapotitlán, ya que la periodicidad de muestreo en cada localidad fue diferente.
Para conocer los estados de desarrollo de O. fultoni en las parcelas de muestreo, cada grillo fue marcado en el pronoto con pintura blanca y se registró la longitud corporal de cada ejemplar recolectado, desde el vertex cefálico hasta el extremo terminal del abdomen. La estructura de edades se estableció siguiendo la categorización propuesta por Fulton (1915), misma que fue estandarizada en los trabajos de Pérez-Escobedo (2007) y Romero-Mata (2008) para 5 estadios ninfales y 2 sexos en adultos. Con los datos procedentes de las búsquedas y los conteos en las parcelas, se realizó una extrapolación de la densidad promedio anual de grillos por hectárea, debido a que el número y tamaño de las parcelas fue diferente entre sitios.
También se obtuvo la proporción sexual en los adultos, pues no fue posible reconocer el sexo en las ninfas, la cual se determinó como el número de machos por hembra, tomando en cuenta el número acumulado de especímenes adultos de cada sexo registrado en cada mes o periodo de muestreo de muestreo y en cada sitio de estudio. Las hembras se distinguían de los machos por la presencia del ovipositor y por sus alas dispuestas lateralmente, ya que los machos las tienen dispuestas sobre el dorso (A. Romero-Mata, obs. pers.). Los resultados fueron analizados con una prueba de χ2 para verificar si la proporción sexual difería de 1:1 (Zar, 2010). Los análisis estadísticos se realizaron con Statistica v.8.0 (StatSoft, 2008).
Para conocer la densidad de machos en ambas localidades, mensualmente, se utilizó un método de detección aural (Petraborg et al., 1953). Para ello, se establecieron 6-10 estaciones en Zapotitlán, basadas en la distribución de la planta hospedera (W. urens), y en el Pedregal, se establecieron cada 100 m de distancia, 10 en la Zona Núcleo Oriente y 15 en la Zona Núcleo Poniente. La densidad de machos fue determinada con el índice modificado de Petraborg (Cano-Santana et al., 2008): D = h/πra2, donde h = número promedio de machos cantando escuchados por cada estación y ra = el radio de audibilidad (7 m en Pedregal, 10 m en Zapotitlán). Con el fin de establecer el efecto de los 2 sitios xerofíticos (Zapotitlán y Pedregal), los meses de muestreo, así como la interacción de ambos factores sobre la densidad de machos, se realizó un análisis de varianza de 2 vías con los datos de densidad transformados como x’ = √ (x + 0.5) por tratarse de datos discretos. Posteriormente, en caso de encontrar algún efecto significativo se procedió a aplicar una prueba post-hoc de Tukey para realizar la comparación múltiple de medias y así detectar las diferencias significativas entre los tratamientos (Zar, 2010). Los análisis estadísticos se realizaron con Statistica v.8.0 (StatSoft, 2008).
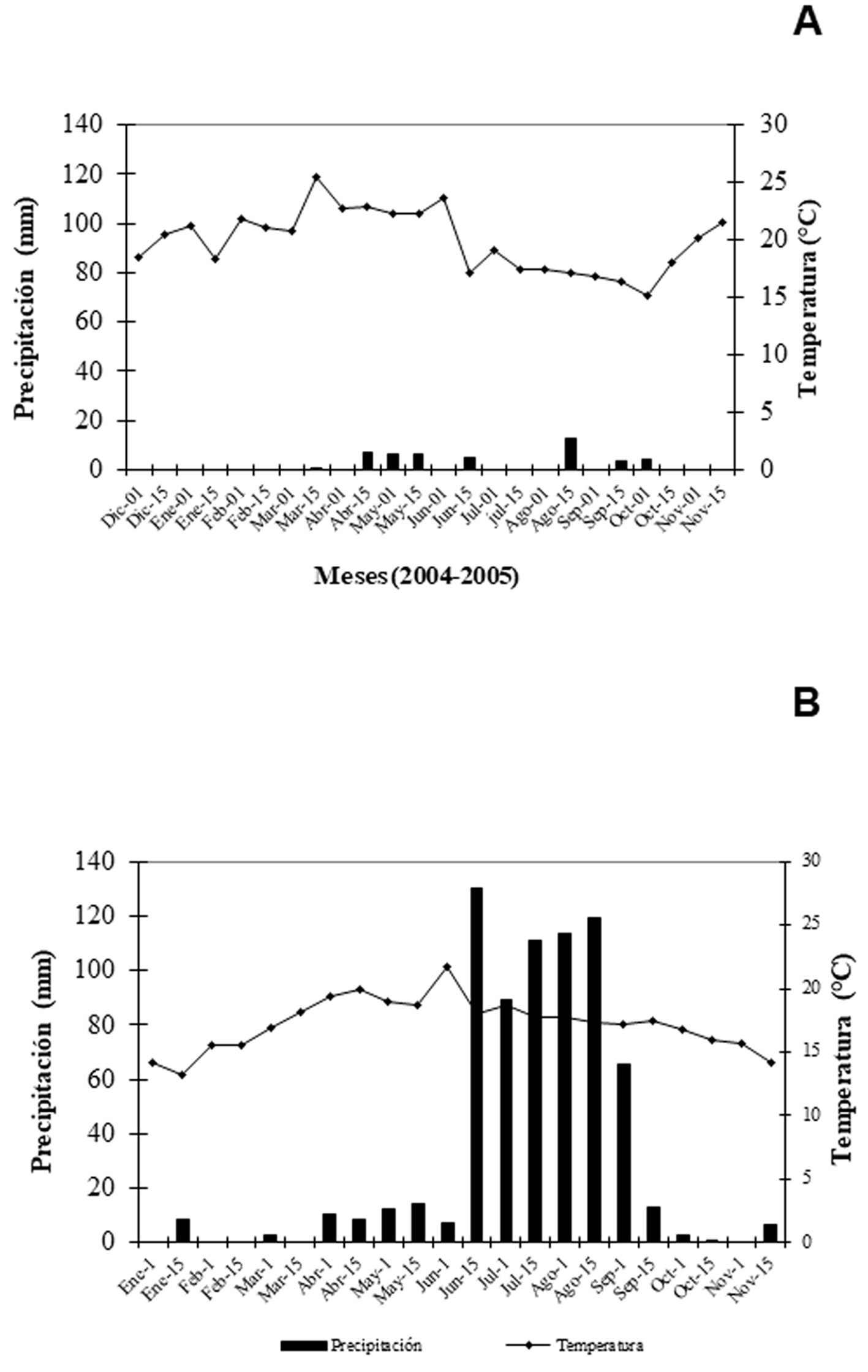
Los datos transformados de densidad de machos fueron correlacionados con la temperatura media mensual y la precipitación acumulada mensual. Los datos meteorológicos de Zapotitlán fueron obtenidos de la Comisión Nacional de Agua de Puebla, y los del Pedregal fueron solicitados al Programa de Estaciones Meteorológicas del Bachillerato Universitario Colegio de Ciencias y Humanidades plantel Sur (fig. 1).
Resultados
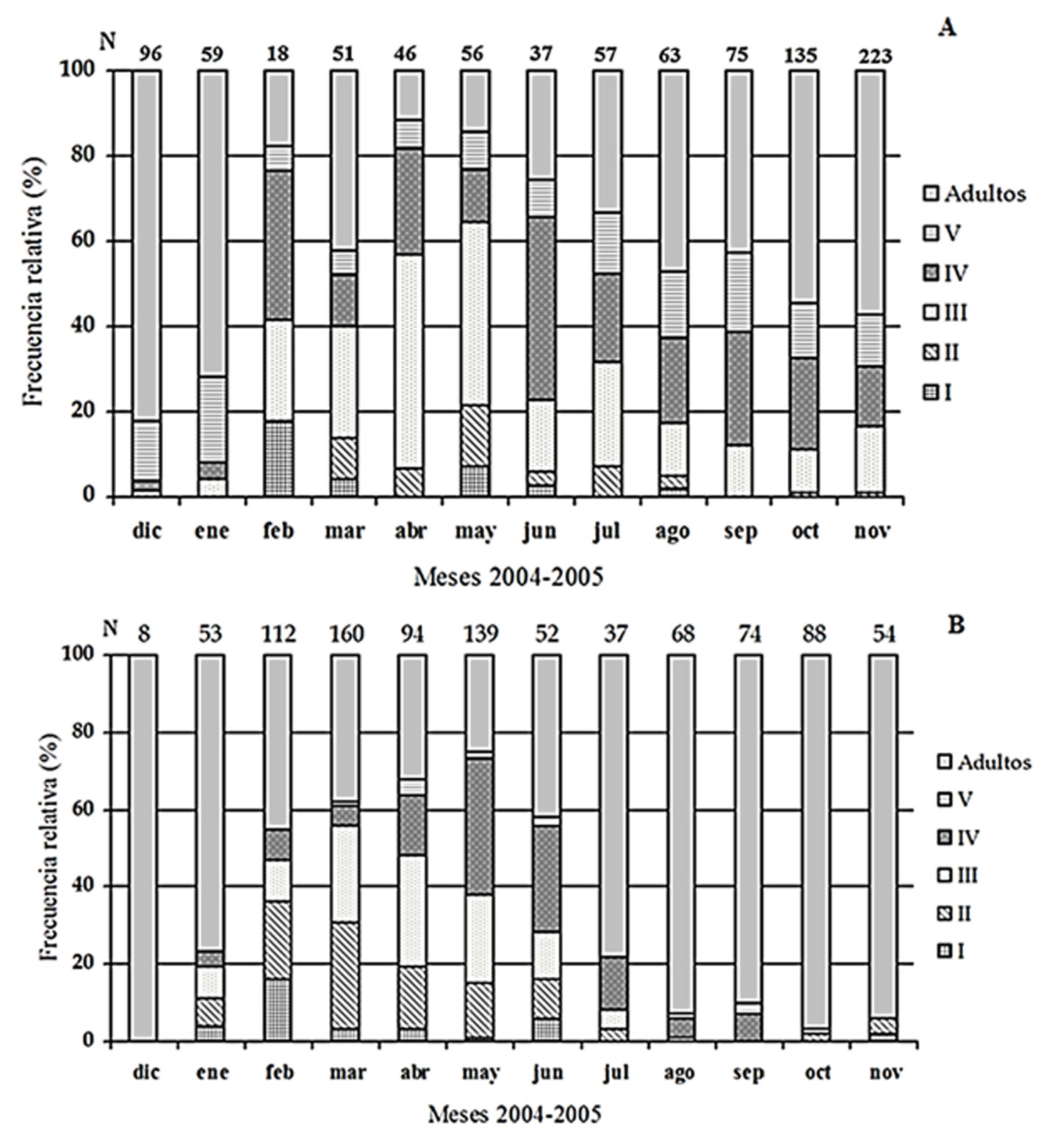
La especie registró 5 estadios ninfales, en ambas localidades (fig. 2a, b). Se contabilizaron en los muestreos 916 ejemplares de O. fultoni en Zapotitlán y 939 ejemplares en el Pedregal. En Zapotitlán, las ninfas del estadio I fueron registradas en febrero-junio y agosto, y las del estadio II de marzo a agosto (fig. 2a), pero las ninfas de los estadios III, IV y V, así como los adultos, fueron registrados todo el año. En diciembre, los adultos representaron 84.1% de la población, mientras que en abril representaban 15.2%. El mayor número de ninfas y adultos fue registrado en noviembre (96 y 127 individuos, respectivamente), en tanto que el número más bajo de ninfas fue registrado en enero y febrero (14 individuos en cada mes) y la abundancia más baja de adultos fue registrada en febrero (4 individuos).
En el Pedregal, el estadio I se registró de enero a junio y en noviembre; el estadio II de enero a julio y de octubre a noviembre; el estadio III de enero a agosto; el estadio IV de enero a septiembre, y el estadio V de marzo a junio y de agosto a octubre (fig. 2b). Los adultos se encontraron todo el año y constituyeron 100% de la población en diciembre. En mayo, se registró la mayor cantidad de ninfas (94 individuos), mientras que los adultos solo representaron 22.3% de los especímenes. El número más bajo de ninfas fue encontrado en octubre y noviembre (3 especímenes en cada mes) y la abundancia más baja de adultos fue registrada en diciembre (8 especímenes) (fig. 2b). Con base en los valores máximos de cada intervalo, se puede observar que la población del Pedregal se compone de individuos con mayor longitud corporal, pues en Zapotitlán los machos alcanzaron 18 mm y las hembras 20 mm
(tabla 1).
La densidad promedio anual de grillos fue más alta en el Pedregal (652.0 ± 0.2 ind./ha) que en Zapotitlán (50.4 ± 0.2 ind./ha). La densidad más alta fue registrada en noviembre en Zapotitlán (149.3 ind/ha) y en marzo en el Pedregal (1,333.3 ind./ha). La densidad más baja en Zapotitlán fue registrada en febrero (11.4 ind./ha) y en diciembre en el Pedregal (66.7 ind./ha). En ambas localidades, los adultos se encontraron durante todo el año (fig. 3a, b). En Zapotitlán los adultos registraron valores altos de densidad entre octubre y diciembre (de 46.0 a 85.3 ind./ha) (fig. 3a); mientras que en el Pedregal, la densidad alcanzó valores de entre 525.0 y 708.3 ind./ha entre agosto y octubre (fig. 3b)
Las figuras 2a y 3a indican que la población de O. fultoni en Zapotitlán es multivoltina, pues todo el año hay presencia de ninfas. En contraste, en el Pedregal, la presencia de las ninfas se concentró específicamente en los meses secos del año (entre febrero y junio), lo que indica que la población en este sitio es univoltina (figs. 2b, 3b).
En Zapotitlán, la proporción sexual de la población de O. fultoni no difirió de 1:1 a lo largo de los meses (p > 0.05); no obstante, la proporción sexual calculada con los datos agrupados difirió significativamente de 1:1, pues se registró un macho por 1.2 hembras (N = 459; χ2 = 6.12, g.l. = 1, p < 0.05; tabla 2). En contraste, en la población del Pedregal, la proporción de machos siempre fue significativamente más alta que la de las hembras a lo largo del año (p < 0.001), incluso en junio y julio, no se registraron hembras (tabla 2). Al agrupar los datos de este sitio se encontró que se registran 6.1 machos por hembra (N = 514; χ2 = 266.342, g.l. = 1, p < 0.001).
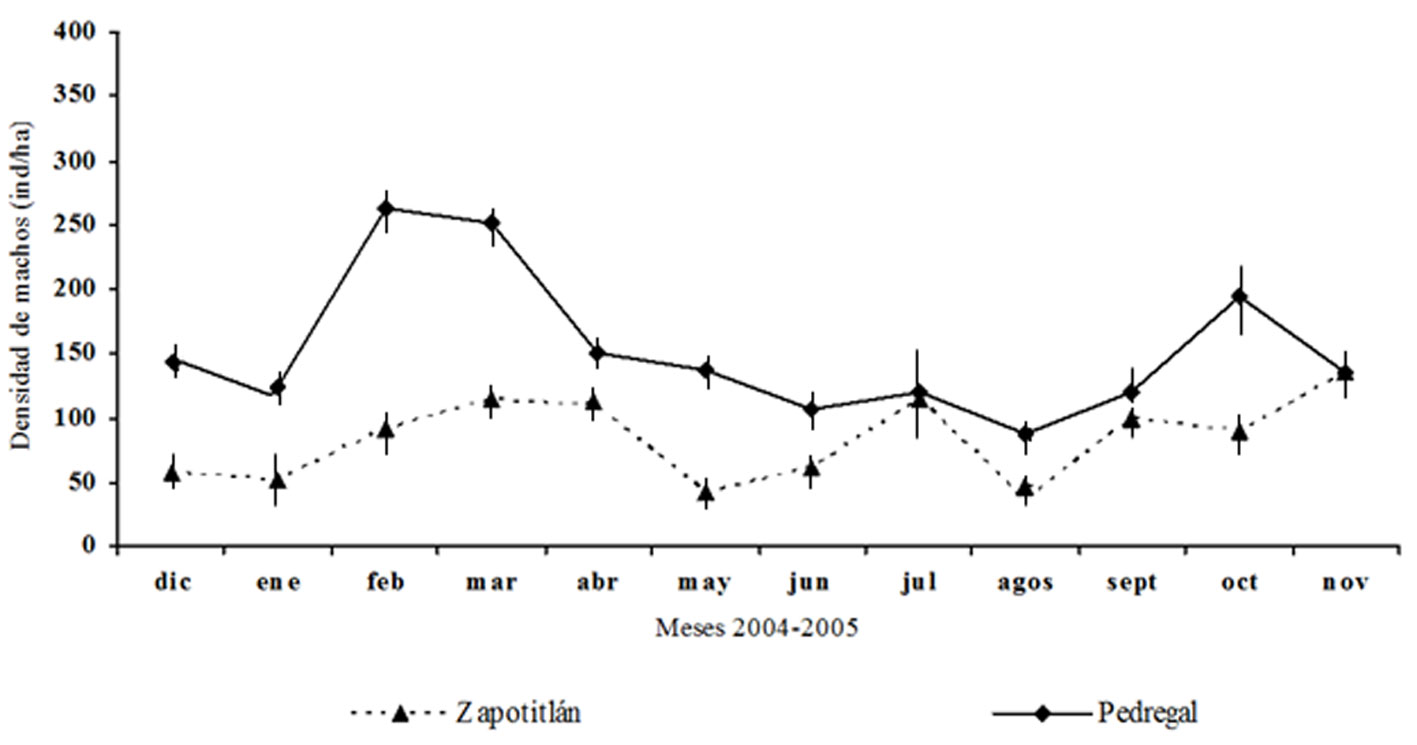
La densidad de machos se afectó significativamente por el sitio (F1,352 = 151.63, p < 0.001), la fecha (F10,352 = 3.40, p = 0.032) y la interacción sitio × fecha (F10,352 = 3.97, p < 0.001). La prueba de comparación múltiple de medias de Tukey mostró que en Zapotitlán se registró la densidad más baja de machos, con 45.52 ± error estándar 10.5 ind./ha en agosto y la más alta en noviembre, con 125 ± 9.3 machos/ha (fig. 4). En el Pedregal la densidad más alta fue registrada en febrero (255 ± 10.2 machos/ha), luego en marzo (250 ± 9.5 machos/ha) y finalmente, en octubre (200 ± 11.3 machos/ha) (fig. 4). En Zapotitlán se registró una densidad promedio anual menor de machos (83.41 ± 5.3 ind./ha) que en el Pedregal (153.75 ± 9.1 ind./ha).
En ambas localidades se encontró una correlación negativa y significativa entre la precipitación acumulada mensual y la densidad de machos (Zapotitlán: r = -0.586, g.l. = 10, p = 0.045; fig. 5a; Pedregal: r = -0.669, g.l. = 9, p = 0.025; fig. 5b). En contraste, no se encontró correlación significativa entre la temperatura media mensual y la densidad de machos (Zapotitlán: r = 0.147, g.l. = 10, p = 0.646; Pedregal: r = 0.221, g.l. = 9, p = 0.553).
Discusión
En la población de Zapotitlán se registraron ninfas de los 5 estadios a lo largo de todo el año, lo cual es un indicio que ésta presenta conducta multivoltina (figs. 2a y 3a). En contraste, en el Pedregal la presencia de las ninfas se concentró específicamente en los meses secos del año (de febrero a junio) lo que indica que la población es univoltina (figs. 2b y 3b). Esta diferencia se atribuye a que Zapotitlán es un sitio localizado a menor altitud (820 m) y menor latitud que el Pedregal, lo cual determina que en Zapotitlán haya una temperatura media anual más alta (tabla 3), lo cual podría permitir a estos grillos a mantener un gran número de generaciones traslapadas durante el año. Nuestros resultados respaldan las observaciones que Alexander (1968) realizó en Canadá y EUA para esta misma especie, quien encontró que las poblaciones de O. fultoni que viven más al sur presentan 2 o 3 generaciones al año, mientras aquellas que están en el norte presentan solamente una. Nuestros resultados indican que O. fultoni registró una abundancia contrastante en los 2 sitios con vegetación xerofítica del centro de México. Los registros diurnos correspondientes a Zapotitlán indican abundancia por decenas de ejemplares, en tanto que en el Pedregal, los conteos nocturnos indican una abundancia contabilizada en cientos de ejemplares y con adultos de mayor talla (tabla 1). Estas diferencias de abundancia y tamaño corporal, se atribuyen a que el hábitat que ofrece el Pedregal es altamente productivo (636 g m-2 año-1 de productividad primaria neta aérea; Cano-Santana, 1994) y con una alta diversidad de plantas arbustivas y arbóreas hospederas de relativa mayor talla (3-7 m) (Pérez-Escobedo, 2007), en tanto que el hábitat que ofrece Zapotitlán evidentemente es menos productivo dadas las condiciones áridas prevalecientes y su menor diversidad vegetal, asociada a que la zona de Barranca Grande presenta una topografía homogénea (tabla 3) y está dominada por plantas de talla pequeña (< 2.0 m), como W. urens y A. cochliacantha (Romero-Mata, 2008, 2018).
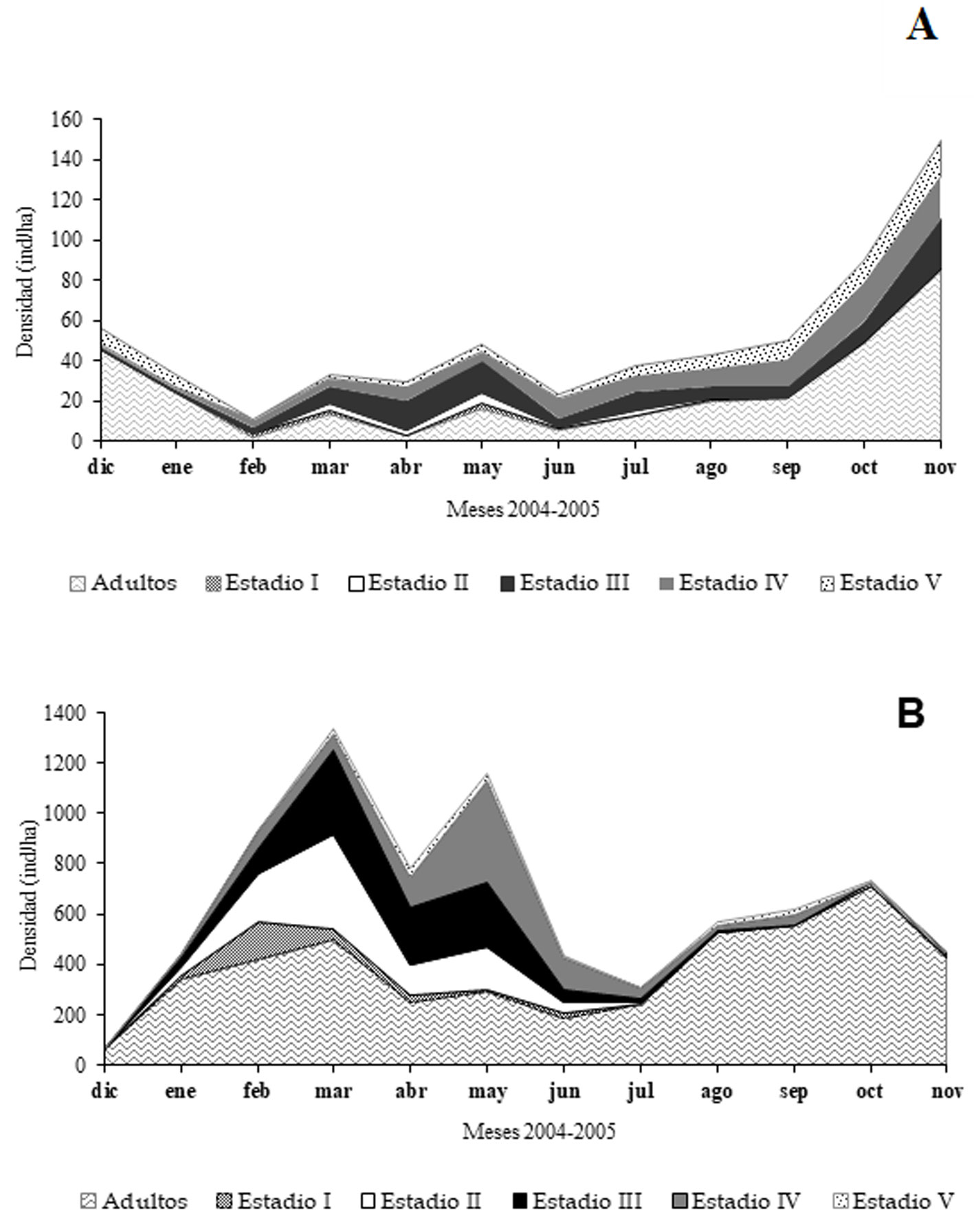
Otros factores a los que se le podría atribuir la variación del número de generaciones por año son las diferencias entre sitios en el patrón de precipitación y en los recursos alimenticios. Respecto al primer factor, en Zapotitlán se registraron ninfas todo el año y hubo una reducción drástica de su densidad entre julio y diciembre (fig. 3a). Por su parte, en el Pedregal, las ninfas experimentaron 2 periodos de reducción de la densidad poblacional, uno de ellos se dio de marzo a abril y el segundo entre mayo y junio (fig. 3b). Los meses en los cuales hubo una gran abundancia relativa de ninfas en ambos sitios fueron de febrero a junio, lo cual corresponde a la primavera seca del centro de México. Se ha reportado que la lluvia puede reducir la supervivencia de los huevos y las ninfas de ortópteros acrídidos y pirgomórfidos debido a los altos niveles de humedad que favorecen el ataque de hongos, en tanto que la anegación del suelo provoca el ahogamiento de las ninfas (Camacho-Castillo, 1999; Cano-Santana, 1994; Castellanos-Vargas, 2001; Pickford, 1966; Rodell, 1977). Respecto al segundo factor, se sabe que la presencia de recursos alimenticios, tales como inflorescencias, hojas e insectos epífitos en plantas perennes favorecen la presencia de ninfas. En el Pedregal las ninfas se alimentan de las flores de Ageratina petiolaris (Moc. Ex. DC.) King et Rob. (Asteraceae), Buddleja cordata Kunth y B. parviflora Kunth (Scrophulariaceae), mientras que en Zapotitlán las ninfas se ven favorecidas con la planta W. urens (Pérez-Escobedo, 2007; Romero-Mata, 2008).
La disponibilidad de alimento, agua, nitrógeno y espacio son factores que favorecen el desempeño de los insectos epífitos, pues promueven la existencia de tamaños poblacionales grandes (Hambäck y Englund, 2005; McCauley, 1991; Soberón, 1986). La densidad de especímenes y de machos de O. fultoni fue más baja en Zapotitlán que en el Pedregal (figs. 3, 5), lo cual se podría relacionar con la abundancia y diversidad de recursos alimenticios que usa en cada sitio. En Zapotitlán, O. fultoni usa 3 de las 27 especies de plantas registradas en las parcelas de estudio, y es un sitio donde la cobertura vegetal es escasa y rala (Romero-Mata, 2008); mientras en el Pedregal, esta especie usa 27 de las 39 especies de plantas registradas y se trata de un área donde la cobertura vegetal es alta y cerrada (Pérez-Escobedo, 2007; tabla 3). Nuestros resultados sugieren que la posición intertropical de los 2 sitios de estudio en México favorecen una alta densidad de O. fultoni, en comparación con las localidades boreales donde Johnson (1996) y Fedor (2001) reportaron densidades muy bajas para diferentes especies de este género: 0.3-8.6 ind./m2 en Hog Island, Virginia y 0-4.25 ind./m2 en Eslovaquia, respectivamente.
Por otro lado, en ambos sitios los resultados de la densidad de machos mostraron correlaciones negativas significativas con la precipitación acumulada mensual. A pesar de que Alexander (1968) sugiere que la precipitación es un parámetro determinante del crecimiento de la vegetación que O. fultoni ocupa para emitir su canto, copular, forrajear y refugiarse de sus depredadores, es posible que la temporada de lluvias tenga efectos negativos sobre los tamaños poblaciones de los grillos arborícolas. Tal patrón puede deberse a que la lluvia favorece la mortalidad de ninfas porque favorece el ataque por hongos, así como por muerte por ahogamiento o el golpeteo mecánico de las gotas de lluvia (Cano-Santana, 1994; Rodell, 1977).
Los resultados de densidad de machos sugieren que O. fultoni puede ser sensible a la cobertura de la vegetación de cada sitio de estudio. En Zapotitlán la vegetación ofrece escasos lugares para el refugio de los machos y facilita la detección por parte de los depredadores a través de su canto. Por el contrario, la cobertura es más densa y cerrada de la vegetación del Pedregal promueve la existencia de una mayor cantidad y calidad de refugio para los machos, que les podría permitir incrementar sus probabilidades de supervivencia ante un depredador.
Nuestros resultados indican que, al agrupar los datos recopilados a lo largo del año de muestreo, la proporción de los sexos de O. fultoni en la población de Zapotitlán se encuentra marginalmente sesgada hacia las hembras, a razón de un macho por cada 1.2 hembras; mientras que en el Pedregal, la proporción fue de 6.1 machos por cada hembra (tabla 2). Los datos del Pedregal deben tomarse con cautela, pues las diferencias en la proporción sexual entre sitios pueden deberse a la diferencia de la hora de muestreo, ya que durante la noche (un método usado en el Pedregal) los machos son más fáciles de detectar que las hembras por el canto que aquéllos emiten, en tanto que en el muestreo diurno (usado en Zapotitlán) la probabilidad observar machos y hembras es la misma, pues a esas horas del día los machos no cantan, y el registro de especímenes depende solamente de la eficiencia del observador para encontrar los especímenes entre los tejidos aéreos de las plantas.
Suponiendo que nuestros resultados se acercan al comportamiento real de las proporciones sexuales en ambas localidades, éstos sugerirían la existencia de una presión selectiva diferencial entre los sitios de estudio. En el Pedregal, si bien existe mayor disponibilidad de refugios diurnos, los machos están sometidos a una intensa competencia intrasexual.
Masaki y Walker (1987) y Queller (2006) indican que en poblaciones de insectos, las cantidades de individuos en cada uno de los sexos es un atributo determinante del proceso evolutivo, pues tiene implicaciones en el tipo de apareamiento que puede ser monógamo, poliándrico o poligínico, así como en el cuidado parental de la progenie. Por su parte, en el caso de abejas eusociales, Godfray y Werren (1996) indican la existencia de costos diferenciales en la producción de individuos de cada uno de los sexos; la producción de machos requiere una alta inversión energética, por lo que su producción está limitada a muy pocos individuos en las colonias, mismos que aparecen en una época específica del año, relacionada con el vuelo nupcial. Si bien O. fultoni no es una especie que forme colonias, nuestros resultados sugieren que la población de Zapotitlán presentaría una estrategia de apareamiento monógamo con tendencia marginal a ser poligínico, mientras que en la población del Pedregal sería dominantemente poliándrico. Los trabajos de Souroukis y Cade (1993) y de Cueva-del Castillo (2015) indican que los machos de Gryllus pennsylvanicus y de Macroanaxipha macilenta, respectivamente, se encuentran bajo presión de selección sexual, pues su tamaño poblacional duplica al de las hembras. Según estos autores, es notorio cómo algunos atributos morfológicos de los machos de ambas especies, tales como el tamaño corporal, el peso y su canto intenso, son preferidos diferencialmente por las hembras, lo que provoca asimetrías en la densidad de machos y en las estrategias de apareamiento que predominan en las poblaciones.
Actualmente, hace falta establecer un estudio para O. fultoni encaminado en determinar el costo energético de la producción de los sexos en cada localidad. Se prevé que en la población de Zapotitlán, la producción de machos tendría un costo elevado con relación a la del Pedregal, pues anteriormente se sugirió la existencia de una mayor disponibilidad de alimento y refugios en este sitio. Se prevé que en el Pedregal, los machos estarían sometidos a una mayor presión de selección sexual y a una alta competencia intrasexual.
Dado que el objetivo de este estudio era tener datos cuantitativos de la estructura de edades, proporción sexual y densidad poblacional en ambas localidades, se buscó tener el mayor número de registros posibles adaptándonos a las condiciones que cada sitio tenía. La vegetación abierta y rala, con baja cobertura y baja talla (< 2.0 m) de las plantas en la zona de Barranca Grande de Zapotitlán, facilitó la búsqueda de ejemplares durante el día sin posibilidad de tener sesgo en los registros de la proporción sexual y de la densidad de ejemplares. Lamentablemente, en el Pedregal la alta cobertura y mayor altura de la vegetación (< 7 m) hacía imposible tener un conteo completo de los especímenes en el día, por lo que se decidió allí hacer el muestreo nocturno, pues los machos muchas veces coexisten con hembras que se acercan a ellos para aparearse y por ninfas que coexisten con ellos en los mismos microhábitats. Lo anterior abre la posibilidad de que los valores de densidad de grillos arborícolas en esta última localidad sea una subestimación de los valores reales y que las proporciones sexuales registradas estén artificialmente sesgadas a los machos.
El tamaño y número de parcelas fue distinto, ya que la baja densidad de plantas y de grillos en Zapotitlán obligaba a tener una mayor área de muestreo (15,000 m2) en 3 zonas, en tanto que en el Pedregal la alta cobertura vegetal y alta densidad de grillos facilitó el muestreo en un área menor (1,200 m2) y en menor número de parcelas. Es conocido el hecho de que se recomienda que el tamaño de la unidad de muestreo sea mayor cuando la densidad de organismos es bajo (Mueller-Dombois y Ellenberg, 1974).
Creemos que ambos métodos fueron eficaces para registrar el mayor número de especímenes en cada localidad. No obstante, un estudio que podemos recomendar para que no haya sesgo en la proporción sexual en el Pedregal es hacer registros directos diurnos por vagabundeo en zonas donde se haya verificado previamente actividad por canto de machos. Por otra parte, para conocer la densidad poblacional real de grillos arborícolas en el Pedregal, sería posible usando fumigaciones en áreas pequeñas (25 m2), con el inconveniente de ser un método destructivo (Tovar-Sánchez et al., 2003).
Concluyendo, el grillo arborícola Oecanthus fultoni presentó tamaños poblacionales altos y actividad durante todo el año en 2 matorrales xerófilos fisonómicamente contrastantes del centro de México. El matorral de Zapotitlán Salinas, en el sur Puebla, estuvo representado por una vegetación secundaria dominada por W. urens y A. cochliacantha en la zona de la Barranca Grande. Por su parte, el matorral de la Reserva Ecológica del Pedregal de San Ángel de Ciudad Universitaria se caracterizó por ser atípicamente húmedo, con vegetación muy diversa, densa y cobertura cerrada.
El grillo arborícola O. fultoni presentó respuestas numéricas diferenciales en cada localidad, las cuales se atribuyeron a su plasticidad de respuesta ante condiciones ambientales limitantes. Nuestros resultados sugieren que la población de Zapotitlán presentaría estrategia de apareamiento monógamo con tendencia marginal a ser poligínico; mientras que la población del Pedregal posiblemente sería dominantemente poliándrica. Se propone la realización de estudios con enfoque evolutivo para conocer las presiones de selección que enfrentan los machos y las hembras en cada localidad; así como para establecer la disyuntiva energética que enfrenta especie ante la existencia de distintas proporciones sexuales entre poblaciones.
Agradecimientos
Este trabajo fue financiado por el Programa de Apoyo a Proyectos de Investigación e Innovación Tecnológica (PAPIIT-UNAM) IN216203 concedido a Raúl Cueva del Castillo y a ZC-S. Iván Castellanos-Vargas apoyó significativamente en el desarrollo de la investigación y del manuscrito, identificó la especie, revisó el manuscrito, apoyó en el análisis estadístico, en el trabajo de campo y elaboró figuras. Agradecemos a B. Urbano, J. López, R. Barzalobre, E. Romero, R. Álvarez, I. Victoria, E. Valdivia, E. Zamorano, J. Antonio y G. Nieto por su ayuda en el campo. Marco Antonio Romero-Romero ofreció apoyo técnico. Dos revisores anónimos ayudaron a corregir errores y a mejorar sustancialmente el manuscrito.
Referencias
Alexander, R. D. (1968). Life cycle origins, speciation, and related phenomena in crickets. The Quarterly Review of Biology, 43, 1–41. https://doi.org/10.1086/405628
Alexander, G. e Hilliard, J. R. (1969). Altitudinal and seasonal distribution of Orthoptera in the Rocky Mountains of Northern Colorado. Ecological Monographs, 39, 385–432. https://doi.org/10.2307/1942354
Arias, A. A., Valverde, M. T. y Reyes, J. (2001). Las plantas de la región de Zapotitlán Salinas, Puebla. México D.F.: Instituto Nacional de Ecología-Secretaría del Medio Ambiente y Recursos Naturales.
Brown, V. K. (1978). Variations in voltinism and diapause intensity in Nemobius sylvestris (Bosc.) (Orthoptera: Gryllidae). Journal of Natural History, 12, 461–472. https://doi.org/10.1080/00222937800770321
Camacho-Castillo, E. (1999). Demografía y movilidad de Sphenarium purpurascens (Orthoptera: Pyrgomorphidae) en la Reserva del Pedregal de San Ángel, D.F. (México) (Tesis). México D.F.: Facultad de Ciencias, Universidad Nacional Autónoma de México.
Cano-Santana, Z. (1994). Flujo de energía a través de Sphenarium purpuracens (Orthoptera: Acrididae) y productividad primaria neta área en una comunidad xerófita (Tesis doctoral). México D.F.: Facultad de Ciencias, Universidad Nacional Autónoma de México.
Cano-Santana, Z. y Oyama, K. (1992). Variation in leaf trichomes and nutrients of Wigandia urens (Hydrophyllaceae) and its implications for herbivory. Oecologia, 92, 405–409. https://doi.org/10.1007/BF00317467
Cano-Santana, Z., Romero-Mata, A. y Pérez-Escobedo H. M. (2008). Modified Petraborg Index applied to the sampling of male crickets by aural detection. Journal of Orthoptera Research, 17, 111–112. https://doi.org/10.1665/1082-6467(2008)17[111:MPIATT]2.0.CO;2
Castellanos-Vargas, I. (2001). Ecología de la oviposición de Sphenarium purpurascens (Orthoptera: Pyrgomorphidae) en la Reserva del Pedregal de San Ángel, México, D.F. (Tesis). México D.F.: Facultad de Ciencias, Universidad Nacional Autónoma de México.
César-García, F. (2002). Análisis de algunos factores que afectan la fenología reproductiva de la comunidad vegetal de la Reserva del Pedregal de San Ángel, D.F. (México) (Tesis). México D.F.: Facultad de Ciencias, Universidad Nacional Autónoma de México.
Costea, M., Weaver, S. E. y Tardif, F. J. (2003). The biology of Canadian weeds. 126. Amaranthus retroflexus L., A. powellii S. Watson and A. hybridus L. Canadian Journal of Plant Science, 84, 631–668. https://doi.org/10.4141/P02-183
Cueva-del Castillo, R. (2015). Body size, fecundity and sexual size dimorphism in the Neotropical cricket Macroanaxipha macilenta (Saussure) (Orthoptera: Gryllidae). Neotropical Entomology, 44, 116–122. https://doi.org/10.1007/s13744-014-0266-1
Demchak, K. (Ed.) (2002). Commercial berry production and pest management guide. University Park: College of Agricultural Sciences, Pennsylvania State University.
Essig, E. O. (1958). Insects and mites of western North America. New York: McMillan Company.
Fedor, P. J. (2001). Seasonal dynamics of the tree cricket Oecanthus pellucens (Scopoli, 1763) (Ensifera, Gryllidae) in South-western Slovakia. Articulata, 16, 21–26.
Fontes, E. M. G., Habeck, D. H. y Slansky, Jr. F. (1994). Phytophagous insects associated with Goldenrods (Solidago spp.) in Gainesville, Florida. Florida Entomologist, 77, 209–221.
Fulton, B. B. (1915). The tree crickets of New York: life history and bionomics. New York Agricultural Experiment Station Technical Bulletin, 42, 1–47.
Fulton, B. B. (1925). Physiological variation in the snowy tree-cricket Oecanthus niveus De Geer [Oecanthus fultoni and O. rileyi]. Annals of the Entomological Society of America, 18, 363-383. https://doi.org/10.1093/aesa/18.3.363
Godfray, H. C. J. y Werren, J. H. (1996). Recent developments in sex ratio studies. Trends in Ecology and Evolution, 11, 59–63. https://doi.org/10.1016/0169-5347(96)81043-3
Hambäck, P. A. y Englund, G. (2005). Patch area, population density and the scaling of migration rates: the resource concentration hypothesis revisited. Ecology Letters, 8, 1057–1065. https://doi.org/10.1111/j.1461-0248.2005.00811.x
Hanks, L. M. y Denno, R. F. (1993). Natural enemies and plant water relations influence the distribution of an armored scale insect. Ecology, 74, 1081–1091. https://doi.org/10.2307/1940478
Hewitt, G. M. y Bultin, R. K. (1997). Causes and consequences of population structure. En J. R. Krebs y N. B. Davies (Eds.), Behavioral ecology (pp. 350–373). Cambridge, Reino Unido: Blackwell Science Publisher.
Kingsolver, J. G. (1983). Ecological significance of flight activity in Colias butterflies: implications for reproductive strategy and population structure. Ecology, 64, 546–551. https://doi.org/10.2307/1939974
Knopf, A. A. (1984). The Audubon Society field guide to North American insects and spiders. Nueva York: Chanticleer Press.
Masaki, S. y Walker, T. J. (1987). Cricket life cycles. En M. K. Hecht, B. Wallace y G. T. Prance (Eds.), Evolutionary Biology (pp. 349–423). Boston, Massachusetts: Springer. https://doi.org/10.1007/978-1-4615-6986-2_11
McCauley, D. E. (1991). The effect of host plant match size variation on the population structure of a specialist herbivore insect, Tetraopes tetraophthalmus. Evolution, 45, 1675–1684. https://doi.org/10.1111/j.1558-5646.1991.tb02672.x
Mueller-Dombois, D. y Ellenberg, D. (1974). Aims and methods of vegetation ecology. Nueva York: Wiley.
Pérez-Escobedo, H. M. (2007). Variación espacial y temporal de la estructura poblacional de dos especies del género Oecanthus (Orthoptera: Gryllidae) en la Reserva Ecológica del Pedregal de San Ángel (Tesis). México D.F.: Facultad de Ciencias, Universidad Nacional Autónoma de México.
Petraborg, W. H., Wellein, E. G. y Gunvalson, V. E. (1953). Roadside drumming counts a spring census method for ruffed grouse. Journal of Wildlife Management, 17, 292–295. https://doi.org/10.2307/3797109
Pickford, R. (1966). The influence of the date of oviposition and climatic conditions on hatching of Camnula pellucida (Scuder) (Orthoptera: Acrididae). Canadian Entomologist, 98, 1145–1159. https://doi.org/10.4039/Ent981145-11
Ponce-Wainer, J. X. y Cueva-del Castillo, R. (2008). Female mate choice and no detected predation risk in relation to the calling song of Oecanthus niveus (Gryllidae: Oecanthinae). Annals of the Entomological Society of America, 101, 260–265. https://doi.org/10.1603/0013-8746(2008)101[260:FMCAND]2.0.CO;2
Queller, D. (2006). Sex ratios and social evolution. Current Biology, 16, R664–R668. https://doi:10.1016/j.cub.2006.08.017
Rodell, C. F. (1977). A grasshopper model for a grassland ecosystem. Ecology, 58, 227–245. https://doi.org/10.2307/
1935600
Romero-Mata, A. (2008). Estructura poblacional y preferencia de oviposición de Oecanthus niveus (Orthoptera: Gryllidae) en Zapotitlán Salinas, Puebla (Tesis). México D.F.: Facultad de Ciencias, Universidad Nacional Autónoma de México.
Romero-Mata, A. (2018). Rasgos de nicho ecológico de especies coexistentes del género Oecanthus (Orthoptera: Gryllidae) en Zapotitlán Salinas, Puebla, México (Tesis de maestría). Ciudad de México: Facultad de Ciencias, Universidad Nacional Autónoma de México.
Schowalter, D. T. (2006). Insect ecology. Amsterdam: Academic Press.
Shure, D. J. (1973). Radionuclide tracer analysis of trophic relationships in an old-field ecosystem. Ecological Monographs, 43, 1–19. https://doi.org/10.2307/1942156
Soberón, J. (1986). The relationship between use and suitability of resources and its consequences to insect population size. The American Naturalist, 127, 338–357. https://doi.org/10.1086/284488
Souroukis, K. y Cade, W. H. (1993). Reproductive competition and selection on male traits at varying sex ratios in the field cricket Gryllus pennsylvanicus. Behaviour, 126, 45–62. https://doi.org/10.1163/156853993X00335
StatSoft, Inc. (2008). STATISTICA (data analysis software system), version 8.0. USA: SAS Institute Inc.
Tovar-Sánchez, E., Cano-Santana, Z. y Oyama, K. (2003). Canopy arthropod communities on Mexican oaks at sites with different disturbance regimes. Biological Conservation, 115, 79–87. https://doi.org/10.1016/S0006-3207(03)00096-X
Walker, T. J. (1962). The taxonomy and calling song of United States tree crickets (Orthoptera: Gryllidae: Oecanthinae). I. The genus Neoxabea and the niveus and varicornis groups of the genus Oecanthus. Annals of the Entomological Society of America, 55, 303–322. https://doi.org/10.1093/aesa/55.3.303
Wiegert, R. G., Odum, E. P. y Schnell, J. H. (1967). Forb-arthropod food chains in a one-year experimental field. Ecology, 48, 75–83. https://doi.org/10.2307/1933419
Willey, B. M. y Adler, P. H. (1989). Biology of Peucetia viridans (Aranae, Oxypidae) in South Carolina, with special reference to predation and maternal care. Journal of Arachnology, 17, 257–284. https://www.jstor.org/stable/3705690
Zar, J. H. (2010). Biostatistical analysis. Upper Saddle River, Nueva Jersey: Prentice-Hall/Pearson.