James Rodríguez-Echeverry a, * y Margareth Leiton b
a Centro de Investigación para el Territorio y el Hábitat Sostenible, Universidad Tecnológica Indoamérica, Machala y Sabanilla, 170301
Quito, Ecuador
b Fundación Takiyaco, Departamento de Ecología de Paisaje, Restauración y Conservación de la Biodiversidad, Carrera 92 Núm. 2C-30,
Cali, Colombia
*Autor para correspondencia: wairajames@yahoo.com (J. Rodríguez-Echeverry)
Recibido: 28 marzo 2020; aceptado: 21 agosto 2020
Resumen
Es necesario evaluar el estado de transformación de un paisaje boscoso para poder realizar una adecuada planificación de su conservación y restauración. El objetivo de este estudio fue evaluar los cambios espacio-temporales de los ecosistemas boscosos nativos y la influencia de estos cambios en la diversidad de hábitats en la cuenca del río Mira, Ecuador, entre 1991 y 2017. La evaluación se realizó usando imágenes satelitales y métricas de paisaje. Se observó una pérdida de ecosistemas boscosos nativos de 9% a una tasa de deforestación de 0.57% año-1 asociada principalmente al incremento de los cultivos agrícolas. La pérdida de bosque nativo más alta se registró para los ecosistemas bosque seco espinoso, bosque seco interandino, bosque seco montano bajo y bosque muy húmedo premontano. Los cambios en los patrones espaciales de los ecosistemas boscosos revelaron una severa fragmentación. El índice de diversidad de Shannon disminuyó en 0.20, lo que refleja la pérdida de diversidad de hábitats boscosos nativos en relación con la pérdida y fragmentación de los ecosistemas estudiados. Se sugiere realizar la planificación de la conservación y restauración a escala de paisaje, mediante el modelo corredor-parche-matriz, el cual debe estar soportado en un marco de políticas ambientales.
Palabras clave: Biodiversidad; Conservación; Cuenca del río Mira; Deforestación; Ecuador; Paisaje; Procesos antrópicos
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Loss and fragmentation of native forest ecosystems and its influence on habitat diversity in the Tropical Andes hotspot
Resumen
It is necessary to evaluate the degree of forest landscape transformation for a proper conservation and restoration planning. The aim of this study was to evaluate the spatio-temporal changes of native forest ecosystems and the influence of these changes on habitat diversity in the Mira River watershed, Ecuador, from 1991 to 2017. The evaluation was carried out using satellite images and landscape metrics. A loss of 9% of native forest ecosystems was recorded at a deforestation rate of 0.57% year-1, which was associated with the increase in agricultural crops. The highest native forest loss was for thorny dry forest, inter-andean dry forest, low-montane dry forest, and premontane very-wet forest. Changes in the spatial patterns of forest ecosystems revealed a severe fragmentation. The Shannon diversity index decreased by 0.20, reflecting the loss of native forest habitats relative to the loss and fragmentation of the ecosystems studied. This study suggested to landscape-scale conservation and restoration planning, using the patch-corridor-matrix model, which must be complemented with land use planning and supported within a framework of environmental policies.
Keywords: Biodiversity; Conservation; Río Mira watershed; Deforestation; Ecuador; Landscape; Anthropogenic processes
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
En el último siglo, a nivel mundial, se han reportado importantes cambios en los paisajes boscosos, los cuales han sido generados por conductores de cambio global (Wu, 2013). El cambio de uso del suelo ha sido identificado como el principal conductor de cambio global (Butchart et al., 2010). Este conductor puede llevar a la pérdida y fragmentación de hábitats, las que son reconocidas como 2 de las mayores amenazas para los paisajes boscosos (Rodríguez-Echeverry, Echeverría et al., 2018). El cambio de uso del suelo modifica los patrones espaciales del paisaje boscoso (composición y configuración espacial), tales como: el área total, el número de parches, conectividad y la riqueza de parches (Lindenmayer, 2016). En consecuencia, estas alteraciones pueden causar pérdida de biodiversidad en sus diferentes niveles (Lindenmayer, 2012).
Los mayores impactos en la biodiversidad se han producido a nivel de la diversidad de hábitats de bosques nativos, como son la reducción y pérdida de hábitat (Hooftman y Bullock, 2012; Liu et al., 2014; Ren et al., 2016). Estos impactos se han generado por el aumento de la población humana, que ha transformado paisajes boscosos en paisajes antrópicos en las últimas décadas (Bai et al., 2011; Pan et al., 2013). Varios autores han evidenciado la necesidad de conservar la diversidad de hábitats de bosques nativos dentro de paisajes boscosos y antrópicos (Iverson et al., 2014), ya que esto ayudaría a mantener la diversidad de flora y fauna, y procesos y servicios ecosistémicos clave, que proveen múltiples beneficios para las poblaciones humanas que habitan estos tipos de paisajes (Delgado et al., 2013; Rodríguez-Echeverry et al., 2017).
Los hotspots son regiones con prioridad mundial para la conservación por su alta biodiversidad, alto grado de endemismo y fuerte impacto antrópico (Myers et al., 2000). Estas regiones tienen al menos 1,500 especies de plantas endémicas y han perdido al menos 70% de su hábitat original (Mittermeier et al., 2011). Actualmente, entre los 35 hotspots se encuentran los Andes Tropicales, que se caracterizan por ser el hotspot más diverso y con el mayor endemismo de plantas en el mundo. Este hotspot alberga un total de 30,000 especies de plantas nativas, de las cuales 50% son endémicas (Mittermeier et al., 2011; NatureServe y EcoDecision, 2015).
Uno de los paisajes más singulares, menos protegido y más alterado en el hotspot Andes Tropicales es el que presenta la cuenca del río Mira, en el norte de Ecuador (Ministerio del Ambiente del Ecuador, 2013). Este paisaje es considerado como un área de alto valor de conservación debido a la diversidad de ecosistemas boscosos nativos y la alta diversidad y endemismo de especies, de los cuales un importante número se encuentran bajo amenaza según la UICN. Entre los ecosistemas amenazados se encuentran el bosque seco y el bosque húmedo categorizados en peligro crítico (Ferrer-Paris et al., 2019). En cuanto a especies endémicas de flora en riesgo de extinción se encuentran Phaedranassa brevifolia (Meerow, 1987), Croton elegans (Kunth, 1817), Chamaesyce jamesonii (Boissier, 1860), entre muchas otras. En cuanto a especies endémicas de fauna en riesgo de extinción se encuentran las especies de aves Eriocnemis godini (Bourcier, 1851), Hylocharis grayi (Delattre y Bourcier, 1846), entre otras; las especies de reptiles Stenocercus chota (Torres-Carvajal, 2000), Dipsas elegans (Boulenger, 1896), entre muchas otras; la especie de mamífero Coendou quichua (Thomas, 1899) (Aguirre et al., 2011; BirdLife International, 2016; Granizo et al., 2002; Oleas y Pitman, 2003; Santiana et al., 2004a, b; Tirira, 2001; Zárate, 2005).
La alta diversidad de ecosistemas boscosos nativos y la alta riqueza de especies y endemismo en el paisaje de la cuenca del río Mira, se atribuyen al hecho de que este paisaje presenta un clima con un patrón complejo y cambiante, debido en gran parte al sistema orográfico existente, el cual presenta altitudes entre los 400 y 3,050 m snm. También debido a la influencia de las masas de aire provenientes del océano Pacífico, lo que hace que se presenten variaciones considerables de los totales pluviométricos anuales, existiendo zonas con precipitaciones anuales inferiores a los 300 mm y áreas donde las precipitaciones anuales sobrepasan los 6,000 mm (Instituto Nacional de Meteorología e Hidrología, 2005). Lo anterior hace que los bosques caducifolios y matorrales característicos de la zona interandina converjan con la vegetación siempreverde de la zona de baja altitud, formando singulares ecosistemas boscosos ecotonales (Ministerio del Ambiente del Ecuador, 2013).
A pesar de su alto valor para la conservación de la biodiversidad, diversos procesos antrópicos, tales como la agricultura intensiva, la extracción de leña y la sobreexplotación de especies nativas, han sido asociados a la degradación y pérdida de ecosistemas boscosos nativos en el paisaje de la cuenca del río Mira (Aguirre et al., 2006; Mittermeier et al., 2011; NatureServe y EcoDecision, 2015). Si bien existen pocos estudios puntuales sobre la diversidad de flora y fauna, y su estado de conservación en los diferentes ecosistemas boscosos nativos (Aguirre et al., 2006; Escribano-Ávila, 2016; Cisneros-Heredia et al., 2017), no existen estudios espacio-temporales sobre la transformación del paisaje, y en particular, de los cambios en los patrones espaciales de los ecosistemas boscosos nativos y como estos cambios impactan la diversidad de hábitats. Debido a ello, no se cuenta con información clave para planificar acciones o estrategias de conservación y restauración a escala de paisaje.
Este estudio evaluó los cambios espacio-temporales de los ecosistemas boscosos nativos y la influencia de éstos en la diversidad de hábitats en la cuenca del río Mira, norte de Ecuador, entre 1991 y 2017. Es posible esperar que la transformación del paisaje genere la pérdida y fragmentación de ecosistemas boscosos nativos, y en consecuencia estos cambios originen la pérdida de la diversidad de hábitats. La información generada en este estudio puede contribuir en la planificación de la conservación y restauración de la diversidad de hábitats de ecosistemas boscosos nativos a escala de paisaje.
Materiales y métodos
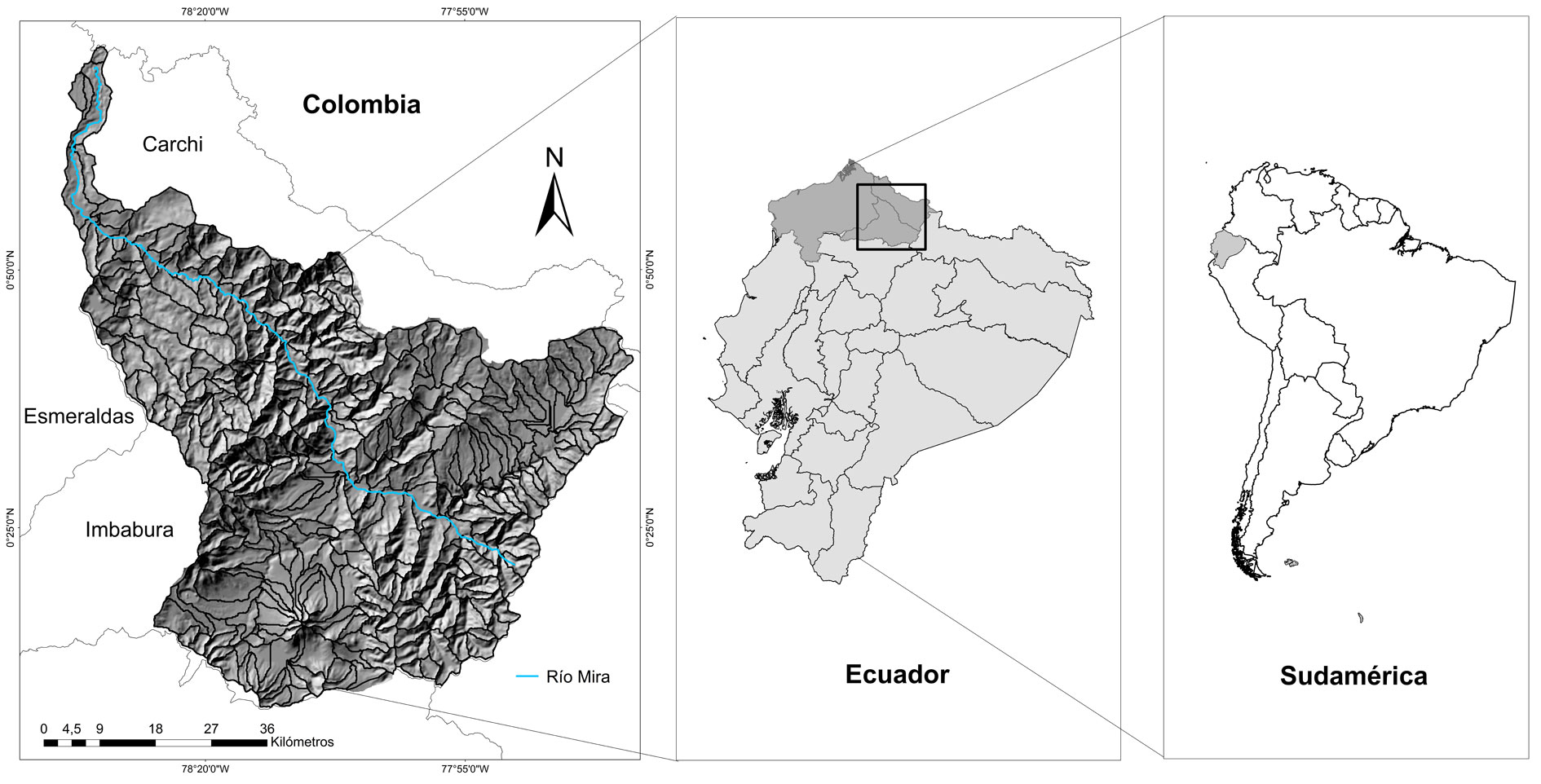
La cuenca del río Mira se localiza en la cordillera de los Andes, en las provincias de Imbabura, Carchi y Esmeraldas, en el norte de Ecuador (1º16’ N, 77º38’ O) (fig. 1). Ésta ocupa una superficie de 5,267 km2, tiene una elevación máxima de 3,050 m snm, y una temperatura media de 21.7 °C (Instituto Nacional de Meteorología e Hidrología, 2005). La cuenca tiene una población de 493,743 habitantes aproximadamente, lo que equivale a una densidad poblacional de 9 personas por km-2. La principal actividad económica que se desarrolla es la agricultura (Secretaría Nacional de Planificación y Desarrollo, 2013). El área de estudio fue dividida en 333 subcuencas, las cuales oscilaron en tamaño entre 600 y 6,000 ha. Estas subcuencas fueron definidas como las unidades de análisis espacial. La delimitación de las subcuencas y todos los análisis espaciales en el estudio se llevaron a cabo utilizando ArcGIS 10.4 (ESRI, 2016).
Se utilizaron imágenes satelitales Landsat para generar los mapas temáticos de uso de suelo para los años 1991 (TM) y 2017 (ETM+), con una nubosidad inferior de 10% y una resolución espacial de 30 × 30 m/píxel, la cual es una resolución apropiada para el análisis espacial (Daly, 2006). Las imágenes fueron corregidas geométrica, atmosférica y topográficamente (Chander et al., 2009). Las sombras proyectadas por la topografía del lugar fueron eliminadas mediante la metodología del factor C (Reese y Olsson, 2011) y para aumentar la exactitud de la clasificación fueron utilizados los índices de vegetación NDVI, SR, SAVI y LSWI (Huete, 1988; Tucker, 1979). Se realizó una clasificación supervisada para cada imagen utilizando el método estadístico de máxima verosimilitud y 750 puntos de entrenamiento tomados en campo, los cuales representan los patrones de los tipos de cobertura de suelo para la imagen del año 2017. Mientras que para la imagen de 1991 se utilizaron mapas de cobertura del suelo generados por estudios previos (Sistema Nacional de Información, 2019). La precisión en la clasificación de las imágenes se calculó por medio de matrices de confusión, a partir de un rango entre 50 y 70 puntos de validación, tomados en campo y fotografías aéreas, para cada tipo de cobertura de suelo.
Además, para una mayor exactitud en la clasificación de los diferentes ecosistemas boscosos nativos presentes en el área de estudio, se consideraron los criterios de clasificación propuestos por Aguirre et al. (2006), Holdridge (1979) y Ministerio del Ambiente del Ecuador (2013), los cuales consideran la cobertura vegetal, la temperatura, la precipitación y altitud sobre el nivel del mar para identificar la distribución espacial cada ecosistema. Por lo tanto, para esta identificación se emplearon shapefile de isotermas, isoyetas y curvas de nivel, los cuales fueron proporcionados por el Sistema Nacional de Información de Ecuador. Los tipos de ecosistemas boscosos identificados en el paisaje de la cuenca del río Mira fueron: 1) bosque seco interandino (bs-I); 2) bosque seco espinoso (bs-E); 3) bosque seco montano bajo (bs-MB); 4) bosque pluvial montano (bp-M); 5) bosque pluvial premontano (bp-PM); 6) bosque húmedo montano bajo (bh-MB); 7) bosque húmedo premontano (bh-PM); 8) bosque muy húmedo montano bajo (bmh-MB); 9) bosque muy húmedo montano (bmh-M), y 10) bosque muy húmedo premontano (bmh-PM) (tabla 1). Además, en cada mapa se identificaron las siguientes clases de coberturas o usos del suelo: vegetación arbustiva, cultivos, zona urbana, áreas sin vegetación, páramo, cuerpos de agua e infraestructura agrícola.
Los cambios en los patrones espaciales del paisaje y en los ecosistemas boscosos nativos se evaluaron determinando los cambios en las métricas área total, número de parches, longitud total de borde, área núcleo total, índice del parche más grande, distancia media al vecino más cercano, índice de agregación y riqueza de parches de hábitat (tabla 2). El análisis de estas métricas se realizó en el software FRAGSTATS (McGarigal et al., 2013). También se aplicó la siguiente fórmula para determinar la tasa de deforestación anual:
P = [(A2/A1)^(1/t2-t1) –1] x 100
donde A1 y A2 son el área del bosque en el tiempo t1 y t2, respectivamente, y P es el porcentaje de pérdida por año (Newton, 2007).
Tabla 1
Variables climáticas y altitud que determinan la presencia de los ecosistemas boscosos nativos en el paisaje de la cuenca del río Mira.
|
Ecosistemas |
Sigla |
Temperatura media anual (C°) |
Precipitacion media anual (mm) |
Altitud (m snm) |
|
Bosque seco interandino |
bs-I |
18 – 22 |
360 – 600 |
1,100 – 2,000 |
|
Bosque seco espinoso |
bs-E |
22 – 26 |
250 – 400 |
200 – 1,000 |
|
Bosque seco montano bajo |
bs-MB |
12 – 18 |
500 – 1,000 |
2,000 – 3,000 |
|
Bosque pluvial montano |
bp-M |
10 – 23 |
4,000 – 6,000 |
2,000 – 3,000 |
|
Bosque pluvial premontano |
bp-PM |
18 – 24 |
2,200 – 4,500 |
700 – 1,400 |
|
Bosque húmedo montano bajo |
bh-MB |
6 – 20 |
1,200 – 1,600 |
2,000 – 3,100 |
|
Bosque húmedo premontano |
bh-PM |
18 – 24 |
1,000 – 2,000 |
300 – 2,000 |
|
Bosque muy húmedo montano bajo |
bmh-MB |
9 – 20 |
2,600 – 3,000 |
1,400 – 2,000 |
|
Bosque muy húmedo montano |
bmh-M |
7 – 12 |
250 – 500 |
3,000 – 3,500 |
|
Bosque muy húmedo premontano |
bmh-PM |
18 – 24 |
2,000 – 4,000 |
1,000 – 2,000 |
La diversidad de hábitat de ecosistemas boscosos nativos fue analizada como proxy de biodiversidad a nivel de paisaje. Esta fue determinada por la variedad y abundancia de hábitats boscosos nativos. En primer lugar, los diferentes tipos de hábitats para cada ecosistema boscoso fueron determinados por la presencia de éstos en las diferentes zonas climáticas, tipos de suelo y pendiente del terreno, presentes en el área de estudio (tabla 3). Las zonas climáticas determinan la presencia de tipos de vegetación en el paisaje. Estas zonas están definidas por variables como la precipitación, la humedad del aire y la temperatura (Ministerio del Ambiente del Ecuador, 2013; Pourrut, 1983). Los tipos de suelo determinan el establecimiento y desarrollo de diferentes especies de plantas, debido a las propiedades físico-químicas y las características morfológicas del suelo (FAO-UNESCO, 1971; SIGTIERRAS, 2017). La pendiente del terreno permite conocer la ubicación de los distintos tipos de vegetación en un paisaje (Zúñiga, 2010). El mapeo de los tipos de hábitats de ecosistemas boscosos nativos se realizó mediante los siguientes mapas: 1) mapa de los ecosistemas boscosos, el cual fue extraído de los mapas temáticos de uso de suelo de los años 1991 y 2017; 2) mapas de zonas climáticas; 3) Mapa de tipos de suelo, y 4) mapa de pendientes del terreno, los cuales tuvieron una resolución espacial de 30 × 30 m/píxel y fueron proporcionados por el Sistema Nacional de Información y Gestión de Tierras Rurales e Infraestructura Tecnológica (SIGTIERRAS, 2017). El mapa de tipos de hábitats de ecosistemas boscosos se derivó del cálculo de la superposición de los anteriores mapas usando el programa ArcGis 10.4 (ESRI, 2016). La diversidad de hábitats se evaluó a través del índice de diversidad de Shannon, que es una métrica del paisaje que relaciona la variedad y abundancia de los diferentes tipos de hábitat boscoso (tabla 2). El índice de diversidad de Shannon se utilizó como una medida de la cantidad relativa de cada tipo de hábitat boscoso en cada unidad espacial de análisis. El índice se expresa mediante la siguiente fórmula (McGarigal et al., 2013):
H = – ∑si=1 [(Pi) × (ln Pi)]
donde Pi es la proporción del paisaje ocupado por el hábitat tipo “i”. El análisis del índice de diversidad de Shannon se realizó en el software FRAGSTATS (McGarigal et al., 2013). Se ingresó un mapa de los tipos de hábitat en el programa y se obtuvieron valores del índice de diversidad de Shannon para cada subcuenca o unidad espacial de análisis.
Tabla 2
Métricas del paisaje usadas para el análisis de patrones espaciales de los ecosistemas boscosos nativos en el paisaje de la cuenca del río Mira.
|
Métrica |
Descripción |
Unidad de medida |
Rango de variación |
|
Área total |
Área total de la cobertura de uso de suelo |
Hectáreas |
Área > 0, sin límite |
|
Número de parches |
Número de praches en el paisaje |
Ninguna |
NP ≥ 1, sin límite |
|
Longitud total de borde |
Es igual a la suma de las longitudes de todos los segmentos de borde que involucran el tipo de parche correspondiente |
Kilómetros |
TE ≥ 0, sin límite |
|
Área núcleo total |
Área núcleo del bosque nativo, especificada por la profundidad de borde según vecindad del parche con otros usos del suelo |
Hectáreas |
CORE ≥ 0 y sin límite |
|
Índice del parche más grande |
Porcentaje del área del parche de bosque nativo más grande respecto al área total del paisaje |
Porcentaje |
0 < LPI £ 100 |
|
Distancia media al vecino más cercano |
Proximidad de los parches de bosque nativo, basado en la distancia media ponderada |
Kilómetros |
ENN > 0 y sin límite |
|
Índice de agregación |
Desviación proporcional de adyacencias que implica la clase de bosque nativo a partir de la esperada para una distribución espacialmente aleatoria |
Porcentaje |
-1 CLUMPY 1 |
|
Riqueza de parches de hábitat |
Número de diferentes tipos de parches de hábitat |
Ninguna |
PR > 1 y sin límite |
|
Índice de diversidad de Shannon |
Es la abundancia proporcional de cada tipo de parche |
Ninguna |
SHDI ≥ 0 y sin límite |
Resultados
La precisión de la clasificación de la imagen del año 1991 fue de 89%. En este año, el bs-I obtuvo una precisión de 91%, mientras que la vegetación arbustiva fue la menos precisa con 78%. Para el año 2017, la precisión de la clasificación se estimó en 83%, para este año, el bs-I obtuvo una precisión de 92%, mientras que el páramo fue la clase menos precisa con 77%.
El paisaje de la cuenca del río Mira posee un área aproximada de 526,700 ha, de las cuales 197,652 ha estaban constituidas por ecosistemas boscosos nativos en 1991, disminuyendo a 170,480 ha al año 2017 (fig. 2). Es decir, en 26 años hubo una pérdida de 9% de cobertura de ecosistemas boscosos, con una tasa de deforestación de 0.57% año–1. La pérdida de cobertura más alta se registró para el bs-E, bs-I, bs-MB y bmh-PM en 65%, 46%, 34% y 18%, respectivamente, con una tasa de deforestación del 4.0%, 2.3%, 1.6% y 0.8% año–1. Cultivos fue la cobertura dominante en el paisaje de la cuenca del río Mira durante todo el periodo de estudio (fig. 2).
Durante los 26 años de estudio los 10 ecosistemas boscosos registraron un importante incremento en el número de parches. Los mayores incrementos en este índice se registraron para los ecosistemas bs-E, bs-I y bmh-PM en 196%, 173% y 158%, respectivamente (tabla 4). Los ecosistemas que registraron el mayor incremento en la longitud total de borde fueron bs-E (903 km), bmh-M (785 km), bmh-PM (406 Km) y bs-I (261 km). Se observó que los ecosistemas bs-E, bs-I y bs-MB registraron las mayores pérdidas de área núcleo en 22%, 20% y 20%, respectivamente; mientras que el ecosistema bmh-M reportó un incremento de 32% en el área núcleo (tabla 4), lo que concuerda con un incremento de 27% en su área total (fig. 2). El índice del parche más grande disminuyó para los ecosistemas bmh-PM, bs-MB, bs-E y bs-I e incremento para el bmh-M. Lo anterior tiene relación con el incremento de la distancia media entre parches de bs-E (185.5m), bs-MB (74.6m), bmh-PM (44.3m) y bs-I (15m) y la disminución de esta distancia para los parches del bmh-M (80.2m), mientras que el bh-MB no registró cambios en la distancia media entre parches. Por otra parte, los ecosistemas que reportaron las mayores disminuciones en el índice de agregación fueron bs-I, bs-MB y bmh-PM en un 6.3, 3.4 y 2.0, respectivamente; mientras que los ecosistemas bmh-M y bp-M no presentaron cambios en su agregación durante los 26 años de estudio (tabla 4).
Tabla 3
Variables abióticas que determinan los diferentes tipos de hábitats de ecosistemas boscosos nativos en el paisaje de la cuenca del río Mira.
|
Ecosistema |
Variables abióticas |
||
|
Zona Climática |
Tipo de suelo |
Pendiente (Grados) |
|
|
bs-I |
Mgt-Cl, Mst-Tc y Mst-Sc |
Alfisol, Andisol, Aridisol, Entisol, Inceptisol y Molisol |
0-20; > 20 |
|
bs-E |
Mgt-Cl y Mst-Sc |
Andisol, Entisol, Inceptisol y Molisol |
0-20; > 20 |
|
bs-MB |
Mgt-Cl, Mst-Tc y Mst-Sc |
Alfisol, Andisol, Entisol, Inceptisol y Molisol |
0-20; > 20 |
|
bp-M |
Mst-Tc y Mst-Tf |
Andisol, Inceptisol y Molisol |
0-20; > 20 |
|
bp-PM |
Mgt-Cl y Mst-Sc |
Alfisol, Andisol, Entisol y Inceptisol |
0-20; > 20 |
|
bh-MB |
Mst-Tc y Mst-Tf |
Andisol, Entisol, Inceptisol y Molisol |
0-20; > 20 |
|
bh-PM |
Mgt-Cl, Mst-Sc, Mst-Tc |
Alfisol, Andisol, Entisol, Inceptisol y Molisol |
0-20; > 20 |
|
bmh-MB |
Mst-Tc y Mst-Tf |
Alfisol, Andisol, Entisol, Inceptisol y Molisol |
0-20; > 20 |
|
bmh-M |
Mst-Tc y Mst-Tf |
Andisol, Entisol, Inceptisol y Molisol |
0-20; > 20 |
|
bmh-PM |
Mst Tc |
Alfisol, Andisol, Entisol, Inceptisol y Molisol |
0-20; > 20 |
Características de las zonas climáticas y tipos de suelo:
Mgt-Cl = megatérmico o cálido: precipitación < 500 mm; temperatura media entre 20 y 28 oC; insolación entre 1,000 y 1,500 horas; humedad relativa 60%; 12 meses secos. Déficit hídrico > 900 mm. Mst-Sc = mesotérmico semicálido: precipitación < 1,000 mm; temperatura media < 22 oC; insolación entre 1,800 y 2,500 horas; humedad relativa 65%; 10 meses secos. Déficit hídrico entre 150 y 600 mm. Mst-Tc = mesotérmico templado cálido: precipitación entre 500 y 2,000 mm; temperatura entre 12 y 22 oC; insolación entre 1,000 y 2,000 horas; humedad relativa 75%; 6 meses secos. Déficit hídrico < 150 mm. Mst-Tf = mesotérmico templado frío: precipitación entre 800 y 2,000 mm; temperatura media < 12 oC; insolación entre 1,000 y 2,200 horas; humedad relativa > 80%; 4 meses secos. Déficit hídrico < 100 mm. Alfisol: suelos minerales con buen grado de desarrollo edafogenético. Tienen una saturación de bases < 35% y alta reserva de nutrientes. Recomendados para explotaciones de ciclo corto. Poseen poca inflitración de agua. Andisol: se desarrollan a partir de depósitos volcánicos. Tienen excelentes condiciones físicas y morfológicas. Poseen alto contenido de arcillas y complejo de humus-aluminio. Tiene buen drenaje y retención de humedad. Aridisol: suelos minerales que se encuentran en áreas secas, muy secas y cálidas. Tienen un regímen de humedad arídico y presencia de sales que limitan el crecimiento vegetal. Tienen poca fertilidad. Entisol: suelos de más baja evolución. Se encuentran en fuertes pendientes. Poseen elementos gruesos, susceptibles a inundaciones y a la saturación de agua. Inceptisol: suelos con meteorización extrema y propiedades físicas y químicas muy variables. Tienen saturación de bases alrededor del 60%. Recomendados para el desarrollo de cultivos agrícolas. Molisol: suelos ricos en materia orgánica y bases de cambio. Tiene excelentes propiedades físicas para el desarrollo radicular. Se dasarrollan en gran variedad de regímenes climáticos.
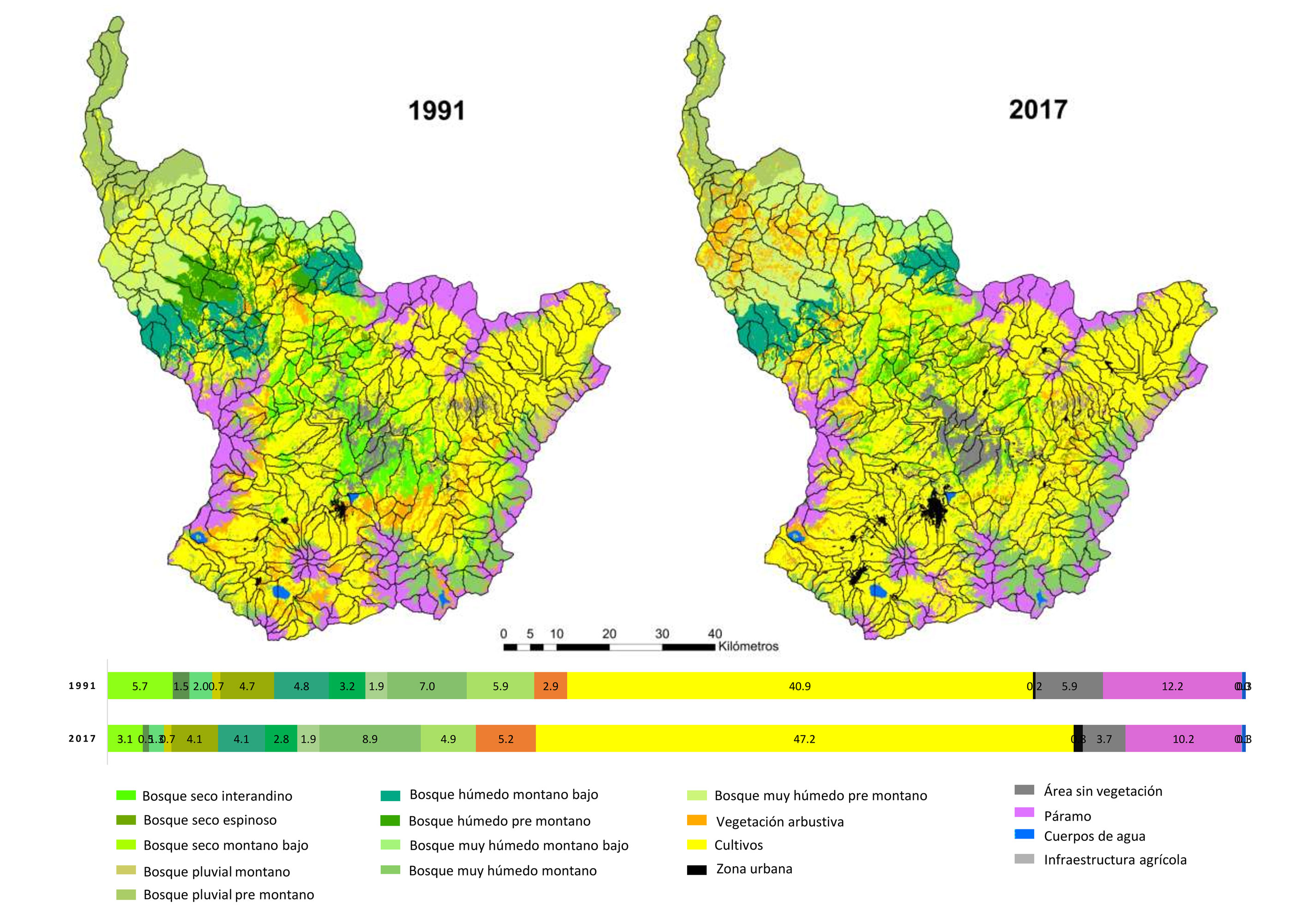
Los 10 ecosistemas boscosos nativos estuvieron distribuidos espacialmente a través del paisaje estudiado (fig. 2). Estos registraron un total de 177 tipos de hábitats. Los ecosistemas bs-I (30), bs-MB (22), bs-E (20), bh-PM (18), bmh-MB (18) y bmh-M (18) registraron el mayor número de tipos de hábitats; mientras que los ecosistemas bp-PM (12) y bp-M (6) registaron el menor número de tipos de hábitat.
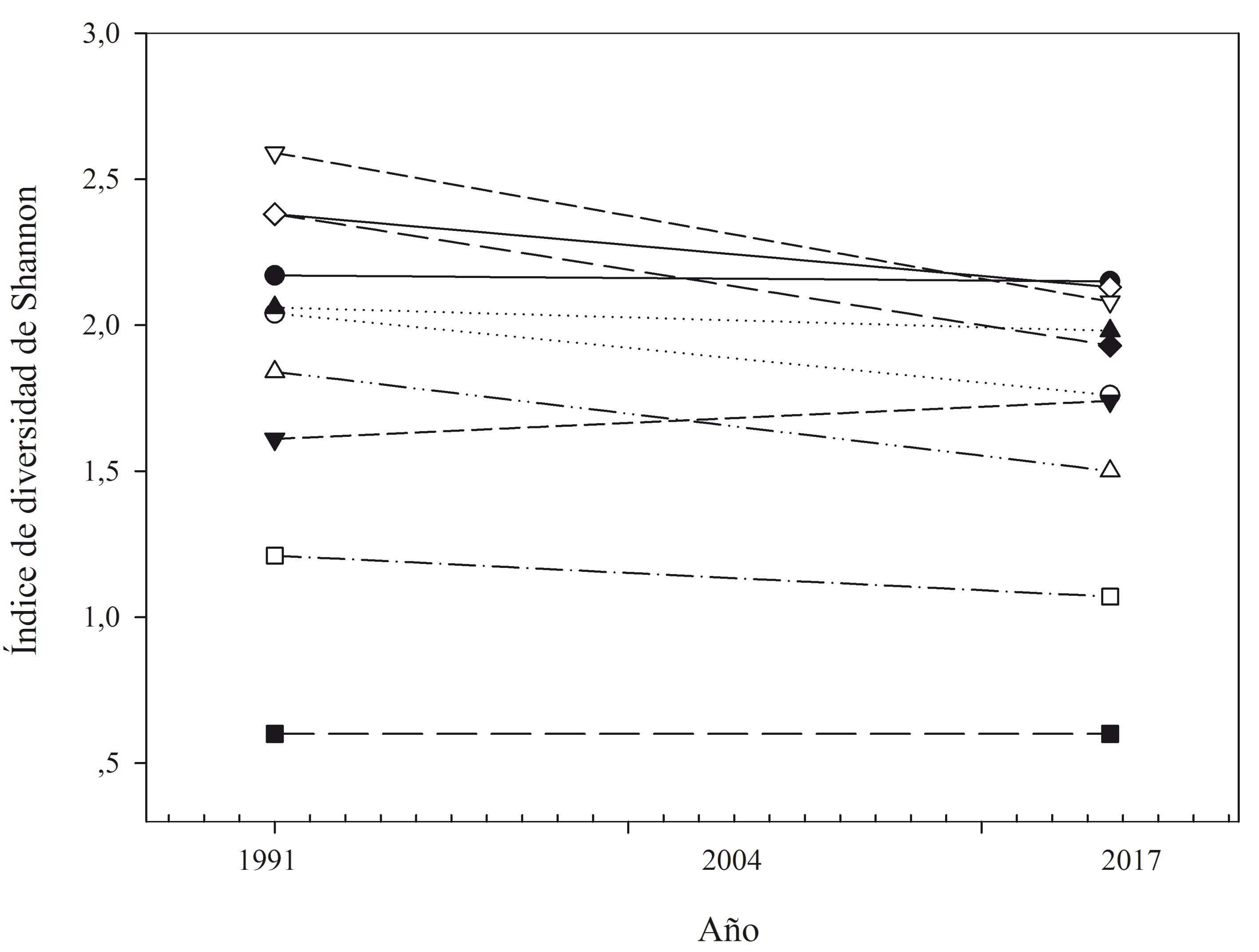
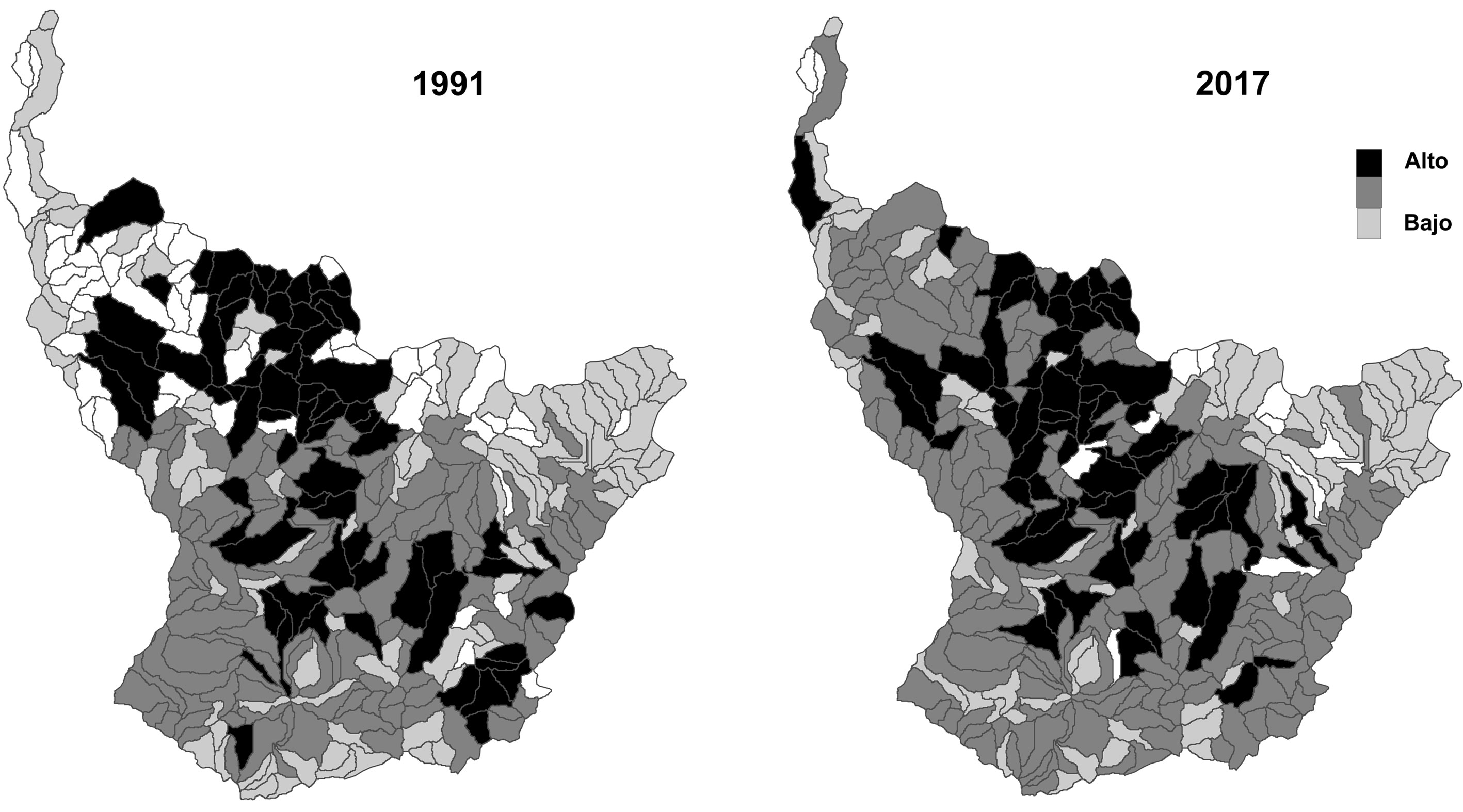
Se registró una pérdida promedio de 0.20 en el índice de diversidad de Shannon durante los 26 años de estudio (fig. 3). Los ecosistemas bs-I, bs-MB y bmh-PM registraron las mayores pérdidas en diversidad de hábitat con una disminución de 0.51, 0.45 y 0.34, respectivamente, en el índice de diversidad de Shannon (fig. 3). El índice de riqueza de parches de hábitat fue de 17.1 y 17.08 en 1991 y 2017, respectivamente. En 1991, 70 subcuencas registraron alta diversidad de hábitats boscosos (> 2.0), lo que representó 21% de las subcuencas. Para el año 2017, el número de subcuencas con alta diversidad se redujó a 59, lo que representó 18% del total de las subcuencas estudiadas (fig. 4).
Discusión
Este estudio reveló una importante pérdida de ecosistemas boscosos nativos entre 1991 y 2017. Esta pérdida ocurrió principalmente por el reemplazo de ecosistemas boscosos por cultivos agrícolas. La tasa de pérdida (0.57% año–1) reportada en este estudio es similar a la registrada en otros paisajes hotspot que también han sido significativamente transformados, tales como: el Bosque Templado Valdiviano en Chile (0.5% año–1) (Rodríguez-Echeverry, Echeverría et al., 2018) y el hotspot de las montañas del Arco Oriental de Tanzania (0.5% año–1) (Green et al., 2013). La tasa de pérdida de bosque más intensa reportada en este estudio fue para los ecosistemas bs-E (4.0% año–1), bs-I (2.3% año–1), bs-MB (1.6% año–1) y bmh-PM (0.8% año–1). Una tasa de pérdida menor fue registrada en el bosque espinoso en Chile central (0.7% año–1) (Schulz et al., 2010), en el bs-I (1.2% año–1) y en el bs-MB (1.2% año–1) en las provincias de Loja y Zamora Chinchipe en Ecuador (Tapia-Armijos et al., 2015). A su vez, este último estudio reportó una tasa de pérdida mayor para el bmh-PM (6% año–1).
Se estima que en Ecuador, la pérdida de bosques es cercana a 80%, como consecuencia principal de la conversión de este ecosistema a cultivos agrícolas (Ferrer-Paris et al., 2019; Paladines, 2003). En el paisaje de estudio, el bosque seco fue el ecosistema más impactado. El proceso de deforestación de bosques secos se caracteriza comúnmente por su conversión a tierras agrícolas, el cual se concentra principalmente en los valles y laderas más bajas, con pequeños parches de bosque que permanecen dentro de las áreas más impactadas. De tal modo que la accesibilidad del terreno, la cual depende directamente de la pendiente, puede ser un factor determinante en el inicio del proceso de deforestación a causa de la necesidad humana de expandir la frontera agrícola.
Tabla 4
Cambios en los índices de patrones del paisaje en la cuenca del río Mira entre 1991 y 2017.
|
Ecosistema |
Métrica Año |
Número de parches |
Longitud total de borde |
Área núcleo total |
Índice del parche más grande |
Distancia al vecino más cercano |
Índice de agregación |
|
bs-I |
1991 |
1,084 |
3,291.6 |
15,186 |
1.1 |
138.5 |
91.5 |
|
2017 |
1,871 |
3,551.5 |
12,123 |
0.2 |
153.5 |
85.2 |
|
|
bs-E |
1991 |
360 |
531.9 |
681 |
3.1 |
202.1 |
86.1 |
|
2017 |
706 |
1,434.9 |
530 |
1.6 |
387.5 |
85.6 |
|
|
bs-MB |
1991 |
261 |
956.1 |
5,379 |
2.5 |
107.1 |
93.5 |
|
2017 |
324 |
961.9 |
4,322 |
0.3 |
181.6 |
90.1 |
|
|
bp-M |
1991 |
27 |
186.2 |
2,732 |
0.7 |
142.5 |
96.4 |
|
2017 |
33 |
213.9 |
2,667 |
0.6 |
146.9 |
96.4 |
|
|
bp-PM |
1991 |
52 |
687.9 |
21,920 |
4.7 |
111.5 |
98.7 |
|
2017 |
65 |
887.8 |
22,262 |
4.0 |
117.1 |
97.7 |
|
|
bh-MB |
1991 |
223 |
1,164.3 |
18,160 |
0.2 |
213.6 |
96.7 |
|
2017 |
302 |
1,308.2 |
18,813 |
0.1 |
213.6 |
95.6 |
|
|
bh-PM |
1991 |
182 |
1,041.9 |
11,566 |
1.9 |
137.5 |
95.6 |
|
2017 |
224 |
1,074.3 |
10,967 |
1.6 |
156.6 |
94.8 |
|
|
bmh-MB |
1991 |
15 |
198.4 |
9,567 |
1.9 |
220.9 |
98.4 |
|
2017 |
20 |
307.1 |
8,628 |
1.8 |
230.1 |
97.7 |
|
|
bmh-M |
1991 |
1,149 |
3,345.9 |
22,369 |
2.9 |
296.9 |
93.5 |
|
2017 |
1,474 |
4,131.3 |
29,462 |
4.4 |
216.7 |
93.5 |
|
|
bmh-PM |
1991 |
197 |
1,515.9 |
22,670 |
5.2 |
117.3 |
96.4 |
|
2017 |
311 |
1,921.6 |
21,753 |
2.3 |
161.6 |
94.5 |
Se observó que las mayores pérdidas de cobertura boscosa estuvieron asociadas con los mayores incrementos en el número de parches de bs-E (196%), bs-I (173%), bmh-PM (156%) y bs-MB (124%), y con las mayores pérdidas de sus áreas núcleo durante los 26 años de estudio. El incremento en el número de parches es uno de los principales síntomas de la fragmentación. De tal modo que la división de un gran parche genera numerosos parches de menor tamaño y menor área núcleo (Lindenmayer y Fischer, 2006). Las áreas núcleo proveen las condiciones bióticas y abióticas óptimas que permiten mantener la biodiversidad y los procesos ecológicos (Bennett, 2003; Isaac-Cubides y Ariza, 2016). Por lo tanto, en la medida que los parches de bosque sean más pequeños la contribución de su área núcleo será menor, así como la integridad de la cobertura. La tendencia en fragmentación y reducción en el área núcleo reportadas en este estudio es similar a la observada en bosques nativos de otros paisajes que también son áreas de alta prioridad de conservación mundial (Arcila et al., 2012; Echeverría et al. 2006; Otavo y Echeverría, 2017). Si en el paisaje estudiado continúa la trayectoria de pérdida y fragmentación de los ecosistemas boscosos, y en particular del bosque seco, se podrían esperar diferentes impactos en procesos ecológicos como en la regeneración de plantas, la dispersión de semillas, el crecimiento y supervivencia de las plantas, entre otros, los que a su vez podrían afectar la disponibilidad de hábitat y alimento para diversas especies de flora y fauna en riesgo de extinción como Coursetia gracilis (Lavin), E. godini (Bourcier, 1851), S. chota (Torres-Carvajal, 2000), entre muchas otras. Por ejemplo, la fragmentación y pérdida de área núcleo de bosque nativo en el sur de Chile redujo la disponibilidad de hábitat para Fitzroya cupressoides, lo que incrementó su riesgo de extinción (Rodríguez-Echeverry et al., 2015). En Ohio, EUA, la diversidad de salamandras se asoció positivamente con la cantidad de área núcleo, por lo tanto, la presencia de áreas núcleo boscosas son críticas para la preservación de la diversidad de estos anfibios (Porej et al., 2004).
En el paisaje de la cuenca del río Mira se observó una importante disminución en el índice del parche más grande para los ecosistemas Bs-I, bs-E, bmh-PM y bs-MB. Algunos estudios han registrado que la deforestación modifica el tamaño de los parches de bosque, y esto a su vez altera la estructura del bosque y la composición de especies (Altamirano et al., 2007; Echeverría et al., 2007; Fontúrbel y Jiménez, 2014; Rodríguez-Echeverry et al., 2015). En consecuencia, la probabilidad de disponibilidad de hábitat para mamíferos y aves en riesgo de extinción es menor a medida que la diversidad estructural del parche disminuye (Fontúrbel y Jiménez, 2014; Moreira-Arce et al., 2016; Moreno-García et al., 2014). Por lo tanto, si la trayectoria actual de disminución del tamaño de parches en el paisaje estudiado continúa, se puede esperar un declive en la disponibilidad de hábitat, lo que podría aumentar el riesgo de extinción de especies amenazadas presentes en estos ecosistemas, tales como: C. quichua (Thomas, 1899), H. grayi (Delattre y Bourcier, 1846), D. elegans (Boulenger, 1896), entre otras.
Un incremento en la distancia entre parches de hábitats boscosos, como el descrito para los ecosistemas Bs-I, bs-E, bmh-PM y bs-MB, es uno de los factores que afecta la conectividad funcional entre parches y altera la capacidad de dispersión de acuerdo con las condiciones de la matriz del paisaje (Bennett, 2003; Uezu y Metzger, 2011). Esto conlleva, a su vez, a un incremento del riesgo de extinciones locales, debido al aumento de la vulnerabilidad de las especies ante procesos estocásticos, catástrofes naturales, amenazas humanas y pérdida de variabilidad genética (Bennett, 2003; Lindenmayer y Fischer, 2006). Algunos investigadores han reportado que la interrupción de la conectividad del paisaje puede tener consecuencias sustanciales para la distribución y persistencia de poblaciones y, por lo tanto, en la preservación de la diversidad de especies (Altamirano et al., 2007; Echeverría et al., 2007; Rouget et al., 2003; Zebisch et al., 2003). De acuerdo a los hallazgos en este estudio, la pérdida y fragmentación de los ecosistemas Bs-I, bs-E, bmh-PM y bs-MB impactaría la conectividad funcional entre los parches de bosque, lo que alteraría la capacidad de dispersión de las poblaciones de especies de flora endémicas y amenazadas de P. brevifolia (Meerow, 1987), C. elegans (Kunth, 1817), Coursetia gracilis (Lavin), C. jamesonii (Pierre Edmond Boissier, 1860), entre otras.
Los ecosistemas bs-E, bmh-M, bmh-PM y bs-I, registraron los mayores incrementos en la longitud de borde. Un cambio común en el patrón del paisaje debido a la fragmentación es el aumento de la longitud de borde en los parches de bosque (Lindenmayer y Franklin, 2002). El incremento de la longitud de borde se relaciona con el aumento del efecto de borde, el cual consiste en profundas modificaciones de condiciones biológicas y físicas que pueden ocurrir de los bordes hacía el interior de los parches. En este sentido, algunos estudios han evidenciado que el incremento del borde de parches de bosques fragmentados puede afectar negativamente las poblaciones de algunas especies que requieren hábitats al interior de parches (Cornelius et al., 2000; Echeverría et al., 2007). Ocho de los 10 ecosistemas boscosos registraron disminución en su agregación, lo que se observó en mayor magnitud para los ecosistemas bs-I, bs-MB y bmh-PM. Algunos estudios han registrado la disminución en la agregación de ecosistemas boscosos debido al incremento del uso de suelo antrópico (Echeverría et al., 2006; Otavo y Echeverría, 2017; Rodríguez-Echeverry, Fuentes et al., 2018). En este estudio, los cultivos incrementaron su área durante los 26 años de estudio, constituyendose en la matriz del paisaje. De tal modo que la mayoría de los ecosistemas disminuyeron su agregación a medida que incrementó el área de cultivos.
Es importante destacar que el bmh-M fue el único ecosistema que registró un incremento en su área total, lo que estuvo asociado al incremento de su área núcleo, del índice del parche más grande, disminución de la distancia al vecino más cercano y la no modificación en su agregación durante los 26 años de estudio. El incremento en el área del bmh-M también estuvo asociado con el incremento en el número de parches y la longitud de borde total observada, esto debido a nuevas áreas del paisaje que registran la presencia de este ecosistema. El bmh-M se encuentra ubicado en áreas de fuertes pendientes, lo que hace difícil el acceso a este tipo de cobertura, constituyéndose esto, posiblemente, en un factor importante en la no alteración de este ecosistema.
Los resultados evidencian que los cambios espacio-temporales de los ecosistemas boscosos nativos, debido al uso de suelo antrópico, están relacionados con la pendiente del terreno. Este patrón de cambio es similar al registrado en los ecosistemas nativos en el Parque Natural Cabo de Gata-Níjar, España, entre 1957 y 1994 (Alados et al., 2003), y en las áreas protegidas Cotacachi-Cayapas, Mache Chindul y Mataje Cayapas, Ecuador, entre 2000 y 2008 (Cuenca y Echeverría, 2017). Los ecosistemas boscosos en pendientes suaves y moderadas tienen una mayor probabilidad de cambio debido a la accesibilidad del terreno para el uso de suelo antrópico. Por lo tanto, la directa relación entre pendiente del terreno y uso de suelo es una variable significativa que puede explicar los cambios de los patrones espaciales de los ecosistemas boscosos nativos (Laurance et al., 2002; Wilson et al., 2005).
Los resultados evidencian que hubo una importante pérdida de diversidad (0.20) entre 1991 y 2017 de los ecosistemas boscosas nativos. Esta tendencia en la pérdida de diversidad es similar a la reportada en otros paisajes boscosos con alta prioridad de conservación, donde la diversidad de hábitat registró una alta transformación (Benini et al., 2010; Rodríguez-Echeverry, Echeverría et al., 2018; Wan et al., 2015; YuhaiBao et al., 2011). En el paisaje de la cuenca del río Mira, la pérdida de diversidad se asoció con una ligera pérdida en la riqueza de parches de hábitat boscoso (0.02). Ambas pérdidas se debieron a la deforestación y fragmentación de los ecosistemas boscosos nativos. Lo anterior, demuestra que la principal transformación de los ecosistemas boscosos fue en la abundancia de los diferentes tipos de hábitat, pero no en la riqueza de estos. Es decir, después de 26 años se mantuvo la variedad de tipos de hábitat boscosos pero algunas áreas ocupadas por estos fueron altamente transformadas, lo que generó la pérdida de diversidad. Este estudio indica que si la trayectoria actual de pérdida y fragmentación de ecosistemas boscosos nativos continúa, en particular para el bs-I, bs-MB y bmh-PM, se esperan importantes pérdidas en la diversidad de sus hábitats, lo que a su vez podría generar importantes impactos en la biodiversidad.
Los resultados indican que la distribución de la diversidad de hábitats boscosos varió espacialmente en toda la cuenca. Esta variación está determinada por los diferentes factores abióticos, como clima regional, el suelo y la topografía. Es importante destacar que la presencia de la diversidad de hábitats boscosos y su variación espacial también puede depender del cambio de uso del suelo, el cual aumentó en las últimas décadas debido a la expansión progresiva de los cultivos agrícolas. Aunque hubo una disminución en la presencia de la diversidad de hábitats boscosos durante los años de estudio, en el año 2017 se reportó que 59 subcuencas (casi 20% de las subcuencas estudiadas) registraron la más alta diversidad. Por lo tanto, estas subcuencas son las áreas del paisaje en las que se recomienda realizar esfuerzos de conservación. Mientras que para las subcuencas que registraron una media y baja diversidad de hábitats boscosos se recomienda llevar a cabo esfuerzos de restauración ecológica. Por lo tanto, estos resultados proporcionan conocimiento clave para la planificación de la conservación y restauración a escala de paisaje.
Se registró una progresiva pérdida y fragmentación en 9 de los 10 ecosistemas boscosos nativos en el paisaje de la cuenca del río Mira, destacándose el bs-E, bs-I y bs-MB como los ecosistemas más impactados. Este estudio evidenció una importante pérdida de diversidad de hábitats boscosos, la que estuvo relacionada con la pérdida y fragmentación de los ecosistemas estudiados. Considerando que el paisaje de la cuenca del río Mira hace parte del hotspot Andes Tropicales, y de acuerdo con lo reportado en este estudio, se justifica aún más la urgencia de conservar los diferentes ecosistemas boscosos nativos y su diversidad de hábitats en pro de mantener los altos niveles de biodiversidad y endemismo que registra
este hotspot.
Este estudio constituye el análisis más extenso sobre los cambios espacio-temporales de ecosistemas boscosos nativos y su diversidad de hábitats realizado en Ecuador. En consecuencia, contribuye con una mejor comprensión de la influencia de los cambios espacio-temporales de los ecosistemas boscosos nativos en la diversidad de hábitats. Los resultados identifican, a escala de paisaje, las áreas donde se puede realizar la planificación de la conservación y restauración de la diversidad de hábitats boscosos en la cuenca del río Mira.
Se sugiere realizar la planificación de la conservación y restauración a escala de paisaje, ya que ésta ofrece una alternativa para disminuir y evitar la degradación de los ecosistemas, y al mismo tiempo garantiza la participación de los diferentes niveles de gobierno y la comunidad en este proceso (Rodríguez-Echeverry y Leiton, 2019). En este sentido, es importante destacar el modelo corredor-parche-matriz como estrategia para la planificación (Lindenmayer y Franklin, 2002). Este modelo es apropiado debido a la configuración actual del paisaje de la cuenca del río Mira, la cual consiste en subcuencas con alta, media y baja diversidad, y los ecosistemas boscosos restringidos en parches distribuidos en el paisaje. El objetivo principal del modelo corredor-parche-matriz es mantener e incrementar la variedad y abundancia de los tipos de parche de bosque a través del manejo de la matriz. Por lo tanto, el manejo de la matriz debe centrarse en las áreas “sensitive buffer” que mejoran la conectividad entre parches de bosque y aumentan la capacidad de la matriz para mantener la biodiversidad (Rodríguez-Echeverry y Leiton, 2019). En consecuencia, y de acuerdo con el estado de diversidad de cada subcuenca, el manejo de la matriz debe implicar la restauración de los ecosistemas boscosos en las áreas “sensitive buffer”, con lo cual se mejoraría la conectividad de los ecosistemas y se incrementaría la diversidad de hábitats y la conservación de las diferentes especies de flora y fauna en riesgo de extinción. También el manejo de la matriz debe implicar la implementación de prácticas de producción sostenible como la agroforestería en las áreas “sensitive buffer”, lo que podría reducir los impactos al interior de los parches de bosques y en consecuencia contribuir en su conservación. El diseño e implementación de esta estrategia requiere la evaluación e identificación de las áreas “sensitive buffer” y su conectividad. Además, esta estrategia debe estar complementada con la planificación de uso del suelo y soportada en un marco de políticas ambientales que garanticen el compromiso y participación activa del gobierno ecuatoriano y la comunidad en general. Por último, se sugiere que futuras investigaciones aborden las causas de transformación del paisaje de la cuenca del río Mira y la pérdida de ecosistemas boscosos, con el fin de ser incluidas en la toma de acciones para la conservación y restauración de la biodiversidad y planificación del territorio.
Agradecimientos
Al proyecto “Planificación para la sustentabilidad ambiental del territorio de la cuenca del río Mira, Ecuador”, del cual hizo parte esta investigación. A los comentarios recibidos de los revisores anónimos.
Referencias
Aguirre, Z., Kvist, L. P. y Sánchez, O. (2006). Bosques secos en Ecuador y su diversidad, En M. Moraes, B. Ollgaard, L. P. Kvist, F. Borchsenius y H. Balslev (Eds.), Botánica económica de los Andes Centrales (pp. 162–187). La Paz, Boliva: Universidad Mayor de San Andrés.
Aguirre, Z., Román, J. L., Montalvo, D., Cevallos, G., Albuja, L., Arguero, A. et al. (2011). Biodiversidad de los valles secos interandinos del Ecuador. Quito: Ecuaoffset, Escuela Politécnica Nacional.
Alados, C. L., Pueyo, Y., Barrantes, O., Escós, J., Giner, L. y Robles, A. B. (2003). Variations in landscape patterns and vegetation cover between 1957 and 1994 in a semiarid Mediterranean ecosystem. Landscape Ecology, 19, 543–559. https://doi.org/10.1023/B:LAND.0000036149.96664.9a
Altamirano, A., Echeverría, C. y Lara, A. (2007). Efecto de la fragmentación forestal sobre la estructura vegetacional de las poblaciones amenazadas de Legrandia concinna (Myrtaceae) del centro-sur de Chile. Revista Chilena de Historia Natural, 80, 27–42. http://dx.doi.org/10.4067/S0716-078X2007000100003
Arcila, A. M., Valderrama, C. y Chacón-de Ulloa, P. (2012). Estado de fragmentación del bosque seco de la cuenca alta del río Cauca, Colombia. Biota Colombiana, 13, 86–100.
Bai, Y., Zhuang, C., Ouyang, Z., Zheng, H. y Jiang, B. (2011). Spatial characteristics between biodiversity and ecosystem services in a human-dominated watershed. Ecological Complex, 8, 177–183. https://doi.org/10.1016/j.ecocom.2011.01.007
Bao, Y., Bao, S. y Shan, Y. (2011). Analysis on temporal and spatial changes of landscape Pattern in Dalinor lake Wetland. Procedia Environmental Sciences, 10, 2367–2375. https://doi.org/10.1016/j.proenv.2011.09.369
Benini, L., Bandini, V., Marazza, D. y Contin, A. (2010). Assessment of land use changes through an indicator-based approach: a case study from the Lamone river basin in Northern Italy. Ecological Indicator, 10, 4–14. https://doi.org/10.1016/j.ecolind.2009.03.016
Bennett, A. F. (2003). Linkages in the landscape: the role of corridors and connectivity in wildlife conservation. Gland, Switzerland, Cambridge: IUCN.
BirdLife International. (2016). Eriocnemis godini. The IUCN Red List of Threatened Species 2016: e.T22687922A93175117. Recuperado el 10 Mayo, 2019 de: http://dx.doi.org/10.2305/IUCN.UK.2016-3.RLTS.T22687922A93175117.en
Butchart, S. H. M., Walpole, M., Collen, B., van Strien, A., Scharlemann, J. P. W., Almond, R. A. E. et al. (2010). Global biodiversity: indicators of recent declines. Science, 328, 1164–1168. http://doi.org/10.1126/science.1187512
Chander, G., Markham, B. L. y Helder, D. L. (2009). Summary of current radiometric calibration coefficients for Landsat MSS, TM, ETM+, and EO-1 ALI sensors. Remote Sensing of Environment, 113, 893–903. https://doi.org/10.1016/j.rse.2009.01.007.
Cisneros-Heredia, D. F., Almendáriz, A. y Yánez-Muñoz, M. (2017). Dipsas elegans. The IUCN Red List of Threatened Species 2017: e.T50951285A50951294. Recuperado el 10 Mayo, 2019 de: http://dx.doi.org/10.2305/IUCN.UK.2017-2.RLTS.T50951285A50951294.en
Cornelius, C., Cofre, H. y Marquet, P. (2000). Effects of habitat fragmentation on bird species in a relict temperate forest in semiarid Chile. Conservation Biology, 14, 534–543. http://doi.org/10.1046/j.1523-1739.2000.98409.x
Cuenca, P. y Echeverría, C. (2017). How do protected landscapes associated with high biodiversity and population levels change? Plos One, 12, e0180537. https://doi.org/10.1371/journal.pone.0180537
Daly, C. (2006). Guidelines for assessing the suitability of spatial climate data sets. International Journal of Climatology, 26, 707–721. https://doi.org/10.1002/joc.1322.
Delgado, L. E., Sepúlveda, M.B. y Marín, V. H. (2013). Provision of ecosystem services by the Aysén watershed, Chilean Patagonia, to rural households. Ecosystem Services, 5, 102–109. https://doi.org/10.1016/j.ecoser.2013.04.008
Echeverría, C., Coomes, D., Salas, J., Rey-Benayas, J. M., Lara, A. y Newton, A. (2006). Rapid deforestation and fragmentation of Chilean temperate forests. Biological Conservation, 130, 481–494. http://doi.org/10.1016/j.biocon.2006.01.017.
Echeverría, C., Newton, A., Lara, A., Rey-Benayas, J. M. y Coomes, D. (2007). Impacts of forest fragmentation on species composition and forest structure in the temperate landscape of southern Chile. Global Ecology and Biogeography, 16, 426–439. https://doi.org/10.1111/j.1466-8238.2007.00311.x
Escribano-Ávila, G. (2016). El bosque seco neotropical de la provincia Ecuatoriana: un pequeño gran desconocido. Ecosistemas, 25, 1–4.
ESRI (Environmental Systems Research Institute). (2016). Environmental systems. Research Institute, Inc. New York.
FAO-UNESCO. (1971). Soil map of the world. Volume IV. Paris: UNESCO.
Ferrer-Paris, J. R., Zager, I., Keith, D. A., Oliveira-Miranda, M. A., Rodríguez, J. P. y Josse, C. (2019). An ecosystem risk assessment of temperate and tropical forests of the Americas with an outlook on future conservation strategies. Conservation Letters, 12, e12623. http://dx.doi.org/10.1111/conl.12623
Fontúrbel, F. E. y Jiménez, J. E. (2014). Does bird species diversity vary among forest types? A local-scale test in Southern Chile. Naturwissenschaften, 101, 855–859. https://doi.org/10.1007/s00114-014-1222-y
Granizo, T., Pacheco, C., Ribadeneira, M. B., Guerrero, M. y Suárez, L. (2002). Libro rojo de las aves del Ecuador. Serie Libros Rojos del Ecuador, Tomo 2. Quito: SIMBIOE/ Conservación Intemacional/ EcoCiencia/ Ministerio del Ambiente/ UICN.
Green, J. M. H., Larrosa, C., Burgess, N. D., Balmford, A., Johnston, A., Mbilinyi, B. P. et al. (2013). Deforestation in an African biodiversity hotspot: extent, variation and the effectiveness of protected areas. Biological Conservation, 164, 62–72. https://doi.org/10.1016/j.biocon.2013.04.016.
Holdridge, L. (1979). Ecología basada en zonas de vida. San José: Agroamérica.
Hooftman, D. A. P. y Bullock, J. M. (2012). Mapping to inform conservation: a case study of changes in semi-natural habitats and their connectivity over 70 years. Biological Conservation, 145, 30–38. https://doi.org/10.1016/j.biocon.2011.09.015
Huete, A. R. (1988). A soil-adjusted vegetation index (SAVI). Remote Sensing of Environment, 25, 295–309.
Instituto Nacional de Meteorología e Hidrología. (2005). Estudio hidrológico del río Mira. Quito: Estudios e Investigaciones Hidrológicas.
Isaac-Cubides, P. y Ariza, A. (2016). Monitoreo a la restauración ecológica desde la escala del paisaje. En M. Aguilar-Garavito y W. Ramírez (Eds.), Monitero a procesos de restauración ecológica aplicado a ecosistemas terrestres (pp 51–66). Bogotá D.C.: Instituto de Investigación de Recursos Biológicos Alexander von Humboldt.
Iverson, L., Echeverría, C., Nahuelhual, L. y Luque, S. (2014). Ecosystem services in changing landscapes: an introduction. Landscape Ecology, 29, 181–186. https://doi.org/10.1007/s10980-014-9993-2
Laurance, W. F., Albernaz, A. K. M., Schroth, G., Fearnside, P. M., Bergen, S, Venticinque, E. M. et al. (2002). Predictors of deforestation in the Brazilian Amazon. Journal of Biogeography, 29, 737–48. https://doi.org/10.1046/j.1365-2699.2002.00721.x
Lindenmayer, D. (2012). Land use intensification in natural forest settings. En D. Lindenmayer, S. Cunningham y Y. Andrew (Eds.), Land use intensification: effects on agriculture, biodiversity and ecological processes (pp 113–121). Melbourne: CSIRO Publishing.
Lindenmayer, D. (2016). Interactions between forest resource management and landscape structure. Current Landscape Ecology Reports, 1, 10–18. http://doi.org/10.1007/s40823-016-0002-0
Lindenmayer, D. y Fischer, J. (2006). Habitat fragmentation and landscape change: an ecological and conservation synthesis. Washington D.C.: Island Press.
Lindenmayer, D. y Franklin, J. (2002). Conserving forest biodiversity: a comprenhensive multiscaled approach. Washington D.C.: Island Press.
Liu, S., Dong, Y., Deng, L., Liu, L., Zhao, H. y Dong, S. (2014). Forest fragmentation and landscape connectivity change associated with road network extension and city expansion: a case study in the Lancang River Valley. Ecology Indicators, 36, 160–168. https://doi.org/10.1016/j.ecolind.2013.07.018
McGarigal, K., Cushman, S., Neel, M. y Ene, E. (2013). FRAGSTATS. Spatial pattern analysis program for categorical maps. University of Massachusetts (Landscape Ecology Program). Recuperado el 30 septiembre, 2019 de: http://www.umass.edu/landeco/research/fragstats/fragstats.html
Ministerio del Ambiente del Ecuador. (2013). Sistema de clasificación de los ecosistemas del Ecuador continental. Subsecretaría de Patrimonio Natural. Quito: Ministerio del Ambiente.
Mittermeier, R. A., Turner, W. R., Larsen, F. W., Brooks, T. M. y Gascon, C. (2011). Global biodiversity conservation: the critical role of hotspots. En F. E. Zachos y J. C. Habel (Eds.), Biodiversity hotspots: distribution and protection of conservation priority areas (pp. 3–23). Berlín, Heidelberg: Springer.
Moreira-Arce, D., Vergara, P. M., Boutin, S., Carrasco, G., Briones, R., Soto, G. E. et al. (2016). Mesocarnivores respond to fine-grain habitat structure in a mosaic landscape comprised by commercial forest plantations in southern Chile. Forest Ecology and Management, 369, 135–143. https://doi.org/10.1016/j.foreco.2016.03.024
Moreno-García, R. A., Zamora, R. y Herrera, M. A. (2014). Habitat selection of endemic birds in temperate forests in a biodiversity “Hotspot”. Forest Systems, 23, 216–224. http://doi.org/10.5424/fs/2014232-03700
Myers, N., Mittermeier, R. A., Mittermeier, C. G., da Fonseca, G. A. y Kent, J. (2000). Biodiversity hotspots for conservation priorities. Nature, 403, 853–858. https://doi.org/10.1038/35002501
NatureServe y EcoDecision. (2015). Hotspot de biodiversidad de los Andes Tropicales. Virginia, USA: Critical Ecosystem/ Partnership Fund.
Newton, A. C. (2007). Biodiversity loss and conservation in fragmented forest landscapes: the forests of montane Mexico and temperate South America. Wallingford, Oxford: CABI.
Oleas, N. y Pitman, N. (2003). Phaedranassa brevifolia. The IUCN Red List of Threatened Species 2003:e.T42809A10754305. Recuperado el 10 Mayo, 2019 de: http://dx.doi.org/10.2305/IUCN.UK.2003.RLTS.T42809A10754305.en
Otavo, S. y Echeverría, C. (2017). Fragmentación progresiva y pérdida de hábitat de bosques naturales en uno de los hotspot mundiales de biodiversidad. Revista Mexicana de Biodiversidad, 88, 924–935. http://dx.doi.org/10.1016/j.rmb.2017.10.041
Paladines, R. (2003). Propuesta de conservación del bosque seco en el Sur de Ecuador. Lyonia, 4, 183–186.
Pan, Y., Xu, Z. y Wu, J. (2013). Spatial differences of the supply of multiple ecosystem services and the environmental and land use factors affecting them. Ecosystem Services, 5, 4–10. https://doi.org/10.1016/j.ecoser.2013.06.002
Porej, D., Micacchion, M. y Hetherington, T. E. (2004). Core terrestrial habitat for conservation of local populations of salamanders and wood frogs in agricultural landscapes. Biological Conservation, 120, 399–409. https://doi.org/10.1016/j.biocon.2004.03.015
Pourrut, P. (1983). Los climas de Ecuador. Fundamentos explicativos. Quito: Programa Nacional de Regionalización Agraria del Ministerio de Agricultura y Ganadería.
Reese, H. y Olsson, H. (2011). C-correction of optical satellite data over alpine vegetation areas: a comparison of sampling strategies for determining the empirical c-parameter. Remote Sensing of Environment, 115, 1387–1400. http://doi.org/10.1016/j.rse.2011.01.019.
Ren, Z., Peng, H. y Liu, Z. W. (2016). The rapid climate change- caused dichotomy on subtropical evergreen broad-leaved forest in Yunnan: reduction in habitat diversity and increase in species diversity. Plant Diversity, 38, 142–148. https://doi.org/10.1016/j.pld.2016.04.003
Rodríguez-Echeverry, J., Echeverría, C. y Nahuelhual, L. (2015). Impacts of anthropogenic land-use change on populations of the Endangered Patagonian cypress Fitzroya cupressoides in southern Chile: implications for its conservation. Oryx, 49, 447–452. https://doi.org/10.1017/S0030605314000945.
Rodríguez-Echeverry, J., Echeverría, C., Oyarzún, C. y Morales, L. (2017). Spatial congruence between biodiversity and ecosystem services in an anthropic landscape in Southern Chile: basis for conservation planning. Bosque, 38, 495–507. http://doi.org/10.4067/S0717-92002017000300007.
Rodríguez-Echeverry, J., Echeverría, C., Oyarzún, C. y Morales, L. (2018). Impact of land-use change on biodiversity and ecosystem services in the Chilean temperate forests. Landscape Ecology, 3, 439–453. http://doi.org/10.1007/s10980-018-0612-5.
Rodríguez-Echeverry, J., Fuentes, R., Leiton, M. y Jaque, E. (2018). Changing landscapes forest: implications for its conservation. Environment and Natural Resources Research, 8, 44–54. http://doi.org/10.5539/enrr.v8n3p44.
Rodríguez-Echeverry, J. y Leiton, M. (2019). Conservation planning in anthropogenic landscapes. Ecology & Conservation Science, 1, 555552. http://doi.org/10.19080/ECOA.2019.01.555552.
Rouget, M., Richardson, D. M. y Cowling, R. M. (2003). The current configuration of protected areas in the Cape Floristic region, South Africa – reservations bias and representation of biodiversity patterns and processes. Biological Conservation, 112, 129–145. https://doi.org/10.1016/S0006-3207(02)00396-8
Santiana, J., Cerón, C. y Pitman, N. (2004a). Croton elegans. The IUCN Red List of Threatened Species 2004:e.T45185A10981149. Recuperado el 10 Mayo, 2019 de: http://dx.doi.org/10.2305/IUCN.UK.2004.RLTS.T45185A10981149.en
Santiana, J., Cerón, C. y Pitman, N. (2004b). Euphorbia jamesonii. The IUCN Red List of Threatened Species 2004:e.T45185A10981149. Recuperado el 10 Mayo, 2019 de: http://dx.doi.org/10.2305/IUCN.UK.2004.RLTS.T45185A10981149.en
Schulz, J. J., Cayuela, L., Echeverria, C., Salas, J. y Rey-Benayas, J. M. (2010). Monitoring land cover change of the dryland forest landscape of Central Chile (1975–2008). Applied Geography, 30, 436–447. https://doi.org/10.1016/j.apgeog.2009.12.003
Secretaría Nacional de Planificación y Desarrollo. (2013). Sistema Nacional de Información. Quito, Ecuador.
SIGTIERRAS (Sistema Nacional de Información de Tierras). (2017). Memoria explicativa del mapa de órdenes de suelos del Ecuador. Quito, Ecuador.
Sistema Nacional de Información. (2019). Mapa de cobertura y uso de la tierra. Recuperado el 12 octubre, 2019 de: http://sni.gob.ec
Tapia-Armijos, M. F., Homeier, J., Espinosa, C. I., Leuschner, C. y de la Cruz, M. (2015). Deforestation and forest fragmentation in South Ecuador since the 1970s – losing a hotspot of biodiversity. Plos One, 10, e0133701. http://doi.org/10.1371/journal.pone.0133701.
Tirira, D. (2001). Libro rojo de los mamíferos del Ecuador. Publicación especial sobre los mamíferos del Ecuador 4. Quito: SIMBIOE/ EcoCiencia/ Ministerio del Ambiente/ UICN. Serie Libros Rojos del Ecuador, Tomo 1.
Tucker, C. J. (1979). Red and photographic infrared linear combinations for monitoring vegetation. Remote Sensing of Environment, 8, 127–150.
Uezu, A. y Metzger, J. P. (2011). Vanishing bird species in the Atlantic Forest: relative importance of landscape configuration, forest structure and species characteristics. Biodiversity and Conservation, 20, 3627–3643. https://doi.org/10.1007/s10531-011-0154-5
Wan, L., Zhang, Y., Zhang, X., Qi, S. y Na, X. (2015). Comparison of land use/land cover change and landscape patterns in Honghe National Nature Reserve and the surrounding Jiansanjiang Region, China. Ecological Indicator, 51, 205–214. http://doi.org/10.1016/j.ecolind.2014.11.025
Wilson, K., Newton, A., Echeverría, C., Weston, C. y Burgman, M. (2005). A vulnerability analysis of the temperate forests of south central Chile. Biological Conservation, 122, 9–21. http://doi.org/10.1016/j.biocon.2004.06.015
Wu, J. (2013). Landscape sustainability science: ecosystem services and human well-being in changing landscapes. Landscape Ecology, 28, 999–1023. https://doi.org/10.1007/s10980-013-9894-9
Zárate, P. (2005). Lista Roja de los reptiles del Ecuador. Fundación Novum Milenium, UICN-Sur/ UICN-Comité Ecuatoriano/ Ministerio de Educación y Cultura.
Zebisch, M., Wechsung, F. y Kenneweg, H. (2003). Landscape response functions for biodiversity – assessing the impact of land-use change at the county level. Landscape and Urban Planning, 1015, 1–16. http://doi.org/10.1016/S0169-2046(03)00036-7