Carlos Andrés Daza-Guerra a, *, Adriana María Osorno-Arango b,
Martha Catalina Gómez-Cubillos a y Sven Zea a
a Instituto de Estudios en Ciencias del Mar, Universidad Nacional de Colombia, Sede Caribe, Calle 25 2-55, Playa Salguero, Rodadero Sur, Santa Marta, Colombia
b Instituto de Investigaciones Marinas y Costeras, Calle 25 2-55, Playa Salguero, Rodadero Sur, Santa Marta, Colombia
*Autor para correspondencia: caadazagu@unal.edu.co (C.A. Daza-Guerra)
Recibido: 7 septiembre 2019; aceptado: 27 marzo 2020
Resumen
Esta investigación buscó determinar el papel de la herbivoría por parte del caracol Cittarium pica sobre el ensamblaje algal del litoral rocoso en el área de Santa Marta, Colombia. Se realizaron experimentos con jaulas en el mesolitoral superior entre diciembre de 2017 y junio de 2018, con tratamientos de inclusión (C. pica), exclusión (sin herbívoros) y controles (2 lados abiertos y sin jaula). La disminución natural de las algas durante la época de lluvia se vio reforzada en abril, cuando se combinaron por varios días mar calmo y mareas bajas al medio día, produciendo altas temperaturas y desecación que generaron mortandad masiva. Se observó una mayor cobertura de algas coralinas incrustantes en los tratamientos con C. pica, insinuando que las favorece el pastoreo, sobre ellas o sobre otros grupos de algas. En general, la herbivoría por C. pica no pareció controlar al ensamblaje algal. Esto podría deberse a que en la población, actualmente dominan ejemplares de tallas pequeñas como consecuencia de la sobreexplotación, lo que los limita físicamente para la ingesta de algas de mayor tamaño y textura firme. Las algas fueron estimuladas principalmente por el afloramiento costero y controladas por factores ambientales, que a veces pueden ser extremos.
Palabras clave: Mesolitoral; Gasterópodo; Santa Marta; Alimentación; Grupo funcional; Afloramiento costero; Macroalgas
© 2020 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Effect of the herbivory of Cittarium pica (Gastropoda: Tegulidae) and seasonality on the rocky shore algal assemblage of Bonito Gordo, Tayrona National Natural Park, Colombian Caribbean
Abstract
This research was aimed at determining the role of herbivory by the Top Shell snail Cittarium pica on the rocky shore algal assemblage in the Santa Marta area, Colombia. Caging experiments were carried out in the upper mesolittoral from December 2017 to June 2018, with inclusion (C. pica), exclusion (no herbivores) and control (2 open sides, no cage) treatments. The natural algal decrease during the rainy season was reinforced in April, when for several days calm seas and noon low tides occurred together, producing high temperatures and desiccation, which generated their massive mortalities. Increased cover of encrusting coralline algae was observed in treatments with C. pica, insinuating that they are favored by grazing, on them or on other groups of algae. In general, herbivory by C. pica did not appear to control the algal assemblage. The current dominance of small individuals in the population from overexploitation could be responsible, owing to their physical limitation to graze on larger and firmer algae. The algae were stimulated mainly by coastal upwelling and controlled by environmental factors that sometimes can be extreme.
Keywords: Mesolittoral; Gastropod; Santa Marta; Feeding; Functional group; Coastal upwelling; Macroalgae
© 2020 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
La estructura de los ensamblajes algales en el litoral rocoso es determinada principalmente por factores físicos como la fuerza y la altura del oleaje, humedad, intensidad lumínica, desecación, temperatura y salinidad; factores químicos como la cantidad de nutrientes, y factores biológicos como la presencia de herbívoros (Aguilera, 2010; Aguilera y Navarrete, 2007; Lewis, 1964; Moreno y Jaramillo, 1983; Stephenson y Stephenson, 1972; White, 1978).
En aguas tropicales y subtropicales, los niveles de nutrientes son generalmente bajos durante todo el año, así que su influencia sobre el desarrollo de las algas podría ser un proceso adicional al estrés generado por la variación de la temperatura, llegando en ciertos casos a confundirse el aumento estacional del estrés térmico con la variación en los nutrientes (Longhurst, 1998; Ormond y Banaimoon, 1994; Vinueza et al., 2006). En tal sentido, es posible considerar a los herbívoros como uno de los principales reguladores de la cobertura algal (Lubchenco et al., 1984).
En la actualidad, la destrucción del hábitat, el aumento en las descargas continentales, la sobreexplotación de recursos, la introducción de especies invasoras, el florecimiento de algas nocivas y el cambio climático, entre otras perturbaciones, están alterando la relación herbívoro-planta; es decir, la función ecológica de las poblaciones sobre los ecosistemas (Mancera, Gavio et al., 2013; Mittelbach, 1981; WWF, 2015). Un ejemplo de ello, es la mortandad masiva o explotación de algunos herbívoros de gran tamaño, como es el caso del erizo Diadema antillarum, en la cuenca del Gran Caribe, que conlleva a una disminución de la tasa general de consumo de algas, en el tiempo de manipulación del recurso alimenticio y en el intervalo de alimentación; favoreciendo el dominio de las macroalgas en los ecosistemas, ya que sobreviven pocos ejemplares, o son de tallas pequeñas, y por lo tanto presentan limitaciones impuestas por su tamaño (Mittelbach, 1981; Randall, 1964; Steiner y Williams, 2006).
La tendencia hacia la disminución en la talla de las poblaciones podría estarse presentando con el gasterópodo Cittarium pica Linnaeus, 1758, el cual es uno de los caracoles con mayor talla (hasta 18 cm) que habita el litoral rocoso del mar Caribe (Castell, 1987; Díaz y Puyana, 1994; Randall, 1964). Esta especie es un importante eslabón en el flujo trófico, al ser uno de los mayores consumidores de biomasa algal en el litoral, y por ser fuente de alimento para muchos organismos (Mclean, 1967; Randall, 1964). A pesar de su importancia ecológica, la extracción de C. pica se practica en toda su área de distribución para consumo local y fines ornamentales, lo que ha provocado disminución de sus poblaciones en toda la región del Caribe (Osorno, 2005; Osorno y Díaz, 2006; Robertson, 2003). En Colombia, particularmente en el Parque Natural Nacional Tayrona (PNNT) y su área de influencia, donde se concentra el 35.3% de las personas dedicadas a la explotación de este recurso en el Caribe continental colombiano, Osorno y Díaz (2006) estimaron que la talla promedio de C. pica es de 2.4 cm, rango de talla pequeño e indicador de sobreexplotación. Adicionalmente, esta especie se encuentra catalogada en el Libro Rojo de Invertebrados Marinos de Colombia como vulnerable (VU A2d) (Ardila et al., 2002).
Por su tamaño y aparente voracidad, C. pica sirve de modelo como posible especie clave, para entender el control de la herbivoría sobre la estructura de los ensamblajes algales en el ecosistema de litorales rocosos a nivel tropical. Además, el área del PNNT puede considerarse como un laboratorio natural debido a que presenta la vegetación algal más abundante y diversa de todo el Caribe colombiano, y a que se encuentra influenciada por 2 fenómenos climáticos estacionales (Bula-Meyer, 1990). Durante la época seca ocurre un fenómeno de afloramiento costero, en el cual se genera un aumento en la riqueza y el tamaño de las especies algales; por el contrario, en la época de lluvia cesa el fenómeno de afloramiento y se presenta una disminución de la cobertura algal (Bula-Meyer, 1990; Díaz-Pulido y Garzón-Ferreira, 2002; Márquez y Guillot, 1983).
Al intentar comprender la relación herbívoro-planta, se han desarrollado experimentos en campo donde se introducen o se remueven especies para observar su efecto sobre los productores primarios. Estos estudios se han realizado generalmente en los litorales rocosos, debido a que este ecosistema abarca variedad de condiciones ambientales, que permiten una alta riqueza de animales y de algas, con varios representantes de grupos funcionales o gremios (Menge et al., 1986). Estas investigaciones han demostrado cómo los consumidores primarios participan de manera directa e indirecta en complejas interacciones con otros miembros de la comunidad, y como estas interacciones afectan la estructura, productividad y el cambio temporal de los ensamblajes algales (Menge, 1995, 1997; Wootton, 1994).
El objetivo de esta investigación fue determinar si la herbivoría ejercida por C. pica, genera un control efectivo sobre el ensamblaje algal. Igualmente, si los nutrientes y factores reguladores como la temperatura y el oleaje pueden también controlar al ensamblaje de algas.
Materiales y métodos
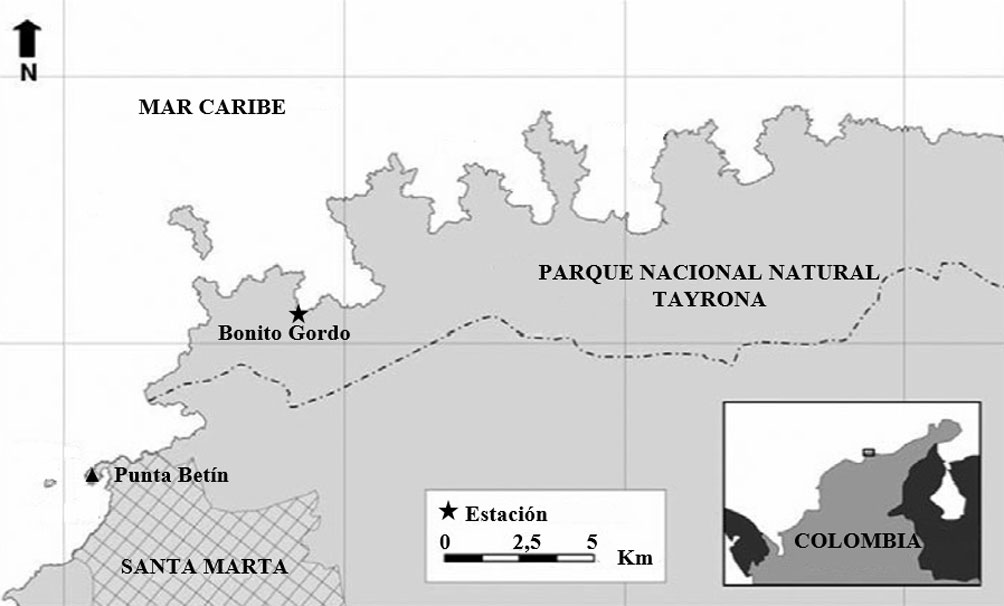
Los experimentos se realizaron en la ensenada de Bonito Gordo (11°17’55.83” N, 74°10’8.20” O) (fig. 1), cuyo litoral rocoso está constituido por esquistos metamórficos (Doolan y McDonald, 1976). Esta ensenada se ubica en el Parque Nacional Natural Tayrona (PNNT) que hace parte de la ecorregión Tayrona (TAY), en el Caribe colombiano, departamento del Magdalena, la cual se extiende desde la desembocadura del río Piedras hasta Punta Gloria (Díaz y Gómez, 2000). Las características geomorfológicas y ecológicas generales del área están determinadas por las estribaciones noroccidentales del macizo montañoso de la Sierra Nevada de Santa Marta, que se adentran hacia el mar configurando un litoral indentado, en que se alternan cabos rocosos y ensenadas con playas. Por su extremo suroccidente recibe la influencia de las descargas de la ciénaga Grande de Santa Marta y de los ríos Manzanares y Gaira (Díaz y Gómez, 2000).
Localmente, se presenta un fenómeno de afloramiento costero de aguas subsuperficiales durante la época seca (diciembre-abril), por efecto de los vientos alisios del noreste, generando cambios bióticos en respuesta a la disminución de la temperatura del agua, al aumento de la salinidad, a ligeros incrementos de nutrientes y al fuerte oleaje (Bula-Meyer, 1985). Por el contrario, en la época de lluvias (mayo-noviembre) disminuye el fenómeno de afloramiento debido a la disminución de los vientos alisios y al efecto de una circulación atmosférica y marina en sentido opuesto, ocasionando aumento en la temperatura, disminución en la salinidad, ligero aumento en la concentración de nutrientes y reducción del oleaje (Bula-Meyer, 1985, 1987).
Se realizaron experimentos de manipulación en la zona del mesolitoral superior, instalando jaulas hechas en un marco en varilla de hierro de 30 × 30 × 10 cm (largo × ancho × alto), forradas con una malla plástica de 0.5 cm de ojo. Cada jaula cubrió un área de sustrato de 0.09 m2. Las jaulas se fijaron al sustrato con tornillos de anclaje de acero inoxidable de ¾”, que se introdujeron en agujeros hechos con taladro neumático impulsado por el aire de un tanque de buceo y su estabilidad se reforzó con pegamento Sikadur 32 Primer®.
Para determinar el efecto de C. pica, sobre la composición y estructura en términos de cobertura (%) del ensamblaje algal establecido en el litoral rocoso, se realizaron 4 tratamientos: a) inclusión: jaula cerrada con presencia de C. pica y ausencia de otros herbívoros; b) exclusión: jaula cerrada removiendo todos los herbívoros; c) abierto: sin jaula, control biológico, con las esquinas marcadas con tornillos de anclaje y sin manipulación de los herbívoros, y d) control metodológico: jaula con techo y 2 lados destapados, para permitir el flujo del agua y la entrada o salida de herbívoros. Cada tratamiento contó con 6 réplicas, que se organizaron en 6 bloques, cada bloque con los 4 tratamientos, se localizaron a lo largo del mesolitoral superior. Para los tratamientos de inclusión (jaulas con C. pica), con el fin de enfatizar el efecto de la herbivoría, se introdujeron en cada jaula 3 individuos con tallas entre 2 y 4 cm de diámetro de la base de la concha. Esto representa una densidad de 33.3 ind/m2, valor mucho mayor al reportado en Bonito Gordo en estudios anteriores (4.61 ± 6.3 ind/m2), y los tamaños de los individuos seleccionados estuvieron dentro de los rangos registrados para el área de estudio (media = 1.9 ± 0.9 cm; mínimo = 0.3 cm; máximo = 9 cm) (Daza-Guerra, 2016; Daza-Guerra et al., 2018).
El experimento se desarrolló durante 6 meses, entre diciembre de 2017 y junio de 2018, abarcando la época seca (diciembre-abril), donde el desarrollo algal es mayor en el área de estudio, y en la época de lluvias menores (mayo-junio), cuando las algas comienzan a declinar (Bula-Meyer, 1990). Al inicio se montaron los experimentos y se hizo la primera cuantificación del ensamblaje algal en términos de composición y cobertura en el área de los tratamientos. Mensualmente se realizaron muestreos para limpiar la malla de las jaulas y registrar cambios en el ensamblaje algal. La cobertura se estimó empleando un cuadrante de acero inoxidable de 30 × 30 cm dividido en cuadriculas de 3 × 3 cm. En cada cuadrante se contó el número de intersecciones bajo los cuales se encontraba cada taxón algal, y el resultado de la cobertura se expresó en porcentaje (Miloslavich y Carbonini, 2010).
Se recolectaron muestras de cada morfotipo algal y se identificaron hasta el menor nivel de resolución posible, empleando las claves taxonómicas de Aponte (1985), Chapman (1961, 1963), Joly (1967), Lemus (1979, 1984), Littler y Littler (2000), Taylor (1960) y Wynne (2011, 2017). Luego, cada morfotipo identificado se clasificó tomando como referencia los 4 grupos funcionales propuestos por Littler y Littler (1980) y Steneck y Dethier (1994) en: a) algas filamentosas (AFIL) que presentan células arregladas en hileras; b) algas coralináceas incrustantes (ACI), que son algas rojas no geniculadas del orden Coralinales; c) algas frondosas (AF) que poseen hojas y consistencia relativamente carnosa, y d) algas costrosas (AC) con crecimiento laminar y sin calcificación (Díaz, 2010).
Las variables físicas temperatura e intensidad lumínica se midieron in situ en el mesolitoral superior cada media hora, empleando un registrador electrónico HOBO® Pendant UA-002-08, que se ubicó al interior de una de las jaulas del tratamiento de exclusión de herbívoros. Adicionalmente, cada mes se recolectaron muestras de agua para medir en el laboratorio la salinidad y la concentración de nutrientes (amonio, nitratos, nitritos y ortotofosfatos). La salinidad se midió con un conductímetro portátil YSI® 30 Pro. El análisis de nutrientes lo realizó el programa Calidad Ambiental Marina (CAM) de INVEMAR, empleando la metodología de colorimetría (Strickland y Parsons, 1972). Con datos de la estación meteorológica de Punta Betín ubicada en la Bahía de Santa Marta (11°24.5850’ N, 74°21.4870’ O) se obtuvieron cada hora valores de la temperatura ambiente, velocidad del viento, precipitación y humedad relativa. Finalmente, la predicción de la marea astronómica para el área de Santa Marta se obtuvo de WxTide32 para el período de estudio.
Se realizaron 7 muestreos en total. Sin embargo, debido a una mortandad algal masiva en el mesolitoral superior durante mayo y junio de 2018, se decidió tomar solo los datos de los 4 primeros meses del experimento (diciembre-abril) para analizar el efecto de los tratamientos y la temporalidad sobre el ensamblaje algal. No obstante, con los datos de todo el experimento se explicó la influencia de las variables ambientales sobre la cobertura de las especies algales y las causas de la mortandad algal. Se estimaron los promedios de la cobertura algal de los grupos funcionales por muestreo y tratamiento. A los datos de cobertura algal expresados en porcentaje se les aplicó una transformación angular (arcoseno√(x/100)), para un mejor ajuste a los supuestos de normalidad y homocedasticidad (Legendre y Legendre, 1998).
Para determinar el efecto de los factores independientes (tiempo y tratamiento) y de sus interacciones sobre la cobertura de los grupos funcionales del ensamblaje algal, se realizó un Anova, usando un modelo lineal general mixto, considerando tiempo y tratamiento como factores fijos y bloque como factor aleatorio. Las comparaciones a posteriori al interior de los factores se realizaron con la prueba de Tukey. Los análisis se realizaron con los paquetes estadísticos nmle (Pinheiro et al., 2018) y emmeans (Russell, 2018) del programa R (R Development Core Team, 2008). Las gráficas se elaboraron con el programa Microsoft Excel 2013, calculando los intervalos de confianza (I.C.) a 95% (p = 0.05). Las comparaciones de la cobertura algal general entre tratamientos y tiempos se realizaron mediante análisis de varianza no paramétrica de Kruskal-Wallis con el programa PAST versión 3.21c (Hammer et al., 2001).
Por último, para determinar en qué medida las variables ambientales (temperatura en el litoral rocoso, temperatura ambiente, humedad relativa, intensidad lumínica, velocidad del viento y salinidad) y los valores de nutrientes explicaban la variación en la cobertura de especies de algas para el tratamiento abierto (ensamblaje natural), se realizó un análisis de correspondencia canónica (ACC) con el programa PAST versión 3.21c (Hammer et al., 2001). Para las variables salinidad y nutrientes se tomaron los datos puntuales medidos en cada muestreo; para las variables de registro continuo —atmosféricas de la estación meteorológica de Punta de Betín y temperatura en el litoral rocoso— se emplearon los valores promedio del día en cada muestreo y para la intensidad lumínica en el litoral rocoso, se tomaron los promedios de los datos comprendidos entre las 6:00 am y 6:00 pm durante los días de muestreo.
Resultados
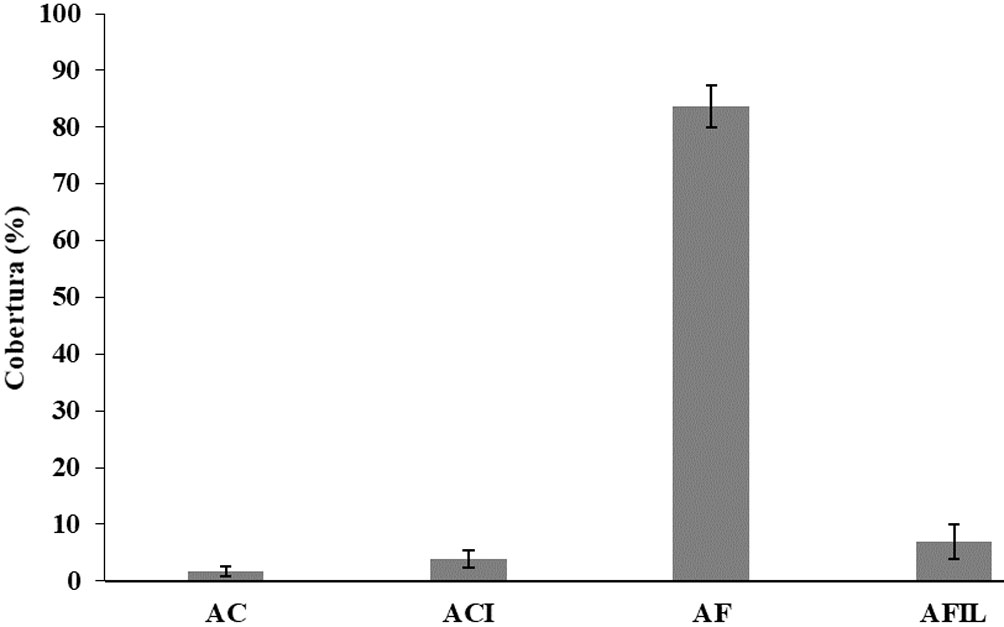
Analizando los grupos funcionales presentes en el tratamiento abierto entre diciembre y abril, se observó que las algas frondosas (AF) representadas principalmente por Acanthophora spicifera (Vahl) Børgesen y Palisada perforata (Bory) K.W. Nam, registraron las coberturas más altas (83.8 ± 9.9%) (media ± 1 desviación estándar) con diferencias significativas respecto a los demás grupos funcionales (Kruskal-Wallis, p < 0.05). Por su parte, las algas costrosas (AC), tuvieron la menor cobertura (1.7 ± 2.3%), representadas solo por las especies Ralfsia sp. y Peyssonnelia sp., que no presentaron diferencias significativas (p > 0.05) con la cobertura de las algas coralináceas incrustantes (ACI) (3.9 ± 4.1%), grupo representado por Lithophyllum sp., pero sí con las algas filamentosas (AFIL) (6.9 ± 8.3%), dominadas por especies del orden Ectocarpales (fig. 2).
Entre diciembre y abril, el modelo lineal mixto explicó más de 94% de la variación de los datos para todos los grupos funcionales. Para los 4 grupos funcionales el factor fijo tiempo fue el que mayor explicó la variabilidad de la cobertura algal (p < 0.05), mientras que el factor tratamiento solo explicó la variabilidad en la cobertura de las ACI y las AFIL (p < 0.05) y por último, la interacción entre factores solo fue relevante para las AF (p < 0.05) (tabla 1).
Tabla 1
Anova del modelo lineal mixto sobre la cobertura de los grupos funcionales de algas. gl = Grados de libertad, valores p significativos (< 0.05) con asterisco.
|
G.F |
Factores |
gl |
Valor-F |
Valor-p |
|
ACI |
Tratamientos |
3 |
7.622 |
0.001* |
|
Tiempo |
4 |
4.640 |
0.002* |
|
|
Tratamientos-tiempo |
12 |
1.341 |
0.213 |
|
|
AC |
Tratamientos |
3 |
1.252 |
0.318 |
|
Tiempo |
4 |
14.649 |
< 0.0001* |
|
|
Tratamientos-tiempo |
12 |
0.597 |
0.838 |
|
|
AFIL |
Tratamientos |
3 |
3.793 |
0.026* |
|
Tiempo |
4 |
5.055 |
0.001* |
|
|
Tratamientos-tiempo |
12 |
0.491 |
0.915 |
|
|
AF |
Tratamientos |
3 |
0.556 |
0.650 |
|
Tiempo |
4 |
2.805 |
0.031* |
|
|
Tratamientos-tiempo |
12 |
2.133 |
0.023* |
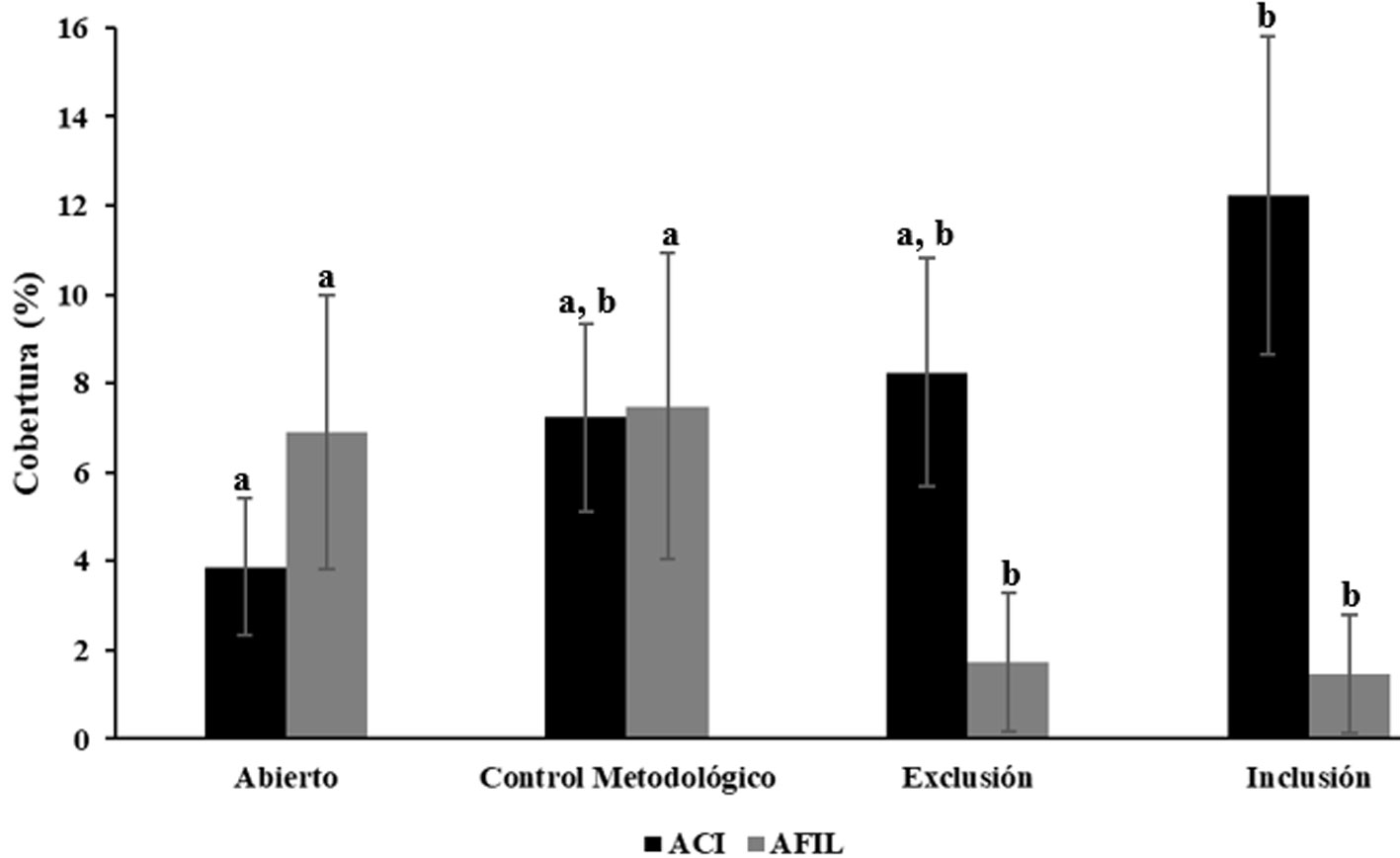
Con respecto al efecto de los tratamientos, se evidenció un efecto aparente de la herbivoría de C. pica sobre las ACI, ya que al incluir a este herbívoro se registró una cobertura significativamente mayor de ACI (12.2 ± 9.6%) en los tratamientos de inclusión respecto de los tratamientos abiertos (3.9 ± 4.2%) (p < 0.05). Para los tratamientos de exclusión y control metodológico se obtuvieron valores intermedios (8.3 ± 6.9% y 7.2 ± 5.6%, respectivamente), los cuales no fueron estadísticamente diferentes entre sí (p > 0.05) (fig. 3). Esto indica que hubo un efecto metodológico de las jaulas sobre la cobertura de las ACI. Para el grupo funcional AFIL, se presentó un efecto (metodológico) debido al enjaulamiento, con independencia de la presencia o ausencia de herbívoros, representado en una disminución significativa (p < 0.05) de las AFIL en los tratamientos enjaulados (exclusión 1.7 ± 4.2%, inclusión 1.4 ± 3.2%), en comparación con el sustrato abierto (6.9 ± 8.3%) y el control metodológico con jaula parcial (7.5 ± 9.2%) (fig. 3).
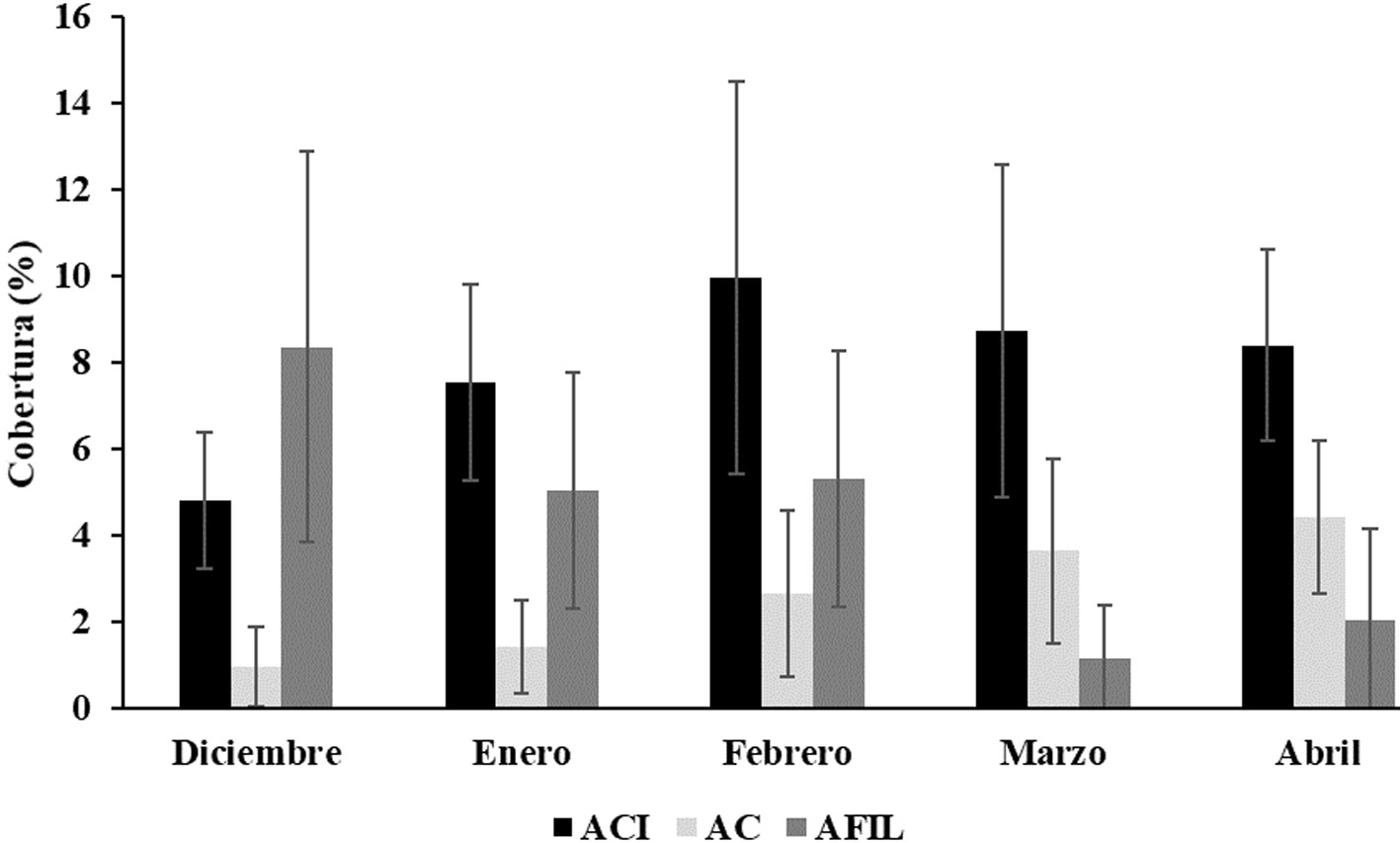
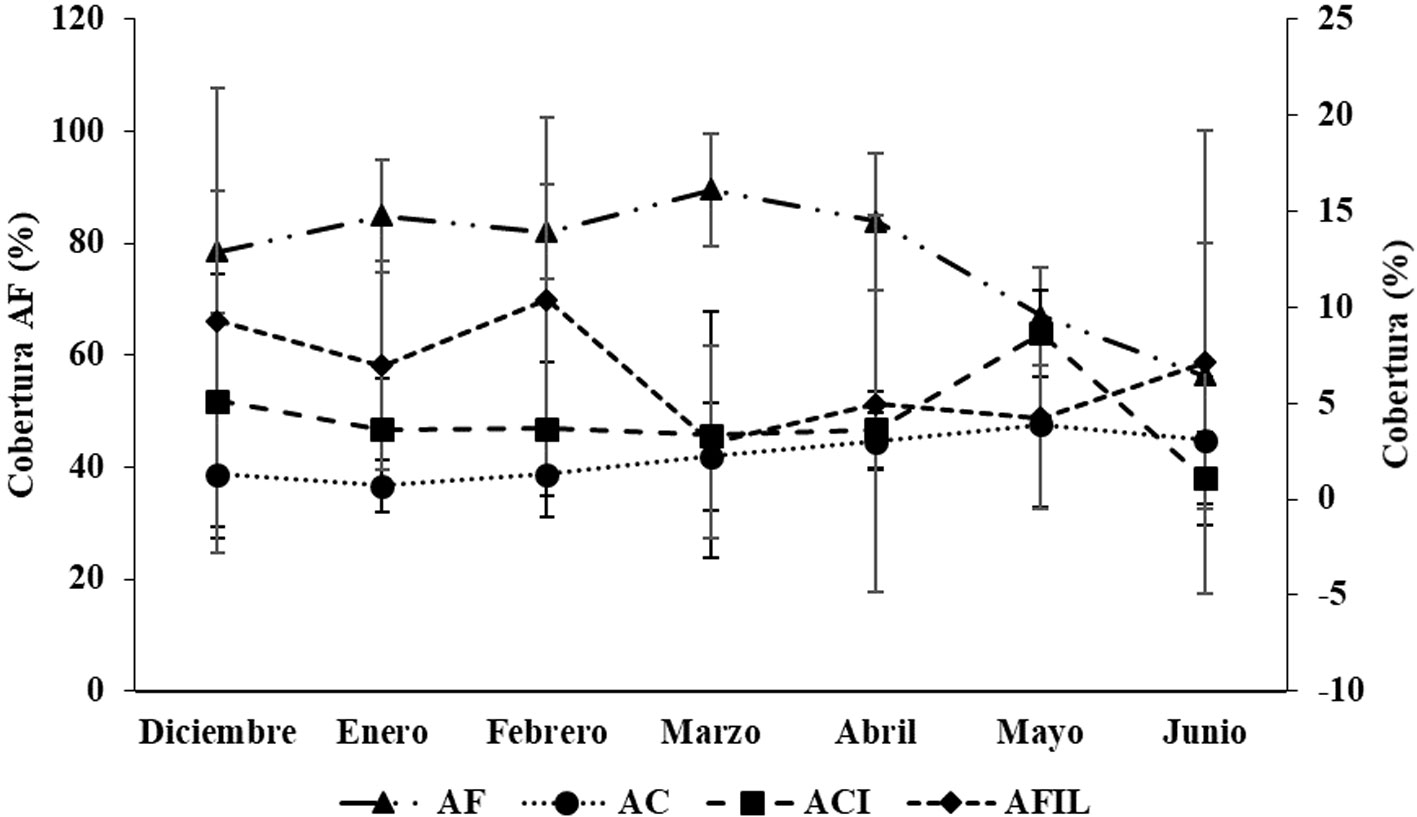
Al analizar el efecto de la temporalidad, se observó que la variación en la cobertura de ACI durante los muestreos indica una tendencia de aumento entre diciembre, mes con la cobertura más baja (4.8 ± 3.7%), hacia febrero y abril con las coberturas más altas (10 ± 10.74% y 8.4 ± 5.23%, respectivamente) (fig. 4). Las AC presentaron un incremento paulatino y constante en su cobertura a lo largo del tiempo de experimentación, con independencia del tratamiento, desde 1 ± 2.2% en diciembre, hasta 4.5 ± 4.2% en abril (fig. 4). Por su parte, la mayor cobertura de las AFIL se presentó en diciembre (8.4 ± 10.7%), y posteriormente descendió hasta su valor más bajo en marzo (1.2 ± 2.9%) (fig. 4).
Por último, Las AF no variaron en su cobertura por efecto de la presencia o ausencia de herbívoros, pero si variaron respecto al tiempo, y a la interacción entre factores (tratamientos y tiempo), manteniendo siempre las mayores coberturas, con promedios desde 68.0 ± 18.5% (inclusión en febrero), hasta 89.5 ± 9.7% (abierto en marzo) (fig. 5). Solo se presentó diferencia significativa entre los tratamientos abierto y el control metodológico en diciembre (p < 0.05).
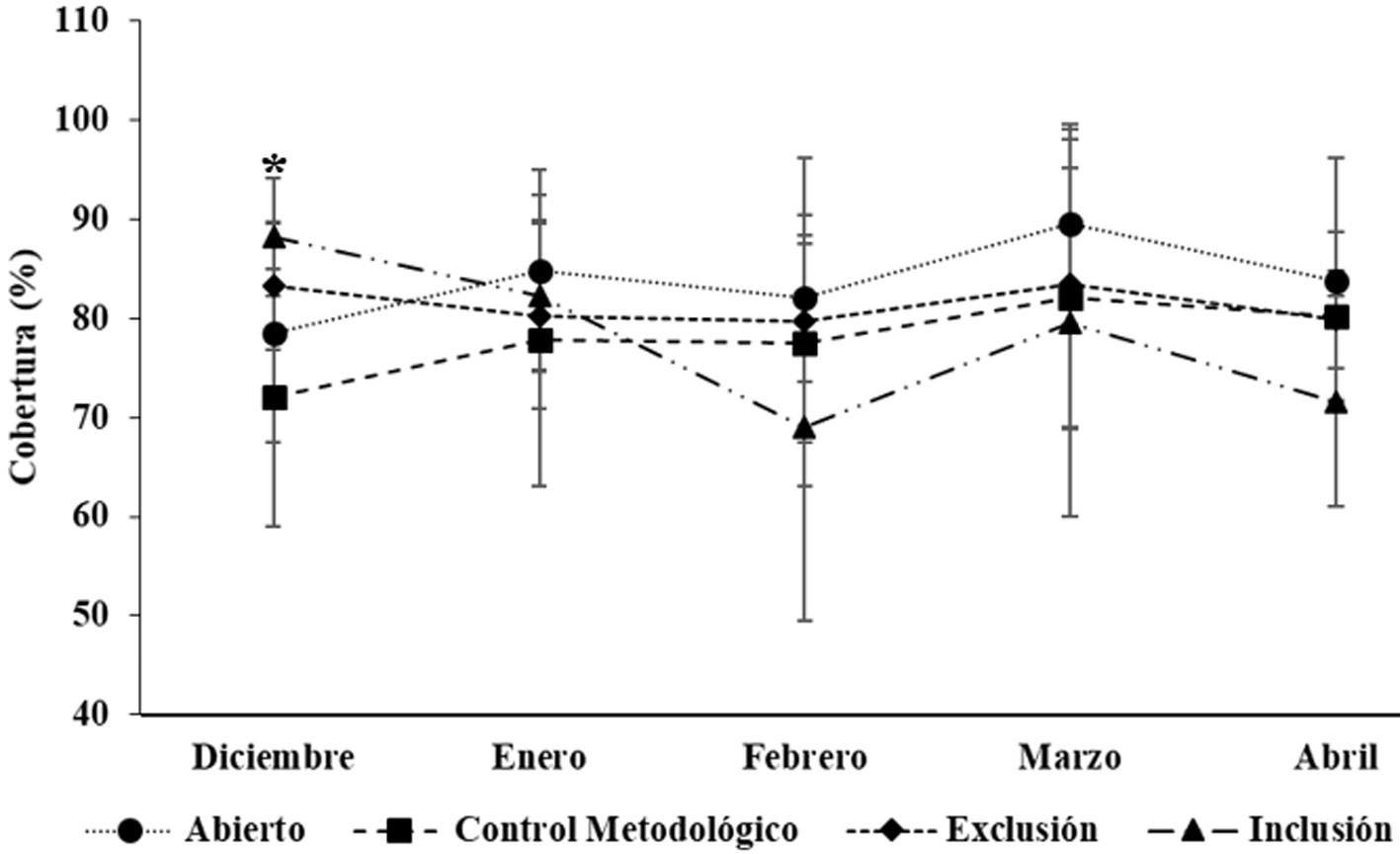
Las variables atmosféricas confirmaron que el período de estudio coincidió con la época seca e inicios de la época de lluvias. La humedad relativa fue baja (50-92%), con los valores más bajos entre enero y marzo. Las temperaturas del aire fueron cálidas (23.8-34.6 °C), con pocas variaciones durante el periodo de estudio y las velocidades del viento fueron altas, con valores máximos entre enero y marzo, y disminuyendo hacia abril y mayo (tabla 2).
Tabla 2
Comportamiento de variables ambientales de registro continuo (mediciones cada media hora). Abreviaturas, T.A: temperatura del aire, V.V: velocidad del viento, H.R: humedad relativa, T: temperatura en el litoral rocoso, I.L: intensidad lumínica. Los valores son promedios (± 1 D.E.; suma total para la precipitación) de los valores registrados en el intervalo entre uno y otro momento de muestreo. Para la intensidad lumínica se usaron los promedios de los datos comprendidos entre las 6:00 am y 6:00 pm durante los días de muestreo.
|
27/12/17-23/01/18 |
24/01/18-04/03/18 |
05/03/18-30/03/18 |
31/03/18-25/04/18 |
26/04/18-21/05/18 |
22/05/18-21/06/18 |
|
|
T.A (°C) |
28.4 ± 1.6 |
28.0 ± 1.6 |
28.2 ± 1.3 |
28.4 ± 1.3 |
28.4 ± 1,7 |
28.8 ± 1.6 |
|
V.V (m/s) |
5.3 ± 3.0 |
9.1 ± 3.7 |
5.6 ± 3.2 |
4.6 ± 2.5 |
3.4 ± 1,9 |
* |
|
H.R (%) |
66.2 ± 8.1 |
58.3 ± 5.8 |
65.4 ± 8.6 |
67.1 ± 6.2 |
72.8 ± 7,5 |
71.7 ± 7.2 |
|
Precipitación (mm) |
1 |
1.6 |
0 |
0 |
31.4 |
7.8 |
|
T (°C) |
27.4 ± 1 |
24.2 ± 1.3 |
26.7 ± 1.2 |
27.4 ± 1.1 |
28.1 ± 1 |
28.6 ± 1.5 |
|
I.L. (lux) |
* |
99,939 ± 41,104 |
113,746 ± 59,062 |
148,694 ± 48,986 |
116,105 ± 45,575 |
124,322 ± 43,070 |
Respecto a las variables medidas in situ, se observó que la salinidad presentó su valor más alto en diciembre y el más bajo en mayo (tabla 3). La temperatura en el litoral rocoso presentó un comportamiento inverso a la salinidad, registrando los valores más bajos entre enero y marzo, y los mayores entre mayo y junio. La intensidad lumínica presentó una amplia variación durante el estudio (14.469-209.424 lux), registrando los valores más altos entre marzo y abril (tabla 2).
Para la concentración de nutrientes, se encontró que el amonio (NH4+) alcanzó su valor más alto en marzo, mientras que en febrero, mayo y junio, sus valores se encontraron por debajo del nivel de detección del método (< 3.10 µg/L). Los nitratos (NO3–) alcanzaron su valor más alto en abril y el más bajo en mayo. Los nitritos (NO2–) presentaron su mayor valor en mayo y en junio se encontró por debajo del nivel de detección del método (< 0.70 µg/L). Por último, los ortofosfatos (PO4)3- presentaron su mayor valor en marzo, disminuyendo hasta encontrarse por debajo del nivel de detección del método (< 2 µg/L) en abril, mayo y junio (tabla 3).
Los 3 primeros ejes del ACC explicaron 85% de la variación de los datos (tabla 4). En el lado izquierdo del primer eje (fig. 6) se observó que en enero y febrero, el ensamblaje algal natural (tratamiento abierto) se asoció con valores altos de amonio y de salinidad, y valores bajos de temperatura en el litoral rocoso, intensidad lumínica y humedad relativa. Las especies de algas que influyeron más en esta variación, particularmente en febrero fueron las AF: Hypnea valentiae (Turner) Montagne, Hypnea musciformis (Wulfen) J.V. Lamouroux y Anadyomene stellata (Wulfen) C. Agardh, y las AFIL: Spyridia hypnoides (Bory) Papenfuss y Centroceras clavulatum (C. Agardh) Montagne. Por el contrario, en el lado derecho del primer eje se ubicaron los muestreos hechos en mayo y junio, los cuales presentaron un comportamiento inverso con las variables ambientales en comparación con enero y febrero, estando el mes de mayo caracterizado por las AFIL: Wrangelia argus (Montagne) Montagne y Herposiphonia bipinnata M. Howe. En el segundo eje, en la parte inferior de la gráfica se encontró el mes de diciembre, durante el cual la composición del ensamblaje algal se asoció con altos valores en la velocidad del viento y de temperatura ambiente, y bajos valores de nitratos y nitritos, aunque no se asoció con la abundancia de alguna especie de alga en particular. Por su parte, abril y marzo se ubicaron en la parte superior de la gráfica, registrando un comportamiento inverso a diciembre, e indicando que en abril existe una mayor relación con las AF: Colpomenia sinuosa (Mertens ex Roth) Derbès y Solier y Dictyota crenulata J. Agardh (tabla 4, fig. 6).
La cobertura algal natural total (tratamiento abierto) fue en general alta, con un promedio global de 96.3 ± 4.4%, incrementándose paulatinamente desde diciembre (94.3 ± 3.5%), hasta alcanzar sus valores más altos en marzo (98.0 ± 1.8%). Mientras transcurría el experimento, se esperaba encontrar un efecto visible de la herbivoría sobre el ensamblaje algal. Sin embargo, en el muestreo de mayo ocurrió un fenómeno de control ambiental sobre las algas, que ocasionó una mortandad importante, la cual disminuyó en mayo a 83.8 ± 7.5% y continuó descendiendo en junio hasta 67.6 ± 18.8% (fig. 7).
Al analizar esta mortandad por grupo funcional para el tratamiento abierto, se evidenció que las AF fueron las que presentaron mayor disminución en su cobertura pasando de 83.8 ± 11.7% en abril, a 67 ± 8.3% y 56.4 ± 22.6% en los meses de mayo y junio, respectivamente. Simultáneamente, al disminuir la cobertura de las AF, se hicieron más evidentes las ACI, cuya cobertura inicial era de 3.6 ± 1.9%, hasta registrar su valor más alto en mayo (8.6 ± 2.2%), el cual volvió a disminuir en junio (1.1 ± 2.3%). Una tendencia similar ocurrió con las AC, que pasaron en abril de 3.0 ± 1.4% a 3.9 ± 4.2% en mayo, disminuyendo nuevamente en junio 3.1 ± 3.6%. Las AFIL presentaron variaciones más erráticas, pero en general, tendieron a incrementar su cobertura entre mayo (4.6 ± 4.5%) y junio (7.1 ± 11.5%) (fig. 8).
La causa evidente de esta disminución considerable en la cobertura algal fue la desecación, pues se observaron restos algales resecos, quemados y con pérdida de color en el mesolitoral superior, donde se ubicaron los experimentos, mientras que las algas del mesolitoral inferior, siempre bañadas por el mar, no se vieron afectadas (fig. 9). Este fenómeno de desecación se debió a la coincidencia por varios días de una baja velocidad del viento y por lo tanto, en el oleaje que baña el mesolitoral superior, con la presencia de mareas bajas durante el mediodía, que por la alta insolación a esas horas, produjeron altas temperaturas en el litoral rocoso, especialmente los días 4, 5, 20 y 21 de mayo (fig. 10). El registrador electrónico de temperatura y de luz ubicado en una de las jaulas, mostró que las temperaturas en esos días alcanzaron valores entre 33 y 35 °C, las más altas registradas en todo el estudio. Aunque en esas fechas las intensidades de luz no fueron las más altas, es probable que debido a la baja marea y al poco oleaje, se favoreció un incremento considerable de la temperatura.
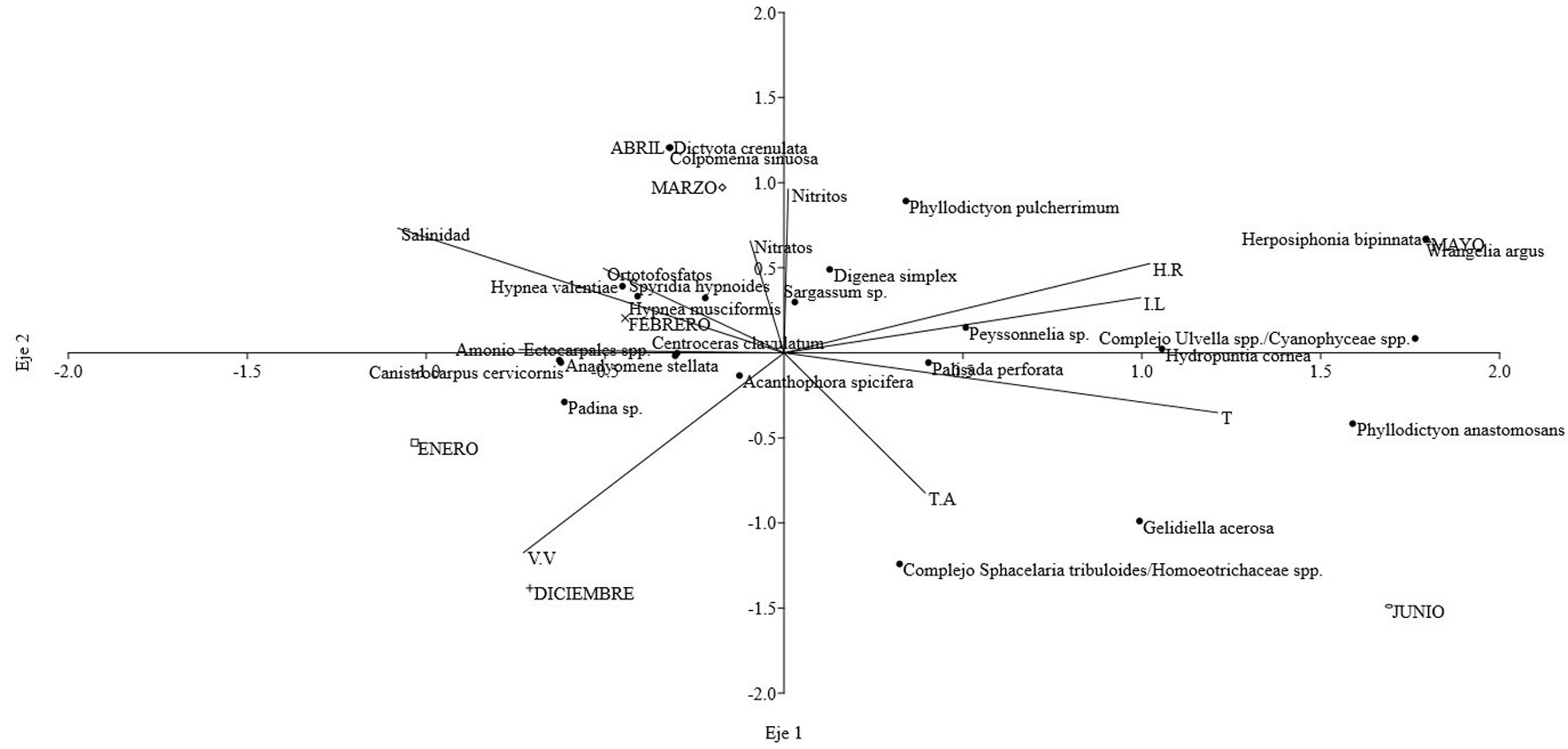
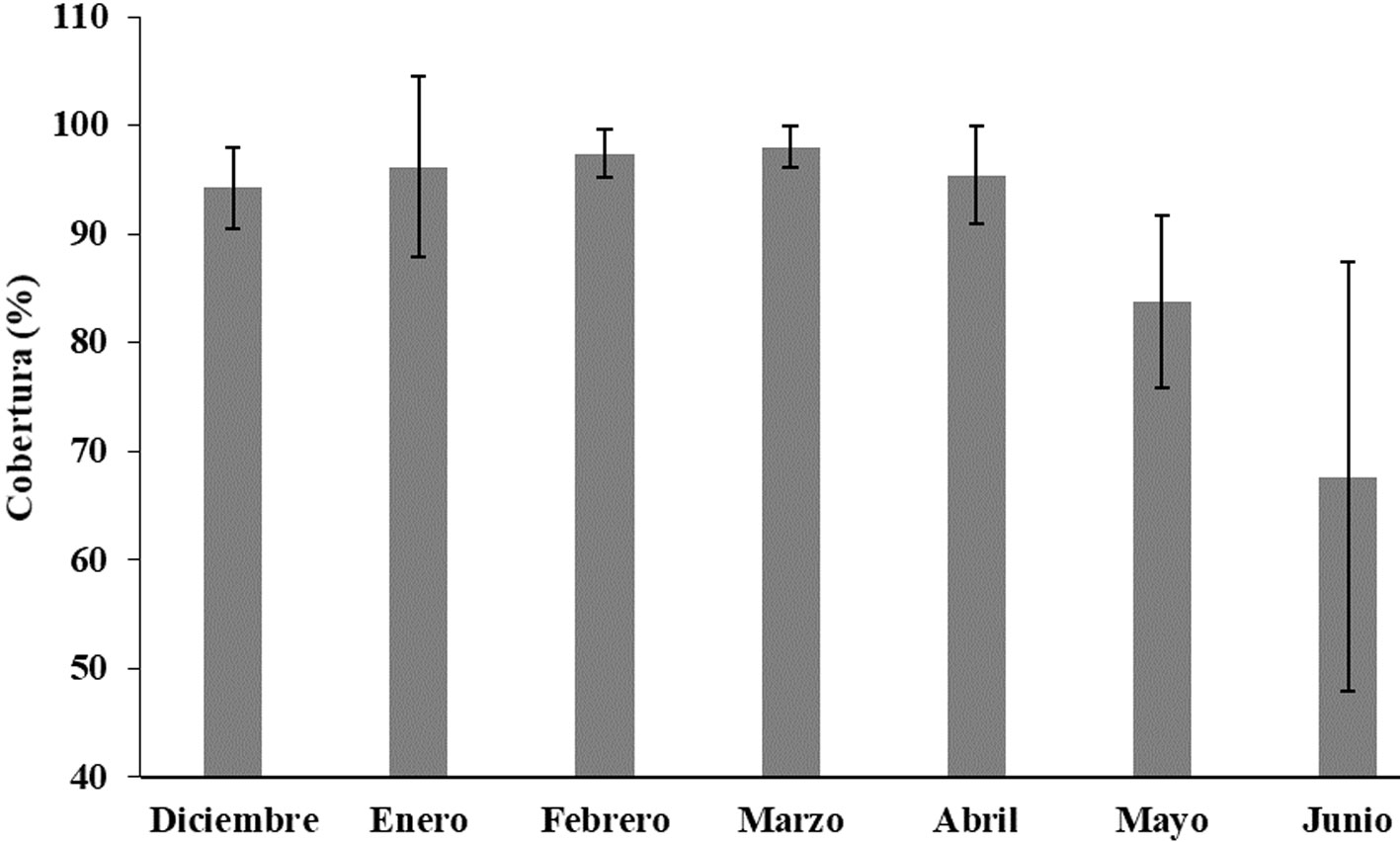
Tabla 3
Comportamiento de variables ambientales tomadas durante cada muestreo.
|
27/12/17 |
24/01/18 |
05/03/18 |
31/03/18 |
26/04/18 |
22/05/18 |
21/06/18 |
|
|
Amonio (µg/L) |
7.37 |
7.37 |
< 3.10 |
11 |
< 3.10 |
< 3.10 |
< 3.10 |
|
Nitratos (µg/L) |
4.33 |
4.03 |
4.64 |
5.66 |
8.48 |
3.88 |
5.64 |
|
Nitritos (µg/L) |
1.10 |
0.82 |
1.39 |
0.9 |
1.52 |
1.56 |
<0.70 |
|
Ortotofosfatos (µg/L) |
2.94 |
2.46 |
4.24 |
6,85 |
< 2 |
< 2 |
< 2 |
|
Salinidad (ppm) |
37.1 |
36.2 |
36.5 |
36.7 |
36.6 |
35.7 |
31.8 |
Tabla 4
Resultados del análisis de correspondencia canónica (ACC) entre la composición de especies de algas en el tratamiento abierto y variables ambientales (diciembre-junio). Las correlaciones con asterisco indican los valores más altos de cada variable.
|
Variable |
Eje 1 |
Eje 2 |
Eje 3 |
|
Valor propio |
0.18 |
0.10 |
0.04 |
|
Variación (%) |
48 (p = 0.78) |
25.7(p = 0.16) |
11.2(p = 0.65) |
|
Variación acumulada (%) |
48 |
73.7 |
84.9 |
|
Correlación con variables ambientales |
|||
|
Amonio |
-0.49* |
0.01 |
-0.33 |
|
Nitratos |
-0.06 |
0.44 |
-0.54* |
|
Nitritos |
0.01 |
0.64* |
0.49 |
|
Ortotofosfatos |
-0.34 |
0.33 |
0.12 |
|
Salinidad |
-0.72* |
0.49 |
0.27 |
|
T |
0.81* |
-0.23 |
-0.32 |
|
I.L |
0.66* |
0.22 |
0.40 |
|
T.A |
0.26 |
-0.55* |
-0.20 |
|
V.V |
-0.49 |
-0.78* |
0.07 |
|
H.R |
0.68* |
0.35 |
-0.53 |
Discusión
Contrario a lo esperado con el paradigma del litoral subtropical, en donde los herbívoros son los principales controladores de la cobertura algal, durante este estudio se encontró que el pastoreo de C. pica, en las densidades y tallas experimentadas, no parece ser determinante. En cambio, se evidenció un papel importante del clima sobre la estructura de los ensamblajes algales, favoreciéndolos durante la época seca y de afloramiento costero, y ocasionando mortandades masivas al inicio de la época de lluvia debido a condiciones extremas circunstanciales en términos de temperatura y oleaje.
Durante exploraciones previas a los montajes experimentales, fue notoria una baja cobertura algal, que aumentó significativamente entre diciembre y enero de 2017, cuando se inició el afloramiento costero. Se estima que el ensamblaje algal tarda entre 7 y 30 días en responder a las variaciones fisicoquímicas asociadas con el afloramiento, el cual produce tanto aumento en la riqueza de especies, como en el crecimiento de los individuos (entre 2 a 4 veces) (Bula-Meyer, 1990; Díaz-Pulido y Garzón-Ferreira, 2002). Estos efectos fueron notorios durante febrero y marzo de 2018, meses en los cuales se encontraron las mayores coberturas algales en los tratamientos abiertos. El ligero descenso de la cobertura en abril se puede atribuir al cese del afloramiento costero, que concuerda con el inicio de la elevación de las temperaturas en el litoral por encima de los 28 °C al mediodía (Bula-Meyer, 1990). Es conocido que durante la estación húmeda menor (mayo-junio) y húmeda mayor (septiembre-noviembre), el afloramiento costero se detiene y en este periodo la biomasa algal disminuye considerablemente, tanto en el mesolitoral como en el infralitoral, suceso que es más notorio en la estación húmeda mayor, y es atribuido en general a las altas temperaturas del agua (Bula-Meyer, 1990).
Al analizar la cobertura de los grupos funcionales, se observó un predominio de las AF durante los meses de muestreo. Esto coincide con lo registrado por Díaz-Pulido y Garzón-Ferreira (2002) en un arrecife de coral en la bahía de Chengue – PNNT. Este grupo de algas presenta un patrón estacional bimodal, aumentando sus coberturas durante el afloramiento costero y disminuyendo durante la época de lluvias, evidenciando una relación inversa con los céspedes algales (AFIL). Esta estacionalidad de las AF podría estar relacionada principalmente con la variación en la temperatura del agua, ya que los cambios térmicos afectan directamente el protoplasma de las macroalgas, limitando la productividad primaria (Bula-Meyer, 1990; Díaz-Pulido y Garzón-Ferreira, 2002; Kinne, 1970). En lo que respecta a las ACI y las AC, Díaz-Pulido y Garzón-Ferreira (2002) mencionan que presentan variaciones en su cobertura a lo largo de todo el año sin evidenciarse un patrón. En esta investigación, las ACI y las AC presentaron un aumento gradual de su cobertura entre diciembre y abril, probablemente porque estas algas presentan un crecimiento bidimensional y lento < 1 cm por año, que en este caso pudo ser favorecido por el fuerte oleaje (Dethier, 1994; Dethier y Steneck, 2001).
Se evidenció un efecto de los tratamientos en las coberturas de las ACI y las AFIL, pero hubo efectos metodológicos asociados con la presencia de las jaulas que no permitieron demostrar la influencia directa de la herbivoría sobre estos grupos de algas. Sin embargo, el aumento significativo en la cobertura de las ACI en los tratamientos con C. pica, respecto a los tratamientos abiertos, sugiere que el pastoreo ejercido por este gasterópodo beneficia el desarrollo de Lithophyllum sp. Estos resultados concuerdan con lo mencionado por Fletcher (1987), Himmelman et al. (1983), Paine y Vadas (1969), Steneck (1982) y Vine (1974), quienes afirman, y en algunos casos demuestran, que la herbivoría por parte de algunos erizos y lapas es necesaria para el desarrollo de las algas calcáreas incrustantes, debido a que controlan su crecimiento excesivo y eliminan epifitas potencialmente letales para éstas. Adicionalmente, Randall (1964) encontró en el contenido estomacal de C. pica restos de algas calcáreas, lo cual demuestra que C. pica se alimenta o pastorea sobre estas algas.
Por otro lado, a pesar de que los controles abiertos tenían acceso libre a todos los herbívoros, se registró una menor cobertura de ACI en relación con el tratamiento de adición de C. pica. En tal sentido, como la abundancia natural de C. pica en el área de estudio es muy baja debido principalmente a la sobreexplotación (Daza-Guerra et al., 2018; Osorno y Díaz, 2006), es posible pensar que las otras especies de herbívoros presentes en el litoral rocoso, como por ejemplo el erizo Echinometra lucunter y los pequeños gasterópodos herbívoros Rhombinella laevigata y Echinolittorina meleagris, no favorecen el desarrollo de las ACI. Con estos resultados se evidencia la compleja relación funcional entre estos organismos, mostrando que los efectos de la herbivoría sobre la cobertura de las ACI dependen directamente de la especie de herbívoro presente en el área (Fletcher, 1987).
Para el caso de las AFIL, se registró una menor cobertura en las jaulas completamente cerradas (inclusión y exclusión), mientas las coberturas más altas se encontraron en los tratamientos de control (abierto y metodológico).

Esto indica un efecto negativo de la presencia de la jaula cerrada. Sin embargo, es posible que este efecto también tenga una base biológica. Por un lado, se sugiere que C. pica podría estar consumiendo este tipo de algas, teniendo en cuenta que se alimenta principalmente de algas filamentosas y algas con talo suave, debido a que su tamaño y estructura radular limitan físicamente la ingesta de algas de gran tamaño y textura firme (Randall, 1964). Cabe resaltar que algas filamentosas del género Oscillatoria y Sphacelaria, descritas en la dieta de C. pica por Randall (1964), se reportaron en el presente estudio agrupadas en AFIL. Por otro lado, que en ausencia de herbívoros, la proliferación de otros tipos de algas podría afectar las AFIL. Estudios previos han registrado una disminución en las coberturas de algas filamentosas en aquellos tratamientos en los cuales han sido excluidos los herbívoros; inicialmente se presenta un aumento de algas filamentosas oportunistas que posteriormente son reemplazadas por diversas especies de algas frondosas que proliferan por falta de depredadores (Lewis, 1986; Miller y Hay, 1998; Smith et al., 2010).
Por su parte, las diferencias observadas en las AF, entre los tratamientos abierto y control metodológico solo para diciembre, obedecen a las diferencias naturales en la cobertura algal inicial encontrada en cada jaula, ya que en este mes se iniciaron los experimentos. Por lo tanto, estas diferencias no pueden deberse a efectos de los tratamientos o del tiempo de muestreo, sino a que la disposición de las jaulas pudo haber abarcado diferentes características del sustrato, como por ejemplo pequeñas hendiduras, grietas y canales, los cuales crean condiciones particulares que generan una gran variedad de microhábitats, modificando la composición de especies a pequeña escala (Ardito y García, 2009; McGuinness y Underwood, 1986).
Para este estudio se emplearon individuos de C. Pica de tamaño pequeño (< 4.13 cm) según las categorías propuestas por Osorno (2005), Osorno y Díaz (2006) y Robertson (2003), teniendo en cuenta que este rango de tamaño es el más frecuente actualmente en los litorales rocosos del Caribe colombiano, producto de la sobreexplotación (Daza-Guerra et al., 2018; Osorno, 2005; Osorno y Díaz, 2006). En la actualidad, al dominar individuos de tallas pequeñas, el control por herbivoría que podrían haber ejercido en el pasado ejemplares de tallas grandes sobre el ensamblaje algal no se puede evidenciar, debido al incremento de las limitaciones físicas para alimentarse de algas grandes y firmes descritas por Randall (1964). C. pica es una especie básicamente herbívora-detritívora (Robertson, 2003). Su dieta consiste primordialmente de algas, tanto macroscópicas como microscópicas, presentando en su contenido estomacal algunas especies como Lyngbya majuscula Harvey ex Gomont, Ulvella lens P.L. Crouan y H.M. Crouan, Coelothrix irregularis (Harvey) Børgesen, Gelidium corneum (Hudson) J.V. Lamouroux, Padina gymnospora (Kützing) Sonder, Neoralfsia expansa (J. Agardh) P.E. Lim y H.Kawai ex Cormaci y G.Furnari, entre otras (Randall, 1964). Adicionalmente, se ha evidenciado que la textura, palatabilidad y/o toxicidad de ciertas algas, juegan un papel importante en la selectividad alimentaria de C. pica (Dawes, 1981; Osorno, 2005).
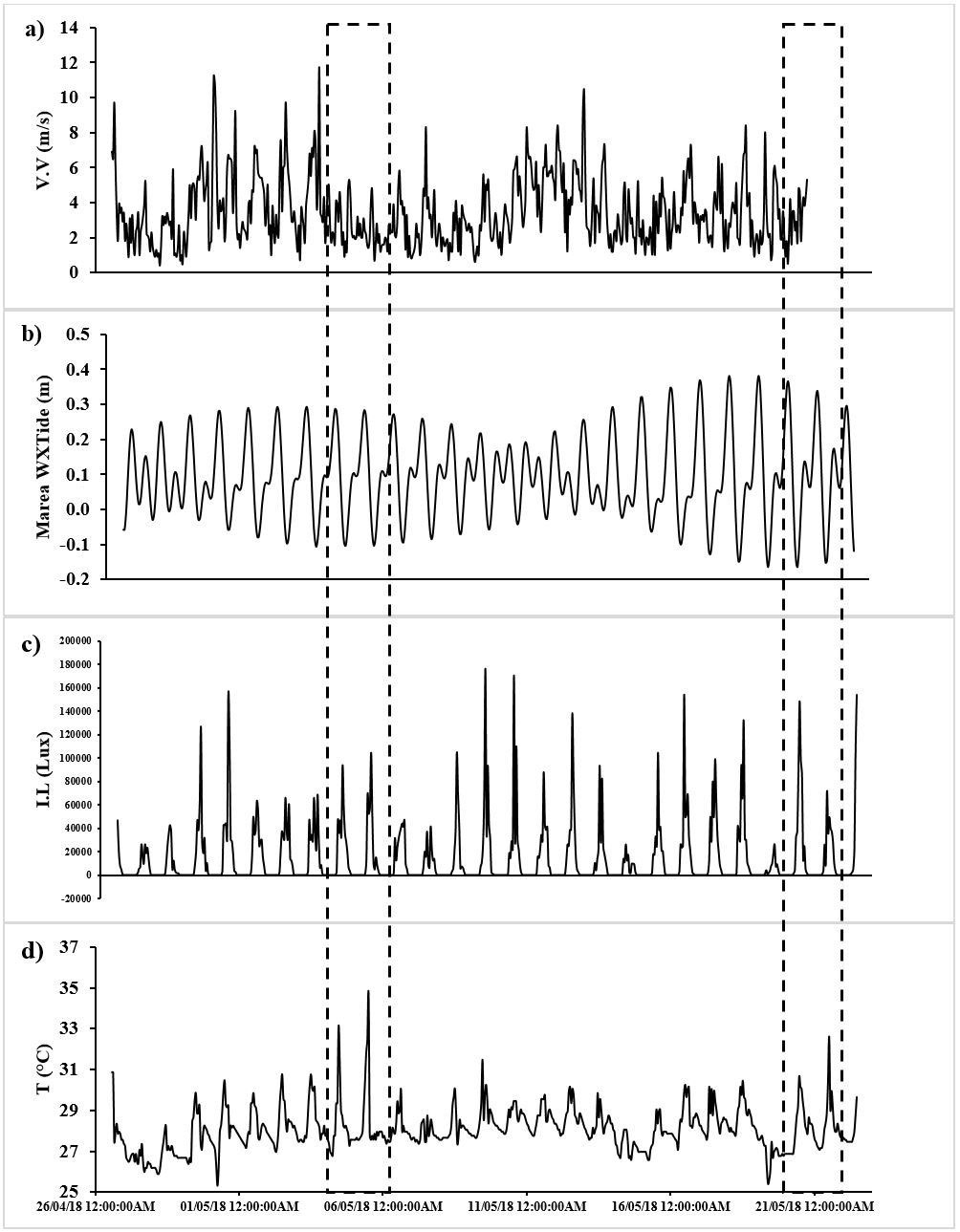
Durante enero y febrero, se observó una fuerte correlación con altos valores de salinidad y bajas temperaturas en el litoral rocoso, evidenciando que las variaciones en las variables fisicoquímicas del agua generadas por el fenómeno de afloramiento costero se acentúan durante este periodo. Estos resultados coinciden con lo registrado en el PNNT por Bula-Meyer (1990), en la bahía de Chengue por Díaz-Pulido y Garzón-Ferreira (2002) y en la bahía de Santa Marta por Mancera, Pinto et al. (2013).
En enero y febrero la cobertura algal mostró una correlación positiva con el amonio, a pesar de que marzo presentó el valor más alto de este nutriente durante el estudio, siendo superior a lo registrado para la bahía de Gaira (7.84 µg-at/L) por Campos et al. (2004) y en la bahía de Santa Marta (7.68 µg-at/L) por Mancera, Pinto et al. (2013). Independiente de presentarse estos valores puntuales elevados durante el afloramiento costero, en la literatura se registran promedios generales de amonio menores en la época seca en comparación con la época de lluvias, lo cual es atribuido a que este nutriente es consumido principalmente por el fitoplancton, mientras que su aumento en la época de lluvias está influenciado por la entrada por escorrentía de compuestos orgánicos nitrogenados (Franco-Herrera, 2005; Furnas, 1992; Mancera, Pinto et al., 2013; Pinto, 2005).
Se ha evidenciado la luz como un factor limitante de la producción bentónica primaria en ecosistemas submareales, en los cuales los efectos por estrés térmico y desecación son bajos (Harley, 2002; Ruiz y Romero, 2001). En el caso del PNNT, se afirma que la luz no es un factor limitante en el desarrollo del ensamblaje algal debido a la mortandad que se presenta al finalizar el afloramiento costero que ocurre en la zona intermareal y en aguas someras claras (Bula-Meyer, 1990). Sin embargo, en algunas ocasiones el aumento en la intensidad lumínica puede generar estrés térmico y desecación en los litorales rocosos, afectando a los organismos que en este habitan. Por lo tanto, podría presentarse una correlación negativa entre la irradiación y la producción/abundancia (Knox, 2001).
Por el contrario, los meses de mayo y junio presentaron una relación inversa con las variables ambientales en comparación con enero y febrero, lo que evidencia el cese del fenómeno de afloramiento costero y el inicio de las lluvias menores, generando una disminución en las coberturas algales de los litorales rocosos del PNNT (Bula-Meyer, 1990; Díaz-Pulido y Garzón-Ferreira, 2002).
Posterior al muestreo de abril, se presentó una mortandad de algas en el mesolitoral superior, evento que repercutió en los valores de cobertura de los meses siguientes. Este fenómeno se observó en litorales aledaños como se pudo constatar simultáneamente en el litoral rocoso de Granate (PNNT) y de manera recurrente en abril de 2019. En general, en ambos lugares se encontró Sargassum spp. con sus hojas quemadas y bajas coberturas algales, datos que concuerdan con lo afirmado por Bula-Meyer (1985, 1987, 1990).
La mortandad algal ocurrió finalizando el afloramiento costero e iniciándose la época de lluvia menor, pero se trató más de un evento extremo, que del fenómeno generalizado que ocurre durante la época de lluvia mayor (Bula-Meyer, 1990). Sin embargo, es probable que este tipo de fenómenos sean recurrentes y sean los responsables en buena medida del inicio de la disminución de la cobertura algal durante la época lluviosa menor descrito por Bula-Meyer (1990). En las zonas tropicales, los litorales rocosos están expuestos a factores estresantes como la temperatura y la desecación, lo cual puede influir indirectamente en la estructura de la comunidad (Good, 2004). El grado de exposición a estos factores determinará así mismo el nivel de los efectos, por ejemplo, en la zona baja de los litorales rocosos se presenta principalmente un control biológico por depredación, mientras que la zona alta es regulada por factores físicos (Macusi y Deepananda, 2013). Este parece ser el caso del mesolitoral superior del área de Santa Marta, en donde se encontró en el ensamblaje algal un fuerte control ambiental por eventos extremos.
Respecto a los grupos funcionales, no todos respondieron de la misma forma al evento de mortandad, las más afectadas fueron las AF. Por su mayor tamaño, fue evidente el efecto de la insolación al encontrarse abundantes algas quemadas. Las AFIL disminuyeron sus coberturas en mayo después de la mortandad, pero luego en junio presentaron un incremento, coincidiendo con lo registrado por Díaz-Pulido y Garzón-Ferreira (2002). Lo anterior es debido a que los céspedes algales, en comparación con otros grupos funcionales, pueden soportar altos niveles de estrés cuando se presentan condiciones adversas (época lluvia), ya que poseen adaptaciones morfológicas que les permite retener una mayor cantidad de partículas de sedimento, acumulando materia rica en fósforo orgánico, fundamental para su crecimiento (Airoldi y Virgilio, 1998; Hackney et al., 1989; Kendrick, 1991; Purcell, 2000; Purcell y Bellwood, 2001).
En cuanto a las AC y las ACI, su mortalidad dejó sobre el sustrato parches con sus remanentes blanqueados. También es probable que mientras las AFIL comenzaran a recuperarse de mayo a junio, las coberturas de ACI y AC se vieran disminuidas por recubrimiento de las AFIL. Se ha evidenciado que las ACI logran vivir como sotobosque en hábitats dominados por macroalgas erectas, y por lo general, terminan recubiertas por otras especies que se desarrollan sobre sustratos duros (Airoldi, 2000; Dethier, 1994). Esto se observó en el presente estudio, ya que las algas filamentosas Ulvella spp. y Cyanophyceae spp. recubrían al alga calcárea Lithophyllum sp. con posteridad a la mortandad, principalmente durante el mes de junio.
En conclusión, la herbivoría realizada por C. pica no ejerce un control fundamental sobre la composición y estructura del ensamblaje algal en el litoral rocoso de Bonito Gordo, al menos en la parte superior del mesolitoral. Solo se logró evidenciar un ligero favorecimiento de las ACI por la presencia de este gasterópodo. Es posible que en la actualidad, al dominar ejemplares de tallas pequeñas como consecuencia de la sobreexplotación, el control por herbivoría que podrían haber ejercido en el pasado ejemplares de tallas grandes sobre el ensamblaje algal no sea evidente en el presente. Por el contrario, el ensamblaje algal está siendo controlado por factores abióticos reguladores, como bajas velocidades del viento y bajas mareas al medio día, las cuales en combinación, incidieron en que la insolación aumentara la temperatura en el mesolitoral superior, generando la mortandad algal observada en el área de estudio. Adicionalmente, los recursos (nutrientes) desempeñarían un papel relevante al impulsar el crecimiento algal en los litorales rocosos del PNNT durante la temporada de afloramiento, mientras las temperaturas estén bajas y el oleaje sea suficiente para mantener húmedas a las algas, pero no en controlarlo, puesto que durante la temporada de lluvias también hay aporte de nutrientes por la descarga continental (Márquez, 1982). Por otro lado, la disminución estacional de las algas podría estar limitando las poblaciones de C. pica, constituyéndose en un control ascendente de éstas sobre el caracol, y no al contrario, como inicialmente se planteó.
Agradecimientos
A la Universidad Nacional de Colombia sede Caribe-CECIMAR y al Programa de Biodiversidad y Ecosistemas Marinos-BEM del Instituto de Investigaciones Marinas y Costeras – INVEMAR, por el apoyo logístico durante la fase de campo. A David Alonso y Diana Gómez por toda su colaboración; a Julieth Guerra, Rubén Daza, Andrea Daza, Yudy Cardona, Luis Ortiz, Edgar Arteaga y Nicolás Espada por su ayuda en las jornadas de muestreo; a Brigitte Gavio y Natalia Rincón, por su colaboración identificando y confirmando las especies de algas; a Nelson Valdivia del Laboratorio de Ecología Litoral de la Universidad Austral de Chile por su colaboración en los análisis estadísticos; a Álvaro Peña y Alfredo González por su hospitalidad en campo y el cuidado de los experimentos. Contribución Núm. 1260 de INVEMAR y Núm. 495 de CECIMAR y del Programa de Posgrado en Ciencias-Biología, Línea Biología Marina, Universidad Nacional de Colombia, Sede Caribe.
Referencias
Aguilera, M. (2010). Functional organization in intertidal molluscan herbivores: Consequences of spatial and behavioral patterns, and interspecific competition in the assemblage structure (Tesis doctural). Pontificia Universidad Católica de Chile, Santiago, Chile.
Aguilera, M. y Navarrete, S. (2007). Effects of Chiton granosus (Frembly, 1827) and other molluscan grazers on algal succession in wave exposed mid-intertidal rocky shores of central Chile. Journal of Experimental Marine Biology and Ecology, 349, 84–98. https://doi.org/10.1016/j.jembe.2007.05.002
Airoldi, L. (2000). Effects of disturbance, life histories, and overgrowth on coexistence of algal crusts and turfs. Ecology, 81, 798–814. https://doi.org/10.1890/0012-9658
(2000)081[0798:eodlha]2.0.co;2
Airoldi, L. y Virgilio, M. (1998). Responses of turf-forming algae to spatial variations in the deposition of sediments. Marine Ecology Progress Series, 165, 271–282. https://doi.org/10.3354/meps165271
Aponte, M. (1985). Evaluación taxonómica de las algas marinas de la costa noreste de la Isla de Margarita, Venezuela (Tesis de maestría). Universidad de Oriente, Cumaná, Venezuela.
Ardila, N., Navas, G. y Reyes, J. (2002). Libro rojo de invertebrados marinos de Colombia. Serie Libros Rojos de Especies Amenazadas de Colombia. Bogotá: Instituto de Investigación de Recursos Biológicos Alexander von Humboldt/ Ministerio del Medio Ambiente.
Ardito, S. y García, M. (2009). Estudio ficológico de las localidades de Puerto Francés y San Francisquito, estado Miranda, Venezuela. Acta Botanica Venezuelica, 32, 113–143.
Bula-Meyer, G. (1985). Un núcleo nuevo de surgencia en el Caribe colombiano detectado en correlación con las macroalgas. Boletín Ecotrópica, 12, 3–25.
Bula-Meyer, G. (1987). Taxonomic and ecologic studies of a subtidal sand plain macroalgal community in the Colombian Caribbean (Tesis doctoral). University of Delaware, Newark, EUA.
Bula-Meyer, G. (1990). Altas temperaturas estacionales del agua como condición disturbadora de las macroalgas del Parque Nacional Natural Tayrona, Caribe Colombiano: una hipótesis. Anales del Instituto de Investigaciones Marinas Punta Betín, 19-20, 9–21.
Campos, M., Orejarena, J. y Palomino, M. (2004). Dinámica de la biomasa fitoplanctónica en la capa de mezcla y su relación con la oceanometereología de la bahía de Gaira, Caribe colombiano, Fase II; febrero-mayo de 2004. Informe final, Universidad Bogotá Jorge Tadeo Lozano, Santa Marta.
Castell, L. (1987). Algunos aspectos de la biología y ecología de Cittarium pica (L.), “Quigua” (Prosobranchia, en el Parque Nacional Archipiélago de los Roques (Tesis). Universidad Central de Venezuela, Caracas, Venezuela.
Chapman, V. (1961). The marine algae of Jamaica. Part I. Myxophyceae and Chorophyceae. Bulletin of the Institute of Jamaica, Science Series, 12, 1–159.
Chapman, V. (1963). The marine algae of Jamaica. Part II. Phaeophyceae and Rhodophyceae. Bulletin of the Institute of Jamaica, Science Series, 10, 1–201.
Dawes, C. (Ed.). (1981). Marine Botany. New York: Wiley-Interscience Publication. https://doi.org/10.2307/2806388
Daza-Guerra, C. (2016). Aspectos poblacionales del burgao Cittarium pica (Linnaeus, 1758), (Mollusca: Gastropoda: Tegulidae) en el litoral rocoso de Santa Marta, Magdalena, Colombia (Tesis). Universidad del Atlántico, Barranquilla, Colombia.
Daza-Guerra, C., Martínez-Hernández, N. y Narváez-Barandica, J. (2018). Aspectos poblacionales del burgao Cittarium pica, (Gastropoda: Tegulidae) en el litoral rocoso de Santa Marta, Magdalena, Colombia. Revista Mexicana de Biodiversidad, 89, 430–442. https://doi.org/10.22201/ib.20078706e.2018.2.2229
Dethier, M. (1994). The ecology of intertidal algal crusts: variation within a functional group. Journal of Experimental Marine Biology and Ecology, 177, 37–71. https://doi.org/10.1016/0022-0981(94)90143-0
Dethier, M. y Steneck, R. (2001). Growth and persistence of diverse intertidal crusts: survival of the slow in a fast-paced world. Marine Ecology Progress Series, 223, 89–100. https://doi.org/10.3354/meps223089
Díaz, M. (2010). El papel de la densidad de propágulos algales, la herbivoría y la sedimentación en la estructura de la comunidad de macroalgas de los arrecifes coralinos del Caribe colombiano (Tesis de maestría). Universidad Nacional de Colombia, Santa Marta, Colombia.
Díaz, J. y Gómez, L. (Eds.). (2000). Programa nacional de investigación en biodiversidad marina y costera PNIBM. Santa Marta: INVEMAR/, FONADE/ MMA.
Díaz, J. y Puyana, M. (1994). Moluscos del Caribe colombiano. Un catálogo ilustrado. Bogotá: COLCIENCIAS/ Fundación Natura/ INVEMAR.
Díaz-Pulido, G. y Garzón-Ferreira, J. (2002). Seasonality in algal assemblages on upwelling-influenced coral reefs in the Colombian Caribbean. Botánica Marina, 45, 284–292. https://doi.org/10.1515/bot.2002.028
Doolan, B. y MacDonald, W. (1976). Structure and metamorphism of Schists of the Santa Marta Area, Colombia. En: Memorias del Congreso Colombiano de Geología, agosto 4-8 de 1969, Universidad Nacional de Colombia, Bogotá.
Fletcher, W. (1987). Interactions among subtidal Australian sea urchins, gastropods, and algae: effects of experimental removals. Ecological Monographs, 57, 89–109. https://doi.org/10.2307/1942640
Franco-Herrera, A. (2005). Oceanografía de la ensenada de Gaira: El Rodadero, más que un centro turístico en el Caribe colombiano. Bogotá: Universidad Bogotá Jorge Tadeo Lozano.
Furnas, M. (1992). The behavior of nutrients in tropical aquatic ecosystems. En D. Connell y D. Wawiker (Eds.), Pollution in tropical aquatic systems. (pp. 29–65). Boca Ratón: CRC Press. https://doi.org/10.1201/9781351075879-2
Good, T. (2004). Distribution and abundance patterns in Caribbean rocky intertidal zones. Bulletin of Marine Science, 74, 459–468.
Hackney, J., Carpenter, R. y Adey, W. (1989). Characteristic adaptations to grazing among algal turfs on a Caribbean coral reef. Phycologia, 28, 109–119. https://doi.org/10.2216/i0031-8884-28-1-109.1
Hammer, Ø., Harper, D. y Ryan, P. (2001). PAST: Paleontological statistics software package for education and data analysis. Palaeontologia Electronica, 4, 9.
Harley, C. (2002). Light availability indirectly limits herbivore growth and abundance in a high rocky intertidal community during the winter. Limnology and Oceanography, 47, 1217–1222. https://doi.org/10.4319/lo.2002.47.4.1217
Himmelman, J., Lavergne, Y., Axelsen, F., Cardinal, A. y Bourget, E. (1983). Sea urchins in the Saint Lawrence Estuary: their abundance, size-structure, and suitability for commercial exploitation. Canadian Journal of Fisheries and Aquatic Sciences, 40, 474–486. https://doi.org/10.1139/f83-066
Joly, A. (1967). Géneros de algas marinhas da costa Atlántica latino-americana. Brasil: Universidad de São Paulo.
Kendrick, G. (1991). Recruitment of coralline crusts and filamentous turf algae in the Galapagos archipelago: effect of simulated scour, erosion and accretion. Journal of Experimental Marine Biology and Ecology, 147, 47–63. https://doi.org/10.1016/0022-0981(91)90036-v
Kinne, O. (1970). Temperature: general introduction. En O. Kinne (Ed.), Marine ecology, Vol 1, Part. 1. (pp. 321–346). New York: John Wiley.
Knox, G. (2001). The ecology of seashores. Boca Ratón: CRC Press. https://doi.org/10.1201/9781420042634
Legendre, P. y Legendre, L. (1998). Numerical ecology. Developments in environmental modelling. Amsterdam: Elsevier Science.
Lemus, A. (1979). Las algas marinas del golfo de Paria, Venezuela. I. Chlorophyta y Phaeophyta. Boletin del Instituto de Oceanografía de la Universidad de Oriente, 18, 17–36.
Lemus, A. (1984). Las algas marinas del golfo de Paria, Venezuela. II. Rhodophyta. Boletin del Instituto de Oceanografía de la Universidad de Oriente, 23, 55–112.
Lewis, J. (1964). The Ecology of rocky shores. London: English University Press.
Lewis, S. (1986). The role of herbivorous fishes in the organization of a Caribbean reef community. Ecological Monographs, 56, 183–200. https://doi.org/10.2307/2937073
Littler, M. y Littler, D. (1980). The evolution of thallus form and survival strategies in benthic marine macroalgae: field and laboratory tests of a functional form model. The American Naturalist, 116, 25–44. https://doi.org/10.1086/283610
Littler, D. y Littler, M. (2000). Caribbean reef plants. Washington: Offshore Graphics.
Longhurst, A. (1998). Ecological geography of the sea. San Diego: Academic Press. https://doi.org/10.1016/b978-0-12-455521-1.x5000-1
Lubchenco, J., Menge, B., Garrity, S., Lubchenco, P., Ashkenas, L., Gaines, S. et al. (1984). Structure, persistence, and role of consumers in a tropical rocky intertidal community (Taboguilla Island, Bay of Panama). Journal of Experimental Marine Biology and Ecology, 78, 23–73. https://doi.org/10.1016/0198-0254(84)93487-3
Macusi, E. y Deepananda, K. (2013). Factors that structure algal communities in tropical rocky shores: what have we learned? International Journal of Scientific and Research Publications, 3, 1–13.
Mancera, J., Gavio, B. y Lasso, J. (2013) Principales amenazas a la biodiversidad marina. Revista Actualidades Biológicas, 35, 111–133.
Mancera, J., Pinto, G. y Vilardy, S. (2013). Patrones de distribución estacional de masas de agua en la bahía de Santa Marta, Caribe colombiano: importancia relativa del upwelling y outwelling. Boletín de Investigaciones Marinas y Costeras, 2, 329–360.
Manrique, N., Bejarano, S. y Garzón, J. (2006). Crecimiento del abanico de mar Gorgonia ventalina (Linnaeus, 1758) (Cnidaria: Gorgoniidae) en el área de Santa Marta, Caribe colombiano. Boletín de Investigaciones Marinas y Costeras, 35, 77–90.
Márquez, G. (1982). Los sistemas ecológicos marinos del sector adyacente a Santa Marta, Caribe colombiano I: Generalidades. Ecología Tropical, 2, 5–18.
Márquez, G. y Guillot, G. (1983). La vegetación marina del Parque Nacional Tayrona, costa caribe colombiana, II. Tipos de vegetación. Anales del Instituto de Investigaciones Marinas Punta Betín, 13, 17–51.
McGuinness, K. y Underwood, A. (1986). Habitat structure and the nature of communities on intertidal boulders. Journal of Experimental Marine Biology and Ecology, 104, 97–123. https://doi.org/10.1016/0022-0981(86)90099-7
Mclean, R. (1967). Measurements of beachrock erosion by some tropical marine gastropods. Bulletin of Marine Science, 17, 551–556.
Menge, B. (1995). Indirect effects in marine rocky intertidal interaction webs: patterns and importance. Ecological Monographs, 65, 21–74. https://doi.org/10.2307/2937158
Menge, B. (1997). Detection of direct versus indirect effects: were experiments long enough? The American Naturalist, 149, 801–823. https://doi.org/10.1086/286025
Menge, B., Lubchenco, J., Ashkenas, L. y Ramsey, F. (1986). Experimental separation of effects of consumers on sessile prey in the low zone of a rocky shore in the Bay of Panama: direct and indirect consequences of food web complexity. Journal of Experimental Marine Biology and Ecology, 100, 225–270. https://doi.org/10.1016/0022-0981(86)90164-4
Miller, M. y Hay, M. (1998). Effects of fish predation and seaweed competition on the survival and growth of corals. Oecologia, 113, 231–238. https://doi.org/10.1007/s004420050373
Miloslavich, P. y Carbonini, A. (2010). Manual de muestreo para comunidades costeras, protocolo para litorales rocosos y praderas de fanerógamas marinas. Caracas: Universidad Simón Bolívar.
Mittelbach, G. (1981). Foraging efficiency and body size: a study of optimal diet and habitat use by bluegills. Ecology, 62, 1370–1386. https://doi.org/10.2307/1937300
Moreno, C. y Jaramillo, E. (1983). The role of grazers in the zonation of intertidal macroalgae of the Chilean coast. Oikos, 41, 73–76. https://doi.org/10.2307/3544348
Ormond, R. y Banaimoon, S. (1994). Ecology of intertidal macroalgal assemblages on the Hadramout coast of southern Yemen, an area of seasonal upwelling. Marine Ecology-Progress Series, 105, 105–120. https://doi.org/10.3354/meps105105
Osorno, A. (2005). Bioecología de la ‘cigua’ o ‘burgao’ Cittarium pica (Linnaeus, 1758) (Mollusca: Gastropoda: Trochidae) en la costa continental del Caribe colombiano. Santa Marta (Tesis). Fundación Universidad de Bogotá Jorge Tadeo Lozano. Bogotá, Colombia.
Osorno, A. y Díaz, J. (2006). Explotación, usos y estado actual de la cigua o burgao Cittarium pica (Mollusca: Gastropoda: Trochidae) en la costa continental del Caribe colombiano. Boletín de Investigaciones Marinas y Costeras, 35, 133–148.
Paine, R. y Vadas, R. (1969). The effects of grazing by sea urchins, strongylocentrotus spp., on benthic algal populations. Limnology and Oceanography, 14, 710–719. https://doi.org/10.4319/lo.1969.14.5.0710
Pinheiro, J., Bates, D., DebRoy, S., Sarkar, D. y R Core Team (2018). nlme: Linear and nonlinear mixed effects models. R package version 3.1-137, https://CRAN.R-project.org/package=nlme
Pinto, G. (2005). Patrones de distribución espacial de la concentración de nitrógeno, fosforo y sílice en la bahía de Santa Marta, Caribe colombiano (Tesis). Universidad Jorge Tadeo Lozano, Santa Marta.
Purcell, S. (2000). Association of epilithic algae with sediment distribution on a windward reef in the northern Great Barrier Reef, Australia. Bulletin of Marine Science, 66, 199–214.
Purcell, S. y Bellwood, D. (2001). Spatial patterns of epilithic algal and detrital resources on a windward coral reef. Coral Reefs, 20, 117–125. https://doi.org/10.1007/s003380100150
R Development Core Team (2008). R: a language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. http://www.R-project.org
Randall, H. (1964). A study of the growth and other aspects of the biology of the West Indian Top Shell Cittarium pica (Linnaeus). Bulletin of Marine Science, 14, 424–443.
Robertson, R. (2003). The edible West Indian “whelk” Cittarium pica (Gastropoda: Trochidae): Natural history with new observations. Proceedings of the Academy of Natural Sciences of Philadelphia, 153, 27–47. https://doi.org/10.1635/0097-3157(2003)153[0027:tewiwc]2.0.co;2
Ruiz, J. y Romero, J. (2001). Effects of in situ experimental shading on the Mediterranean seagrass Posidonia oceanica. Marine Ecology Progress Series, 215, 107–120. https://doi.org/10.3354/meps215107
Russell, L. (2018). emmeans: Estimated marginal means, aka Least-Squares Means. R package version 1.3.0. https://CRAN.R-project.org/package=emmeans
Smith, J., Hunter, C. y Smith, C. (2010). The effects of top–down versus bottom–up control on benthic coral reef community structure. Oecologia, 163, 497–507. https://doi.org/10.1007/s00442-009-1546-z
Steiner, S. y Williams, S. (2006). The density and size distribution of Diadema antillarum in Dominica (Lesser Antilles): 2001-2004. Marine Biology, 149, 1071–1078. https://doi.org/10.1007/s00227-006-0279-3
Steneck, R. (1982). A limpet-coralline alga association: adaptations and defenses between a selective herbivore and its prey. Ecology, 63, 507–522. https://doi.org/10.2307/1938967
Steneck, R. y Dethier, M. (1994). A functional group approach to the structure of algal dominated communities. Oikos, 69, 476–498. https://doi.org/10.2307/3545860
Stephenson, T. y Stephenson, A. (1972). Life between tidemarks on rocky shores. San Francisco: Freeman.
Strickland, J. y Parsons, T. (1972). A practical handbook of seawater analysis. Otawa: Fisheries Research Board of Canada.
Taylor, W. (1960). Marine algae of the eastern tropical and subtropical coast of the Americas. Michigan: Lord Baltimore Press/ Universidad de Michigan.
Vine, P. (1974). Effects of algal grazing and aggressive behaviour of the fishes Pomacentrus lividus and Acanthurus sohal on coral-reef ecology. Marine Biology, 24, 131–136. https://doi.org/10.1007/bf00389347
Vinueza, L., Branch, G., Branch, M. y Bustamante, R. (2006). Top-down herbivory and bottom-up el niño effects on galápagos rocky-shore communities. Ecological Monographs, 76, 111–131. https://doi.org/10.1890/04-1957
White, T. (1978). The importance of relative shortage of food in animal ecology. Oecologia, 33, 233–242. https://doi.org/10.1007/bf00376997
Wootton, J. (1994). The nature and consequences of indirect effects in ecological communities. The Annual Review of Ecology, Evolution, and Systematics, 25, 443–466. https://doi.org/10.1146/annurev.es.25.110194.002303
WWF (Fondo Mundial para la Naturaleza ). (2015). Living blue planet report: species, habitats and human well-being. Gland, Suiza: WWF.
Wynne, M. (2011). A check-list of benthic marine algae of the tropical and subtropical western Atlantic: third revision. Nova Hedwigia, 140, 1–166.
Wynne, M. (2017). A checklist of benthic marine algae of the tropical and subtropical western Atlantic: fourth revision. Nova Hedwigia Beihefte, 145, 1–202.




