Hiram Herrera-Barquín a, Antonio Leija-Tristán a, * y Carlos Javier Aguilera-González b
a Universidad Autónoma de Nuevo León, Facultad de Ciencias Biológicas, Departamento de Ecología, Laboratorio de Ecología Pesquera, Avenida Universidad s/n, Ciudad Universitaria, 66455 San Nicolás de los Garza, Nuevo León, México
b Universidad Autónoma de Nuevo León, Facultad de Ciencias Biológicas, Departamento de Ecología, Laboratorio de Ecofisiología, Avenida Universidad s/n, Ciudad Universitaria, 66455 San Nicolás de los Garza, Nuevo León, México
*Autor para correspondencia: antonio.leijatr@uanl.edu.mx (A. Leija-Tristán)
Recibido: 13 marzo 2020; aceptado: 25 junio 2020
Resumen
Se estudió el crecimiento individual, el factor de condición y la condición relativa de Tozeuma carolinense durante las temporadas de lluvias y estiaje en 3 sitios cubiertos por pastos marinos en el área meridional de la laguna Madre de Tamaulipas, México. El material biológico se obtuvo tamizando una muestra superficial equivalente a 1.5 m2. A cada individuo se le midió la longitud total y se registró su peso. Los parámetros analizados para comparar la condición de la población fueron examinados por temporada, para datos agrupados y por sexo, a través de la relación peso-longitud (W = a*Lb), definido mediante el valor de la pendiente (b) y significado por una prueba de t-student (p < 0.05). Un total de 412 individuos fueron identificados y distribuidos en 4 grupos: datos agrupados (DA), machos (M), hembras no ovígeras (HNO) y hembras ovígeras (HOV), de los cuales 307 fueron recolectados en la temporada de lluvias y 105 en la del estiaje. Los especímenes de T. carolinense mostraron que la mayoría de los grupos, en ambas temporadas, se ajustaron a un crecimiento de tipo alométrico, exceptuando los DA en estiaje y las HNO en lluvias que presentaron isometría. Los valores más altos del factor de condición se encontraron en las HOV (0.628). La condición relativa osciló entre 0.893 en M en el estiaje y 1.26 en las HOV en la temporada de lluvias.
Palabras clave: Hippolytidae; Crecimiento; Condición; Condición relativa
© 2022 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Growth, condition factor and relative condition of the shrimp Tozeuma carolinense (Decapoda: Caridea: Hippolytidae) in the southern region of Laguna Madre, Tamaulipas, Mexico
Abstract
We studied individual growth, condition factor and relative condition of the shrimp Tozeuma carolinense during dry and rainy season from three seagrass-covered locations at the southern region of Laguna Madre of Tamaulipas, Mexico. Biological material was obtained by sieving a superficial sample equivalent to 1.5 m2. Total length and weight for each individual were measured. The analyzed parameters to compare the population condition were examined by season, pooled data and sex, through the length-weight relationship (W = a*Lb), which was defined by the b slope value and tested for significance with a t-student test (p < 0.05). A total of 412 specimens were identified and arranged within 4 groups: pooled data (DA), males (M), non-ovigerous females (HNO) and ovigerous females (HOV), of which 307 were collected in the rainy season and 105 in the dry season. Most of the analyzed groups of T. carolinense specimens showed allometric growth at both seasons, except for DA during dry season and HNO in the rainy period, which presented isometry. The highest values of condition factor were for HOV (0.628). Relative condition ranged from 0.893 for M in the dry period to 1.26 for HOV during the rainy season.
Keywords: Hippolytidae; Growth; Condition factor; Relative condition factor
© 2022 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
La reproducción, el crecimiento individual y la condición relativa o grado de bienestar son aspectos importantes en la ecología y ciclo de vida de las poblaciones (Anger y Moreira, 1998; Corey y Reid, 1991; Zare et al., 2011). En crustáceos, estos parámetros son cuantificados mediante relaciones biométricas y analizados a través de modelos de regresión lineal y no lineal (Anger y Moreira, 1998). El crecimiento individual se relaciona con rasgos biológicos, tales como la longitud y la amplitud corporal, así como su madurez sexual (Bauer, 2004; Cházaro-Olvera, 2009; Kim, 2005). La relación peso-longitud es una herramienta matemática frecuentemente utilizada en ecología pesquera para describir el crecimiento de los organismos en su hábitat (Deekae y Abowei, 2010; Lalrinsanga et al., 2012). Esta relación puede variar temporalmente en función de la disponibilidad de alimento, la tasa de ingesta y la actividad reproductiva (Bagenal y Tesch, 1978; Vafidis et al., 2008). Por otro lado, los factores de condición comparan el estado de bienestar de los individuos y su criterio fundamental indica que, a mayor peso de un organismo a una longitud determinada, mejor será su condición (Abowei y George, 2009; Deekae y Abowei, 2010; Soomro et al., 2012). Estas cuantificaciones representan indicadores que reflejan las interacciones entre el grupo de factores bióticos y abióticos y la condición fisiológica del organismo, el estatus de bienestar poblacional y la condición o reserva energética de los individuos en una población (Lalrinsanga et al., 2012).
Tozeuma carolinense es un camarón con distribución en el Atlántico oeste, desde Vineyard Sound, en la costa noreste de EUA, el golfo de México hasta São Paulo, Brasil, y de Bermuda a la Isla de Santa Lucía y Curaçao, Venezuela (Bauer, 2004; Román-Contreras y Martínez-Mayén, 2009). Es muy abundante en hábitats con vegetación acuática sumergida compuesta de Syringodium filiforme, Thalassia testudinum y Halodule wrightii en latitudes tropicales, y de Zostera spp. y Diplanthera spp. en regiones templadas (Barba-Macías, 2012; Barba-Macías et al., 2005; Ewald, 1969; Herrera-Barquín et al., 2018). Los ejemplares de T. carolinense se mantienen adheridos a las hojas de estos pastos para alimentarse de las epífitas y a la vez se protegen de los depredadores (Hays, 2005; Kneib, 1988). Esta especie habita en aguas euhalinas y poli-hipersalinas y está ausente en hábitats con baja salinidad (Barba-Macías et al., 2005; Sánchez et al., 1996). Las hembras adultas son considerablemente más grandes que los machos (54 y 40 mm, respectivamente) y de color más vívido, el cual puede variar dependiendo del hábitat (Ewald, 1969). Pueden residir en profundidades de hasta 150 m y son fácilmente distinguibles por su forma alargada y por poseer un rostro de mayor longitud que el caparazón, con borde libre en su porción dorsal, pero armado en la región ventral con una serie de hasta 19 dientes (Abele y Kim, 1986; Chace, 1972; Ewald, 1969; Holthuis, 1947; Williams, 1984). Ewald (1969) describió el desarrollo larvario y reportó que las hembras ovígeras se presentan todo el año, con una correlación entre el tamaño de la hembra y su masa ovígera.
En la literatura especializada se encuentra información de Tozeuma carolinense sobre aspectos de fecundidad y reproducción (Bortolini et al., 2019; Corey y Reid, 1991; Heck, 1977; Martínez-Mayén et al., 2020), el papel que desempeña en la estructura de la comunidad de macroinvertebrados asociados a pastos marinos bajo diversas condiciones ecológicas (Barba-Macías et al., 2005; Heck, 1977; Livingston, 1984; Sheridan, 2004; Sheridan y Minello, 2003), los mecanismos antipredatorios (Cournoyer y Cohen, 2011; Main, 1985, 1987) y la prevalencia de infestación parasitaria por isópodos (Romero-Rodríguez y Martínez-Mayén, 2018). Asimismo, T. carolinense ha sido reportada en inventarios faunísticos regionales (Almeida y Guerrazzi, 2007; Barba-Macías, 2012; Barba-Macías et al., 2005; Herrera-Barquín et al., 2018; Leija-Tristán et al., 2000; Nizinski, 2003; Rodríguez-Almaráz et al., 2000; Román-Contreras y Martínez-Mayén, 2009; Souza et al., 2011).
En el golfo de México, la laguna Madre es el ecosistema estuarino más grande de México (Contreras y Castañeda, 2004). Por sus características físicas, químicas y biológicas provee bienes y servicios que sustentan una alta biodiversidad, el desarrollo de la comunidad bentónica estuarina y la economía del sector pesquero y productivo (Leija-Tristán, 2005; Semarnat, 2015). Se han reportado 96 especies de crustáceos, de las cuales 14 son camarones carídeos (Leija-Tristán et al., 2000). Los Caridea, con ca. 3,500 especies conocidas en todo el mundo, representan el segundo infraorden más diverso entre los crustáceos decápodos y el primero entre los camarones. En la laguna Madre y otros sistemas costeros del golfo de México, T. carolinense se ha reportado como una especie de gran abundancia, sólo superada por Hippolyte zostericola (Barba-Macías, 2012; Herrera-Barquín et al., 2018). A pesar de los atributos ecológicos de abundancia y amplia distribución, los estudios sobre T. carolinense en la laguna Madre, se han enfocado primordialmente a su participación como parte de la comunidad en listados faunísticos (Barba-Macías, 2012; Barba-Macías et al., 2005; Herrera-Barquín et al., 2018; Leija-Tristán et al., 2000; Rodríguez-Almaráz et al., 2000). El presente trabajo se enfocó en el análisis comparativo del crecimiento individual, el factor de condición y la condición relativa del camarón Tozeuma carolinense durante los periodos de estiaje y lluvias del año 2014.
Materiales y métodos
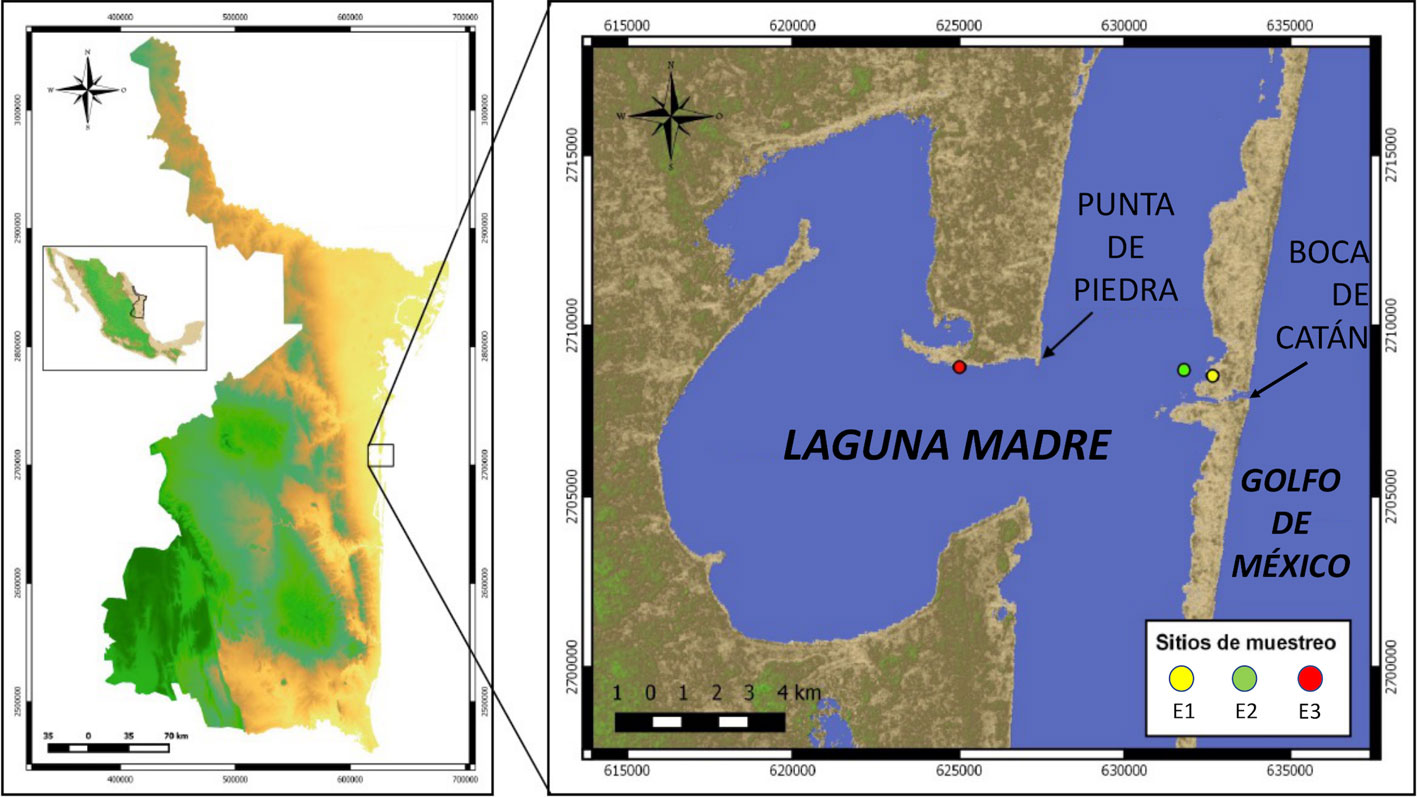
Especímenes adultos de Tozeuma carolinense se recolectaron durante las temporadas de estiaje y lluvias en marzo y agosto del 2014, respectivamente, en 3 sitios ubicados en la región meridional de la laguna Madre de Tamaulipas, México. Los muestreos se realizaron entre las 11:00 y las 15:00 h, durante 3 días consecutivos, en: 1) zona cubierta por bancos de Crassostrea virginica, ubicada en el sotavento de la isla de barrera y de gran influencia marina (24°28’55” N, 97°41’24” O); 2) zona de pequeñas terrazas revestidas por pastos marinos situadas a un costado del canal de navegación (24°29’05” N, 97°41’55” O); y 3) zona somera localizada en la Laguna de Catán (24°29’17” N, 97°46’03” O) (fig. 1).
El material biológico se obtuvo con un tamiz rectangular de 60 cm de longitud y 20 cm de anchura con una luz de malla de 1.26 mm. Se obtuvieron muestras de 1.5 m2 de área superficial con pasto marino y sedimento. Las muestras se tomaron cada 5 m a lo largo de 2 transectos, cada uno de 20 m lineales en praderas de vegetación acuática compuesta de Syringodium filiforme, Thalassia testudinum y Halodule wrightii. Los ejemplares de T. carolinense fueron identificados de acuerdo con Abele y Kim (1986), Chace (1972) y Williams (1984) y se fijaron en alcohol isopropílico al 70%. En cada sitio de muestreo se registraron los valores de las variables temperatura y pH del agua con un potenciómetro/termómetro digital Combo Waterproof HANNA HI 98130, el oxígeno disuelto con un oxímetro HANNA modelo HI 9146, y la salinidad con un refractómetro portable Vista modelo A366ATC (tabla 1).
A cada individuo de T. carolinense se le midió la longitud total (LT) (punta del rostro a la punta del telson) con un vernier (digital Kobalt 293883). Asimismo, se registró el peso total individual en gramos (PT) con una balanza digital (Ohaus Navigator 8110). Los ejemplares fueron separados por sexo y se obtuvo la proporción de hembras ovígeras. La proporción de sexos fue estimada como el cociente entre el número de machos y el número total de individuos recolectados en cada muestra (Martínez-Mayén et al., 2020). Se aplicó una prueba de Chi-cuadrada con corrección de Yates para medir la desviación de la proporción sexual calculada del valor esperado de 1:1 (macho:hembra) por temporada (Yates, 1934; Zar, 2010). Con los datos biométricos de 4 grupos de individuos: (1) datos agrupados (DA), (2) machos (M), (3) hembras no-ovígeras (HNO) y (4) hembras ovígeras (HOV), se determinó el tipo de crecimiento individual por temporada, con base en la relación peso-longitud, a través de la ecuación con modelo potencial propuesta por Ricker (1975), definida como los ajustes en el peso en función de la talla (W = a*Lb), determinado como isométrico si b = 3, alométrico negativo si b < 3 y alométrico positivo si b > 3 (Morey et al., 2003). Se aplicó una prueba de t-student (p < 0.05) para evaluar la significancia de los valores de la pendiente con la siguiente ecuación (Sokal y Rohlf, 1981): t = b-3/Sb, donde b es la pendiente de la relación peso-longitud, 3 = valor hipotético de la pendiente (o hipótesis nula) y Sb es el error estándar de la pendiente. Asimismo, se aplicó otra prueba de t-student para determinar diferencias temporales (p < 0.05) entre los valores de la pendiente mediante la ecuación: t = b1–b2/Sb1–b2 (Zar, 2010), donde b1 es la pendiente de la muestra 1, b2 es la pendiente de la muestra 2 y Sb1-b2 es el error estándar de la diferencia entre las pendientes, el cual se calculó de la siguiente manera: Sb1–b2 = √S2b1 + S2b2, que es la raíz cuadrática de los errores estándar de las pendientes elevadas al cuadrado. El error estándar de la pendiente se estimó mediante: Sb = (b/√n–2) ( √1/r2–1), donde b es la pendiente de la relación peso-longitud, n es el número de individuos de la población analizada y r2 es el coeficiente de determinación.
Tabla 1
Variables de la calidad del agua en los sitios de muestreo en marzo (temporada de estiaje [ES]) y agosto (temporada de lluvias [LL]) 2014. E1 = Estación 1; E2 = estación 2; E3 = estación 3; ES = estiaje; LL = lluvias; nd = no determinado.
|
Variable |
E1 |
E2 |
E3 |
|||
|
ES |
LL |
ES |
LL |
ES |
LL |
|
|
T (ºC) |
22.6 |
35.2 |
18.1 |
36.2 |
15.4 |
34.3 |
|
Salinidad (‰) |
30 |
32 |
34 |
31 |
35 |
35 |
|
Oxígeno disuelto (mg/l) |
nd |
12.9 |
nd |
12.8 |
nd |
13.3 |
|
pH |
7.2 |
8.6 |
7.3 |
8.5 |
7.8 |
8.8 |
Posteriormente, se comparó el valor calculado de t con el tabulado para obtener la significancia del mismo. Si el valor calculado de t es menor que el tabulado, no se rechaza la hipótesis nula y por lo tanto b = 3, o bien, no hay diferencias temporales en los valores de las pendientes (b1 = b2). Adicionalmente, se realizó un análisis de covarianza (Ancova) para determinar si existen diferencias (p < 0.05) en las pendientes calculadas entre los distintos grupos de estadio sexual.
Con los resultados de las relaciones peso-longitud, de los grupos analizados, se calculó el factor de condición K (o índice de Fulton) y la condición relativa (Kn o Wr), los cuales representan el grado de bienestar de las poblaciones de especies acuáticas en su hábitat (Gomiero y de Souza-Braga 2005). El factor K se estimó para cada individuo con la información arrojada por el modelo potencial W = a*Lb mediante una modificación a la ecuación: K = 100 * W/L3, donde K es el factor de condición, W es el peso de los camarones en gramos, L es la longitud total (mm) de los individuos y 3 es el valor hipotético de la pendiente para un crecimiento isométrico. En el presente estudio, se sustituyó el valor de 3 por el parámetro b resultante de la relación peso-longitud, ajustando la pendiente de acuerdo al grupo analizado. La interpretación es que entre mayor sea el valor de K, mejor será la condición de la población. La fórmula modificada quedó como sigue:
K = 100 * W/Lb.
La condición relativa o peso relativo (Wr) fue propuesta por Le Cren (1951) y es definida como la tasa entre el peso individual y el peso estándar de una población (derivado de la relación peso-longitud). Se calculó con la ecuación: Wr = W/Ws, donde W es el peso observado individual (o peso empírico) y Ws es el peso estándar ajustado a la longitud específica individual, derivado de la relación peso-longitud (Murphy et al., 1990). Una buena condición en el crecimiento se deduce cuando Wr ≥ 1, mientras que el organismo se encuentra en pobre condición de crecimiento comparado con un individuo promedio de la misma longitud cuando Wr < 1 (Jisr et al., 2018). Se usó la prueba no-paramétrica de Kruskal-Wallis (H) para detectar diferencias en el factor de condición y condición relativa entre los grupos de camarones para ambas temporadas de estudio. Adicionalmente, se probaron diferencias en estos índices en función de la temporada mediante una prueba de t-student (Jisr et al., 2018). Todos los análisis se llevaron a cabo con el paquete estadístico SPSS versión 26.
Resultados
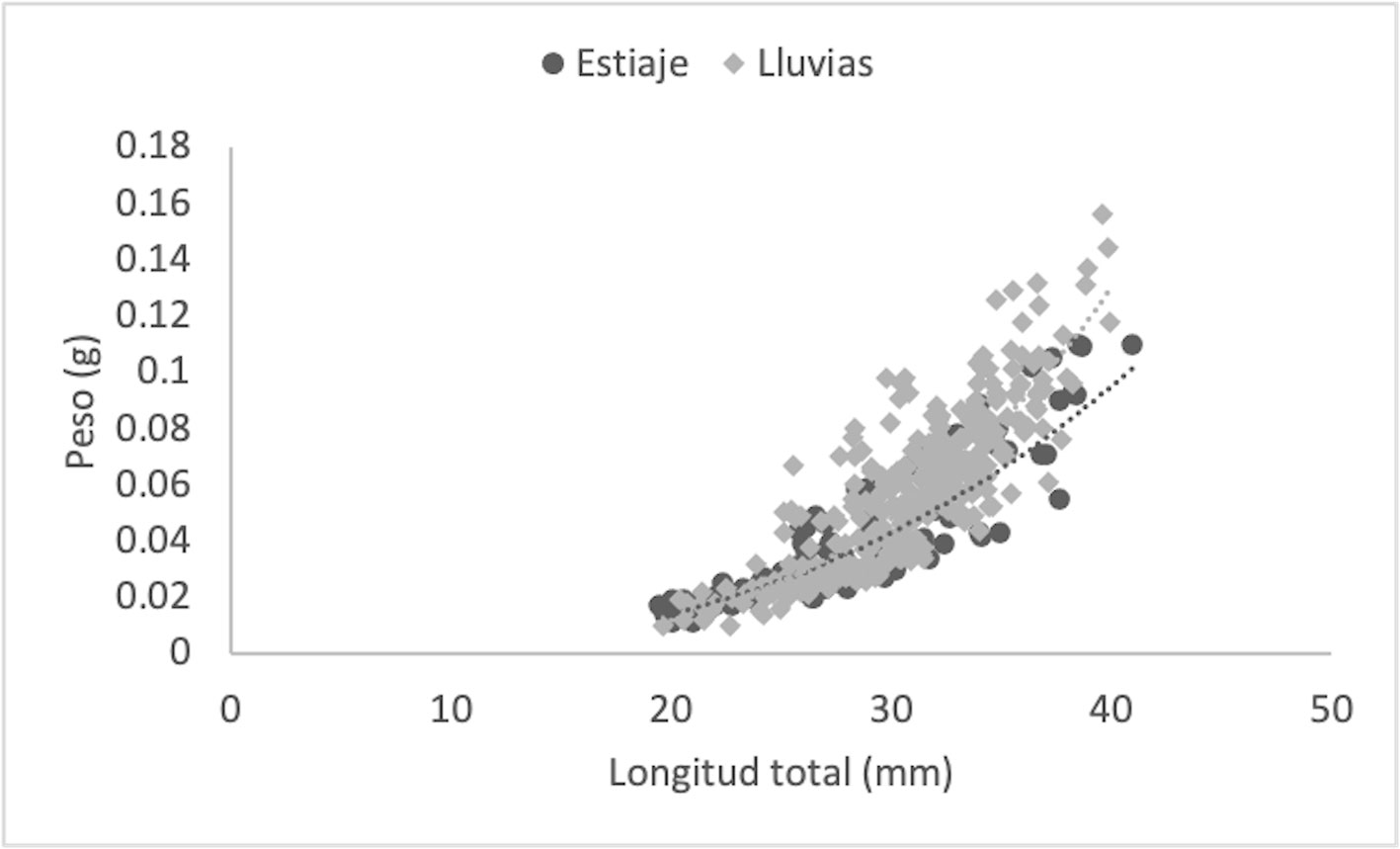
Se estudiaron un total de 412 individuos de Tozeuma carolinense, 307 recolectados en la temporada de lluvias y 105 en la de estiaje. Los resultados numéricos de cada parámetro y grupos medidos se muestran en tabla 2. En la temporada de estiaje, el número de machos fue mayor que el de las hembras, con una proporción de 0.50:1, sin embargo, no fue significativamente diferente a la tasa esperada de 1:1 (χ2 = 0.002, p < 0.05). En la temporada de lluvias, el total de hembras fue claramente superior a los machos (0.24:1), difiriendo significativamente de la proporción 1:1 (χ2= 81.8, p < 0.05). Con los datos biométricos fue determinado el crecimiento individual, para datos agrupados y por sexo, a través de la relación peso-longitud (W = a*Lb), definido mediante el valor de la pendiente (b) y significado por una prueba de t-student (p < 0.05), la cual osciló entre 2.02 (M: estiaje) y 3.45 (DA: lluvias). Los especímenes de T. carolinense en DA, se ajustaron a un crecimiento de tipo isométrico en la época de estiaje (t = -1.96; b ≈ 3) y alométrico positivo en lluvias (t = 4.03; b > 3). De forma particular los M (t = -7.07; b < 3, estiaje: t = -7.48; b < 3, lluvias) y las HOV (t = -3.57, b < 3, estiaje: t = -4.34, b < 3, lluvias), de ambas temporadas, mostraron alometría negativa. Las HNO, exhibieron alometría negativa en estiaje (t = -1.97; b < 3) e isometría en lluvias (t = 1.19; b ≈ 3) (figs. 2-5; tabla 2). El Ancova reveló diferencias significativas en las pendientes de los grupos por estadio sexual (F = 12.3; p < 0.05) y temporada (F = 4.51; p < 0.05).
Los valores promedio del factor de condición K, oscilaron entre 0.1131 para datos agrupados en la temporada de lluvias y 0.6280 en hembras ovígeras en la temporada de estiaje. Se encontraron diferencias significativas en el factor de condición de los 4 grupos, en ambas temporadas. No se encontró diferencia significativa en los datos agrupados por época (tabla 3).
El factor de condición relativa fluctuó de 0.893 en los machos en la temporada de estiaje a 1.26 en las hembras ovígeras en la temporada de lluvias. Los machos y HNO no mostraron diferencias significativas en el análisis de la temporalidad. En las HOV sí se presentó efecto significativo considerando las fechas de muestreo. La condición relativa mostró diferencias significativas por temporada en los datos agrupados (tabla 4).
Discusión
Las diferencias en la relación peso-longitud de poblaciones de camarones silvestres han sido relacionadas con su metabolismo, cambios en su biología reproductiva y con las variaciones en la disponibilidad de alimento (Pérez-Castañeda y Defeo, 2002). En el presente estudio, los machos de Tozeuma carolinense mostraron crecimiento alométrico negativo, en ambas temporadas similar a lo reportado en Macrobrachium jelskii (Taddei et al., 2017), Macrobrachium mamillodactylus (Jurniati et al., 2021) y Palaemon longirostris (Cartaxana, 2003). Lo anterior puede ser el reflejo de una menor inversión energética hacia el incremento de tamaño en beneficio de capacidades antipredatorias y estrategias reproductivas, tales como la búsqueda dirigida (Ahamed y Ohtomi, 2012; Barros-Alves et al., 2012; Bauer, 2001; Bortolini et al., 2019; Pinheiro y Franzoso, 2002; Taddei et al., 2017), la cual se ha observado también para otros camarones carideos (Bae y Oh, 2014; Cházaro-Olvera, 2009; Manjón-Cabeza et al., 2009; Paschoal et al., 2016; Romero-Rodríguez y Román-Contreras, 2013; Terossi y Mantelatto, 2010), y ha sido sugerido también para T. carolinense (Bortolini et al.,2019; Martínez- Mayen et al., 2020).
Tabla 2
Peso promedio, longitud total (LT), ecuación potencial, valor de la pendiente (b), coeficiente de determinación (R2), tipo de crecimiento, factor de condición (K) y condición relativa (WR), de los siguientes grupos: DA = datos agrupados; M = machos; HNO = hembras no ovígeras; HOV = hembras ovígeras. ES = Estiaje; LL = lluvias; N = número de individuos.
|
Temporada |
N |
Grupo |
Peso (g) |
LT (mm) |
Ecuación |
b |
R2 |
Tipo de crecimiento |
K |
WR |
|
ES |
105 |
DA |
0.039 |
27.95 |
W=4E-06x2.7569 |
2.756 |
0.827 |
Isométrico |
0.213 |
0.934 |
|
53 |
M |
0.025 |
25.68 |
W=4E-05x2.0194 |
2.019 |
0.806 |
Alométrico (-) |
0.373 |
0.893 |
|
|
36 |
HNO |
0.043 |
28.61 |
W=7E-06x2.5693 |
2.569 |
0.803 |
Alométrico (-) |
0.273 |
1.054 |
|
|
16 |
HOV |
0.078 |
34.01 |
W=6E-05x2.0496 |
2.049 |
0.808 |
Alométrico (-) |
0.628 |
0.933 |
|
|
LL |
307 |
DA |
0.057 |
30.55 |
W=4E-07x3.4503 |
3.450 |
0.757 |
Alométrico(+) |
0.113 |
1.003 |
|
74 |
M |
0.028 |
27.34 |
W=3E-05x2.0901 |
2.090 |
0.804 |
Alométrico (-) |
0.341 |
0.924 |
|
|
41 |
HNO |
0.036 |
27.41 |
W=6E-07x3.2996 |
3.299 |
0.815 |
Isométrico |
0.120 |
1.009 |
|
|
192 |
HOV |
0.072 |
32.46 |
W=2E-05x2.2846 |
2.284 |
0.502 |
Alométrico (-) |
0.485 |
1.260 |
Tabla 3
Resultados de Kruskal Wallis para probar diferencias en el factor de condición (k) entre los siguientes grupos: M = machos; HNO = hembras no ovígeras; HOV = hembras ovígeras. ES = Estiaje; LL = lluvias.
|
Muestra 1- muestra 2 |
Estadístico de prueba |
Desv. Error |
Desv. Estadístico de prueba |
Sig. |
|
HNO(LL)-HNO (ES) |
62.009 |
27.198 |
2.280 |
0.023 |
|
HNO(LL)-M(LL) |
118.780 |
23.183 |
5.124 |
0.000 |
|
HNO(LL)-M(ES) |
162.159 |
24.767 |
6.547 |
0.000 |
|
HNO(LL)-HOV(LL) |
-265.339 |
20.487 |
-12.952 |
0.000 |
|
HNO(LL)-HOV(ES) |
354.599 |
35.101 |
10.102 |
0.000 |
|
HNO(ES)-M(LL) |
-56.771 |
24.197 |
-2.346 |
0.019 |
|
HNO(ES)- M(ES) |
100.150 |
25.718 |
3.894 |
0.000 |
|
HNO(ES)- HOV(LL) |
-203.330 |
21.627 |
-9.402 |
0.000 |
|
HNO(ES)- HOV(ES) |
-292.590 |
35.779 |
-8.178 |
0.000 |
|
M(LL)- M(ES) |
43.379 |
21.428 |
2.024 |
0.043 |
|
M(LL)- HOV(LL) |
-146.559 |
16.293 |
-8.995 |
0.000 |
|
M(LL)- HOV(ES) |
235.819 |
32.831 |
7.183 |
0.000 |
|
M(ES)- HOV(LL) |
-103.179 |
18.477 |
-5.584 |
0.000 |
|
M(ES)- HOV(ES) |
-192.440 |
33.967 |
-5.665 |
0.000 |
|
HOV(LL)- HOV(ES) |
89.260 |
30.985 |
2.881 |
0.004 |
Tabla 4
Resultados de Kruskal Wallis para probar diferencias en la condición relativa los siguientes grupos: M = machos; HNO = hembras no ovígeras; HOV = hembras ovígeras. ES = Estiaje; LL = lluvias.
|
Muestra 1- Muestra 2 |
Estadístico de prueba |
Desv. Error |
Desv. Estadístico de prueba |
Sig. |
|
M(ES)-M(LL) |
-17.940 |
21.428 |
-.837 |
0.402 |
|
M(ES)- HOV(ES) |
-30.513 |
33.967 |
-.898 |
0.369 |
|
M(ES)-HNO(LL) |
-61.514 |
24.767 |
-2.484 |
0.013 |
|
M(ES)-HNO(ES) |
-91.075 |
25.718 |
-3.541 |
0.000 |
|
M(ES)- HOV(LL) |
-174.003 |
18.477 |
-9.417 |
0.000 |
|
M(LL)- HOV(ES) |
12.573 |
32.831 |
.383 |
0.702 |
|
M(LL)-HNO(LL) |
-43.574 |
23.183 |
-1.880 |
0.060 |
|
M(LL)-HNO(ES) |
73.135 |
24.197 |
3.022 |
0.003 |
|
M(LL)- HOV(LL) |
-156.062 |
16.293 |
-9.578 |
0.000 |
|
HOV(ES)-HNO(LL) |
-31.002 |
35.101 |
-.883 |
0.377 |
|
HOV(ES)-HNO(ES) |
60.563 |
35.779 |
1.693 |
0.091 |
|
HOV(ES)-HOV(LL) |
-143.490 |
30.985 |
-4.631 |
0.000 |
|
HNO(LL)-HOV(ES) |
29.561 |
27.198 |
1.087 |
0.277 |
|
HNO(LL)-HOV(LL) |
-112.488 |
20.487 |
-5.491 |
.000 |
|
HNO(ES)- HOV(LL) |
-82.927 |
21.627 |
-3.834 |
.000 |
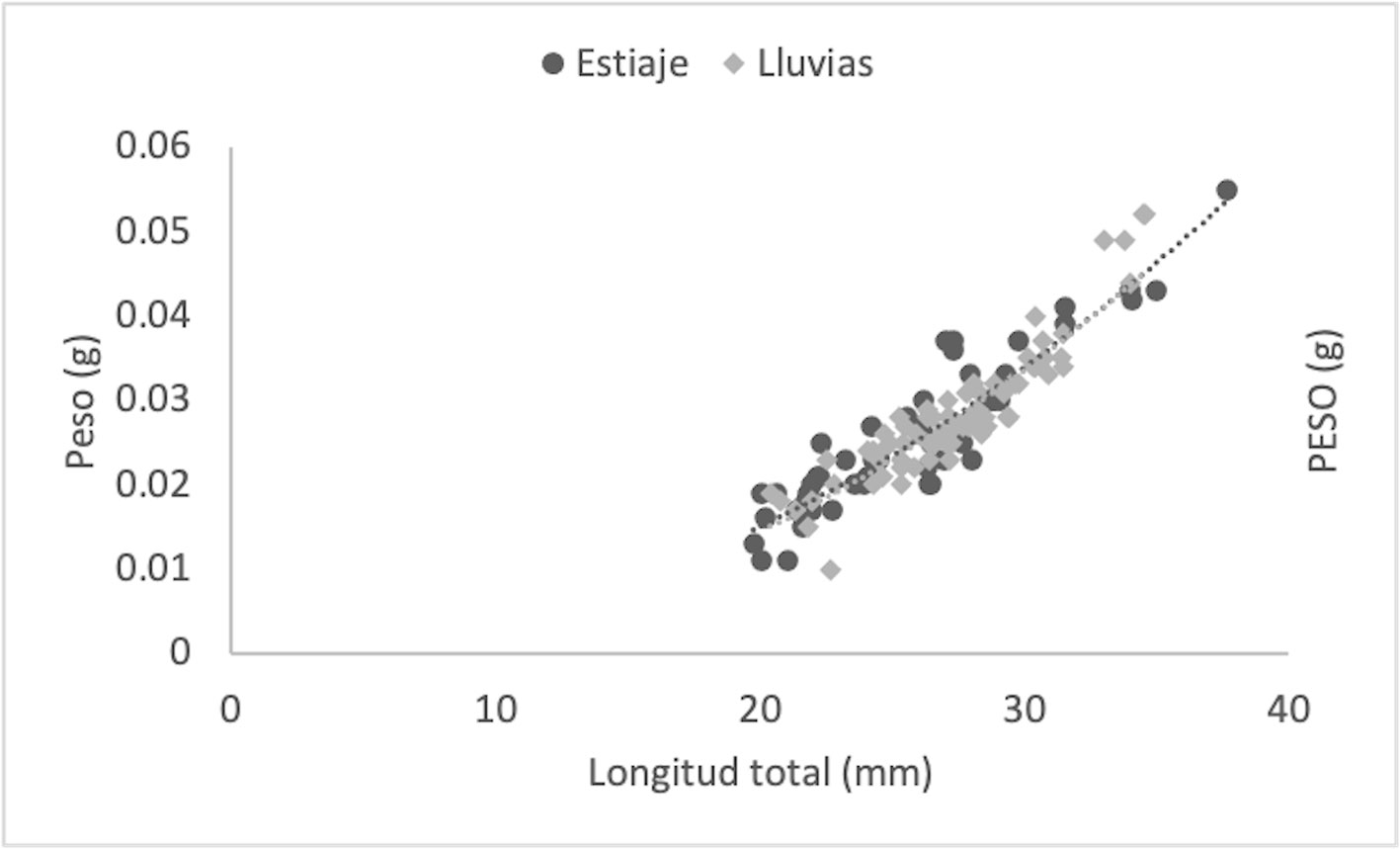
Las hembras, en general, también exhibieron crecimiento alométrico negativo, excepto para las HNO durante la temporada de lluvias, que fue isométrico. La presencia de isometría en hembras de carideos fue observada por Vafidis et al. (2008); sin embargo, este fenómeno ha sido escasamente reportado en camarones, ya que en general los antecedentes describen alometría negativa para hembras en distintas especies de carideos (Cartaxana, 2003; Collins y Petriella, 1999; Rocha et al., 2015; Taddei et al., 2017) y peneidos (Díaz et al., 2014; Leite y Petrere, 2006; Rahman y Ohtomi, 2018; Silva et al., 2015; Udoinyang et al., 2016). La alometría negativa en hembras, se atribuye a la presencia de hembras ovígeras con la reducción en el incremento en peso por el inicio de la madurez sexual y el desove (Maiorano et al., 2002), lo cual puede explicar el crecimiento de las HOV de T. carolinense en ambas temporadas con un sistema de reproducción continua, como sugirieron Bortolini et al. (2019) y Martinez-Mayén et al. (2020). No obstante, se recomienda realizar un mayor número de muestreos a lo largo del año para confirmar si la reproducción continua es una caracterísica de las poblaciones de esta especie en la laguna Madre.
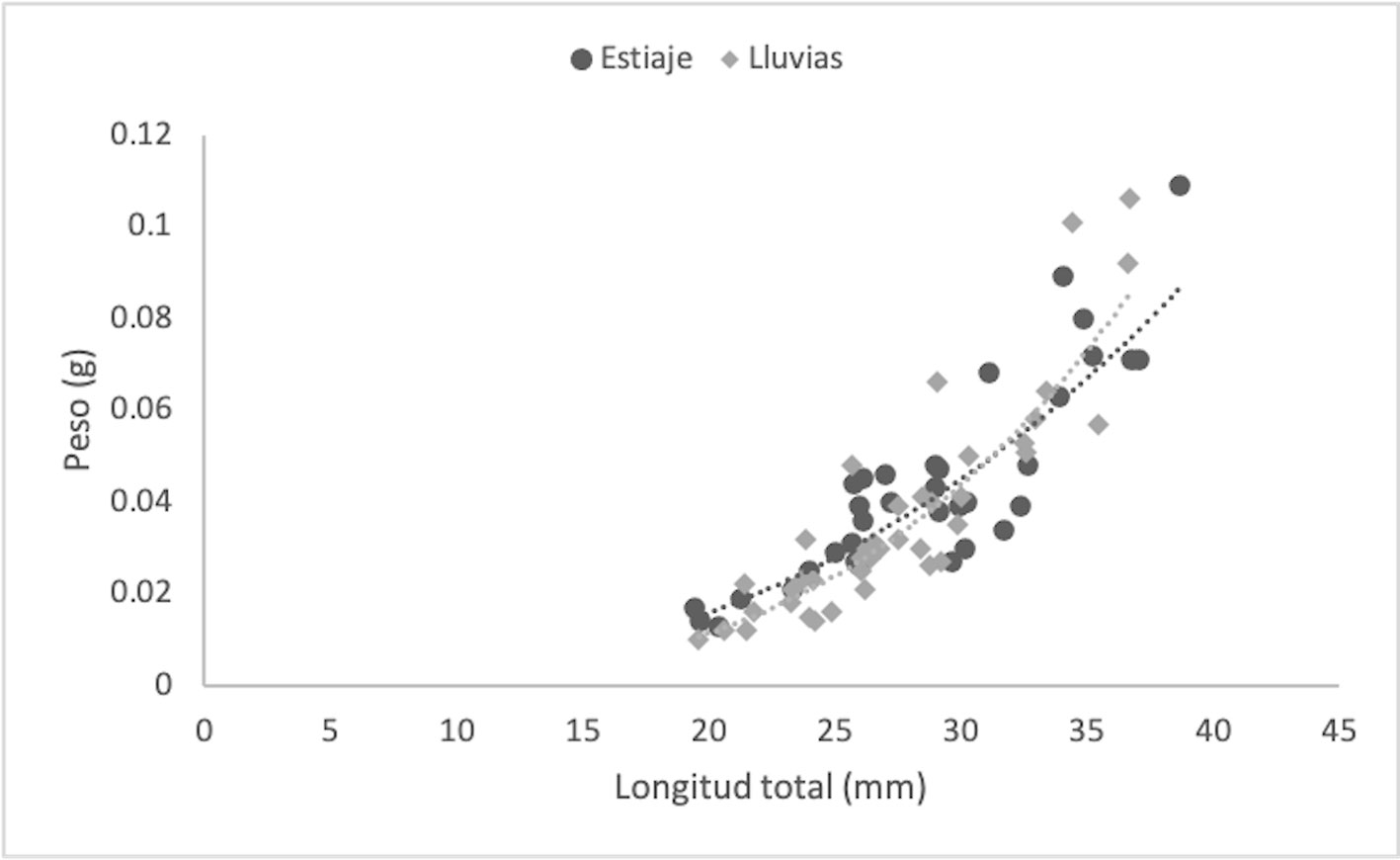
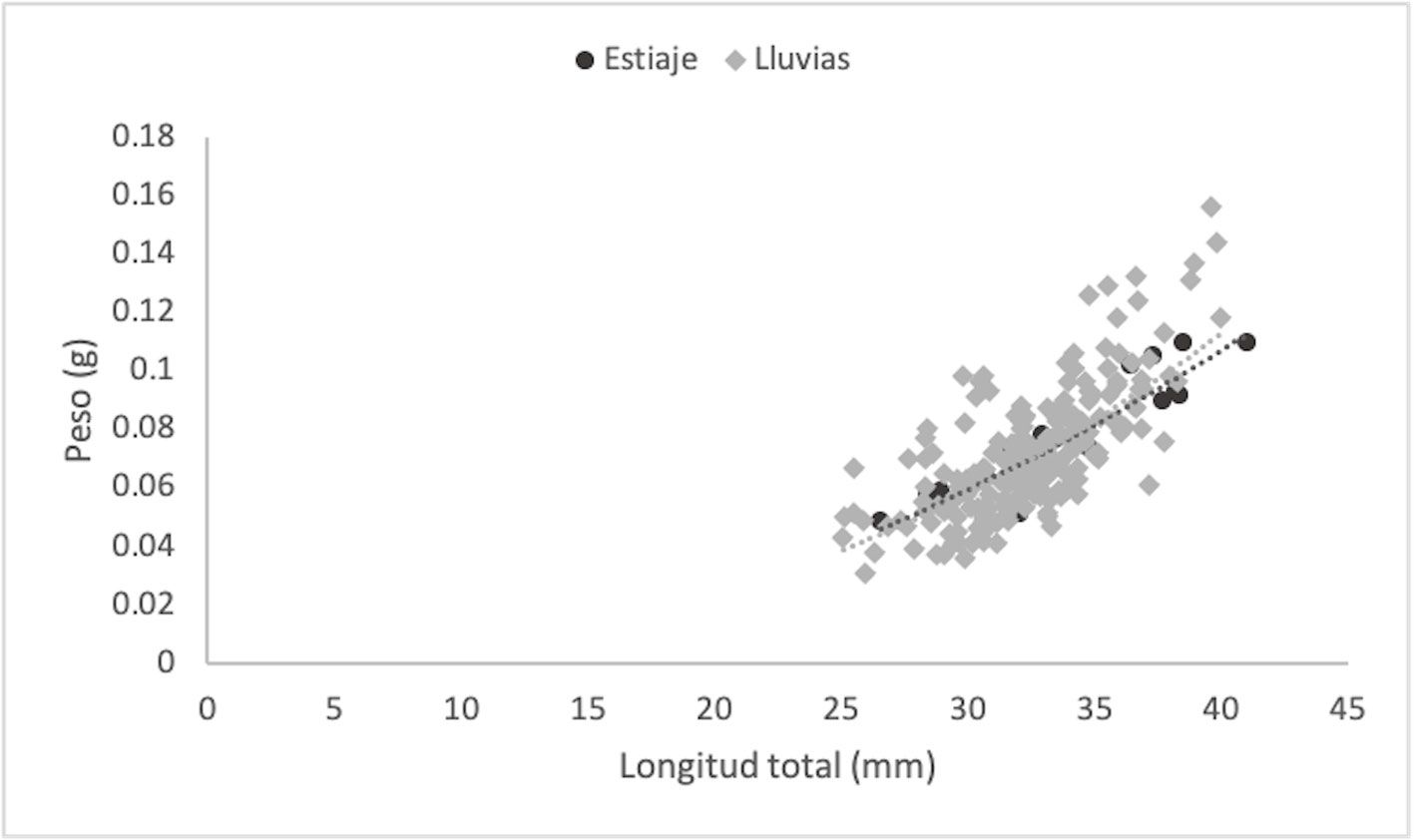
Factores como la temperatura y el aumento de los nutrientes tienen influencia sobre la abundancia de las hembras ovígeras y las dinámicas en el crecimiento y condición de los organismos (Terossi y Mantelatto, 2010). En hábitats con mayor disponibilidad de alimento y temperaturas apropiadas, los crustáceos tienden a mostrar una mayor tasa de crecimiento (Hartnoll, 1983). Las altas temperaturas del agua (28 – 30 ºC) favorecen el desarrollo rápido gonadal, la madurez sexual, el desove y la reproducción continua (Bauer, 1989), mientras que las bajas temperaturas (15 ºC) alargan considerablemente los periodos de intermuda y el tiempo total de desarrollo en T. carolinense (Ewald, 1969). Las temperaturas del agua registradas en el presente estudio fueron menores en marzo (15.4 – 22.6 ºC) y mayores en agosto (34.6 – 36.2 ºC) (tabla 1) lo que puede explicar las diferencias temporales en los valores de la pendiente, el tipo de crecimiento y condición de los organismos (tabla 2).
Con respecto al factor de condición, Lalrinsanga et al. (2012) observaron una mayor condición en machos que en hembras de Macrobrachium rosenbergii, al igual que Abohweyere y Williams (2008) y Arimoro y Meye (2007) en Macrobrachium macrobrachion, lo cual concuerda con los resultados del presente estudio en el análisis del factor de condición entre machos y hembras no ovígeras de T. carolinense (tabla 2). De acuerdo con diferentes estudios realizados en machos, las interacciones biológicas, como la competencia por alimento y espacio o el despliegue de agresividad, incrementan el factor de condición, mientras que disminuye en individuos pequeños que no desarrollan dichas interacciones y evitan la confrontación (Arimoro y Meye, 2007; Deekae y Abowei, 2010). La ausencia de comportamiento agonístico y el tipo de estrategia reproductiva de los machos de T. carolinense, sugieren que es poco probable una respuesta similar del factor de condición, sin embargo, los valores observados (0.373) (tabla 2) pueden indicar la canalización de su energía hacia el mantenimiento de características convenientes para la especie, como desplazarse con agilidad en búsqueda de hembras para llevar a cabo el apareamiento o mantener un tamaño pequeño que beneficie comportamientos furtivos (Ahamed y Ohtomi, 2012; Bauer, 2001; Bortolini et al., 2019; Lalrinsanga et al., 2012; Pinheiro y Franzoso, 2002).
Los valores del factor de condición en HOV fueron mayores en marzo, pero no significativos temporalmente. Este incremento ha sido observado en hembras ovígeras de palemónidos y se atribuye a una mayor presencia de las mismas, debido a la influencia de un mayor peso y tamaño de las gónadas (Deekae y Abowei 2010; Taddei et al., 2017), así como de su capacidad para almacenar energía durante la maduración gonadal, lo que también explica diferencias en la condición a nivel sexual (Araújo et al., 2011; Gomiero et al., 2008; Lira et al., 2012; Pinheiro y Taddei, 2005).
En la ecuación del factor de condición, el incremento del parámetro b (K = 100 * W/Lb) genera resultados mayores en este índice dependiendo del sexo o grupo bajo análisis (Lira et al., 2012; Pinheiro y Fiscarelli, 2009; Pinheiro y Taddei, 2005; Rocha et al., 2015). Las hembras del presente estudio mostraron un peso promedio y un valor de la pendiente mayores en marzo (tabla 2) y dado que no hubo un efecto significativo de la estacionalidad en el factor de condición, cabe suponer que la variabilidad observada en T. carolinense podría estar influenciada por factores como el aumento en peso o el tipo de crecimiento. Desafortunadamente, no se cuentan con estudios del factor de condición en T. carolinense u otros miembros de la familia Hippolytidae que sirvan como punto de comparación; sin embargo, sí existen estudios en carideos de importancia comercial como los palemónidos del género Macrobrachium (Abohweyere y Williams, 2008; Arimoro y Meye, 2007; Deekae y Abowei, 2010; Hossain et al., 2012; Lalrinsanga et al., 2012; Rocha et al., 2015; Soomro et al., 2012; Taddei et al., 2017).
El WR es estadísticamente menos influenciado por efecto de la longitud de los individuos de una población (Stevenson y Woods, 2006). En el presente estudio, el WR se observó con una variación menor en función de la talla y un aumento en los grupos analizados, particularmente en aquellos con bajo índice de condición (K) (tabla 2). El WR fue significativamente mayor en agosto que en marzo, lo que sugiere que en dicha época los organismos tuvieron una mejor condición y que, por lo tanto, el ambiente proveía de los elementos necesarios para su desarrollo. En general, los organismos tuvieron una buena WR por presentar valores cercanos o mayores a uno (tabla 2), tal como es señalado por Jisr et al. (2018). Variaciones temporales en el WR han sido observadas en pandálidos por Guijarro et al. (2012), quienes argumentan relaciones con el periodo reproductivo, ya que la condición relativa fue menor tanto mayor fue el porcentaje de hembras ovígeras. Contrariamente, en el presente estudio, la WR de T. carolinense fue mayor cuando las hembras ovígeras fueron más abundantes, sugiriendo que otros factores determinan este parámetro en el área de estudio, como las mayores temperaturas del agua que pueden relacionarse con una mayor disponibilidad de alimento e intensidad en la alimentación cuando alcanzan un umbral óptimo para una determinada especie (De Giosa et al., 2014; Jisr et al., 2018). Similar al presente estudio, una mejor condición de las hembras que la presentada por los machos fue reportada en el género Macrobrachium (Deekae y Abowei, 2010; Hossain et al., 2011; Rocha et al., 2015). Las diferencias entre los machos y las hembras en las tasas metabólicas, aspectos nutricionales, estado de madurez, tiempo de reclutamiento y la captura selectiva pueden también afectar las diferencias sexuales en el factor de condición (Araújo y Lira, 2012; Rodríguez, 1987). Los factores de condición informan sobre la resistencia del organismo y funcionan como un indicador indirecto de la calidad del entorno, lo cual puede servir a los tomadores de decisiones con la implementación de políticas y procedimientos de conservación de un hábitat o ecosistema (Fernández et al., 2019; Stevenson y Woods, 2006)
Lo anterior es de notoria importancia en un ambiente como la laguna Madre, que por su ubicación y geomorfología se encuentra sometida a los aportes derivados de la escorrentía continental y por las actividades antropogénicas aledañas, como la agricultura y la ganadería, además de que el tiempo de residencia de sus aguas y el sedimento es largo y tiene conexión limitada con el medio oceánico, manteniendo los elementos traza depositados dentro del ecosistema por un mayor período (Yáñez-Arancibia et al., 2004). El presente trabajo representa una aportación al análisis de la relación peso-longitud y factores de condición del camarón T. carolinense que habita en el sistema laguna Madre de Tamaulipas, lo cual permite el incremento del conocimiento de la biología reproductiva y ciclo de vida de esta especie en un ecosistema de gran relevancia para la costa del golfo de México.
Agradecimientos
A la Facultad de Ciencias Biológicas-UANL por las facilidades de logística prestadas para los viajes de campo. Asimismo, al Conacyt, por el apoyo otorgado a través de la beca Núm. 330167, al PAICYT con clave CN351-15: “Análisis del efecto de los contaminantes presentes en los sedimentos del área meridional de la laguna Madre, Tamaulipas, en comunidades macrobénticas para determinar la condición biológica del ecosistema” y al PAICYT con clave CN930-19: “Macrofauna béntica como bioindicadora de contaminación y su relación con variaciones en la fisicoquímica de los sedimentos, en el área meridional de la laguna Madre, Tamaulipas, México”
Referencias
Abele, L. G. y Kim, W. (1986). An illustrated guide to the marine decapod crustaceans of Florida. Tallahassee, Florida: Florida State University.
Abohweyere, P. O. y Williams, A. B. (2008). Length-weight relationship and condition factor of Macrobrachium macrobrachion in the Lagos-Lekki Lagoon system, Nigeria. Research Journal of Biological Sciences, 3, 1333–1336.
Abowei, J. F. N. y George, A. D. I. (2009). A study of the length-weight relationship and condition factor of Callinectes amnicola (De Rochebrune, 1883) from Okpoka Creek, Niger Delta, Nigeria. International Journal of Animal and Veterinary Advances, 1, 66–72.
Ahamed, F. y Ohtomi, J. (2012). Growth patterns and longevity of the pandalid shrimp Plesionika izumiae (Decapoda: Caridea). Journal of Crustacean Biology, 32, 733–740. https://doi.org/10.1163/193724012X645853
Almeida, A. O. y Guerrazzi, M. C. (2007). Stomatopod and decapod crustaceans from Camamu Bay, state of Bahia, Brazil. Zootaxa, 15531, 1–45. https://doi.org/10.11646/zootaxa.1553.1.1
Anger, K. y Moreira, G. S. (1998). Morphometric and reproductive traits of tropical Caridean shrimps. Journal of Crustacean Biology, 18, 823–838. https://doi.org/10.1163/
193724098X00674
Araújo, M. D. S. L. C. y Lira, J. J. P. R. D. (2012). Condition factor and carapace width versus wet weight relationship in the swimming crab Callinectes danae Smith 1869 (Decapoda: Portunidae) at the Santa Cruz Channel, Pernambuco State, Brazil. Nauplius, 20, 41–50. https://doi.org/10.1590/S0104-64972012000100005
Araújo, M. D. S. L. C., Negromonte, A. D. O. y Barreto, A. D. V. (2011). Reproductive period of the swimming crab Callinectes danae at the Santa Cruz Channel, a highly productive tropical estuary in Brazil. Nauplius, 19, 155–162.
Arimoro, F. O. y Meye, J. A. (2007). Some aspects of the biology of Macrobrachium dux (Lenz, 1910) (Crustacea: Decapoda: Natantia) in river Orogodo, Niger Delta, Nigeria. Acta Biológica Colombiana, 12, 111–122.
Bae, H. J. y Oh, C. W. (2014). Reproduction and growth of the spiny lebbeid shrimp, Lebbeus groenlandicus (Fabricius, 1775) (Caridea: Hippolytidae) in the east sea of Korea. Crustaceana, 87, 1430–1446. https://doi.org/10.1163/15685403-00003357
Bagenal, T. B. y Tesch, F. W. (1978). Age and growth. En T. Bagenal, (Ed.), Methods for assessment of fish production in fresh waters (pp. 101–136). Oxford, UK: Blackwell Scientific Publications.
Barba-Macías, E. (2012). Faunistic analysis of the caridean shrimps inhabiting seagrasses along the NW coast of the Gulf of Mexico and Caribbean Sea. Revista de Biología Tropical, 60, 1161–1175. https://doi.org/10.15517/rbt.v60i3.1765
Barba-Macías, E., Raz-Guzmán, A. y Sánchez, A. J. (2005). Distribution patterns of estuarine caridean shrimps in the southwestern Gulf of México. Crustaceana, 78, 709–726. https://doi.org/10.1163/156854005774353502
Barros-Alves, S. D. P., Almeida, A. C., Fransozo, V., Alves, D. F. R., Silva, J. C. D. y Cobo, V. J. (2012). Population biology of shrimp Macrobrachium jelskii (Miers, 1778) (Decapoda: Palaemonoidea) at the Grande River at northwest of the state of Minas Gerais, Brazil. Acta Limnologica Brasiliensia, 24, 266–275. https://doi.org/10.1590/S2179-
975X2012005000044
Bauer, R. T. (1989). Continuous reproduction and episodic recruitment in nine shrimp species inhabiting a tropical seagrass meadow. Journal of Experimental Marine Biology and Ecology, 127, 175–187. https://doi.org/10.10
16/0022-0981(89)90183-4
Bauer, R. T. (2001). Hermafroditismo en camarones: el sistema sexual y su relación con atributos socioecológicos. Interciencia, 26, 434–439.
Bauer, R. T. (2004). Remarkable shrimps: adaptations and natural history of the carideans, Vol. 7. Oklahoma: University of Oklahoma Press.
Bortolini, J. L., del Pilar-Alonso, M. y Mercado, I. L. (2019). Reproductive characteristics of Tozeuma carolinense (Decapoda: Caridea: Hippolytidae) in the Gulf of Mexico. Revista Mexicana de Biodiversidad, 90, e902670. https://doi.org/10.22201/ib.20078706e.2019.90.2670
Cartaxana, A. (2003). Growth of the prawn Palaemon longirostris (Decapoda: Palaemonidae) in Mira River and estuary, SW Portugal. Journal of Crustacean Biology, 23, 251–257. https://doi.org/10.1163/20021975-99990334
Chace, F. A. (1972). The shrimps of the Smithsonian-Bredin Caribbean Expeditions with summary of the West Indian shallow-water species (Crustacea: Decapoda: Natantia). Washington D.C.: United States Government Printing Office.
Cházaro-Olvera, S. (2009). Growth, mortality, and fecundity of Palaemonetes pugio from a lagoon system inlet in the southwestern Gulf of Mexico. Journal of Crustacean Biology, 29, 201–207. https://doi.org/10.1651/08-3055R.1
Collins, P. y Petriella, A. (1999). Growth pattern of isolated prawns of Macrobrachium borellii (Crustacea: Decapoda: Palaemonidae). Invertebrate Reproduction & Development, 36, 87–91. https://doi.org/10.1080/07924259.1999.9652682
Contreras, F. y Castañeda, O. (2004). Las lagunas costeras y estuarios del golfo de México: hacia el establecimiento de índices ecológicos. En M. Caso, I. Pisanty y E. Ezcurra (Eds.), Diagnóstico ambiental del Golfo de México (pp. 373–415). Ciudad de México: Secretaría de Medio Ambiente y Recursos Naturales/ Instituto Nacional de Ecología/ Instituto de Ecología A.C.
Corey, S. y Reid, D. M. (1991). Comparative fecundity of decapod crustaceans I. The fecundity of thirty-three species of nine families of caridean shrimp. Crustaceana, 60, 270–294. https://doi.org/10.1163/156854091X00056
Cournoyer, B. L. y Cohen, J. H. (2011). Cryptic coloration as a predator avoidance strategy in seagrass arrow shrimp colormorphs. Journal of Experimental Marine Biology and Ecology, 402, 27–34. https://doi.org/10.1016/j.jembe.
2011.03.011
Deekae, S. N. y Abowei, J. F. N. (2010). Macrobrachium macrobrachion (Herklots, 1851) length-weight relationship and Fulton’s condition factor in Luubara creek, Ogoni land, Niger Delta, Nigeria. International Journal of Animal and Veterinary Advances, 2, 155–162.
De Giosa, M., Czerniejewski, P. y Rybczyk, A. (2014). Seasonal changes in condition factor and weight-length relationship of invasive Carassius gibelio (Bloch, 1782) from Leszczynskie Lakeland, Poland. Advances in Zoology, 2014, 678763. https://doi.org/10.1155/2014/678763
Díaz, A., Ferrer, O., Álvarez, R., González, L., Méndez, J. y Corona, M. (2014). Mortality, recruitment pattern and growth of the white shrimp Litopenaeus schmitti (Crustacea: Penaeidae) from the Gulf of Venezuela. Ciencia, 22, 187–196.
Ewald, J. J. (1969). Observations on the biology of Tozeuma carolinense (Decapoda, Hippolytidae) from Florida, with special reference to larval development. Bulletin of Marine Science, 19, 510–549.
Fernández, R. G., Chávez-Hurtado, L. J. y Brito-Pérez, R. (2019). Relación longitud-peso, y factor de condición relativa de postlarvas epibentónicas y de jóvenes, del camarón rosado Farfantepenaeus duorarum (Crustacea: Penaeidae) en Laguna de Términos, México. Revista de Biología Tropical, 67, 585–598.
Gomiero, L. M. y de Souza-Braga, F. M. (2005). The condition factor of fishes from two river basins in São Paulo state, Southeast of Brazil. Acta Scientiarum: Biological Sciences, 27, 73–78. http://dx.doi.org/10.4025/actascibiolsci.v27i1.1368
Gomiero, L. M., Junior, G. A. V. y Naous, F. (2008). Relação peso-comprimento e fator de condição de Cichla kelberi (Perciformes: Cichlidae) introduzidos em um lago artificial no Sudeste brasileiro. Acta Scientiarum. Biological Scien-
ces, 30, 173–178. https://doi.org/10.4025/actascibiolsci.v30i2.300
Guijarro, B., Fanelli, E., Moranta, J., Cartes, J. E. y Massutí, E. (2012). Small-scale differences in the distribution and population dynamics of pandalid shrimps in the western Mediterranean in relation to environmental factors. Fisheries Research, 119, 33–47. https://doi.org/10.1016/j.fishres.2011.12.001
Hartnoll, R. G. (1983). Growth. En B. E. Bliss (Ed.), The Biology of Crustacea (pp. 214–282). New York: Academic Press.
Hays, C. G. (2005). Effect of nutrient availability, grazer assemblage and seagrass source population on the interaction between Thalassia testudinum (turtle grass) and its algal epiphytes. Journal of Experimental Marine Biology and Ecology, 314, 53–68. https://doi.org/10.1016/j.jembe.2004.08.017
Heck, K. L. Jr. (1977). Comparative species richness, composition, and abundance of invertebrates in Caribbean seagrass (Thalassia testudinum) meadows (Panamá). Marine Biology, 41, 335–348. https://doi.org/10.1007/BF00389099
Herrera-Barquín, H., Leija-Tristán, A. y Favela-Lara, S. (2018). Updated checklist of estuarine caridean shrimps (Decapoda: Caridea) from the southern region of Laguna Madre, Tamaulipas, Mexico, with new records and a key for taxonomic identification. Check List, 14, 479–494. https://doi.org/10.15560/14.2.479
Holthuis, L. B. (1947). The Decapoda of the Siboga expedition Part IX: the Hippolytidae and Rhynchocinetidae. Siboga Expeditie, 39a, 1–100.
Hossain, M. Y., Ohtomi, J., Jaman, A., Jasmine, S. y Vadas, R. L. Jr. (2012). Life history traits of the monsoon river prawn Macrobrachium malcolmsonii (Milne-Edwards, 1844) (Palaemonidae) in the Ganges (Padma) river, northwestern Bangladesh. Journal of Freshwater Ecology, 27, 131–142. https://doi.org/10.1080/02705060.2011.633739
Jisr, N., Younes, G., Sukhn, C. y El-Dakdouki, M. H. (2018). Length-weight relationships and relative condition factor of fish inhabiting the marine area of the Eastern Mediterranean city, Tripoli-Lebanon. The Egyptian Journal of Aquatic Research, 44, 299–305. https://doi.org/10.1016/j.ejar.2018.11.004
Jurniati, J., Arfiati, D., M. S. Hertika, A. y Kurniawan, A. (2021). Morphometric-meristic characters and length-weight relationships of Macrobrachium mammillodactylus (Thallwitz, 1892) inhabiting downstream of Rongkong watershed, South Sulawesi, Indonesia. Egyptian Journal of Aquatic Biology and Fisheries, 25, 91–110. https://dx.doi.org/10.21608/ejabf.2021.138346
Kim, S. (2005). Population structure, growth, mortality, and size at sexual maturity of Palaemon gravieri (Decapoda: Caridea: Palaemonidae), Journal of Crustacean Biology, 25, 226–232. https://doi.org/10.1651/C-2510
Kneib, R. T. (1988). Testing for indirect effects of predation in an intertidal soft-bottom community. Ecology, 69, 1795–1805. https://doi.org/10.2307/1941158
Lalrinsanga, P. L., Pillai, B. R., Patra, G., Mohanty, S., Naik, N. K. y Sahu, S. (2012). Length weight relationship and condition factor of giant freshwater prawn Macrobrachium rosenbergii (De Man, 1879) based on developmental stages, culture stages and sex. Turkish Journal of Fisheries and Aquatic Sciences, 12, 917–924.
Le Cren, E. D. (1951). The length-weight relationship and seasonal cycle in gonad weight and condition in the perch (Perca fluviatilis). The Journal of Animal Ecology, 20, 201–219. https://doi.org/10.2307/1540
Leija-Tristán, A. (2005). Ecología y estructura poblacional de los stocks reproductora-recluta, del camarón café Farantepenaeus aztecus Ives, 1891, en la laguna Madre y plataforma continental de Tamaulipas, México (Tesis de doctorado). Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León. San Nicolás de los Garza, Nuevo León.
Leija-Tristán, A., Contreras-Arquieta, A., García-Garza, M. E., Contreras-Balderas, A. J., Lozano-Vilano, M. L., Contreras-Balderas, S. et al. (2000). Taxonomic, bioecological and biogeographic aspects of select biota of the Laguna Madre, Tamaulipas, Mexico. En M. S. G. Munawar, S. G. Lawrence, I. F. Munawar y D. F. Malley (Eds.), Aquatic ecosystems of Mexico: status and scope (pp. 399-425). Leiden, The Netherlands: Ecovision World Monograph Series/ Backhuys Publishers.
Leite, N. O. Jr. y Petrere, M. Jr. (2006). Growth and mortalities of the pink-shrimp Farfantepenaeus brasiliensis (Latreille, 1970) and F. paulensis (Pérez-Farfante, 1967) in Southeast Brazil. Brazilian Journal of Biology, 66, 523–536. https://doi.org/10.1590/S1519-69842006000300019
Lira, J. J. P. R., Calado, T. C. S. y Araújo, M. S. L. C. (2012). Condition factor of Goniopsis cruentata (Crustacea: Brachyura: Grapsidae) from Munda/Manguaba estuarine complex, Alagoas, Brazil. Iheringia, Série Zoologia, 102, 285–291. https://doi.org/10.1590/S0073-47212012005000001
Livingston, R. J. (1984). The relationship of physical factors and biological response in coastal seagrass meadows. Estuaries, 7, 377–390. https://doi.org/10.2307/1351620
Martínez-Mayén, M., Romero-Rodríguez, J. y Martínez-Muñoz, M. A. (2020). Population traits and reproduction of the hippolytid shrimp Tozeuma carolinense (Decapoda: Caridea) at Laguna de Términos, Campeche, southwestern Gulf of Mexico. Revista Mexicana de Biodiversidad, 91, e913026. https://doi.org/10.22201/ib.20078706e.2020.91.3026
Main, K. L. (1985). The influence of prey identity and size on selection of prey by two marine fishes. Journal of Experimental Marine Biology and Ecology, 88, 145–152. https://doi.org/10.1016/0022-0981(85)90034-6
Main, K. L. (1987). Predator avoidance in seagrass meadows: prey behavior, microhabitat selection, and cryptic coloration. Ecology, 68, 170–180. https://doi.org/10.2307/1938817
Maiorano, P., D’onghia, G., Capezzuto, F. y Sion, L. (2002). Life-history traits of Plesionika martia (Decapoda: Caridea) from the eastern-central Mediterranean Sea. Marine Biology, 141, 527–539. https://doi.org/10.1007/s00227-002-0851-4
Manjón-Cabeza, M. E., Cobos, V., García-Muñoz, J. E. y García-Raso, J. E. (2009). Structure and absolute growth of a population of Hippolyte inermis Leach 1815 (Decapoda: Caridea) from Zostera marina (L.) meadows (Malaga, southern Spain). Scientia Marina, 73, 377–386. https://doi.org/10.3989/scimar.2009.73n2377
Morey, G., Moranta, J., Massutí, E., Grau, A., Linde, M., Riera, F. et al. (2003). Weight-length relationships of littoral to lower slope fishes from the western Mediterranean. Fisheries Research, 62, 89–96. https://doi.org/10.1016/S0165-7836(02)00250-3
Murphy, B. R., Brown, M. L. y Springer, T. A. (1990). Evaluation of the relative weight (Wr) index, with new applications to walleye. North American Journal of Fisheries Management, 10, 85–97. https://doi.org/10.1577/1548-8675(1990)010%3C0085:EOTRWW%3E2.3.CO;2
Nizinski, M. S. (2003). Annotated checklist of decapod crustaceans of Atlantic coastal and continental shelf waters of the United States. Proceedings-Biological Society of Washington, 116, 96–157.
Paschoal, L. R. P., Guimarães, F. J. y Couto, E. C. G. (2016). Growth and reproductive biology of the amphidromous shrimp Palaemon pandaliformis (Decapoda: Caridea) in a neotropical river from northeastern Brazil. Zoologia, 33, 1–14. https://doi.org/10.1590/S1984-4689zool-20160060
Pérez-Castañeda, R. y Defeo, O. (2002). Morphometric relationships of penaeid shrimps in a coastal lagoon: spatiotemporal variability and management implications. Estuaries, 25, 282–287. https://doi.org/10.1007/BF02691315
Pinheiro, M. A. y Fiscarelli, A. G. (2009). Length-weight relationship and condition factor of the Mangrove Crab Ucides cordatus (Linnaeus, 1763) (Crustacea: Brachyura: Ucididae). Brazilian Archives of Biology and Technology, 52, 397–406. https://doi.org/10.1590/S1516-89132009000200017
Pinheiro, M. A. y Fransozo, A. (2002). Reproduction of the speckled swimming crab Arenaeus cribrarius (Brachyura: Portunidae) on the Brazilian coast near 23° 30’S. Journal of Crustacean Biology, 22, 416–428. https://doi.org/10.1163/20021975-99990249
Pinheiro, M. A. y Taddei, F. G. (2005). Relação peso/largura da carapaça e fator de condição em Dilocarcinus pagei Stimpson (Crustacea: Trichodactylidae), em São José do Rio Preto, São Paulo, Brasil. Revista brasileira de Zoologia, 22, 825–829. https://doi.org/10.1590/S0101-81752005000400002
Rahman, M. M. y Ohtomi, J. (2018). Relative growth and morphological sexual maturity of the deep-water velvet shrimp Metapenaeopsis sibogae (Crustacea: Decapoda: Penaeidae). Invertebrate Reproduction & Development, 62, 125–132. https://doi.org/10.1080/07924259.2018.1452299
Ricker, W. E. (1975). Computation and interpretation of biological statistics of fish populations. Bulletin of the Fisheries Research Board of Canada, 191, 1–382.
Rocha, S. S. D., Silva, R. L. S. D., Santos, J. D. L. y Oliveira, G. D. (2015). Length-weight relationship and condition factor of Macrobrachium amazonicum (Heller, 1862) (Decapoda: Palaemonidae) from a reservoir in Bahia, Brazil. Nauplius, 23, 146–158. https://doi.org/10.1590/S0104-64972015002308
Rodríguez, A. (1987). Biología del langostino Penaeus kerathurus (Forskal, 1775) del Golfo de Cádiz. III. Biometría, edad y crecimiento. Investigaciones Pesqueras, 51, 23–37.
Rodríguez-Almaraz, G. A., A. Leija-Tristán y R. Mendoza. (2000). Records of caridean shrimps (Crustacea: Decapoda) from the coasts of the Mexican Pacific Ocean, Gulf of Mexico and Mexican Caribbean. Bulletin of Marine Science, 67, 857–867.
Román-Contreras, R. y Martínez-Mayén, M. (2009). Shallow water hippolytid shrimps (Crustacea: Decapoda: Caridea) from the Mexican Caribbean coast. Hidrobiológica, 19, 119–128.
Romero-Rodríguez, J. y Martínez-Mayén, M. (2018). Rediscovery of the bopyrid isopod Parabopyrella thomasi (Nierstrasz & Brenderà Brandis, 1929), parasite of the arrow shrimp Tozeuma carolinense Kingsley, 1878 (Decapoda: Caridea) in the Caribbean region. Crustaceana, 91, 1183–1194. https://doi.org/10.1163/15685403-00003811
Romero-Rodríguez, J. y Román-Contreras, R. (2013). Population structure and reproduction of the seagrass shrimp Hippolyte zostericola (Decapoda: Hippolytidae) at Laguna de Términos, Campeche, Mexico. Journal of the Marine Biological Association of the United Kingdom, 93, 675–682. https://doi.org/10.1017/S0025315411001974
Sánchez, A. J., Raz-Guzmán, A. y Barba, E. (1996). Habitat value of seagrasses for decapods in tropical coastal lagoons of the southwestern Gulf of Mexico: an overview. En J. Kuo, R. C. Phillips, D. I. Walker y H. Kirkman (Eds.), Seagrass Biology: Proceedings of an International Seagrass Workshop (pp. 1–240). Rottnest Island, Western Australia: The University of Western Australia.
Semarnat (Secretaría de Medio Ambiente y Recursos Naturales). (2015). Programa Manejo Área de Protección de Flora y Fauna Laguna Madre y Delta del Río Bravo. Ciudad de México: Conabio, Semarnat.
Sheridan, P. (2004). Comparison of restored and natural seagrass beds near Corpus Christi, Texas. Estuaries, 27, 781–792. https://doi.org/10.1007/BF02912040
Sheridan, P. F. y Minello, T. J. (2003). Nekton use of different habitat types in seagrass beds of lower Laguna Madre, Texas. Bulletin of Marine Science, 72, 37–61.
Silva, E. F., Calazans, N., Nolé, L., Viana, A., Soares, R., Peixoto, S. et al. (2015). Population dynamics of the pink shrimp Farfantepenaeus subtilis in Northeastern Brazil. Journal of Crustacean Biology, 35, 132–139. https://doi.org/10.1163/1937240X-00002325
Sokal, R. R. y Rohlf, F. J. (1981). Biometry: the principles and practice of statistics in biological research. New York: Freeman.
Soomro, A. N., Baloch, W. A., Chandio, T. J., Achakzai, W. M. y Saddozai, S. (2012). Condition factor and length-weight relationship of monsoon river prawn Macrobrachium malcolmsonii malcolmsonii (H. Milne-Edwards, 1844) (Palaemonidae) in lower Indus River. Pakistan Journal of Zoology, 44, 1279–1283.
Souza, J. A. F., Schwamborn, R. A. L. F., Barreto, A. V., Farias, I. D., Fernandes, L. M. G. y Coelho, P. A. (2011). Marine and estuarine shrimps (Dendrobranchiata, Stenopodidea, and Caridea), of Pernambuco State (Brazil) and northeastern Brazilian oceanic islands. Atlântica, 33, 33–63.
Stevenson, R. D. y Woods, W. A. Jr. (2006). Condition indices for conservation: new uses for evolving tools. Integrative and Comparative Biology, 46, 1169–1190. https://doi.org/10.1093/icb/icl052
Taddei, F. G., Herrera, D. R., Davanso, T. M., Silva, T. E. D., Costa, R. C. D. y Fransozo, A. (2017). Length/weight relationship and condition factor of Macrobrachium jelskii (Miers, 1877) and M. brasiliense (Heller, 1862) (Decapoda: Palaemonidae) in two locations in the state of São Paulo. Nauplius, 25, e2017022. https://doi.org/10.1590/2358-2936e2017022
Terossi, M. y Mantelatto, F. L. (2010). Sexual ratio, reproductive period and seasonal variation of the gonochoric shrimp Hippolyte obliquimanus (Caridea: Hippolytidae). Marine Biology Research, 6, 213–219. https://doi.org/10.1080/17451000903078630
Udoinyang, E. P., Amali, O., Iheukwumere, C. C. y Ukpatu, J. E. (2016). Length-weight relationship and condition factor of seven shrimp species in the artisanal shrimp fishery of Iko river estuary, southeastern Nigeria. International Journal of Fisheries and Aquatic Studies, 4, 109–114.
Vafidis, D., Leontarakis, P. K., Dailianis, T. y Kallianiotis, A. (2008). Population characteristics of four deep-water pandalid shrimps (Decapoda: Caridea) in the northern Aegean Sea (NE Mediterranean). Journal of Natural History, 42, 2079–2093. https://doi.org/10.1080/00222930802254672
Williams, A. B. (1984). Shrimps, lobsters, and crabs of the Atlantic coast of the eastern United States, Maine to Florida. Washington D.C.: Smithsonian Institution Press.
Yáñez-Arancibia, A., Lara-Domínguez, A. L., Sánchez-Gil, P. y Day, J. W. (2004). Interacciones ecológicas estuario-mar: marco conceptual para el manejo ambiental costero. En M. Caso, I. Pisanty y E. Ezcurra (Eds.), Diagnóstico ambiental del golfo de México (pp. 432–490). Ciudad de México: Secretaría de Medio Ambiente y Recursos Naturales/ Instituto Nacional de Ecología/ Instituto de Ecología
A.C.
Yates, F. (1934). Contingency tables involving small numbers and the x2 test. Supplement to the Journal of the Royal Statistical Society, 1, 217–235.
Zar, J. H. 2010. Biostatistical analysis, 5th Ed. New Jersey: Upper Saddle River.
Zare, P., Naderi, M., Eshghi, H. y Anastasiadou, C. (2011). Reproductive traits of the freshwater shrimp Caridina fossarum Heller, 1862 (Decapoda, Caridea, Atyidae) in the Ghomp-Atashkedeh spring (Iran). Limnologica, 41, 244–248. https://doi.org/10.1016/j.limno.2010.11.003




