Endoparásitos de una población de cerdos silvestres (Sus scrofa) en Bahía Samborombón, Buenos Aires, Argentina
Rocío B. Ciocco a, Bruno N. Carpinetti b, Pablo Rojas c, Gabriel Castresana c y Juliana Notarnicola d,
a Facultad de Ciencias Naturales y Museo, Universidad Nacional de La Plata, Paseo del Bosque s/n, La Plata, 1900 Buenos Aires, Argentina
b Cátedra de Ecología y Recursos Naturales, Instituto de Ciencias Sociales y Administración, Universidad Nacional Arturo Jauretche, Av. Calchaquí 6200, Florencio Varela, 1888 Buenos Aires, Argentina
c Reserva Natural Bahía Samborombón, Organismo Provincial para el Desarrollo Sostenible, Ferrari 500, General Concesa (CP7101), Buenos Aires, Argentina
d Instituto de Biología Subtropical – Nodo Iguazú, Consejo Nacional de Investigaciones Científicas y Técnicas, Centro Científico Tecnológico Nordeste, Bertoni 85, Puerto Iguazú, Misiones, Argentina
* Autor para correspondencia: julinota@yahoo.com.ar (J. Notarnicola)
Resumen
En Argentina se sabe poco sobre la parasitofauna en cerdos silvestres. Aquí, se describe por primera vez la comunidad parasitaria de una población silvestre de Sus scrofa en el área protegida Bahía Samborombón. Se tomaron muestras de materia fecal y se revisaron las vísceras de 30 individuos. La prevalencia (P) total fue de 90%, registrándose Eimeria sp. (P = 18.5%), Isospora sp. (P = 22%) (Coccidia), Iodamoeba sp. (P = 52%) (Amoebidae), Macracanthorhynchus hirudinaceus (P = 33%) (Acanthocephala), Ascaris suum (P = 22%), Oesophagostomum dentatum (P = 4%), Globocephalus sp. (P = 7.5%), Metastrongylus sp. (P = 7.5%), Hyostrongylus sp. (P = 18.5%) y Trichuris sp. (P = 4%) (Nematoda) en el análisis coprológico y M. hirudinaceus (P = 33%) y A. suum (P = 23%); O. dentatum (P = 3%) y quistes hidatídicos de Echinococcus sp. (P = 20%) (Cestoda, Taeniidae) en la prospección helmintológica. Los valores de asociación del índice de Fager fueron no significativos con excepción del par Isospora sp.-Eimeria sp. El presente estudio muestra que la población de cerdos silvestres de Bahía Samborombón presenta una alta riqueza de especies parásitas, muchas de las cuales revisten importancia zoonótica como Eimeria sp., Isospora sp., Macracanthorhynchus sp., Ascaris sp. y Echinococcus sp.
Palabras clave: Cerdos silvestres; Endoparásitos; Riqueza parasitaria; Riesgo zoonótico; Buenos Aires
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Endoparasites in a wild boar population (Sus scrofa) from Bahía Samborombón, Buenos Aires, Argentina
Abstract
In Argentina little is known about the parasitofauna in wild pigs. This work discloses parasitic species in a wild population of Sus scrofa in the Bahía Samborombón protected area. Fecal samples were taken from 30 individuals and their viscera were prospected. The total prevalence (P) was 90%, with a specific richness of 11. In the coprological analysis were detected: Eimeria sp. (P = 18.5%), Isospora sp. (P = 22%) (Coccidia), Iodamoeba sp. (P = 52%) (Amoebidae), Macracanthorhynchus hirudinaceus (P = 33%) (Acanthocephala), Ascaris suum (P = 22%), Oesophagostomum dentatum (P = 4%), Globocephalus sp. (P = 7.5%), Metastrongylus sp. (P = 7.5%), Hyostrongylus sp. (P = 18.5%), and Trichuris sp. (P = 4%) (Nematoda). In the helminthological prospections were observed juveniles and adults of M. hirudinaceus (P = 33%) and A. suum (P = 23%); O. dentatum (P = 3%) and hydatid cysts of Echinococcus sp. (P = 20%) (Cestoda, Taeniidae). The association values of the Fager index were not significant except for the pair Isospora sp.-Eimeria sp. The present study shows that the population of wild pigs of Samborombón Bay presents a high richness of parasitic species, many of which have zoonotic importance such as Eimeria sp., Isospora sp., Macracanthorhynchus sp., Ascaris sp., and Echinococcus sp.
Keywords: Wild boar; Endoparasites; Parasite richness; Zoonotic risk; Buenos Aires
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
La Bahía Samborombón, sitio RAMSAR desde 1997, es el humedal mixohalino más extenso de Argentina. Es un área protegida y alberga una gran biodiversidad de especies nativas, algunas de ellas en peligro de extinción como el venado de las Pampas Ozotoceros bezoarticus y especies introducidas como perros asilvestrados (Canis familiaris) y cerdos cimarrones (Sus scrofa) (Merino y Carpinetti, 2003; Pérez-Carusi et al., 2009).
En la actualidad, se sabe que la introducción deliberada o accidental de ganado y animales silvestres fuera de su rango original de distribución genera una serie de alteraciones que pueden conducir a la extinción local de especies nativas por efecto de depredación, competencia, transmisión de enfermedades parásitas o transformación del hábitat, entre otros factores (Mack et al., 2000; Pedersen et al., 2007).
La introducción del cerdo silvestre en la región del pastizal pampeano se cree que data del siglo XVI, con individuos traídos en las primeras expediciones españolas que se naturalizaron en la zona. Sin embargo, los registros documentados de la especie en los partidos que conforman la Bahía Samborombón —Magdalena, Punta Indio, Chascomús y Castelli— datan del siglo XIX (Carpinetti et al., 2016). En la mayoría de los lugares donde existen poblaciones naturalizadas de cerdos silvestres se han identificado múltiples impactos negativos de la especie sobre el ambiente, la ganadería y la agricultura (Carpinetti, 1998; Choquenot et al., 1997; Sanguinetti y Pastore, 2016; Singer et al., 1984). Como ejemplo, en la Patagonia Argentina, el jabalí puede alimentarse del 30% de las semillas de Araucaria afectando la regeneración de la conífera y compitiendo con los roedores nativos (Sanguinetti y Kitzberger, 2010). En tanto en la región pampeana, se determinó una tendencia inversa entre la abundancia del venado de las pampas (O. bezoarticus) y el jabalí, por lo cual existiría competencia con este cérvido amenazado (Pérez-Carusi et al., 2009).
Existen numerosas especies de mamíferos introducidos exitosamente en Argentina y sus parásitos pueden representar una amenaza para la biodiversidad (Pedersen y Greives, 2008), ya que por diversos mecanismos tienen la capacidad de ejercer una regulación directa o indirecta en las dinámicas poblacionales de sus hospedadores (Tompkins y Begon, 1999). Las especies introducidas suelen presentar baja riqueza, prevalencia y abundancia de parásitos, además de contar con la ausencia de sus parásitos naturales (Heger y Jeschke, 2014; Torchin et al., 2003). Conocer la parasitofauna de animales introducidos en diferentes ambientes permite comprender si estas especies se liberaron de sus parásitos naturales o si adquirieron parásitos de animales nativos y evaluar las consecuencias que puede tener el ingreso de una nueva especie hospedadora en la comunidad receptora (Dunn y Hatcher, 2015; Dunn et al., 2012; Gozzi, 2015).
El cerdo es una de las especies con mayor relevancia sanitaria para la salud humana y de animales domésticos. Es ampliamente reconocido que las poblaciones de cerdos actúan como reservorios de algunas enfermedades trasmisibles al hombre y a los animales domésticos y silvestres. Entre las enfermedades reportadas, a nivel mundial, se encuentran la fasciolacis, hidatidosis, triquinosis, coccidiosis, brucelosis porcina, tuberculosis, leptospirosis, entre otras (Carpinetti et al., 2014; Kaufmann, 1996; Zimmerman et al., 2012). Existen numerosos estudios que describen la fauna parasitaria de las poblaciones de jabalíes tanto dentro de su rango de distribución natural como en áreas recientemente invadidas (Amayour et al., 2017; De la Muela et al., 2001; García-González et al., 2013; Hampton et al., 2006; Pence et al., 1988; Senlik et al., 2011; Solaymani-Mohammadi et al., 2003). En Argentina se han realizado pocos estudios de endoparásitos (protozoos y helmintos) en poblaciones silvestres de cerdos. Cohen et al. (2010) mencionan una prevalencia de Trichinella spiralis de11% en jabalíes del Parque Nacional El Palmar, Entre Ríos; en tanto que en el Parque Nacional Nahuel Huapi reportaron infestaciones por Fasciola hepatica, Metastrongylus pudendotectus y T. spiralis (Chang-Reissig et al., 2010). En Bahía Samborombón, Carpinetti et al. (2014, 2017) detectaron cerdos asilvestrados con serología positiva para leptospirosis y la enfermedad de Aujeszky.
El objetivo de este trabajo fue reportar las especies parásitas de protozoos y helmintos presentes en una población de cerdos silvestres Sus scrofa en el área protegida Bahía Samborombón y evaluar posibles riesgos zoonóticos ante la presencia de parásitos de importancia para la salud humana, para la producción animal o para la fauna silvestre.
Materiales y métodos
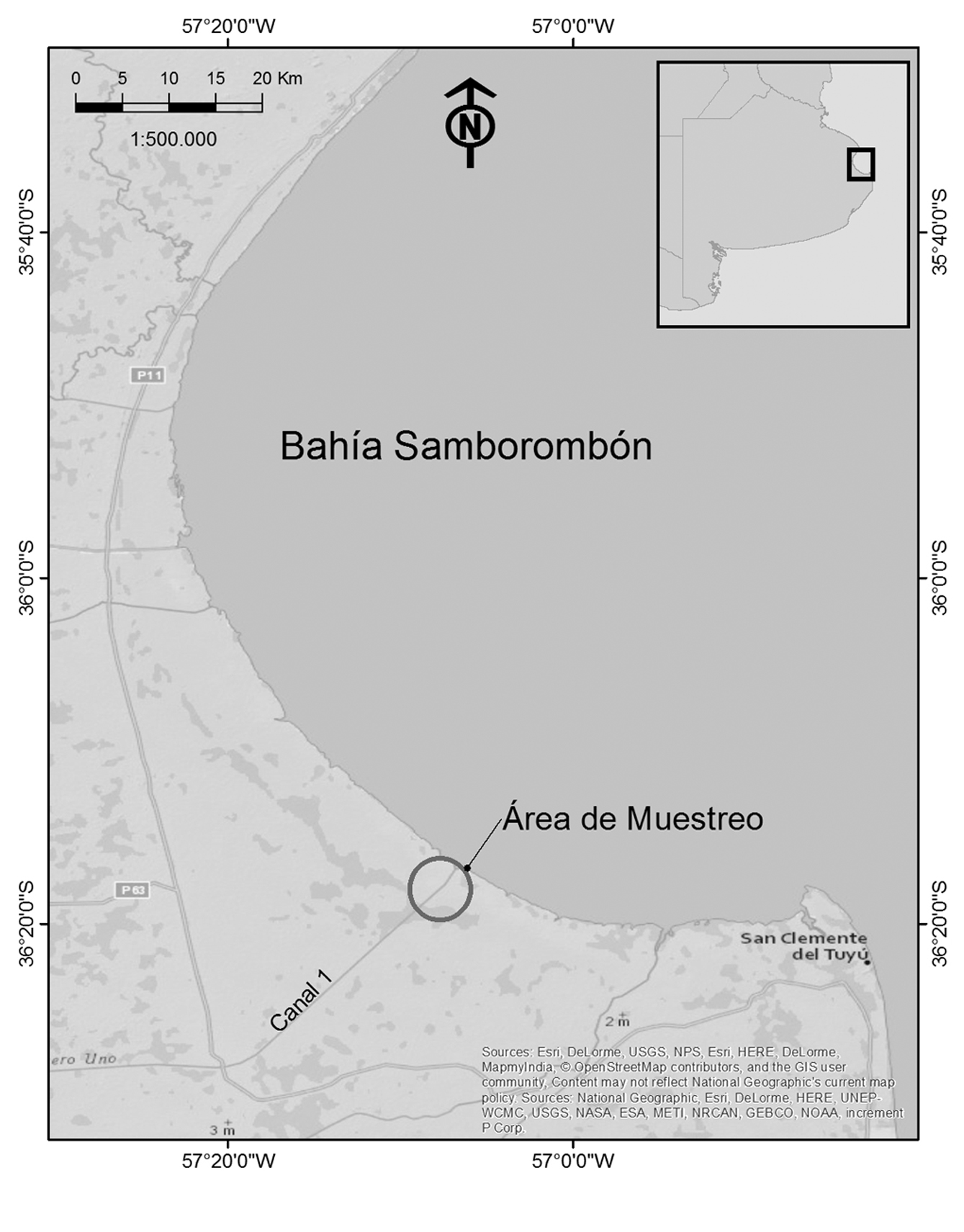
La Bahía Samborombón se localiza a 90 km al sur de la ciudad de La Plata y se extiende desde Punta Piedras (35º27’ S, 56º45’ O) hasta Punta Rasa (36º22’ S, 56º35’ O), Provincia de Buenos Aires, Argentina. La vegetación del área es un mosaico dominado por factores edáficos tales como la duración y extensión de las inundaciones de agua dulce o estuariales y por las características del suelo, con bancos de conchillas donde crecen bosques de “tala” Celtis tala (Cabrera, 1971). El presente trabajo se desarrolló en el Refugio de Vida Silvestre Bahía Samborombón, en las cercanías de la desembocadura del canal 1, estuario del río de la Plata (fig. 1). En el área, se combinan una variedad de hábitats como marismas intermareales con altas densidades de cangrejales, marismas saladas, arroyos, lagunas y pantanos de agua dulce tanto permanentes como estacionales y pastizales e islas de tierras altas con árboles y arbustos, además de asentamientos humanos basados en la explotación ganadera para su subsistencia (Carpinetti et al., 2014; Merino y Carpinetti, 2003).
En el marco del proyecto “Vigilancia epidemiológica en poblaciones de cerdos silvestres” aprobado por SENASA (Carpinetti et al., 2014), los cerdos cimarrones fueron capturados estacionalmente por guardaparques del Refugio de Vida Silvestre Bahía Samborombón durante un año, desde septiembre de 2015 a septiembre de 2016. Los métodos de captura dependieron de los recursos disponibles y las condiciones ambientales. Se utilizaron armas de fuego y/o trampas de captura con perros entrenados para control y erradicación de esta especie exótica en el área protegida. Para la captura y sacrificio se siguieron los lineamientos establecidos por la “American Society of Mammalogists” para el uso de animales silvestres en investigación (Sikes y The Animal Care and Use Committee of the America Society of Mammalogists, 2016).
Las muestras de materia fecal fueron tomadas del recto de cada animal y conservadas en dicromato de potasio y/o formol 5%. Se revisó la cavidad del cuerpo y se extrajeron las vísceras. In situ se revisaron los órganos. Al observar alguna anormalidad se procedió a tomar una muestra de éste. Para la obtención de muestras del intestino delgado se tomaron 2 porciones de 20 cm cada una, la primera a continuación del estómago y la segunda en el tercio posterior y fueron fijadas en formol 10%. El contenido del ciego fue revisado utilizando bandejas, coladores y abundante agua. Para el análisis de la materia fecal se utilizaron las técnicas de flotación de Sheather y de sedimentación de Ritchie (Vignau et al., 2005) y posteriormente fueron observadas con microscopio óptico (MO) Olympus BX51(Olympus Corporation, Tokio, Japón). Los quistes de protozoos y huevos fueron medidos y fotografiados con una cámara Olympus SC30 (Olympus Corporation, Tokio, Japón) e identificados utilizando bibliografía específica (Kauffmann, 1996; Thienpont et al., 1979). Los helmintos adultos fueron aclarados en lactofenol, observados al MO e identificados utilizando claves (Anderson et al., 2009; Arrabal et al., 2017; D’Alessandro, 2002; Kalhil et al., 1994; Richardson, 2005; Yamaguti, 1963). Los acantocéfalos fueron deshidratados en una serie de alcoholes (70u, 80u, 90u, 95u y 100u), utilizando la técnica de punto crítico y observados usando el microscopio electrónico de barrido (MEB) Jeol 6360 LV y fotografiados.
Se estimó la prevalencia (P) según Bush et al. (1997) y el índice de Fager para estimar la asociación entre especies parásitas. La prueba de “t” determinó si el índice de afinidad era significativo a un nivel de 5%, considerándose que existe afinidad real entre las especies involucradas cuando el valor “t” calculado es superior a 1.645 (Morales y Pino, 1987).
Resultados
Se capturaron un total de 30 individuos, cuyo 90% (27/30) estaba parasitado. En la tabla 1 se detallan los resultados de las especies parásitas halladas y su prevalencia en el análisis coprológico y en la prospección de vísceras.
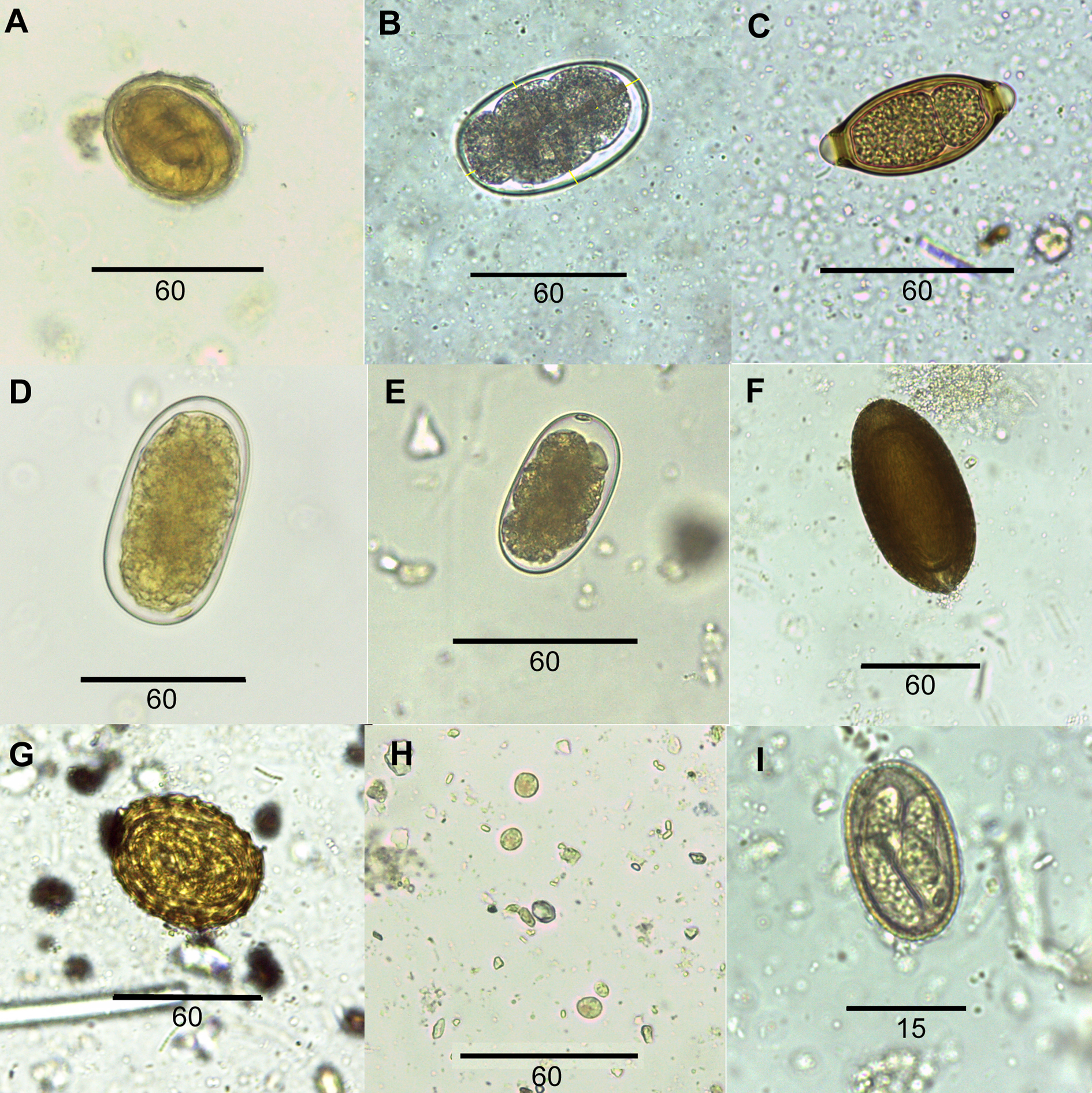
Se hallaron un total de 11 especies parásitas: 3 protozoos, 1 céstodo, 1 acantocéfalo y 6 nemátodos. En el análisis coprológico se encontraron ooquistes de Eimeria sp. e Isospora sp. (Coccidia), quistes de Iodamoeba sp. (Amoebidae), huevos de Macracanthorhynchus hirudinaceus (Acanthocephala, Gygantorhynchidae) y de los nemátodos Ascaris suum (Ascarididae), Oesophagostomum dentatum, Globocephalus sp., Metastrongylus sp. e Hyostrongylus sp. (Strongylida) y de Trichuris sp. (Trichuridae) (tabla 1; fig. 2). Las medidas de los quistes y huevos se detallan en la tabla 2. En la prospección helmintológica se observó el intestino parasitado por juveniles y adultos de M. hirudinaceus y A. suum; en el ciego se encontró O. dentatum y en el hígado, quistes hidatídicos de Echinococcus sp. (Cestoda, Taeniidae) (fig. 3). El resto de los órganos no estuvieron parasitados. En el intestino de los cerdos parasitados por M. hirudinaceus se observaron las típicas lesiones en la pared externa provocadas por la probóscis y los ganchos del acantocéfalo. Los quistes de Echinococcus sp. midieron de 1 a 6 cm. En su interior se observó líquido conteniendo vesículas poliquísticas de metacéstodos con 3-6 protoescólices. Cada protoescólex lleva una doble corona de ganchos (fig. 3).
Las especies con mayor prevalencia registradas en las heces fueron Iodamoeba sp. (P = 52%), M. hirudinaceus (P = 33%), A. suum (22%) e Isospora sp. (P = 22%), en tanto que, en la prospección parasitológica, M. hirudinaceus alcanzó una P = 63% (tabla 1).
La riqueza específica por individuo hospedador fue variable, habiendo cerdos monoparasitados hasta hexaparasitados. El 70% de los cerdos estuvieron parasitados por 1 (18.5%), 2 (22.2%) o 3 (29.6%) especies parásitas y la mayor frecuencia de parasitismo fue de 3 especies. Los valores de asociación del índice de Fager fueron no significativos con excepción del par Isospora sp.-Eimeria sp. (Ind Fager = 0.91; t = 2.05; tabla 3).

Discusión
El presente trabajo da a conocer por primera vez 11 especies parásitas (3 protozoos y 8 helmintos) en una población silvestre de S. scrofa en Bahía Samborombón. Hasta el momento, se habían reportado en jabalíes salvajes cazados en el Parque Nacional Nahuel Huapi y sus alrededores, 3 especies de helmintos (F. hepatica, M. pudendotectus y T. spiralis), sarcocistosis en corazón y serología positiva para rotavirus, influenza tipo 3 y leptospirosis (Chang-Reissig et al., 2010) y en el Parque Nacional El Palmar, T. spiralis (Cohen et al., 2010). Otros estudios realizados en animales de criadero en Brasil reportaron las mismas especies halladas en el presente estudio (Mundin et al., 2004).
Entre los protozoos, 8 especies de Eimeria y una de Isospora producen la coccidiosis detectada en cerdos de cautiverio (Kauffmann, 1996; Mundim et al., 2004) y en menor medida en cerdos silvestres (Greiner et al., 1982). La presencia de estos protozoos en los cerdos salvajes tiene importancia para la fauna nativa, ya que se sabe que la prevalencia de estos coccidios es mayor en cerdos juveniles sobre los que depredan los felinos nativos, pudiendo ser transmitidos a éstos y también a otros carnívoros que comparten el ambiente con los cerdos (Pescador et al., 2009). Además, la presencia de estos protozoos en Bahía Samborombón podría ser de importancia sanitaria para los animales de ganadería presentes en la zona, dado que altas prevalencias de estos coccidios generan efectos económicos en la industria ganadera.
Tabla 1
Prevalencia de especies parásitas halladas en el análisis coprológico y en la prospección de vísceras de cerdos asilvestrados en Bahía Samborombón.
|
Parásitos |
Materia fecal (n = 27) |
Prospección de vísceras (n = 30) |
|
Protozoa |
||
|
Iodamoeba sp. |
52 % |
– |
|
Eimeria sp. |
18.5 % |
– |
|
Isospora sp. |
22 % |
– |
|
Cestoda |
||
|
Quistes de Echinococcus sp. |
– |
20 %* |
|
Nematoda |
||
|
Ascaris suum |
22 % |
23 % |
|
Globocephalus sp. |
7.5% |
– |
|
Metastrongylus sp. |
7.5% |
– |
|
Hyostrongylus sp. |
18.5% |
– |
|
Oesophagostomun dentatum |
4% |
3%† |
|
Trichuris sp. |
4% |
– |
|
Acanthocephala |
||
|
Macracanthorhynchus hirudinaceus |
33% |
63% |
* Localización en hígado. † Localización en ciego.
Tabla 2
Medidas de los quistes y huevos hallados en el análisis coprológico de cerdos asilvestrados en Bahía Samborombón.
|
Parásitos |
Medidas de quistes / huevos |
|
Protozoa |
|
|
Iodamoeba sp. |
12 × 7.2 µm (n = 14) |
|
Eimeria sp. |
17 × 12.7 µm (n = 2) |
|
Isospora sp. |
18.7 × 15.6 µm (n = 4) |
|
Nematoda |
|
|
Ascaris suum |
73.1 × 60.7 µm (n = 4) |
|
Globocephalus sp. |
48.8 × 27.5 µm (n = 2) |
|
Metastrongylus sp. |
48.2 × 39.2 µm (n = 2) |
|
Hyostrongylus sp. |
80.8 × 44,7 µm (n = 5) |
|
Oesophagostomun dentatum |
67.4 × 30.2 µm (n = 1) |
|
Trichuris sp. |
68 × 31 µm (n = 1) |
|
Acanthocephala |
|
|
Macracanthorhynchus hirudinaceus |
10.8 × 51.6 µm (n = 9) |
Iodamoeba sp. también fue reportada en cerdos en cautiverio y asilvestrados en otros países, aunque ésta no es una especie patógena (Solaymani-Mohammadi et al., 2004; Yaghoobi et al., 2016). En este trabajo se observaron altas cargas parasitarias, lo que indicaría que los cerdos frecuentan ambientes contaminados con materia fecal. El presente trabajo da a conocer el primer reporte de Eimeria sp., Isospora sp. e Iodamoeba sp. en cerdos asilvestrados para Argentina.
Las 4 especies de Strongylida (O. dentatum, Globocephalus sp., Metastrongylus sp. e Hyostrongylus sp.) halladas en el presente estudio son parásitos frecuentes de cerdos en cautiverio (Kaufmann, 1996; Zimmerman et al., 2012). En Bulgaria, Panayotova-Pencheva y Dakova (2018) han reportado la presencia de estas especies en cerdos silvestres con prevalencias que varían entre 7.5% para Hyostrongylus sp. y 28.75% para Metastrongylus sp.; en tanto en Brasil, da Silva y Müller (2013) reportan solo la presencia de O. dentatum en cerdos de granjas. Al presente, para Argentina no hay reportes de estos 4 Strongylida para cerdos en cautiverio, siendo éste el primer registro. Hyostrongylus sp. es un parásito que suele reportarse en cerdos de criadero que frecuentan pastizales (Kaufmann, 1996). La alta prevalencia (18.5%) reportada en este trabajo podría deberse a los pastizales que frecuentan estos cerdos asilvestrados en el área de estudio.
El hallazgo de M. hirudinaceus, Echinococcus sp. y A. suum reviste importancia debido a que son especies zoonóticas y pueden afectar al hombre. Las 2 primeras especies son parásitos con ciclos indirectos, con hospedadores intermediarios como coleópteros y roedores, respectivamente. Para M. hirudinaceus se sabe que diferentes especies de la familia Scarabaeidae actúan como hospedadores intermediarios (Pavlovic et al., 2010); sin embargo, para Argentina aún es desconocido. Durante la prospección de vísceras de los cerdos salvajes, los autores observaron numerosos coleópteros de la especie Diloboderus abderus o escarabajo torito en el contenido estomacal, además de hallarlos en el ambiente. Este coleóptero podría estar involucrado como hospedador intermediario del acantocéfalo.
Actualmente, en Argentina se registran 3 especies de Echinococcus: E. granulosus y E. vogeli que parasitan a cánidos, y E. oligarthrus a felinos, y como hospedadores intermediarios roedores miomorfos (Arrabal et al., 2017; D’Alessandro, 2002; D’Alessandro y Rauch, 2008). Echinococcus granulosus también fue detectado en cerdos de criaderos y en la fauna silvestre; Sciocia et al. (2013) lo mencionan para la provincia de Buenos Aires en el zorro gris pampeano Lycalopex gymnocercus y la liebre introducida Lepus europaeus. Sin embargo, el presente hallazgo resulta novedoso debido a que la morfología de los ganchos de los protoescólices difieren de los de E. granulosus, siendo semejantes a los de E. oligarthrus. Estudios moleculares permitirán confirmar la identidad de esta especie en la población de cerdos asilvestrados de Bahía Samborombón.
Actualmente, algunos autores sostienen que las especies Ascaris suum y Ascaris lumbricoides son sinónimos dado que las diferencias morfológicas y moleculares halladas son escasas de manera que podrían ser asignadas a variaciones geográficas y hospedatorias (Leles et al., 2012). De ser ésto confirmado, el hallazgo de Ascaris en los cerdos debería ser considerado de importancia zoonótica para Bahía Samborombón.
Tabla 3
Índice de Fager y valores de “t” de las especies parásitas halladas en el análisis coprológico y en la prospección de vísceras de cerdos asilvestrados en Bahía Samborombón.
|
I Fager |
Iod |
Mac |
Asc |
Glob |
Met |
Hyos |
Oes |
Eim |
Isos |
Tric |
Echin |
|
Iod |
1 |
0.61 |
0.36 |
0.25 |
0.12 |
0.21 |
0.25 |
0.31 |
0.30 |
0 |
0.10 |
|
Mac |
1 |
0.53 |
0.08 |
0.16 |
0.37 |
0 |
0.29 |
0.35 |
0.08 |
0.42 |
|
|
Asc |
1 |
0 |
0.20 |
0.30 |
0 |
0.61 |
0.71 |
0.22 |
0.42 |
||
|
Glob |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|||
|
Met |
1 |
0.28 |
0.50 |
0.28 |
0.25 |
0.66 |
0 |
||||
|
Hyos |
1 |
0.28 |
0.20 |
0.18 |
0 |
0.36 |
|||||
|
Oes |
1 |
0.28 |
0.25 |
0.66 |
0 |
||||||
|
Eim |
1 |
0.90 |
0.33 |
0.36 |
|||||||
|
Isos |
1 |
0.28 |
0.66 |
||||||||
|
Tric |
1 |
0 |
|||||||||
|
Echin |
1 |
||||||||||
|
t values |
Iod |
Mac |
Asc |
Glob |
Met |
Hyos |
Oes |
Eim |
Isos |
Tric |
Echin |
|
Iod |
1 |
1.3 |
-1.4 |
-0.6 |
-2.7 |
-2.5 |
-0.6 |
-1.4 |
-1.8 |
-3.83 |
|
|
Mac |
1 |
1.5 |
-3.5 |
-0.9 |
0.5 |
-0.7 |
-0.2 |
-2.2 |
0.42 |
||
|
Asc |
1 |
-2.1 |
-1.8 |
0.5 |
1.1 |
-1.2 |
0.48 |
||||
|
Glob |
1 |
||||||||||
|
Met |
1 |
-1.6 |
-0.9 |
-1.6 |
-1.8 |
-0.4 |
|||||
|
Hyos |
1 |
-1.6 |
-2.4 |
-2.6 |
-3.6 |
-1.42 |
|||||
|
Oes |
1 |
-1.6 |
-1.8 |
-0.4 |
-3.52 |
||||||
|
Eim |
1 |
2.1 |
-0.9 |
-1.42 |
|||||||
|
Isos |
1 |
-1 |
0.55 |
||||||||
|
Tric |
1 |
||||||||||
|
Echin |
1 |
La detección de helmintos intestinales en el análisis coprológico difirió de la detección en la prospección parasitológica. Se observó que algunos hospedadores fueron positivos para Macracanthorhynchus, Ascaris y Oesophagostomum en el análisis de materia fecal, en tanto que los adultos no fueron detectados en la prospección helmintológica; mientras que en otros cerdos sólo se hallaron los adultos y el análisis coprológico dio negativo. Estos resultados apoyan la tesis de que no sólo se deben utilizar técnicas no invasivas, como las técnicas coprológicas, sino también, de ser posible, realizar la prospección de los animales en cuestión.
El presente estudio demostró que la población de cerdos silvestres de Bahía Samborombón presenta una alta riqueza de especies parásitas, muchas de las cuales revisten importancia zoonótica.
Resulta evidente la necesidad de realizar estudios exhaustivos y prolongados en el tiempo en estas poblaciones de cerdos, para conocer la dinámica poblacional de sus parásitos y establecer políticas de control tanto para los cerdos salvajes, como para las parasitosis zoonóticas halladas en ellos.
Agradecimientos
A Hernán Améndola y Cristian Galetto por su inestimable ayuda en la toma de muestras. A G. T. Navone y M. L. Zonta (CEPAVE- CCT La Plata- CONICET) por la ayuda en la realización de los análisis coprológicos; a Juan Manuel Unzaga (Fac. Cs. Veterinarias- CONICET) por la identificación de los coccidios; a Patricia Sarmiento del Museo de La Plata por su ayuda en el MEB. Este trabajo fue realizado en el marco de una pasantía para alumnos de la FCNyM- UNLP a RC y financiado por el proyecto “Vigilancia epidemiológica en poblaciones de cerdos silvestres –SENASA” a BC.
Referencias
Amayour, A., El Alaqui, Z., Alkhali, A., Hassouni, T., Elkharrim K. y Belghyti, D. (2017). Presence of very high prevalence of Macracanthorhynchus hirudinaceus infection in Wild Boars (Sus scrofa Barbarus) in El Hajeb province, Middle Atlas, Morocco. Journal of Entomology and Zoology Studies, 5, 1784–1787.
Anderson, R. G., Chabaud, A. G. y Willmott, S. (2009). Keys to the Nematodes parasites of vertebrates. Archival Volume. Wallingford: CAB International.
Arrabal, J. P., Ávila, H. G., Rivero, M. R., Camicia, F., Salas, M. M., Costa, S. A. et al. (2017). Echinococcus oligarthrus in the subtropical region of Argentina: first integration of morphological and molecular analyses determines two distinct populations. Veterinary Parasitology, 240, 60–67. https://doi.org/10.1016/j.vetpar.2017.03.019
Bush, A. O., Lafferty, K. D., Lotz, J. M. y Shostak, A. W. (1997). Parasitology meets ecology on its own terms: Margolis et al. revisited. Journal of Parasitology, 83, 575–583.
Cabrera, A. L. (1971). Fitogeografía de la República Argentina. Boletín de la Sociedad Argentina de Botánica, 14, 1–42.
Carpinetti, B. N. (1998). Spatio-temporal variation in a pampas deer (Ozotocerus bezoarticus celer) population: influence of habitat structure and sympatric ungulates (Tesis de maestría). Durrell Institute of Conservation and Ecology, University of Kent, Canterbury, Reino Unido.
Carpinetti, B. N., Castresana, G., Rojas, P., Grant, J., Marcos, A., Monterubbianesi, M. et al. (2014). Vigilancia epidemiológica en poblaciones de cerdos silvestres (Sus scrofa). Implicancias para la salud pública, la producción animal y la conservación de la biodiversidad. SENASA, 5-6, 67–76.
Carpinetti, B. N., Castresana, G., Rojas, P., Grant, J., Marcos, A., Monterubbianesi, M. et al. (2017). Determinación de anticuerpos contra patógenos virales y bacterianos seleccionados en la población de cerdos silvestres (Sus scrofa) de la Reserva Natural Bahía Samborombón, Argentina. Analecta Veterinaria, 37, 21–27.
Carpinetti, B. N., Di Guirolamo, G., Delgado, J. V. y Martínez, R. D. (2016). El cerdo criollo costero: valioso recurso zoogenético local de la provincia de Buenos Aires Argentina. Archivos de Zootecnia, 65, 403–407.
Chang-Reissig, E., Massone, A. y Uzal, F. A. (2010). Evaluación sanitaria del ciervo colorado (Cervus elaphus) y jabalí (Sus scrofa). Macroscopia, 1, 1–4.
Choquenot, D., Lukins, B. y Curran, G. (1997). Assessing lamb predation by feral pigs in Australia’s semi-arid rangelands. Journal of Applied Ecology, 34, 1445–1454. https://doi.org/10.2307/2405260
Cohen, M., Costantino, S. N., Calcagno, M. A., Blanco, G. A., Pozio, E. y Venturiello, S. M. (2010). Trichinella infection in wild boars (Sus scrofa) from a protected area of Argentina and its relationship with the presence of humans. Veterinary Parasitology, 169, 362–366. https://doi.org/10.1016/j.vetpar.2010.01.005
D’Alessandro, A. (2002). Descripción morfológica, ciclo biológico y distribución geográfica de las especies del género Echinococcus. En G. M. Denegri, M. C. Elissondo y M. C. Dopchiz (Eds.), Situación de la hidatidosis en la República Argentina. Mar del Plata: Editorial Martin.
D’Alessandro, A. y Rauch, R. L. (2008). New aspects of neotropical polycystic (Echinococcus vogeli) and unicystic (Echinococcus oligarthrus) Echinococcosis. Clinical Microbiology Reviews, 21, 380–401. https://doi.org/10.1128/CMR.00050-07
da Silva, D. S. y Müller, G. (2013). Parasitic helminths of the digestive system of wild boards breed in captivity. Revista Brasileira de Parasitología Veterinaria, 22, 433–436.
De La Muela, N., Hernández-De Luján, S. y Ferre, I. (2001). Helminths of wild boar in Spain. Journal of Wildlife Diseases, 37, 840–843. https://doi.org/10.7589/0090-3558-37.4.840
Dunn, A. M. y Hatcher, M. J. (2015). Parasites and biological invasions: parallels, interactions, and control. Trends in Parasitology, 31, 189–199. https://doi.org/10.1016/j.pt.2014.12.003
Dunn, A. M., Torchin, M. E., Hatcher, M. J., Kotanen, P. M., Blumenthal, D. M., Byers, J. E. et al. (2012). Indirect effects of parasites in invasions. Functional Ecology, 26, 1262-1274. https://doi.org/10.1111/j.1365-2435.2012.02041.x
García-González, A. M., Pérez-Martín, J. E., Gamito-Santos, J. A., Calero-Bernal, R., Alonso, M. A. y Carrión, E. M. F. (2013). Epidemiologic study of lung parasites (Metastrongylus spp.) in wild boar (Sus scrofa) in southwestern Spain. Journal of Wildlife Diseases, 49, 157–162. https:// doi.org/10.7589/2011-07-217
Gozzi, A. C. (2015). Estudios parasitológicos y zoonóticos de la ardilla de vientre rojo Callosciurus erythraeus introducida en Argentina y su relación con la comunidad de mamíferos del ambiente receptor (Tesis de Doctorado). Universidad Nacional de Luján, Luján, Argentina.
Greiner, E. C., Taylor, C., Frankenberger, W. B. y Belden, R. C. (1982). Coccidia of feral swine from Florida. Journal of the American Veterinary Medical Association, 181, 1275–1277.
Hampton, J., Spencer, P. B., Elliot, A. D. y Thompson, R. A. (2006). Prevalence of zoonotic pathogens from feral pigs in major public drinking water catchments in Western Australia. EcoHealth, 3, 103–108. https://doi.org/10.1007/S10393-006-0018-8
Heger, T. y Jeschke, J. M. (2014). The enemy release hypothesis as hierarchy of hypotheses. Oikos, 123, 741–750. https://doi.org/10.1111/j.1600-0706.2013.01263.x
Kauffmann, J. (1996). Parasitic infections of domestic animals. A diagnostic manual. Basel, Alemania: Bierkhäuser Verlag.
Khalil, L. F., Jones, A. y Bray, R. A. (1994). Key to the Cestode Parasite of Vertebrates, Albans, RU: CAB International.
Leles, D., Gardner, S. L., Reinhard, K., Íñiguez, A. y Araujo, A. (2012). Are Ascaris lumbricoides and Ascaris suum a single species. Parasites & Vectors, 5, 42–49. https://doi.org/10.1186/1756-3305-5-42
Mack, R. N., Simberloff, D., Lonsdale, W. M., Evans, H., Count, M. y Bazzaz, F. A. (2000). Biotic invasions: causes, epidemiology, global consequences, and control. Ecological Applications, 10, 689–710. https://doi.org/10.1890/1051-0761(2000)010[0689:BICEGC]2.0.CO;2
Merino, M. y Carpinetti, B. N. (2003). Feral pig (Sus scrofa) population estimates in Bahia Samborombón conservation area, Argentina. Mastozoología Neotropical, 10, 269–275.
Morales, G. y Pino, L. A. (1987). Parasitología cuantitativa. Caracas: Fundación Fondo Editorial, Acta Científica Venezolana.
Mundim, M. J. S., Mundim, A. V., Santos, A. L. Q., Cabral, D. D., Faria, E. S. M. y Moraes, F. M. (2004). Helmintos e protozoários em fezes de javalis (Sus scrofa scrofa) criados em cativeiro. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, 56, 792–795.
Panayotova-Pencheva, M. y Dakova, V. (2018). Studies on the gastrointestinal and lung parasites fauna of wild boards (Sus scrofa scrofa L.) from Bulgaria. Annals of Parasitology, 64, 379–384. https://doi.org/10.17420/ap6404.174
Pavlovic, I., Kulisic, Z., Tambur, Z. y Protic, N. (2010). Scarabidae: Intermediate host for Macracanthorhynchus hirudinaceus. Zbornik Matice Srpske za Prirodne Nauke, 119, 89–95.
Pedersen, A. B. y Greives, T. J. (2008). The interaction of parasites and resources cause crashes in a wild mouse population. Journal of Animal Ecology, 77, 370–377. https://doi.org/10.1111/j.1365-2656.2007.01321.x
Pedersen, A. B., Jones, K. E., Nunn, C. L. y Altizer, S. (2007). Infectious diseases and extinction risk in wild mammals. Conservation Biology, 21, 1269–1279. https://doi.org/10.1111/j.1523-1739.2007.00776.x
Pence, D. B., Warren, R. J. y Ford, C. R. (1988). Visceral helminth communities of an insular population of feral swine. Journal of Wildlife Diseases, 24, 105–112. https://doi.org/10.7589/0090-3558-24.1.105
Pérez-Carusi, L. C., Beade, M. S., Miñarro, F., Vila, A. R., Giménez-Dixon, M. y Bilenca, D. N. (2009). Relaciones espaciales y numéricas entre venados de las pampas (Ozotoceros bezoarticus celer) y chanchos cimarrones (Sus scrofa) en el Refugio de Vida Silvestre Bahía Samborombón, Argentina. Ecología Austral, 19, 63–71.
Pescador, M., Sanguinetti, J., Pastre, H. y Peris, S. (2009). Expansion of the introduced wild boar (Sus scrofa) in the andean region, Argentinean Patagonia. Galemys, 21, 121–132.
Richardson, D. (2005). Identification of cystacanths and adults of Oligacanthorhynchus tortuosa, Macracanthorhynchus ingens, and Macracanthorhynchus hirudinaceus based on proboscis and hook morphometrics. Journal of the Arkansas Academy of Science, 59, 205–209.
Sanguinetti, J. y Kitzberger, T. (2010). Factors controlling seed predation by rodents and non-native Sus scrofa in Araucaria araucana forests: potential effects on seedling establishment. Biological Invasion, 12, 689–706. https://doi.org/10.1007/s10530-009-9474-8
Sanguinetti, J. y Pastore, H. (2016). Abundancia poblacional y manejo del jabalí (Sus scrofa): una revisión global para abordar su gestión en la Argentina. Mastozoología Neotropical, 23, 305–323.
Scioscia, N. P., Beldomenico, P. M., Petrigh, R. S., Pierangeli, N. y Denegri, G. M. (2013). Epidemiological studies on Echinococcus in Pampas fox (Lycalopex gymnocercus) and European hare (Lepus europaeus) in Buenos Aires province, Argentina. Parasitology Research, 112, 3607–3613. https://doi.org/10.1007/s00436-013-3548-3
Senlik, B., Cirak, V. Y., Girisgin, O. y Akyol, C. V. (2011). Helminth infections of wild boars (Sus scrofa) in the Bursa province of Turkey. Journal of Helminthology, 85, 404–408. https://doi.org/10.1017/S0022149X1000074X
Sikes, R. S. y The animal care and use committee of the American Society of Mammalogists. (2016). Guidelines of the American Society of Mammalogists for the use of wild mammals in research and education. Journal of Mammalogy, 97, 663–688. https://doi.org/10.1093/jmammal/gyw078
Singer, F. J., Swank, W. T. y Clebsch, E. E. C. (1984). Effects of wild pig rooting in a deciduous forest. Journal of Wildlife Management, 48, 464–473.
Solaymani-Mohammadi, S., Mobedi, I., Rezaian, M., Massoud, J., Mohebali, M., Hooshyar, H. et al. (2003). Helminth parasites of the wild boar, Sus scrofa, in Luristan province, western Iran and their public health significance. Journal of Helminthology, 77, 263–267. https://doi.org/10.1079/JOH2003168
Solaymani-Mohammadi, S., Rezaian, M., Hooshyar, H., Molavi, G. R., Babaei, Z. y Anwar, M. A. (2004). Intestinal protozoa in wild boars (Sus scrofa) in western Iran. Journal of Wildlife Diseases, 40, 801–803. https://doi.org/10.7589/0090-3558-40.4.801
Thienpont, D., Rochette, F. y Vanparijs, O. F. J. (1979). Diagnóstico de las helmintiasis por medio del examen coprológico. Beerse, Bélgica: Janssen Research Foundation.
Tompkins, D. M. y Begon, M. (1999). Parasites can regulate wildlife populations. Parasitology Today, 15, 311–313.
Torchin, M. E., Lafferty, K. D., Dobson, A. P., Mckenzie, V. J. y Kuris, A. M. (2003). Introduced species and their missing parasites. Nature, 421, 428–430. https://doi.org/.1038/nature01346
Vignau, M. L., Venturini, L. M., Romero, J. R., Eiras, D. F. y Basso, W. U. (2005). Parasitología práctica y modelos de enfermedades parasitarias en los animales domésticos. La Plata: Facultad de Ciencias Veterinarias, Universidad Nacional de La Plata.
Yaghoobi, K., Sarkari, B., Mansouri, M. y Motazedian, M. H. (2016). Zoonotic intestinal protozoan of the wild boars, Sus scrofa, in Persian Gulf’s coastal area (Bushehr province), Southwestern Iran. Veterinary World, 9, 1047–1050. https://doi.org/10.14202/vetworld.2016.1047-1050
Yamaguti, S. (1963). Systema Heminthum Volume V, Acanthocephala. New York: Interscience publishers.
Zimmerman, J. J., Karriker, L. A., Ramírez, A., Schwartz, K. J. y Stevenson, G. W. (2012). Diseases of swine. 10th Edition. Oxford, RU: Wiley-Blackwell.



