Manejo forestal comunitario en el sur de México: ¿es una práctica sustentable para el mantenimiento de los ensambles de escarabajos?
Iliana Ruíz-Pérez a, Jorge L. León-Cortés a, *, Lucrecia Arellano b y Darío A. Navarrete c
a Departamento de Conservación de la Biodiversidad, El Colegio de la Frontera Sur, Carretera Panamericana y Av. Periférico Sur s/n, Barrio María Auxiliadora, 29290 San Cristóbal de Las Casas, Chiapas, México
b Red de Ecoetología, Instituto de Ecología, A.C,. Carretera antigua a Coatepec 351, El Haya, 91070 Xalapa, Veracruz, México
c Laboratorio de Análisis de Información Geográfica (LAIGE). El Colegio de la Frontera Sur, Carretera Panamericana y Av. Periférico Sur s/n, Barrio María Auxiliadora, 29290 San Cristóbal de Las Casas, Chiapas, México
*Autor para correspondencia: jleon@ecosur.mx (J.L. León-Cortés)
Resumen
Evaluamos los cambios en la diversidad, estructura y composición de especies de escarabajos copronecrófagos (Coleoptera: Scarabaeidae: Scarabaeinae) en un paisaje bajo manejo forestal comunitario en el sur de México. Se dispusieron trampas de caída cebadas con excretas de cerdo y calamar en descomposición en sitios con diferente tratamiento forestal. En total, se registraron 3,608 individuos y 21 especies de Scarabaeinae. Registramos un mayor número de especies en el área sin intervención y cambios significativos en la composición de especies entre sitios. Dos escarabajos generalistas (Ontherus mexicanus y Onthophagus cyanellus) representaron 51% de la abundancia total. Nuestros resultados indican que el efecto relativo del manejo forestal sobre el ensamble de escarabajos es proporcional a la intensidad de corte. El impacto negativo sobre las comunidades de escarabajos puede contravenir al modelo de aprovechamiento silvícola, pues la pérdida gradual de especies a nivel local podría generar impactos significativos en la funcionalidad del ecosistema en el largo plazo. Es necesario establecer esquemas de monitoreo para la valoración del estatus de los elementos de la biodiversidad, con el fin de garantizar un manejo comunitario sustentable en áreas forestales en el Sur de México.
Palabras clave:
Insectos; Scarabaeinae; Manejo del bosque; Método de desarrollo silvícola; Intensidad de manejo
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Community forest management in southern Mexico: a sustainable practice for the maintenance of beetle assemblages?
Abstract
We evaluated changes in the diversity, structure, and composition of dung and carrion beetle species (Coleoptera: Scarabaeidae: Scarabaeinae) in a landscape under community forest management in southern Mexico. Baited pit-fall traps were set with pig dung and squid carrion in areas with different forest treatment. In total, we recorded 3,608 individuals and 21 species of Scarabaeinae. We registered a greater number of species in areas without intervention and significant changes in beetle species composition among sites. Two generalist beetles (Ontherus mexicanus and Onthophagus cyanellus) accounted for 51% of the total abundance. Our results indicate that the relative effect of forest management on beetle assemblage is proportional to the intensity of cutting. The negative impact on beetle communities may contravene a silvicultural model, since the gradual loss of species at the local level could generate significant impacts on ecosystem functionality in the long term. It is a matter of urgency to establish monitoring schemes to assess the status of biodiversity components, in order to ensure a sustainable community management in forest areas in southern Mexico.
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Keywords:
Insects; Scarabaeinae; Forest management; Silvicultural development method; Logging intensity
Introducción
Las concesiones de aprovechamiento forestal en diferentes regiones de México han provocado modificaciones importantes en los ecosistemas manejados (Cayuela, 2006). Tales cambios están asociados a prácticas poco sustentables como la corta selectiva de especies y la tala clandestina (Armenteras y Rodríguez, 2014; Jardel, 1998). Para mitigar el impacto de las prácticas convencionales, se han propuesto sistemas de ordenación forestal de impacto reducido (Putz et al., 2008). El método de desarrollo silvícola (MDS) ha sido el instrumento de aprovechamiento forestal más común durante las últimas 4 décadas en México (Hernández-López, 2007).
El MDS incluye2 tratamientos principales, la corta de regeneración y la corta de aclareo. El primero implica la remoción total de especies de encinos y entre 60 y 75% de las de pinos, mientras que las cortas de aclareo requieren la eliminación de hasta el 40% de los pinos y encinos presentes en el área bajo aprovechamiento (SARH, 1985; TSI, 2008). Bajo la premisa de promover la regeneración natural y minimizar los impactos al ecosistema, el MDS ha sido implementado como una alternativa de ordenación forestal de los bosques templados para planificar y mejorar la aplicación de las técnicas silvícolas e incrementar la productividad de las áreas forestales (SARH, 1985).
A pesar de las ventajas relativas del MDS sobre la explotación convencional (Jardel, 2012; Ordóñez-Díaz, 2008; SARH, 1985), el método incluye la aplicación de tratamientos intensivos como talas rasas y cortas sucesivas, con una aparente tendencia a la “pinarización” (o la propagación predominante de especies de pino; Jardel, 2012). La aplicación inadecuada del MDS puede originar graves problemas de degradación en las áreas de aprovechamiento (Balam-Ballote y León-Cortes, 2010), que en el largo plazo puede propiciar la pérdida de la diversidad de los ecosistemas forestales y sus funciones (Ascanio-Lárraga et al., 2018; Ochoa, 1998; Putz et al., 2008). A pesar de ello, los costos ecológicos asociados a esas actividades se han valorado de manera limitada (Ascanio-Lárraga et al., 2018; Darrigo et al., 2016).
Una aproximación ecológica para valorar los cambios sobre la biota asociada en áreas de aprovechamiento forestal representa el reconocimiento y uso de especies o ensambles sensibles o bioindicadores para valorar la salud de un ecosistema (Favila y Halffter, 1997; Halffter y Arellano, 2002). Debido a su gran diversidad, respuesta rápida al cambio ambiental a una variedad de escalas (Spector, 2006), a su intervención en procesos ecológicos relativos a la remoción y control de la biomasa vegetal y animal, y a su función como presas de otros artrópodos y vertebrados (Summerville, 2011), los insectos han sido considerados como indicadores ecológicos adecuados (McGeoch, 1998). En particular, los ensambles de escarabajos copronecrófagos representan biomodelos adecuados, debido a su respuesta directa a los cambios resultantes de actividades humanas en el hábitat (Slade et al., 2011), a las variaciones microclimáticas (Halffter y Arellano, 2002; Navarrete-Gutiérrez y Halffter, 2008) y a las condiciones del suelo (Arellano et al., 2008; Farías et al., 2015). ¿Esperaríamos registrar cambios importantes en los niveles de diversidad o en la estructura de los ensambles de especies en áreas sujetas a extracción y regeneración forestal?
El objetivo de este estudio fue evaluar los cambios en la diversidad, estructura y composición de especies de escarabajos copronecrófagos (Insecta: Coleoptera: Scarabaeinae) en sitios con distinta intensidad de manejo forestal. Bajo la premisa de que el esquema de manejo y
explotación forestal a través del método de desarrollo silvícola promueve la regeneración natural y minimiza los efectos de la tala sobre la estructura del bosque, no esperaríamos registrar variaciones importantes en los niveles de diversidad o en la estructura de los ensambles del grupo. Discutimos las implicaciones ecológicas del manejo forestal ante la posibilidad de la gestión comunitaria en el largo plazo.
Materiales y métodos
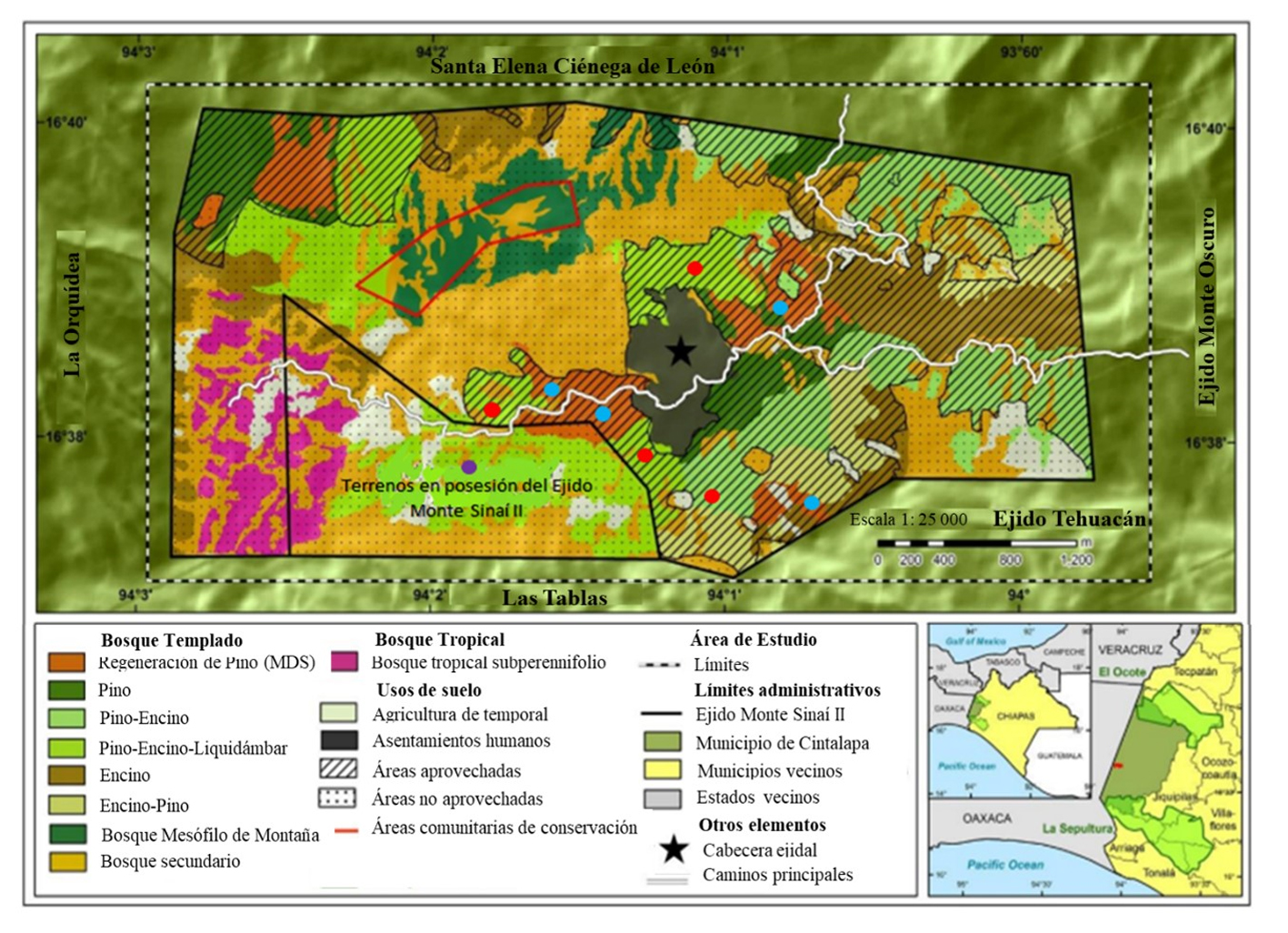
El ejido Monte Sinaí II se encuentra en el municipio de Cintalapa, al noroeste de Chiapas, entre las coordenadas 16°00’32” – 17°32’00” N, 93°21’40” – 94°53’53” O (fig. 1) y comprende una superficie de 1,080 ha (Pérez et al., 2010). La altitud promedio es de 1,320 m snm. El clima predominante corresponde al semicálido subhúmedo ((A) C (w2)) con una temperatura que oscila entre 18 y 26 °C; la precipitación pluvial anual varía de 1,000 a 1,800 mm. El relieve es accidentado; los suelos presentes son Acrisoles húmicos combinados con Acrisoles órticos y Litosoles. La vegetación predominante incluye asociaciones de pino-encino, con presencia importante de vegetación en diferentes etapas de sucesión; las especies arbóreas más representativas son: Pinus maximinoi, P. chiapensis, P. oocarpa, Liquidambar styraciflua y varias especies de Quercus, como Quercus candicans, Q. elliptica, Q. glucoides y Q. laurina (TSI, 2008).
Monte Sinaí II forma parte del corredor biológico Chimalapas-Uxpanapa-El Ocote, así como de la Región Terrestre Prioritaria 132 (Conabio RTP-132) y del Área de Importancia para la Conservación de las Aves (AICA 157 Chimalapas) (Martínez, 2012). El área del ejido ha estado sujeta a aprovechamiento forestal desde la década de 1950, a partir de concesiones a empresas particulares. Desde 2006, el manejo del bosque está a cargo de los ejidatarios, bajo los lineamientos del MDS (TSI, 2008). La superficie total de aprovechamiento incluye 580 ha y cuenta con la certificación internacional del “Forest Stewardship Council” (FSC). Las especies sujetas a aprovechamiento forestal son P. oocarpa y P. maximinoi, así como Q. candicans, Q. elliptica y Q. laurina, para la producción de carbón (Velasco, 2012).
Para cuantificar los posibles efectos del manejo forestal sobre el ensamble de escarabajos copronecrófagos, se seleccionaron 3 tratamientos: corta de aclareo (CA), corta de regeneración (CR) y un área sin intervención (ASI, tabla 1). Para los tratamientos CA y CR se designaron 8 sitios o anualidades (cuatro sitios por tratamiento), además del área sin intervención ASI (un sitio). Cada sitio o anualidad representó una unidad de extracción forestal y refiere al periodo anual en que comenzó su explotación o aprovechamiento, así como la fase de sucesión de la vegetación posterior a las intervenciones (tabla 1).
La recolecta de escarabajos se llevó a cabo de manera mensual de marzo a septiembre de 2016 (N = 7 meses). La duración del muestreo mensual incluyó de 10 a 15 días por sitio. En cada sitio se designó un transecto fijo, donde se instalaron 10 trampas de caída cebadas, separadas al menos 100 m entre sí (para un total de 90 trampas/mes) (Silva y Hernández, 2015). Cada trampa incluyó un recipiente plástico (1 litro), con un plato sostenido por alambres como protección para evitar que los recipientes se inundaran ante la posibilidad de lluvias intensas. Se utilizaron 2 tipos de cebos colocados de manera intercalada sobre el transecto (i.e., 5 trampas con calamar en estado de descomposición y 5 más con excremento de cerdo). El empleo de ambos cebos pretendió complementar la eficiencia del muestreo (Escobar, 2000) y la representatividad de la diversidad del grupo de estudio. La revisión de las trampas se llevó a cabo cada 48 h; las trampas cebadas con excretas de cerdo fueron retiradas después de las primeras 48 h, en tanto que las trampas cebadas con calamar permanecieron activas por la totalidad del periodo de muestreo mensual (15 días), siguiendo las recomendaciones de Yanes-Gómez y Morón (2010).
Los ejemplares fueron procesados e identificados a la categoría taxonómica de especie en la Colección Entomológica de El Colegio de la Frontera Sur (ECOSUR, Unidad San Cristóbal). Se utilizaron las claves dicotómicas y las revisiones taxonómicas de Edmonds y Zidek (2012); Génier (2009); Kohlmann y Solís (2001, 2006); Solís y Kohlmann (2002, 2004) y Vaz de Mello et al. (2011). La identificación de algunas especies fue corroborada en el Instituto de Ecología, A.C.
Se calcularon varios estadísticos referentes a la estimación de la diversidad y los cambios en la estructura y composición por sitio, al análisis de los ensambles y las preferencias de hábitat de los escarabajos por tratamiento.
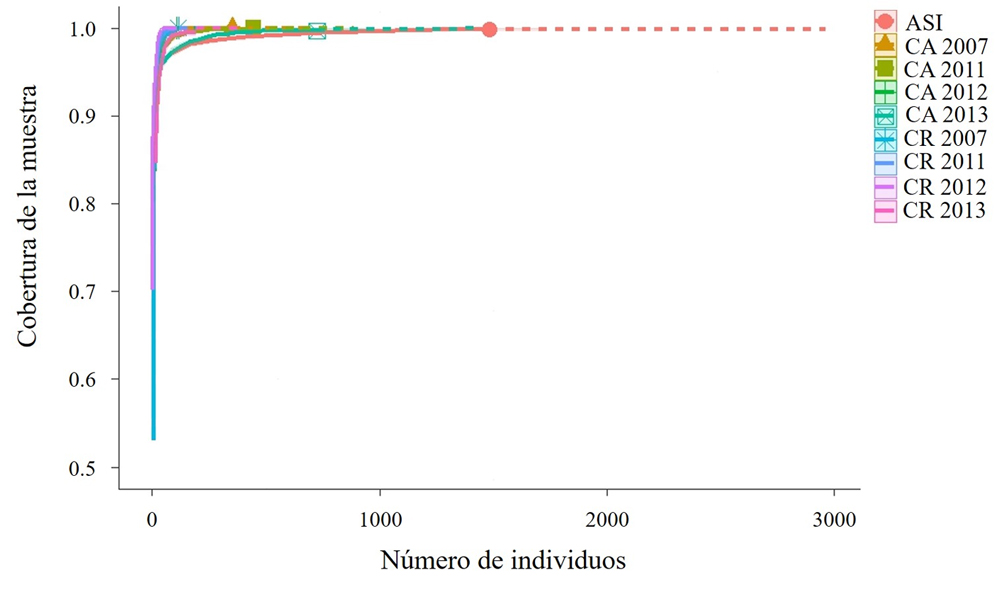
La completitud del muestreo se estimó para cada sitio mediante un análisis de la cobertura de la muestra, que considera la proporción del número total de individuos de las especies representadas en la muestra y tiene valores que oscilan entre 0 (mínima completitud) y 1 (máxima completitud) (Chao y Jost, 2012). Para estimar la riqueza esperada de las especies y comparar los resultados del análisis de cobertura de la muestra, se utilizó el estimador de cobertura basado en la abundancia (ACE). El cálculo de la cobertura de la muestra se realizó con el paquete iNEXT (Chao et al., 2014; Hsieh et al., 2016) integrado al programa estadístico R versión 3.3.2 (R CoreTeam, 2016); para la obtención del estimador ACE se utilizó el programa EstimateS versión 9.1.0 (Colwell, 2013).
Tabla 1
Descripción de los sitios (anualidades) y tratamientos forestales estudiados en el ejido Monte Sinaí II, Cintalapa, Chiapas, México.
|
Tratamiento |
Sitio (anualidad) |
Altitud (m snm) |
Observaciones* |
|
Área sin intervención (ASI) |
1,400 |
Acahual maduro de bosque de pino-encino, 3 estratos bien definidos. Cuerpos de agua y áreas destinadas para la conservación |
|
|
Cortas de aclareo (CA) |
2007 |
1,400 |
Área semillera de P. maximinoi, presencia de Quercus spp., distribuidos de manera aislada. Áreas cercanas de cultivo. Presencia de brechas de saca y caminos principales |
|
2011 |
1,400 |
Individuos de P. maximinoi relativamente abundantes, El estrato arbustivo con altura < 4 m. Árboles con altura promedio 10 m. Presencia de brechas de saca y áreas para el troceado de madera |
|
|
2012 |
1,380 |
Algunos fragmentos con mayor cobertura de dosel, principalmente por la presencia de P. maximinoi y Liquidambar styraciflua, (esta especie permanece pues la comunidad de Sinaí no cuenta con un permiso para su aprovechamiento). Presencia de brechas para el traslado de madera |
|
|
2013 |
1,350 |
Asociación de pino-encino. Una porción de este sitio fue destinada a la conservación por la presencia de epífitas. Cuerpos de agua cercanos |
|
|
Cortas de regeneración (CR) |
2007 |
1,350 |
Dominancia de P. maximinoi en regeneración, claros al interior del área, presencia de caminos y brechas forestales, zonas aledañas de cultivo de maíz |
|
2011 |
1,380 |
Área dominada principalmente por P. maximinoi y P. oocarpa, algunos Quercus spp. segregados. Presencia de brechas de saca y áreas para el troceado de madera |
|
|
2012 |
1,400 |
Dominancia de P. maximinoi, se pueden observar algunos árboles de Liquidambar sp. con DAP > 10, presencia de Quercus sp. con formación arbustiva. Presencia de caminos forestales y brechas de saca |
|
|
2013 |
1,340 |
Área con Pinus maximinoi y P. oocarpa, presencia de algunos Quercus spp. distribuidos por el área. Los caminos forestales en este sitio han sido abandonados |
*Basado en reconocimiento de campo y en la información contenida en el plan de manejo del ejido Monte Sinaí II (TSI, 2008).
La diversidad de los escarabajos recolectados para cada sitio se calculó a partir de la estimación del número de especies efectivas propuesto por Jost (2006): 0D, cuyo valor es equivalente a la riqueza de especies, 1D (el exponencial del índice de Shannon) y 2D (inverso del índice de Simpson). La magnitud de estas 2 últimas medidas indica los valores de las especies relativamente abundantes y muy abundantes, respectivamente. Los valores estimados de la diversidad fueron obtenidos con el paquete iNEXT (Hsieh et al., 2016) y fueron ejecutados en el programa R versión 3.3.2 (R CoreTeam, 2016).
La distribución de abundancia de las especies en cada tratamiento (CA, CR, ASI) se comparó mediante la construcción de curvas de rango-abundancia (Magurran, 2004). Se calculó la disimilitud total de la composición de especies entre los diferentes sitios (βSOR) embebidos en cada tratamiento, originada por el recambio de especies (βSIM) o por un probable anidamiento (pérdida de especies de un sitio a otro; βNES) (Baselga, 2010). El procedimiento se realizó con el paquete “betapart” (Baselga et al., 2017) integrado al programa R versión 3.3.1. (R Core Team, 2016). Además, se utilizó el coeficiente NODF (nestedness measure based on overlap and decreasing fills; Almeida-Neto et al., 2008) para calcular el grado de anidamiento de los sitios. Para comprobar la validez de los resultados se obtuvo el valor de Z (> 1.64) a partir del modelo nulo CE (Strona et al., 2014), en el que el valor de significancia de Z permite descartar el efecto de la aleatoriedad sobre el patrón observado. Este procedimiento se realizó usando el programa NeD (Strona y Fattorini, 2014).
Para identificar la posible asociación de las especies de estudio con los tratamientos forestales, se empleó el análisis CLAM (Classification Method) (Chao y Lin, 2011; Chazdon et al., 2011). El análisis CLAM permitió el cálculo de una asociación estadística de las preferencias de hábitat de las especies (especialistas y generalistas), sin excluir a las especies raras, a priori. El análisis se realizó en el programa CLAM (Chao y Lin, 2011), utilizando un valor umbral de referencia (K = 0.667) (Chazdon et al., 2011). Dado que CLAM está diseñado para el análisis por pares, se efectuaron 2 comparaciones: ASI vs. CA y ASI vs. CR.
Resultados
Se recolectaron 3,608 individuos, distribuidos en 11 géneros y 21 especies de escarabajos copronecrófagos. El género mejor representado de la muestra total fue Onthophagus (38% de la abundancia relativa total). Onthophagus cyanellus fue la especie más abundante, seguida de Eurysternus magnus y Ontherus mexicanus con 70% de la abundancia acumulada registrada. Deltochilum mexicanum, O. cyanellus y Phanaeus endymion fueron registrados en todos los sitios, en tanto que 7 especies fueron exclusivas del sitio sin intervención y una especie para el sitio de corta de aclareo 2013 (tabla 2).
La completitud del muestreo para la diversidad global fue mayor al 99% (fig. 2); las estimaciones con ACE oscilaron entre el 94 y 100% de completitud. Para la riqueza específica esperada del área sin intervención se estimaron 22 especies (94% del número de especies registrado). Para los sitios del aclareo y regeneración de la anualidad de 2013, la riqueza esperada fue de 16 (90%) y 8 (96%), respectivamente.
El área sin intervención registró la mayor diversidad 0D (riqueza de especies) con 20 especies. En contraste, los valores de diversidad más bajos se encontraron en los sitios de regeneración (entre 3 y 8 especies; tabla 2). La diversidad de orden 1 (1D) registrada en el área sin intervención y el área de aclareo de 2013 fue similar (N = 7 especies). La diversidad de orden 1 (1D) fue la más baja en la corta de regeneración de 2012 (N = 2 especies). Para los valores de la diversidad del orden 2 (2D) se registró una tendencia comparable a la del orden 1 (1D). Los valores máximos se obtuvieron en el área sin intervención (1D = 6.75 y 2D = 5.02) y en el sitio aclareo 2013 (1D = 7.01 y 2D = 5.95) (fig. 3), en tanto que los valores más bajos se registraron en el sitio de corta de regeneración de 2012 (1D = 1.76 y 2D = 1.41). Todas las comparaciones entre sitios para la diversidad efectiva 0D, 1D y 2D mostraron diferencias significativas (fig. 3, tabla 3).
Por otro lado, la composición de especies entre sitios mostró un bajo recambio (βSIM = 0.07) y un alto anidamiento de los sitios manejados con respecto al área ‘sin intervención’ (βNES = 0.60). El valor de NODF indicó un grado de anidamiento de 83.78 (Z = 8.76, p < 0.001); donde los sitios más anidados correspondieron a aquellos que tuvieron un manejo con tratamientos de cortas de regeneración (tabla 4).
Las curvas de rango-abundancia mostraron una pendiente similar entre los tratamientos. No se apreció una marcada dominancia en el área sin intervención. Sin embargo, la separación entre la especie más abundante y la segunda especie fue mayor en los tratamientos CA y CR. (fig. 4). En el área sin intervención, E. magnus fue la especie más abundante, seguida de O. cyanellus y O. mexicanus. En los tratamientos CA y CR, O. cyanellus fue la especie más abundante (fig. 4).
Las comparaciones entre tratamientos mostraron discrepancias en la clasificación de las especies. El 29% de las especies mostraron una asociación significativa con alguno de los tratamientos (tabla 5). Para la comparación área ASI vs. CA, 3 especies pueden estar asociadas de forma específica al área sin intervención: Ateuchus rodriguezi, Eurysternus foedus y E. magnus; 1 especie al CA (P. endymion), 5 pueden ser consideradas como generalistas y otras 13 sin mayor asociación debido a su incipiente abundancia. Para la comparación área sin intervención vs. CR, 3 especies se asociaron de forma particular al área sin intervención (E. foedus, E. magnus y Onthophagus championi); 2 al tratamiento de CR (O. cyanellus, P. endymion); 3 especies podrían considerarse como generalistas, en tanto que otras 14 no mostraron mayor asociación debido a su incipiente abundancia (fig. 5).
Tabla 2
Número de especies y estimaciones de la diversidad efectiva (0D, riqueza de especies; 1D valor del exponencial del índice de Shannon; 2D valor del inverso del índice de Simpson), de escarabajos copronecrófagos (Coleoptera: Scarabaeinae) registrados para los tratamientos (cortas de aclareo (CA), cortas de regeneración (CR) y área sin intervención (ASI)) y sitios de estudio en Monte Sinaí II, Cintalapa, Chiapas.
|
Especies |
ASI |
CA |
CR |
Total |
||||||
|
2007 |
2011 |
2012 |
2013 |
2007 |
2011 |
2012 |
2013 |
|||
|
Ateuchus rodriguezi de Borre, 1886 |
12 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
12 |
|
Ateuchus sp. |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
1 |
|
Canthidium ardens Bates, 1887 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
|
Canthon femoralis Chevrolat, 1834 |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
3 |
|
Canthon humectus Say, 1832 |
4 |
0 |
0 |
0 |
5 |
0 |
0 |
0 |
7 |
16 |
|
Canthon indigaceus LeConte, 1866 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
|
Copris sp. |
5 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
6 |
|
Deltochilum mexicanum Burmeister, 1848 |
103 |
45 |
62 |
7 |
61 |
11 |
4 |
5 |
14 |
312 |
|
Deltochilum scabriusculum Bates,1887 |
87 |
18 |
13 |
4 |
92 |
2 |
0 |
0 |
8 |
224 |
|
Dichotomius colonicus Say 1835 |
6 |
0 |
0 |
0 |
7 |
0 |
0 |
0 |
0 |
13 |
|
Dichotomius amplicollis Harold, 1869 |
3 |
0 |
0 |
0 |
4 |
0 |
0 |
0 |
0 |
7 |
|
Dichotomius satanas Harold, 1867 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
|
Eurysternus foedus Gue´rin1844 |
83 |
17 |
2 |
0 |
4 |
0 |
0 |
0 |
0 |
106 |
|
Eurysternus magnus Laporte, 1840 |
491 |
37 |
46 |
0 |
83 |
0 |
0 |
0 |
5 |
662 |
|
Ontherus mexicanus Harold, 1868 |
275 |
36 |
38 |
9 |
164 |
8 |
11 |
0 |
13 |
554 |
|
Onthophagus championi Bates, 1887 |
44 |
0 |
5 |
0 |
13 |
0 |
0 |
0 |
0 |
62 |
|
Onthophagus cyanellus Bates, 1887 |
302 |
183 |
257 |
84 |
159 |
82 |
75 |
59 |
95 |
1,296 |
|
Onthophagus sp. |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
3 |
|
Phanaeus amethystinus Harold, 1863 |
3 |
0 |
0 |
0 |
4 |
0 |
0 |
0 |
1 |
8 |
|
Phanaeus endymion Harold, 1863 |
53 |
16 |
21 |
5 |
126 |
12 |
29 |
7 |
49 |
318 |
|
Uroxys sp. |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
|
Núm. de especies (0D) |
20 |
7 |
8 |
5 |
14 |
5 |
4 |
3 |
8 |
– |
|
Núm. especies exclusivas |
7 |
1 |
– |
|||||||
|
Abundancia total por sitio |
1,482 |
352 |
444 |
109 |
724 |
115 |
119 |
71 |
192 |
3,608 |
|
Abundancia total por tratamiento |
1,482 |
1,629 |
497 |
|||||||
|
1D |
6.75 |
4.54 |
3.89 |
2.33 |
7.01 |
2.61 |
2.64 |
1.76 |
4.24 |
|
|
2D |
5.02 |
3.17 |
2.66 |
1.64 |
5.95 |
1.87 |
2.15 |
1.41 |
3.09 |
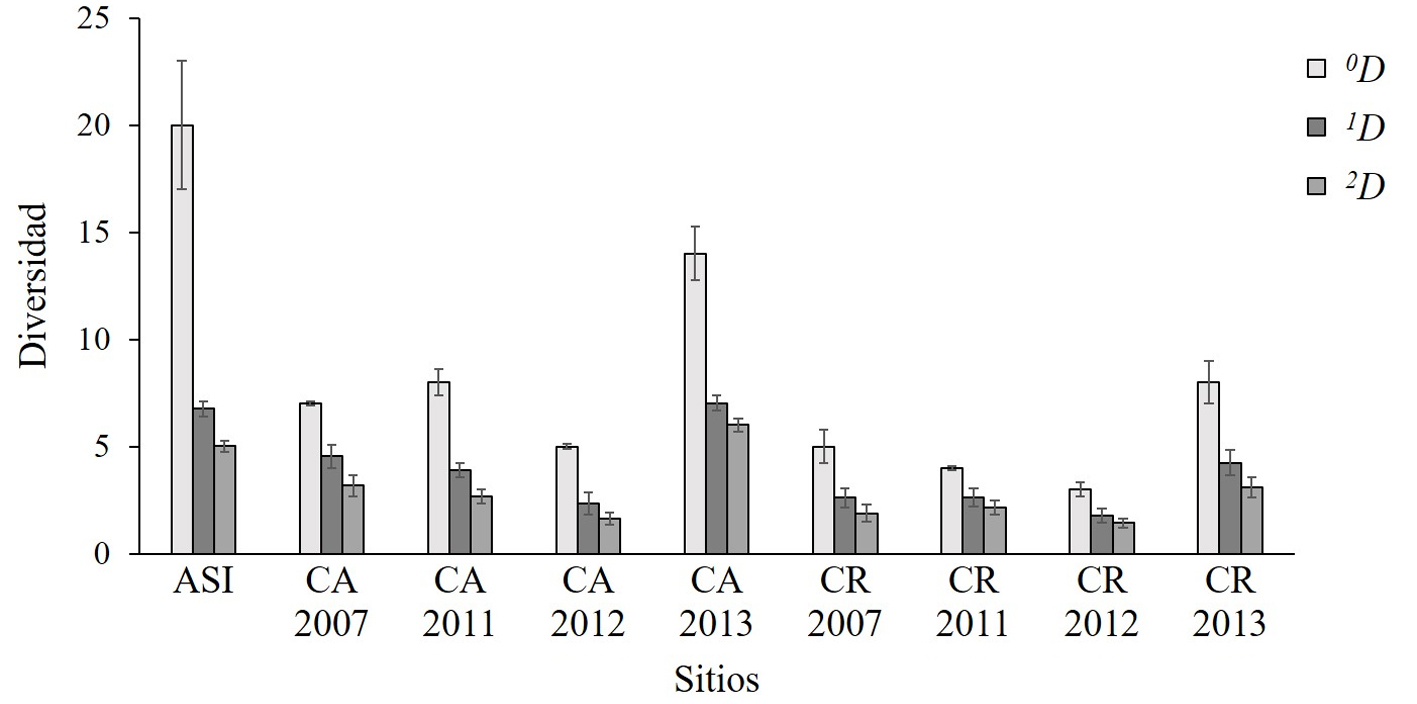
Tabla 3
Análisis comparativo de la diversidad efectiva de escarabajos copronecrófagos (0D, 1D y 2D) para los sitios del ejido Monte Sinaí II, Cintalapa, Chiapas, México. ASI = Área sin intervención, CA = cortas de aclareo, CR = cortas de regeneración.
|
Variable |
Prueba de Kruskal-Wallis (p < 0.05) |
Sitios |
Significancia (Dunn-Bonferroni) |
|
0D |
H8, N= 27 = 25.43, p = 0.001 |
ASI-CR 2011 |
p < 0.01 |
|
ASI-CR 2012 |
p = 0.04 |
||
|
CA 2013- CR 2012 |
p = 0.04 |
||
|
1D |
H8, N= 27 = 24.06, p = 0.002 |
ASI-CR 2012 |
p = 0.03 |
|
CA 2013- CR 2012 |
p = 0.02 |
||
|
2D |
H8, N= 27 = 24.04, p = 0.001 |
ASI-CR 2012 |
p = 0.03 |
|
CA 2013- CR 2012 |
p = 0.01 |
Tabla 4
Valores del anidamiento para los tratamientos CA, CR y ASI, y los sitios estudiados en el ejido Monte Sinaí II, Cintalapa, Chiapas, México. Los valores cercanos a 1 corresponden al mayor anidamiento.
|
Sitios |
Área sin intervención (ASI) |
CA |
CR |
||||||
|
2007 |
2011 |
2012 |
2013 |
2007 |
2011 |
2012 |
|||
|
Corta de aclareo |
2007 |
0.48 |
|||||||
|
2011 |
0.43 |
0.06 |
|||||||
|
2012 |
0.60 |
0.16 |
0.23 |
||||||
|
2013 |
0.16 |
0.33 |
0.27 |
0.47 |
|||||
|
Corta de regeneración |
2007 |
0.66 |
0.16 |
0.23 |
0 |
0.47 |
|||
|
2011 |
0.74 |
0.27 |
0.33 |
0.11 |
0.55 |
0.11 |
|||
|
2012 |
0.74 |
0.4 |
0.45 |
0.25 |
0.64 |
0.25 |
0.14 |
||
|
2013 |
0.42 |
0.05 |
0 |
0.23 |
0.27 |
0.23 |
0.33 |
0.45 |
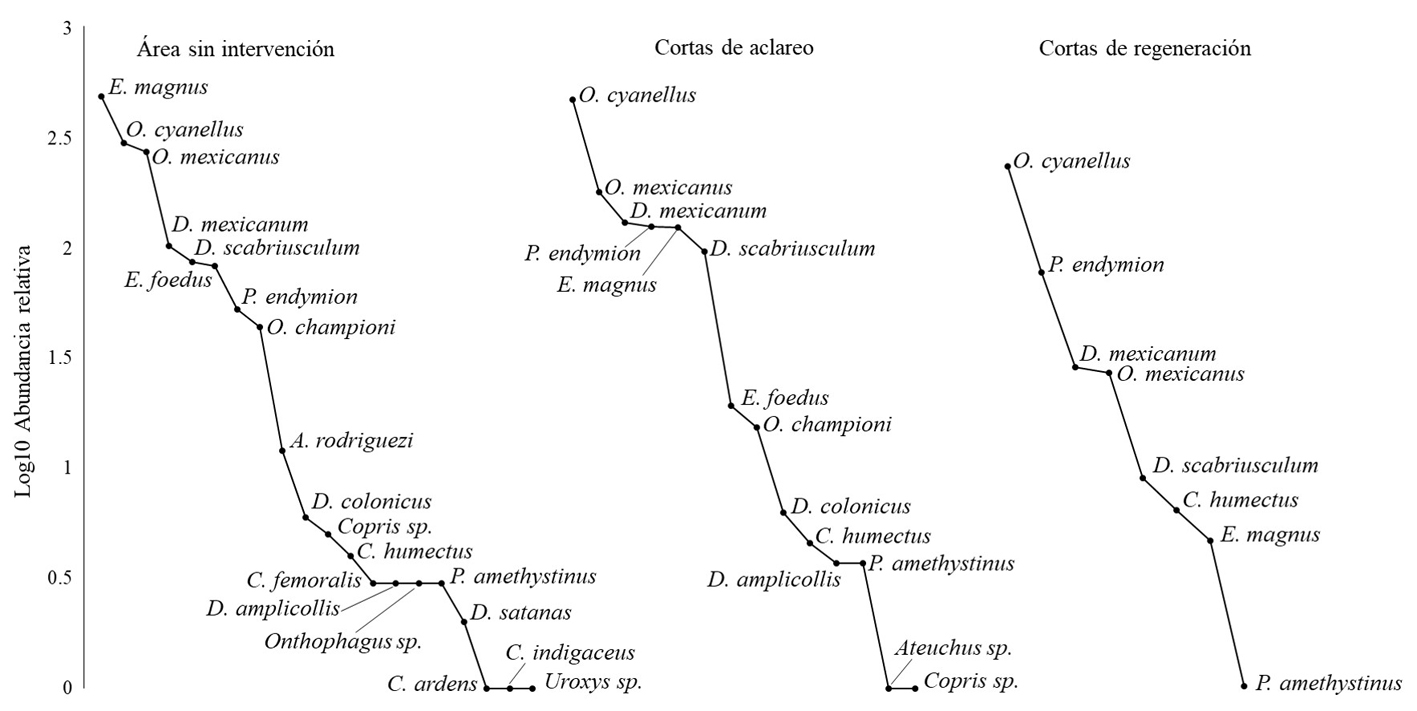
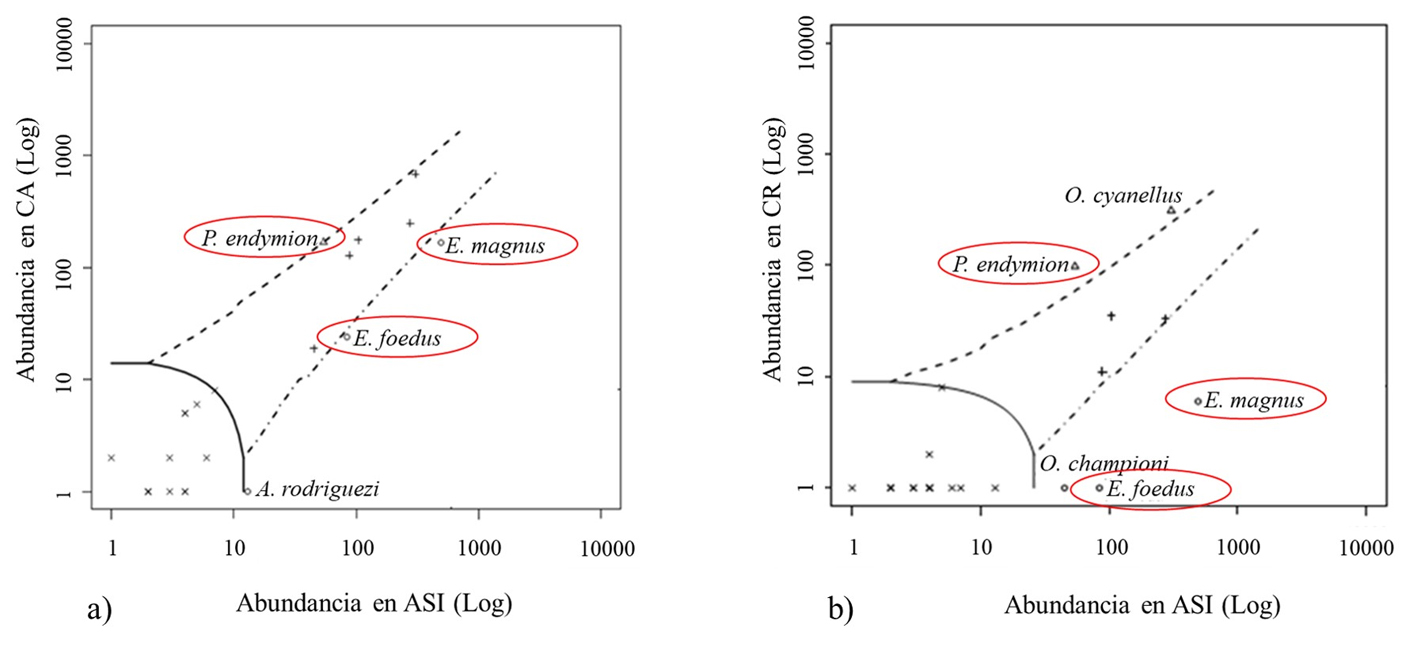
Tabla 5
Especificidad de escarabajos copronecrófagos en Monte Sinaí II, según los tratamientos de manejo forestal. Área sin intervención (ASI), cortas de aclareo (CA) y cortas de regeneración (CR). Se usaron las rutinas de CLAM (K = 0.667, p = 0.005). Rara indica: no asociada a ninguna condición (ver texto).
|
Tabla 5 Continuación. |
||
|
Especies |
ASI y CA |
ASI y CR |
|
Especies |
ASI y CA |
ASI y CR |
|
Ateuchus rodriguezi de Borre, 1886 |
Especialista ASI |
Rara |
|
Ateuchus sp. Harold, 1868 |
Rara |
Rara |
|
Canthidium ardens Bates, 1887 |
Rara |
Rara |
|
Canthon femoralis Chevrolat, 1834 |
Rara |
Rara |
|
Canthon humectus Say, 1832 |
Rara |
Rara |
|
Canthon indigaceus LeConte, 1866 |
Rara |
Rara |
|
Copris sp. Müller, 1764 |
Rara |
Rara |
|
Deltochilum mexicanum Burmeister 1848 |
Generalista |
Generalista |
|
Deltochilum scabriusculum Bates 1887 |
Generalista |
Generalista |
|
Dichotomius amplicollis Harold 1869 |
Rara |
Rara |
|
Dichotomius colonicus Say, 1835 |
Rara |
Rara |
|
Dichotomius satanas Harold, 1867 |
Rara |
Rara |
|
Eurysternus foedus Guérin-Méneville, 1830 |
Especialista ASI |
Especialista ASI |
|
Eurysternus magnus Castelnau, 1840 |
Especialista ASI |
Especialista ASI |
|
Ontherus mexicanus Harold, 1868 |
Generalista |
Generalista |
|
Onthophagus championi Bates, 1887 |
Generalista |
Especialista ASI |
|
Onthophagus cyanellus Bates, 1868 |
Generalista |
Especialista CR |
|
Onthophagus sp. Latreille, 1802 |
Rara |
Rara |
|
Phanaeus amethystinus Harold, 1863 |
Rara |
Rara |
|
Phanaeus endymion Harold, 1863 |
Especialista CA |
Especialista CR |
|
Uroxys sp. Westwood, 1842 |
Rara |
Rara |
Discusión
El número de especies registradas en Monte Sinaí II (N = 21) corresponde al 19% de la fauna de Scarabaeinae reportada para Chiapas. Una comparación acotada de nuestros resultados faunísticos sugiere que la riqueza de escarabajos registrada en Monte Sinaí II es comparable con lo reportado para otros bosques templados de México (Deloya, 1996; Trevilla-Rebollar et al., 2010), pero mayor a la riqueza registrada en áreas de bosque de pino-encino en Veracruz (8 especies) (Arellano y Halffter, 2003) y bosques de pino-encino en Montebello, Chiapas (13 especies; Delgado et al., 2012).
La proximidad de Monte Sinaí respecto de áreas protegidas (i.e., las reservas de la biosfera de El Ocote y La Sepultura) que incluyen asociaciones vegetales de bosque mesófilo y bosque tropical perennifolio, podrían explicar la presencia de una variedad de especies con afinidades biogeográficas y ecológicas distintas. Más del 60% de las especies registradas en Monte Sinaí II tienen una afiliación neotropical (ej. Canthidium ardens, Canthon femoralis, Ateuchus rodriguezi, Canthon indigaceus, Dichotomius amplicollis); 24% son especies con afinidad neotropical asociadas a zonas de bosque mesófilo de montaña, encinares y cafetales sombreados (ej. Dichotomius satanas, Deltochilum mexicanum, Eurysternus magnus); en tanto que 14% son típicas de zonas submontanas (ej. Canthon humectus, Phanaeus amethystinus, Onthophagus cyanellus) (Arellano y Halffter, 2003; Halffter et al., 1995). En adición, algunas de las especies registradas se observaron de manera ocasional (por ejemplo, Canthidium ardens y Uroxys sp.). Estas especies se pueden considerar turistas o transitorias, relativamente móviles y asociadas a una variedad de ambientes, lo que les permite deambular a través del paisaje (Quintero y Halffter, 2009).
Sin embargo, como en el caso de otros escarabajos, los márgenes de la distribución de las poblaciones de Scarabaeinae en el sur de México no coinciden estrictamente con los límites históricos o fisiográficos del hábitat, por lo que dichos factores no pueden considerarse como la única fuente de variación en la composición o diversidad de la fauna (Caballero et al., 2009). Los patrones de perturbación actuales en el sur de México pueden representar los principales factores de los cambios relativos en los niveles de diversidad entre faunas prístinas y aquellas relativamente perturbadas, por ejemplo, para escarabajos Scarabaeinae (Arellano y Halffter, 2003; Navarrete-Gutiérrez y Halffter, 2008), mariposas Papilionidae (León-Cortés et al., 2004) y arañas (Pinkus-Rendón et al., 2006).
Los cambios en el ensamble y la especificidad de hábitat de los escarabajos pueden reflejar el efecto de la simplificación del bosque, i.e., una disminución en el número de especies de los sitios manejados en relación con el área no intervenida, así como un anidamiento de las especies registradas en áreas intervenidas. En este sentido, se ha sugerido que las especies neotropicales de escarabajos copronecrófagos afiliadas a ambientes de bosque, raramente incursionan en hábitats modificados que exhiben altas temperaturas (Navarrete-Gutiérrez y Halffter, 2008) o donde las condiciones climáticas atípicas pueden ocasionar cambios en las abundancias poblacionales (e.g., Laurance et al., 2009). Tal fue el caso de E. magnus, especie que predominantemente se encuentra en bosques tropicales (Arellano y Halffter, 2003; Halffter et al., 1995; Howden y Young, 1981; Jessop, 1985; Morón et al., 1985), pero que en nuestro estudio tuvo abundancias de 76% menores en las áreas bajo manejo.
Estudios previos han documentado que el incremento de la radiación solar y un decremento en la humedad —derivada de la apertura del dosel, podrían causar una reducción en el uso de este recurso y un incremento en la mortalidad de las larvas y emergencia de los escarabajos adultos (Halffter y Edmonds, 1982). Se ha sugerido también que E. magnus y E. foedus son especies asociadas a áreas de bosque mesófilo, a selva tropical siempre verde, o a aquellas áreas abiertas con bosque aledaño (Arellano y Halffter, 2003; Pulido-Herrera, 2009; Deloya, 2011; Rangel-Acosta y Martínez-Hernández, 2017). En contraste, P. endymion es una especie dominante asociada a ambientes modificados (Arellano y Halffter, 2003; Deloya, 2011; Halffter y Arellano, 2002; Morón et al., 1985).
Nuestros resultados demuestran que el cambio en el uso del suelo en Monte Sinaí II, ha provocado modificaciones importantes en los niveles de diversidad específica y en la estructura de los ensambles de Scarabaeinae a nivel local, donde el área sin intervención tiene una riqueza y una abundancia de especies mucho mayor que la registrada en las áreas intervenidas. Sin embargo, a la escala de paisaje, Sinaí mantiene una estructura heterogénea y en mosaico, con un nivel de diversidad comparable (o incluso mayor) al de otros paisajes en México. Es necesario recabar más información para evaluar el rol de las crecientes áreas modificadas como hábitat de calidad para la persistencia de las poblaciones de copronecrófagos en el largo plazo.
Las prácticas de manejo forestal comunitario en Monte Sinaí II han generado extensiones heterogéneas cuyos patrones espaciales están dominados por rodales forestales con diferentes historias de perturbación (Ascanio-Lárraga et al., 2018). Tales áreas pueden aún retener elementos forestales originales, pero también una fracción importante de asociaciones vegetales de sucesión secundaria que, en conjunto, pueden representar un potencial valioso de biodiversidad y regeneración (Makana y Thomas, 2006).
En Monte Sinaí II, la frecuencia e intensidad de la extracción selectiva parecen ser los factores de mayor impacto sobre la estructura y diversidad del bosque (Ascanio-Lárraga et al., 2018). A pesar de que los tratamientos silvícolas en Monte Sinaí han estado orientados al incremento en la apertura del dosel para promover la regeneración de las especies de Pinus (Ascanio-Lárraga et al., 2018; Hernández-López, 2007; Jardel, 1998), la estructura forestal modificada puede acarrear efectos prominentes sobre los componentes de la diversidad asociados y sobre su persistencia (Darrigo et al., 2016; Nichols et al., 2007; Putz et al., 2008).
En nuestro caso de estudio, la pérdida gradual de especies de escarabajos en las áreas bajo aprovechamiento indica que aquellas especies que poseen requerimientos particulares de hábitat pueden enfrentar consecuencias poblacionales de largo plazo (e.g., disminuciones o extinciones locales). Asimismo, la variación en la estructura de los ensambles también puede ser reflejo del estatus (alterado) de otros grupos taxonómicos. Es decir, la disminución o ausencia de ciertos vertebrados en aquellas áreas bajo manejo, podría desencadenar efectos en cascada en el ecosistema, particularmente ante la posible alteración de las interacciones entre vertebrados y escarabajos, estos últimos al fungir como recicladores de nutrientes y dispersores secundarios de semillas (Larsen et al., 2008; Scheffler, 2005; Slade et al., 2007). El reemplazo de la estructura original del bosque por áreas empobrecidas representa una amenaza para la persistencia de los elementos de la biodiversidad.
En suma, el impacto negativo del manejo forestal sobre el ensamble de los escarabajos del estiércol indica la necesidad de revalorar las prácticas de manejo forestal que aluden a facilitar un proceso de regeneración luego de una extracción selectiva. Varias son las acciones en Monte Sinaí II que han permitido amortiguar el efecto de la extracción selectiva de madera y de la creciente heterogeneidad en aquellos espacios de regeneración. Por ejemplo, la designación de áreas de conservación, la implementación de alternativas de producción, tales como la producción de carbón, áreas de semilleros para el resguardo y reproducción de especies nativas, la reproducción de orquídeas, y la designación de sitios para la cría de venados. Tales acciones han iniciado en los últimos años y su impacto se ha reflejado en el fortalecimiento de los procesos de autogestión, organización social, y cohesión familiar, más que en representar insumos rentables a la economía de la comunidad.
Estamos convencidos de que la comunidad Tzotzil que administra los recursos del paisaje forestal de Monte Sinaí II, representa un ejemplo genuino de procesos de toma de decisiones colectivas, gobernanza y desarrollo comunitario en el sur de México, que en suma persigue generar beneficios económicos y sociales al fortalecer las capacidades locales, el empleo, la infraestructura social y la educación (Bray et al., 2003).
Desde el punto de vista del análisis y conservación de la biodiversidad, nuestro estudio pone de relieve que los escarabajos del estiércol son componentes de la biota que indican claramente los impactos negativos de las prácticas de manejo forestal. Las alteraciones significativas registradas en los niveles de diversidad y en la estructura de los ensambles de los escarabajos, alertan sobre la urgente necesidad de establecer esquemas de monitoreo y valoración de la biodiversidad en áreas sujetas a prácticas forestales.
Agradecimientos
A los ejidatarios de Monte Sinaí II por las facilidades otorgadas para el desarrollo de esta investigación. A José Daniel Rivera Duarte y Leonardo Delgado por corroborar identificaciones taxonómicas. Manuel Girón-Intzín y Javier Ascanio-Lárraga, brindaron facilidades y apoyo en la Colección Entomológica de ECOSUR-SC y en trabajo de campo y análisis espacial, respectivamente. La primera autora agradece al Consejo Nacional de Ciencia y Tecnología por la beca de estudios de posgrado, así como el apoyo del Conacyt a través del proyecto (258792, CB-2015-01,) otorgado a JLL-C. Agradecemos a los revisores las sugerencias al manuscrito.
Referencias
Almeida-Neto, M., Guimarães, P., Guimarães, P. R., Loyola, F. D. y Ulrich, W. (2008). A consistent metric for nestedness analysis in ecological systems: reconciling concept and measurement. Oikos, 117, 1227–1239.
Arellano, L. y Halffter, G. (2003). Gamma diversity: derived from and a determinant of alpha diversity and beta diversity. An analysis of three tropical landscapes. Acta Zoológica Mexicana, 90, 27–76.
Arellano, L., León-Cortés, J. L. y Halffter, G. (2008). Response of dung beetle assemblages and their conservation in remnant natural and modified habitats in southern Mexico. Insect Conservation and Diversity, 1, 253–262.
Armenteras, D. y Rodríguez-Eraso, N. (2014). Forest deforestation dynamics and drivers in Latin America: a review since 1990. Colombia Forestal, 17, 233–246.
Ascanio-Lárraga, J., León-Cortés, J. L., Castillo-Santiago, M. A. y Ramírez-Segura, E. (2018). Logging pattern and landscape change in southern Mexico: identifying potential weaknesses and strengthening conservation in community-based management programs through landscape analysis. Journal of Forestry, 116, 539–546.
Balam-Ballote, Y. R. y León-Cortes, J. L. (2010). Forest management and biodiversity: a study of an indicator insect group in southern Mexico. Interciencia, 37, 526–533.
Baselga, A. (2010). Partitioning the turnover and nestedness components of beta diversity. Global Ecology and Biogeography, 19, 134–143.
Baselga, A., Orme, D., Villeger, S., De Bortoli, J. y Leprieur, F. (2017). Betapart: Partitioning beta diversity into turnover and nestedness components. Recuperado el 01 de octubre, 2017 de https://cran.r-project.org/web/packages/betapart/betapart.pdf
Bray, D. B., Merino-Pérez, L., Negreros-Castillo, P., Segura-Warnholtz, G., Torres-Rojo, J. M. y Vester, H. F. M. (2003). Mexico’s community-managed forests as a global model for sustainable landscapes. Conservation Biology, 17, 672–677.
Caballero, U., León-Cortés, J. L. y Morón-Ríos, A. (2009) Response of rove beetles (Staphylinidae) to various habitat types and change in Southern Mexico. Journal of Insect Conservation, 13, 67–75.
Cayuela, L. (2006). Deforestación y fragmentación de bosques tropicales montanos en los Altos de Chiapas, México. Efectos sobre la diversidad de árboles. Ecosistemas, 3, 191–196.
Chao, A., Gotelli, N. J., Hsieh, T. C., Sander, E. L., Ma, K. H., Colwell, R. K. et al. (2014). Rarefaction and extrapolation with Hill numbers: a framework for sampling and estimation in species diversity studies. Ecological Monographs, 84, 45–67.
Chao, A. y Jost, L. (2012). Coverage-based rarefaction and extrapolation: standardizing samples by completeness rather than size. Ecology, 93, 2533–2547.
Chao, A. y Lin, S. Y. (2011). User’s Guide for Program CLAM (Classification Method). Recuperado el 13 de marzo, 2017 de: http://chao.stat.nthu.edu.tw/wordpress/software_download/clam/
Chazdon, R. L., Chao, A., Colwell, R. K., Lin, S. Y., Norden, N., Letcher, S. G. et al. (2011). A novel statistical method for classifying habitat generalists and specialists. Ecology, 92, 1332–1343.
Colwell, R. K. (2013). EstimateS: Statistical estimation of species richness and shared species from samples. Versión 9.1. Recuperado el 18 de agosto, 2016 de: http://purl.oclc.org/estimates
Da-Silva, P. G. y Hernández, M. I. M. (2015). Spatial patterns of movement of dung beetle species in a tropical forest suggest a new trap spacing for dung beetle biodiversity studies. Plos One, 10, e0126112.
Darrigo, M. R., Venticinque, E. M. y Dos-Santos, A. M. (2016). Effects of reduced impact logging on the forest regeneration in the central Amazonia. Forest Ecology and Management, 360, 52–59.
Delgado, J. M., Castro-Ramírez, A. E., Morón, M. A. y Ruiz-Montoya, L. (2012). Diversidad de Scarabaeoidea (Coleoptera) en las principales condiciones de hábitat de Montebello, Chiapas, México. Acta Zoológica Mexicana, 28, 185–210.
Deloya, C. (1996). Los macro-coleópteros necrófilos de Tepoztlán, Morelos, México (Scarabaeidae, Trogidae, Silphidae). Folia Entomológica Mexicana, 97, 39–54.
Deloya, C. (2011). Escarabajos coprófagos y necrófagos (Insecta: Coleoptera: Scarabaeidae). En Conabio (Eds.), La biodiversidad de Veracruz: estudio de estado (pp. 540–545). México D.F.: Conabio/ Gobierno del Estado de Veracruz/ Universidad Veracruzana/ Instituto de Ecología, A.C.
Edmonds, W. D. y Zidek, J. (2012). Taxonomy of Phanaeus revisited: revised keys to and comments on species of the New World dung beetle genus Phanaeus MacLeay, 1819 (Coleoptera: Scarabaeidae: Scarabaeinae: Phanaeini). Insecta Mundi, 784, 3–104.
Escobar, F. (2000). Diversidad de coleópteros coprófagos (Scarabaeidae: Scarabaeinae) en un mosaico de hábitats en la reserva natural Nukak, Guaviare, Colombia. Acta Zoológica Mexicana, 79, 103–121.
Farías, P. M., Arellano, L., Hernández, M. I. M. y López-Ortiz, S. (2015). Response of the copronecrophagous beetle (Coleoptera: Scarabaeinae) assemblage to a range of soil characteristics and livestock management in a Mexican tropical landscape. Journal of Insect Conservation, 19, 947–960.
Favila, M. E. y Halffter, G. (1997). The use of indicator groups for measuring biodiversity as related to community structure and function. Acta Zoológica Mexicana, 72, 1–25.
Génier, F. (2009). Le genre Eurysternus Dalman, 1824. Révision taxonomique et clés de détermination illustrées. Pensoft Series Faunistica, 85, 1–430.
Halffter, G., Favila, M. E. y Arellano, L. (1995). Spatial distribution of three groups of Coleoptera along an altitudinal transect in the Mexican Transition Zone and its biogeographical implications. Elytron, 9,151–185.
Halffter, G. y Arellano, L. (2002). Response of dung beetle diversity to human-induced changes in a tropical landscape. Biotropica, 34, 144–154.
Halffter, G. y Edmonds, W. D. (1982). The nesting behavior of dung beetles (Scarabaeinae) an ecological and evolutive approach. México D.F.: Instituto de Ecología.
Hernández-López, I. (2007). Cambios en la estructura y composición del bosque bajo dos tratamientos silviculturales en la comunidad de Capulalpan de Méndez, Ixtlán, Oaxaca, México (Tesis de maestría). Centro Agronómico Tropical de Investigación y Enseñanza. Turrialba, Costa Rica.
Howden, H. F. y Young, O. P. (1981). Panamanian Scarabaeinae: taxonomy, distribution and habits (Coleoptera, Scarabaeidae). Contributions of the American Entomological Institution, 18, 1–204.
Hsieh, T. C., Ma, K. H. y Chao, A. (2016). iNEXT: an R package for interpolation and extrapolation of species diversity (Hill numbers). Methods in Ecology and Evolution, 7, 1451–1546.
Jardel, E. J. (1998). Efectos ecológicos y sociales de la explotación maderera de los bosques de la sierra de Manantlán. En R. Ávila, J. P. Emphoux, L. G. Gastélum, S. Ramírez, O. Schöndube, y F. Valdez. (Eds.), El occidente de México: arqueología, historia y medio ambiente. Perspectivas regionales (pp. 231–251). Guadalajara, Jalisco: Universidad de Guadalajara e Instituto Francés de Investigación Científica para el Desarrollo en Cooperación.
Jardel, E. J. (2012). El manejo forestal en México: estado actual y perspectivas. En F. Chapela (Eds.), Estado de los bosques de México (pp. 69–115). México D.F.: Consejo Civil Mexicano para la Silvicultura Sostenible, A.C.
Jessop, L. (1985). An identification guide to Eurysternine dung beetles (Coleoptera, Scarabaeidae). Journal of Natural History, 19, 1087–1111.
Jost, L. (2006). Entropy and diversity. Oikos, 113, 363–375.
Kohlmann, B. y Solís, A. (2001). El género Onthophagus en Costa Rica. Giornale Italiano di Entomologia, 49, 159–261.
Kohlmann, B. y Solís, A. (2006). El género Canthidium en Norteamérica. Giornale Italiano di Entomologia, 11, 235–295.
Larsen, T., Lopera, A. y Forsyth, A. (2008). Understanding trait-dependent communitydisassembly: dung beetles, density functions,and forest fragmentation. Conservation Biology, 22, 1288–1298.
Laurance, W. F., Goosem, M. y Laurance, S. (2009). Impacts of roads and linear clearings on tropical forests. Trends in Ecology and Evolution, 24, 659–669.
León-Cortés, J. L., Pérez-Espinoza, F., Marín, L. y Molina-Martínez, A. (2004). Complex habitat requirements and conservation needs of the only extant Baroniinae swallowtail butterfly. Animal Conservation, 7, 241–250.
Magurran, A. E. (2004). Measuring biological diversity. Londres: Blackwell Science.
Makana, J. R. y Thomas, S. C. (2006). Impacts of selective logging and agricultural clearing on forest structure, floristic composition and diversity, and timber tree regeneration in the Ituri Forest, Democratic Republic of Congo. Biodiversity and Conservation, 15, 1375–1397.
Martínez, E. J. (2012). Caracterización florística de los sitios de monitoreo de aves en el ejido Monte Sinaí II, Municipio de Cintalapa, Chiapas, México. Macías C. (Coord.). San Cristóbal de las Casas, Chiapas: Pronatura Sur A.C.
McGeoch, M. A. (1998). The selection, testing and application of terrestrial insects as bioindicators. Biological Review, 73, 181–201.
Morón, M. A., Villalobos, F. J. y Deloya, C. (1985). Fauna de coleópteros lamelicornios de Boca del Chajul, Chiapas, México. Folia Entomológica Mexicana, 66, 57–118.
Navarrete-Gutiérrez, D. y Halffter, G. (2008). Dung beetle (Coleoptera: Scarabaeidae: Scarabaeinae) diversity in continuous forest, forest fragments and cattle pastures in a landscape of Chiapas, Mexico: the effects of anthropogenic changes. Biodiversity Conservation, 17, 2869–2898.
Nichols, E., Larsen, T., Spector, S., Davis, A., Escobar, F., Favila, M. E. et al. (2007). Global dung beetle response to tropical forest modification and fragmentation: a quantitative review and meta-analysis. Biological Conservation, 137, 1–19.
Ochoa, J. (1998). Análisis preliminar de los efectos del aprovechamiento de maderas sobre la composición y estructura de bosques en la Guayana Venezolana. Interciencia, 23, 197–207.
Ordóñez-Díaz, J. A. B. (2008). Cómo entender el manejo forestal, la captura de carbono y el pago de servicios ambientales. Ciencias, 90, 37–42.
Pérez, C. R., Zenteno-Mancilla, C. A. y González-Domínguez, P. (2010). Línea de base para las áreas prioritarias de conservación en el ejido Monte Sinaí II, municipio de Cintalapa, Chiapas. San Cristóbal de las Casas: Pronatura Sur, A.C.
Pinkus-Rendón, M. A., León-Cortés, J. L. e Ibarra-Núñez, G. (2006) Spider diversity in a tropical habitat gradient in Chiapas, México. Diversity and Distributions, 12, 61–69.
Pulido-Herrera, L. A. (2009). Diversidad y distribución potencial de escarabajos coprófagos (Coleoptera: Scarabaeidae: Scarabaeinae) bajo escenarios de cambio climático en un paisaje fragmentado al Sur de Costa Rica (Tesis de maestría). Centro Agronómico Tropical de Investigación y Enseñanza. Turrialba, Costa Rica.
Putz, F. E., Sist, P., Fredericksen, T. y Dykstra, D. (2008). Reduced-impact logging: challenges and opportunities. Forest Ecology and Management, 256, 1427–1433.
Quintero, G. y Halffter, G. (2009). Temporal changes in a community of dung beetles (Insecta: Coleoptera: Scarabaeinae) resulting from the modification and fragmentation of tropical rain forest. Acta Zoológica Mexicana, 25, 625–649.
R CoreTeam. (2016). R: a language and environment for statistical. Recuperado el 29 de marzo, 2017 de: https://cran.r-project.org/bin/windows/base/old/3.3.2/
Rangel-Acosta, J. L. y Martínez-Hernández, N. J. (2017). Comparación de los ensamblajes de escarabajos copronecrófagos (Scarabaeidae: Scarabaeinae) entre fragmentos de bosque seco tropical y la matriz adyacente en el departamento del Atlántico-Colombia. Revista Mexicana de Biodiversidad, 88, 389–401.
Scheffler, P. Y. (2005). Dung beetle (Coleoptera: Scarabaeidae) diversity and community structure across three disturbance regimes in eastern Amazonia. Journal of Tropical Ecology, 21, 9–19.
SARH (Secretaría de Agricultura y Recursos Hidraúlicos). (1985). Normas mínimas de calidad para la formulación de estudios dasonómicos en bosques. México D.F.: SARH.
Slade, E. M., Mann, D. J. y Lewis, O. T. (2011). Biodiversity and ecosystem function of tropical forest dung beetles under contrasting logging regimes. Biological Conservation, 144, 166–174.
Slade, E. M., Mann, D. J., Villanueva, J. F. y Lewis, O. T. (2007). Experimental evidence for the effects of dung beetle functional group richness and composition on ecosystem function in a tropical forest. Journal of Animal Ecology, 76, 1094–1104.
Solís, A. y Kohlmann, B. (2002). El género Canthon en Costa Rica. Giornale Italiano di Entomologia, 10, 1–68.
Solís, A. y Kohlmann, B. (2004). El género Canthidium en Costa Rica. Giornale Italiano di Entomologia, 52, 1–73.
Spector, S. (2006). Scarabaeinae dung beetles (Coleoptera: Scarabaeidae: Scarabaeinae): an invertebrate focal taxon for biodiversity research and conservation. The Coleopterists Bulletin, 60, 71–83.
Strona, G. y Fattorini, S. (2014). NeD. Nestedness for Dummies. Recuperado el 1 de octubre, 2017 de: http://ecosoft.alwaysdata.net/
Strona, G., Nappo, D., Boccacci, F., Fattorini, S. y San Miguel-Ayanz, J. (2014). A fast and unbiased procedure to randomize ecological binary matrices with fixed row and column totals. Nature Communications, 5, 1–7.
Summerville, K. S. (2011). Managing the forest for more than the trees: effects of experimental timber harvest on forest Lepidoptera. Ecological Applications, 21, 806–816.
TSI (Técnica Silvícola Integral S.C.). (2008). Plan de manejo forestal 2008-2016. Ejido Monte Sinaí II. Cintalapa, Chiapas: Técnica Silvícola Integral, S.C.
Trevilla-Rebollar, A., Deloya, C. y Padilla, J. (2010). Coleópteros necrófilos (Scarabaeidae, Silphidae y Trogidae) de Malinalco, Estado de México, México. Neotropical Entomology, 39, 486–495.
Vaz de Mello, F., Edmonds, W. D., Ocampo, F. C. y Schoolmeesters, P. (2011). A multilingual key to the genera and subgenera of the subfamily Scarabaeinae of the New World (Coleoptera: Scarabaeidae). Zootaxa, 2854, 1–73.
Velasco, L. R. (2012). El impacto del manejo forestal comunitario en la conservación de los bosques. Estudio de caso: ejido Monte Sinaí II, Cintalapa, Chiapas (Tesis de maestría). Universidad Autónoma de Chapingo. Estado de México, México.
Yanes-Gómez, G. y Morón, M. A. (2010). Fauna de Coleópteros Scarabaeoidea de Santo Domingo Huehuetlán, Puebla, México. Su potencial como indicadores ecológicos. Acta Zoológica Mexicana, 26, 123–145.