María Felix Ramos-Ordoñez, Laura Rocío Santamaría-Estrada, Tania Gretchen Gonzalez-Lopez, Katia Isidra-Flores y Ana María Contreras-González *
Universidad Nacional Autónoma de México, Facultad de Estudios Superiores Iztacala, Unidad de Biotecnología y Prototipos, Laboratorio de Ecología, Los Reyes Iztacala, Avenida de los Barrios, Núm. 1, 54090 Tlalnepantla, Estado de México, México
*Autor para correspondencia: amcontrerasg@comunidad.unam.mx (A.M. Contreras-González)
Recibido: 22 enero 2021; aceptado: 21 junio 2021
Resumen
El cuachalalate (Amphipterygium adstringens) es una especie endémica del bosque tropical caducifolio mexicano, su corteza tiene gran importancia en la medicina tradicional, sin embargo, las características de sus poblaciones han sido poco estudiadas. Evaluamos la densidad de individuos, el patrón de distribución espacial, la estructura de edades, su asociación con nodrizas y extracción de corteza de A. adstringens en 10 localidades de México, mediante 4 unidades de muestreo de 30 × 40 m en cada sitio. Se encontraron variaciones en el tamaño poblacional con densidades promedio de 70 a 279 individuos/ha, la distribución espacial de los individuos fue al azar en 3 localidades y agregado en 7. No se registraron plántulas, 63% de los individuos son adultos y el resto son pre-reproductivos, lo que indica poca o nula regeneración, característica de poblaciones en declive, lo que pone en riesgo a la especie. Los individuos pre-reproductivos se establecen a cielo abierto y bajo otras plantas perennes, principalmente arbóreas incluyendo conespecíficos, posiblemente debido al patrón de dispersión de diásporas y factores tanto bióticos como abióticos. Se presentaron porcentajes bajos de extracción en los árboles de mayor talla, sugiriendo que no hay sobreexplotación de la corteza y que el uso responde al conocimiento de los pobladores.
Palabras clave: Densidad; Distribución espacial; Establecimiento; Especie en riesgo; Estructura de edades
© 2022 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Population parameters of a medicinal species at risk, the case of Amphipterygium adstringens
Abstract
Cuachalalate (Amphipterygium adstringens) is an endemic species of the Mexican tropical deciduous forest; its bark is important in traditional medicine. However, the characteristics of its population have been poorly studied. We evaluated density of the individuals, spatial distribution pattern, age structure, association with nurses, and extraction of A. adstringens bark, in 10 locations in Mexico, using four 30 × 40 m sampling units at each site. We found variations in the populations size with average densities of 70 to 279 individuals/ha, the spatial distribution of individuals was random in 3 locations and aggregated in 7. Seedlings were not recorded, 63% of the individuals are adults, and the rest are pre-reproductive, indicating few or no regeneration, characteristic of declining populations, which causes the species to present some risk. Pre-reproductive individuals establish in open areas or under other perennials, mainly arboreal, including conspecific ones, possibly due to the diaspore dispersal pattern and to both biotic and abiotic factors. There were low percentages of extraction in the larger trees, which suggests no overexploitation of the bark and that the use responds to the knowledge of the inhabitants.
Keywords: Density; Spatial distribution; Establishment; Endangered species; Age structure
© 2022 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
Amphipterygium adstringens (Schltdl.) Schiede ex Standl. o cuachalalate, es una de las especies de mayor importancia en la herbolaria mexicana, actualmente su corteza es utilizada para aliviar más de 30 enfermedades, entre ellas la malaria, cáncer de estómago, ulcera gástrica y enfermedades renales (Casas, Blancas et al., 2016; Cuevas, 2005; Osorio-García et al., 2018; Solares et al., 2012). Amphipterygium adstringens ha sido catalogada como una especie altamente vulnerable de acuerdo con la amplitud de su área de distribución, el tipo de vegetación en que se desarrolla, las características de su ciclo de vida y la gran cantidad de usos que se le da (Beltrán-Rodríguez et al., 2017; Casas, Lira et al., 2016).
Solares et al. (2012) indicaban que en la región centro sur de México se recolecta un aproximado de 57.5 toneladas anuales de corteza de A. adstringens. El descortezamiento tradicional puede ser letal, se ha descrito que 60% de los árboles llega a morir, ya que se afecta el cambium vascular y el floema del individuo ocasionando su muerte (Solares y Gálvez, 2002; Solares et al., 2006). En un estudio con descortezamiento experimental en A. adstringens, se encontró una mortalidad de 13.9% en 2 años, la cual está asociada a la época en que se realiza el descortezamiento y la cantidad de corteza extraída (Beltrán-Rodríguez et al., 2021). Por otro lado, el cuachalalate presenta un alto porcentaje de frutos sin semilla, y el número de semillas por fruto es muy variable (Guzmán-Pozos y Cruz-Cruz, 2014), sugiriendo que la reproducción sexual es una limitante en el mantenimiento de las poblaciones.
En el municipio de Chietla, Puebla, la baja abundancia relativa de individuos adultos (19 a 56 individuos/ha), indica que las poblaciones desaparecerán en el corto plazo si no se realizan acciones de conservación (Martínez, 2011). Además de la demanda regional y nacional, la explotación del cuachalalate ha aumentado en los últimos años debido a la demanda de empresas transnacionales, a partir de que se descubrió un compuesto con alto potencial en el tratamiento de adenocarcinoma (Solares et al., 2012). Tal explotación, sumada al cambio de uso de suelo y el cambio climático, ha provocado la desaparición de poblaciones en diversos sitios y/o la disminución del número de individuos y de su diversidad genética, además, se ha proyectado un decremento de 10% para las siguientes 3 generaciones (Guzmán-Pozos y Cruz-Cruz, 2014; Martínez et al., 2020; Solares et al., 2006).
A pesar de su importancia, A. adstringens no se encuentra protegida por las leyes nacionales (DOF, 2019), solo se ha catalogado como especie vulnerable internacionalmente por la IUCN (Martínez et al., 2020), aunque no se conoce el estatus de sus poblaciones. Particularmente en aquellas especies silvestres que se encuentran bajo explotación, el conocimiento sobre su dinámica poblacional y ecología es imperativo (Beltrán-Rodríguez et al., 2017). El análisis de los parámetros poblacionales ayuda a establecer estrategias de conservación, uso y manejo para especies en riesgo (Krebs y Elwood, 2008; Mollers, 2008). Una población se caracteriza por la distribución de sus individuos y la abundancia de estos. El tamaño poblacional, el patrón de distribución espacial, la estructura de tamaños/edades, la proporción de sexos, las tasas de natalidad y mortalidad, y la tasa finita de crecimiento, son indicadores del estado de la población (Caswell, 1986; Mollers, 2008).
El patrón de distribución espacial es particularmente importante cuando se pretende dar un manejo a la población o recuperar las poblaciones naturales. Cada especie presenta un patrón particular en el espacio, que está determinado por factores bióticos y abióticos, tales como la dispersión de semillas, distribución de las plantas parentales, polinización, depredación, presencia y ubicación de especies facilitadoras, condiciones climáticas y microclimáticas (Sousa y Cunha, 2018). Un patrón al azar ocurre en ambientes en donde las condiciones son homogéneas y hay la misma probabilidad de encontrar a los organismos en cualquier lugar, un patrón uniforme es indicativo de que los organismos se separan de manera consistente a distancias mayores de lo esperado en una distribución azarosa, es decir, la distancia entre vecinos se maximiza, mientras que un patrón agregado muestra que los organismos se encuentran en un ambiente heterogéneo y se establecen principalmente bajo ciertas condiciones (Fortin y Dale, 2005).
La estructura de edades permite conocer el estado de una población, puede indicar periodos reproductivos exitosos, periodos de baja o alta supervivencia, y puede predecir si una vez que los individuos adultos mueran, habrá o no un reemplazamiento. En una población estable la cantidad de organismos pre-reproductivos será muy similar a la de aquellos reproductivos, asegurando el reemplazamiento de individuos en el tiempo; mientras que en una población en crecimiento los organismos pre-reproductivos serán más abundantes que los reproductivos, incrementando el número poblacional al paso del tiempo; finalmente, una población se considera decreciente cuando no hay producción de nuevos individuos o ésta es muy baja, de manera que a largo plazo, se pone en peligro la existencia de la población (Begon et al., 2006; Elzinga et al., 2009; Mollers, 2008).
El monitoreo de la edad (en años) para especies caducifolias arbóreas es complicado por el crecimiento lento y reducido que ocurre particularmente durante la época de lluvias (Brienen et al., 2016; Verdú y García-Fayos, 2002). Sin embargo, diversos estudios han demostrado que el diámetro a la altura del pecho (DAP) de varias especies se correlaciona positiva y significativamente con la cantidad de anillos de crecimiento, permitiendo establecer estrategias de manejo, y teniendo al DAP como una medida indirecta de la edad (Brienen et al., 2016; Paredes-Villanueva et al., 2013; Tolera et al., 2013, Worbes et al., 2003).
Las tasas de natalidad, mortalidad y crecimiento son más difíciles de determinar, ya que requieren de estudios a mediano y largo plazo para evitar interpretaciones erróneas, por ejemplo, en una especie arbórea y caducifolia como A. adstringens, la producción de semillas, germinación, establecimiento y crecimiento estará determinado por factores bióticos y abióticos, cuya variación anual es difícil de predecir.
El objetivo de este trabajo fue determinar el estado actual de las poblaciones de A. adstringens en 10 localidades a lo largo de su distribución en México. En cada población se evaluó, la densidad de individuos, el patrón de distribución espacial, la estructura de edades (reproductiva y pre-reproductiva), densidad de individuos por edad y su distribución espacial, así como la posible asociación con especies nodriza y la evidencia de extracción de corteza. De acuerdo con los antecedentes de explotación y estatus de vulnerabilidad de A. adstringens, se hipotetiza que las poblaciones de cuachalalate tendrán una baja densidad de individuos y una estructura de edades decreciente, esto es, una mayor proporción de adultos en comparación con los estadios jóvenes y, por tanto, un bajo establecimiento de nuevos individuos, lo que podría poner en riesgo a las poblaciones.
Materiales y métodos
Amphipterygium adstringens (Anacardiaceae) es un árbol endémico de México, su distribución se restringe al bosque tropical caducifolio (BTC) de Sinaloa, Nayarit, Jalisco, Colima, Michoacán, Morelos, Estado de México, Puebla, Guerrero, Oaxaca y Chiapas (Cuevas, 2005; Guzmán-Pozos y Cruz-Cruz, 2014), a una altitud entre 5 y 1,500 m (Cuevas, 2005). En Morelos, la especie es considerada un elemento abundante del bosque, tanto por su densidad como por su tamaño; se han reportado individuos entre 2 y 16 m de altura con un DAP de hasta 35 cm (circunferencia a la altura del pecho o CAP aproximada de 110 cm) y hasta 12.85 m2 de cobertura (Beltrán-Rodríguez et al., 2018).
Amphipterygium adstringens es dioica, la floración ocurre durante la época de lluvias (usualmente de mayo a junio) y dura menos de 2 meses, mientras que la fructificación ocurre en la época seca y tiene una duración mayor a 5 meses, el pico de dispersión de semillas se presenta al inicio de la época seca (octubre) (Luna-Nieves et al., 2017). El fruto es alado sugiriendo la dispersión por viento, presenta de 1 a 4 semillas, los frutos más grandes tienen mayor probabilidad de desarrollar semillas viables, las semillas abortadas son comunes (Guzmán-Pozos y Cruz-Cruz, 2014).
El trabajo se realizó en los estados de Guerrero, Morelos, Michoacán, Puebla y Oaxaca durante la temporada seca 2016-2017. Se estudiaron 2 localidades por estado (tabla 1). Se obtuvo el apoyo de los pobladores quienes compartieron (de manera informal) sus conocimientos sobre la especie, tanto sobre su presencia en las localidades como del aprovechamiento en cada región. En la mayoría de los sitios se realizan actividades agropecuarias y ganaderas (cultivos de diferentes especies y pastoreo de ganado bovino, vacuno y caprino). Los terrenos son de propiedad ejidal, excepto en Michoacán y Oaxaca, en donde son de propiedad comunal.
Las localidades de Morelos (Tlayca y Tlayecac) se eligieron debido a que son sitios con remanentes de BTC fuera de la Reserva de la Biósfera Sierra de Huautla, en donde la especie se encuentra ampliamente estudiada. Particularmente, en Ostula y Pómaro (Michoacán), los sitios fueron propuestos por el Regidor de Ecología del Ayuntamiento del municipio de Aquila, con la finalidad de contribuir al poco conocimiento de la zona en materia de recursos naturales y que el equipo de trabajo se encontraría protegido ante la inseguridad social de zonas aledañas. En las localidades de Puebla, Oaxaca y Guerrero el equipo de trabajo ha realizado diferentes estudios por varios años lo que facilitó la obtención de permisos y permitió la observación previa. El uso en los sitios de estudio que se da al cuachalalate en general es local, aunque en Tlayca y Tlayecac, las personas indicaron que los árboles de esta especie y de Bursera han disminuido en los últimos años, ya que la gente de otros pueblos realiza el saqueo de corteza y resina de manera constante y eso provoca la muerte de los árboles, al grado de que ellos ya no pueden aprovechar nada.
En cada localidad se establecieron 4 unidades de muestreo de 30 × 40 m, únicamente se consideró que las unidades de muestreo no fueran parte de un camino o vereda y que los pobladores reconocieran el sitio como hábitat de A. adstringens. En cada unidad de muestreo se realizó una búsqueda intensiva de las plántulas, juveniles y adultos. No se registraron plántulas durante los censos, para juveniles se midió la altura, circunferencia a la altura de la base (CAB). Para los adultos se midió circunferencia a la altura del pecho (CAP1.30m), altura y tamaño de la copa; el CAP se obtuvo de acuerdo con Eshete et al. (2011) y Tolera et al (2013).
Las edades de los individuos se asignaron apegándose en la medida de lo posible, a la clasificación de Komarov et al. (2003), de acuerdo con la edad pre-reproductiva (plántulas y juveniles) y reproductiva (adultos, con evidencia de estructuras reproductivas). Particularmente, en organismos reproductivos de A. adstringens no hay reportes sobre los cambios que sufre el crecimiento vegetativo o la actividad reproductiva durante la vida de los individuos. Por lo tanto, para la estructura de edades también se consideró la altura y diámetro, de manera que se obtuvieron las siguientes edades: juvenil 1 o individuos pre-reproductivos de reciente establecimiento, sin cotiledones y sin un sistema de ramas laterales desarrollado, con altura < 50 cm y CAB < 10 cm; juvenil 2, individuos pre-reproductivos con altura de 50.1-130 cm y CAB < 10cm; adulto 1, individuos con CAP = 10.1-50 cm; adulto 2, individuos con CAP = 50.1-100 cm y adulto 3, individuos con CAP > 100.1 cm (modificado de Ponce [2013]).
La cantidad de individuos registrados en las localidades se comparó con una prueba de χ2, la densidad absoluta de individuos se obtuvo por unidad de muestreo y se expresó como densidad promedio por hectárea para cada localidad.
Para determinar el patrón de distribución espacial se utilizó el índice estandarizado de Morisita (IEM). Este índice se ha utilizado ampliamente para diferentes organismos y no es sensible al tamaño de la unidad de muestreo, ni al cambio en la densidad de individuos (Dalmagro y Vieira, 2005; García-González et al., 2016; García-Ibáñez et al., 2007; Marín et al., 2009; Wattanachaiyingcharoen et al., 2008); el análisis se hizo con el programa Past 4.03 (Hammer et al., 2001). Los datos utilizados consisten en una serie de recuentos de puntos en cuadrantes o unidades muestreo del mismo tamaño. El índice estandarizado de Morisita (IEM) fue sugerido por Smith-Gill (1975), como una modificación al índice de Morisita Iδ (1959), y es calculado por las siguientes fórmulas:
Iδ = n [∑ x2 − ∑ x / (∑ x)2 − ∑ x]
En donde n es el número de cuadrantes y x son los conteos. La prueba de significancia que sigue al índice de Morisita Iδ dada por la razón de F consiste en:
F0 = [Iδ (∑ x −1) + n − ∑ x] / n −1
Los grados de libertad son n-1 y ∞, adicionalmente se incluye una prueba de Monte Carlo con 9999 repeticiones, cada una con una distribución al azar de puntos en los cuadrantes. Posteriormente se calculan los límites de confianza superior e inferior (a 95%) con respecto al índice de Morisita Iδ. El límite inferior también es llamado índice uniforme (Mu), mientras que el límite superior es conocido como índice agrupado (Mc).
Mu = (X20.975 – n + ∑ x) / ∑ x −1
Mc = (X20.025 – n + ∑ x) / ∑ x −1
En donde es el percentil 97.5 de la distribución chi-cuadrada con n-1 grados de libertad. El índice estandarizado de Morisita (IEM) se calcula como sigue:
Iδ ≥ Mc > 1: IEM = 0.5 + 0.5 (Iδ − Mc / n − Mc)
Mc > Iδ ≥ 1: IEM = 0.5 (Iδ − 1 / Mc − 1)
1 > Iδ > Mu: IEM = −0.5 (Iδ − 1 / Mu − 1)
1 > Mu > Iδ: IEM = −0.5 + 0.5 (Iδ – Mu / Mu)
Cuando el índice de Morisita es mayor que el límite agrupado (Iδ >Mu) el patrón de distribución espacial es agregado. En cambio, cuando el índice de Morisita es menor que el límite uniforme (Iδ < Mc), el patrón es uniforme. El índice estandarizado de Morisita (IEM) indica una distribución al azar cuando el valor obtenido se encuentra entre -0.5 y 0.5, una distribución uniforme cuando es menor que -0.5 y un patrón agregado cuando es mayor que 0.5 (Hammer et al., 2001; Krebs, 1999; Sousa y Cunha, 2018).
Tabla 1
Características de los sitios de muestreo para el estudio poblacional de A. adstringens. Localidad y estado, coordenadas geográficas, altitud (A), precipitación media anual (P), temperatura media anual (T) y especies representativas.
|
Localidad |
Característica |
Especies representativas |
Referencias |
|
Ostula (Michoacán) |
18°28’44” y 18°36’21” N, 103°28’17” y 103°28’42” O A = 186-645 m P = 983 mm T = 25.2 °C |
Asclepias curassavica, Bdallophytum americanum, Beiselia mexicana, Bursera spp., Cordia sp., Cupania dentata, Enterolobium cyclocarpum, Euphorbia schlechtendalii, Haematoxylum brasiletto, Plumeria rubra y Senna spectabilis |
Villalobos, 2021 |
|
Pómaro (Michoacán) |
18°16’48” y 18°21’47” N, 103°17’06” y 103°22’30” O A = 75-502 m P = 983 mm T = 25.2 °C |
Acacia cochliacantha, Amphipterygium adstringens, Bursera spp., Conzattia multiflora, Comocladia engleriana, Haematoxylum brasiletto, Pseudobombax palmeri, Thevetia sp. y Tabebuia chrysanta |
Villalobos, 2021 |
|
Cuambio (Guerrero) |
18°22’7.6” N, 100°55’9” O A = 209-324 m P = 753 mm T = 28.9 °C |
Bunchosia lanceolata, Cordia elaeagnoides, Conzattia multiflora, Haematoxylum brasiletto, Lysiloma tergemina, Pithecellobium dulce, Psidium guajava y Randia capitata |
Flores-Alta et al., 2019; Flores 2018a. |
|
Papalutla (Guerrero) |
18°1’44’’ N, 98°54’6” O A = 630-690 m P = 1200 mm T = 30 °C |
Ceiba aesculifolia, Cyrtocarpa procera, Jatropha dioica, Bursera spp., y cactus columnares |
Jiménez-Arcos et al., 2012; Rivera-Ortiz et al., 2013. |
|
Tlayca (Morelos) |
18°41’2.4” N, 98°51’31.2” O A = 1271-1480 m P = 806 mm T = 20.1 °C |
Conzattia multiflora, Amphipterygium adstringens, Acacia cochliacantha, Senna skinneri, Bursera spp., Cordia curasavica, Haematoxylum brasiletto y Stemmadenia obovata |
Flores, 2018b. |
|
Tlayecac (Morelos) |
18°45’29.1” N, 98°53’9.1” O A = 1280-1561 m P = 900 mm T = 24 °C |
Acacia cochliacantha, Amphipterygium adstringens, Bursera spp., Combretum sp., Cyrtocarpa procera, Haematoxylum brasiletto y Opuntia sp. |
Observaciones durante este estudio |
|
Tilapa (Puebla) |
20°0.8’12.4’’ N, 100°26’2.3’’ O A = 924-1100 m P = 776 mm T = 23.6 °C |
Acacia cochliacantha, Boerhavia coccinea, Brickellia laxiflora, Indigofera conzattii, Mimosa luisana, M. polyantha y Parkinsonia praecox |
Hernández, 2017. |
|
Coxcatlán (Puebla) |
18°13’3.9’’ N, 97°8’16.4’’ O A = 800-1050 m P = 394.6 mm T = 20 °C |
Acacia cochliacantha, Agave macroacantha, Amphipterygium adstringens, Bursera spp., Cephalocereus columna-trajani, Ceiba aesculifolia, Escontria chiotilla, Neobuxbaumia tetetzo, Opuntia puberula, Pachycereus weberi y Parkinsonia praecox |
Albino-García et al., 2011; Gonzalez, 2019. |
|
Cañón el Sabino (Oaxaca) |
17°51’55.6” N, 97°2’16.5” O A = 660-820 m P = 513.2 mm T = 25 °C |
Bursera spp., Cyrtocarpa procera, Ceiba aesculifolia Subs. parvifolia, Cnidoscolus tehuacanensis, Euphorbia schlechtendalii, Ferocactus latispinus, Jatropha dioica, Lysiloma divaricata, Coryphantha palida, Neobuxbaumia tetetzo, Parkinsonia praecox, Pedilanthus sp., Plumeria rubra y Pseudosmodingium multifolium |
Rivera-Ortíz et al., 2008; Contreras-González, et al. 2009; Contreras 2015. |
|
El Cascalote (Oaxaca) |
17°55’13.93” N, 97°0’59.04” O A = 571-649 m P = 513.2 mm T = 25 °C |
Bursera aptera, B. morelensis, B. schlechtendalii, Acacia angustissima, Amphipterygium adstringens, Pachycereus webery, Plumeria rubra, entre otras especies |
Lira y Blanckaert, 2006. |
La distribución espacial se analizó primero considerando el número de individuos en cada sitio. Posteriormente, también se analizó la distribución de adultos y de individuos pre-reproductivos por separado, en el análisis se omitieron las localidades con menos de 3 individuos pre-reproductivos.
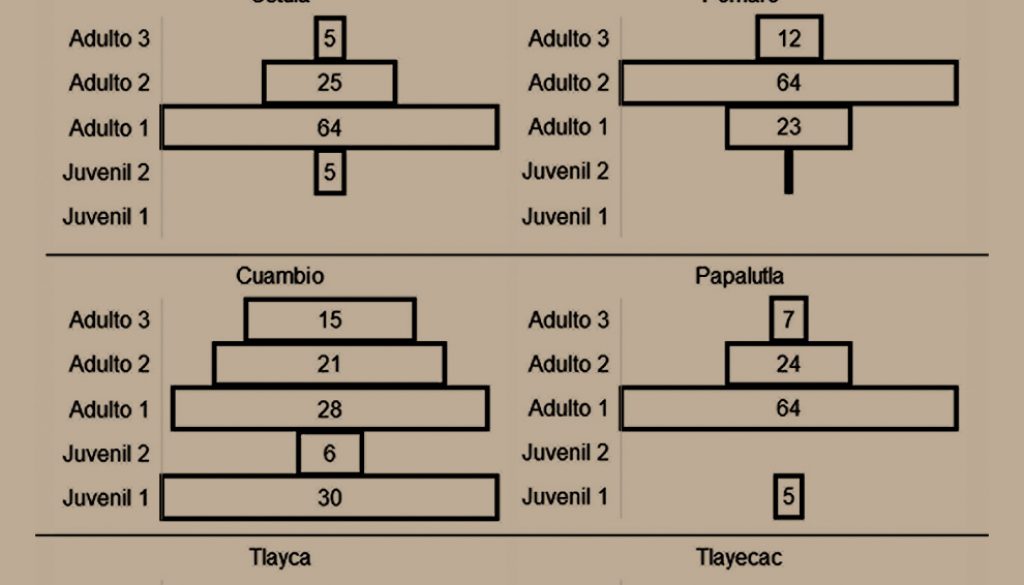
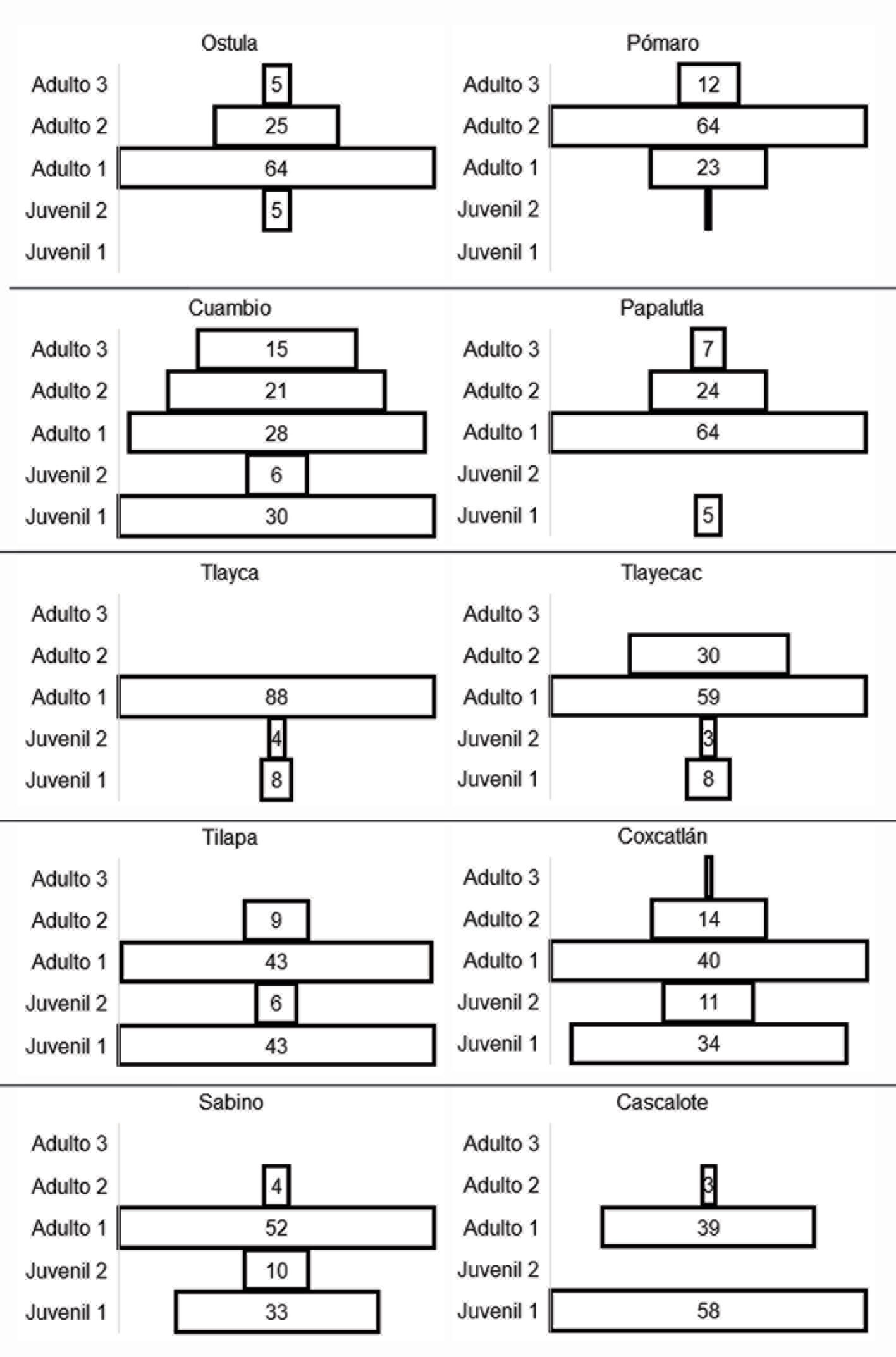
La cantidad de individuos registrados por categoría de edad se comparó con una prueba de χ2. La estructura de edades se analizó para cada localidad cuantitativa y cualitativamente a través de la densidad y mediante histogramas horizontales considerando que en la base se coloca el estadio más joven y por encima de éste los estadios sucesivos. Una estructura con forma triangular es considerada una población en crecimiento, ya que cuenta con una gran proporción de individuos jóvenes e indica alta tasa de natalidad; una población con forma de campana es una población estable, ya que la proporción de juveniles y adultos es similar e indica tasas de natalidad y mortalidad similares. Finalmente, una población decreciente tendrá forma de urna o bulbo, con estadios jóvenes reducidos en comparación con la proporción de adultos, este tipo de estructura indica baja tasa de natalidad o establecimiento de nuevos individuos y pronostica la desaparición de la población si los estadios adultos desaparecen (Krebs, 2009; Smith y Smith, 2007).
La facilitación en zonas áridas y en el BTC es un proceso clave en el reclutamiento de nuevos individuos, por lo que consideramos importante evaluar estos datos (Contreras, 2015; González, 2012, 2013; Khurana y Singh, 2004; Schleicher et al., 2011; Valiente-Banuet y Verdú, 2007). Cuando se encontraron individuos pre-reproductivos bajo la copa de plantas perennes adultas, se registró la orientación del individuo con respecto al centro de la copa considerando 4 puntos cardinales, las plantas adultas fueron identificadas a nivel de especie, se midió la altura, CAP1.30m, tamaño de la copa y se registró su forma de crecimiento según Judd et al. (2002). Para estimar el tamaño de la copa se midieron 2 diámetros perpendiculares y el tamaño se calculó por medio del área de una elipse.
Se utilizó una prueba de t para determinar si había diferencias entre la cantidad de individuos pre-reproductivos creciendo a cielo abierto y aquellos que crecían bajo la copa de plantas adultas. Se analizó la riqueza de especies de plantas bajo las que se encontraron los individuos pre-reproductivos. Para determinar cuántos organismos asociados había por cada individuo adulto, se calculó la razón de asociación por especie nodriza dividiendo el número de individuos pre-reproductivos de A. adstringens en la unidad de muestreo, entre el total de individuos de la especie nodriza con registros asociados. Se utilizaron correlaciones de Spearman para determinar si el número de individuos asociados tenía alguna relación con el tamaño de la copa y con el número de plantas adultas, considerando la totalidad de éstas, así como las especies arbóreas y arbustivas por separado. Se utilizó la correlación de Pearson para determinar si había una relación entre el número de individuos pre-reproductivos creciendo bajo conespecíficos y el número de A. adstringens adultos.
Finalmente, se analizó si existían diferencias significativas entre el número de individuos de A. adstringens establecidos bajo las copas considerando las diferentes orientaciones mediante pruebas de χ2, bajo el supuesto de que existe la misma probabilidad de establecimiento hacia cualquier punto cardinal. Para definir qué orientación era significativa, se hizo un análisis de residuales estandarizados cuya fórmula es R=(O-E)/√E, en donde O son los datos observados y E son los datos esperados; una orientación se consideró significativa para un valor residual absoluto R ≥ 1.96 (Sheskin, 2011). Los análisis se realizaron con GraphPad Prism 7, previa prueba de normalidad, con error alfa de 0.05.
En todos los sitios se buscaron los árboles con evidencia de extracción de corteza considerando que al retirar ésta, se observa el xilema secundario desnudo (cuando la extracción es reciente), o el árbol produce nueva corteza y su desarrollo es evidente por diferencias en el grosor y coloración de la peridermis. Para determinar si la cantidad de árboles presentes en los sitios está correlacionada con la cantidad de árboles sometidos a extracción de corteza, se utilizó una correlación de Pearson previa prueba de normalidad con error alfa de 0.05 en el programa GraphPad Prism 7. Los porcentajes de extracción se analizaron con respecto a la edad de los árboles utilizados.
Resultados
Se registraron 839 individuos en total en las unidades de muestreo. El número de individuos varió entre localidades (χ2 = 444.34, g.l. = 27, p < 0.0001). La mayor densidad de individuos se registró en Puebla (tabla 2), en las localidades de Coxcatlán (279 ± 163 individuos/ha) y Tilapa (265 ± 28 individuos/ha), seguido de Cascalote en Oaxaca (250 ± 84 individuos/ha) y Pómaro en Michoacán (242 ± 94 individuos/ha). Las localidades con menor densidad fueron Tlayca y Tlayecac en el estado de Morelos (50 ± 11 individuos/ha y 77 ± 40 individuos/ha, respectivamente). En algunas unidades se registró 1 solo individuo y en el caso de Tlayecac, una de las unidades no presentó individuos.
De los 839 individuos registrados, 27.2% eran juveniles de reciente establecimiento (juvenil 1), 4.9% eran individuos pre-reproductivos juvenil 2; 44.6% adultos 1, 19.6% adultos 2 y 3.7% adultos 3. Esta diferencia entre la cantidad de individuos registrados en cada categoría de edad fue significativa (χ2 = 422.9, g.l. = 36, p < 0.0001), de manera que 2/3 de los organismos fueron individuos reproductivos (67.9%). La alometría promedio de los individuos se presenta en la tabla 3. En ninguno de los sitios se registraron plántulas.
En Michoacán no se encontraron organismos de la categoría juvenil 1 (tabla 4), la menor densidad promedio se registró en las 2 localidades de Morelos (4 ± 2 individuos/ha en Tlayca y 6 ± 4 individuos/ha en Tlayecac), mientras que la mayor densidad fue en Cascalote, Oaxaca (146 ± 76 individuos/ha) y Tilapa, Puebla (115 ± 47 individuos/ha). En cuanto a los individuos de la categoría juvenil 2, en 5 localidades (Ostula, Pómaro, Cuambio, Tlayca y Tlayecac) los individuos se encontraron en una sola unidad de muestreo, mientras que en Papalutla y Cascalote no hubo registros. La densidad promedio más alta se registró en Coxcatlán en Puebla (31 ± 20 individuos/ha), seguida del cañón el Sabino en Oaxaca y Tilapa en Puebla (21 ± 12 y 15 ± 10 individuos/ha, respectivamente).
A su vez, los organismos de la categoría adulto 1 estuvieron bien representados en todas las localidades, con una densidad mínima de 31 ± 14 individuos/ha en Cuambio en Guerrero, y la máxima en Tilapa en Puebla (113 ± 35 individuos/ha), otras localidades con alta densidad fueron Papalutla, Coxcatlán y el cañón el Sabino, sin embargo, también presentaron una fuerte variación entre los resultados por unidad de muestreo. Los registros de la categoría adulto 2 en general presentaron bajas densidades (0 a 5 individuos/ha), excepto en Pómaro en Michoacán (19 ± 7 individuos/ha). Finalmente, la densidad de adultos 3 fue nula en 5 localidades, mientras que en Coxcatlán en Puebla y Ostula en Michoacán solo se encontraron individuos de dicha categoría en una unidad de muestreo; en cambio, los sitios con mayor representación fueron Cuambio y Papalutla en Guerrero (17 ± 8 y 10 ± 8 individuos/ha, respectivamente), y Pómaro en Michoacán (29 ± 10 individuos/ha).
En Ostula se localizaron 2 individuos pequeños (1.5 m y 1.54 m de altura, ambos con 9 cm de CAB) con estructuras reproductivas, no presentaban cobertura, el ápice estaba representado por una rama delgada sin ramificación, el primero presentaba 3 botones florales y el segundo, 2 flores en antesis, sugiriendo que estas características de tamaño ya son un primer indicio de la etapa adulta para la especie, al menos en esa región.
El patrón de distribución espacial de los individuos (pre-reproductivos y reproductivos) en las poblaciones fue al azar en Cuambio (Guerrero), Tilapa (Puebla) y Tlayca (Morelos), en el resto de las localidades se encontró un patrón agregado (tabla 2). Sin embargo, al analizar por separado la distribución de adultos e individuos pre-reproductivos asociados y no asociados, únicamente en Cuambio y Tlayca se conservó el patrón, en el resto de los sitios se observaron cambios.
El conjunto de individuos adultos por localidad mostró una distribución al azar únicamente en Cuambio (IEM = -0.43, n = 34 individuos) y Tlayca (IEM = -0.03, n = 21 individuos), en el resto de las localidades se observó una distribución agregada (IEM = 0.51 a 0.82, n = 33 en Tlayecac, n = 50 en El Cascalote, n = 53 en Ostula, n = 54 en el cañón el Sabino, n = 65 en Tilapa, n =72 en Papalutla, n =73 en Coxcatlán, n =115 en Pómaro). En cuanto a los individuos pre-reproductivos, 56% se registró creciendo a cielo abierto y 44% bajo la sombra de alguna planta adulta (n = 250).
Tabla 2
Número de individuos pre-reproductivos y reproductivos, densidad promedio por hectárea (± error estándar), índice estandarizado de Morisita (IEM) y respectivo patrón de distribución espacial de A. adstringens registrado por localidad.
|
Localidad |
Número de individuos |
Densidad |
IEM |
Patrón de distribución |
|
Ostula |
56 |
117 ± 79 |
0.71 |
Agregado |
|
Pómaro |
116 |
242 ± 94 |
0.56 |
Agregado |
|
Cuambio |
53 |
110 ± 22 |
0.28 |
Azar |
|
Papalutla |
76 |
158 ± 121 |
0.78 |
Agregado |
|
Tlayca |
24 |
50 ± 11 |
0.03 |
Azar |
|
Tlayecac |
37 |
77 ± 40 |
0.6 |
Agregado |
|
Tilapa |
127 |
265 ± 28 |
0.1 |
Azar |
|
Coxcatlán |
134 |
279 ± 163 |
0.66 |
Agregado |
|
Cañón el Sabino |
96 |
200 ± 101 |
0.62 |
Agregado |
|
El Cascalote |
120 |
250 ± 84 |
0.55 |
Agregado |
Los organismos no asociados a plantas (n = 140 individuos totales, 98.2% juvenil 1 y 1.8% juvenil 2), mostraron una distribución agregada en Tilapa, Coxcatlán, cañón el Sabino y El Cascalote (IEM = 0.54 a 0.62), mientras que en Ostula, Cuambio, Tlayca y Tlayecac se encontró una distribución al azar (IEM = -0.35 a 0.47); en Papalutla y Pómaro solo se registró 1 individuo. Los organismos asociados a plantas adultas (n =110, 75.7% juvenil 1 y 24.3% juvenil 2) presentaron una distribución agregada en Tilapa, Coxcatlán y El Cascalote (IEM = 0.53 a 0.69), en Cuambio y en el cañón el Sabino la distribución fue al azar (IEM = 0 a 0.08), Papalutla solo tuvo un registro y finalmente, Ostula, Pómaro, Tlayca y Tlayecac no tuvieron registros.
No se encontraron poblaciones en crecimiento o estables, en cada localidad la estructura poblacional es decreciente ya que la proporción de adultos es mucho mayor que la de individuos pre-reproductivos (fig. 1). La proporción de juvenil 1 fue de 5 a 8% en Papalutla y las 2 localidades de Morelos, y de 30 a 34% en Cuambio, cañón el Sabino y Coxcatlán, en tanto que, las localidades con mayor proporción fueron Tilapa y El Cascalote (43 y 58%, respectivamente). En todas las poblaciones la proporción de individuos de la categoría juveniles 2 es preocupante, ya que no se localizaron individuos en Papalutla y El Cascalote, o dicha proporción fue demasiado baja en el resto de las localidades (entre 1 y 11%).
En cuanto a los organismos adultos, el patrón general indica que dominan los individuos adulto 1 y adulto 2, mientras que los adulto 3 se encuentran en baja proporción o no existen. En la mitad de los sitios (Ostula, Papalutla, Tlayca, Tlayecac y el cañón el Sabino), la proporción de adulto 1 estuvo por arriba de 52%; en Pómaro la mayor proporción fue de adulto 2 (64%); Cuambio presentó proporciones decrecientes a medida que se observan árboles más grandes (28% en adulto 1, 21% en adulto 2 y 15% en adulto 3), en Ostula se observó un patrón similar, sin embargo, la diferencia entre las categorías de adulto fue más grande que en Cuambio (64% en adulto 1, 25% en adulto 2 y 5% en adulto 3). Salvo por la baja proporción de juvenil 2, la estructura poblacional de Cuambio, Guerrero podría considerarse estable.
Tabla 3
Características alométricas de los individuos de A. adstringens. Altura, circunferencia a la altura de la base (CAB) o el pecho (CAP) y cobertura de la copa. Datos tomados en 10 localidades a lo largo de la distribución de la especie; se presenta el valor promedio ± error estándar.
|
Juvenil 1 |
Juvenil2 |
Adulto 1 |
Adulto 2 |
Adulto 3 |
|
|
Altura (m) |
0.65 ± 0.04 |
2.3 ± 0.16 |
4.19 ± 0.08 |
5.97 ± 0.13 |
6.6 ± 0.31 |
|
CAB (cm) |
4.03 ± 0.018 |
7.55 ± 0.33 |
|||
|
CAP (cm) |
29.2 ± 0.58 |
67.6 ± 1.08 |
123.5 ± 6.02 |
||
|
Cobertura (m2) |
7.75 ± 0.41 |
12.95 ± 0.87 |
17.34 ± 3.14 |
Tabla 4
Densidad promedio de individuos/ha (± error estándar) de A. adstringens por localidad y categoría de edad.
|
Juvenil 1 |
Juvenil2 |
Adulto 1 |
Adulto 2 |
Adulto 3 |
|
|
Ostula |
0 |
6 ± 6 |
75 ± 69 |
4 ± 1 |
6 ± 6 |
|
Pómaro |
0 |
2 ± 2 |
56 ± 31 |
19 ± 7 |
29 ± 10 |
|
Cuambio |
33 ± 18 |
6 ± 6 |
31 ± 14 |
3 ± 1 |
17 ± 8 |
|
Papalutla |
8 ± 8 |
0 |
102 ± 91 |
5 ± 3 |
10 ± 8 |
|
Tlayca |
4 ± 2 |
2 ± 2 |
44 ± 9 |
0 |
0 |
|
Tlayecac |
6 ± 4 |
2 ± 2 |
46 ± 24 |
3 ± 2 |
0 |
|
Tilapa |
115 ± 47 |
15 ± 10 |
113 ± 32 |
3 ± 1 |
0 |
|
Coxcatlán |
96 ± 34 |
31 ± 20 |
111 ± 97 |
5 ± 2 |
2 ± 2 |
|
Cañón el Sabino |
67 ± 34 |
21 ± 12 |
104 ± 68 |
1 ± 1 |
0 |
|
El Cascalote |
146 ± 76 |
0 |
98 ± 37 |
1 |
0 |
La proporción de individuos asociados y no asociados mostró un comportamiento distinto en cada localidad, en Cascalote se encontró la misma proporción de individuos asociados que no asociados. En Coxcatlán y el cañón el Sabino la mayor proporción fue de individuos no asociados (62.3% y 72.4%, respectivamente), mientras que en Cuambio y Tilapa la mayor proporción fue de individuos asociados (53.3% y 56.5%, respectivamente). Sin embargo, estas diferencias no fueron suficientes para establecer un patrón general de asociación (t = 0.92, df = 4, p = 0.4).
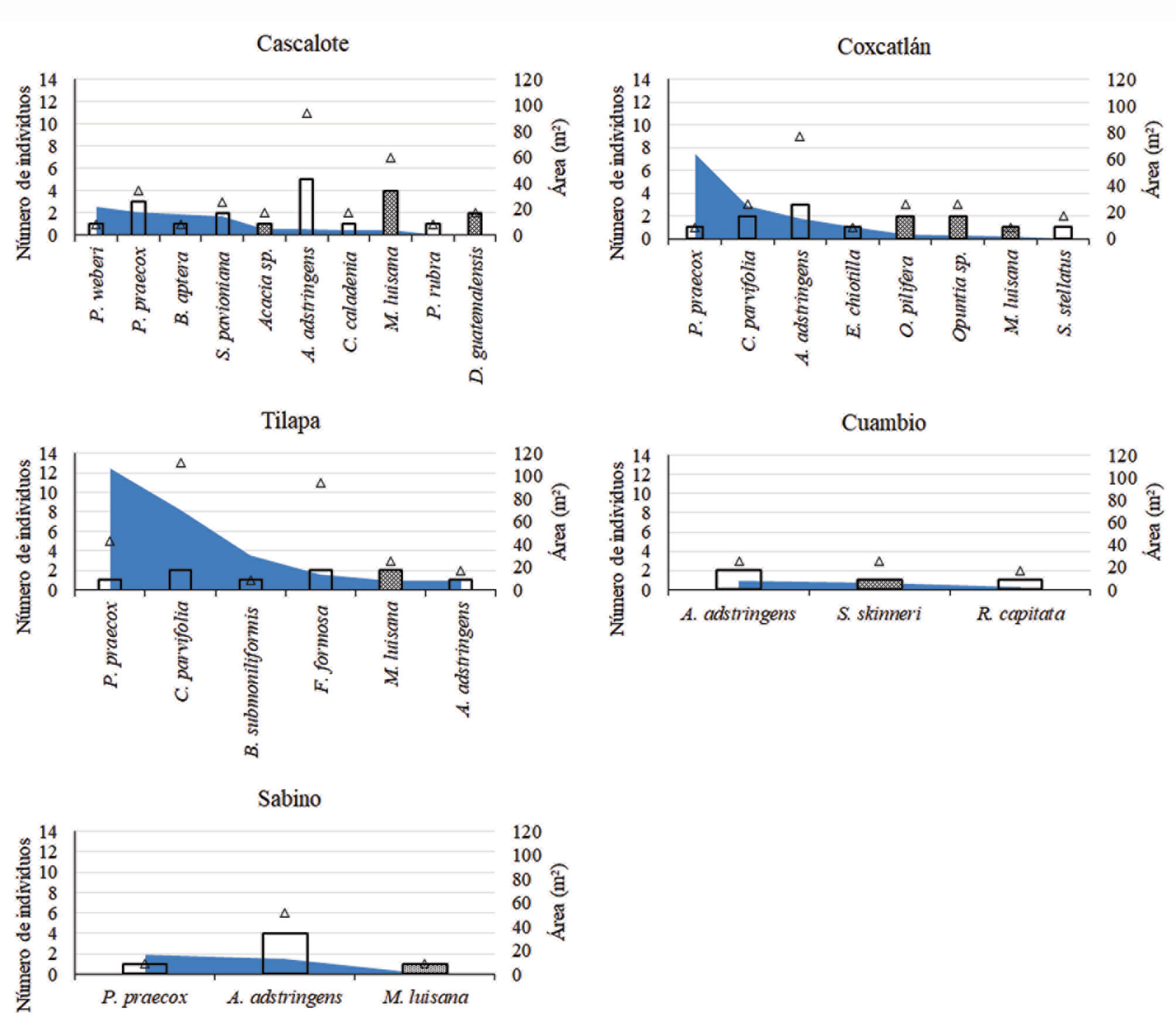
Los individuos asociados se encontraron principalmente bajo especies arbóreas (77.1%) y en menor proporción bajo especies arbustivas (22.9%); solo se encontró 1 individuo asociado a una roca. La mayor proporción de organismos asociados se encontró en Cascalote y Tilapa (31.8% en cada localidad), seguido de Coxcatlán (21%). Se registró un total de 54 individuos de 20 especies de plantas asociadas, pertenecientes a 8 familias, la más común fue Fabaceae con 6 especies, seguida de Cactaceae con 5, y Euphorbiaceae y Burseraceae con 2 especies cada una (tabla 5).
Los sitios con mayor riqueza de plantas asociadas fueron El Cascalote (10 especies), Coxcatlán (8 especies) y Tilapa (6 especies). En 31.2% de los casos, la razón de asociación fue igual a 1, es decir, 1 organismo asociado por cada individuo adulto, en el resto la razón de asociación varió entre 1.3 y 6.5 individuos por planta adulta. En varios sitios destacan algunas especies, tal es el caso de Tilapa en donde Ceiba parvifolia, Fouquieria formosa y Parkinsonia praecox (razón de asociación igual a 6.5, 5.5 y 5, respectivamente), son las especies con mayor número de individuos asociados. Se encontró que los individuos no reproductivos de A. adstringens se establecen bajo la cobertura de conespecíficos adultos en 5 de 6 localidades (en Papalutla solo hubo un registro bajo Lysiloma sp.), además, la razón de asociación fue de 1.5 a 3 asociados por adulto, sugiriendo que no es una relación azarosa. Especies como Mimosa luisana y Parkinsonia praecox, también resultaron con asociaciones importantes en las localidades de Puebla y Oaxaca.
Se observó también que el número de individuos asociados no tiene relación con el tamaño de la copa de las plantas adultas (rs = 0.07, p = 0.77, n = 20), sino con el número de plantas adultas presentes (rs = 0.86, p < 0.0001, n = 20), incluso dicha asociación es significativa cuando se considera solo la cantidad de especies arbóreas (rs = 0.89, p < 0.0001, n = 14), pero se pierde con las especies arbustivas (rs = 0.58, p = 0.24, n = 6). Excepto en Tilapa, donde se encontraron las copas más grandes, se observó que la amplitud de la copa no es relevante en el número de asociaciones, ya que la mayor cantidad de asociados se encuentra en donde hay mayor cantidad de adultos.
Por otro lado, también se observó que en todas las localidades hay al menos 1 especie arbustiva importante en la interacción (fig. 2). En todas las localidades se encontró que la asociación de A. adstringens y sus conespecíficos adultos aumenta cuando hay más adultos, aunque la relación no fue significativa (r = 0.86, p = 0.057, n = 5). Estos resultados sugieren que la asociación está determinada por patrones de dispersión, condiciones de facilitación y características del desarrollo de A. adstringens.
La orientación de individuos establecidos bajo la copa mostró diferencias significativas (χ2 = 65.86, df = 3, p < 0.0001), indicando que hay una mayor cantidad de individuos en el oeste, el norte y el este (R > |2| para cada orientación) con respecto al sur. El 78% del total de los datos se concentró en 5 especies (A. adstringens, C. parvifolia, M. luisana, F. formosa y P. praecox) en las localidades de Puebla y Oaxaca; para este porcentaje se observó el mismo patrón de orientación con mayor cantidad de individuos en el oeste, el norte y el este (R > |2| para cada orientación), mientras que los individuos en el sur no fueron significativos (χ2 = 45.67, df = 3, p < 0.0001). Los individuos asociados a A. adstringens (28% del total de los datos), mostraron una tendencia a establecerse al oeste (R > |2|) de la planta adulta (χ2 = 15.71, df = 3, p = 0.0013).
Las marcas de extracción de corteza se localizaron en 37 individuos adultos en las localidades de Guerrero y Puebla y en el cañón el Sabino (Oaxaca). Se observó una relación negativa pero no significativa entre el total de individuos adultos y el número de organismos con marcas (r = -0.63, p = 0.25, n = 5). Se destaca que en Cuambio 35.3% se presentó alguna marca de extracción, esta es la población con menor densidad de adultos y la proporción de adulto 1 es el doble de las 2 categorías restantes; sin embargo, las marcas se encontraron en árboles adulto 2 (14.7%) y adulto 3 (20.6%). En Coxcatlán solo se encontraron marcas en 12.5% de los adultos, 2/3 partes eran adulto 2 y 1/3 era adulto 1, sin embargo, ésta es una de las poblaciones con mayor densidad de adultos y solo 1 individuo en categoría adulto 3. En el cañón el Sabino se registró la extracción en 18.9% de los adultos, en este sitio la densidad de adulto 2 es muy baja aun cuando los organismos registraron marcas (3.8%), el restante 15.1% fue localizado en adulto 1; en este sitio no había adulto 3. Estos resultados sugieren que los pobladores tienden a utilizar la corteza de los árboles con mayor tamaño.
Discusión
Amphipterygium adstringens es un árbol dominante en algunas localidades de BTC de México (Beltrán-Rodríguez, 2018; Cortés-Flores et al., 2017; Luis, 2017; Maldonado et al., 2013; Méndez-Toribio et al., 2014; Sánchez et al., 2018). En el presente estudio encontramos variaciones en la densidad de individuos entre los sitios. Los valores más altos de densidad se encontraron en Tilapa, Coxcatlán, Pómaro y El Cascalote, seguido del cañón el Sabino, tales valores pueden deberse a la baja perturbación y las pocas actividades antrópicas que existen en estos sitios, ya que 4 de ellos se encuentran en un área destinada a la conservación de especies dentro de la Reserva de la Biósfera Tehuacán-Cuicatlán (Conanp, 2021).
Las densidades más bajas encontradas fueron en los sitios Tlayca y Tlayecac, similares o mayores a las reportadas para Chietla, Puebla (19 a 56 individuos/ha; Martínez, 2011) y para las descritas en 2 localidades de San Juan Bautista Jayacatlán, Oaxaca (54.9 y 29.6 individuos/ha; Zamora, 2003). Las bajas densidades encontradas en el presente trabajo en Tlayca y Tlayecac pueden deberse a que estos sitios son los más fragmentados de las localidades estudiadas; por una parte, en Tlayecac solo quedan remanentes de vegetación natural debido a los cultivos, el crecimiento de la mancha urbana y el pastoreo de ganado vacuno (Messenguer, 2013). Por otro lado, en Tlayca también se ha observado ganado vacuno y el sitio de estudio se encuentra rodeado por cultivos, actividades piscícolas y extracción de roca (Flores, 2018b). Así mismo, el estado de Morelos se ha descrito como uno de los sitios con mayor extracción de corteza para uso medicinal, además de uso para postes y combustible (Anzures et al., 2004; Solares et al., 2012). Por otra parte, en el estado de Morelos se ha observado una disminución en el patrón de precipitación en los últimos 50 años, con un aumento en la frecuencia de fuertes precipitaciones concentradas en pocos días durante la temporada de lluvias (CICESE, 2017), lo cual tiene efectos en las poblaciones.
Tabla 5
Familias y especies de plantas adultas con las que se asocian los individuos pre-reproductivos de A. adstringens, forma de crecimiento y razón de asociación por especies y localidad.
|
Familia |
Especie |
Forma de crecimiento |
Cuambio |
Papalutla |
Tilapa |
Coxcatlan |
Cañón el Sabino |
Cascalote |
|
Anacardiaceae |
Amphipterygium adstringens |
Arbórea |
1.5 |
2 |
3 |
1.5 |
2.2 |
|
|
Apocynaceae |
Plumeria rubra |
Arbórea |
1 |
|||||
|
Burseraceae |
Bursera aptera |
Arbórea |
1 |
|||||
|
Bursera submoniliformis |
Arbórea |
1 |
||||||
|
Cactaceae |
Escontria chiotilla |
Arbórea |
1 |
|||||
|
Opuntia pilifera |
Arbustiva |
1.5 |
||||||
|
Opuntia sp. |
Arbustiva |
1.5 |
||||||
|
Pachycereus weberi |
Arbórea |
1 |
||||||
|
Stenocereus stellatus |
Arbórea |
2 |
||||||
|
Euphorbiaceae |
Ditaxis guatemalensis |
Arbustiva |
1 |
|||||
|
Sebastiania pavoniana |
Arbórea |
1.5 |
||||||
|
Fabaceae |
Caesalpinia caladenia |
Arbórea |
2 |
|||||
|
Lysiloma sp. |
Arbórea |
1 |
||||||
|
Mimosa luisana |
Arbustiva |
1.5 |
1 |
1 |
1.75 |
|||
|
Parkinsonia praecox |
Arbórea |
5 |
1 |
1 |
1.33 |
|||
|
Senna skinneri |
Arbustiva |
3 |
||||||
|
Vachellia (Acacia) sp. |
Arbustiva |
2 |
||||||
|
Fouquieriaceae |
Fouquieria formosa |
Arbórea |
5.5 |
|||||
|
Malvaceae |
Ceiba parvifolia |
Arbórea |
6.5 |
1.5 |
||||
|
Rubiaceae |
Randia capitata |
Arbórea |
2 |
|||||
|
Total de individuos asociados |
8 |
1 |
35 |
23 |
8 |
34 |
Las variaciones en el número de individuos de A. adstringens también se deben a que cada sitio de estudio presenta condiciones ambientales particulares, en donde los procesos ecológicos y factores tanto abióticos como bióticos, tales como el clima, la topografía, la precipitación, la germinación, el establecimiento, la competencia, la fenología, la reproducción, la producción de semillas, la dispersión de éstas, y el disturbio presente, influyen de diferente manera en la densidad, distribución espacial de los individuos y en la estructura de las poblaciones (CICESE, 2017; Ceccon et al., 2006; Fortin y Dale, 2005; Hubbell, 1979).
El patrón de distribución al azar encontrado en Cuambio, Tilapa y Tlayca pueden ser resultado de la homogeneidad ambiental, donde los individuos de la misma especie pueden encontrarse en cualquier lugar (Begon et al., 2006; Fortin y Dale, 2005), que posiblemente es causada por la fragmentación del hábitat presente en estos sitios, y por la capacidad de A. adstringens de establecerse a cielo abierto o bajo el dosel de plantas adultas. Por otro lado, el patrón de distribución agregado encontrado en Ostula, Pómaro, Papalutla, Coxcatlán, El Cascalote y el cañón el Sabino, es similar a lo descrito para la especie en San Juan Bautista Jayacatlán, Oaxaca (Zamora, 2003). Este patrón de distribución de individuos se debe a la disposición heterogénea de los recursos, en dónde los individuos de la misma especie se encuentran cercanos en áreas con condiciones favorables y suficientes recursos (Begon et al., 2006; Fortin y Dale, 2005). Sin embargo, este patrón se contrapone con la disposición espacial azarosa, por lo que es importante indagar que factores o procesos intervienen en la supervivencia de A. adstringens a lo largo del ciclo de vida y determinan un patrón u otro, ya que a nivel de paisaje solo se observó diferente grado de fragmentación.
En el BTC, los recursos como los nutrientes y el agua varían estacionalmente en el ambiente, son fundamentales para el establecimiento, supervivencia y desarrollo de los individuos, lo cual tiene efectos en la distribución espacial (Balvanera et al., 2011; Begon et al., 2006; Mooney et al., 2009; Rahman et al., 2009). Así como el alto grado de deforestación presente en Cuambio, Tlayca y Tlayecac (Flores-Alta et al., 2019; Flores, 2018b), y la presencia de eventos esporádicos de lluvias torrenciales que se han presentado en los últimos 2 sitios (CICESE, 2017), pueden ocasionar la pérdida de recursos por deterioro o arrastre por agua, lo que afecta la productividad del ambiente (Bertol et al., 2003; Borrelli y Oliva, 2001; Jie et al., 2002), y por el contrario, en los sitios donde existe muy baja perturbación, los recursos tienen mayor disponibilidad. Así mismo, el tipo de dispersión de semillas que presenta la especie de estudio (anemocoria) puede influir en el tipo de distribución en algunos sitios, además del ambiente y del espacio (Balvanera et al., 2011; Condit et al., 2000), por lo que las diferencias en los patrones de distribución pueden deberse también a la variedad de interacciones entre organismos y el medio abiótico (Fortin y Dale, 2005; Sapkota et al., 2009).
Por otra parte, encontramos que el mayor porcentaje de individuos de A. adstringens corresponde a la categoría adulto 1, es decir adultos jóvenes, lo que nos indica que existe poca regeneración reciente de la especie, lo cual es característico de poblaciones que se encuentran en declive (Mollers, 2008; Rahman et al., 2009). Este patrón también fue observado para A. adstringens en Chamela, Jalisco (Fernández, 2014), y en el Ejido el Limón, Morelos (Beltrán, 2018), así como para otras especies caducifolias como Bursera glabrifolia en Jayacatlán, Oaxaca (Hernández-Apolinar et al., 2006).
En las poblaciones de A. adstringens del presente estudio, el bajo número de individuos pre-reproductivos juega un papel fundamental en la estructura, la composición y en la diversidad de los bosques (Johnson et al., 2017). La ausencia de plántulas puede ser resultado de la temporada en la que se realizaron los muestreos, ya que la mayoría de éstos se realizaron en temporada de secas, y la germinación de semillas del BTC ocurre durante la temporada de lluvias (Ceccon et al., 2006). Así mismo, puede deberse a un rápido desarrollo de las plántulas (plantas que ya han perdido los cotiledones), que no permitió observarlas durante los muestreos y lo que se registró fueron juveniles. Además, se ha descrito que especies del BTC con semillas de tamaño pequeño, como es el caso de A. adstringens, tienen menor sobrevivencia que las especies que presentan semillas de tamaño grande (Khurana y Singh, 2004; Maass y Burgos, 2011).
Por otro lado, los cambios en el patrón de precipitación de los últimos años y la disminución de ésta en Coxcatlán, Tlayca y Aquila (CICESE, 2017; Serrano, 2018; Villalobos, 2021), pueden tener consecuencias negativas sobre las plántulas y juveniles, ya que se ha descrito que los eventos de lluvia torrencial, pueden afectar las semillas y plántulas de especies filogenéticamente cercanas (Beiselia y Bursera, Burseraceae), debido a que éstas se saturan de agua y mueren “ahogadas” o son arrastradas por la corriente debido al incipiente desarrollo del sistema radicular (Villalobos, 2021), así mismo, estas especies requieren un periodo de lluvia constante durante al menos 4 meses para que se diferencie eficientemente el sistema vascular y puedan resistir el periodo de sequía, un proceso que puede estar limitado por los cambios en el régimen de lluvias o las sequías prolongadas (Azcón-Bieto y Talón, 2008; Ortega y Collazo, 2013; Serrano, 2018).
El bajo número de individuos de la categoría juvenil 1 se puede explicar por una limitación en la producción de semillas, la germinación, la sobrevivencia y establecimiento de plántulas, ya que los individuos de primeras etapas son más susceptibles a la muerte que los individuos adultos (Ceccon et al., 2006; Fortin y Dale, 2005; Hubbell, 1979; Lieberman y Li, 1992). La producción de semillas es afectada negativamente por una reducción de la fecundidad, limitación por polen o errores en el desarrollo de la semilla, entre otros factores (Callaway, 2007; Jordano et al., 2008). Mientras que la sobrevivencia de plántulas y juveniles depende de factores bióticos y abióticos como las especies de plantas bajo las cuales crecen, las características de los micrositios en donde se lleva a cabo la germinación y establecimiento de plántulas, además de la maduración de tejidos del organismo, la depredación, y de las actividades antrópicas (Callaway, 2007; Beltrán, 2018).
Particularmente en el municipio de Aquila (al que pertenecen Ostula y Pómaro), se sabe que A. adstringens es una especie agroforestal, la hojarasca producida por ésta y otras especies arbóreas es usada como forraje para el ganado, lo que contribuye a su conservación (Herrera et al., 2018). Sin embargo, el pisoteo del ganado durante el forrajeo puede ocasionar la muerte de plántulas y/o juveniles o incluso puede haber ingesta de pequeños individuos, ya que es poco probable que hayan desarrollado metabolitos secundarios y sean palatables para el ganado (Serrano, 2018). Otro factor observado en Aquila es la quema de hierbas al inicio de la época seca para permitir que la hojarasca esté “limpia” para el ganado; aunque se cuida que los árboles adultos permanezcan sin daños, es probable que se influya negativamente en el establecimiento de nuevos individuos.
Durante las primeras etapas de vida, las plantas asignan la mayor cantidad de recursos al crecimiento y expansión de tejidos, quedando en segundo término la construcción de defensas químicas y físicas, lo que las hace más susceptibles a herbívoros y patógenos (García y Collazo, 2013). Particularmente, en las especies de Bursera de Coxcatlán y Tilapa (en donde habita A. adstringens) se ha observado que las plántulas no desarrollan defensas químicas o físicas, es alrededor de los 4 meses de edad, cuando ya son juveniles, que comienza la producción de defensas contra la herbivoría (Serrano, 2018), es factible que A. adstringens tenga un desarrollo similar al crecer bajo las mismas condiciones ambientales y estar relacionado filogenéticamente, sin embargo, es un tema que debe estudiarse.
Adicionalmente, en A. adstringens se han reportado escarabajos xilófagos (Cerambycidae), considerados parásitos para varias especies de plantas de importancia comercial, ya que las larvas perforan los tejidos conductores provocando la caída de las ramas y facilitan la entrada de otra fauna nociva (Calderón-Cortés et al., 2016; López-Martínez et al., 2015; Vargas-Cardoso et al., 2018). Si bien esta afectación en los árboles adultos puede no ser importante, en el caso de los individuos pre-reproductivos que comienzan a producir ramas, podría significar una reducción en el crecimiento del individuo o incluso la muerte, ya que la cantidad de meristemos para el crecimiento lateral y/o apical aún es reducido y se afecta directamente el sistema vascular.
En el presente estudio no encontramos poblaciones en crecimiento o estables debido a que en todas las localidades la estructura poblacional es decreciente, ya que la proporción de adultos es mayor que la de individuos pre-reproductivos, como es el caso de la población de A. adstringens en el Ejido el Limón, Morelos (Beltrán, 2018). La categoría juvenil 2 es la menos representada en 8 sitios, contrario a lo descrito para A. adstringens en La Barranca de Horcones y la laguna en San Juan Bautista Jayacatlán, Oaxaca, en donde la categoría mejor representada es la que presenta una altura mayor de 100 cm, pero menor de 10 cm de diámetro a la altura del pecho (Zamora, 2003). Por otro lado, se ha observado un patrón similar al encontrado para A. adstringens en especies filogenéticamente relacionadas como; Bursera fagaroides, B. arida, B. submoniliformis y B. schlechtendalii en Coxcatlán, Puebla, así como para B. submoniliformis, en Guadalupe Victoria, Puebla (Gonzalez, 2019), para Bursera cuneata en la Ciudad de México (Hernández, 2018), y para el género Bursera en Pómaro (Hernández y Ramos-Ordoñez, 2018).
La baja representatividad de individuos juveniles (1 y 2) en el presente estudio indica que en algún momento la especie presentó un establecimiento irregular, y que su producción de semillas y el establecimiento no es constante en el tiempo, debido a las condiciones a las que se encontraron expuestos, por lo que posiblemente A. adstringens es una especie sensible a los cambios que afectan su establecimiento (Zamora, 2003). Así mismo, esta disminución en el número de individuos también se puede atribuir al pastoreo que existe en los sitios estudiados, principalmente en Tilapa, Coxcatlán, Tlayca, Tlayecac y Papalutla. Tal disminución en el número de individuos podría traer consecuencias negativas a las poblaciones generando cuellos de botella (Groenendijk et al., 2012; Tolera et al., 2013), ya que los individuos de estas categorías en los siguientes años remplazaran a las subsecuentes, resultando en una reducción en el número de individuos adultos.
Uno de los factores que determina la sobrevivencia de individuos juveniles es el microclima, debido a que éste afecta su crecimiento. Se ha descrito que especies de plantas con las que se asocian proporcionan mayor humedad, menor compactación del suelo, menor radiación solar y bajo éstas existe mayor cantidad de materia orgánica (Callaway, 2007; Verdú y García-Fayos, 2002). Esta asociación también se ha descrito en otras especies en el BTC, la cual permite el establecimiento de diferentes plantas en este ambiente altamente estacional (Arriaga et al., 1993; Contreras, 2015; Méndez et al., 2006; Ruiz, 2007).
No obstante, en el presente estudio se encontró que los individuos de A. adstringens no necesariamente requieren de una planta perenne para establecerse, como es el caso de especies pertenecientes al género Bursera (Gonzalez, 2019). Sin embargo, los individuos juveniles de A. adstringens que se encuentran asociados se localizan principalmente bajo el dosel de árboles de diferentes géneros, debido a que estos son los elementos dominantes en este tipo de vegetación (Flores, 2018b; Rivera-Ortíz et al., 2013; Trejo, 1998; Vázquez, 2007).
Encontramos que un gran número de juveniles de A. adstringens asociados se encontraron bajo el dosel de la misma especie en El Cascalote, Coxcatlán, Cuambio y el cañón el Sabino, a pesar de que se ha descrito que existe mayor mortalidad de plántulas bajo individuos conespecíficos, debido a patógenos y herbivoría (Howe y Smallwood, 1982). Además, se sabe que existe mayor competencia entre especies filogenéticamente cercanas debido a que tienen nichos similares (Valiente-Banuet y Verdú, 2008). Dicha asociación puede deberse a la dispersión de semillas anemócora propia de la especie (dispersión por viento), que influye en la distribución limitada de las semillas (Balvanera et al., 2011), las cuales pueden caer cerca de la misma especie, incluso del progenitor. Por lo que sería importante evaluar en estudios futuros el sexo de los individuos adultos de A. adstringens con los cuales se asocian los juveniles, lo cual podría ayudar a explicar un poco más el proceso de facilitación con individuos de la misma especie.
Esta asociación se puede explicar ya que las especies vecinas a los individuos asociados de A. adstringens, son taxa filogenéticamente alejados y neutralizan los efectos negativos como la competencia, dado que puede existir mayor complementariedad, y el efecto de los depredadores es menor; además, la presencia de una red de micorrizas que une a las especies vegetales permite la transferencia de nutrientes y protección contra patógenos (Cerón, 2015; Montesinos-Navarro et al., 2019; Valiente-Banuet y Verdú, 2013).
Debido a que A. adstringens puede establecerse en espacios desprovistos de vegetación y otras plantas se establecen bajo su copa en sitios como el Clarín (Guanajuato), Talyca (Morelos), la cueva del Maíz (Coxcatlán, Puebla), y en el cañón el Sabino en Oaxaca (Godinez-Manriquez y Contreras-González, 2019; Gonzalez, 2019; Segundo-Hernández y Ramos-Ordoñez, 2016; Serrano-Rosas et al., 2018), se puede considerar a A. adstringens como especie facilitadora de otras especies, como es el caso de Mimosa luisana en el BTC y en el matorral xerófilo (Contreras, 2015; Valiente-Banuet y Ezcurra, 1991; Valiente-Banuet y Verdú, 2007).
Sin embargo, en algunos puntos de su distribución, A. adstringens se extrae en gran medida para uso medicinal (Solares et al., 2012), presenta diferencias fisiológicas entre sexos (que podría afectar más a un sexo en ambientes estresantes [Beltrán, 2018]), produce un bajo número de semillas por fruto (Guzmán-Pozos y Cruz-Cruz, 2014), los juveniles tienen una tasa relativa de crecimiento baja (Rincón y Huante, 1993), así como una limitada transición entre etapas de desarrollo. Todos estos son factores que pueden llegar a poner en riesgo la dinámica de las comunidades en donde se encuentra presente la especie, ya que es facilitadora de otras especies de plantas del BTC.
En este trabajo también resultaron asociaciones importantes entre los juveniles de A. adstringens y los adultos de M. luisana y Parkinsonia praecox en El Cascalote y el cañón el Sabino, C. parvifolia y M. luisana en Tilapa. Parkinsonia praecox, también ha sido descrita como nodriza de otras especies de plantas ya que puede favorecer su crecimiento (Contreras, 2015; Valiente-Banuet y Escurra, 1991; Valiente-Banuet y Verdú, 2007). Se sabe que bajo el dosel de M. luisana y P. praecox, se presentan suelos con mayor cantidad de nutrientes que los sitios desprovistos de vegetación, y hay mayor sobrevivencia de plantas asociadas a éstas (García-Chávez et al., 2014; Valiente-Banuet et al., 1991), tales interacciones presentes entre plantas pueden influir positivamente en la estructura de las comunidades (Valiente-Banuet y Verdú, 2013; Valiente-Banuet et al., 2014).
Los individuos juveniles de A. adstringens asociados al dosel de una planta adulta principalmente se encontraron orientados al norte, este y oeste, lo que nos indica que evitan establecerse al sur de la planta con la cual se asocian, ya que al norte la radiación solar anual es menor, mientras que al oeste reciben mayor radiación en la tarde, sin embargo, es una zona menos cálida (Valiente-Banuet et al., 1991). Además, en especies suculentas se ha descrito mayor sobrevivencia de juveniles de reciente establecimiento al este, y existe una mayor distribución de suculentas al norte con respecto a las plantas perennes con las que se asocian en regiones áridas de México (Valiente-Banuet y Ezcurra, 1991). No obstante, en la Reserva de Chamela-Cuixmala se encontró que el crecimiento de los individuos juveniles de A. adstringens no es diferente en una orientación sur y norte (Fernández, 2014).
Los individuos de A. adstringens que mostraron marcas de extracción de corteza fueron pocos, y éstos se encontraron en Guerrero, Puebla y en el cañón el Sabino en Oaxaca. En general, encontramos que los individuos que presentaron marcas de extracción principalmente fueron los individuos de mayores tamaños, lo que nos indica que al parecer existe una extracción selectiva de la corteza. El sitio que presentó mayor porcentaje de individuos con marcas de extracción de corteza fue Cuambio, y es el sitio que presenta menor número de individuos adultos con respecto a los otros sitios estudiados.
Durante la toma de datos en Cuambio se observó que los sitios con individuos de A. adstringens son parches de vegetación rodeados de parcelas dedicadas a la agricultura y ganadería, y Guerrero es uno de los estados que presenta mayor velocidad de degradación de la vegetación natural primaria (2.46 % anual; Semarnat, 2016). Por el contrario, en los sitios de Morelos no se encontraron árboles con marcas de extracción, pero es el sitio con menor cantidad de individuos, Tlayecac se encuentra rodeado de parcelas dedicadas a la agricultura y a la ganadería y Tlayca se encuentra sometido al pastoreo y al turismo; además, Morelos también es uno de los estados con mayor velocidad de degradación de vegetación primaria (1.26 % anual; Semarnat, 2016).
A pesar de que se ha descrito una elevada demanda de la corteza de esta especie para venta (Solares et al., 2012), la extracción de corteza en Cuambio, en el cañón el Sabino y en Coxcatlán se ha indicado de manera informal por los pobladores de estos sitios, que la especie solamente es utilizada por personas de las comunidades cercanas, es decir, es aprovechada localmente y la extracción no es con fines comerciales, al menos por parte de los pobladores. Esta información coincide con un trabajo previo en la comunidad de San Rafael, dentro del municipio de Coxcatlán (Dávila y Lira-Saade, 2002).
Finalmente, los resultados de este trabajo complementan estudios anteriores desde una perspectiva poblacional y confirman que A. adstringens es una especie en alto riesgo, tanto por sus características ecológicas y socioeconómicas (Beltrán-Rodríguez et al., 2017, 2018), como por las características antrópicas de las poblaciones naturales. El tamaño poblacional, particularmente en sitios con poblaciones pequeñas, se podría incrementar con ayuda de planes de manejo y reforestación. Las estructuras poblacionales en declive coincidieron en una baja densidad de individuos pre-reproductivos como se esperaba, por lo que es importante analizar los factores y procesos que causan esto en diferentes poblaciones a lo largo de la distribución de la especie, e intentar cambiar dicho patrón hasta establecer poblaciones en crecimiento.
Los resultados obtenidos sobre el sitio de establecimiento de A. astringens contribuyen al conocimiento de la especie, pero también pueden dar la pauta para la investigación sobre el crecimiento de los individuos. El patrón de distribución espacial agregado y azaroso y la falta de diferencias entre los individuos establecidos a cielo abierto y los que se establecen bajo otras plantas, sugieren que es posible realizar plantaciones en sitios perturbados aprovechando tanto la vegetación remanente como los sitios abiertos. Por otro lado, la evidencia de extracción de corteza en árboles de talla grande podría indicar la aplicación del conocimiento local por parte de los pobladores en los sitios de estudio, sin embargo, es necesario un estudio etnobotánico para evaluar la sostenibilidad de esta práctica. No obstante, en algunos puntos de su distribución, la extracción elevada con fines comerciales (Anzures et al., 2006; Beltrán-Rodríguez et al., 2017; Casas, Lira et al., 2016; Solares et al., 2012) puede poner en riesgo a la especie, como ha ocurrido con algunas otras del género Bursera que han sido sobre explotadas para la obtención de combustibles, aceites esenciales, medicinas locales, y en la elaboración de artesanías, con una evidente disminución en sus poblaciones (dos Santos, 2017; Hersch, 2009; Weeks y Tye, 2009).
Agradecimientos
El trabajo fue financiado por el proyecto FESI-DIP-PAPCA-2016-4 de MF Ramos-Ordoñez y AM Contreras-González. Martín López, Carlos Verdía, Julio Segundo, Iraís Duque Díaz, Antonio Ferrer y Leobardo Ramos ayudaron en la obtención de permisos en las localidades y en la recolecta de datos. MC Arizmendi y dos revisores anónimos revisaron el manuscrito.
Referencias
Albino-García, C., Cervantes-López, H. M., Ríos-Casanova, L. y Lira, R. (2011). Patrones de diversidad y aspectos etnobotánicos de las plantas arvenses del valle de Tehuacán-Cuicatlán: el caso de San Rafael, municipio de Coxcatlán, Puebla. Revista Mexicana de Biodiversidad, 82, 1005–1019. http://dx.doi.org/10.22201/ib.20078706e.2011.3.719
Anzures, V. E., Boyás, D. J. C, Martínez, T. J. I. Monroy, M. R., Solares, A. F. y Torres G. M. G. (2004). Uso de la biodiversidad. En T. Contreras-MacBeath, J.C. Boyás y F. Jaramillo (Eds.), La diversidad biológica en Morelos: estudio del estado (pp 59–78). México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/ Universidad Autónoma del Estado de Morelos.
Arriaga, L., Maya, Y., Diaz, S. y Cancino, J. (1993). Association between cacti and nurse perennials in a heterogeneous tropical dry forest in northwestern Mexico. Journal of Vegetation Science, 4, 349–356. https://doi.org/10.2307/3235593
Azcón-Bieto, J. y Talón, M. 2008. Fundamentos de fisiología vegetal, 2da edición. Madrid: McGraw-Hill Interamericana.
Balvanera, P., Quijas, S. y Pérez-Jiménez, A. (2011). Distribution patterns of tropical dry forest trees along a mesoscale water availability gradient. Biotropica, 43, 414–422. https://doi.org/10.1111/j.1744-7429.2010.00712.x
Begon, M., Townsend, C. N. y Harper, J. L. (2006). Ecology from individuals to ecosystems, 4th. Edición. Londres: Blackwell publishing.
Beltrán, R. L. A. (2018). Estructura, dinámica poblacional y regeneración del leño de Amphipterygium adstringens (Anacardiaceae) en el Ejido el Limón, Morelos, México (Tesis de doctorado). Institución de Enseñanza e Investigación en Ciencias Agrícolas, Campus Montecillo. Colegio de Posgraduados, Texcoco, Estado de México.
Beltrán-Rodríguez, L., Manzo-Ramos, F., Maldonado-Almanza, B., Martínez-Ballesté, A. y Blancas, J. (2017). Wild medicinal species traded in the Balsas Basin, Mexico: risk analysis and recommendations for their conservation. Journal of Ethnobiology, 37, 743–764. https://doi.org/10.2993/0278-0771-37.4.743
Beltrán-Rodríguez, L., Valdez-Hernández, J. I., Luna-Cavazos, M., Romero-Manzanares, A., Pineda-Herrera, E., Maldonado-Almanza, B. et al. (2018). Estructura y diversidad arbórea de bosques tropicales caducifolios secundarios en la Reserva de la Biósfera Sierra de Huautla, Morelos. Revista Mexicana de Biodiversidad, 89, 108–122. https://doi.org/10.22201/ib.20078706e.2018.1.2004
Beltrán-Rodríguez, L., Valdez-Hernández, J. I., Saynes-Vásquez, A., Blancas, J., Sierra-Huelsz, J. A., Cristians, S. et al. (2021). Sustaining medicinal barks: survival and bark regeneration of Amphipterygium adstringens (Anacardiaceae), a tropical tree under experimental debarking. Sustainability, 13, 2860. https://doi.org/10.3390/su13052860
Bertol, I., Lemos, M. E., Guadagnin, J. C., Vedana, Z. A. L. y Carrafa, M. R. (2003). Nutrient losses by water erosion. Scientia Agricola, 60, 581–586.
Borrelli, P. y Oliva G. (2001). Efectos del ganado sobre los pastizales. En P. Borrelli y G. Oliva (Eds.), Ganadería sustentable en la Patagonia Austral (pp. 99–128). Santa Cruz: INTA Centro Regional Patagonia Sur.
Brienen, R. J., Schöngart, J. y Zuidema, P. A. (2016). Tree rings in the tropics: insights into the ecology and climate sensitivity of tropical trees. En G. Goldstein y L. Santiago (Eds.), Tropical Tree Physiology (pp. 439–461). Dordrecht: Springer. https://doi.org/10.1007/978-3-319-27422-5_20
Calderón-Cortés, N., Uribe-Mú, C. A., Martínez-Méndez, A. K., Escalera-Vázquez, L. H., Cristobal-Pérez, E. J., García-Oliva, F. et al. (2016). Ecosystem engineering and manipulation of host plant tissues by the insect borer Oncideres albomarginata chamela. Journal of Insect Physiology, 84, 128–136. https://doi.org/10.1016/j.jinsphys.2015.10.008
Callaway, R. M. (2007). Positive interactions and interdependence in plant communities. Dordrecht: Springer. https://doi.org/10.1007/978-1-4020-6224-7
Casas, A., Blancas, J. y Lira, R. (2016). Mexican ethnobotany: interactions of people and plants in Mesoamerica. En R. Lira, A. Casas y J. Blancas (Eds.), Ethnobotany of Mexico. Interactions of people and plants in Mesoamerica (pp. 1–19). New York: Springer. https://doi.org/10.1007/978-1-4614-6669-7_1
Casas, A., Lira, R., Torres, I., Delgado, A., Moreno-Calles, A. I. et al. (2016). Ethnobotany for sustainable ecosystem management: a regional perspective in the Tehuacán Valley. En R. Lira, A. Casas y J. Blancas (Eds.), Ethnobotany of Mexico. Interactions of people and plants in Mesoamerica (pp. 179–206). New York: Springer. https://doi.org/10.1007/978-1-4614-6669-7_8
Caswell, H. (1986). Life cycle models for plants. Lectures on Mathematics in the Life Sciences, 18, 171–233.
Ceccon, E., Huante, P. y Rincón, E. (2006). Abiotic factors regeneration influencing tropical dry forest regeneration. Brazilian Archives of Biology and Technology, 49, 305–312.
Cerón, A. A. C. (2015). Interacciones ecológicas asociadas a la formación de parches de vegetación por Mimosa luisana y otras leguminosas en Zapotitlán, Puebla, Méxco (Tesis). Facultad de Ciencias, UNAM. México D.F.
CICESE (Centro de Investigación Científica y de Educación Superior de Ensenada). (2017). Compuestos diarios en malla del CLICOM. Centro de Investigación Científica y de Educación Superior de Ensenada, Baja California. Recuperado el 10 noviembre, 2017 de http://clicom-mex.cicese.mx/malla
Conanp (Comisión Nacional de Áreas Naturales Protegidas). (2021). Listado de las Áreas Naturales Protegidas de México (LISTANP). Recuperado el 23 abril, 2021 de http://sig.conanp.gob.mx/website/pagsig/listanp/
Condit, R., Ashton, P. S., Baker, P., Bunyavejchewin, S., Gunatilleke, S., Gunatilleke, N. et al. (2000). Spatial patterns in the distribution of tropical tree species. Science, 288, 1414–1418. https://doi.org/10.1126/science.288.5470.1414
Contreras, G. A. M. (2015). Efecto de las interacciones bióticas en algunos aspectos de la biología reproductiva del cactus Neobuxbaumia tetetzo en un bosque tropical caducifolio (Tesis de doctorado). Facultad de Estudios Superiores Iztacala, UNAM. México D.F.
Contreras-González, A. M., Rivera-Ortíz, F. A., Soberanes-González, C. A., Valiente-Banuet, A. y Arizmendi, M. C. (2009). Feeding ecology of the Military macaw (Ara militaris) in a semi-arid region of central México. Wilson Journal Ornithology, 121, 384–391.
Cortés-Flores, J., Hernández-Esquivel, K., González-Rodríguez, A. e Ibarra-Manríquez, G. (2017). Flowering phenology, growth forms, and pollination syndromes in tropical dry forest species: Influence of phylogeny and abiotic factors. American Journal of Botany, 104, 39–49. https://doi.org/10.3732/ajb.1600305
Cuevas, F. X. M. (2005). A revision of the genus Amphipterygium (Julianiaceae). Ibugana, Boletín del Instituto de Botánica, 13, 27–47.
Dalmagro, A. D. y Vieira, E. M. (2005). Patterns of habitat utilization of small rodents in an area of Araucaria forest in Southern Brazil. Austral Ecology, 30, 353–362. https://doi.org/10.1111/j.1442-9993.2005.01447.x
Dávila-Aranda, P. y Lira-Saade, R. (2002). La flora útil de dos comunidades indígenas del Valle de Tehuacán-Cuicatlán: Coxcatlán y Zapotitlán de las Salinas, Puebla. Universidad Nacional Autónoma de México. Facultad de Estudios Superiores Iztacala. Informe final SNIB-CONABIO proyecto No. T015. México D.F.
DOF. (Diario Oficial de la Federecaión). (2019). Modificación del Anexo Normativo III, Lista de especies en riesgo de la Norma Oficial Mexicana NOM-059-SEMARNAT-2010. Diario Oficial de la Federación, Secretaría de Gobernación, México. Recuperado el 15 diciembre, 2019 de: https://www.dof.gob.mx/nota_detalle.php?codigo=5578808&fecha=14/11/2019
dos Santos, S., Albuqueque, U. P., Borda, N. A. L., Santoro, F. R., Torres-Avilés, W. M., Paiva, L. R. F. et al. (2017). Temporal evaluation of the Conservation Priority Index for medicinal plants. Acta Botanica Brasilica, 31, 169–179. https://doi.org/10.1590/0102-33062017abb0027
Elzinga, C. L., Salzer, D. W., Willoughby, J. W. y Gibbs, J. P. (2009). Monitoring plant and animal populations: a handbook for field biologists. Malden MA: Blackwell Science.
Eshete, A., Sterck, F. y Bongers, F. (2011). Diversity and production of Ethiopian dry woodlands explained by climate-and soil-stress gradients. Forest Ecology and Management, 261, 1499–1509. https://doi.org/10.1016/j.foreco.2011.01.021
Fernández, M. T. Y. (2014). Efecto del microclima en el crecimiento y supervivencia del cuachalalate Amphipterygium adstringens Schiede (Tesis). Facultad de Ciencias, UNAM. México D.F.
Flores, A. D. (2018a). Interacción planta-animal de Notocitellus adocetus (Sciuridae) con algunas especies de bosque tropical caducifolio y zonas de cultivo de Zirándaro de los Chávez, Guerrero (Tesis). Facultad de Estudios Superiores Iztacala, UNAM. Tlalnepantla, Estado de México.
Flores, S. L. R. (2018b). Estructura de la comunidad de aves en un bosque tropical caducifolio del estado de Morelos (Tesis). Facultad de Estudios Superiores Iztacala, UNAM. Tlalnepantla, Estado de México.
Flores-Alta, D., Rivera-Ortiz, F. A. y Contreras-González, A. M. (2019). Record of a population and description of some aspects of the life history of Notocitellus adocetus in the north of the state of Guerrero, Mexico. Mastozoología Neotropical, 26, 175–181. https://doi.org/10.31687/saremMN.19.26.1.0.02
Fortin, M. J. y Dale, M. R. (2005). Spatial analysis: a guide for ecologists. New York: Cambridge University Press.
García, C. F. y Collazo, O. M. (2013). Crecimiento, desarrollo y morfogénesis. En G. J. Márquez, O. M. Collazo, G. M. Martínez, S. A. Orozco y S. S. Vázquez (Eds.), Biología de angiospermas (pp. 181–184). México D.F.: Facultad de Ciencias, Coordinación de la Investigación Científica, UNAM.
García-Chávez, J. H., Montaña, C., Perroni, Y., Sosa, V. J. y García-Licona, J. B. (2014). The relative importance of solar radiation and soil origin in cactus seedling survivorship at two spatial scales: Plant association and microhabitat. Journal of Vegetation Science, 25, 668–680. https://doi.org/10.1111/jvs.12139
García-González, A., Riverón-Giró, F. B., González-Ramírez, I. S., Domenech, R. Y. E., Montero, Y. H. y Verdecia, E. P. (2016). Características poblacionales y ecología del endemismo cubano Melocactus nagyi (Cactaceae), en la Reserva Florística Manejada El Macío, Cuba. Revista Cubana de Ciencias Biológicas, 5, 33–42.
García-Ibáñez, S., Flores-Rodríguez, P., Flores-Garza, R. y Valdés-González, A. (2007). Dispersión espacial de Plicopurpura patula pansa en playas rocosas del estado de Guerrero, México. Revista Mexicana de Biodiversidad, 78, 15–21. http://dx.doi.org/10.22201/ib.20078706e.2007.002.300
Godinez-Manriquez, A. D. y Contreras-González, A. M. (2018). Especies de plantas perennes importantes para los cactus de una selva baja caducifolia del centro de México. Acta Fitogenética, 5, 255.
Gonzalez, L. T. G. (2019). Parámetros poblacionales de Bursera en una selva baja de Coxcatlán Puebla, México (Tesis). Facultad de Estudios Superiores Iztacala, UNAM. Estado de México.
González, M. F. (2012). Las zonas áridas de México y su vegetación. México D.F.: Instituto Nacional de Ecología (INE-Semarnat).
González, M. F. (2013). Tipos de vegetación de México. En G. J. Márquez, O. M. Collazo, G. M. Martínez, S. A. Orozco y S. S. Vázquez (Eds.), Biología de angiospermas (pp. 478–487). México D.F.: Facultad de Ciencias, Coordinación de la Investigación Científica, UNAM.
Groenendijk, P., Eshete, A., Sterck, F. J., Zuidema, P. A. y Bongers, F. (2012). Limitations to sustainable frankincense production: Blocked regeneration, high adult mortality and declining populations. Journal of Applied Ecology, 49, 164–173. https://doi.org/10.1111/j.1365-2664.2011.02078.x
Guzmán-Pozos, A. M. y Cruz-Cruz, E. (2014). Características físicas de frutos de cuachalalate (Amphipterygium adstringens (Schltdl.) Standl) de tres procedencias. Revista Fitotecnia Mexicana, 37, 255–260.
Hammer, O., Harper, D. A. T. y Ryan, P. D. (2001). PAST: Paleontological statistics software package for education and data analysis. Paleontologia Electrónica, 4, 9.
Hernández, A. (2017). Estructura de la comunidad vegetal de cuatro zonas de selva baja caducifolia sujetas a disturbio en el ejido de San José Tilapa, Coxcatlán Puebla (México) (Tesis). Facultad de Estudios Superiores Iztacala, UNAM. Tlalnepantla, Estado de México.
Hernández, G. A. (2018). Destino de las semillas de Bursera cuneata en la REPSA, Ciudad de México (Tesis). Facultad de Estudios Superiores Iztacala, UNAM. Estado de México.
Hernández, C. O. D. y Ramos-Ordoñez, M. F. (2018). Estructura de edades de Bursera en dos comunidades de Aquila, Michoacán. Acta Fitogenética, 5, 276.
Hernández-Apolinar, M., Valverde, T. y Purata, S. (2006). Demography of Bursera glabrifolia, a tropical tree used for folk woodcrafting in Southern Mexico: an evaluation of its management plan. Forest Ecology and Management, 223, 139–151. https://doi.org/10.1016/j.foreco.2005.10.072
Herrera, C. J., Chay, C. A. J., Casanova, L. F., Piñeiro, V. A. T., Márquez, B. L., Santillán, F. E. et al. (2018). Avances de la investigación sobre producción animal y seguridad alimentaria en México. Universidad Michoacana de San Nicolás de Hidalgo. Morelia, Michoacán, México.
Hersch, M. P. (2009). Perspectivas de la producción de linaloe. Estado del desarrollo económico y social de los pueblos indígenas de Guerrero, Programa Universitario México Nación Multicultural de la UNAM. Recuperado el 6 de mayo, 2021 de https://www.nacionmulticultural.unam.mx/edespig/diagnostico_y_perspectivas/RECUADROS/CAPITULO%204/2%20Perspectivas%20de%20la%20produccion%20de%20linaloe.pdf
Howe, H. F. y Smallwood, J. (1982). Ecology of seed dispersal. Annual Review of Ecology and Systematics, 13, 201–228. https://doi.org/10.1146/annurev.es.13.110182.001221
Hubbell, S. P. (1979). Tree dispersion, abundance, and diversity in a tropical dry forest: That tropical trees are clumped, not spaced, alters conceptions of the organization and dynamics. Science, 203, 1299–1309. https://doi.org/10.1126/science.203.4387.1299
Jie, C., Jing-zhang, C., Man-zhi, T. y Zi-tong, G. (2002). Soil degradation: a global problem endangering sustainable development. Journal of Geographical Sciences, 12, 243–252. https://doi.org/10.1007/BF02837480
Jiménez-Arcos, V. H., Santa Cruz-Padilla, S. A., Escalona-López, A., Arizmendi, M. C. y Vázquez, L. (2012). Ampliación de la distribución y presencia de una colonia reproductiva de la guacamaya verde (Ara militaris) en el alto Balsas de Guerrero, México. Revista Mexicana de Biodiversidad, 83, 864–867. https://doi.org/10.7550/rmb.27460
Johnson, D. J., Condit, R., Hubbell, S. P. y Comita, L. S. (2017). Abiotic niche partitioning and negative density dependence drive tree seedling survival in a tropical forest. Proceedings of the Royal Society B: Biological Sciences, 284, 1–8. https://doi.org/10.1098/rspb.2017.2210
Jordano, P., Pulido, F., Arroyo, J., García-Castaño, J. L. y García-Fayos, P. (2008). Procesos de limitación demográfica. En F. Valladares (Ed.), Ecología del bosque mediterráneo en un mundo cambiante (pp. 229–248). Madrid: Ministerio de Medio Ambiente/ EGRAF, S.A,
Judd, W. S., Campbell, C. S., Kellogg, E. A., Stevens, P. F. y Donoghue, M. J. (2002). Plant Systematics: a phylogenetic approach. Sunderland, MA: Sinauer.
Khurana, E. y Singh, J. S. (2004). Germination and seedling growth of five tree species from tropical dry forest in relation to water stress: Impact of seed size. Journal of Tropical Ecology, 20, 385–396. https://doi.org/10.1017/S026646740400135X
Komarov, A. S., Palenova, M. M. y Smirnova, O. V. (2003). The concept of discrete description of plant ontogenesis and cellular automata models of plant populations. Ecological Modelling, 170, 427–439. https://doi.org/10.1016/S0304-3800(03)00243-6
Krebs, C. J. (1999). Ecological methodology. New York: Harper & Row.
Krebs, C. J. (2009). Ecology: the experimental analysis of distribution and abundance, 6a Edición. San Francisco: Benjamin Cummings.
Krebs, C. y Elwood, B. (2008). The ecological world view. Los Angeles: University of California Press.
Lieberman, D. y Li, M. (1992). Seedling recruitment patterns in a tropical dry forest in Ghana. Journal of Vegetation Science, 3, 375–382. https://doi.org/10.2307/3235763
Lira, S. R. y Blanckaert, I. (2006). Estudio etnobotánico de las malezas útiles presentes en diferentes agroecosistemas en el municipio de Santa María Tecomavaca, Valle de Tehuacán-Cuicatlán, México. Universidad Nacional Autónoma de México. Informe final SNIB-CONABIO proyecto No. BE010. México D.F.
López-Martínez, V., Vargas, O. R., Alia-Tejacal, I., Toledo-Hernández, V. H., Corona-López, A. M., Delfín-González, H. et al. (2015). Xylophagous Beetles (Coleoptera: Buprestidae and Cerambycidae) from Ficus carica L. (Moraceae) in Morelos, Mexico. The Coleopterists Bulletin, 69, 780–788. https://doi.org/10.1649/0010-065X-69.4.780
Luis, S. M. Y. (2017). Estructura de la vegetación arbórea en la microcuenca del Río Yerba Santa en la costa de Oaxaca (Tesis). Universidad del Mar, Campus Puerto Escondido Oaxaca.
Luna-Nieves, A. L., Meave, J. A., Morellato, L. P. C. e Ibarra-Manríquez, G. (2017). Reproductive phenology of useful seasonally dry tropical Forest trees: Guiding patterns for seed collection and plant propagation in nurseries. Forest Ecology and Management, 393, 52–62. https://doi.org/10.1016/j.foreco.2017.03.014
Maass, M. y Burgos, A. (2011). Water dynamics at the ecosystem level in seasonally dry tropical forests. En R. Dirzo, H. S. Young, H. A. Mooney y G. Ceballos (Eds.), Seasonally Dry Tropical Forests (pp. 141–157). Washington, D.C.: Island Press. https://doi.org/10.5822/978-1-61091-021-7_9
Maldonado, B., Caballero, J., Delgado-Salinas, A. y Lira, R. (2013). Relationship between use value and ecological importance of floristic resources of seasonally dry tropical forest in the Balsas River Basin, México. Economic Botany, 67, 17–29. https://doi.org/10.1007/s12231-013-9222-y
Marín, G. C., Tigabu, M., Rivas, B. G. y Odén, P. C. (2009). Natural regeneration dynamics of three dry deciduous
forest species in Chacocente Wildlife Reserve, Nicaragua. Journal of Forestry Research, 20, 1–6. https://doi.org/10.
1007/s11676-009-0001-7
Martínez, P. A. (2011). Usos, importancia y abundancia relativa de especies vegetales silvestres en la Mixteca Poblana, México (Tesis de Maestría en Ciencias). Colegio de Postgraduados. Puebla, Puebla.
Martínez, S. E., Samain, M. S. y Fuentes, A. C. D. (2020). Amphipterygium adstringens. The IUCN Red List of Threatened Species 2020: e.T136749685A137375999. Recuperado el 06 febrero, 2021 de https://dx.doi.org/10.2305/IUCN.UK.2020-1.RLTS.T136749685A137375999.en
Méndez, M., Dorantes, A., Dzib, G., Argáez, J. y Durán, R. (2006). Germinación y establecimiento de plántulas de Pterocereus gaumeri, una cactácea columnar, rara y endémica de Yucatán, México. Botanical Sciences, 79, 33–41.
Méndez-Toribio, M., Martínez-Cruz, J., Cortés-Flores, J., Rendón-Sandoval, F. J. e Ibarra-Manríquez, G. (2014). Composición, estructura y diversidad de la comunidad arbórea del bosque tropical caducifolio en Tziritzícuaro, Depresión del Balsas, Michoacán, México. Revista Mexicana de Biodiversidad, 85, 1117–1128. https://doi.org/10.7550/rmb.43457
Messenguer, G. J. V. (2013). Periódico Oficial, tierra y libertad. Recuperado el 25 de abril, 2021 de https://periodico.morelos.gob.mx/periodicos/2013/5128_3A.pdf
Mollers, M. C. (2008). Ecology: concepts and applications, 4th Ed. New York: McGraw Hill.
Montesinos-Navarro, A., Valiente-Banuet, A. y Verdú, M. (2019). Plant facilitation through mycorrhizal symbiosis is stronger between distantly related plant species. New Phytologist, 224, 928–935. https://doi.org/10.1111/nph.16051
Mooney, H. A., Bullock, S. H. y Medina, E. (2009). Introduction. En S. H. Bullock, H. A. Mooney, and E. Medina (Eds.), Seasonally dry tropical forest. (pp. 1–8). Cambridge University Press.
Morisita, M. (1959). Measuring of the dispersion of individuals and analysis of the distributional patterns. Memoirs of the Faculty of Science, Kyushu University, Series E (Biology), 2, 215–235.
Ortega, D. E. y Collazo, O. M. (2013). Absorción y ascenso del agua. En G. J. Márquez, O. M. Collazo, G. M. Martínez, S. A. Orozco y S. S. Vázquez (Eds.), Biología de angiospermas (pp. 254–259). México D.F.: Facultad de Ciencias, Coordinación de la Investigación Científica, UNAM.
Osorio-García, A., Macías-López, A., Tornero-Campante, M. A., Loera-Martínez, J. y Garza-Bueno, L. E. (2018). Canales y márgenes de comercialización de la corteza de cuachalalate (Amphipterygium adstringens Schiede ex Schlecht.) en la ciudad de Puebla y área conurbada. Agroproductividad, 11, 111–119.
Paredes-Villanueva, K., Sánchez-Salguero, R., Manzanedo, R. D., Sopepi, R. Q., Palacios, G. y Navarro-Cerrillo, R. M. (2013). Growth rate and climatic response of Machaerium scleroxylon in a dry tropical forest in southeastern Santa Cruz, Bolivia. Tree-Ring Research, 69, 63–79. https://doi.org/10.3959/1536-1098-69.2.63
Ponce, G. O. O. (2013). Efecto de la fragmentación del bosque tropical caducifolio sobre la estructura poblacional y éxito reproductivo de Bursera fagaroides y B. palmeri (Tesis). Facultad de Ciencias Naturales, Universidad Autónoma de Querétaro. Santiago de Querétaro, Querétaro, México.
Rahman, M., Nishat, A. y Vacik, H. (2009). Anthropogenic disturbances and plant diversity of the Madhupur Sal forests (Shorea robusta CF Gaertn) of Bangladesh. International Journal of Biodiversity Science & Management, 5, 162–173. https://doi.org/10.1080/17451590903236741
Rincón, E. y Huante, P. (1993). Growth responses of tropical deciduous tree seedlings to contrasting light conditions. Trees, 7, 202–207. https://doi.org/10.1007/BF00202074
Rivera-Ortíz, F. A., Contreras-González, A. M., Soberanes-González, C. A., Valiente-Banuet, A. y Arizmendi, M. C. (2008). Seasonal abundance and breeding chronology of the Military Macaw (Ara militaris) in a semi-arid region of central Mexico. Ornitología Neotropical, 19, 255–263.
Rivera-Ortíz, F. A., Oyama, K., Ríos-Muñoz, C. A., Solórzano, S., Navarro-Sigüenza, A. G. y Arizmendi, M. C. (2013). Habitat characterization and modeling of the potential distribution of the Military Macaw (Ara militaris) in Mexico. Revista Mexicana de Biodiversidad, 84, 1200–1215. https://doi.org/10.7550/rmb.34953
Ruiz, N. N. C. (2007). Interacciones ecológicas entre cactáceas columnares y plantas perennes a lo largo de un gradiente de estrés (Tesis de maestría). Instituto de Ecología, UNAM. México D.F.
Sánchez, H. M. Á., Fierros, G. A. M., Velázquez, M. A., De los Santos, P. H. M., Aldrete, A. y Cortés, D. E. (2018). Estructura, riqueza y diversidad de especies de árboles en un bosque tropical caducifolio de Morelos. Revista Mexicana de Ciencias Forestales, 9, 131–156.
Sapkota, I. P., Tigabu, M. y Odén, P. C. (2009). Spatial distribution, advanced regeneration and stand structure of Nepalese Sal (Shorea robusta) forests subject to disturbances of different intensities. Forest Ecology and Management, 257, 1966–1975. https://doi.org/10.1016/j.foreco.2009.02.008
Schleicher, J., Meyer, K. M., Wiegand, K., Schurr, F. M. y Ward, D. (2011). Disentangling facilitation and seed dispersal from environmental heterogeneity as mechanisms generating associations between savanna plants. Journal of Vegetation Science, 22, 1038–1048. https://doi.org/10.1111/j.1654-1103.2011.01310.x
Segundo-Hernández, J. y Ramos-Ordoñez, M. F. (2016). Dinámica poblacional de Bursera en un bosque tropical seco de Morelos. Memorias del XX Congreso Mexicano de Botánica. Ciudad de México. Sociedad Mexicana de Botánica.
Semarnat (Secretaría de Medio Ambiente y Recursos Naturales). (2016). Informe de la situación del medio ambiente en México. Compendio de estadísticas ambientales. Indicadores clave, de desempeño ambiental y de crecimiento verde 2015. México D.F.: Secretaría de Medio Ambiente y Recursos Naturales.
Serrano, R. I. (2018). Diferenciación de los sistemas vascular y de defensa en plántulas del género Bursera (Burseraceae) (Tesis). Facultad de Estudios Superiores Iztacala, UNAM. Estado de México, México.
Serrano-Rosas, I., González-López, T. G. y Ramos-Ordoñez, M. F. (2018). Densidad y estructura de edades de Bursera en dos sitios con diferente grado de perturbación en la Región del Bajío. Acta Fitogenética, 5, 265.
Sheskin, D. J. (2011). Handbook of parametric and nonparametric statistical procedures. New York: CRC Press.
Smith, T. M. y Smith, R. L. (2007) Ecología, 6ª edición. Madrid: Pearson Educación S.A.
Smith-Gill, S. J. (1975). Cytophysiological basis of disruptive pigmentary patterns in the leopard frog, Rana pipiens. II. Wild type and mutant cell specific patterns. Journal of Morphology, 146, 35–54. https://doi.org/10.1002/jmor.1051460103
Solares, A. F. y Gálvez, C. M. C. (2002). Manual para una producción sustentable de corteza de cuachalalate (Amphipterygium adstringens Schiede ex Schlecht). Sagarpa. Inifap. Publicación especial Núm. 34. C. E. Zacatepec, Mor., México.
Solares, A. F., Jasso-Mata, J., Vargas-Hernández, J., Soto Hernández, M. y Rodríguez-Franco, C. (2006). Capacidad de regeneración en grosor y lateral en corteza de cuachalalate (Amphipterygium adstringens Schiede ex Schlecht) en el estado de Morelos. Ra Ximhai, 2, 481–495.
Solares, A. F., Vázquez-Alvarado, J. M. P. y Gálvez-Cortés, M. (2012). Canales de comercialización de la corteza de cuachalalate (Amphipterigium adstringens Schiede ex Schlecht.) en México. Revista Mexicana de Ciencias Forestales, 3, 29–42.
Sousa, D. G. D. y Cunha, H. F. D. (2018). Population structure, spatial distribution and phenology of Anacardium humile A. St.-Hil. (Anacardiaceae) in cerrado stricto sensu. Hoehnea, 45, 450–467. https://doi.org/10.1590/2236-8906-81/2017
Tolera, M., Sass-Klaassen, U., Eshete, A., Bongers, F. y Sterck, F. J. (2013). Frankincense tree recruitment failed over the past half century. Forest Ecology and Management, 304, 65–72. https://doi.org/10.1016/j.foreco.2013.04.036
Trejo, V. R. I. (1998). Distribución y diversidad de selvas bajas de México: relaciones con el clima y el suelo (Tesis de doctorado). Facultad de Ciencias, UNAM. México. D.F.
Valiente-Banuet, A., Bolongaro-Crevenna, A., Briones, O., Ezcurra, E., Rosas, M., Núñez, H. et al. (1991). Spatial relationships between cacti and nurse shrubs in a semi-arid environment in central Mexico. Journal of Vegetation Science, 2, 15–20. https://doi.org/10.2307/3235893
Valiente-Banuet, A. y Ezcurra, E. (1991). Shade as a cause of the association between the cactus Neobuxbaumia tetetzo and the nurse-plant Mimosa luisana in the Tehuacan Valley, Mexico. Journal of Ecology, 79, 961–971. https://www.jstor.org/stable/2261091
Valiente-Banuet, A., Ramírez, E., Verdú, E. y Montesinos, A. (2014). Plant community ecology. En M. Benítez, O. Miramontes y A. Valiente-Banuet (Eds.), Frontiers in Ecology, Evolution and Complexity (pp. 12–30). Ciudad de México: EditoraC3 CopIt-arXives.
Valiente-Banuet, A. y Verdú, M. (2007). Facilitation can increase the phylogenetic diversity of plant communities. Ecology Letters, 10, 1029–1036. https://doi.org/10.1111/j.1461-0248.2007.01100.x
Valiente-Banuet, A. y Verdú, M. (2008). Temporal shifts from facilitation to competition occur between closely related taxa. Journal of Ecology, 96, 489–494. https://doi.org/10.1111/j.1365-2745.2008.01357.x
Valiente-Banuet, A. y Verdú, M. (2013). Plant facilitation and phylogenetics. Annual Review of Ecology, Evolution, and Systematics, 44, 347–366. https://doi.org/10.1146/annurev-ecolsys-110512-135855
Vargas-Cardoso, O. R., Corona-López, A. M., López-Martínez, V., Flores-Palacios, A., Figueroa-Brito, R. y Toledo-Hernández, V. H. (2018). New host records of Cerambycidae (Coleoptera) from central Mexico. The Pan-Pacific Entomologist, 94, 91–102. https://doi.org/10.3956/2018-94.2.91
Vázquez, R. L. D. (2007). Descripción de la comunidad de aves de la selva baja caducifolia y su relación con la estructura del hábitat en Santa María Tecomavaca, Oaxaca (Tesis). Facultad de Estudios Superiores Iztacala, UNAM. Tlalnepantla, Estado de México, México.
Verdú, M. y García-Fayos, P. (2002). Ecología reproductiva de Pistacia lentiscus L. (Anacardiaceae): un anacronismo evolutivo en el matorral mediterráneo. Revista Chilena de Historia Natural, 75, 57–65. http://dx.doi.org/10.4067/S0716-078X2002000100006
Villalobos, S. D. (2021). Germinación in situ de Beiselia mexicana (Burseraceae) (Tesis). Facultad de Biología, Universidad Michoacana de San Nicolás de Hidalgo. Michoacán, México.
Wattanachaiyingcharoen, W., Wongsiri, S. y Oldroyd, B. P. (2008). Aggregations of unrelated Apis florea colonies. Apidologie, 39, 531–536. http://dx.doi.org/10.1051/apido:
2008045
Weeks, A. y Tye, A. (2009). Phylogeography of palo santo trees (Bursera graveolens and Bursera malacophylla; Burseraceae) in the Galápagos archipelago. Botanical Journal of the Linnean Society, 161, 396–410. https://doi.org/10.1111/j.1095-8339.2009.01008.x
Worbes, M., Staschel, R., Roloff, A. y Junk, W. J. (2003). Tree ring analysis reveals age structure, dynamics and wood production of a natural forest stand in Cameroon. Forest Ecology and Management, 173, 105–123. https://doi.org/10.1016/S0378-1127(01)00814-3
Zamora, T. P. E. (2003). Evaluación del aprovechamiento potencial del cuachalalate (Amphipterygium adstringens Schiede ex Schlecht) en San Juan Bautista Jayacatlán, Oaxaca (Tesis). Facultad de Ciencias, UNAM. México D.F.