Juan M. Díaz-García a, *, Fabiola López-Barrera b y Eduardo Pineda c
a Universidad Autónoma de Tlaxcala, Centro Tlaxcala de Biología de la Conducta, Km 1.5 Carretera Tlaxcala-Puebla s/n, La Loma Xicoténcatl, 90070 Tlaxcala, Tlaxcala, México
b Instituto de Ecología, A.C., Red de Ecología Funcional, Carretera Antigua a Coatepec Núm. 351, El Haya 91073 Xalapa, Veracruz, México
c Instituto de Ecología, A.C., Red de Biología y Conservación de Vertebrados, Carretera Antigua a Coatepec Núm. 351, El Haya 91073 Xalapa, Veracruz, México
*Autor para correspondencia: juanm.diazgarcia@gmail.com (J.M. Díaz-García)
Recibido: 26 octubre 2022; aceptado: 18 agosto 2023
Resumen
La restauración activa y pasiva son estrategias utilizadas para recuperar paisajes forestales. Pocos estudios han evaluado la recuperación de la fauna comparando diferentes estrategias de restauración de la misma edad en un paisaje tropical. En este estudio comparamos la abundancia y la frecuencia de presencia de los escarabajos carroñeros Nicrophorus olidus y Oxelytrum discicolle, entre un bosque en restauración pasiva de 23 años (RP), un bosque en restauración activa de 23 años (RA), un pastizal ganadero y un bosque de niebla. Analizamos cómo varían las poblaciones de los escarabajos entre temporadas climáticas y examinamos la relación de 10 variables ambientales con la respuesta de los escarabajos. Nicrophorus olidus fue más abundante en RA y O. discicolle en RP. La abundancia de ambas especies varió entre temporadas. La respuesta de N. olidus a la restauración estuvo relacionada con las coberturas del dosel y del helecho Pteridium arachnoideum. La abundancia de O. discicolle no estuvo relacionada con ninguna variable. Cada estrategia de restauración ofrece condiciones ambientales que influyen de manera diferencial en las especies, aun cuando pertenecen al mismo gremio. Destacamos la importancia de restaurar paisajes con estrategias complementarias que contribuyan a recuperar poblaciones de distintas especies.
Palabras clave: Abundancia; Dinámica de poblaciones; Éxito de restauración; Recuperación de fauna
© 2023 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Response of carrion beetles Nicrophorus olidus and Oxelytrum discicolle (Coleoptera: Silphidae) to active and passive restoration in a cloud forest landscape in Mexico
Abstract
Active and passive restoration are strategies used to recover forest landscapes. Few studies have assessed wildlife recovery by comparing different restoration strategies of the same age in a tropical landscape. In this study, we compared the abundance and occurrence frequency of the carrion beetles, Nicrophorus olidus and Oxelytrum discicolle, between a 23-year-old forest under passive restoration (RP), a 23-year-old forest under active restoration (RA), a cattle pasture, and a cloud forest. We analyzed how beetle populations vary between climatic seasons, and examined the relationship of 10 environmental variables to beetle response. Nicrophorus olidus was more abundant in RA and O. discicolle in RP. The abundance of both species varied between seasons. The response of N. olidus to restoration was related to canopy cover and cover of the fern Pteridium arachnoideum. The abundance of O. discicolle was not related to any variable. Each restoration strategy offers environmental conditions that differentially influenced the species, despite the fact they belong to the same guild. We emphasize the importance of restoring landscapes with complementary strategies that contribute to recovering different species populations.
Keywords: Abundance; Population dynamics; Restoration success; Fauna recovery
© 2023 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
La práctica de la restauración forestal se ha incrementado a nivel mundial para ayudar a mitigar la pérdida de la biodiversidad y de los servicios ecosistémicos ocasionada por la destrucción, degradación y fragmentación de los bosques (Gann et al., 2019). Tan sólo en la región tropical, se perdieron 3.6 millones de hectáreas de bosques primarios en 2018 (WRI, 2019). Uno de los grupos de animales más afectados por esta pérdida forestal son los invertebrados terrestres. Se estima que sus poblaciones disminuyen ~ 9% cada década (van Klink et al., 2020). Sin embargo, existe evidencia que indica que la restauración de los bosques tropicales puede tener un papel fundamental en la recuperación de las poblaciones de invertebrados y de sus funciones ecológicas (Crouzeilles et al., 2017;
Meli et al., 2017).
Existen principalmente 2 estrategias de restauración de bosques, la restauración pasiva, que se realiza a partir de procesos de regeneración natural, y la restauración activa, realizada mediante la siembra de plantaciones multiespecíficas con especies nativas (Fagan et al., 2020). Se ha demostrado que cada estrategia de restauración puede generar una estructura del hábitat y condiciones ambientales particulares cuando son implementadas de manera simultánea en el mismo paisaje tropical (Gilman et al., 2016; Lanping et al., 2017; Morrison et al., 2011; Shoo et al., 2016; Suganuma et al., 2014; Trujillo-Miranda et al., 2018), y en consecuencia presentar comunidades animales diferentes (Díaz-García et al., 2020; Smith et al., 2015). Sin embargo, existen pocos estudios sobre cuál estrategia de restauración puede ser más exitosa para recuperar a los invertebrados, debido a que la mayoría de ellos han evaluado la respuesta considerando un solo tipo de estrategia (Majer, 2009). Entre los pocos estudios que han comparado la respuesta de los invertebrados con diferentes estrategias de restauración, se ha encontrado que la diversidad de artrópodos puede ser similar con ambas estrategias (pasiva y activa) después de 8 años de implementación. Sin embargo, con ninguna estrategia de restauración se alcanzó la diversidad registrada en el bosque de referencia (Cole et al., 2016). También existe evidencia que señala que después de 40 años de intervención, la diversidad de artrópodos puede ser mayor en plantaciones nativas que en áreas en regeneración natural (Kattan et al., 2006).
Conocer la respuesta de los invertebrados a los procesos de restauración activa y pasiva es importante debido a que pueden modular la trayectoria de recuperación de la vegetación y el funcionamiento ecosistémico (Catterall, 2018; Cross et al., 2019; Fraser et al., 2015). Por ejemplo, las hormigas, escarabajos, mariposas y abejas desempeñan importantes funciones ecológicas como la polinización, la herbivoría y la depredación de semillas (Dixon, 2009; Lawes et al., 2017; Schwartz y Salisbury, 2018), que influyen en el reclutamiento de plantas leñosas (Catterall, 2018). Por su parte, los escarabajos estrictamente carroñeros de la familia Silphidae podrían contribuir a restablecer el reciclaje de nutrientes en las áreas en restauración, debido a que son el grupo de escarabajos de mayor relevancia en la descomposición de la materia orgánica de origen animal (Naranjo-López y Navarrete-Heredia, 2011; Pérez-Villamares et al., 2016; Ratcliffe, 1996).
En los bosques tropicales de México habitan 11 especies de escarabajos sílfidos que se alimentan estrictamente de carroña (Navarrete-Heredia, 2009). En bosques de niebla, bosques caducifolios y bosques de pino-encino del país, las especies carroñeras Nicrophorus olidus y Oxelytrum discicolle viven en simpatría (Halffter et al., 1995; Quiroz-Rocha et al., 2008; Trevilla-Rebollar et al., 2010). Oxelytrum discicolle es de origen neotropical y se distribuye desde el nivel del mar hasta los 3,000 m snm en zonas perturbadas (Peck y Anderson, 1985), semiáridas y bosques (Carvalho et al., 2000; Navarrete-Heredia, 1995). Por lo general, O. discicolle se alimenta y ovoposita alrededor de cadáveres grandes, debido a que sus larvas obtienen alimento aun cuando la carroña ha sido explotada por larvas de moscas, las cuales tienen un período de eclosión más rápido que las larvas del escarabajo (Anderson, 1982). Por su parte, N. olidus es de origen neártico y se distribuye entre los 300 y 3,000 m snm, en bosques conservados y poco perturbados (Navarrete-Heredia, 1995; Peck y Anderson, 1985). Esta especie se alimenta, principalmente, de cadáveres pequeños que entierra en el suelo o en la hojarasca. Para su reproducción, N. olidus deposita y cuida sus huevecillos en una galería lateral al cadáver enterrado, una vez que eclosionan las larvas se dirigen hacia la carroña para alimentarse. N. olidus evita la competencia con las moscas al alimentarse de sus larvas y, al mismo tiempo, transporta en su cuerpo ácaros que también depredan a las larvas de moscas (Anderson, 1982).
A pesar de encontrarse en los mismos paisajes tropicales, ambas especies cuentan con un desplazamiento temporal y/o espacial definido: cuando N. olidus es abundante, las poblaciones de O. discicolle disminuyen y viceversa. En el centro de México, O. discicolle puede ser más abundante durante la etapa final de la época seca (mayo), mientras que N. olidus puede ser más abundante a partir del comienzo de la época lluviosa (junio-julio; Arellano et al., 2005; Naranjo-López y Navarrete-Heredia, 2011; Pérez-Villamares et al., 2016). Esta dinámica poblacional y la diferencia en rasgos ecológicos entre ambas especies podrían tener un papel importante en su respuesta a la modificación de los hábitats (Arellano et al., 2005; Rivera-Cervantes y García-Real, 1998), como los cambios en la estructura de la vegetación generados por las estrategias de restauración forestal a partir de pastizales ganaderos.
La diversidad de escarabajos asociados a la carroña es necesaria para conservar sus contribuciones al funcionamiento de los bosques, por lo tanto, los factores que influyen en el mantenimiento de sus poblaciones necesitan ser identificados (von Hoermann et al., 2018). Analizar la respuesta de especies de fácil estudio con diferentes rasgos ecológicos, como N. olidus y O. discicolle a la restauración de los bosques, puede ser relevante para reconocer la importancia de la restauración en la conservación de los escarabajos, y para identificar los factores ambientales que modulan la persistencia y recuperación de sus poblaciones. Asimismo, puede ayudar a comprender cuál estrategia de restauración (activa vs. pasiva) utilizada en la recuperación de paisajes forestales tropicales es más eficiente para restablecer la dinámica espacio-temporal entre especies.
Para contribuir al conocimiento sobre la ecología de poblaciones y estrategias de conservación de los escarabajos sílfidos, el objetivo de este trabajo fue evaluar cómo varía la respuesta de 2 especies de escarabajos estrictamente carroñeros, N. olidus y O. discicolle, entre estrategias de restauración activa y restauración pasiva implementadas hace 23 años en un paisaje de bosque de niebla en México. Particularmente, se comparó la abundancia y la frecuencia de presencia de cada especie entre 4 tipos de hábitat: un bosque en restauración activa, un bosque en restauración pasiva, un bosque conservado (ecosistema de referencia) y un pastizal ganadero (ecosistema degradado). Asimismo, se analizó cómo varían la abundancia y frecuencia de presencia entre 2 temporadas climáticas. Finalmente, se compararon 10 variables ambientales potencialmente relevantes para los escarabajos entre las condiciones de vegetación estudiadas y se examinó su relación con la respuesta de los escarabajos carroñeros a la restauración del bosque de niebla. Esperamos una respuesta particular de cada especie de escarabajo a los procesos de restauración debido a las diferencias en los rasgos ecológicos de las especies y a la variación en la recuperación de las condiciones ambientales entre las estrategias de restauración.
Materiales y métodos
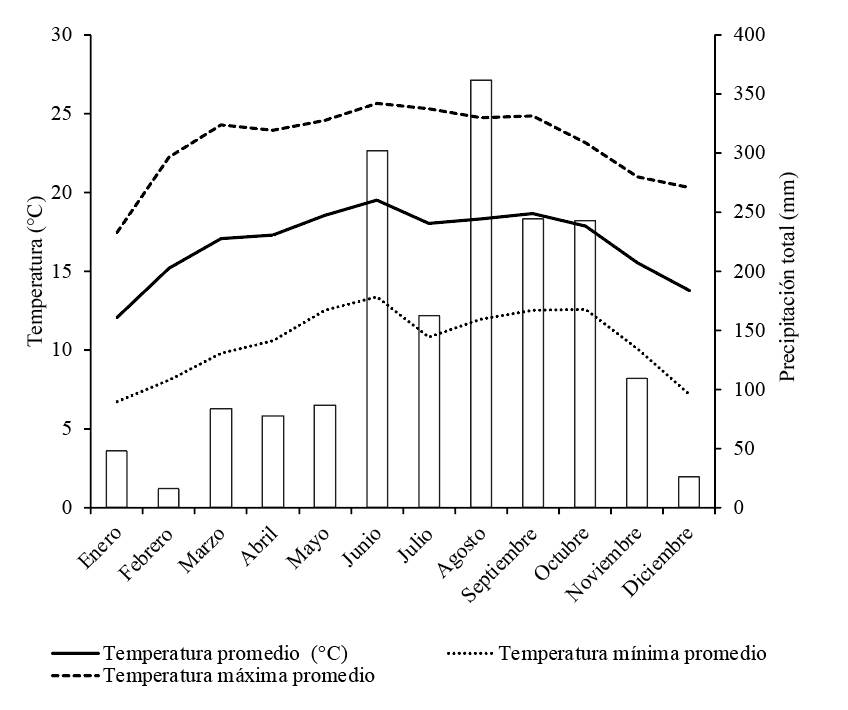
Realizamos este estudio en el municipio de Huatusco (19°11’23” N, 96°59’11” O), ubicado en la región montañosa central de Veracruz, al oriente de México. En esta región, la vegetación original corresponde a bosque de niebla, la temperatura promedio anual es igual a 19.8 °C y la precipitación promedio anual es igual a 1,850 mm (Conagua, 2018). El clima es subhúmedo con 3 temporadas bien definidas: fría-seca (noviembre-marzo), cálida-seca (abril-mayo) y cálida-húmeda (junio-octubre; apéndice). Actualmente, existen algunos fragmentos de bosque de niebla maduro rodeados por pastizales ganaderos, cultivos agrícolas, cafetales bajo sombra y bosques secundarios (Conabio, 2010; fig. 1).
Seleccionamos 4 tipos de hábitat con diferentes características de estructura y composición de la vegetación (Trujillo-Miranda et al., 2018): 1) un pastizal ganadero de 80 ha, donde hasta hace ~30 años existía el bosque de niebla, 2) un bosque en restauración pasiva de 62 ha, donde ocurrió un proceso de regeneración natural hace 23 años, 3) un bosque en restauración activa de 37 ha, donde hace 23 años se realizaron plantaciones multiespecíficas con especies nativas (casi 40 mil árboles) del bosque de niebla, y 4) un bosque de niebla maduro de 30 ha (fig. 1). Los 2 bosques en restauración cuentan con la misma historia de uso de suelo: a finales de 1980, el bosque de niebla de esas áreas fue convertido en pastizal ganadero (1 cabeza/ha) y se mantuvo así hasta 1992, cuando el ganado fue excluido y se implementaron las 2 estrategias de restauración de manera simultánea (Romero-González, 2018).
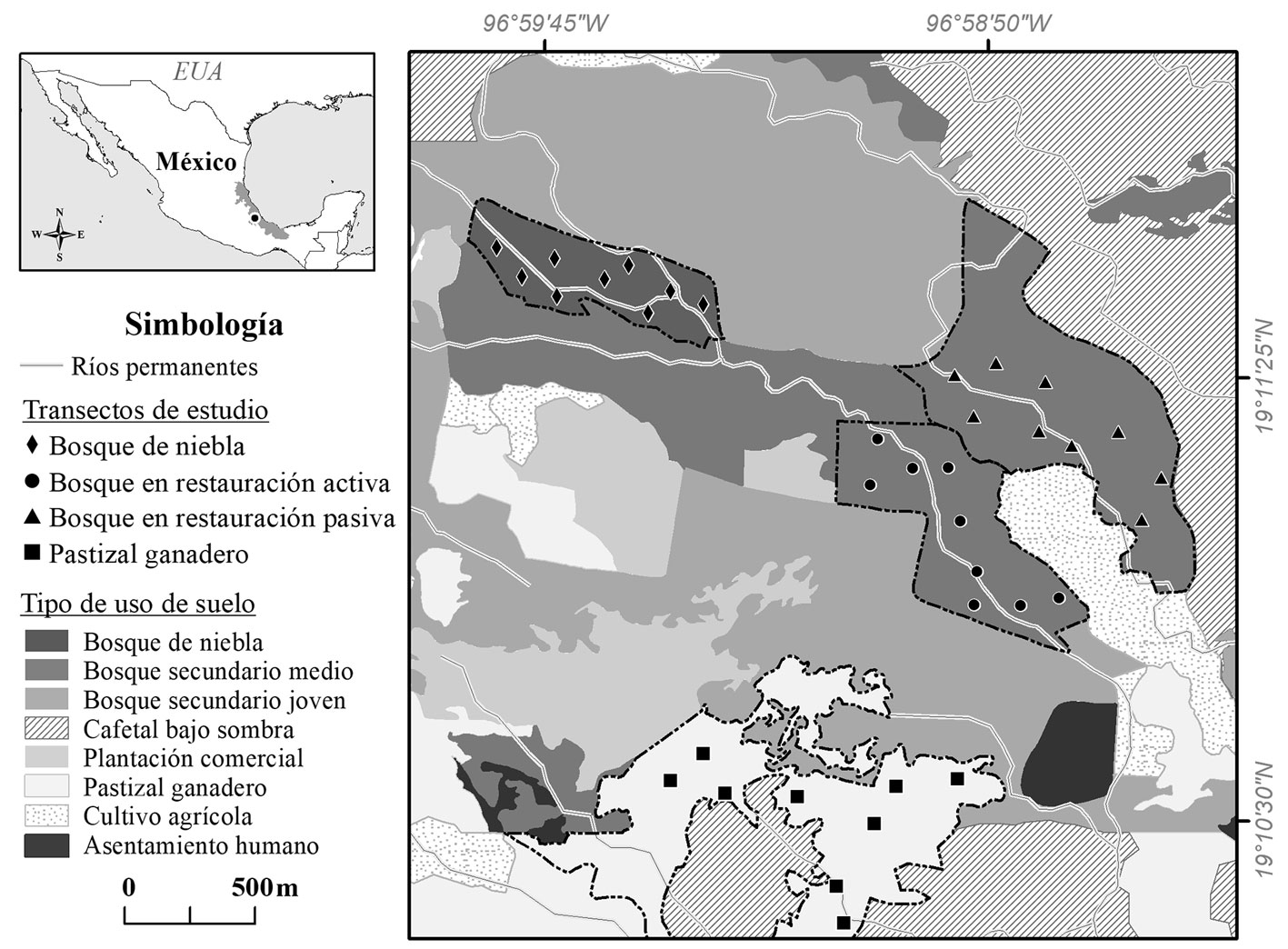
En cada tipo de hábitat instalamos 9 parcelas de 500 m2 (50 × 10 m) orientadas de norte a sur. Mantuvimos una distancia mínima de 100 m entre todas las parcelas y con los bordes de otros tipos de hábitat adyacentes. Las 36 parcelas totales se ubicaron dentro de un intervalo de elevación de 1,330 a 1,450 m snm, donde cohabitan las especies de estudio en la región (Arellano et al., 2005; Halffter et al., 1995).
Registro de escarabajos carroñeros. Realizamos un muestreo en la temporada cálida-seca (mayo) y otro en la temporada cálida-húmeda (agosto) de 2018. En cada muestreo, a los 0 y 25 m de cada parcela colocamos una trampa de caída de plástico (500 ml) a nivel del suelo, y a los 17 y 50 m colocamos una trampa arbustiva de plástico (200 ml) a 2 m sobre el suelo. Utilizamos trampas a 2 alturas distintas debido a que los escarabajos carroñeros pueden usar diferentes microhábitats. Incluso entre especies del mismo género se ha reportado que diferentes especies pueden ser encontradas a distintas alturas del suelo (Lowe y Lauff, 2015). Todas las trampas estuvieron separadas por 5 m del centro de la parcela: las trampas de caída quedaron a la izquierda y las trampas arbustivas a la derecha de las parcelas. Llenamos las trampas con agua jabonosa hasta 2 tercios de su capacidad y dentro de cada trampa colocamos un vaso de plástico de menor capacidad con 20 gr de cebo. Los cebos que utilizamos fueron tilapia en descomposición para las trampas de caída y atún enlatado para las trampas arbustivas. Cubrimos todas las trampas con un plato de plástico para evitar que se llenaran de agua de lluvia o de material biológico, como hojas o ramas. Revisamos todas las trampas después de 72 h de su colocación, preservamos en alcohol al 70% los escarabajos colectados y los identificamos en el laboratorio.
Variables ambientales. Consideramos la distancia al borde más cercano con el bosque de niebla, la densidad de árboles, la compactación del suelo y las coberturas del estrato postrado (0 – 50 cm), estrato arbustivo (50 – 150 cm) y dosel (5 – 20 m). Calculamos la distancia al bosque con el software ArcMap, utilizando una fotografía aérea de Google Earth (2019) y tomando como referencia el punto central de cada parcela.
En marzo de 2018, contamos el número de árboles adultos ≥ 10 cm de diámetro a la altura del pecho (DAP) en subparcelas de 200 m2 (20 × 10 m), ubicadas en el centro de las parcelas de 500 m2. En mayo y septiembre de 2018, establecimos 3 puntos de registro (0, 25 y 50 m) sobre la línea central de cada parcela. En cada punto de registro, medimos la cobertura del dosel con una fotografía del dosel tomada a 120 cm del suelo y procesamos las fotos en el software Image J siguiendo el método de Korhonen et al. (2006). En los mismos puntos y utilizando un cuadro de 1 m2, una misma persona estimó visualmente las coberturas del estrato postrado, que incluyó a la hojarasca, suelo desnudo, gramíneas exóticas y herbáceas no gramíneas. También, se estimó la cobertura del estrato arbustivo, que incluyó al helecho invasor Pteridium arachnoideum y otros arbustos. Asimismo, en los mismos puntos se midió la compactación del suelo utilizando un penetrómetro de mano con resorte.
Análisis de datos. Calculamos la abundancia de los escarabajos como el número de individuos registrados en cada parcela. Para comparar la abundancia de los escarabajos carroñeros entre tipos de hábitat y entre temporadas climáticas, utilizamos modelos lineales generalizados (GLM) con distribución Poisson y pruebas “post hoc” de contrastes. Para comparar las variables del hábitat utilizamos análisis de varianza y pruebas “post hoc” de Tukey, y examinamos la normalidad de los residuales con pruebas de Shapiro-Wilk (p > 0.05).
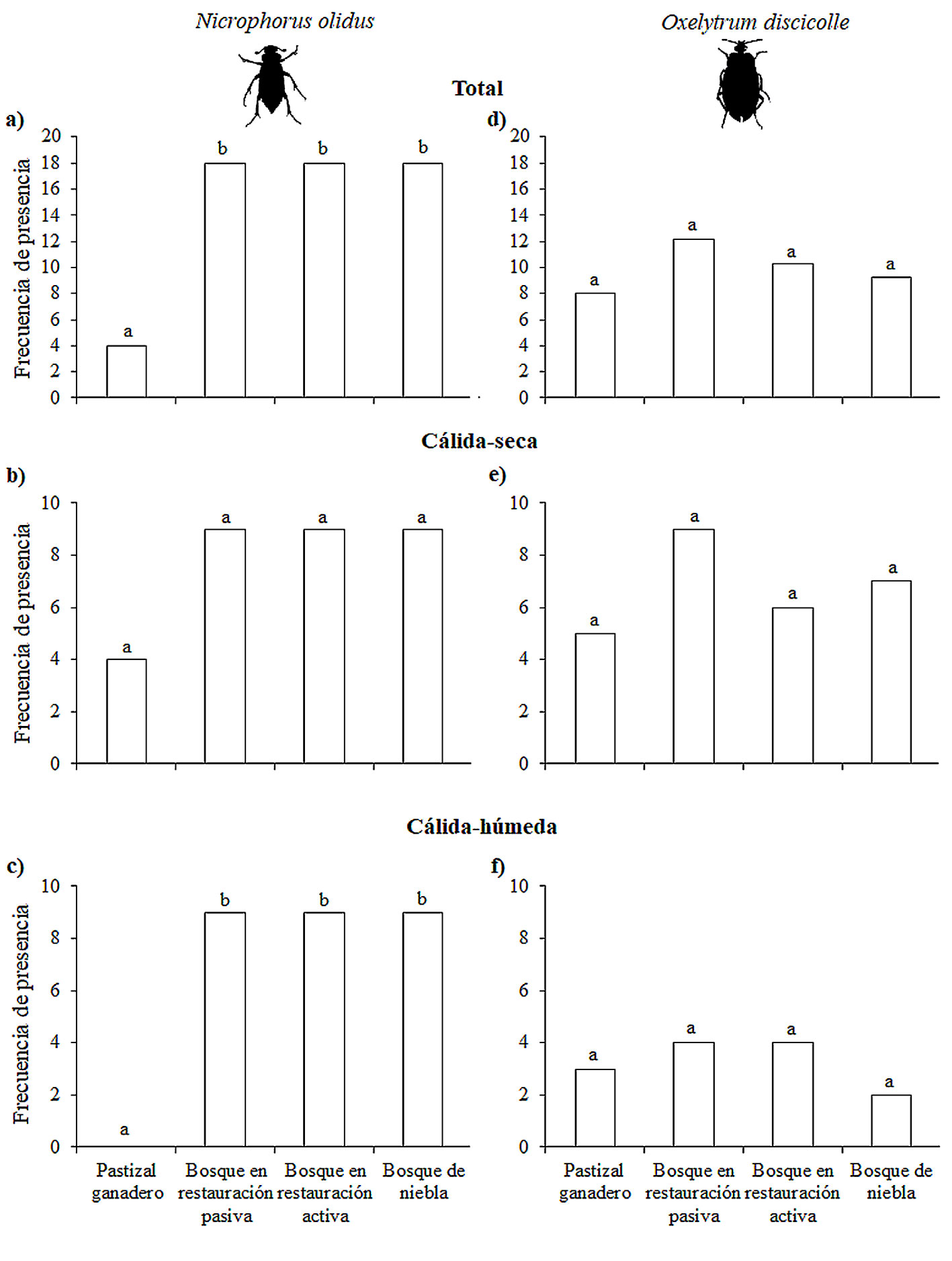
Calculamos la frecuencia de presencia de los escarabajos como el número de parcelas en que se registraron uno o más individuos. La frecuencia de presencia total fue de 18 parcelas por tipo de hábitat (9 parcelas × 2 temporadas climáticas) y la frecuencia de presencia de cada temporada climática fue de 9 parcelas por cada tipo de hábitat. Para comparar la frecuencia de presencia total entre tipos de hábitats y entre temporadas climáticas, utilizamos pruebas de Chi-cuadrada y sus respectivas pruebas “post hoc”.
Para determinar las variables del hábitat relacionadas con la abundancia de cada especie, utilizamos GLM con distribución Poisson y función de liga logarítmica. Para determinar las variables del hábitat relacionadas con la frecuencia de presencia de cada especie, utilizamos GLM con distribución binomial y función de liga logarítmica. Estandarizamos todas las variables de hábitat con media = 0 y desviación estándar = 1. Eliminamos las variables correlacionadas significativamente según la prueba de Pearson (R ≥ 0.6, p < 0.05): cobertura de arbustos, de suelo desnudo y de gramíneas exóticas. Comenzamos los GLMs incluyendo todas las variables no correlacionadas y buscamos el mejor conjunto de variables usando un procedimiento de pasos hacia atrás. Seleccionamos el mejor modelo usando el criterio de información de Akaike de segundo orden (AICC). Todos los análisis estadísticos fueron realizados con los paquetes gmodels (Warnes et al., 2018), MASS (Venables y Ripley, 2002), geiger (Harmon et al., 2008) y fifer (Fife, 2014) en R versión 1.1.383 (R Core Team, 2017).
Resultados
Registramos un total de 1,899 individuos de N. olidus y 280 individuos de O. discicolle. La abundancia total de N. olidus varió significativamente entre los hábitats (devianza = 462.9, g. l. = 32, p < 0.001), siendo mayor en el bosque en restauración activa y menor en el pastizal ganadero que en el resto de los hábitats estudiados (fig. 2a). La abundancia total de N. olidus fue mayor en la temporada cálida-húmeda que en la cálida-seca (devianza = 51.8, g. l. = 70, p < 0.001). En ambas temporadas climáticas, la abundancia de N. olidus fue mayor en el bosque en restauración activa que en el resto de los tipos de hábitat (fig. 2b, c).
La abundancia total de O. discicolle también varió significativamente (devianza = 388.6, g. l. = 32, p < 0.001), siendo mayor en el bosque en restauración pasiva que en el resto de los hábitats, entre los que no hubo diferencias (fig. 2d). La abundancia total de O. discicolle fue mayor en la temporada cálida-seca que en la cálida-húmeda (devianza = 265.5, g. l. = 70, p < 0.001). La abundancia de O. discicolle fue mayor en el bosque en restauración pasiva que en resto de los hábitats en la temporada cálida-seca, mientras que en la cálida-húmeda su abundancia no varió significativamente (fig. 2e, f).
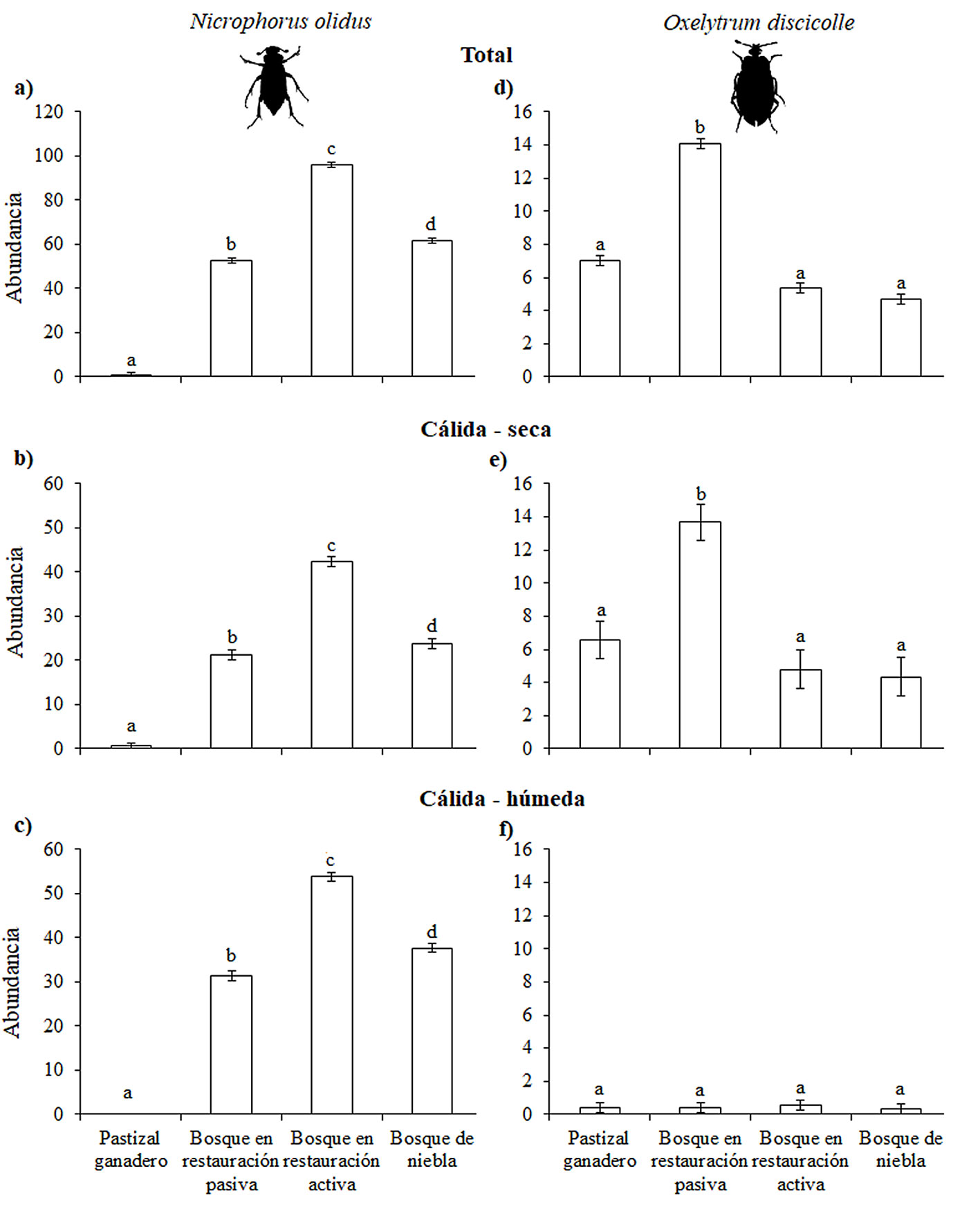
Para N. olidus, la frecuencia de presencia total (raw.p = 0.02, p = 0.04) y en la temporada cálida-húmeda (raw.p = 0.01, p = 0.02) fueron similares en los 3 tipos de bosque y mayores con respecto al pastizal ganadero (fig. 3a, c). En la temporada cálida-seca, la frecuencia de presencia de N. olidus no varió significativamente entre tipos de hábitat (fig. 3b). Para O. discicolle, la frecuencia de presencia total y por temporadas climáticas no variaron significativamente entre tipos de hábitat (fig. 3d, e, f).
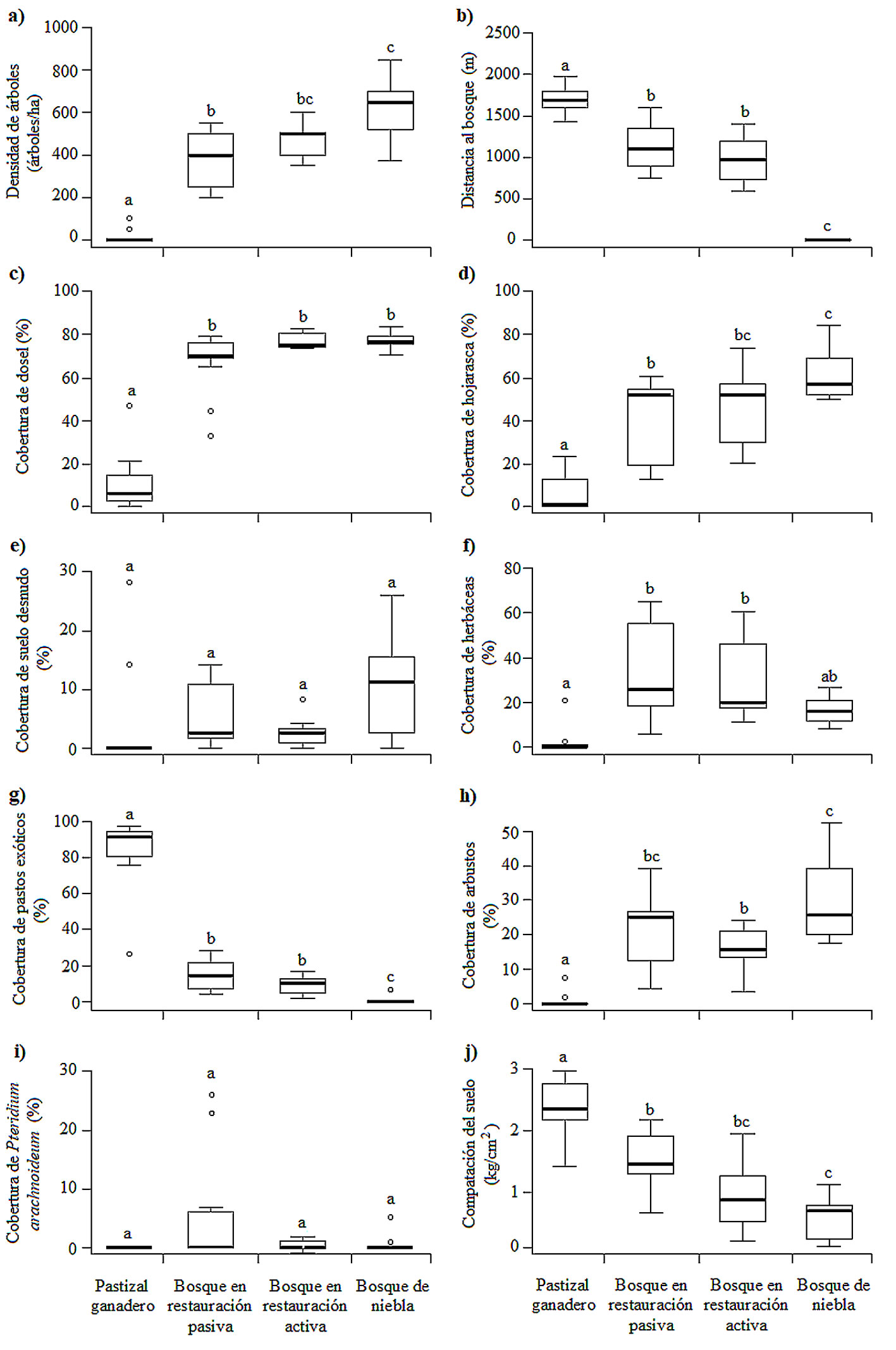
La densidad de árboles (F = 32.6, g.l. = 3, p < 0.001), la distancia al bosque maduro (F = 21.6, g.l. = 3, p < 0.001), la compactación del suelo (F = 18.2, g.l. = 3, p < 0.001) y las coberturas del dosel (F = 121, g.l. = 3, p < 0.001), de hojarasca (F = 18.8, g.l. = 3, p < 0.001), de herbáceas (F = 6.7, g.l. = 3, p < 0.01), de pastos exóticos (F = 66.1, g.l. = 3, p < 0.001) y de arbustos (F = 15.6, g.l. = 3, p < 0.001) variaron significativamente entre los hábitats. Las coberturas de suelo desnudo (F = 2.4, g.l. = 3, p = 0.08) y del helecho P. arachnoideum (F = 1.6, g.l. = 3, p = 0.2) no variaron significativamente entre los hábitats (fig.4).
La distancia al bosque de niebla fue mayor en el pastizal ganadero que en el resto de los tipos de hábitat, pero no difirió entre los bosques en restauración. La densidad de árboles y la cobertura de hojarasca fueron similares en el bosque de niebla y el bosque en restauración activa, presentando ambos bosques los valores más elevados. La cobertura del dosel y la cobertura de herbáceas no gramíneas fueron similares en los 3 tipos de bosque. La cobertura de arbustos fue mayor en el bosque en restauración pasiva y en el bosque de niebla. La cobertura de pastos exóticos y la compactación del suelo fueron mayores en el pastizal ganadero que en el resto de los tipos de hábitat (fig. 4).
Relación entre la abundancia y la frecuencia de presencia de los escarabajos carroñeros y las variables ambientales. La abundancia de N. olidus incrementó significativamente a mayor cobertura de dosel y menor cobertura del helecho P. arachnoideum. La frecuencia de presencia de N. olidus incrementó con la cercanía al bosque de niebla. La abundancia y frecuencia de presencia de O. discicolle no estuvo relacionada significativamente con ninguna de las variables ambientales medidas (tabla 1).
Discusión
Nuestros resultados sugieren que después de 23 años, la restauración ecológica del bosque de niebla a partir de pastizales ganaderos puede generar la creación de hábitat y condiciones bióticas y abióticas favorables para recuperar las poblaciones de N. olidus y para asegurar el mantenimiento de las poblaciones de O. discicolle en paisajes modificados por el ser humano. La respuesta de los escarabajos carroñeros a las prácticas de restauración forestal difirió en función de la especie, la temporada climática y el tipo de estrategia de restauración implementada. La población de N. olidus fue más beneficiada por la restauración activa, mientras que la población de O. discicolle fue más favorecida por la restauración pasiva. En ambos casos, la población de cada especie de escarabajo fue mayor en el bosque en restauración mencionado que en el ecosistema de referencia. Por lo tanto, cada bosque en restauración podría estar proporcionando condiciones ambientales particulares para cada especie y, probablemente, la dinámica de las funciones ecológicas llevadas por estas especies, como el reciclaje de nutrientes, podría ser distinta a lo que ocurre en el bosque maduro.
Tabla 1
Resultados de los modelos lineales generalizados seleccionados para explicar la recuperación de la abundancia y frecuencia de presencia de Nicrophorus olidus y Oxelytrum discicolle en 4 tipos de hábitat estudiados (pastizal ganadero, bosque en restauración pasiva, bosque en restauración activa y bosque maduro), en un paisaje de bosque de niebla en el centro de Veracruz, México.
| Estimación | Error estándar | T | p | |
| Nicrophorus olidus
Abundancia (devianza = 262.4, AIC = 349.46, AICC = 1.45) |
||||
| Intercepto | 50.7 | 5.0 | 10.1 | < 0.001 |
| Cobertura de dosel | 35.4 | 6.1 | 5.8 | < 0.001 |
| Cobertura de Pteridium arachnoideum | -19.2 | 8.3 | -2.3 | < 0.05 |
| Cobertura de arbustos | -10.5 | 6.4 | -1.6 | 0.10 |
| Frecuencia de presencia (devianza = 2.39, AIC = 18.6, AICC = 0.18) | ||||
| Intercepto | 0.8 | 0.05 | 17.4 | < 0.001 |
| Distancia al bosque | 0.16 | 0.08 | 1.9 | 0.05 |
| Cobertura de hojarasca | 0.10 | 0.07 | 1.4 | 0.15 |
| Cobertura de herbáceas | 0.12 | 0.06 | 1.9 | 0.06 |
| Densidad de árboles | 0.06 | 0.07 | 0.83 | 0.41 |
| Compactación del suelo | -0.17 | 0.08 | -1.95 | 0.06 |
| Oxelytrum discicolle
Abundancia (devianza = 347.2, AIC = 272.7, AICC = 1.76) |
||||
| Intercepto | 7.7 | 1.6 | 4.6 | < 0.001 |
| Compactación del suelo | -3.3 | 1.7 | -1.9 | 0.06 |
| Frecuencia de presencia (Devianza = 4.8, AIC = 43.6, AICC = 1.54) | ||||
| Intercepto | 0.8 | 0.07 | 11.7 | < 0.001 |
| Distancia al bosque | -0.08 | 0.10 | -0.78 | 0.4 |
| Cobertura de dosel | 0.04 | 0.22 | 0.21 | 0.8 |
| Cobertura de hojarasca | -0.01 | 0.19 | -0.65 | 0.5 |
| Cobertura de herbáceas | -0.90 | 0.17 | -0.53 | 0.5 |
Pocos estudios han comparado la respuesta de la fauna entre estrategias de restauración activa y pasiva, implementadas de forma simultánea en sitios con historias de uso similar (Crouzeilles et al., 2017; Meli et al., 2017). En los estudios existentes, se ha registrado que ambas estrategias de restauración son igualmente exitosas para recuperar la riqueza de especies de anfibios (Díaz-García et al., 2020), reptiles, aves, mamíferos (Smith et al., 2015) y artrópodos (Cole et al., 2016). No obstante, se ha señalado que la abundancia de anfibios (Díaz-García et al., 2020) y de artrópodos (Kattan et al., 2006) puede incrementarse en mayor proporción con la restauración activa que con la restauración pasiva, aunque no alcanza los valores del bosque de referencia. Después de 23 años de implementación, la mayor abundancia de N. olidus fue registrada en el bosque en restauración activa y la mayor abundancia de O. discicolle fue registrada en el bosque en restauración pasiva, superando el número de individuos registrados en el bosque de niebla. Probablemente ésto se deba a que en la región de estudio, la abundancia de diferentes grupos de mamíferos, cuyos cadáveres sirven a los escarabajos para alimentarse y reproducirse, es mayor en áreas en restauración pasiva o activa, que en el bosque de niebla (Pérez-Gracida, 2021). Algunos de los mamíferos que pudieran ser importantes para los escarabajos carroñeros en los bosques en restauración pueden ser roedores como ratones y tuzas, debido a que se ha reportado que existe una relación entre la disponibilidad de estos mamíferos y la abundancia de los escarabajos sílfidos (Holloway y Schnell, 1998; Merrick y Smith, 2004). Asimismo, nuestros resultados sugieren que cada bosque en restauración podría estar proporcionando condiciones ambientales favorables particulares para cada especie, las cuales estarían determinadas por la variación en la estructura horizontal y vertical de la vegetación, las variables de microhábitat, y la abundancia de otros recursos potenciales de origen animal para alimentarse y nidificar, como los anfibios u otros vertebrados (Díaz-García et al., 2020; Trujillo-Miranda et al., 2018).
La respuesta diferencial de las poblaciones de N. olidus y O. discicolle a las estrategias de restauración también puede estar relacionada con su origen biogeográfico y grado de especificidad de hábitat, como ha sido reportado para otros invertebrados como los ácaros, las hormigas y los escarabajos del estiércol (Audino et al., 2014; Díaz-García et al., 2020; Kanowski et al., 2005). En diferentes especies de Nicrophorus se ha observado un alto grado de especificidad a los bosques templados conservados debido a su origen neártico (Martín-Vega y Baz, 2012; Rivera-Cervantes y García-Real, 1998; Trumbo, 1990). Nuestros resultados muestran que la frecuencia de presencia de N. olidus está asociada principalmente a los bosques y que su abundancia es escasa en el pastizal ganadero, lo cual podría confirmar la alta sensibilidad de esta especie a la pérdida y disminución del bosque (Navarrete-Heredia, 1995). Asimismo, N. olidus fue favorecida por el incremento de la estructura de la vegetación a través de la restauración forestal, particularmente en las áreas en restauración activa. Trujillo-Miranda et al. (2018) reportaron una mayor recuperación en la estructura de la vegetación (densidad, altura y área basal de árboles) en el bosque en restauración activa, que en el bosque en restauración pasiva, lo cual pudo beneficiar el restablecimiento de temperaturas constantes y alta humedad ambiental y en consecuencia, contribuir a la proliferación de esta especie (Suganuma et al., 2014).
Con respecto a O. discicolle, este estudio muestra que la especie puede persistir en bosques maduros, bosques secundarios y pastizales con árboles aislados de especies nativas del bosque de niebla y con baja densidad de ganado (~ 1 cabeza de ganado/ha). En otros estudios se ha reportado la presencia de esta especie incluso en zonas urbanas (Lira y Vasconcelos, 2016), por lo que podría considerarse de hábitos generalistas. La persistencia de especies generalistas en pastizales ganaderos ha sido reportada para algunas especies de anfibios, hormigas y escarabajos del estiércol en la misma área de estudio y en Los Tuxtlas, México (Díaz-García et al., 2017, 2020), así como en varias especies de escarabajos de las familias Scarabaeidae y Trogidae en la misma región de estudio (Deloya et al., 2007).
Trujillo-Miranda et al. (2018) registraron una recuperación heterogénea de la vegetación y condiciones ambientales en el área en restauración pasiva estudiada, es decir, existen tanto espacios boscosos como espacios abiertos donde no ocurrió la recuperación de la vegetación. La convergencia de diferentes características ambientales dentro de las áreas en restauración pasiva puede representar condiciones favorables para que O. discicolle sea abundante. Por ejemplo, la tolerancia de O. discicolle a ambientes con diferentes microclimas (Carvalho et al., 2000), como los sitios cálidos y templados que ocurren dentro del mismo bosque en restauración pasiva. Al mismo tiempo, O. discicolle podría verse beneficiada por la presencia de espacios con mayor cobertura arbórea en el bosque en restauración pasiva, que son refugio de recursos de origen animal (cadáveres) para alimentarse y nidificar, a diferencia de lo que ocurre en los pastizales ganaderos, donde la abundancia de O. discicolle pudo verse limitada por la ausencia de recursos para su reproducción y alimentación. Otro factor que pudo contribuir a la alta abundancia de O. discicolle registrada en el bosque en restauración pasiva es la repartición de espacios con N. olidus (Naranjo-López y Navarrete-Heredia, 2011; Pérez-Villamares et al., 2016). La abundancia de N. olidus disminuyó en sitios con alta cobertura del helecho invasor Pteridium arachnoideum, que principalmente estuvo presente en el bosque en restauración pasiva (Trujillo-Miranda et al., 2018). Ésto, probablemente limita la presencia de N. olidus a los espacios boscosos del bosque en restauración pasiva, mientras que O. discicolle podría habitar tanto en espacios boscosos como en abiertos, debido que no se vio afectada por la dominancia del helecho invasor y las características ambientales que éste genera.
Variables ambientales que modulan la respuesta de los escarabajos a la restauración forestal. La respuesta de N. olidus a las estrategias de restauración estuvo relacionada principalmente con el incremento de la cobertura del dosel y la pérdida de la cobertura del helecho invasor P. arachnoideum. En general, los escarabajos del género Nicrophorus pueden ser más exitosos para conseguir carroña y reproducirse en hábitats con un dosel cerrado que en hábitats abiertos (Lomolino y Creighton et al., 1996; Trumbo, 1990). Asimismo, las especies de este género no son comunes en hábitats secos y calurosos debido a su baja tolerancia a las altas temperaturas (Merrick y Smith, 2004). En los procesos de sucesión de los bosques, el restablecimiento de la densidad de árboles, la cobertura del dosel y la cobertura de hojarasca promueven una baja evapotranspiración, y ayudan a reducir la temperatura y a mantener niveles constantes de humedad (Guariguata y Ostertag, 2001). Por el contrario, la respuesta de O. discicolle a las estrategias de restauración no estuvo relacionada con alguna de las variables ambientales. Ésto concuerda con el hecho de que O. discicolle es una especie de amplia distribución y considerada como generalista, por ello puede habitar sitios con diferentes condiciones climáticas y ambientales (Navarrete-Heredia, 1995).
Aunque no fue evaluado en este estudio, la disponibilidad de cadáveres de vertebrados puede ser otro de los factores importantes en la respuesta de los escarabajos sílfidos a la restauración del bosque de niebla. Se ha reportado que la presencia de carroña es uno de los factores más influyentes en la sobrevivencia, el éxito reproductivo y la ocupación de hábitat de los sílfidos debido a que es indispensable para la alimentación de sus larvas (Kalinová et al., 2009; Scott, 1998). En la región de estudio habitan animales vertebrados de diferentes tamaños que pueden representar una fuente potencial de alimento, tanto para N. olidus como para O. discicolle. Las áreas en restauración estudiadas contienen comunidades de vertebrados, como mamíferos y anfibios, diferentes al bosque maduro (Díaz-García et al., 2020; Pérez-Gracida, 2021), que ofrece recursos potenciales para cada especie de escarabajo en específico. En fragmentos de bosques de niebla conservados y en restauración del área de estudio se han reportado poblaciones de 13 especies de anfibios (Díaz-García et al., 2020), 17 de reptiles (León-López, 2018) y 15 especies de mamíferos medianos (Ramos-Ixmatlahua, 2018).
Con respecto a la variación estacional, la abundancia de N. olidus fue mayor en la temporada cálida-húmeda y menor en la cálida-seca, mientras que la abundancia de O. discicolle tuvo un patrón a la inversa. Contrario a otros estudios (Arellano et al., 2005), no registramos un desplazamiento temporal bien definido debido a que N. olidus fue más abundante que O. discicolle en ambas temporadas. Nuestros resultados sugieren que las condiciones que prevalecen en cada temporada climática favorecen de diferente manera a cada especie, a N. olidus la temporada cálida-húmeda y a O. discicolle la temporada cálida-seca. Ésto puede estar relacionado con los niveles de tolerancia térmica de cada especie debido a que N. olidus es poco tolerante a las altas temperaturas (Merrick y Smith, 2004), mientras que O. discicolle puede tolerar distintas condiciones climáticas (Navarrete-Heredia, 1995). Sin embargo, otros factores como la disponibilidad de alimento también pueden tener un papel importante en la dinámica estacional entre los escarabajos sílfidos. Por ejemplo, la cantidad de cadáveres o el tiempo de descomposición de los mismos, puede diferir entre la época cálida-lluviosa y la cálida-seca (Arellano et al., 2005).
Con respecto a la variación espacial, en otro paisaje de bosque de niebla en México por debajo de 2,000 m snm, se ha reportado el mismo patrón de desplazamiento espacial que observamos, donde O. discicolle fue menos abundante que N. olidus (Pérez-Villamares et al., 2016). El desplazamiento espacial entre estas especies de sílfidos puede ocurrir probablemente para evitar la competencia por la carroña, ya que a pesar de que se alimentan de especies de distintos tamaños, la competencia entre N. olidus y O. discicolle puede ocurrir (Arellano et al., 2005; Navarrete-Heredia, 2009).
Implicaciones para la restauración del bosque de niebla y su monitoreo. Los escarabajos necrófagos estrictos N. olidus y O. discicolle tienen gran relevancia en la descomposición de la materia orgánica de origen animal (Naranjo-López y Navarrete-Heredia, 2011). Específicamente, los adultos de N. olidus suelen alimentarse de otras larvas que se encuentran en la carroña, participando también en el control de moscas (Navarrete-Heredia, 1995). La persistencia de estas especies en los bosques en restauración puede contribuir a incrementar la disposición de nutrientes en el suelo, los cuales podrían ser utilizados por las plantas, otros animales y microorganismos. Sin embargo, para entender ampliamente la respuesta y el papel funcional de los sílfidos en los procesos de restauración, se necesitan estudios complementarios que evalúen la cantidad de materia orgánica removida por estas especies, así como la disponibilidad de carroña para los escarabajos en las áreas en restauración.
En nuestro estudio, cada estrategia de restauración tiene una importancia distinta para cada especie, aun cuando ambas pertenecen a un mismo gremio. Particularmente, N. olidus podría ser considerada como una especie indicadora de restauración debido a que sus poblaciones incrementan con el restablecimiento homogéneo de los atributos de la vegetación, por ejemplo, en sitios en restauración con un dosel cerrado y con menor presencia de espacios abiertos dominados por pastos exóticos y helechos invasores. Igualmente, estudiar una especie que puede indicar una función al relacionarse con los tamaños de las presas, es útil para conocer el avance de la recuperación funcional con las estrategias de restauración pasiva y activa, un aspecto poco abordado en la literatura. Sin embargo, para comprobar la eficacia de N. olidus como una especie indicadora de la función en procesos de restauración, se necesitan más estudios que repliquen este diseño y que consideren el desplazamiento espacial-temporal en mayores escalas.
Agradecimientos
La Cooperativa Las Cañadas proporcionó el hospedaje y otras facilidades durante el trabajo de campo. Ricardo Romero, Tania de Alba, Juan Acosta y Carlos Nolasco dieron los permisos para trabajar en sus propiedades. Antonio Reyes y Carlos Nolasco fueron nuestros guías de campo. Saraí Gómez, Adriana Sandoval, María de Jesús Peralta, Juan Fernando Escobar, Judith Ramos, Arístides García y Enrique Silva ayudaron con el trabajo de campo. Adriana Sandoval y Policarpo Ronzón proporcionaron ayuda técnica y logística. Alfonso Díaz identificó las especies de escarabajos carroñeros. Este estudio fue financiado por el proyecto “Atributos funcionales de especies arbóreas y los escenarios para la restauración del paisaje de bosque mesófilo de montaña en el Centro de Veracruz” de la Secretaría de Educación Pública-Consejo Nacional de Ciencia y Tecnología (SEP-Conacyt), número CB2014-238831-B. JMDG estuvo inscrito en el programa de doctorado del Instituto de Ecología y recibió una beca de manutención mensual por parte del Conacyt (Núm. 486768). Agradecemos los comentarios de dos revisores anónimos que ayudaron a mejorar la calidad de nuestro artículo.
Apéndice. Climograma del municipio de Huatusco (19°11’23” N, 96°59’11” O) ubicado en la región montañosa central de Veracruz, al oriente de México. Datos obtenidos de la Comisión Nacional del Agua (Conagua, 2018).
Referencias
Anderson, R. S. (1982). Resource partitioning in the carrion beetle (Coleoptera: Silphidae) fauna of southern Ontario: ecological and evolutionary considerations. Canadian Journal of Zoology, 60, 1314–1325. https://doi.org/10.1139/z82-178
Arellano, L., Favila, M. E. y Huerta, C. (2005). Diversity of dung and carrion beetles in a disturbed Mexican tropical montane cloud forest and on shade coffee plantations. Biodiversity and Conservation, 14, 601–615. https://doi.org/10.1007/s10531-004-3918-3
Audino, L. D., Louzada, J. y Comita, L. (2014). Dung beetles as indicators of tropical forest restoration success: is it possible to recover species and functional diversity? Biological Conservation, 169, 248–257. https://doi.org/10.1016/j.biocon.2013.11.023
Carvalho, L. M., Thyssen, P. J., Linhares, A. X. F. y Palhares, A. B. (2000). A checklist of arthropods associated with pig carrion and human corpses in Southeastern Brazil. Memórias do Instituto Oswaldo Cruz, 95, 135–138. https://doi.org/10.1590/S0074-02762000000100023
Catterall, C. P. (2018). Fauna as passengers and drivers in vegetation restoration: a synthesis of processes and evidence. Ecological Management and Restoration, 19, 54–62. https://doi.org/10.1111/emr.12306
Cole, R. J., Holl, K. D., Zahawi, R. A., Wickey, P. y Townsend, A. R. (2016). Leaf litter arthropod responses to tropical forest restoration. Ecology and Evolution, 6, 5158–5168. https://doi.org/10.1002/ece3.2220
Conabio (Comisión Nacional para el Conocimiento y Uso de la Biodiversidad). (2010). El bosque mesófilo de montaña en México: amenazas y oportunidades para su conservación y manejo sostenible. México D.F.: Conabio.
Conagua (Comisión Nacional del Agua). (2016). Estaciones Meteorológicas Automáticas, Los Tuxtlas II. Servicio Meteorológico Nacional. Recuperado el 06 mayo, 2023 de: https://smn.conagua.gob.mx/
Cross, S. L., Bateman, P. W. y Cross, A. T. (2019). Restoration goals: Why are fauna still overlooked in the process of recovering functioning ecosystems and what can be done about it? Ecological Management and Restoration, 21, 4–8. https://doi.org/10.1111/emr.12393
Crouzeilles, R., Ferreira, M. S., Chazdon, R. L., Lindenmayer, D. B., Sansevero, J. B. B., Monteiro, L. et al. (2017). Ecological restoration success is higher for natural regeneration than for active restoration in tropical forests. Science Advances, 3, 1–7. https://doi.org/10.1126/sciadv.1701345
Deloya, C., Parra-Tabla, V. y Delfín-González, H. (2007). Fauna de Coleópteros Scarabaeidae Laparosticti y Trogidae (Coleoptera: Scarabaeoidea) asociados al bosque mesófilo de montaña, cafetales bajo sombra y comunidades derivadas en el centro de Veracruz, México. Neotropical Entomology, 36, 5–21. https://doi.org/10.1590/S1519-566X2007000100002
Díaz-García, J. M., López-Barrera, F., Toledo-Aceves, T., Andresen, E. y Pineda, E. (2020). Does forest restoration assist the recovery of threatened species? A study of cloud forest amphibian communities. Biological Conservation, 242, 108400. https://doi.org/10.1016/j.biocon.2019.108400
Díaz-García, J. M., Pineda, E., López-Barrera, F., Moreno, C. E. (2017). Amphibian species and functional diversity as indicators of restoration success in tropical montane forest. Biodiversity and Conservation, 26, 2569–2589. https://doi.org/10.1007/s10531-017-1372-2
Dixon, K. W. (2009). Pollination and restoration. Science, 325, 571–573. https://doi.org/10.1126/science.1176295
Fagan, M. E., Reid, J. L., Holland, M. B., Drew, J. D. y Zahawi, R. A. (2020). How feasible are global forest restoration commitments? Conservation Letters, 13, 1–8. https://doi.org/10.1111/conl.12700
Fife, D. A. (2014). An introduction to the fifer package in R. Recuperado el 20 marzo, 2023 de: https://CRAN.R-project.org/package=fifer
Fraser, L. H., Harrower, W. L., Garris, H. W., Davidson, S., Hebert, P. D. N., Howie, R. et al. (2015). A call for applying trophic structure in ecological restoration. Restoration Ecology, 23, 503–507. https://doi.org/10.1111/rec.12225
Gann, G. D., McDonald, T., Walder, B., Aronson, J., Nelson, C. R., Johnson, J. et al. (2019). International principles and standards for the practice of ecological restoration. Restoration Ecology, 27, 1–46. https://doi.org/10.1111/rec.
13035
Gibbs, J. P. y Stanton, E. J. (2001). Habitat fragmentation and arthropod community change: carrion beetles, phoretic mites, and flies. Ecological Applications, 11, 79–85. https://doi.org/10.1890/1051-0761(2001)011[0079:HFAACC]2.0.CO;2
Gilman, A. C., Letcher, S. G., Fincher, R. M., Pérez, A. I., Madell, T. W., Finkelstein, A. L. et al. (2016). Recovery of floristic diversity and basal area in natural forest regeneration and planted plots in a Costa Rican wet forest. Biotropica, 48, 798–808. https://doi.org/10.1111/btp.12361
Google Earth (2019). Imagen de Huatusco, Veracruz, México. Google Earth. Recuperado el 20 marzo, 2023 de: https://n9.cl/igdr6
Guariguata, M. R. y Ostertag, R. (2001). Neotropical secondary forest succession: changes in structural and structural and functional characteristics. Forest Ecology and Management, 148, 185–206. https://doi.org/10.1016/S0378-1127(00)00535-1
Halffter, G., Favila, M. E. y Arellano, L. (1995). Spatial distribution of three groups of Coleoptera along an altitudinal transect in the Mexican Transition Zone and its biogeographical implications. Elytron, 9, 151–185.
Harmon, L. J., Jason, T. W., Chad, D. B., Richard, E. G. y Challenger, W. (2008). GEIGER: investigating evolutionary radiations. Bioinformatics, 24, 129–131. https://doi.org/10.
1093/bioinformatics/btm538
Holloway, A. K. y Schnell, G. D. (1997). Relationship between numbers of the endangered American burying beetle Nicrophorus americanus (Coleoptera: Silphidae) and available food resources. Biological Conservation, 81, 145–152. https://doi.org/10.1016/S0006-3207(96)00158-9
Kalinová, B., Podskalská, H., Růžička, J. y Hoskovec, M. (2009) Irresistible bouquet of death – how are burying beetles (Coleoptera: Silphidae: Nicrophorus) attracted by carcasses. Naturwissenschaften, 96, 889–899. https://doi.org/10.1007/s00114-009-0545-6
Kanowski, J., Catterrall, C. P., Proctor, H., Reis, T., Tucker, N. y Wardell-Johnson, G. (2005). Biodiversity values of timber plantations and restoration plantings for rainforest fauna in tropical and subtropical Australia. En P. Erskine, D. Lamb, M. Bristow (Eds.), Reforestation in the tropics and subtropics of Australia using rainforest tree species (pp. 183–205). Canberra, Australia: Rainforest Cooperative Research Center.
Kattan, G. H., Correa, D., Escobar, F. y Medina, C. (2006). Leaf-litter arthropods in restored forests in the Colombian Andes: a comparison between secondary forest and tree plantations. Restoration Ecology, 14, 95–102. https://doi.org/10.1111/j.1526-100X.2006.00109.x
Korhonen, L., Korhonen, K. T., Rautiainen, M. y Stenberg, P. (2006). Estimation of forest canopy cover: comparison of field measurement techniques. Silva Fennica, 40, 577–588. https://doi.org/10.14214/sf.315
Lanping, L., Cadotte, M. W., Martínez-García, C. y de la Peña-Domene, M. (2017). Planting accelerates restoration of tropical forest but assembly mechanisms appear insensitive to initial composition. Journal of Applied Ecology, 55, 986–996. https://doi.org/10.1111/1365-2664.12976
Lawes, M. J., Moore, A. M., Andersen, A. N., Preece, N. D. y Franklin, C. D. (2017). Ants as ecological indicators of rainforests restoration: community convergence and the development of an Ant Forest Indicator Index in the Australian wet tropics. Ecology and Evolution, 7, 8442–8455.
https://doi.org/10.1002/ece3.2992
Lira, L. A. y Vasconcelos, S. D. (2016). New Record and Update on the Distribution of Oxelytrum discicolle (Brullé, 1840) (Coleoptera: Silphidae) in South America. The Coleopterists Bulletin, 70, 399–402. https://doi.org/10.1649/
0010-065X-70.2.399
Lomolino, M. V. y Creighton, J. C. (1996). Habitat selection, breeding success and conservation of the endangered American burying beetle Nicrophorus americanus. Biological Conservation, 77, 235–241. https://doi.org/10.
1016/0006-3207(96)00003-1
Lowe, A. J. y Lauff, R. F. (2015). Habitat and microhabitat preferences in a Nova Scotian carrion beetle (Coleoptera: Silphidae) community. En O. R. P. Bininda-Emonds, G. L. Powell, H. A. Jamniczky, A. M. Bauer y J. Theodor (Eds.). All animals are interesting: a festschrift in honour of Anthony P. Russell (pp. 455–468). Oldenburg, Alemania: BIS Verlag.
MacArthur, R. y Levins, R. (1964). Competition, habitat selection, and character displacement in a patchy environment. Proceedings of the National Academy of Sciences, 51, 1207–1210. https://doi.org/10.1073/pnas.51.6.1207
Majer, J. D. (2009). Animals in the restoration process – progressing the trends. Restoration Ecology, 17, 315–319. https://doi.org/10.1111/j.1526-100X.2009.00528.x
Martín-Vega, D. y Baz, A. (2012). Spatiotemporal distribution of necrophagous beetles (Coleoptera: Dermestidae, Silphidae) assemblages in natural habitats of central Spain. Annals of the Entomology Society of America, 105, 44–53. https://doi.org/10.1603/AN11062
Meli, P., Holl, K. D., Rey-Benayas, J. M., Jones, H. P., Jones, P. C., Montoya, D. et al. (2017). A global review of past land use, climate, and active vs passive restoration effects on forest recovery. Plos One, 12, e0171368. https://doi.org/10.1371/journal.pone.0171368
Merrick, M. J., y Smith, R. J. (2004). Temperature regulation in burying beetles (Nicrophorus spp.: Coleoptera: Silphidae): effects of body size, morphology and environmental temperature. Journal of Experimental Biology, 207, 723–733. https://doi.org/10.1242/jeb.00807
Morrison, E. B. y Lindell, C. A. (2011). Active or passive forest restoration? Assessing restoration alternatives with avian foraging behavior. Restoration Ecology, 19, 170–177. https://doi.org/10.1111/j.1526-100X.2010.00725.x
Naranjo-López, A. G. y Navarrete-Heredia, J. L. (2011). Coleópteros necrócolos (Histeridae, Silphidae y Scarabaei-
dae) en dos localidades de Gómez Farías, Jalisco, México. Revista Colombiana de Entomología, 37, 103–110. https://doi.org/10.25100/socolen.v37i1.9051
Navarrete-Heredia, J. L. (1995). Coleópteros Silphidae de Jalisco y del volcán de Tequila incluyendo comentarios generales sobre su biología. Dugesiana, 26, 11–28.
Navarrete-Heredia, J. L. (2009). Silphidae (Coleoptera) de México: diversidad y distribución. Guadalajara, Jalisco: Universidad de Guadalajara.
Peck, S. B. y Anderson, R. S. (1985). Taxonomy, phylogeny and biogeography of the carrion beetles of Latin America (Coleoptera: Silphidae). Quaestiones Entomologicae, 21, 243–317.
Pérez-Gracida, L. D. (2021). Características de la comunidad de mamíferos en un área restaurada y un fragmento de bosque mesófilo de montaña, Huatusco, Veracruz, México (Tesis). Facultad de Ciencias Biológicas Agropecuarias Región Orizaba-Córdoba. Universidad Veracruzana. Peñuela, Veracruz.
Pérez-Villamares, J. C., Jiménez-Sánchez, E. y Padilla-Ramírez, J. (2016). Escarabajos atraídos a la carroña (Coleoptera: Scarabaeidae, Geotrupidae, Hybosoridae, Trogidae y Silphidae) en las cañadas de Coatepec Harinas, Estado de México, México. Revista Mexicana de Biodiversidad, 87, 443–450. https://doi.org/10.1016/j.rmb.2016.03.005
Quiroz-Rocha, G. A., Navarrete-Heredia, J. L. y Martínez, P. (2008). Especies de Scarabaeinae (Coleoptera: Scarabaeidae) y Silphidae (Coleoptera) necrófilas de bosque de pino-encino y bosque mesófilo de montaña en el municipio de Mascota, Jalisco, México. Dugesiana, 15, 27–37.
R Core Team, (2017). A language and environment for
statistical computing. Recuperado el 20 marzo, 2023 de: https://www.R-project.org/
Ramírez-Soto, A., Lucio-Palacio, C. R., Rodríguez-Mesa, R., Sheseña-Hernández, I., Farhat, F. N., Villa-Bonilla, B. et al. (2018). Restoration of tropical montane cloud forests: a six-prong strategy. Restoration Ecology, 26, 106–211. https://doi.org/10.1111/rec.12660
Ratcliffe, B. C. (1996). The carrion beetles (Coleoptera: Silphidae) of Nebraska. Lincoln: University of Nebraska.
Rivera-Cervantes, L. E. y García-Real, E. (1998). Análisis preliminar sobre la composición de los escarabajos necrófilos (Coleoptera: Silphidae y Scarabaeidae) presentes en dos bosques de pino (uno dañado por fuego), en la estación científica Las Joyas, Sierra de Manantlán, Jalisco, México. Dugesiana, 5, 11–22.
Romero-González, R. (2018). Ganadería agroecológica en una zona de bosque de niebla. En G. Halffter, M. Cruz y C. Huerta (Eds.), Ganadería sustentable en el golfo de México (pp. 345–367). Xalapa, México: Instituto de Ecología, A.C.
Scott, M. P. (1998). The ecology and behavior of burying beetles. Annual Review of Entomology, 43, 595–618. https://doi.org/10.1146/annurev.ento.43.1.595
Schwartz, M. B. y Salisbury, N. (2018). The native pollinator habitat restoration guide. Washington D.C.: Earth Cops.
Shoo, L. P., Freebody, K., Kanowski, J. y Catterall, C. P. (2016). Slow recovery of tropical old-field rainforest regrowth and the value and limitations of active restoration. Conservation Biology, 30, 121–132. https://doi.org/10.1111/cobi.12606
Smith, G. C., Lewis, T. y Hogan L. D. (2015). Fauna community trends during early restoration of alluvial open forest/woodland ecosystems on former agricultural land. Restoration Ecology, 23, 787–799. https://doi.org/10.1111/rec.12269
Suganuma, M. S., de Assis, G. B. y Durigan, G. (2014). Changes in plant species composition and functional traits along the successional trajectory of a restored patch of Atlantic Forest. Community Ecology, 15, 27–36. https://doi.org/10.1556/ComEc.15.2014.1.3
Trevilla-Rebollar, A., Deloya, C. y Padilla-Ramírez, J. (2010). Coleópteros necrófilos (Scarabaeidae, Silphidae y Trogidae) de Malinalco, Estado de México, México. Neotropical Entomology, 39, 486–495. https://doi.org/10.1590/S1519-56
6X2010000400005
Trujillo-Miranda, A. L., Toledo-Aceves, T., López-Barrera, F. y Gerez-Fernández, P. (2018). Active versus passive restoration: recovery of cloud forest structure, diversity and soil condition in abandoned pastures. Ecological Engineering, 117, 50–61. https://doi.org/10.1016/j.ecoleng.2018.03.011
Trumbo, S. T. (1990). Reproductive success, phenology and biogeography of burying beetles (Silphidae, Nicrophorus). The American Midland Naturalist, 124, 1-11. https://doi.org/10.2307/2426074
van Klink, R., Bowler, D. E., Gongalsky, K. B., Swengel, A. B., Gentile, A. y Chase, J. M. (2020). Meta-analysis reveals declines in terrestrial but increases in freshwater insect abundances. Science, 368, 417–420. https://doi.org/10.1126/science.aax9931
von Hoermann, C., Jauch, D., Kubotsh, C., Reichel-Jung, K., Steiger, S. y Ayasse, M. (2018). Effects of abiotic environmental factors and land use on the diversity of carrion-visiting silphid beetles (Coleoptera: Silphidae): a large scale carrion study. Plos One, 13, e0196839. https://doi.org/10.1371/journal.pone.0196839
Venables, W. N. y Ripley, B. D. (2002). Modern applied statistics with S. New York: Springer. https://doi.org/10.
1007/978-0-387-21706-2
Warnes, G. R., Bolker, B., Lumley, T. y Johnson, R. C. (2018). gmodels: various R Programming tools for model fitting for R. Recuperado el 20 marzo, 2023 de: https://cran.r-project.org/web/packages/gmodels/index.html
WRI. (2019). The world lost a Belgium-sized area of primary rainforests last year. Recuperado el 10 de junio de 2020.
https://www.wri.org/blog/2019/04/world-lost-belgium-sized-
area-primary-rainforests-lastyear