Ibeth Rodríguez-Gutiérrez a, b, Roberto Garibay-Orijel c, *, Beatriz Santiago-Morales d y Roberto Lindig-Cisneros e
a Posgrado en Ciencias Biológicas, Universidad Nacional Autónoma de México, Edificio D, 1º Piso, Circuito de Posgrados, Ciudad Universitaria, Coyoacán, 04510 Ciudad de México, México
b Tecnológico de Estudios Superiores de Huixquilucan, Paraje El Río s/n, Col. La Magdalena Chichicaspa, 52773 Estado de México, México
c Instituto de Biología, Universidad Nacional Autónoma de México, Circuito exterior s/n, Ciudad Universitaria, Coyoacán, 04510 Ciudad de México, México
d Instituto Tecnológico del Valle de Oaxaca, Ex Hacienda de Nazareno s/n, 71230 Santa Cruz Xoxocotlán, Oaxaca, México
e Instituto de Investigaciones en Ecosistemas y Sustentabilidad, Universidad Nacional Autónoma de México, Antigua Carretera a Pátzcuaro Núm. 8701, Col. Ex Hacienda de Sán José de la Huerta, 58190 Morelia, Michoacán, México
*Autor para correspondencia: rgaribay@ib.unam.mx (R. Garibay-Orijel)
Recibido: 30 diciembre 2019; aceptado: 26 abril 2020
Resumen
En los bosques de Ixtlán de Juárez, Oaxaca, el género Laccaria es de los más productivos a nivel de esporomas. En este trabajo se comparó la posición que ocupa el género Laccaria en la estructura de la comunidad de hongos ectomicorrízicos medida a través de la abundancia de esporomas vs. micorrizas. El muestreo se desarrolló en 3 sitios con dominancia de Pinus patula. Los esporomas de hongos fueron recolectados y se tomaron los datos de producción (cantidad y peso). Las micorrizas se obtuvieron de muestras de suelo, de éstas se secuenció la región ITS para su identificación molecular. No existió una correspondencia entre la abundancia relativa (AR) de las especies más abundantes a nivel de esporoma (L. laccata AR = 0.43, Cantharellus tubaeformis AR = 0.27, Lactarius chrysorrehus AR = 0.10 y L. vinaceobrunnea AR = 0.08) y las más abundantes a nivel de micorrizas (Lactarius aff deceptivus AR = 0.25, Cortinarius aff ochrophyllus AR = 0.12, Hydnum aff cuspidatum AR = 0.05, Russula sp.1 AR = 0.05 y Sebacina aff dimitica AR = 0.05). Potencialmente, los géneros abundantes a nivel de esporomas y micorrizas tendrían que usarse en programas de micorrización y evaluarse en invernadero para desarrollar inóculos.
Palabras clave: Pinus patula; Lactarius deceptivus; Laccaria laccata; Ecología; Macromicetos; Oaxaca
© 2020 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Comparison between Laccaria basidiomata and ectomycorrhizae abundances in Ixtlán de Juarez, Oaxaca
Abstract
In the forests of Ixtlán de Juarez, Oaxaca, the genus Laccaria is one of the most productive at basidiomata level. In this work, we compared the placement of Laccaria in the edible ectomycorrhizal fungi community measured by basidiomata abundance versus mycorrhizae. The sampling took place in 3 sites with Pinus patula dominance. The fungi basidiomata were collected to determine their taxonomic identity and production data (quantity and weight). Mycorrhizae were obtained from soil core samples, which ITS DNA was sequenced for molecular identification. There was no correspondence between the species with higher basidiomata production (L. laccata AR = 0.43, Cantharellus tubaeformis AR = 0.27, Lactarius chrysorrehus AR = 0.10, and L. vinaceobrunnea AR = 0.08) and those with more abundant mycorrhizae (Lactarius aff deceptivus AR = 0.25, Cortinarius aff ochrophyllus AR = 0.12, Hydnum aff cuspidatum AR = 0.05, Russula sp.1 AR = 0.05, and Sebacina aff dimitica AR = 0.05). Potentially, the genera with most basidiomata and mycorrhizae should be used in mycorrhization programs and tested in greenhouse experiments. This would allow the production of ectomycorrhizal inoculums consortia based on most ecologically outstanding species.
Keywords: Pinus patula; Lactarius deceptivus; Laccaria laccata; Ecology; Mushrooms; Oaxaca
© 2020 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
Las comunidades microbianas del suelo presentan un papel importante en la mediación de los procesos del ecosistema, estas interacciones ecológicas y fisiológicas entre los organismos, están determinadas por factores bióticos y abióticos. Las plantas han desarrollado diferentes adaptaciones para contrarrestar sus limitaciones nutricionales, estrés hídrico, resistencia a patógenos o contaminantes (Gil-Martínez et al., 2018; Martin et al., 2008; Smith y Read, 2008). Una de las estrategias, es el establecer asociaciones mutualistas con microorganismos, como bacterias y hongos en las raíces; lo que se logra, entre otros mecanismos, a través de los exudados de las raíces que regulan las comunidades microbianas facilitando la simbiosis mutualista (Bais et al., 2004; Sanon et al., 2009).
La simbiosis ectomicorrízica se define como “una estructura en la cual la unión simbiótica entre un hongo y el órgano de absorción de las plantas, confiere un incremento en la adecuación sobre una o ambas partes” (Smith y Read, 2008), este tipo de interacción se lleva a cabo con cientos de especies de los phyla Basidiomycota, Ascomycota y Zigomycota. Se estima que existen entre 20,000 y 25,000 especies de hongos ectomicorrízicos a nivel global, de las cuales se han descrito cerca de 6,000, asociadas a cerca de 2.2% de plantas vasculares (Brundrett y Tedersoo, 2018; O´Hanlon, 2012; Smith y Read, 2008; Tedersoo et al., 2009, 2012). Los hongos ectomicorrízicos (HEC) facilitan hasta 75% de P y 80% del N que absorbe la planta; ésto mediante diferentes tipos de exploración ya sea corta, mediana y de larga distancia (Rosinger et al., 2018). Por lo tanto, las comunidades fúngicas en los bosques son esenciales para la salud forestal, la productividad y recuperación de los eventos de disturbio (Bowman y Arnold, 2018).
Los HEC presentan un ciclo de vida con una fase asexual o vegetativa (micelio y micorrizas), y una fase sexual (esporomas y esporas); por lo tanto, el estudio de las comunidades de hongos ectomicorrízicos puede realizarse a partir de esporomas y esporas encontradas en la superficie del suelo y/o por micelio y micorrizas extraídas del mismo. De hecho, cada una de estas fases del ciclo de vida reflejan un nivel de estructura diferente de la comunidad.
Los estudios a través de la producción de esporomas tienen como objetivo medir la disponibilidad del recurso y hacer propuestas de manejo, por ejemplo, como recursos alimenticios o como inóculo nativo para procesos de micorrización (Garibay-Orijel et al., 2009; Gómez-Hernández et al., 2019; Montoya, 2005; Montoya et al., 2005; Nantel y Peter, 1992; Salo, 1993, Schmitt et al., 1999). Mientras que el estudio a partir de las micorrizas se ha centrado en conocer la presencia, abundancia y diversidad de las especies en su fase de interacción con sus hospederos (Argüelles-Moyao y Garibay-Orijel, 2018; Argüelles-Moyao et al., 2016; Baeza-Guzmán et al., 2017; Dickie y Reich, 2005; Dickie et al., 2013; García et al., 2017; Garibay-Orijel et al., 2013; Izzo et al., 2005; Kranabetter et al., 2009; Tedersoo et al., 2003).
Pocos estudios se han llevado a cabo con ambas fases del ciclo de vida. Gardes y Bruns (1996) encontraron que la producción de esporomas por Suillus pungens y Amanita franchetii es prolífica en Pinus muricata, pero la abundancia relativa de micorrizas formadas por estas 2 especies es baja. En contraste, las micorrizas formadas por Russula amoenolens forman cerca de 30% del número total de micorrizas que se analizaron; sin embargo, el número de estructuras reproductoras producidas por esta especie es baja. Reverchon et al. (2012) reportan la estructura de la comunidad en ambas fases de la asociación fúngica en Pinus montezumae en la sierra Chichinautzin, México, teniendo que a nivel de esporoma los géneros Inocybe y Laccaria son los dominantes en los sitios jóvenes e intermedios, mientras que Amanita flavoconia, Cantharellus cibarius y Tricholoma imbricatum son dominantes en sitios antiguos. Al estudiar las micorrizas, las especies más abundantes fueron Cenococcum geophilum, una especie del género Clavulina y muestras pertenecientes a la familia Atheliaceae en los sitios jóvenes, mientras que los sitios intermedios y antiguos fueron dominados por muestras de especies de la familia Thelephoraceae.
En México, las investigaciones se han enfocado en la ecología de comunidades de hongos ectomicorrízicos en bosques de coníferas a nivel de esporomas, estos trabajos frecuentemente encuentran que el género Laccaria es de los que produce esporomas más abundantemente. Por ejemplo: L. amethystina y L. laccata en el estado de Veracruz (Villarreal, 1996); L. laccata s.l., L. proxima, L. bicolor s.l. y L. amethystina s.l. en Michoacán (Gómez-Reyes, 2005); L. laccata s.l., L. amethystina s.l. y L. bicolor s.l. en Chihuahua (Quiñonez-Martínez et al., 2005); L. trichodermophora, L. bicolor s.l. y L. amethystina s.l. en Tlaxcala (Montoya et al., 2005); L. laccata var. pallidifolia, L. vinaceobrunnea y L. amethysteo-occidentalis en Oaxaca (Garibay-Orijel et al., 2009); L. bicolor s.l. y L. laccata s.l. en Morelos (Reverchon et al., 2012); L. sp. 1 y L. sp. 2 en Oaxaca (Gómez-Hernández et al., 2019).
En contraste, los estudios de estructura de comunidades a nivel de ectomicorrizas registran que los géneros más abundantes son: Tuber en Guerrero en un bosque de Quercus (Morris et al., 2008a, b); Clavulina y Cortinarius en Tlaxcala en Alnus (Kennedy et al., 2011); Clavulina cf. cinerea en el Estado de México en Abies religiosa (Argüelles-Moyao et al., 2016); Tomentella y Russula en Michoacán en Quercus (García et al., 2017); Russula aff. olivobrunnea en el Estado de México en Abies religiosa (Argüelles-Moyao y Garibay-Orijel, 2018).
Ixtlán de Juárez, Oaxaca es una comunidad modelo desde el punto de vista forestal. Tiene la certificación internacional del Forest Stewardship Council (FSC) desde 2001 hasta la fecha (Pacheco-Aquino et al., 2015). También es un modelo micológico pues diversos estudios de estructura de la comunidad a nivel de esporoma se han llevado a cabo en dicha zona en los cuales el género Laccaria es de los más abundantes (Garibay-Orijel et al., 2009; Gómez-Hernández et al., 2019). Dado que este patrón persiste a lo largo del tiempo, se planteó la siguiente hipótesis de trabajo: siendo el género Laccaria el más abundante a nivel de esporomas, también debe serlo a nivel de micorrizas.
Materiales y métodos
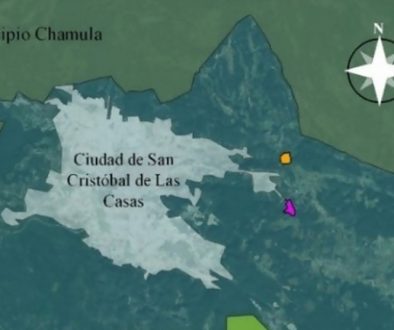
Ixtlán de Juárez, Oaxaca, se ubica entre las coordenadas 17o18’16” y 17o34’00” N, 96o31’38” y 96o20’00” O, en un intervalo altitudinal de 1,900 a 2,900 m. Tiene clima templado húmedo con lluvias en verano C(m) (w´) b(i´)g, con temperatura media anual de 15 oC, precipitaciones que van de 1,000 a 1,300 mm concentradas en junio a noviembre (Castellanos-Bolaños et al., 2010; Ruíz-Aquino et al., 2015). El tipo de suelo predominante es acrisol húmico (Ah) con textura media limosa. La región se encuentra incluida en la provincia fisiográfica denominada Sistema Montañoso del Norte de Oaxaca. Es un área de topografía muy accidentada, una parte de esta provincia podría considerarse como prolongación de la Sierra Madre Occidental (Castellanos-Bolaños et al., 2010).
La superficie total del municipio es de 19,310 hectáreas, de las cuales 12,389 están bajo manejo forestal; la comunidad es pionera en el manejo forestal sustentable desde el año de 2001 y hasta la fecha, cuenta con la certificación forestal internacional SmartWood de Rainforest Alliance, que ejecuta la certificación para FSG (Forest Stewardship Council), así como la certificación por parte del Fondo Mundial para la Naturaleza (WWF). La estructura del bosque está integrada por Pinus patula, P. oaxacana, P. pseudostrobus, P. douglasiana, P. ayacahuite, P. teocote, P. hartwegii (= rudis), P. leiophylla, Quercus corrugata, Q. crassifolia, Q. rugosa, Clethra lanata y Arbutus xalapensis (Castellanos-Bolaños et al., 2010; Ruiz-Aquino et al., 2015); si bien la diversidad es amplia, cabe mencionar que existen rodales de uso forestal que son estrictamente de P. patula y en sus alrededores domina Q. crassifolia generalmente.
Para conocer la importancia del género Laccaria en la comunidad de esporomas de hongos ectomicorrízicos comestibles, se eligieron 3 parcelas al azar monitoreando la producción de esporomas durante la temporada de lluvias (junio-octubre de 2013) cada 15 días, teniendo un total de 9 muestreos en cada sitio (tabla 1). Las parcelas tuvieron una extensión de 100×100 m y en cada una de ellas, se trazaron 10 transectos aleatorios de 34 m de largo × 4 m de ancho. Se tomó el dato de número de esporomas y peso fresco por especie presente; teniendo en consideración el rango de hongos raros (1 a 10 esporomas), escasos (11-100), abundantes (101-1,000) y muy abundantes (más de 1,000 esporomas) (Garibay-Orijel et al., 2009); la determinación taxonómica se llevó a cabo con literatura especializada de los diversos géneros encontrados.
Tabla 1
Características de las parcelas estudiadas a nivel de esporomas y ectomicorrizas en Ixtlán de Juárez, Oaxaca.
|
Sitio I “Camino Real” |
Sitio II “Viveros” |
Sitio III “Madroños” |
|
|
Ubicación (UTM) |
1921348 N 770298 E |
1920835 N 768728 E |
1923044 N 767783 E |
|
Altitud |
2,796 |
2,480 |
2,461 |
|
Pendiente |
22o |
15o |
47o |
|
Exposición de ladera |
Sur (S) |
Noreste (NE) |
Sureste (SE) |
|
Compactación de suelo |
Baja |
Media |
Baja |
|
Tipo de vegetación |
Pinus (70%) Quercus (30%) |
Pinus (90%) Quercus (10%) |
Pinus (60%) Quercus (40%) |
|
Altura dominante |
24.1 m en promedio |
31.2 m en promedio |
25.2 m en promedio |
|
Especie arbórea dominante |
Pinus patula |
Pinus patula |
Pinus patula |
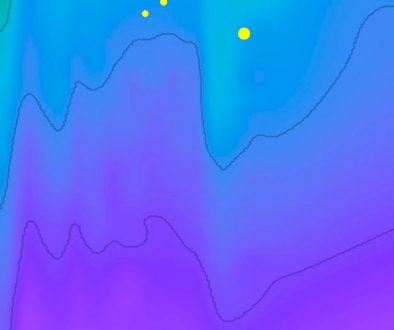
En el caso de las ectomicorrizas, el muestreo se llevó a cabo en septiembre del mismo año, en las mismas parcelas en las que se muestrearon los esporomas, con 3 transectos de 60 m de largo separados entre sí por 20 m. En éstos, en los metros 20, 40 y 60, se recolectó suelo con un tubo de PVC de 30 cm de largo por 2.5 cm de diámetro (Kennedy et al., 2011; Reverchon et al., 2012). En total se muestrearon 9 núcleos de suelo por parcela, cada uno de 30 cm de profundidad, los cuales se almacenaron en bolsas de plástico en campo y se colocaron en el refrigerador para ser procesados en laboratorio.
Para la obtención de las ectomicorrizas, se tamizó el suelo a través de 2 mallas, una de 850 micras y otra de 2 mm de apertura. El suelo se enjuagó con agua corriente y se colocó el contenido de las raíces que quedó sobre éstos, en una tina de color blanco (para facilitar la observación de raíces) llena de agua. Se tomaron las raíces ectomicorrizadas con ayuda de pinzas de punta fina y se colocaron en frascos con agua destilada fría. La disección se realizó sobre una caja de Petri bajo el microscopio estereoscópico.
La extracción de ADN se llevó a cabo con el kit Xnap (Sigma-Aldrich) utilizando placas para PCR (GENEMate, ISC BioEXpress) de 96 pozos, en cada pozo se agregaron 10 mm de solución de extracción adicionando en cada uno un fragmento de 1 mm de micorriza. Posteriormente, en el termociclador (Applied biosystems), se colocaron las muestras con el siguiente programa: 65 oC por 10 minutos y 95 oC por 10 minutos (Kennedy et al., 2011; Garibay-Orijel et al., 2013). Luego, se añadieron 20 mm de solución de dilución, se dejaron reposar durante 30 minutos a temperatura ambiente y después se guardaron a 4 oC. Una vez que se obtuvo el ADN, se amplificó la región de los interespaciadores ribosomales (ITS). La región ITS de ADNr se amplificó utilizando los cebadores ITS1F e ITS4 y la mezcla maestra Redextract-N-Amp (Sigma-Aldrich) (Gardes y Bruns, 1996; White et al., 1990).
La PCR se llevó a cabo mediante el siguiente protocolo: 94 oC por 3 min (desnaturalización); 34 ciclos de 94 oC por 1 min (desnaturalización), 51 oC por 1 min (alineamiento), 72 oC por 1 min (elongación); un ciclo de 72 oC por 8 min y finalmente 4 oC (Argüelles-Moyao et al., 2016; Garibay-Orijel et al., 2013; Izzo et al., 2005). La calidad de los amplicones se evaluó mediante electroforesis en gel de agarosa a 1%, aquellos amplicones de buena calidad se limpiaron con 1 mm de EXO-SAP-IT (Affymetrix) y 1 mm de agua de PCR por cada 3.5 mm de muestra de PCR en un termociclador a 37 oC durante 45 min, seguido de 80 oC durante 15 min y manteniéndola a 4 oC. Los productos de PCR limpios, se secuenciaron en sentido inverso con el cebador ITS4 en el Laboratorio de Secuenciación Genómica de la Biodiversidad en el Instituto de Biología de la Universidad Nacional Autónoma de México (Argüelles-Moyao et al., 2016; Garibay-Orijel et al., 2013).
Las secuencias de ADN fueron editadas y agrupadas en unidades moleculares de operación taxonómica (MOTU) con una similitud de nucleótidos de 97% en Geneious R8. Para asignar identidad taxonómica a los MOTU, realizamos una búsqueda BLAST en GenBank (NCBI) utilizando solo secuencias de especímenes voucher (Argüelles-Moyao y Garibay-Orijel, 2018; Argüelles-Moyao et al., 2016). Las secuencias representativas de cada MOTU se depositaron en Genbank con los códigos MT329593-MT329618.
Se comparó la abundancia de las especies de hongos ectomicorrízicos encontrados a nivel de esporomas contra la abundancia de las micorrizas en 3 parcelas en el año 2013.
Resultados
La diversidad de hongos comestibles a nivel de esporomas fue de 17 taxones (13 ectomicorrízicos y 4 saprobios). Los sitios muestreados con mayor diversidad de especies fueron el S1 y S2 con 12 taxones cada uno; el sitio con menos especies fue el S2 con 10. Teniendo que los sitios más parecidos entre sí fueron S1-S3 con similitudes de 54%, mientras que los sitios más distintos entre sí fueron S1-S2 y S2-S3, con 25% y 10% respectivamente.
Se registraron en total 2,380 esporomas, en promedio, 793 por sitio de muestreo; durante agosto, el S1 y S3 alcanzaron un promedio de 500 esporomas, mientras que para septiembre, el S1 disminuyó a 180 y el S3 aumentó a 1,050. Laccaria laccata fue la única especie que produjo más de 1,000 esporomas; de tal forma que 7 especies fueron comunes y 6 raras (tabla 2, fig. 1).
En el caso de la producción de biomasa total, Laccaria laccata fue la especie de mayor producción con 2.107 kg/3 SM, seguida de Cantharellus tubaeformis con 1.428 kg/3 SM; el resto de las especies obtuvieron una biomasa menor a los 500 g/3 SM. La producción de esporomas comenzó desde principios de junio hasta finales de octubre para Lactarius chrysorrehus (FT = 0.88), seguida de Suillus tomentosus (FT = 0.66) y L. laccata, C. tubaeformis e Hydnum repandum (FT = 0.55) (tabla 2). Se encontró que Russula cyanoxantha solo apareció en el S1, así como L. proxima, exclusivamente en el S2; 4 especies estuvieron presentes en todos los sitios de muestreo: S. tomentosus, L. laccata, L. vinaceobrunnea y L. chrysorrheus.
Se obtuvieron 57 secuencias de ectomicorrizas, las cuales correspondieron con 26 taxones de hongos ectomicorrízicos, 14 identificados a nivel de especie, 10 a nivel de género, 1 familia y 1 orden. Las especies pertenecieron principalmente a la familia Russulaceae (2 géneros, 6 especies) siendo también la familia más abundante, seguida de Cortinariaceae (1 género, 4 especies) y Thelephoraceae (1 género, 3 especies). Se encontró una riqueza de 13 géneros ectomicorrízicos: Byssocorticium, Cenococcum, Cortinarius, Elaphomyces, Hydnum, Hygrophorus, Lactarius, Piloderma, Ramaria, Russula, Sebacina, Sistotrema y Tomentella (tabla 3). El género más diverso fue Russula con 5 especies, seguido de Cortinarius con 4 y Piloderma y Tomentella con 3 especies cada uno. Las especies con mayor frecuencia fueron Lactarius aff deceptivus (14 micorrizas) con una AR = 0.25, Cortinarius aff ochrophyllus AR = 0.12 (7 micorrizas), Hydnum aff cuspidatum, Russula sp.1 y Sebacina aff dimitica (3 micorrizas cada una) AR = 0.05; el resto fueron encontradas en 2 (AR = 0.04) o en una micorriza (AR = 0.02) (tabla 3, fig. 2).
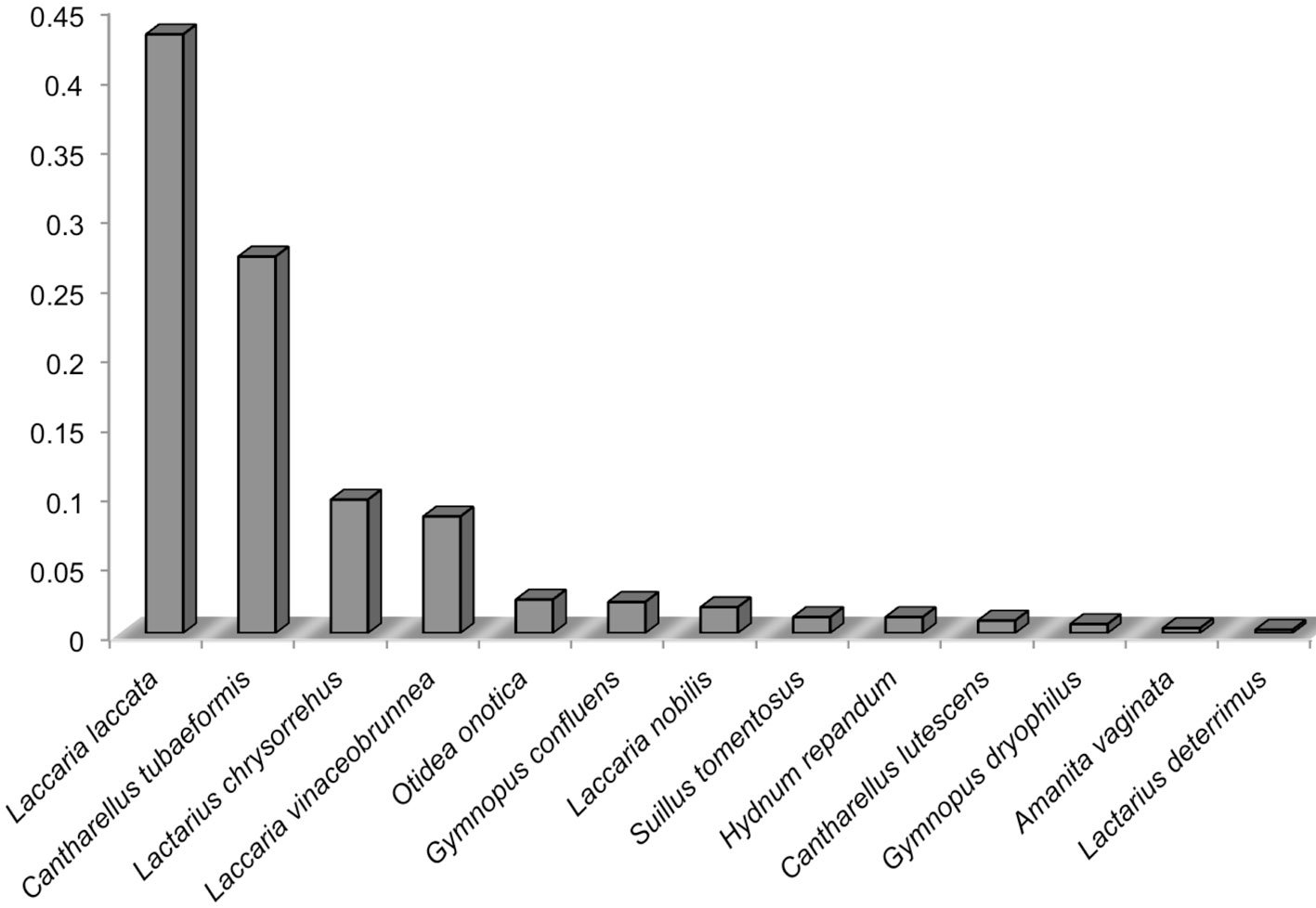
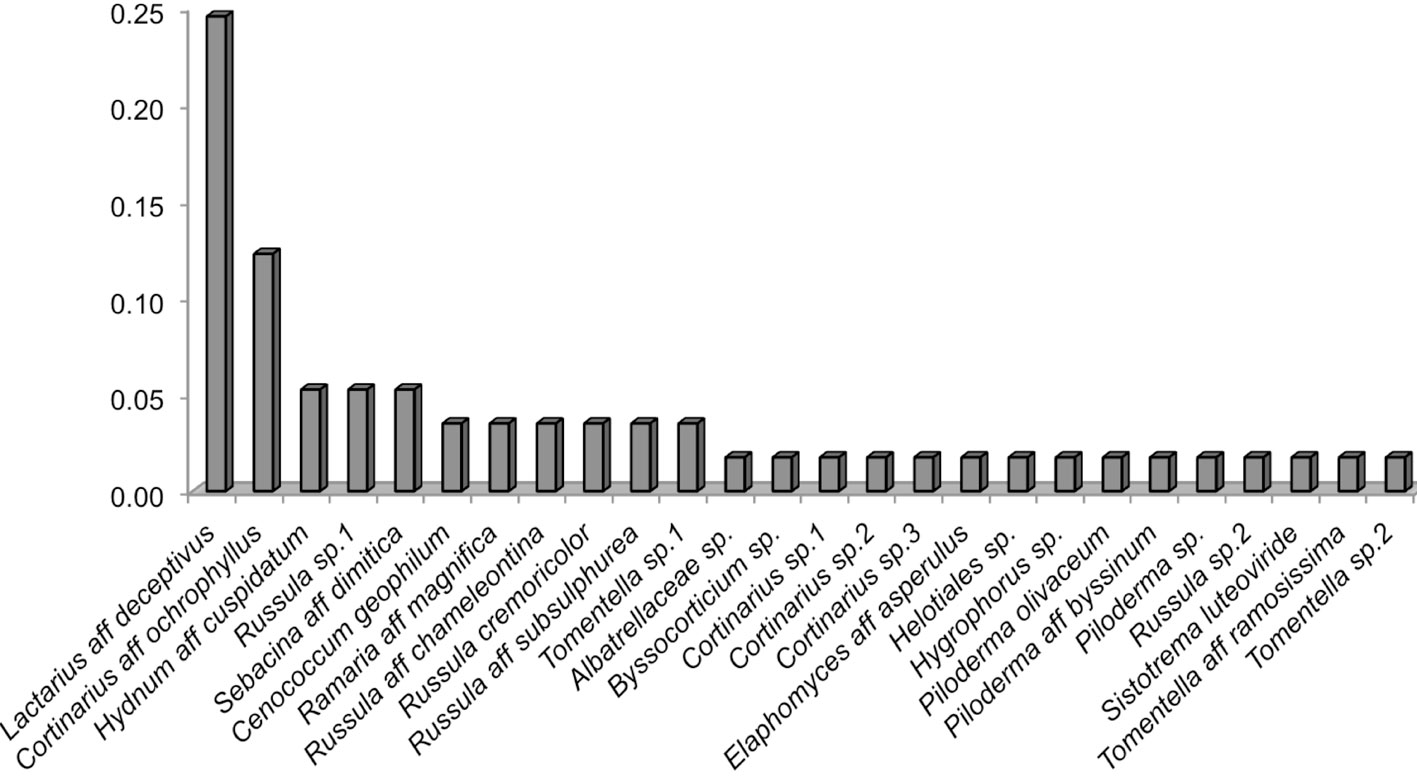
Tabla 2
Variables ecológicas en la producción de esporomas de hongos ectomicorrízicos de Ixtlán de Juárez, Oaxaca
|
Especie |
AA |
AR |
FT |
FE |
FER |
EBT |
EBR |
|
*Laccaria laccata |
1,033 |
0.43 |
0.5 |
1 |
0.09 |
2,107.3 |
0.34 |
|
*Cantharellus tubaeformis |
648 |
0.27 |
0.5 |
0.6 |
0.05 |
1,428.8 |
0.23 |
|
*Lactarius chrysorrehus |
230 |
0.10 |
0.8 |
1 |
0.09 |
1,007.3 |
0.16 |
|
*Laccaria vinaceobrunnea |
201 |
0.08 |
0.4 |
1 |
0.09 |
346.2 |
0.06 |
|
*Otidea onotica |
58 |
0.02 |
0.4 |
0.6 |
0.05 |
91.8 |
0.02 |
|
*Gymnopus confluens |
54 |
0.02 |
0.2 |
0.3 |
0.03 |
37.5 |
0.01 |
|
*Laccaria proxima |
45 |
0.02 |
0.1 |
0.3 |
0.03 |
91.5 |
0.01 |
|
**Hydnum repandum |
28 |
0.01 |
0.5 |
1 |
0.09 |
265.1 |
0.04 |
|
**Suillus tomentosus |
28 |
0.01 |
0.6 |
1 |
0.09 |
487.7 |
0.08 |
|
**Cantharellus lutescens |
22 |
0.009 |
0.1 |
0.3 |
0.03 |
11.5 |
0.002 |
|
**Gymnopus dryophilus |
16 |
0.007 |
0.3 |
1 |
0.09 |
62.4 |
0.01 |
|
**Amanita vaginata |
9 |
0.004 |
0.3 |
1 |
0.09 |
174.5 |
0.03 |
|
**Lactarius deterrimus |
6 |
0.003 |
0.1 |
1 |
0.05 |
74.8 |
0.01 |
AA: Abundancia absoluta; AR: abundancia relativa; FT: frecuencia temporal; FE: frecuencia espacial; FER: frecuencia espacial relativa; EBT: estimación de biomasa total; EBR: estimación de biomasa relativa. *Especies comunes; **especies raras.
Discusión
Laccaria es el género más productivo en esporomas en los bosques de Ixtlán de Juárez, en sitios con manejo y sin manejo forestal a través del tiempo (Garibay-Orijel et al., 2009; Gómez-Hernández et al., 2019). Garibay-Orijel et al. (2009) registraron un total de 81 especies de hongos comestibles monitoreados durante 2 años en 8 sitios muestreados; en el presente estudio, la diversidad estuvo representada por tan solo 21% de lo reportado en 2009, ésto en una temporada de lluvias en 3 sitios muestreados. La producción total de esporomas en 2001 fue de 5,851, en 2002 fue de 4,611 (tomando en cuenta solo 3 sitios muestreados), mientras que en 2013, se obtuvo 41% y 51% en relación al 2001 y 2002, respectivamente. La baja producción de esporomas en 2013 se puede deber a diversos factores ambientales, edáficos, entre otros; recordando que los hongos presentan la característica de formar esporomas de forma no periódica y/o regular. No obstante, la especie con mayor abundancia en 2009 (AR = 0.44) y 2013 (AR = 0.43) fue Laccaria laccata, cabe mencionar que los sitios muestreados por Garibay-Orijel et al. y los del presente estudio, aunque son diferentes, son homogéneos teniendo a Pinus patula como la especie dominante a nivel arbóreo.
El tamaño del área muestreada, en términos de abundancia, en los bosques de Ixtlán de Juárez parece no ser un factor que afecte el resultado en cuanto a la especie dominante de hongos micorrízicos y ésto podría ser por la homogeneidad de la vegetación; en términos de biomasa, L. laccata presentó la mayor producción en 2001 con 6.62 kg/3 SM y en 2002, con 6.61 kg/3 SM; de igual forma, para 2013 fue la especie más productiva, sin embargo, comparando con lo reportado por Garibay-Orijel et al. (2009), fue 68% más bajo.
Gómez-Hernández et al. (2019) registraron al género Laccaria como uno de los más diversos en terminos de especies (9), teniendo que Laccaria sp.1 es la tercera especie más abundante, creciendo en un bosque bajo manejo forestal. Garibay-Orijel et al. (2009) y el presente estudio coincidieron en la dominancia de L. laccata en un bosque sin manejo forestal.
Tabla 2
Variables ecológicas en la producción de esporomas de hongos ectomicorrízicos de Ixtlán de Juárez, Oaxaca
|
Especie |
AA |
AR |
FT |
FE |
FER |
EBT |
EBR |
|
*Laccaria laccata |
1,033 |
0.43 |
0.5 |
1 |
0.09 |
2,107.3 |
0.34 |
|
*Cantharellus tubaeformis |
648 |
0.27 |
0.5 |
0.6 |
0.05 |
1,428.8 |
0.23 |
|
*Lactarius chrysorrehus |
230 |
0.10 |
0.8 |
1 |
0.09 |
1,007.3 |
0.16 |
|
*Laccaria vinaceobrunnea |
201 |
0.08 |
0.4 |
1 |
0.09 |
346.2 |
0.06 |
|
*Otidea onotica |
58 |
0.02 |
0.4 |
0.6 |
0.05 |
91.8 |
0.02 |
|
*Gymnopus confluens |
54 |
0.02 |
0.2 |
0.3 |
0.03 |
37.5 |
0.01 |
|
*Laccaria proxima |
45 |
0.02 |
0.1 |
0.3 |
0.03 |
91.5 |
0.01 |
|
**Hydnum repandum |
28 |
0.01 |
0.5 |
1 |
0.09 |
265.1 |
0.04 |
|
**Suillus tomentosus |
28 |
0.01 |
0.6 |
1 |
0.09 |
487.7 |
0.08 |
|
**Cantharellus lutescens |
22 |
0.009 |
0.1 |
0.3 |
0.03 |
11.5 |
0.002 |
|
**Gymnopus dryophilus |
16 |
0.007 |
0.3 |
1 |
0.09 |
62.4 |
0.01 |
|
**Amanita vaginata |
9 |
0.004 |
0.3 |
1 |
0.09 |
174.5 |
0.03 |
|
**Lactarius deterrimus |
6 |
0.003 |
0.1 |
1 |
0.05 |
74.8 |
0.01 |
AA: Abundancia absoluta; AR: abundancia relativa; FT: frecuencia temporal; FE: frecuencia espacial; FER: frecuencia espacial relativa; EBT: estimación de biomasa total; EBR: estimación de biomasa relativa. *Especies comunes; **especies raras.
El muestreo de micorrizas nos permitió reconocer las especies abundantes a nivel de raíz, teniendo que Lactarius aff deceptivus (fig. 3) y Cortinarius aff ochrophyllus, fueron las especies más representativas en los sitios de muestreo dentro de un bosque de edad madura, no encontrando a Laccaria dentro de los géneros identificados. Ramírez-Miguel et al. (en prensa) en la misma localidad (Ixtlán de Juárez), estudió la frecuencia de micorrizas en un bosque en regeneración con 3 años de edad después del aprovechamiento forestal de Pinus patula. Él reporta a Russula (19%) como el género más abundante, seguido de Cenococcum y Tomentella (11%, respectivamente), y finalmente Laccaria (4%). Si bien la dominancia a nivel de esporoma en los bosques de Pinus en Ixtlán de Juárez la presenta Laccaria, a nivel de micorrizas no es así, obteniendo una falta de correspondencia entre ambas fases en bosques maduros, aunque en bosques jóvenes sí se encuentran sus micorrizas.
Se sabe que las especies de Laccaria son de las primeras en colonizar los sistemas radiculares en plantas jóvenes, siendo utilizadas para la inoculación desde invernadero, por su capacidad de micorrizar y con ello, garantizar el éxito en el establecimiento en campo (Pera y Parladé, 2005; Quoreshi et al., 2009). Un fenómeno observado en los estudios a nivel de esporomas en México, es la dominancia del género Laccaria, permitiendo de esta forma ser especies modelo en procesos de inoculación en invernadero (Garibay-Orijel et al., 2009; Gómez-Hernández et al., 2019; Gómez-Reyes, 2005; Montoya et al., 2005; Quiñonez-Martínez et al., 2005; Rodríguez-Gutiérrez et al., 2019; Villarreal, 1996).

Reverchon et al. (2012), en un bosque joven de Pinus montezumae, econtraron que Inocybe y Laccaria eran los géneros con mayor dominancia a nivel de esporomas; mientras que a nivel de micorrizas fueron: Cenococcum geophilum, Clavulina sp. 2 y la Familia Athilaceae. Para los bosques de Pinus en Ixtlán de Juárez, existe una similitud en cuanto a patrones, teniendo una falta de correspondencia entre las fases sexuales (esporomas) y vegetativas (micorrizas). Nuestro estudio coincide con Rerverchon et al. (2012), encontando a Laccaria dominante a nivel de esporoma, pero no a nivel de micorrizas. Mientras que en un bosque viejo, Reverchon et al. (2012) registraron como abundantes a Amanita flavoconia, Cantharellus cibarius y Tricholoma imbricatum, y en micorrizas, a la Familia Thelephoraceae. Existe una clara diferencia entre un bosque joven y uno maduro en cuanto a dominancia de hongos ectomicorrizicos y ésto potencialmente puede ser por los requerimientos nutrimentales de la planta en los diferentes estados de desarrollo, así como las condiciones edáficas, la comunidad microbiana, entre otros factores. Pérez-Pazos (2018) estudió la composición de la comunidad fúngica en ambas fases en un bosque monodominante de Abies religiosa en el Estado de México, encontrando una dominancia en esporomas y micorrizas por Clavulina, ésto es un fenómeno poco frecuente, no obstante, él propone que los esporomas de Clavulina se pueden comportar como saprobios facultativos.
La falta de correspondencia entre los estudios a nivel de esporomas vs. micorrizas es una constante en ecología de hongos ectomicorrízicos, sin embargo, el tipo de muestreo puede ser un factor determinante. Las estrategias de exploración del suelo y adquisición de nutrientes son inherentes a cada género de hongos ectomicorrízicos (Rosinger et al., 2018). Se sabe que Laccaria suele estar cerca de las raíces secundarias ya que presenta micorrizas de corta y media distancia. Por lo tanto, el muestreo debería realizarse cerca de los troncos de los hospederos potenciales.
Potencialmente, los géneros abundantes a nivel de esporomas y micorrizas, como son: Laccaria, Cantharellus, Lactarius y Cortinarius (fig. 3) tendrían que ser centro de atención en programas de micorrización y ser evaluados en invernadero; con eso, comenzar a pensar en consorcios de hongos ectomicorrízicos más importantes. Conocer y reconocer los actores involucrados en el sistema ectomicorrízico en los diferentes niveles de estudio (esporomas, esporas, micelio y micorriza), permitirá un mejor entendimiento de la compleja simbiosis, generando nuevas estrategias en los procesos de micorrización con un enfoque holístico, garantizando de esta forma el éxito en invernadero y en campo, en proyectos de reforestación, aforestación y migración asistida.
Las caracteristicas de los bosques de Pinus en Ixtlan de Juárez presentan un patrón muy similar de condiciones, que a nivel de producción de esporomas se ve reflejado en la dominancia de Laccaria, patrón que ha sido constante durante los últimos 20 años.
La hipótesis planteada en el presente estudio se rechaza, ya que la dominancia a nivel de esporoma de Laccaria no corresponde con el de micorrizas, donde Lactarius (L. aff deceptivus) es el más abundante.
Finalmente, la falta de correspondencia entre ambas fases pudiera ser por diversos motivos, el más probable es que Laccaria es un simbionte especializado en pinos jóvenes, pionero en la micorrización de plántulas, por lo tanto, en los bosques maduros estudiados ya ha sido reemplazado por géneros de etapas mas avanzadas como Lactarius, Cortinarius y Russula.
Agradecimientos
Los autores agradecen el apoyo a las autoridades de Ixtlán de Juárez, Oaxaca por el permiso para entrar a la comunidad; a las oficinas de Servicios Técnicos Forestales por el apoyo en el traslado y en la toma de datos en los sitios de muestreo y en especial, a Julio Aureliano Ruiz Aquino y a Elizabeth Nashielly Ramírez Santiago. Al Laboratorio de Secuenciación Genómica de la Biodiversidad en el Instituto de Biología de la Universidad Nacional Autónoma de México. Al Posgrado en Ciencias Biológicas de la Universidad Nacional Autónoma de México; al Consejo Nacional de Ciencia y Tecnología, por la beca otorgada durante los estudios de doctorado. Este proyecto fue parcialmente financiado a RGO por UNAM PAPIIT IN210217.
Referencias
Argüelles-Moyao, A. y Garibay-Orijel, R. (2018). Ectomycorrhizal fungal communities in high mountain conifer forest in central Mexico and their potential use in the assisted migration of Abies religiosa. Mycorrhiza, 28, 1–13. https://doi.org/10.1007/s00572-018-084-0
Argüelles-Moyao, A., Garibay-Orijel, R., Márquez-Valdelamar, L. M. y Arellano-Torrez, E. (2016). Clavulina-Membranomyces is the most important linage within the highly diverse ectomycorrhizal fungal community of Abies religiosa. Mycorrhiza, 27, 53–65. https://doi.org/10.1007/s00572-016-0724-1
Baeza, Y. B., Medel-Ortiz, R. y Garibay-Orijel, R. (2017). Caracterización morfológica y genética de los hongos ectomicorrízicos asociados a bosques de Pinus hartwegii en el Parque Nacional Cofre de Perote, Veracruz. Revista Mexicana de Biodiversidad, 88, 41–48. https://doi.org/10.1016/j.rmb.2017.027
Bais, H. P., Park, S. W., Weir, T. T., Callaway, R. M. y Vivanco, J. M. (2004). How plants communicate using the underground information superhighway. Trends in Plant Science, 9, 26–32. https://doi.org/10.1016/j.tplants.2003.11.008
Bowman, E. A. y Arnold, A. E. (2018). Distributions of ectomycorrhizal and foliar endophytic fungal communities associated with Pinus ponderosa along a spatially constrained elevation gradient. American Journal of Botany, 104, 687–699. https://doi.org/10.1002/ajb2.1072
Brundrett, M. C. y Tedersoo, L. (2018). Evolutionary history of mycorrhizal symbioses and global host plant diversity. New Phytologist, 220, 1108–1114. https://doi.org/10.1111/nph.14976
Castellanos-Bolaños, J. F., Treviño-Garza, E. J., Aguirre-Calderón, O. A., Jiménez-Pérez, J. y Velázquez-Martín, A. (2010). Diversidad arbórea y estructura espacial de bosques de pino-encino en Ixtlán de Juárez, Oaxaca. Revista Mexicana de Ciencias Forestales, 1, 39–52.
Dickie, I. A., Martínez-García, L. B., Koele, K., Grelet, G. A., Tylianakis, J. M., Peltzer, D. A. y Richardson, S. J. (2013). Mycorrhizas and mycorrhizal fungal communities throughout ecosystem development. Plant Soil, 367, 11–39. https://doi.org/10.1007/s11104-013-1609-0
Dickie, I. A. y Reich, P. B. (2005). Ectomycorrhizal fungal communities at forest edges. Journal of Ecology, 93, 244–255. https://doi.org/10.2307/3599392
García, G. O. M., Garibay-Orijel, R., Hernández, E., Arellano-Torres, E. y Oyama, K. (2017). Word-wide meta-analysis of Quercus forests ectomycorrhizal fungal diversity reveals soutwestern Mexico as a hotspot. Mycorrhiza, 27, 811–822.
Gardes, M. y Bruns, T. D. (1996). Community structure of ectomycorrhizal fungi in a Pinus muricata forest: above- and below-ground views. Canadian Journal of Botany, 74, 1572–583. https://doi.org/10.1007/s00572-017-0793-9
Garibay-Orijel, R., Martínez-Ramos, M. y Cifuentes, J. (2009). Disponibilidad de esporomas de hongos comestibles en los bosques de pino-encino de Ixtlán de Juárez, Oaxaca. Revista Mexicana de Biodiversidad, 80, 521–534. http://dx.doi.org/10.22201/ib.20078706e.2009.002.615
Garibay-Orijel, R., Morales-Marañón, E., Domínguez-Gutiérrez, M. y Flores-García, A. (2013). Caracterización morfológica y genética de las ectomicorrizas formadas entre Pinus montezumae y los hongos presentes en los bancos de esporas en la Faja Volcánica Transmexicana. Revista Mexicana de Biodiversidad, 84, 153–169. https://doi.org/10.7550/rmb.29839
Gil-Martínez, M., López-García, A., Domínguez, A., Navarro-Fernández, C. M., Kjøller, R., Tibbett, M. et al. (2018). Ectomycorrhizal fungal communities and their functional traits mediate plant-soil interactions in trace element contaminated soils. Frontiers in Plans Science, 9, 1–15. https://doi.org/10.3389/fpls.2018.01682
Gómez-Hernández, M., Ramírez-Antonio, K. G. y Gándara, E. (2019). Ectomycorrhizal and Wood-decay macromycete communities along development stage of managed Pinus patula in Southwest Mexico. Fungal Ecology, 39, 109–116. https://doi.org/10.1016/j.funeco.2018.12.007
Gómez-Reyes, V. M. (2005). Diversidad de hongos ectomicorrízicos y su relación con diferentes unidades ambientales en el Parque Nacional Barranca del Cupatitzio, Uruapan (Tesis de maestría). Facultad de Biología Universidad Michoacana de San Nicolás de Hidalgo. Morelia, Michoacán.
Izzo, A., Josephine, A. y Bruns, T. D. (2005). Detection of plot-level changes in ectomycorrhizal communities across years in an old-growth mixed-conifer forest. New Phytologist, 166, 619–630. https://doi.org/10.1111/j.1469-8137.2005.01354.x
Kennedy, P. G., Garibay-Orijel, R., Higgins, L. M. y Ángeles-Argáiz, R. (2011). Ectomycorrhizal fungi in Mexican Alnus forests supports the host co-migration hypothesis and continental-scale patterns in phylogeography. Micorrhiza, 6, 559–568. https://doi.org/10.1007/s00572-011-0366-2
Kranabetter, J. M., Durall, D. M. y MacKenzie, W. M. (2009). Diversity and species distribution of ectomycorrhizal fungi along productivity gradients of a southern boreal forest. Mycorrhiza, 19, 99–111. https://doi.org/10.1007/s00572-008-0208-z
Martin, F., Aerts, A., Ahrén, D., Brun, A., Danchin, E. G. J., Duchaussoy, F. et al. (2008). The genome of Laccaria bicolor provides insights into mycorrhizal symbiosis. Nature, 452, 88–93.
Montoya, A. (2005). Aprovechamiento de los hongos silvestres comestibles en el volcán La Malinche, Tlaxcala (Tesis doctoral). Facultad de Ciencias, Universidad Nacional Autónoma de México. México D.F.
Montoya, A., Kong, A., Estrada-Torres, A., Cifuentes, J. y Caballero, J. (2005). Useful wild fungi. La Malinche National Park, Mexico. Fungal Diversity, 17, 115–143.
Morris, M. H., Pérez-Pérez, Smith, M. A. y Bledsoe, M. E. (2008a). Influence of host species on ectomycorrhizal communities associated with two co-occurring oaks (Quercus spp.) in a tropical cloud forest. FEMS Microbiology Ecology, 69, 274–287. https://doi.org/10.1111/j.1574-6941.2009.00704.x
Morris, M. H., Pérez-Pérez, Smith, M. A. y Bledsoe, M. E. (2008b). Multiple species of ectomycorrhizal fungi are frequently detected on individual oak root tips in a tropical cloud forest. Mycorrhiza, 18, 375–383.
Nantel, P. y Peter, N. (1992). Ecology of ectomycorrhizal Basidiomycetes communities on a local vegetation gradient. Ecology, 73, 99–117. https://doi.org/10.2307/1938724
O´Hanlon, R. (2012). Below-ground ectomycorrhizal communities: the effect of small scale spatial and short term temporal variation. Symbiosis, 57, 57–71. https://doi.org/10.1007/s13199-012-0179-x
Pacheco-Aquino, G., Durán-Medina, E. y Ordóñez-Díaz, J. A. (2015). Estimación de carbono arbóreo en el área de manejo forestal de Ixtlán de Juárez, Oaxaca, México. Revista Mexicana de Ciencias Forestales, 29, 126–145.
Pera, J. y Parladé, J. (2005). Inoculación controlada con hongos ectomicorrízicos en la producción de planta destinada a repoblaciones forestales: estado actual en España. Investigación Agraria, Sistemas y Recursos Forestales, 14, 419–433.
Pérez-Pazos, F. E. (2018). Diversidad, ecología y huella isotópica de Clavulina en bosques de Abies del suroeste de la cuenca de México (Tesis de maestría). Faculta de Ciencias, Universidad Nacional Autónoma de México. Ciudad de México.
Quiñonez-Martínez, M., Garza, F. y Vargas, M. (2005). Aspectos ecológicos y diversidad de hongos ectomicorrízicos en bosque de pino encino de 5 localidades del municipio de Bocoyna, Chihuahua. Ciencia en la Frontera, 3, 29–38.
Quoreshi, A. M., Kernaghan, G. y Hunt, G. A. (2009). Mycorrhizal fungi in Canadian forest nurseries and field performance of inoculated seedlings. En D. Khasa, Y. Piché y A. Coughlan (Eds.), Advances in Mycorrhizal Science and Technology (pp. 115-128). Press Ottawa: NRC.
Ramírez-Miguel, A. A., Hernández-Díaz, A. F., Valenzuela-Encinas, C., Garibay-Orijel, R. y Truong, C. (En prensa). Hongos ectomicorrízicos asociados a plantas jóvenes de Pinus patula y Quercus crassifolia en plantaciones del sistema matarrasa de la Sierra Juárez de Oaxaca, México. Scientia Fungorum.
Reverchon, F., Ortega-Larrocea, M. P., Bonilla-Rosso, G. y Pérez-Moreno, J. (2012). Structure and species composition of ectomycorrhizal fungal communities colonizing seedling and adult trees of Pinus montezumae in Mexican neotropical forest. FEMS Microbiology Ecology, 80, 479–487. https://doi.org/10.1111/j.1574-6941.2012.01314.x
Rodríguez-Gutiérrez, I., Ramírez-Martínez, D., Garibay-Orijel, R., Jacob-Cervantes, V., Pérez-Moreno, J., Ortega-Larrocea, M. P. y Arellano-Torrez, E. (2019). Sympatric species develop more efficient ectomycorrhizas in the Pinus-Laccaria symbiosis. Revista Mexicana de Biodiversidad, 90, e902868. https://doi.org/10.22201/ib.20078706e.2019.90.2868
Rosinger, C., Sandén, H., Matthews, B., Mayer, M. y Godbold, D. (2018). Patterns in ectomycorrhizal diversity, community composition, and exploration types in european beech, pine, and spruce forests. Forest, 9, 445. https://doi.org/10.3390/f9080445
Ruiz-Aquino, F., Valdez-Hernández, J. I., Romero-Manzanares. A., Manzano-Méndez, F., Fuentes-López, M. E. (2015). Spatial distribution of two oak species and ecological attributes of pine-oak woodlands from Ixtlán de Juárez, Oaxaca. Revista Chapingo Serie Ciencia Forestal y del Ambiente, 21, 67–80.
Salo, K. (1993). The composition and structure of macrofungus communities in boreal upland type forest and peatlands in North Karelia, Finland. Karstenia, 33, 61–91. https://doi.org/10.29203/ka.1993.299
Sanon, A., Andrianjaka, Z. N., Prin, Y., Bally, R., Thioulouse, J., Comte, G. y Duponnois, R. (2009). Rhizosphere microbiota interferes with plant-plant interactions. Plant and Soil, 321, 259–278. https://doi.org/10.1007/s11104-009-0010-5
Schmitt, J. P., Murphy, J. F. y Mueller, G. (1999). Macrofungal diversity of a temperate oak forest: a test of species richness estimators. Canadian Journal of Botany, 77, 1014–1027.
Smith, S. E. y Read, D. J. (2008). Mycorrhizal symbiosis. Londres: Academic Press.
Tedersoo, L., Bahram, M., Toots, M., Diédhiou, G., Henkel, W. T., Kjoller, R. et al. (2012). Towards global patterns in the diversity and community structure of ectomycorrhizal fungi. Molecular Ecology, 21, 4160–4170. https://doi.org/10.1111/j1565-294X.2012.05602.x
Tedersoo, L., Köljalg, U., Hallenberg, N. y Larsson, K. H. (2003). Fine scale distribution of ectomycorrhizal fungi and roots across substrate layers including coarse woody debris in a mixed forest. New Phytologist, 159, 153–165. https://doi.org/10.1046/j0028-664x.2003.00792.x
Tedersoo, L., May, T. W. y Smith, M. E. (2009). Ectomycorrhizal lifestyle in fungi: global diversity, distribution, and evolution of phylogenetic lineages. Mycorrhiza, 20, 217–263. https://doi.org/10.1007/s00572-009-0274.x
Villarreal, L. (1996). Los hongos silvestres: componentes de la biodiversidad y alternativas para la sustentabilidad de los bosques templados de México. Montecillo, Estado de México: Colegio de Posgraduados.
White, T. J., Bruns, T. D., Lee, S. B. y Taylor, J. W. (1990). Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. En M. Innis, D. Gelfand, J. Sninsky y T. White. (Eds.), PCR protocols: a guide to methods and applications (pp. 315–322). San Diego: Academic Press.