La estacionalidad climática no afecta la fenología de murciélagos cavernícolas con dieta omnívora
Daniel Ferreyra-García a, Romeo Alberto Saldaña-Vázquez b, * y Jorge E. Schondube a
a Instituto de Investigaciones en Ecosistemas y Sustentabilidad, Universidad Nacional Autónoma de México, Antigua Carretera a Pátzcuaro Núm. 8701, Col. Ex-Hacienda de San José de La Huerta, 58190 Morelia, Michoacán, México
b Instituto de Investigaciones sobre los Recursos Naturales, Universidad Michoacana de San Nicolás de Hidalgo, Av. San Juanito Itzícuaro s/n, Col. Nueva Esperanza, 58337 Morelia, Michoacán, México
*Autor de correspondencia: romeo.saldana@gmail.com (R. A. Saldaña-Vázquez)
Resumen
La fenología de los animales es influenciada de manera importante por la estacionalidad climática que promueve cambios en la abundancia de recursos alimenticios. Especies con dieta omnívora podrían no ser afectadas por la estacionalidad al poder utilizar diferentes recursos disponibles en el tiempo. Para probar esta hipótesis, describimos la fenología reproductiva de 3 especies de murciélagos cavernícolas con diferentes hábitos alimenticios en un bosque templado. Los murciélagos fueron capturados mensualmente a lo largo de 1 año con redes de golpeo y de niebla dentro de 2 cuevas, se encontró que Anoura geoffroyi que se alimenta de insectos, frutos, polen y puede consumir néctar de baja concentración de azúcar, presentó individuos reproductivos en todas las estaciones. Mientras que Leptonycteris yerbabuenae, una especie que se especializa en el consumo de néctar con alta concentración de azúcar y realiza migraciones en busca de la floración y fructificación de plantas quiropterofílicas y quiropterocóricas, estuvo activa reproductivamente en la estación seca/ cálida y al final de las lluvias, lo cual coincidió con la floración de plantas quieropterofílicas de la zona. Finalmente, Myotis velifer, que es insectívoro de los bordes de la vegetación, formó una colonia de maternidad al final de la estación seca/ cálida y al principio de la estación de lluvias. Concluimos que la estacionalidad climática afecta en menor manera la fenología de murciélagos con dieta omnívora en bosques templados.
Palabras clave:
México; Michoacán; Phyllostomidae; Vespertilionidae; Reproducción
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Climatic seasonality does not affect the phenology of cave bats with an omnivorous diet
Abstract
Animals’ phenology is strongly influenced by the climatic seasonality that promotes changes in the abundance of food resources. Species with omnivorous diet may not be affected by seasonality, being able to use different resources over time. To test this hypothesis, we describe the reproductive phenology of 3 species of cave bats with different diet habits in a temperate forest. Bats were captured monthly over 1 year with batting and mist nets traps inside 2 caves, finding that Anoura geoffroyi, a bat that feeds insects, pollen and can consume nectar with low sugar concentration, presented reproductive individuals at all seasons. Whereas, Leptonycteris yerbabuenae, a bat specialized in the consumption of nectar with high concentration of sugar that performs migrations following the flowering and fructification of chiropterophilic and chiropterochoric plants, was reproductive during the dry-warm season and at the end of the rainy one, when chiropterophilic plants was flowering in the zone. Finally, Myotis velifer, a bat that consumes insects on edges and within forest vegetation, formed a maternity colony at the end of the dry-warm season and early rainy season. We conclude that the climatic seasonality does not affect the phenology of bats with an omnivorous diet in temperate forests.
Keywords:
Mexico; Michoacan; Phyllostomidae; Vespertilionidae; Reproduction
Introducción
Los cambios en la composición de las poblaciones de animales y su fenología siguen ciclos anuales sincronizados con eventos climáticos, y de disponibilidad de recursos que disparan respuestas fisiológicas en los individuos de estas poblaciones (Bronson, 1985; Durant et al., 2013; Mello et al., 2004). Por lo tanto, los factores que influyen en los momentos de la reproducción son bióticos y abióticos. Para los murciélagos, la disponibilidad de recursos alimenticios y la selección de parejas reproductivas son los factores bióticos más importantes (Mello et al., 2004; Muñoz-Romo et al., 2012). Mientras que dentro de los abióticos, la disponibilidad de refugio, la temperatura ambiental y la precipitación pluvial son los más importantes (Bronson, 1985; Durant et al., 2013; Mello et al., 2009).
En bosques templados, la actividad reproductiva de murciélagos insectívoros está fuertemente influenciada por la disponibilidad de insectos y el aumento de la temperatura (Anthony et al., 1981; Burles et al., 2009; Hoying y Kunz, 1998). Mientras que en bosques tropicales los patrones de reproducción de murciélagos insectívoros se ven influenciados por el régimen de lluvias que determinan la disponibilidad de recursos alimenticios (Happold y Happold, 1990; Racey y Entwistle, 2000). Por ejemplo, en los bosques tropicales secos del Pacífico mexicano, el final de la gestación en murciélagos insectívoros de la familia Mormoopidae y Natalidae, está sincronizada con la estación de lluvias la cual determina una mayor abundancia de insectos que permite satisfacer las demandas energéticas de las hembras lactantes (Torres-Flores et al., 2012).
En murciélagos frugívoros el final de la gestación se sincroniza con el inicio de la estación lluviosa, lo cual sugiere un ajuste temporal que favorece el encuentro con una mayor disponibilidad de frutos para satisfacer a hembras lactantes (Durant et al., 2013; León y Montiel, 2006). Sin embargo, en bosques tropicales con estaciones climáticas frías (< a 15 ºC) el patrón reproductivo de murciélagos frugívoros se sincroniza con el aumento de la temperatura y no con la disponibilidad de alimentos (Mello et al., 2009). En murciélagos nectarívoros la reproducción está sincronizada con los meses de mayor floración de plantas quiropterofílicas, lo cual generalmente ocurre en la estación seca (Ceballos et al., 1997; Fleming et al., 1972; Stoner et al., 2003).
Un aspecto poco discutido e investigado es el efecto que puede tener la estacionalidad climática en la fenología de especies capaces de alimentarse de animales y plantas (dieta omnívora; Coll y Guershon, 2002). Por ejemplo, los murciélagos Glossophaga commissarisi y Anoura geoffroyi pueden consumir néctar, polen, fruta e insectos de acuerdo a la disponibilidad de recursos del hábitat (Kelm et al., 2008; Ortega y Alarcón, 2008; Tschapka, 2004). Por lo tanto, podríamos suponer que su fenología no estaría sincronizada a la disponibilidad de un recurso alimenticio específico. Por otro lado, dentro de los murciélagos nectarívoros, existen especies como Leptonycteris yerbabuenae, especializadas en el consumo de néctar de alta concentración de azúcar, y que de no hacerlo comprometen sus requerimientos energéticos (Ayala-Berdón y Schondube, 2011; Ayala-Berdón et al., 2013). Por lo que estos murciélagos especializados en el consumo de néctar de alta concentración de azúcar se ven obligados a ajustar su reproducción y migración a la floración de plantas con tal característica (Stoner et al., 2003).
Es de suma importancia conocer los patrones de fenología reproductiva de murciélagos cavernícolas, ya que las cuevas representan uno de los hábitats clave para la reproducción y descanso de los murciélagos (Kunz, 1982; Kunz et al., 2012). Esto es más relevante si se tiene en cuenta que las cuevas y los bosques donde se encuentran están bajo una alta presión antropogénica (Kunz et al., 2012; McCracken, 1989) debido a que de ellas se extrae roca y guano de murciélago para fertilizar cultivos que se encuentran en sus alrededores (Ferreyra-García, 2016). Por lo que las presiones antropogénicas pueden modificar la disponibilidad de recursos o la sincronización de señales próximas que guían el inicio del comportamiento reproductivo (Durant et al., 2013).
El objetivo de este trabajo fue describir la fenología de 3 especies de murciélagos cavernícolas con dieta diferente: A. geoffroyi, omnívoro con capacidad de consumir néctar de flores con baja concentración de azúcar, polen, fruta e insectos (Cruzblanca-Castro, 2016; Ortega y Alarcón, 2008), L. yerbabuenae, nectarívoro especializado en el consumo de néctar de alta concentración de azúcar (Ayala-Berdón y Schondube, 2011), y Myotis velifer, insectívoro que forrajea dentro y en el borde de la vegetación (Kunz, 1974). Estos murciélagos se refugiaron en 2 cuevas de origen volcánico ubicadas en un bosque templado al norte de Michoacán, México (Ferreyra-García, 2016; Rivera-García et al., 2017). Además, describimos la floración de Ipomeoa murucoides y otras plantas quiropterofílicas importantes de la zona de estudio. Esto con el objetivo de evaluar si la floración de las plantas quiropterofílicas coincidía con la reproducción de los murciélagos capaces de consumir néctar.
Predecimos que A. geoffroyi, murciélago omnívoro, presentará individuos reproductivos en todas las estaciones del año, por su alimentación a base de néctar de baja concentración de azúcar, fruta, polen, e insectos (Cruzblanca-Castro, 2016; Ortega y Alarcón, 2008). Mientras que la actividad reproductiva de L. yerbabuenae coincidirá con la estación seca/ caliente, donde la floración de plantas quiropterofílicas de los alrededores es mayor (Carranza-González y Blanco-García, 2000). Por último, M. velifer presentará individuos reproductivos únicamente en las estaciones seca/ cálida y de lluvias, debido al aumento de la temperatura y humedad que incrementa la abundancia de insectos (Anthony et al., 1981; Burles et al., 2009; Hoying y Kunz, 1998; Racey y Entwistle, 2000).
Materiales y métodos
El estudio se realizó de septiembre del 2014 a septiembre del 2015, en 2 cuevas ubicadas en una región montañosa de bosque templado al norte de Michoacán. Ambas cuevas colindan del lado noroeste con la región de selva seca y flora del Bajío y en el resto de las orientaciones con bosque de Pinus–Quercus del Eje Neovolcánico Transversal (Olson et al., 2001). La primera cueva está ubicada en las coordenadas geográficas 19°27’13.60” N, 101°12’54.25” O a 2,215 m snm y se caracteriza por ser una cueva de un solo acceso. La segunda se encuentra a menos de 1 km de distancia de la primera en las coordenadas 19°27’23.22” N, 101°12’40.75” O a una altura de 2,176 m snm y se caracteriza por presentar múltiples accesos. Los árboles dominantes en el bosque templado son Quercus spp., e I. murucoides, el cual es un árbol que posee flores con el síndrome de la quiropterofilia (Caballero-Martínez et al., 2012). Mientras que en la región de selva seca y flora del Bajío se encuentran poblaciones de árboles de la familia Bombacaceae, los cuales también son polinizados por murciélagos, es decir también presentan el síndrome de la quiropterofilia y son un recurso crucial para la supervivencia de murciélagos nectarívoros en selvas secas (Quesada et al., 2003; Stoner et al., 2003).
La captura de murciélagos se realizó mensualmente de septiembre del 2014 a septiembre del 2015. Se utilizaron 2 tipos de redes: 1) 2 redes de mano con tubos telescópicos de 2m, cada una con un aro de 60 cm de diámetro y 1.30 de largo de la bolsa y 2) 1 red de niebla de 12 × 2.5 m. En la cueva de un solo acceso, la recolecta se realizó con la red de niebla colocada en el interior de la cueva y con las redes de mano se capturaron los murciélagos que se encontraban perchados en las zonas más bajas de la misma. Para recolectar los murciélagos de la cueva de múltiple acceso, no fue necesario usar red de niebla, ya que el techo presenta una altura de 4 m, por lo tanto, la recolecta solo se hizo con las redes de mano. Todos los individuos capturados fueron colocados dentro de sacos de manta, para su posterior identificación hasta nivel de especie con el uso de la clave de identificación de murciélagos de México (Medellín et al., 2008). Los murciélagos fueron capturados y manejados de acuerdo a las leyes y con el permiso de colecta (SGPA/DGVS Permiso 12889/13) emitido por la Secretaría del Medio Ambiente y Recursos Naturales (Semarnat).
De cada individuo capturado se registraron los siguientes datos: especie, peso, longitud del antebrazo, edad y condición reproductiva. En el caso de la edad se utilizaron 2 categorías: adulto y juvenil; tomando como criterios el grado de osificación de las falanges (Kunz y Parsons, 2009). Para clasificar la condición reproductiva de cada individuo se tomaron distintos atributos con base al género, macho o hembra. En el caso de los machos se observó la posición de los testículos, abdominales y escrotados (Kunz y Parsons, 2009), a los individuos con testículos abdominales se les consideró en la categoría inactivos. Para las hembras se asignaron 4 categorías: 1) inactivas, hembras sin secreción de leche, y pezones pequeños con pelo alrededor; 2) preñadas, con base en la palpitación del vientre; 3) lactantes, hembras con pezones irritados e inflamados, con ausencia de pelo alrededor del pezón y secreción de leche, y 4) postlactantes, hembras con pezones de color oscuro, ausencia de pelo alrededor del pezón sin secreción de leche (Kunz y Parsons, 2009). Para describir la composición de la población y la fenología reproductiva de cada especie se calculó el porcentaje general de machos y hembras y el porcentaje de individuos reproductivos por sexo y mes. Todos los cálculos y gráficas fueron realizados con el programa de lenguaje de programación R (R Core Team, 2015).
Los datos de temperatura y precipitación diaria de septiembre de 2014 a septiembre de 2015 se obtuvieron a través de la Comisión Nacional del Agua (Conagua). Dentro del área de estudio se describen 3 estaciones: seca/ fría, seca/ cálida y lluvias (tabla 1).
Tabla 1
Valores promedio y error estándar de la temperatura máxima y mínima y precipitación para la zona de estudio. Los datos corresponden al ciclo 2014-2015 y se obtuvieron de la estación meteorológica Tercer Mundo (19º45’54” N, 101º17’53” O) a través de la Conagua, http://www.conagua.gob.mx.
|
Estación |
Mes |
Tmin (ºC) |
Tmax (ºC) |
Precipitación(mm) |
|
Seca/ fría |
Octubre, noviembre, diciembre, enero, febrero |
7.22 ± 0.53 |
21.72 ± 6.87 |
0.95 ± 0.45 |
|
Seca/ caliente |
Marzo, abril, mayo |
8.83 ± 0.50 |
23.92 ± 0.42 |
1.88 ± 0.82 |
|
Lluvias |
Junio, julio, agosto, septiembre |
10.85 ± 0.16 |
23.71 ± 0.29 |
4.35 ± 0.37 |
Para investigar si la actividad reproductiva de los murciélagos nectarívoros coincide con la floración de las plantas quiropterofílicas adyacentes a las cuevas, se tomó nota en cada salida a campo de los meses en los que I. murucoides se encontraba en floración, ya que se encuentran poblaciones de esta planta alrededor de las cuevas y en gran parte del camino hacia la zona de estudio. Posteriormente se buscó información en la literatura de la fenología floral de plantas quiropterofílicas de los alrededores de la zona de estudio y de la selva seca del Bajío, la cual se encuentra al noroeste de las cuevas y de las especies de murciélagos que se alimentan de ellas.
Resultados
Se capturaron un total de 352 individuos, de los cuales 130 correspondieron a individuos de A. geoffroyi (55 hembras y 75 machos), 118 de L. yerbabuenae (62 hembras y 57 machos) y 104 de M. velifer (68 hembras y 36 machos). Se presentaron cambios mensuales en el porcentaje de individuos capturados de las 3 especies a lo largo del año de muestreo (fig. 1). A. geoffroyi fue la única especie residente (fig. 1). Las 2 especies restantes no estuvieron presentes en las cuevas en la estación seca/ fría (fig. 1).
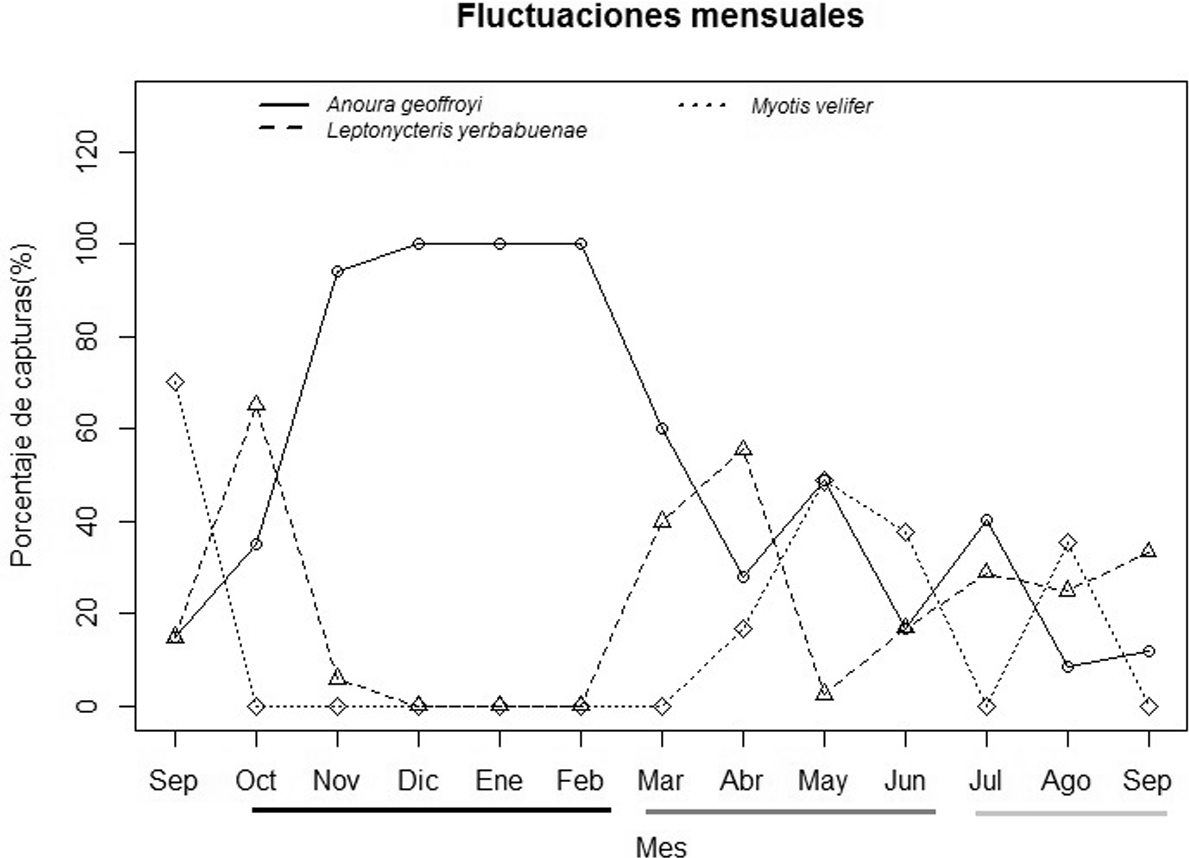
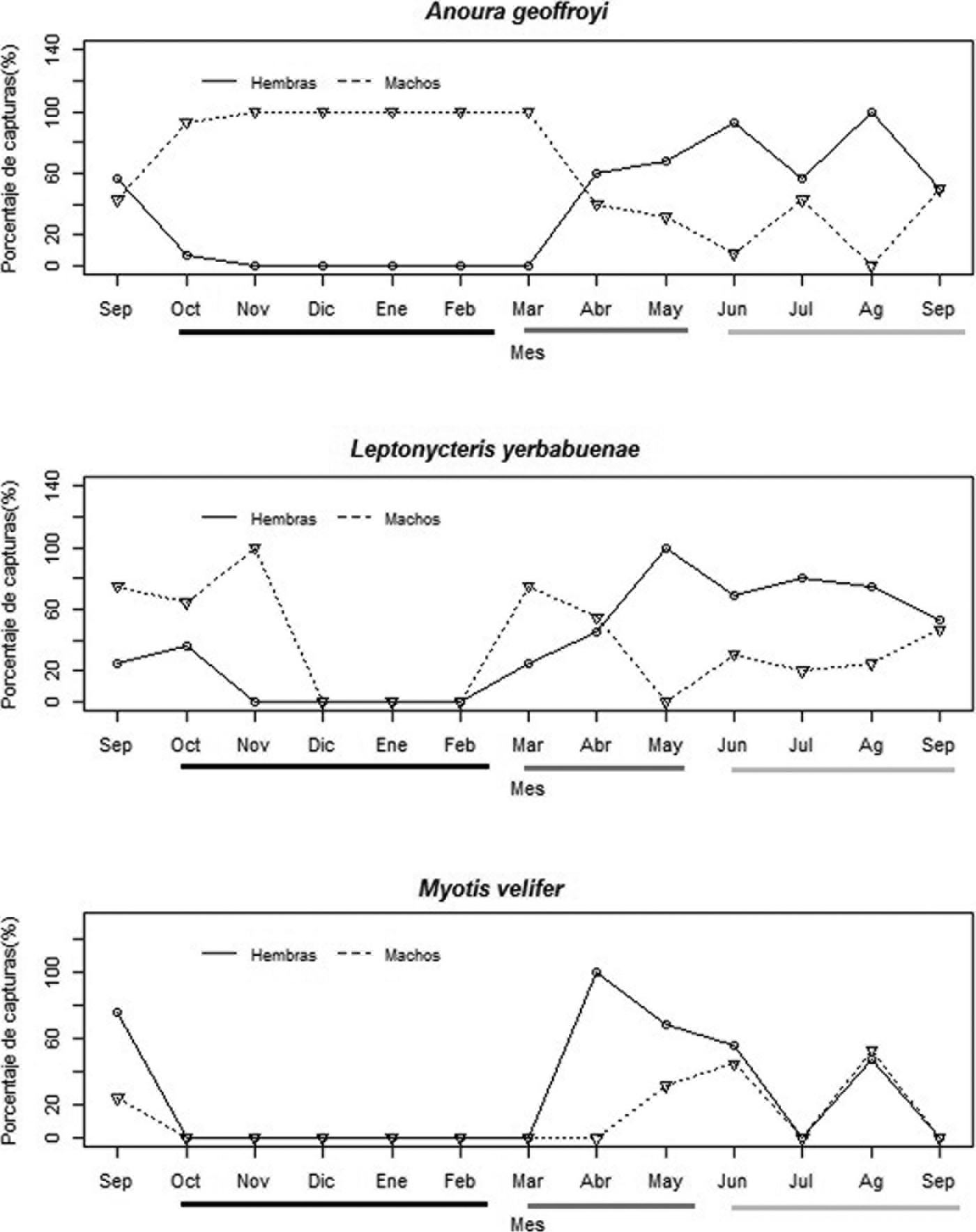
El porcentaje de hembras y machos capturados de las 3 especies presentó variaciones a lo largo del año. A. geoffroyi presentó un mayor porcentaje de machos durante la estación seca/ fría, y seca/ caliente, mientras que en la de lluvias hubo un mayor porcentaje de hembras (fig. 2a). El porcentaje de machos en L. yerbabuenae fue mayor al inicio de la estación seca/ fría y las hembras al final de la estación seca/ caliente y en toda la estación de lluvias (fig. 2b). M. velifer presentó un patrón diferente al mostrado por las 2 especies anteriores. Las hembras dominaron la población al inicio de la estación seca/ caliente, mientras que en la estación de lluvias el porcentaje de hembras y machos capturados fue similar (fig. 2c).
Se presentó una variación en los patrones reproductivos de las especies de murciélagos estudiadas. A. geoffroyi, presentó machos reproductivos durante casi todos los meses del año, y hembras solo en la estación de lluvias (fig. 3a). L. yerbabuenae presentó actividad reproductiva en la estación seca/ caliente y en la de lluvias, los machos reproductivos fueron los más dominantes en la estación seca/ caliente y las hembras preñadas en la estación de lluvias (fig. 3b). La población de M. velifer solo presentó un pico reproductivo, con hembras preñadas en la estación seca/ caliente (fig. 3c). De las 3 especies de murciélagos estudiadas, M. velifer fue la única que formó una colonia de maternidad en la estación seca/ caliente.
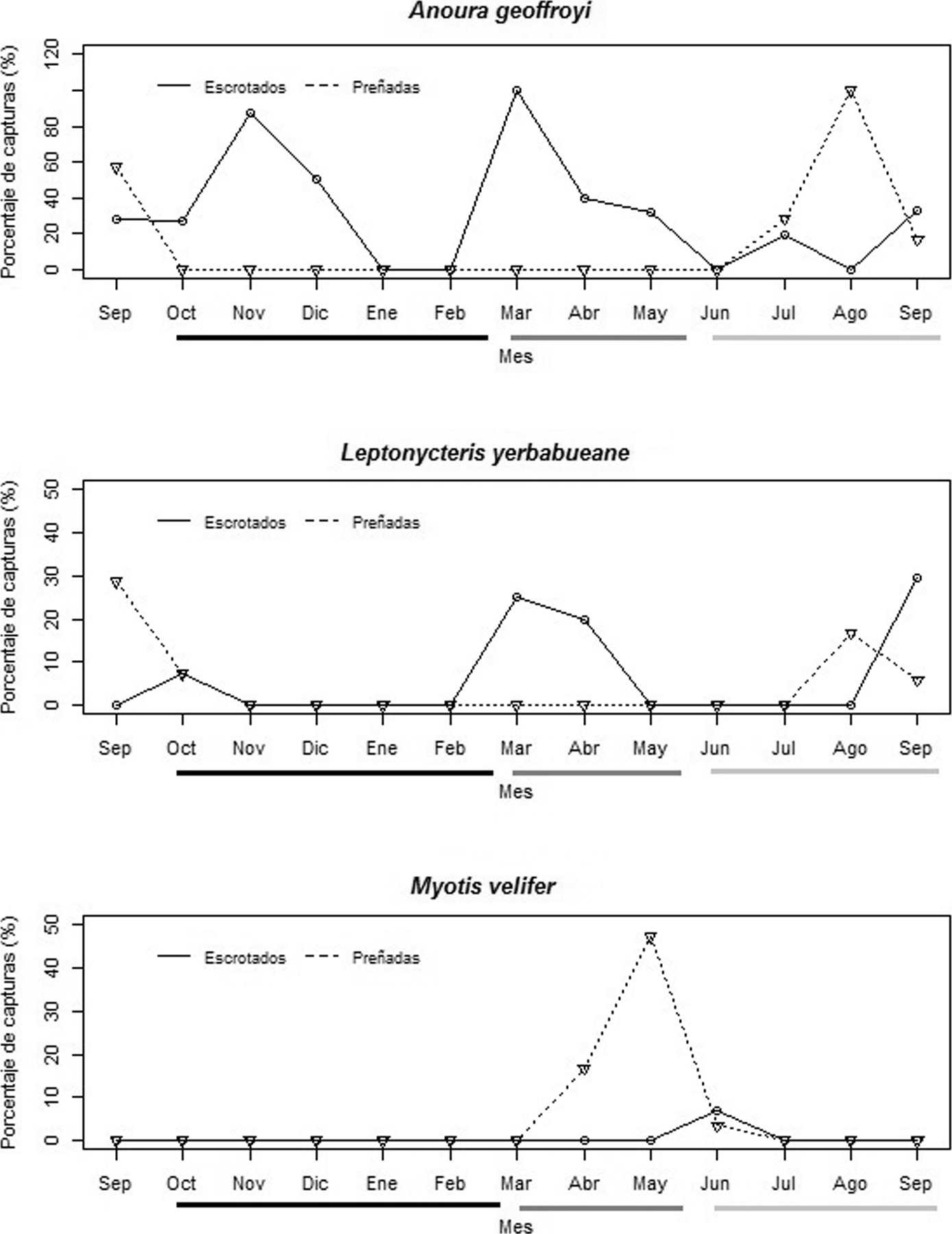
La floración de I. murucoides se presentó de septiembre a febrero (tabla 2) meses que corresponden al final de la estación lluviosa y en la estación seca/ fría (tabla 1). El periodo de floración de esta planta coincidió con la presencia de machos reproductivos de A. geoffroyi y con la ausencia de hembras (figs. 2a, 3a). Encontramos que las especies de plantas que son polinizadas por murciélagos alrededor de la región fueron Ceiba petandra, Ceiba aesculifolia y Pseudobombax ellipticum. La floración de C. petandra y P. ellipticum es al final de la estación seca/ fría e inicio de la seca/ caliente. Mientras que C. aesculifolia está en floración al final de la seca/ caliente y lluvias (tabla 1). El patrón reproductivo de machos de A. geoffroyi coincidió con algunos meses de floración de C. petandra, C. aesculifolia y P. ellipticum y el de las hembras con algunos meses de C. aesculifolia. Por otra parte, la actividad reproductiva de L. yerbabuenae parece coincidir con los primeros meses de floración de I. murucoides y los últimos de C. petandra, P. ellipticum y C. aesculifolia.
Discusión
De acuerdo a nuestras predicciones A. geoffroyi, la especie omnívora, fue la única que presentó individuos reproductivos y fue residente a lo largo del año. Mientras que L. yerbabuenae (nectarívora) y M. velifer (insectívora) estuvieron presentes y activas reproductivamente en las estaciones seca/ caliente y de lluvias. Nuestros resultados sugieren que las especies de murciélagos omnívoras se mantienen reproductivas a lo largo del año, a pesar de las fluctuaciones climáticas. En las siguientes secciones discutiremos otros aspectos de la composición de la población y fenología de cada una de las especies estudiadas.
El rol del clima en la segregación sexual de A. geoffroyi
Anoura geoffroyi presentó una segregación sexual muy marcada a lo largo del año, donde las hembras, incluidas las preñadas, abandonaron la cueva, dejando solo machos reproductivos en la estación seca/ fría. Esto se ha reportado en otras especies de murciélagos de regiones templadas (Barclay, 1991), donde las hembras realizan migraciones a sitios con mayor densidad de alimento y mayor temperatura (Barclay, 1991; Cryan et al., 2000; Dwyer, 1971).
Por otro lado, las hembras reproductivas podrían facilitar su termorregulación y alimentación al migrar a sitios con temperaturas más elevadas (Cryan et al., 2000). Las hembras preñadas y lactantes necesitan mayor ingesta de alimentos, debido a que la reproducción es energéticamente muy costosa, especialmente la lactancia (Neuweiler, 2000; Racey, 1982). Por otro lado, la temperatura más cálida del refugio contribuye al desarrollo de los embriones y crecimiento de las crías (Hoying y Kunz, 1998; Kunz, 1982; Racey, 1982). Por lo tanto, suponemos pero no podemos probar, que las hembras preñadas de A. geoffroyi desaparecieron de la cueva estudiada para moverse a lugares más bajos y cálidos donde pueden formar colonias de maternidad.
La residencia de los machos de A. geoffroyi en las cuevas estudiadas podría deberse a 2 razones: 1) su dieta omnívora y una alta capacidad de mantener un flujo constante de energía al alimentarse de néctares diluidos (Ortega y Alarcón, 2008; Cruzblanca-Castro, 2016) y 2) un menor costo energético en la activación de la reproducción en los machos. Estas razones podrían ocasionar que los machos de A. geoffroyi no necesitan migrar a lugares más cálidos en la estación seca/ fría y mantenerse activos reproductivamente.
El patrón reproductivo descrito para A. geoffroyi, en localidades de clima templado y tropical, es monoestro, el cual se caracteriza por un ciclo de individuos escrotados y gestantes al año (Baumgarten y Vieira, 1994; Galindo-Galindo et al., 2000; Heideman et al., 1992). Este patrón reproductivo no coincide con lo observado en este estudio, pues se registró la presencia de machos escrotados en las estaciones seca/ fría y seca/ caliente. Por otro lado, los machos estuvieron activos reproductivamente sin estar presentes las hembras en el mismo refugio. Una posible explicación a este patrón es que los machos observados busquen a las hembras reproductivas en refugios más cálidos en la misma zona de estudio (Galindo-Galindo et al., 2000).
Tabla 2
Fenología floral de 5 especies de plantas quiropterófilas de la zona de estudio. Las celdas con guión muestran los meses de floración para cada especie. Además se muestran las especies de murciélagos que se han reportado que consumen polen y néctar de dichas especies de plantas.
|
Especie de planta |
S |
O |
N |
D |
E |
F |
M |
A |
My |
J |
Jl |
A |
Murciélago consumidor |
|
I. murucoides |
_ |
_ |
_ |
_ |
_ |
_ |
Ageo |
||||||
|
C. petandra* |
_ |
_ |
_ |
Lyerb |
|||||||||
|
C. aesculifolia* |
_ |
_ |
_ |
_ |
_ |
_ |
Ageo, Lyerb |
||||||
|
P. ellipticum* |
_ |
_ |
_ |
Ageo, Lyerb |
*Información obtenida de literatura (Stoner et al., 2003, Caballero-Martínez et al., 2009, 2012; Carranza-González y Blanco-García, 2000). Código meses: septiembre (S), octubre (O), noviembre (N), diciembre (D), enero (E), febrero (F), marzo (M), abril (A),
mayo (My), junio (J), julio (Jl), agosto (A). Código murciélagos: Anoura geoffroyi (Ageo), Leptonycteris yerbabuenae (Lyerb).
La fenología de murciélagos nectarívoros e insectívoros es más afectada por el clima, que la de los omnívoros
La desaparición de la población de L. yerbabuenae y M. velifer durante la estación seca/ fría puede deberse a los traslados estacionales que realizan estas especies en búsqueda de alimento y refugios de maternidad (Kunz 1974; Stoner et al., 2003; Wilkinson y Fleming, 1996). Se han registrado hembras de L. yerbabuenae en estado de gestación y lactancia en invierno, en el bosque seco del Pacífico de México (Stoner et al., 2003). Por lo tanto, nuestros datos podrían indicar que la ausencia de L. yerbabuenae en la estación seca/ fría se debe a la búsqueda de refugios de maternidad en bosques tropicales secos, donde podrán aprovechar una gran variedad de plantas en floración y refugios con una temperatura más elevada (Stoner et al., 2003; Quiroz et al., 1986).
El patrón reproductivo mostrado por L. yerbabuenae fue bimodal, es decir 2 picos de actividad reproductiva durante 1 año. Esto concuerda con lo reportado en regiones más tropicales (Stoner et al., 2003). Sin embargo, otras publicaciones han registrado un patrón monoestro para esta especie (Ceballos et al., 1997), lo cual puede indicar que el patrón reproductivo de esta especie varía geográficamente.
Myotis velifer mostró un pico reproductivo a lo largo del año lo cual coincide con otros estudios sobre su biología reproductiva, donde describen un patrón monoestro estacional (Krutzsch, 2009). Las especies de murciélagos de zonas templadas, particularmente de las familias Vespertilionidae y Rhinolophidae, se caracterizan por dicho patrón reproductivo (Racey, 1982). En regiones templadas, la abundancia de insectos empieza a aumentar gradualmente en primavera (marzo/ abril en latitudes norteñas) al igual que la temperatura, lo que produce un gran pico de insectos en verano (julio/ agosto, Racey y Entwistle, 2000) que posteriormente declina en otoño e invierno cuando la temperatura ambiental es baja (Antony et al., 1981), esto lleva a una reducción de presas disponibles para los murciélagos insectívoros al reducirse la temperatura (Racey y Entwistle, 2000). Por lo tanto, en zonas templadas, la actividad reproductiva de murciélagos está fuertemente limitada por el clima y la disponibilidad de insectos (Anthony et al., 1981; Burles et al., 2009; Hoying y Kunz, 1998), de modo tal que el parto ocurre a mediados de verano, seguido por el rápido crecimiento postnatal y la inactividad reproductiva durante los meses de otoño-invierno (Racey y Entwistle, 2000).
Esto coincide con el patrón encontrado en M. velifer, ya que la colonia de maternidad y hembras preñadas se encontraron en la estación seca/ caliente y lluvias, cuando la temperatura mínima fue mayor (tabla 1). Esto podría favorecer la abundancia de insectos lo cual permitió la actividad reproductiva y la formación de una colonia de maternidad, para posteriormente abandonar la cueva cuando empezó la estación seca/ fría donde se presentó una temperatura mínima significativamente más baja (tabla 1).
Nuestros datos revelan que la estacionalidad climática no es un factor que afecte la fenología reproductiva de murciélagos con una dieta omnívora y capaces de consumir néctar de baja concentración de azúcar. Por otro lado, especies con una dieta especializada sí mostraron un patrón reproductivo asociado a la estacionalidad, debido a que se ven obligados a seguir recursos vegetales y animales asociados con el aumento de la temperatura y la humedad. Nuestro estudio sugiere que la estacionalidad climática afecta en menor manera la fenología de murciélagos con una dieta omnívora en bosques templados. Pensamos que las especies que se ven afectadas por la estacionalidad corren mayores riesgos ante las presiones antropogénicas y el cambio climático debido a la dependencia de recursos alimenticios específicos.
Agradecimientos
Apreciamos la asistencia en campo de Alejandro Mendez-Andrade, Karina D. Rivera-García y César A. Sandoval-Ruiz. RASV agradece al Laboratorio de Ecología de Paisajes Fragmentados del Instituto de Investigaciones en Ecosistemas y Sustentabilidad de la Universidad Nacional Autónoma de México y al Laboratorio de Análisis para la Conservación de la Biodiversidad, del Instituto de Investigaciones sobre los Recursos Naturales, de la Universidad Michoacana de San Nicolás de Hidalgo, por permitirle trabajar en este manuscrito durante su estancia postdoctoral en dichas instituciones. También agradece al CTIC-UNAM (CJIC/CTIC/0380/2015) y a la SEP por las becas postdoctorales (PRODEP 511-6/17-626) en el Cuerpo Académico (UMSNH-CA-178). Especialmente a la comunidad de ganaderos y agricultores de Tiristarán, en especial al Sr. Ángel y su familia. JES agradece el financiamiento económico de la UNAM a través de la proyecto PAPIIT IN-205413.
Referencias
Anthony, L. P., Stack, M. H. y Kunz, T. H. (1981). Night roosting and the nocturnal time budget of the little brown bat, Myotis lucifugus: effects of reproductive status, prey density, and environmental conditions. Oecologia, 51, 151–156.
Ayala-Berdón, J., Galicia, R., Flores-Ortíz, C., Medellín, R. A. y Schondube, J. E. (2013). Digestive capacities allow the Mexican long-nosed bat (Leptonycteris nivalis) to live in cold environments. Comparative Biochemistry and Physiology, 164, 622–628.
Ayala-Berdón, J. y Schondube, J. E. (2011). A physiological perspective on nectar-feeding adaptation in phyllostomid bats. Physiological and Biochemical Zoology, 84, 458–466.
Barclay, M. R. (1991). Population structure of temperate zone insectivorous bats in relation to foraging behaviour and energy demand. Journal of Animal Ecology, 60, 165–178.
Baumgarten, J. E. y Vieira, E. M. (1994). Reproductive seasonality and development of Anoura geoffroyi (Chiroptera: Phyllostomidae) in central Brazil. Mammalia, 58, 415–422.
Bronson, F. H. (1985). Mammalian reproduction: an ecological perspective. Biology of Reproduction, 32, 1–26.
Burles, D. W., Brigham, R. M., Ring, R. A. y Reimchen, T. E. (2009). Influence of weather on two insectivorous bats in a temperate Pacific Northwest rainforest. Canadian Journal Zoology, 87, 132–138.
Caballero-Martínez, L. A., Aguilera-Gómez, L. I., Rivas-Manzano, I. V., Aguilar-Ortigoza, C. J. y Lamus-Molina, V. (2012). Biología floral y polinización de Ipomoea murucoides Roem. & Schult. (Convolvulaceae) en Ixtapan del Oro, Estado de México (México). Anales de Biología, 34, 65–76.
Caballero-Martínez, L. A, Rivas, I. V. y Aguilera, L. I. (2009). Hábitos alimentarios de Anoura geoffroyi (Chiroptera; Phyllostomidae), en Ixtapan del Oro, Estado de México. Acta Zoológica Mexicana, 1, 161–175.
Carranza-González, E. y Blanco-García, A. (2000). Bombacaceae. Flora del Bajío y Regiones Adyacentes, 90, 1–13.
Ceballos, G., Fleming, T. H. Chávez, C. y Nassar, J. (1997). Population dynamics of Leptonycteris curasoae (Chiroptera: Phyllostomidae) in Jalisco, Mexico. Journal of Mammalogy, 4, 1220–1230.
Coll, M. y Guershon, M. (2002). Omnivory in terrestrial arthropods: mixing plant and prey diets. Annual Review of Entomology, 47, 267–297.
Cruzblanca-Castro, M. (2016). Cambios conductuales del murciélagos nectarívoro (Anoura geoffroyi) ligados a las características nutritivas del alimento (Tesis). Facultad de Ciencias, Universidad Nacional Autónoma de México. Ciudad de México, México.
Cryan, P. M., Bogan, M. A. y Altenbach, J. S. (2000). Effect of elevation on distribution of female bats in the black hills, South Dakota. Journal of Mammalogy, 81, 719–725.
Durant, K. A., Hall, R. W., Cisneros, M. L., Hyland, M. R. y Willig, R. M. (2013). Reproductive phenologies of phyllostomid bats in Costa Rica. Journal of Mammalogy, 6, 1438–1448.
Dwyer, P. D. (1971). Temperature regulation and cave dwelling bats: an evolutionary perspective. Mammalia, 35, 424–455.
Ferreyra-García, D. (2016). Efecto del microclima en la ocupación de refugios cavernícolas por murciélagos (Tesis). Universidad Michoacana de San Nicolás de Hidalgo. Morelia, México.
Fleming, T. H., Hooper, E. T. y Wilson, D. E. (1972). Three Central American bat communities: structure, reproductive cycles, and movement patterns. Ecology, 53, 655–670.
Galindo-Galindo, C., Castro-Campillo, A., Salame-Méndez, A. y Ramírez-Pulido, J. (2000). Reproductive events and social organization in a colony of Anoura geoffroyi (Chiroptera: Phyllostomidae) from a temperate Mexican cave. Acta Zoológica Mexicana, 80, 51–68.
Happold, D. C. D. y Happold, M. (1990). Reproductive strategies of bats from Africa. Journal of Zoology, 222, 557–583.
Heideman, P. D., Deoraj, P. y Bronson, F. H. (1992). Seasonal reproduction of a tropical bat, Anoura geoffroyi, in relation to photoperiod. Journal of Reproduction Fertility, 96, 765–773.
Hoying, K. M. y Kunz, T. H. (1998). Variation in size at birth and post-natal growth in the insectivorous bat Pipistrellus subflavus (Chiroptera: Vespertilionidae). Journal of Zoology, 245, 15–27.
Kelm, D. H., Schaer, J., Ortmann, S., Wibbelt, G., Speakman, J. R. y Voigt, C. C. (2008). Efficiency of facultative frugivory in the nectar-feeding bat Glossophaga commissarisi: the quality of fruits as an alternative food source. Journal of Comparative Physiology, 178, 985–996.
Krutzsch, P. H. (2009). The reproductive biology of the cave myotis (Myotis velifer). Acta Chiropterologica, 11, 89–104.
Kunz, T. H. (1974). Feeding ecology of a temperate insectivorous bat (Myotis velifer). Ecology, 55, 693–711.
Kunz, T. H. (1982). Roosting ecology of bats. En T. H. Kunz (Eds.), Ecology of bats (pp. 1–46). Plenum, New York.
Kunz, T. H., Murray, S. W. y Fuller, N. W. (2012). Bats. En W. B. White y D. C. Culver (Eds.) Encyclopedia of caves (pp. 45–54). Washington, D.C.: American University.
Kunz, T. H. y Parsons, S. (2009) Ecological and behavioral methods for the study of bats. Baltimore: Johns Hopkins University Press.
León, P. y Montiel, S. (2006). Fenología reproductiva de Dermanura phaeotis Miller y Artibeus intermedius Allen (Chiroptera: Phyllostomidae) en Petenes del noroestes de la Península de Yucatán. Trópico Húmedo, 22, 95–99.
McCracken, G. F. (1989). Cave conservation: special problems of bats. NSS Bulletin, 51, 49–51.
Medellín, R. A., Arita, T. H. y Sánchez, H. O. (2008). Identificación de los murciélagos de México, clave de campo. Segunda edición Instituto de Ecología, UNAM. Ciudad de México.
Mello, M. A. R., Kalko, E. K. V. y Silva, W. R. (2009). Ambient temperature is more important than food availability in explaining reproductive timing of the bat Sturnira lilium (Mammalian: Chiroptera) in a montane Atlantic Forest. Canadian Journal of Zoology, 87, 239–245.
Mello, M. A. R., Menezes-Schittini, G., Selig, P. y Godoy-Bergallo, H. (2004) A test of the effects of climate and fruiting of Piper species (Piperaceae) on reproductive patterns of the bat Carollia perspicillata (Phyllostomidae). Acta Chiropterologica, 6, 309–318.
Muñoz-Romo, M., Nielsen, T. L., Nassar, M. J. y Kunz, T. H. (2012). Chemical composition of the substances from dorsal patches of males of the Curacaoan long-nosed bats, Leptonycteris curasoae (Phyllostomidae: Glossophaginae). Acta Chiropterologica, 1, 213–224.
Neuweiler, G. (2000). Reproduction and development. En G. Neuweiler (Eds.), The biology of bats (pp. 236–250). Oxford University Press.
Olson, D. M., Dinerstein, E., Wikramanayake, E. D., Burgess, N. D., Powell, G. V. N., Underwood, E. C. et al. (2001). Terrestrial ecoregions of the world: A new map of life earth. BioScience, 51, 933–938.
Ortega, J. y Alarcón, I. (2008). Anoura geoffroyi (Chiroptera: Phyllostomidae). Mammalian Species, 818, 1–7.
Quesada, M., Stoner, K. E., Rosas-Guerrero, V., Palacios-Guevara, C. y Lobo, J. A. (2003). Effects of habitat disruption on the activity of nectarivorous bats (Chiroptera: Phyllostomidae) in a dry tropical forest: implications for the reproductive success of the neotropical tree Ceiba grandiflora. Oecologia, 135, 400–406.
Quiroz, D. L., Xelhuantzi, M. S. y Zamora, M. C. (1986). Análisis palinológico del contenido gastrointestinal de los murciélagos Glossophaga soricina y Leptonycteris yerbabuenae de las Grutas de Juxtlahuaca, Guerrero. Instituto Nacional de Antropología e Historia Serie Prehispánica, 1, 1–62.
R Core Team. (2015). R: a language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. https://www.R-project.org/
Racey, P. A. (1982). Ecology of bat reproduction. En T. H. Kunz
(Eds.), Ecology of bats (pp. 57–93). New York: Plenum Press.
Racey, P. A. y Entwistle A. C. (2000). Life-history and reproductive strategies of bats. En E. G. Crichton y P. H. Krutzsch (Eds.), Reproductive Biology of Bats (pp. 364–400). Tucson: University of Arizona.
Rivera-García, K. D., Sandoval-Ruiz, C. A., Saldaña-Vázquez, R. A. y Schondube, J. E. (2017). The effects of seasonality on host-bat fly ecological networks in a temperate mountain cave. Parasitology, 144, 692–697.
Stoner, K. E., Salazar, K. A. O., Fernández, R. C. R. y Quesada, M. (2003). Population dynamics, reproduction, and diet of the lesser long-nosed bat (Leptonycteris curasoae) in Jalisco, Mexico: implications for conservation. Biodiversity and Conservation, 12, 357–373.
Torres-Flores, J. W., López-Wilchis, R. y Soto-Castruita, A. (2012). Dinámica poblacional, selección de sitios de percha y patrones reproductivos de algunos murciélagos cavernícolas en el oeste de México. Revista de Biología Tropical, 3, 1369–1389.
Tschapka, M. (2004). Energy density patterns on nectar resources permit coexistence within a guild of a Neotropical flower-visiting bats. Journal of Zoology, 263, 7–21.
Wilkinson, G. S. y Fleming, T. H. (1996). Migration and evolution of lesser long-nosed bats Leptonycteris curasoae, inferred from mitochondrial DNA. Molecular Ecology, 5, 329–339.



