Relaciones filogenéticas del subgénero Hypodictyon (Anura: Strabomantidae: Pristimantis) con la descripción de tres especies nuevas de la región del Chocó
Carolina Reyes-Puig a, b, *, Mario H. Yánez-Muñoz a, Jhael A. Ortega c y Santiago R. Ron c
a Instituto Nacional de Biodiversidad, Unidad de Investigación, Rumipamba 341 y Av. De los Shyris, Casilla postal 17-07-8976, Quito, Ecuador
b Instituto de Diversidad Biológica Tropical iBOTROP, Museo de Zoología, Colegio de Ciencias Biológicas y Ambientales, Universidad San Francisco de Quito, Diego de Robles y Vía Interoceánica, 170901 Quito, Ecuador
c Museo de Zoología, Escuela de Biología, Pontificia Universidad Católica del Ecuador, 12 de Octubre y Roca, Quito, Ecuador
*Autor para correspondencia: carolina_reyes.88@hotmail.com (C. Reyes-Puig)
Recibido: 29 marzo 2019; aceptado: 13 enero 2020
http://zoobank.org/urn:lsid:zoobank.org:pub:D24A8A3F-D8B2-4B0F-800A-47DF8B6E605D
Resumen
Describimos 3 nuevas especies de cutines Pristimantis del subgénero Hypodictyon de la bioregión del Chocó de Colombia y Ecuador. Además, presentamos una filogenia actualizada del subgénero Hypodictyon en la que reportamos por primera vez la posición filogenética de P. calcaratus, P. colomai, P. illotus, P. kuri, P. rosadoi, P. tenebrionis y P. variabilis. Se revisó el contenido de Hypodictyon y sus 2 grupos de especies. Pristimantis afrox sp. nov. se caracteriza por la presencia de un pliegue escapular en forma de ×; pliegue interocular y tubérculo longitudinal en la región interorbital; dedos del pie con pronunciados rebordes cutáneos basales en los dedos II-V; distintiva coloración inguinal y superficies ocultas de los muslos rojas. Pristimantis chocoensis sp. nov. posee dedo I de la mano igual o ligeramente más corto que el II; vientre y garganta homogéneamente crema a ligeramente manchados de café, pliegue interorbital, rebordes cutáneos laterales presentes, pliegue metatarsal interno y manchas negras hacia la inserción posterior del brazo. Pristimantis cisnerosi sp. nov. presenta distintivos huesos nasales fuertemente convexos y acampanados; narinas protuberantes proyectadas anteriormente; coloración dorsal café oscura y vientre café escarlata; tubérculos cónicos sobre el párpado y tímpano reducido.
Palabras clave: Bioregión; Terrarana; Filogenia; Pristimantis afrox sp. nov.; Pristimantis chocoensis sp. nov.; Pristimantis cisnerosi sp. nov.
© 2020 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Phylogenetic relationships of the subgenus Hypodictyon (Anura: Strabomantidae: Pristimantis) with the description of three new species from the Chocó región
Abstract
We describe 3 new species of frogs Pristimantis, subgenus Hypodictyon from the Chocó of Colombia and Ecuador. Additionally, we present an updated phylogeny of the subgenus Hypodictyon on which we report, for the first time, the phylogenetic position of P. calcaratus, P. colomai, P. illotus, P. kuri, P. rosadoi, P. tenebrionis, and P. variabilis. We review the species content of Hypodictyon and its 2 species groups. Pristimantis afrox sp. nov. is characterized by bearing an ×-shaped scapular fold; an interocular fold and a longitudinal tubercle in the interorbital region, toes with conspicuous lateral fringes on fingers II-V; distinctive coloration on groin and hidden surfaces of thighs red. Pristimantis chocoensis sp. nov. is characterized by having finger I equal or slightly shorter than II; venter and throat homogenously cream to slightly stained with brown, and black marks towards the insertion of the arm. Pristimantis cisnerosi sp. nov. exhibits strongly convex and flared nasal bones; protruding nostrils anteriorly; dorsal coloration dark brown and venter scarlet; bearing conical tubercles on the upper eyelid and reduced tympanum.
Keywords: Bioregion; Terrarana; Phylogeny; Pristimantis afrox sp. nov.; Pristimantis chocoensis sp. nov.; Pristimantis cisnerosi sp. nov.
© 2020 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
Los límites suroccidentales de la formación biogeográfica del Chocó alcanzan los bosques tropicales de la provincia de Esmeraldas en Ecuador (MECN, 2010), mucha de la fauna anfibia que se registra en la zona es compartida con la vertiente suroccidental de Colombia (Lynch, 1999). Esta zona es una de las más húmedas del mundo y concentra una extraordinaria diversidad de anfibios y reptiles a escala local y regional (MECN, 2010; Morales-Mite et al., 2013). Colombia y Ecuador son los 2 países con mayor diversidad de ranas terrestres Pristimantis (Frost, 2019; Lynch, 1999; Lynch y Duellman, 1997). La alta riqueza representada por este género es reflejada en el número de especies descritas por año (= 7 sp.) (Frost, 2019; Ron et al., 2019). Se ha documentado la presencia de no menos de 60 especies de Pristimantis para la bioregión del Chocó colombiano y ecuatoriano, correspondiendo al grupo de anuros más diverso del área (Frost, 2019; Lynch, 1999; MECN, 2010; Ron et al., 2019). Sin embargo, tan solo 2 especies han sido descritas en los últimos 15 años (Arteaga et al., 2016; Guayasamin, 2004). No obstante, revisiones exhaustivas del material de uno de los clados de este género (i.e., Hypodictyon sensu Hedges et al., 2008), más la incorporación de análisis moleculares han revelado la presencia de 3 nuevas especies para esta importante área de conservación.
El subgénero Hypodictyon fue propuesto por Cope (1885), inicialmente como género para separar Phyllobates, considerando como especie tipo a P. ridens y haciendo alusión con el nombre subgenérico a la superficie del vientre granulado que observó Cope (Cope, 1885; Hedges et al., 2008). Los subgéneros dentro del género Pristimantis han sido inconsistentes a través de los años, Hedges et al. (2008) propusieron 3 subgéneros (Hypodictyon, Pristimantis, Yunganastes) y Crawford et al. (2010) confirmaron la monofilia de Hypodictyon. Sin embargo, más tarde, Padial et al. (2014) reconocieron un solo subgénero (i.e., Pristimantis) basándose en la parafilia de los subgéneros (comentarios sobre los resultados de este trabajo con respecto a Hypodictyon son presentados más adelante). Recientemente, Heinicke et al. (2017) reconocieron el subgénero Hypodictyon basados en evidencia de su monofilia. Páez y Ron (2019) siguieron la propuesta de Heinicke et al. (2017) en el reconocimiento de Hypodictyon y describieron un nuevo subgénero (Huicundomantis).
Históricamente, las relaciones filogenéticas de las especies asociadas al clado Hypodictyon, han sido confusas e inestables. Inicialmente, Lynch (1976) al describir Pristimantis crenunguis especuló que la textura del vientre y el tamaño del dedo I podrían ser caracteres informativos para asociarlos con el grupo fitzingeri. Sin embargo, en su revisión del complejo de especies asociadas a Eleutherodactylus latidiscus (Lynch et al., 1994) y en su revisión de Eleutherodactylus del oeste de Ecuador (Lynch y Duellman, 1997) identifican una cercana relación entre las especies asignadas al grupo de E. cerasinus, aun cuando no reportan sinapomorfías. Más de una década después, Hedges et al. (2008) reconocieron algunas de las especies de los grupos de Eleutherodactylus cerasinus y E. unistrigatus como miembros del subgénero Hypodictyon, con 2 grupos de especies (Pristimantis ridens y P. rubicundus), aunque parte de la composición de especies propuesta en este trabajo no contó con un soporte molecular. Posteriormente, Crawford et al. (2010) trasladan a Pristimantis cerasinus a la serie de P. ridens y excluye a 3 especies previamente consideradas por Hedges et al. (2008) dentro de esta serie (P. altae, P. pirrensis y P. pardalis). Tanto Hedges et al. (2008: 116, 162) como Crawford et al. (2010: 201) asignaron erróneamente a Pristimantis achatinus al grupo P. rubicundus. Este error pasó desapercibido reiteradamente en compendios como Padial et al. (2014) y Frost (2019). En el caso de Hedges et al. (2008), al parecer se trata de un doble error tipográfico al incluir la especie en la definición del grupo de Pristimantis rubicundus (p. 116) y en el apéndice que lista la reorganización taxonómica (p. 162), pese a asignarlo dentro del grupo de P. conspicillatus y de la topología molecular. No obstante, la asignación de Crawford et al. (2010) sí parece ser conceptual, al sugerir que Pristimantis achatinus es la única especie del grupo en Centro América y restringe a la serie P. rubicundus al este de Panamá.
En el presente trabajo presentamos una nueva filogenia del clado Hypodictyon y describimos 3 nuevas especies del subgénero a través de un enfoque de taxonomía integradora vinculando caracteres morfológicos, morfométricos y secuencias de ADN para su descripción.
Materiales y métodos
Estimamos las relaciones filogenéticas del subgénero Hypodictyon con base en secuencias de ADN de los genes mitocondriales 12S, 16S (secuencia parcial), tARN Leu, NADH deshidrogenasa subunidad 1 (ND1), tARN Ile, tARN Gln y el gen nuclear activador de la recombinación RAG1. El ADN total fue extraído de tejido de hígado preservado en etanol al 95% con el protocolo de tiocianato de guanidina. Aplicamos la reacción en cadena de la polimerasa (PCR) para amplificar el ADN. La amplificación se llevó a cabo con protocolos estándar. Los productos de PCR fueron secuenciados por el grupo de secuenciación Macrogen (Macrogen Inc., Seúl, Corea). Los especímenes voucher para las nuevas secuencias se listan en la tabla 1.
Tabla 1
Números de acceso de muestras GenBank usadas para análisis filogenéticos. En la tabla se incluyen únicamente las secuencias nuevas generadas para este estudio. Datos de colección de los especímenes disponibles en https://zenodo.org/; bajo DOI: 10.5281/zenodo.3597495.
| Tabla 1
Continuación |
||||
| Voucher | Especies | 16S | ND1 | RAG1 |
| Voucher | Especies | 16S | ND1 | RAG1 |
| QCAZ 65405 | Craugastor longirostris | MT372674 | – | MT372616 |
| QCAZ 65432 | Craugastor longirostris | MT372722 | – | MT372617 |
| QCAZ 41125 | Noblella myrmecoides | MT372720 | – | MT372595 |
| QCAZ 30980 | Nymphargus siren | MT372719 | MT372560 | MT372589 |
| QCAZ 24448 | Osteocephalus buckleyi | MT372699 | MT372557 | MT372585 |
| QCAZ 40400 | Pristimantis actites | MT372702 | MT372565 | MT372594 |
| MECN 6576 | Pristimantis afrox sp. nov. | MT372695 | – | MT372578 |
| MECN 6579 | Pristimantis afrox sp. nov. | MT372694 | – | MT372579 |
| QCAZ 65464 | Pristimantis chocoensis sp. nov. | MT372677 | – | MT372619 |
| QCAZ 65555 | Pristimantis chocoensis sp. nov. | MT372676 | – | MT372629 |
| QCAZ 32120 | Pristimantis cisneros sp. nov. | MT372698 | MT372562 | MT372591 |
| QCAZ 45432 | Pristimantis cisnerosi sp. nov. | MT372697 | MT372570 | MT372601 |
| QCAZ 65528 | Pristimantis cisnerosi sp. nov. | – | – | MT372625 |
| QCAZ 65533 | Pristimantis cisnerosi sp. nov. | MT372663 | – | MT372627 |
| QCAZ 65554 | Pristimantis cisnerosi sp. nov. | MT372683 | – | MT372628 |
| QCAZ 65576 | Pristimantis colomai | MT372688 | – | MT372630 |
| QCAZ 56519 | Pristimantis illotus | MT372714 | MT372576 | MT372611 |
| QCAZ 49634 | Pristimantis kuri | MT372692 | – | MT372605 |
| QCAZ 13038 | Pristimantis labiosus | MT372693 | – | MT372581 |
| QCAZ 13054 | Pristimantis labiosus | MT372696 | – | MT372582 |
| QCAZ 15319 | Pristimantis labiosus | MT372686 | – | MT372583 |
| QCAZ 45998 | Pristimantis labiosus | MT372687 | – | MT372602 |
| QCAZ 65531 | Pristimantis labiosus | MT372675 | – | MT372626 |
| QCAZ 39236 | Pristimantis lanthanites | MT372706 | MT372563 | MT372592 |
| QCAZ 51071 | Pristimantis lanthanites | MT372707 | MT372573 | MT372606 |
| QCAZ 52354 | Pristimantis lanthanites | MT372708 | MT372574 | MT372607 |
| QCAZ 32060 | Pristimantis latidiscus | MT372709 | MT372561 | MT372590 |
| QCAZ 65448 | Pristimantis latidiscus | MT372689 | – | MT372618 |
| QCAZ 65488 | Pristimantis latidiscus | MT372678 | – | MT372620 |
| QCAZ 65508 | Pristimantis latidiscus | MT372690 | – | MT372621 |
| QCAZ 65512 | Pristimantis rosadoi | MT372679 | – | MT372622 |
| QCAZ 65514 | Pristimantis rosadoi | MT372680 | – | MT372623 |
| QCAZ 65515 | Pristimantis rosadoi | MT372681 | – | MT372624 |
| QCAZ 26551 | Pristimantis rubicundus | MT372710 | MT372558 | MT372586 |
| QCAZ 29423 | Pristimantis rubicundus | MT372711 | MT372559 | MT372588 |
| QCAZ 41836 | Pristimantis rubicundus | MT372715 | MT372566 | MT372596 |
| QCAZ 41930 | Pristimantis rubicundus | MT372712 | MT372567 | MT372597 |
| QCAZ 41943 | Pristimantis rubicundus | MT372713 | MT372568 | MT372578 |
| QCAZ 52508 | Pristimantis rubicundus | MT372682 | – | MT372610 |
| QCAZ 58852 | Pristimantis rubicundus | MT372669 | – | MT372612 |
| QCAZ 58932 | Pristimantis rubicundus | MT372670 | – | MT372613 |
| QCAZ 58933 | Pristimantis rubicundus | MT372671 | – | MT372614 |
| QCAZ 58964 | Pristimantis rubicundus | MT372672 | – | MT372615 |
| QCAZ 19905 | Pristimantis sp. | MT372701 | MT372556 | MT372584 |
| QCAZ 26586 | Pristimantis sp. | MT372722 | – | MT372587 |
| QCAZ 40065 | Pristimantis sp. | MT372718 | MT372564 | MT372593 |
| QCAZ 45200 | Pristimantis sp. | MT372703 | MT372569 | MT372600 |
| QCAZ 46702 | Pristimantis sp. | MT372716 | MT372572 | MT372604 |
| QCAZ 65582 | Pristimantis tenebrionis | MT372685 | – | MT372631 |
| QCAZ 44621 | Pristimantis variabilis | MT372684 | – | MT372599 |
| QCAZ 52375 | Pristimantis variabilis | MT372717 | MT372577 | MT372609 |
| QCAZ 11685 | Pristimantis w-nigrum | MT372700 | MT372555 | MT372580 |
| QCAZ 41818 | Pristimantis w-nigrum | MT372691 | – | – |
| QCAZ 46256 | Pristimantis w-nigrum | MT372704 | MT372571 | MT372603 |
| QCAZ 52365 | Pristimantis w-nigrum | MT372705 | MT372575 | MT372608 |
Los datos de recolección de los especímenes están disponibles en https://zenodo.org/ bajo DOI: 10.5281/zenodo.3597495
Para ampliar el muestreo de especies, adicionamos secuencias del GenBank publicadas por Arteaga et al. (2016), Barrio-Amorós et al. (2012), Brito et al. (2017), Canedo y Haddad (2012), Darts y Canatella (2004), Crawford et al. (2010, 2013), Firkowski et al. (2016), García et al. (2012, 2014), Heinicke et al. (2007, 2009), Monteiro et al. (2018), Ortega-Andrade y Venegas (2014), Padial et al. (2012), Paz et al. (2015), Pinto-Sánchez et al. (2012), Waddell et al. (2018). Incluimos todas las secuencias disponibles de Hypodictyon y además secuencias representativas de otros clados de Pristimantis y los géneros Craugastor, Noblella, Hypodactylus, y Oreobates. Para ubicar la raíz incluimos secuencias de Nymphargus siren y Osteocephalus buckleyi. La matriz final tuvo 3,776 pb y 178 terminales.
La alineación preliminar de las secuencias se hizo con el software MAFFT 6.814b con el algoritmo L-INS-i (Katoh y Standley, 2013; Katoh et al., 2002). Regiones de alineación ambigua en la matriz fueron corregidas manualmente en Mesquite 2.72 (Maddison y Maddison, 2009). Los árboles filogenéticos fueron obtenidos usando máxima verosimilitud como criterio de optimalidad. Debido a que los loci analizados pueden evolucionar bajo procesos distintos, es posible que no se ajusten a un solo modelo evolutivo. Por lo tanto, dividimos la matriz de datos en 8 particiones “a priori”, una para 12S, otra para 16S y tRNAVal y una para cada una de las 3 posiciones codantes de los 2 genes codificantes. El mejor modelo para cada partición y el mejor esquema de partición fueron seleccionados con la aplicación IQ-TREE versión 1.6.8 (Nguyen et al., 2014) con el comando –m MFP+MERGE que basa su búsqueda en PartitionFinder (Lanfear et al., 2012). La búsqueda filogenética se hizo con el programa IQ-TREE versión 1.6.8 (Nguyen et al., 2014). Los parámetros de búsqueda fueron los del programa por omisión. Se comparó los valores de verosimilitud entre 5 réplicas para determinar si las búsquedas convergían en árboles con verosimilitud similar. En caso de obtener valores de verosimilitud con menos de una unidad de diferencia se asumió que la búsqueda había sido suficientemente exhaustiva. El soporte de las ramas fue evaluado con 100 pseudoréplicas de bootstrap no paramétrico estándar (comando -b 100).
La descripción de las especies sigue el formato propuesto por Lynch y Duellman (1997), los caracteres diagnósticos hacen referencia a las definiciones propuestas por Duellman y Lehr (2009). Utilizamos la propuesta de Heinicke et al. (2017) para la clasificación sistemática de la familia, seguimos y discutimos los grupos putativos de especies de interés propuestos por Hedges et al. (2008) (i.e., grupo P. rubicundus y P. ridens) y Padial et al. (2014) (grupo de P. ridens). Los especímenes colectados fueron sacrificados en una solución de benzocaína, fijados en formalina al 10% y preservados en etanol al 70%. El sexo y la condición reproductiva de los especímenes se determinaron por la presencia de almohadillas nupciales, hendiduras vocales, tamaño y por inspección directa de las gónadas a través de incisiones dorsolaterales. Los patrones de coloración en vida fueron extraídos de los cuadernos de campo y fotografías a color de los colectores, seguimos el formato de Duellman y Lehr (2009) para patrones de coloración. Las medidas morfométricas fueron tomadas con un calibrador electrónico (precisión ± 0.01 mm, redondeadas al 0.1 mm más cercano) según la propuesta de Duellman y Lehr (2009): ON = distancia órbita-narina, desde el margen anterior de la órbita hasta el margen posterior de la narina; LC = longitud cefálica, desde el margen posterior de la mandíbula hasta el extremo del rostro; AC = ancho cefálico entre las comisuras de la boca, DIO = distancia interorbital, tomada desde los bordes proximales de las órbitas; DIN = distancia internarinal; LRC = longitud rostro-cloaca; LT = longitud de la tibia; LP = longitud del pie, desde el margen proximal del tubérculo metatarsal interno hasta la punta del dedo IV; LM = longitud de la mano, desde la base del tubérculo tenar hasta la punta del dedo III; DT = diámetro del tímpano, DO = diámetro del ojo; AP = ancho del párpado. Las coordenadas y elevación de las localidades tipo fueron registradas con un GPS y determinadas en base a las notas de campo. Para identificar diferencias morfológicas en la anatomía craneana de las nuevas especies y sus congéneres morfológicamente relacionados, analizamos la osteología craneana de 6 especímenes. Las muestras fueron preparadas en colonias de derméstidos, y posteriormente blanqueadas en una solución dodecilsulfato sódico por 48 horas. Los ejemplares fueron almacenados en seco dentro de algodón y sobres de papel.
Los especímenes examinados se encuentran depositados en Quito, Ecuador: en la Sección de Herpetología del Instituto Nacional de Biodiversidad (DHMECN), Museo de Zoología de la Pontificia Universidad Católica del Ecuador (QCAZ); Valle del Cauca, Colombia: Colección Herpetológica de la Universidad del Valle del Cauca (UVC); y en Bogotá, Colombia: Colección de anfibios del Instituto de Ciencias Naturales (ICN). En el apéndice 1 se listan los especímenes examinados. Los créditos fotográficos utilizados en el compendio de figuras utilizan las siguientes siglas para: Santiago R. Ron-BIOWEB, (SRR-BIOWEB), Mario H. Yánez-Muñoz (MYM), Carolina Reyes-Puig (CRP).
Solo se midieron hembras adultas para eliminar el efecto del dimorfismo sexual. Incluimos las medidas de las series tipo de las 3 especies nuevas y ejemplares de especies morfológicamente similares como Pristimantis crenunguis, P. labiosus, P. rubicundus y P. latidiscus, esto con el afán de identificar variables morfométricas que permitan disgregar especies con características externas similares, aun cuando no se encuentren estrechamente relacionadas, previos estudios han realizado similares análisis con aplicaciones netamente taxonómicas (Yánez-Muñoz et al., 2018). Para reducir la dimensionalidad del conjunto de datos morfométricos, se utilizó prospectivamente un Análisis de Componentes Principales (PCA). Este análisis multivariado permite condensar la variación de un conjunto de variables en componentes principales. Inicialmente se determinó la normalidad de datos utilizando la prueba de Shapiro-Wilk. Luego se eliminó el efecto de la covariación de las variables con el tamaño a través de una regresión lineal simple entre LRC y las demás variables; para aquellas variables donde la LRC fue significativa, se extrajeron los residuos de la regresión lineal, para trabajar con estos valores en el PCA. Se retuvieron los componentes principales con autovalores mayores a la unidad. Las variables con mayor carga en los componentes retenidos fueron comparadas entre las especies nuevas y sus especies hermanas con las pruebas de Kruskal-Wallis y U de Mann-Whitney, para de ese modo identificar diferencias en el espacio morfológico. Los análisis fueron realizados en los programas SPSS 17.0 (SPSS Inc., 2008) y Past (Hammer et al., 2008).
Resultados
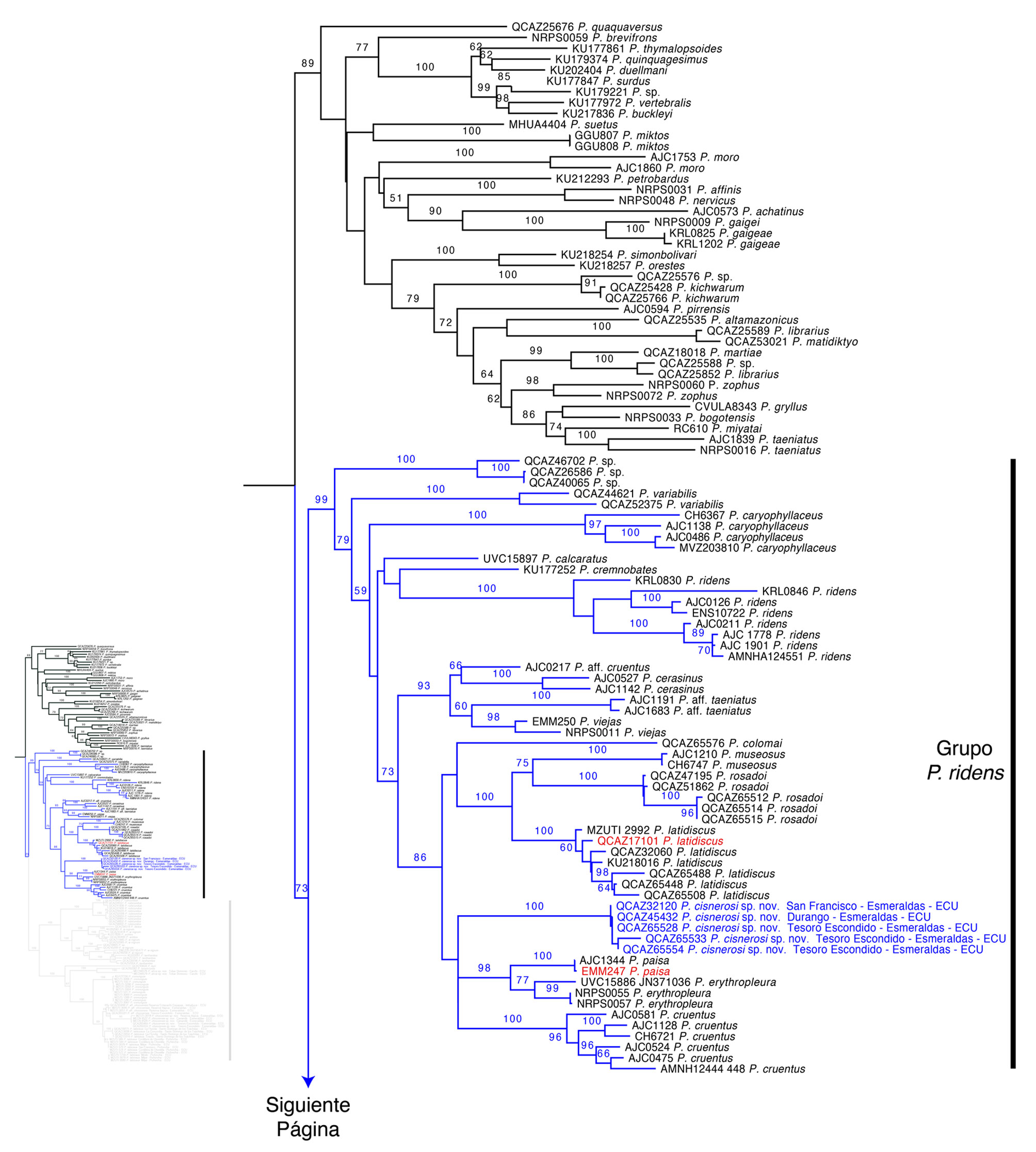
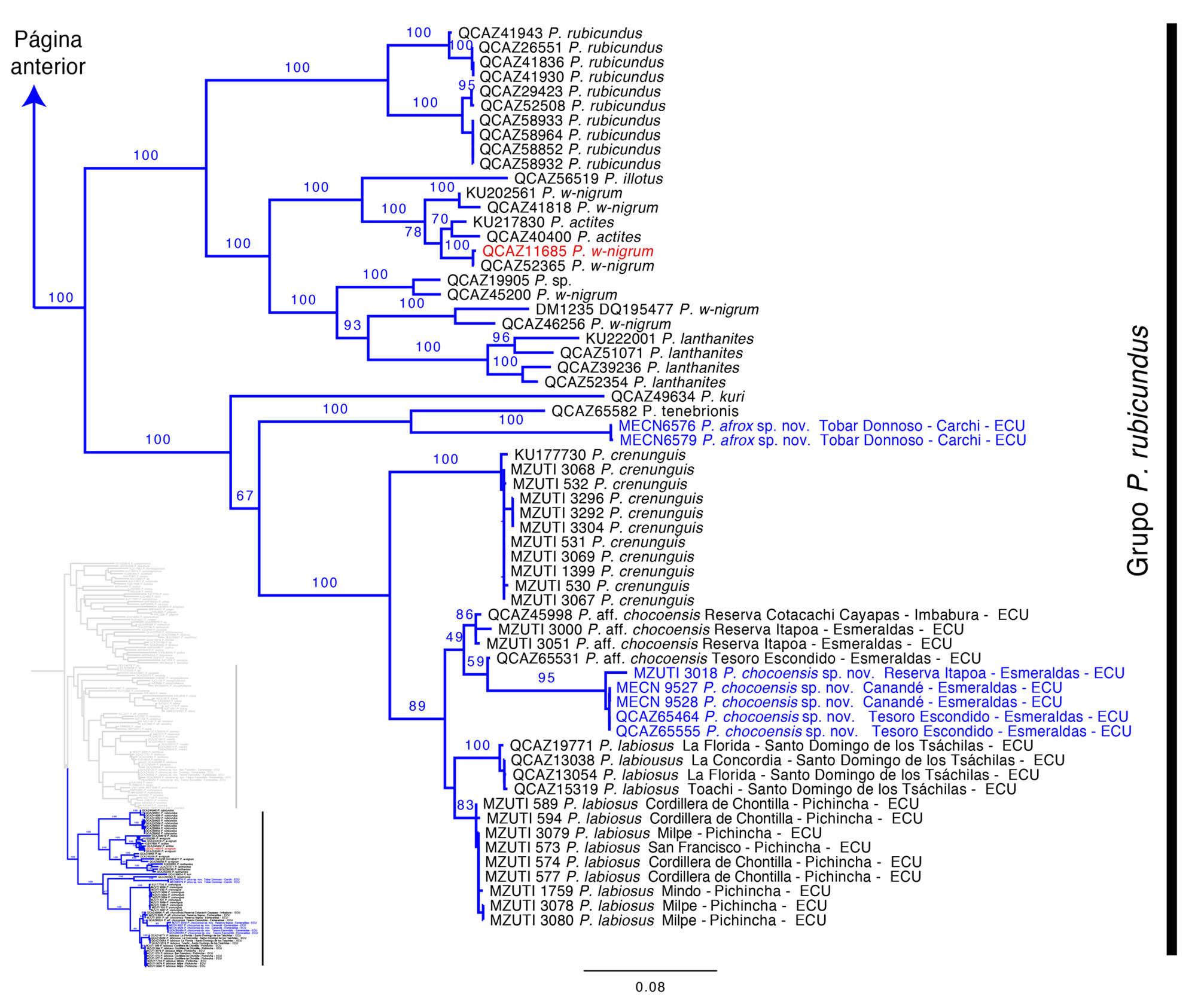
Nuestra filogenia muestra un soporte alto para el subgénero Hypodictyon (bootstrap = 73) (fig. 1). Dentro de Hypodictyon hay 2 clados con soporte alto; uno corresponde a especies previamente asociadas con la serie de Pristimantis ridens, mientras que el otro a especies de la serie de P. rubicundus, conforme a lo definido por Hedges et al. (2008). Se reporta por primera vez la posición filogenética de P. calcaratus, P. colomai, P. illotus, P. kuri, P. rosadoi, P. tenebrionis y P. variabilis.
El posicionamiento de Pristimantis afrox sp. nov., P. chocoensis sp. nov. y P. cisnerosi sp. nov., en el género Pristimantis y subgénero Hypodictyon tuvo un alto soporte. La filogenia muestra que Pristimantis afrox sp. nov., es la especie hermana de P. tenebrionis. Por otro lado, Pristimantis chocoensis sp. nov., es la especie hermana de P. aff. chocoensis (especie candidata nueva) y ambas son hermanas de P. labiosus. En conjunto estas 3 especies conforman el clado hermano de P. crenunguis (fig. 1). Tanto para Pristimantis afrox sp. nov. como para P. chocoensis sp. nov., los valores bootstrap que los asocian con sus especies hermanas son altos. Pristimantis cinseros sp. nov. es parte de un clado conformado por P. cruentus, P. erythropleura y P. paisa, el mismo que es hermano de un clado representado por P. colomai, P. museosus, P. rosadoi y P. latidiscus (fig. 1).
Subgénero Hypodictyon Cope, 1885
Diagnosis. Ranas terrestres y arbóreas que se caracterizan por presentar: 1) cabeza moderadamente estrecha, 2) membrana timpánica diferenciada, 3) crestas craneales usualmente ausentes (presentes bajas P. afrox sp. nov., P. cisnerosi sp. nov., P. chocoensis sp. nov., P. crenunguis), 4) procesos dentígeros del vómer bien desarrollados, usualmente triangulares, 5) condición “S” del músculo aductor, 6) discos terminales de los dígitos expandidos, con surcos circunmarginales bien desarrollados, falanges terminales con forma de T, 7) dedo I de la mano ligeramente más corto, igual o más largo que el dedo II, 8) dedo V más largo que el dedo III, 9) tubérculos subarticulares prominentes, 10) textura del dorso variable (ligeramente granular a fuertemente tuberculada), 11) textura del vientre variable (lisa a areolada), 12) rango de LRC de individuos adultos desde 16 mm en machos (Pristimantis colomai) hasta 72 mm en hembras (P. w-nigrum) (modificado de Hedges et al., 2008).
Diversidad. Treinta y nueve especies en 2 grupos: Pristimantis (Hypodictyon) grupo de especies de Pristimantis ridens y rubicundus (modificado de Hedges et al., 2008).
Distribución. El rango de distribución del subgénero Hypodictyon se extiende desde Honduras, Centro América, a través de las tierras bajas y estribaciones andinas de Colombia, Ecuador, norte de Perú y el extremo occidental de Brasil (Hedges et al., 2008).
Comentarios. El subgénero Hypodictyon se posiciona filogenéticamente dentro del género Pristimantis. El soporte para la monofilia del subgénero fue moderadamente fuerte (fig. 1). Incluimos especies que no han sido previamente evaluadas dentro del subgénero (P. calcaratus, P. colomai, P. illotus, P. kuri, P. rosadoi P. tenebrionis y P. variabilis). Dentro de Hypodictyon hay 2 clados bien respaldados que corresponden a los grupos de especies propuestos por Hedges et al. (2008). Incluimos dentro de estos grupos de especies los taxones confirmados, considerando la propuesta de Hedges et al. (2008), Padial et al. (2014) y la presentada en este estudio.
Grupo de especies Pristimantis (Hypodictyon) ridens
Diagnosis. Ranas de tamaño pequeño a moderado, con extremidades proporcionalmente cortas; el rango en LRC en machos desde 16 mm en P. ridens a 32.5 mm en P. cremnobates. Ancho de la cabeza 35-43% de la LRC. Crestas craneales ausentes excepto en hembras de P. cisnerosi sp. nov. La membrana timpánica y el anillo timpánico son distintivos, excepto en P. cruentus. El dorso es variable (liso, finamente granular o tuberculado), el vientre es fuertemente areolado. Los dedos del pie no presentan membranas interdigitales y el dedo V es mucho más largo que el dedo III, un pliegue tarsal interno o tubérculo elongado está usualmente presente. Rebordes cutáneos laterales usualmente presentes. Hendiduras vocales y almohadillas nupciales presentes o ausentes.
Diversidad. Veintitrés especies incluidas. Pristimantis (Hypodictyon) adnus (Crawford, Ryan y Jaramillo, 2010), P. almendariz (Brito y Pozo-Zamora, 2013), P. bicolor (Rueda-Almonacid y Lynch, 1983), P. calcaratus (Boulenger, 1908), P. caryophyllaceus (Barbour, 1928), P. cerasinus (Cope, 1875), P. cisnerosi sp. nov., P. colomai (Lynch y Duellman, 1997), P. cremnobates (Lynch y Duellman, 1980), P. cruentus (Peters, 1873), P. educatoris (Ryan, Lips y Giermakowski, 2010), P. erythropleura (Boulenger, 1896), P. jubatus (García y Lynch, 2006), P. kelephus (1998), P. laticlavius (Lynch y Burrowes, 1990), P. latidiscus (Boulenger, 1898), P. museosus (Ibáñez, Jaramillo y Arosemena, 1994), P. paisa (Lynch y Ardila-Robayo, 1999), P. ridens (Cope, 1866), P. rosadoi (Flores, 1988), P. sanguineus (Lynch, 1998), P. variabilis (Lynch, 1968) , P. viejas (Lynch y Rueda-Almonacid, 1999).
Distribución. Las especies del grupo de especies de P. ridens habitan principalmente a elevaciones menores de 2,000 m en Centroamérica y tierras bajas y estribaciones de Colombia y Ecuador. Dos especies (P. almendariz y P. cremnobates) se presentan en estribaciones orientales de los Andes de Colombia y Ecuador.
Grupo de especies Pristimantis (Hypodictyon) rubicundus
Diagnosis. Ranas de cuerpos moderadamente robustos y extremidades proporcionalmente largas, el rango en LRC en machos desde 20.8 mm en P. tenebrionis a 72 mm en P. w-nigrum. Ancho de la cabeza 37-42% de la LRC. Crestas craneales usualmente ausentes, excepto en hembras de P. afrox sp. nov., P. chocoensis sp. nov. y P. orpacobates. La membrana timpánica y el anillo timpánico son distintivos. El dorso es finamente granular o tuberculado, el vientre es usualmente liso, pero débilmente areolado en P. afrox sp. nov., cersinus, kuri, labiosus, orpacobates, rubicundus y tenebrionis. Los dedos del pie no presentan membranas interdigitales y el dedo V es mucho más largo que el dedo III, pliegue tarsal interno ausente, excepto en P. actites, P. chocoensis sp. nov. Rebordes cutáneos laterales usualmente ausentes, excepto en P. actites, P. afrox sp. nov., P. chocoensis sp. nov., P. ocellatus, P. w-nigrum, P. rubicundus. Hendiduras vocales y almohadillas nupciales presentes o ausentes.
Diversidad. Dieciséis especies incluidas. Pristimantis (Hypodictyon) actites (Lynch, 1979), P. afrox sp. nov., P. chocoensis sp. nov., P. crenunguis (Lynch, 1976), P. epacrus (Lynch y Suárez-Mayorga, 2000), P. illotus (Lynch y Duellman 1997), P. ixalus (Lynch, 2003), P. kuri (Yánez-Muñoz, Sánchez-Nivecela y Reyes-Puig, 2016), P. labiosus (Lynch, Ruiz-Carranza y Ardila-Robayo, 1994), P. lanthanites (Lynch, 1975), P. ocellatus (Lynch y Burrowes, 1990), P. orpacobates (Lynch, Ruiz-Carranza y Ardila-Robayo, 1994), P. rubicundus (Jiménez- de la Espada, 1875), P. tanyrhynchus (Lehr, 2007), P. tenebrionis (Lynch y Miyata, 1980), P. w-nigrum (Boettger, 1892).
Distribución. La mayoría de especies de este grupo habitan a elevaciones entre 40 y 2,700 m en las tierras bajas y estribaciones occidentales de los Andes de Colombia y Ecuador; 3 especies se distribuyen en las estribaciones orientales de los Andes de Colombia y Ecuador. Pristimantis w-nigrum y P. tanyrhynchus se distribuyen sobre 3,000 m de elevación en los Andes sur de Colombia, Ecuador y Perú respectivamente. Pristimantis lanthanites está distribuido en las estribaciones orientales y Amazonía desde Colombia hasta Perú.
Pristimantis afrox sp. nov.
Nombre común sugerido: Cutín Afro
Nombre común en inglés sugerido: Afrox’s robber frog
Figs. 2-5
http://zoobank.org/urn:lsid:zoobank.org:act:4AD5482B-
7D40-4E64-8DC4-E64660CE1E1F
Diagnosis. Pristimantis afrox sp. nov. es un miembro del subgénero Hypodictyon grupo de especies de P. rubicundus caracterizado por presentar: 1) piel del dorso finamente granular con verrugas esparcidas a lo largo de todo el cuerpo, pliegue escapular en forma de ×, piel del vientre débilmente areolada, pliegue discoidal presente, pliegues dorsolaterales ausentes; pliegue interocular presente; 2) membrana y anillo timpánico presentes, redondo, diámetro horizontal del tímpano 39.15% del diámetro del ojo, margen anterodorsal parcialmente cubierto por pliegue supratimpánico, tubérculos postrictales subcónicos pequeños; 3) hocico subacuminado en vista dorsal, moderadamente largo, redondeado de perfil, labios acampanados; 4) párpado superior con un tubérculo cónico alargado rodeado por varios tubérculos pequeños, igual que la distancia interorbital, con tubérculos subcónicos interorbitales, con un tubérculo largo longitudinal en la región interorbital, cresta craneal baja en hembras; 5) procesos dentígeros del vómer masivos, triangulares de contorno, con 6 a 10 dientes; 6) machos sin hendiduras vocales y almohadillas nupciales; 7) dedo I de la mano ligeramente más pequeño que el segundo, discos anchos, dilatados, con surcos circunmarginales; 8) dedos de la mano sin rebordes cutáneos laterales; 9) tubérculos ulnares ausentes; 10) talón con un tubérculo cónico pequeño, borde externo del tarso con 1 o 2 tubérculos pequeños aplanados, pliegue tarsal interno ausente; 11) tubérculo metatarsal interno oval 3-4 veces más grande que el tubérculo metatarsal externo ovoide, tubérculos supernumerarios ausentes; 12) dedos del pie con pronunciados rebordes cutáneos basales en los dedos II-V, membranas interdigitales ausentes, dedo V más largo que el III; 13) dorsalmente café rojizo en preservado (café oscuro en vida), pliegue escapular en forma de × crema en preservado (café escarlata en vida), extremidades delanteras con bandas transversales color crema, superficie ventral crema débilmente punteada de negro, superficie de la garganta en fondo crema densamente punteado de negro, marcas diagonales crema amarillentas detrás del ojo y sobre los labios, superficies anteriores de los muslos y piernas variegado, ingles y superficies ocultas de los muslos rojizos, iris gris claro con finas reticulaciones negras, con línea media horizontal gris oscuro; 14) LRC en hembras 32.3-45.8 mm ( = 40.8, n = 9); machos 21.75-34 mm ( = 30.7, n = 8).
Resumen taxonómico
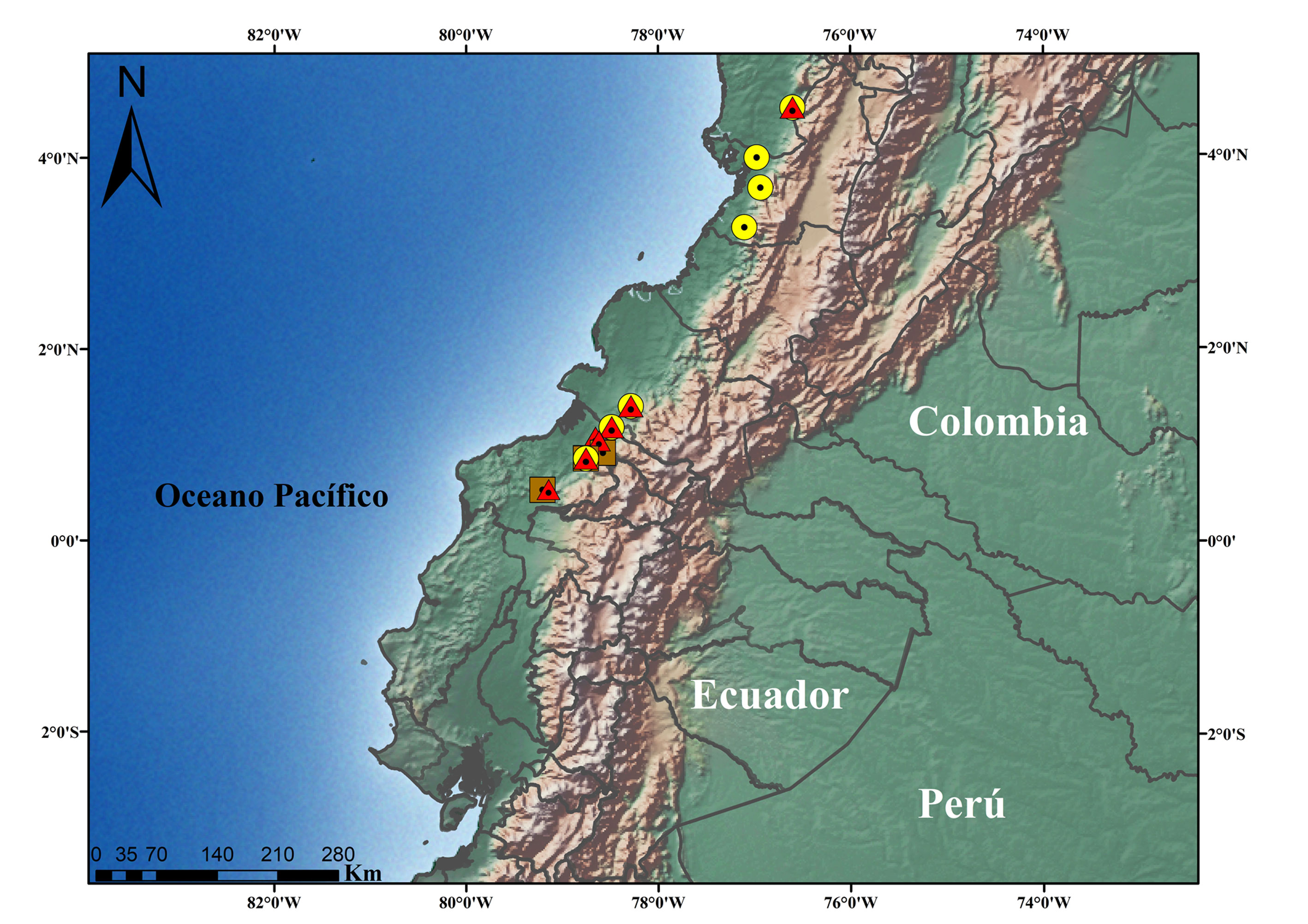
Holotipo: DHMECN 6578, hembra adulta, recolectada en Tobar Donoso (1°10’59.76” N, 78°29’32.18” O, 243 m snm, fig. 6), parroquia Mira, Cantón Tulcán, provincia de Carchi, República del Ecuador, por MYM y Luis Oyagata, 12-IX-2009.
Paratipos (9♀, 8♂): Ecuador: Hembras adultas recolectadas en la misma localidad del holotipo, DHMECN 6573-65748, IX-2009; DHMECN 6576, 11-IX-2009; DHMECN 6577-6578, 11460 (material osteológico), 12-IX-2009; MYM y Luis Oyagata; DHMECN 7970, VIII-2010; Luis Oyagata y Francisco Padilla. Machos adultos, DHMECN 6572, 7-IX-2009; DHMECN 6575 8-IX-2009; DHMECN 6580, 18-IX-2009; DHMECN 6582 22-IX-2009; MYM y Luis Oyagata; DHMECN 7971 VIII-2010; Luis Oyagata y Francisco Padilla; DHMECN 11467, hembra. Machos, estero Pote y Angostura (0°51’35” N, 78º45’35” O, 163 m snm), DHMECN 11468, 11469; Provincia de Esmeraldas, Manuel Morales y Eduardo Toral; 24-XII-1995. Colombia: UVC 6934, hembra, Granja Agroforestal, Bajo Calima, Valle del Cauca (3°59’52.11” N, 76°58’43.30” O, 40 m snm); 10-X-1981; Luis Ríos; ICN 53760, macho, Reserva Natural Biotopo Selva Húmeda, Vereda Berlín, Municipio de Barbacoas, Nariño (1º24’5” N, 78º17’30” O, 600 m snm), John Jairo Mueses.
Material referido (4): Ecuador: DHMECN 6579, 12-IX-2009, MYM y Luis Oyagata, mismos datos del holotipo. Colombia: UVC 13655, 1-VI-1999, Vereda Bellavista, Valle del Cauca (4°31’3.68” N, 76°36’9.01” O, 201 m snm), Fernando Vargas; UVC 13688, 1-III-1999, Bajo Anchicayá, Vereda Guamia, Valle del Cauca (3°40’56.32” N, 76°56’29.60” O, 36 m snm), Ma. Eugenia Bolaños; UVC 14693, 30-I-1998, Río Yurumanguí, Municipio Buenvanetura, Valle del Cauca (3°16’11.51” N, 77°6’32.39” O, 48 m snm), Fernando Vargas.
Etimología: el nombre “afrox” proviene de la combinación del término “afro”, el cual hace alusión a las etnias de afrodescendientes circunscritas al territorio de la provincia de Esmeraldas, donde se distribuye esta especie y de la letra X, que hace referencia a la forma del pliegue dérmico en la región escapular.
Comentarios taxonómicos
Comparación con especies similares: Pristimantis afrox sp. nov. difiere de otros congéneres del subgénero Hypodictyon¸ grupo de especies de P. rubicundus de Ecuador por la combinación de los siguientes caracteres: presencia de pliegue escapular en forma de ×; pliegue interocular presente, tubérculo largo longitudinal en la región interorbital; dedos del pie con pronunciados rebordes cutáneos basales en los dedos II-V, distintiva coloración inguinal y superficies ocultas de los muslos rojo; iris gris claro con línea media horizontal gris oscura.
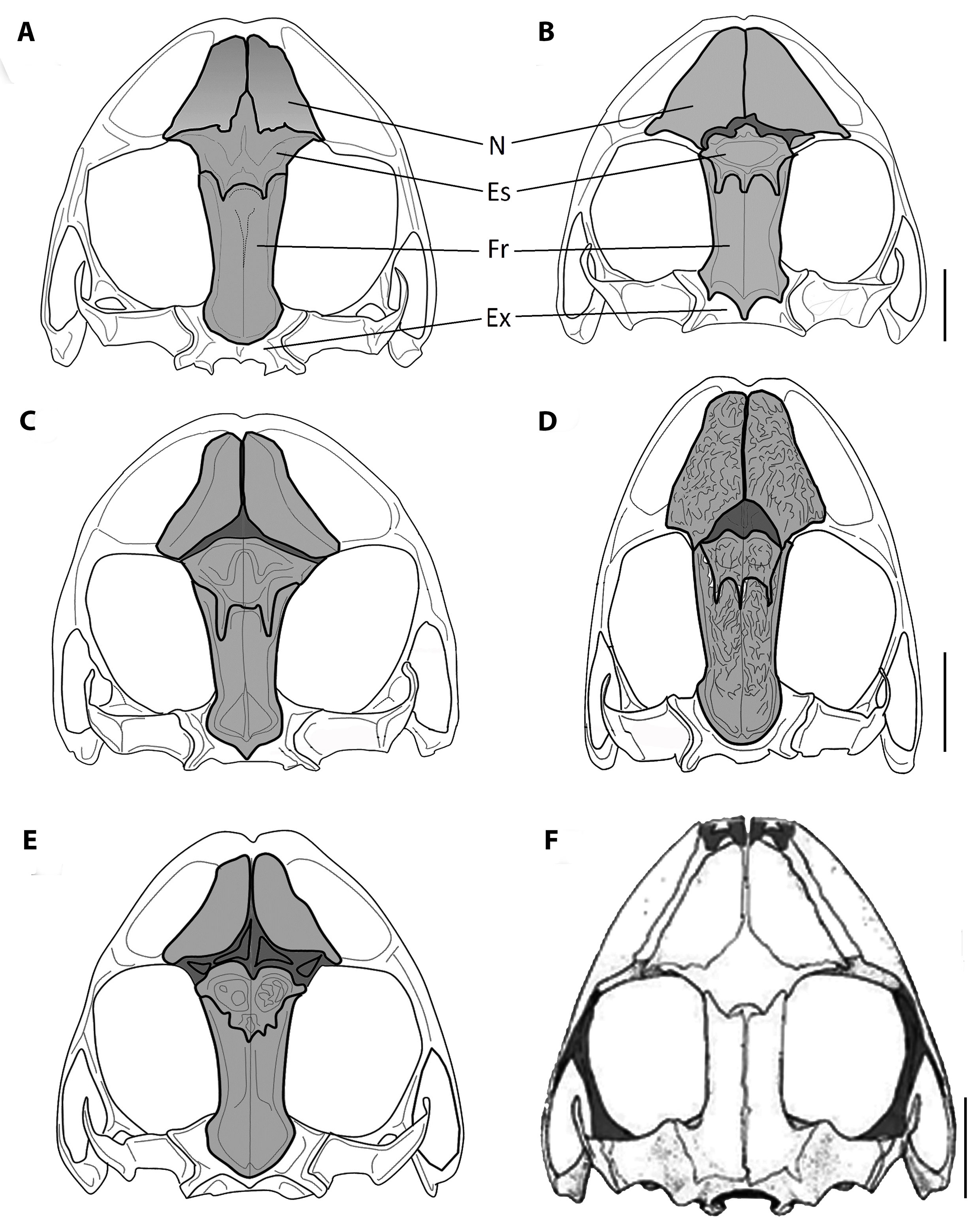
De acuerdo con nuestra filogenia, P. afrox (caracteres de esta especie entre paréntesis) es la especie hermana de P. tenebrionis (Lynch y Miyata, 1980). No obstante, P. tenebrionis carece de pliegue escapular en forma de × (presente), tubérculo cónico sobre el párpado rodeado de tubérculos pequeños (presente), tubérculos en el borde externo del tarso (presentes), rebordes cutáneos laterales en las patas traseras (presentes), además, P. tenebrionis presenta un iris azul (gris claro con finas reticulaciones negras). Entre otras de las especies de Hypodictyon de las tierras bajas y occidente de Ecuador, P. afrox puede ser confundido primariamente con P. labiosus Lynch et al. (1994) por la presencia de tubérculos en el ojo y talón, dedo I del mano ligeramente más pequeño que el II, discos anchos y emarginados. Sin embargo, P. labiosus alcanza un tamaño corporal máximo de 52.3 mm en hembras (45.75 mm), pliegue interocular usualmente ausente (presente), pliegue escapular en forma de W (forma de ×), tubérculo cónico pequeño en el párpado (cónico alargado), pliegue supratimpánico débilmente definido, pronunciado anteriormente al tímpano (conspicuamente definido y no pronunciado) con finos rebordes cutáneos basales (pronunciados en los dedos II-V), superficies posteriores de los muslos en fondo café (rojo), iris bronce rojizo brillante (iris gris claro con línea media horizontal gris oscura), esfenetmoides de contorno semicircular (acorazonado), frontoparietales débilmente estriados (fuertemente estriados), frontoparietales separados de los nasales por esfenetmoides (en contacto con los nasales encerrando al esfenetmoides), bordes frontoparietales elevados encerrando al exoccipital sin formar depresión cóncava (bordes posteriores de los frontoparietales fuertemente elevados generando una depresión cóncava en el exooccipital) (fig. 7).
Pristimantis rubicundus Jiménez-de la Espada (1875) de las estribaciones orientales de Ecuador es similar a P. afrox por presentar un tubérculo largo longitudinal en la zona interorbital y coloraciones rojizas en las superficies de las ingles y muslos; no obstante, P. rubicundus presenta un piel dorsal fuertemente tuberculada con un pliegue dérmico escapular en forma de W (finamente granular con tubérculos esparcidos y en ×), tubérculos postrictales conspicuos cónicos (pequeños subcónicos, vientre en fondo blanco marmoleado de café y de textura finamente areolada (fondo crema densamente punteado de negro y débilmente areolada), esfenetmoides de contorno estrellado, osificado (acorazonado, separado de los nasales por tejido condrictio), frontoparietales planos (cóncavos, desde el borde en contacto con el esfenetmoides hasta exooccipital) (fig. 7).
Pristimantis crenunguis Lynch (1976) de los bosques montano bajos, de las estribaciones occidentales de Ecuador difiere de P. afrox por presentar una LRC significativamente mayor (tabla 2); presenta pliegue escapular en forma de W (en ×), coloración ventral naranja pálido reticulado con café e iris dorado con línea café media horizontal (ventral crema débilmente punteada de negro, gris claro con línea media horizontal gris oscuro), esfenetmoides de contorno estrellado, osificado (acorazonado, separado de los nasales por tejido condrictio), frontoparietales no estriados (frontoparietales y nasales estriados), frontoparietales planos en vista dorsal y de perfil (cóncavos, desde el borde en contacto con el esfenetmoides hasta exooccipital) (fig. 7).
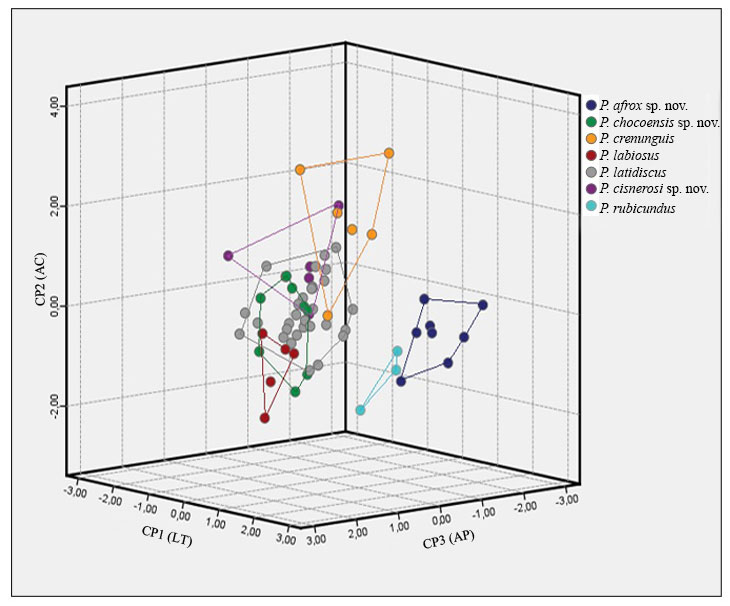
Morfométricamente y por medio de la prueba de Kruskall Wallis, P. afrox presenta diferencias estadísticamente significativas (figs. 8, 9) con P. labiosus y P. crenunguis (H = 40, p < 0.001) por poseer menor longitud de la tibia, cabezas menos anchas que P. labiosus, P. crenunguis y P. chocoensis, párpados más estrechos que P. labiosus, P. crenunguis y P. chocoensis y longitud rostro-cloacal menor que P. labiosus y P. crenunguis (tabla 2). En el método de ordenamiento PCA es posible identificar a P. afrox como un grupo sin sobreposición con otras especies en el espacio morfológico (fig. 8). Otras especies de Hypodictyon de Colombia y Ecuador comparadas con P. afrox se presentan en el apéndice 2.
Tabla 2
Medidas morfométricas de la serie tipo de Pristimantis afrox sp. nov., P. cisnerosi sp. nov., P. chocoensis sp. nov. y de hembras adultas de P. labiosus, P. crenunguis, P. rubicundus y P. latidiscus. Rango de medidas (máximo, mínimo, media y ± desviación estándar). DON = distancia órbita-narina; LC = longitud cefálica; AC = ancho cefálico; DIO = distancia interorbital; DIN = distancia internarinal; LT = longitud de la tibia; LP = longitud del pie; LM = longitud de la mano; DT = diámetro horizontal del tímpano; DO = diámetro de la órbita; AP = ancho del párpado.
| Pristimantis afrox
sp. nov. |
P. cisnerosi
sp. nov. |
P. chocoensis
sp. nov. |
P.
labiosus |
P. crenunguis | P. rubicundus | P. latidiscus | ||||
| Machos
n = 8 |
Hembras
n = 9 |
Machos
n = 4 |
Hembras
n = 6 |
Machos
n = 8 |
Hembras
n = 8 |
Hembras
n = 5 |
Hembras
n = 7 |
Hembras
n = 5 |
Hembras
n = 31 |
|
| LRC | 21.8-33.3 (30.7±4.2) | 32.3-45.8 (40.8±4.3) | 25.9-29.8 (27.5±1.8) | 32.8-49.1 (43.2±7) | 22.2-47.3 (34.3±8) | 33.3-58 (44.8±6.5) | 52.5-61.5 (57.4±4) | 44.2-65.9 (53.5±8.7) | 37.1-46.9 (41.6±4.9) | 26-42 (31.6±3.9) |
| ON | 5.4-6.8 (6.3±0.5) | 5.9-8.6 (7.5±0.8) | 4-5.2 (4.6±0.6) | 5-7.8 (6.6±1.1) | 4.6-7.5 (5.9±1.1) | 6.3-8.9 (7.5±0.9) | 8.7-11.8 (9.7±1.2) | 7.5-10.3 (8.7±0.9) | 6.4-7.7 (7.1±0.7) | 4.5-6.4 (5.2±0.5) |
| LC | 9.4-16.2 (13.6±2.3) | 12.7-19.9 (17.4±2.2) | 10.3-12.2 (11.6±0.9) | 14.8-21.5 (18.8±2.5) | 11.7-19 (15.1±2.9) | 15.8-22.6 (19.5±2.3) | 22.8-26.1 (24.1±1.3) | 19.5-29.9 (24.6±4) | 16.2-18.8 (17.4±1.3) | 11.2-16.9 (13.8±1.5) |
| AC | 8-12.8 (11.5±1.7) | 12.8-19.1 (15.6±1.5) | 10.1-11.9 (11±0.9) | 13.7-19.5 (17.3±2.2) | 10.9-18.5 (14.6±3) | 15.3-22.5 (±) | 22.2-26.8 (23.6±1.9) | 18.9-27.5 (22.8±3.6) | 15.1-17.3 (15.8±1.3) | 10.5-16.7 (13.1±1.5) |
| DIO | 3.1-3.8 (3.5±0.2) | 3.6-5.1 (4.8± 0.5) | 3-3.5 (3.2±0.2) | 3.8-6.1 (5.2±0.9) | 3-5.2 (4.1±0.9) | 4.4-6.8 (5.3±0.9) | 5.8-6.9 (6.3±0.4) | 4.9-7.6 (6.7±0.9) | 4.1-4.9 (4.5±0.4) | 3.1-5 (3.6±0.6) |
| DIN | 2.5-3.5 (3.1±0.4) | 3.2-4.5 (4± 0.5) | 2.7-3 (2.7±0.1) | 3.2-3.6 (3.4±0.2) | 2.7-3.8 (3.1±0.4) | 3.4-4.3 (3.9±0.3) | 4.7-5.3 (4.8±0.3) | 4.3-6.7 (5.2±0.8) | 3.7-3.8 (3.8±0.1) | 2.3-4.3 (3.2±0.4) |
| LT | 13.8-22.6 (19.8±2.9) | 21.2-30.3 (27.6±2.9) | 13.2-14.7 (13.7±0.7) | 16.2-23.2 (21±2.8) | 16.5-27.2 (22±4.1) | 23.9-32.5 (28.2±3.1) | 33.3-42.4 (36.3±3.7) | 29-39.8 (33.9±4.5) | 24.3-27.4 (25.5±1.7) | 14.7-21.8 (17.5±1.8) |
| LP | 16.3-24.5 (21.3±2.6) | 22.5-29.1 (27±2.1) | 12.6-14.5 (13.6±0.9) | 16.8-23.2 20.8(±2.5) | 13.2-23.1 (18±3.7) | 19.3-28.6 (24±3.2) | 29.5-41.3 (33±4.9) | 22.5-37.8 (31±5.5) | 21.3-25.7 (23.2±2.2) | 13-20.2 (15.8±1.9) |
| LM | 7-11.8 (10.1±1.6) | 10.2-15.7 (13.9±1.7) | 7.5-9.1 (8.4±0.8) | 9.7-19.2 (14.2±3.4) | 8.2-15.7 (12±2.4) | 12.3-17.2 (15±1.8) | 17.5-24.7 (20.2±2.7) | 17.2-23 (19.9±2.2) | 14.2-15.1 (14.6±0.5) | 8.4-13.6 (10.1±1.5) |
| DT | 1.4-2.1 (1.8±0.2) | 1.8-2.5 (2.8±0.2) | 1.2-1.4 (1.3±0.1) | 1.5-1.9 (1.6±0.2) | 1.6-2.7 (2±0.5) | 2.4-3.1 (2.7±0.2) | 2.3-2.9 (2.7±0.3) | 2.5-3.2 (2.8±0.3) | 2.7-2.8 (2.7±0) | 1.4-2.4 (1.8±0.2) |
| DO | 3.1-5.5 (4.7±0.8) | 4.2-6.3 (5.7±0.7) | 3.3-4.8 (4.1±0.7) | 4.9-6.4 (5.5±0.6) | 4.3-6.5 (5.4±0.8) | 5.1-7.5 (6.5±0.8) | 7.4-9 (7.9±0.7) | 6.8-9.6 (7.8±0.9) | 4.9-5.9 (5.3±0.6) | 4.1-5.5 (4.9±0.4) |
| AP | 2-3.9 (3.2±0.6) | 3.1-4 (3.5±0.3) | 2.4-3 (2.7±0.3) | 3-5 (3.8±0.8) | 2.9-4.9 (3.6±0.8) | 4-5.5 (4.7±0.5) | 5.9-6.9 (6.2±0.4) | 4.2-6.1 (5±0.8) | 3.4-4.4 (3.8±0.5) | 2.4-4.3 (3.2±0.4) |
Descripción del holotipo. Hembra adulta (fig. 3) con cabeza más larga que ancha, hocico subacuminado en vista dorsal, moderadamente largo, redondeado de perfil, labios acampanados, distancia ojo-narina 17.21% de LRC, canto rostral ligeramente cóncavo, definido, región loreal cóncava, narinas protuberantes proyectadas anteriormente sobre los labios, dirigidas lateralmente; área interorbital plana con un pliegue interorbital y un tubérculo largo longitudinal, más ancha que la distancia interorbital, el párpado superior equivale a 92% de la distancia interorbital; cresta craneal baja, presente y pronunciada posteriormente en relación al occipital; varios tubérculos redondeados en la región interorbital, párpado superior con un tubérculo cónico alargado rodeado por varios tubérculos pequeños, membrana timpánica diferenciada de la piel que la rodea, anillo timpánico evidente y cubierto en el margen superior por pliegue supratimpánico, tímpano visible dorsalmente, diámetro del tímpano equivale a 41% del diámetro del ojo, parte inferior del tímpano con tubérculos postrictales subcónicos pequeños; coanas pequeñas de contorno triangular, no cubiertas por piso palatal del maxilar; procesos dentígeros del vómer grandes, triangulares de 5 a 8 dientes, lengua tan ancha como larga, ligeramente acorazonada, con 40% adherida al piso de la boca.
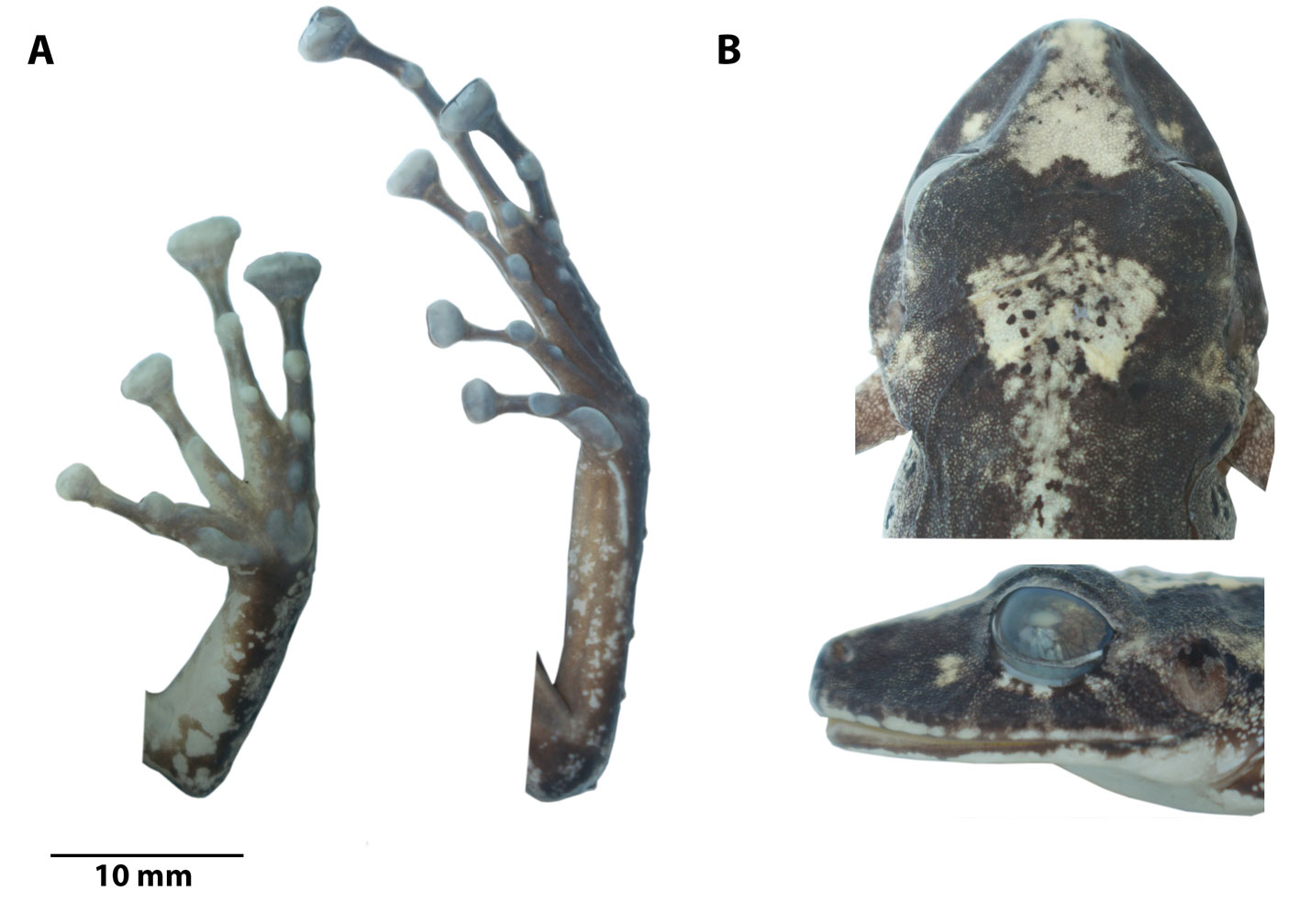
Textura del dorso finamente granular con verrugas esparcidas a lo largo de todo el cuerpo, vientre débilmente areolado, sin pliegues dorsolaterales, con pliegue dérmico en forma de ×, pliegue discoidal presente, se extiende desde la inserción de los brazos hasta antes del vientre; cloaca con una textura lisa a finamente granular, brazos esbeltos, sin tubérculos en la superficie dorsal y ventral del brazo, tubérculos ulnares ausentes; discos anchos en los dedos II-IV, emarginados, con superficie dorsal bilobulada, con hendiduras circunmarginales, tubérculos subarticulares redondeados y elevados en vista lateral; sin rebordes cutáneos laterales, tubérculo tenar largo y ovalado con tubérculo palmar acorazonado, superficie palmar sin tubérculos supernumerarios; extremidades posteriores esbeltas, longitud de la tibia equivale a 63% de la LRC, con pequeños tubérculos redondeados en el borde exterior de la tibia, con un tubérculo cónico en el talón, pliegue tarsal interno ausente, dedos del pie con rebordes cutáneos basales en los dedos II-IV, sin membranas interdigitales; tubérculos subarticulares redondos y prominentes, tubérculo metatarsal interno oval, 3 veces el tamaño del externo redondeado y aplanado, tubérculos supernumerarios plantares ausentes; discos expandidos en todos los dedos, más pequeños que los de la mano y dorsalmente bilobulados, dedo pedial V más largo que el III y no se extiende más allá del tubérculo subarticular distal del dedo IV (fig. 4).

Coloración del holotipo en preservado. Superficie dorsal café rojiza con pliegue escapular en forma de × crema, superficie ulnar y tarsal con bandas transversales crema, superficies dorsales de los dedos I y II crema con manchas café oscuras, superficie de todos los discos pigmentados de café oscuro, flancos crema manchados con café; vientre crema con finas puntuaciones café oscuro, garganta y pecho en fondo crema densamente punteado con café oscuro; superficies de los muslos, pierna y metatarso café marmoleado con crema; pliegue supratimpánico blanco, con 2 líneas suboculares y de 2 a 3 líneas supralabiales de color crema (fig. 3).
Coloración en vida y variación de holotipo y paratipos (descripción basada en fotografías en vida, fig. 2). Superficie dorsal desde café oscuro rojizo (DHMECN 6578, holotipo) a café verde olivo, con marca en × café rojizo (DHMECN 6578, holotipo) a café anaranjado, región nasal con marcas café doradas; flancos desde homogéneamente rojizos (DHMECN 6578, holotipo) a crema; región inguinal rojiza, extremidades con bandas transversales café anaranjadas o crema verde olivo; marcas suboculares crema; vientre homogéneamente crema a crema con débiles marcas café oscuras (DHMECN 6578, holotipo). Iris gris claro con línea media horizontal gris oscura.
Medidas del holotipo. LCR = 42.4; ON = 7.3; LC = 17.5; AC = 14.9; DIO = 4.9; DIN = 4.5; LT = 26.9; LP = 26.1; LM = 14; DT = 2.4; DO = 5.9; AP = 3.5.
Variaciones morfométricas. Las de la serie tipo son presentadas en la tabla 2. Los patrones de coloración en preservado (fig. 5) de la región medio dorsal variaron desde café anaranjado (DHMECN 7971), café rojizo (DHMECN 6578), café oscuro (DHMECN 7970) hasta café grisáceo (DHMECN 6574), 30% de los especímenes examinados entre machos y hembras (DHMECN 6575, 6579, 6582, 11467, 11469) presentaron un patrón de coloración medio dorsal bajo la marca en X y en la región nasal conspicuamente café crema; un solo espécimen (DHMECN11468) presentó bajo la marca en forma de × una línea medio dorsal crema hasta la cloaca. El 66% de los especímenes examinados exhibieron un patrón ventral crema finamente punteado de café oscuro, mientras que 5 especímenes presentaron el vientre marmoleado con café oscuro (DHMECN 6579, 6580, 11467 11468 y 11469). El 40% de la serie tipo presentó la coloración de la garganta en fondo blanco densamente punteado con café, el 33% exhibió una garganta en fondo blanco manchado con café oscuro y tan sólo en 4 especímenes, la coloración de la garganta fue mayoritariamente café oscuro (DHMECN 6579, 6580, 11467,11468). En la mayoría de ejemplares tipo, el pliegue interocular es elevado y fuertemente definido al igual que el tubérculo interorbital alargado.
Distribución e historia natural. La especie es conocida en 7 localidades de la vertiente pacífica del centro-sur de Colombia, en los departamentos de Valle del Cauca y Nariño, y en el extremo norte de Ecuador en la provincia de Esmeraldas (fig. 6). En Ecuador, está presente en la región natural bosque húmedo tropical del Chocó (Ron et al., 2019). En el ecosistema de bosque siempreverde de tierras bajas del occidente del Ecuador (MAE, 2013) y bosques húmedos subandinos en Colombia (SIAC, 2019), entre los 40 y 600 m de elevación. Pristimantis afrox fue recolectado sobre hojas de vegetación arbustiva, en el interior de bosque maduro, secundario y vegetación riparia entre los 0.50 y 1.80 m de altura. Fue registrado en simpatría con otras especies de Terrarana como: Craugastor longirostris, Diasporus gularis, P. achatinus, P. esmeraldas, P. latidiscus y P. cisnerosi sp. nov.; otros anuros registrados en simpatría fueron Boana rubracyla, Hyloscirtus palmeri y Espadarana prosoblepon.
Estado de conservación. Se sugiere que Pristimantis afrox debería ser considerado como vulnerable siguiendo los criterios de la UICN B1a, b(iii) porque: i) su extensión de presencia estimada es menor a 20,000 km2 (i.e., 9,614 km2), ii) sus localidades conocidas son menos de 10, iii) la calidad de hábitat y área de extensión presenta una disminución continua observada durante las últimas décadas (SIAC, 2019; Sierra, 2013).
Pristimantis cisnerosi sp. nov.
Nombre común sugerido: Cutín de Cisneros
Nombre común en inglés sugerido: Cisneros’s robber frog
Figs. 10-13
http://zoobank.org/urn:lsid:zoobank.org:act:9F1FBF15-A974-4BFB-88E6-575F2E2B9660


Diagnosis. Pristimantis cisnerosi sp. nov. es un miembro del subgénero Hypodictyon grupo de especies de P. ridens caracterizado por: 1) piel del dorso liso; piel del vientre areolada; pliegue discoidal presente; pliegues dorsolaterales ausentes; 2) membrana y anillo timpánico presente, oval, diámetro horizontal del tímpano 30% del diámetro del ojo; 3) hocico subacuminado en vista dorsal, moderadamente largo, redondeado de perfil; labios acampanados; 4) párpado superior con un tubérculo cónico sobre el ojo; menor que la distancia interorbital; cresta craneal presente, baja; 5) procesos dentígeros del vómer masivos, triangulares de contorno, con 6 a 10 dientes; 6) machos con hendiduras vocales y sin almohadillas nupciales; 7) dedo I de la mano ligeramente más corto que el dedo II; discos emarginados, dilatados en todos los dedos; 8) dedos de la mano con finos rebordes cutáneos laterales; 9) tubérculos ulnares ausentes; 10) talón con un tubérculo pequeño cónico; borde externo del tarso con 3-4 tubérculos subcónicos; pliegue tarsal interno presente; 11) tubérculo metatarsal interno oval 6 veces más grande que el tubérculo metatarsal externo pequeño subcónico; tubérculos supernumerarios indistintos; 12) dedos del pie con rebordes cutáneos laterales presentes, basales fuertemente definidos en los dedos II y III; membranas interdigitales ausentes; dedo V más largo que el III, más allá de la distancia del tubérculo subarticular distal del dedo IV; 13) dorsalmente desde homogéneamente café oscuro a café grisáceo salpicado de manchas oscuras café; vientre homogéneamente café escarlata a café escarlata con manchas cremas; superficies anteriores de los muslos y piernas densamente salpicado de crema; barras diagonales suboculares café oscuro finamente delineadas con crema; superficies anteriores de las extremidades con barras café oscuras; iris café oscuro, con finas reticulaciones cobre rojizas y pupila negra; 14) LRC en hembras 32.1-49.1 (= 43.2, n = 5); machos 25.1-4 mm (= 29.21, n = 5).
Resumen taxonómico
Holotipo: DHMECN 6683, hembra adulta, recolectada en Tobar Donoso (1°16’43” N, 78°50’71” O, 243 m snm, fig. 6), parroquia Mira, Cantón Tulcán, provincia de Carchi, República del Ecuador, por MYM y Luis Oyagata, 22-IX-2009.

Paratipos (6♀, 4♂): Ecuador: Provincia de Esmeraldas. Hembras DHMECN 11493 (material osteológico), DHMECN 11494, machos DHMECN 11495-11498, estero Pote y Angostura (0°51’35” N, 78°45’35” O, 163 m snm), Manuel Morales y Eduardo Toral, 1995; hembras QCAZ 17093, Alto Tambo, Rafael de Sá e Italo Tapia, 13-X-2001; hembra QCAZ 45432, Durango (1º2’30.7” N, 78º37’26.54” O, 243 m snm), Elicio Tapia, 3-X-2009; QCAZ 32120, 2 km E de vía Durango, Diego Almeida, 25-V-2006; juveniles QCAZ 65528, 65533, hembra adulta 65554, Parroquia Telembí, Reserva Tesoro Escondido (0º 31’54.9” N, 78º8’47” O; 252 m snm), Diego Almeida, Kunam Nusirquia, Diego Paucar, Estefany Guerra y Diego Quirola, X-2016. Colombia: Departamento de Valle del Cauca, UVC 13656, Vereda Bellavista (4°31’3.68” N, 76°36’9.01” O, 201 m snm), 1-VI-1999, Fernando Vargas.
Etimología: el epíteto específico de la especie es un patronímico con referencia a Diego Francisco Cisneros-Heredia (1980, Quito, Ecuador), investigador y profesor del Colegio de Ciencias Biológicas y Ambientales de la Universidad San Francisco de Quito. Diego Cisneros-Heredia ha contribuido significativamente al estudio y la taxonomía de la herpetofauna ecuatoriana por más de 12 años.
Comentarios taxonómicos
Comparación con especies similares. Pristimantis cisnerosi sp. nov., difiere de otros congéneres del subgénero Hypodictyon¸ grupo de especies de P. ridens de las tierras bajas del occidente de Ecuador por sus distintivos huesos nasales fuertemente convexos y acampanados, narinas protuberantes proyectadas anteriormente, coloración dorsal café oscura y vientre café escarlata, tubérculos cónicos sobre el párpado y tímpano reducido.
Pristimantis cisnerosi (caracteres de esta especie entre paréntesis) es morfológicamente similar a P. latidiscus del occidente de Colombia y Ecuador, el cual se caracteriza por una textura de la piel del dorso tuberculada a finamente granular (liso), tubérculo sobre el párpado subcónico (cónico), distintivo pliegue dérmico escapular con forma de / (ausente), pliegue supratimpánico (ausente), I dedo más corto que el dedo II (ligeramente más corto), borde interno del tarso con tubérculo en forma de pliegue (con pliegue presente), dorso con patrón polimórfico usualmente con marca escapular en forma de W y vientre café con garganta naranja (homogéneamente café oscuro con vientre café escarlata); LRC máxima en hembras de 53. 4 mm (49.07 mm) (fig. 9).
Por su patrón de coloración café oscuro, P. cisnerosi sp. nov. puede ser similar a P. crenunguis de los bosques montano bajos de las estribaciones occidentales de los Andes de Ecuador, el cual es fácilmente distinguible de la nueva especie por presentar el dedo I más largo que el II (I ligeramente más corto que dedo II), sin pliegue tarsal interno (pliegue presente) un tamaño corporal máximo en hembras hasta 64.5 mm (49.07 mm) y un vientre café rosáceo a café anaranjado (vientre café escarlata); el hueso esfenetmoides de contorno estrellado, osificado y no se separa de los nasales por tejido condrictio (trilobulado, borde distal del esfenetmoides separado de los nasales), frontoparietales planos en vista dorsal y de perfil (ligeramente convexo de perfil) (fig. 7).
Morfométricamente y por medio de la prueba de Kruskall Wallis, Pristimantis cisnerosi sp. nov. presenta diferencias estadísticamente significativas (figs. 8, 9) con la especie morfológicamente más similar P. latidiscus (H = 44.6, p <0.001), por poseer mayor longitud de la tibia, ancho de la cabeza y longitud rostro-cloacal (tabla 2). En el método de ordenamiento PCA es posible identificar a P. cisnerosi como un grupo diferenciado de P. latidiscus, aunque comparte espacio morfológico en menor proporción con P. crenunguis, del grupo de P. rubicundus (fig. 8). Otras especies de Hypodictyon de Colombia y Ecuador filogenéticamente relacionadas con P. cisnerosi sp. nov. se presentan en el apéndice 3.
Descripción del holotipo. Hembra adulta (fig. 11), cabeza tan ancha como el cuerpo, ligeramente más larga que ancha, hocico subacuminado en vista dorsal, redondeado de perfil, labios acampanados; distancia ojo-narina 19.13% de LRC; canto rostral convexo, región loreal convexa; narinas protuberantes proyectadas anteriormente sobrepasando los labios y dirigidas dorsolateralmente; área interorbital elevada, el párpado superior equivale al 68.27% de la distancia interorbital; cresta craneal presente, baja definida en el borde anterior occipital; párpado superior con un tubérculo cónico; membrana timpánica bien diferenciada de la piel que lo rodea, anillo timpánico débilmente definido y oval, con margen posterior cubierto ¾ por un pliegue postimpánico que se extiende hasta la inserción de la mandíbula (fig. 11), tímpano visible dorsalmente, diámetro del tímpano equivale al 29.35% del diámetro del ojo; coanas grandes semicirculares, no adheridas por piso palatal del maxilar superior; procesos dentígeros del vómer grandes, masivos, triangulares con 13-15 dientes, lengua más larga que ancha de forma oval, con una 40% adherida al piso de la boca.
Textura del dorso lisa, granular hacia la parte posterior del dorso, vientre areolado, sin pliegues dorsolaterales y con pliegue discoidal definido; cloaca rodeada por verrugas planas; brazos delgados, sin tubérculos ulnares; dedos de la mano con finos rebordes cutáneos laterales; discos anchos dilatados en los dedos III-IV, todos los dedos definidos por surcos circunmarginales, I dedo de la mano ligeramente más corto que el II; tubérculo tenar elíptico, tubérculo palmar acorazonado, sin tubérculos supernumerarios, tubérculos subarticulares redondos y elevados en vista lateral; extremidades posteriores esbeltas, longitud de la tibia equivale al 54.71% de la LRC, con un tubérculo subcónico en el talón y con varios tubérculos subcónicos en la superficie dorsal de la tibia, con 2-3 tubérculos subcónicos redondeados en el borde externo del tarso; dedos del pie con finos rebordes cutáneos laterales, basales fuertemente definidos entre los dedos II-IV, sin membranas interdigitales; tubérculos subarticulares redondos y elevados en vista lateral; tubérculo metatarsal interno oval, 6 veces el tamaño del externo pequeño subcónico (fig. 12); tubérculos supernumerarios plantares indistintos; pliegue metatarsal interno presente, pequeño (fig. 12); discos expandidos en los dedos II-V, ligeramente más pequeños que los de la mano; dedo V del pie más largo que el III y se extiende más allá del tubérculo subarticular distal del dedo IV.


Coloración en preservado del holotipo. Aspecto dorsal homogéneamente café oscuro con bandas transversales negras en las extremidades anteriores y posteriores; coloración ventral homogéneamente café oscura con reticulaciones oscuras cafés en la garganta, finamente punteado de blanco en el vientre y en la superficie ventral de las extremidades posteriores; con 2 barras diagonales suboculares (fig. 11).
Coloración en vida y variación de holotipo y paratipos (descripción basada en fotografías en vida y notas de campo de MYM) (fig. 10). Coloración dorsal homogéneamente café oscura, con manchas negras dirigidas hacia los flancos; vientre café en tonalidad escarlata, finamente punteado de blanco; con bandas diagonales suboculares finamente delineadas de café claro; extremidades anteriores y posteriores con barras café oscuro; iris café con finas reticulaciones cobre.
Medidas del holotipo. LCR = 39.2; ON = 7.5; LC = 18.8; AC = 17.3; DIO = 4.9; DIN = 3.6; LT = 21.5; LP = 21.3; LM = 19.2; DT = 1.6; DO = 5.5; AP = 3.4
Variaciones morfométricas. Las de la serie tipo son presentadas en la tabla 2. Se evidenciaron variaciones en los patrones de coloración dorsal y ventral (fig. 13), los ejemplares DHMECN 11494-11496 y 11498 presentaron coloración dorsal café grisáceo con manchas negras, cremas blanquecinas dispersas a lo largo del dorso; DHMECN 11497 presentó una evidente marca escapular en forma de W y marcas diagonales café oscuras en los flancos, mientras que el DHMECN 11494 exhibió una fina línea blanca media dorsal desde la punta del hocico hasta la cloaca. Ventralmente las hembras (DHMECN 6383, holotipo; QCAZ 17093) presentaron vientres homogéneamente café oscuros, mientras que los machos y hembras subadultas (DHMECN 11494-11498, QCAZ 32120, 45432) exhibieron vientres y gargantas café en tonalidades crema densamente salpicado de café oscuro, además, presentaron banda supratimpánica negra a café oscura.

Distribución e historia natural. Pristimantis cisnerosi se distribuye en 8 localidades en los bosques siempreverdes de tierras bajas del Ecuador (MAE, 2013), en la provincia de Esmeraldas y en los bosques húmedos subandinos (SIAC, 2019) de Colombia, en los departamentos de Valle del Cauca, Chocó y Nariño (fig. 6), entre los 70 y 600 m de elevación. En Ecuador está presente en las regiones naturales del bosque húmedo tropical del Chocó y bosque piemontano occidental (Ron et al., 2019). Esta especie de Pristimantis fue recolectada en el interior de bosque primario en vegetación media, perchando sobre hojas y ramas, a una altura de 1.60 m. Algunas especies de Pristimantis simpátricas registradas junto al holotipo en los bosques de Tobar Donoso incluyen a: P. esmeraldas, P. latidiscus, P. afrox sp. nov. y Craugastor longirostris.
Estado de conservación. Se sugiere que P. cisnerosi debería ser considerado como vulnerable siguiendo los criterios de la UICN B1a, b(iii) debido a que: i) su extensión de presencia estimada es menor a 20,000 km2 (i.e., 9,171 km2), ii) sus localidades conocidas son menos de 10, iii) la calidad de hábitat y área de extensión presenta una disminución continua observada durante las últimas décadas (SIAC, 2019; Sierra, 2013).
Pristimantis chocoensis sp. nov.
Nombre común sugerido: Cutín del Chocó
Nombre común en inglés sugerido: Choco’s robber frog
Figs. 14-17
http://zoobank.org/urn:lsid:zoobank.org:act:D7A3C577-287D-4991-9354-42F6C7F0BE03

Diagnosis. Pristimantis chocoensis sp. nov. es un miembro del subgénero Hypodictyon grupo de especies de P. rubicundus caracterizado por: 1) piel del dorso finamente granular y granular hacia los flancos; textura ventral granular hacia los flancos y vientre, pecho y garganta lisos; evidente pliegue discoidal, bien definido; pliegue interocular débilmente definido; 2) membrana y anillo timpánico presente, ovoide, diámetro horizontal del tímpano 40% del diámetro del ojo, tubérculos postrictales subcónicos; 3) hocico subacuminado en vista dorsal, redondeado de perfil, labios acampanados; 4) párpado superior con varios tubérculos subcónicos pequeños poco elevados sobre el ojo; menor que la distancia interorbital; cresta craneal presente, baja; 5) procesos dentígeros del vómer masivos, triangulares de contorno, con 7 a 10 dientes; 6) machos con hendiduras vocales y sin almohadillas nupciales; 7) dedo I de la mano igual o ligeramente más corto que el dedo II; discos anchos, dilatados en todos los dedos, bilobulados dorsalmente; 8) dedos de la mano con finos rebordes cutáneos laterales; 9) tubérculos ulnares presentes, pequeños de subcónicos a redondeados; 10) talón con un tubérculo pequeño subcónico; borde externo del tarso con 3 tubérculos subcónicos; pliegue tarsal interno presente; 11) tubérculo metatarsal interno oval 5 veces más grande que el tubérculo metatarsal externo pequeño triangular; tubérculos supernumerarios ausentes; 12) dedos del pie con finos rebordes cutáneos laterales; membranas interdigitales ausentes; dedo V más largo que el III, no sobrepasa al tubérculo subarticular distal del dedo IV; 13) patrón de coloración dorsal policromático desde homogéneamente café oscuro a café grisáceo, con marcas occipitales, medio dorsales y en la parte anterior del rostro café crema, café grisáceo hasta café oscuro; la parte posterior a la inserción del brazo con manchas negras, extremidades anteriores y posteriores con bandas transversales café oscuras, superficies posteriores de los muslos homogéneamente cafés; vientre, pecho y garganta crema inmaculado a crema con manchas café irregulares, con bandas diagonales suboculares y línea labial blanca completa a interrumpida; iris en vida café bronceado con un parche en el cuarto inferior del iris crema bronce; 14) LRC en hembras 31.3-51.9 (= 44.8, n = 8); machos 22.2-47.3 mm (= 34.3, n = 8).
Resumen taxonómico
Holotipo: DHMECN 9529, hembra adulta, Reserva Biológica Canandé (0°31’46.8” N, 79°12’37.8” O; 320 m snm, fig. 6), recinto Las Yucas, Parroquia Santo Domingo de Onzole, cantón Eloy Alfaro, provincia de Esmeraldas, República del Ecuador, Manuel Morales, J. P. Reyes-Puig, Rene Valverde y Karem López, 17-IV-2012.
Paratipos (9♀, 12♂, 1 juvenil): Ecuador. Hembra DHMECN 9526, machos DHMECN 9525, 9527, 9528, 9530 con los mismos datos del holotipo; hembra DHMECN 2788, macho DHMECN 2786 recolectado en la misma localidad del holotipo, MYM, P. Meza-Ramos, M. M. Reyes-Puig y A. Loaiza, 17-VIII-2004, hembra DHMECN 10285, misma localidad del holotipo, Jesse Delia, 4-5-VIII-2007; hembra DHMECN 3303 (material osteológico), Río Negro (0°54’59” N, 78°34’59.99” O, 680 m snm), Parroquia Alto Tambo, Cantón San Lorenzo, Provincia de Esmeraldas, MYM y Carlos Landazuri, 28-IX-2005; hembras DHMECN 11470, 11473, 11474; machos DHMECN 11471, 11472, 11475, estero Pote y Angostura (0°51’35” N, 78°45’35” O, 163 m snm), Provincia de Esmeraldas, Manuel Morales y Eduardo Toral, 1995. Juvenil QCAZ 65461, macho subadulto QCAZ 65464, machos adultos QCAZ 65555, 65560; hembra adulta QCAZ 65556, Cantón Eloy Alfaro, Parroquia Telembí, Reserva Tesoro Escondido. Macho adulto, QCAZ 65461 (0°32’21.12” N, 78°8’39.12” O, 347 m snm); macho subadulto, QCAZ 65556 (0°32’1.32” N, 79°8’40.20” O, 281 m snm); macho adulto, QCAZ 65560 (0°29’48.12” N, 79°8’12.12” O, 619 m snm); Diego Almeida, Eloy Nusirquia, Diego Paucar, Estefany Guerra, y Diego Quirola, 1920-X-2016.
Material referido (4): DHMECN 2787, 2791, 2794 y 2795 con los mismos datos del 2788.
Etimología: el epíteto específico “chocoensis” es un adjetivo que hace alusión a la región biogeográfica del Chocó, caracterizada por una alta diversidad de ranas del subgénero Hypodictyon.

Comentarios taxonómicos
Comparación con especies similares. Pristimantis chocoensis sp. nov. difiere de otros miembros del subgénero Hypodictyon, grupo de especies rubicundus, por presentar: dedo de I de la mano igual o ligeramente más corto que el II, vientre y garganta homogéneamente crema a ligeramente manchado de café, pliegue interorbital débilmente definido, rebordes cutáneos laterales estrechamente definidos hacia la base de la mano, pliegue metatarsal interno bien definido, conspicuas manchas negras hacia la inserción posterior del brazo.
Pristimantis chocoensis sp. nov. (caracteres de esta especie entre paréntesis) está estrechamente relacionado con P. labiosus de los bosques piemontanos del Ecuador, el cual se caracteriza por la presencia de un tubérculo subcónico sobre el párpado (varios pequeños, bajos), pliegue interorbital usualmente ausente (presente débilmente definido), tubérculos ulnares ausentes (pequeños de subcónicos a redondeados), ausencia de pliegue metatarsal interno (presente bien definido), ausencia de rebordes cutáneos laterales en la mano (presentes, estrechos), rebordes cutáneos laterales del pie definidos en las bases (estrechos y no definidos en las bases), tubérculo metatarsal externo redondo (triangular elevado), vientre crema con flecos cafés (crema inmaculado a crema con manchas cafés irregulares), ausencia de marcas negras en la inserción posterior de los brazos (presentes). El hueso esfenetmoides en su porción anterior es de contorno semicircular (acorazonado), tejido condrictio entre los huesos nasales y el esfenetmoides menor que en P. chocoensis (fig. 7), el tamaño relativo de los procesos dentígeros del vómer en P. labiosos es mayor que en P. chocoensis.
Pristimantis chocoensis (caracteres de esta especie entre paréntesis) en su morfología externa puede ser similar a P. crenunguis de los bosques montanos bajos del occidente de Ecuador, caracterizado por: dedo I de la mano más grande que el II (dedo I ligeramente más pequeño que el II), ausencia de pliegue interorbital y pliegue tarsal interno (presentes), coloración dorsal y ventral café oscura (policromática y vientre inmaculado). El hueso esfenetmoides completo, osificado contactando los nasales, de contorno estrellado (dividido, separados por tejido condrictio, osificado en las 3/4 partes y de forma acorazonada), frontoparietales planos en vista dorsal y de perfil (cóncavos solo en el borde proximal en contacto con el exoccipital) (fig. 7).


Morfométricamente y por medio de la prueba de Kruskall Wallis, Pristimantis chocoensis presenta diferencias estadísticamente significativas (figs. 8-9) con P. labiosus (H = 49.4, p <0.0001), por exhibir cabezas y párpados menos anchos, así como menor longitud rostro-cloacal (tabla 2). La longitud de la tibia en P. chocoensis fue significativamente más corta que en P. crenunguis y P. labiosus (fig. 9). En el método de ordenamiento PCA es posible identificar a Pristimantis chocoensis como un grupo que comparte parte del espacio morfológico con P. labiosus, especie morfológica y filogenéticamente relacionada, sin embargo, no comparte variables con las 2 especies nuevas descritas en este trabajo (P. afrox y P. cisnerosi) (fig. 8). Otras especies de Hypodictyon comparadas con Pristimantis chocoensis sp. nov. se presentan en el apéndice 2.
Descripción del holotipo. Hembra adulta (fig. 15), cabeza ligeramente más ancha que el cuerpo, tan ancha como larga, hocico largo subacuminado en vista dorsal, redondeado de perfil, labios acampanados; distancia ojo-narina 15.34% de LRC; canto rostral recto, definido, región loreal recta; narinas protuberantes dirigidas dorsolateralmente; área interorbital plana, con un fino pliegue interocular, el párpado superior equivale al 84% de la distancia interorbital; cresta craneal presente, con bordes frontoparietales posteriores elevados hacia el exooccital; párpado superior con varios tubérculos subcónicos; membrana timpánica visible, bien diferenciada de la piel que lo rodea, anillo timpánico cubriendo sólo la mitad anterior del tímpano, la mitad posterior cubierta por un fino pliegue supratimpánico; tímpano visible dorsalmente, diámetro del tímpano equivale al 42.75% del diámetro del ojo, con 2 tubérculos postrictales subcónicos, pliegue dérmico escapular en forma de W; coanas de contorno semicircular, no cubiertas por piso palatal del maxilar superior, más pequeñas que los procesos dentígeros del vómer; procesos dentígeros del vómer masivos de contorno triangular, con 8-11 dientes, lengua ligeramente más ancha que larga de forma lanceolada, con un 40% adherida al piso de la boca.
Textura del dorso finamente granular y granular hacia los flancos, vientre liso en la garganta y pecho, areolado hacia los flancos y la parte inferior del vientre, sin pliegues dorsolaterales y con pliegue discoidal bien definido desde las axilas hasta ¼ antes de la inserción con la ingle; cloaca rodeada por piel finamente granular; brazos delgados, cubiertos dorsal y ventralmente por un par de tubérculos redondeados, borde externo sin tubérculos ulnares; dedos de la mano con estrechos rebordes cutáneos laterales, extendiéndose como un fino pliegue desde el borde externo del dedo IV hasta la palmeadura; tubérculo palmar interno acorazonado, tubérculo tenar elíptico, tubérculos subarticulares redondos, fuertemente elevados en vista de perfil, discos expandidos más anchos que los dígitos, truncados, con hendiduras circunmarginales y bilobulados en vista dorsal, dedo I de la mano igual que el dedo II; extremidades posteriores delgadas, longitud de la tibia equivale al 55.1% de la LRC, con un tubérculo subcónico en el talón y con 3 tubérculos subcónicos en el borde externo del tarso, pliegue metatarsal interno presente, bien definido, se extiende desde el borde del tubérculo metatarsal interno hasta el primer tercio de la longitud de la tibia; dedos del pie con estrechos rebordes cutáneos laterales, sin membranas interdigitales; tubérculos subarticulares redondos , fuertemente elevados en vista de perfil; tubérculo metatarsal interno oval, 5 veces el tamaño del externo triangular y de punta redondeada; discos expandidos en todos los dedos, tan anchos como los dedos de la mano; dedo del pie V más largo que el III y alcanza al del tubérculo subarticular distal del dedo IV, pero no se extiende más allá de éste (fig. 16).
Coloración en preservado del holotipo. Coloración dorsal café grisácea con marca media crema pálida desde la punta del hocico, región occipital, a lo largo del dorso hasta cerca de la inserción con la cloaca; flancos gris pálido con marcas negras hacia la inserción de los brazos; extremidades anteriores y posteriores con bandas transversales débilmente definidas, superficies posteriores de los muslos café; ventralmente crema inmaculado en la garganta, pecho y vientre; superficies ventrales de las extremidades ligeramente variegadas, con bandas diagonales suboculares café grisáceas y línea labial blanca completa (fig. 15).
Coloración en vida y variación de holotipo y paratipos (descripción basada en fotografías en vida) (figs. 13-14). Coloración dorsal de café claro a café grisáceo, con marcas beige en la punta del hocico y en el medio del dorso; las manchas negras en las axilas varían entre conspicuas (e.g, QCAZ 65461) e inconspicuas (QCAZ 65560); vientre crema inmaculado o crema con manchas irregulares cafés (e.g., QCAZ 65464); con barras café oscuras diagonales bajo el ojo y en las extremidades, línea labial variable entre crema y café clara; superficies posteriores de los muslos café achocolatado, superficie ventral con la mitad superior crema y la mitad inferior café achocolatado; iris en sus ¾ partes café claro, ¼ inferior crema finamente reticulado con café oscuro.
Medidas del holotipo. LCR = 58; ON = 8.9; LC = 22.55; AC = 22.5; DIO = 6.6; DIN = 4,2; LT = 32; LP = 28.6; LM = 17.2; DT = 3.1; DO = 7.3; AP = 5.5

Variaciones morfométricas. Las de la serie tipo se presentan en la tabla 2. Variaciones evidentes fueron determinadas en los patrones de coloración dorsal (fig. 17), en preservado desde homogéneamente café grisáceo (DHMECN 2788), con distintivas marcas cremas media dorsales y en la punta del hocico (DHMECN 9529), dorso crema con marca medio dorsal gris (DHMECN 11470), crema con marca dorsal café oscura (DHMECN 1473), dorso café grisáceo con marca escapular en forma de W (DHMECN 10285) y homogéneamente café (DHMECN 11472). La piel dorsal puede carecer de tubérculos o puede ser tuberculada (QCAZ 65464).
Distribución e historia natural. Pristimantis chocoensis sp. nov. es conocida de 4 localidades en los bosques siempreverdes de tierras bajas (MAE, 2013) de la Provincia de Esmeraldas, entre los 200 a 680 m de elevación. Está presente en las regiones naturales del bosque húmedo tropical del Chocó y bosque piemontano occidental (Ron et al. 2019). Las especies fueron registradas en el interior de bosque primario, en vegetación de sotobosque; en la Reserva Biológica Canandé fue registrada en simpatría con P. achatinus, P. degener, P. esmeraldas, P. latidiscus, P. rosadoi, P. subsigillatus y P. walkeri.
Estado de conservación. Se sugiere que Pristimantis chocoensis debería estar considerada como en peligro siguiendo los criterios de la UICN B1a, b(iii) debido a: i) su extensión de presencia estimada es menor a 5,000 km2 (i.e. 201 km2), ii) sus localidades conocidas son menos de 5, iii) la calidad de hábitat y área de extensión presenta una disminución continua observada durante las últimas décadas (Sierra, 2013)
Observaciones. Pristimantis chocoensis es especie hermana de un clado distribuido en las provincias de Esmeraldas e Imbabura, Ecuador. La distancia genética no corregida para el gen 16S entre los 2 clados es 5.4%, en promedio. Ambas especies son simpátricas en la Reserva Tesoro Escondido. Su simpatría y las altas distancias genéticas demostrarían la existencia de aislamiento reproductivo.
Discusión
Canedo y Haddad (2012), Padial et al. (2014), Pinto-Sánchez et al. (2012) y Pyron y Wiens (2011) determinaron altos valores de soporte para el subgénero Hypodictyon y sus 2 grupos de especies. No obstante, la revisión de Padial et al. (2014) desconoce al subgénero Hypodictyon y plantea prematuramente una sola serie de especies (i.e., Pristimantis ridens) sin definirla ni justificando la posición de P. caryophyllaceus y P. cerasinus como miembros del grupo de P. rubicundus, cuando previamente ya fueron reportadas en el grupo de P. ridens (Crawford et al., 2010; Hedges et al., 2008). Además, desconoce la asignación de Crawford et al. (2010) de P. altae, P. pirrensis y P. pardalis como especies externas al subgénero Hypodictyon (sensu Hedges et al., 2008) y las mantiene dentro de éste por lo que concluye que Hypodictyon es parafilético. Con base en nuestros resultados y los de Heinicke et al. (2017), sugerimos la validez del subgénero Hypodictyon.
Otra inconsistencia de Padial et al. (2014) fue afirmar que las series de P. ridens y P. rubicundus (sensu Hedges et al., 2008) son parafiléticas. La parafilia reportada por Padial et al. (2014; fig. 20) sería causada por la posición de P. caryophyllaceus dentro del grupo de P. ridens. Sin embargo, P. caryophyllaceus es parte de la serie P. ridens de acuerdo con Hedges et al. (2008), no de P. rubicundus como menciona Padial et al. (2014), por lo tanto, ambos grupos serían monofiléticos en las filogenias presentadas por Hedges et al. (2008) y Padial et al. (2014). Con base en la supuesta parafilia de ambas series, Padial et al. (2014) fusionaron y reconocieron un solo grupo de especies para ambas, el grupo Pristimantis ridens. Nosotros retomamos la propuesta de Hedges et al. (2008) reconociendo ambos grupos de especies.
Se reportan por primera vez las relaciones y posicionamiento filogenético de Pristimantis calcaratus, P. colomai, P. illotus, P. kuri, P. rosadoi, P. tenebrionis y P. variabilis. Estas especies nunca habían sido asociadas con Hypodictyon o con los grupos de especies de P. ridens o P. rubicundus. Pristimantis variabilis y P. calcaratus habían sido asignados previamente al grupo de P. unistrigatus (Hedges et al., 2008), sin embargo, nuestros resultados indican el posicionamiento de ambas especies dentro del grupo de P. ridens. García et al. (2014) evalúan la diferenciación genética de 3 especies de Pristimantis morfológicamente similares (P. calcaratus, P. jubatus, P. kelephas), no obstante, no asignan a ninguna de ellas al subgénero Hypodictyon. Nuestros análisis demuestran que P. calcaratus forma parte del grupo de especies de P. ridens, por lo tanto, incluimos a las 3 especies mencionadas dentro de este grupo basados en su estrecha similitud genética. Del mismo modo, Pristimantis illotus forma parte del grupo de P. rubicundus, en lugar del grupo de P. unistrigatus propuesto por Hedges et al. (2008). Pristimantis kuri también formaría parte del grupo de P. rubicundus. Nuestros análisis permiten identificar la presencia y posicionamiento filogenético de al menos 2 especies candidatas nuevas dentro del subgénero aparte de las descritas en este manuscrito (Pristimantis sp. del grupo de P. ridens QCAZ 40065, Pristimantis aff. chocoensis QCAZ 45998) (fig. 1).
Se asigna a las 3 especies nuevas al subgénero Hypodictyon. Pristimantis afrox y P. chocoensis son parte del grupo de P. rubicundus; mientras que P. cisnerosi es parte del grupo de P. ridens (fig. 1). Las características morfológicas coinciden en cabezas moderadamente anchas, tímpano diferenciado, procesos dentígeros del vómer masivos y de contorno triangular, discos terminales en los dígitos anchos, bien definidos por surcos circunmarginales en forma de T, dedo I de la mano igual o ligeramente más corto que el II y tubérculos subarticulares prominentes (Hedges et al., 2008).
Nuestras observaciones morfológicas concuerdan con nuestros análisis filogenéticos porque indican que Pristimantis labiosus, P. crenunguis, P. chocoensis, P. afrox y P. rubicundus están estrechamente relacionadas y asociadas al grupo de especies P. rubicundus (sensu Hedges et al., 2008) al presentar tamaños corporales medianos a grandes (20.8-71.5 mm de LRC), el dedo I de la mano igual o ligeramente más corto que el II, usualmente condición B para el dedo V del pie, pliegue interocular usualmente presente, vientres desde lisos a finamente areolados y estructura craneal caracterizada por frontoparietales no fusionados con el proótico. Estas especies están distribuidas en las estribaciones y tierras bajas del occidente del Ecuador y sur de Colombia, es importante mencionar que P. crenunguis correspondería al linaje de los bosques montanos, P. labiosus al de los bosques piemontanos, P. afrox y P. chocoensis al de bosques de tierras bajas; experimentando un aumento en el tamaño corporal a medida que asciende la gradiente altitudinal, sugiriendo un modelo de especiación parapátrico en función de la grandiente altitudinal.
Pristimantis chocoensis está estrechamente relacionado con P. labiosus de las estribaciones piemontanas de los Andes norte de Ecuador y sur de Colombia, morfológicamente son muy similiares (aunque la presencia de pliegue metatarsal interno es una evidencia clara para separarla de P. labiosus). Por su similitud, P. chocoensis ha sido identificado como P. labiosus (Morales-Mite et al., 2013). Pristimantis afrox es la especie hermana de P. tenebrionis, en conjunto las 2 especies se anclan a un clado conformado por P. crenunguis, P. aff. chocoensis, P. chocoensis y P, labiosus. Pristimantis afrox exhibe patrones morfométricos y caracteres morfológicos similares a los del grupo de especies de P. rubicundus, como la presencia de tubérculo interorbital alargado. Pristimantis cisnerosi está asociada al grupo de especies de P. ridens, por presentar tamaños corporales pequeños y medianos (16-49 mm de LRC), el dedo I de la mano es más corto que el II, vientres fuertemente areolados, ausencia de pliegue interocular, condición C para el dedo V del pie, estructura craneal caracterizada por la fusión de los frontoparietales con el proótico.
La descripción de estas 3 especies nuevas de ranas Pristimantis para el Chocó biogeográfico, incrementa a un total de 67 Pristimantis formalmente reportadas para la región (Lynch, 1999; Ron et al., 2019; Yánez-Muñoz et al., 2010); que estarían agrupadas en por lo menos 5 clados, entre los cuales Hypodictyon sería el más diverso, con 40% del total de especies para la bioregión. En su mayoría, las especies de Pristimantis del Chocó presentan amplios rangos de distribución desde el sur occidente de Colombia y noroccidente de Ecuador, 2 de las nuevas especies (Pristimanntis afrox y P. cisnerosi) coinciden con este tipo de distribución. Contrastando así con la distribución restringida que presenta P. chocoensis, de pocas localidades en la porción norte de la provincia de Esmeraldas. La cercanía limítrofe de dichas localidades supondría la presencia de P. chocoensis en la parte sur occidental de Colombia, sin embargo, después de la revisión exhaustiva de material de Pristimantis en las colecciones de la Universidad de Valle del Cauca (UVC) e Instituto de Ciencias Naturales (ICN), no hallamos ningún espécimen que corresponda a la nueva especie.
La fuerte presión antrópica por procesos de deforestación a los cuales siguen siendo sometidos los ecosistemas tropicales del Chocó biogeográfico (Echeverry y Harper, 2009), puede constituir una amenaza para las poblaciones de Terrarana que habitan en los remanentes boscosos del Chocó colombiano y ecuatoriano. Es por esto que identificamos la necesidad de ampliar áreas de conservación dentro de esta bioregión, considerando que el rango de distribución de las nuevas especies estaría limitado a sus localidades típicas y ninguna de ellas son parte del Sistema Nacional de Áreas Protegidas en el Ecuador. Por lo tanto, actividades enfocadas en la conservación de extensiones boscosas entre los 200 a 600 metros de elevación, son imperantes para disminuir el riesgo de extinción de las especies endémicas en la región.
Agradecimientos
A la Secretaría Nacional de Educación Superior, Ciencia, Tecnología e Innovación del Ecuador SENESCYT quién financió la investigación de campo de INABIO a través del proyecto: “Efectos de la Aspersión del Glifosato sobre la biodiversidad en la frontera norte de Ecuador” (PIC-08-0000478), de igual forma a Fundación de Conservación Jocotoco, quien financió el levantamiento de información en la Reserva Biológica Canandé durante los años 2004 y 2012. MYM agradece la colaboración de Marco M. Reyes-Puig, Juan P. Reyes-Puig, Paúl A. Meza-Ramos, Abraham Loaiza, Galo Velez, Luis Oyagata, Manuel Morales y Karem López, durante la visita a los sitios de estudio. El trabajo de MYM y CRP es parte del programa de investigación Red Terrarana Ecuador, auspiciado por Diego Inclan y Francisco Prieto de INABIO. MYM agradece al Ministerio de Ambiente de Ecuador por los permisos de investigación N°018-IC-FAU-DNBAP/MA y el convenio marco de acceso a recursos genéticos Nº MAE-DNB-CM-2019-0120. El trabajo de campo y laboratorio de SRR y JO fue financiado por la Secretaría Nacional de Educación Superior, Ciencia, Tecnología e Innovación del Ecuador SENESCYT (Arca de Noé initiative; investigadores principales SRR y Omar Torres y un proyecto de la Pontificia Universidad Católica del Ecuador, Dirección General Académica. John D. Lynch y Raúl Sedano brindaron las mejores condiciones durante la visita de MYM a las colecciones del Instituto de Ciencias Naturales (ICN) de la Universidad de Colombia y la Colección Herpetológica de la Universidad del Valle del Cauca (UVC). La visita a las colecciones en Colombia de MYM fue posible gracias a la Fundación EcoMinga y El Jardín Botánico de Basell, a través de Javier Robayo, Lou Jost, Juan P. Reyes-Puig y Heinz Schneider.La publicación de este artículo fue financiada por la Universidad San Francisco de Quito USFQ, fondo para publicación de Investigaciones (HUBI ID: 12268). CRP agradece asiduamente a Gorki Ríos-Alvear por su particular paciencia y apoyo con el desarrollo y publicación de este manuscrito. MYM hace un reconocimiento especial a Alejandra Figueroa, Mauro, Joaquín y Julieta Yánez por el continuo apoyo y paciencia tras las largas ausencias.
Apéndice 1. Material de Pristimantis examinado.
Pristimantis crenunguis (n = 6): Pichincha: Pachijal, Las Tolas, 1,200-1,600 m, DHMECN 4345, 4346, 4348, 4349, 5791, 5794. Pristimantis labiosus (n = 5): Pichincha: Puerto Quito, 291 m, DHMECN 2606; Pichincha: Bosque Protector Mashpi, 800- 1,200 m,
DHMECN 7143, 7166, 7169; Pichincha: Pedro Vicente Maldonado, 1,100 m, DHMECN 8599. Pristimantis latidiscus (n = 30): Esmeraldas: Reserva Biológica Canandé, 660-671 m, DHMECN 2797, 2807, 2810, 2811; Esmeraldas: Santa Rita, 824, DHMECN 3258; Esmeraldas, Alto Tambo, 899, DHMECN 3301; Esmeraldas, Reserva Biológica Bilsa, 550 m, DHMECN 3639- 3658; Carchi: Tobar Donoso, 88-243 m, DHMECN 6548, 6552, 6558, 6559, 6560, 6563-6565, 6652, 6653, 6665, 6667-6669, 6679, 8025, 8026, 8026, 8929, 8031, 8040, 8041. Pristimantis rubicundus (n = 4): Tungurahua: Reserva Río Zuñag, 1,269 m, DHMECN 5199, 5200, 5251; Tungurahua, El Topo, 1,300 m, DHMECN 10435. Pristimantis lanthanites (n = 18): Sucumbíos: Santa Elena, 304 m, DHMECN 7861- 7872; Francisco de Orellana, Joya de los Sachas, 276m, 5058- 6865. Pristimantis w-nigrum (n = 11): Pichincha: Estación Experimental “La Favorita”, 1,800 m, 1448- 1458. Pristimantis tenebrionis (n = 1): Pichincha, Bosque Protector Mashpi, 800- 1,267 m,
DHMECN 7181. Pristimantis muricatus (n = 1): Esmeraldas, Reserva Biológica Bilsa, 552 m, DHMECN 3652.
Apéndice 2. Sumario de caracteres utilizados para las comparaciones morfológicas de las nuevas especies con las especies más similares del grupo de especies de P. rubicundus del subgénero Hypodyction. La información de caracteres ha sido extraída de Lynch (1975, 1976, 1979), Lynch y Burrowes (1990), Lynch y Miyata (1980), Lynch et al. (1994), Jiménez-de la Espada (1875), Boettger (1892).
| Apéndice 2
Continuación |
|||||
| Especie | Pliegue interocular | Pliegue discoidal | Tímpano | Hocico en vista dorsal | Hocico en vista de perfil |
| P. actites | Ausente | Presente | Prominente | Acuminado | Redondeado |
| P. afrox sp. nov. | Presente | Presente | Presente | Subacuminado | Redondeado |
| P. chocoensis sp. nov. | Presente | Presente | Presente | Subacuminado | Redondeado |
| P. crenunguis | Ausente | Presente | Prominente | Subacuminado | Redondeado |
| P. labiosus | Ausente | Presente | Prominente | Subovoideo | Redondeado |
| P. lanthanites | Ausente | Presente | Prominente | Acuminada | Redondeado |
| P. ocellatus | Ausente | Presente | Prominente | Subacuminado | Redondeado |
| P. rubicundus | Presente | Presente | Prominente | Subacuminado | Redondeado |
| P. tenebrionis | Ausente | Presente | Presente | Redondeado | Truncado |
| P. w-nigrum | Ausente | Presente | Prominente | Acuminado | Redondeado |
| Especie | Tubérculos en el párpado | Cresta craneal | Procesos dentígeros del vómer | Hendiduras
vocales |
Almohadillas nupciales |
| P. actites | Ausentes | Ausente | Triangulares | Presentes | Presentes |
| P. afrox sp. nov. | Presentes, 1 cónico rodeado de varios pequeños | Presente, baja en hembras | Triangulares | Presentes | Ausentes |
| P. chocoensis sp. nov. | Presentes, subcónicos pequeños | Presente, baja | Triangulares | Presentes | Ausentes |
| P. crenunguis | Ausentes | Presentes, bajas | Triangulares | Presentes | Ausentes |
| P. labiosus | Un tubérculo cónico | Presentes, bajas en hembras; ausentes en machos | Triangulares | Presentes | Ausentes |
| P. lanthanites | Ausentes | Ausentes | Prominentes, oblicuos a subtriangulares | Presentes | Ausentes |
| P. ocellatus | Ausentes | Ausentes | Triangulares | No se conoce | No se conoce |
| P. rubicundus | Ausentes | Ausentes | Prominentes, triangulares | Ausentes | Ausentes |
| P. tenebrionis | Presente, un tubérculo pequeño cónico | Presentes, bajas en hembras; ausentes en machos | Triangulares | Presentes | Ausentes |
| P. w-nigrum | Ausentes | Ausentes | Triangulares | Presentes | Presentes |
| Especie | Dedo I de la mano | Forma de los discos | Rebordes cutáneos laterales de la mano | Tubérculos ulnares | |
| P. actites | I>II | Truncados (anchos) | Presentes | Ausentes | |
| P. afrox sp. nov. | I<II | Anchos emarginados | Ausentes | Ausentes | |
| P. chocoensis sp. nov. | I<ó=II | Anchos, dilatados | Presentes | Presentes | |
| P. crenunguis | I>II | Emarginados | Ausentes | Ausentes | |
| P. labiosus | I<II | Emarginados | Ausentes | Ausentes | |
| P. lanthanites | I>II | Truncados | Ausentes | Ausentes | |
| P. ocellatus | I<II | Truncados | Presentes | Presentes, pequeños | |
| P. rubicundus | I>II | Truncados, expandidos | Ausentes | Presentes, pequeños y subcónicos | |
| P. tenebrionis | I<II | Truncados (anchos) | Ausentes | Ausentes | |
| P. w-nigrum | I>II | Truncados, del doble de ancho de los dígitos | Presentes | Ausentes | |
| Especie | Tubérculos en el talón | Tubérculos en el borde externo del tarso | Pliegue metatarsal interno | ||
| P. actites | Presentes, pequeños | Ausentes | Presente, delgado | ||
| P. afrox sp. nov. | Tubérculo pequeño, cónico | Uno o 2 tubérculos aplanados | Ausente | ||
| P. chocoensis sp. nov. | Tubérculo pequeño, subcónico | Tres tubérculos subcónicos | Presente | ||
| P. crenunguis | Presentes, pequeños y cónicos | Presentes, pequeños cónicos | Ausente | ||
| P. labiosus | Tubérculo pequeño, cónico | Presentes, pequeños en hilera | Ausente | ||
| P. lanthanites | Tubérculo cónico | Presentes, indistintos | Ausente | ||
| P. ocellatus | Presentes, pequeños | Presentes, pequeños | Presente, pequeño | ||
| P. rubicundus | Tubérculo cónico elongado | Presentes, cónicos | Ausente | ||
| P. tenebrionis | Presentes, pequeños | Ausentes | Ausente | ||
| P. w-nigrum | Presente, uno diminuto | Ausentes | Presente, bajo | ||
| Especie | Tubérculo metatarsal interno | Tubérculos metatarsal externo | Tubérculos supernumerarios | Rebordes cutáneos laterales del pie | |
| P. actites | Elongado 4- 6X | Subcónico | Presentes, sólo en la base de los dedos | Presentes | |
| P. afrox sp. nov. | Oval 4X | Ovoide | Ausentes | Ausentes | |
| P. chocoensis sp. nov. | Oval 5X | Triangular | Ausentes | Presentes | |
| P. crenunguis | Elongado 4- 6X | Redondo | Presentes | Ausentes | |
| P. labiosus | Oval 4X | Redondo | Presentes, sólo en las bases de los dedos | Presentes, quillas | |
| P. lanthanites | Elongado 5-6X | Cónico | Presentes | Ausentes | |
| P. ocellatus | Elongado 4X | Redondo | Presentes en las bases de los dedos II-V | Ausentes | |
| P. rubicundus | Elongado 4X | Subcónico | Presentes | Presentes | |
| P. tenebrionis | Oval 4X | Plano | Presentes sólo en la base de los pies | Ausentes | |
| P. w-nigrum | Elongado 10X | Redondo | Presentes | Presentes | |
| Especie | Condición del dedo V del pie | Membranas interdigitales | Coloración | Tamaños | |
| Hembra | Macho | ||||
| P. actites | B | Ausentes | Dorso gris con marcas oscuras, vientre crema con puntos grises, superficies posteriores de los músculos con flecos negros | 48.2-64.2 | 30.00-40.00 |
| P. afrox sp. nov. | B | Ausentes | Dorsalmente café rojizo en preservado (café oscuro en vida), pliegue escapular en forma de × crema en preservado (café escarlata en vida); extremidades delanteras con bandas transversales color crema; superficie ventral crema débilmente punteada de negro; ingles y superficies ocultas de los muslos rojizos; iris gris claro con finas reticulaciones negras, con línea media horizontal gris oscuro | 32.25- 45.75 | 21.75-34 |
| P. chocoensis sp. nov. | B | Ausentes | Dorso desde homogéneamente café oscuro a café grisáceo, con marcas occipitales medio dorsales; manchas conspicuas negras en la parte posterior a la inserción del brazo; vientre pecho y garganta crema inmaculado; superficies posteriores de los muslos homogéneamente café | 31.28-51.9 | 22.21-47.25 |
| P. crenunguis | B | Ausentes | Dorso gris con marcas cafés, vientre crema salpicado con marcas cafés; superficies posteriores de los muslos negros con flecos crema | 59.1-64.5 | 35.2-49.2 |
| P. labiosus | B | Ausentes | Dorso café con marcas oscuras, vientre crema con flecos cafés, superficies posteriores de los muslos cafés con flecos cremas | 48.5-52.3 | 35.4-50.8 |
| P. lanthanites | B | Ausentes | Dorso café con marcas café oscuras; superficies posteriores de los muslos café uniforme; garganta densamente salpicada de café; franja media blanca | 38.7-45.4 | 23.9-27.9 |
| P. ocellatus | B | Ausentes | Dorso café con puntos negros y centro pálido, vientre crema moteado con café, superficies posteriores de los muslos café oscuro | 45.7 | |
| P. rubicundus | B | Ausentes | Dorso café con manchas café oscuras; vientre crema moteado con café; muslos posteriores cafés con flecos crema | 46.5-52.2 | 32.0-35.6 |
| P. tenebrionis | B | Ausentes | Dorso café, vientre crema con reticulaciones cafés, superficies posteriores de los muslos café con pequeños flecos crema | 30.6-36.9 | 20.8-26.8 |
| P. w-nigrum | B | Ausentes | Dorso café pálido con marcas café o negras, vientre blanco a crema, puntos negros; superficies ocultas de los muslos negras con puntos blancos | 43.2-71.5 | 25.0-46.1 |
Apéndice 3. Sumario de caracteres utilizados para las comparaciones morfológicas de la nueva especie con las especies morfológicamente similares del grupo de especies de P. ridens del subgénero Hypodictyon. La información de caracteres ha sido extraída de la siguiente literatura: Boulenger (1896, 1898), Flores (1988), Lynch y Burrowes (1990), Lynch y Duellman (1997, 1980), Peters (1873).
| Apéndice 3
Continuación |
|||||
| Especie | Pliegue interocular | Pliegue discoidal | Tímpano | Hocico en vista dorsal | Hocico en vista de perfil |
| P. cisnerosi sp. nov | Ausente | Presente | Presente | Subacuminado | Redondeado |
| P. colomai | Ausente | Prominente | Prominente | Subacuminado | Sobresaliente |
| P. cremnobates | Ausente | Prominente | Presente | Subacuminado | Redondeado |
| P. cruentus | No se presenta información en la descripción | No se presenta información en la descripción | Presente, pequeño | No se presenta información en la descripción | Redondeado |
| P. erythropleura | No se presenta información en la descripción | Presente | Presente | Subacuminado | Redondeado |
| P. laticlavius | Ausente | Presente | Prominente | Redondeado | Redondeado |
| P. latidiscus | Ausente | Prominente | Prominente | Subacuminado a redondeado | Redondeado |
| P. rosadoi | Ausente | Prominente | Prominente | Subacuminado | Redondeado |
| Especie | Tubérculos en el párpado | Cresta craneal | Procesos dentígeros del vómer | Hendiduras
vocales |
Almohadillas nupciales |
| P. cisnerosi sp. nov | Presente, 1 cónico | Presente, baja | Masivos, triangulares | Presentes | Ausentes |
| P. colomai | Ausentes | Ausente | Prominentes, ovales | Presentes | Presentes |
| P. cremnobates | Ausentes | Ausente | Prominentes, triangulares | Ausentes | Ausentes |
| P. cruentus | No se presenta información en la descripción | No se presenta información en la descripción | Presentes | Ausentes | No se presenta información en la descripción |
| P. erythropleura | Presente subcónico | Ausente | Prominentes, ovales | Ausentes | Presentes |
| P. laticlavius | Presente, 1 pequeño | Ausente | Triangulares | Ausentes | Ausentes |
| P. latidiscus | Presente, 1 subcónico | Ausente | Triangulares | Ausentes | Presentes |
| P. rosadoi | Presentes, 1 o 2 cónicos | Ausente | Ovales | Ausentes | Presentes |
| Especie | Dedo I de la mano | Forma de los discos | Rebordes cutáneos laterales de la mano | Tubérculos ulnares | |
| P. cisnerosi sp. nov | I<II | Anchos, expandidos | Presentes, finos | Ausentes | |
| P. colomai | I<II | Anchos, redondeados | Ausentes | Presentes, bajos | |
| P. cremnobates | I<II | Anchos | Presentes | Ausentes | |
| P. cruentus | I<II | Anchos, expandidos | No se presenta información en la descripción | No se presenta información en la descripción | |
| P. erythropleura | I<II | Anchos | Presentes, quillas | Presentes diminutos | |
| P. laticlavius | I<II | Anchos | Presentes, quillas | Ausentes | |
| P. latidiscus | I<II | Anchos | Presentes | Ausentes | |
| P. rosadoi | I<II | Anchos, redondeados | Presentes | Presentes (no cónicos) | |
| Especie | Tubérculos en el talón | Tubérculos en el borde externo del tarso | Pliegue metatarsal interno | ||
| P. cisnerosi sp. nov | Presente, pequeño, cónico | Presentes | Presente | ||
| P. colomai | Presente, un calcar corto | Presentes, indistintos | Presente | ||
| P. cremnobates | Presentes (no cónico) | Presentes (no cónico) | Ausente | ||
| P. cruentus | No se presenta información en la descripción | No se presenta información en la descripción | Presente | ||
| P. erythropleura | Presentes, subcónicos | Ausentes | Presente, pequeño | ||
| P. laticlavius | Presente, cónico pequeño | Presentes, pequeños | Tubérculo pequeño como pliegue | ||
| P. latidiscus | Presente, 1 pequeño | Presentes, pequeños | Tubérculo pequeño como pliegue | ||
| P. rosadoi | Presente, pequeños | Presentes, pequeños | Ausente | ||
| Especie | Tubérculo metatarsal interno | Tubérculos metatarsal externo | Tubérculos supernumerarios | Rebordes cutáneos laterales del pie | |
| P. cisnerosi sp. nov | Oval -6X | Subcónico | Presentes, indistintos | Presentes | |
| P. colomai | Oval 2.5-4X | Redondo | Ausentes | Presentes | |
| P. cremnobates | Elongado 4-6X | Oval | Presentes | Presentes | |
| P. cruentus | Presente – | Ausente | Ausentes | No se presenta información en la descripción | |
| P. erythropleura | Oval 6X | No se presenta información en la descripción | Presentes | Presentes, quillas | |
| P. laticlavius | Oval 6X | Elongado | Presentes, bajos | Presentes | |
| P. latidiscus | Oval 4X | Redondo | Presentes, plantares | Presentes | |
| P. rosadoi | Oval 4X | Redondo | Presentes, bajos | Presentes | |
| Especie | Condición del dedo V del pie | Membranas interdigitales | Coloración | Tamaños | |
| Hembra | Macho | ||||
| P. cisnerosi sp. nov | C | Ausentes | Dorso desde homogéneamente café oscuro a café grisáceo salpicado de manchas café; vientre homogéneamente café escarlata a café escarlata con manchas crema; superficies anteriores de los muslos y piernas densamente salpicado de crema; con barras diagonales suboculares café oscuro finamente delineadas con crema; superficies anteriores de las extremidades con barras café oscuro | 32.1- 49.1 | 25.1-4 |
| P. colomai | C | Ausentes | Dorso bronce con puntos oscuros en el sacro y en la región suprainguinal; cabeza y flancos café oscuro con franjas blancas; vientre crema con flecos cafés | – | 16.5-17.8 |
| P. cremnobates | No se presenta información en la descripción | Ausentes | Dorso café jaspeado café oscuro; vientre gris pálido a crema con marcas café como chevron a través del pecho; garganta amarillenta con puntos esparcidos cafés | 41.6-51.7 | 28.4-32.5 |
| P. cruentus | No se presenta información en la descripción | Basales | Dorso café chocolate con manchas negras, piernas con bandas negras; vientre y garganta crema con reticulaciones negras, con 2 bandas oscuras suboculares | – | – |
| P. erythropleura | No se presenta información en la descripción | Basales | Dorso grisáceo, superficies laterales de la cabeza y cuerpo más oscuras; 3 bandas oscuras a través del dorso; 3 barras oscuras delineadas de crema en el labio superior; garganta y vientre blancuzco con flecos grises; lados del vientre, muslos y superficies inferiores de la tibia rojizos | 20.8-25.1 | 17.0-210 |
| P. laticlavius | C | Ausentes | Dorso café con franjas dorsolaterales pálidas u oscuras y flancos cafés; vientre crema moteado de café; superficies posteriores de los muslos café con puntos blancos | 35.0-42.9 | 22.5-26.3 |
| P. latidiscus | C | Ausentes | Patrón dorsal polimórfico, usualmente con líneas blancas alrededor de los bordes de una marca escapular en W; vientre crema con manchas cafés; superficies posteriores de los muslos café con puntos crema | 35.2-53.4 | 21.9-25.9 |
| P. rosadoi | C | Ausentes | Dorso café con marcas café oscuras, con una mancha postaxilar; vientre crema con flecos cafés formando puntos y/o reticulaciones; superficies posteriores de los muslos crema moteado de café | 16.5-16.7 | 23.4-25.7 |
Referencias
Arteaga, A., Pyron, A., Peñafiel, N., Romero-Barreto, P., Culebras, J., Bustamante, L. et al. (2016). Comparative phylogeography reveals cryptic diversity and repeated patterns of cladogenesis for amphibians and reptiles in Northwestern Ecuador. Plos One, 11, e0151746. https://doi.org/10.1371/journal.pone.0151746
Barbour, T. (1928). New Central American frogs. Proceedings of the New England Zoölogical Club. Cambridge, Massachusetts, 10, 25–31.
Barrio-Amorós, C. L., Guayasamin, J. M. y Hedges, S. B. (2012). A new minute Andean Pristimantis (Anura: Strabomantidae) from Venezuela. Phyllomedusa, 11, 83–93. https://doi.org/10.11606/issn.2316-9079.v11i2p83-93
Boettger, O. (1892). Katalog der Batrachier-Sammlung im Museum der Senckenbergischen Naturforschenden Gesellshaft in Frankfurt am Main. Frankfurt: Gebrüder Knauer.
Boulenger, G. A. (1896). Descriptions of new reptiles and batrachians from Colombia. Annals and Magazine of Natural History, Series 6, 17, 16–21.
Boulenger, G. A. (1898). An account of the reptiles and batrachians collected by Mr. W. F. H. Rosenberg in Western Ecuador. Proceedings of the Zoological Society of London, 1898, 107–126.
Boulenger, G. A. (1908). Descriptions of new batrachians and reptiles discovered by Mr. M.G. Palmer in south-western Colombia. Annals and Magazine of Natural History, Series 8, 2, 515–522.
Brito, J., Almendáriz, A., Batallas, D. y Ron, S. R. (2017). Nueva especie de rana bromelícola del género Pristimantis (Amphibia: Craugastoridae), meseta de la cordillera del Cóndor, Ecuador. Papeis Avulsos de Zoologia, São Paulo, 57, 177–195. http://dx.doi.org/10.11606/0031-1049.2017.57.15
Brito, J. y Pozo-Zamora, G. (2013). Una nueva especie de rana terrestre del género Pristimantis (Amphibia: Craugastoridae), de la Cordillera de Kutukú, Ecuador. Papéis Avulsos de Zoologia, São Paulo, 53, 315–325. http://dx.doi.org/10.1590/S0031-10492013002400001
Canedo, C. y Haddad, C. F. (2012). Phylogenetic relationships within anuran clade Terrarana, with emphasis on the placement of Brazilian Atlantic rainforest frogs genus Ischnocnema (Anura: Brachycephalidae). Molecular Phylogenetics and Evolution, 65, 610–620. https://doi.org/10.1016/j.ympev.2012.07.016
Cope, E. D. (1866). Fourth contribution to the herpetology of tropical America. Proceedings of the Academy of Natural Sciences of Philadelphia, 18, 123–132.
Cope, E. D. (1875). On the Batrachia and Reptilia of Costa Rica. Journal of the Academy of Natural Sciences of Philadelphia, Series 2, 8, 93–154.
Cope, E. D. (1885) A contribution to the herpetology of Mexico. Proceedings of the American Philosophical Society, 22, 380–404.
Crawford, A. J., Cruz, C., Griffith, E., Ross, H., Ibáñez, R., Lips, K. R. et al. (2013). DNA barcoding applied to ex situ tropical amphibian conservation programme reveals cryptic diversity in captive populations. Molecular Ecology Resources, 13, 1005–18. https://doi.org/10.1111/1755-0998.12054
Crawford, A. J., Ryan, M. J. y Jaramillo, C. A. (2010). A new species of Pristimantis (Anura: Strabomantidae) from the Pacific coast of the Darien Province, Panama, with a molecular analysis of its phylogenetic position. Herpetologica, 66, 192–206. https://doi.org/10.1655/09-018R1.1
Darst, C. R. y Cannatella, D. C. (2004). Novel relationships among hyloid frogs inferred from 12S and 16S mitochondrial DNA sequences. Molecular Phylogenetics and Evolution, 31, 462–475. https://doi.org/10.1016/j.ympev.2003.09.003
Duellman, W. y Lehr, E. (2009). Terrestrial breeding frogs (Strabomantidae) in Peru. Alemania: NTV Science.
Echeverry, D. y Harper, G. J. (2009). Fragmentación y deforestación como indicadores del estado de los ecosistemas en el Corredor de Conservación Choco-Manabí (Colombia-Ecuador). Recursos Naturales y Ambiente, 58, 78–88.
Firkowski, C. R., Bornschein, M. R., Ribeiro, L. F. y Pie, M. R. (2016). Species delimitation, phylogeny and evolutionary demography of co-distributed, montane frogs in the southern Brazilian Atlantic Forest. Molecular Phylogenetics and Evolution, 100, 345–360. https://doi.org/10.1016/j.ympev.2016.04.023
Flores, G. (1988). Two new species of Ecuadorian Eleutherodactylus (Leptodactylidae) of the E. crucifer assembly. Journal of Herpetology, 22, 34–41.
Frost, D. R. (2019). Amphibian species of the world: an online reference. Version 6.0. Disponible en: http://research.amnh.org/herpetology/amphibia/index.html American Museum of Natural History, New York, USA. Último acceso: 18 de diciembre del 2017.
García, J. C., Crawford, A. J., Mendoza, Á. M., Ospina, O., Cardenas, H. y Castro, F. (2012). Comparative phylogeography of direct-developing frogs (Anura: Craugastoridae: Pristimantis) in the southern Andes of Colombia. Plos One, 7, e46077. https://doi.org/10.1371/journal.pone.0046077
García y Lynch, J. D. (2006). A new species of frog (genus Eleutherodactylus) from a cloud forest in western Colombia. Zootaxa, 1171, 39–45. http://dx.doi.org/10.11646/zootaxa.1171.1.4
García, J. C., Mendoza, Á. M., Ospina, O., Cardenas, H. y Castro, F. (2014). A morphometric and molecular approach to define three closely related species of frogs of the Genus Pristimantis (Anura: Craugastoridae) from the Cordillera Occidental in Colombia. Journal of Herpetology, 48, 220–227. https://doi.org/10.1670/12-091
Guayasamin, J. M. (2004). A new species of Eleutherodactylus (Anura: Leptodactylidae) from the northwestern lowlands of Ecuador. Herpetologica, 60, 103–116. https://doi.org/10.1655/02-106
Hammer, Ø., Harper, D. A. T. y Ryan, P. D. (2008). PAST-palaeontological statistics, ver. 1.89. Paleontological Museum, University of Oslo, Noruega. Disponible en: http://folk. uio. no/ohammer/past/index. html).
Hedges, S. B., Duellman, W. E. y Heinicke, M. P. (2008). New World direct-developing frogs (Anura: Terrarana): molecular phylogeny, classification, biogeography, and conservation. Zootaxa, 1737, 1–182. http://dx.doi.org/10.11646/zootaxa.1737.1.1
Heinicke, M. P., Duellman, W. E. y Hedges, S. B. (2007). Major Caribbean and Central American frog faunas originated by ancient oceanic dispersal. Proceedings of the National Academy of Sciences of the United States of America, 104, 10092–10097. https://doi.org/10.1073/pnas.0611051104
Heinicke, M. P., Duellman, W. E., Trueb, L., Means, D. B., MacCulloch, R. D. y Hedges, S. B. (2009). A new frog family (Anura: Terrarana) from South America and an expanded direct-eeveloping clade revealed by molecular phylogeny. Zootaxa, 2211, 1–35. http://dx.doi.org/10.11646/zootaxa.2211.1.1
Heinicke, M. P., Lemmon, A. R., Lemmon, E. M., McGrath, K. y Hedges, S. B. (2017). Phylogenomic support for evolutionary relationships of New World direct-developing frogs (Anura: Terraranae). Molecular Phylogenetics and Evolution, 118, 145–155. https://doi.org/10.1016/j.ympev.2017.09.021
Ibáñez, D., Jaramillo, C. A. y Arosemena, F. A. (1994). A new species of Eleutherodactylus (Anura: Leptodactylidae) from Panamá. Amphibia-Reptilia, 15, 337–341. https://doi.org/10.1163/156853894X00371
Jiménez-de la Espada, M. (1875). Vertebrados del Viaje al Pacífico Verificado de 1862 a 1865 por una Comisión de Naturalistas Enviada por el Gobierno Español. Madrid: Batracios.
Katoh, K., Kuma, K., Toh, H y Miyata, T. (2005). MAFFT version 5: improvement in accuracy of multiple sequence alignment. Nucleic Acids Research, 33, 511–518.
Katoh, K., Misawa, K., Kuma, K. I. y Miyata, T. (2002). MAFFT: a novel method for rapid multiple sequence alignment based on fast Fourier transform. Nucleic Acids Research, 30, 3059–3066.
Katoh, K. y Stanley, D. M. (2013). MAFFT multiple sequence alignment software version 7: improvements in performance and usability. Molecular Biology and Evolution, 30, 772–780. https://doi.org/10.1093/molbev/mst010
Lanfear, R., Calcott, B., Ho, S. Y. y Guindon, S. (2012). PartitionFinder: combined selection of partitioning schemes and substitution models for phylogenetic analyses. Molecular Biology and Evolution, 29, 1695–1701. https://doi.org/10.1093/molbev/mss020
Lehr, E. (2007). New eleutherodactyline frogs (Leptodactylidae: Pristimantis, Phrynopus) from Peru. Bulletin of the Museum of Comparative Zoology, Cambridge, Massachusetts, 159, 145–178.
Lynch, J. D. (1968). Two new frogs of the genus Eleutherodactylus from eastern Ecuador (Amphibia: Leptodactylidae). Journal of Herpetology, 2, 129–135.
Lynch, J. D. (1975). The identity of the frog Eleutherodactylus conspicillatus (Günther), with descriptions of two related species from northwestern South America (Amphibia, Leptodactylidae). Contributions in Science. Natural History Museum of Los Angeles County, 272, 1–19.
Lynch, J. D. (1976). New species of frogs (Leptodactylidae: Eleutherodactylus) from the Pacific Versant of Ecuador. Occasional Papers of the Museum of Natural History, The University of Kansas, Lawrence, Kansas, 55, 1–33.
Lynch, J. D. (1979). A new frog species of the Eleutherodactylus fitzingeri group from the Pacific Andean versant in Ecuador. Herpetologica, 35, 228–233.
Lynch, J. D. (1994). A new species of frog (genus Eleutherodactylus: Leptodactylidae) from a cloud forest in Departamento de Santander, Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 19, 205–208.
Lynch, J. D. (1998). New species of Eleutherodactylus from the Cordillera Occidental of western Colombia with a synopsis of the distributions of species in western Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 22, 117–148.
Lynch, J. D. (1999). Lista anotada y clave para las ranas (género Eleutherodactylus) chocoanas del Valle del Cauca, y apuntes sobre las especies de la Cordillera Occidental adyacente. Caldasia, 21, 184–202.
Lynch, J. D. (2003). New species of frogs (Eleutherodactylus: Leptodactylidae) from the Cordillera Oriental of Norte de Santander and Santander, Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 27, 449–460.
Lynch, J. D. y Ardila-Robayo, M. C. (1999). The Eleutherodactylus of the taeniatus complex in western Colombia: taxonomy and distribution. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 23, 615–624
Lynch, J. D. y Burrowes, P. A. (1990). The frogs of the genus Eleutherodactylus (family Leptodactylidae) at the La Planada Reserve in southwestern Colombia with descriptions of eight new species. Occasional Papers of the Museum of Natural History, University of Kansas, 136, 1–31.
Lynch, J. D. y Duellman, W. E. (1997). Frogs of the genus Eleutherodactylus (Leptodactylidae) in western Ecuador: systematics, ecology, and biogeography. Special publication 23. University of Kansas, Museum of Natural History.
Lynch, J. D. y Duellman, W. E. (1980). The Eleutherodactylus of the Amazonian slopes of the Ecuadorian Andes (Anura: Leptodactylidae). Miscellaneous Publication. Museum of Natural History, University of Kansas, 69, 1–86.
Lynch, J. D. y Miyata, K. (1980). Two new species of Eleutherodactylus (Amphibia: Leptodactylidae) from the lowlands and lower cloud forests of western Ecuador. Breviora. Museum of Comparative Zoology, Cambridge, Massachusetts, 457, 1–12.
Lynch, J. D., Ruiz-Carranza, P. M. y Miyamoto, J. (1994). The identities of the colombian frogs confused with Eleutherodactylus latidiscus (Boulenger) (Amphibia: Anura, Leptodactylidae). Occasional Papers of the Museum of Natural History, The University of Kansas, Lawrence, Kansas, 170, 1–42.
Lynch, J. D. y Suárez-Mayorga, Á. M. (2000). A new frog (Eleutherodactylus: Leptodactylidae) from the southern part of the Cordillera Oriental of Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 24, 289–293.
Maddison, W. P. y Maddison, D. R. (2009). Mesquite: a modular system for evolutionary analysis. Version 2.72. http://mesquiteproject.org.
MAE (Ministerio del Ambiente del Ecuador). (2013). Sistema de clasificación de los ecosistemas del Ecuador continental. Quito: Subsecretaría de Patrimonio Natural.
MECN (Museo Ecuatoriano de Ciencias Naturales). (2010). Serie Herpetofauna del Ecuador: El Chocó Esmeraldeño. Monografía 5. Quito: Museo Ecuatoriano de Ciencias Naturales. http://doi.org/10.13140/2.1.3554.8480
Monteiro, J. P. D. C., Condez, T. H., García, P. C. D. A., Comitti, E. J., Amaral, I. B. y Haddad, C. F. B. (2018). A new species of Brachycephalus (Anura, Brachycephalidae) from the coast of Santa Catarina State, southern Atlantic Forest, Brazil. Zootaxa, 4407, 483–505. http://dx.doi.org/10.11646/zootaxa.4407.4.2
Morales-Mite, M., Yánez-Muñoz, M. H., Meza-Ramos, P. y Reyes-Puig, M. (2013). Herpetofauna en las reservas de la Fundación Jocotoco: Reserva Biológica Canandé. En MECN (Eds.), Herpetofauna en Áreas Prioritarias para la Conservación: el sistema de reservas Jocotoco y Ecominga. Monografía 6 (pp. 1–408). Serie de Publicaciones del Museo Ecuatoriano de Ciencias Naturales (MECN). Quito: Fundación para la Conservación Jocotoco, Fundación Ecominga.
Nguyen, L. T., Schmidt, H. A., von Haeseler, A. y Minh, B. Q. (2014). IQ-TREE: a fast and effective stochastic algorithm for estimating maximum-likelihood phylogenies. Molecular Biology and Evolution, 32, 268–275. https://doi.org/10.1093/molbev/msu300
Ortega-Andrade, H. M. y Venegas, P. J. (2014). A new synonym for Pristimantis luscombei (Duellman and Mendelson 1995) and the description of a new species of Pristimantis from the upper Amazon basin (Amphibia: Craugastoridae). Zootaxa, 3895, 31–57. http://dx.doi.org/10.11646/zootaxa.3895.1.2
Padial, J. M., Chaparro, J. C., Castroviejo-Fisher, S., Guayasamin, J. M., Lehr, E., Delgado, A. J. et al. (2012). A revision of species diversity in the Neotropical genus Oreobates (Anura: Strabomantidae), with the description of three new species from the Amazonian slopes of the Andes. American Museum Novitates, 3752, 1–55.
Padial, J. M., Grant, T. y Frost, D. R. (2014). Molecular systematics of terraranas (Anura: Brachycephaloidea) with an assessment of the effects of alignment and optimality criteria. Zootaxa, 3825, 1–132. http://dx.doi.org/10.11646/zootaxa.3825.1.1
Páez, N. B. y Ron, S. R. (2019). Systematics of Huicundomantis, a new subgenus of Pristimantis (Anura, Strabomantidae) with extraordinary cryptic diversity and eleven new species. Zookeys, 868, 1–112. https://doi.org/10.3897/zookeys.868.26766
Paz, A., Ibáñez, R., Lips, K. R. y Crawford, A. J. (2015). Testing the role of ecology and life history in structuring genetic variation across a landscape: a trait-based phylogeographic approach. Molecular Ecology, 24, 3723–3737. https://doi.org/10.1111/mec.13275
Peters, W. C. H. (1873). Über eine neue Schildrötenart, Cinosternon Effeldtii und einige andere neue oder weniger bekannte Amphibien. Monatsberichte der Königlichen Preussische Akademie des Wissenschaften zu Berlink, 1873, 603–618.
Pinto-Sánchez, N. R., Ibáñez, R., Madriñán, S., Sanjur, O. I., Bermingham, E. y Crawford, A. J. (2012). The Great American Biotic Interchange in frogs: multiple and early colonization of Central America by the South American genus Pristimantis (Anura: Craugastoridae). Molecular Phylogenetics and Evolution, 62, 954–72. https://doi.org/10.1016/j.ympev.2011.11.022
Pyron, R. A. y Wiens, J. J. (2011). A large-scale phylogeny of Amphibia including over 2800 species, and a revised classification of extant frogs, salamanders, and caecilians. Molecular Phylogenetics and Evolution, 61, 543–583. https://doi.org/10.1016/j.ympev.2011.06.012
Ron, S. R., Merino-Viteri, A. y Ortiz, D. A. (2019). Anfibios del Ecuador. Version 2019.0. Museo de Zoología, Pontificia Universidad Católica del Ecuador. https://bioweb.bio/faunaweb/amphibiaweb, fecha de acceso 3 de enero, 2019.
Rueda-Almonacid, J. V. y Lynch, J. D. (1983). Una nueva especie de Eleutherodactylus (Amphibia: Leptodactylidae) para la Cordillera Oriental de Colombia. Lozania, 42, 1–6.
Ryan, M. J., Lips, K. R. y Giermakowski, J. T. (2010). New species of Pristimantis (Anura: Terrarana: Strabomantinae) from Lower Central America. Journal of Herpetology, 44, 193–200. https://doi.org/10.1670/08-280.1
Savage, J. M. (1965). A new bromeliad frog of the genus Eleutherodactylus from Costa Rica. Bulletin of the Southern California Academy of Sciences, 64, 106–110.
SIAC (Sistema de información ambiental de Colombia). (2019). Sistema de Información ambiental de Colombia. Consultado el 14 mayo 2019; http://www.siac.gov.co/
Sierra, R. (2013). Patrones y factores de deforestación en el Ecuador continental, 1990–2010. Y un acercamiento a los próximos 10 años. Quito: Conservación Internacional Ecuador y Forest Trends.
SPSS Inc. Released (2008). SPSS statistics for Windows, version 17.0. Chicago.
Waddell, E. H., Crotti, M., Lougheed, S. C., Cannatella, D. C. y Elmer, K. R. (2018). Hierarchies of evolutionary radiation in the world’s most species rich vertebrate group, the Neotropical Pristimantis leaf litter frogs. Systematics and Biodiversity, 16, 807–819. https://doi.org/10.1080/14772000.2018.1503202
Yánez-Muñoz, M., Meza-Ramos, P., Cisneros-Heredia, D. y Ortega-Andrade, H. M. (2010). Claves de identificación y lista de chequeo de la herpetofauna del Chocó esmeraldeño. En MECN (Ed.), Serie Herpetofauna del Ecuador: El Chocó Esmeraldeño (pp. 57–94). Monografía 5. Quito: Museo Ecuatoriano de Ciencias Naturales.
Yánez-Muñoz, M. H., Reyes-Puig, C., Reyes-Puig, J. P., Velasco, J. A., Ayala-Varela, F., y Torres-Carvajal, O. (2018). A new cryptic species of Anolis lizard from northwestern South America (Iguanidae, Dactyloinae). Zookeys, 794, 135. https://doi.org/10.3897/zookeys.794.26936
Yánez-Muñoz, M. H., Sánchez-Nivicela, J. C. y Reyes-Puig, C. (2016). Tres nuevas especies de ranas terrestres Pristimantis (Anura: Craugastoridae) de la Provincia de El Oro, Ecuador. Avances en Ciencias e Ingeníerias, Sección B, 8, 5–25. https://doi.org/10.18272/aci.v8i1.455