Hongos entomopatógenos asociados a Diaphorina citri (Hemiptera: Liviidae) en Colima, México
Angélica María Berlanga-Padilla, Adrien Gallou, Miguel Angel Ayala-Zermeño*, María Guadalupe Serna-Domínguez, Roberto Montesinos-Matías, José Carlos Rodríguez-Rodríguez y Hugo César Arredondo-Bernal
Centro Nacional de Referencia de Control Biológico, SENASICA-DGSV, Km. 1.5 Carretera Tecomán-Estación FFCC, Col. Tepeyac, 28110 Tecomán, Colima, México
*Autor para correspondencia: ayalazermeno@yahoo.com.mx (M.A. Ayala-Zermeño)
Resumen
Diaphorina citri es el vector del Huanglongbing (HLB), enfermedad devastadora de los cítricos a escala mundial. Se realizó la búsqueda de hongos entomopatógenos (HE) como agentes potenciales de control biológico de D. citri en huertas comerciales de cítricos y plantas de mirto en zonas urbanas del estado de Colima, México. Los hongos que se encontraron asociados a la plaga fueron aislados e identificados por métodos morfológicos y moleculares. Se aislaron 30 cepas de HE del orden Hypocreales: Hirsutella citriformis, Isaria javanica, Beauveria bassiana y Simplicillium lanosoniveum; 2 géneros de HE del orden Entomophthorales (Batkoa sp. y Entomophthora sp.) de los cuales no se logró su aislamiento. Se reporta por primera ocasión, la incidencia natural de Simplicillium lanosoniveum y Batkoa sp. asociados a D. citri en Colima, México. Por la incidencia con la que se encontró a H. citriformis, podría considerarse como un buen candidato para el control biológico del psílido D. citri, que al igual que las especies de Entomophthorales, abren la posibilidad de explorar su potencial como agentes microbianos de este psílido.
Palabras clave:
Caracterización; Morfología; Control biológico; Cítricos; Huertos comerciales; Hypocreales; Entomophthorales
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Entomopathogenic fungi associated to Diaphorina citri (Hemiptera: Liviidae) in Colima, Mexico
Abstract
Diaphorina citri is the vector of Huanglongbing (HLB), a devastating disease of citrus fruits worldwide. We searched for entomopathogenic fungi (EF) as potential biological control agents of D. citri in commercial citrus orchards and myrtle plants in urban areas of the state of Colima, Mexico. The fungi that were found associated with the pest were isolated and identified by morphological and molecular methods. Thirty strains of EF were isolated from the order Hypocreales: Hirsutella citriformis, Isaria javanica, Beauveria bassiana, and Simplicillium lanosoniveum; 2 genera of Entomophthorales (Batkoa sp. y Entomophthora sp.) with unsuccessful isolation. The natural incidence of Simplicillium lanosoniveum and Batkoa sp. associated with D. citri in Colima, Mexico is reported for the first time. Due to the incidence of H. citriformis, it could be considered as a good candidate for the biological control of the psyllid D. citri, as the Entomophthorales species, all of them open the possibility of exploring their potential as microbial agents of this psyllid.
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Keywords:
Characterization; Morphology; Biological control; Citrus fruit; Commercial orchards; Hypocreales; Entomophthorales
Introducción
El psílido asiático de los cítricos (PAC) Diaphorina citri Kuwayama (Hemiptera: Liviidae), es el vector de las bacterias gram-negativas ‘Candidatus Liberibacter asiaticus’, ‘Ca. L. americanus’, ‘Ca. L. africanus’ y ‘Ca. L. caribbeanus’, esta última recientemente encontrada en Colombia (Keremane et al., 2015). Estas bacterias son agentes causales de la enfermedad conocida como Huanglongbing (HLB) de los cítricos que tiene un efecto devastador a escala mundial (Bové, 2006; Hall, Richardson et al., 2012). Considerando el riesgo de la enfermedad y su vector, se recomienda como estrategias controlar las poblaciones del PAC con insecticidas sintéticos, eliminar árboles enfermos y realizar siembra de plantas libres de enfermedades (Brlansky et al., 2006). El control químico constituye una importante herramienta para reducir la población de D. citri; sin embargo, las aplicaciones foliares dirigidas al control de adultos y ninfas, proporcionan un periodo corto de protección y tienen un efecto nocivo sobre la entomofauna benéfica (Qureshi et al., 2009). Para limitar la dispersión del HLB y disminuir la densidad poblacional de D. citri se requiere de un esquema de manejo integrado, ya que el uso continuo de insecticidas químicos puede originar la selección de psílidos resistentes (Hoy, 1998). Lo anterior plantea buscar y desarrollar alternativas como el control biológico, esta estrategia aspira, a la conservación de enemigos naturales de las plagas en los sistemas agrícolas. Los agentes de control biológico de D. citri reportados son varios artrópodos depredadores y parasitoides (Hall, Richardson et al., 2012), además de la infección natural de diferentes especies de hongos entomopatógenos (HE) como Hirsutella citriformis Speare (Étienne et al., 2001; Rivero-Aragón y Grillo-Ravelo, 2000; Subandiyah et al., 2000); Isaria fumosorosea Wize (≡ Paecilomyces fumosoroseus) (Samson, 1974; Subandiyah et al., 2000); Isaria javanica (Friedrichs y Bally) Samson y Hywel-Jones (≡ Paecilomyces javanicus) (Yang et al., 2006); Lecanicillium lecanii (Zimmerman) Zare y W. Gams (≡ Verticillium lecanii) (Rivero-Aragón y Grillo-Ravelo, 2000; Xie et al., 1988; Yang et al., 2006) y Beauveria bassiana (Balsamo) Vuillemin (Rivero-Aragón y Grillo-Ravelo, 2000; Yang et al., 2006).
Las alternativas a los plaguicidas sintéticos como el control biológico son relevantes y pueden ser aprovechadas para llevar a cabo un manejo integrado de plagas (MIP) o cualquier tipo de acción fitosanitaria. En México, el Servicio Nacional de Sanidad, Inocuidad y Calidad Agroalimentaria (Senasica) a través de la Dirección General de Sanidad Vegetal (DGSV), desarrolló un programa de control biológico para el manejo de D. citri a través del uso de HE y del parasitoide Tamarixia radiata (Waterston) (Sánchez-González et al., 2015). Con el propósito de contar con una mayor cantidad de enemigos naturales de esta plaga, el presente trabajo tuvo como objetivo realizar exploraciones para conocer las especies de HE asociados a D. citri en huertos comerciales de cítricos y en plantas de Murraya paniculata (L) Jack en el estado de Colima, México.
Materiales y métodos
Las exploraciones para la recolección de los insectos se realizaron en huertos comerciales de limón mexicano (Citrus aurantifolia Christm. Swingle), limón persa (Citrus latifolia Tanaka) y plantas de mirto o limonaria (M. paniculata) del área urbana en los municipios de Tecomán, Armería y Manzanillo, en Colima, México, desde el año 2012 hasta 2014. El muestreo fue dirigido a los diferentes estadios del insecto. Para recolectar huevos y ninfas, se tomaron brotes tiernos de la planta, los cuales fueron colocados en bolsas de papel. En insectos adultos se buscaron signos y síntomas de infección por hongos, incluyendo alteraciones en la conducta, cambios de coloración, momificación o presencia de micelio y conidios en la superficie de su cuerpo. Los insectos con estas características se recolectaron en forma individual tomando la hoja o parte del sustrato en que se encontraban y se depositaron individualmente en contenedores secos, evitando las partículas de tierra y otros contaminantes. También se incluyó la recolecta de insectos muertos sin indicios aparentes de infección; el material fue colocado en viales entomológicos debidamente etiquetados y depositados en una hielera de poliestireno con geles refrigerantes y llevados al laboratorio para su análisis.
Los insectos recolectados en campo se examinaron en un microscopio estereoscópico (Stemi 2000-C, Carl Zeiss), para visualizar los signos externos característicos de las especies de HE. Los insectos muertos carentes de signos de infección fueron colocados en cámara húmeda (K2SO4, al 11%) a 25 °C para favorecer el desarrollo de posibles HE (Goettel e Inglis, 1997); una vez que el hongo se desarrolló, se procedió a revisar las estructuras morfológicas. Los especímenes con signos de micosis se examinaron mediante la preparación de laminillas con lactofenol azul de algodón (10:1) o aceto orceína según el HE. Las preparaciones fueron observadas en un microscopio óptico (AXIO SCOPE A1, Carl Zeiss) para analizar las características morfológicas. Se consideraron las estructuras de reproducción asexual (conidios y conidióforos) para su identificación taxonómica, tomando como referencia las claves reportadas por Humber (2012). Para realizar la identificación específica se procedió a evaluar su morfometría; para ello se realizaron preparaciones de insectos micosados y microcultivos de acuerdo con Ayala-Zermeño et al. (2015). Se tomaron fotografías con el objetivo 100× (AXIO SCOPE A1) y una cámara digital AxioCam ICc 1 (Carl Zeiss) utilizando el software AxionVision 4.9.1 (03-2013). Por cada uno de los aislados se midieron 30 conidios y 30 fiálides considerando largo y ancho de cada estructura.
Para purificar los aislados a partir del insecto, se seleccionaron especímenes con micosis utilizando la transferencia directa de esporas y el método de descarga de conidios acorde a la especie de hongo causante de la infección (Hayek et al., 2012). Se utilizaron los medios de cultivo Sabouraud dextrosa agar (SDA) suplementado con extracto de levadura [g L-1: dextrosa 40, peptona de carne 5, peptona de caseína 5, extracto de levadura 10, agar 15] y SDA suplementado con yema de huevo (120 mL) y leche (80 mL); la incubación se realizó a 25 ± 2 °C hasta su esporulación. Los hongos aislados fueron depositados en la Colección de Hongos Entomopatógenos (CHE) del Centro Nacional de Referencia de Control Biológico (CNRCB-DGSV), con el acrónimo CHE-CNRCB correspondiente.
El ADN genómico de la mayoría de los aislados fue extraído a partir de 10 mg de micelio liofilizado y macerado con un balín de tungsteno (3 mm) o acero (5 mm) en el equipo TissueLyser II™ (Qiagen Valencia, USA) y usando el kit DNeasy Plant Mini (Qiagen, Valencia, USA) de acuerdo a las instrucciones del fabricante. La extracción de ADN de los aislados CHE-CNRCB 373 y 375 se llevó a cabo con 10 mg de micelio liofilizado macerado con nitrógeno líquido en un mortero y el procedimiento convencional descrito por Amer et al. (2011). Los parámetros de calidad del ADN genómico extraído (i.e., pureza, concentración e integridad) se determinaron según Gallou et al. (2016). Acorde con el género, las regiones utilizadas para la identificación fueron las siguientes: la región intergénica Bloc (5.3F/B5.1R; Rehner et al., 2006), el factor de elongación de traducción 1α (TEF) (983F/2218R; Carbone y Kohn, 1999; Rehner y Buckley, 2005) y los espaciadores internos transcritos (ITS) (ITS5/ITS4; White et al., 1990) para los aislados del género Beauveria. Las regiones TEF e ITS para los aislados del género Isaria. La subunidad pequeña ribosomal (SSU) (NS1/NS4; White et al., 1990), la subunidad 1 de la ribopolimerasa II (RPB1) (CRPB1A/RPB1Cr; Castlebury et al., 2004), el TEF y la región ITS para los aislados del género Hirsutella, y la región ITS para el género Simplicillium. La mezcla de reacción de PCR para cada región a amplificar consistió de Polimerasa Phire Hot Start II (Thermo Fisher Scientific, Waltham, USA), 1X del buffer Phire Reaction (ThermoFisher Scientific), 0.2 mM del mix de dNTPs, 0.4 µM de cada primer y 1-20 ng de ADN genómico, ajustados a un volumen final de 25 µL. Los programas de amplificación por PCR se efectuaron como sigue: para Bloc, 1 ciclo de desnaturalización inicial a 98 °C por 30 s, seguido de 35 ciclos de desnaturalización a 98 °C por 5 s, alineación a 56 °C por 5 s y extensión a 72 °C por 22 s, con 1 ciclo de extensión final a 72 °C por 1 min. TEF, 1 ciclo de desnaturalización inicial a 98 °C por 30 s, seguido de 10 ciclos de: 98 °C por 5 s, 66 °C (disminuyendo 1 °C por ciclo) por 5 s y 72 °C por 15 s, en seguida 30 ciclos de: 98 °C por 5 s, 56 °C por 5 s y 72 °C por 15 s y por último, un ciclo de extensión final a 72 °C por 1 min. ITS, 1 ciclo de desnaturalización inicial a 98 °C por 30 s, seguido de 36 ciclos a 98 °C por 5 s, 55 °C por 5 s, 72 °C por 9 s y 1 ciclo de extensión final a 72 °C por 1 min. SSU, 1 ciclo de desnaturalización inicial a 98 °C por 30 s, seguido de 4 ciclos de: 98 °C por 5 s, 55 °C (disminuyendo 1 °C por ciclo) por 5 s y 72 °C por 15 s, continuando con 42 ciclos de: 98 °C por 5 s, 50.5 °C por 5 s y 72 °C por 15 s, con 1 ciclo de extensión final a 72 °C por 1 min. RPB1, 1 ciclo de desnaturalización inicial a 98 °C por 30 s, seguido de 4 ciclos de: 98 °C por 5 s, 47 °C por 5 s y 72 °C por 10 s, continuando con 40 ciclos de: 98 °C por 5 s, 47 °C por 5 s y 72 °C por 10 s, con 1 ciclo de extensión final a 72 °C por 1 min. La purificación de los productos de PCR se realizó con el kit Wizard® SV Gel y PCR Clean-Up System Kit (Promega, Madison, EUA). Para la secuenciación de los amplicones se utilizaron los primers de PCR y en algunos casos, primers adicionales específicos a las regiones Bloc Brint, Bfn6, B822Ldg, B22Udg, Bfn2 y BRn2 (Rehner et al., 2011) y TEF 1577F y 1567R (Rehner y Buckley, 2005) para los géneros Beauveria e Isaria (Macrogen, Seúl, Corea del Sur).
|
Tabla 1 Especies, acrónimos y número de acceso en el GenBank. |
||||||
|
Especie |
Acrónimo |
Número de acceso en el GenBank |
||||
|
TEF |
ITS |
Bloc |
RPB1 |
SSU |
||
|
Hirsutella citriformis |
335 |
KY587203 |
KU725692 |
– |
KY587213 |
KY587216 |
|
339 |
KY587204 |
– |
– |
KY587214 |
KY587217 |
|
|
338 |
KU725695 |
– |
– |
KU725698 |
KU725707 |
|
|
375 |
KY587205 |
– |
– |
KY587215 |
KY587218 |
|
|
Isaria javanica |
357 |
KY587206 |
KX686124 |
– |
– |
– |
|
358 |
KY587207 |
KX686125 |
– |
– |
– |
|
|
363 |
KY587208 |
KX686126 |
– |
– |
– |
|
|
Beauveria bassiana |
167 |
KU725693 |
KX686119 |
KY587219 |
– |
– |
|
168 |
KU725693 |
KU725691 |
KU725706 |
– |
– |
|
|
169 |
KY587210 |
KX686120 |
KY587220 |
– |
– |
|
|
170 |
KY587211 |
KX686121 |
KY587221 |
– |
– |
|
|
365 |
KY587212 |
KX686122 |
KY587222 |
– |
– |
|
|
Simplicillium lanosoniveum |
373 |
– |
KX686123 |
– |
– |
– |
La edición y el ensamble de las secuencias se realizó en el programa BioEdit 7.2.0 (Hall, 1999). Las secuencias correspondientes a cada región fueron depositadas en el GenBank (tabla 1). Los alineamientos múltiples se efectuaron con MUSCLE (Edgar, 2004) para el género Simplicillium y MAFFT (Katoh et al., 2002) para los géneros Beauveria, Isaria e Hirsutella. El análisis filogenético para el género Beauveria se realizó por inferencia bayesiana (IB) derivada de la concatenación de las regiones Bloc, TEF e ITS. Se utilizaron 2 modelos de evolución de acuerdo con el programa jModelTest 2.1.10 (Darriba et al., 2012): Hasegawa-Kishino-Yano (HKY) con una distribución gama para las regiones Bloc e ITS, mientras que para el TEF, se usó el modelo “general time reversible” (GTR) con sitios invariantes y una distribución gama. El análisis fue llevado a cabo con 1,000,000 de generaciones y un muestreo cada 100 árboles en el programa MrBayes 3.2.5 (Ronquist y Huelsenbeck, 2003). Las secuencias de las cepas de referencia tipo se obtuvieron de Rehner et al. (2011), mientras que las secuencias de Isaria cicadae ARSEF 7260, I. tenuipes ARSEF 4096, I. farinosa ARSEF 4029 y Cordyceps militaris ARSEF 5050 se utilizaron como grupo externo. El análisis filogenético para el género Isaria se realizó por IB con las regiones TEF e ITS de forma individual. Se utilizaron 2 modelos de evolución acorde al programa jModelTest 2.1.10 (Darriba et al., 2012): Kimura de 2 parámetros (K80) con una distribución gama para el TEF, mientras que para el ITS, se usó el modelo HKY con una distribución gama. El análisis fue llevado a cabo con 1,400,000 generaciones y un muestreo cada 100 árboles para el TEF y con 1,000,000 de generaciones y un muestreo cada 100 árboles para el ITS en el programa MrBayes 3.2.5 (Ronquist y Huelsenbeck, 2003). Las cepas de referencia tipo se obtuvieron de Cabanillas et al. (2013), mientras que las cepas Metarhizium marquandii CBS 182.27, M. robertsii ARSEF 727 e Hirsutella sp. OSC 128575 se utilizaron como grupo externo. El análisis filogenético para el género Hirsutella se realizó por IB derivada de la concatenación de las regiones SSU, TEF y RPB1. Se utilizó el modelo GTR con una distribución gama y sitios invariantes para las 3 regiones con base al jModelTest 2.1.10 (Darriba et al., 2012). El análisis bayesiano se realizó con 1,000,000 de generaciones y un muestreo cada 100 árboles en el programa MrBayes 3.2.5 (Ronquist y Huelsenbeck, 2003). Las cepas de referencia tipo se obtuvieron de Quandt et al. (2014), mientras que las cepas Metarhizium guizhouense ARSEF 5714, M. majus ARSEF 3145, Pochonia chlamydosporia CBS 504.66 y P. chlamydosporia CBS 101244 se utilizaron como grupo externo. Para el IB de los géneros Beauveria, Isaria e Hirsutella, los árboles resultantes se visualizaron en FigTree 1.4.2 (Rambaut, 2014) y se calculó un árbol de consenso del 50%. El análisis filogenético para el género Simplicillium se realizó con el método de máxima verosimilitud (MV) de la región ITS. Se utilizó el modelo de evolución de Tamura de 3 parámetros con base al programa MEGA 6 (Tamura et al., 2013). Se aplicó una distribución gamma para el análisis con 1,000 réplicas de bootstrap. Las cepas de referencia tipo se obtuvieron de Nonaka et al. (2013), mientras que las cepas Torrubiella luteorostrata CBS 398.86, Verticillium chlamydosporium CBS 103.65 y Pochonia chlamydosporia ARSEF 2218 se utilizaron como grupo externo.
Tabla 2
Aislados de hongos entomopatógenos asociados a Diaphorina citri recolectados en el estado de Colima, México conservados en la Colección de Hongos Entomopatógenos del Centro Nacional de Referencia de Control Biológico.
|
Tabla 2 Continuación. |
||||
|
Especie |
Acrónimo |
Huésped (estadio) |
Hospedero |
Origen |
|
Especie |
Acrónimo |
Huésped (estadio) |
Hospedero |
Origen |
|
Hirsutella citriformis |
328 |
Diaphorina citri (adulto) |
Citrus aurantifolia |
El Roble, Cofradía de Morelos, Tecomán, Colima, MX. 18°51’16.3” N 103°50’58.9” O |
|
Hirsutella citriformis |
329 |
Diaphorina citri (adulto) |
Citrus aurantifolia |
El Roble, Cofradía de Morelos, Tecomán, Colima, MX. 18°51’16.3” N 103°50’58.9” O |
|
Hirsutella citriformis |
330 |
Diaphorina citri (adulto) |
Citrus aurantifolia |
Tecuanillo, Tecomán, Colima, MX. 18°49’00.1” N 103°52’58.8” O |
|
Hirsutella citriformis |
331 |
Diaphorina citri (adulto) |
Citrus aurantifolia |
Tecuanillo, Tecomán, Colima, MX. 18°49’00.1” N 103°52’58.8” O |
|
Hirsutella citriformis |
332 |
Diaphorina citri (adulto) |
Citrus aurantifolia |
Cofradía de Morelos,Tecomán, Colima, MX. 18°52’09.8” N 103°50’16.8” O |
|
Hirsutella citriformis |
333 |
Diaphorina citri (adulto) |
Citrus aurantifolia |
El Roble, Cofradía de Morelos, Tecomán, Colima, MX. 18°51’16.3” N 103°50’58.9” O |
|
Hirsutella citriformis |
335 |
Diaphorina citri (adulto) |
Citrus aurantifolia |
Cofradía de Morelos, Tecomán, Colima, MX. 18°52’09.8” N 103°50’16.8” O |
|
Hirsutella citriformis |
337 |
Diaphorina citri (adulto) |
Citrus aurantifolia |
El Pandelo, Tecomán, Colima, MX. 18°53’21.0” N 103°53’10.7” O |
|
Hirsutella citriformis |
338 |
Diaphorina citri (adulto) |
Citrus latifolia |
Tecuanillo, Tecomán, Colima, MX. 18°49’00.1” N 103°52’58.8” O |
|
Hirsutella citriformis |
339 |
Diaphorina citri (adulto) |
Citrus latifolia |
Tecomán, Colima, MX. 18°55’37.9” N 103°53’01.7” O |
|
Hirsutella citriformis |
340 |
Diaphorina citri (adulto) |
Citrus aurantifolia |
Tecomán, Colima, MX. 18°55’37.9” N 103°53’01.7” O |
|
Hirsutella citriformis |
341 |
Diaphorina citri (adulto) |
Citrus latifolia |
Tecomán, Colima, MX. 18°55’37.9” N 103°53’01.7” O |
|
Hirsutella citriformis |
342 |
Diaphorina citri (adulto) |
Citrus aurantifolia |
Tecomán, Colima, MX. 18°55’37.9” N 103°53’01.7” O |
|
Hirsutella citriformis |
345 |
Diaphorina citri (adulto) |
Murraya paniculata |
Tecomán, Colima, MX. 18°55’37.9” N 103°53’01.7” O |
|
Hirsutella citriformis |
346 |
Diaphorina citri (adulto) |
Citrus aurantifolia |
Tecuanillo, Tecomán, Colima, MX. 18°49’00.1” N 103°52’58.8” O |
|
Hirsutella citriformis |
347 |
Diaphorina citri (adulto) |
Citrus aurantifolia |
Cofradía de Morelos, Tecomán, Colima, MX. 18°52’09.8” N 103°50’16.8” O |
|
Hirsutella citriformis |
350 |
Diaphorina citri (adulto) |
Citrus aurantifolia |
Ejido Augusto Gómez Villanueva, Coalatilla, Armería, Colima, MX. 19°01’00.1” N 104°00’00.0” O |
|
Hirsutella citriformis |
360 |
Diaphorina citri (adulto) |
Citrus aurantifolia |
Ejido Vicente Guerrero, Tecomán, Colima, MX. 18°57’40.0” N 103°50’04.3” O |
|
Hirsutella citriformis |
375 |
Diaphorina citri (ninfa) |
Citrus aurantifolia |
Ejido Augusto Gómez Villanueva, Coalatilla, Armería, Colima, MX. 19°01’00.1” N 104°00’00.0” O |
|
Isaria javanica |
356 |
Diaphorina citri (ninfa) |
Citrus aurantifolia |
El Saucito, Tecomán, Colima, MX. 18°52’00.1” N 103°48’00.0” O |
|
Isaria javanica |
357 |
Diaphorina citri (ninfa) |
Citrus aurantifolia |
El Saucito,Tecomán,Colima, MX. 18°52’00.1” N 103°48’00.0” O |
|
Isaria javanica |
358 |
Diaphorina citri (ninfa) |
Citrus aurantifolia |
Tecomán, Colima, MX. 18°55’37.9” N 103°53’01.7” O |
|
Isaria javanica |
359 |
Diaphorina citri (ninfa) |
Citrus aurantifolia |
Tecomán, Colima, MX. 18°55’37.9” N 103°53’01.7” O |
|
Isaria javanica |
363 |
Diaphorina citri (adulto) |
Citrus aurantifolia |
Tecomán,Colima, MX. 18°55’37.9” N 103°53’01.7” O |
|
Beauveria bassiana |
167 |
Diaphorina citri (adulto) |
Murraya paniculata |
Tecomán, Colima, MX. 18°55’37.9” N 103°53’01.7” O |
|
Beauveria bassiana |
168 |
Diaphorina citri (adulto) |
Citrus aurantifolia |
San Miguel del ojo de agua, Tecomán, Colima, MX. 18°49’25.0” N 103°42’03.6” O |
|
Beauveria bassiana |
169 |
Diaphorina citri (adulto) |
Murraya paniculata |
Tecomán, Colima, MX. 18°55’37.9” N 103°53’01.7” O |
|
Beauveria bassiana |
170 |
Diaphorina citri (adulto) |
Murraya paniculata |
Tecomán, Colima, MX. 18°55’37.9” N 103°53’01.7” O |
|
Beauveria bassiana |
365 |
Diaphorina citri (adulto) |
Citrus aurantifolia |
Ejido Augusto Gómez Villanueva, Coalatilla, Armería, Colima, MX. 19°01’00.1” N 104°00’00.0” O |
|
Simplicillum lanosoniveum |
373 |
Diaphorina citri (ninfa) |
Citrus aurantifolia |
Ejido Augusto Gómez Villanueva, Coalatilla, Armería, Colima, MX. 19°01’00.1” N 104°00’00.0” O |
Resultados
Las exploraciones realizadas en huertos comerciales de limón y plantas de M. paniculata permitieron recolectar insectos infectados de diferentes estadios de desarrollo con signos de micosis. Los HE asociados a ninfas y adultos de D. citri corresponden a 6 géneros de HE, de los cuales 4 pertenecen al orden Hypocreales: Hirsutella (19), Isaria (5), Beauveria (5) y Simplicillium (1), obteniendo un total de 30 aislados (tabla 2). Además se identificaron 2 géneros del orden Entomophthorales: Batkoa y Entomophthora, de los cuales no fue posible obtener los aislados.
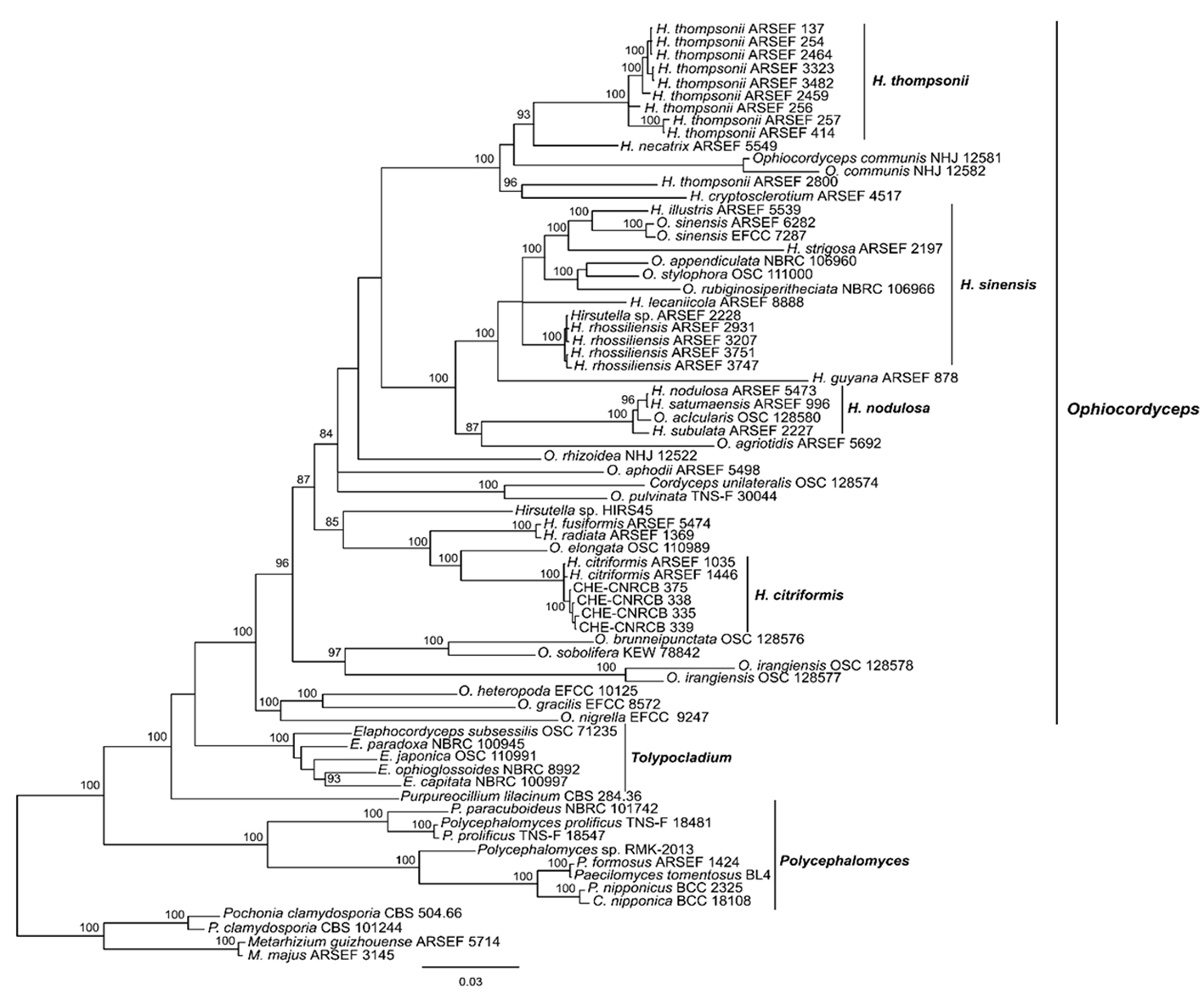
Hirsutella citriformis fue el hongo con mayor incidencia y distribución, se encontró en todos los huertos muestreados infectando adultos, aunque en el verano de 2014 se encontraron 3 ninfas infectadas por H. citriformis en la comunidad de Coalatilla en Armería, siendo el primer reporte de infección de esta especie sobre ninfas en México. Los PAC infectados con este hongo se encontraban adheridos a hojas y ramas en limón y limonaria, cubiertos por micelio blanco a grisáceo, su característica particular fue la presencia de sinemas largos y cilíndricos de tamaño variable que emergían del tórax del insecto, en algunos casos ramificados, regularmente con protuberancias cónicas en la base del sinema (fig. 1a, b). La estructura conidiógena mostró forma de botella con la base ensanchada y la parte distal con un cuello delgado y alargado, distribuidas a lo largo del sinema (fig. 1c, d) y los conidios mostraron una forma fusiforme (fig. 1e).

Del material recolectado se obtuvieron 19 aislados que se registraron con los acrónimos CHE-CNRCB 328, 329, 330, 331,332, 333, 335, 337, 338, 339, 340, 341, 342, 345, 346, 347, 350 y 360, todos ellos de adultos y el aislado 375 obtenido a partir de ninfas del psílido. Considerando la morfometría de 5 aislados, presentaron variabilidad en sus dimensiones (tabla 3). La longitud de las fiálides mostraron un intervalo de 24.61 – 29.32 µm de cuello y la base de las fiálides mostró valores entre 5.82 – 6.73 µm. Las dimensiones de los conidios fueron de 6.95 – 7.68 × 2.09 – 2.54 µm (largo × ancho). El análisis filogenético por IB derivada de la concatenación de las regiones SSU,
TEF y RPB1 de las muestras de Hirsutella spp. mostró que los aislados CHE-CNRCB 335, 338, 339 y 375 forman parte del clado de H. citriformis y en el que se incluyen los 2 aislados H. citriformis ARSEF 1035 y ARSEF 1446 (fig. 2). La rama tiene un apoyo fuerte y significativo de 100% de probabilidades posteriores por IB (PP IB).
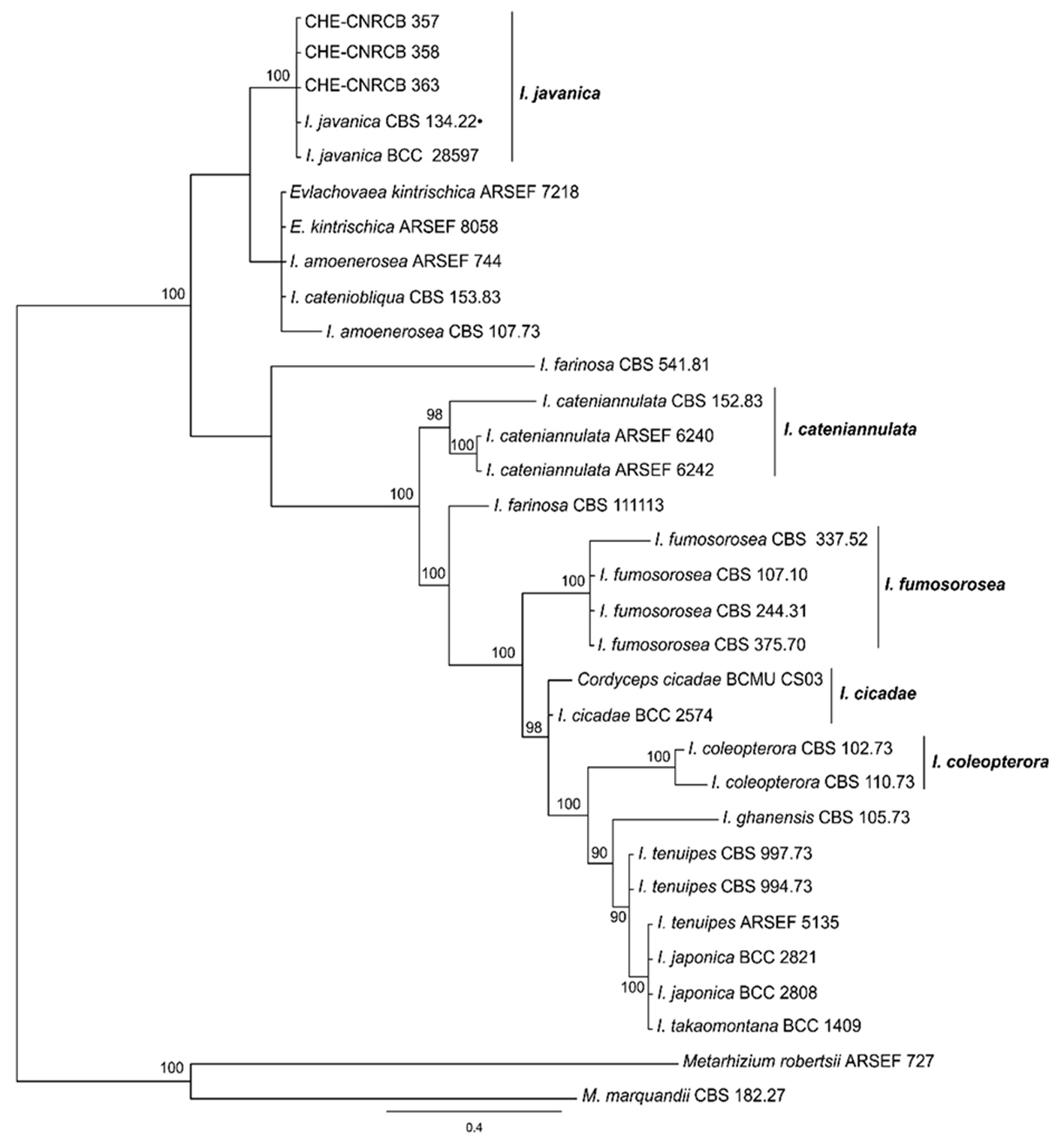
Isaria javanica. Durante los muestreos de campo se encontraron ninfas y adultos del PAC infectadas con I. javanica en 2 huertos de limón del municipio de Tecomán, los insectos momificados tenían apariencia polvosa grisácea. Los adultos momificados se observaron adheridos al follaje en posición de alimentación con el abdomen cubierto por el hongo (fig. 1f). En ninfas se observó micosis en la parte ventral sobresaliendo por sus costados (fig. 1g). Se obtuvieron 5 aislados CHE-CNRCB 356, 357, 358, 359 y 363. La morfología de las células conidiógenas fue en forma de botella con la porción basal ensanchada con un ahusamiento que da origen a un cuello característico (fig. 1h), las dimensiones de las fiálides fueron de 5.5 × 2.3 µm (4.6 – 6.3 ± 0.45 × 1.7 – 2.9 ± 0.29 µm, n = 90) y los conidios en cadenas de forma cilíndrica a fusiforme (fig. 1i) de 4.5 ×1.6 µm (4.0 – 5.4 ± 0.41 × 1.3 – 2.0 ± 0.15, n = 90), características acordes con la especie I. javanica (Gallou et al., 2016). Los análisis filogenéticos individuales por IB de las regiones ITS y TEF de las cepas de Isaria spp. mostraron que los aislados CHE-CNRCB 357, 358 y 363 forman parte del clado de I. javanica y en el que se incluye el aislado de referencia tipo I. javanica CBS 134.22 (fig. 3). Para las 2 regiones, las ramas tienen un apoyo significativo de 100% de PP IB.
Tabla 3
Morfometría de Hirsutella citriformis a partir de estructuras crecidas sobre Diaphorina citri en Colima, México y su comparación con otras investigaciones.
|
Acrónimo |
Fiálide |
Conidio |
||
|
Base (largo × ancho) |
Cuello (largo × ancho) |
Largo |
Ancho |
|
|
CHE-CNRCB 331 |
6.73 ± 0.93 × 4.21 ± 0.40 |
25.94 ± 3.55 × 1.42 ± 0.20 |
6.95 ± 0.78 |
2.54 ± 0.33 |
|
CHE-CNRCB 335 |
5.82 ± 0.69 × 3.83 ± 0.31 |
24.61 ± 3.62 × 1.2 ± 0.17 |
7.57 ± 0.81 |
2.18 ± 0.20 |
|
CHE-CNRCB 338 |
6.47 ± 0.77 × 4.3 ± 0.36 |
28.53 ±3.57 × 1.33 ± 0.21 |
7.2 ± 0.72 |
2.6 ± |
|
CHE-CNRCB 339 |
6.51 ± 0.82 × 4.02 ± 0.40 |
28.84 ± 3.53 × 1.07 ± 0.25 |
7.68 ± 0.76 |
2.30 ± 0.40 |
|
CHE-CNRCB 375 |
6.08 ± 0.66 × 3.88 ± 0.43 |
29.32 ± 3.34 × 1.33 ± 0.17 |
7.36 ± 0.71 |
2.51 ± 0.32 |
|
Estudios comparativos |
Base (largo) |
Cuello (largo) |
– |
– |
|
Mains (1951) |
6.0 − 14.0 |
30.0 − 40.0 |
5.0 − 8.0 |
2.0 − 2.5 |
|
Subandiyah et al. (2000) |
5.1 − 9.4 |
22.4 − 52.9 |
6.4 − 7.6 |
2.1 − 2.8 |
|
Alvarez et al. (2003) |
– |
16.8 − 23.6 |
6.8 − 9.1 |
1.5 − 2.3 |
|
Meyer et al. (2007) |
– |
17.5 ± 1.9 |
5.9 ± 0.8 |
2.6 ± 0.3 |
|
Casique-Valdés et al. (2011) |
– |
– |
6.8 − 7.0 |
1.5 − 2.0 |
|
Toledo et al. (2013) |
– |
28.7 − 47.5 |
5.9 − 7.9 |
2.0 − 3.0 |
|
Toledo et al. (2013) |
– |
16.8 − 28.0 |
5.6 − 7.8 |
2.2 − 2.8 |
|
Pérez-González et al. (2015), Colima |
6.00 ± 0.48 |
24.7 ± 0.84 |
5.91 ± 0.14 |
1.79 ± 0.03 |
|
Pérez-González et al. (2015), Chiapas |
5.12 ± 0.23 |
26.88 ± 0.19 |
6.04 ± 0.05 |
1.99 ± 0.03 |
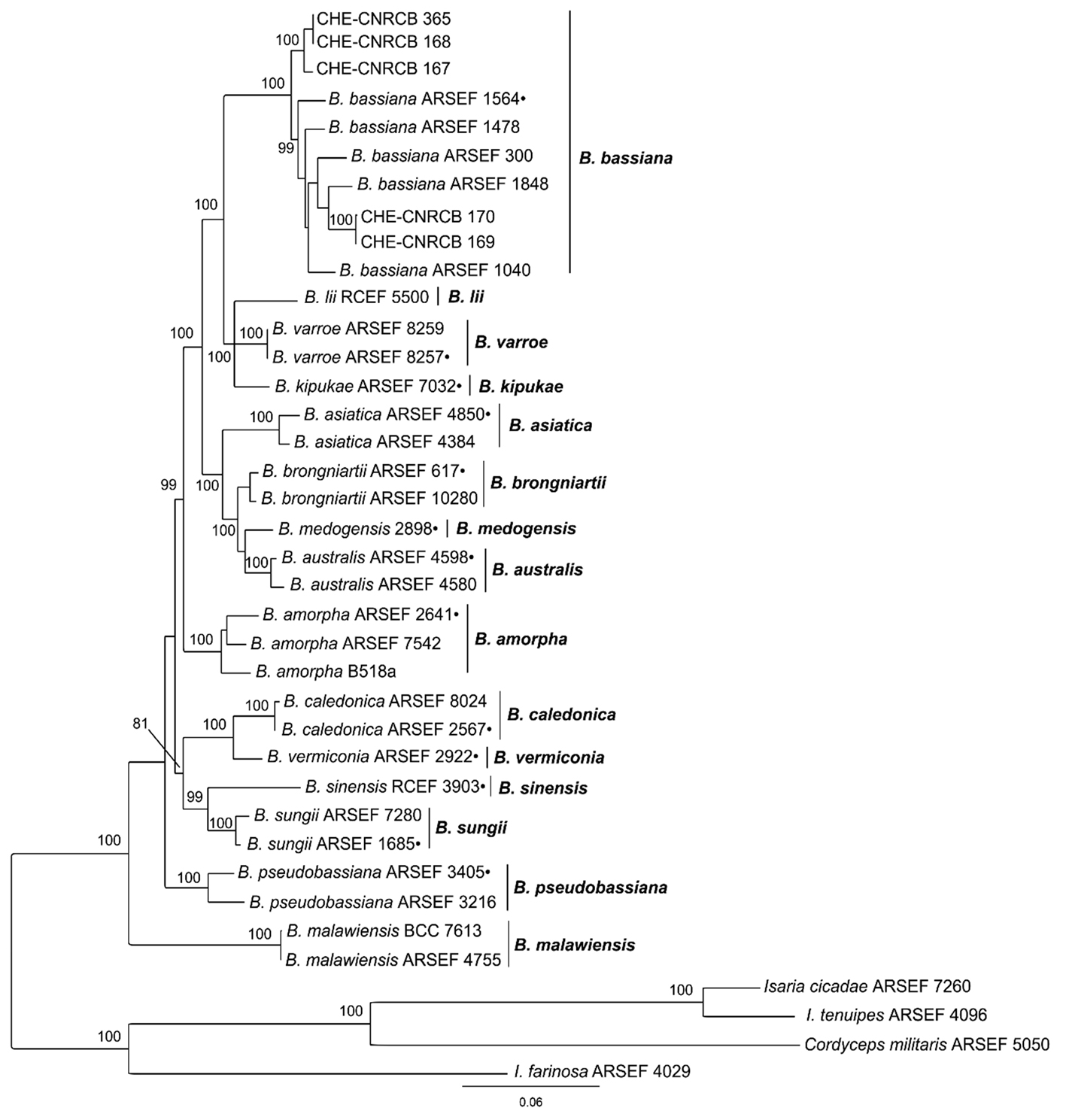
Beauveria bassiana. Se recolectaron adultos de D. citri infectados con B. bassiana en plantas de M. paniculata y en huertos de limón en los municipios de Armería y Tecomán, los insectos mostraron crecimiento micelial en el abdomen que se fue tornando polvoso, de coloración blanca a amarillo cremoso (fig. 1j). Se observaron estructuras de reproducción asexual típicas del género, micelio septado con un diámetro de 1.8 µm (1.3 – 2.3 ± 0.29, n = 40), células conidiógenas de 2.42 µm (1.8 – 3.3 ± 0.33, n = 90) con una base globosa en forma de botella adelgazadas en la parte superior, formando un raquis curveado en zig-zag que se extiende apicalmente con un conidio por dentículo (fig. 1k); conidios globosos a sub-globosos (fig. 1l) de 2.5 × 2.2 µm (2.1 – 3 ± 0.23 × 1.9 – 2.6 ± 0.15, n = 90). Cinco aislados fueron obtenidos (i.e., CHE-CNRCB 167, 168, 169, 170 y 365). El análisis filogenético por IB derivada de la concatenación de las regiones Bloc, TEF e ITS de las muestras de Beauveria spp. mostró que los aislados CHE-CNRCB 167, 168, 169, 170 y 365 forman parte del clado de B. bassiana y en el que se incluye el aislado de referencia tipo B. bassiana ARSEF 1564. La rama tiene un apoyo fuerte y significativo de 100% de PP IB. Sin embargo, dentro de la especie B. bassiana se observaron 2 clados distintos con un apoyo del 100% y del 99% de PP IB, separando los aislados CHE-CNRCB 167, 168 y 365 de los aislados CHE-CNRCB 169, 170 y ARSEF 1564. Esta diferencia genética fue soportada únicamente por la región intergénica nuclear Bloc, la cual fue desarrollada inicialmente para realizar investigaciones de especiación críptica de B. bassiana (Rehner et al., 2006) y posteriormente utilizada en un análisis filogenético multilocus para evaluar la diversidad del género Beauveria y el estatus taxonómico de sus especies (Rehner et al., 2011). Por ejemplo, la secuencia Bloc del aislado CHE-CNRCB 365 presentó 96% de similitud (1,452/1,510 pb) respecto a la secuencia Bloc del aislado tipo ARSEF 1564 (EF222317), mientras que las secuencias ITS y TEF del mismo aislado presentaron más de 99% de similitud (515/519 pb y 984/986 pb, respectivamente) con las secuencias ITS (NR_111594) y TEF (HQ880974) del aislado tipo ARSEF 1564. Adicionalmente, el análisis realizado con la herramienta “basic logic alignment tool” (BLAST) en la base de datos del National Center for Biotechnology Information (NCBI) mostró que la secuencia Bloc del aislado CHE-CNRCB 365 presentó 100% de similitud con la secuencia Bloc del aislado B. bassiana ARSEF 1966 (DQ384384), confirmando su identificación como B. bassiana. Debido a lo anterior, el contenido de linajes hermanos o como se observa en la figura 4, la presencia de clados dentro de la especie B. bassiana sugiere una gran variación intraespecífica que es determinada principalmente por la región intergénica Bloc.
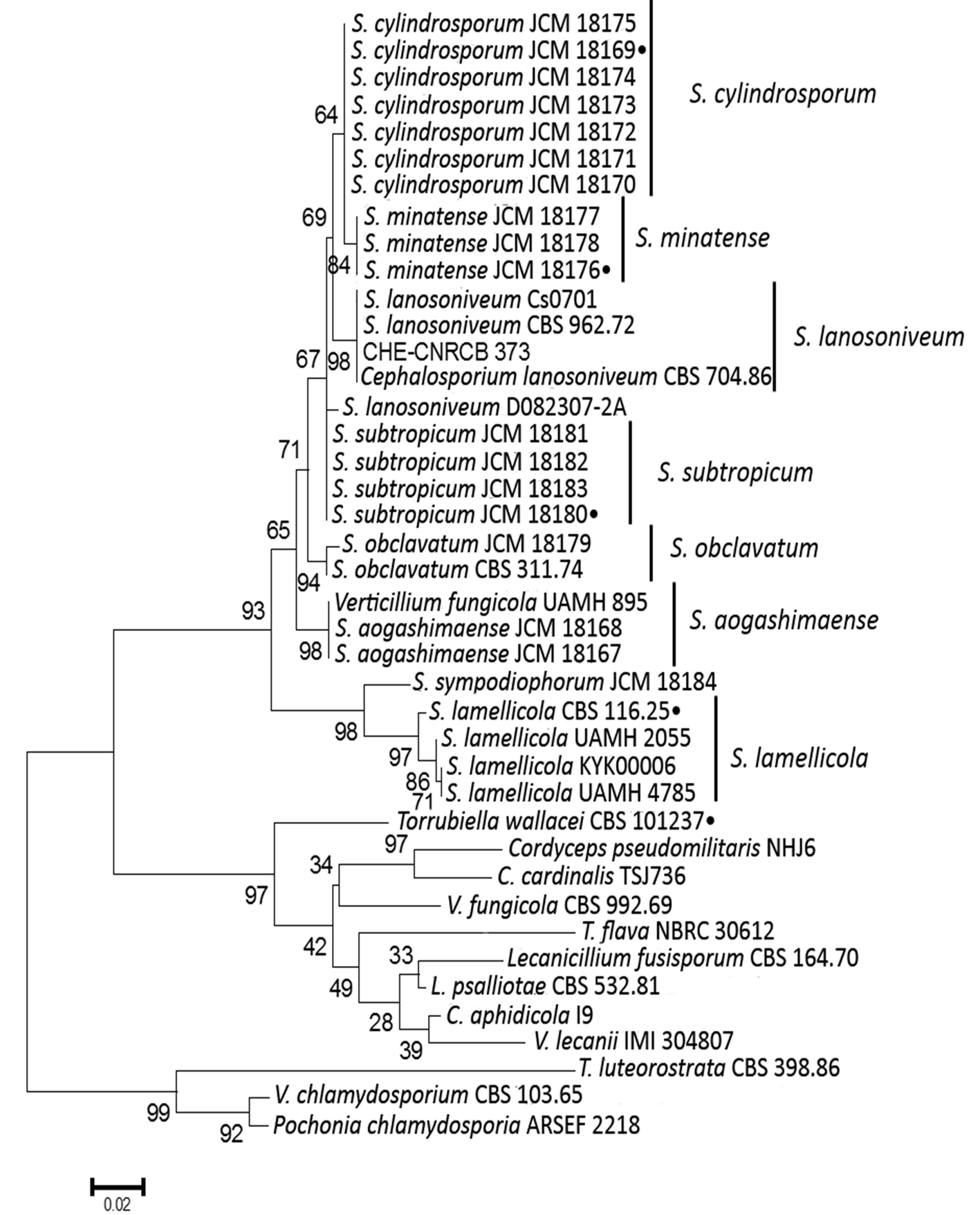
Simplicillium lanosoniveum. La especie se localizó en un huerto de Armería sobre ninfas cubiertas por micelio blanco y de aspecto granuloso (fig. 1m), sin sinemas; al aislado se le asignó el acrónimo CHE-CNRCB 373. Esta especie se caracteriza por presentar fiálides largas y delgadas generalmente solitarias y raramente verticiladas (fig. 1n); las dimensiones de sus fiálides fueron 29.3 × 1.2 µm (20 – 44 ± 0.57 × 0.8 – 1.7 ± 0.21, n = 30), los conidios cilíndricos se mostraron agregados en cabezas en los vértices de cada fiálide (fig. 1n, o), constituidos por una sola célula de 3.1 × 1.3 µm (2.4 – 4.3 ± 0.43 × 0.9 – 1.6 ± 0.17, n = 30). El análisis filogenético por IB de la región ITS de la muestra de Simplicillium spp. mostró que el aislado CHE-CNRCB 373 forma parte del clado de S. lanosoniveum y en el que se incluyen los 2 aislados S. lanosoniveum CBS 704.86 y CBS 962.72 (fig. 5). La rama tiene un apoyo significativo de 100% de PP IB.
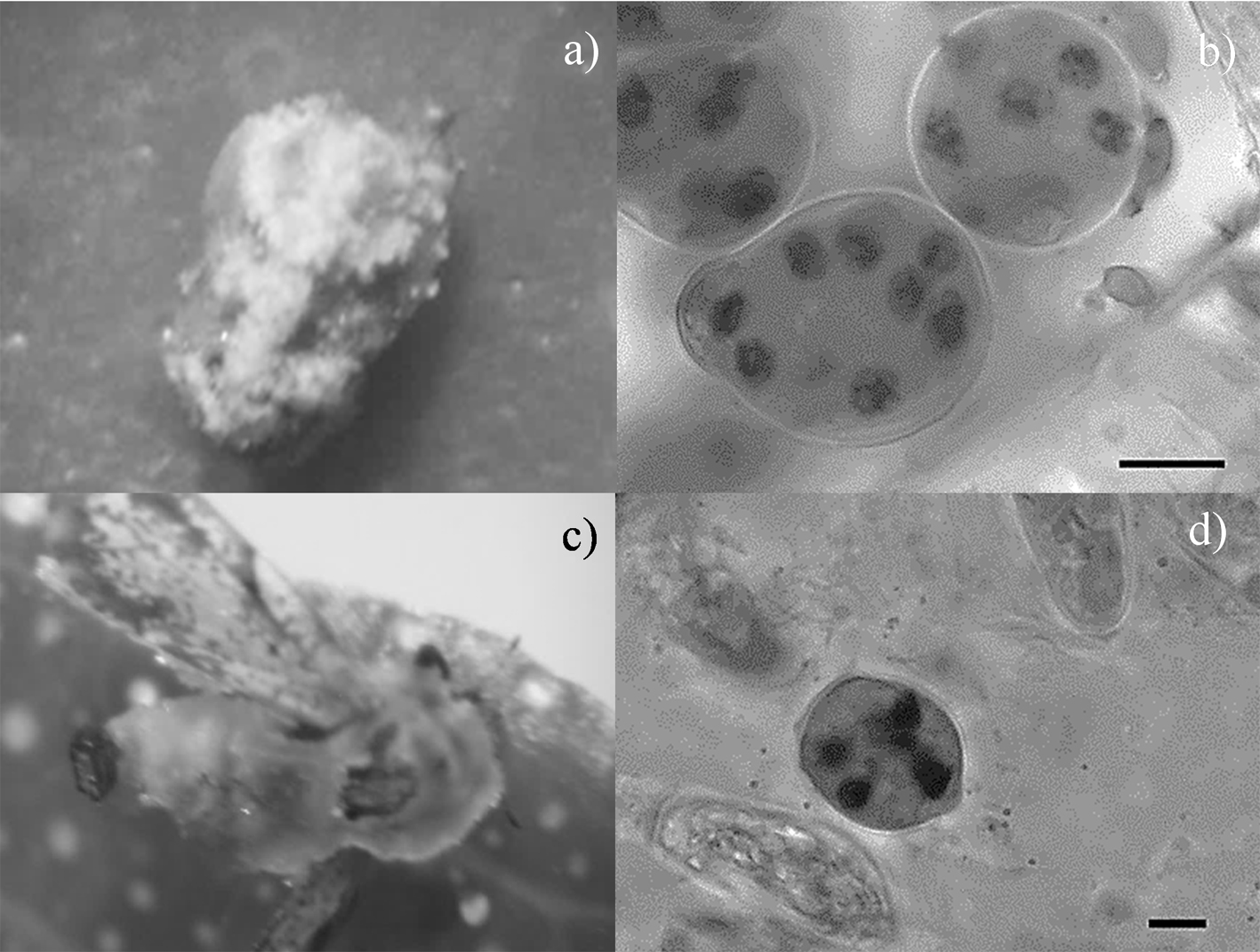
El género Batkoa se encontró sobre ninfas de D. citri, el crecimiento del hongo exhibió una textura granulosa dando la apariencia que se encontraba cubierta por azúcar (fig. 6a), con conidios primarios subesféricos con una papila característica de la especie (fig. 6b), con dimensiones de 29.5 ± 2.5 µm de largo × 24.14 ± 2 µm (n = 15) ancho, conteniendo un promedio de 8 núcleos por conidio con un diámetro de 4.25 ± 0.67µm (n = 60). No se logró aislar este género por lo cual no se realizó el análisis molecular correspondiente.
El género Entomophthora fue identificado sobre adultos; las características de los insectos infectados con este hongo fueron abdomen hinchado, las alas extendidas dorso-lateralmente y elevadas por encima del abdomen, con una masa de hifas y conidióforos aglutinados emergiendo a través de las membranas intersegmentales del abdomen y el tórax (fig. 6c). Se observaron conidios primarios con una base plana, rodeada con un halo de mucílago, con punto apical prominente y papila basal amplia (fig. 6d), típicos del género Entomophthora (Keller y Dhoi, 2007), con 5 núcleos por conidio con un diámetro de 2.83 ± 0.32 µm (n = 40). El promedio de las dimensiones de los conidios primarios fue de 14.59 µm ± 0.73 × 11.9 µm ± 0.61 (n = 20) de largo por ancho respectivamente. No se obtuvieron aislados de este género.
Discusión
En México, se ha reportado a H. citriformis infectando a D. citri en la mayoría de las zonas citrícolas que incluyen Chiapas, Quintana Roo, San Luis Potosí, Tabasco, Veracruz, Yucatán (Pérez-González et al., 2015), Nuevo León y Tamaulipas (Casique-Valdes et al., 2011). Hirsutella citriformis se encontró en todos los huertos muestreados, por lo que fue el hongo con mayor incidencia y distribución en Colima. La presencia de insectos infectados se dio durante los 3 años de recolecta, aunque se observó una mayor abundancia de septiembre a febrero. Al respecto, Hall, Hentz et al. (2012) reportan mayor abundancia de psílidos micosados con H. citriformis en otoño e invierno y afirman que existe una correlación positiva entre la humedad relativa (HR) y la proporción de adultos infectados, cuando esta condición se mantiene estable por 7 días. La infección de H. citriformis sobre adultos es más común que en ninfas, durante la exploración se encontraron ninfas micosadas por el hongo en huertos de limón, en la localidad de Coalatilla en Armería. El desarrollo del hongo sobre las ninfas del psílido fue favorecido por un periodo de lluvias intensas que generaron condiciones de alta HR. Estas observaciones coinciden con lo reportado por Étienne et al. (2001), quienes encontraron a H. citriformis atacando ninfas y adultos en Guadeloupe, Francia durante periodos con lluvias intensas provocando una mortalidad de más de 80% de psílidos. Bajo condiciones similares, Álvarez et al. (2003), indican la infección del hongo sobre ninfas de PAC en Jovellanos, Matanzas, Cuba.
La morfometría de los conidios de H. citriformis es similar a la descrita por Mains (1951), Subandiyah et al. (2000), Álvarez et al. (2003), Meyer et al. (2007) y Toledo et al. (2013) (tabla 3); sin embargo, mostró mayores dimensiones conidiales que con otras cepas aisladas en México reportadas por Pérez-González et al. (2015). Estos autores afirman que los aislados de H. citriformis recolectados en México presentan variabilidad en las dimensiones de sus estructuras.
La presencia de I. javanica fue menos abundante, se ubicó únicamente en 2 huertos de limón en Tecomán, en el primero se encontró infectando ninfas, en el segundo sobre adultos. Isaria fumosorosea Wize ha sido asociada a D. citri en México (Casique-Valdés et al., 2015; Lezama-Gutiérrez et al., 2011) y en otros Países (Subandiyah et al., 2000). Las cepas de I. javanica obtenidas en nuestro estudio presentaron estructuras de mayor tamaño a las reportadas para la cepa DCP03 de I. fumosorosea cuyas dimensiones para las fiálides son de 4.7 × 1.9 µm y conidios de 2.9 × 1.4 µm (Subandiyah et al., 2000), pero similares a las cepas de I. javanica caracterizadas por Gallou et al. (2016).
Aunque B. bassiana es una especie que ocasiona infección sobre muchas especies de insectos (Zimmermann, 2007), su presencia fue baja. Lezama-Gutiérrez et al. (2011) encontraron ninfas y adultos de D. citri infectados con B. bassiana en Colima, mientras que en el presente estudio, solo se hallaron adultos infectados en un huerto de limón y en plantas de limonaria en los municipios de Armería y Tecomán. Igualmente se ha detectado la presencia de este hongo en el estado de Nayarit (Rodríguez-Palomera et al., 2012) en limón persa con bajos porcentajes de infección.
El género Simplicillium tiene parentesco con el género Lecanicillium, ambos géneros producen fiálides delgadas en forma de espina, conidios que se adhieren en cabezas viscosas mucilaginosas o formando cadenas. Simplicillium y Lecanicillium se pueden distinguir por la disposición de fiálides, el primero generalmente posee una disposición de fiálides solitarias con poca diferencia entre las hifas, mientras que este último tiene fiálides verticiladas. Los caracteres morfológicos del aislamiento CHE-CNRCB 373 coinciden con la descripción de S. lanosoniveum (Zare y Gams, 2001), en este género se incluyen aislados de diversos artrópodos, otros hongos y suelo (Bałazy et al., 2008; Nonaka et al., 2013; Zare y Gams, 2001). Se reporta por primera vez la presencia de S. lanosoniveum sobre D. citri.
Los Entomophthorales Batkoa sp. y Entomophthora sp. fueron detectados sobre ninfas y adultos de D. citri respectivamente, este es el primer reporte de Batkoa sp. asociado al PAC en Colima, México. Estos géneros se presentaron en los meses de diciembre a febrero cuando las condiciones ambientales son frescas por la mañana con presencia de rocío. Los 2 géneros fueron identificados solo morfológicamente ya que no fue posible su aislamiento. Las características morfométricas de Batkoa sp. se confirmaron considerando las dimensiones reportadas por Keller y Dhoi (2007) y para Entomophthora sp. la forma de campana del conidio primario, número de núcleos y las dimensiones concuerdan con la descripción de Keller (2007). Los conidios primarios (CP) y sus núcleos presentaron dimensiones similares a la espora de Entomophthora philippinensis Villacarlos y Wilding (CP: 11.5 – 20.5 × 9 – 18.5 μm; con 2 – 6 núcleos de 2 – 4.5 × 2 – 3.5 μm) reportado infectando al psílido de la leucaena, Heteropsylla cubana Crawford, en las Filipinas (Villacarlos y Wilding 1994), y más pequeños que los reportados sobre D. citri (CP: 16.6 × 22.7 μm) en Veracruz, México (Guízar-Guzmán y Sánchez-Peña, 2013). Los insectos infectados con Batkoa sp. se encontraron en un solo huerto, mientras que Entomophthora sp. estaba presente en huertos de los 3 municipios explorados encontrando pocos insectos infectados por huerto. En algunos de los casos los insectos que inicialmente fueron infectados por Entomophthora presentaron estructuras típicas del género Cladosporium, lo anterior se evidenció al encontrar insectos con estructuras de los 2 hongos, pero con los síntomas característicos de infección por Entomophthorales, al respecto Guízar-Guzmán y Sánchez-Peña (2013) afirman que el porcentaje de infección causado por Entomophthora es posiblemente subestimado por el rápido crecimiento de hongos secundarios. Los hongos del orden Entomophthorales asociados a D. citri reportados previamente en México son Zoophthora radicans (Brefeld) Batko para Colima (Lezama-Gutiérrez et al., 2011), el cual no fue encontrado en esta búsqueda y Entomophthora sp. en el estado de Veracruz (Guízar-Guzmán y Sánchez-Peña, 2013).
Considerando los resultados obtenidos y otros reportes de hongos asociados al PAC en México se cuenta con una gran diversidad de HE. La obtención de aislados de hongos patógenos presentes en las poblaciones de D. citri bajo determinadas condiciones ambientales, deben ser consideradas para generar tecnología que en un futuro permita incluir acciones adicionales para el manejo de la plaga como parte del programa de control biológico del PAC implementado por la DGSV. En condiciones naturales se observó a H. citriformis con un alto potencial infectivo sobre D. citri, lo que sugiere el desarrollo de técnicas para su reproducción masiva; además se requiere desarrollar estrategias para el uso de Entomophthorales con el fin de explotar su potencial como agentes de control de la plaga.
Agradecimientos
Al Dr. Richard A. Humber “Insect Mycologist and Curator” de la “ARSEF Collection of Entomopathogenic Fungal Cultures” por su apoyo en la identificación de los hongos del orden Entomophthorales. Al personal del Comité Estatal de Sanidad Vegetal del Estado de Colima, a los compañeros de los Departamentos de Hongos Entomopatógenos (DHE- CNRCB) y de Insectos Entomófagos (DIE-CNRCB) por los insectos recolectados en campo proporcionados a la CHE-CNRCB.
Referencias
Álvarez, J. F., Naranjo, M. O. F. y Grillo, R. H. (2003). Hongos entomopatógenos de Diaphorina citri Kirk. (Homoptera; Psillidae) en Jovellanos, Matanzas. Centro Agrícola, 30, 87.
Amer, O. E., Mahmound, M. A., El-Samawaty, A. M. A. y Sayed, R. M. (2011). Non liquid nitrogen-based-method for isolation of DNA from filamentous fungi. African Journal of Biotechnology, 10, 14337–14341.
Ayala-Zermeño, M. A., Gallou, A., Berlanga-Padilla, A. M., Serna-Domínguez, M. G., Arredondo-Bernal, H. C. y Montesinos-Matías, R. (2015). Characterisation of entomopathogenic fungi used in the biological control programme of Diaphorina citri in Mexico. Biocontrol Science and Technology, 25, 1192–1207.
Bałazy, S., Mietkiewski, R., Tkaczuk, C., Wegensteiner, R. y Wrzosek, M. (2008).Diversity of acaropathogenic fungi in Poland and other European countries. Experimental and Applied Acarology, 46, 53–70.
Bové, J. M. (2006). Huanglongbing: a destructive, newly-emerging, century-old disease of citrus. Journal of Plant Pathology, 88, 7–37.
Brlansky, R. H., Chung, K. R. y Rogers, M. E. (2006). Huanglongbing (Citrus Greening), En M. E. Rogers y L. W. Timmer (Eds.), Florida citrus pest management guide. (pp. 109–111). University of Florida, IFAS Extension. Recuperado el 08 de mayo, 2017 de: http://edis.ifas.ufl.edu/CG086
Cabanillas, H. E., de León, J. H., Humber, R. A., Murray, K. D. y Jones, W. A. (2013). Isaria poprawskii sp. nov. (Hypocreales: Cordycipitaceae), a new entomopathogenic fungus from Texas affecting sweet potato whitefly. Mycoscience, 54, 158–169.
Carbone, I. y Kohn, L. M. (1999). A method for designing primer sets for speciation studies in filamentous Ascomycetes. Mycologia, 9, 553–556.
Casique-Valdés, R., Reyes-Martínez, A. Y., Sánchez-Peña, S. R., Bidochka, M. J. y López-Arroyo, J. I. (2011). Pathogenicity of Hirsutella citriformis (Ascomycota: Cordycipitaceae) to Diaphorina citri (Hemiptera: Psyllidae) and Bactericera cockerelli (Hemiptera: Triozidae). Florida Entomologist, 94, 703–705.
Casique-Valdes, R., Sánchez-Lara, B., Ek-Maas, J., Hernández-Guerra, C., Bidochka, M., Guízar-Guzmán, L. et al. (2015). Field trial of aqueous and emulsion preparations of entomopathogenic fungi against the Asian citrus psyllid (Hemiptera: Liviidae) in a lime orchard in Mexico. Journal of Entomological Science, 50, 79–87.
Castlebury, L. A., Rossman, A. Y., Sung, G. H., Hyten, A. S. y Spatafora, J. W. (2004). Multigene phylogeny reveals new lineage for Stachybotrys chartarum, the indoor air fungus. Mycological Research, 108, 864–872.
Darriba, D., Taboada, G. L., Doallo, R. y Posada, D. (2012). jModelTest 2: more models, new heuristics and parallel computing. Nature Methods, 9, 772.
Edgar, R. C. (2004). MUSCLE: multiple sequence alignment with high accuracy and high throughput. Nucleic Acids Research, 32, 1792–1797.
Étienne, J., Quilici, S., Marival, D. y Franck, A. (2001). Biological control of Diaphorina citri (Hemiptera: Psyllidae) in Guadeloupe by imported Tamarixia radiata (Hymenoptera: Eulophidae). Fruits, 56, 307–315.
Gallou, A., Serna-Domínguez, M. G., Berlanga-Padilla, A. M., Ayala-Zermeño, M. A., Mellin-Rosas, M., Montesinos-Matías, R. et al. (2016). Species clarification of Isaria isolates used as biocontrol agents against Diaphorina citri (Hemiptera: Liviidae) in Mexico. Fungal Biology, 120, 414–423.
Goettel, M. S. e Inglis, D. (1997). Fungi: Hyphomycetes. En L. A. Lacey (Ed.), Manual of techniques in insect pathology (pp. 213–248). Londres: Academic Press.
Guízar-Guzmán, L. y Sánchez-Peña, S. R. (2013). Infection by Entomophthora sensu stricto (Entomophthoromycota: Entomophthorales) in Diaphorina citri (Hemiptera: Liviidae) in Veracruz, Mexico. Florida Entomologist, 96, 624–627.
Hall, D. G., Hentz, M. G., Meyer, J. M., Kriss, A. B., Gottwald, T. R. y Boucias, D. G. (2012). Observations on the entomopathogenic fungus Hirsutella citriformis attacking adult Diaphorina citri (Hemiptera: Psyllidae) in a managed citrus grove. Biocontrol, 57, 663–675.
Hall, D. G., Richardson, M. L., Ammar, E. D. y Halbert, S. E. (2012). Asian citrus psyllid, Diaphorina citri, vector of citrus huanglongbing disease. Mini review. Entomologia Experimentalis et Applicata, 146, 207–223.
Hall, T. A. (1999). BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT. Nucleic Acids Symposium Serie, 41, 95–98.
Hayek, A. E., Papierok, B. y Eilenberg, J. (2012). Methods for study of the entomophthorales. En L. A. Lacey (Ed.), Manual of techniques in insect pathology (pp. 285–314). Londres: Academic Press.
Hoy, M. A. (1998). Myths, models and mitigation of resistance to pesticides. Philosophical Transactions of the Royal Society of London Biological Sciences, 353, 1787–1795.
Humber, R. A. (2012). Identification of entomopathogenic fungi. En L. A. Lacey (Ed.), Manual of techniques in insect pathology (pp. 151–186). Londres: Academic Press.
Katoh, K., Misawa, K., Kuma, K. y Miyata, T. (2002). MAFFT: a novel method for rapid multiple sequence alignment based on fast Fourier transform. Nucleic Acids Research, 30, 3059–3066.
Keller, S. (2007). Systematics, taxonomy and identification. En S. Keller (Ed.), Arthropod-pathogenic Entomophthorales: biology, ecology, identification (pp. 110–132). Luxemburgo: COST Office.
Keller, S. y Dhoi, G. C. Y. (2007). Insect pathogenic Entomophthorales from Nepal and India. Mitteilungen der Schweizerischen Entomologischen Gesellschaft. Journal of the Swiss Entomological Society, 80, 211–215.
Keremane, M. L., Ramadugu, C., Castaneda, A., Díaz, J. E., Peñaranda, E. A., Chen, J. (2015). Report of Candidatus Liberibacter caribbeanus, a new citrus- and psyllid-associated Liberibacter from Colombia, South America. American Phytopathological Society (APS). Annual Meeting, August 1-5, Pasadena California, USA. Recuperado el 31 de mayo, 2017 de: http://www.apsnet.org/meetings/Documents/2015_meeting_abstracts/aps2015abO253.htm
Lezama-Gutiérrez, R., Galván-Gutiérrez, G., Contreras-Bermúdez, Y., Díaz-Flores, S., Reyes-Martínez, G., Barba-Reynoso, M. et al. (2011). Presencia natural y patogenicidad de los hongos Metarhizium anisopliae y Cordyceps bassiana (Ascomycetes) en ninfas y adultos de Diaphorina citri (Hemiptera: Psyllidae) en el estado de Colima. En M. Elías-Santos, K. Arévalo-Niño, I. Quintero-Zapata, C. Solís-Rojas, C. F Sandoval-Coronado, H. A. Luna-Olvera et al. (Eds.), Memorias del XXXIV Congreso Nacional de Control Biológico (pp. 90–96). 6-11 noviembre, Monterrey, Nuevo León, México.
Mains, E. B. (1951). Entomogenous species of Hirsutella, Tilachlidium and Synnematium. Mycologia, 43, 691–718.
Meyer, J. M., Hoy, M. A. y Boucias, D. G. (2007). Morphological and molecular characterization of a Hirsutella species infecting the Asian citrus psyllid, Diaphorina citri Kuwayama (Hemiptera: Psyllidae), in Florida. Journal of Invertebrate Pathology, 95, 101–109.
Nonaka, K., Kaifuchi, S., Omura, S. y Masumaa, R. (2013). Five new Simplicillium species (Cordycipitaceae) from soils in Tokyo, Japan. Mycoscience, 54, 42–53.
Pérez-González, O., Rodríguez-Villarreal R. A., López-Arroyo, J. I., Maldonado-Blanco, M. G. y Rodríguez-Guerra, R. (2015). Mexican strains of Hirsutella isolated from Diaphorina citri (Hemiptera: Liviidae): morphologic and molecular characterization. Florida Entomologist, 98, 111–120.
Quandt, C. A., Kepler, R. M., Gams, W., Araújo, J. P. M., Ban, S., Evans, H. C. et al. (2014). Phylogenetic-based nomenclatural proposals for Ophiocordycipitaceae (Hypocreales) with new combinations in Tolypocladium. IMA fungus, 5, 121–134.
Qureshi, J. A., Kostyk, B. y Stansly, P. A. (2009). Control of Diaphorina citri (Hemiptera: Psyllidae) with foliar and soil-applied insecticides. Proceedings of the Florida State Horticultural Society, 122, 189–193.
Rambaut, A. (2014). FigTree v1.4.2: tree figure drawing tool, disponible en: http://tree.bio.ed.ac.uk/software/figtree/
Rehner, S. A. y Buckley, E. (2005). A Beauveria phylogeny inferred from nuclear ITS and EF1-α sequences: evidence for cryptic diversification and links to Cordyceps teleomorphs. Mycologia, 97, 84–98.
Rehner, S. A., Minnis, A. M., Sung, G., Luangsa-ard, J. J., Devotto, L. y Humber, R. A. (2011). Phylogeny and systematics of the anamorphic, entomopathogenic genus Beauveria. Mycologia, 103, 1055–1073.
Rehner, S. A., Posada, F., Buckley, E. P., Infante, F., Castillo, A. y Vega, F. E. (2006). Phylogenetic origins of African and Neotropical Beauveria bassiana pathogens of the coffee berry borer, Hypothenemus hampei. Journal of Invertebrate Pathology, 93, 11–21.
Rivero-Aragón, A. y Grillo-Ravelo, H. (2000). Natural enemies of Diaphorina citri Kuwayama (Homoptera: Psyllidae) in the central region of Cuba. Centro-Agrícola, 27, 87–88.
Rodríguez-Palomera, M., Cambero-Campos, J., Robles-Bermúdez, A., Carvajal-Cazola, C. y Estrada-Virgen, O. (2012). Natural enemies associated to Diaphorina citri Kuwayama (Hemiptera: Psyllidae) in Citrus latifolia Tanaka, in the state of Nayarit, Mexico. Acta Zoológica Mexicana (n.s), 28, 625–629.
Ronquist, F. y Huelsenbeck, J. P. (2003). MrBayes version 3.0: Bayesian phylogenetic inference under mixed models. Bioinformatics, 19, 1572–1574.
Samson, R. A. (1974). Paecilomyces and some allied Hyphomycetes. Studies in Mycology, 6, 1–119.
Sánchez-González, J. A., Mellín-Rosas, M. A., Arredondo-Bernal, H. C., Vizcarra-Valdez, N. I., González-Hernández A. y Montesinos-Matías, R. (2015). Psílido asiático de los cítricos Diaphorina citri (Hemiptera: Psyllidae). En H. C. Arredondo-Bernal y L. A. Rodríguez-del Bosque (Eds.), Casos de control biológico en México. (pp. 339–372). México D.F.: bba, Colegio de Posgraduados.
Subandiyah, S., Nlkoh, N., Sato, H., Wagiman, F., Tsyuymyu, S. y Fukatsu, T. (2000). Isolation and characterization of two entomopathogenic fungi attacking Diaphorina citri (Homoptera: Psylloidea) in Indonesia. Mycoscience, 41, 509–513.
Tamura, K., Stecher, G., Peterson, D., Filipski, A. y Kumar, S. (2013). MEGA6: Molecular evolutionary genetics analysis version 6.0. Molecular Biology and Evolution, 30, 2725–2729.
Toledo, A. V., Simurro, M. E. y Balatti, P. A. (2013). Morphological and molecular characterization of a fungus, Hirsutella sp., isolated from planthoppers and psocids in Argentina. Journal of Insect Science, 13, 1–11.
Villacarlos, L. y Wilding, N. (1994). Four new species of Entomophthorales infecting the leucaena psyllid Heteropsylla cubana in the Philippines. Mycological Research, 98, 53–164.
White, T. J., Bruns, T., Lee, S. y Taylor, J. W. (1990). Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. En M. A. Innis, D. H. Gelfand, J. J. Sninsky y T. J. White (Eds.). PCR Protocols: a guide to methods and applications (pp. 315–322). Nueva York: Academic Press, Inc.
Xie, P. H., Su, C. y Lin, Z. G. (1988). A preliminary study on an entomogenous fungus (Verticillium lecanii) of Diaphorina citri Kuwayama (Hom:Psyllidae). Chinese Journal of Biological Control, 4, 92.
Yang, Y., Huang, M., Beattie, G., Xia, Y., Ouyang, G. y Xiong, J. (2006). Distribution, biology, ecology and control of the psyllid Diaphorina citri Kuwayama, a major pest of citrus: a status report for China. International Journal of Pest Management, 52, 343–352.
Zare, R. y Gams, W. (2001). A revision of Verticillium section Prostrata. IV. The genera Lecanicillium and Simplicillium gen. nov. Nova Hedwigia, 73, l–50.
Zimmermann, G. (2007). Review on safety of the entomopathogenic fungi Beauveria bassiana and Beauveria brongniartii. Biocontrol Science and Technology, 17, 553–596.



