Diversidad de hormigas epigeas en cultivos de nopal tunero (Opuntia albicarpa) y matorrales de Opuntia spp. del estado de Hidalgo, México
Edel Gómez-Otamendi a, Yessica Ortiz-Arteaga a, Eva Samanta Ávila-Gómez a, Gibrán Pérez- Toledob , Jorge Valenzuela b y Claudia E. Moreno a, *
a Centro de Investigaciones Biológicas, Instituto de Ciencias Básicas e Ingeniería, Universidad Autónoma del Estado de Hidalgo, Carretera Pachuca-Tulancingo km 4.5, Col. Carboneras, 42184, Mineral de la Reforma, Hidalgo, México
b Red de Ecología Funcional, Instituto de Ecología, A.C., Carretera Antigua a Coatepec 351, El Haya, 91070 Xalapa, Veracruz, México
*Autor para correspondencia: cmoreno@uaeh.edu.mx (C. E. Moreno)
Resumen
Para equilibrar la conservación de la biodiversidad y las necesidades alimentarias humanas, es crucial reconocer paisajes agrícolas que puedan mantener la diversidad biológica local. En el Altiplano Mexicano los cultivos de nopal tunero (Opuntia albicarpa Scheinvar) son agroecosistemas perennes con estructura vegetal compleja, pero poco se sabe de su papel en el mantenimiento de la biodiversidad del ecosistema nativo (matorral xerófilo dominado por Opuntia spp.). El objetivo de este trabajo fue comparar la riqueza, abundancia, diversidad y composición de especies de hormigas epigeas (Formicidae) entre nopaleras naturales y cultivos de nopal, así como detectar posibles especies indicadoras de estos hábitats. Con trampas de caída se recolectaron 12,839 hormigas de 25 especies, 17 géneros y 6 subfamilias. No se detectaron diferencias significativas en la riqueza de especies acumulada, ni en la abundancia, riqueza o diversidad promedio entre las nopaleras naturales y los cultivos de nopal. Tampoco se detectó una diferencia significativa en la composición de especies entre sitios de nopaleras naturales y cultivos de nopal. Estos resultados indican que los cultivos de nopal podrían considerarse como reservorios de la diversidad de hormigas, pues contribuyen a mantener la homogeneidad biótica regional del matorral xerófilo.
Palabras clave:
Agroecosistemas; Ecología de comunidades de hormigas; Especies indicadoras; Formicidae; Nopaleras; Reservorios de biodiversidad
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Ground-dwelling ant diversity in cactus pear crops (Opuntia albicarpa) and Opuntia spp. scrublands in the state of Hidalgo, Mexico
Abstract
To achieve equilibrium between biodiversity conservation and human food requirements, we must recognize agricultural landscapes that maintain local biological diversity. In the Mexican High Plateau, cactus pear crops (Opuntia albicarpa Scheinvar) are perennial agroecosystems with complex vegetation structure, but little is known about their role in maintaining the biodiversity of the native ecosystem (xerophilous scrubland dominated by Opuntia spp). Our objective was to compare ground-dwelling ant (Formicidae) species richness, abundance, diversity and composition between natural Opuntia scrubland and cactus pear crops in the state of Hidalgo, Mexico, as well as to detect possible ant indicator species of these habitats. Using pitfall traps we collected 12,839 ants of 25 species, 17 genera and 6 subfamilies. We did not find significant differences in cumulative species richness, nor in mean abundance, richness or diversity between natural scrublands and cactus crops. Neither a significant difference was found in species composition between natural scrublands and cactus crops sites. Our results indicate that cactus pear crops may be considered as reservoirs of ant diversity, given their role in maintaining the regional biotic homogeneity of the xerophilous scrubland.
Keywords:
Agroecosystems; Ant community ecology; Indicator species; Formicidae; Prickly pear cactus; Biodiversity reservoirs
Introducción
Los cambios en el uso de suelo derivados de las actividades humanas son una de las principales causas de que más del 58% de la superficie terrestre presente un empobrecimiento importante en su biodiversidad, medida como la proporción promedio de biodiversidad remanente en ecosistemas locales (Newbold et al., 2016). Esta pérdida de la biodiversidad está asociada directa o indirectamente con una disminución en la provisión de servicios ambientales que repercuten en el bienestar humano (Millennium Ecosystem Assessment, 2005). Por ello, es necesario proteger la biodiversidad subsistente en el contexto global de una creciente población humana, que requiere continuar incrementado su producción de alimentos de forma cada vez más eficiente (Crist et al., 2017). Ante este ineludible reto, una de las líneas a seguir es evaluar la capacidad de los paisajes agrícolas para conservar y promover la biodiversidad (Johnson et al., 2017). Los agroecosistemas pueden tener una composición de especies cada vez más diferente, o más similar, a la de los ecosistemas nativos, lo que genera heterogeneidad u homogeneidad biótica en la región (Solar et al., 2015). La homogeneidad biótica entre los agroecosistemas y los ecosistemas nativos indica que el manejo humano permite la conservación de la diversidad regional, por el contrario, la heterogeneidad biótica entre estos ambientes ocurre por la pérdida de especies, o por la presencia de especies invasoras. Por ello, el conocimiento sobre los cambios en la riqueza, diversidad y composición de especies entre áreas de uso agrícola y ecosistemas nativos es esencial para la protección de la biodiversidad regional y el manejo ambiental sostenible de los sistemas agrícolas (Bush et al., 2016; Socolar et al., 2016).
En el territorio mexicano, cerca del 34% de la superficie terrestre está dedicada a actividades agrícolas y ganaderas (Velázquez et al., 2005), pero poca atención se ha dado al potencial de los sistemas agrícolas como sitios de conservación de la biodiversidad. Por ejemplo, se ha estudiado el papel de algunos agroecosistemas tropicales como sistemas de milpa (e.g., Mateos-Maces et al., 2016), sistemas agroforestales (e.g., Campos-Salas et al., 2016) y plantaciones de café bajo sombra (e.g., González-Zamora et al., 2016) como reservorios de la biodiversidad regional. En las zonas áridas y semiáridas de matorral xerófilo en el Altiplano Central de México uno de los principales cultivos es el de nopal (Opuntia spp., Cactaceae). Las plantaciones comerciales de nopal son agroecosistemas perennes que utilizan distintas variedades nativas domesticadas del género Opuntia, principalmente para la producción de fruta (tuna), nopal verdura y como forraje para el ganado (Financiera Rural, 2011). Sin embargo, a pesar de su importancia económica, son aún pocos los trabajos acerca del potencial de los cultivos de nopal para la conservación de la biodiversidad (Riojas-López y Mellink, 2005). En el estado de Jalisco se ha visto que los agroecosistemas de nopal pueden formar estructuras complejas de hábitats por los estratos de la vegetación, que contribuyen a mantener la biodiversidad y los servicios ecosistémicos (Riojas-López, 2006, 2012; Riojas-López y Mellink, 2005).
Las hormigas (Hymenoptera: Formicidae) se han considerado como un buen grupo indicador para evaluar los cambios ambientales derivados de las actividades humanas, tales como cambios en el uso del suelo por agricultura (e.g., Andersen et al., 2002). Son un grupo diverso, tanto taxonómica como funcionalmente, y son abundantes en casi todos los ecosistemas y hábitats. En México la fauna de hormigas incluye 973 especies, y las subfamilias más diversas son Myrmicinae y Formicinae, que agrupan el 51 y 20% de la diversidad de especies, respectivamente (Ríos-Casanova, 2014). Entre las ventajas del grupo como indicador del impacto de prácticas agrícolas están su elevada biomasa, su sensibilidad a distintas alteraciones ambientales y la variedad de funciones que realizan en los ecosistemas (Andersen et al., 2002). Estas características hacen que las comunidades de hormigas sean sensibles a los cambios ambientales que reducen la complejidad del hábitat (Perfecto y Snelling, 1995), pues a mayor complejidad estructural en la vegetación, hay una mayor variación microambiental que favorece la riqueza de especies de hormigas (Hernández-Ruiz y Castaño-Meneses, 2006).
En la zona árida del valle del Mezquital, en el estado de Hidalgo, los sistemas agrícolas con bajo nivel de disturbio y buena calidad de agua de riego albergan mayor riqueza y abundancia de hormigas que los sistemas agrícolas irrigados con aguas residuales, y se han identificado los géneros Tapinoma y Odontomachus como bioindicadores de poco disturbio en estos agroecosistemas (Hernández-Ruiz y Castaño-Meneses, 2006). Sin embargo, cuando las prácticas agrícolas se vuelven intensivas, pueden depauperar la diversidad y composición de las comunidades de hormigas (Asfiya et al., 2015; de Castro-Solar et al., 2016; Hernández-Ruiz y Castaño-Meneses, 2006; Perfecto y Vandermeer, 2002). Por ello, se deben mantener remanentes de vegetación natural, aunque sean pequeños, pues pueden tener un potencial importante para el mantenimiento de la diversidad de hormigas en paisajes agrícolas (de Castro-Solar et al., 2016; Gray et al., 2015; Pacheco et al., 2013).
Este trabajo tiene como objetivos: 1) comparar la riqueza, abundancia, diversidad y composición de especies epigeas de hormigas entre zonas de matorral xerófilo dominado por Opuntia spp. (de aquí en adelante, nopaleras naturales) y cultivos de nopal tunero (Opuntia albicarpa Scheinvar); 2) detectar posibles especies indicadoras en cada tipo de vegetación y 3) evaluar la influencia de algunas variables del hábitat (volumen de las plantas de nopal, complejidad vertical de la vegetación, número de flores y frutos de nopal), en la riqueza, abundancia y diversidad de las comunidades de hormigas. En el género Opuntia se ha registrado una asociación mutualista con las hormigas que visitan los nectarios extraflorales y brindan protección antiherbívoros y depredadores de semillas, lo que repercute en un incremento del 50% en el éxito reproductivo de la planta, representado por el número de frutos producidos (Oliveira et al., 1999). Sin embargo, no todas las especies de Opuntia tienen nectarios extraflorales y el mutualismo con hormigas es facultativo (Miller, 2007). El estado de Hidalgo es uno de los centros de producción de tuna más importantes en el país (Jolalpa-Barrera et al., 2011), y es el tercer estado con el mayor número de géneros y especies de hormigas (57 y 229 respectivamente), solo por detrás de Veracruz y Chiapas (Ríos-Casanova, 2014), aunque estos números pueden ser menores debido a las sinonimias que se han presentado en los últimos años (Vásquez-Bolaños, 2015). Por ello, se espera encontrar una alta riqueza y diversidad de hormigas tanto en las nopaleras naturales como en los cultivos, y considerando que los cultivos de nopal pueden proveer un hábitat similar al de las nopaleras naturales, predecimos que su composición de especies será similar , lo que contribuiría a mantener la homogeneidad biótica en la región.
Materiales y métodos
El área de estudio se ubica en la región del Altiplano en el estado de Hidalgo, la cual se constituye de amplios valles seccionados por cadenas montañosas volcánicas (Morrone, 2001). La vegetación dominante es matorral xerófilo y el clima es semiseco templado, con precipitación anual promedio de 350.80 mm y temperatura promedio de 17.15 °C (Inegi, 2010). La zona de estudio incluyó los municipios de Actopan, Singuilucan, Pachuca, Zempoala, Epazoyucan y Mineral de la Reforma, todos ellos con suelos de origen volcánico (Inegi, 2010). Los cultivos de nopal estudiados pertenecen a la variedad de tuna blanca de la especie Opuntia albicarpa Scheinvar cv. “Reyna”, registrada como NOP-020-221104 en el Catálogo Nacional de Variedades Vegetales de la Sagarpa. En los sitios de nopaleras naturales se identificaron 4 especies: Opuntia streptacantha, O. heliabravoana, O. spinulifera y O. robusta.
El muestreo se realizó en 13 sitios: 8 cultivos de nopal tunero y 5 nopaleras naturales. Los sitios se ubicaron a una distancia mínima de 1 km entre ellos. Los muestreos se realizaron una vez al mes en cada sitio, durante 4 meses (entre mayo y agosto del 2014). En cada muestreo se utilizaron 9 trampas de caída por sitio, separadas 100 metros, las cuales consistieron en recipientes de 20 cm de altura y 10 cm de diámetro, llenos a un 20 % de su capacidad con una mezcla de alcohol al 70%, etilenglicol para evitar la evaporación y jabón para romper la tensión superficial, sin ningún cebo como atrayente. Las trampas fueron enterradas a nivel del suelo y permanecieron abiertas por 48 horas. Cada muestra fue almacenada en etanol al 70% para su posterior montaje en seco. La recolecta de ejemplares se realizó con el permiso Semarnat-FAUT 0254. La identificación se llevó a cabo con las claves de Cuezzo y Guerrero (2012), Mackay y Mackay (2005), MacGown et al. (2014) y Snelling y Snelling (2007), y con la base de datos AntWeb (The California Academy of Sciences, 2012). Ejemplares de referencia se depositaron en la colección entomológica del Instituto de Ecología, A.C. (IEXA; Reg. SEMARNAT: Ver. IN.048.0198).
Se midieron 4 características del hábitat: volumen de las plantas, complejidad vertical, número de flores y número de frutos, tanto en los cultivos como en las nopaleras naturales, para explorar su relación con los atributos de las comunidades de hormigas. A continuación se describe brevemente la metodología realizada para estas 4 características del hábitat, pero una descripción más amplia de los 2 tipos de hábitat se incluye en el Material Suplementario. El volumen (ancho × largo × altura) se midió en 9 plantas de nopal de cada sitio, separadas por una distancia de al menos 100 m. La complejidad vertical se refiere a la densidad vertical de la vegetación a diferentes alturas, la cual se estimó utilizando una barra de 2 m x 10 cm con rayas blancas y negras de 10 cm de ancho. La barra se colocó a 50 m del centro de cada sitio de muestreo, perpendicularmente a las plantas de nopal. Desde el punto central se estimó el porcentaje de rayas que eran visibles para un observador. Se utilizó el inverso de este porcentaje como el índice de la cubierta vertical (Griffith y Youtie, 1988) y se usó el promedio obtenido de 10 medidas hechas a lo largo de 2 transectos de 100 m de longitud en cada sitio. Los números de flores y de frutos (tunas) se contaron en 2 trayectos lineales en banda (100 × 1 m), desde el centro de cada uno de los sitios (Gardner, 1998; Rich et al., 2005).
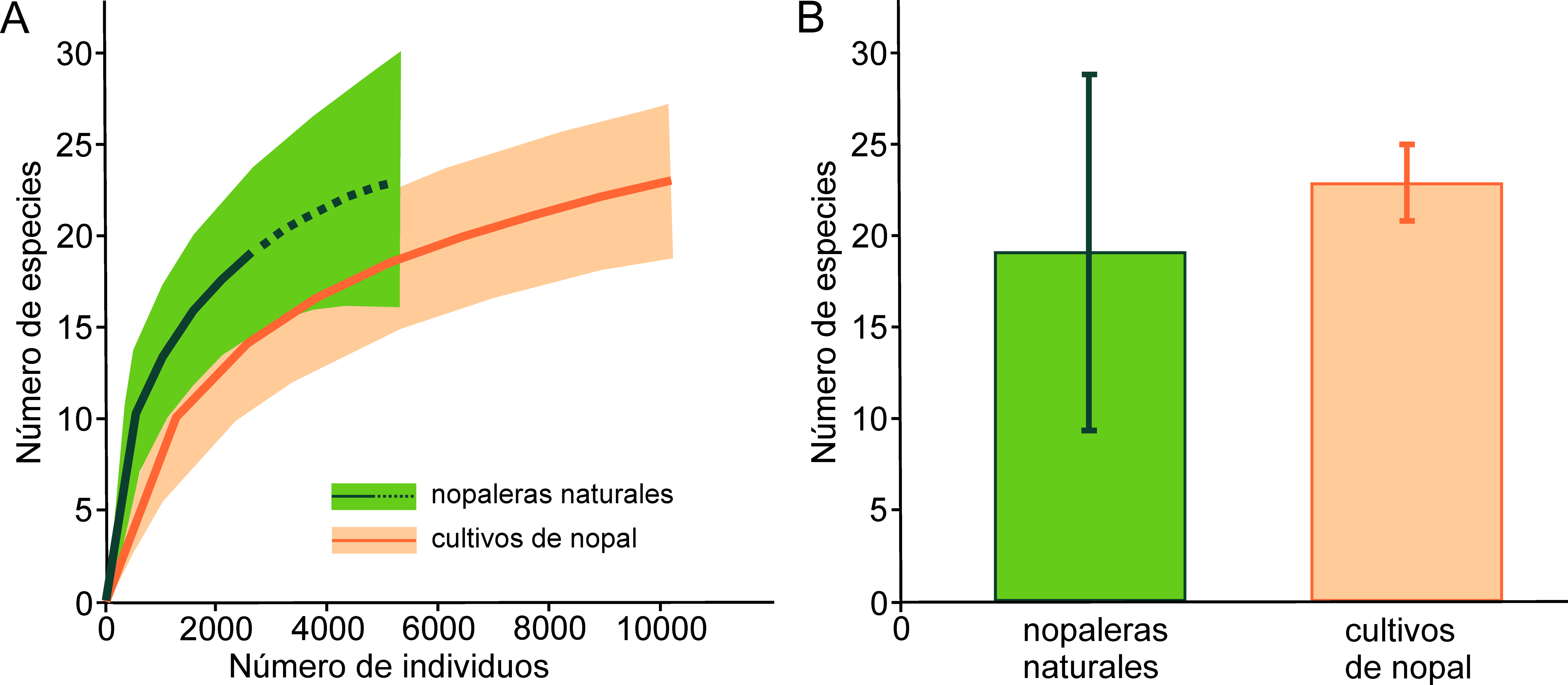
Para comparar la riqueza de especies acumulada entre las nopaleras naturales y los cultivos, se realizaron curvas de acumulación de especies y se calcularon intervalos de confianza al 95%. Debido a que en las nopaleras naturales el número de individuos fue bajo, se realizó una extrapolación de la riqueza de especies para predecir la curva de acumulación al doble del número de individuos encontrados. Además, se calculó el estimador de riqueza Chao1 para predecir la riqueza máxima y evaluar qué tan completos fueron los inventarios. Las curvas de acumulación y el estimador Chao1 se obtuvieron con el programa EstimateS 9.1.0. (Colwell, 2013). Considerando la amplia diferencia en el número de individuos capturados entre ambientes, se comparó la riqueza total de especies estandarizando a un mismo esfuerzo de muestreo (medido como cobertura de la muestra, i.e., la proporción que representan los individuos de cada especie en la muestra, con respecto al número total de individuos), en lugar de un mismo número de individuos como se hace en la rarefacción tradicional (Chao y Jost, 2012; López-Mejía et al., 2017). Esta estandarización por cobertura de la muestra, y sus intervalos de confianza al 95%, se obtuvieron en el programa iNEXT (Hsieh et al., 2013).
Se comparó el promedio por sitio de la abundancia (número de individuos), la riqueza y la diversidad de especies entre las nopaleras naturales y los cultivos. La diversidad se midió con el exponencial del índice de Shannon, que corresponde a la serie de números de Hill cuando el parámetro q = 1, y cuyas unidades son números de especies efectivas (Jost, 2006). Para las comparaciones se utilizaron pruebas de t, verificando previamente la normalidad de los datos con pruebas de Kolmogorov-Smirnov (p > 0.05) en el programa SigmaStat 3.5 (Systat Software, 2006).
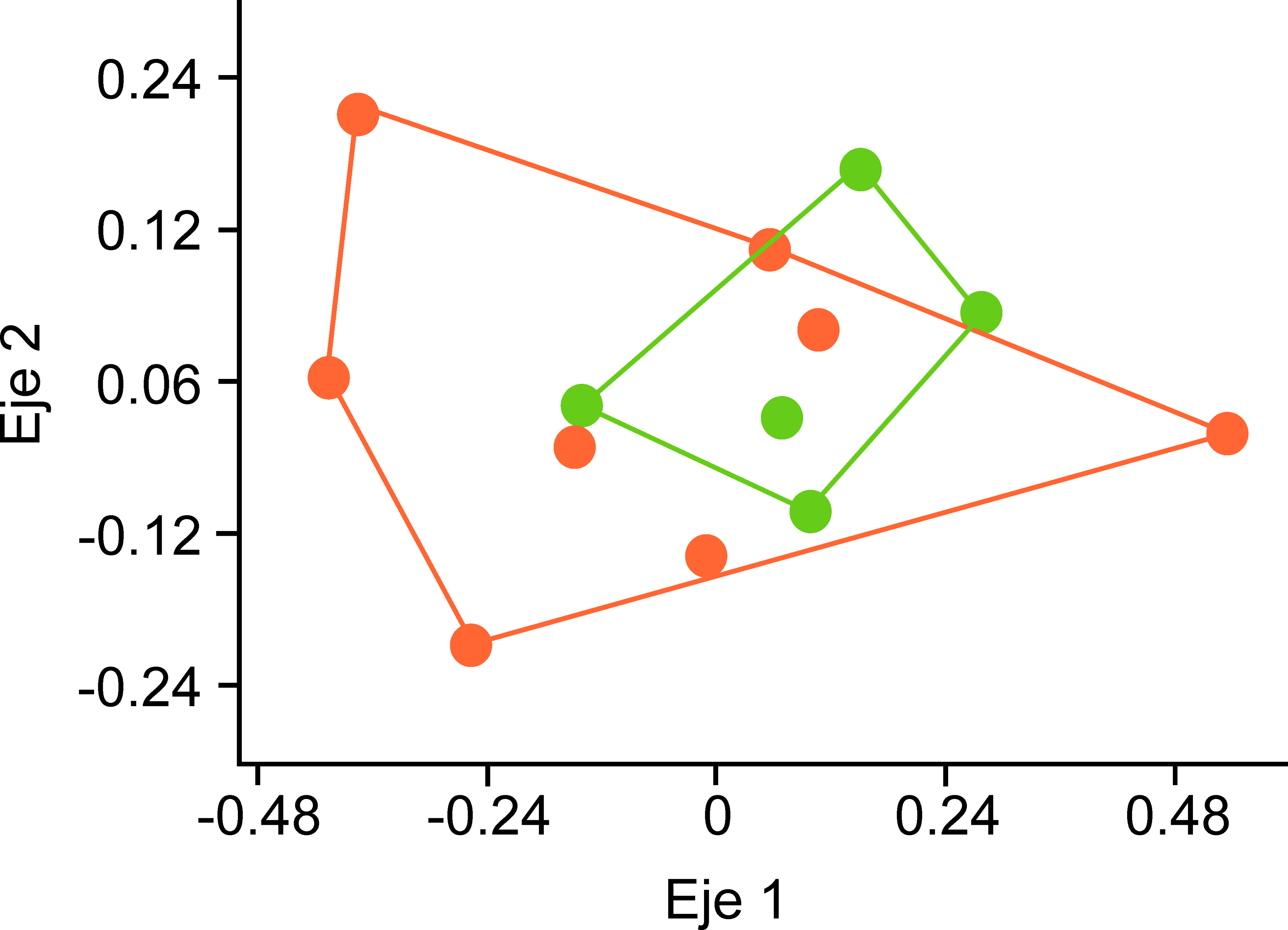
Para comparar la composición de especies entre sitios de nopaleras naturales y de cultivos de nopal, se realizó un análisis de ordenación no paramétrico multidimensional (NMDS) con el índice de Bray-Curtis. Este análisis permite ubicar la posición relativa de sitios de muestreo en un espacio de 2 dimensiones, de forma que la distancia entre los sitios es un reflejo de la disimilitud en su composición de especies. Posteriormente, para evaluar las diferencias estadísticas en la composición entre las nopaleras naturales y nopaleras cultivadas se realizó un análisis de similitud (Anosim). El Anosim es análogo a un Anova y se basa en el parámetro R, que mide la variación en la disimilitud de especies (1-índice de Bray-Curtis) entre grupos de sitios y la compara con la variación dentro de los grupos. En este trabajo, la hipótesis nula (un valor de R cercano a cero) es que no hay diferencias estadísticas en la composición de especies entre nopaleras naturales y cultivos de nopal. Tanto el NMDS como el Anosim se realizaron en el programa PC-ORD (McCune y Mefford, 1999).
Para la identificación de especies indicadoras de cada tipo de hábitat se calculó el índice de valor indicador (IndVal) propuesto por Dufrêne y Legendre (1997). Este índice se basa en la abundancia y la frecuencia relativa de cada especie en cada tipo de hábitat, y su valor (que va de 0 a 100) se compara con el valor esperado de una prueba de aleatorización de Monte Carlo para probar su significación estadística (α = 0.05). Para cada especie, el IndVal y su valor P, se calcularon en el programa PC-ORD (McCune y Mefford, 1999).
Finalmente, para evaluar la influencia de las variables del hábitat en las comunidades de hormigas se usaron modelos lineares generalizados (GLM) simples tomando el volumen de las plantas, la complejidad vertical, el número de flores y el número de frutos como variables explicativas; la riqueza, abundancia, y diversidad de hormigas se consideraron como variables de respuesta. Se usó la distribución Poisson para la riqueza por ser una variable discreta (conteos), la distribución binomial para la abundancia con el fin controlar la sobredispersión de los datos en una variable discreta, y la distribución gaussiana para la diversidad porque los datos son normales (Crawley, 2007). Los GLM se realizaron en el programa R 3.3.2 (R Development Core Team, 2016).
Resultados
Se recolectaron en total 12,839 hormigas (2,643 en nopaleras naturales y 10,196 en cultivos de nopal), pertenecientes a 25 especies de 17 géneros y 6 subfamilias (tabla 1). Pogonomyrmex barbatus (Myrmicinae) fue la especie más abundante en ambos hábitats. En las nopaleras naturales se registraron 19 especies, lo cual representa el 97.56 de la riqueza estimada, mientras que en los cultivos de nopal se observaron 23 especies y el estimador Chao1 proporcionó el mismo número, por lo que el inventario está 100% completo de acuerdo a este estimador. Al extrapolar la curva de acumulación de especies de las nopaleras naturales, se observa que la riqueza no es distinta de la de cultivos (fig. 1A). Además, al estandarizar ambos ambientes a un mismo esfuerzo de muestreo (cobertura de la muestra 1.00) la riqueza no difiere estadísticamente pues la extrapolación de las nopaleras naturales genera intervalos de confianza muy amplios (fig. 1B). Tampoco hubo diferencias significativas en la riqueza (t < 0.01, g.l. 11, p = 1.00), abundancia (t = 0.91, g.l. = 11, p = 0.38) y la diversidad (t = -0.17, g.l. = 11, p = 0.86) promedio de los sitios entre nopaleras naturales y cultivos de nopal (fig. 2). Cabe resaltar que la abundancia promedio es mucho menor en las nopaleras naturales, pero entre los sitios de cultivos presenta mucha mayor dispersión.
Tabla 1
Número de individuos de hormigas epigeas capturadas en 8 cultivos de nopal tunero (Opuntia albicarpa) y 5 nopaleras naturales (matorral xerófilo dominado por Opuntia spp.) del Altiplano Central en el estado de Hidalgo, México.
|
Cultivos de nopal tunero |
Nopaleras naturales |
||||||||||||||
|
Subfamilias y especies |
C1 |
C2 |
C3 |
C4 |
C5 |
C6 |
C7 |
C8 |
Total cultivos |
N1 |
N2 |
N3 |
N4 |
N5 |
Total nopaleras |
|
Dolichoderinae |
|||||||||||||||
|
Dorymyrmex insanus (Buckley, 1866) |
54 |
8 |
93 |
29 |
554 |
55 |
196 |
176 |
1,165 |
0 |
53 |
323 |
67 |
0 |
443 |
|
Dorymyrmex sp. |
0 |
0 |
0 |
0 |
0 |
4 |
86 |
9 |
99 |
0 |
0 |
3 |
0 |
0 |
3 |
|
Forelius pruinosus(Roger, 1863) |
0 |
0 |
0 |
3 |
0 |
0 |
0 |
0 |
3 |
0 |
0 |
0 |
4 |
0 |
4 |
|
Linepithema dispertitum (Forel, 1885) |
0 |
0 |
0 |
3 |
0 |
0 |
0 |
0 |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Liometopum apiculatum Mayr, 1870 |
0 |
0 |
0 |
0 |
5 |
3 |
0 |
0 |
8 |
0 |
2 |
0 |
0 |
9 |
11 |
|
Tapinoma sessile (Say, 1836) |
0 |
0 |
0 |
0 |
4 |
3 |
0 |
3 |
10 |
0 |
0 |
0 |
2 |
0 |
2 |
|
Ecitoninae |
|||||||||||||||
|
Neivamyrmex asper Borgmeier, 1955 |
0 |
0 |
0 |
0 |
0 |
3 |
0 |
0 |
3 |
20 |
0 |
0 |
0 |
0 |
20 |
|
Formicinae |
|||||||||||||||
|
Camponotus aff. curviscapus |
0 |
0 |
0 |
0 |
0 |
2 |
0 |
78 |
80 |
0 |
4 |
0 |
8 |
0 |
12 |
|
Camponotus andrei Forel, 1885 |
0 |
0 |
0 |
2 |
6 |
11 |
29 |
1 |
49 |
12 |
99 |
32 |
10 |
28 |
181 |
|
Camponotus pellarius Wheeler, 1914 |
0 |
0 |
0 |
9 |
0 |
0 |
0 |
0 |
9 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Camponotus picipes (Olivier, 1792) |
0 |
29 |
3 |
3 |
41 |
16 |
3 |
0 |
95 |
44 |
13 |
16 |
3 |
10 |
86 |
|
Camponotus pudorosus Emery, 1925 |
0 |
1 |
135 |
1 |
1 |
1 |
0 |
0 |
139 |
13 |
10 |
64 |
5 |
2 |
94 |
|
Formica sp. |
0 |
0 |
0 |
8 |
0 |
0 |
1 |
0 |
9 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Lasius californicus Wheeler, 1917 |
0 |
0 |
0 |
8 |
0 |
0 |
0 |
0 |
8 |
2 |
0 |
0 |
0 |
0 |
2 |
|
Myrmecocystus melanoticus Wheeler, 1914 |
0 |
0 |
0 |
0 |
0 |
0 |
13 |
0 |
13 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Myrmecocystus melliger Forel, 1886 |
0 |
0 |
92 |
222 |
191 |
1 |
28 |
0 |
534 |
0 |
3 |
6 |
1 |
0 |
10 |
|
Myrmecocystus mexicanus Wesmael, 1838 |
0 |
0 |
0 |
0 |
2 |
0 |
45 |
0 |
47 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Myrmicinae |
|||||||||||||||
|
Leptothorax sp. |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Monomorium minimum (Buckley, 1866) |
0 |
0 |
13 |
1 |
0 |
4 |
14 |
1 |
33 |
8 |
28 |
0 |
2 |
0 |
38 |
|
Pheidole centeotl Wheeler, 1914 |
19 |
0 |
2 |
0 |
46 |
66 |
48 |
12 |
193 |
0 |
73 |
30 |
3 |
0 |
106 |
|
Pheidole obtusospinosa Pergande, 1896 |
19 |
53 |
48 |
4,401 |
92 |
148 |
23 |
122 |
4,906 |
18 |
6 |
27 |
66 |
14 |
131 |
|
Pogonomyrmex barbatus (Smith, 1858) |
2 |
0 |
121 |
730 |
201 |
57 |
212 |
1,435 |
2,758 |
1 |
381 |
485 |
66 |
552 |
1,485 |
|
Temnothorax sp. |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
0 |
2 |
|
Ponerinae |
|||||||||||||||
|
Odontomachus clarus Wheeler, 1915 |
0 |
0 |
1 |
27 |
0 |
2 |
1 |
0 |
31 |
0 |
10 |
2 |
0 |
0 |
12 |
|
Pseudomyrmecinae |
|||||||||||||||
|
Pseudomyrmex gracilis (Fabricius, 1804) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
1 |
Diecisiete especies de hormigas (68%) se comparten en ambos hábitats, pero Camponotus pellarius, Formica sp., Myrmecocystus melanoticus, M. mexicanus y Leptothorax sp. se encontraron únicamente en las nopaleras cultivadas, mientras que Pseudomyrmex mexicanus y Temnothorax sp. sólo en las nopaleras naturales (tabla 1). La disimilitud promedio entre pares de sitios fue de 0.73, con la mayor disimilitud (0.99) entre 2 sitios de cultivos y la menor (0.33) entre un sitio de cultivo y una nopalera natural. En el NMDS no se separan los sitios de diferentes ambientes por su composición de especies (fig. 3), y el análisis de disimilitud mostró que no hay diferencias significativas en la composición de especies de hormigas entre las nopaleras naturales y los cultivos de nopal (Anosim R = -0.003, p = 0.53).
Se encontraron únicamente 3 especies con valor indicador significativo (p < 0.05) para cultivos de nopal tunero: Dorymyrmex sp. (IndVal = 58.9), Liometopum apiculatum (IndVal = 55.9) y Tapinoma sessile (IndVal = 53.3). Por otro lado, en las nopaleras naturales Camponotus pudorosus y Pheidole obtusospinosa tuvieron valores de IndVal altos, aunque dichos valores no fueron significativos (tabla 2).
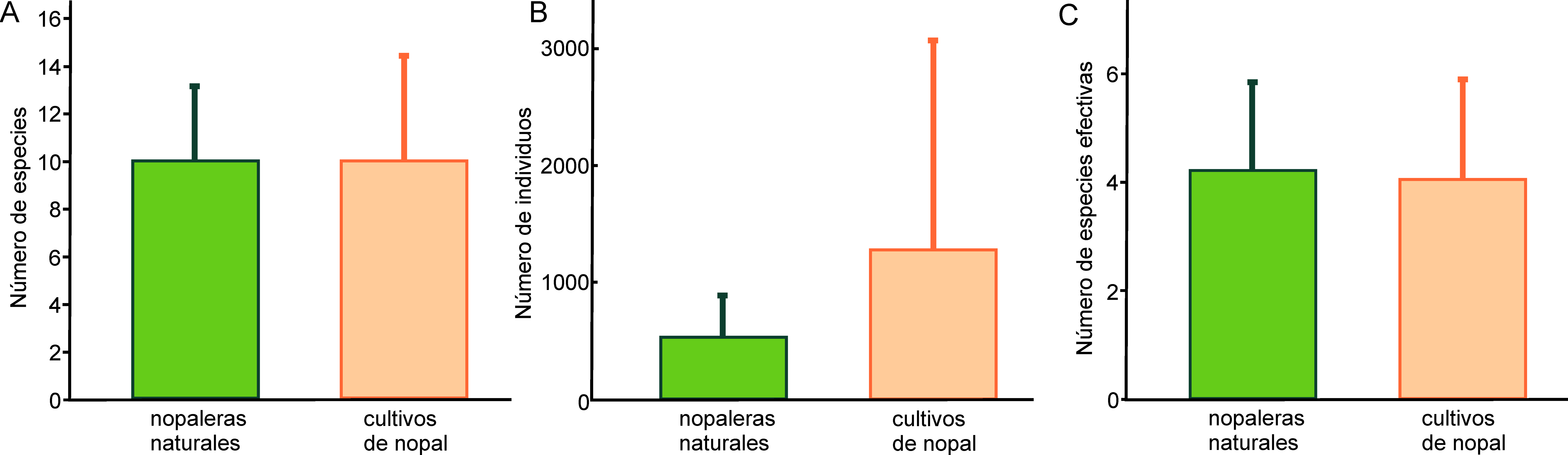
Tabla 2
Valor de indicador (IndVal) de las especies de hormigas que obtuvieron los valores más altos en cultivos de nopal tunero (Opuntia albicarpa) y nopaleras naturales. El valor esperado y el valor de p se obtuvieron mediante pruebas de aleatorización de Monte Carlo.
|
Valor de indicador |
||||
|
Hábitat |
Especie |
Observado |
Esperado |
p |
|
Cultivos de nopal |
Dorymyrmex sp. |
58.90 |
34.10 |
0.03 |
|
Liometopum apiculatum |
55.90 |
30.30 |
0.03 |
|
|
Tapinoma sessile |
53.30 |
30.10 |
0.03 |
|
|
Pogonomyrmex barbatus |
68.80 |
61.40 |
0.25 |
|
|
Nopaleras naturales |
Camponotus pudorosus |
85.10 |
62.40 |
0.09 |
|
Pheidole obtusospinosa |
87.90 |
92.90 |
0.97 |
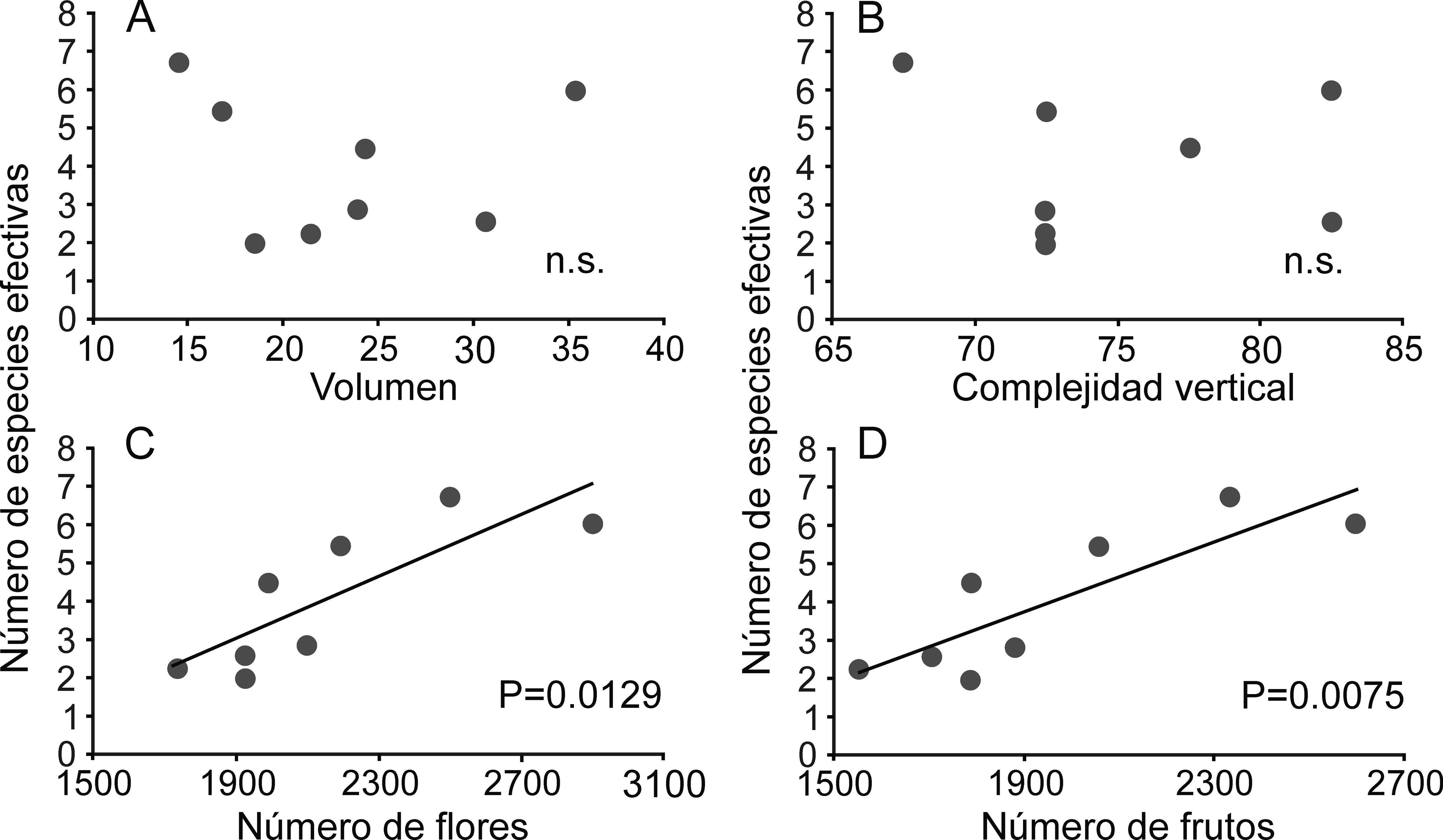
En las nopaleras naturales ninguno de los parámetros de las comunidades de hormigas (riqueza, abundancia y diversidad) estuvo relacionado con las variables de estructura de la vegetación (volumen de las plantas y complejidad vertical) ni con la producción de flores y frutos (tabla 3). Sin embargo, en los cultivos de nopal, la riqueza y la diversidad de especies sí se relacionan significativamente con el número de flores y el número de frutos, aunque no con la estructura de la vegetación (tabla 3, fig. 4).
Tabla 3
Resultados básicos de los modelos lineales generalizados entre las características evaluadas del hábitat (variables explicativas) y parámetros de las comunidades de hormigas (riqueza, abundancia y diversidad como variables de respuesta) en cultivos de nopal y nopaleras naturales. Se resaltan en negritas las relaciones significativas. En el material suplementario se presentan los resultados completos de estos análisis.
|
Variables de respuesta |
Variables explicativas |
Cultivos de nopal (n = 8) |
Nopaleras naturales (n = 5) |
|
Riqueza |
Volumen de las plantas |
z = -0.19, p = 0.85 |
z = 0.32, p = 0.75 |
|
Complejidad vertical |
z = -0.22, p = 0.82 |
z = 0.94, p = 0.35 |
|
|
Número de flores |
z = 2.06, p = 0.04 |
z = 1.04, p = 0.30 |
|
|
Número de frutos |
z = 2.17, p = 0.03 |
z = 0.91, p = 0.36 |
|
|
Abundancia |
Volumen de las plantas |
t = -1.02, p = 0.35 |
t = -0.68, p = 0.55 |
|
Complejidad vertical |
t = -0.73, p = 0.49 |
t = -0.54, p = 0.62 |
|
|
Número de flores |
t = -1.08, p = 0.32 |
t = 0.72, p = 0.52 |
|
|
Número de frutos |
t = -0.87, p = 0.42 |
t = 1.5, p = 0.23 |
|
|
Diversidad |
Volumen de las plantas |
t = -0.18, p = 0.86 |
t = -0.04, p = 0.97 |
|
Complejidad vertical |
t = -0.22, p = 0.83 |
t = 0.12, p = 0.92 |
|
|
Número de flores |
t = 3.49, p = 0.01 |
t = 0.31, p = 0.78 |
|
|
Número de frutos |
t = 3.95, p < 0.01 |
t = 0.03, p = 0.98 |
Discusión
Como se esperaba, la riqueza de hormigas en los 2 tipos de hábitat estudiados es alta (25 especies), en comparación con las 21 especies encontradas en sistemas agrícolas del valle del Mezquital (Hernández-Ruiz y Castaño-Meneses, 2006) y las 26 especies encontradas en la zona árida del valle de Tehuacán (Ríos-Casanova et al., 2006). Esta riqueza de especies es relevante tomando en cuenta que, a diferencia de nuestro estudio, en ambos trabajos referidos el muestreo abarcó toda la variación climática anual. En este trabajo, el muestreo realizado en los 2 tipos de hábitat alcanzó un buen nivel de completitud, por lo que las listas de especies son representativas de estos ambientes.
La riqueza de especies encontrada en los cultivos de nopal (23 especies) es mayor a la encontrada en otros estudios realizados en agroecosistemas (Hernández-Ruiz y Castaño-Meneses, 2006; Perfecto y Vandermeer, 1996; Risch y Carroll, 1982) y es similar a la encontrada en las nopaleras naturales. No siempre se encuentra una relación directa entre la intensidad de manejo humano y la riqueza de especies de hormigas, y en consecuencia un ambiente modificado puede representar una alta o baja diversidad en comparación con el ecosistema nativo (Chanatásig-Vaca et al., 2011). Nuestros resultados muestran una clara semejanza en la riqueza, abundancia, diversidad y composición de especies de hormigas entre los cultivos de nopal y las nopaleras naturales. Esta semejanza corrobora lo reportado en otros estudios que indican que algunos agroecosistemas pueden ser reservorios de la biodiversidad de hormigas (e.g., Chanatásig-Vaca et al., 2011; Valenzuela-González et al., 2008). En nuestro caso, es posible que las condiciones ambientales en los cultivos de nopal contribuyan a mantener la homogeneidad biótica entre estos agroecosistemas y los remanentes del ecosistema nativo.
La mayor abundancia y riqueza de hormigas en nuestro estudio corresponde a las subfamilias Myrmicinae y Formicinae, que son las mejor representadas a nivel nacional (Guzmán-Mendoza et al., 2010; Ríos-Casanova, 2014; Ríos-Casanova et al., 2004; Rojas-Fernández, 2001; Vásquez-Bolaños, 2015). Los géneros Pogonomyrmex, Dorymyrmex y Pheidole, al igual que en los trabajos de Hernández-Ruíz y Castaño-Meneses (2006) y Guzmán-Mendoza et al. (2010), fueron los más abundantes. La especie Liometopum apiculatum es una de las indicadoras de los cultivos de nopal y tiene una alta importancia por el valor gastronómico de sus larvas (escamoles) en la región (Cruz-Labana et al., 2014). Además, esta especie se ha reportado que visita frecuentemente a las plantas de Opuntia sp. dando protección a los nopales contra herbívoros y depredadores (Miller, 2007). También Tapinoma sessile resultó ser una especie indicadora de los cultivos de nopal, y este género ya había sido propuesto como indicador de agroecosistemas con poco disturbio del valle del Mezquital (Hernández-Ruiz y Castaño-Meneses, 2006). Por lo tanto, es una especie con alta frecuencia de aparición y abundancia relativa en sitios con las condiciones ambientales de los cultivos de nopal. Será muy interesante evaluar cuáles variables del ambiente y del paisaje influyen en la permanencia de las especies en estos agroecosistemas.
La alta riqueza de especies de hormigas en los cultivos de nopal puede estar relacionada con la variación microambiental generada por la complejidad estructural de la vegetación (Hernández-Ruiz y Castaño-Meneses, 2006). Por ello, en ambientes modificados el cambio en la composición de la vegetación puede disminuir, o no afectar, la estructura y composición de las comunidades de hormigas (Perfecto y Snelling, 1995). Nuestros resultados indican que la complejidad estructural de la vegetación (volumen de las plantas de Opuntia y complejidad vertical) no afecta a las comunidades de hormigas de los cultivos ni de las nopaleras naturales. Sin embargo, en los cultivos de nopal el número de flores y frutos de Opuntia sí se relaciona con la riqueza y la diversidad de hormigas. Estas relaciones podrían deberse a la protección que dan algunas especies de hormigas a las plantas de Opuntia contra hervíboros (Miller, 2007). Sin embargo, esta hipótesis requerirá un diseño experimental apropiado para su estudio. Cabe resaltar que nuestros muestreos se realizaron durante la época de floración y principio de la fructificación de los nopales, pero no hay datos sobre las comunidades de hormigas en los cultivos de nopal durante el resto del año.
En la zona árida de Tehuacán, en el centro de México, la distribución y abundancia de las especies dominantes se relaciona con características particulares de los suelos, como el porcentaje de arena (Ríos-Casanova et al., 2006). Por lo tanto, para la protección de las hormigas epigeas y otros elementos de la biodiversidad del suelo, así como de los procesos del ecosistema, será necesario evaluar el impacto de los agroquímicos que se utilizan en los cultivos de nopal tunero. Un esquema de manejo sustentable y orgánico, libre de plaguicidas, herbicidas y fertilizantes químicos favorecerá la capacidad de estos cultivos perennes para conservar la biodiversidad. Además, será necesario evaluar los posibles costos y beneficios que la alta diversidad de hormigas podría tener para la producción de tunas. Por ejemplo, la herbivoría podría causar daños severos en las raíces y tallos de Opuntia, pero la presencia de las hormigas también podría beneficiar la productividad al dar protección contra otros herbívoros, frugívoros o robadores de néctar en estos cultivos.
Agradecimientos
Agradecemos a las autoridades y dueños de los cultivos tuneros y terrenos con nopaleras naturales de los municipios de la región del Altiplano central del estado de Hidalgo. Agradecemos también a Judith Galván Juárez por su ayuda en campo, al Dr. Miguel Ángel García Martínez del Instituto de Ecología A.C. por su colaboración en la determinación de los ejemplares, al M. en C. Manuel González Ledezma por su ayuda en la determinación de las especies de Opuntia, así como al Dr. Wesley Dáttilo y a un revisor anónimo por sus comentarios y sugerencias para mejorar el manuscrito. Este trabajo es una contribución al proyecto 222632 «Evaluación de la diversidad de especies mediante el análisis e integración de elementos ecológicos, funcionales y evolutivos» apoyado por el fondo SEP-Conacyt de Ciencia Básica.
Referencias
Andersen, A. N., Hoffmann, B. D., Müller, W. J. y Griffiths, A. D. (2002). Using ants as bioindicators in land management: simplifying assessment of ant community responses. Journal of Applied Ecology, 39, 8–17.
Asfiya, W. A. R. A., Lach, L., Majer, J. D., Heterick, B. R. I. A. N. y Didham, R. K. (2015). Intensive agroforestry practices negatively affect ant (Hymenoptera: Formicidae) diversity and composition in southeast Sulawesi, Indonesia. Asian Myrmecology, 7, 87–104.
Bush, A., Harwood, T., Hoskins, A. J., Mokany, K. y Ferrier, S. (2016). Current uses of beta-diversity in biodiversity conservation: a response to Socolar et al. Trends in Ecology & Evolution, 31, 337–338.
Campos-Salas, N., Casas, A., Moreno-Calles, A. I. y Vallejo, M. (2016). Plant management in agroforestry systems of rosetophyllous forests in the Tehuacán Valley, Mexico. Economic Botany, 70, 254–269.
Chanatásig-Vaca, C. I., Huerta-Lwanga, E., Rojas-Fernández, P., Ponce-Mendoza, A., Mendoza-Vega, J., Morón-Ríos, A. et al. (2011). Efecto del uso de suelo en las hormigas (Formicidae: Hymenoptera) de Tikinmul, Campeche, México. Acta Zoológica Mexicana, 2, 441–461.
Chao, A. y Jost, L. (2012). Coverage-based rarefaction and extrapolation: standardizing samples by completeness rather than size. Ecology, 93, 2533–2547.
Crawley, M. J. (2007) Statistics: an introduction using R. Londres, Wiley.
Crist, E., Mora, C. y Engelman, R. (2017). The interaction of human population, food production, and biodiversity protection. Science, 356, 260–264.
Cruz-Labana, J. D., Tarango-Arámbula, L. A., Alcántara-Carbajal, J. L., Pimentel-López, J., Ugalde-Lezama, S., Ramírez-Valverde, G. et al. (2014). Habitat use by the “Escamolera” ant (Liometopum apiculatum Mayr) in central Mexico. Agrociencia, 48, 569–582.
Colwell, R. K. (2013). EstimateS: statistical estimation of species richness and shared species from samples. Version 9.1.0. Recuperado el 18 octubre, 2016 de: http://purl.oclc.org/estimates
Cuezzo, F. y Guerrero, R. J. (2012). The ant genus Dorymyrmex Mayr (Hymenoptera: Formicidae: Dolichoderinae) in Colombia. Psyche: A Journal of Entomology, 2012, ID: 516058. http://dx.doi.org/10.1155/2012/516058.
de Castro-Solar, R. R., Barlow, J., Andersen, A. N., Schoereder, J. H., Berenguer, E., Ferreira, J. N. et al. (2016). Biodiversity consequences of land-use change and forest disturbance in the Amazon: A multi-scale assessment using ant communities. Biological Conservation, 197, 98–107.
Financiera Rural. (2011). Monografía del nopal y la tuna. Dirección General Adjunta de Planeación Estratégica y Análisis Sectorial, Dirección Ejecutiva de Análisis Sectorial. México. Recuperado el 5 abril, 2017 de: http://siproduce.sifupro.org.mx/seguimiento/archivero/14/2013/anuales/anu_2251-6-2014-05-26.pdf
Dufrêne, M. y Legendre, P. (1997). Species assemblages and indicator species: the need for a flexible asymmetrical approach. Ecological Monographs, 67, 345–366.
Gardner, R. H. (1998). Pattern, process, and the analysis of spatial scales. En D. L. Peterson y V. T. Parker (Eds). Ecological scale. Theory and applications (pp. 17–34). Nueva York: Columbia University Press.
González-Zamora, A., Esperón-Rodríguez, M. y Barradas, V. L. (2016). Mountain cloud forest and grown-shade coffee plantations: a comparison of tree biodiversity in central Veracruz, Mexico. Forest Systems, 25, e055.
Gray, C. L., Lewis, O.T., Chung, A. Y. C. y Fayle, T. M. (2015). Riparian reserves within oil palm plantations conserve logged forest leaf litter ant communities and maintain associated scavenging rates. Journal of Applied Ecology, 52, 31–40.
Griffith, B. y Youtie, B. A. (1988). Two devices for estimating foliage density and deer hiding cover. Wildlife Society Bulletin, 16, 206–210.
Guzmán-Mendoza, R., Castaño-Meneses, G. y Herrera-Fuentes, M. C. (2010). Variación espacial de la diversidad de hormigas en el jardín botánico del valle de Zapotitlán de las Salinas, Puebla. Revista Mexicana de la Biodiversidad, 81, 427–435.
Hernández-Ruiz, P. y Castaño-Meneses, G. (2006). Ant (Hymenoptera: Formicidae) diversity in agricultural ecosystems at Mezquital Valley, Hidalgo, Mexico. European Journal of Soil Biology, 42, 208–212.
Hsieh, T. C., Ma, K. H. y Chao, A. (2013). iNEXT online: interpolation and extrapolation. Version 1.0. Recuperado el 18 octubre, 2016 de: http://chao.stat.nthu.edu.tw/blog/software-download/
Inegi (Instituto Nacional de Estadística y Geografía). (2010). Anuario estadístico del Estado de Hidalgo. Aguascalientes: Instituto Nacional de Estadística y Geografía.
Johnson, C. N, Balmford, A., Brook, B. W., Buettel, C. J., Galetti, M., Guangchun, L. et al. (2017). Biodiversity losses and conservation responses in the Anthropocene. Science, 356, 270–275.
Jolalpa-Barrera, J. L., Aguilar-Zamora, A., Ortiz-Barreto, O. y García López, L. (2011). Producción y comercialización de tuna en fresco bajo diferentes modalidades en Hidalgo, México. Revista Mexicana de Agronegocios, 28, 605–614.
Jost, L. (2006). Entropy and diversity. Oikos, 113, 363–375.
López-Mejía, M., Moreno, C. E., Zuria, I., Sánchez-Rojas, G. y Rojas-Martínez A. (2017). Comparación de dos métodos para analizar la proporción de riqueza de especies entre comunidades: un ejemplo con murciélagos de selvas y hábitats modificados. Revista Mexicana de Biodiversidad, 88, 183–191.
MacGown, J. A., Boudinot, B., Deyrup, M. y Sorger, D. M. (2014). A review of the Nearctic Odontomachus (Hymenoptera: Formicidae: Ponerinae) with a treatment of the males. Zootaxa, 4, 515–552.
Mackay, W. y Mackay, E. (2005). Clave de los géneros de hormigas en México (Hymenoptera: Formicidae). Recuperado el 15 julio, 2016 de: www.utep.edu/leb/ants/Mexicoants.doc
Mateos-Maces, L., Castillo-González, F., Chávez Servia, J. L., Estrada-Gómez, J. A. y Livera-Muñoz, M. (2016). Manejo y aprovechamiento de la agrobiodiversidad en el sistema milpa del sureste de México. Acta Agronómica, 65, 413–421.
McCune, B. y Mefford, M. J. (1999). PC-ORD for Windows: multivariate analysis of ecological data. Version 4.0. MjM Software, Gleneden Beach, Oregon.
Millennium Ecosystem Assessment. (2005). Millennium Ecosystem Assessment. Washington D.C.: World Resources Institute.
Miller, T. E. X. (2007) Does having multiple partners weaken the benefits of facultative mutualism? A test with cacti and cactus-tending ants. Oikos, 116, 500–512.
Morrone, J. J. (2001). Biogeografía de América Latina y el Caribe. M & T-Manuales &Tesis, SEA, Zaragoza.
Newbold, T., Hudson, L. N., Arnell, A. P., Contu, S., De Palma, A., Ferrier, S. et al. (2016). Has land use pushed terrestrial biodiversity beyond the planetary boundary? A global assessment. Science, 353, 288–291.
Oliveira, P. S., Rico-Gray, V., Díaz-Castelazo, C. y Castillo-Guevara, C. (1999). Interaction between ants, extrafloral nectaries and insect herbivores in Neotropical coastal sand dunes: herbivore deterrence by visiting ants increases fruit set in Opuntia stricta (Cactaceae). Functional Ecology, 13, 623–631.
Pacheco, R., Vasconcelos, H. L., Groc, S., Camacho, G. P. y Frizzo, T. L. (2013). The importance of remnants of natural vegetation for maintaining ant diversity in Brazilian agricultural landscapes. Biodiversity and Conservation, 22, 983–997.
Perfecto, I. y Vandermeer, J. (1996). Microclimatic changes and the indirect loss of ant diversity in a tropical agroecosystem. Oecologia, 108, 577–582.
Perfecto, I. y Vandermeer, J. (2002). The quality of agroecological matrix in a tropical montane landscape: ants in coffee plantations in southern Mexico. Conservation Biology, 16, 174–182.
Perfecto, I. y Snelling, R. (1995). Biodiversity and the transformation of a tropical agroecosystems: ants in coffee plantations. Ecological Applications, 5, 1084–1097.
R Development Core Team. (2016). R: a language and environment for statistical computing. Viena: R Foundation for Statistical Computing.
Rich, T., Peterken, G., Tucker, G., McMeechan, F. y Dobson, D. (2005). Habitat requirements and issues. En D. Hill, M. Fasham, G. Tucker, M. Shewry y P. Shaw (Eds.), Handbook of biodiversity methods. Survey, evaluation and monitoring (pp. 107–150), Cambridge: Cambridge University Press.
Riojas-López, M. E. (2006). Rodent communities in two natural and one cultivated “nopaleras” (Opuntia spp.) in north-eastern Jalisco, México. Journal of Arid Environments, 67, 428–435.
Riojas-López, M. E. (2012). Response of rodent assemblages to change in habitat heterogeneity in fruit-oriented nopal orchards in the Central High Plateau of Mexico. Journal of Arid Environments, 85, 27–32.
Riojas-López, M. E. y Mellink, E. (2005). Potential for biological conservation in man-modified semiarid habitats in northeastern Jalisco, Mexico. Biodiversity and Conservation, 14, 2251–2263.
Ríos-Casanova, L. (2014). Biodiversidad de hormigas en México. Revista Mexicana de Biodiversidad (Suplem.), 85, S392–S398.
Ríos-Casanova, L., Valiente-Banuet, A. y Rico-Gray, V. (2004). Las hormigas del valle de Tehuacán (Hymenoptera: Formicidae): una comparación con otras zonas áridas de México. Acta Zoológica Mexicana, 20, 37–54.
Ríos-Casanova, L., Valiente-Banuet, A. y Rico-Gray, V. (2006). Ant diversity and its relationship with vegetation and soil factors in an alluvial fan of the Tehuacán Valley, Mexico. Acta Oecologica, 29, 316–323.
Risch, S. J. y Carroll, C. R. (1982). The ecological role of ants in two Mexican agroecosystems. Oecologia, 55, 114–119.
Rojas-Fernández, P. (2001). Las hormigas del suelo en México: diversidad, distribución e importancia (Hymenoptera: Formicidae). Acta Zoológica Mexicana (Número Especial), 1, 189–238.
Snelling, G. C. y Snelling, R. R. (2007). New synonymy, new species, new keys to Neivamyrmex army ants of the United States. En R. R. Snelling, B. L. Fisher y P. S. Ward (Eds), Advances in ant systematics (Hymenoptera: Formicidae): homage to E. O. Wilson – 50 years of contributions. Memoirs of the American Entomological Institute 80 (pp. 459–550). Gainesville: American Entomological Institute.
Socolar, J. B., Gilroy, J. J., Kunin, W. E. y Edwards, D. P. (2016). How should beta-diversity inform biodiversity conservation? Trends in Ecology & Evolution, 31, 67–80.
Solar, R. R. C., Barlow, J., Ferreira, J., Berenguer, E., Alexander, C. L., Thomson, J. R. et al. (2015). How pervasive is biotic homogenization in human-modified tropical forest landscapes? Ecology Letters, 18, 1108–1118.
Systat Software. (2006). SigmaStat for Windows. Version 3.5. Point Richmond, Systat Software.
The California Academy of Sciences (2012). AntWeb. Recuperado el 20 junio, 2015 de: http://www.antweb.org
Valenzuela-González, J, Quiroz-Robledo, L. y Martínez-Tlapa, D. L. (2008). Hormigas (Insecta: Hymenoptera: Formicidae). En R. H. Manson, V. Hernández-Ortiz, S. Gallina y K. Mehltreter (Eds.), Agroecosistemas cafetaleros de Veracruz: diversidad, manejo y conservación (pp. 107–121). México D.F.: Instituto Nacional de Ecología/ Semarnat.
Vásquez-Bolaños, M. (2015). Taxonomía de Formicidae (Hymenoptera) para México. Métodos en Ecología y Sistemática, 10, 1–53.
Velázquez, A., Durán, E., Mas, J. F., Bray, D. y Bocco, G. (2005) Situación actual y prospectiva del cambio de la cubierta vegetal y usos del suelo en México. En E. Zúñiga-Herrera (Ed.), Más allá de las metas de desarrollo del milenio (pp. 391–416). México D.F.: Conapo.



