Diversidad íctica en la cuenca del Usumacinta, México
Miriam Soria-Barreto a, Alfonso A. González-Díaz b, Alfonso Castillo-Domínguez c, Nicolás Álvarez-Pliego d y Rocío Rodiles-Hernández b, *
a Cátedra Conacyt – El Colegio de la Frontera Sur, Carretera Panamericana y Periférico Sur, Barrio María Auxiliadora, 29290 San Cristóbal de Las Casas, Chiapas, México
b Colección de Peces, Departamento de Conservación de la Biodiversidad, El Colegio de la Frontera Sur, Carretera Panamericana y Periférico Sur, Barrio María Auxiliadora, 29290 San Cristóbal de Las Casas, Chiapas, México
c División Académica Multidisciplinaria de los Ríos, Universidad Juárez Autónoma de Tabasco, Km. 1 carretera Tenosique-Estapilla, 86901 Tenosique, Tabasco, México
d Diagnóstico y Manejo de Humedales Tropicales, División Académica de Ciencias Biológicas, Universidad Juárez Autónoma de Tabasco, Km. 0.5 carretera Villahermosa-Cárdenas s/n, entronque a Bosques de Saloya, 86150 Villahermosa, Tabasco, México
*Autor para correspondencia: rrodiles@ecosur.mx (R. Rodiles-Hernández)
Resumen
La cuenca del río Usumacinta se caracteriza por su gran extensión, heterogeneidad ecológica y alta biodiversidad. Con el objetivo de documentar de manera integral la riqueza y distribución de la ictiofauna, se incluyen en este trabajo los registros para la cuenca (1994-2014) depositados en la Colección de Peces (ECOSC), además de la revisión bibliográfica y de los registros de otras bases de datos nacionales e internacionales. Adicionalmente y con la finalidad de analizar la diversidad y abundancia, se realizaron muestreos (2014 y 2015) en 3 zonas: selva, planicie y delta. La ictiofauna se compone de 2 clases, 28 órdenes, 50 familias y 172 especies, de las cuales 3 son nuevos registros. De acuerdo a su afinidad ecológica, 75 especies son dulceacuícolas, 8 estuarinas y 89 marinas. La zona selva tuvo más especies dulceacuícolas exclusivas y la zona delta registró la mayor riqueza de peces marinos. Los cambios observados en la diversidad a lo largo de las 3 zonas están influidos por la historia geológica, dinámica hidrológica y su conectividad con el golfo de México. Es necesario continuar con el estudio de la ictiofauna en función de la complejidad geomorfológica para entender patrones biogeográficos, así como procesos ecológicos importantes para su conservación.
Palabras clave:
Mesoamérica; Peces dulceacuícolas; Peces marinos; Peces estuarinos; Especies migratorias
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Diversity of fish fauna in the Usumacinta Basin, Mexico
Abstract
The Usumacinta Basin is characterized by its large size, ecological heterogeneity and high diversity of fish. The purpose of this work was to examine the richness and distribution of the fish fauna, and analyze the diversity and abundance in three zones of the basin. The records (1994-2014) in the Fish Collection (ECOSC) are included, additional information was obtained from a review of the scientific literature, records of national and international fish databases, and from samplings conducted (2014-2015) in 3 zones: rainforest, floodplain and delta. The fish fauna is composed of 2 classes, 28 orders, 50 families and 172 species; 3 of these are new records for the region. According to the ecological affinity, 75 species are freshwater, 8 estuarine and 89 marine. The rainforest zone had more freshwater exclusive species, and the delta zone had the biggest richness of marine fish. The diversity changes along 3 zones, which is influenced by its hydrological dynamics, geological history and its connectivity with the Gulf of Mexico. It is necessary to continue studying the ichthyofauna as related to the geomorphological complexity to understand biogeographical patterns, as well as ecological processes important for conservation.
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Keywords:
Mesoamerica; Freshwater fish; Marine fish; Estuarine fish; Migratory species
Introducción
os ríos tropicales en América son ambientes con gran riqueza biológica, donde la ictiofauna manifiesta una amplia diversidad taxonómica, constituye la base de importantes pesquerías y proporciona alimento para la subsistencia de las poblaciones humanas (Lowe-McConnell, 1987; Toledo, 2003; Winemiller, 2005). Peces dulceacuícolas como los Characiformes, Siluriformes y Gymnotiformes son los grupos más diversos en el Neotrópico (Albert et al., 2011); sin embargo, existen variaciones en la riqueza, diversificación e incluso la presencia de endemismos entre las cuencas dependiendo de su historia geológica (Miller et al., 2009).
La cuenca del río Usumacinta está ubicada en la vertiente Atlántico, es el río más grande y caudaloso de Mesoamérica (Yáñez–Arancibia et al., 2009). Es una cuenca importante desde el punto de vista biológico, evolutivo y biogeográfico, y se ha considerado como una región con alta diversificación para los peces de las familias Cichlidae y Poeciliidae (Matamoros et al., 2015; Miller, 1986; Miller et al., 2009).
Como otros grandes ríos tropicales (Winemiller y Jepsen, 1998), el río Usumacinta es un sistema hidrológico complejo. En México, la cuenca nace en la sierra de Los Altos de Chiapas y la sierra de Comitán, y conforma una red hidrológica constituida de innumerables arroyos y ríos, así como lagos endorreicos en una zona kárstica originada durante el Mioceno tardío (INE, 2000b). Posteriormente, forma parte de la planicie costera del sureste que se originó por la deposición de sedimentos durante el Pleistoceno y el Holoceno (Hudson et al., 2005; INE, 2000b; Lozano-Vilano y Contreras-Balderas, 1987). Estas condiciones pueden modificar la composición y dinámica íctica a lo largo de su cauce, debido al periodo de aislamiento de la parte alta y la conexión con el ambiente marino en la planicie.
Los estudios ictiofaunísticos en la cuenca del río Usumacinta en México son diversos y aislados espacialmente; se han enfocado principalmente a los ecosistemas acuáticos de las áreas naturales protegidas. Los listados ícticos más recientes han reportado 79 especies para la cuenca en el estado de Chiapas (Velázquez-Velázquez et al., 2016); para la Reserva de la Biosfera de Montes Azules se mencionaron 66 especies (Ramírez-Martínez et al., 2015). En la planicie de inundación, los estudios se han enfocado en el río San Pedro, afluente del río Usumacinta que contiene 40 especies (Castillo-Domínguez et al., 2011, 2015; Chávez-Lomelí et al., 1988), y para la Reserva de la Biosfera de Pantanos de Centla se documentan 106 especies dulceacuícolas y marinas (Arévalo-Frías y Mendoza-Carranza, 2012; Macossay-Cortéz et al., 2011). Por lo que, la información íctica disponible para toda la cuenca es incompleta.
El objetivo de este estudio fue elaborar el primer listado de la cuenca río Usumacinta en la porción mexicana, mediante la incorporación de los registros (1994-2014) depositados en la Colección de Peces de ECOSUR (ECOSC), publicados por primera vez en este trabajo, la revisión de la información bibliográfica y la depuración de bases de datos nacionales e internacionales. Así como, la información de recolectas realizadas durante 2014 y 2015, con la finalidad de analizar y comparar la diversidad y abundancia de la ictiofauna en 3 zonas a lo largo de la cuenca. La nomenclatura de la ictiofauna fue actualizada con los cambios taxonómicos más recientes principalmente en especies dulceacuícolas (McMahan et al., 2015; Poeser, 2002; Rican et al., 2016).
Materiales y métodos
La cuenca del río Usumacinta tiene una extensión de 73, 945 km2, constituye una cuenca compartida entre Guatemala (58% de su superficie) y México (42%). Nace en Guatemala en la sierra de los Cuchumatanes y en México en las montañas de Los Altos en Chiapas, recorre de manera ininterrumpida cerca de 1,000 km, para finalmente unirse al río Grijalva y desembocar en el golfo de México, con una descarga de 4,402 m3/s (Sánchez, Salcedo et al., 2015; Toledo, 2003; Yáñez-Arancibia et al., 2009) en promedio.
Por razones logísticas de estudio el área fue dividida en 3 zonas. La zona selva que comprende desde el río Lacantún y hasta el río Usumacinta en el poblado de Frontera Corozal, Chiapas. Esta zona se caracteriza por procesos kársticos, presencia de lagos, arroyos, cascadas, pozas y diversos tributarios. La vegetación predominante es selva alta perennifolia y selva mediana, aquí se concentran diversas reservas y áreas protegidas entre las que destacan: la Reserva de La Biosfera de Montes Azules (REBIMA), Reserva de la Biosfera Lacantún y Monumentos Naturales en Bonampak y Yaxchilán (INE, 2000a).
Zona de planicie incluye las regiones de Balancán, Emiliano Zapata y Tenosique; se localiza desde el cañón del Usumacinta en Tenosique hasta la zona de inundación de Catazajá; tiene diversas lagunas y algunas se conectan al canal principal durante la época de lluvias (Rodríguez, 2002); además recibe 2 afluentes principales, el río San Pedro que procede del Petén guatemalteco y el río Chacamax proveniente de serranías cercanas a Palenque, Chiapas. Presenta vegetación acuática, pastizales y manchones de selva mediana y baja, así como modificaciones ambientales por actividades como la agricultura y ganadería, contaminación por asentamientos humanos y presencia de especies exóticas (Lienart et al., 2013).
Zona delta, corresponde a los humedales conformados por los aluviones de 3 principales brazos del río Usumacinta, que abarca desde los Pantanos de Centla en Tabasco, los ríos San Pedro-San Pablo, hasta el río Palizada en Campeche. Se caracteriza por tener selva mediana y baja, manglar, matorral y vegetación acuática; tiene influencia marina y posee sistemas lagunares conectados de manera continua al canal principal (INE, 2000b; Ramos-Miranda y Villalobos-Zapata, 2015; Yáñez-Arancibia et al., 2009).
Se realizó una revisión de publicaciones sobre estudios ictiofaunísticos en las áreas de protección Montes Azules, Lacantún y Pantanos de Centla; listados ícticos nacionales, estatales y de ecosistemas acuáticos ubicados en la cuenca; así como estudios biológicos y ecológicos de las especies.
La literatura recabada hasta 2018 se incluye a continuación: Álvarez-Pliego et al. (2016); Arévalo-Frías y Mendoza-Carranza (2012); Ayala-Pérez et al. (2015); Capps et al. (2011); Castillo-Domínguez et al. (2011, 2015); Castro-Aguirre et al. (1999); Chávez-Lomelí et al. (1988); Domínguez-Cisneros y Rodiles-Hernández (1997); Espinosa-Pérez y Daza-Zepeda (2005); Espinosa-Pérez et al. (2011, 2014); Gaspar-Dillanes (1996); González-Acosta y Rodiles-Hernández (2013); Hernández-Gómez et al. (2013); Lazcano-Barrero y Vogt (1992); Lienart et al. (2013); Lozano-Vilano y Contreras-Balderas, (1987); Lozano-Vilano et al. (2007); Macossay-Cortez et al. (2011); Marceniuk y Betancur (2008); Mendoza-Carranza et al. (2010); Miller et al. (2009); Morales-Román y Rodiles-Hernández (2000); Perera-García et al. (2013); Ramírez-Martínez et al. (2015); Rodiles-Hernández (2005); Rodiles-Hernández et al. (1999, 2013); Rodiles-Hernández, González-Díaz et al. (2005); Rodiles-Hernández, Hendrickson et al. (2005); Sánchez et al. (2012); Schmitter-Soto (2007); Schmitter-Soto (2017); Soria-Barreto y Rodiles-Hernández (2008); Sosa-Nishizaki et al. (1998); Valdez-Zenil et al. (2014); Velasco (1976); Velázquez-Velázquez et al. (2013, 2016) y Wakida-Kusunoki y Amador-del Ángel (2008).
Se revisó e incluyó el considerable acervo de registros depositados en la Colección de Peces de El Colegio de la Frontera Sur Unidad San Cristóbal (ECOSC) producto de recolectas realizadas desde 1994 y hasta mediados de 2014. Estos registros no habían sido publicados previamente y cubren gran parte de la cuenca. Adicionalmente, se complementó con la depuración de registros contenidos en el Sistema Nacional de Información sobre la Biodiversidad (SNIB) incluidos en los proyectos de Contreras-Balderas, (2008), Díaz-Pardo (2003), Espinosa-Pérez (2002), Muñoz-Alonso y March-Mifsut, (2003) y Soto-Galera (2006). Así como los registros de la base de datos de la Colección Mundial de Información sobre Biodiversidad (https://www.gbif.org).
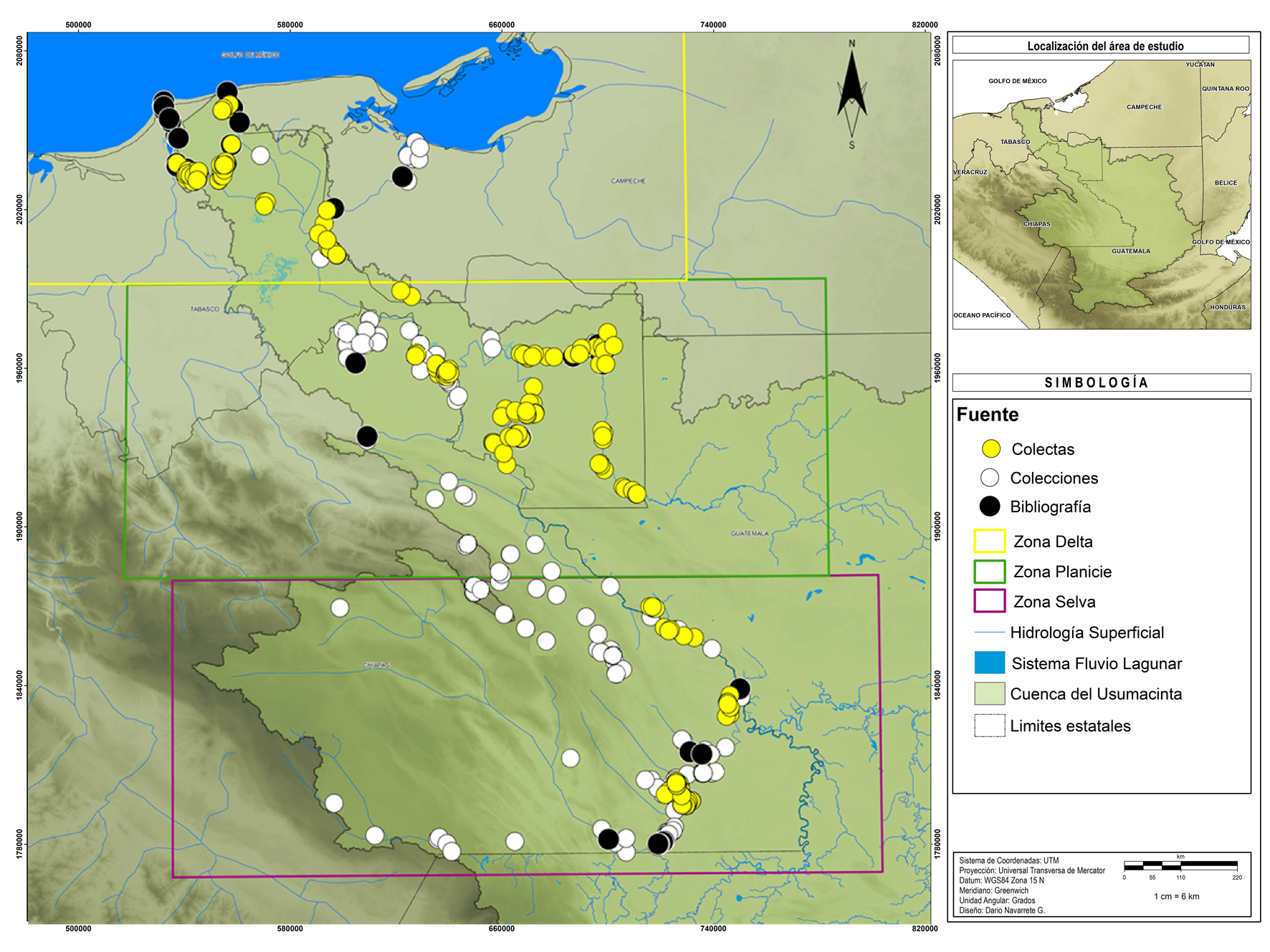
La información geográfica (coordenadas, sitios y localidades) procedente de colecciones y literatura se depuró usando los sistemas de información geográfica por el Laboratorio de Análisis de Información Geográfica y Estadística (LAIGE) de ECOSUR. Todos los registros fueron georefenciados, incluyendo las recolectas (fig. 1).
Se llevaron a cabo recolectas en 32 localidades, desde el río Lacantún y Usumacinta en Chiapas, hasta los Pantanos de Centla en Tabasco y río Palizada en Campeche. Se realizaron 7 campañas desde noviembre de 2014 hasta octubre de 2015, en diversos ambientes acuáticos tales como humedales, arroyos, lagunas y ríos principales (tabla 1). Las localidades se establecieron tratando de cubrir un gradiente longitudinal a lo largo de 3 zonas de la cuenca. Con la finalidad de obtener la mayor representatividad de la ictiofauna en las recolectas, se usaron diversos métodos de captura dependiendo de las características de cada localidad: redes agalleras multimalla de 30 m y con una caída de 2 m con luz de malla de 5 a 12.7 cm; equipo de electropesca ABP-3TM Pulsed-DC con una descarga de 150V; atarrayas de 2 m de altura y 1 cm de luz de malla; chinchorros playeros de 100 m de largo por 1.5 m de altura, con luz de malla de 0.8 cm; curricanes, nasas y anzuelos, palangres, y trampas.
En cada localidad se registraron la temperatura (°C), oxígeno disuelto (mg/l), conductividad (μS/cm), salinidad (ups) y pH, con el multiparamétrico HANNA modelo HI 9829.
Los peces recolectados se fijaron en una solución de formalina al 10% y se etiquetaron con los datos respectivos. En el laboratorio se lavaron en agua corriente y se preservaron en alcohol etílico al 70%, se identificaron a nivel de especie con base en Castro-Aguirre et al. (1999), Marceniuk y Betancur (2008) y Miller et al. (2009). Todo el material fue depositado en la Colección de Peces de El Colegio de la Frontera Sur, unidad San Cristóbal (ECOSC). En los casos donde los peces se pudieron determinar en campo, los especímenes se cuantificaron para conocer la abundancia durante la captura y se regresaron vivos al ambiente.
Schmitter-Soto (2017) publicó recientemente una revisión del género Astyanax, donde propone nuevas especies y revalida otras. En el presente trabajo no se aplicó esta propuesta taxonómica, debido a que se requiere una revisión metódica y cuidadosa de todos los ejemplares de la cuenca, incluyendo el análisis y la revisión de caracteres morfológicos principalmente osteológicos. En este sentido, todos los ejemplares asignados a Astyanax aeneus o Bramocharax fueron considerados como Astyanax spp.
El listado taxonómico se ordenó de acuerdo a la clasificación taxonómica de Nelson et al. (2016), para las categorías de clase, orden y familia. Los géneros y especies se ordenaron alfabéticamente. Los nombres científicos y las autoridades fueron validadas de acuerdo con Eschmeyer et al. (2018). El estatus de conservación se revisó con base en la Norma Oficial Mexicana (NOM 059) (Semarnat, 2010); la lista roja de la UICN (2018) y la clasificación sugerida por la Sociedad Pesquera Americana (AFS) (Jelks et al., 2008). La afinidad ecológica para los peces dulceacuícolas se estableció con base en los criterios de Myers (1949) y para los marinos y estuarinos los propuestos por Castro-Aguirre et al. (1999).
La información de colecciones, bibliografía y las recolectas sirvió para conocer de manera integral la composición (riqueza íctica) y distribución de las especies en la cuenca del río Usumacinta.
La descripción ambiental se basó en los valores promedio y errores estándares de cada parámetro. Posteriormente, se llevó a cabo una prueba no parámetrica de Kruskal-Wallis para analizar la variación ambiental entre las 3 zonas.
La comparación de la riqueza y la abundancia relativa en las 3 zonas de estudio se obtuvo únicamente con los datos obtenidos de las recolectas. Se analizó la riqueza total, abundancia de peces dulceacuícolas, estuarinos y marinos, estos datos fueron transformados en logaritmo, debido a que no cumplían con el criterio de normalidad. Con la finalidad de estimar las diferencias significativas entre las zonas se efectuó un análisis de similitud (Anosim) con el índice de Sorensen. Adicionalmente, cada categoría se comparó entre zonas mediante una prueba no parámetrica de Kruskal-Wallis. Los análisis estadísticos se realizaron con el programa Past 3.14 (Hammer et al., 2001).
Tabla 1
Localidades de recolecta en la cuenca del río Usumacinta, México (2014 -2015).
|
Zonas |
Localidades |
Latitud |
Longitud |
|
Selva |
Arroyo El Remolino |
16°14’47” |
90°50’54” |
|
Boca Lacantún |
16°34’17” |
90°42’18” |
|
|
Laguna Chavín |
16°31’51” |
90°42’37” |
|
|
Laguna San Leandro |
16°15’28” |
90°52’32” |
|
|
Río Lacantún |
16°15’45” |
90°52’01” |
|
|
Río San Pedro |
16°18’49” |
90°53’24” |
|
|
Río Tzendales |
16°17’02” |
90°54’23” |
|
|
Río Usumacinta |
16°49’19” |
90°54’34” |
|
|
Planicie |
Arroyo El Chismuck |
17°33’28” |
91°22’37” |
|
Laguna Canitzán |
17°35’31” |
91°23’31” |
|
|
Laguna Cantemoc |
17°41’49” |
91°41’19” |
|
|
Laguna El Maíz |
17°56’26” |
91°49’15” |
|
|
Laguna El Mangal |
17°38’47” |
91°22’58” |
|
|
Laguna Estapilla |
17°33’08” |
91°24’18” |
|
|
Laguna Nueva Esperanza |
17°45’16” |
91°48’03” |
|
|
Laguna Pino Suarez |
17°33’49” |
91°26’38” |
|
|
Laguna Santa Cruz |
17°27’38” |
91°31’36” |
|
|
Playa Boca del Cerro – Río Usumacinta |
17°25’25” |
91°29’25” |
|
|
Playa Cabecera – Río Usumacinta |
17°32’53” |
91°29’44” |
|
|
Laguna El Copo – Río Usumacinta |
17°57’16” |
91°48’48” |
|
|
Playa El Recreo – Río Usumacinta |
17°29’22” |
91°26’15” |
|
|
Playa Las Delicias – Río Usumacinta |
17°38’55” |
91°48’31” |
|
|
Río Chacamax |
17°41’15” |
91°41’24” |
|
|
Río San Pedro |
17°44’55” |
91°23’08” |
|
|
Río Usumacinta |
17°29’24” |
91°26’26” |
|
|
Delta |
Laguna El Cometa |
18°28’05” |
92°27’18” |
|
Laguna La Puerta |
18°21’46” |
92°37’04” |
|
|
Laguna San Isidro |
18°24’21” |
92°28’29” |
|
|
Laguna San Pedrito |
18°21’30” |
92°35’44” |
|
|
Río Palizada |
18°08’47” |
92°06’46” |
|
|
Río Sábalo |
18°35’59” |
92°27’55” |
|
|
Río Usumacinta |
18°23’35” |
92°39’03” |
Resultados
Las colecciones biológicas tuvieron un total de 5,878 registros curatoriales, de los cuales 4,719 (80%) corresponden a la Colección de Peces de ECOSUR para un total de 112 especies. La revisión bibliográfica contenía 158 especies, de las cuales sólo 45 especies se reportan de manera bibliográfica. Finalmente, a través de las recolectas se obtuvieron 98 especies, 3 constituyen nuevos registros para la cuenca: la especie exótica Carassius auratus y 2 especies nativas: Gobionellus aff. atripinnis y Gobiosoma robustum (tabla 2).
Tabla 2
Composición íctica de la cuenca del río Usumacinta en México. Se indica el número de registros en colecciones de ECOSUR, GBIF y SNIB-Conabio, presencia en la literatura y las abundancias obtenidas durante las recolectas de 2014 -2015. D ZS = distribución en la zona selva, D ZP = Distribución en la zona de planicie, D ZD = Distribución en la zona del delta. Afinidad ecológica, DP = dulceacuícola primario, DS = dulceacuícola secundario, DV = dulceacuícola de origen vicario, DEx = dulceacuícola exótico, E = estuarino, M-EU = marino eurihalino, M-ES = marino estenohalino. + = especie endémica, *= nuevo registro.
|
Tabla 2 Continuación. |
|||||||||
|
Núm. |
Taxón |
Registros |
Literatura |
Abundancia |
D ZS |
D ZP |
D ZD |
Tolerancia a la salinidad |
Protección |
|
Núm. |
Taxón |
Registros |
Literatura |
Abundancia |
D ZS |
D ZP |
D ZD |
Tolerancia a la salinidad |
Protección |
|
Clase Chondrichthyes |
|||||||||
|
Orden Carcharhiniformes |
|||||||||
|
Familia Carcharhinidae |
|||||||||
|
1 |
Carcharhinus leucas (Valenciennes, 1839) |
x |
X |
M-EU |
NT (IUCN, 2016) |
||||
|
Orden Myliobatiformes |
|||||||||
|
Familia Dasyatidae |
|||||||||
|
2 |
Hypanus americana (Hildebrand y Schroeder, 1928) |
3 |
X |
M-ES |
|||||
|
3 |
Hypanus sabinus (Lesueur, 1824) |
x |
1 |
X |
M-ES |
||||
|
Clase Osteichthyes |
|||||||||
|
Orden Lepisosteiformes |
|||||||||
|
Familia Lepisosteidae |
|||||||||
|
4 |
Atractosteus tropicus Gill, 1863 |
54 |
x |
48 |
X |
X |
X |
DP |
|
|
Orden Elopiformes |
|||||||||
|
Familia Elopidae |
|||||||||
|
5 |
Elops saurus Linnaeus, 1766 |
x |
12 |
X |
M-EU |
||||
|
Familia Megalopidae |
|||||||||
|
6 |
Megalops atlanticus Valenciennes, 1847 |
8 |
x |
15 |
X |
X |
X |
M-EU |
VU (IUCN, 2016) |
|
Orden Albuliformes |
|||||||||
|
Familia Albulidae |
|||||||||
|
7 |
Albula vulpes (Linnaeus, 1758) |
2 |
X |
M-ES |
NT (IUCN, 2016) |
||||
|
Orden Anguilliformes |
|||||||||
|
Familia Ophichthidae |
|||||||||
|
8 |
Myrophis punctatus Lütken, 1852 |
2 |
x |
X |
M-EU |
||||
|
Orden Clupeiformes |
|||||||||
|
Familia Clupeidae |
|||||||||
|
9 |
Brevoortia gunteri Hildebrand, 1948 |
1 |
x |
X |
M-EU |
||||
|
10 |
Dorosoma anale Meek, 1904 |
165 |
x |
1399 |
X |
X |
X |
DV |
|
|
11 |
Dorosoma petenense (Günther, 1867) |
119 |
x |
1657 |
X |
X |
X |
DV |
|
|
12 |
Harengula jaguana Poey, 1865 |
3 |
x |
X |
M-EU |
||||
|
13 |
Opisthonema oglinum (Lesueur, 1818) |
2 |
x |
X |
M-ES |
||||
|
Familia Engraulidae |
|||||||||
|
14 |
Anchoa hepsetus (Linnaeus, 1758) |
2 |
x |
14 |
X |
M-EU |
|||
|
15 |
Anchoa mitchilli (Valenciennes, 1848) |
4 |
x |
7 |
X |
X |
M-EU |
||
|
16 |
Anchoa parva (Meek y Hildebrand, 1923) |
x |
1 |
X |
M-EU |
||||
|
17 |
Anchovia clupeoides (Swainson, 1839) |
1 |
X |
M-ES |
|||||
|
18 |
Cetengraulis edentulus (Cuvier, 1829) |
1 |
x |
38 |
X |
M-ES |
|||
|
Orden Cypriniformes |
|||||||||
|
Familia Cyprinidae |
|||||||||
|
19 |
*Carassius auratus (Linnaeus, 1758) |
1 |
X |
DEx |
|||||
|
20 |
Ctenopharyngodon idella (Valenciennes, 1844) |
62 |
x |
18 |
X |
X |
X |
DEx |
|
|
21 |
Cyprinus carpio Linnaeus, 1758 |
3 |
x |
32 |
X |
X |
X |
DEx |
|
|
Familia Catostomidae |
|||||||||
|
22 |
Ictiobus meridionalis (Günther, 1868) |
23 |
x |
8 |
X |
X |
X |
DP |
|
|
Orden Characiformes |
|||||||||
|
Familia Characidae |
|||||||||
|
23 |
Astyanax spp. |
507 |
x |
3156 |
X |
X |
X |
DP |
|
|
24 |
Hyphessobrycon compressus (Meek, 1904) |
47 |
x |
330 |
X |
X |
X |
DP |
|
|
Familia Bryconidae |
|||||||||
|
25 |
Brycon guatemalensis Regan, 1908 |
219 |
x |
212 |
X |
X |
X |
DP |
|
|
Orden Siluriformes |
|||||||||
|
Familia Lacantuniidae |
|||||||||
|
26 |
Lacantunia enigmatica Rodiles-Hernández, Hendrickson y Lundberg, 2005 |
77 |
x |
X |
DP+ |
P (NOM 059), V (AFS) |
|||
|
Familia Ictaluridae |
|||||||||
|
27 |
Ictalurus meridionalis (Günther, 1864) |
106 |
x |
112 |
X |
X |
X |
DP |
|
|
Familia Ariidae |
|||||||||
|
28 |
Bagre marinus (Mitchill, 1815) |
2 |
x |
17 |
X |
M-EU |
|||
|
29 |
Cathorops kailolae Marceniuk y Bentancur-R., 2008 |
152 |
x |
760 |
X |
X |
X |
D-V |
|
|
30 |
Potamarius nelsoni (Evermann y Goldsborough, 1902) |
78 |
x |
63 |
X |
X |
X |
DV |
Pr (NOM 059), V (AFS) |
|
31 |
Potamarius usumacintae Betancur-R. y Willink, 2007 |
61 |
x |
37 |
X |
X |
X |
DV |
V (AFS) |
|
32 |
Ariopsis felis (Linnaeus, 1766) |
x |
3 |
X |
X |
M-EU |
|||
|
Familia Heptapteridae |
|||||||||
|
33 |
Rhamdia guatemalensis (Günther, 1864) |
231 |
x |
53 |
X |
X |
X |
DP |
Protección especial (NOM 059) |
|
34 |
Rhamdia laticauda (Kner, 1858) |
15 |
x |
15 |
X |
X |
X |
DP |
|
|
Familia Loricariidae |
|||||||||
|
35 |
Pterygoplichthys disjunctivus (Weber, 1991) |
5 |
x |
206 |
X |
X |
X |
DEx |
|
|
36 |
Pterygoplichthys pardalis (Castelnau, 1855) |
32 |
x |
1093 |
X |
X |
X |
DEx |
|
|
37 |
Pterygoplichthys sp. |
3 |
x |
113 |
X |
X |
X |
DEx |
|
|
Orden Aulopiformes |
|||||||||
|
Familia Synodontidae |
|||||||||
|
38 |
Synodus foetens (Linnaeus, 1766) |
2 |
x |
X |
M-EU |
||||
|
Orden Batrachoidiformes |
|||||||||
|
Familia Batrachoididae |
|||||||||
|
39 |
Batrachoides goldmani Evermann y Goldsborough, 1902 |
19 |
x |
15 |
X |
X |
X |
DV+ |
|
|
40 |
Opsanus beta (Goode y Bean, 1880) |
x |
X |
M-EU |
|||||
|
Orden Gobiiformes |
|||||||||
|
Familia Gobiidae |
|||||||||
|
41 |
Bathygobius soporator (Valenciennes, 1837) |
x |
X |
M-EU |
|||||
|
42 |
Ctenogobius boleosoma (Jordan y Gilbert, 1882) |
x |
1 |
X |
M-EU |
||||
|
43 |
Ctenogobius claytonii (Meek, 1902) |
x |
11 |
X |
E |
VU (IUCN, 2016) |
|||
|
44 |
Ctenogobius shufeldti (Jordan y Eigenmann, 1887) |
x |
X |
M-EU |
|||||
|
45 |
Evorthodus lyricus (Girard, 1858) |
x |
X |
M-EU |
|||||
|
46 |
Gobioides broussonneti Lacepède, 1800 |
x |
X |
M-EU |
|||||
|
47 |
*Gobionellus aff. atripinnis |
21 |
X |
E |
|||||
|
48 |
Gobionellus hastatus Girard, 1858 |
1 |
X |
M-EU |
|||||
|
49 |
Gobionellus oceanicus (Pallas, 1770) |
1 |
x |
60 |
X |
M-ES |
|||
|
50 |
*Gobiosoma robustum Ginsburg, 1933 |
1 |
X |
M-ES |
|||||
|
51 |
Microdesmus longipinnis (Weymouth, 1910) |
x |
X |
E |
|||||
|
Familia Eleotridae |
|||||||||
|
52 |
Dormitator maculatus (Bloch, 1792) |
x |
96 |
X |
E |
||||
|
53 |
Eleotris amblyopsis (Cope, 1871) |
x |
5 |
X |
E |
||||
|
54 |
Eleotris perniger (Cope, 1871) |
x |
X |
M-EU |
|||||
|
55 |
Eleotris pisonis (Gmelin, 1789) |
x |
X |
E |
|||||
|
56 |
Gobiomorus dormitor Lacepède, 1800 |
40 |
x |
74 |
X |
X |
X |
E |
|
|
57 |
Leptophilypnus guatemalensis Thacker y Pezold, 2006 |
x |
X |
DV* |
|||||
|
Orden Mugiliformes |
|||||||||
|
Familia Mugilidae |
|||||||||
|
58 |
Joturus pichardi Poey, 1860 |
2 |
x |
X |
X |
MM |
|||
|
59 |
Mugil cephalus Linnaeus, 1758 |
7 |
x |
1 |
X |
X |
X |
M-EU |
|
|
60 |
Mugil curema Valenciennes, 1836 |
7 |
x |
13 |
X |
X |
X |
M-EU |
|
|
61 |
Mugil trichodon Poey, 1875 |
x |
X |
M-EU |
|||||
|
Orden Cichliformes |
|||||||||
|
Familia Cichlidae |
|||||||||
|
62 |
Chuco intermedium (Günther, 1862) |
274 |
x |
146 |
X |
X |
DS |
Pr (NOM 059) |
|
|
63 |
Cincelichthys pearsei (Hubbs, 1936) |
166 |
x |
50 |
X |
X |
X |
DS |
|
|
64 |
Cribroheros robertsoni (Regan, 1905) |
48 |
x |
56 |
X |
X |
X |
DS |
|
|
65 |
Kihnichthys ufermanni (Allgayer, 2002) |
83 |
x |
13 |
X |
DS+ |
V (AFS) |
||
|
66 |
Maskaheros argenteus (Allgayer, 1991) |
115 |
x |
37 |
X |
X |
X |
DS+ |
|
|
67 |
Mayaheros urophthalmus (Günther, 1862) |
134 |
x |
142 |
X |
X |
X |
DS |
|
|
68 |
Oreochromis aureus (Steindachner, 1864) |
26 |
x |
X |
X |
DEx |
|||
|
69 |
Oreochromis mossambicus (Peters, 1852) |
4 |
x |
3 |
X |
X |
DEx |
||
|
70 |
Oreochromis niloticus (Linnaeus, 1758) |
31 |
x |
162 |
X |
X |
X |
DEx |
|
|
71 |
Oscura heterospila (Hubbs, 1936) |
20 |
x |
168 |
X |
X |
X |
DS |
|
|
72 |
Parachromis friedrichsthalii (Heckel, 1840) |
127 |
x |
41 |
X |
X |
X |
DS |
|
|
73 |
Parachromis managuensis (Günther, 1867) |
50 |
x |
64 |
X |
X |
X |
DEx |
|
|
74 |
Petenia splendida Günther, 1862 |
238 |
x |
147 |
X |
X |
X |
DS |
|
|
75 |
Rheoheros coeruleus (Stawikowski y Werner, 1987) |
x |
X |
DS+ |
|||||
|
76 |
Rheoheros lentiginosus (Steindachner, 1864) |
111 |
x |
259 |
X |
X |
DS+ |
||
|
77 |
Rocio ocotal Schmitter-Soto, 2007 |
3 |
x |
X |
DS+ |
||||
|
78 |
Rocio octofasciata (Regan, 1903) |
80 |
x |
25 |
X |
X |
X |
DS |
|
|
79 |
Theraps irregularis Günther, 1862 |
56 |
x |
43 |
X |
X |
DS |
||
|
80 |
Thorichthys helleri (Steindachner, 1864) |
272 |
x |
1195 |
X |
X |
X |
DS |
|
|
81 |
Thorichthys meeki Brind, 1918 |
149 |
x |
311 |
X |
X |
X |
DS |
|
|
82 |
Thorichthys pasionis (Rivas, 1962) |
91 |
x |
397 |
X |
X |
X |
DS |
|
|
83 |
Thorichthys socolofi (Miller y Taylor, 1984) |
10 |
x |
X |
X |
X |
DS |
A (NOM 059), V (AFS) |
|
|
84 |
Trichromis salvini (Günther, 1862) |
186 |
x |
139 |
X |
X |
X |
DS |
|
|
85 |
Vieja bifasciata (Steindachner, 1864) |
106 |
x |
34 |
X |
X |
X |
DS |
|
|
86 |
Vieja melanura (Günther, 1862) |
235 |
x |
216 |
X |
X |
X |
DS |
|
|
87 |
Wajpamheros nourissati (Allgayer, 1989) |
171 |
x |
26 |
X |
X |
DS |
||
|
Orden Atheriniformes |
|||||||||
|
Familia Atherinopsidae |
|||||||||
|
88 |
Atherinella alvarezi (Díaz-Pardo, 1972) |
70 |
x |
78 |
X |
X |
X |
DV |
|
|
89 |
Atherinella schultzi (Álvarez y Carranza, 1952) |
3 |
x |
1 |
X |
X |
X |
DV |
V (AFS) |
|
90 |
Atherinomorus stipes (Müller y Troschel, 1848) |
x |
X |
M-ES |
|||||
|
Orden Beloniformes |
|||||||||
|
Familia Belonidae |
|||||||||
|
91 |
Strongylura hubbsi Collette, 1974 |
50 |
x |
80 |
X |
X |
X |
DV |
|
|
92 |
Strongylura marina (Walbaum, 1792) |
1 |
x |
1 |
X |
X |
M-EU |
||
|
93 |
Strongylura notata (Poey, 1860) |
x |
X |
M-EU |
|||||
|
Familia Hemiramphidae |
|||||||||
|
94 |
Hemiramphus brasiliensis (Linnaeus, 1758) |
x |
X |
M-ES |
|||||
|
95 |
Hyporhamphus mexicanus Álvarez, 1959 |
9 |
x |
19 |
X |
X |
X |
DV |
|
|
Orden Cyprinodontiformes |
|||||||||
|
Familia Rivulidae |
|||||||||
|
96 |
Cynodonichthys tenuis Meek, 1904 |
17 |
x |
2 |
X |
X |
X |
DP |
|
|
Familia Profundulidae |
|||||||||
|
97 |
Tlaloc candalarius (Hubbs, 1924) |
29 |
X |
DP+ |
|||||
|
98 |
Tlaloc hildebrandi (Miller, 1950) |
x |
X |
DP+ |
|||||
|
99 |
Tlaloc labialis (Günther, 1866) |
11 |
x |
X |
X |
DP |
|||
|
Familia Fundulidae |
|||||||||
|
100 |
Fundulus grandis Baird y Girard, 1853 |
x |
X |
E |
|||||
|
Familia Poeciliidae |
|||||||||
|
101 |
Belonesox belizanus Kner, 1860 |
51 |
x |
19 |
X |
X |
X |
DS |
|
|
102 |
Carlhubbsia kidderi (Hubbs, 1936) |
24 |
x |
26 |
X |
X |
X |
DS |
|
|
103 |
Gambusia sexradiata Hubbs, 1936 |
4 |
x |
612 |
X |
X |
X |
DS |
|
|
104 |
Gambusia yucatana Regan, 1914 |
98 |
x |
24 |
X |
X |
X |
DS |
|
|
105 |
Heterophallus echeagarayi (Álvarez, 1952) |
3 |
x |
459 |
X |
X |
X |
DS |
|
|
106 |
Phallichthys fairweatheri Rosen y Bailey, 1959 |
14 |
x |
134 |
X |
X |
X |
DS |
|
|
107 |
Poecilia kykesis Poeser, 2002 |
53 |
x |
43 |
X |
X |
X |
DS |
|
|
108 |
Poecilia mexicana Steindachner, 1863 |
199 |
x |
536 |
X |
X |
X |
DS |
|
|
109 |
Poecilia sphenops Valenciennes, 1846 |
30 |
x |
X |
X |
DS |
|||
|
110 |
Poeciliopsis hnilickai Meyer y Vogel, 1981 |
22 |
X |
DS+ |
|||||
|
111 |
Poeciliopsis pleurospilus (Günther, 1866) |
10 |
X |
DS+ |
|||||
|
112 |
Priapella compressa Álvarez, 1948 |
10 |
x |
X |
X |
DS |
|||
|
113 |
Pseudoxiphophorus bimaculatus (Heckel, 1848) |
78 |
x |
94 |
X |
X |
X |
DS |
|
|
114 |
Xenodexia ctenolepis Hubbs, 1950 |
6 |
x |
76 |
X |
DS |
|||
|
115 |
Xiphophorus alvarezi Rosen, 1960 |
10 |
x |
X |
X |
DS |
|||
|
116 |
Xiphophorus hellerii Heckel, 1848 |
47 |
x |
X |
X |
DS |
|||
|
117 |
Xiphophorus maculatus (Günther, 1866) |
21 |
x |
21 |
X |
X |
X |
DS |
|
|
Orden Synbranchiformes |
|||||||||
|
Familia Synbranchidae |
|||||||||
|
118 |
Ophisternon aenigmaticum Rosen y Greenwood, 1976 |
28 |
x |
17 |
X |
X |
X |
DP |
|
|
Orden Carangiformes |
|||||||||
|
Familia Carangidae |
|||||||||
|
119 |
Caranx hippos (Linnaeus, 1766) |
x |
6 |
X |
M-EU |
||||
|
120 |
Chloroscombrus chrysurus (Linnaeus, 1766) |
1 |
x |
X |
M-EU |
||||
|
121 |
Hemicaranx amblyrhynchus (Cuvier, 1833) |
x |
X |
M-ES |
|||||
|
122 |
Oligoplites saurus (Bloch y Schneider, 1801) |
1 |
x |
1 |
X |
M-EU |
|||
|
123 |
Selene vomer (Linnaeus, 1758) |
1 |
x |
X |
M-EU |
||||
|
124 |
Selene setapinnis (Mitchill, 1815) |
x |
X |
M-EU |
|||||
|
125 |
Trachinotus carolinus (Linnaeus, 1766) |
x |
X |
M-ES |
|||||
|
126 |
Trachinotus falcatus (Linnaeus, 1758) |
x |
X |
M-ES |
|||||
|
Orden Pleuronectiformes |
|||||||||
|
Familia Paralichthyidae |
|||||||||
|
127 |
Citharichthys spilopterus Günther, 1862 |
2 |
x |
7 |
X |
M-EU |
|||
|
Familia Bothidae |
|||||||||
|
128 |
Etropus crossotus Jordan y Gilbert, 1882 |
x |
X |
M-ES |
|||||
|
Familia Achiridae |
|||||||||
|
129 |
Achirus lineatus (Quoy y Gaimard, 1824) |
1 |
x |
1 |
X |
M-EU |
|||
|
130 |
Trinectes maculatus (Bloch y Schneider, 1801) |
1 |
x |
3 |
X |
M-EU |
|||
|
Familia Cynoglossidae |
|||||||||
|
131 |
Symphurus civitatium Ginsburg, 1951 |
x |
X |
M-ES |
|||||
|
Orden Syngnathiformes |
|||||||||
|
Familia Syngnathidae |
|||||||||
|
132 |
Microphis lineatus (Kaup, 1856) |
x |
4 |
X |
M-EU |
||||
|
133 |
Syngnathus scovelli (Evermann y Kendall, 1896) |
1 |
x |
X |
M-EU |
||||
|
134 |
Syngnathus louisianae Günther, 1870 |
x |
X |
M-EU |
|||||
|
Orden Scombriformes |
|||||||||
|
Familia Trichiuridae |
|||||||||
|
135 |
Trichiurus lepturus Linnaeus, 1758 |
x |
X |
M-EU |
|||||
|
Orden Perciformes |
|||||||||
|
Familia Centropomidae |
|||||||||
|
136 |
Centropomus mexicanus Bocourt, 1868 |
1 |
x |
5 |
X |
X |
X |
MM |
|
|
137 |
Centropomus parallelus Poey, 1860 |
2 |
x |
4 |
X |
MM |
|||
|
138 |
Centropomus poeyi Chávez, 1961 |
1 |
x |
3 |
X |
X |
X |
MM |
|
|
139 |
Centropomus undecimalis (Bloch, 1792) |
19 |
x |
75 |
X |
X |
X |
MM |
|
|
Familia Gerreidae |
|||||||||
|
140 |
Diapterus auratus Ranzani, 1842 |
x |
205 |
X |
M-EU |
||||
|
141 |
Diapterus rhombeus (Cuvier, 1829) |
1 |
x |
42 |
X |
M-EU |
|||
|
142 |
Eucinostomus argenteus Baird y Girard, 1854 |
x |
X |
M-EU |
|||||
|
143 |
Eucinostomus gula (Quoy y Gaimard, 1824) |
x |
X |
M-EU |
|||||
|
144 |
Eucinostomus melanopterus (Bleeker, 1863) |
x |
12 |
X |
M-EU |
||||
|
145 |
Eugerres mexicanus (Steindachner, 1863) |
70 |
x |
148 |
X |
X |
X |
DV |
|
|
146 |
Eugerres plumieri (Cuvier, 1830) |
2 |
x |
1 |
X |
M-EU |
|||
|
147 |
Gerres cinereus (Walbaum, 1792) |
x |
X |
M-EU |
|||||
|
Familia Polynemidae |
|||||||||
|
148 |
Polydactylus octonemus (Girard, 1858) |
1 |
x |
X |
M-EU |
||||
|
Familia Serranidae |
|||||||||
|
149 |
Epinephelus itajara (Lichtenstein, 1822) |
x |
X |
M-ES |
CR (IUCN, 2016) |
||||
|
Familia Haemulidae |
|||||||||
|
150 |
Conodon nobilis (Linnaeus, 1758) |
x |
X |
M-ES |
|||||
|
151 |
Pomadasys crocro (Cuvier, 1830) |
x |
6 |
X |
X |
M-EU |
|||
|
Familia Lutjanidae |
|||||||||
|
152 |
Lutjanus griseus (Linnaeus, 1758) |
x |
X |
M-EU |
|||||
|
153 |
Lutjanus synagris (Linnaeus, 1758) |
x |
X |
M-ES |
|||||
|
Orden Moroniformes |
|||||||||
|
Familia Ephippidae |
|||||||||
|
154 |
Chaetodipterus faber (Broussonet, 1782) |
x |
X |
M-ES |
|||||
|
Orden Acanthuriformes |
|||||||||
|
Familia Sciaenidae |
|||||||||
|
155 |
Aplodinotus grunniens Rafinesque, 1819 |
15 |
x |
42 |
X |
X |
X |
DV |
|
|
156 |
Bairdiella chrysoura (Lacepède, 1802) |
1 |
x |
X |
M-EU |
||||
|
157 |
Bairdiella ronchus (Cuvier, 1830) |
x |
1 |
X |
M-EU |
||||
|
158 |
Cynoscion arenarius Ginsburg, 1930 |
1 |
x |
X |
M-EU |
||||
|
159 |
Cynoscion nebulosus (Cuvier, 1830) |
x |
X |
M-EU |
|||||
|
160 |
Menticirrhus americanus (Linnaeus, 1758) |
x |
X |
M-EU |
|||||
|
161 |
Menticirrhus saxatilis (Bloch y Schneider, 1801) |
x |
X |
M-EU |
|||||
|
162 |
Micropogonias undulatus (Linnaeus, 1766) |
x |
2 |
X |
M-EU |
||||
|
163 |
Stellifer lanceolatus (Holbrook, 1855) |
1 |
X |
M-EU |
|||||
|
Orden Spariformes |
|||||||||
|
Familia Sparidae |
|||||||||
|
164 |
Archosargus probatocephalus (Walbaum, 1792) |
x |
X |
M-EU |
|||||
|
165 |
Archosargus rhomboidalis (Linnaeus, 1758) |
x |
X |
M-ES |
|||||
|
166 |
Calamus penna (Valenciennes, 1830) |
x |
X |
M-ES |
|||||
|
Orden Tetraodontiformes |
|||||||||
|
Familia Monacanthidae |
|||||||||
|
167 |
Stephanolepis hispidus (Linnaeus, 1766) |
x |
X |
M-ES |
|||||
|
FamiliaTetraodontidae |
|||||||||
|
168 |
Lagocephalus laevigatus (Linnaeus, 1766) |
x |
X |
M-ES |
|||||
|
169 |
Sphoeroides nephelus (Goode y Bean, 1882) |
x |
X |
M-EU |
|||||
|
170 |
Sphoeroides pachygaster (Müller y Troschel, 1848) |
x |
X |
M-EU |
VU (IUCN, 2016) |
||||
|
171 |
Sphoeroides parvus Shipp y Yerger, 1969 |
x |
X |
M-EU |
|||||
|
172 |
Sphoeroides testudineus (Linnaeus, 1758) |
2 |
X |
M-EU |
|||||
|
Total de especies |
85 |
78 |
150 |
De acuerdo con toda la información recabada en la cuenca del río Usumacinta en México, la ictiofauna se encuentra compuesta por 2 clases (Chondrichthyes y Osteichthyes), 28 órdenes, 50 familias y 172 especies (tabla 2). Los cíclidos fueron la familia más diversa con 26 especies (22 nativas y 4 exóticas), siguiendo en importancia Poeciliidae (17 spp.), Gobiidae (11) y Scianidae (9).
El género Astyanax spp., tuvo el mayor número de registros en las bases de datos de las colecciones (505); seguido de Chuco intermedium con 274 y Thorichthys helleri con 272 (tabla 2). De acuerdo a las capturas, los taxones más abundantes fueron: Astyanax spp. (19.5% del total de organismos), Dorosoma petenense (10.2%), D. anale (8.6%), T. helleri (7.3%) y el bagre armado Pterygoplichthys pardalis (6.7%), que es una especie invasora en la cuenca (tabla 2).
En la figura 1 se observa que en el territorio mexicano se han realizado mayor cantidad de recolectas en la zona selva de manera específica en la subcuenca del río Lacantún; así como en la zona de la planicie en el río San Pedro y ecosistemas acuáticos aledaños a la ciudad de Tenosique, Tabasco.
Considerando su afinidad ecológica, las especies registradas en la cuenca se componen de 88 marinas, incluyendo estenohalinas y eurihalinas (51.2%), 76 dulceacuícolas (44.1%) y 8 estuarinas (4.7%). Mientras que entre las especies residentes de los ambientes dulceacuícolas, 54 son nativas, 12 son endémicas y 10 exóticas. Las especies bajo alguna categoría de protección nacional e internacional son 15 (9 dulceacuícolas, 5 marinas y 1 estuarina): Carcharhinus leucas, Megalops atlanticus, Albula vulpes, Lacantunia enigmatica, Potamarius nelsoni, P. usumacintae, Rhamdia guatemalensis, Ctenogobius claytonii, Chuco intermedium, Thorichthys socolofi, Kihnichthys ufermanni, Tlaloc hildebrandi, Atherinella schultzi, Epinephelus itajara y Sphoeroides pachygaster (tabla 3).
Tabla 3
Parámetros ambientales registrados en las zonas del Usumacinta, se indican los promedios y el error estándar entre paréntesis.
|
Parámetro |
Zona selva |
Zona planicie |
Zona delta |
|
Oxígeno disuelto (mg/l) |
6.9 (0.4) |
5.6 (0.4) |
4.4 (0.4) |
|
Temperatura (°C) |
26.2 (0.7) |
29.4 (0.6) |
29.6 (0.4) |
|
Conductividad (μS/cm) |
569.3 (87.8) |
386.3 (109.8) |
3,285.7 (2,116.2) |
|
Salinidad (ups) |
0.3 (0.0) |
0.2 (0.1) |
1.5 (1.1) |
|
pH |
8.4 (0.1) |
8.1 (0.1) |
7.9 (0.1) |
De acuerdo a su distribución, 61 especies presentan una amplia presencia a lo largo de cuenca, de las cuales 5 son especies marinas que migran a lo largo del cauce: Megalops atlanticus, Centropomus poeyi, C. undecimalis, Joturus pichardi y Mugil curema, y 7 son especies exóticas que se encuentran ampliamente distribuidas: Pterygoplichthys disjunctivus, P. pardalis, Pterygoplichthys sp., Oreochromis niloticus, Parachromis managuensis, Cyprinus carpio y Ctenopharyngodon idella.
La distribución de la ictiofauna en las zonas del río Usumacinta indica que en la zona selva se registraron 85 especies, de las cuales la mayor parte son de origen dulceacuícola. Nueve especies nativas se encuentran únicamente en esta zona: Lacantunia enigmatica, Leptophilypnus guatemalensis, K. ufermanni, Rocio ocotal, Tlaloc candalarius, T. hildebrandi, Poeciliopsis hnilickai, Poeciliopsis pleurospilus y Xenodexia ctenolepis. En la zona de la planicie se registraron 78 especies, solo Reoheros coeruleus es la única especie cuya distribución es exclusiva en esta zona, el resto se comparte con las otras, de manera que se comporta como una zona de transición. En la zona delta se registraron 150 especies, de las cuales 84 son de origen marino y estuarino.
Las variables ambientales indicaron que la zona selva tuvo mayor oxígeno disuelto (KW = 8.22, p = 0.01) y menor temperatura (KW = 9.82, p = 0.007) (tabla 3). El pH, la salinidad y conductividad no presentaron diferencias estadísticas significativas.
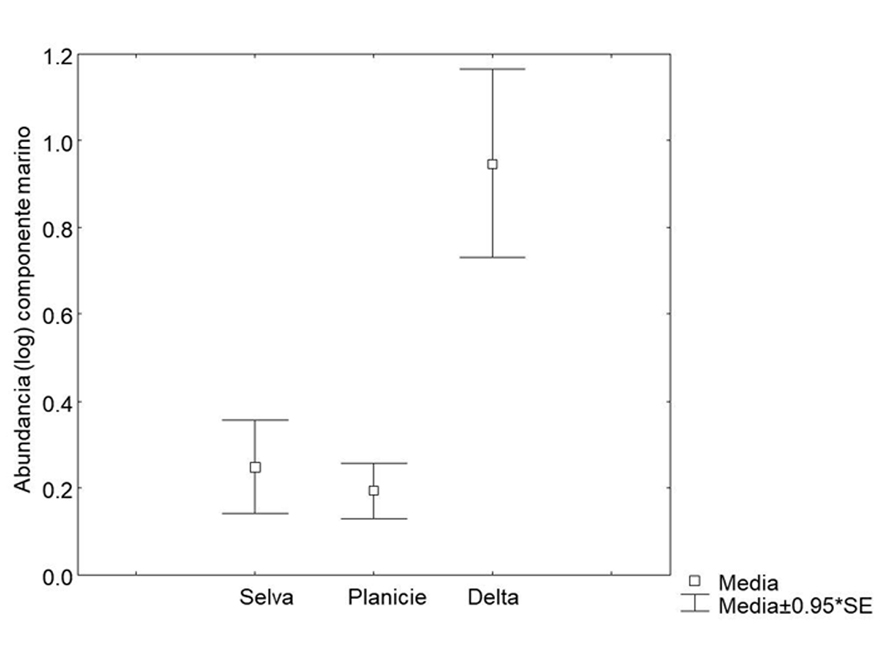
El análisis de similitud basado en la abundancia de los grupos ícticos señaló que la zona delta es diferente por su composición y abundancia (R = 0.197, p = 0.01). Las especies marinas fueron significativamente mayores en esta zona que en las 2 restantes (KW = 9.509, p = 0.008) (fig. 2).
Discusión
Con los registros del presente estudio, la cuenca del río Usumacinta en la porción mexicana alberga 172 especies en un área aproximada de 307,000 km2, esta estimación representa una elevada diversidad íctica para los ríos de México. Por ejemplo, para la cuenca del Grijalva se han enlistado 92 especies de peces (Gómez-González et al., 2015). Realizar recolectas en áreas poco exploradas permitirá incrementar el conocimiento de la ictiofauna, tal como se sucedió en la Reserva de la Biosfera Pantanos de Centla, donde se habían registrado 106 especies (Arévalo-Frías y Mendoza-Carranza, 2012) y como resultado del presente trabajo donde se reporta por primera vez a Carassius auratus, Gobionellus aff. atripnnis y G. robustum. De acuerdo a la georeferenciación de la información recabada, existen áreas poco exploradas por lo que estudios subsecuentes deberán dirigirse en los ríos ubicados en la región de las cañadas de Ocosingo y Margaritas, en los lagos endorreicos de la Reserva de la Biosfera de Montes Azules y del Parque Nacional Lagunas de Montebello, y en la zona costera en los ríos San Pedro-San Pablo y Palizada hasta su desembocadura en la laguna de Términos.
Uno de los cambios más notables y negativos para la ictiofauna del río Usumacinta es la presencia de las especies exóticas e introducidas a la cuenca con fines de producción acuícola o por accidentes antropogénicos entre ellas destacan 3 especies de origen asiático de la familia Cyprinidae, 3 especies de origen africano de la familia Cichlidae y los bagres armados Pterygoplichthys spp., originarios de Brasil (Nelson et al., 2016). Estos bagres invasores fueron reportados para la cuenca desde 2005 (Sánchez, Florido et al., 2015; Wakida-Kusunoki et al., 2007), su abundancia y amplia distribución es alarmante a pesar de que se desconoce el impacto de estas especies en la dinámica de la comunidad de peces en la cuenca (Lienart et al., 2013); sin embargo, pueden tener efectos directos en los peces nativos (Chaichana y Jongphadungkiet, 2012).
Durante la revisión, se evidenciaron problemas taxonómicos que requieren atención tales como los ejemplares de Cathorops que manifestaron algunas características morfológicas diferentes a las asignadas para la especie C. kailolae (Marceniuk y Betancur, 2008). Los bagres armados cuya morfología permitió definir a las especies P. pardalis y P. disjunctivus, también muestran características mezcladas que no permitieron diferenciar a las especies, incluidas como Pterygoplichthys sp., es necesaria la revisión más detallada de este género (Álvarez-Pliego et al., 2015) incluyendo otras herramientas de análisis como las moleculares. Las especies propuestas para el género Astyanax (Schmitter-Soto, 2017), que no fueron consideradas en el presente estudio, requieren una revisión taxonómica más detallada.
Las diferencias en la riqueza biológica, distribución y abundancia de los peces en los ríos tropicales pueden ser el producto de diversos factores como la historia geológica de la cuenca, diversidad acuática y su dinámica fluvial (Albert et al., 2011; Lowe-McConnell, 1987; Winemiller et al., 2008, 2010). En la cuenca del río Usumacinta, el tiempo de origen y aislamiento de la zona selva (Mioceno tardío) (INE, 2000a), es un factor que pudo facilitar la existencia de un mayor número de elementos endémicos en la cuenca: como el bagre del Lacantún, Lacantunia enigmatica distribuido en los ríos Lacantún y Lacanjá (Rodiles-Hernández, Hendrickson et al., 2005); Kihnichthys ufermanni habitante de ríos de la Reserva de Montes Azules (Miller et al., 2009; Soria-Barreto y Rodiles-Hernández, 2008), Rocio ocotal y la nueva especie propuesta Astyanax ocotal, en la laguna Ocotal (Schmitter-Soto, 2007; 2017). En contraste, las zonas planicie y delta son geológicamente más recientes (Hudson et al., 2005; INE, 2000b). Hidrológicamente, la zona media manifiesta periodos de inundación que permiten conectar el canal principal con algunos sistemas lagunares (Castillo-Domínguez et al., 2011); este fenómeno permite la migración lateral de los peces y su permanencia en las lagunas del plano de inundación.
La zona delta fue la más diversa y con mayor riqueza de peces marinos que entran al río de manera constante, encuentran refugio y alimentación y logran su crecimiento en las zonas de humedales en los ríos y lagunas (Arévalo-Frías y Mendoza-Carranza, 2012; Ayala-Pérez et al., 2015). Miembros de las familias Scianidae, Gobiidae y Gerreidae, entre otras, se distribuyen principalmente en esta sección de la cuenca, lo cual refleja la fuerte interacción de ambiente marino con el dulceacuícola, creando condiciones estuarinas óptimas para la presencia de estos peces de afinidad marina (Yáñez-Arancibia et al., 2009).
El flujo continuo del río Usumacinta a lo largo de su cuenca, permite el ingreso de 5 especies marinas migratorias hasta la subcuenca del Lacantún, y destacan por su importancia pesquera y económica las especies de los robalos blanco y prieto Centropomus undecimalis y C. poeyi, respectivamente (Caballero-Chávez, 2011; Carta Nacional Pesquera, 2012; Hernández-Vidal et al., 2014; Perera-García et al., 2008; Sánchez, Salcedo et al., 2015).
En conclusión, el presente trabajo constituye la primera aproximación sobre la riqueza íctica en la cuenca del Usumacinta de México. El análisis de las zonas de estudio, permitió evidenciar una diferenciación en la diversidad de peces a lo largo de la cuenca. No obstante, dada la extensión, complejidad de paisaje y las características hidrológicas de la cuenca, se requiere efectuar estudios a una escala más fina como las subcuencas y unidades geomorfológicas, de tal forma que se expliquen los patrones biogeográficos y de diversidad. Desde el punto de vista ecológico, es necesario analizar los factores que afectan la distribución de manera local, por ejemplo, en la zona de la planicie de inundación los estudios deben enfocarse en las lagunas y sus características como la profundidad, distancia del río principal o grado de aislamiento.
Agradecimientos
Al proyecto “Conectividad y Diversidad Funcional del Usumacinta” y a la Comisión Federal de Electricidad por el apoyo otorgado. Al Sistema Nacional de Información sobre Biodiversidad de la Comisión Nacional para el Conocimiento y Uso de la Biodiversidad, por facilitar las bases de datos de los proyectos AE002, T023, T027, U014, Y026. A los directores de las Reservas y al personal técnico de las Reservas de la Biosfera de Montes Azules, Lacantún, Yaxchilán, Pantanos de Centla y Laguna de Términos por su la accesibilidad a los sitios y apoyo en la logística. Se agradece a Edgar Aragón, Gamaliel Álvarez, Karen Cárdenas, Yuriria Olvera, Carlos Garita, Beatriz Naranjo y Jazmín Terán por su apoyo en el trabajo de campo y laboratorio. A Darío Alejandro Navarrete Gutiérrez por su apoyo en la elaboración de la figura 1. Las recolectas se hicieron con el Permiso de Pesca DGOPA.07525.250706.3233. Rocío Rodiles-Hernández agradece el financiamiento otorgado por la Conabio para realizar los proyectos FM020, EE025 y DC001, así como al proyecto FOMIX-CHIS-2007-07-77187. También agradece al Conacyt (265570) y al SNI por las becas otorgadas.
Referencias
Albert, J. S., Petry, P. y Reis, R. E. (2011). Major biogeographic and phylogenetic patterns. En J. S. Albert y R. E. Reis (Eds.), Historical biogeography of Neotropical freshwater fishes (pp. 21–57). Los Angeles: University of California Press.
Álvarez-Pliego, N., Sánchez, A. J., Florido, R. y Salcedo, M. A. (2015). First record of South American suckermouth armored catfishes (Loricariidae, Pterygoplichthys spp.) in the Chumpan system, southeast Mexico. BioInvasions Records, 4, 309–314.
Álvarez-Pliego, N., Sánchez, A. J., Florido, R., Salcedo, M. A., Macossay-Cortez, A., Brito, R. et al. (2016). New records and extension of geographical distribution of Heterophallus echeagarayi (Poeciliidae) in the Usumacinta Province, Mexico. Cybium, 40, 178–180.
Arévalo-Frías, W. y Mendoza-Carranza, M. (2012). Larvas y juveniles de peces en ambientes estuarinos de la Reserva de la Biosfera Pantanos de Centla y su costa adyacente. En A. J. Sánchez, X. Chiappa-Carrara y R. Brito Pérez (Eds.), Recursos acuáticos costeros del sureste (pp. 242–269). Mérida: Fondo Mixto Conacyt/ Gobierno del Estado de Yucatán, Red para el Conocimiento de los Recursos Costeros del Sureste/ Universidad Nacional Autónoma de México, Unidad Académica Sisal.
Ayala-Pérez, L. A., Ramos, M. J., Flores, H. D., Sosa, L. A. y Martínez, R. G. E. (2015). Ictiofauna marina y costera de Campeche. México D.F.: Universidad Autónoma de Campeche/ Universidad Autónoma Metropolitana.
Caballero-Chávez, V. (2011). Reproducción y fecundidad del robalo blanco (C. undecimalis) en el suroeste de Campeche. Ciencia Pesquera, 19, 35–45.
Capps, K. A., Nico, L. G., Mendoza-Carranza, M., Arévalo-Frías, W., Ropicki, A. J., Heilpern, S. A. et al. (2011). Salinity tolerance of non-native suckermouth armoured catfish (Loricariidae: Pterygoplichthys) in south-eastern Mexico: implications for invasion and dispersal. Aquatic Conservation: Marine and Freshwater Ecosystems, 21, 528–540.
Carta Nacional Pesquera. (2012). Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. Diario Oficial. Viernes 14 de agosto de 2012.Segunda sección.
Castillo-Domínguez, A., Barba-Macías, E., Navarrete, A. D. J., Rodiles-Hernández, R. y Jiménez Badillo, M. D. L. (2011). Ictiofauna de los humedales del río San Pedro, Balancán, Tabasco, México. Revista de Biología Tropical, 59, 693–708.
Castillo-Domínguez, A., Melgar-Valdés, C. E., Barba-Macías, E., Rodiles-Hernández, R., Navarrete, A. J., Perera-García, M. A. et al. (2015). Composición y diversidad de peces del río San Pedro, Balancán, Tabasco, México. Hidrobiológica, 25, 285–292.
Castro-Aguirre, J. L., Espinosa-Pérez, H. y Schmitter-Soto, J. J. (1999). Ictiofauna estuarino-lagunar y vicaria de México. México D.F.: Limusa-Noriega.
Chaichana, R. y Jongphadungkiet, S. (2012). Assessment of the invasive catfish Pterygoplichthys pardalis (Castelnau, 1855) in Thailand: ecological impacts and biological control alternatives. Tropical Zoology, 2012, 1–10.
Chávez-Lomelí, M. O., Mattheuws, A. E. y Perez-Vega, M. H. (1988). Biología de 10 peces del rio San Pedro en vista de determinar su potencial para la piscicultura. Villahermosa: Instituto Nacional de Investigaciones sobre Recursos Bióticos.
Contreras-Balderas, S. (2008). Especies de peces introducidas en aguas continentales de México. Catálogo y manuscrito. México D.F.: Bases de datos SNIB2010-Conabio Proyecto No. AE002.
Díaz-Pardo, E. (2003). Sistematización de la Colección nacional de peces dulceacuícolas mexicanos de la Escuela Nacional de Ciencias Biológicas, IPN. México D.F.: Escuela Nacional de Ciencias Biológicas, Instituto Politécnico Nacional. Bases de datos SNIB2010-Conabio proyecto No. T027.
Domínguez-Cisneros, S. y Rodiles-Hernández, R. (1997). Guía de peces del Río Lacanjá, Selva Lacandona, México. San Cristóbal de Las Casas Chiapas: El Colegio de la Frontera Sur.
Eschmeyer, W. N., Fricke, R. y van der Laan, R. (2018). Catalog of fishes: genera, species, references. Recuperado el 2 de julio, 2018 de: http://researcharchive.calacademy.org/research/ichthyology/catalog/fishcatmain.asp
Espinosa-Pérez, H. (2002). Computarización de la Colección Nacional de Peces del Instituto de Biología UNAM. México D.F.: Instituto de Biología, Universidad Nacional Autónoma de México. Bases de datos SNIB2010-Conabio proyecto No. T023.
Espinosa-Pérez, H. y Daza-Zepeda, A. (2005). Peces. En J. Bueno, F. Álvarez y S. Santiago (Eds.). Biodiversidad del estado de Tabasco (pp. 225–240). México D.F.: Instituto de Biología, UNAM/ Conabio.
Espinosa-Pérez, H., Martínez, C. A. y Sepúlveda. J. D. (2014). Leptophilypnus guatemalensis Thacker & Pezold, 2006 (Gobiiformes: Eleotridae): first record in México. Check List, 10, 1535–1537.
Espinosa-Pérez, H. S, Valencia-Díaz, X. y Rodiles–Hernández, R. (2011). Peces dulceacuícolas de Chiapas. En F. Álvarez-Noguera (Ed.), Chiapas: estudios sobre su diversidad biológica (pp. 401–457). México D.F.: Instituto de Biología y Dirección General de Publicaciones, UNAM.
Gaspar-Dillanes, M. T. (1996). Aportación al conocimiento de la ictiofauna de la Selva Lacandona, Chiapas. Zoologia Informa, 1996, 41–54.
Gómez-González, A. E., Velázquez-Velázquez, E., Anzueto, C. M. J. y Maza-Cruz, M. F. (2015). Fishes of the Grijalva River basin of Mexico and Guatemala. Check List, 11, 1–11.
González-Acosta, A. F. y Rodiles-Hernández, R. (2013). New species of Eugerres from the Usumacinta Province, México and Guatemala with a redescription of E. mexicanus (Steindachner , 1863) (Teleostei : Gerreidae). Neotropical Ichthyology, 11, 307–318.
Hammer, O., Harper, D. A. T. y Ryan, P. D. (2001). PAST: paleontological statistics software package for education and data analysis. Paleontologia Electronica, 4, 9.
Hernández-Gómez, R. E., Perera-García, M. A., Valenzuela C. I, Durán, M. T. y Mendoza-Carranza, M. (2013). Embryonic Development of Aplodinotus grunniens (Perciformes: Sciaenidae) in Tenosique, Tabasco, Mexico. International Journal of Morphology, 31, 633–639.
Hernández-Vidal, U., Chiappa-Carrara, X., y Contreras-Sánchez, W. (2014a). Variabilidad reproductiva del robalo común, Centropomis undecimalis, en ambientes de salinidad contrastante interconectados por el sistema fluvial Grijalva-Usumacinta. Ciencias Marinas, 40, 173–185.
Hudson, P. F., Hendrickson, D. A., Benke, A. C., Varela-Romero, A., Rodiles-Hernández R. y Minckley, W. L. (2005). Rivers of Mexico. En C. Benke y C. E. Cushing (Eds.), Rivers of North America (pp. 1031–1084). Oxford, RU: Elsevier.
INE (Instituto Nacional de Ecología). (2000a). Programa de manejo de Reserva de la Biosfera Montes Azules, México. México D.F.: Instituto Nacional de Ecología, Semarnap.
INE (Instituto Nacional de Ecología). (2000b). Programa de manejo de Reserva de la Biosfera Pantanos de Centla, México. México D.F.: Instituto Nacional de Ecología, Semarnap.
Jelks, H. L., Walsh, S. J., Burkhead, N. M., Contreras-Balderas, S., Díaz-Pardo, E., Hendrickson, D. A. et al. (2008). Conservation status of imperiled North American freshwater and diadromous fishes. Fisheries, 33, 372–389.
Lazcano-Barrero, M. A. y Vogt, R. C. (1992). Peces de la Selva Lacandona, un recurso potencial. En M. A. Vásquez-Sánchez y M. A. Ramos, O. (Eds.). Reserva de la Biosfera Montes Azules, Selva Lacandona: investigación para su conservación (pp. 135–144). San Cristóbal de Las Casas Chiapas: Conservación de los Recursos Naturales/ Centro de Investigaciones Ecológicas del Sureste/ Publicaciones especiales ECOSFERA No. 1.
Lienart, G. H., Rodiles-Hernández, R. y Capps, K. A. (2013). Nesting burrows and behavior of nonnative catfishes (Siluriformes : Loricariidae) in the Usumacinta-Grijalva Watershed, Mexico. The Southwestern Naturalist, 58, 238–243.
Lowe-McConnell, R. H. (1987). Ecological studies in tropical fish communities. Cambridge, RU: Cambridge University.
Lozano-Vilano, M. L. y Contreras-Balderas, S. (1987). Lista zoogeográfica y ecológica de la ictiofauna continental de Chiapas, Mexico. The Southwestern Naturalist, 32, 223–236.
Lozano-Vilano, M. L., García-Ramírez, M. E., Contreras-Balderas, S. y Ramírez-Martínez, C. (2007). Diversity and conservation status of the Ichthyofauna of the Río Lacantún basin in the Biosphere Reserve Montes Azules, Chiapas, México. Zootaxa, 1410, 43–53.
Macossay-Cortéz, A., Sánchez, A. J., Florido, R., Huidobro, L. y Montalvo-Urgel, H. (2011). Historical and environmental distribution of ichthyofauna in the tropical wetland of Pantanos de Centla, southern Gulf of Mexico. Acta Icthyologica et Piscatoria, 41, 229–245.
Marceniuk, A. P. y Betancur, R. (2008). Revision of the species of the genus Cathorops (Siluriformes: Ariidae) from Mesoamerica and the Central American Caribbean, with description of three new species. Neotropical Ichthyology, 6, 25–44.
Matamoros, W. A., McMahan, C. D., Chakrabarty, P., Albert, J. S. y Schaefer, J. F. (2015). Derivation of the freshwater fish fauna of Central America revisited: Myers’s hypothesis in the twenty-first century. Cladistics, 31, 177–188.
McMahan, C. D., Matamoros, W. M., Piller, K. R. y Chakrabarty, P. (2015). Taxonomy and systematics of the Herichthys (Cichlidae: Tribe Heroini), with the description of eight a new Middle American Genera. Zootaxa, 3999, 211–234.
Mendoza-Carranza M., Hoeinghaus, D. J., García, A. M. y Romero-Rodríguez, A. (2010). Aquatic food webs in mangrove and seagrass habitats of Centla Wetland, a Biosphere Reserve in Southeastern Mexico. Neotropical Ichthyology, 8, 171–178.
Miller, R. R. (1986). Composition and derivation of the freshwater fish fauna of Mexico. Anales de la Escuela Nacional de Ciencias Biológicas, México, 30, 121–153.
Miller, R. R., Minckley, W. L. y Norris, S. M. (2009). Peces dulceacuícolas de México. Mexico City: Comisiòn Nacional para el Conocimiento y Uso de la Biodiversidad/ El Colegio de la Frontera Sur/ Sociedad Ictiológica Mexicana/ Desert Fishes Council.
Morales-Román, M. y Rodiles-Hernández, R. (2000). Implicaciones de Ctenopharyngodon idella en la comunidad de peces del río Lacanjá, Chiapas. Hidrobiológica, 10, 13– 24.
Muñoz-Alonso, L. A. y March-Mifsut, I. J. (2003). Actualización y enriquecimiento de las bases de datos del proyecto de evaluación y análisis geográfico de la diversidad faunística de Chiapas. México D.F.: El Colegio de la Frontera Sur. Bases de datos SNIB2010-Conabio proyectos No. U014 y P132.
Myers, G. S. (1949). Salt-tolerance of Fresh-water fish groups in relation to zoogeographical problems. Bijdragen tot der Dierkunde, 28, 315–322.
Nelson, J. S., Grande, T. C. y Wilson, M. V. H. (2016). Fishes of the world. Hoboken, New Jersey: John Wiley and Sons.
Perera-García, M. A., Mendoza-Carranza, M., Contreras-Sánchez, W., Ferrara, A., Huerta-Ortíz, M. y Hernández-Gómez, R. E. (2013). Comparative age and growth of common snook Centropomus undecimalis (Pisces: Centropomidae) from coastal and riverine areas in Southern Mexico. Revista de Biología Tropical, 61, 807–819.
Perera-García, M. A., Mendoza-Carranza, M. y Paramo-Delgadillo, S. (2008). Reproductive and population dynamics of common snook Centropomus undecimalis (Perciformes: Centropomidae) in Barra San Pedro, Centla, Mexico. Universidad y Ciencia, 24, 49–60.
Poeser, F. N. (2002). Poecilia kykesis nom. nov., name for Mollienesia petenensis Günther, 1866, and redescription, revalidation and the designation of a lectotype for Poecilia petenensis Günther, 1866 (Teleostei: Poeciliidae). Contribution to Zoology, 70, 243–246.
Ramírez-Martínez, C., Naranjo, E., Caspeta, J. M., Espinosa-Pérez, H. y Barba, R. (2015). Ecosistemas acuáticos. En J. Carabias, J. de la Maza y R. Cadena (Eds.), Conservación y desarrollo sustentable en la Selva Lacandona. 25 años de actividades y experiencias (pp. 193 –207). México D.F.: Natura y Ecosistemas Mexicanos.
Ramos-Miranda J. y Villalobos-Zapata, G. J. (2015). Aspectos socioambientales de la región de la laguna de Términos, Campeche. Campeche: Universidad Autónoma de Campeche.
Rican, O., Pialek, L., Dragova, K. y Novak, J. (2016). Diversity and evolution of the Middle American cichlid fishes (Teleostei. Cichlidae) with revised classification. Vertebrate Zoology, 66, 1 –102.
Rodiles-Hernández, R. (2005). Diversidad de peces continentales en Chiapas. En M. González-Espinosa, N. Ramírez-Marcial y L. Ruíz-Montoya (Eds.), Diversidad biológica de Chiapas (pp. 195–220). México D.F.: Plaza y Valdés/ ECOSUR/ COCYTECH.
Rodiles-Hernández, R., Díaz-Pardo, E. y Lyons, J. (1999). Patterns in the species diversity and composition of the fish community of the Lacanja River, Chiapas, Mexico. Journal of Freshwater Ecology, 14, 455–468.
Rodiles-Hernández, R., González-Díaz, A. A. y Chan-Sala, C. (2005). Lista de peces continentales de Chiapas, México. Hidrobiológica, 15, 245–253.
Rodiles-Hernández, R., González-Díaz, A. A., González-Acosta, A. F., Soria-Barreto, M. y Espinosa-Pérez, H. S. (2013). Ictiofauna. En Comisión Nacional para el Conocimiento y Uso de la Biodiversidad y Gobierno del Estado de Chiapas (Eds.), La biodiversidad en Chiapas: estudio de estado (pp. 283–297). México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/ Gobierno del Estado de Chiapas.
Rodiles-Hernández, R., Hendrickson D. A., Lundberg, J. G. y Humphries, J. M. (2005). Lacantunia enigmatica (Teleostei: Siluriformes) a new and phylogenetically puzzling freshwater fish from Mesoamerica. Zootaxa, 1000, 1–24.
Rodríguez, R. E. (2002). Las lagunas continentales de Tabasco. Colección José N. Rovirosa. Biodiversidad, Desarrollo sustentable y Trópico Húmedo. Villahermosa: Universidad Juárez Autónoma de Tabasco.
Sánchez, A. J., Florido, R., Álvarez-Pliego, N. y Salcedo, M. A. (2015). Distribución de Pterygoplichthys spp. (Siluriformes: Loricariidae) en la cuenca baja de los ríos Grijalva-Usumacinta. Revista Mexicana de Biodiversidad, 86, 1099 –1102.
Sánchez, A. J., Florido, R., Salcedo, M. A., Ruiz-Carrera, V., Montalvo-Urgel, H. y Raz-Guzmán, A. (2012). Macrofaunistic diversity in Vallisneria americana Michx. In a tropical wetland, southern Gulf of Mexico. En M. Ali (Ed.), Diversity of ecosystems (pp.1–26). Rijeka, Croatia: InTech.
Sánchez, A. J., Salcedo, M. A., Florido, R., Mendoza, J. D., Ruíz-Carrera, V. y Álvarez-Pliego, N. (2015). Ciclos de inundación y servicios ambientales en Grijalva-Usumacinta. ContactoS, 97, 5–14.
Schmitter-Soto, J. J. (2007). A systematic revision of the genus Archocentrus (Perciformes: Cichlidae), with the description of two new genera and six new species. Zootaxa, 1603, 1–78.
Schmitter-Soto, J. J. (2017). A revision of Astyanax (Characiformes: Characidae) in Central and North America, with the description of nine species. Journal of Natural History, 51, 1331–1424.
Semarnat (Secretaría del Medio Ambiente y Recursos Naturales). (2010). Norma Oficial Mexicana NOM-059-SEMARNAT-2010, Protección ambiental – Especies nativas de México de flora y fauna silvestres – Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio – Lista de especies en riesgo. Diario Oficial de la Federación. 30 de diciembre de 2010, Segunda Sección, México.
Soria-Barreto, M. y Rodiles-Hernández, R. (2008). Spatial distribution of cichlids in Tzendales River, Biosphere Reserve Montes Azules, Chiapas, Mexico. Environmental Biology of Fishes, 83, 459–469.
Sosa-Nishizaki, O., Taniuchi, T., Ishihara, H. y Shimizu, M. (1998). El tiburón chato, Charharhinus leucas (Valenciennes, 1841), del río Usumacinta, Tabasco, México, con notas sobre la composición de su suero sanguíneo y osmolaridad. Ciencias Marinas, 24, 183–192.
Soto-Galera, E. (2006). Ictiofauna de los corredores biológicos Sierra Madre del Sur y Selva Maya Zoque. México D.F.: Instituto Politécnico Nacional. Informe final SNIB-Conabio proyecto No. Y026.
Toledo, A. (2003). Ríos, costas, mares. Hacia un análisis integrado de las regiones hidrológicas de México. México D.F.: Instituto Nacional de Ecología/ El Colegio de México, A.C./ El Colegio de Michoacán, A.C.
UICN. (2018). The IUCN Red list of threatened species. Version 2018-1. Recuperado 5 de julio 2018 de: http://www.iucnredlist.org
Valdez-Zenil, J., Rodiles-Hernández, R., González-Acosta, A. F., Mendoza-Carranza, M. y Barba, M. E. (2014). Length-weight and length-length relationships, gonadosomatic indices and size at first maturity of Eugerres mexicanus (Steindachner, 1863) (Percoidei: Gerreidae) from the Usumacinta River, Mexico. Journal of Applied Ichthyology, 30, 218–220.
Velasco, C. R. (1976). Los peces de agua dulce del estado de Chiapas. Tuxtla Gutiérrez: Gobierno del Estado de Chiapas.
Velázquez-Velázquez, E., Contreras-Balderas, S., Domínguez-Cisneros, S. y Gómez-González, A. E. (2013) Riqueza y diversidad de peces continentales. En Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (Ed.), La biodiversidad en Chiapas: estudio de caso. (pp. 275–282). México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/ Gobierno del Estado de Chiapas.
Velázquez-Velázquez, E., López-Vila, J. M., Gómez-González, A. E., Romero-Berny, E. I., Lievano-Trujillo, J. L. y Matamoros, W. A. (2016). Checklist of the continental fishes of the state of Chiapas, Mexico and their distribution. ZooKeys, 632, 99–120.
Wakida-Kusunoki, A. T. y Amador-del Ángel, E. (2008). Nuevos registros de los plecos Pterygoplichthys pardalis (Castelnau 1855) y P. disjunctivus (Weber 1991) (Siluriformes: Loricariidae) en el Sureste de México. Hydrobiologica, 18, 251–256.
Wakida-Kusunoki, A. T., Ruiz-Carus, R. y Amador-del Ángel, E. (2007). Amazon sailfin catfish, Pterygoplichthys pardalis (Castelnau, 1855) (Loricariidae), another exotic species established in southeastern Mexico. The Southwestern Naturalist, 52, 141–144.
Winemiller, K. O. (2005). Floodplain river food webs: generalizations and implications for fisheries management. En R. L. Welcomme y T. Petrs (Eds.), Proceedings of the Second International Symposium on the Management of Large Rivers for Fisheries, Volume 2 (pp. 285–312). Phnom Penh, Camboya: Mekong River Commision.
Winemiller, K. O., Agostinho, A. A. y Caramaschi, E. P. (2008). Fish ecology in tropical streams. En D. Dudgeon (Ed.), Tropical stream ecology (pp.107 –146). Burlington Massachusetts: Academic Press.
Winemiller, K. O., Hoeinghaus, D. J., Pease, A. A., Esselman, P. C., Honeycutt, R. L., Gbannador, D. et al. (2010). Stable isotope analysis reveals food web structure and watershed impacts along the fluvial gradient of a mesoamerican coata river. River Research and Applications, 27, 791–803.
Winemiller, K. O. y Jepsen, D. B. (1998). Effects of seasonality and fish movement on tropical river food webs. Journal of Fish Biology, 53, 267–296.
Yáñez-Arancibia, A., Day, J. W. y Currie-Alder, B. (2009). Functioning of the Grijalva-Usumacinta river delta, Mexico: challenges for coastal management. Ocean Yearbook, 3, 479–507.
