Juan A. Sarquis a, b, *, Alejandro R. Giraudo a, b, Fabricio Reales c y Sebastián Dardanelli d
a Universidad Nacional del Litoral-Consejo Nacional de Investigaciones Científicas y Técnicas, Instituto Nacional de Limnología, Ciudad Universitaria Paraje el Pozo s/n, Santa Fe, Santa Fe, Argentina
b Universidad Nacional del Litoral, Facultad de Humanidades y Ciencias, Ciudad Universitaria Paraje el Pozo s/n, Santa Fe, Santa Fe, Argentina
c Universidad Autónoma de Entre Ríos-Consejo Nacional de Investigaciones Científicas y Técnicas, Centro de Investigación Científica y de Transferencia Tecnológica a la Producción, Laboratorio de Ornitología y Conservación, España 149, Diamante (E3105BWA), Entre Ríos, Argentina
d Instituto Nacional de Tecnología Agropecuaria, Estación Experimental Agropecuaria Paraná, Ruta 11, km 12,5, Oro Verde, Entre Ríos, Argentina
*Autor para correspondencia: juandres.sarquis@gmail.com (J.A. Sarquis)
Recibido: 17 septiembre 2020; aceptado: 22 febrero 2021
Resumen
La región neotropical se caracteriza por su gran riqueza de aves, cuya protección e inventarios presentan sesgos de representación geográfica y composición de especies. En la provincia de Entre Ríos, las áreas protegidas han sido establecidas con escasa planificación, lo que generó profundos sesgos en la representatividad de la biodiversidad provincial. Se actualizó el inventario de las aves de Entre Ríos con 80,000 registros. Se dividió la provincia en 39 celdas de 0.5° lat-long para analizar la riqueza de aves y priorizarlas mediante un análisis de complementariedad. Se comparó el sistema de áreas protegidas (AP) con las áreas complementarias para detectar vacíos de conservación. Entre Ríos posee 396 especies requiriendo 10 celdas para incluirlas a todas. Las áreas prioritarias mayormente incluyeron celdas sobre los ríos Paraná y Uruguay. Estas áreas prioritarias se superponen deficientemente con las AP existentes. Se recomienda la creación de nuevas AP o cambiar las categorías de protección de AP ubicadas en las áreas prioritarias. El presente trabajo revaloriza la importancia de contar con inventarios actualizados para poder realizar priorizaciones espaciales y contrastar el sistema actual de AP para generar sistemas representativos y eficientes.
Palabras clave: Áreas prioritarias; Áreas protegidas; Riqueza; Complementariedad; Inventarios
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Inventory and complementary areas for the conservation of the birds of Entre Ríos Province, Argentina
Abstract
The Neotropical region is characterized by the high species richness of birds, whose protection and inventories show biases due to lack of geographic representation and species diversity. In Entre Ríos province its protected areas have not been well established, generating biases in biodiversity representativeness. We updated the birds’ inventory of Entre Ríos with 80,000 records. The province was divided into 39 cells of 0.5° lat-long to analyze birds’ richness and priority areas through a complementary analysis. The Protected Areas (PAs) system was overlapped with the complementary areas to detect gap conservation areas. Entre Ríos presents 396 bird species and needs 10 cells to protect them all. The priority areas included cells on the Paraná and Uruguay rivers. These priority areas overlap poorly with the current PAs system. We recommend the creation of new PAs or change the protection categories of PAs that overlap with priority areas selected. This work revaluates the importance of updated inventories to perform spatial prioritization and contrast the current PAs system to generate representative and efficient systems.
Keywords: Priority areas; Protected areas; Richness; Complementary; Inventories
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
La pérdida de biodiversidad causada por cambios en el uso de la tierra, cambio climático, pérdida y fragmentación de hábitats, invasión de especies exóticas, sobreexplotación de especies y el crecimiento poblacional humano es un tema de preocupación mundial (Ceballos et al., 2017). Resulta fundamental el desarrollo de programas de conservación que puedan implementarse en todas las escalas (local, regional y global) para optimizar los recursos disponibles y ser eficientes en conservar la diversidad biológica (Ceballos y Ortega-Baes, 2011). La planeación sistemática para la conservación requiere inventarios adecuados de biodiversidad, que permitan comparar áreas mediante riqueza y complementariedad para detectar áreas prioritarias representativas y evaluar vacíos en los sistemas de áreas protegidas (AP; Margules y Sarkar, 2007). Las soluciones a la crisis de la biodiversidad necesitan de un abordaje geográfico con datos precisos (Arzamendia y Giraudo, 2012). Las AP constituyen la primera línea de defensa para proteger la biodiversidad ya que en muchos casos son efectivas para mitigar las actividades antrópicas (Gray et al., 2016). Desde 1990, la red mundial de AP ha crecido un promedio de 2.5% anuales en su extensión ocupando más de 17 millones de km2 terrestres, aunque solo 5.8% presenta categorías estrictas de protección (Butchart et al., 2010). Uno de los objetivos del establecimiento de AP consiste en cubrir la totalidad de especies de interés (Rodrigues et al., 2004). No obstante, por oportunismo u otros criterios variados, muchas AP no cubren el total de especies de un área ni se superponen con las áreas de mayor diversidad (Chape et al., 2005; Margules y Sarkar, 2007). La complementariedad es un principio clave para lograr la representatividad necesaria, porque logra incluir al menos una vez a todas las especies analizadas en el menor conjunto de celdas posibles (Margules y Sarkar, 2007). De las 75 ecorregiones sudamericanas, 35 tienen menos de 10% de su extensión total protegida y solo 13 ecorregiones presentan categorías estrictas de conservación. Los ecosistemas boscosos están bien representados mientras que los desiertos, pastizales y humedales son ecosistemas deficientemente representados en los sistemas de AP (Soutullo y Gudynas, 2006).
En Entre Ríos, el avance de la agricultura, las forestaciones con especies exóticas y la urbanización, han disminuido y modificado fuertemente los hábitats naturales. Entre ellos, una parte importante de los pastizales subtropicales del sureste de Sudamérica (SESA), un ecosistema amenazado a nivel global (Azpiroz et al., 2012). Además, posee algunos de los relictos más australes del hotspot “Selva Atlántica o Paranaense”, representada en los bosques en galería del río Uruguay y otras ecorregiones diversas, algunas amenazadas como el valle de inundación del río Paraná y su delta, los bosques y sabanas del Espinal y los pastizales pampeanos (Arzamendia y Giraudo, 2012).
En la última década, las bases de datos de acceso abierto disponibles en la web y los proyectos de ciencia ciudadana han contribuido enormemente a la disponibilidad de datos de biodiversidad (Domínguez et al., 2020), complementando a las colecciones biológicas y a los listados sistemáticos. A pesar de ello, los datos disponibles continúan siendo en algunas regiones escasos y sesgados (Callaghan et al., 2019). Estos sesgos presentan deficiencias Wallaceanas referidas a los vacíos en el conocimiento sobre la distribución geográfica de las especies, y Linneanas, que son deficiencias en el conocimiento de la composición de especies (Bini et al., 2006). Para subsanar estas deficiencias es importante evaluar la calidad de los datos, desde los registros históricos hasta los registros actuales (Navarro-Sigüenza et al., 2014).
Tanto la provincia de Entre Ríos, como gran parte de la región neotropical, se caracterizan por la existencia de inventarios faunísticos aún incompletos con falta de datos en algunas regiones (Arzamendia y Giraudo, 2012; Lees et al., 2020). Los antecedentes sobre la avifauna provincial presentan notables diferencias en la riqueza de especies reportadas. Freiberg (1943) reportó 301 especies, De la Peña (1997) 333 especies (considerando citas de otros autores) y en un trabajo posterior, 261 especies (De la Peña, 2012). Beltzer et al. (2006) reportaron 291 especies. No obstante, Dardanelli et al. (2018) analizaron la avifauna del norte de la provincia reportando un total de 317 especies, valor cercano al total de Entre Ríos, y además, adicionaron varias especies. En consecuencia, el número total de aves que habitan Entre Ríos continúa siendo incierto debido a vacíos de información en diferentes áreas. En este marco, los objetivos del presente trabajo fueron: 1) recopilar la información de distribución de la avifauna de la provincia de Entre Ríos actualizando su inventario con una revisión exhaustiva de diferentes fuentes; 2) detectar áreas prioritarias para su conservación aplicando el principio de complementariedad y 3), evaluar vacíos de conservación en relación con el sistema de las AP de la provincia.
Materiales y métodos
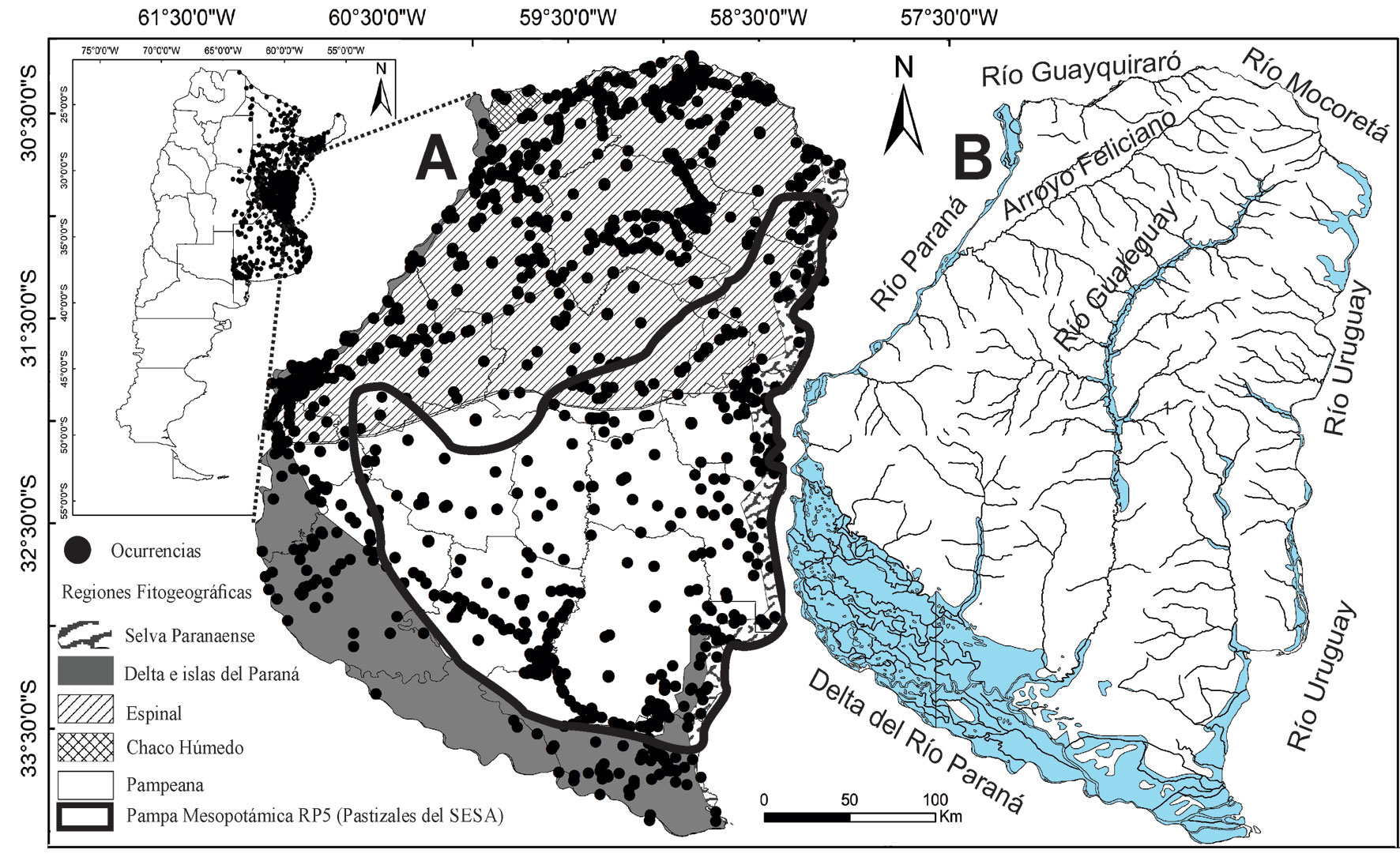
Entre Ríos ocupa la región centro-oriente de Argentina, con una superficie de 78,781 km2 (2.09% de Argentina), entre áreas subtropicales y templadas del Neotrópico, presentando una amplia heterogeneidad de hábitats. Comprende 5 ecorregiones (Morello et al., 2012; Giraudo y Arzamendia, 2018): Selva Paranaense o Atlántica desarrollada por el río Uruguay (ocupa 7.5% de la provincia), Delta e Islas del Paraná (17%), Espinal (40.4%), Pampa (34.6%) y Chaco Húmedo (0.5%) (fig. 1A). Los bosques ocupaban 49,300 km2 (62% de Entre Ríos) en 1919, y disminuyeron a 13,600 km2 (73% de pérdida) en 2005, incluyendo mayoritariamente bosques de algarrobo y ñandubay (Prosopis spp.), y en menor proporción selvas ribereñas pluriespecíficas y multiestratificadas con abundancia de lianas, epífitas y helechos, y otros tipos de bosques como los mixtos, de sauces (Salix) y alisos (Tessaria) y densos palmares de yatay (Butia yatay) (Muñoz et al., 2005). Los variados humedales incluyen ríos, arroyos, esteros y bañados que ocupan 20% de la provincia (fig. 1B), y los pastizales y sabanas aproximadamente 18% (Morello et al., 2012). Estos últimos representan el área de endemismo global de pastizales de la Mesopotamia Argentina, reconocidos por Birdlife International (Azpiroz et al., 2012; Di Giacomo et al., 2007). La provincia de Entre Ríos posee 2 Parques Nacionales (PN El Palmar y PN Pre-Delta) con adecuada infraestructura de protección y un sistema de AP provinciales y municipales, la mayoría sin infraestructura o con graves deficiencias en su implementación. Entre Ríos desarrolla un acelerado proceso de cambio en el uso del suelo que reemplaza hábitats naturales para la agricultura, con estimaciones para el 2030 de 52% de las tierras cultivadas (Badaracco, 2012).
Se analizó la composición y distribución de las aves de Entre Ríos mediante 80,000 registros georreferenciados obtenidos de 4 fuentes entre los años 1880 y 2020: 1) revisión de 102 publicaciones científicas; 2) revisión de 18 colecciones de museos; 3) revisión de 8 bases de datos disponibles en la web (ver museos y bases web en Dardanelli et al., 2018; Reales et al., 2019; Sarquis, 2018), y 4) registros propios obtenidos en 200 campañas entre 1989 y 2019. Cada registro fue georreferenciado con grados decimales utilizando Google Earth Pro, GPS y mapeado en QGIS (fig. 1A). Los registros con inconsistencias entre una localidad y su georreferenciación y/o duplicados fueron eliminados del análisis.
El listado se elaboró siguiendo los criterios del Comité Brasileiro de Registros Ornitológicos (CBRO, 2010) por carecer de criterios en Argentina (Fandiño y Giraudo, 2010, 2012). Se diferenciaron 3 categorías: 1) la lista primaria se constituyó con las especies que poseen evidencia documental verificable (vouchers, restos óseos, pieles, fotografías, videos o vocalizaciones grabadas); 2) la lista secundaria correspondió a las especies con registros publicados, aunque sin evidencia documental pero cuya ocurrencia es probable a partir de su patrón de distribución establecido con base en evidencias documentales y 3) lista terciaria: son especies con registros publicados para Entre Ríos, aunque con evidencia documental inválida o con presencia improbable en la provincia y carente de evidencia documental. Siguiendo a Fandiño y Giraudo (2010), dentro de la lista consolidada se determinaron especies que pueden ser: errantes (ER), que son aquellas cuya presencia se supone accidental porque Entre Ríos no forma parte de su geonemia característica, y/o porque no existen los hábitats adecuados para el establecimiento de poblaciones, y/o no se conoce que la especie realice migraciones que determinen su presencia regular; de estatus desconocido (ED), que son aquellas que no han sido registradas regularmente en la provincia y no son especies amenazadas o que se conozca que hayan declinado poblacionalmente, aunque presentan poblaciones en áreas limítrofes, y/o existen hábitats adecuados para el establecimiento de poblaciones. Se incluyen a aquellas especies con 3 o menos registros y que cumplen los requisitos antes enunciados. La fenología sigue las categorías de Fandiño y Giraudo (2010) y la literatura allí citada. Se incluyó el grado de amenaza global (UICN, 2021) y nacional (Res. MAyDS Nº 795.2017). Por último, se dividieron los datos en registros históricos entre 1880 y 1970 (1,930 registros) y actuales entre 1971 y 2020 (78,070 registros) para evaluar si alguna especie debiera ser clasificada como extinta a nivel regional (ExNR; UICN, 2012). Se estableció un umbral de aproximadamente 50 años siguiendo los criterios de UICN (2012) para aquellas especies con declinación poblacional comprobada.
Análisis de la composición de especies en áreas protegidas y AICA. Para determinar las áreas prioritarias y evaluar el desempeño de las AP, se solaparon los 78,070 registros actuales con la capa vectorial del sistema de AP de la provincia a través del programa Q-Gis 3.2. Solo se incluyeron las AP nacionales o provinciales con categoría de conservación estricta I-II de UICN (Dudley, 2008). Adicionalmente, se solaparon los registros con la capa vectorial de las “Áreas Importantes para la Conservación de las Aves” (AICA – IBAs en inglés), que si bien no poseen categorías formales de protección (salvo cuando incluyen un AP) son ampliamente utilizadas a nivel local e internacional por ornitólogos y tomadores de decisiones (Di Giacomo et al., 2007).
Análisis de completitud, riqueza y complementariedad. Aunque los inventarios suelen presentar esfuerzos de muestreo diferentes pudiendo presentar sesgos en las estimaciones de riqueza, han sido frecuentemente utilizados para evaluar la riqueza de especies (Bini et al., 2006; Fandiño y Giraudo, 2012). El análisis de completitud del inventario se realizó evaluando el número acumulado de especies en relación con el número de registros por año desde 1920 a 2020, por la baja cantidad de registros, el primer listado de 1920 incluyó los datos desde 1880. Se asumió que el número de inventarios para Entre Ríos representa una sustitución del conocimiento temporal de la composición de aves (Jiménez-Valverde y Hortal, 2003). Un análisis similar fue realizado para una provincia vecina con bases de datos e inventarios similares demostrando ser efectiva utilizando esta metodología (Fandiño y Giraudo, 2012). Se utilizó el paquete “vegan” en el programa Rstudio (Oksanen et al., 2019). La curva de rarefacción de especies se realizó con el modelo exponencial, intervalos de confianza de 95% y 100 repeticiones. Se utilizó el estimador no paramétrico jackknife 1, ya que en términos de exactitud global se considera un estimador adecuado para utilizarlo como límite inferior de la riqueza real de especies (González-Oreja et al., 2010). Para cuantificar la riqueza de especies y sus áreas complementarias, se utilizaron los registros actuales (1971-2020) en un grillado de 0.5° lat-long siguiendo a Fandiño y Giraudo (2012), quienes probaron diferentes tamaños de grilla en la provincia de Santa Fe (con bases de datos similares) e identificaron a este tamaño de grilla adecuado para captar la heterogeneidad de hábitats existentes y permite proteger poblaciones mayormente viables. La riqueza por celda y su complementariedad se obtuvieron mediante el programa DIVA-GIS (Hijmans et al., 2012). La complementariedad permite encontrar el conjunto mínimo de celdas que maximicen la representación de todas las especies, porque incluye al menos una vez a todas las especies en el menor set de grillas posibles (Rebelo y Sigfried, 1992). En ambos análisis solo se incluyeron las especies que forman la lista consolidada y poseen registros actuales, exceptuándose las especies catalogadas como ExNR.
Resultados
Se registraron 408 especies en 1,550 puntos georreferenciados (fig. 1). El listado consolidado de Entre Ríos incluyó 396 especies, 373 constituyen la lista primaria y 24 la lista secundaria (apéndice). Entre ellas, 271 son residentes, 101 migrantes y 24 especies tienen una fenología incierta (ED – ER). Once especies cumplieron con los requisitos para ser incluidas en la lista terciaria (apéndice). La lista consolidada representa casi 40% de las aves argentinas y más de 11% de las aves sudamericanas (Remsen et al., 2021). Se registraron 20 especies amenazadas globalmente y 40 amenazadas a nivel nacional (Res. MAyDS Nº 795.2017, Argentina) (apéndice).
Las siguientes especies han declinado globalmente y cumplen con los criterios para considerarlas como probablemente ExNR. 1) Numenius borealis: citada el 9 de septiembre de 1880 por Barrows (1884), considerada en peligro crítico con posibilidades de estar extinta globalmente ya que el último registro confirmado es de 1963 (Butchart et al., 2018). 2) Leistes defillippi: el último registro es de Zapata (1975) en pastizales cerca de Gualeguaychú. En su lista, llamativamente no registró a L. superciliaris, especie muy similar y abundante en la región, no debe descartarse la posibilidad de un error en la identificación. El registro anterior de L. defillippi es de 1926 y consiste en una piel depositada en el Museo Argentino de Ciencias Naturales (MACN 926a), recolectada en Pehuajó Norte, Gualeguaychú. 3) Alectrurus risora: especie que desapareció del sur, de su distribución desde las primeras décadas del siglo-XX, incluso de la provincia de Entre Ríos (Di Giacomo y Di Giacomo, 2004). Dos observaciones entre 1991 y 1992 en el Parque Nacional (PN) el Palmar, fueron atribuidas a un mismo individuo vagante (Di Giacomo y Di Giacomo, 2004; Marateo et al., 2009). Nunca más fue registrada allí a pesar de ser un lugar permanentemente monitoreado por guardaparques y ornitólogos.
Completitud del inventario y riqueza de especies en áreas protegidas y AICA. El cálculo de rarefacción a través del estimador no paramétrico jackknife 1, mostró que el inventario posee una completitud de 96% (fig. 2). El estimador arrojó un total de 412 especies, valor cercano y superior a las 396 encontradas en este estudio. El análisis de riqueza en las AP indicó que el PN el Palmar posee 300 especies (76% del total de especies nativas), seguido por el PN Pre-Delta con 270 (68%) y el Parque Escolar Rural Enrique Berduc con 215 (54%). En total, 336 especies (85%) se encontraron dentro de las AP de la provincia. Las AICA con mayor riqueza fueron el Ñandubaysal de Gualeguaychú y la Aurora del Palmar con 298 especies, seguidas por los pastizales del Ibicuy con 180 y la selva de Montiel con 170. Un total de 40 especies (10.4%) no se encuentran dentro de alguna AICA.
Las celdas con mayor riqueza contienen entre 241 y 303 especies. Todas las celdas linderas al río Uruguay poseen más de 241 especies, encontrándose la mayor riqueza de especies al sur con 301 especies. Las celdas con mayor riqueza sobre el río Paraná poseen más de 241 especies e incluyen a la ciudad de Paraná y alrededores, el PN Pre-Delta y el Parque Escolar Rural Enrique Berduc. Otras 2 celdas poseen más de 241 especies, una en el norte que incluye un borde del río Paraná y al arroyo Feliciano y otra en el centro de la provincia, sobre el río Gualeguay (fig. 3).
El análisis de complementariedad mostró que se necesitan 10 celdas para contener toda la avifauna. Las 2 celdas con mayor prioridad y riqueza están ubicada al sur sobre la margen del río Uruguay con 301 especies y al centro (PN El Palmar) que agrega 34 especies (fig. 4A). La tercera celda se encuentra en el río Paraná (centro) sumando 18 especies y la cuarta, al norte del río Paraná que adiciona 14 especies. Estas 4 celdas suman 93% de la avifauna. Las 6 celdas restantes suman 27 especies únicas. Con excepción de las celdas 9 y 10 (fig. 4A), el resto de las celdas se encuentran asociadas a los grandes ríos que rodean la provincia. Las celdas prioritarias 2, 3, 5, y 10 comprenden áreas protegidas dentro de las categorías I-II de UICN: el PN El Palmar (celda 2), PN Pre-Delta (celdas 5) y el Parque Escolar Rural Enrique Berduc (celda 3) (fig. 4A). Las celdas prioritarias 6, 7 y 9 poseen AP con categorías de protección menos estrictas. En la celda 6, se encuentra la reserva Bi-provincial Mocoretá, en la celda 7 el potrero de Gualeguaychú y en la celda 9, el Área Protegida Don Sebastián (fig. 4B). Por último, las celdas prioritarias 1, 4, 8 y 10 no poseen áreas protegidas. En la celda 1, se encuentran las AICA Perdices y Ceibas.
Discusión
El número de especies detectado en este trabajo (396) estuvo levemente por debajo del estimador jackknife 1 (421 especies), indicando que la avifauna de la provincia está relativamente bien conocida, aunque seguramente se adicionarán especies. Si bien no existe un estimador que sea el más indicado en todas las situaciones, dependiendo de las bases de datos y esfuerzos de muestreo, varios estudios han demostrado que jackknife 1 se comporta mejor que otros estimadores (González-Oreja et al., 2010). De hecho, en el transcurso del 2020, se han encontrado 2 especies nuevas para la provincia, Tersina viridis (Dardanelli et al., 2020) y Heliomaster squamosus (Puente et al., 2020). Este trabajo adicionó 63 especies más (20%) respecto al mayor valor provincial publicado (De la Peña, 1997). Esta diferencia se debe a: 1) la revisión de material depositado en Museos; 2) un aumento de publicaciones y de información dispersa dada por la disponibilidad de bases de acceso abierto, que aportan un caudal de datos sin precedentes y contribuyen a complementar las colecciones biológicas y listados sistemáticos (Callaghan et al., 2019); 3) priorización de muestreos en áreas poco conocidas; 4) la expansión de la distribución de las aves, por ejemplo, Campylorhamphus trochilirostris, que en las últimas décadas se desplazó hacia el sur por el río Paraná (Alvarado y La Grotteria, 2011), lo que podría estar relacionado con el cambio climático y con la tendencia de muchas aves a conservar su nicho (Triviño et al., 2018). La mayoría de los registros nuevos provienen del norte de la provincia y de áreas linderas a los ríos Paraná y Uruguay (Dardanelli et al., 2018; Sarquis et al., 2017). La función de estos grandes ríos como corredores y refugios de biodiversidad, frente a la pérdida de hábitats y el cambio climático, fueron postulados regionalmente (Arzamendia y Giraudo, 2012; Cristaldi et al., 2019; Giraudo y Arzamendia, 2004).

Se consideraron 3 especies como ExNR en Entre Ríos, Numenius borealis es una especie migradora que se encuentra probablemente extinta a nivel mundial, su último avistaje confiable fue en 1963 en su área reproductiva, y desde 1939 no tiene registros en el hemisferio sur (Butchart et al., 2018). Las principales causas de su extinción se atribuyen a cambios en el uso de suelo, disminución de ítems de su dieta y al cambio climático (Butchart et al., 2018; UICN, 2021). Las poblaciones de Alectrurus risora disminuyeron drásticamente debido al avance de la frontera agrícola, por lo que la mayoría de las poblaciones actuales se concentra en las provincias de Corrientes, Chaco y Formosa (Argentina) y el sur de Paraguay (Di Giacomo y Di Giacomo, 2004). Esta situación es similar para L. defillippi, que depende de la presencia de pastizales que fueron modificados por la expansión agrícola, aunque aún existen parches que podrían ser utilizados y/o recolonizados (Azpiroz et al., 2012).
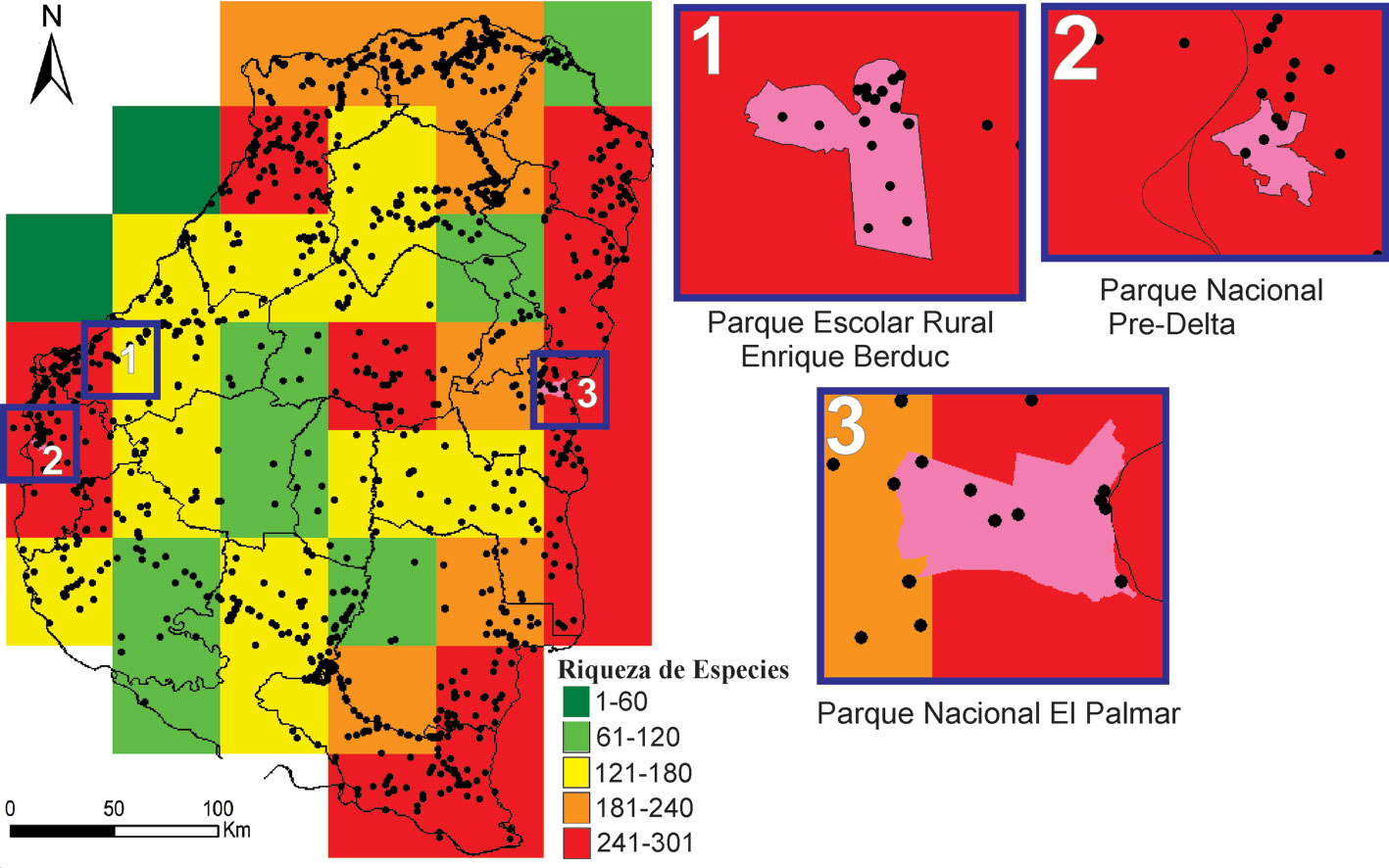
La mayor riqueza de especies se encontró asociada a los grandes ríos que limitan la provincia como el Paraná y el Uruguay. Estos grandes afluentes constituyen corredores biogeográficos para muchas especies tropicales de flora y fauna que extienden su distribución hacia latitudes templadas siguiendo las selvas en galería y los extensos humedales de estos ríos (Arzamendia y Giraudo, 2012; Arzamendia et al., 2015; Giraudo y Arzamendia, 2004; Nores et al., 2005). Además, las celdas asociadas a los ríos Uruguay y Paraná incluyen ambientes de casi todas las ecorregiones de Entre Ríos, con una elevada heterogeneidad ambiental que influye sobre una mayor diversidad de especies. Sin embargo, el río Paraná mostró menor cantidad de celdas con elevada riqueza y prioridad en comparación con el río Uruguay. Es probable que esta mayor diversidad esté relacionada a la presencia de la Selva Atlántica (ecorregión con mayor diversidad de Argentina), que al estar asociado al río Uruguay, trae consigo mayor diversidad de especies (Giraudo y Arzamendia, 2018; Nores et al., 2005). Además, podría también reflejar un mayor esfuerzo de muestreo en el río Uruguay, cuyo desarrollo turístico, accesibilidad y cercanía a grandes ciudades (Buenos Aires), atrae un mayor número de observadores de aves que la costa del río Paraná (Boakes et al., 2010).

Por su parte, la riqueza asociada al río Paraná presentó celdas con elevado número de especies (rojo) y otras con bajo número (de amarillo a verde oscuro). El mismo patrón se observa en el norte y centro de la provincia, con baja densidad de habitantes, con algunas celdas con mediana a baja riqueza lo que podría estar mostrando asimetrías en la cantidad de datos, lo que genera áreas sobre-muestreadas que adicionan especies raras y ocasionales. A pesar de los esfuerzos realizados en la búsqueda de datos, existen sesgos que se relacionan con áreas sobre-muestreadas históricamente y otras con vacíos de información (Lees et al., 2020). Recientemente, Dardanelli et al. (2018) reportaron 317 especies de aves en el norte provincial, revalorizando al espinal como un área importante para la conservación de las aves, con especies endémicas para la provincia. La celda del centro con mayor riqueza se encuentra atravesada por el río Gualeguay, que genera una amplia heterogeneidad de hábitats como bañados, pajonales, pastizales, playas y bosques (Beltzer et al., 2006).
Si bien la riqueza total de especies ha sido ampliamente utilizada para comprender los patrones de biodiversidad se debe considerar que las áreas prioritarias determinadas, podrían verse afectadas en mayor o menor grado por modificaciones antrópicas que excluyan algunas especies importantes para su conservación como las amenazadas, por lo que monitoreos actualizados deberían ser realizados para tomar decisiones que permitan cubrir todas las especies dentro de los sistemas de reservas (Albuquerque y Beier, 2015). El uso del principio de complementariedad permitió captar todas las aves que habitan la provincia optimizando el espacio requerido y detectando vacíos de conservación (Kati et al., 2004; Rebelo y Siegfried, 1992). Estos resultados permiten confeccionar un mapa de las áreas prioritarias, siendo un primer e importante paso en la planificación sistemática de la conservación (Margules y Pressey, 2000). Sin embargo, las áreas prioritarias seleccionadas por complementariedad pueden presentar sesgos relacionados con la dependencia de los registros disponibles, los lugares muestreados y la biología de las especies (Boakes et al., 2010; Callaghan et al., 2019; Triviño et al., 2018). Adicionalmente, muchos registros obtenidos en los últimos años pueden ubicarse en zonas actualmente desfavorables por modificaciones antrópicas y/o climáticas e influir en la selección de áreas cuyo estado de conservación es dudoso, desconocido o ha sido recientemente modificado (Muñoz et al., 2005). Resulta fundamental verificar el estado de las áreas seleccionadas, con el fin de acelerar la toma de decisiones. También se pueden utilizar otras estrategias que permitan realizar priorizaciones espaciales, como los modelos de distribución de especies (MDE). Éstos permiten combinar los registros de una especie con diferentes tipos de variables proporcionando estimaciones probabilísticas de la distribución de especies, siempre que sean utilizados bajo determinados supuestos (ver diagrama BAM en Soberón y Peterson [2005]). Pero excede las posibilidades de la actual base de datos por no contar con la cantidad de registros necesarios para todas las especies y la necesidad de ampliar el “background” o área de modelado a un sector más amplio que Entre Ríos, para lograr captar mayor heterogeneidad ambiental y climática en los modelos (Acevedo et al., 2012; Wisz et al., 2008). En este marco, se revaloriza la importancia de contar con inventarios completos y actualizados que constituyen la base para realizar análisis de priorización espacial (Navarro-Singüenza et al., 2014), que por la cantidad de registros (78,070), pueden ser analizados por algoritmos sencillos como la complementariedad (Veach et al., 2017). Este estudio constituye un importante punto de partida en la implementación de estrategias que puedan ser efectivas para la conservación de las aves que habitan la provincia de Entre Ríos, como también permite detectar áreas de elevada riqueza de aves y complementarias en zonas que no poseen AP, sobre todo en una región considerada como prioritaria para la conservación a nivel nacional y global por contener bosques, pastizales y humedales únicos y en retroceso.
Agradecimientos
Este trabajo fue financiado por: CONICET (PIP 2011-0355), Universidad Nacional del Litoral (CAID-2016-UNL), ANPCYT- FONCYT (PICTs 2013-2203 y 2016-1415), INTA (PNNAT-1128053), Fontagro (FTG/RF-15461-RG) y Birdfair/RSPB Research Fund for Endangered Birds y Neotropical Bird Club. Agradecemos al Consejo Nacional de Investigaciones Científicas y Técnicas a la Universidad Nacional del Litoral y al Instituto Nacional de Limnología (CONICET-UNL), que brindaron los medios para la realización de este trabajo. Agradecemos a todos aquellos entrerrianos que nos abrieron las tranqueras de sus campos.
Apéndice. Lista consolidada de las aves de Entre Ríos. Donde: ǿave comercial/escapada de Jaula; XX probablemente extinta en la provincia; END endémicas de Argentina. Categoría: 1 = lista primaria; 2 = lista secundaria; 3 = lista terciaria; ED = estatus desconocido; ER = errante; EX = especie exótica. Fenología: MN = migrantes neárticas; MAN = migrantes australes del norte; MAS = migrantes australes del sur; MLE = migrantes longitudinales del este; MLO = migrantes longitudinales del oeste; R = residentes; ? = fenología incierta. ** = Misma categoría de amenaza a nivel global como local.
|
N |
Orden/ Familia |
Especies |
Categoría |
Fenología |
Categoría de amenaza: UICN / Nacional |
|
1 |
Rheiiformes / Rheidae |
Rhea americana |
1 |
R |
Casi amenazada / Vulnerable |
|
2 |
Tinamiformes / Tinamidae |
Rhynchotus rufescens |
1 |
R |
No Amenazada** |
|
3 |
Nothura maculosa |
1 |
R |
No Amenazada** |
|
|
4 |
Eudromia elegans |
3 |
– |
No Amenazada** |
|
|
5 |
Anseriformes / Anhimidae |
Chauna torquata |
1 |
R |
No Amenazada** |
|
6 |
Anatidae |
Dendrocygna bicolor |
1 |
R |
No Amenazada** |
|
7 |
Dendrocygna viduata |
1 |
R |
No Amenazada** |
|
|
Apéndice. Continúa |
|||||
|
N |
Orden/ Familia |
Especies |
Categoría |
Fenología |
Categoría de amenaza: UICN / Nacional |
|
8 |
Dendrocygna autumnalis |
1 |
R |
No Amenazada** |
|
|
9 |
Cygnus melancoryphus |
1 |
R |
No Amenazada** |
|
|
10 |
Coscoroba coscoroba |
1 |
R |
No Amenazada** |
|
|
11 |
Cairina moschata |
1 |
R |
No Amenazada / Amenazada |
|
|
12 |
Sarkidiornis sylvicola |
1 |
R |
No Amenazada / Amenazada |
|
|
13 |
Callonetta leucophrys |
1 |
R |
No Amenazada** |
|
|
14 |
Amazonetta brasiliensis |
1 |
R |
No Amenazada** |
|
|
15 |
Spatula versicolor |
1 |
R |
No Amenazada** |
|
|
16 |
Spatula platalea |
1 |
R |
No Amenazada** |
|
|
17 |
Spatula discors |
2 |
MN |
No Amenazada** |
|
|
18 |
Spatula cyanoptera |
1 |
R |
No Amenazada** |
|
|
19 |
Mareca sibilatrix |
1 |
R |
No Amenazada** |
|
|
20 |
Anas bahamensis |
1 |
R |
No Amenazada** |
|
|
21 |
Anas georgica |
1 |
R |
No Amenazada** |
|
|
22 |
Anas flavirostris |
1 |
R |
No Amenazada** |
|
|
23 |
Netta peposaca |
1 |
R |
No Amenazada** |
|
|
24 |
Heteronetta atricapilla |
1 |
R |
No Amenazada** |
|
|
25 |
Nomonyx dominicus |
1 |
R |
No Amenazada** |
|
|
26 |
Oxyura vittata |
1 |
R |
No Amenazada** |
|
|
27 |
Galliformes / Cracidae |
Penelope obscura |
1 |
R |
No Amenazada / Amenazada |
|
28 |
Ortalis canicollis |
1 |
R |
No Amenazada** |
|
|
29 |
Phoenicopteriformes / Phoenicopteridae |
Phoenicopterus chilensis |
1 |
R |
No Amenazada / Vulnerable |
|
30 |
Podicipediformes / Podicipedidae |
Rollandia rolland |
1 |
R |
No Amenazada** |
|
31 |
Tachybaptus dominicus |
1 |
R |
No Amenazada** |
|
|
32 |
Podilymbus podiceps |
1 |
R |
No Amenazada** |
|
|
33 |
Podiceps major |
1 |
R |
No Amenazada** |
|
|
34 |
Columbiformes / Columbidae |
Columba livia |
1 Ex |
R |
No Amenazada** |
|
35 |
Patagioenas picazuro |
1 |
R |
No Amenazada** |
|
|
36 |
Patagioenas maculosa |
1 |
R |
No Amenazada** |
|
|
37 |
Leptotila verreauxi |
1 |
R |
No Amenazada** |
|
|
38 |
Zenaida auriculata |
1 |
R |
No Amenazada** |
|
|
39 |
Columbina talpacoti |
1 |
R |
No Amenazada** |
|
|
40 |
Columbina picui |
1 |
R |
No Amenazada** |
|
|
41 |
Cuculiformes / Cuculidae |
Guira guira |
1 |
R |
No Amenazada** |
|
42 |
Crotophaga major |
1 |
MAN |
No Amenazada** |
|
|
43 |
Crotophaga ani |
1 |
R |
No Amenazada** |
|
|
44 |
Tapera naevia |
1 |
MAN |
No Amenazada** |
|
|
45 |
Coccycua cinerea |
1 |
MAN |
No Amenazada** |
|
|
Apéndice. Continúa |
|||||
|
N |
Orden/ Familia |
Especies |
Categoría |
Fenología |
Categoría de amenaza: UICN / Nacional |
|
46 |
Piaya cayana |
1 |
R |
No Amenazada** |
|
|
47 |
Coccyzus melacoryphus |
1 |
MAN |
No Amenazada** |
|
|
48 |
Coccyzus americanus |
1 |
MAN |
No Amenazada** |
|
|
49 |
Nyctibiiformes / Nyctibiidae |
Nyctibius griseus |
1 |
R |
No Amenazada** |
|
50 |
Caprimulgiformes / Caprimulgidae |
Chordeiles nacunda |
1 |
R |
No Amenazada** |
|
51 |
Chordeiles minor |
1 |
MAN |
No Amenazada** |
|
|
52 |
Systellura longirostris |
1 |
R? |
No Amenazada** |
|
|
53 |
Nyctidromus albicollis |
2 ED |
MAN |
No Amenazada** |
|
|
54 |
Eleothreptus anomalus |
2 ED |
R? |
Casi amenazada / En Peligro |
|
|
55 |
Setopagis parvula |
1 |
MAN |
No Amenazada** |
|
|
56 |
Hydropsalis torquata |
1 |
R |
No Amenazada** |
|
|
57 |
Apodiformes / Trochilidae |
Florisuga fusca |
1 |
MLE |
No Amenazada** |
|
58 |
Polytmus guainumbi |
2 ED |
? |
No Amenazada / Vulnerable |
|
|
59 |
Anthracothorax nigricollis |
1 ED |
? |
No Amenazada** |
|
|
60 |
Heliomaster furcifer |
1 |
R |
No Amenazada** |
|
|
61 |
Heliomaster squamosus |
1 ED |
? |
No Amenazada** |
|
|
62 |
Chlorostilbon lucidus |
1 |
R |
No Amenazada** |
|
|
63 |
Leucochloris albicollis |
1 |
R |
No Amenazada** |
|
|
64 |
Lophornis chalybeus |
3 |
– |
Casi amenazada** |
|
|
65 |
Hylocharis chrysura |
1 |
R |
No Amenazada** |
|
|
66 |
Sappho sparganurus |
1 ED |
MLO |
No Amenazada** |
|
|
67 |
Gruiformes / Aramidae |
Aramus guarauna |
1 |
R |
No Amenazada** |
|
68 |
Rallidae |
Porphyrio martinica |
1 |
R |
No Amenazada** |
|
69 |
Laterallus melanophaius |
1 |
R |
No Amenazada** |
|
|
70 |
Laterallus leucopyrrhus |
1 |
R |
No Amenazada** |
|
|
71 |
Mustelirallus erythrops |
1 ED |
? |
No Amenazada** |
|
|
72 |
Mustelirallus albicollis |
1 ED |
? |
No Amenazada** |
|
|
73 |
Pardirallus maculatus |
1 |
R |
No Amenazada** |
|
|
74 |
Pardirallus sanguinolentus |
1 |
R |
No Amenazada** |
|
|
75 |
Aramides ypecaha |
1 |
R |
No Amenazada** |
|
|
76 |
Aramides cajaneus |
1 |
R |
No Amenazada** |
|
|
77 |
Porphyriops melanops |
1 |
R |
No Amenazada** |
|
|
78 |
Porzana flaviventer |
1 |
R |
No Amenazada** |
|
|
79 |
Coturnicops notatus |
1 ED |
? |
No Amenazada** |
|
|
80 |
Gallinula galeata |
1 |
R |
No Amenazada** |
|
|
81 |
Fulica rufifrons |
1 |
R |
No Amenazada** |
|
|
82 |
Fulica armillata |
1 |
R |
No Amenazada** |
|
|
83 |
Fulica leucoptera |
1 |
R |
No Amenazada** |
|
|
Apéndice. Continúa |
|||||
|
N |
Orden/ Familia |
Especies |
Categoría |
Fenología |
Categoría de amenaza: UICN / Nacional |
|
84 |
Charadriiformes / Charadriidae |
Pluvialis dominica |
1 |
MN |
No Amenazada** |
|
85 |
Pluvialis squatarola |
1 ED |
MN |
No Amenazada** |
|
|
86 |
Oreopholus ruficollis |
1 |
MAS |
No Amenazada** |
|
|
87 |
Vanellus chilensis |
1 |
R |
No Amenazada** |
|
|
88 |
Charadrius modestus |
1 |
MAS |
No Amenazada** |
|
|
89 |
Charadrius semipalmatus |
2 ED |
MN |
No Amenazada** |
|
|
90 |
Charadrius collaris |
1 |
R |
No Amenazada** |
|
|
91 |
Charadrius falklandicus |
1 |
MAS |
No Amenazada** |
|
|
92 |
Recurvirostridae |
Himantopus mexicanus |
1 |
R |
No Amenazada** |
|
93 |
Thinocoridae |
Thinocorus rumicivorus |
1 |
MAS |
No Amenazada** |
|
94 |
Scolopacidae |
Bartramia longicauda |
1 |
MN |
No Amenazada / Vulnerable |
|
95 |
Limosa haemastica |
1 |
MN |
No Amenazada** |
|
|
96 |
Calidris canutus |
1 ED |
MN |
Casi amenazada / En peligro crítico |
|
|
97 |
Calidris himantopus |
1 |
MN |
No Amenazada** |
|
|
98 |
Calidris alba |
2 ED |
MN |
No Amenazada** |
|
|
99 |
Calidris bairdii |
1 |
MN |
No Amenazada** |
|
|
100 |
Calidris fuscicollis |
1 |
MN |
No Amenazada** |
|
|
101 |
Calidris subruficollis |
1 |
MN |
Casi amenazada / Amenazada |
|
|
102 |
Calidris melanotos |
1 |
MN |
No Amenazada** |
|
|
103 |
Gallinago paraguaiae |
1 |
R |
No Amenazada** |
|
|
104 |
Phalaropus tricolor |
1 |
MN |
No Amenazada** |
|
|
105 |
Actitis macularius |
1 |
MN |
No Amenazada** |
|
|
106 |
Numenius borealisXX |
2 |
MN |
En peligro crítico/Probablemente extinta |
|
|
107 |
Tringa solitaria |
1 |
MN |
No Amenazada** |
|
|
108 |
Tringa melanoleuca |
1 |
MN |
No Amenazada** |
|
|
109 |
Tringa flavipes |
1 |
MN |
No Amenazada** |
|
|
110 |
Jacanidae |
Jacana jacana |
1 |
R |
No Amenazada** |
|
111 |
Rostratulidae |
Nycticryphes semicollaris |
1 |
R |
No Amenazada** |
|
112 |
Rynchopidae |
Rynchops niger |
1 |
R |
No Amenazada** |
|
113 |
Laridae |
Chroicocephalus maculipennis |
1 |
R |
No Amenazada** |
|
114 |
Chroicocephalus cirrocephalus |
1 |
R |
No Amenazada** |
|
|
115 |
Larus dominicanus |
1 |
R |
No Amenazada** |
|
|
116 |
Sternula superciliaris |
1 |
R |
No Amenazada** |
|
|
117 |
Phaetusa simplex |
1 |
R |
No Amenazada** |
|
|
118 |
Gelochelidon nilotica |
1 |
R |
No Amenazada** |
|
|
119 |
Sterna trudeaui |
1 |
R |
No Amenazada** |
|
|
Apéndice. Continúa |
|||||
|
N |
Orden/ Familia |
Especies |
Categoría |
Fenología |
Categoría de amenaza: UICN / Nacional |
|
120 |
Ciconiiformes / Ciconiidae |
Ciconia maguari |
1 |
R |
No Amenazada** |
|
121 |
Jabiru mycteria |
1 |
R |
No Amenazada** |
|
|
122 |
Mycteria americana |
1 |
R |
No Amenazada** |
|
|
123 |
Suliformes / Anhingidae |
Anhinga anhinga |
1 |
R |
No Amenazada** |
|
124 |
Phalacrocoracidae |
Phalacrocorax brasilianus |
1 |
R |
No Amenazada** |
|
125 |
Pelecaniformes / Ardeidae |
Tigrisoma lineatum |
1 |
R |
No Amenazada** |
|
126 |
Botaurus pinnatus |
1 |
R |
No Amenazada** |
|
|
127 |
Ixobrychus involucris |
1 |
R |
No Amenazada** |
|
|
128 |
Nycticorax nycticorax |
1 |
R |
No Amenazada** |
|
|
129 |
Butorides striata |
1 |
R |
No Amenazada** |
|
|
130 |
Bubulcus ibis |
1 |
R |
No Amenazada** |
|
|
131 |
Ardea cocoi |
1 |
R |
No Amenazada** |
|
|
132 |
Ardea alba |
1 |
R |
No Amenazada** |
|
|
133 |
Syrigma sibilatrix |
1 |
R |
No Amenazada** |
|
|
134 |
Egretta thula |
1 |
R |
No Amenazada** |
|
|
135 |
Egretta caerulea |
1 ER |
? |
No Amenazada** |
|
|
136 |
Threskiornithidae |
Plegadis chihi |
1 |
R |
No Amenazada** |
|
137 |
Phimosus infuscatus |
1 |
R |
No Amenazada** |
|
|
138 |
Theristicus caerulescens |
1 |
R |
No Amenazada** |
|
|
139 |
Theristicus caudatus |
1 |
R |
No Amenazada** |
|
|
140 |
Platalea ajaja |
1 |
R |
No Amenazada** |
|
|
141 |
Cathartiformes / Cathartidae |
Sarcoramphus papa |
2 ED |
? |
No Amenazada** |
|
142 |
Coragyps atratus |
1 |
R |
No Amenazada** |
|
|
143 |
Cathartes aura |
1 |
R |
No Amenazada** |
|
|
144 |
Cathartes burrovianus |
1 |
R |
No Amenazada** |
|
|
145 |
Pandionidae |
Pandion haliaetus |
1 |
R |
No Amenazada** |
|
146 |
Accipotriformes / Accipitridae |
Elanus leucurus |
1 |
R |
No Amenazada** |
|
147 |
Elanoides forficatus |
2 ED |
MN |
No Amenazada** |
|
|
148 |
Gampsonyx swainsonii |
1 |
? |
No Amenazada** |
|
|
149 |
Busarellus nigricollis |
1 |
R |
No Amenazada** |
|
|
150 |
Rostrhamus sociabilis |
1 |
R |
No Amenazada** |
|
|
151 |
Ictinia mississippiensis |
1 |
MN |
No Amenazada** |
|
|
152 |
Ictinia plumbea |
2 |
MAN |
No Amenazada** |
|
|
153 |
Circus cinereus |
1 |
MAS |
No Amenazada** |
|
|
154 |
Circus buffoni |
1 |
R |
No Amenazada** |
|
|
155 |
Accipiter striatus |
1 |
R |
No Amenazada** |
|
|
156 |
Accipiter bicolor |
1 |
R |
No Amenazada** |
|
|
157 |
Geranospiza caerulescens |
1 |
R |
No Amenazada** |
|
|
158 |
Buteogallus meridionalis |
1 |
R |
No Amenazada** |
|
|
Apéndice. Continúa |
|||||
|
N |
Orden/ Familia |
Especies |
Categoría |
Fenología |
Categoría de amenaza: UICN / Nacional |
|
159 |
Buteogallus urubitinga |
1 |
R |
No Amenazada** |
|
|
160 |
Buteogallus coronatus |
2 ED |
R |
Amenazada / En Peligro |
|
|
161 |
Rupornis magnirostris |
1 |
R |
No Amenazada** |
|
|
162 |
Parabuteo unicinctus |
1 |
R |
No Amenazada** |
|
|
163 |
Parabuteo leucorrhous |
2 ED |
? |
No Amenazada / Vulnerable |
|
|
164 |
Geranoaetus albicaudatus |
1 |
R |
No Amenazada** |
|
|
165 |
Geranoaetus polyosoma |
2 |
? |
No Amenazada** |
|
|
166 |
Geranoaetus melanoleucus |
1 |
R |
No Amenazada** |
|
|
167 |
Buteo swainsoni |
1 |
MN |
No Amenazada** |
|
|
168 |
Strigiformes / Tytonidae |
Tyto alba |
1 |
R |
No Amenazada** |
|
169 |
Strigidae |
Megascops choliba |
1 |
R |
No Amenazada** |
|
170 |
Bubo virginianus |
1 |
R |
No Amenazada** |
|
|
171 |
Glaucidium brasilianum |
1 |
R |
No Amenazada** |
|
|
172 |
Glaucidium nana |
1 ED |
MAS |
No Amenazada** |
|
|
173 |
Athene cunicularia |
1 |
R |
No Amenazada** |
|
|
174 |
Asio clamator |
1 |
R |
No Amenazada** |
|
|
175 |
Asio flammeus |
1 |
R |
No Amenazada / Vulnerable |
|
|
176 |
Trogoniformes / Trogonidae |
Trogon surrucura |
1 ED |
? |
No Amenazada** |
|
177 |
Coraciiformes / Alcedinidae |
Megaceryle torquata |
1 |
R |
No Amenazada** |
|
178 |
Chloroceryle amazona |
1 |
R |
No Amenazada** |
|
|
179 |
Chloroceryle americana |
1 |
R |
No Amenazada** |
|
|
180 |
Piciformes / Ramphastidae |
Ramphastos tocoǿ |
3 |
– |
No Amenazada** |
|
181 |
Picidae |
Picumnus cirratus |
1 |
R |
No Amenazada** |
|
182 |
Melanerpes candidus |
1 |
R |
No Amenazada** |
|
|
183 |
Melanerpes cactorum |
1 |
R |
No Amenazada** |
|
|
184 |
Dryobates spilogaster |
1 |
R |
No Amenazada** |
|
|
185 |
Dryobates mixtus |
1 |
R |
No Amenazada** |
|
|
186 |
Campephilus leucopogon |
1 |
R |
No Amenazada** |
|
|
187 |
Colaptes melanochloros |
1 |
R |
No Amenazada** |
|
|
188 |
Colaptes campestris |
1 |
R |
No Amenazada** |
|
|
189 |
Cariamiformes / Cariamidae |
Cariama cristata |
3 |
– |
No Amenazada** |
|
190 |
Falconiformes / Falconidae |
Caracara plancus |
1 |
R |
No Amenazada** |
|
191 |
Milvago chimachima |
1 |
R |
No Amenazada** |
|
|
192 |
Milvago chimango |
1 |
R |
No Amenazada** |
|
|
193 |
Falco sparverius |
1 |
R |
No Amenazada** |
|
|
194 |
Falco femoralis |
1 |
R |
No Amenazada** |
|
|
195 |
Falco peregrinus |
1 |
R? |
No Amenazada** |
|
|
196 |
Spiziapteryx circumcincta |
3 |
– |
No Amenazada** |
|
|
197 |
Psittaciformes / Psittacidae |
Myiopsitta monachus |
1 |
R |
No Amenazada** |
|
Apéndice. Continúa |
|||||
|
N |
Orden/ Familia |
Especies |
Categoría |
Fenología |
Categoría de amenaza: UICN / Nacional |
|
198 |
Amazona aestivaǿ |
3 |
– |
No Amenazada / Amenazada |
|
|
199 |
Pionus maximiliani |
2 ED |
? |
No Amenazada** |
|
|
200 |
Aratinga nendayǿ |
3 |
– |
No Amenazada / Amenazada |
|
|
201 |
Thectocercus acuticaudatus |
1 |
R |
No Amenazada** |
|
|
202 |
Psittacara leucophthalmus |
1 |
R |
No Amenazada** |
|
|
203 |
Psittacara mitratusǿ |
3 |
– |
No Amenazada** |
|
|
204 |
Passeriformes / Thamnophilidae |
Taraba major |
1 |
R |
No Amenazada** |
|
205 |
Thamnophilus ruficapillus |
1 |
R |
No Amenazada** |
|
|
206 |
Thamnophilus caerulescens |
1 |
R |
No Amenazada** |
|
|
207 |
Thamnophilus doliatus |
1 ED |
? |
No Amenazada** |
|
|
208 |
Furnariidae |
Geositta cunicularia |
1 |
MAS |
No Amenazada** |
|
209 |
Sittasomus griseicapillus |
1 |
R |
No Amenazada** |
|
|
210 |
Campylorhamphus trochilirostris |
1 |
R |
No Amenazada** |
|
|
211 |
Drymornis bridgesii |
1 |
R |
No Amenazada** |
|
|
212 |
Lepidocolaptes angustirostris |
1 |
R |
No Amenazada** |
|
|
213 |
Tarphonomus certhioides |
1 |
R |
No Amenazada** |
|
|
214 |
Furnarius rufus |
1 |
R |
No Amenazada** |
|
|
215 |
Furnarius cristatus |
3 |
– |
No Amenazada** |
|
|
216 |
Phleocryptes melanops |
1 |
R |
No Amenazada** |
|
|
217 |
Limnornis curvirostris |
1 |
R |
No Amenazada / Vulnerable |
|
|
218 |
Cinclodes fuscus |
1 |
MAS |
No Amenazada** |
|
|
219 |
Syndactyla rufosuperciliata |
1 |
R |
No Amenazada** |
|
|
220 |
Leptasthenura platensis |
1 |
R |
No Amenazada** |
|
|
221 |
Phacellodomus sibilatrix |
1 |
R |
No Amenazada** |
|
|
222 |
Phacellodomus striaticollis |
1 |
R |
No Amenazada** |
|
|
223 |
Phacellodomus ruber |
1 |
R |
No Amenazada** |
|
|
224 |
Anumbius annumbi |
1 |
R |
No Amenazada** |
|
|
225 |
Coryphistera alaudina |
1 |
R |
No Amenazada** |
|
|
226 |
Asthenes baeri |
1 |
R |
No Amenazada** |
|
|
227 |
Asthenes hudsoni |
1 |
MAS |
Casi amenazada / Amenazada |
|
|
228 |
Asthenes pyrrholeuca |
1 |
MAS |
No Amenazada** |
|
|
229 |
Limnoctites rectirostris |
1 |
R |
Casi amenazada / Amenazada |
|
|
230 |
Limnoctites sulphuriferus |
1 |
R |
No Amenazada** |
|
|
231 |
Cranioleuca pyrrhophia |
1 |
R |
No Amenazada** |
|
|
232 |
Spartonoica maluroides |
1 |
R |
Casi amenazada / Vulnerable |
|
|
233 |
Pseudoseisura lophotes |
1 |
R |
No Amenazada** |
|
|
234 |
Certhiaxis cinnamomeus |
1 |
R |
No Amenazada** |
|
|
Apéndice. Continúa |
|||||
|
N |
Orden/ Familia |
Especies |
Categoría |
Fenología |
Categoría de amenaza: UICN / Nacional |
|
235 |
Schoeniophylax phryganophilus |
1 |
R |
No Amenazada** |
|
|
236 |
Synallaxis spixi |
1 |
R |
No Amenazada** |
|
|
237 |
Synallaxis albescens |
1 |
R |
No Amenazada** |
|
|
238 |
Synallaxis frontalis |
1 |
R |
No Amenazada** |
|
|
239 |
Tyrannidae |
Elaenia spectabilis |
1 |
MAN |
No Amenazada** |
|
240 |
Elaenia albiceps |
1 |
MAS |
No Amenazada** |
|
|
241 |
Elaenia parvirostris |
1 |
MAN |
No Amenazada** |
|
|
242 |
Camptostoma obsoletum |
1 |
R |
No Amenazada** |
|
|
243 |
Suiriri suiriri |
1 |
R |
No Amenazada** |
|
|
244 |
Anairetes parulus |
1 |
MAS |
No Amenazada** |
|
|
245 |
Anairetes flavirostris |
1 ED |
MAS |
No Amenazada** |
|
|
246 |
Serpophaga nigricans |
1 |
R |
No Amenazada** |
|
|
247 |
Serpophaga subcristata |
1 |
R |
No Amenazada** |
|
|
248 |
Serpophaga munda |
2 |
? |
No Amenazada** |
|
|
249 |
Serpophaga griseicapilla |
1 |
MLO |
No Amenazada** |
|
|
250 |
Polystictus pectoralis |
1 |
MAN |
Casi amenazada / Vulnerable |
|
|
251 |
Pseudocolopteryx sclateri |
1 |
R |
No Amenazada** |
|
|
252 |
Pseudocolopteryx acutipennis |
2 |
? |
No Amenazada** |
|
|
253 |
Pseudocolopteryx flaviventris |
1 |
R |
No Amenazada** |
|
|
254 |
Pseudocolopteryx citreola |
1 |
? |
No Amenazada** |
|
|
255 |
Euscarthmus meloryphus |
1 |
MAN |
No Amenazada** |
|
|
256 |
Stigmatura budytoides |
2 ED |
? |
No Amenazada** |
|
|
257 |
Phylloscartes ventralis |
1 |
R |
No Amenazada** |
|
|
258 |
Sublegatus modestus |
1 |
MAN |
No Amenazada** |
|
|
259 |
Tachuris rubrigastra |
1 |
R |
No Amenazada** |
|
|
260 |
Culicivora caudacuta |
1 |
R |
Vulnerable / Amenazada |
|
|
261 |
Hemitriccus margaritaceiventer |
1 |
R |
No Amenazada** |
|
|
262 |
Myiophobus fasciatus |
1 |
MAN |
No Amenazada** |
|
|
263 |
Lathrotriccus euleri |
1 |
MAN |
No Amenazada** |
|
|
264 |
Cnemotriccus fuscatus |
1 |
MAN |
No Amenazada** |
|
|
265 |
Pyrocephalus rubinus |
1 |
MAN |
No Amenazada** |
|
|
266 |
Lessonia rufa |
1 |
MAS |
No Amenazada** |
|
|
267 |
Knipolegus cyanirostris |
1 |
R |
No Amenazada** |
|
|
268 |
Knipolegus aterrimus |
1 |
R |
No Amenazada** |
|
|
269 |
Hymenops perspicillatus |
1 |
R |
No Amenazada** |
|
|
270 |
Satrapa icterophrys |
1 |
R |
No Amenazada** |
|
|
Apéndice. Continúa |
|||||
|
N |
Orden/ Familia |
Especies |
Categoría |
Fenología |
Categoría de amenaza: UICN / Nacional |
|
271 |
Muscisaxicola maclovianus |
2 |
MAS |
No Amenazada** |
|
|
272 |
Agriornis murinus |
1 |
MAS |
No Amenazada** |
|
|
273 |
Nengetus cinereus |
1 |
R |
No Amenazada** |
|
|
274 |
Neoxolmis coronatus |
1 |
MAS |
No Amenazada** |
|
|
275 |
Xolmis irupero |
1 |
R |
No Amenazada** |
|
|
276 |
Neoxolmis rubetraEND |
2 ED |
MAS |
No Amenazada / Vulnerable |
|
|
277 |
Heteroxolmis dominicana |
1 |
R |
Vulnerable / En peligro |
|
|
278 |
Neoxolmis rufiventris |
1 |
MAS |
No Amenazada** |
|
|
279 |
Fluvicola albiventer |
1 |
MAN |
No Amenazada** |
|
|
280 |
Arundinicola leucocephala |
1 |
R |
No Amenazada** |
|
|
281 |
Alectrurus risoraXX |
2 |
? |
Vulnerable / En peligro |
|
|
282 |
Machetornis rixosa |
1 |
R |
No Amenazada** |
|
|
283 |
Megarynchus pitangua |
2 ED |
MAS |
No Amenazada** |
|
|
284 |
Pitangus sulphuratus |
1 |
R |
No Amenazada** |
|
|
285 |
Myiodynastes maculatus |
1 |
MAN |
No Amenazada** |
|
|
286 |
Empidonomus varius |
1 |
MAN |
No Amenazada** |
|
|
287 |
Empidonomus aurantioatrocristatus |
1 |
MAN |
No Amenazada** |
|
|
288 |
Tyrannus melancholicus |
1 |
MAN |
No Amenazada** |
|
|
289 |
Tyrannus savanna |
1 |
MAN |
No Amenazada** |
|
|
290 |
Casiornis rufus |
1 |
R |
No Amenazada** |
|
|
291 |
Myiarchus swainsoni |
1 |
MAN |
No Amenazada** |
|
|
292 |
Myiarchus ferox |
1 |
R |
No Amenazada** |
|
|
293 |
Myiarchus tyrannulus |
1 |
R |
No Amenazada** |
|
|
294 |
Cotingidae |
Phytotoma rutila |
1 |
MLO |
No Amenazada** |
|
295 |
Tityridae |
Xenopsaris albinucha |
1 |
MAN |
No Amenazada** |
|
296 |
Pachyramphus viridis |
1 |
R |
No Amenazada** |
|
|
297 |
Pachyramphus polychopterus |
1 |
MAN |
No Amenazada** |
|
|
298 |
Pachyramphus validus |
1 |
R |
No Amenazada** |
|
|
299 |
Vireonidae |
Cyclarhis gujanensis |
1 |
R |
No Amenazada** |
|
300 |
Vireo chivi |
1 |
MAN |
No Amenazada** |
|
|
301 |
Corvidae |
Cyanocorax chrysops |
1 |
R |
No Amenazada** |
|
302 |
Hirundinidae |
Pygochelidon cyanoleuca |
1 |
R |
No Amenazada** |
|
303 |
Alopochelidon fucata |
1 |
MAN |
No Amenazada** |
|
|
304 |
Stelgidopteryx ruficollis |
1 |
MAN |
No Amenazada** |
|
|
305 |
Progne tapera |
1 |
MAN |
No Amenazada** |
|
|
306 |
Progne chalybea |
1 |
MAN |
No Amenazada** |
|
|
307 |
Progne elegans |
1 |
MAN |
No Amenazada** |
|
|
308 |
Tachycineta leucorrhoa |
1 |
R |
No Amenazada** |
|
|
Apéndice. Continúa |
|||||
|
N |
Orden/ Familia |
Especies |
Categoría |
Fenología |
Categoría de amenaza: UICN / Nacional |
|
309 |
Tachycineta leucopyga |
1 |
MAS |
No Amenazada** |
|
|
310 |
Riparia riparia |
1 |
MN |
No Amenazada** |
|
|
311 |
Hirundo rustica |
1 |
MN |
No Amenazada** |
|
|
312 |
Petrochelidon pyrrhonota |
1 |
MN |
No Amenazada** |
|
|
313 |
Troglodytidae |
Troglodytes aedon |
1 |
R |
No Amenazada** |
|
314 |
Cistothorus platensis |
1 |
R |
No Amenazada** |
|
|
315 |
Campylorhynchus turdinus |
1 |
? |
No Amenazada** |
|
|
316 |
Polioptilidae |
Polioptila dumicola |
1 |
R |
No Amenazada** |
|
317 |
Donacobiidae |
Donacobius atricapilla |
1 |
R |
No Amenazada** |
|
318 |
Turdidae |
Catharus ustulatus |
1 ED |
MN |
No Amenazada** |
|
319 |
Turdus rufiventris |
1 |
R |
No Amenazada** |
|
|
320 |
Turdus amaurochalinus |
1 |
R |
No Amenazada** |
|
|
321 |
Mimidae |
Mimus patagonicus |
1 |
MAS |
No Amenazada** |
|
322 |
Mimus saturninus |
1 |
R |
No Amenazada** |
|
|
323 |
Mimus triurus |
1 |
MLO |
No Amenazada** |
|
|
324 |
Sturnidae |
Acridotheres cristatellus |
2 EX |
? |
No Amenazada** |
|
325 |
Sturnus vulgaris |
1 EX |
R |
No Amenazada** |
|
|
326 |
Passeridae |
Passer domesticus |
1 EX |
R |
No Amenazada** |
|
327 |
Motacillidae |
Anthus chii |
1 |
R |
No Amenazada** |
|
328 |
Anthus furcatus |
1 |
R |
No Amenazada** |
|
|
329 |
Anthus chacoensis |
2 |
MAN |
No Amenazada** |
|
|
330 |
Anthus correndera |
1 |
R |
No Amenazada** |
|
|
331 |
Anthus hellmayri |
1 |
R |
No Amenazada** |
|
|
332 |
Fringillidae |
Chloris chloris |
1 EX |
? |
No Amenazada** |
|
333 |
Spinus magellanicus |
1 |
R |
No Amenazada** |
|
|
334 |
Euphonia chlorotica |
1 |
R |
No Amenazada / Vulnerable |
|
|
335 |
Euphonia cyanocephala |
1 ED |
MLE |
No Amenazada** |
|
|
336 |
Passerellidae |
Rhynchospiza strigiceps |
1 |
R |
No Amenazada** |
|
337 |
Ammodramus humeralis |
1 |
R |
No Amenazada** |
|
|
338 |
Arremon flavirostris |
1 |
R |
No Amenazada** |
|
|
339 |
Zonotrichia capensis |
1 |
R |
No Amenazada** |
|
|
340 |
Icteridae |
Cacicus solitarius |
1 |
R |
No Amenazada** |
|
341 |
Cacicus chrysopterus |
1 |
R |
No Amenazada** |
|
|
342 |
Icterus croconotusǿ |
3 |
– |
No Amenazada / Vulnerable |
|
|
343 |
Icterus pyrrhopterus |
1 |
R |
No Amenazada** |
|
|
344 |
Gnorimopsar chopi |
1 |
R |
No Amenazada** |
|
|
345 |
Amblyramphus holosericeus |
1 |
R |
No Amenazada / Vulnerable |
|
|
346 |
Agelasticus cyanopus |
1 |
R |
No Amenazada** |
|
|
347 |
Agelasticus thilius |
1 |
R |
No Amenazada** |
|
|
Apéndice. Continúa |
|||||
|
N |
Orden/ Familia |
Especies |
Categoría |
Fenología |
Categoría de amenaza: UICN / Nacional |
|
348 |
Chrysomus ruficapillus |
1 |
R |
No Amenazada** |
|
|
349 |
Xanthopsar flavus |
1 |
R |
Vulnerable / En peligro crítico |
|
|
350 |
Pseudoleistes guirahuro |
1 |
R |
No Amenazada** |
|
|
351 |
Pseudoleistes virescens |
1 |
R |
No Amenazada** |
|
|
352 |
Agelaioides badius |
1 |
R |
No Amenazada** |
|
|
353 |
Molothrus rufoaxillaris |
1 |
R |
No Amenazada** |
|
|
354 |
Molothrus bonariensis |
1 |
R |
No Amenazada** |
|
|
355 |
Dolichonyx oryzivorus |
1 |
MN |
No Amenazada / Vulnerable |
|
|
356 |
Leistes superciliaris |
1 |
R |
No Amenazada** |
|
|
357 |
Leistes defilippiiXX |
1 |
R |
Vulnerable / En peligro |
|
|
358 |
Leistes loyca |
2 |
R |
No Amenazada** |
|
|
359 |
Parulidae |
Geothlypis aequinoctialis |
1 |
R |
No Amenazada** |
|
360 |
Setophaga pitiayumi |
1 |
R |
No Amenazada** |
|
|
361 |
Myiothlypis leucoblephara |
1 |
R |
No Amenazada** |
|
|
362 |
Basileuterus culicivorus |
1 |
R |
No Amenazada** |
|
|
363 |
Cardinalidae |
Piranga flava |
1 |
R |
No Amenazada** |
|
364 |
Pheucticus aureoventrisǿ |
3 |
– |
No Amenazada** |
|
|
365 |
Cyanoloxia glaucocaerulea |
1 |
MAN |
No Amenazada / Vulnerable |
|
|
366 |
Cyanoloxia brissonii |
1 |
R |
No Amenazada** |
|
|
367 |
Thraupidae |
Hemithraupis guira |
1 ED |
? |
No Amenazada** |
|
368 |
Conirostrum speciosum |
1 |
R |
No Amenazada** |
|
|
369 |
Sicalis flaveola |
1 |
R |
No Amenazada** |
|
|
370 |
Sicalis luteola |
1 |
R |
No Amenazada** |
|
|
371 |
Rhopospina carbonariaEND |
1 |
MAS |
No Amenazada** |
|
|
372 |
Volatinia jacarina |
1 |
MAN |
No Amenazada** |
|
|
373 |
Tachyphonus rufus |
1 |
R |
No Amenazada** |
|
|
374 |
Trichothraupis melanops |
1 |
? |
No Amenazada** |
|
|
375 |
Coryphospingus cucullatus |
1 |
R |
No Amenazada** |
|
|
376 |
Tersina viridis |
1 ED |
ER |
No Amenazada** |
|
|
377 |
Sporophila leucoptera |
1 |
MAN |
No Amenazada** |
|
|
378 |
Sporophila hypoxantha |
1 |
MAN |
No Amenazada / Vulnerable |
|
|
379 |
Sporophila ruficollis |
1 |
MAN |
Casi amenazada / Vulnerable |
|
|
380 |
Sporophila palustris |
1 |
MAN |
En peligro de extinción / En peligro de extinción |
|
|
381 |
Sporophila hypochroma |
1 |
MAN |
Casi amenazada / Amenazada |
|
|
382 |
Sporophila cinnamomea |
1 |
MAN |
Vulnerable / Amenazada |
|
|
383 |
Sporophila caerulescens |
1 |
R |
No Amenazada** |
|
|
384 |
Sporophila collaris |
1 |
R |
No Amenazada** |
|
|
385 |
Saltatricula multicolor |
1 |
R |
No Amenazada** |
|
|
Apéndice. Continúa |
|||||
|
N |
Orden/ Familia |
Especies |
Categoría |
Fenología |
Categoría de amenaza: UICN / Nacional |
|
386 |
Saltator coerulescens |
1 |
R |
No Amenazada** |
|
|
387 |
Saltator similis |
1 |
R |
No Amenazada** |
|
|
388 |
Saltator aurantiirostris |
1 |
R |
No Amenazada** |
|
|
389 |
Embernagra platensis |
1 |
R |
No Amenazada** |
|
|
390 |
Emberizoides herbicola |
1 |
R |
No Amenazada** |
|
|
391 |
Emberizoides ypiranganus |
1 |
R |
No Amenazada / Vulnerable |
|
|
392 |
Poospiza ornataEND |
1 |
MLO |
No Amenazada** |
|
|
393 |
Poospiza nigrorufa |
1 |
R |
No Amenazada** |
|
|
394 |
Thlypopsis sordida |
1 |
R |
No Amenazada** |
|
|
395 |
Microspingus cabanisi |
1 |
R |
No Amenazada** |
|
|
396 |
Microspingus torquatus |
1 |
R |
No Amenazada** |
|
|
397 |
Microspingus melanoleucus |
1 |
R |
No Amenazada** |
|
|
398 |
Donacospiza albifrons |
1 |
R |
No Amenazada** |
|
|
399 |
Asemospiza obscura |
1 |
MAN |
No Amenazada** |
|
|
400 |
Diuca diuca |
1 |
MAS |
No Amenazada** |
|
|
401 |
Gubernatrix cristata |
1 |
R |
En Peligro** |
|
|
402 |
Paroaria coronata |
1 |
R |
No Amenazada** |
|
|
403 |
Paroaria capitata |
1 |
R |
No Amenazada** |
|
|
404 |
Stephanophorus diadematus |
1 |
R |
No Amenazada** |
|
|
405 |
Pipraeidea melanonota |
1 |
R |
No Amenazada** |
|
|
406 |
Rauenia bonariensis |
1 |
R |
No Amenazada** |
|
|
407 |
Thraupis sayaca |
1 |
R |
No Amenazada** |
|
|
408 |
Stilpnia preciosa |
1 |
R |
No Amenazada** |
Referencias
Acevedo, P., Jiménez-Valverde, A., Lobo, J. M. y Real, R. (2012). Delimiting the geographical background in species distribution modelling. Journal of Biogeography, 39, 1383–1390. https://doi.org/1010.1111/j.1365-2699.2012.02713.x
Albuquerque, F. S. y Beier, P. (2015). Rarity-weighted richness: A simple and reliable alternative to integer programming and heuristic algorithms for minimum set and maximum coverage problems in conservation planning. Plos One, 10, 1–7. https://doi.org/10.1371/journal.pone.0119905
Alvarado, H. y La Grotteria, J. (2011). Expansión del Picapalo Colorado (Campylorhamphus trochilirostris) hasta el límite austral del bosque en galería sobre el río Paraná en la provincia de Entre Ríos. Ecoregistros, 1, 1–4.
Arzamendia, V. y Giraudo, A. R. (2012). A panbiogeographical model to prioritize areas for conservation along large rivers. Diversity and Distribution, 18, 168–179. https://doi.org/10.1111/j.1472-4642.2011.00829.x
Arzamendia, V., Giraudo, A. R. y Bellini, G. P. (2015). Relaciones biogeográficas de los grandes ríos de la cuenca del Plata basadas en ensambles de serpientes. Revista Mexicana de Biodiversidad, 86, 674 – 684. https://doi.org/10.1016/j.rmb.2015.06.006
Azpiroz, A. B., Isacch, J. P., Dias, R. A., Di Giacomo, A. S., Fontana, C. S. y Palarea, C. M. (2012). Ecology and conservation of grassland birds in southeastern South America: a review. Journal of Field Ornithology, 83, 217–246. http://doi.org/10.1111/j.1557-9263.2012.00372.x
Badaracco, V. (2012). Diagnóstico ambiental de la provincia de Entre Ríos. Estudios y proyectos provincials. Buenos Aires: Consejo Federal de Inversiones.
Barrows, W. B. (1884). Birds of the Lower Uruguay (concluded). Oxford University Press The Auk, 1, 313–319.
Beltzer, A. H., Collins P. A. y Quiroga, M. A. (2006). Atlas ornitogeográfico de la provincia de Entre Ríos. Santa Fe, Santa Fe: INALI/ CERIDE-CONICET/ Serie Climax.
Bini, L. M., Diniz-Filho, J. A. F., Rangel, T. F., Bastos, R. P. y Pinto, M. P. (2006). Challenging Wallacean and Linnean shortfalls: knowledge gradients and conservation planning in a biodiversity hotspot. Diversity and Distributions, 12, 475–482. https://doi.org/10.1111/j.1366-9516.2006.00286.x
Boakes, E. H., McGowan, P. J. K., Fuller, R. A., Chang-qing, D., Clark, N. E., O’Connor, K. et al. (2010). Distorted views of biodiversity: Spatial and temporal bias in species occurrence data. Plos Biological, 8, e1000385. https://doi.org/10.1371/journal.pbio.1000385
Butchart, S. H. M., Walpole, M., Collen, B., van Strien, A., Scharlemann, J. P. W., Almond, R. E. A., et al. (2010). Global biodiversity: indicators of recent declines. Science, 328, 1164–1168. https://doi.org/10.1126/science.1187512
Butchart, S. H. M., Lowe, S., Martin, R. W., Symes, A., Westrip, J. R. S., Wheatley, H. (2018). Which birds have gone extinct? A novel quantitative classification approach. Biological Conservation, 227, 9–18. https://doi.org/10.1016/j.biocon.2018.08.014
Callaghan, C. T., Rowley, J. J. L., Cornwell, W. K., Poore, A. G. B. y Major, R. E. (2019). Improving big citizen science data: Moving beyond haphazard sampling. Plos Biology, 17, e300035. https://doi.org/10.1371/journal.pbio.3000357
CBRO. (2010). Listas das Aves do Brasil. Comitê Brasileiro de Registros Ornitológicos (CBRO) 9ª Edição: www.cbro.org.br/CBRO/pdf/avesbrasil_ago2009.pdf
Ceballos, G., Ehrlich, P. R. y Dirzo, R. (2017). Biological annihilation via the ongoing sixth mass extinction signaled by vertebrate population losses and declines. Proceedings of the National Academy of Sciences, 114, E6089–E6096. https://doi.org/10.1073/pnas.1704949114
Ceballos, G. y Ortega-Baes, P. (2011). La sexta extinción: la pérdida de especies y poblaciones en el Neotrópico. En J. Simonetti y R. Dirzo (Eds.), Conservación biológica: perspectivas de Latinoamérica (pp. 95–108). Santiago de Chile: Editorial Universitaria.
Chape, S., Harrison, J., Spalding, M. y Lysenko, I. (2005). Measuring the extent and effectiveness of Protected Areas as an indicator for meeting global biodiversity targets. Philosophical Transactions of the Royal Society B: Biological Sciences, 360, 443–455. https://doi.org/10.1098/rstb.2004.1592
Cristaldi, M. A., Sarquis, A., Arzamendia, V., Bellini, P. y Giraudo, A. R. (2019). Human activity and climate change as determinants of spatial prioritization for the conservation of globally threatened birds in the southern Neotropic (Santa Fe, Argentina). Biodiversity and Conservation, 28, 2531–2553. https://doi.org/10.1007/s10531-019-01774-z
Dardanelli, S., Reales, F., Ali, S. y Bisheimer, J. (2020). Primer registro de Tersina (Tersina viridis) para la provincia de Entre Ríos, Argentina. Nuestras Aves, 65, 88–89.
Dardanelli, S., Reales, C. F. y Sarquis, J. A. (2018). Avifaunal inventory of northern Entre Ríos, Argentina: noteworthy records and conservation prospects. Revista del Museo Argentino de Ciencias Naturales, 20, 217–227.
De la Peña, M. R. (1997). Lista y distribución de las aves de Santa Fe y Entre Ríos. Buenos Aires: Lola.
De la Peña, M. R. (2012). Distribución y citas de aves de Entre Ríos. Santa Fe: Ediciones Biológica, Serie Naturaleza, Conservación y Sociedad N°6.
Di Giacomo, A. S. y Di Giacomo, A. G. (2004). Extinción, historia natural y conservación de las poblaciones del Yetapá de Collar (Alectrurus risora) en la Argentina. Ornitología Neotropical, 15, 145–157.
Di Giacomo, A. S., De Francesco, M. V. y Coconier, E. G. (2007). Áreas importantes para la conservación de las aves en Argentina. Sitios prioritarios para la conservación de la biodiversidad. Buenos Aires: Temas de Naturaleza y Conservación Aves Argentinas/Asociación ornitológica del Plata.
Domínguez, M., Lapido, R., Gorrindo, A., Archuby, D., Correa, E., Llanos, F., et al. (2020). A citizen science survey discloses the current distribution of the endangered Yellow Cardinal Gubernatrix cristata in Argentina. Bird Conservation International, 31, 139–150. https://doi.org/10.1017/S0959270920000155
Dudley, N. (2008). Directrices para la aplicación de las categorías de gestión de áreas protegidas. UICN, Gland, Suiza.
Fandiño, B. y Giraudo, A. R. (2010). Revisión del inventario de aves de la provincia de Santa Fe, Argentina. FABICIB, 14, 116–137.
Fandiño, B. y Giraudo, A. R. (2012). Un análisis biogeográfico de la composición y distribución de la avifauna de Santa Fe, Argentina. Ornitología Neotropical, 23, 467–488.
Freiberg, M. (1943). Enumeración sistemática de las aves de Entre Ríos y lista de ejemplares representados en el Museo de Entre Ríos. Memorias Museo de Entre Ríos, 77, 1–110.
Giraudo, A. R. y Arzamendia, V. (2004). ¿Son las planicies fluviales de la Cuenca del Plata, corredores de biodiversidad? Los vertebrados amniotas como ejemplo. En J. J. Neiff (Ed.), Humedales de Iberoamérica (pp. 157–170). La Habana: CYTED/ Programa Iberoamericano de Ciencia y Tecnología para el desarrollo/ Red Iberoamericana de Humedales (RIHU).
Giraudo, A. R. y Arzamendia, V. (2018). Descriptive bioregionalisation and conservation biogeography: what is the true bioregional representativeness of protected areas? Australian Systematic Botany, 30, 403–413. https://doi.org/10.1071/SB16056
González-Oreja, J. A., De la Fuente-Díaz Ordaz, A. A., Hernández-Santín, L., Buzo-Franco, D. y Bonache-Regidor, C. (2010). Evaluación de estimadores no paramétricos de la riqueza de especies. Un ejemplo con aves en áreas verdes de la ciudad de Puebla, México. Animal Biodiversity and Conservation, 33, 31–45.
Gray, C. L., Hill, S. L. L., Newbold, T., Hudson, L. N., Börger, L., Contu, S. et al. (2016). Local biodiversity is higher inside than outside terrestrial protected areas worldwide. Nature Communications, 7, 12306. https://doi.org/10.1038/ncomms12306
Hijmans, A. R. J., Guarino, L. y Mathur, P. (2012). DIVA-GIS Version 7.5 Manual. University of California, USA.
Jiménez-Valverde, A. y Hortal, J. (2003). Las curvas de acumulación de especies y la necesidad de evaluar la calidad de los inventarios biológicos. Revista Ibérica de Aracnología, 1, 151–161.
Kati, V., Devillers, P., Dufrêne, M., Legakis, A., Vokou, D. y Lebrun, P. (2004). Hotspots, complementarity or representativeness? Designing optimal small-scale reserves for biodiversity conservation. Biological Conservation, 120, 471–480. https://doi.org/10.1016/j.biocon.2004.03.020
Lees, A. C., Rosenberg, K. V., Ruiz-Gutierrez, V., Marsden, S., Schulenberg, T. S. y Rodewald, A. D. (2020). A roadmap to identifying and filling shortfalls in Neotropical ornithology. The Auk, 137, 1–17. https://doi.org/10.1093/auk/ukaa048
Marateo, G., Povedano, H. y Alonso, J. (2009). Inventario de las aves del Parque Nacional El Palmar, Argentina. Cotinga, 31, 47–60.
Margules, C. y Sarkar, S. (2007). Systematic conservation planning. Cambridge: Cambridge University Press.
Margules, C. R. y Pressey, R. L. (2000). Systematic conservation planning. Nature, 405, 243–253. https://doi.org/10.1038/35012251
Morello, J. H., Matteucci, S. D., Rodríguez, A. F. S., Rodríguez, A. F. y Silva, M. E. (2012). Ecorregiones y complejos ecosistémicos argentinos. Buenos Aires: FADU.
Muñoz, J., Milera, S., Romero, C. y Brizuela, A. B. (2005). Bosques nativos y selvas ribereñas en la provincia de Entre Ríos. INSUGEO, Miscelánea, 14, 169–182.
Navarro-Sigüenza, A. G., Rebón-Gallardo, M. F., Gordillo-Martínez, A., Peterson, A. T., Berlanga-García, H. y Sánchez-González, L. A. (2014). Biodiversidad de aves en México. Revista Mexicana de Biodiversidad, 85, S476–S495. https://doi.org/10.7550/rmb.41882
Nores, M., Cerana, M. M. y Serra, D. A. (2005). Dispersal of forest birds and trees along the Uruguay River in southern South America. Diversity and Distributions, 11, 205–217. https://doi.org/10.1111/j.1366-9516.2005.00141.x
Oksanen, J., Blanchet, F. G., Friendly, M., Kindt, R., Legendre, P., McGlinn, D., et al. (2019). Vegan: Community Ecology Package. R package version 2.5-6.
Puente, G., Maugeri, G. y Spais R. (2020). Tercer registro de Picaflor Garganta Escamada (Heliomaster squamosus) en Argentina. Nuestras Aves, 65, 84.
Reales, F., Sarquis, J. A., Dardanelli, S. y Lammertink, M. (2019). Range contraction and conservation of the endangered Yellow Cardinal. Journal for Nature Conservation, 50, 125708. https://doi.org/10.1002/aqc.3270040406
Rebelo, A. G. y Siegfried, W. R. (1992). Where should nature reserves be located in the Cape Floristic Region, South Africa? Models for the spatial configuration of a reserve network aimed at maximising the protection of floral diversity. Conservation Biology, 6, 243–252. https://doi.org/10.1046/j.1523-1739.1992.620243.x
Remsen, J. V., Areta, J. I., Bonaccorso, E., Claramunt, S., Jaramillo, A., Pacheco, J. F. et al. (2021). A classification of the bird species of South America. American Ornithological Society. Recuperado 10 Octubre 2021. http://www.museum.lsu.edu/~Remsen/SACCBaseline.htm
Rodrigues, A. S., Andelman, S. J., Bakarr, M. I., Boitani, L., Brooks, T. M., Cowling, R. M. et al. (2004). Effectiveness of the global protected area network in representing species diversity. Nature, 428, 9–12. https://doi.org/10.1038/nature02422
Sarquis, J. A. (2018). Conservación de la avifauna de Entre Ríos (Argentina): uso de métodos biogeográficos y de optimización para evaluar la efectividad de las áreas protegidas (Tesis doctoral). Facultad de Bioquímica y Ciencias Biológicas, Universidad Nacional del Litoral. Argentina, Santa Fe. Disponible en: https://bibliotecavirtual.unl.edu.ar:8443/handle/11185/1122
Sarquis, J. A., Alonso, L., Giraudo, A. R. y Berduc, A. (2017). First records of Calidris canutus Linnaeus, 1758 (Charadriiformes: Scolopacidae) and Trogon surrucura Vieillot, 1817 (Trogoniformes: Trogonidae) for Entre Ríos province (Argentina), and noteworthy reports of other birds in protected areas. Check List, 13, 1067–1073. https://doi.org/10.15560/13.6.1067
Soberón, J. y Peterson, A. T. (2005). Interpretation of models of fundamental ecological niches and species’ distributional areas. Biodiversity and Informatics, 2, 1–10. https://doi.org/10.17161/bi.v2i0.4
Soutullo, A. y Gudynas, E. (2006). How effective is the MERCOSUR’s network of protected areas in representing South America’s ecoregions? Oryx, 40, 112–116.
Triviño, M., Kujala, H., Araújo, M. B. y Cabeza, M. (2018). Planning for the future: identifying conservation priority areas for Iberian birds under climate change. Landscape Ecology, 33, 659–673. https://doi.org/10.1007/s10980-018-0626-z
UICN (2012) Directrices para el uso de los Criterios de la Lista Roja de la UICN a nivel regional y nacional: Versión 4.0. Gland, Suiza y Cambridge, Reino Unido.
UICN (2021) The IUCN Red List of Threatened Species. http://www.iucnredlist.org Recuperdado el 06 febrero, 2021.
Veach, V., Di Minin, E., Pouzols, F. M. y Moilanen, A. (2017). Species richness as criterion for global conservation area placement leads to large losses in coverage of biodiversity. Diversity and Distribution, 23, 715–726. https://doi.org/10.1111/ddi.12571
Wisz, S., Hijmans, R. J., Li, J., Peterson, A. T., Graham, C. H., Guisan, A. et al. (2008). Effects of sample size on the performance of species distribution models. Diversity and Distribution, 14, 763–773. https://doi.org/10.1111/j.1472-4642.2008.00482.x
Zapata, A. R. P. (1975). Aves observadas en la proximidad de la confluencia de los ríos Uruguay y Gualeguaychú, provincia de Entre Ríos. Hornero, 11, 291–304.