Diversidad de avispas depredadoras en dos tipos de vegetación del estado de Yucatán en México
Maximiliano Vanoye-Eligio a, *, Virginia Meléndez-Ramírez b, Ricardo Ayala-Barajas c, Hugo Delfín-González b y Jorge Víctor Horta-Vega d
a Instituto Tecnológico Superior de Escárcega, Calle 85 s/n entre 10-B Col. Unidad Esfuerzo y Trabajo Núm. 1, 24350 Escárcega, Campeche, México
b Departamento de Zoología, Campus de Ciencias Biológicas y Agropecuarias, Universidad Autónoma de Yucatán, Apartado postal 4-116, Itzimná, 97000 Mérida, Yucatán, México
c Estación de Biología Chamela, Instituto de Biología, Universidad Nacional Autónoma de México, Apartado postal 21, 48980 San Patricio, Jalisco, México
d Instituto Tecnológico de Cd. Victoria, Boulevard Emilio Portes Gil Núm. 1301 Pte. Apartado postal 175, 87010 Cd. Victoria, Tamaulipas, México
*Autor para correspondencia: maxvanoye@itsescarcega.edu.mx (M. Vanoye-Eligio)
Resumen
Las avispas depredadoras o cazadoras son importantes en los ecosistemas ya que regulan las poblaciones de otros insectos y arañas. En este trabajo se determinó la diversidad espacial y temporal de avispas depredadoras en los 2 tipos de vegetación principales del estado de Yucatán: selva baja caducifolia y selva mediana subcaducifolia. El material revisado proviene de trampas Malaise colocadas en áreas de los tipos de vegetación, que estuvieron activas 1 año y de recolectas con red aérea. Se revisaron 877 individuos pertenecientes a 4 familias de avispas depredadoras (Crabronidae, Pompilidae, Sphecidae y Vespidae), se identificaron 68 especies, siendo Crabronidae la familia con mayor riqueza (26) y Pompilidae la de mayor abundancia (458 individuos). En la selva baja caducifolia se encontró mayor abundancia y riqueza de especies (86% y 91%, respectivamente) que en la selva mediana subcaducifolia (48% y 13%). No hubo diferencias en la riqueza de especies y la abundancia entre temporadas del año, pero la composición de especies tuvo baja similitud. Se encontraron 10 nuevos registros de especies para Yucatán. Se sugieren otros estudios de estas avispas en el neotrópico, en especial en México, y se indica la importancia de su biodiversidad en los ecosistemas estudiados para su conservación y posible uso.
Palabras clave: Crabronidae; Pompilidae; Sphecidae; Vespidae; Riqueza de especies; Yucatán
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Diversity of predatory wasps in two types of vegetation of the State of Yucatán in Mexico
Abstract
Predatory wasps or hunters are important in ecosystems because they regulate the populations of other insects and spiders. In the state of Yucatán, these insects have been studied very little and in this work, their spatial and temporal diversity was determined in the 2 main vegetation types of Yucatán, low deciduous forest and the medium subcaducifolia forest. The material reviewed comes from Malaise traps placed in areas of vegetation types, which were active one year and from collections with aerial networks. We reviewed 877 individuals belonging to 4 families of predatory wasps (Crabronidae, Pompilidae, Sphecidae and Vespidae), 68 species were identified, being Crabronidae the richest family (26) and Pompilidae the most abundant (458 individuals). In the low deciduous forest, the highest abundance and species richness was found (86% and 91%, respectively) than in the medium subcaducifolia forest (48% and 13%). There were no differences in species richness and abundance between seasons of the year but the composition of species had low similarity. Ten new species records were found for Yucatán. Other studies of these wasps are suggested in the neotropics, especially in Mexico, and the importance of their biodiversity in the studied ecosystems is indicated for their conservation and possible use.
Keywords: Crabronidae; Pompilidae; Sphecidae; Vespidae; Species richness; Yucatán
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
Entre los insectos, un grupo importante en los ecosistemas terrestres es el orden Hymenoptera, ya que numerosas especies son polinizadores, depredadores o parasitoides de importancia ecológica y económica (Ruíz-Cancino et al., 2010). Las avispas depredadoras o cazadoras son himenópteros de importancia ecológica por sus hábitos alimenticios ya que regulan a las poblaciones de otros insectos y arañas, y algunas especies se han sugerido para el control biológico de plagas (Ábrego y Murgas, 2018; O`Neill, 2001; Ruíz-Cancino et al., 2010). Varias avispas se pueden considerar como depredadoras con fines pedotróficos, es decir, las hembras capturan presas que paraliza y acumulan en nidos, estas presas permanecen inmóviles pero vivas y proporcionan el alimento a las larvas para su desarrollo, entre estas avispas cazadoras se encuentran las especies de algunas familias como Crabronidae, Sphecidae y Pompilidae, en éstas los adultos se alimentan de néctar de las flores. Otras avispas como las especies de la familia Vespidae son depredadores ya que los adultos se alimentan de su presa (Ayala y Meléndez, 2017; Fernández y Pujade, 2015).
A la fecha, hacen falta estudios de estas avispas sobre su distribución, diversos aspectos de su ecología y trabajos faunísticos (Horta et al., 2007). En general, en México hay pocos estudios de avispas depredadoras o cazadoras y para la península de Yucatán solo recientemente se publicó una revisión de las especies previamente registradas (Vanoye et al., 2014), así como un estudio en Yucatán en los principales tipos de vegetación de Áreas Naturales Protegidas de competencia estatal (Vanoye et al., 2015). Al presente, para el estado de Yucatán se tiene el registro de 126 especies de avispas de las principales familias, Crabronidae y Sphecidae (Superfamilia Apoidea) y Pompilidae y Vespidae (Superfamilia Vespoidea) (Vanoye et al., 2014, 2015).
Las avispas ocupan numerosos nichos ecológicos en los ecosistemas terrestres del mundo. En la península de Yucatán se observan ecosistemas muy variados (Carnevali et al., 2003), particularmente en el estado de Yucatán destacan la selva baja caducifolia por ser uno de los tipos de vegetación predominante (Flores y Espejel, 1993), de importancia ecológica y desde el punto de vista de la conservación (Orellana et al., 2003); así como la selva mediana subcaducifolia que se distribuye en la parte centro y norte de la península de Yucatán, en forma de franja (Pennington y Sarukhán, 2005), y que ocupa una superficie amplia, y hacia el sur del estado es la selva dominante. Estas selvas han sido y son usadas por las sociedades humanas y se encuentran en diferentes estados sucesionales (Flores y Espejel, 1993).
En México, la deforestación y el cambio del uso de suelo a zonas principalmente agrícolas y ganaderas están impactando negativamente los ecosistemas y recientemente existe la reducción en la riqueza y abundancia de organismos (Espadas-Manrique, 2004). Por ello, el conocimiento de la diversidad de especies en estas selvas es urgente, ya que aún es escaso para diferentes grupos de insectos, incluyendo a las avispas depredadoras y a las cazadoras, y es necesario tener mejor conocimiento por su posible aplicación en el control biológico y para la conservación de la biodiversidad (Butchart et al., 2006; Carignan y Villard, 2002). El objetivo del presente trabajo fue revisar y determinar la diversidad espacial y temporal de avispas depredadoras y cazadoras en Selva Baja Caducifolia y Selva Mediana Subcaducifolia (SBC y SMSC, respectivamente) del estado de Yucatán, consideradas los 2 principales tipos de vegetación del estado, y que frecuentemente se encuentran contiguos (Dzib-Castillo et al., 2014).
Materiales y métodos
El material revisado proviene de muestreos en 2 tipos de vegetación: SBC y SMSC del estado de Yucatán. La SBC se encuentra en la localidad de Xmatkuil, Municipio de Mérida (20°58’01″ N, 89°37’28” O), a 10 m snm, con temperatura mensual promedio de 26.2 °C y precipitación anual promedio de 1,014 mm. La SMSC está ubicada en la localidad de Hobonil, Municipio de Tzucacab (20°04’19” N, 89°03’01” O), a 31 m snm, con temperatura mensual promedio de 26.3 y precipitación anual promedio de 1,200 mm, ambos tipos de vegetación con clima tipo AW0 (INEGI, 2017).
En los tipos de vegetación fueron colocadas 8 trampas Malaise, trampas comúnmente usadas en otros estudios de himenópteros y consideradas como un buen método pasivo basado en la intercepción del vuelo (González-Oreja et al., 2003; Horta et al., 2007, 2009; Noyes, 1989; Nuez et al., 2003; Rodríguez-Vélez et al., 2011). La recolecta de avispas se realizó en las 2 selvas, estableciendo 4 áreas de 1,000 m2 cada una, considerando vegetación conservada y en sucesión, para recolectar el mayor número de especies. La distancia entre cada área de muestreo fue de 500 m, las trampas estuvieron activas durante todo un año para el análisis temporal de la diversidad y abundancia de avispas, las muestras de las trampas Malaise se recogieron cada 15 días. Aunado a esto se realizaron recolectas con una red aérea en un horario de 09:00 a 13:00 hrs. durante 2 días para cada tipo de vegetación, en los primeros días de cada mes. Los ejemplares se determinaron a nivel específico con literatura especializada (Bohart y Menke, 1976; Buck et al., 2008; Carpenter y Garcete-Barrett, 2002; Corro y Cambra, 2011; Evans, 1966; Gauld y Bolton, 1988; La Salle y Gauld, 1993; Rodríguez et al., 2010; Sharkey, 2006; Wenzel, 1998) y con el apoyo de expertos en el área. Las especies que no se pudieron determinar se identificaron a género y se siguió el criterio de morfoespecie. Además, se acudió a verificar la determinación de las especies en colecciones de la Universidad Nacional Autónoma de México, la Universidad Autónoma de Tamaulipas y el Instituto Tecnológico de Ciudad Victoria del mismo estado. El material identificado a nivel específico está depositado en la Colección entomológica Regional de la Universidad Autónoma de Yucatán.
La riqueza específica observada se obtuvo mediante el número de especies total y para cada familia de avispas depredadoras, en cada tipo de vegetación. Para determinar la riqueza de especies, se calculó el estimador de riqueza no paramétrico Chao 1 (Chao 1 = S + a2/2b), ya que es el que mejor estima el número de especies que faltan por recolectar basándose en la cuantificación de la rareza de las especies recolectadas (González-Oreja et al., 2010; López-Gómez y Williams-Linera, 2006; Toti et al., 2000). La abundancia se analizó de acuerdo al número total de individuos por familia y tipo de vegetación. Se construyeron gráficos de rango-abundancia para cada tipo de vegetación (Feisinger, 2001). Se definieron el número de especies con 1 o 2 individuos.
La diversidad (desde el punto de vista de la estructura de las comunidades) se obtuvo mediante índices comúnmente utilizados (Shannon-Wiener: H = -∑Pi (lnPi) y Equidad de Pielou: J´= H’/lnS). Además, al índice de Shannon-Wiener se le aplicó una prueba aleatorizada para detectar diferencias entre las diversidades descritas por el índice de cada tipo de vegetación (Solow, 1993). Para los índices de diversidad y la prueba para observar diferencias se utilizó el programa Species Diversity & Richness, versión SDR 3.03 (Pisces Conservation, 2004). Para complementar los análisis de biodiversidad se realizó un análisis de similitud mediante el índice de Sorensen (ISS = [2c/(A+B)] 100; Krebs, 1989) para definir si hay diferencias en la composición de especies entre los 2 tipos de vegetación. La riqueza y abundancia a través de los meses y épocas del año se determinó considerando 3 temporadas del año: secas (marzo-junio), lluvias (julio-octubre) y nortes (noviembre-febrero). Mediante una prueba de Kruskal-Wallis, se determinó si hay diferencias en la riqueza y en la abundancia entre las temporadas del año utilizando el programa PAST (Hammer et al., 2001) y adicionalmente, se utilizó el índice de Sorensen para definir si había diferencias en la composición de especies entre temporadas del año.
Resultados
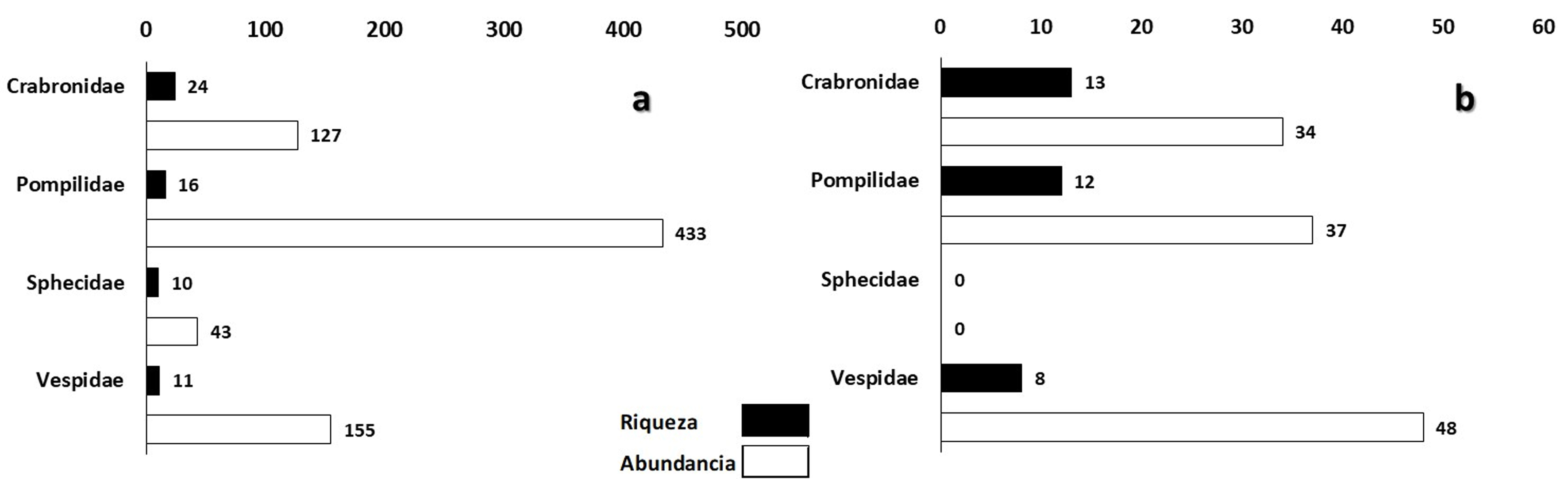
Se identificaron 68 especies (apéndice 1), siendo la familia Crabronidae la que presentó mayor riqueza de especies (26), seguida de Pompilidae (18), Vespidae (14) y Sphecidae (10). En la SBC se registró el mayor número de especies, siendo menor el número de especies para SMSC, se encontraron varias especies con 1 o 2 individuos (singletons y dobletons). Ambos tipos de vegetación compartieron 26 especies. La familia Crabronidae fue la más rica en especies en ambos tipos de vegetación, siendo la SBC donde se presentó el mayor número (tabla 1). En estas selvas se encontraron 10 nuevos registros de especies para el estado de Yucatán (apéndice 1). De acuerdo al estimador de riqueza que se calculó (Chao 1) en los diferentes tipos de vegetación los valores fueron bajos, 35% (SMSC) y 65% (SBC) (tabla 2).
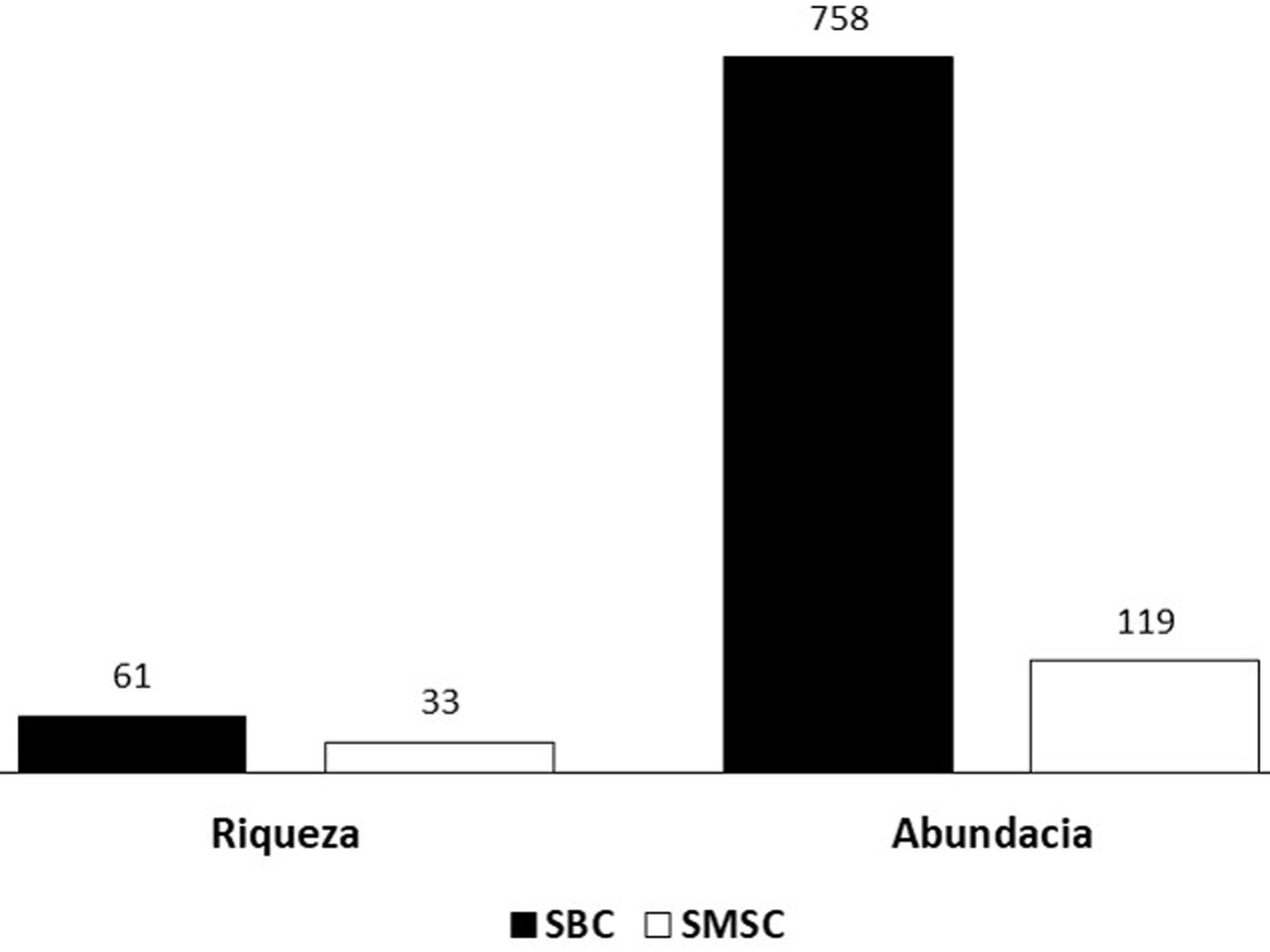
La abundancia total fue de 877 individuos, la familia Pompilidae presentó la mayor abundancia, ya que representa el 54% de la abundancia total, seguida por Vespidae (23%), Crabronidae (18%) y Sphecidae (5%) (apéndice 1). En los tipos de vegetación que se estudiaron, se observa que la SBC fue donde se presentó la mayor abundancia (86%) (figs. 1, 2).
Tabla 1
Riqueza, especies únicas y compartidas de avispas depredadoras en 2 tipos de vegetación en Yucatán. SBC = Selva baja caducifolia, SMSC = selva mediana subcaducifolia.
|
|
Especies únicas |
Especies compartidas |
Total |
||
|
SBC |
SMSC |
SBC |
SMSC |
||
|
Crabronidae |
14 |
2 |
11 |
24 |
13 |
|
Pompilidae |
6 |
2 |
10 |
16 |
12 |
|
Sphecidae |
12 |
0 |
0 |
10 |
0 |
|
Vespidae |
6 |
3 |
5 |
11 |
8 |
|
Total |
38 |
7 |
26 |
61 |
33 |
Tabla 2
Valores calculados con el estimador de riqueza no paramétrico (Chao 1) de avispas depredadoras en 2 tipos de vegetación. % = porcentaje de la riqueza observada respecto a los valores obtenidos con el estimador de riqueza.
|
Tipo de selva |
Spp. Obs |
Chao 1 |
% |
Sing |
Doble |
H´ |
J |
|
SBC |
77 |
117.63 |
65 |
32 |
18 |
2.92 |
0.71 |
|
SMSC |
37 |
107 |
35 |
5 |
16 |
2.81 |
0.80 |
SBC = Selva baja caducifolia, SMSC = selva mediana subcaducifolia, H’ = índice de Shannon-Wiener, J = índice de equidad (Pielou), Sing = singletons y Doble = dobletons.
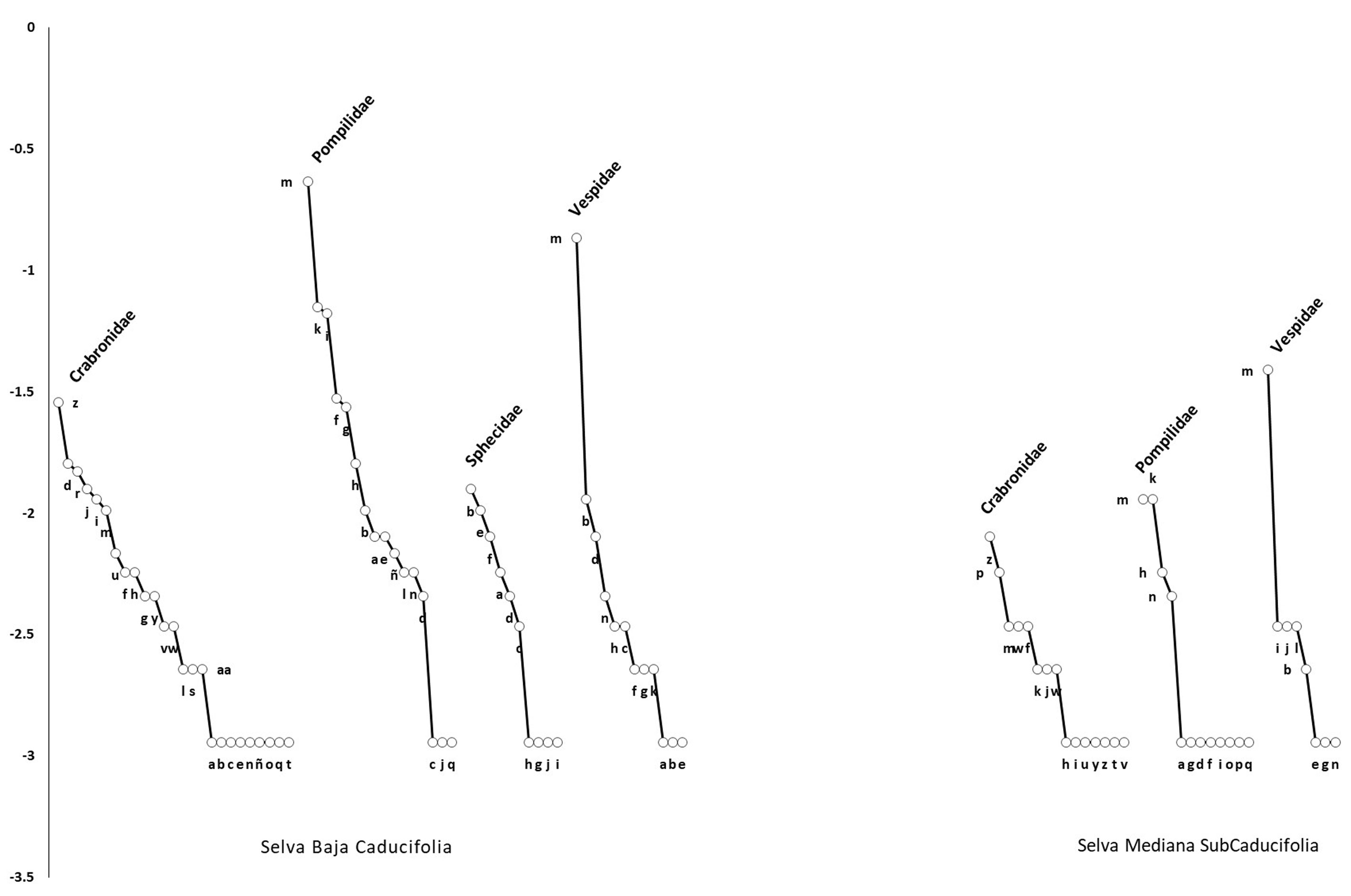
Las abundancias de las especies en las curvas de rango-abundancia (fig. 3) muestran estructuras diferentes de la comunidad de avispas para cada tipo de vegetación. En SBC se registraron 61 (91%) especies y en SMSC 33 (48%). En SBC, las especies más abundantes fueron Aporus notabilis notabilis (Pompilidae) que representó 27%, seguida por Polybia diguetana (16%); es en este tipo de vegetación en donde se presentó el mayor número de especies (91%) e individuos (86%) recolectados en el estudio. En SMSC, Polybia diguetana (Vespidae) y Aporus notabilis notabilis (Pompilidae) fueron las especies con más individuos (29 y 8%, respectivamente), mientras que la familia Sphecidae no se registró en esta selva. En ambas selvas se presentaron numerosas especies con 1 o 2 ejemplares (tabla 2).
A nivel de familia, las abundancias de cada especie fueron diferentes en cada tipo de vegetación. La SBC registró 758 individuos, de los cuales Crabronidae representó 17%, Pompilidae 57%, Sphecidae 6% y Vespidae 20%. Las especies con mayor abundancia de cada familia fueron Trypoxylon spinosum (3.2%) (Crabronidae), Aporus notabilis notabilis (27%) (Pompilidae), Ammophila picipes (1.4%) (Sphecidae) y Polybia diguetana (15.6%) (Vespidae) (apéndice 1). Para la SMSC, en donde se recolectaron 119 individuos, las abundancias de cada familia fueron diferentes, Sphecidae no se registró en este tipo de vegetación, Crabronidae representó 29%, Pompilidae 31% y Vespidae 40%. Crabronidae, en SMSC, tuvo mayor presencia con Trypoxylon spinosum (6%), Pompilidae con Aporus notabilis notabilis (8%) y Vespidae con Polybia diguetana (29%) (fig. 2).
Las SBC fue más diversa (2.92) en relación con la SMSC (2.81), de acuerdo con los valores del índice de Shannon-Wiener y la prueba para ver diferencias entre diversidades (p < 0.5), mientras que la equidad fue relativamente alta (por encima de 0.7) en ambos tipos de vegetación (tabla 2). La similitud fue de 55% entre los 2 tipos de vegetación.
No hubo diferencias en la riqueza (p > 0.05) y en la abundancia (p > 0.05) entre las temporadas del año, pero en la composición de especies entre temporadas, la similitud fue de intermedia a baja (60% entre lluvias y nortes, 47% entre secas y nortes y entre secas y lluvias fue de 39%). Sin embargo destacan los meses con mayor riqueza de especies, agosto, septiembre, octubre y noviembre para la SBC (fig. 4a) y septiembre, octubre y noviembre para la SMSC (fig. 4b). La abundancia fue mayor en febrero, agosto, septiembre, octubre y noviembre para la SBC (fig. 4c) y en marzo, octubre y noviembre para la SMSC (fig. 4d). En el mes de diciembre se encontraron muy pocas especies e individuos en ambos tipos de selvas.
Discusión
En este estudio se identificaron 69 especies de avispas depredadoras, de las cuales 10 no habían sido registradas Yucatán (Vanoye et al., 2014, 2015), con ésto se tienen ahora 135 especies registradas para el estado. La selva baja caducifolia (SBC) presentó mayor riqueza en contraste con los estudios en las áreas naturales protegidas (ANP) de Yucatán, los cuales indicaron que las especies de avispas depredadoras de las familias estudiadas presentan una riqueza de especies similar entre estos tipos de vegetación (Vanoye et al., 2015). Sin embargo, el estimador de riqueza (Chao 1), basado en la abundancia (Colwell et al., 2004), fue bajo para ambas selvas (65 y 35%), indicando la necesidad realizar mayor esfuerzo de muestreo para obtener mejor representación de las especies en estos tipos de vegetación.
Los esfécidos no fueron encontrados en SMSC probablemente porque hay menor apertura del dosel, lo que puede afectar a las especies de esta familia en la búsqueda de presas y su anidación, de manera similar en las ANP de Yucatán hubo pocas especies con baja abundancia (Vanoye et al., 2015). En ambas selvas se presentaron muchas especies con 1 o 2 individuos, éstas se podrían considerar especies raras, ya que viven y se reproducen en las selvas pero están representadas por poblaciones con pocos individuos y su captura se torna más aleatoria que la de otras especies (Halffter y Moreno, 2005). Por su parte, Benavides y Florez (2006) y Silva y Coddington (1996) indican que un alto porcentaje de especies con un individuo encontrados en los diferentes trabajos realizados, se debe a que las selvas tropicales son altamente diversas y que por lo tanto las especies dominantes son pocas y son más comunes las especies raras. En este estudio, el registro de estas especies es bastante elevado en los diferentes tipos de vegetación, ya que en la SBC el porcentaje de especies raras fue de 42% y en la SMSC se presentó más de 50% de las especies con 1 solo individuo, estos valores se consideran elevados como en otros estudios con insectos que muestran valores arriba de 20% (Ávalos et al., 2013; Beltrán et al., 2005; Coddington et al., 1996; New, 1999; Sørensen et al., 2002).
Los resultados de este estudio indican que las familias de avispas cazadoras (Crabronidae, Pompilidae y Sphecidae) y depredadoras (Vespidae) son familias diversas con varias especies con baja abundancia, lo cual parece común en otras familias de avispas como Ichneumonidae y Braconidae con un elevado número de especies con pocos individuos (Bartlett et al., 1999), y aunque se trata de avispas parasitoides presentan la misma tendencia. Rodríguez (2006) ya había observado que en avispas existe mucha diversidad taxonómica con poca abundancia de individuos, y de acuerdo con Magurran (1988) este tipo de distribución está relacionado con insectos que habitan en áreas naturales más o menos equilibradas, o con perturbación moderada.
Las curvas rango-abundancia para cada tipo de vegetación mostraron algunas similitudes y diferencias con relación a las abundancias de la comunidad de avispas depredadoras (fig. 3). Las curvas rango-abundancia por familia, muestran a Aporus notabilis notabilis (Pompilidae) como especie dominante, esta especie ya había sido registrada para Yucatán (Vanoye et al., 2014, 2015), fue abundante a muy abundante en los 2 tipos de vegetación, y junto con Anoplius amethystinus se han considerado como especies abundantes en el ANP de Dzilam (Vanoye et al., 2015) e igualmente abundante en el centro y sur del estado de Tamaulipas (Horta et al., 2009); de la misma familia Aporinellus taeniatus taeniatus fue abundante en ambos tipos de vegetación y ha sido reportada para 15 estados del país (Vanoye et al., 2014).
La especie Polybia diguetana (Vespidae) fue muy abundante en ambos tipos de vegetación (≥ 70%), es una especie social (Sarmiento, 1994) que ha sido reportada incluso en cultivos agrícolas como muy abundante (Castañeda-Vildózola et al., 1999), en la vegetación de las ANP de Yucatán representó más del 90% de la abundancia (Vanoye et al., 2015), por lo que se considera una especie dominante. En la familia Crabronidae, Trypoxylon nitidum, Trypoxylon spinosum y el género Liris presentaron abundancias mayores a 30% en las selvas estudiadas, estos géneros se han registrado de abundantes a muy abundantes en los estados de Tamaulipas y Yucatán (Horta et al., 2007; Vanoye et al., 2015). Ammophila picipes, de la familia Sphecidae, presentó una abundancia de 25%. Esta especie ha sido registrada para el Tamaulipas como la especie más abundante y con mayor distribución (Horta et al., 2003, 2007), y aún falta corroborarla en otras zonas del país para saber si se trata de una especie de amplia distribución para selvas caducifolias, ya que se ha reportado en 14 estados de la República Mexicana (Vanoye et al., 2014).
Con relación a la diversidad de especies de avispas depredadoras en los diferentes tipos de vegetación, la SBC fue más diversa que la SMSC, pero como se ha mencionado se requiere más esfuerzo de muestreo. La similitud entre las selvas fue baja mostrando que la composición de especies es diferente en estos tipos de vegetación, lo cual es importante para la conservación de la biodiversidad ya que indica la protección de ambos ecosistemas. De manera general, la riqueza de especies y la abundancia no tuvieron diferencias entre temporadas, sin embargo, a través de los meses del año fue variable, alcanzando sus valores máximos en los meses de lluvias. Es conocido que la mayor precipitación favorece la abundancia y riqueza de avispas depredadoras al incrementarse los recursos utilizados en su dieta pedotrófica y alimenticia (Horta et al., 2007, 2009; Rodríguez-Parilli y De Almeida, 2010; Rodríguez-Vélez et al., 2011), el alto número de individuos y especies en los meses de lluvias puede deberse también a que es la época de reproducción de la mayoría de las especies de insectos (Nogueira et al., 2006). La baja similitud en la composición de especies entre épocas indica alto recambio de especies por lo que no todas las especies están en la misma época del año.
A la fecha, hacen falta estudios ecológicos y sobre la riqueza y abundancia de himenópteros aculeados en selvas con vegetación secundaria (Abadía et al., 2010; Candia y Máyida, 2005; Comas et al., 2009).
Agradecimientos
Se agradece al Consejo Nacional de Ciencia y Tecnología por la beca de doctorado concedida a Maximiliano Vanoye-Eligio y por el financiamiento del proyecto Conacyt-Semarnat (2004-C01-180/A-1) otorgado a Virginia Meléndez Ramírez. Asimismo, agradecemos muy especialmente a los dos revisores anónimos por sus valiosos comentarios y sugerencias.
Apéndice 1. Especies de avispas depredadoras en 2 tipos de vegetación. √ = Presente, — = ausente. SBC = Selva baja caducifolia y SMSC = selva mediana subcaducifolia. * = Nuevo registro para Yucatán.
|
Apéndice 1. Continuación. |
|||
|
Familias/Especies |
SBC |
SMSC |
Abundancia |
|
Familias/Especies |
SBC |
SMSC |
Abundancia |
|
Crabronidae |
|||
|
Aphilanthops subfrigidus Dunning* |
√ |
— |
1 |
|
Bembicinus sp. 1 |
√ |
— |
1 |
|
Foxia cuna Pate, 1938* |
√ |
— |
1 |
|
Idionysson sp. 1 |
√ |
— |
14 |
|
Liris apicipennis (Cameron) |
√ |
— |
1 |
|
Liris mexicanus Krombein y Shanks Gingras, 1984 |
√ |
√ |
8 |
|
Liris sp. 3 |
√ |
— |
4 |
|
Liris sp. 4 |
√ |
√ |
6 |
|
Liris sp. 5 |
√ |
√ |
11 |
|
Liris sp. 6 |
√ |
√ |
13 |
|
Liris vincenti Krombein y Shanks Gingras, 1984 |
— |
√ |
2 |
|
Mellinus alpestris Cameron, 1890* |
√ |
— |
2 |
|
Microstigmus sp. 1 |
√ |
√ |
12 |
|
Microstigmus xanthosceles Melo y Matthews, 1997* |
√ |
— |
1 |
|
Passaloecus sp. 1 |
√ |
— |
1 |
|
Pisonopsis sp. 1* |
√ |
— |
1 |
|
Pisoxylon sp. 1 |
— |
√ |
5 |
|
Pryonyx thomae Fabricius 1775 |
√ |
— |
1 |
|
Psenulus mayorum Bohart y Grissell, 1969* |
√ |
— |
13 |
|
Tachysphex antennatus W. Fox, 1894* |
√ |
— |
2 |
|
Trypoxylon albitarse Fabricius, 1804 |
√ |
√ |
2 |
|
Trypoxylon marginatum Cameron, 1912 |
√ |
√ |
4 |
|
Trypoxylon nitidum Smith, 1856 |
√ |
√ |
7 |
|
Trypoxylon rufidens Cameron, 1905a |
√ |
√ |
8 |
|
Trypoxylon scutatum Cheverier, 1876 |
√ |
√ |
5 |
|
Trypoxylon spinosum Cameron |
√ |
√ |
35 |
|
Abundancia |
127 |
34 |
161 |
|
Riqueza |
24 |
13 |
|
|
Pompilidae |
|||
|
Ageniella isolata Banks |
√ |
√ |
8 |
|
Allaporus pulchellus Banks, 1910 |
√ |
— |
9 |
|
Allaporus sp. 1 |
√ |
— |
1 |
|
Allaporus sp. 2 |
√ |
√ |
5 |
|
Allaporus sp. 3 |
√ |
— |
7 |
|
Anoplius americanus Beauvois, 1811 |
√ |
√ |
25 |
|
Anoplius amethystinus Dahlbom, 1834 |
√ |
√ |
19 |
|
Anoplius sp. 1 |
√ |
√ |
59 |
|
Anoplius sp. 2 |
√ |
√ |
27 |
|
Aporinellus taeniatus (Kohl, 1886) |
√ |
— |
1 |
|
Aporinellus taeniatus taeniatus Kohl |
√ |
√ |
72 |
|
Aporinellus yucatanensis (Cameron, 1893) |
√ |
— |
5 |
|
Aporus notabilis notabilis Smith, 1860 |
√ |
√ |
213 |
|
Aporus sp. 4 |
√ |
√ |
9 |
|
Ceropales sp. 1 |
√ |
— |
6 |
|
Notocyphus violaceipenis Cresson, 1872 |
— |
√ |
1 |
|
Psorthosphis sp. 1 |
— |
√ |
1 |
|
Psorthosphis sp. 2 |
√ |
√ |
2 |
|
Abundancia |
433 |
37 |
470 |
|
Riqueza |
16 |
12 |
|
|
Sphecidae |
|||
|
Ammophila picipes Cameron, 1888 |
√ |
— |
11 |
|
Ammophila gaumeri Cameron, 1888 |
√ |
— |
5 |
|
Ammophila procera (Dahlbom)* |
√ |
— |
3 |
|
Ammophila sp. 1 |
√ |
— |
4 |
|
Chalybion californicum (Saussure)* |
√ |
— |
9 |
|
Isodontia mexicana (Saussure, 1867) |
√ |
— |
7 |
|
Pryonyx kirbii (Van der Linden, 1827) |
√ |
— |
1 |
|
Podium luctuosum Smith, 1856 |
√ |
— |
1 |
|
Trachyphus mexicanus (Cameron, 1891) |
√ |
— |
1 |
|
Sphex ichneumoneus (Linnaeus)* |
√ |
— |
1 |
|
Abundancia |
43 |
0 |
43 |
|
Riqueza |
10 |
0 |
|
|
Vespidae |
|||
|
Anastraceroides sp. 1 |
√ |
— |
1 |
|
Brachygastra mellifica (Say, 1837) |
√ |
√ |
13 |
|
Leptochilus mixtecus Parker, 1966 |
√ |
— |
3 |
|
Leptochilus sp. 1 |
√ |
— |
7 |
|
Leptochilus sp. 2 |
√ |
√ |
2 |
|
Leptochilus sp. 3 |
√ |
— |
2 |
|
Omicron reguloide Giordani Soika, 1978 |
√ |
√ |
3 |
|
Pachodynerus nasidens (Latreille, 1817) |
√ |
— |
3 |
|
Pachodynerus quadrisectus (Say, 1837) |
— |
√ |
3 |
|
Polistes instabilis Saussure, 1853 |
— |
√ |
3 |
|
Polistes major Beauvois, 1818 |
√ |
— |
2 |
|
Polistes stabilinus Richards, 1978 |
√ |
√ |
3 |
|
Polybia diguetana Buysson, 1905 |
√ |
√ |
153 |
|
Zethus miscogaster Saussure, 1852 |
√ |
√ |
5 |
|
Abundancia |
155 |
48 |
203 |
|
Riqueza |
11 |
8 |
|
|
Total/Abundancia |
758 |
119 |
877 |
|
Total/Riqueza |
63 |
33 |
69 |
Referencias
Abadía, J. C., Bermúdez, C., Lozano-Zambrano, F. H., y Chacón, P. (2010). Hormigas cazadoras en un paisaje subandino de Colombia: riqueza, composición y especies indicadoras. Revista Colombiana de Entomología, 36, 127–134.
Ábrego, J. C. y Murgas, A. S. (2018). Nuevo registro de Viadana (Arcuadana) zetterstedti (Stal, 1861) (Orthoptera: Tettigonidae) como hospedero de la avispa excavadora dorada Sphex ichneumoneus (Linnaeus, 1758) (Hymenoptera: Sphecidae) de Panamá. Centros: Revista Científica Universitaria, 7, 106–109.
Ávalos, G., Bar, M. E., Oscherov, E. B. y González, A. (2013). Diversidad de Araneae en cultivos de Citrus sinensis (Rutaceae) de la Provincia de Corrientes, Argentina. Revista de Biología Tropical, 61, 1243–1260. https://doi.org/10.15517/rbt.v61i3.11938
Ayala, R. y Meléndez, R. V. (2017). Vespidae. En T.V. Cibrián (Ed.), Fundamentos de entomología forestal (pp. 289–293). Chapingo, Estado de México: Universidad Autónoma de Chapingo.
Bartlett, R., Pickeringgauld, J., Gauld, I. y Windsor, D. (1999). Estimating global biodiversity, tropical beetles and wasps send different signals. Ecological Entomology, 24, 118–121. https://doi.org/10.1046/j.1365-2311.1999.00177.x
Beltrán, A., Juan, P., Álvarez, D. y Flórez, D. (2005). Diversidad de arañas (Arachnida: Araneae) en el Parque Nacional Natural isla Gorgona, Pacífico colombiano. Biota Neotropica, 5, 99–110. https://doi.org/10.1590/s1676-06032005000200009
Benavides, L. y Florez, E. (2006). Comunidades de arañas (Arachnida: Araneae) em microhábitats de dosel em bosques de tierra firme e igapó de La Amazônia colombiana. Revista Ibérica de Aracnología, 14, 49–62.
Bohart, R. M. y Menke, A. S. (1976). Sphecid wasps of the world: a generic revision. Oakland: Universidad de California Press. https://doi.org/10.1086/409786.
Buck, M., Marshall, S. A. y Cheung, D. K. (2008). Identification Atlas of the Vespidae (Hymenoptera, Aculeata) of the northeastern Nearctic region. Canadian journal of arthropod identification, 5, 1–492. https://doi.org/10.3752/cjai.2008.05
Butchart, S. H., Akcakaya, H. R., Kennedy, E. y Hilton-Taylor, C. (2006). Biodiversity indicators based on trends in conservation status: strengths of the IUCN Red List Index. Conservation Biology, 20, 579–581. https://doi.org/10.1111/j.1523-1739.2006.00410.x
Candia, R. y Máyida, S. (2005). Efecto de borde de dos tipos de matriz sobre la estructura comunitaria de himenópteros aculeados en fragmentos de Bosque Seco Tropical en época de sequía. Entomotropica, 20, 127–204.
Carignan, V. y Villard, M. A. (2002). Selecting indicator species to monitor ecological integrity: a review. Environmental Monitoring and Assessment, 78, 45–61. https://doi.org/10.1023/a:1016136723584
Carnevali, G., Ramírez, I. M. y González-Iturbe, J. A. (2003). Flora y vegetación de la península de Yucatán. En M. P. Colunga-García y A. Larqué-Saavedra (Eds.), Naturaleza y sociedad en el área maya. Pasado, presente y futuro (pp. 53–68). Mérida: CICY.
Carpenter, J. M. y Garcete-Barrett, B. R. (2002). A key to the Neotropical genera of Eumeninae (Hymenoptera: Vespidae). Boletín del Museo Nacional de Historia Natural del Paraguay, 14, 52–73.
Castañeda-Vildózola, A., Equihua-Martínez, A., Valdés-Carrasco, A., Barrientos-Priego, A. F., Ish-Am, G. y Grazit, S. (1999). Insectos polinizadores del aguacatero en los estados de México y Michoacán. Revista Chapingo Serie Horticultura, 5, 129–136.
Coddington, J. A., Young, L. H. y Coyle, F. A. (1996). Estimating spider species richness in a southern Appalachian cove hardwood forest. Journal of Arachnology, 24, 111–128.
Colwell, R. K., Mao, C. X. y Chang, J. (2004). Interpolating, extrapolating, and comparing incidence-based species accumulation curves. Ecology, 85, 2717–2727. https://doi.org/10.1890/03-0557
Comas, L. B., Viadiu, X. A., Graciamoya, M., Retana, J. A. y Bosch, J. G. (2009). Relación entre el grado de madurez del bosque y las comunidades de himenópteros voladores y micromamíferos en el Parque Nacional De Aigüestortes Estany De Sant Maurici. Proyectos de investigación en Parques Nacionales: 2006-2009. Barcelona, España:
Corro, C. P. y Cambra, T. R. A. (2011). Clave genérica para la Pepsinae (Hymenoptera: Pompilidae) de Panamá. Scientia, 21, 33–46.
Dzib-Castillo, B., Chanatásig-Vaca, C. y González-Valdivia, N. A. (2014). Estructura y composición en dos comunidades arbóreas de la selva baja caducifolia y mediana subcaducifolia en Campeche, México. Revista Mexicana de Biodiversidad, 85, 167–178. https://doi.org/10.7550/rmb.38706
Espadas-Manrique, C. M. (2004). Estudio fitogeográfico de las especies endémicas de la Península de Yucatán (Tesis de doctorado). Centro de Investigación Científica de Yucatán, Mérida. Yuc.
Evans, H. E. (1966). A revision of the Mexican and Central American spider wasps of subfamily Pompilinae (Hymenoptera: Pompilidae). Memoirs of the American Entomological Society 20. Philadelphia: Academy of Natural Sciences.
Feisinger, P. (2001). Designing field studies for Biodiversity Conservation. Washington D.C.: Island Press.
Fernández, G. S. y Pujade, V. J. (2015). Orden Hymenoptera. Sociedad Entomológica Aragonesa. Revista IDE@ – SEA, 59, 1–36.
Flores, J. S. y Espejel, C. (1993). Tipos de vegetación de la Península de Yucatán. Etnoflora Yucatanense. Fascículo 3. Mérida: UADY-Sostenibilidad Maya.
Gauld, I. D. y Bolton, B. (Eds.). (1988). The Hymenoptera. Oxford: Oxford Univ. Press. https://doi.org/10.1163/187631289×00410
González-Oreja, J. A., De la Fuente-Díaz Ordaz, A. A., Hernández-Santín, L., Buzo-Franco, D. y Bonache-Regidor, C. (2010). Evaluación de estimadores no paramétricos de la riqueza de especies. Un ejemplo con aves en áreas verdes de la ciudad de Puebla, México. Animal Biodiversity and Conservation, 33, 31–45.
González-Oreja, J. A., Gayubo, S. F., Asís, J. D., Tormos, J. y García, C. (2003). Estructura y dinámica temporal de la comunidad de avispas Esfeciformes (hymenoptera: Apoidea: Ampulicidae, Sphecidae y Crabronidae) en un pastizal de la Cuenca Alta del Duero (España). Boletín de la SEA, 32, 59–65.
Halffter G. y Moreno, C. E. (2005). Significado biológico de las diversidades alfa, beta y gamma. En G. Halffter, J. Soberón, P. Koleff y A. Melic (Eds.), Sobre diversidad biológica: el significado de las diversidades alfa, beta y gamma. m3m-Monografías Tercer Milenio, Zaragoza.
Hammer, Ø. Harper, D. A. T. y P. D. Ryan (2001). PAST: paleontological statistics software package for education and data analysis. Palaeontologia Electronica, 4, 1–9.
Horta, V. J. V., García, G. M. E., Benavides, M. M. I. y Correa, S. A. (2009). Pompilidae (Hymenoptera) de algunos Municipios del Centro y Sur de Tamaulipas, México. Acta Zoológica Mexicana (n.s.) 25, 71–82. https://doi.org/10.21829/azm.2009.251592
Horta, V. J. V., Pinson, D. O. N., Barriento, L. L. y Correa, S. A. (2007). Sphecidae y Crabronidae (Hymenoptera) de algunos municipios del centro y sur de Tamaulipas. Acta Zoológica Mexicana (ns), 23, 35–48. https://doi.org/10.21829/azm.2007.233584
Horta, V. J. V., Vanoye, E. M., Pinzón, D. O. N. y Ruíz, C. E. (2003). Géneros de Sphecoidea (Hymenoptera) del Centro de Tamaulipas, México. Biotam (n.s.), 14, 47–62.
INEGI (Instituto Nacional de Estadística y Geografía). (2017). Anuario estadístico y geográfico de Yucatán, Gobierno del estado de Yucatán, México. Ciudad de México: INEGI.
Krebs, C. J. (1989). Ecological methodology. New York: Harper & Row.
La Salle, J. y Gauld, I. D. (Eds.). (1993). Hymenoptera and biodiversity. Wallingford, RU: CABI Publishing.
López-Gómez, A. M. y Williams-Linera, G. (2006). Evaluación de métodos no paramétricos para la estimación de la riqueza de especies de plantas leñosas en cafetales. Boletín de la Sociedad Botánica de México, 78, 7–15. https://doi.org/10.17129/botsci.1717
Magurran A. E. (1988). Ecological diversity and its measurement. New Jersey: Princeton University Press. https://doi.org/10.1007/978-94-015-7358-0_1
New, T. R. (1999). Untangling the web: spiders and the challenges of invertebrate conservation. Journal of Insect Conservation, 3, 251–256. https://doi.org/10.1023/a:1009697104759
Nogueira, A. A., Pinto-da Rocha, R. y Brescovit, A. D. (2006). Comunidade de aranhas orbitelas (Arachnida-Araneae) na regiao da Reserva Florestal do Morro Grande, Cotia, Sao Paulo, Brasil. Biota Neotropica, 6, 1–24. https://doi.org/10.1590/s1676-06032006000200010
Noyes, J. S. (1989). The diversity of Hymenoptera in the tropics, with special reference to Parasitica in Sulawesi. Ecological Entomology, 14, 197–207. https://doi.org/10.1111/j.1365-2311.1989.tb00770.x
Nuez, A. D. L., González, J. A., Gayubo, S. F. y Torres, F. (2003). Abundancia y diversidad de avispas sociales (Hymenoptera: Vespidae) en el Parque Natural de Arribes del Duero (oeste español). Boletín de la SEA, 32, 87–93.
O`Neill, K. M. (2001). Solitary wasps: Behavior and Natural History. Ithaca: Cornell University Press. https://doi.org/10.1086/374476
Orellana, R., Islebe, G. y Espadas, C. (2003). Presente, pasado y futuro de los climas de la Península de Yucatán. En P. Colunga-García Marín y A. Larqué-Saavedra (Eds.), Naturaleza y sociedad del área maya. Pasado presente y futuro. Mérida: Academia Mexicana de Ciencias y Centro de Investigación Científica de Yucatán.
Pennington, T. D. y Sarukhán, J. (2005). Árboles tropicales de México. Manual para la Identificación de las principales especies. México D.F.: UNAM/ Fondo de Cultura Económica.
Pisces Conservation, L. T. D. (2004). Community analysis package version 3.0. A program to search for structure in ecological community data. England.
Rodríguez, A. (2006). Estudio de la Fauna de Ichneumonidae cenobionte (Hymenoptera) como potenciales bioindicadores de diversidad en ecosistemas de montaña mediterráneas (Tesis doctoral). Universidad de Alicante, Alicante, España.
Rodríguez-Parilli, S. y de Almeida, M. C. (2010). Comunidad de abejas (Apoidea, Anthophila) atraídas por fragancias en un bosque seco tropical de los llanos centrales del Estado Guárico (Venezuela). Acta Biológica Paranaense, 39, 97–107. https://doi.org/10.5380/abpr.v39i0.20257
Rodríguez, J., Von Dohlen, C. D. y Pitts, J. P. (2010). The genus Psorthaspis (Hymenoptera: Pompilidae) in Colombia. Caldasia, 32, 435–441.
Rodríguez-Vélez, B., Zaragoza-Caballero, S., Noguera, F. A., González-Soriano, E., Ramírez-García, E., Rodríguez-Palafox, A. et al. (2011). Diversidad de avispas parasitoides de la familia Encyrtidae (Hymenoptera: Chalcidoidea) del bosque tropical caducifolio en San Buenaventura, Jalisco, México. Revista Mexicana de Biodiversidad, 82, 836–843.
https://doi.org/10.22201/ib.20078706e.2011.3.696.
Ruíz-Cancino, E., Kasparyan, D. R., Coronado-Blanco, J. M., Myartseva, S. N., Trjapitzin, V. A., Hernández-Aguilar, S. G. et al. (2010). Himenópteros de la reserva “El Cielo”, Tamaulipas, México. Dugesiana, 17, 53–71.
Sarmiento, C. E. (1994). Lista de las avispas sociales (Hymenoptera: Vespidae) de Colombia. Revista de Biología Tropical, 42, 357–363.
Sharkey, M. J. (2006). Introducción a los Hymenoptera de la Región Neotropical (No. Doc. 22389) CO-BAC, Bogotá). F. Fernández (Ed.). Univ. Nacional de Colombia.
Silva, D. y Coddington, J. A. (1996). Spiders of Pakitza (Madre de Dios, Perú): species richness and notes on community structure. En D. E. Wilson y A. Sandoval (Eds.), The biodiversity of Southeastern Perú (pp. 253–311). Washington D.C.: El Instituto Smithsoniano. https://doi.org/10.1017/s0266467498260391
Solow, R. (1993). An almost practical step toward sustainability. Resources Policy, 19, 162–172. https://doi.org/10.1016/0301-4207(93)90001-4
Sørensen, L. L., Coddington, J. A. y Scharff, N. (2002). Inventorying and estimating subcanopy spider diversity using semiquantitative sampling methods in an Afromontane forest. Environ Entomology, 31, 319–330. https://doi.org/10.1603/0046-225x-31.2.319
Toti, D. S., Coyle, F. A. y Miller, J. A. (2000). A structured inventory of Appalachian grass bald and heath bald spider assemblages and a test of species richness estimator performance. Journal of. Arachnology, 28, 329–345. https://doi.org/10.1636/0161-8202(2000)028[0329:asioag]2.0.co;2
Vanoye-Eligio, M., Meléndez-Ramírez, V., Ayala, R., Navarro-Alberto, J. y Delfín-González, H. (2015). Avispas depredadoras de áreas naturales protegidas del estado de Yucatán, México. Revista Mexicana de Biodiversidad, 86, 989–997. https://doi.org/10.1016/j.rmb.2015.04.037
Vanoye-Eligio, M., Ramírez, V. M., Ayala, R., Navarro, J. y Delfin-González, H. (2014). Predatory Wasps (Hymenoptera) of the Yucatan Peninsula. Southwestern Entomologist, 39, 635–646. https://doi.org/10.3958/059.039.0322
Wenzel, J. W. (1998). A generic key to the nests of hornets, yellowjackets, and paper wasps worldwide (Vespidae, Vespinae, Polistinae). American Museum Novitates, 3224, 1–39.



