José Armando Carrillo-Birkhahn a, Yassir Edén Torres-Rojas a, *, Sergio Aguíñiga-García b y Alberto Sánchez-González b
a Universidad Autónoma de Campeche, Instituto de Ecología, Pesquerías Oceanografía del Golfo de México, Av. Héroes de Nacozari Núm. 480, 24079 Campeche, Campeche, México
b Instituto Politécnico Nacional, Centro Interdisciplinario de Ciencias Marinas, Av. Instituto Politécnico Nacional s/n, 23096 La Paz, Baja California Sur, México
*Autor para correspondencia: yetorres@uacam.mx (Y.E. Torres-Rojas)
Recibido: 7 octubre 2021; aceptado: 15 agosto 2022
Resumen
Con la finalidad de estudiar las variaciones ambientales a nivel espacio-temporal en lagunas costeras tropicales y su impacto en fauna residente, se analizó la composición isotópica (δ18O y δ13C) de 70 otolitos (1 por par) pertenecientes al pez Bairdiella chrysoura, considerada especie residente del Área de Protección de Flora y Fauna Laguna de Términos (APFFLT). Se realizaron muestreos mensuales (septiembre de 2016 a agosto de 2017) en 17 estaciones del APFFLT, donde se obtuvieron los ejemplares a los cuales se les analizó el otolito “sagitta” mediante “GasBench” acoplado a un espectrómetro de masas de razones isotópicas. Se encontraron diferencias significativas en δ18O a nivel temporal, lo que sugiere que los otolitos responden a cambios ambientales, asociados a fluctuaciones de temperatura y salinidad relacionadas a la zona (bajo traslape entre temporadas en δ13C). Las ecuaciones de paleotemperatura mostraron un mejor ajuste con cambios de salinidad, lo que demuestra la influencia de la variable en lagunas costeras tropicales. En conclusión, el δ18O y δ13C mostraron que B. chrysoura registra cambios ambientales que se presentan en el APFFLT; sin embargo, se recomienda desarrollar ecuaciones paleoclimáticas para lagunas costeras tropicales para proyectar escenarios climáticos regionales.
Palabras clave: Isótopos estables; Laguna de Términos; Bioindicadores; Peces; Cambio climático
© 2023 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Environmental changes in a tropical coastal lagoon: a δ18O and δ13C approach in a resident species
Abstract
To study the environmental variations at the spatio-temporal level in tropical coastal lagoons and their impact on resident fauna, the isotopic composition (δ18O and δ13C) of 70 otoliths (1 per pair) of the fish Bairdiella chrysoura were analyzed. This fish species is considered as resident of the Laguna de Términos Flora and Fauna Protection Area (APFFLT). Monthly samplings were carried out (September 2016 to August 2017) at 17 APFFLT stations, where the specimens were obtained and the “sagitta” otolith was analyzed using GasBench coupled to an isotopic ratios mass spectrometer. Significant differences were found in δ18O at the temporal level, suggesting that the otoliths respond to environmental changes, associated with fluctuations in temperature and salinity related with the zone (low overlap between seasons in δ13C). Paleo-temperature equations showed a better fit with salinity changes, demonstrating the influence of this variable in tropical coastal lagoons. In conclusion, the δ18O and δ13C showed that B. chrysoura registers environmental changes present in the APFFLT, however, it is suggested to develop paleo-climatic equations for tropical coastal lagoons to project regional climate scenarios.
Keywords: Stable isotopes; Términos Lagoon; Bioindicators; Fishes; Climate change
© 2023 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
Las lagunas costeras son cuerpos de agua que cubren aproximadamente 13% de línea de costa alrededor del mundo (Kjerfve, 1986, 1994), altamente productivas, dinámicas y con una importancia ecológica debido a los servicios ecosistémicos que brindan (Ramos-Miranda et al., 2006). En México, la laguna de Términos es considerada la laguna costera tropical más grande del país con una alta diversidad de flora y fauna por lo que ha sido catalogada como área de protección (Torres-Rojas et al., 2017). Sin embargo, estudios recientes registran en los últimos 30 años un decremento en su biodiversidad y abundancia (Dorantes-Hernández et al., 2020).
El decremento de biodiversidad en la laguna de Términos se ha asociado con cambios ambientales (Dorante-Hernández et al., 2020). Por ejemplo, Fichez et al. (2016) reportan un decremento significativo en la humedad de la laguna con el pasar de los años hasta el registro de sequías en 2016, asociado a impactos de los sistemas deltaicos (Atasta y Palizada), considerados como cruciales en la región (Villalobos-Zapata, 2015), los cuales han presentado impactos antrópicos (i.e, cambios de uso de suelo y contaminación urbana), así como por una alta actividad industrial y portuaria, lo que ha generado altas variaciones en temperatura y salinidad (Irola-Sansores et al., 2021; Santos-Santoyo et al., 2021).
Ante la presencia de cambios ambientales, existen bioindicadores como los peces, que pueden ser una gran herramienta que permita detectar y cuantificar alteraciones negativas o positivas en ecosistemas acuáticos. En el caso de los peces, los otolitos son utilizados como una estructura indicadora, ya que registran información acerca de la interacción organismo-ambiente (Volpedo y Vaz-dos-Santos, 2015). Estudios previos han demostrado que los otolitos son estructuras calcáreas, compuestas de carbonato de calcio en 96% y solo 3.1% de matriz orgánica, que durante su formación, el carbonato de calcio es asimilado del ambiente a partir del proceso denominado biomineralización (Campana, 1999).
Debido a estas características, los otolitos han sido catalogados como estructuras metabólicamente inertes que están en equilibrio isotópico con las condiciones ambientales (Volpedo y Vaz-dos-Santos, 2015). Diferentes autores han reportado que el δ18O depositado en los otolitos registra la señal isotópica del agua donde los organismos residen y presenta valores isotópicos enriquecidos a temperaturas bajas, mientras que en temperaturas cálidas refleja señales empobrecidas (Peterson y Fry, 1987; Trasviña-Carrillo et al., 2018). Kerr et al. (2007) reportaron que el δ13C de los otolitos refleja los cambios de salinidad (93% – 100% de precisión) debido a que la mayor parte del carbono incorporado al otolito proviene del carbono inorgánico disuelto (65% a 80%), y en menor proporción, derivado de un origen metabólico (20% a 35%).
Un ejemplo de lo anterior es el estudio realizado por Romo-Curiel et al. (2016), quienes, a partir de isótopos, estimaron temperaturas retro calculadas durante la formación de anillos de crecimiento estacional de Atractoscion nobilis registrando que las temperaturas más altas coincidieron con la precipitación estival de aragonita y las temperaturas más bajas corresponden a los anillos de invierno; por tanto, los otolitos pueden ser usados para generar ecuaciones paleoclimáticas basadas en temperatura y salinidad, que ayudarían entender las condiciones en las que un organismos vive y se desarrolla (Rowell et al., 2008).
La aplicación de δ18O y δ13C en otolitos de especies representativas en ecosistemas costeros, como las lagunas tropicales (en particular la laguna de Términos), permitiría explorar los cambios ambientales que se están registrando en años recientes, además de poder analizar cómo los organismos residentes están siendo impactados. Si bien la laguna de Términos cuenta con un programa de manejo para áreas naturales protegidas (Carabias-Lillo et al., 1997), para el estudio o caracterización de la salud del ecosistema, que considera diversas variables como la temperatura, salinidad, pH y el oxígeno, éstos son registrados in situ, por lo que existe un vacío en cómo se puede estudiar la salud del ecosistema usando especies indicadoras residentes que reflejen los cambios ambientales.
Una especie indicadora potencial es el pez Bairdiella chrysoura, dado que es considerada como representativa, asociada con los sistemas deltaicos en la laguna de Términos durante la mayor parte de su ciclo de vida y ha sido reportada en la mayoría de las zonas (Chavance et al., 1984; Irola-Sansores et al., 2021; Ramos-Miranda et al., 2006). El presente estudio tiene como objetivo comparar la composición isotópica (δ18O y δ13C) presente en otolitos de B. chrysoura a nivel espacio-temporal, con el fin de analizar (a partir de ecuaciones paleoclimáticas previamente desarrolladas) los cambios ambientales de la laguna de Términos durante el período 2016-2017, y los posibles escenarios de mitigación y adaptación que presentaría la fauna de seguir registrando cambios ambientales de mayor intensidad.
Materiales y métodos
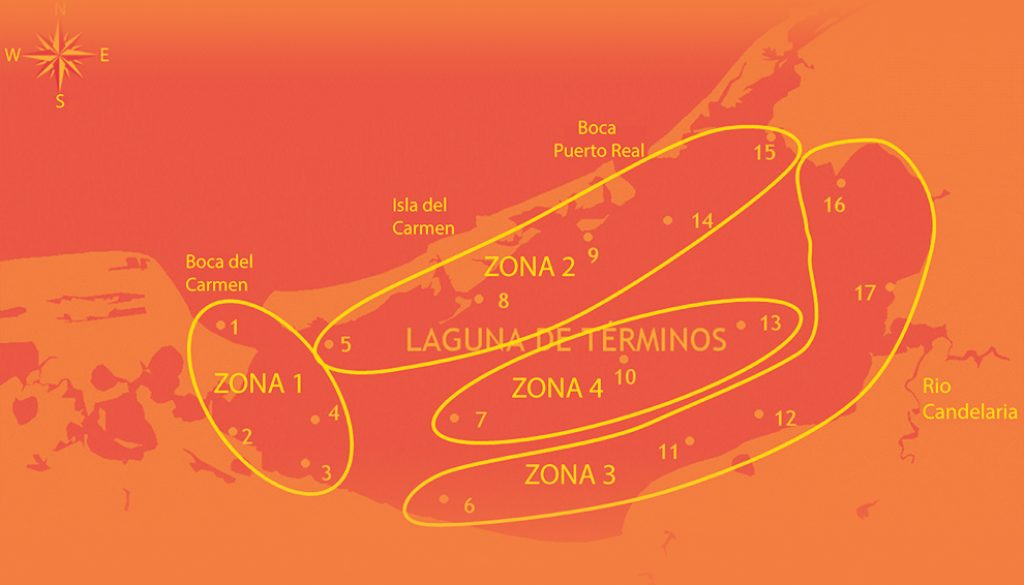
El APFFLT se ubica en el sur del golfo de México, en la cual descargan 3 ríos (Palizada, Chumpán y Candelaria) con flujos variables a través del año y cuenta con 2 bocas que permiten una dinámica de agua marina y salobre (Ramos-Miranda et al., 2006). A nivel temporal, recibe la influencia de 3 temporadas climáticas: secas (febrero a mayo), lluvias (junio a septiembre) y nortes (octubre a enero). A nivel espacial, la laguna de Términos está dividida en 4 zonas con 17 sitios de muestro (fig. 1). La zona 1 incluye la boca del Carmen, Punta Zacatal, la boca del sistema Atasta y la boca Chica; en esta área, el agua marina proveniente de la boca del Carmen y el agua dulce de los sistemas deltaicos se mezclan. La zona 2 incluye la boca de Puerto Real, Punta Gorda y la mayoría de la costa de la isla del Carmen, en esta área la influencia del agua de mar prevalece. La zona 3 incluye las bocas de los ríos Palizada, Chumpán y Candelaria; el agua dulce tiene mayor influencia en esta área debido a los aportes de estos ríos. La zona 4 incluye la parte central de la laguna de Términos, por lo que actúa como una zona de mezcla entre el agua dulce y salada (Santos-Santoyo et al., 2021).
Se realizaron muestreos mensuales —septiembre de 2016 a agosto de 2017— a bordo de una embarcación (21 pies de eslora), y con la ayuda de un GPS, se localizó cada uno de los 17 sitios de muestreo establecidos por Ramos-Miranda et al. (2006). En cada sitio se registraron temperatura y salinidad del agua mediante una sonda multiparamétrica (YSI, Pro20), para posteriormente realizar la recolecta de los organismos de B. chrysoura, por arrastres con una red tipo camaronera, donde cada uno tuvo una duración de 12 min a una velocidad de 2.5 nudos. Después de cada arrastre, todos los organismos recolectados fueron etiquetados, almacenados y trasladados al laboratorio de Ecología Trófica, en el Instituto EPOMEX de la Universidad Autónoma de Campeche.
En laboratorio, B. chrysoura fue identificada (Carpenter, 2002), se registraron sus datos biométricos (longitud total “LT”, peso total “PT”) y se extrajo el par de los otolitos “sagitta”. Posterior a la extracción y con el fin de eliminar los restos de tejido y sangre, los otolitos fueron limpiados en un baño ultrasónico digital (Branson 1800), en 3 ciclos de 10 min cada uno y fueron secados a 60 °C en un horno de convección natural (Thermo Scientific) por 12 h, para finalmente, ser pesados (g) y almacenados en viales Eppendorf.
Para el análisis isotópico, de los 242 pares de otolitos extraídos, se seleccionaron 70 otolitos pertenecientes a organismos con tallas mayores de 10 cm (organismos adultos residentes); a cada par de otolito se le extrajo una muestra de 200 a 300 µg de carbonatos usando un microtaladro de alta precisión (Merchantek Micromil) con una broca de 1 mm, perforando la parte más externa de cada uno, esta muestra se almacenó en viales Exentainer. Posteriormente, cada vial Exentainer fue purgado con gas helio para desplazar el gas atmosférico y se le agregó ácido fosfórico, el cual se dejó reaccionar con la muestra de otolito (carbonato de calcio) por 12 h a 72 °C liberando CO2 en el proceso. Finalmente, los valores de δ18O y δ13C de las muestras carbonatadas de otolitos se cuantificaron utilizando un analizador GasBench de flujo continuo (Thermo Scientific) acoplado a un espectrómetro de masas de razones isotópicas (Thermo Scientific Delta V Plus) en el LESMA-CICIMAR-IPN, mediante un estándar NBS-19 (n = 4) y con una precisión analítica < 0.4‰.
Los valores obtenidos de δ18O y δ13C fueron calculados con la ecuación de Park y Epstein (1961):
δ18O o δ13C = [(R muestra/R estándar) -1] [(1000)]
R muestra = 18O/16O o 13C/12C
R estándar = 18O/16O o 13C/12C
Para demostrar que el valor de δ18OA de los otolitos de B. chrysoura es independiente de la fisiología del organismo, de parámetros como la longitud total y el estado nutricional (peso total), se realizaron análisis de correlación (coeficiente de Pearson) entre los valores de δ18OA y los valores de la longitud total (LT), el peso total (PT) y el peso del otolito (PO). Para evaluar la distribución espacial entre la zona de muestreo y la temporada climática, se determinó la amplitud y traslape del nicho isotópico (δ18O vs. δ13C) mediante el paquete SIBER (Stable Isotopic Bayesian Ellipses in R) del programa R (versión 4.0.2) propuesto por Jackson et al. (2011). Para corroborar la significancia del traslape de δ18O y δ13C, así como de los valores de temperatura y salinidad registradas in situ, las muestras fueron organizadas por sitio de muestreo y zonas (1, 2, 3, 4; fig. 1). Mientras que estacionalmente fueron organizadas por temporada climática: secas, lluvias y nortes. En ambos casos (δ18O y valores registrados in situ), se les aplicó una prueba paramétrica (Anova 1 vía) para determinar si existían diferencias significativas a nivel espacio temporal.
Una vez determinada las condiciones in situ, se calculó la composición isotópica del oxígeno en la aragonita en equilibrio con el agua de mar, usando la ecuación propuesta por Bemis et al. (2000).
T = C1 – C2 * (δ18OA – δ18OW)
donde T = temperatura estimada de mar expresada en °C, C = son las constantes de calcificación en foraminíferos de acuerdo con la temperatura y salinidad, C1 = 14.9 y C2 = 4.8, δ18OA = valor isotópico del aragonito (otolito), δ18OW = valor isotópico del agua de mar.
El valor del δ18Ow fue calculado usando la ecuación propuesta por Surge et al. (2005) para regiones tropicales:
δ18Ow = C1 * (S) – C2
donde, δ18Ow = al valor isotópico del agua de mar, S = el valor de la salinidad del agua de mar, C1 = 0.13 y C2 = -2.7.
Resultados
La talla promedio de los 70 organismos de B. chrysoura seleccionados fue de 13.62 ± 1.78 cm (DE). Se detectaron diferencias significativas entre las tallas a nivel espacial (p < 0.05), encontrando tallas promedio máximas en la zona 2 (12.55 ± 3.31 cm) y mínimas en la zona 4 (10.13 ± 3.39 cm). No se encontraron correlaciones significativas entre los valores de δ18O del otolito y el peso total (PT) del organismo (p = 0.70), así como con el peso total del otolito (p = 0.07). Se encontró una correlación entre los valores de δ18O y la longitud total del organismo (p = 0.02), pero con un bajo coeficiente de determinación (fig. 2).
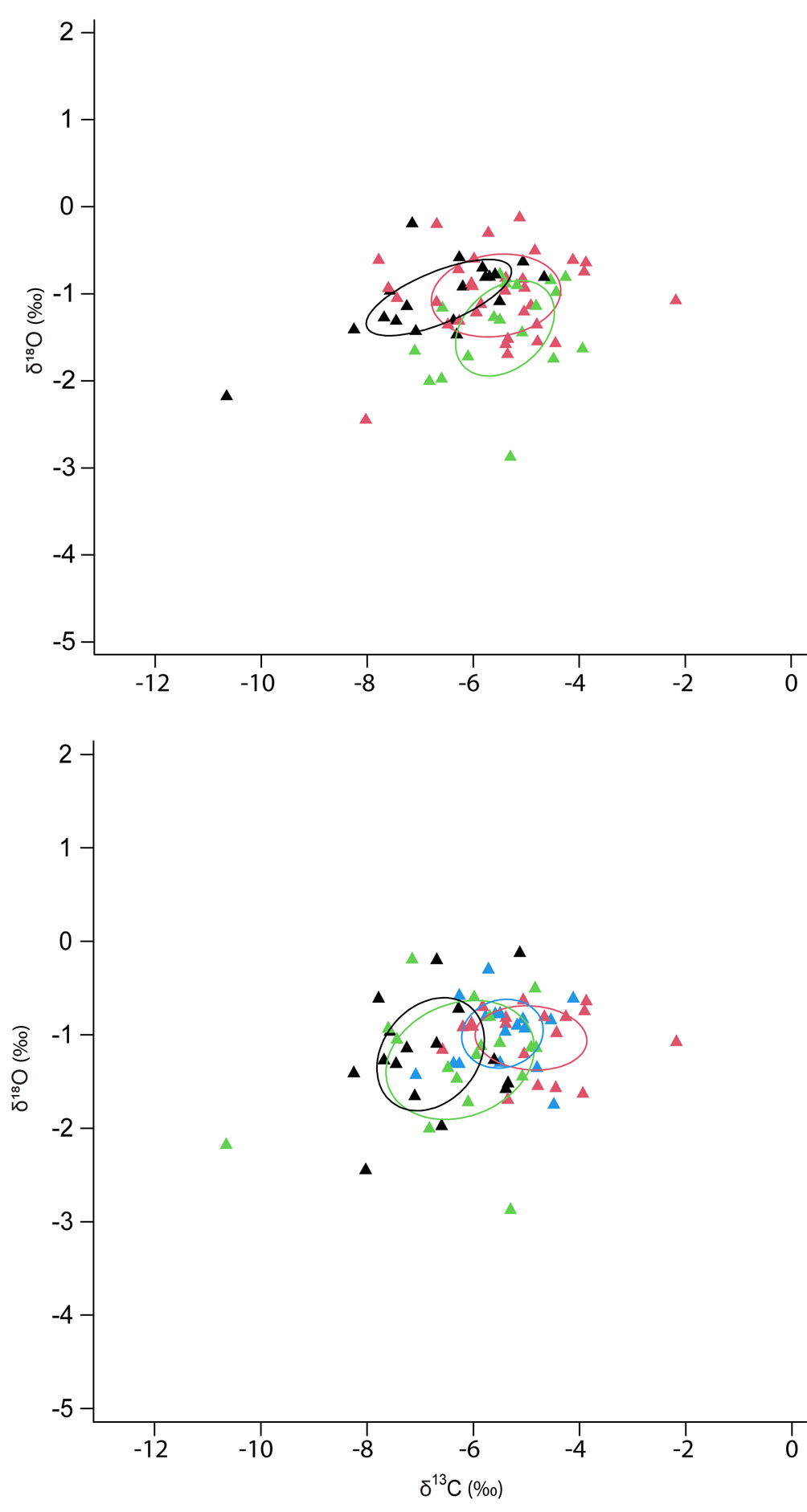
De acuerdo con SIBER, el traslape isotópico de B. chrysoura a nivel temporal fue medio (0.53), donde organismos de la temporada de secas mostraron una elipse con área menor (1.45); en contraste, organismos de la temporada de lluvias mostraron una elipse con área más grande (1.87) (tabla 1; fig. 3a). A nivel espacial el traslape isotópico de B. chrysoura entre las zonas se encuentra en un nivel bajo (0.30); en los organismos en la zona 3 se observó la elipse con el área más grande (2.90). Por otro lado, los organismos en la zona 4 mostraron el área de elipse más pequeña (0.94) (tabla 2, fig. 3b). No se encontraron diferencias significativas a nivel espacial (p = 0.20), pero si a nivel temporal (p < 0.05) donde la temporada seca y de lluvias mostraron valores más enriquecidos en el isótopo pesado que la temporada de nortes (-1.04 ± 0.42‰, -1.01 ± 0.46‰, y -1.39 ± 0.53‰, respectivamente; tabla 3).
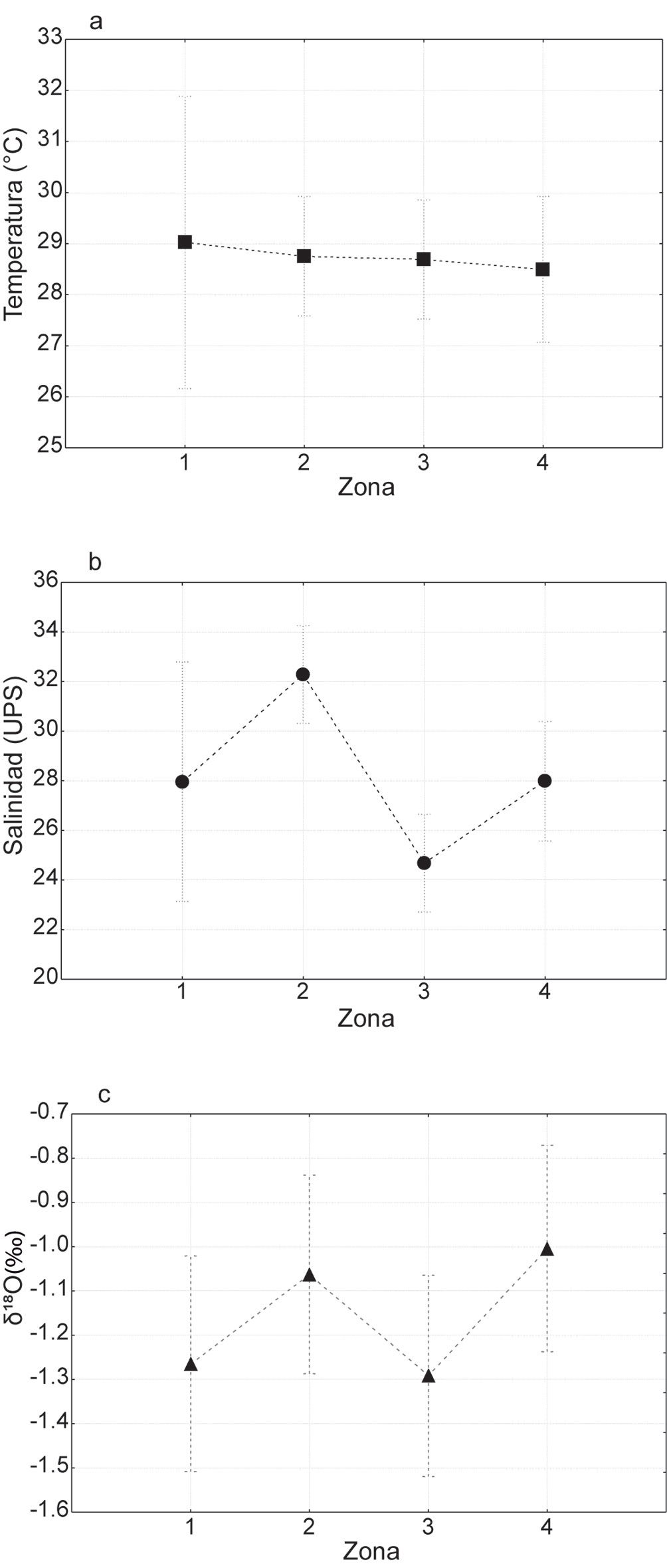
A nivel temporal, se encontraron diferencias significativas en salinidad (p < 0.05), el valor promedio más alto fue durante la temporada de secas (31.71 ± 5.22 UPS), la temporada de lluvias mostró un valor promedio de 30.44 ± 1.48 UPS, y el valor promedio mínimo fue observado en la temporada de nortes (21.54 ± 8.03 UPS). La temperatura mostró diferencia significativa (p < 0.05) con un promedio máximo durante temporada de lluvias (30.44 ± 7.45°C), la temporada de secas presentó una temperatura promedio de 28.57 ± 0.48°C, y la temporada de nortes reportó la temperatura promedio mínima (26.89 ± 7.02°C) (fig. 4).
A nivel espacial (fig. 5), los valores de temperatura no mostraron diferencias significativas (p = 0.98), con valores promedio similares (28.69 ± 4.03°C), pero con una tendencia en decremento en la temperatura de la zona 1 a la zona 4. Para la salinidad se presentaron diferencias significativas (p < 0.05), donde la zona 3 reportó el promedio mínimo de salinidad (24.69 ± 7.45 UPS), en la zona 1 y la zona 4 se observó un comportamiento similar en los promedios de salinidad (27.96 y 27.99 UPS, respectivamente), mientras que el promedio de salinidad más alto fue en la zona 2 (32.29 ± 6.07 UPS). La temperatura estimada por zonas mostró diferencias con respecto a la temperatura in situ (fig. 6a). Sin embargo, tanto en condiciones in situ como a partir de las ecuaciones paleoclimáticas, se observó menor temperatura en la zona 3 y en la zona 4, comparadas con las zonas 1 y 2.
A nivel temporal, la temperatura estimada siempre fue menor que la observada in situ, excepto para los meses de 2017 (fig. 6b). Se observa que la tendencia de las mediciones in situ, al igual que las estimadas por las ecuaciones para el período de septiembre a diciembre de 2016, es, en ambos casos, de disminución de las temperaturas. Sin embargo, la magnitud en los cambios de temperatura estimada fue mayor al observado in situ para el período de diciembre a marzo. De marzo a agosto, la medición in situ es inversa a la estimada. Sin embargo, se pudo observar tanto en escala espacial como temporal, que la temperatura estimada con ecuaciones paleoclimáticas mostró un comportamiento similar a la salinidad registrada in situ, lo que sugiere que esta variable tiene un importante efecto en la variabilidad observada en el δ18O de los otolitos de B. chrysoura.



Discusión
La especie B. chrysoura es de gran importancia para la laguna de Términos debido a su amplia distribución espacial y temporal en este ecosistema (Chavance et al., 1984; Ramos-Miranda et al., 2006). Esta especie fue encontrada en el presente trabajo en 16 de 17 estaciones y tuvo presencia en las 4 zonas de la laguna. También se observó durante las 3 estaciones climáticas. Su distribución en la laguna de Términos refuerza lo reportado por diversos autores (Irola-Sansores et al., 2021; Ramos-Miranda et al., 2006), quienes ubican a B. chrysoura como una especie representativa de la laguna, haciendo que su uso como especie indicadora sea viable, dado que cumple con los criterios establecidos por la literatura, como son la cohesión del grupo y una representatividad espacial y temporal del ecosistema (Gonzáles-Coto, 2014).
En la laguna de Términos, B. chrysoura mantiene preferencia por las áreas cerca de las bocas de los ríos Palizada, Chumpán y Candelaria, donde se ha observado con mayor frecuencia y representatividad a nivel temporal y espacial, lo que coincide con lo reportado por Chavance et al. (1984) y Ramos-Miranda et al. (2006); además, este comportamiento también es mencionado por otros autores en ecosistemas estuarinos en el golfo de México, donde reportan que tienen una preferencia por zonas ricas en pastos marinos (Sobocinski y Latour, 2015). Contrario a ésto, la zona 2 mostró la menor cantidad de organismos, lo que coincide con otros autores (Ramos-Miranda et al., 2006). La gran presencia de organismos en la temporada de lluvias observada en el presente trabajo contrasta con lo mencionado por otros autores (Chavance et al., 1984; Ramos-Miranda et al., 2006).
El rango de longitud total de los organismos del presente estudio es similar a la documentada en otros trabajos que han estudiado a B. chrysoura en ecosistemas estuarinos (Grammer et al., 2009). Al respecto, se reporta que los procesos fisiológicos pueden tener influencia en los otolitos, durante su formación (Volpedo y Vaz-dos-Santos, 2015); sin embargo, estudios con otolitos, donde se analiza la relación entre la edad y las bandas de crecimiento de estas estructuras —producto de los cambios ambientales a los que se ve sometido el organismo (Grammer et al., 2009), indican que al incorporar los valores de δ18O en los otolitos, sí reflejan una gran influencia de las variaciones en las condiciones ambientales, pero no mostraron una relación directa con los procesos fisiológicos (Rowell et al., 2008). La baja correlación de los valores de δ18O de los otolitos vs. el peso y la talla, así como el peso del otolito, sugiere que los factores fisiológicos no afectan de forma significativa en la señal isotópica. La relación positiva y significativa, pero con bajo coeficiente de determinación, puede reflejar hábitos migratorios del organismo, así como el desplazamiento de adultos a áreas menos salobres, probablemente, para su época de reproducción, así como la migración de juveniles a zonas más salobres por los procesos de reclutamiento (Chavance et al., 1984; Grammer et al., 2009; Sobocinski
y Latour, 2015).
En el análisis del traslape se observa uno bajo entre los organismos de diferentes zonas, lo que sugiere que los organismos están registrando la señal isotópica de la zona específica donde habitan a través de la deposición de δ18O en el otolito. La elipse más grande corresponde a la zona 3, y ésto puede deberse a la fuerte influencia de los ríos que descargan sus aguas en esta área dependiendo de la temporada (Cerón-Gómez, 2010; Ramos-Miranda et al., 2006). La zona 1 muestra una tendencia similar a la zona 3, lo que puede deberse a que ambas tienen influencia de agua dulce, en este caso del sistema Atasta, pero también a que es una zona con gran influencia de agua marina proveniente de la boca del Carmen. Adicionalmente, la zona 1 y 3 son regiones reportadas como migratorias de B. chrysoura, desde la laguna hasta las zonas de estuarios, en las bocas de los ríos durante los meses de reclutamiento y reproducción (Chavance et al., 1984). La elipse más pequeña se presenta en la zona 4, lo que sugiere que los organismos reflejan menos variaciones ambientales, debido a la poca influencia que tienen los sistemas deltaicos.
Los valores de δ18O de la calcita o aragonita que son precipitados por los organismos de ambientes marinos o costeros reflejan la temperatura de donde estos organismos vivieron, así como, la influencia en los cambios de salinidad que tienen lugar en las zonas debido a la descarga de los ríos, en algunos casos este efecto es más importante que la temperatura (Dorantes-Hernández et al., 2020; Kerr et al., 2007; Rowell et al., 2008). Lo anterior contrasta con lo reportado en otros trabajos, en donde la temperatura es el factor clave en el comportamiento del δ18O, prevaleciendo sobre todo en ambientes marinos, donde las salinidades son constantes (Høie et al., 2004; Kalish, 1991).
Las fluctuaciones espaciales de los valores δ18O en la zona 1 y la zona 3 mostraron un empobrecimiento en 18O de -1.29‰ y -1.27‰, respectivamente. Ésto pudo deberse a las contribuciones de agua dulce (empobrecida en 18O), provenientes de los ríos Palizada y Atasta (en la zona 1) y de los ríos Candelaria y Chumpán (en la zona 3), esta influencia se puede corroborar por los bajos valores de salinidad promedios obtenidos in situ (24.69 y 27.96 UPS, respectivamente). Los valores de δ18O en la zona 3 están más empobrecidos en el isótopo pesado que las áreas con poca influencia de aguas continentales y predominancia de agua marina, como las zonas 2 y 4 (más salobres y enriquecidas en el isótopo) (Høie et al., 2004) . Específicamente la zona 1, se mostró como una zona de mezcla, porque pese a tener la influencia de los sistemas Palizada y Atasta, también recibe grandes aportes de agua marina proveniente de la boca del Carmen, lo que se refleja en sus valores de salinidad (27.96 UPS); sin embargo, la influencia del agua dulce puede observarse en los valores empobrecidos en δ18O, similares a los de la zona 3.
A nivel temporal, los valores de δ18O obtenidos en otolitos indicaron diferencias significativas entre las 3 zonas climáticas (secas, lluvias y nortes), éstas coinciden con las diferencias encontradas tanto en temperatura como salinidad a partir de los datos in situ, lo que refuerza la posibilidad de usar los otolitos como proxies de los cambios ambientales en ecosistemas lagunares. También se puede inferir que los cambios ambientales a nivel temporal son más pronunciados que los cambios a nivel espacial, lo que coincide con lo mencionado por Surge y Walker (2005). En el caso de la temporada de secas y lluvias, los valores promedio fueron similares (-1.04‰ y -1.02‰, respectivamente), contrastando con la temporada de nortes con el valor promedio de δ18O más empobrecido (-1.39‰). Lo anterior sugiere que las contribuciones de agua dulce en la laguna llegan a su máximo durante esta temporada, lo cual se hace evidente al notar que durante esta temporada, también se alcanzan los valores promedio de salinidad más bajos (21.54 UPS). Similar a los valores de δ18O, ambas temporadas también mostraron valores de salinidad y temperatura promedios similares, lo que sugiere que durante estas 2 temporadas los aportes de agua dulce son menores en la laguna. En general, la señal isotópica de los otolitos refleja las diferencias entre los organismos que viven en áreas con influencia predominantemente marina y los que habitan en zonas con influencia mayormente estuarina en la laguna de Términos.
Tabla 1
Área de la elipse y traslape del nicho isotópico (SIBER), correspondiente a la categoría de temporada climática en función de los valores de δ13C y δ18O obtenido de los otolitos de Bairdiella chrysoura.
| Categoría | Área de la elipse | Área corregida | Traslape |
| 1 – Secas | 4.50 | 1.45 | 0.53 |
| 2 – Lluvias | 7.47 | 1.87 | |
| 3 – Nortes | 4.14 | 1.61 |
Tabla 2
Área de la elipse y el traslape del nicho isotópico (SIBER), correspondiente a la categoría de zona de muestreo en función de los valores de δ13C y δ18O obtenidos de los otolitos de Bairdiella chrysoura.
| Zona | Área de la elipse | Área corregida | Traslape |
| 1 | 4.82 | 1.99 | 0.30 |
| 2 | 3.07 | 1.20 | |
| 3 | 9.52 | 2.90 | |
| 4 | 2.76 | 0.94 |
El rango observado en los valores de δ18O va de -1.5% a -0.8% en la laguna de Términos, presentan una similitud con los reportados en trabajos realizados para la parte norte del golfo de México, donde se estudió el δ18O a partir de conchas de foraminíferos en los núcleos sedimentarios y donde el rango obtenido fue desde -1.86‰ hasta -1.13‰ (Emiliani et al., 1975); sin embargo, el comportamiento de los valores de δ18O observados durante el presente trabajo mostró mayor influencia a escala temporal, comparado con las observaciones de otros trabajos realizados en el norte del golfo de México (Emiliani et al., 1975), esta mayor variabilidad en los registros isotópicos de los otolitos puede explicarse por el dinamismo de la laguna producto de los aportes de aguas territoriales a través de las bocas de la laguna y el tipo de estructura estudiada.
Tabla 3
Datos isotópicos (δ18O y δ13C) obtenidos en lo otolitos de Bairdiella chrysoura organizados por zona de muestreo (Villegér, 2010) y temporada climática en la laguna de Términos, Campeche, México, del 2016 al 2017. DE = Desviación estándar; N = número de otolitos analizados.
| Temporada | Nortes | Lluvias | Secas | Anual | |||||||||||
| Zona | N | δ18O | DE | δ13C | DE | δ18O | DE | δ13C | DE | δ18O | DE | δ13C | DE | Prom.
δ18O |
Prom. δ13C |
| 1 | 16 | -1.63 | 0.35 | -6.44 | 0.62 | -1.03 | 0.79 | -6.42 | 1.03 | -1.22 | 0.17 | -7.64 | 0.34 | -1.29 | -6.80 |
| 2 | 19 | -1.09 | 0.12 | -4.92 | 0.96 | -1.11 | 0.36 | -4.70 | 1.11 | -0.77 | 0.12 | -5.44 | 0.61 | -1.03 | -4.91 |
| 3 | 18 | -1.83 | 0.66 | -5.62 | -5.04 | -0.99 | 0.30 | -6.13 | 0.95 | -1.15 | 0.74 | -7.06 | 1.89 | -1.27 | -6.25 |
| 4 | 17 | -1.11 | 0.40 | 0.74 | 0.45 | -0.90 | 0.37 | -5.20 | 0.63 | -0.98 | 0.37 | -6.21 | 0.52 | -0.99 | -5.45 |
| Total | 70 | -1.42 | 0.53 | -6.65 | 1.33 | -1.02 | 0.47 | -5.57 | 1.20 | -1.04 | 0.43 | -5.4 | 0.88 | -1.15 | -5.82 |
La estimación de la temperatura del mar, a partir de δ18O obtenido de organismos marinos en sus estructuras metabólicamente inertes, ha sido uno de los principales desafíos, debido a la dependencia del δ18O del agua de mar, a cambios en la temperatura y salinidad del mar (Bemis et al., 2000; Cerón-Gómez, 2010; Dorantes-Hernández et al., 2020; Rowell et al., 2008; Surge y Walker, 2005; Trasviña-Carrillo et al., 2018). La estimación de la temperatura marina es más compleja en ambientes de transición entre lo marino y estuarino, donde las contribuciones de agua dulce continentales son significativas (Dorantes-Hernández et al., 2020; Kerr et al., 2007). Esta complejidad puede ser observada cuando las temperaturas de la laguna tomadas in situ son comparadas con las temperaturas estimadas. En la zona 2, la temperatura estimada es de 25.57 °C y tiene la menor diferencia (3.18 °C), con respecto a la temperatura in situ 28.75 °C. El resto de las zonas (1, 3 y 4) tienen una temperatura estimada con un rango de diferencia de 7 a 11 °C con respecto a la temperatura in situ.
A escala temporal, al igual que a nivel espacial, la temperatura estimada es inferior a la temperatura in situ. En la época de secas, la diferencia entre la temperatura observada y la estimada fue de aproximadamente 3 °C; por el contrario, para las temporadas de norte y lluvias, las ecuaciones resultaron en valores más alejados de la temperatura observada para ambas zonas; sin embargo, el comportamiento de la temperatura estimada en las 3 estaciones climáticas fue el esperado, dado que tanto la observada como la estimada siguieron la misma tendencia, y que la temperatura más baja de las 3 estaciones se reporta en la estación nortes. Por lo que, algo que se debe considerar al estimar la temperatura, es la influencia de la salinidad. A diferencia de otros estudios donde la temperatura estimada de los organismos fue muy similar a la medida in situ, cuando las condiciones fueron marinas y con variaciones de salinidad mínimas (Bemis et al., 2000; Grossman y Ku, 1986; Rowell et al., 2008; Surge y Walker, 2005; Trasviña-Carrillo et al., 2018).
A partir del presente estudio, se puede señalar que no existe una influencia significativa de factores fisiológicos en los valores de δ18O de los otolitos. Aunque los valores de δ18O muestran que los isótopos de oxígeno responden a cambios ambientales, particularmente variaciones de temperatura y salinidad, se observó que no existen diferencias significativas entre las 4 zonas de la laguna de Términos. En cambio, se encontraron diferencias significativas a nivel temporal. Además de ésto, SIBER mostró que los otolitos reflejan la señal isotópica de cada área y estación. Finalmente, la respuesta de la ecuación de paleo temperatura a los cambios ambientales, dadas las condiciones ambientales dinámicas de la laguna de Términos, mostró que los valores estimados de temperatura son imprecisos y, principalmente, están asociados a la respuesta de δ18O a los cambios de salinidad, y no tanto a los cambios de temperatura, por lo que es necesario desarrollar nuevas ecuaciones adaptadas a ecosistema tropicales costeros e incluir el análisis isotópico en los programas de manejo de áreas naturales protegidas para mejorar el proceso de gestión costero.
Agradecimientos
JACB agradece al Consejo Nacional de Ciencia y Tecnología (Conacyt) y al Programa de Becas para Estudios de Posgrado, por la beca otorgada con DNI 1002645 y YETR agradece al Proyecto Semarnat-Conacyt 263401 “Análisis de δ13C y δ18O en otolitos de peces marinos presentes en el Área de Protección de Flora y Fauna Laguna de Términos, Campeche: indicadores del cambio climático”.
Referencias
Bemis, B. E., Spero, H. J., Lea, D. W. y Bijma, J. (2000). Temperature influence on the carbon isotopic composition of Globigerina bulloides and Orbulina universa (planktonic foraminifera). Marine Micropaleontology, 38, 213–228. https://doi.org/10.1016/S0377-8398(00)00006-2
Campana, S. E. (1999). Chemistry and composition of fish otoliths: pathways, mechanism and application. Marine Ecology Progress Series, 188, 263–297. https://doi.org/10.3354/meps188263
Carabias-Lillo, J., Quadri-de la Torre, G. y De la Maza-Elvira, J. (1997). Programa de manejo del Área de Protección de Flora y Fauna “Laguna de Términos”. México D.F.: Instituto Nacional de Ecología.
Carpenter, K. (2002). Bony fishes, Part 2 (Opistognathidae to Molidae), sea turtles and marine mammals. En K. Carpenter (Ed.), The living marine resources of the Western Central Atlantic (pp. 1375–2127). Rome: FAO.
Cerón-Gómez, J. A. (2010). Discriminación de subpoblaciones de la sardina del Pacífico (Sardinops sagax) con base en la temperatura de ciranza estimada a partir de valores de δ18O de los núcleos de otolitos (Tesis de maestría). Centro de Investigación Científica y de Educación Superior de Ensenada. Baja California, México.
Chavance, P., Flores-Hernández, D., Yáñez-Arancibia, A. y Amezcua-Linares, F. (1984). Ecología, biología y dinámica de las poblaciones de Bairdiella chrysoura en la laguna de Términos, sur del golfo de México. (Pisces: Sciaenidae). Anales del Instituto de Ciencias Del Mar y Limnología, Universidad Nacional Autonoma de México, 11, 126–161.
Dorantes-Hernández, J. M., Torres-Rojas, Y. E., Aguíñiga-García, S., Ramos-Miranda, J., Trasviña-Carrillo, L. D., Flores-Hernández, D. et al. (2020). Variation of δ18O in otoliths of Stellifer lanceolatus and Eucinostomus gula environmental change indicator in Terminos Lagoon, Mexico. Marine Environmental Research, 161, 105135. https://doi.org/10.1016/j.marenvres.2020.105135
Emiliani, C., Gartner, S., Lidz, B., Eldridge, K., Elvey, D. K., Huang, T. C. et al. (1975). Paleoclimatological analysis of Late Quaternary cores from the Northeastern Gulf of Mexico. Science, 189, 1083–1088. https://doi.org/10.1126/science.189.4208.1083
Fichez, R., Archundia, D., Grenz, C., Douillet, P., Gutíerrez, F., Origel, M. et al. (2016). Global climate change and local watershed management as potential drivers of salinity variation in a tropical coastal lagoon (Laguna de Terminos, Mexico). Aquatic Sciences, 79, 219–230. https://doi.org/10.1007/s00027-016-0492-1
Gonzáles-Coto, J. D. (2014). Bioindicadores como aliados en el monitoreo de condiciones ambientales. Éxito Empresarial, 252, 1–4.
Grammer, G. L., Brown-Peterson, N. J., Peterson, M. S. y Comyns, B. H. (2009). Life history of silver perch Bairdiella chrysoura (Lacepède, 1803) in North-Central Gulf of Mexico Estuaries. Gulf of Mexico Science, 27, 62–73. https://doi.org/10.18785/goms.2701.07
Grossman, E. L. y Ku, T. L. (1986). Oxygen and carbon isotope fractionation in biogenic aragonite: temperature effects. Chemical Geology: Isotope Geoscience Section, 59, 59–74. https://doi.org/10.1016/0168-9622(86)90057-6
Høie, H., Otterlei, E. y Folkvord, A. (2004). Temperature-dependent fractionation of stable oxygen isotopes in otoliths of juvenile cod (Gadus morhua L.). ICES Journal of Marine Science, 61, 243–251. https://doi.org/10.1016/j.icesjms.2003.11.006
Irola-Sansores, B. N., Torres-Rojas, Y. E. y Cuevas-Jiménez, A. (2021). Spatial temporal behavior of benthic communities in the Terminos Lagoon, Mexico: possible areas of protection and conservation. JAINA Costas y Mares ante el Cambio Climático, 3, 55–76. doi 10.26359/52462.0421
Jackson, A. L., Parnell, A. C., Inger, R. y Bearhop, S. (2011). Comparing isotopic niche widths among and within communities: SIBER – stable isotope Bayesian ellipses in R. Journal of Animal Ecology, 80, 595–602.
Kalish, J. M. (1991). 13C and 18O isotopic disequilibria in fish otoliths: metabolic and kinetic effects. Marine Ecology Progress Series, 75, 191–203. https://doi.org/10.3354/meps075191
Kerr, L., Secor, D. y Kraus, R. (2007). Stable isotope (δ13C and δ18O) and Sr/Ca composition of otoliths as proxies for environmental salinity experienced by an estuarine fish. Marine Ecology Progress Series, 349, 245–253. https://doi.org/10.3354/meps07064
Kjerfve, B. (1986). Comparative oceanography of coastal lagoons. En D. A. Wolfe (Ed.) Estuarine variability
(pp. 63–81). Rockville, Maryland: Academic Press. https://doi.org/10.1016/B978-0-12-761890-6.50009-5
Kjerfve, B. (1994). Coastal lagoons. En B. Kjerfve (Ed.), Elsevier oceanography series (pp. 1–8). College Station, TX: Elsevier Science Publishers.
Park, R. y Epstein, S. (1961). Metabolic fractionation of 13C and 12C in plants. Plant Physiology, 36, 133–138. https://doi.org/10.1104/pp.36.2.133
Peterson, B. J. y Fry, B. (1987). Stable isotopes in ecosystem studies. Annual Review of Ecology and Systematics, 18, 293–320. https://doi.org/10.1146/annurev.es.18.110187.001453
Ramos-Miranda, J., Flores-Hernández, D., Ayala-Pérez, L. A., Rendón-von Osten, J., Villalobos-Zapata, G. y Sosa-López, A. (2006). Átlas hidrológico e ictiológico de la Laguna de Términos. Campeche, Mexico: Universidad Autónoma de Campeche.
Romo-Curiel, A. E., Herzka, S. H., Sepulveda, C. A., Pérez-Brunius, P., y Aalbers, S. A. (2016). Rearing conditions and habitat use of white seabass (Atractoscion nobilis) in the northeastern Pacific based on otolith isotopic composition, Estuarine, Coastal and Shelf Science, 170, 134–144. https://doi.org/10.1016/j.ecss.2016.01.016.
Rowell, K., True, C., Flessa, K. W. y Dettman, D. L. (2008). Peces sin agua: validación y aplicación de δ18O en los otolitos de Totoaba macdonaldi. Ciencias Marinas, 34, 55–68. https://doi.org/10.7773/cm.v34i1.1256
Santos-Santoyo, J. E., Torres-Rojas, Y. E. y Cuevas-Jiménez, A. (2021). Record of changes in the regionalization of Términos Lagoon, Campeche. JAINA Costas y Mares ante el Cambio Climático, 3, 23–40. https://doi 10.26359/52462.0221
Sobocinski, K. y Latour, R. (2015). Trophic transfer in seagrass systems: estimating seasonal production of an abundant seagrass fish, Bairdiella chrysoura, in lower Chesapeake Bay. Marine Ecology Progress Series, 523, 157–174. https://doi.org/10.3354/meps11163
Surge, D. y Walker, K. J. (2005). Oxygen isotope composition of modern and archaeological otoliths from the estuarine hardhead catfish (Ariopsis felis) and their potential to record low-latitude climate change. Palaeogeography, Palaeoclimatology, Palaeoecology, 228, 179–191. https://doi.org/10.1016/j.palaeo.2005.03.051
Torres-Rojas, Y. E., Flores-Hernández, D., Gómez-Críollo, F., Aguiñiga-García, S., Sánchez-González, A., Concepción-Pérez, C. et al. (2017). Isótopos estables y diversidad de peces en Laguna de Términos : indicadores del cambio climático. En Semarnat-Conacyt (Eds.), Primer Encuentro Científico y Técnico. Fondo Sectorial para la Investigacion Ambiental (pp. 151–158). México D.F.: Semarnat/ Conacyt.
Trasviña-Carrillo, L. D., Hernández-Herrera, A., Torres-Rojas,
Y. E., Galván-Magaña, F., Sánchez-González, A. y Aguíñiga-García, S. (2018). Spatial and trophic preferences of jumbo squid Dosidicus gigas (D’Orbigny, 1835) in the central Gulf of California: ecological inferences using stable isotopes. Rapid Communications in Mass Spectrometry, 32, 1225–1236. https://doi.org/10.1002/rcm.8147.
Villalobos-Zapata, G. J. (2015). Conservación y manejo del Área de Protección de Flora y Fauna: (1994-2015). En J. Ramos y G. J. Villalobos (Eds.), Aspectos socioambientales de la región de la laguna de Términos, Campeche (pp. 1–20). Campeche: Universidad Autónoma de Campeche.
Villeger, S., Ramos, J., Flores, D. y Mouillot, D. (2010). Contrasted changes in taxonomic versus functional diversity of tropical fish communities after habitat degradation. Ecological Applications, 20, 1512–1522. https://doi.org/10.
1890/09-1310.1
Volpedo, A. V. y Vaz-dos-Santos, A. M. (2015). Métodos de estudios con otolitos:principios y aplicaciones. Buenos Aires: Programa de Internacionalización de la Educación Superior y Cooperación Internacional (PIESCI).