Conceptos taxonómicos, fenología y epifitismo: el caso de Ceratozamia tenuis (Zamiaceae)
Lilí Martínez-Domínguez a, b, *, Fernando Nicolalde-Morejón a, Dennis W. Stevenson c y Quiyari Santiago-Jiménez d
a Laboratorio de Taxonomía Integrativa, Instituto de Investigaciones Biológicas, Universidad Veracruzana, Av. Luis Castelazo Ayala s/n, Industrial
Ánimas, 91190 Xalapa, Veracruz, México
b Centro de Investigaciones Tropicales, Universidad Veracruzana, José María Morelos 44, Zona Centro, 91000 Xalapa, Veracruz, México
c The New York Botanical Garden, 2900 Southern Blvd., Bronx, NY 10458, USA
d Museo de Zoología, Facultad de Biología, Universidad Veracruzana, Circuito Gonzalo Aguirre Beltrán s/n, Zona Universitaria, 91090 Xalapa, Veracruz, México
*Autor para correspondencia: lilimartinezd@gmail.com (L. Martínez-Domínguez)
Resumen
En este estudio abordamos la identidad taxonómica de Ceratozamia tenuis (Dyer) D. W. Stev. & Vovides, 2016, un binomio que históricamente ha estado relacionado con el concepto taxonómico de C. mexicana Brongn., 1846. Describimos los estadios fenológicos de C. tenuis, el período reproductivo y el grado de sincronía entre machos y hembras en hábitat natural. Nuestros resultados muestran que el período reproductivo entre machos y hembras no es sincrónico. Todas las hembras de las poblaciones estudiadas emergen de agosto a octubre y exhiben el mismo tiempo de crecimiento, llegando a la receptividad en sincronía. En contraste, los machos tienen un período de emergencia diferencial en la población que se prolonga durante más meses y despliega diferentes ritmos de crecimiento. El período de correspondencia en receptividad entre machos y hembras ocurre de enero a marzo, pero a nivel poblacional algunos machos continuarán su desarrollo y llegarán a la madurez hasta julio. Además, describimos el reciente descubrimiento del epifitismo para la especie, que constituye una condición ecológica que no había sido reportada previamente para el género. Finalmente, discutimos las implicaciones de estos rasgos ecológicos en la dispersión.
Palabras clave:
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Taxonomic concepts, phenology and epiphytism: the case of Ceratozamia tenuis (Zamiaceae)
Abstract
This study addresses the taxonomic identity of Ceratozamia tenuis (Dyer) D. W. Stev. & Vovides, 2016, a binomial that has been related historically with the taxonomic concept of C. mexicana Brongn., 1846. We describe the phenological stages of the C. tenuis, the reproductive period, and the degree of synchrony between males and females in natural habitat. Our results show that the reproductive period between pollen plants and ovulate plants is not synchronous. All ovulate plants in the populations studied emerge from August to October and exhibit the same time scale of growth, and thus their receptivity is synchronous. In contrast, pollen plants have a differential emergence period in the populations that lasts for more months and displays different growth rates. The correspondence in
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Keywords:
Cycads; Dispersal; Reproductive phenology; Mexico; Taxonomy
Introducción
La correcta identificación de las especies es clave para comprender el origen de la diversidad y proponer estrategias de conservación. La claridad en los nombres taxonómicos y en sus conceptos –es decir, tanto en validez nomenclatural como su definición– son a su vez indispensables para la identificación. Sin embargo, los nombres en la historia de una entidad biológica pueden presentar cambios, los cuales generan confusión taxonómica si no son tomados en cuenta por los taxónomos contemporáneos (Berendsohn, 1995; Franz y Peet, 2009; Patterson et al., 2010). Dado que el avance en el conocimiento taxonómico continúa en aumento, para todos los taxones se han propuesto y continúan desarrollándose enfoques para hacer frente a estos desafíos (Deans et al., 2012; Franz y Cardona-Duque, 2013).
En grupos no tan diversos como las cícadas (orden Cycadales) existen contrastantes e interesantes escenarios taxonómicos en la evolución de los nombres. Un buen ejemplo lo constituye el género Ceratozamia Brongn. (Zamiaceae), el cual ha experimentado un aumento exponencial de conocimiento sobre su diversidad de especies. Actualmente, Ceratozamia comprende 31 especies; no obstante, los tratamientos taxonómicos son escasos. Los trabajos taxonómicos más relevantes son Miquel (1847, 1848, 1868, 1869), Regel (1876), Thiselton-Dyer (1884) y Schuster (1932); este último es el tratamiento más reciente, pero a su vez, más controversial, debido a la escasa revisión de material botánico y trabajo de campo. En el tratamiento de Schuster, de las 9 especies descritas hasta esa fecha, solo se validaron 2 y las otras entidades se reconocieron como variedades y formas.
La historia taxonómica y nomenclatural de Ceratozamia representa un reto, desde su origen, debido en parte a las transferencias conceptuales entre taxa y a su asignación dentro de grupos de especies a los que no pertenecen. Esta situación se ha intensificado en los últimos 10 años, llegando a interpretaciones divergentes (Medina-Villarreal y González-Astorga, 2016; Vovides et al., 2016). Todos estos cambios han implicado sinonimia y redescubrimiento de binomios previamente publicados. Tal es el caso del actual concepto de C. tenuis (Dyer) D. W. Stev. & Vovides, que se describió como una variedad de C. mexicana Brongn., (C. mexicana var. tenuis) a partir de un espécimen colectado desde una localidad no especificada en México y que fue tipificado por Stevenson y Sabato (1986) con la descripción de la especie.
Debido al desconocimiento de las localidades tipos, la región central de Veracruz fue reconocida como hábitat de Ceratozamia mexicana, y el binomio C. tenuis no se consideró en los trabajos posteriores sobre diversidad y relaciones filogenéticas del género (Vovides et al., 2004; González y Vovides, 2012; Nicolalde-Morejón et al., 2014). La decisión nomenclatural para validar y modificar la categoría taxonómica de C. tenuis se basó en la identificación de material botánico depositado en los Reales Jardines Botánicos de Kew (Londres) por parte de Stevenson, en 1999.
Este último es un binomio actualmente válido y reemplaza biológicamente a la entidad conocida históricamente como Ceratozamia mexicana, en especial si se considera el territorio desde la región central del estado de Veracruz (Vovides et al., 2016). Aquí presentamos la historia del concepto taxonómico para C. tenuis con el objetivo de contribuir a esclarecer la identidad conceptual del binomio de esta especie, así como aspectos de su historia natural, incluyendo la ampliación del intervalo de distribución geográfica.
En cuanto a la información aquí proporcionada sobre la historia natural de Ceratozamia tenuis, esta investigación pone énfasis en el estudio del desarrollo de las estructuras reproductivas y la variación en sus diferentes estadios ontogenéticos. Pocos aspectos de la reproducción en Ceratozamia han sido estudiados en detalle (Stevenson, 1981) y se desconocen los patrones de variación fenológica. Chamberlain (1912) describió la espermatogénesis y la fertilización, y algunos aspectos de la morfología general de las estructuras reproductivas al término del desarrollo de las mismas, aunque las observaciones en campo han sido limitadas.
En este contexto, en Ceratozamia se ha reportado que el evento de conificación es sincrónico. Cuando el estróbilo ovulífero está receptivo, existe un cambio en la coloración de la pubescencia en las megasporófilas (rojizo), así como la aparición de cavidades entre cada una de estas estructuras (Chamberlain, 1912; Norstog y Nicholls, 1997). Debido a que la fenología es una característica importante de la historia de vida de los organismos que influye directamente en la capacidad de una especie para sobrevivir, el objetivo adicional de este trabajo es proporcionar información detallada sobre su historia natural, a partir de trabajo periódico realizado en poblaciones naturales, así como describir y clasificar los cambios fenológicos y morfológicos asociados a su ciclo reproductivo.
Materiales y métodos
Se revisaron todos los tratamientos taxonómicos relacionados con la especie Ceratozamia tenuis. También se consideraron los trabajos con circunscripciones independientes en los cuales se describen nuevas especies morfológicamente relacionadas a ésta. Se revisó el material botánico disponible en los siguientes herbarios: CIB, CHIP, FCME, HEM, IEB, K, MEXU, MO, NY, P, SLPM, US, XAL, XALU.
La distribución se obtuvo luego de sistematizar las colecciones botánicas depositadas en herbarios nacionales e internacionales, de los cuales se extrajeron los datos de etiqueta y se proyectaron en un sistema de coordenadas geográficas en el programa ArcMap GIS 10.2 (ESRI, 2011). Esta información se complementó con trabajo de campo intensivo en la región central de Veracruz.
Se monitorearon periódicamente 2 poblaciones ubica-
das en el municipio de Coacoatzintla, Veracruz. En la población “Tlachinola” se realizó un censo y en “Chirimoyo” un muestreo dirigido, orientado a registrar aquellos individuos que se encontraban en etapa reproductiva y se evaluó la producción de estructuras reproductivas (estróbilos poliníferos y ovulíferos). Para este propósito se realizaron visitas mensuales durante 2015 y 2016. Las visitas se intensificaron a una vez por semana o cada tercer día, dependiendo del avance en el desarrollo de las estructuras, particularmente durante las fases de liberación del polen y la receptividad de la hembra. Un total de 177 individuos fueron analizados. De cada uno se registró el sexo, estadio de desarrollo, temporada de producción y cantidad de estróbilos. El sexo de la planta –debido al dimorfismo sexual que presentan las cícadas– fue determinado por la presencia o restos de estróbilos. Con los datos obtenidos, se identificaron y describieron los diferentes estadios fenológicos para la especie. Además, cada una de las estructuras reproductivas poliníferas y ovulíferas fueron medidas para caracterizar el crecimiento de la estructura en cada estadio fenológico. La caracterización de los estadios fenológicos se realizó siguiendo una versión extendida de la propuesta de Clugston et al. (2016), realizada para Zamia L., 1763.
Con estos datos se realizó un análisis a nivel individual, para lo cual se dio seguimiento detallado a 107 individuos poliníferos y 70 ovulíferos. En estos individuos se describió el tiempo de maduración de cada uno de los estadios fenológicos y se evaluó la sincronía de estos eventos (es decir, la correspondencia temporal) entre machos y hembras.
Resultados
Ceratozamia mexicana var. tenuis se publicó en 1884 dentro de la obra Biologia Centrali Americana por Thiselton-Dyer. La publicación original de esta especie no presenta una descripción detallada; por el contrario, únicamente se enfatiza en la diferencia en el hábitat con relación al resto de especies del género hasta esa fecha publicadas. Schuster (1932) reconoció a esta entidad como C. mexicana var. longifolia forma tenuis, haciendo alusión a los folíolos de 30 cm de largo y 1.5 cm de ancho. Hasta aquella fecha, la localidad puntual de procedencia de la especie era desconocida y se reconocía como un taxón que habitaba en México. Debido a sus cambios taxonómico-nomenclaturales, a la procedencia desconocida y carencia de tipo nomenclatural, esta variedad (tenuis) permaneció en entredicho.
La confusión histórica sobre la distribución de Ceratozamia mexicana sobre el valle de Coacoatzintla-Jilotepec tiene lugar en 1912, con la visita a Veracruz de Charles Joseph Chamberlain, quien identificó por primera vez como C. mexicana al material biológico proveniente del municipio de Jilotepec. De acuerdo a los registros históricos, este material fue colectado en los predios de la hacienda del Sr. Luis Caraza, cuyos terrenos abarcaban 800 ha, en lo que ahora se conoce como La Concepción, Chiltoyac y Paso de San Juan (Chamberlain, 1912). Durante los años posteriores, Chamberlain continuó recibiendo material botánico, principalmente estructuras reproductivas, provenientes de este lugar. Este constante trabajo botánico en la región por parte de Chamberlain fue motivo para considerar a Jilotepec como la localidad tipo de C. mexicana (Vovides et al., 2016).
Actualmente, la cabecera de la hacienda se ubica en la congregación Chiltoyac, del municipio de Xalapa, Veracruz. La presencia de Ceratozamia en esta zona no había sido corroborada, pero trabajo de campo realizado en 2016 corrobora la ubicación de una población en las inmediaciones de la zona conurbada de Xalapa, en terrenos con pendientes muy fuertes, bajo encinares.
De acuerdo con este escenario histórico, la inercia taxonómica que Chamberlain estableció para Ceratozamia mexicana se refleja en la revisión del género en “Flora de Veracruz” (Vovides et al., 1983), bajo el nombre C. mexicana var. mexicana. Por tal motivo, durante más de un siglo, de manera errónea la localidad de la especie tipo del género fue esa región geográfica, lo cual se observa en una serie de trabajos escritos desde puntos de vista ecológicos, taxonómicos, biogeográficos y de conservación (Chamberlain, 1912; Nicolalde-Morejón et al., 2014; Rivera-Fernández et al., 2012; Sánchez-Tinoco y Engleman, 2004; Vovides et al., 1983, 2010).
Sin embargo, los conceptos taxonómicos de estos 2 binomios en cuestión se modificaron por Vovides et al. (2016). Ceratozamia tenuis corresponde morfológicamente a la población “El Esquilón” en Jilotepec (Veracruz), por lo cual, su concepto taxonómico es parcialmente congruente con Thiselton-Dyer (1884); mientras que, C. mexicana se circunscribió a la población “El Mirador” en Totutla (Veracruz), por lo que, su concepto es mutuamente excluyente con el propuesto por sus predecesores y congruente con Brongniart, quien describió a la especie en 1846.
En resumen, morfológicamente Ceratozamia tenuis es diagnosticable con respecto a sus afines geográficos (C. mexicana, C. morettii Vázq. Torres & Vovides, C. brevifrons Miq., C. delucana Vázq.-Torres, Moretti & Carvajal-Hernández, y C. decumbens Vovides, Avendaño, Pérez-Farr. & Gonz.-Astorga) en términos de los siguientes caracteres: folíolos lineares; lámina involuta y simétrica; ápice del folíolo simétrico; peciolo y raquis generalmente con aguijones; hojas nuevas color verde oscuro a negruzco; y estróbilo ovulífero de color verde oscuro con pubescencia negruzca en la madurez.
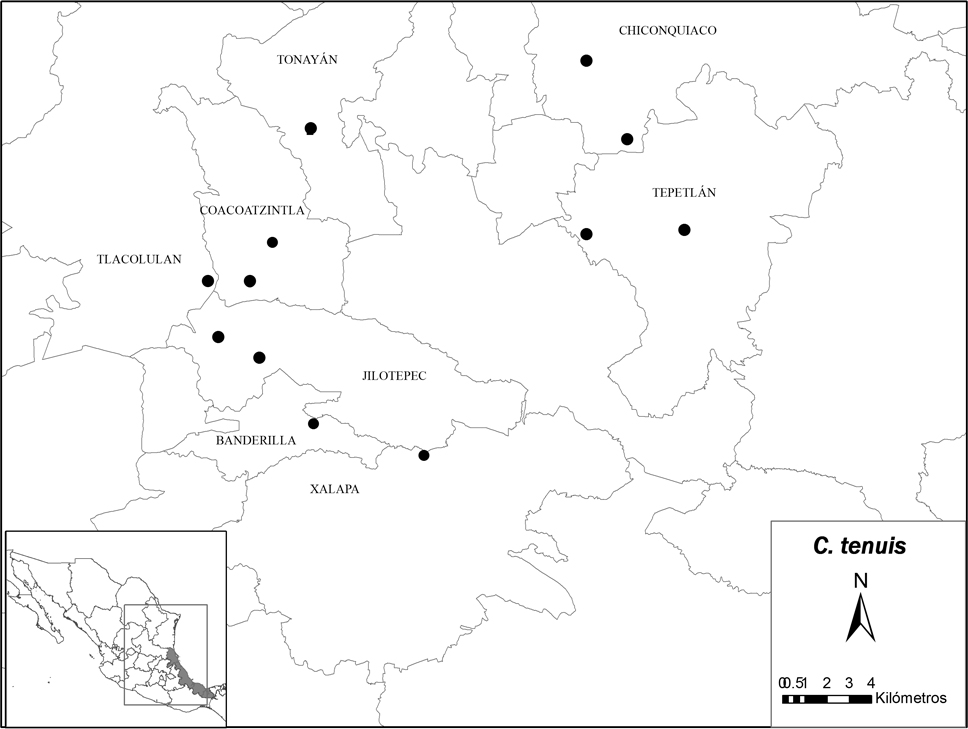
Los patrones de variación morfológica observados en campo muestran que Ceratozamia tenuis es endémica de la región montañosa central de Veracruz, comprendida entre los municipios de Banderilla, Xalapa, Jilotepec y Coacoatzintla en el extremo sur y, Tepetlán y Chiconquiaco en el extremo norte (fig. 1).
La especie habita en bosque mesófilo de montaña sensu Rzedowski (1978), sobre laderas escarpadas en un rango de elevación de 1,200 hasta 1,850 m de altitud en suelos de origen volcánico. En relación a las provincias biogeográficas, la especie se encuentra en la zona de transición entre la Sierra Madre Oriental y el Eje Neovolcánico Transversal Mexicano.
Fenología reproductiva. Las fases encontradas son las siguientes: 1) emergencia (E), cuando las estructuras reproductivas, tanto ovulíferas como poliníferas, emergen y se considera hasta antes de la separación de las catáfilas, mismas que recubren el estróbilo durante esta fase inicial de desarrollo; 2) microsporangios inmaduros (MI), el eje central del estróbilo polinífero está condensado y los microsporangios son visibles pero cerrados; 3) microsporangios maduros (MM), con el eje central del estróbilo polinífero alargado y microsporófilas libres, y cuando ocurre la liberación del polen; 4) óvulo temprano o receptividad (R), cuando los óvulos del estróbilo ovulífero aún están inmaduros pero son visibles debido a la separación de las megasporófilas (durante esta fase ocurre un cambio de color en la base de las megasporófilas, indicando que la planta ovulífera está receptiva para que ocurra la polinización); 5) óvulo tardío (OT), cuando el megagametófito encontrado en el estróbilo ovulífero comienza a madurar (durante este período ocurre la fertilización); 6) desgrane (D), cuando el estróbilo ovulífero comienza a liberar las megasporófilas y la sarcotesta comienza a degradarse, y finalmente 7) senescencia (S), cuando las microsporófilas se desprenden del estróbilo polinífero.
Fenología reproductiva polinífera. La primera fase, E, ocurre de agosto a noviembre, aunque el mayor registro ocurrió en agosto. Durante estos meses el estróbilo aumenta de 1 a 4 cm por mes. El color de los estróbilos durante esta fase es amarillo con pubescencia naranja, que al aumentar en tamaño se torna verde amarillento y la pubescencia cambia a negro, mismo que exhibirá durante la madurez (fig. 2A).

El desarrollo de estas estructuras continúa progresivamente hasta la fase MM.
La fase MI se caracteriza por el desarrollo completo de las microsporófilas y el aumento en la intensidad del color característico del estróbilo polinífero. Dura aproximadamente un mes (fig. 2B) y puede tener lugar entre diciembre y junio (fig. 3). El mayor número de estróbilos en esta fase se registró de diciembre a marzo.
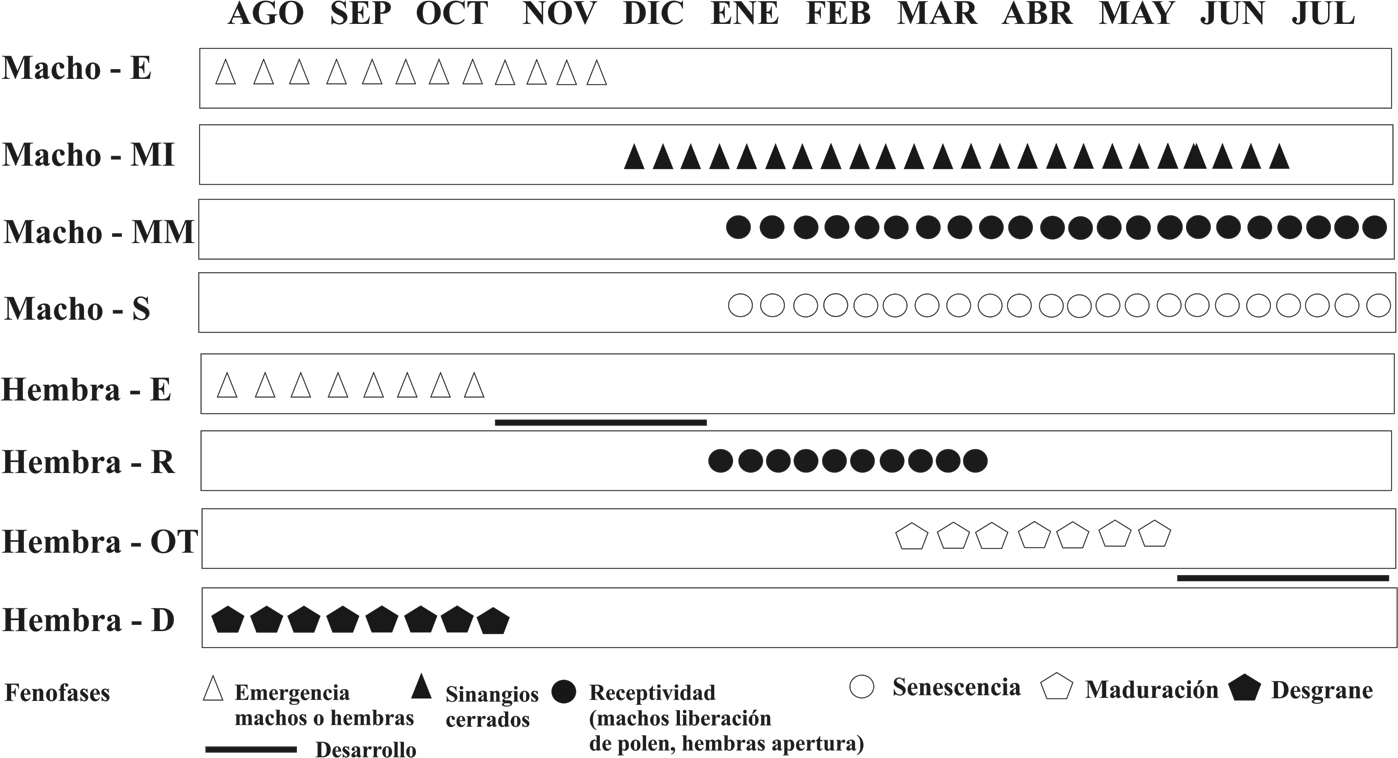
Durante la fase MM ocurre la elongación final del estróbilo polinífero. En ella, el color cambia a amarillo o crema y el polen se libera de los soros (fig. 2C), por lo que se observan insectos habitando en las microsporófilas. Esta fase ocurre entre enero y julio; el mayor número de estróbilos maduros se registró de enero a marzo. A partir de abril la cantidad de plantas individuales en esta fase disminuye progresivamente (fig. 4); este proceso dura de 3 a 4 semanas. Finalmente, la fase S se caracteriza por el desprendimiento de las microsporófilas del eje central del estróbilo y la aparición de una curvatura del ápice, hasta que finalmente la estructura se seca. Este proceso dura un mes (fig. 2D).

Fenología reproductiva ovulífera. La fase E ocurre principalmente entre agosto y septiembre, aunque se registró la emergencia de algunos estróbilos en octubre. Durante estos meses el estróbilo aumenta hasta 3 cm por mes. El color de las estructuras es verde claro a verde amarillento, con tricomas negros (fig. 5A). El desarrollo continuará durante los meses siguientes, aunque en menor proporción.
La fase R tiene lugar de enero a marzo (fig. 3). El mayor registro se presentó en febrero y el menor en marzo. El color de las megasporófilas es verde oscuro con abundantes tricomas negruzcos en el extremo distal. Durante esta fase ocurre la polinización, por lo que hay una separación entre las megasporófilas (fig. 5B).
La fase OT inicia en marzo y finaliza en julio. Durante los primeros meses del desarrollo de los óvulos, el color de la sarcotesta se mantiene de color amarillo verdoso (figs. 4, 5C). Conforme pasan los meses la sarcotesta se vuelve opaca y el extremo distal de las megasporófilas puede tornarse café. Por su parte, la fase D ocurre de agosto a octubre, y se caracteriza por el desprendimiento de las megasporófilas y los óvulos del eje central del estróbilo (fig. 5D).

Considerando la fase de liberación de polen del estróbilo polinífero y la receptividad del estróbilo ovulífero, la sincronía reproductiva entre plantas poliníferas y ovulíferas a nivel poblacional es parcial. Dicha congruencia entre las ontogenias de los 2 sexos ocurre de enero a marzo, teniendo como punto máximo febrero. Sin embargo, la producción de polen continúa hasta julio, cuando ya no hay plantas ovulíferas receptivas (fig. 4).
Epifitismo. Durante el trabajo de campo realizado en las poblaciones del centro de Veracruz, se encontraron varios individuos de Ceratozamia tenuis habitando sobre árboles (fig. 6). En total se registraron 2 individuos adultos no reproductivos, 4 juveniles, 5 plántulas y 8 semillas germinando. Estos individuos se localizan en los microhábitats que se encuentran entre las ramas intermedias (primera ramificación) y el dosel de los árboles más viejos (particularmente sobre Quercus spp.). En estos espacios se acumula materia orgánica (restos de hojas secas) y se favorece el asentamiento de monocotiledóneas como orquídeas y bromelias, entre otros tipos de angiospermas.
Todos los individuos juveniles y adultos fueron registrados a una altura de 1 – 2.5 m desde la base del árbol; las semillas y plántulas entre 1 – 1.5 m de altura. Los individuos adultos no muestran evidencia de daño en las estructuras vegetativas; por el contrario, presentan abundantes hojas de hasta 1.70 m de largo. Además, todos los individuos registran presencia de numerosas raíces coraloides (fig. 6E, F).
La raíz principal de los individuos está adherida al tallo y no muestra evidencia de crecimiento más allá del sitio de germinación y establecimiento de la planta, sobre las horquillas de los hospederos pertenecientes al género Quercus. Por otro lado, los tallos de dichos hospederos no presentaron daño. En algunos casos, se registró competencia con otras especies de plantas como son Tillandsia schiedeana Steud., Tillandsia imperialis E. Morren ex Mez, Peperomia obtusifolia (L.) A. Dietr., Isochilus linearis (Jacq.) R. Br., Dichaea sp., y Polypodium sp. Por otra parte, las raíces coraloides se observaron en la circunferencia del tallo del individuo (fig. 6E); patrón que también se presenta en las plántulas. Finalmente, se registraron semillas viables sin germinar y en proceso de germinación sobre ramas de los árboles.

Discusión
Los nombres de las especies son la base del conocimiento que se ha generado a través del tiempo sobre un determinado organismo; sin embargo, estos identificadores no son permanentes y cambian a través del tiempo (Franz y Peet, 2009; Knapp et al., 2004). Las diferentes formas en que se aborda la evidencia o la integración de fuentes de evidencia pueden modificar una hipótesis de especie. En algunos casos, como en Ceratozamia tenuis, especie de reciente descripción pero con una larga historia de investigación, es de vital importancia conocer los cambios en sus conceptos taxonómico nomenclaturales en el espacio y tiempo para preservar la información indispensable para subsecuentes aplicaciones.
Por otra parte, el estudio de los ciclos de vida también son útiles en investigaciones desde puntos de vista aplicados; por ejemplo, para comprender los efectos del cambio climático e incluso para plantear estrategias de conservación adecuadas a las características de un grupo biológico (Wang et al., 2016). En general, nuestras observaciones en Ceratozamia tenuis muestran una estacionalidad marcada para las plantas ovulíferas en la fase de receptividad (fig. 4). En contraste, las plantas poliníferas no presentan la misma estacionalidad, por lo cual, no existe sincronía entre plantas poliníferas de la especie ni entre plantas poliníferas y ovulíferas, con excepción de un corto período en el cual ocurre la polinización (Nicolalde-Morejón et al., 2014; Norstog y Nicholls, 1997; figs. 4, 5).
Lo anterior plantea nuevas interrogantes sobre la dinámica poblacional de las especies en el género Ceratozamia. La mayoría de las plantas poliníferas liberan el polen durante el corto período en que las plantas ovulíferas están receptivas. A partir de este evento el número de estróbilos poliníferos desciende de manera progresiva, pero la maduración se mantiene y continúa durante 4 meses más, cuando no hay plantas ovulíferas receptivas para que ocurra la polinización, ya que durante estos meses todas las plantas ovulíferas están en la fase de fecundación (fig. 4). En este contexto, la liberación de polen de las plantas poliníferas terminó primero durante abril en Tlachinola, la población más pequeña, mientras que en la población de Chirimoyo prosiguió hasta julio. Debe notarse que este evento no inició en el mismo mes (en Chirimoyo, el polen se liberó en febrero). Este evento podría estar relacionado con el ciclo de vida de los insectos polinizadores con los cuales estas cícadas mantienen una estrecha relación evolutiva (Peñalver et al., 2012; Suinyuy et al., 2016).
El epifitismo en el orden Cycadales solo ha sido reportado para el género Zamia, en una especie endémica de Panamá (Zamia pseudoparasitica Yates in Seem). Esta especie es hemiepífita obligada y se encuentra hasta los 20 m de altura, cubierta por el dosel de los árboles que le sirven de soporte; posee una raíz pivotante muy larga de hasta 30 m de longitud que llega al suelo (Stevenson, 1993; Taylor et al., 2008). En contraste, en Ceratozamia tenuis, no se encontró evidencia de continuidad del crecimiento de la raíz principal. Sin embargo, la asociación simbiótica de las raíces con una alta diversidad de cianobacterias fijadoras de nitrógeno (Grobbelaar et al., 1987; Norstog y Nicholls, 1997; Zheng et al., 2002) podrían ser las responsables de que habiten en suelos pobres y afloramientos rocosos. Por tanto, estas raíces coraloides podrían representar una ventaja evolutiva que permite a las plantas de esta especie desarrollarse sobre los árboles.
En Zamia pseudoparasitica las raíces coraloides se producen en grupos densos hemiesféricos de 5-10 cm de ancho (Stevenson, 1993). Este patrón también se encontró en aquellos individuos de Ceratozamia tenuis encontrados sobre los árboles, cuyas raíces coraloides forman grupos densos distribuidos en toda la circunferencia del tallo (fig. 6). Todos los individuos adultos registrados no han alcanzado la edad reproductiva (i.e., no hay evidencia de producción de estructuras reproductivas), por lo cual aún se desconoce si los nutrientes obtenidos son suficientes para que dichas plantas puedan alcanzar esta etapa ontogenética.
Este epifitismo accidental es evidencia de los mecanismos de dispersión existentes en el género Ceratozamia. Particularmente, la dispersión es uno de los aspectos menos estudiados en las cícadas en general (Ballardie y Whelan, 1986; Burbidge y Whelan, 1982). Las semillas de las cícadas poseen sustancias tóxicas como la cicasina (Moretti et al., 1983), lo cual constituye un impedimento para su dispersión por la fauna. No obstante, se ha reportado dispersión de semillas de Dioon edule Lindl. por el roedor Peromyscus mexicanus Saussure (González-Christen, 1990) y, ardillas (Scirius spp.) y urracas (Calocitta formosa Swaincson) en D. holmgrenii De Luca, Sabato & Vázq. Torres (Velasco-García et al., 2016). Por otra parte, en Zamia pumila L. y Z. furfuracea L. f. se ha reportado intervención de cenzontles (Mimus polyglottos L.) (Eckenwalder, 1980).
En Ceratozamia, como en otros géneros de cícadas, la gravedad es la forma de dispersión más conocida. Sin embargo, en Ceratozamia matudae Lundell y C. mirandae Vovides, Pérez-Farr. & Iglesias, los pecarí́es (Pecari tajacu L.) son capaces de dispersar semillas (Pérez-Farrera y Vovides, 2004; Pérez-Farrera et al., 2000, 2006). Durante nuestro trabajo de campo registramos semillas sin depredación aparente en diversas partes de los árboles (horquetas, hojarasca acumulada) y en madrigueras de roedores. Además, se encontró evidencia de depredación en la cubierta externa de las semillas que aún se encontraban cerca de la planta madre. El mucílago que protege a la semilla después de la liberación del estróbilo ovulífero en especies de Ceratozamia favorece la dispersión por los animales (Hall y Walter, 2013; Yang et al., 2012). En las áreas monitoreadas se registraron abundantes ardillas y roedores los cuales podrían ser dispersores de las semillas en esta región.
Finalmente, integrar la información taxonómica, fenológica y ecológica de las especies en Ceratozamia podría tener implicaciones en el planteamiento de estrategias de conservación (Krishnamurthy et al., 2013). Es interesante considerar que si la producción diferencial de estróbilos poliníferos está relacionada con la dinámica poblacional de insectos polinizadores que pasan su ciclo de vida en las estructuras reproductivas poliníferas, las estrategias de conservación deberían considerar un programa para preservar pequeños parches de vegetación interconectados y así mantener la viabilidad de la especie, en lugar de conservar relictos de vegetación aislados.
Agradecimientos
Este trabajo fue auspiciado por el Consejo Nacional de Ciencia y Tecnología (Conacyt) bajo el proyecto Núm. 134960 y por el Instituto de Investigaciones Biológicas de la Universidad Veracruzana. La primera autora agradece al Conacyt por la beca de posgrado Núm. 291047 (Ecología Tropical). Los autores agradecen especialmente a Héctor Hernández por permitir el acceso al Rancho El Chirimoyo y a los habitantes del municipio de Coacoatzintla por facilitar el acceso a los sitios de muestreo. Finalmente, agradecemos a los revisores anónimos por las críticas constructivas.
Referencias
Ballardie, R. T. y Whelan, R. J. (1986). Masting, seed dispersal and seed predation in the cycad Macrozamia communis. Oecologia, 70, 100–105.
Berendsohn, W. G. (1995). The concept of ‘potential taxa’ in databases. Taxon, 44, 207–212.
Brongniart, A. T. (1846). Note sur un nouveau genre de Cycadées du Mexique. Annales des Science Naturelles, 5, 5–10.
Burbidge, A. H. y Whelan, R. J. (1982). Seed dispersal in a cycad, Macrozamia riedlei. Austral Ecology, 7, 63–67.
Chamberlain, C. J. (1912). Morphology of Ceratozamia. Botanical Gazette, 531, 1–19.
Clugston, J. A. R., Griffith, M. P., Kenicer, G. J., Husby, C. E., Calonje, M. A., Stevenson, D. W. et al. (2016). Zamia (Zamiaceae) phenology in a phylogenetic context: does in situ reproductive timing correlate with ancestry? Edinburgh Journal of Botany, 73, 345–370.
Deans, A. R., Yoder, M. J. y Balhoff, J. P. (2012). Time to change how we describe biodiversity. Trends in Ecology and Evolution, 27, 78–84.
Eckenwalder, J. E. (1980). Dispersal of the West Indian cycad, Zamia pumila L. Biotropica, 12, 79–80.
ESRI (Environmental Systems Research Institute). (2011). ArcGIS Desktop: Release 10. Redlands, CA.
Franz, N. M. y Cardona-Duque, J. (2013). Description of two new species and phylogenetic reassessment of Perelleschus O’Brien & Wibmer, 1986 (Coleoptera: Curculionidae), with a complete taxonomic concept history of Perelleschus sec. Franz & Cardona-Duque, 2013. Systematics and Biodiversity, 11, 209–236.
Franz, N. M. y Peet, R. K. (2009). Towards a language for mapping relationships among taxonomic concepts. Systematics and Biodiversity, 7, 5–20.
González, D. y Vovides, A. P. (2012). A modification to the SCAR (Sequence Characterized Amplified Region) method provides phylogenetic insights within Ceratozamia (Zamiaceae). Revista Mexicana de Biodiversidad, 83, 929–938.
González-Christen, A. (1990). Algunas interacciones entre Dioon edule (Zamiaceae) y Peromyscus mexicanus (Rodentia: Cricentidae). La Ciencia y el Hombre, 5, 77–92.
Grobbelaar, N., Scott, W. E., Hattingh, W. E. y Marshall, J. (1987). The identification of the coralloid root endophytes of the southern African cycads and the ability of the isolates to fix nitrogen. South African Journal of Botany, 53, 111–118.
Hall, J. A. y Walter, G. H. (2013). Seed dispersal of the Australian cycad Macrozamia miquelii (Zamiaceae): Are cycads megafauna-dispersed “grove forming” plants? American Journal of Botany, 100, 1127–1136.
Knapp, S., Lamas, G., Lughadha, E. N. y Novarino, G. (2004). Stability or stasis in the names of organisms: the evolving codes of nomenclature. Philosophical Transactions of the Royal Society B, 359, 611–622.
Krishnamurthy, V., Mandle, L., Ticktin, T., Saneesh, C. S. y Varghese, A. (2013). Conservation status and effects of harvest on an endemic multi-purpose cycad, Cycas circinalis L., Western Ghats, India. Tropical Ecology, 54, 309–320.
Medina-Villarreal, A. y González-Astorga, J. (2016). Morphometric and geographical variation in the Ceratozamia mexicana Brongn. (Zamiaceae) complex: evolutionary and taxonomic implications. Biological Journal of the Linnean Society, 119, 213–233.
Miquel, F. A. W. (1847). Over eenige nieuwe of zeldame Cycadeen in den Hortus Botanicus te Amsterdam. Eerste gedeelte. Tijschr. Wissen natuurk. Wet., 1, 33–43.
Miquel, F. A. W. (1848). Over eenige nieuwe of zeldame Cycadeen in den Hortus Botanicus te Amsterdam. Derde gedeelte. Tijschr. Wissen natuurk. Wet., 1, 197–208.
Miquel, F. A. W. (1868). Nouveaux materiaux pour servir ala connaissance des Cycadees. Cinquieme parties. Archives Neerlandaises des Sciences Exactes et Naturelles, 3, 403–427.
Miquel, F. A. W. (1869). Nouveaux materiaux pour servir ala connaissance des Cycadees. Cinqyieme partie. Adansonia, 9, 169–180.
Moretti, A., Sabato, S. y Gigliano, S. (1983). Taxonomic significance of methylazoxymethanol glycosides in the cycads. Phytochemistry, 22, 115–117.
Nicolalde-Morejón, F., González-Astorga, J., Vergara-Silva, G., Stevenson, D. W., Rojas-Soto, O. y Medina-Villarreal, A. (2014). Biodiversidad de Zamiaceae en México. Revista Mexicana de Biodiversidad, 85 (Suplem.), S114–S125.
Norstog, K. J. y Nicholls, T. J. (1997). The biology of the cycads. Cornell University Press, Ithaca.
Patterson, D. J., Cooper, J., Kirk, P. M., Pyle, R. L. y Remsen, D. P. (2010). Names are key to the big new biology. Trends in Ecology and Evolution, 25, 686–691.
Peñalver, E., Labandeira, C. C., Barrón, E., Delclòs, X., Nel, P., Nel, A. et al. (2012). Thrips pollination of Mesozoic gymnosperms. Proceedings of the National Academy of Sciences of the United States of America, 109, 8623–8628.
Pérez-Farrera, M. A., Quintana-Ascencio, P. F., Salvatierra-Izaba, B. y Vovides, A. P. (2000). Population dynamics of Ceratozamia matudai (Zamiacae) in El Triunfo Biosfere Reserve, Chiapas, México. Journal of the Torrey Botanical Society, 127, 291–299.
Pérez-Farrera, M. A. y Vovides, A. P. (2004). Spatial distribution, population structure, and fecundity of Ceratozamia mirandae Lundell (Zamiaceae) in El Triunfo Biosfere Reserve, Chiapas, Mexico. Botanical Review, 70, 299–311.
Pérez-Farrera, M. A., Vovides, A. P., Octavio-Aguilar, P., González-Astorga, J., De la Cruz-Rodríguez, J., Hernández-Jonapá, R. et al. (2006). Demography of the cycad Ceratozamia mirandae (Zamiaceae) under disturbed and undisturbed conditions in a biosphere reserve of Mexico. Plant Ecology, 187, 97–108.
Regel, E. (1876). Cycadearum generum specierumque revisio. Acta Horti Petropolitani, 4, 273–320.
Rivera-Fernández, A., Octavio-Aguilar, P., Sánchez-Coello, N. G., Sánchez-Velásquez, L. R., Vázquez-Torres, M. y Iglesias-Andreu, L. G. (2012). Estructura poblacional y distribución espacial de Ceratozamia mexicana Brongn. (Zamiaceae) en un ambiente conservado y en uno perturbado. Tropical and Subtropical Agroecosystems, 15, S110–S117.
Rzedowski, J. (1978). Vegetación de México. México D.F.: Limusa.
Sánchez-Tinoco, M. Y. y Engleman, E. M. (2004). Seed coat anatomy of Ceratozamia mexicana (Cycadales). The Botanical Review, 70, 24–38.
Schuster, J. (1932). Cycadaceae. En A. Engler (Ed.), Das Pflanzenreich 99 (IV. 1), 1–168.
Stevenson, D. W. (1981). Observations on ptyxis, phenology, and trichomes in the Cycadales and their systematic implications. American Journal of Botany, 68, 1104–1114.
Stevenson, D. W. (1993). The Zamiaceae in Panama with comments on phytogeography and species relationships. Brittonia, 45, 1–16.
Stevenson, D. W. y Sabato, S. (1986). Typification of names in Ceratozamia Brongn. Dion Lindl., and Microcycas A. D.C. (Zamiaceae). Taxon, 35, 578–584.
Suinyuy, T. N., Donaldson, J. S. y Johnson, S. D. (2016). Geographical matching of volatile signals and pollinator olfactory responses in a cycad brood-site mutualism. Proceedings of the Royal Society of London B, 282, 2015–2053.
Taylor, A. S., Mendieta, J., Bernal, R. y Silvera, G. (2008). A never-before-reported characteristic of Zamia pseudoparasitica. The Cycad Newsletter, 31, 8–9.
Thiselton-Dyer, W. T. (1884). Cycadaceae. Biologia Centrali-Americana, 3, 190–195.
Velasco-García, M. V., Valdez-Hernández, J. I., Ramírez-Herrera, C., Hernández-Hernández, M. L., López-Upton, J., López-Mata, L. et al. (2016). Estructura, heterogeneidad de estadios y patrón de dispersión espacial de Dioon holmgrenii (Zamiaceae). Botanical Sciences, 94, 75–87.
Vovides, A. P., González, D., Pérez-Farrera, M. A., Avendaño, S. y Bárcenas, C. (2004). A review of research on the cycad genus Ceratozamia Brongn. (Zamiaceae) in Mexico. Taxon, 53, 291–297.
Vovides, A. P., Pérez-Farrera, M. A. e Iglesias, C. (2010). Cycad propagation by rural nurseries in Mexico as an alternative conservation strategy: 20 years on. Kew Bulletin, 65, 603–611.
Vovides, A. P., Stevenson, D. W., Pérez-Farrera, M. A., López, S. y Avendaño, S. (2016). What is Ceratozamia mexicana Brongniart (Zamiaceae)? Botanical Sciences, 94, 419–429.
Vovides, A. P., Rees, J. D. y Vázquez-Torres, M. (1983). Flora de Veracruz. Zamiaceae. Fascículo 26. Xalapa: Instituto Nacional de Investigaciones sobre Recursos Bióticos.
Wang, C., Tang, Y. y Chen, J. (2016). Plant phenological synchrony increases under rapid within-spring warming. Scientific Reports, 6, 1–7.
Yang, X., Baskin, J. M., Baskin, C. C. y Huang, Z. (2012). More than just a coating: ecological importance, taxonomic occurrence and phylogenetic relationships of seed coat mucilage. Perspectives in Plant Ecology, Evolution and Systematics, 14, 434–442.
Zheng, W., Song, T., Bao, X., Bergman, B. y Rasmussen, U. (2002). High cyanobacterial diversity in coralloid roots of cycads revealed by PCR fingerprinting. Microbiology Ecology, 40, 215–222.