Cristina Nicté Vega-Flores y Verónica Farías-González *
Universidad Nacional Autónoma de México, Facultad de Estudios Superiores Iztacala, Unidad de Biología, Tecnología y Prototipos, Laboratorio de Recursos Naturales, Avenida de Los Barrios 1, Los Reyes Iztacala, 54090 Tlalnepantla de Baz, Estado de México, México
*Autor para correspondencia: veronicafarias2006@gmail.com (V. Farías-González)
Recibido: 10 julio 2020; aceptado: 8 diciembre 2020
Resumen
El puma (Puma concolor) coexiste con el gato montés (Lynx rufus) en la Reserva de la Biosfera Tehuacán-Cuicatlán (RBTC). El puma es el felino de mayor tamaño en el centro de México, por lo que su presencia es un indicador de integridad ecológica. Nuestro objetivo fue comparar la densidad de puma y de gato montés en una zona conservada dentro del área natural protegida. Colocamos 15 estaciones de fototrampeo a lo largo de la cima y de una cañada del cerro Tepetroja, en selva baja caducifolia. Para estimar la densidad poblacional utilizamos modelos de captura-recaptura y analizamos las imágenes del 1 de mayo de 2013 al 30 abril de 2017 con el programa MARK y la herramienta CAPTURE. Para el puma obtuvimos una densidad de 6.8 ± 2.0 ind/100 km2 en un área efectiva de muestreo (“effective trapping area”, ETA) de 70 km2 y un promedio de distancia máxima de desplazamiento (“mean maximum distance moved”, MMDM) de 2.46 ± 0.45 km. Para el gato montés, nuestra estimación de la densidad poblacional (15.4 ± 3.5 ind/100 km2 en ETA de 38 km2) y distancia de desplazamiento (MMDM = 1.76 ± 0.41 km) es la primera para el centro de México en vegetación nativa conservada. La abundancia de los pumas fue menor que la abundancia de los gatos monteses en la selva baja caducifolia de la reserva, por lo que inferimos que la densidad de los felinos silvestres está determinada por su tamaño corporal en un ecosistema que preserva su integridad ecológica.
Palabras clave: Abundancia; Felidae; Felino; Fototrampeo; Modelo de captura-recaptura; Selva baja caducifolia
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Puma (Puma concolor) and bobcat (Lynx rufus) density in Tehuacán-Cuicatlán Biosphere Reserve, Mexico
Abstract
Puma (Puma concolor) coexists with bobcat (Lynx rufus) in Tehuacán-Cuicatlán Biosphere Reserve (RBTC). Because P. concolor is the largest feline in central México, puma’s presence is an indicator of ecological integrity. Our objective was to compare puma and bobcat density in a conserved area within the reserve. We deployed 15 camera stations along the ridge and a dry riverbed in Mount Tepetroja in tropical dry forest. To estimate population density, we used capture-recapture models and analyzed images from 1 May 2013 to 30 April 2017 with MARK software and CAPTURE tool. For puma, we obtained a density of 6.8 ind/100 km2 in an effective trapping area (ETA) of 70 km2, and a mean maximum distance moved (MMDM) of 2.46 ± 0.45 km. For bobcat, our population density estimate (15.4 ind/100 km2 in ETA of 38 km2) and MMDM (1.76 ± 0.41 km) is the first for central Mexico in conserved native vegetation. Puma abundance was lower compared to bobcat abundance in the reserve’s tropical dry forest; therefore, we infer that the wild felids’ density is determined by their body size in an ecosystem with ecological integrity.
Key words: Abundance; Felidae; Felid; Photo-capture; Capture-recapture model; Tropical dry forest
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
Los grandes felinos en México sufren de persecución y aniquilamiento frecuente en lugares cercanos a asentamientos humanos como consecuencia de la cacería ilegal de fauna silvestre y de las afectaciones negativas sobre el ganado doméstico (Hoogesteijn et al., 2020; Lira-Torres y Briones-Salas, 2011; Rosas-Rosas et al., 2008). Los grandes felinos son depredadores alfa y componentes críticos para la funcionalidad de los ecosistemas, por lo que su ausencia se ha convertido en un problema y factor antagonista a la conservación de la biodiversidad (Estes et al., 2011; Sergio et al., 2005). Por lo tanto, la protección que se brinde a los depredadores alfa será altamente redituable en beneficios ecosistémicos porque su presencia previene la simplificación gradual de las redes tróficas y la consiguiente extinción de interacciones bióticas (Estes et al., 2011; Ripple et al., 2014). Por ejemplo, en áreas suburbanas del sur de California, USA, donde se extirpó al puma, se produjo la liberación de mesodepredadores como el coyote (Canis latrans), cánido que impuso mayor presión e incluso restringió la presencia de competidores intragremiales de menor talla como el gato montés y la zorra gris (Urocyon cinereoargenteus) con los que coexiste (Crooks, 2002; Farías et al., 2005; Fedriani et al., 2000). Como consecuencias ecológicas a la ausencia de pumas y gatos monteses los herbívoros aumentaron en abundancia y se redujeron las tasas de reclutamiento y de supervivencia de las especies vegetales (Crooks y Soulé, 1999).
La simplificación en la complejidad y funcionalidad de los ecosistemas puede ser desencadenada por la inadecuada atención a los conflictos entre humanos y depredadores alfa (Ripple et al., 2014; Sergio et al., 2005), lo que hace necesario monitorear y evaluar las tendencias poblaciones de los felinos silvestres, y para ello se requieren estimaciones de parámetros como la densidad (Ávila-Nájera et al., 2015; Crooks, 2002; De La Torre y Medellín, 2011; Rosas-Rosas y Bender, 2012). Además, estimar la densidad de felinos simpátricos ayuda a comprender las condiciones ecológicas que permiten su coexistencia y a evaluar de forma indirecta la calidad protectora del hábitat (Estes et al., 2011; Newby et al., 2013).
La densidad poblacional de los felinos está determinada en gran medida por la competencia y depredación intragremial (Donadio y Buskirk, 2006; Durant, 1998; Holt y Polis, 1997; Palomares y Caro, 1999). Los felinos grandes suelen ser dominantes en la competencia por interferencia, mientras que para coexistir los felinos de menor tamaño deben ser superiores en la competencia por explotación de los recursos compartidos (Holt y Polis, 1997; Simberloff y Dayan, 1991). En las interacciones asimétricas los felinos perdedores suelen ser aquellos de menor talla, y por ello evitan los encuentros agonísticos (Durant, 1998; Palomares y Caro, 1999; Persson, 1985).
La densidad de los felinos también está determinada por el tamaño de su ámbito hogareño, y los grandes felinos requieren áreas de actividad más extensas que los pequeños para obtener presas en abundancia y densidad suficiente, de manera que el tamaño del ámbito hogareño de la especie suele presentar una relación positiva y proporcional a su tamaño corporal y puede variar entre poblaciones y entre los individuos de acuerdo con los requerimientos fisiológicos y con la calidad y abundancia de los recursos (Harestad y Bunnel, 1979; Karanth et al., 2017). Cuando los recursos son abundantes el ámbito hogareño puede ser de menor tamaño en comparación a periodos o sitios donde los recursos son escasos y/o se encuentran espacialmente dispersos (Ferguson et al., 2009; Lindstedt et al., 1986).
El tamaño de las áreas naturales protegidas (ANP) se ha convertido en un factor determinante para la supervivencia de las poblaciones de felinos silvestres en países como México porque para dar protección a los mamíferos carnívoros de gran tamaño se requiere de territorios extensos con abundancia de presas nativas (De la Torre y Medellín, 2011; Estes et al., 2011; Newby et al., 2013). La Reserva de la Biosfera Tehuacán-Cuicatlán (RBTC) es una de las ANP más extensas de México, pertenece a la provincia florística del Valle de Tehuacán-Cuicatlán reconocida por su valiosa biodiversidad, elevado grado de endemismos y alta riqueza específica de mamíferos, y es una ANP potencialmente clave para la conservación de los felinos silvestres en el centro del país (Arriaga et al., 2000; Dávila et al., 2002; Rzedowski, 1978; Téllez-Valdés et al., 2010). La selva baja caducifolia es el tipo de vegetación con mayor extensión en la RBTC con el 38%, y el matorral xerófilo es el segundo en extensión con 25% (Dávila et al., 2002; Semarnat, 2013). En las ANP del centro de México, el conocimiento sobre la densidad de puma y gato montés es limitado, ya que solo se ha estimado en el Parque Natural Sierra de Nanchititla (PNSN), en la cuenca del río Balsas y en el Parque Nacional El Cimatario (PNC), Querétaro. En el PNSN se estimó la densidad de puma en 2.74 a 6.86 ind/100 km2 en selva baja caducifolia y en el PNC, la densidad de gato montés fue de 17 ind/100 km2 en una pequeña población que podría estar siendo diezmada por perros ferales (Canis lupus familiaris; López-González et al., 2015; Soria-Díaz et al., 2010).
En la selva baja caducifolia de la RBTC, el puma coexiste con al menos otros 3 felinos, de los cuales el gato montés es el segundo en tamaño corporal (Briones-Salas, 2000; Currier, 1983; Farías et al., 2015; Lariviere y Walton, 1997). La presencia de puma en la RBTC puede ser un indicador de la integridad en la complejidad del ecosistema debido a que los depredadores alfa pueden regular la densidad poblacional de sus presas y competidores intragremiales (Estes et al., 2011; Ripple et al., 2014; Soria-Díaz et al., 2017). Asimismo, la subsistencia de las poblaciones de grandes felinos en el Valle de Tehuacán-Cuicatlán está ligada a la abundancia en las poblaciones de sus presas principales, el venado cola blanca (Odocoileus virginianus) y el pecarí de collar (Pecari tajacu), que son de las especies con mayor abundancia relativa dentro de la reserva (Berruecos-Pérez, 2015; Cruz-Jácome et al., 2015; Estes et al., 2011; Ripple et al., 2014; Soria-Díaz et al., 2017).
El objetivo general de este trabajo fue estimar y comparar la densidad de puma (P. concolor) y de gato montés (L. rufus) en un ecosistema íntegro dentro de un área natural protegida. Nuestra primera hipótesis planteó que, si la densidad de las poblaciones de los felinos está relacionada al tamaño corporal, entonces el felino de mayor tamaño presentará menor densidad poblacional. La segunda hipótesis planteó que, si la densidad de las poblaciones de los felinos está determinada por sus interacciones interespecíficas, entonces el felino de mayor tamaño presentará mayor densidad poblacional.
Materiales y métodos
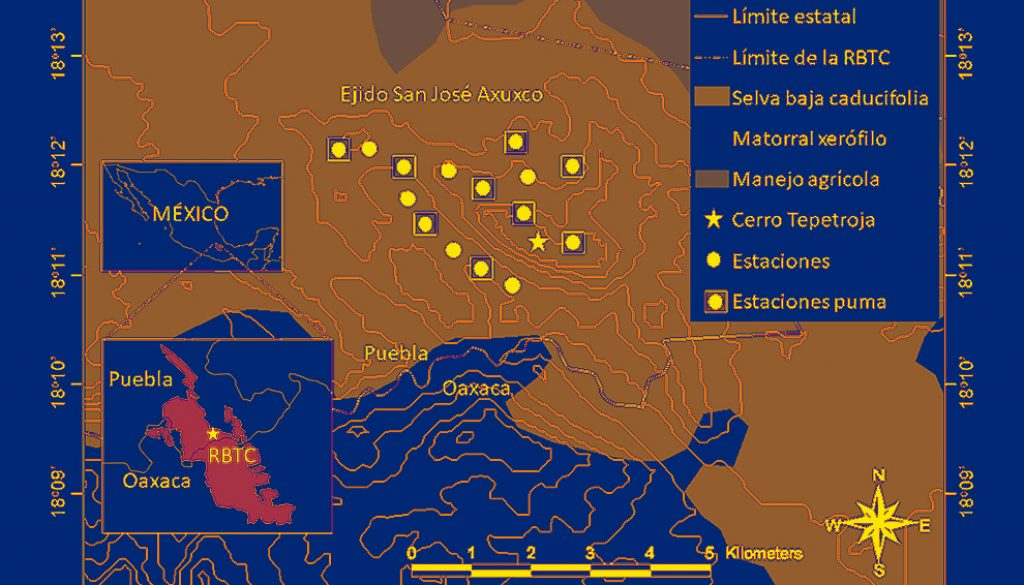
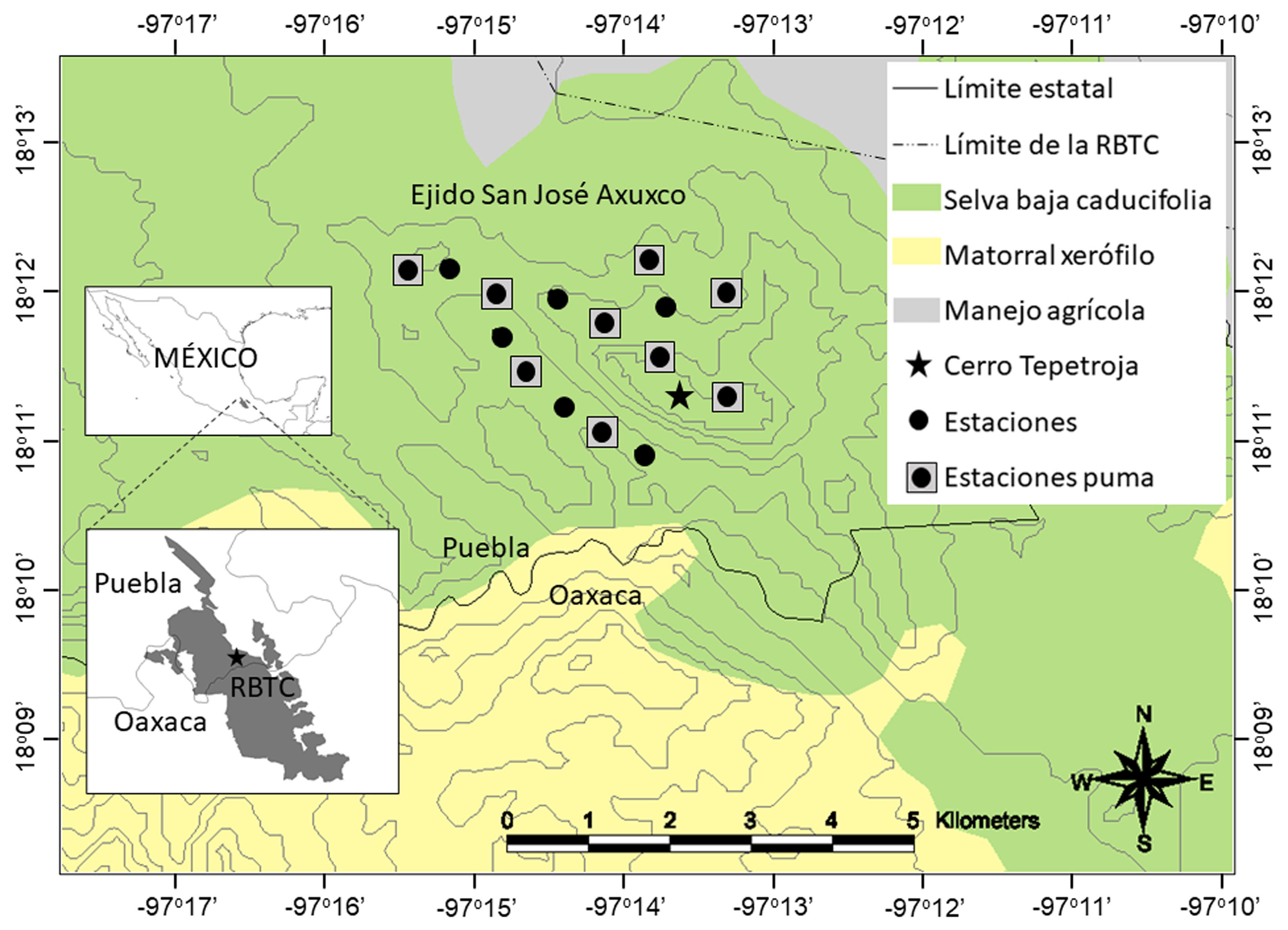
El área de estudio fue el ejido de San José Axuxco, municipio de San José Miahuatlán, Puebla, dentro de la RBTC y colindante con el estado de Oaxaca (fig. 1). El fototrampeo se llevó a cabo en el cerro Tepetroja con cima en las coordenadas geográficas 18º11’52.2” N, 97º12’26.3” O y altitud de 900 a 1,400 m snm. La vegetación en el cerro Tepetroja es selva baja caducifolia con cactáceas columnares de los géneros Cephalocereus, Myrtillocactus, Neobuxbaumia y Pachycereus como principales dominantes fisonómicos y árboles de copas extendidas y arbustos principalmente de los géneros Bursera, Castela, Ceiba, Ficus, Fouquieria, Parkinsonia y Ziziphus (Rzedowski, 1978; Valiente-Banuet et al., 2000). El clima es semiárido con lluvias en verano de mayo a octubre, precipitación promedio anual de 300 mm y temperatura media anual de 22 °C (Dávila et al., 2002).
Las unidades de muestreo fueron estaciones con 1 cámara trampa digital (LTL Acorn 6210, Little Acorn Outdoors, Green Bay, Wisconsin, USA) separadas por una distancia lineal de 500 m a lo largo de la cima y de una cañada del cerro Tepetroja, cubriendo un área de aprox. 6 km2 (fig.1). Las cámaras fueron programadas para operar las 24 horas del día y activarse mediante un sensor infrarrojo al detectar algún animal, y registrar una fotografía de 12 megapixeles y un video de 15 s de 1,080 megapixeles con un periodo de inactividad de 30 s entre cada detección, e imprimir el ID de la estación, la fecha y la hora de acuerdo al horario natural. No utilizamos el horario de verano (Farías-González y Vega-Flores, 2019). Las cámaras se colocaron en la intersección de 2 a 3 senderos de fauna silvestre donde se localizaron huellas o excrementos de mamíferos, se sujetaron a la base de cactáceas columnares a una altura de 20 a 40 cm del suelo, y no se utilizaron atrayentes ni cebos. Visitamos las estaciones cada 5 a 8 semanas para cambiar las baterías AA y las tarjetas de memoria digital de alta capacidad (SDHC) de 8 GB.
El periodo de muestreo analizado fue del 1 de mayo de 2013 al 30 de abril de 2017 y se consideró temporada de lluvia del 1 de mayo al 31 de octubre, y temporada seca del 1 de noviembre al 30 de abril. Entre 8 y 15 cámaras fueron funcionales y la variación se debió a que en 2013 iniciamos el fototrampeo con 8 cámaras y añadimos más estaciones en 2014; además, en ocasiones algunas cámaras dejaron de funcionar durante periodos cortos por fallas, agotamiento de las baterías, porque un becerro feral (Bos taurus) las tiró o alguna persona se las llevó (Farías-González y Vega-Flores, 2019).
El esfuerzo de muestreo se estimó sumando todos los días (1 día = 24 h) que cada cámara permaneció activa durante el periodo de muestreo y las unidades fueron los días-trampa, de manera que 1 día trampa representa 1 estación funcionando durante las 24 h de 1 día (Meek et al., 2014). Las especies de felinos se identificaron de acuerdo al manual de Aranda-Sánchez (2012). Para estimar la densidad del gato montés se analizó la información de las 15 estaciones de muestreo separadas por 500 m y para el puma se analizaron las fotocapturas de 9 estaciones separadas por 1 km (fig.1). La distancia lineal que debe separar a las estaciones de fototrampeo para el estudio de los mamíferos silvestres dependerá de la biología y del comportamiento de la especie estudiada, de la calidad del hábitat y de los objetivos de la investigación. Los diseños efectivos para obtener datos confiables sobre tendencias demográficas consisten en colocar las estaciones a una distancia que permita que al menos una cámara trampa esté incluida dentro del ámbito hogareño de los individuos residentes que habiten en las inmediaciones de cada estación de fototrampeo (Karanth, 1995; Gilbert et al., 2020). Por lo tanto, la distancia entre cámaras trampa fue elegida en base al tamaño mínimo reportado para el ámbito hogareño de los individuos de las especies bajo estudio. Para el puma el tamaño mínimo de ámbito hogareño, se reportó en 25 km2 para una hembra adulta en la Reserva de la Biosfera Chamela-Cuixmala y para el gato montés, en 0.99 km2 para una hembra adulta en el volcán de Colima (Burton et al., 2003; Karanth, 1995; Núñez-Pérez y Miller, 2019).
Obtuvimos fotocapturas de puma y gato montés, y también de jaguarundi (P. yagouaroundi) y margay (Leopardus wiedii) en el cerro Tepetroja; sin embargo, para este trabajo solo los individuos de puma y de gato montés pudieron ser diferenciados a nivel de individuo (Farías et al., 2015). No logramos diferenciar a los individuos de margay porque las fotocapturas fueron escasas (n = 26) y sin la nitidez suficiente para distinguir marcas particulares en las rosetas del pelaje del pequeño felino. Tampoco fue posible identificar a los individuos de jaguarundi debido a que las fotos fueron escasas (n = 11) y los individuos foto-capturados presentaron la fase oscura de pelaje (de Oliveira, 1998; Holbroock et al., 2012). Para la identificación de pumas y gatos monteses se comparó el tamaño corporal, la robustez y porte corporal, porte de la cola, la coloración y marcas del pelaje, la presencia o ausencia de testículos, y el patrón de manchas en rostro, orejas, patas y cola (Heilbrun et al., 2003; Kelly et al., 2008). Los individuos fueron identificados mediante análisis cruzado de opiniones donde las 2 autoras de este trabajo categorizaron las imágenes y posteriormente se llegó a un consenso (Kelly et al., 2008).
En el fototrampeo, las detecciones múltiples de individuos que no pueden ser distinguidos individualmente pueden tratarse de un individuo residente que repite sus incursiones en el área de detección de la cámara, o de varios individuos transeúntes (Gilbert et al., 2020). Debido a ésto, cuando no fue confiable la identificación individual de los felinos y para prevenir la pseudoreplicación de los registros utilizamos 1 registro por cámara por día por especie, con la excepción de aquellas fotografías y videos en los que se pudo identificar la presencia de 2 a 3 individuos diferentes, en cuyo caso se tomó como 1 registro independiente a cada individuo.
Utilizamos el modelo de captura-recaptura de una población cerrada para estimar el tamaño y densidad de la población a partir de los registros de individuos de puma y de gato montés que fue posible distinguir mediante sus marcas naturales y que contaron con al menos 1 recaptura (Heilbrun et al., 2003; Karanth y Nichols, 1998; Kelly et al., 2008; Otis et al., 1978; Wilson y Anderson, 1985). Para crear las historias de captura-recaptura bajo el supuesto de simular el comportamiento de una población cerrada, se registró la presencia (1) o ausencia (0) diaria de cada individuo en 24 periodos de 2 meses, a partir de los registros del periodo de 4 años de muestreo, del 1 de mayo de 2013 al 30 de abril de 2017 (Karanth y Nichols, 1998; Kelly et al., 2008; Wilson y Anderson, 1985).
Las historias de captura-recaptura se analizaron con el programa MARK 8.2 (Cooch y White, 2016) y la herramienta CAPTURE (White et al., 1982), y el software seleccionó al modelo de heterogeneidad de captura (Mh) y/o al modelo nulo (M0) como los más apropiados para el conjunto de datos; es decir, aquel que se acercó más al valor de 1.0 de acuerdo al estimador de jackknife (Di Bitteti et al., 2006; White et al., 1982). Consideramos congruente la selección del modelo de heterogeneidad de captura (Mh) debido a que permite una probabilidad de captura diferente para cada individuo y es el modelo que mejor se ajusta al comportamiento de los felinos debido a que el tamaño de su área de actividad está relacionado con el sexo de los individuos y con la defensa de los territorios (Karanth y Nichols, 1998). Asimismo, la selección del modelo nulo (M0) también fue congruente debido a que asume que no hay diferencia en la probabilidad de captura entre ocasiones de muestreo.
Para estimar la densidad absoluta de la población, dividimos el valor de la abundancia entre el área efectiva de muestreo (“effective trapping área”, ETA), la cual se definió como el área ocupada por el conjunto de cámaras trampa y un área buffer que rodeó al polígono que incluyó a las cámaras trampa (Di Bitteti et al., 2006; Wilson y Anderson, 1985). El radio del área buffer representa el radio de captura, que es la distancia que debe existir entre una trampa y un animal para que exista la probabilidad de que el animal caiga en la trampa (Wilson y Anderson, 1985). Realizamos 2 estimaciones para el radio del buffer a partir del promedio de la distancia máxima de desplazamiento (“mean maximum distance moved”, MMDM) y de su valor medio (½ MMDM) con fines comparativos ya que no existe consenso para determinar cuál de las 2 estimaciones es la más apropiada (MMDM vs. ½ MMDM); sin embargo, las investigaciones previas concuerdan en que a mayor tamaño del radio del buffer, aumenta el ETA y la densidad poblacional disminuye (Di Bitteti et al., 2006; Kelly et al., 2008; Sharma et al., 2010; Tobler y Powell, 2013; Wilson y Anderson, 1985).
Para cada individuo recapturado se midió la distancia máxima de desplazamiento; es decir, la distancia lineal máxima recorrida por el individuo entre 2 cámaras trampa donde se capturó-recapturó y luego se estimó el promedio (MMDM) para todos los individuos recapturados (Karanth y Nichols, 1998; Wilson y Anderson, 1985). En teoría, MMDM es una aproximación al diámetro del ámbito hogareño y ½ MMDM al radio del ámbito hogareño, por lo que se agrega una franja límite (W) equivalente al diámetro promedio del ámbito hogareño, o a su mitad, como perímetro del conjunto de trampas para compensar el efecto de borde (Di Bitteti et al., 2006; Wilson y Anderson, 1985).
Para calcular el ETA, proyectamos los valores de MMDM y ½ MMDM en un mapa como el diámetro y radio de círculos cuyo centro fue cada estación de muestreo, con el sistema de información geográfica ArcMap GIS versión 10.3 (ESRI® (Environmental Systems Research Institute), Redlands, California, USA). Se fusionaron los 15 círculos en un solo polígono y se estimó el área del polígono con el conjunto de cámaras trampa y su buffer, mismo que definió el ETA en km2 (Di Bitteti et al., 2006; Kelly et al., 2008). Para la discusión de nuestros resultados, consideramos las estimaciones de la densidad poblacional de pumas y gatos monteses basadas en MMDM, y por lo tanto, con un ETA de mayor tamaño para prevenir una sobreestimación de la densidad poblacional (Di Bitteti et al., 2006; Kelly et al., 2008; Sharma et al., 2010; Tobler y Powell, 2013).
Resultados
Para el puma se logró un esfuerzo de muestreo de 9,046 días-trampa y para el gato montés de 15,980 días-trampa, y se obtuvieron 62 registros de puma y 119 de gato montés. Las fotocapturas de puma consistieron en registros de individuos solitarios, registros con 2 a 3 individuos en la misma fotografía y/o video, y registros donde se pudo identificar a 1 hembra adulta con 1 a 2 cachorros. Identificamos a nivel de individuo a 7 pumas, de los cuales 3 fueron hembras y 3 machos, con 39 recapturas a lo largo de los 4 años de estudio, y un individuo cachorro del que no pudimos identificar el sexo y no obtuvimos recapturas. Los pumas pudieron ser identificados por sus características morfológicas generales, sumadas a la información complementaria que brindó la presencia de los otros individuos en los registros. Para el gato montés, todas las fotocapturas fueron de individuos solitarios. Identificamos 26 ejemplares de acuerdo a las marcas de su costado derecho y de la cara interior de las patas izquierdas y 21 ejemplares de acuerdo a las marcas de su costado izquierdo y de la cara interior de las patas derechas (Heilbrun et al., 2003; Kelly et al., 2008; Vega-Flores, 2019). Ya que no fue posible diferenciar a todos los gatos monteses por ambos costados el análisis se limitó a un solo costado y utilizamos los registros de los 26 gatos monteses identificados en base a su costado derecho, los cuales contaron con 35 recapturas a lo largo de los 4 años de estudio (Foster y Harmsen, 2012; Vega-Flores, 2019).
De los 24 periodos de 2 meses analizados, solo obtuvimos historias de captura-recaptura en 4 periodos para 5 pumas (3 hembras y 2 machos) y también en 4 periodos para 15 gatos monteses (tabla 1). La abundancia entre periodos varió para el puma de 3 a 9 individuos y para el gato montés de 3 a 8 individuos en el cerro Tepetroja, la probabilidad de captura fue similar para las 2 especies de felinos y el periodo con mayor abundancia para ambos felinos fue may-jun de 2015 en la temporada de lluvia (tabla 1).
La puma hembra Pc-01, madre de 2 cachorros nacidos en 2013, recorrió la mayor distancia (3.35 km) entre 2 cámaras trampa durante el periodo ene-feb 2014 y también fue capturada-recapturada en el periodo may-jun 2015. Pc-01 apareció fotografiada en el mayor número de cámaras en comparación con los otros pumas. No obtuvimos distancia de desplazamiento para pumas machos porque los 2 individuos con historias de captura-recaptura fueron recapturados en la misma cámara trampa. Por lo tanto, para las pumas hembras el MMDM fue de 2.46 km (tabla 2). Para los gatos monteses, solo un individuo, Lr-09 fue recapturado en una cámara trampa diferente a donde fue capturado por primera vez, por lo que únicamente obtuvimos el valor de la distancia máxima de desplazamiento de 1.73 km para Lr-09 en el periodo may-jun 2015. Lr-09 fue recapturado también en el periodo jul-ago 2014, pero en la misma cámara trampa. Para obtener la MMDM de los gatos monteses, decidimos realizar de nuevo el análisis tomando la distancia máxima de desplazamiento sin cumplir el supuesto del modelo de población cerrada; es decir, quitamos la restricción de 2 meses para crear las historias de captura-recaptura (Otis et al., 1978; Tobler y Powell, 2013). De esta manera, analizamos la información de 5 individuos que fueron recapturados en más de una estación y de los cuales el gato montés Lr-06 recorrió la mayor distancia de desplazamiento con un valor de 2.86 km. El gato montés Lr-09 apareció en el mayor número de estaciones en comparación con los otros gatos monteses y su distancia máxima de desplazamiento en este segundo análisis fue de 1.85 km. Para los 5 gatos monteses, la MMDM fue de 1.76 km (tabla 2). Las estimaciones de distancia máxima de desplazamiento del primer y segundo análisis fueron muy parecidas (1 gato con 1.73 km vs. 5 gatos con 1.76 ± 0.41 km), por lo que optamos por utilizar, para la estimación de la densidad absoluta, el valor resultado del primer análisis, aun cuando fue calculado a partir de un solo individuo para respetar el supuesto de la población cerrada (Karanth y Nichols, 1998; Tobler y Powell, 2013).
El ETA para el puma se estimó en 70.1 km2 cuando utilizamos el valor de MMDM = 2.46 km y en 30.4 km2 con ½ MMDM; mientras que para al gato montés el ETA fue de 37.5 km2 con MMDM = 1.73 km y 16.2 km2 con ½ MMDM.
El promedio de la densidad absoluta estimada para el puma fue de 6.8 ± 2.0 ind/100 km2 con MMDM y 15.7 ± 4.7 ind/100 km2 con ½ MMDM. Para el gato montés, el promedio de la densidad absoluta fue de 15.4 ± 3.5 ind/100 km2 con MMDM y de 35.4 ± 8.1 ind/100 km2 con ½ MMDM (tabla 3). Elegimos los valores de densidad basados en MMDM debido a que fueron más congruentes que los valores basados en ½ MMDM y para evitar la sobreestimación de la densidad poblacional (Di Bitteti et al., 2006; Kelly et al., 2008; Tobler y Powell, 2013).
Discusión
Nuestras estimaciones de densidad absoluta para el puma (6.8 ind/100 km2) y para el gato montés (15.4 ind/100 km2) en el cerro Tepetroja, en la RBTC, concordaron con nuestra primera hipótesis donde se planteó que el puma tendría menor densidad poblacional que el gato montés. Inferimos que las interacciones interespecíficas entre los 2 felinos y/o la densidad del puma, no incidieron negativamente sobre la abundancia de gato montés en nuestra área de estudio.
Las estimaciones de MMDM para pumas y gatos monteses en el cerro Tepetroja fueron acordes a la relación positiva esperada entre tamaño corporal y área de actividad en mamíferos; es decir, que el puma, por ser el felino más grande, presentó un MMDM mayor en comparación con el gato montés en el cerro Tepetroja, RBTC (Harestad y Bunnel, 1979; Lindstedt et al., 1986). Asimismo, nuestros resultados fueron congruentes con estudios previos sobre distancias de desplazamiento y áreas de actividad de los felinos. La MMDM de 2.46 + 0.45 km calculada para pumas en nuestro estudio fue similar a las estimaciones publicadas para el centro de México, en el Parque Natural Sierra de Nanchititla (674 km2), donde la distancia máxima de desplazamiento para 8 pumas varió de 2.4 a 3.6 km en selva baja caducifolia (Soria-Díaz et al., 2010). En la Reserva de la Biosfera Chamela-Cuixmala (RBCC, 131 km2), Jalisco, mediante radio-telemetría, se estimó el promedio de la distancia de desplazamiento diario de pumas machos en 2.14 ± 1.4 km durante la temporada seca (feb-may) y en 2.90 ± 1.7 km durante la temporada de lluvia (jun-nov) y el tamaño del ámbito hogareño fue estimado para las hembras de 25 a 60 km2 y para los machos de 67 a 97 km2 (Núñez-Pérez y Miller, 2019). En la RBCC, jaguares, pumas y ocelotes (Leopardus pardalis) coexisten en selva baja caducifolia y existe evidencia de la presencia de gato montés (López-González et al., 1998; Núñez-Pérez y Miller, 2019). Para el gato montés no encontramos información sobre estimaciones previas de la distancia de desplazamiento en el centro de México, lo que convierte a nuestra estimación (MMDM = 1.76 ± 0.41 km) en la primera. Sin embargo, en la Reserva de la Biosfera Mapimí, en el desierto Chihuahuense, se estimó la distancia diaria de desplazamiento en 4.9 + 0.7 km y el ámbito hogareño en 25.9 + 3.7 km2 para 4 hembras y 4 machos equipados con collares GPS de telemetría (Elizalde-Arellano et al., 2012). El desierto Chihuahuense presenta un clima más árido y extremoso que la RBTC y la disponibilidad de recursos para los felinos es menor, lo que puede ocasionar que los gatos se vean en la necesidad de recorrer mayores distancias para encontrar su alimento, cobertura y refugio, en comparación con los félidos de la RBTC donde las presas son abundantes y la vegetación provee de cobertura densa (Berruecos-Pérez, 2015; Cruz-Jácome et al., 2015; Elizalde-Arellano et al., 2012).
Tabla 1
Abundancia de puma (Puma concolor) y gato montés (Lynx rufus) en el cerro Tepetroja, Reserva de la Biosfera Tehuacán-Cuicatlán, Puebla, estimada con modelos de captura-recaptura a partir de registros fotográficos.
|
Periodo |
Modelo* |
Probabilidad de captura |
Abundancia (Núm. de individuos) |
Error estándar |
Intervalo de confianza 95% |
|||
|
Mo |
Mh |
Mb |
Mt |
|||||
|
Puma concolor |
||||||||
|
Ene-feb 2014 |
0.91 |
1.0 |
0.47 |
0 |
0.02 |
3 |
1.7 |
3 a 12 |
|
Nov-dic 2014 |
1.0 |
0.85 |
0.40 |
0 |
0.02 |
3 |
1.2 |
3 a 11 |
|
Ene-feb 2015 |
0.92 |
1.0 |
0.70 |
0 |
0.02 |
4 |
3.6 |
4 a 22 |
|
May-jun 2015 |
0.72 |
1.0 |
0.82 |
0.08 |
0.01 |
9 |
11.9 |
5 a 78 |
|
Lynx rufus |
||||||||
|
May-jun 2013 |
1.0 |
0.89 |
0.47 |
0 |
0.01 |
8 |
6.1 |
5 a 37 |
|
Jul-ago 2014 |
0.69 |
1.0 |
0.90 |
0.20 |
0.02 |
3 |
1.5 |
3 a 10 |
|
Ene-feb 2015 |
0.70 |
1.0 |
0.88 |
0.20 |
0.02 |
4 |
2.6 |
4 a 22 |
|
May-jun 2015 |
1.0 |
0.98 |
0.59 |
0 |
0.02 |
8 |
3.6 |
7 a 27 |
*En cada periodo utilizamos el modelo más apropiado que fue el que se igualó a 1.0, de acuerdo al estimador de jackknife. M0 = Modelo nulo, Mh = modelo de heterogeneidad, Mb = modelo de comportamiento, Mt = modelo de ocasión de muestreo.
Tabla 2
Distancia máxima de desplazamiento del puma (Puma concolor) y del gato montés (Lynx rufus) en el cerro Tepetroja, Reserva de la Biosfera Tehuacán-Cuicatlán, Puebla, México.
|
Individuo |
Sexo |
Periodo |
Distancia máxima de desplazamiento (km) |
|
Puma concolor a |
|||
|
Pc-01 |
Hembra |
Ene-feb 2014 |
3.35 |
|
Pc-01 |
Hembra |
May-jun 2015 |
2.64 |
|
Pc-02 |
Hembra |
Ene-feb 2015 |
2.64 |
|
Pc-03 |
Hembra |
Nov-dic 2014 |
1.21 |
|
MMDM ± ES = 2.46 ± 0.45c |
|||
|
Lynx rufus a |
|||
|
Lr-09 |
Macho |
May-jun 2015 |
1.73 |
|
Lynx rufus b |
|||
|
Lr-02 |
No determinado |
May 2013-feb 2014 |
1.03 |
|
Lr-06 |
Macho |
Ago 2013-ene 2014 |
2.86 |
|
Lr-09 |
Macho |
Jul 2014-may 2015 |
1.85 |
|
Lr-14 |
Hembra |
Feb 2015-abr 2015 |
2.37 |
|
Lr-17 |
No determinado |
May 2015-sep 2016 |
0.68 |
|
MMDM ± ES = 1.76 ± 0.41c |
a Con cumplimiento del supuesto del modelo de captura-recaptura en una población cerrada. Los periodos de muestreo fueron de 2 meses. b Sin cumplimiento del supuesto del modelo de captura-recaptura en una población cerrada. c Promedio de la distancia máxima de desplazamiento ± error estándar.
Tabla 3
Densidad de puma (Puma concolor) y gato montés (Lynx rufus) en el cerro Tepetroja, Reserva de la Biosfera Tehuacán-Cuicatlán, Puebla, México.
|
Periodo |
Densidad (individuos/100 km2) |
|
|
Puma concolor a |
||
|
MMDM = 2.46 km |
½ MMDM = 1.23 km |
|
|
Ene-feb 2014 |
4.3 |
9.9 |
|
Nov-dic 2014 |
4.3 |
9.9 |
|
Ene-feb 2015 |
5.7 |
13.2 |
|
May-jun 2015 |
12.8 |
29.6 |
|
Promedio ± ES |
6.8 ± 2.0 |
15.7 ± 4.7 |
|
Lynx rufus b |
||
|
MMDM = 1.73 km |
½ MMDM = 0.86 km |
|
|
May-jun 2013 |
21.4 |
49.3 |
|
Jul-ago 2014 |
8.0 |
18.5 |
|
Ene-feb 2015 |
10.7 |
24.6 |
|
May-jun 2015 |
21.4 |
49.3 |
|
Promedio ± ES |
15.4 ± 3.5 |
35.4 ± 8.1 |
a Con cumplimiento del supuesto del modelo de captura-recaptura en una población cerrada. Los periodos de muestreo fueron de 2 meses. b Sin cumplimiento del supuesto del modelo de captura-recaptura en una población cerrada.
En contraste, en clima templado subhúmedo en la sierra Madre de Oaxaca, el ámbito hogareño de un gato montés macho, se estimó en 11.4 km2, mediante radio-telemetría, en bosques de pino y de pino-encino donde existe una mayor disponibilidad de presas y refugios en comparación con las zonas áridas (Monroy y Briones-Salas, 2012). También, en un estudio realizado en el estado de Colima, se obtuvo un ámbito hogareño de 5.60 km2 para un gato montés macho y de 0.99 km2 para una hembra en hábitat con zacatonal subalpino (Calamagrostis tolucensis) y herbáceas creciendo sobre los flujos de lava solidificados de la vertiente oeste del volcán de Colima, entre 3,100 y 3,200 m snm, donde los mamíferos pequeños fueron abundantes y la vegetación y las rocas volcánicas proporcionaron refugios y cobertura para el acecho de las presas (Burton et al., 2003).
La variación en el tamaño del ámbito hogareño del gato montés, estimada con diversos métodos, se comparó para 29 poblaciones a lo largo de su distribución geográfica (0.99 – 167.9 km2; Ferguson et al., 2009). Se encontró una relación inversa entre la productividad del ecosistema y el tamaño del ámbito hogareño, y los valores más pequeños fueron reportados para las poblaciones de México (Burton et al., 2003; Ferguson et al., 2009). Por lo tanto, la relación que existe entre el tamaño corporal de un mamífero, el tamaño de su ámbito hogareño y la disponibilidad de recursos, ha sido comprobada en las investigaciones sobre felinos silvestres (Ferguson et al., 2009; Grigione et al., 2002; Harestad y Bunnel, 1979; Karanth et al., 2017; Kelly et al., 2008; Powell, 2000).
También se ha demostrado que en ocasiones es posible que no exista correspondencia entre el tamaño de los individuos y el tamaño de su ámbito hogareño, pero es debido a factores como la edad, sexo y estado reproductivo, como el caso de hembras con crías pequeñas o machos que buscan establecer su ámbito hogareño o encontrar una pareja en estado receptivo (Grigione et al., 2002; Lindstedt et al., 1986).
Es importante mencionar que en nuestro estudio en la RBTC, la mayoría de los gatos monteses fueron recapturados en la misma estación de fototrampeo donde fueron capturados, en comparación con los pumas que fueron recapturados en diferentes estaciones y en las más distantes entre sí. Entre los pumas con historias de captura-recaptura pudimos monitorear a una madre y a sus 2 cachorros desde que comenzaron a acompañar a su madre hasta los 2 años de edad (Currier, 1983; Farías et al., 2015). La presencia de cachorros de puma menores de 4 meses de edad se registró en junio de 2013 (2 cachorros; Farías et al., 2015) y en abril de 2017 (1 cachorro), lo que también demostró que la población de pumas tiene potencial reproductivo.
En cuanto a los gatos monteses, la mayoría fueron capturados y recapturados en la misma cámara y 1 individuo macho (Lr-09) fue capturado-recapturado en 2 periodos diferentes y separados entre sí por 10 meses. Por lo tanto, nuestros resultados dieron sustento al supuesto de que monitoreamos individuos residentes, en su mayoría, que permanecieron en sus ámbitos hogareños a lo largo de nuestra investigación. Estos hechos también dieron soporte a nuestro planteamiento de que el área de actividad de los pumas en el cerro Tepetroja fue mayor en comparación con la de los gatos monteses, y por lo tanto, la distancia que empleamos para las estaciones de muestreo fue adecuada para las condiciones de nuestra área de estudio y sus poblaciones de felinos (500 m para gatos monteses y 1 km para pumas).
Al respecto, Soria-Díaz et al. (2010) demostraron que obtuvieron mejores estimaciones de la densidad de pumas con estaciones de fototrampeo separadas entre sí por una distancia de 1.6 km (2.7 – 6.9 ind/100 km2; ETA = 73 km2), en comparación con estaciones separadas por 4.6 km (1.2 ind/100 km2; ETA = 226 km2) y lo atribuyeron a que a mayor densidad de estaciones (0.13 vs. 0.03 estaciones/km2) se incrementó la probabilidad de capturar y recapturar a los pumas. Asimismo, sugirieron que la distancia excesiva entre las cámaras trampas (4.6 km) pudo haber ocasionado una subestimación de la densidad poblacional.
Las estimaciones de densidad fueron coherentes con el número de pumas y gatos monteses que logramos identificar a nivel de individuo en el cerro Tepetroja, RBTC, mediante la identificación de las características morfológicas de cada felino. De los pumas, logramos diferenciar a 7 individuos y la densidad estimada de la población fue de 6.8 ind/100 km2 (ETA = 70 km2); mientras que para gato montés, identificamos a 26 individuos y la densidad fue de 15.4 ind/100 km2 (ETA = 38 km2). De igual modo, la densidad de puma que estimamos para el cerro Tepetroja, RBTC fue comparable con 2 estudios previos en México (Ávila-Nájera et al., 2015; Soria-Díaz et al. 2010).
En el Parque Natural Sierra de Nanchititla (674 km2), en la cuenca del río Balsas, en el centro de México, la densidad de puma varió de 2.7 a 6.9 ind/100 km2 (ETA = 73 km2) en selva baja caducifolia (Soria-Díaz et al., 2010). En la Reserva Ecológica El Edén (REE, 31 km2), Quintana Roo, el puma coexistió con jaguar, ocelote, jaguarundi y margay en selva mediana subcaducifolia y acahuales, y su densidad varió de 1.8 a 4.3 ind/100 km2 (ETA = 277 – 467 km2; Ávila-Nájera et al., 2015). En la REE, también se estimó la densidad de ocelotes, felinos de tamaño corporal parecido a los gatos monteses (Aranda-Sánchez, 2012), entre 1.4 y 13.9 ind/100 km2 (ETA = 137 – 510 km2; Ávila-Nájera et al., 2015), misma que fue inferior a la densidad estimada para gatos monteses en nuestro trabajo en la RBTC.
En uno de los primeros estudios para estimar la densidad de felinos silvestres mediante el uso de cámaras trampa y modelos de captura-recaptura (Maffei et al., 2002), la densidad del puma se reportó en 3 ind/100 km2, y del ocelote en 41 ind/100 km2 en el ecotono Chaco-Chiquitanía, Parque Nacional El Chaco (PNEC), Bolivia. Kelly et al. (2008), también fueron pioneros al utilizar el fototrampeo para estimar la densidad del puma en el neotrópico y en el PNEC la densidad de puma varió de 5 a 8 ind/100 km2, mientras que en la Reserva de la Biosfera Yaobí, en el bosque del Atlántico, Argentina, la densidad estimada fue menor a 1 ind/100km2, y en la reserva Chiquibul, Belize, fue de 2.3 a 4.9 ind/100km2. De las 3 regiones analizadas por Kelly et al. (2008), es posible que el PNEC obtuviera la mayor densidad de pumas por tratarse de bosque seco subtropical, comparado con Yaobí, donde el clima es húmedo subtropical y con Chiquibul, que presentó bosque húmedo subtropical.
En contraste con el puma, las estimaciones de densidad poblacional del gato montés son escasas en hábitat nativo con integridad ecológica. Al sur de California, en el Área de Recreación Nacional Montañas de Santa Mónica, EUA, la densidad de gato montés fue estimada en 25 a 42 ind/100 km2 en vegetación mediterránea nativa, después de una epizootia por sarna del ácaro Notoedres cacti, que repercutió negativamente en el tamaño poblacional (Ruell et al., 2009). En el altiplano potosino-zacatecano, San Luis Potosí, México, se reportó una abundancia de 7 individuos en el cerro Peñón Blanco, con matorral crasicaule y bosques de encino, con la vegetación nativa deteriorada por actividades de ganadería y minería (Sánchez-González et al., 2018). En el Parque Nacional El Cimatario, Querétaro, se estimó la densidad de gato montés en 17 ind/100 km2 en vegetación nativa deteriorada (López-González et al., 2015). Nuestra estimación de densidad poblacional de gato montés es la primera para el centro de México en vegetación nativa conservada y dentro de una reserva natural donde está prohibida la cacería de fauna silvestre. La validez de las estimaciones de densidad poblacional mediante modelos de captura-recaptura dependerá de respetar los supuestos de la población cerrada demográficamente (sin nacimientos, sin muertes) y geográficamente (sin inmigración, sin emigración). En nuestros estudios respetamos los supuestos al analizar la información en periodos de 2 meses, así como utilizar un diseño de muestreo donde las estaciones estuvieron separadas por distancias menores al tamaño mínimo del ámbito hogareño y al elegir los valores de MMDM en la estimación del ETA, para evitar la sobreestimación en el número de individuos.
El puma y el gato montés son especies generalistas de origen neártico y por ello estos 2 felinos pueden estar mejor adaptados a climas semiáridos como el clima de la RBTC, donde las principales presas de los felinos, venados y pecaríes para los pumas y lepóridos para los gatos monteses, fueron los mamíferos registrados con mayor abundancia relativa (Berruecos-Pérez, 2015; Cruz-Jácome et al., 2015; Janecka et al., 2016; Johnson et al., 2006; Kelly et al., 2008). Además, el tamaño de la RBTC es de 1,453 km2 + 3,449 km2 de zona de amortiguamiento, que es muy superior al área de otras ANP en el centro de México donde se ha estudiado al puma y al gato montés (Semarnat, 2013).
En nuestro estudio, el gato montés presentó mayor densidad absoluta que el puma, por lo que los resultados sugirieron que las interacciones interespecíficas entre los felinos no ocurrieron en detrimento de la abundancia del gato montés en el cerro Tepetroja, RBTC. En México, los pumas (35 – 65 kg) tienen una masa corporal que puede ser muy superior a la de los gatos monteses (5 – 15 kg) y las presas que consumen son también diferentes en tamaño corporal, lo que facilita a los gatos monteses evitar interacciones directas con los pumas (Aranda-Sánchez, 2012; Currier, 1983; Hutchinson y MacArthur, 1959; Lariviere y Walton, 1997; Núñez-Pérez y Miller, 2019). De acuerdo con la teoría de depredación intragremial, el gato montés podría estar sujeto a un riesgo asimétrico frente al puma debido a que sería el deperdedor en las interacciones agonísticas y por ello, se vería obligado a superar al puma en la explotación de los recursos compartidos (Palomares y Caro, 1999; Persson, 1985; Polis et al., 1989).
Por ejemplo, Burton et al. (2003) reportaron que 1 de 2 gatos monteses machos que capturaron para su investigación en el volcán de Colima, fue hallado muerto a causa de un ataque de puma, pero se encontró el cadáver en una zona que era paso frecuente de los pumas y estaba desprovista de cobertura vegetal. En contraste, inferimos que en nuestra área de estudio en la RBTC los gatos monteses pueden evitar activamente la cercanía física con los pumas durante las horas del día en que ambos felinos están activos (Vega-Flores, 2019).
Una estrategia que los felinos subordinados realizan es aprovechar los recursos en sitios que los felinos dominantes visitan con poca frecuencia o los sitios alejados de los centros de actividad de las especies dominantes (Durant, 1998; Núñez-Pérez y Miller, 2019). Asimismo, los gatos monteses pueden evitar interacciones directas con los pumas debido a la gran diferencia entre el tamaño corporal de las presas de puma como el venado cola blanca y el pecarí de collar, y las presas de los gatos monteses, lepóridos principalmente y roedores, aves y pequeños reptiles (Aranda et al., 2002; Aranda y Sánchez-Cordero, 1996; Lariviere y Walton, 1997). Sin embargo, la mayoría de los encuentros agonísticos entre especies de mamíferos carnívoros ocurre durante la escasez de presas, en cuyo caso un gato montés elegiría arriesgarse a consumir los restos escondidos de alguna presa de puma, y el puma podría atacar al gato montés (Donadio y Bursik, 2006; Koehler y Hornocker, 1991).
La RBTC es una de las áreas más extensas y diversas de México, constituye un refugio para poblaciones de numerosas especies bajo amenaza y es el hábitat de felinos que necesitan territorios extensos para subsistir. La abundancia y diversidad de presas es fundamental para la coexistencia de varias especies de felinos silvestres (Karanth y Nichols, 1998; Karanth et al., 2017). En la selva baja caducifolia del centro de México, la abundancia de herbívoros grandes como el venado cola blanca y el pecarí de collar proveen de biomasa para satisfacer las demandas de los grandes felinos, y se complementa con la diversidad de presas como el armadillo (Dasypus novemcinctus), el coatí (Nasua narica), los lepóridos, los roedores, las aves y los reptiles que contribuyen a la diversificación de la dieta entre los felinos (Núñez-Pérez y Miller, 2019; Soria-Díaz et al., 2018). En la RBTC existe abundancia de presas grandes y diversidad de presas medianas y pequeñas que permiten la coexistencia de al menos 4 especies de felinos simpátricos (Berruecos-Pérez, 2015; Cruz-Jácome et al., 2015; Farías et al., 2015).
El puma es el felino de mayor talla corporal en el centro de México y como depredador alfa puede ejercer control sobre las poblaciones de herbívoros y mesocarnívoros (Núñez-Pérez y Miller, 2019; Soria-Díaz et al., 2017). La presencia del puma fue indicadora de la integridad ecológica en la selva baja caducifolia de la RBTC, que a su vez favoreció la abundancia y diversidad de presas que permitieron que el gato montés haya presentado mayor densidad que el puma.
Agradecimientos
Se agradece y reconoce la colaboración del ejido de San José Axuxco, municipio de San José Miahuatlán, Puebla. La Comisión Nacional de Áreas Naturales Protegidas (Conanp), a través de las autoridades de la RBTC, otorgó las facilidades y el permiso para realizar este estudio. La Comisión Nacional Forestal (Conafor) brindó apoyo a las autoridades civiles de San José Axuxco a través del pago de servicios ambientales para realizar recorridos de vigilancia. Agradecemos a 2 revisores anónimos por sus contribuciones para mejorar este manuscrito. Investigación realizada gracias al Programa UNAM-DGAPA-PAPIIT Proyecto IA200812 y UNAM-DGAPA-PAPIIT Proyecto IN221814.
Referencias
Aranda, M., Rosas, O., Ríos, J. J. y García, N. (2002). Análisis comparativo de la alimentación del gato montés (Lynx rufus) en dos diferentes ambientes de México. Acta Zoológica Mexicana (n. s.), 87, 99–109. https://www.redalyc.org/articulo.oa?id=57508707
Aranda, M. y Sanchez-Cordero, V. (1996). Prey spectra of jaguar (Panthera onca) and puma (Puma concolor) in tropical forest of Mexico. Studies on Neotropical Fauna and Environment, 31, 65–67. https://doi.org/10.1076/snfe.31.2.65.13334
Aranda-Sánchez, J. M. (2012). Manual para el rastreo de mamíferos silvestres de México. Ciudad de México: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Arriaga, L., Espinoza, J. M., Aguilar, C., Martínez, E., Gómez, L. y Loa, E. (2000). RTP-121 Valle de Tehuacán-Cuicatlán. En L. Arriaga, J. M. Espinoza, C. Aguilar, E. Martínez, L. Gómez y E. Loa (Coords.), Regiones terrestres prioritarias de México (pp. 472–475). Ciudad de México: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Ávila-Nájera, D. M., Chávez, C., Lazcano-Barrero, M. A., Pérez Elizalde, S. y Alcántara-Carbajal, J. L. (2015). Estimación poblacional y conservación de felinos (Carnívora: Felidae) en el norte de Quintana Roo, México. Revista de Biología Tropical, 63, 799–813. https://www.redalyc.org/pdf/449/44939781020.pdf
Berruecos-Pérez, J. (2015). Riqueza de mamíferos medianos y grandes del Ejido San José Axuxco, Puebla (Tesis). Facultad de Estudios Superiores Iztacala UNAM. México D.F.
Briones-Salas, M. (2000). Lista anotada de los mamíferos de la región de la cañada en el valle de Tehuacán-Cuicatlán, Oaxaca. México. Acta Zoológica Mexicana, 61, 83–103. https://www.redalyc.org/pdf/575/57508106.pdf
Burton, A. M., Navarro-Pérez, S. y Chávez-Tovar, C. (2003). Bobcat ranging behavior in relation to small mammal abundance on Colima Volcano, México. Anales del Instituto de Biología, Universidad Nacional Autónoma de México, Serie Zoología, 74, 67–82.
Cooch, E. G. y White, G. C. (2016). Program MARK – a gentle introduction (16th edition). http://www.phidot.org/software/mark/docs/book/
Crooks, K. R. (2002). Relative sensitivities of mammalian carnivores to habitat fragmentation. Conservation Biology, 16, 488–502. https://doi.org/10.1046/j.1523-1739.2002.00386.x
Crooks, K. R. y Soulé, M. E. (1999). Mesopredator release and avifaunal extinctions in a fragmented landscape. Nature, 400, 563–566. https://doi.org/10.1038/23028
Cruz-Jácome, O., López-Tello, E., Delfín-Alfonso, A. y Mandujano, S. (2015). Riqueza y abundancia relativa de mamíferos medianos y grandes en una localidad en la Reserva de la Biosfera Tehuacán-Cuicatlán, Oaxaca, México. Therya, 6, 435–448. https://doi.org/10.12933/therya-15-277
Currier, M. J. (1983). Felis concolor. Mammalian Species, 200, 1–7. https://doi.org/10.2307/3503951
Dávila, P., Arizmendi, M. C., Valiente-Banuet, A., Villaseñor, J. L., Casas, A. y Lira, R. (2002). Biological diversity in the Tehuacán-Cuicatlán Valley, México. Biodiversity and Conservation, 11, 421–442. https://doi.org/10.1023/A:1014888822920
De La Torre, J. A. y Medellín, R. (2011). Jaguars Panthera onca on the Greater Lacandona Ecosystem, Chiapas, Mexico: population estimates and future prospects. Oryx, 45, 546–553. https://doi.org/10.1017/S0030605310001511
de Oliveira, T. G. (1998). Herpailurus yagouaroundi. Mammalian Species, 578, 1–6. https://doi.org/10.2307/3504500
Di Bitetti, M. S., Paviolo, A. y De Angelo, C. (2006). Density, habitat use and activity patterns of ocelots (Leopardus pardalis) in the Atlantic Forest of Misiones, Argentina. Journal of Zoology, 270, 153–163. https://doi.org/10.1111/j.1469-7998.2006.00102.x
Donadio, E. y Buskirk, S. W. (2006). Diet, morphology, and interspecific killing in Carnivora. The American Naturalist, 167, 524–535. https://doi.org/10.1086/501033
Durant, S. M. (1998). Competition refuges and coexistence: an example from Serengeti carnivores. Journal of Animal Ecology, 67, 370–386. https://doi.org/10.1046/j.1365-2656.1998.00202.x
Elizalde-Arellano, C., López-Vidal, J. C., Hernández, L., Laundré, J. W., Cervantes, F. A. y Spilsbury, M. A. (2012). Home range size and activity patterns of bobcats (Lynx rufus) in the southern part of their range in the Chihuahuan Desert, Mexico. The American Midland Naturalist, 168, 247–264. https://doi.org/10.1674/0003-0031-168.2.247
Estes, J. A., Terborgh, J., Brashares, J. S., Power, M. E., Berger, J., Bond, W. J. et al. (2011). Trophic downgrading of planet Earth. Science, 333, 301–306. https://doi.org/10.1126/science.1205106
Farías, V., Fuller, T. K., Wayne, R. K. y Sauvajot, R. M. (2005). Survival and cause-specific mortality of gray foxes (Urocyon cinereoargenteus) in southern California. Journal of Zoology, 266, 249–254. https://doi.org/10.1017/S0952836905006850
Farías, V., Téllez, O., Botello, F., Hernández, O., Berruecos, J., Olivares, S. J. et al. (2015). Primeros registros de cuatro especies de felinos en el sur de Puebla, México. Revista Mexicana de Biodiversidad, 86, 1065–1071. https://doi.org/10.1016/j.rmb.2015.06.014
Farías-González, V. y Vega-Flores, C. N. (2019). Spotted skunks (Spilogale angustifrons) photo-captured following gray foxes (Urocyon cinereoargenteus) in tropical dry forest in central Mexico. Journal of Arid Environments, 160, 25–31. https://doi.org/10.1016/j.jaridenv.2018.09.010
Fedriani, J. M., Fuller, T. K., Sauvajot, R. M. y York, E. C. (2000). Competition and intraguild predation among three sympatric carnivores. Oecologia, 125, 258–270. https://doi.org/10.1007/s004420000448
Ferguson, A. W., Currit, N. A. y Weckerly, F. W. (2009). Isometric scaling in home-range size of male and female bobcats (Lynx rufus). Canadian Journal of Zoology, 87, 1052–1060. https://doi.org/10.1139/Z09-095
Foster, R. J. y Harmsen, B. J. (2012). A critique of density estimation from camera-trap data. The Journal of Wildlife Management, 76, 224–236. https://doi.org/10.1002/jwmg.275
Gilbert, N. A., Clare, J. D. J., Strenglein, J. L. y Zuckerberg, B. (2020). Abundance estimation of unmarked animals based on camera-trap data. Conservation Biology, 35, 88–100. https://doi.org/10.1111/cobi.13517
Grigione, M. M., Beier, P., Hopkins, R. A., Neal, D., Padly, W. D., Schonewald, C. M. et al. (2002). Ecological and allometric determinants of home-range size for mountain lions (Puma concolor). Animal Conservation, 5, 317–324. https://doi.org/10.1017/S1367943002004079
Harestad, A. S. y Bunnel, F. L. (1979). Home range and body weight. A reevaluation. Ecology, 60, 389–402. https://doi.org/10.2307/1937667
Heilbrun, R. D., Silvy, N. J., Tewes, M. E. y Peterson, M. J. (2003). Using automatically triggered cameras to individually identify bobcats. Wildlife Society Bulletin, 31, 748–755. https://www.jstor.org/stable/3784595
Holbrook, J. D., Caso, A., De Young, R. W. y Tewes, M. (2012). Population genetics of jaguarundis in Mexico: implications for future research and conservation. Wildlife Society Bulletin, 37, 336–341. https://doi.org/10.1002/wsb.246
Holt, R., D. y Polis., G. A. (1997). A theoretical framework for intraguild predation. The American Naturalist, 14, 745–764. https://doi.org/10.1086/286018
Hoogesteijn, A. L., Faller, J. C., Núñez, R., Feblesi, J. L., Caso, A. y Manterola, C. (2020). Translocations: challenges experienced with Mexican jaguars. CATnews, 71, 32–37.
Hutchinson, G. y MacArthur, R. H. (1959). A theoretical ecological model of size distributions among species of animals. The American Naturalist, 93, 117–125. https://doi.org/10.1086/282063
Janecka, J. E., Tewes, M. E., Davis, I. A., Haines, A. M., Caso, A., Blankenship, T. L. et al. (2016). Genetic differences in the response to landscape fragmentation by a habitat generalist, the bobcat, and a habitat specialist, the ocelot. Conservation Genetics, 17, 1093–1108. https://doi.org/10.1007/s10592-016-0846-1
Johnson, W. E, Eizirik, E., Peacon-Slattery, J., Murphy, W. J., Antunes, A., Teeling, E. et al. (2006). The late Miocene radiation of modern Felidae: a genetic assessment. Science, 311, 73–77. https://doi.org/10.1126/science.1122277
Karanth, K. U. (1995). Estimating tiger Panthera tigris populations from camera-trap data using capture-recapture models. Biological Conservation, 71, 333–338. http://dx.doi.org/10.1016/0006-3207(94)00057-W
Karanth, K. U. y Nichols, J. D. (1998). Estimation of tiger densities in India using photographic captures and recaptures. Ecology, 79, 2852–2862. https://doi.org/10.1890/0012-9658(1998)079[2852:EOTDII]2.0.CO;2
Karanth, K. U., Srivathsa, A., Vasudev, D., Puri, M., Parameshwaran, R. y Kumar, N. S. (2017). Spatio-temporal interactions facilitate large carnivore sympatry across a resource gradient. Proceedings of the Royal Society B, 284, 20161860. https://doi.org/10.1098/rspb.2016.1860
Kelly, M. J., Noss, A. J., Di Bitetti, M. S., Maffei, L., Arispe, R. L., Paviolo, A. et al. (2008). Estimating puma densities from camera trapping across three study sites: Bolivia, Argentina, and Belize. Journal of Mammalogy, 89, 408–418. https://doi.org/10.1644/06-MAMM-A-424R.1
Koehler, G. M. y Hornocker, M. G. (1991). Seasonal resource use among mountain lions, bobcats, and coyotes. Journal of Mammalogy, 72, 391–396. https://doi.org/10.2307/1382112
Lariviere, S. y Walton, L. R. (1997). Lynx rufus. Mammalian Species, 563, 1–8. https://doi.org/10.2307/3504533
Lindstedt, S. L., Miller, B. J. y Buskirk, S. W. (1986). Home range, time, and body size in mammals. Ecology, 67, 413–418. https://doi.org/10.2307/1938584
Lira-Torres, I. y Briones-Salas, M. (2011). Impacto de la ganadería extensiva y cacería de subsistencia sobre la abundancia relativa de mamíferos en la Selva Zoque, Oaxaca, México. Therya, 2, 217–244.
López-González, C. A., Ávila-Aguilar, D. y Cruz-Torres, M. F. (2015). Abundancia del gato montés (Lynx rufus escuinapae J. A. Allen, 1903) en el Parque Nacional el Cimatario, Querétaro, México. Acta Zoológica Mexicana, 31, 138–140.
López-González, C. A., González-Romero, A. y Laundré, J. W. (1998). Range extensión of the bobcat (Lynx rufus) in Jalisco, Mexico. The Southwestern Naturalist, 43, 103–105. https://www.redalyc.org/articulo.oa?id=57537094025
Maffei, L., Cuéllar, E. y Noss, A. (2002). Uso de trampas cámara para la evaluación de mamíferos en el ecotono del Chaco-Chiquitanía. Revista Boliviana de Ecología y Conservación Ambiental, 11, 55–65.
Meek, P. D., Ballard, G., Claridge, A., Kays, R., Moseby, K., O’Brien, T. et al. (2014). Recommended guiding principles for reporting on camera trapping research. Biodiversity Conservation, 23, 2321–2343. https://doi.org/10.1007/s10531-014-0712-8
Monroy, G. y Briones-Salas, M. (2012). Primeros datos sobre área de actividad de gato montés (Lynx rufus) en Oaxaca, México. Acta Zoológica Mexicana (n. s.), 28, 471–474. https://doi.org/10.21829/azm.2012.282848
Newby, J. R., Mills, L. S., Ruth, T. K., Pletscher, D. H., Mitchell, M. S., Quigley, H. B. et al. (2013). Human-caused mortality influences spatial population dyamics: pumas in landscapes with varying mortality risks. Biological Conservation, 159, 230–239. https://doi.org/10.1016/j.biocon.2012.10.018
Núñez-Pérez, R. y Miller, B. (2019). Movements and home range of jaguars (Panthera onca) and mountain lions (Puma concolor) in a tropical dry forest of western Mexco. En R. Reyna-Hurtado y C. A. Chapman (Eds.), Movement ecology of Neotropical forest mammals (pp. 243–262). Cham: Springer Nature Switzerland. https://doi.org/10.1007/978-3-030-03463-4
Otis, D. L., Burnham, K. P., White, G. C. y Anderson, D. R. (1978). Statistical inference from capture data on closed animal populations. Wildlife Monographs, 62, 3–135. https://doi.org/10.2307/2287873
Palomares, F. y Caro, T. M. (1999). Interspecific killing among mammalian carnivores. The American Naturalist, 153, 492–508. https://doi.org/10.2307/2463664
Persson, L. (1985). Asymmetrical competition: are larger animals competitively superior? The American Naturalist, 126, 261–266. https://doi.org/10.1086/284413
Polis, G. A., Myers, C. A y Holt, R. D. (1989). The ecology and evolution of intraguild predation: Potential competitors that eat each other. Annual Review on Ecology and Systematics, 20, 297–330. https://doi.org/10.1146/annurev.ecolsys.20.1.297
Powell, R. A. (2000). Animal home ranges and territories and home range estimators. En L. Boitani y T. K. Fuller (Eds.), Research techniques in animal ecology: controversies and consequence (pp. 65–110). New York: Columbia University Press.
Ripple, W. J., Estes, J. A., Beschta, R. L., Wilmers, C. C., Ritchie, E. G., Hebblewhite, M. et al. (2014). Status and ecological effects of the world’s largest carnivores. Science, 343, 1–11. https://doi.org/10.1126/science.1241484
Rosas-Rosas, O. C., Bender, L. C. y Valdez, R. (2008). Jaguar and puma predation on cattle calves in northeastern Sonora, Mexico. Rangeland Ecology and Management, 61, 554–560. https://doi.org/10.2111/08-038.1
Rosas-Rosas, O. C. y Bender, L. C. (2012). Population status of jaguars (Panthera onca) and pumas (Puma concolor) in northeastern Sonora, México. Acta Zoológica Mexicana (n.s.), 28, 86–101. https://doi.org/10.21829/azm.2012.281818
Ruell, E.W., Riley, S. P. D., Douglas, M. R., Pollinger, J. P. y Crooks, K. (2009). Estimating bobcat population sizes and densities in a fragmented urban landscape using noninvasive capture-recapture sampling. Journal of Mammalogy, 90, 120–135. https://doi.org/10.1644/07-MAMM-A-249.1
Rzedowski, J. (1978). Vegetación de México. Ciudad de México: Limusa.
Sánchez-González, R., Hernández-Saint Martín, A. D., Rosas-Rosas, O. C. y García-Chávez, J. (2018). Diet and abundance of bobcat (Lynx rufus) in the Potosino-Zacatecano Plateau, Mexico. Therya, 9, 107–112. https://doi.org/10.12933/therya-18-498
Semarnat (Secretaría de Medio Ambiente y Recursos Naturales) (2013). Programa de Manejo Reserva de la Biosfera Tehuacán-Cuicatlán. Secretaría de Medio Ambiente y Recursos Naturales. Comisión Nacional de Áreas Naturales Protegidas. México D.F.
Sergio, F., Newton, I. y Marchesi, L. (2005). Top predators and biodiversity. Nature, 436, 192. https://doi.org/10.1038/436192a
Sharma, R. K, Jhala, Y., Qureshi, Q., Vattakaven, J., Gopal, R. y Nayak, K. (2010). Evaluating capture-recapture population and density estimation of tigers in a population with known parameters. Animal Conservation, 13, 94–103. https://doi.org/10.1111/j.1469-1795.2009.00305.x
Simberloff, D. y Dayan, T. (1991). The guild concept and the structure of ecological communities. Annual Review on Ecology and Systematics, 22, 115–143. https://doi.org/10.1146/annurev.es.22.110191.000555
Soria-Díaz, L., Fowler, M. S. y Monroy-Vilchis, O. (2017). Top-down and bottom-up control on cougar and its prey in a central Mexican natural reserve. European Journal of Wildlife Research, 63, 73. https://doi.org/10.1007/s10344-017-1129-y
Soria-Díaz, L., Fowler, M. S., Monroy-Vilchis, O. y Oro, D. (2018). Functional responses of cougars (Puma concolor) in a multiple prey-species system. Integrative Zoology, 13, 84–93. https://doi.org/10.1111/1749-4877.12262
Soria-Díaz, L., Monroy-Vilchis, O., Rodríguez-Soto, C., Zarco-González, M. M. y Urios, V. (2010). Variation of abundance and density of Puma concolor in zones of high and low concentration of camera traps in Central Mexico. Animal Biology, 60, 361–371. https://doi.org/10.1163/157075610X523251
Téllez-Valdés, O., Farías, V., Dávila-Aranda, P., Stein, J. L., Lira-Saade, R. y Botello, F. (2010). Diversidad de mamíferos en los dominios climáticos de la Reserva de la Biosfera Tehuacán-Cuicatlán, México. Revista Mexicana de Biodiversidad, 81, 863–874. https://doi.org/10.22201/ib.20078706e.2010.003.656
Tobler, M. W. y Powell, V. N. (2013). Estimating jaguar densities with camera traps: problems with current designs and recommendations for future studies. Biological Conservation, 159, 109–118. https://doi.org/10.1016/j.biocon.2012.12.009
Valiente-Banuet, A., Casas, A., Alcántara, A., Dávila, P., Flores-Hernández, N., Arizmendi, M. C. et al. (2000). La vegetación del valle de Tehuacán-Cuicatlán. Boletín de la Sociedad Botánica de México, 67, 27–74. https://doi.org/10.17129/botsci.1625
Vega-Flores, C. N. (2019). Segregación temporal y coexistencia de cuatro felinos simpátricos en la Reserva de la Biosfera Tehuacán-Cuicatlán (Tesis). Facultad de Estudios Superiores Iztacala, Universidad Nacional Autónoma de México. México.
White, G. C., Anderson, D. R, Burnham, K. P. y Otis, D. L. (1982). Capture-recapture and removal methods for sampling closed populations. Los Alamos National Laboratory Report LA-8787-NERP. Informe. Washington D.C.: United States Government Printing Office.
Wilson, K. R. y Anderson, D. R. (1985). Evaluation of two density estimators of small mammal population size. Journal of Mammalogy, 66, 13–21. https://doi.org/10.2307/1380951