Diversidad estacional de aves en una región prioritaria para la conservación en el centro oeste de la Sierra Madre Occidental
Gabriel López-Segoviano a, Lorenzo Díaz-Verduzco b, Maribel Arenas-Navarro a
y María del Coro Arizmendi c, *
a Posgrado en Ciencias Biológicas, Unidad de Posgrado, Coordinación del Posgrado en Ciencias Biológicas, Universidad Nacional Autónoma de México, Edificio D 1er piso, Cd. Universitaria, Coyoacán, 04510 Ciudad de México, México
b Escuela de Biología, Universidad Autónoma de Sinaloa, Calzada de las Américas y Universitarios s/n, Ciudad Universitaria, 80040 Culiacán Rosales, Sinaloa, México
c Laboratorio de Ecología, UBIPRO Facultad de Estudios Superiores Iztacala, Universidad Nacional Autónoma de México, Av. de los Barrios 1, Los Reyes Iztacala, 54090, Tlalnepantla, Estado de México, México
*Autor para correspondencia: coro@unam.mx (M.C. Arizmendi)
Resumen
La Sierra Madre Occidental (SMO) es una de las regiones de mayor importancia para la conservación de las aves en México. Este estudio evaluó la diversidad estacional de la comunidad de aves dentro de la SMO en la región prioritaria para la conservación El Palmito, Concordia, Sinaloa. A través de un muestreo realizado durante el 2014 (3-10 enero, 12-14 abril, 12-15 julio y 12-16 noviembre), se establecieron 80 puntos de conteo, distribuidos al azar dentro de un área de 1,427 ha. Se registraron las especies de aves durante las 4 estaciones del año. Se evaluó la completitud de la muestra por cada estación. Posteriormente, se evaluó la diversidad alfa y beta de cada estación. Se registraron 120 especies de aves pertenecientes a 30 familias, de las cuales 14 especies fueron endémicas y 2 se encuentran en peligro de extinción (Ara militaris y Cyanocorax dickeyi). Los valores de completitud para cada estación fueron mayores a 0.95. En primavera se registró la mayor diversidad alfa (q0 = 84, q1 = 50.3), mientras que en otoño la menor (q0 = 68, q1 = 35.3). Lo cual puede deberse a los movimientos migratorios altitudinales y latitudinales de las especies en la región.
Palabras clave:
Biodiversidad; Endémicas; Completitud; Riqueza de especies; Disimilitud; Bosque
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Seasonal bird diversity in a priority region for conservation in the west center of the Sierra Madre Occidental
Abstract
The Sierra Madre Occidental (SMO) is one of the most important regions for bird’s conservation in Mexico. This study evaluated seasonal diversity of the bird community within the SMO in the in the priority region for conservation El Palmito, Sinaloa. Through a sampling conducted during 2014 (3-10 January, 12-14 April, 12-15 July and 12-16 November), 80 bird counting points were established, randomly distributed within an area of 1,427 ha. We characterized the bird species recorded during the 4 seasons. Later, we determined the alpha and beta diversity in each season. A total of 120 species of birds were registered belonging to 30 families, of which 14 species were endemic and 2 are endangered (Ara militaris y Cyanocorax dickeyi). The completeness values for each station were greater than 0.95. We recorded in spring the higher alpha diversity (q0 = 84, q1 = 50.3) and in autumn the lowest (q0 = 68, q1 = 35.3). This may be due to the altitudinal and latitudinal migratory movements of the species in the region.
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Keywords:
Floral divergence; Morphometry; Polymorphism of the labellum; Vanilla
Introducción
Conocer la diversidad es un tópico central de la ecología y de la biología de la conservación, ya que permite describir, comparar y relacionar el funcionamiento de los ecosistemas (Halfter y Moreno, 2005; Magurran, 1988; Moreno et al., 2011). Estas tareas han adquirido una gran relevancia debido a la constante modificación del paisaje.
La diversidad de especies desde el enfoque de la ecología de comunidades constituye un concepto relacionado con la estructura de la comunidad (Ricklefs y Miller, 1999). Establece que si en una comunidad las especies tienen las mismas abundancias, la diversidad debe ser proporcional al número de especies (riqueza específica) (Hill, 1973; Moreno et al., 2011). Sin embargo, al describir la composición de una comunidad simplemente en términos de número de especies presentes, se ignora un aspecto importante de la estructura de comunidad. La estructura de la comunidad es una propiedad de las comunidades que conjunta el número y la equidad de las abundancias de estas especies (Begon et al., 2006).
Las medidas de diversidad, en números efectivos de Jost (2006), se basan en el exponente q. Este exponente determina la sensibilidad del índice a las abundancias relativas de las especies (comunes o raras). Una de las ventajas de expresar la diversidad de una comunidad en números de especies efectivas es que permite comparar la magnitud de la diferencia en la diversidad de 2 o más comunidades (Moreno et al., 2011). Estas comparaciones pueden ser entre sitios o entre estaciones del año; lo cual es de utilidad para cuantificar la diversidad de especies con movimientos migratorios, como las aves.
Las aves son uno de los grupos más diversos y estudiados (Berlanga et al., 2015). En el mundo existen 10,550 especies (Clements et al., 2017). Para México, Berlanga et al. (2008) reportaron 1,116 especies de aves, de las cuales 104 se distribuyen solo en nuestro país. Del total de diversidad de aves que podemos encontrar en México, 69 especies se encuentran en peligro de extinción, 99 se encuentran amenazadas y 118 se encuentran bajo protección especial, según la Norma Oficial Mexicana (NOM-059-Semarnat-2010) (Berlanga et al., 2008). De las especies que se distribuyen en México 77% se reproducen en territorio nacional y el resto migra a otras regiones para procrear (Navarro-Sigüenza et al., 2014). Por lo general, se reproducen en el norte del continente (Canadá y EUA) y migran a México durante otoño-invierno (Del Hoyo et al., 1992; Howell y Webb, 1995; Sibley, 2001). Estas inmigraciones hacen una gran contribución a la diversidad de la fauna local (Begon et al., 2006). De hecho, las aves migratorias forman parte de diferentes comunidades en sus hábitats reproductivos y no reproductivos; donde aprovechan la estacionalidad de la disponibilidad de recursos alimenticios en cada región (Newton, 2007).
La Sierra Madre Occidental (SMO) es el complejo montañoso más grande de México y uno de los corredores biológicos más importantes del país (González-Elizondo et al., 2012; Kobelkowsky-Vidrio et al., 2014). La SMO es una de las regiones que concentran la mayoría de las especies de aves endémicas y cuasiendémicas del país (Escalante et al., 1993; Kobelkowsky-Vidrio et al., 2014). Berlanga et al. (2008) reportaron que en la región de las montañas del noroeste de México se encuentran 355 especies de aves; de las cuales 23 (22.11%) son endémicas, 8 se encuentran en peligro de extinción, 13 amenazadas y 23 en protección especial. Además, esta región tiene una gran variedad de tipos de vegetación, entre los que destacan: el bosque de pino-encino, bosque de pino, bosque de encino e incluso mesófilo de montaña en baja proporción (González-Elizondo et al., 2012). Es en estos tipos de vegetación donde se encuentra el mayor porcentaje de endemismos de aves en México (Navarro-Sigüenza et al., 2014).
El estado de Sinaloa se ubica al noroeste de México, entre las regiones neártica y neotropical, forma parte de la SMO, lo que le confiere una alta diversidad biológica (Navarro-Sigüenza y Sánchez-González, 2003). El objetivo del presente trabajo es conocer la diversidad alfa y beta estacional (primavera, verano, otoño e invierno) de la comunidad de aves en la región prioritaria para la conservación de El Palmito, ubicado en el municipio de Concordia en el estado de Sinaloa. Se evaluó la completitud de la muestra por cada estación del año, se determinó la diversidad alfa como la diversidad en números efectivos en cada estación y la diversidad beta como la disimilitud de la composición de la comunidad de aves entre las estaciones del año. Adicionalmente, se caracterizó a cada una de las especies de aves de acuerdo a su estatus de conservación (categoría de riesgo), de endemismo y migratorio.
Materiales y metodos
El sitio de estudio forma parte de la Región Prioritaria para la Conservación El Palmito, ubicado en el municipio de Concordia en el estado de Sinaloa, México (Diario Oficial de la Federación, 2007) (fig. 1). Esta región se ubica en las inmediaciones de la Sierra Madre Occidental (23°35.020’ N, 105°52.00’ O). La vegetación de El Palmito se encuentra constituida principalmente por bosque de pino, bosque de encino-pino, bosque de encino y bosque mesófilo de montaña; también se encuentran zonas con pequeños potreros, desmontes, vegetación secundaria, brechas cercanas a las casas de los habitantes del ejido (Díaz, 2005). El clima es templado subhúmedo con lluvias en verano, principalmente en los meses de junio y septiembre (fig. 2), registrándose un promedio anual de precipitación de 1,246 mm y una temperatura media anual de 16º C (SMN, 2000).
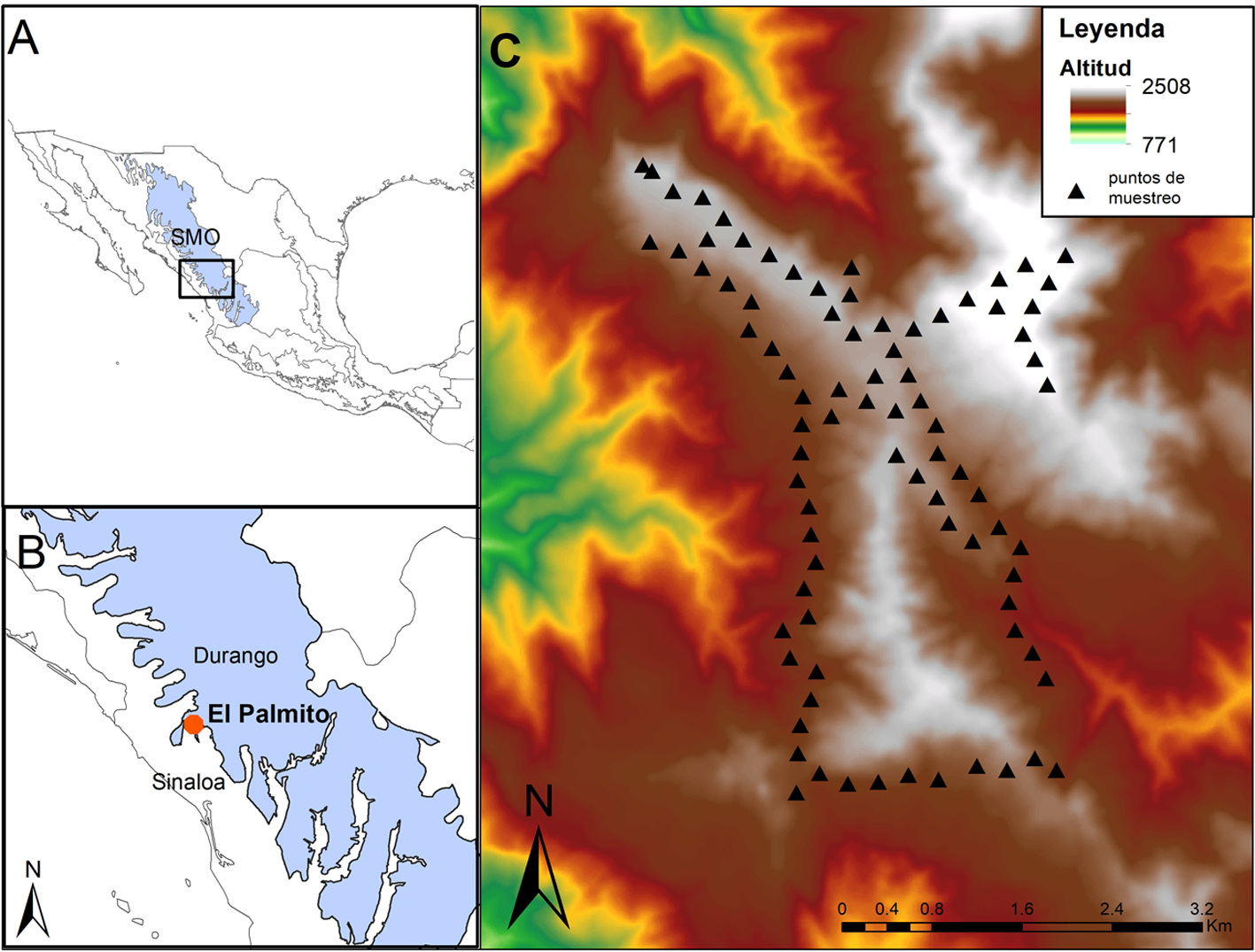
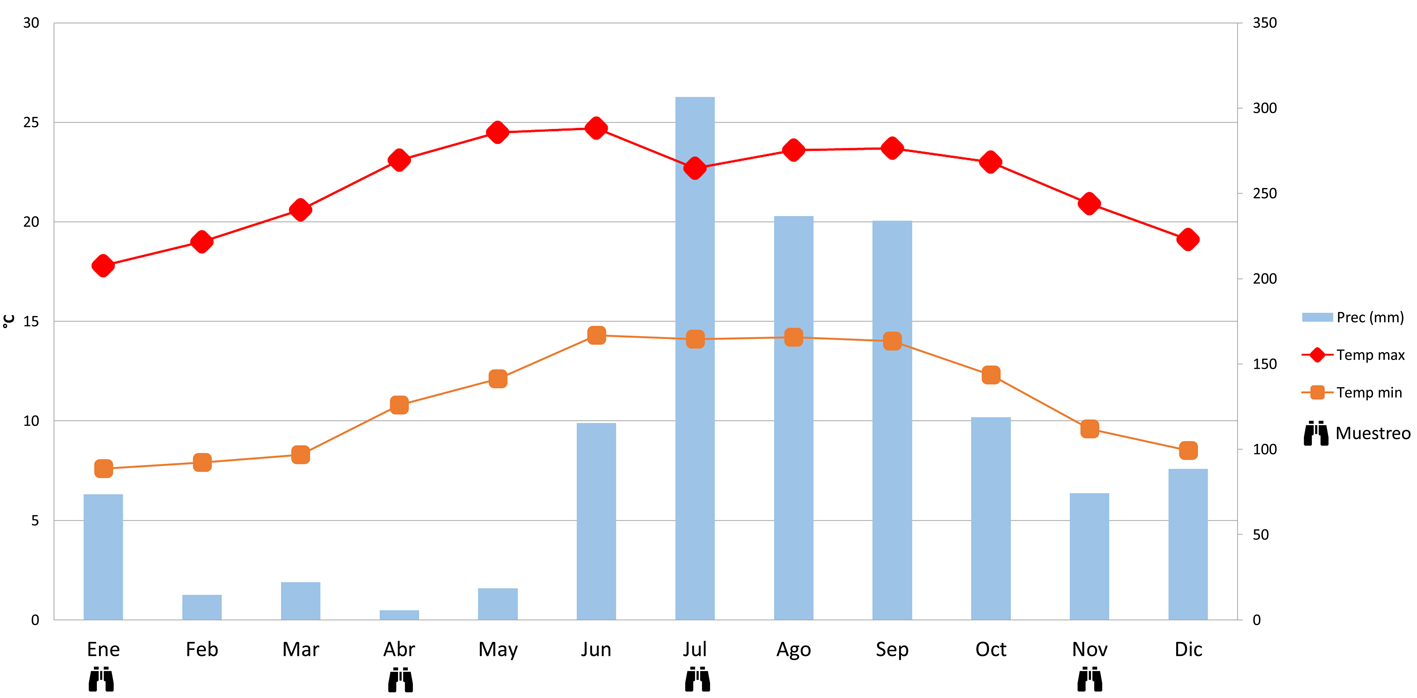
Para registrar el número de especies de aves y su abundancia se utilizó el método de puntos de conteo con radio variable (Wunderle, 1994). En el cual se registraron todas las especies detectadas de manera visual o auditiva durante 10 min. Dentro de El Palmito, en un área de 1,427 ha, se distribuyeron al azar un total de 80 puntos de conteo de aves en los diferentes tipos de vegetación en un intervalo altitudinal desde los 1,800 a los 2,500 m snm, y separados entre ellos por al menos 250 m. Los 80 puntos de conteo se registraron con un GPS Garmin etrex® y se realizaron observaciones en los mismos puntos cada estación del año para poder ver la variación estacional de la comunidad de aves en la región.
La identificación de las especies registradas en los puntos de conteo fue de manera visual con el apoyo de unos binoculares Bushnell® 10 × 50 y cotejando la observación con las imágenes de las especies en las guías de campo para la identificación de aves de Howell y Webb (1995), Kaufman (2005), Van-Perlo (2006) y Sibley (2001). Adicionalmente, para el registro y la identificación se contó con la colaboración del guía y experto de la avifauna local Santos Vázquez. El esfuerzo de muestreo para el registro de las especies fue de 2 observadores por punto de muestreo. Las observaciones en los puntos de conteo se realizaron en un periodo no mayor a 7 días; en cada estación del año se observaron los 80 puntos de conteo. Los puntos de conteo fueron realizados a partir del amanecer hasta 5 horas después. El primer muestreo se realizó del 3 al 10 de enero de 2014 (invierno), el segundo, del 12 al 14 abril de 2014 (primavera), el tercero se realizó del 12 al 15 de julio de 2014 (verano) y el último muestreo, del 12 al 16 de noviembre de 2014 (otoño).
Para determinar el estatus de conservación (categoría de riesgo) de las especies se utilizó la Norma Oficial Mexicana NOM-059-Semarnat 2010 (Semarnat, 2010); el estado de endemismo de las especies fue determinado de acuerdo con la propuesta de Berlanga et al. (2008), ésta también se utilizó para determinar el estatus migratorio, además de la de Del Hoyo et al. (1992).
Para evaluar la completitud del inventario se estimó la completitud del muestreo (Cm) para cada estación. La Cm se basa en la proporción del número de individuos totales en la comunidad que pertenecen a las especies registradas en el inventario y es considerada como una medida de la integridad del inventario (Chao y Jost, 2012). Los valores de completitud van de 0 (integridad mínima) a 1 (integridad máxima) (González-Tokman, et al., 2018), donde valores por encima del 0.5 se considera un inventario aceptable (Hsieh et al., 2016). Los análisis se realizaron con el software R versión 3.0.3 (R Core Team, 2014), con el paquete “iNEXT” 2.0.5 2.0.5 (Hsieh et al., 2016).
La diversidad alfa de aves se estimó como el número de especies efectivas (Jost, 2006; Moreno et al., 2011). Donde la diversidad de orden cero (q = 0) es igual a la riqueza de especies, mientras que la diversidad del orden 1 (q = 1) pesa proporcionalmente todas las especies de acuerdo con su abundancia en la comunidad (Jost, 2006). Los índices de diversidad fueron calculados en el software R versión 3.0.3 (R Development Core Team, 2014) con el paquete “vegetarian” Ver. 1.2 (Charney y Record, 2009). Para este trabajo, ambas medidas (q = 0 y q = 1) se calcularon para cada estación (primavera, verano, otoño e invierno) junto con sus intervalos de confianza al 95%.
La diversidad beta se midió como la disimilitud en la composición de especies registradas en cada estación, para lo cual se utilizó el índice de Jaccard en el programa R 3.0.3 (R Development Core Team, 2014) con la función “vegdist” del paquete “vegan” Ver. 2.0.9 (Oksanen et al., 2013). El índice de similitud de Jaccard (βJ), es definido como βJ = a / (a + b + c). En este caso utilizamos el inverso de este índice que mide la disimilitud entre 2 conjuntos de muestras donde βJ = (1- βJ). Valores altos del índice se interpretan como disimilitud elevada, lo que puede interpretarse como diversidad beta alta (cercanos a 1), mientras que los valores bajos (cercanos a 0) reflejan poca disimilitud que puede interpretarse como diversidad beta baja (Legendre et al., 2005). Para visualizar la composición de las especies a través de las 4 estaciones, utilizamos el escalamiento multidimensional no métrico (NMDS) implementado por la función “metaMDS” del paquete “vegan” Ver. 2.0.9 (Oksanen et al., 2013). Por último, para probar las diferencias estadísticas en la similitud de la comunidad entre las estaciones, se utilizó el análisis de varianza usando matrices de distancia (Adonis) con 999 permutaciones implementado por la función “adonis” del paquete “vegan” Ver. 2.0.9 (Oksanen et al., 2013). Ambos análisis se realizaron en el programa R 3.0.3 (R Development Core Team, 2014)
Resultados
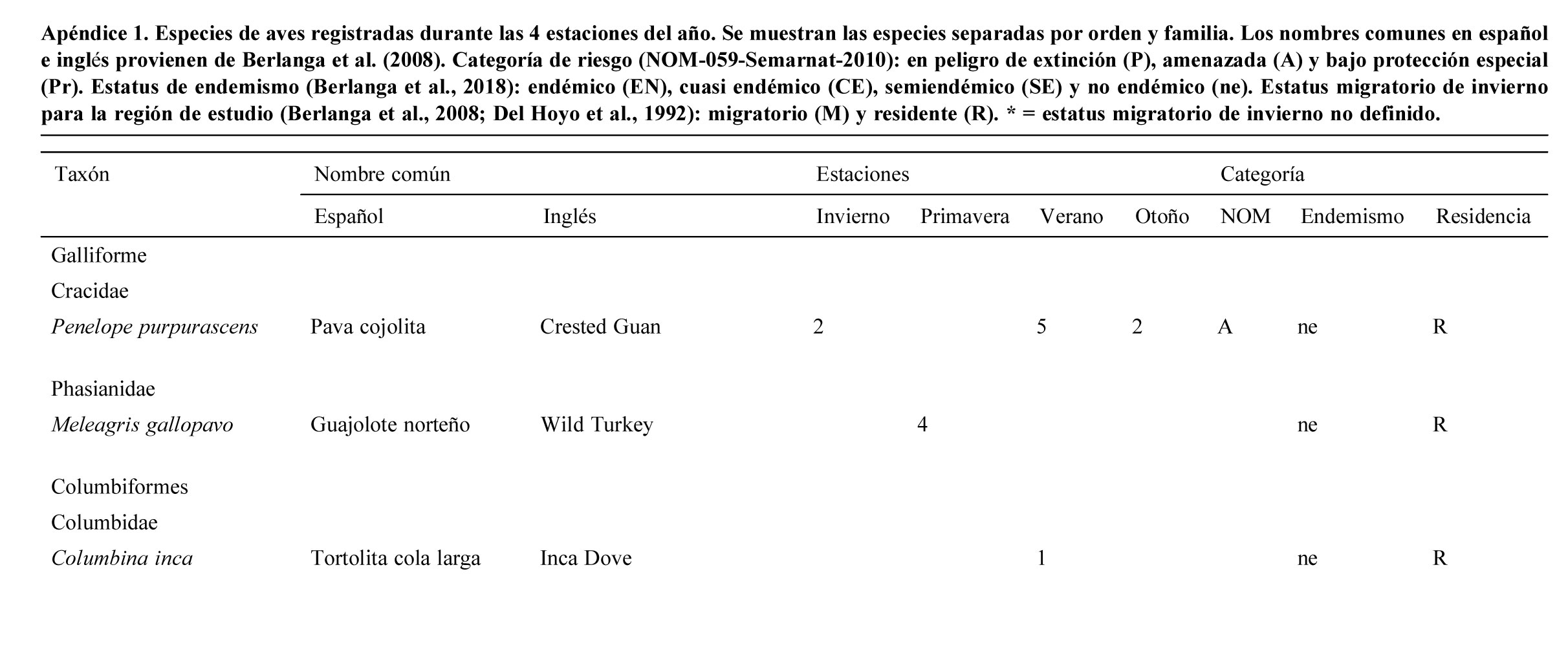
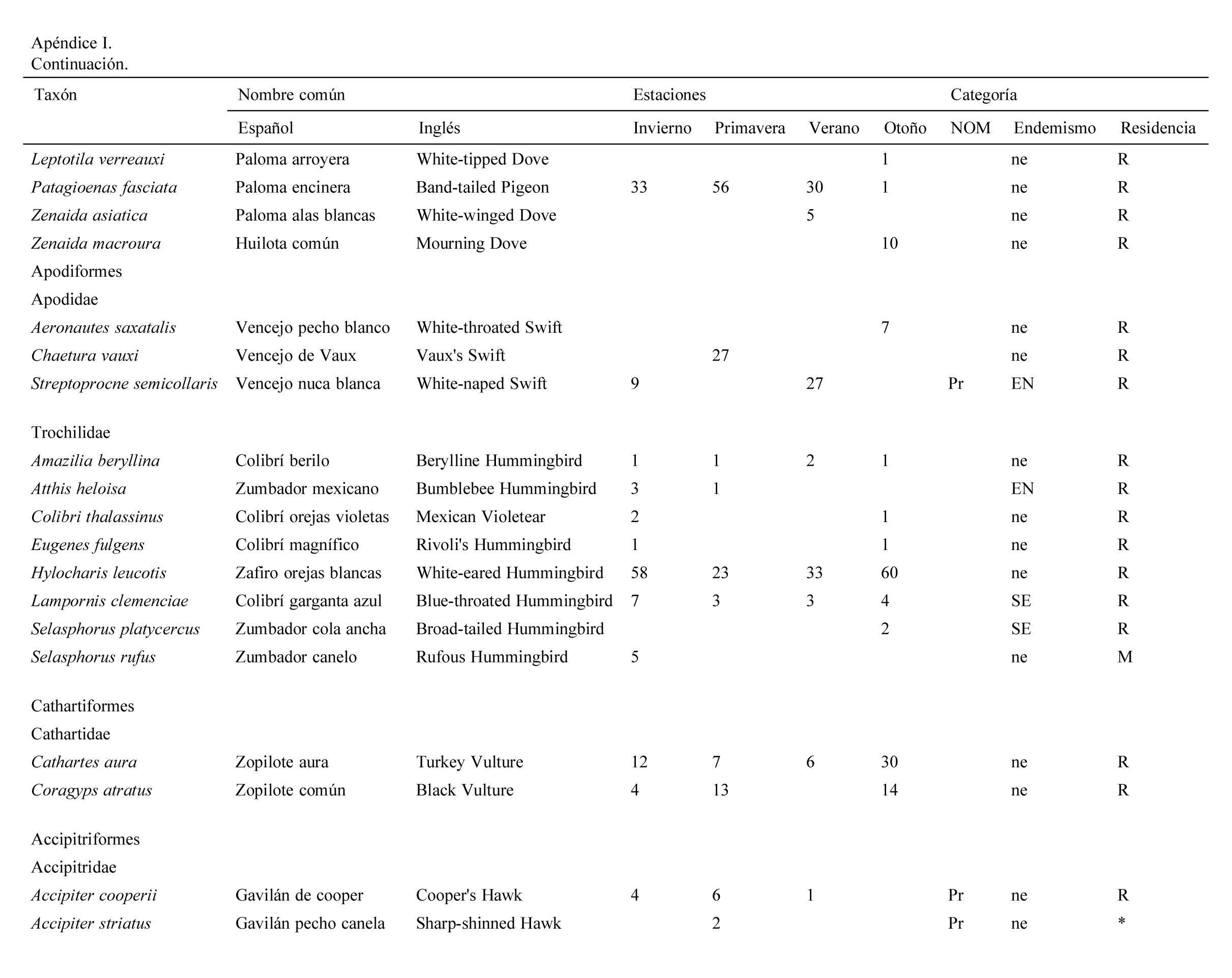
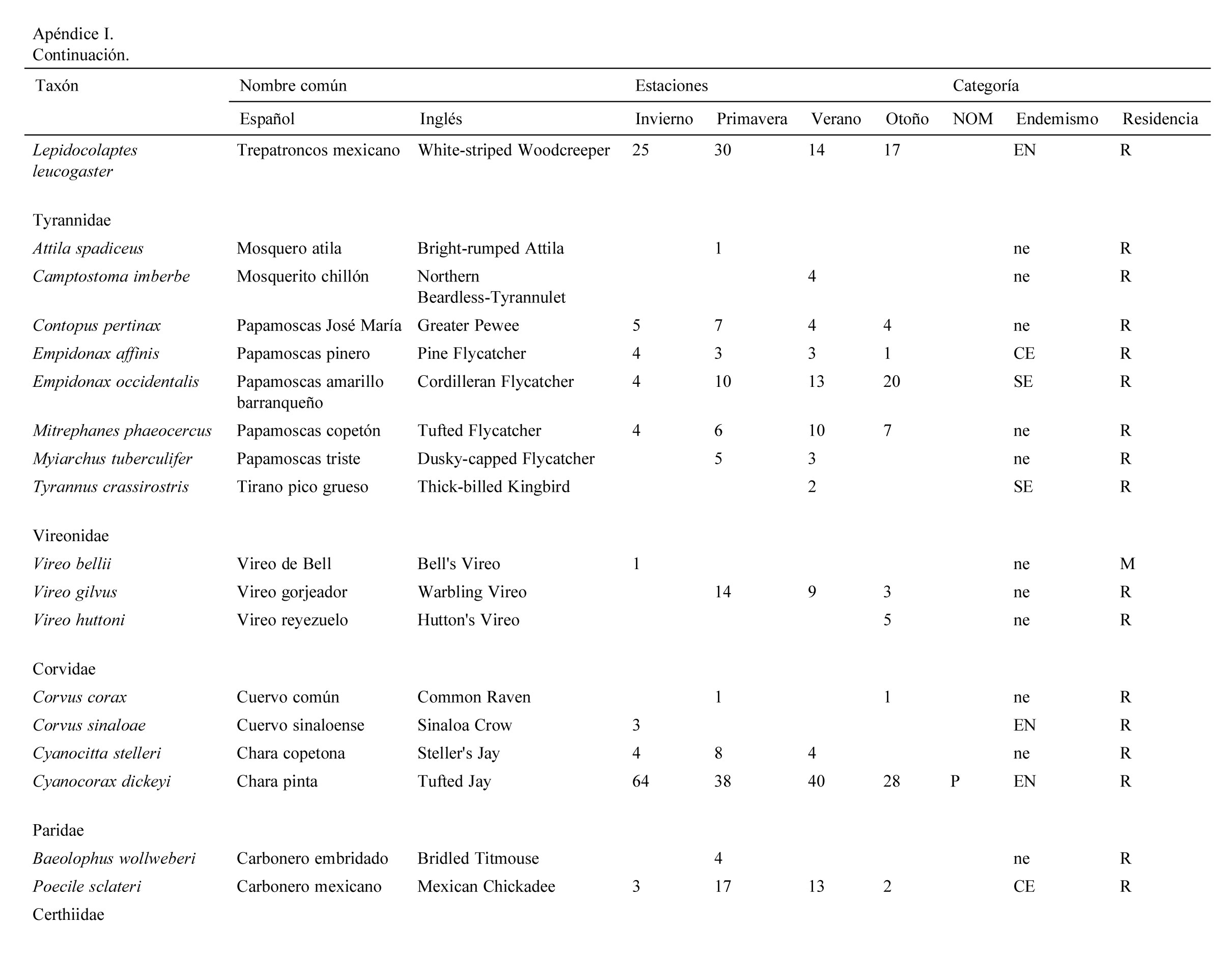
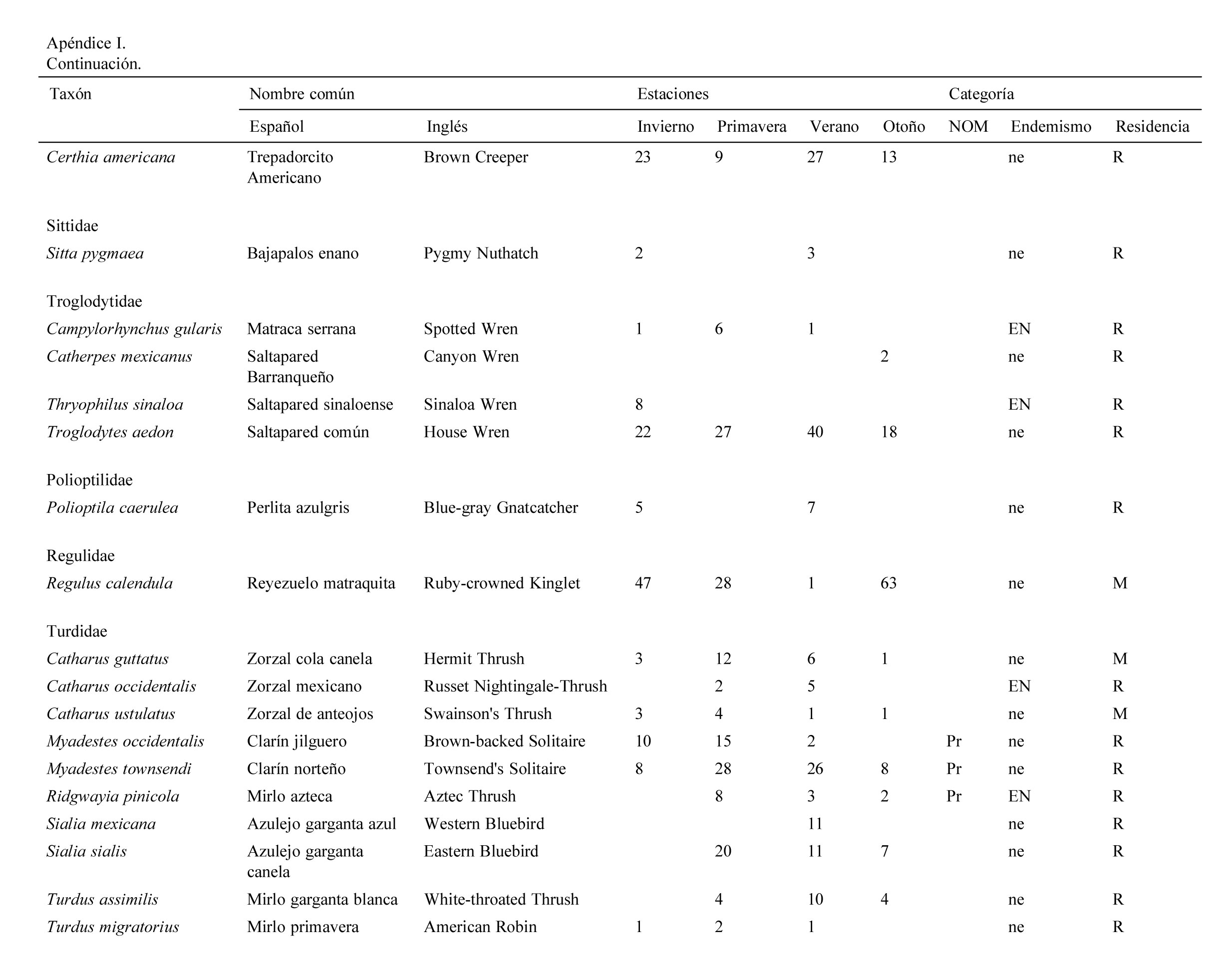
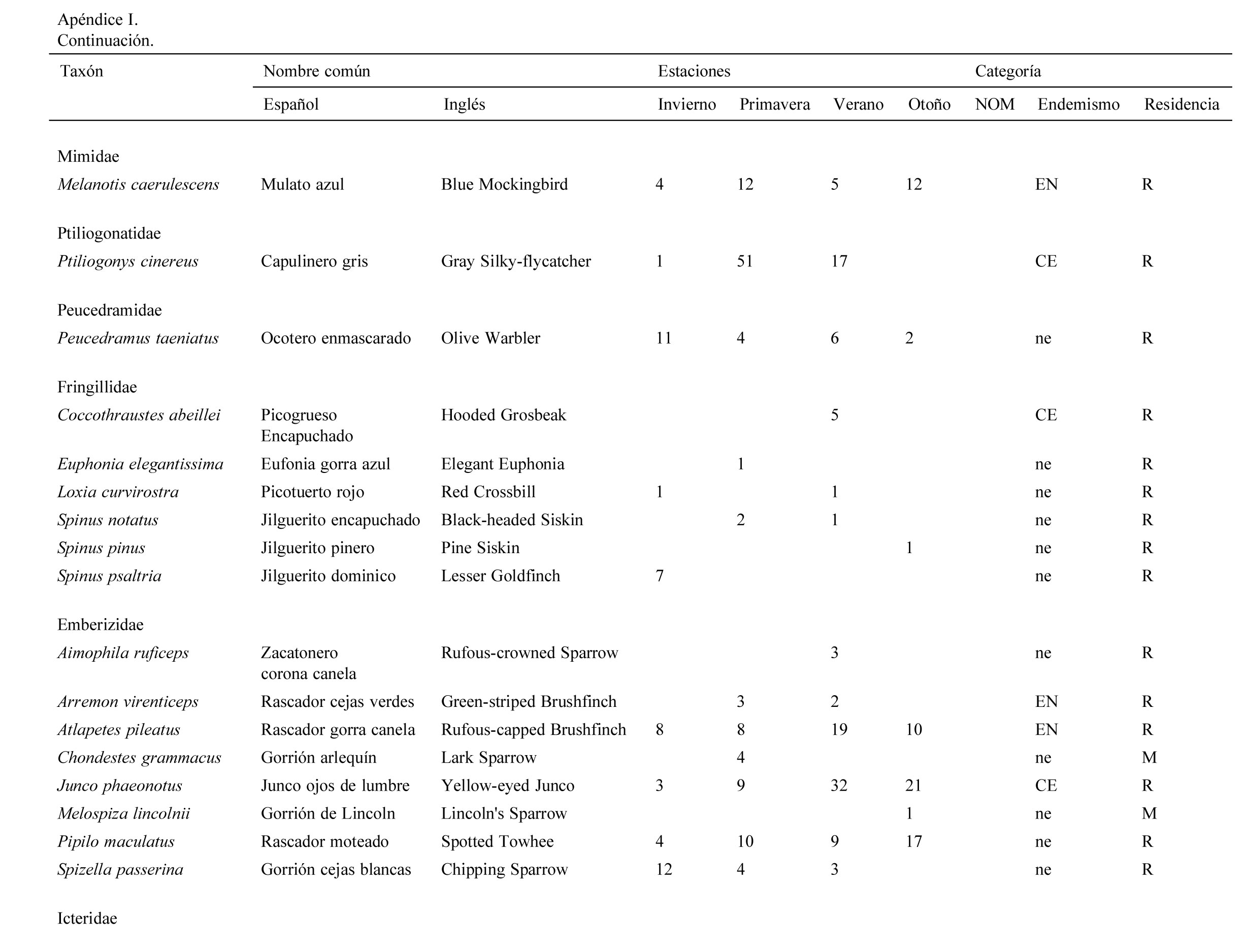
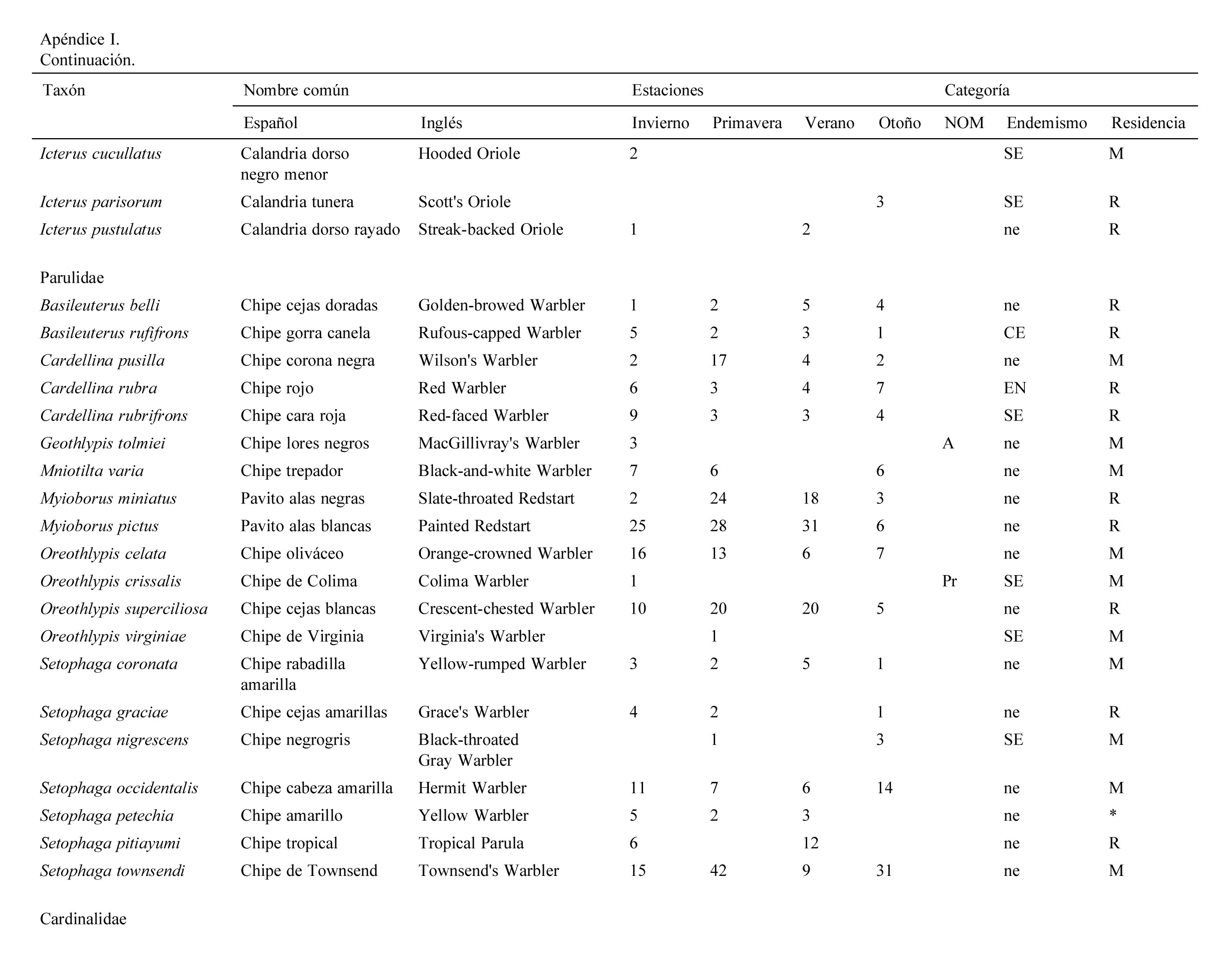
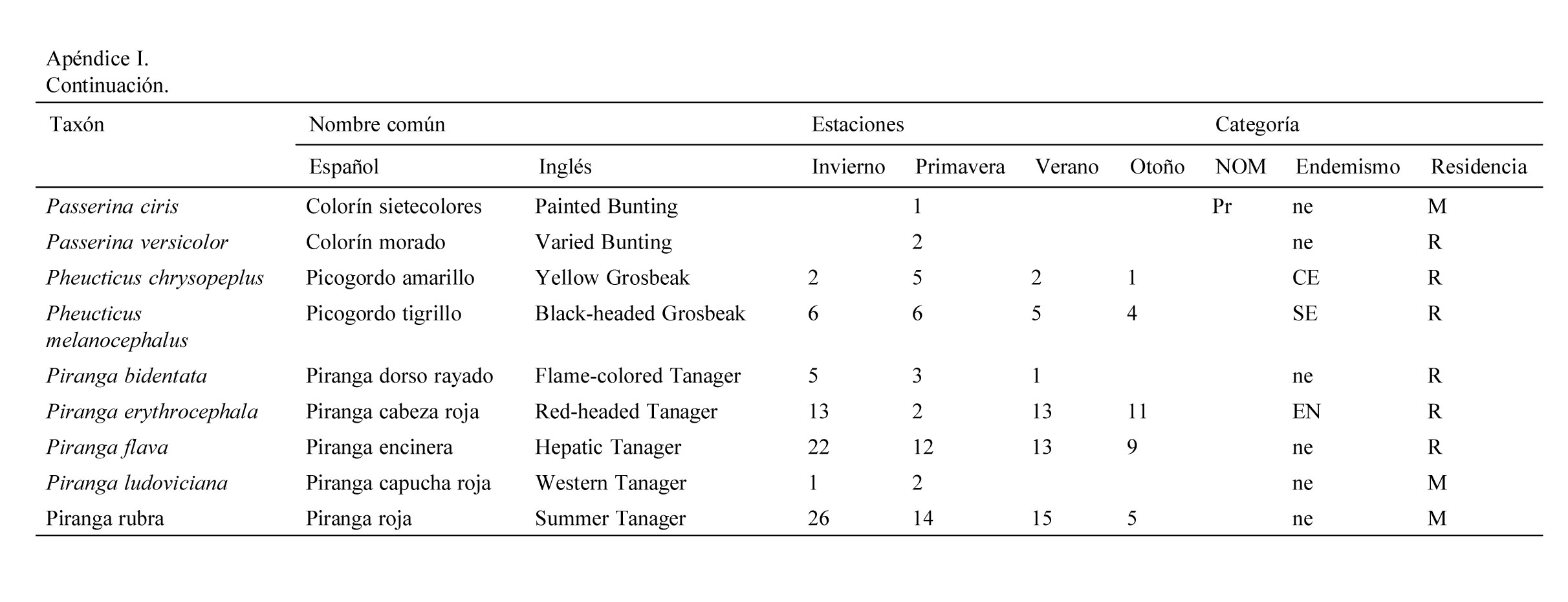
Se registraron 2,834 individuos pertenecientes a 120 especies, 30 familias y 9 órdenes de aves. Las familias con más especies registradas fueron: Parulidae (20), Turdidae (10), Cardinalidae (9). La mayor abundancia de individuos se registró en primavera con 830 individuos (29%) y la menor en otoño con 554 (19%).
Los valores de completitud para cada estación fueron satisfactorios, ya que se obtuvieron valores por arriba del 0.95 en todas las estaciones, obteniendo el valor más alto en la estación de primavera con 0.98 (tabla 1).
Tabla 1
Completitud del muestreo, donde la abundancia total representa el número de individuos registrados, Sobs es la riqueza observada, Sest es la riqueza estimada según la cobertura de la muestra (Cm) y completitud del inventario calculada a través de la Cm.
|
Estación |
Abundancia total |
Sobs |
Sest |
Completitud (Cm) |
Singletons |
Doubletons |
|
Primavera |
830 |
84 |
88 |
0.988 |
10 |
14 |
|
Verano |
762 |
80 |
92 |
0.981 |
14 |
8 |
|
Otoño |
554 |
68 |
91 |
0.967 |
18 |
7 |
|
Invierno |
688 |
80 |
89 |
0.981 |
13 |
9 |
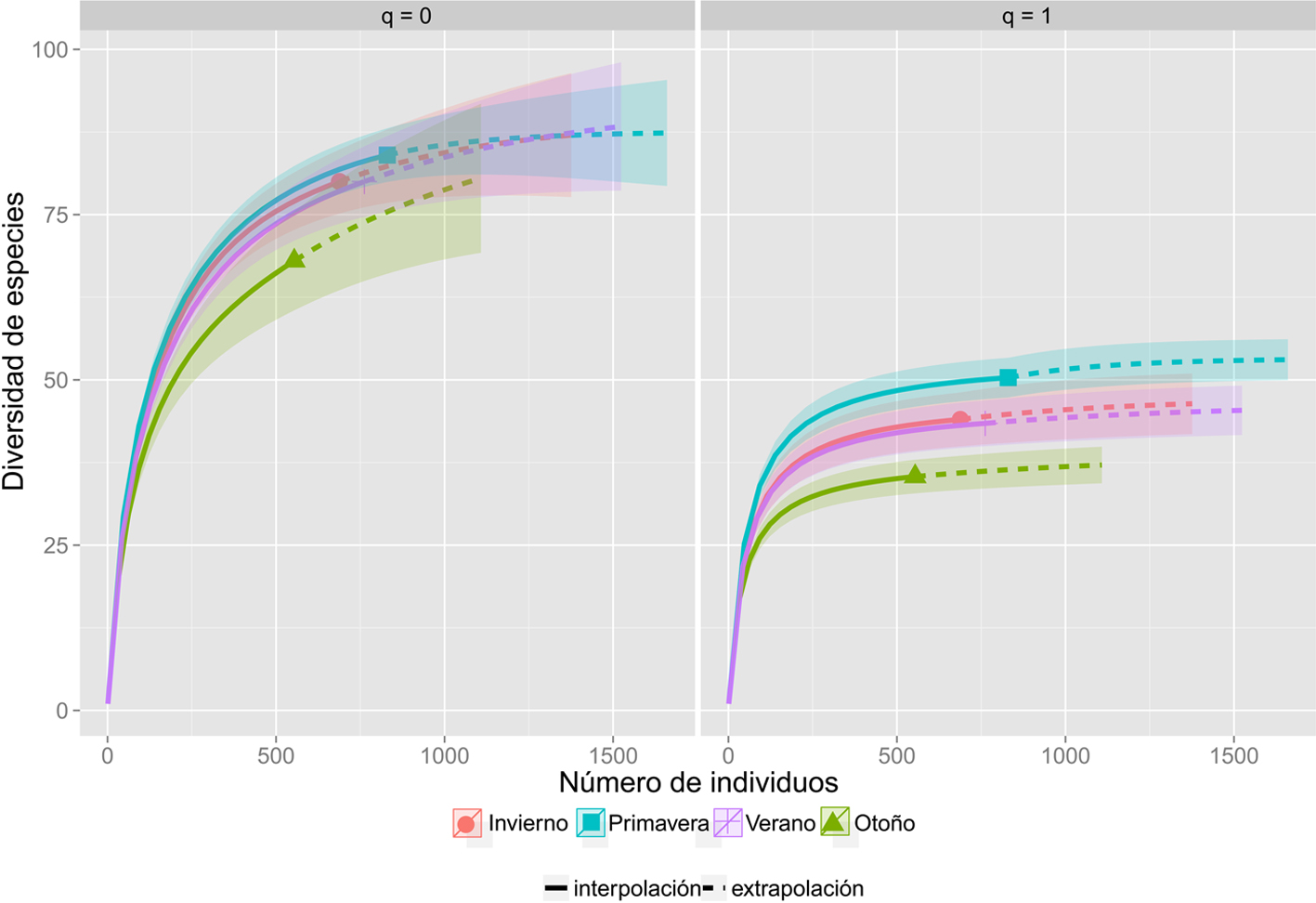
Durante la primavera se registró la mayor diversidad alfa con ambos estimadores (q0 = 84 y q1 = 50.3 especies) y en otoño la menor diversidad (q0 = 68 y q1 = 35.3 especies); mientras que en verano e invierno se obtuvo el mismo valor de diversidad (q0 = 80) y para q1 se obtuvo un valor similar (q1 = 43.4 y q1 = 44, respectivamente) (fig. 3). Si bien se obtuvo un valor similar en la cantidad de especies en estas 2 estaciones, la identidad taxonómica de las especies fue sumamente diferente como se muestra en la diversidad beta.
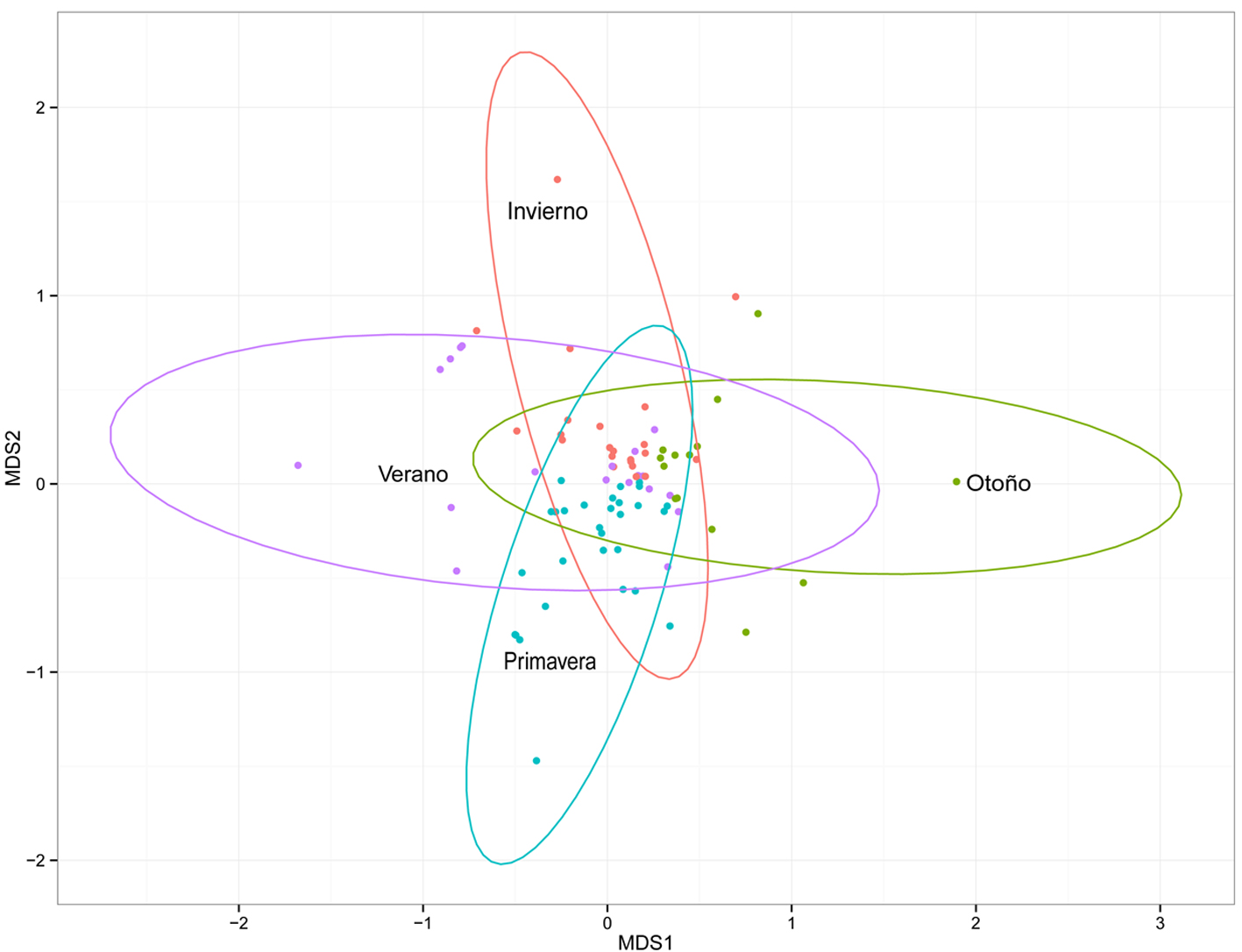
La gráfica del NMDS (estrés = 0.094) reveló un fuerte sobrelapamiento de las elipses que representan las estaciones, lo que indica que hay especies que podemos encontrar en las 4 estaciones; sin embargo, también se observa que los 2 ejes del NMDS resaltaron las diferencias en la composición de las estaciones (fig. 4). Es así como las estaciones verano y otoño se encuentran en posiciones contrarias compartiendo algunas especies (βJ = 0.484); mientras que primavera y verano presentan la menor disimilitud entre las estaciones (βJ = 0.380), es decir comparten más especies.
Las estaciones de primavera y verano son las que comparten el mayor número de especies, con 65 de las 80 especies registradas en ambas estaciones (fig. 5). El muestreo de otoño presentó 10 especies (14.7%) diferentes al resto de los muestreos (Aeronautes saxatalis, Catherpes mexicanus, Icterus parisorum, Leptotila verreauxi, Melospiza lincolnii, Picoides scalaris, Selasphorus platycercus, Spinus pinus, Vireo huttoni y Zenaida macroura) (fig. 5). Esto se debe a que hay 75 especies que están temporalmente, ya sea que respondan a movimientos migratorios altitudinales o latitudinales. Estos patrones fueron apoyados por el análisis Adonis, que mostró una interacción significativa (Adonis: F = 13.93; R2 = 0.26, p < 0.001), lo que indica que la estación es un factor que tiene un efecto significativo en la estructura de la comunidad.
Se registraron 14 especies endémicas de México, de las que destaca la microendémica Cyanocorax dickeyi. De las especies registradas, 2 se encuentran peligro de extinción (Ara militaris y C. dickeyi), 4 amenazadas (Asio stygius, Geothlypis tolmiei, Penelope purpurascens y Euptilotis neoxenus) y 8 bajo protección especial (Accipiter cooperii, A. striatus, Myadestes occidentalis, Myadestes townsendi, Oreothlypis crissalis, Passerina ciris, Ridgwayia pinicola y Streptoprocne semicollaris) (apéndice 1). La mayoría de las especies registradas fueron residentes de la región (96) y 22 migratorias de invierno (apéndice 1).
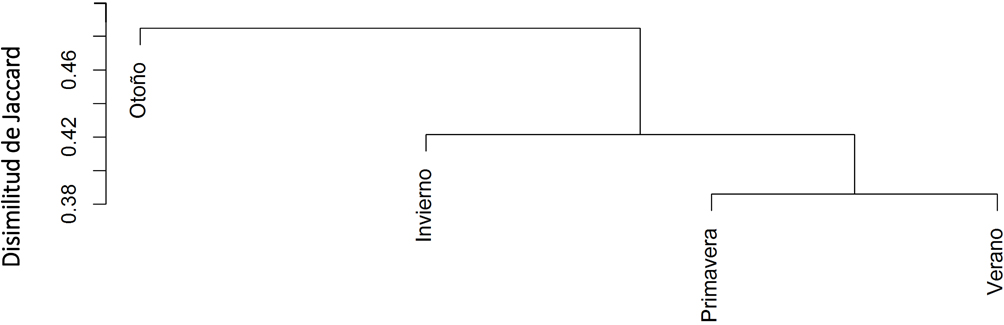
Tabla 2
Medidas de especies efectivas por estación de orden 0 y 1.
|
Diversidad alfa |
||
|
q = 0 |
q = 1 |
|
|
Primavera |
84 |
54.3 |
|
Verano |
80 |
43.4 |
|
Otoño |
68 |
35.3 |
|
Invierno |
80 |
44 |
Discusión
Si bien es importante destacar la alta riqueza de la zona de estudio, fue imprescindible conocer si el esfuerzo del muestreo fue el adecuado para poder establecer la importancia de la zona y proponer acciones a posteriori. Conocer la cobertura de la muestra es un aspecto importante, ya que entre más completa esté la muestra, hay menos probabilidad de que un individuo colectado sea de una especie no registrada (Moreno et al., 2011). En este estudio se obtuvieron valores por encima del 0.96 del Cm, lo que indica que fue una muestra completa con el esfuerzo realizado para los objetivos de este trabajo y hay pocas probabilidades de encontrar especies no detectadas en el muestreo. Sin embargo, es importante reconocer que el trabajo de campo, aunque esté bien establecido y realizado con expertos, suele ser insuficiente para registrar a todas las especies. Un ejemplo de esto es el avistamiento de un águila real (Aquila chrysaetos) fuera de los puntos de muestreo, pero dentro del polígono del área de estudio; no se consideró para los análisis debido a que no sabemos si fue un avistamiento casual, pero sin duda aumenta la riqueza de especies en la zona con un alto valor ecológico.
La estimación de la diversidad a través de números efectivos es ampliamente recomendada cuando se requiere comparar adecuadamente la diversidad de distintas comunidades, ya que acepta que las muestras son representaciones incompletas de las mismas (Moreno et al., 2011). Los resultados de este estudio evidenciaron una tendencia similar al utilizar la diversidad de orden q = 0 y q = 1; donde quedó ratificado que en primavera es cuando se observa la mayor riqueza de especies y en otoño cuando se observa una menor. Este decremento en la riqueza de especies puede deberse a factores bióticos y abióticos como la disponibilidad de alimento y las condiciones ambientales. Si bien en las estaciones de verano e invierno se registró la misma cantidad de especies, el 40% de éstas son taxonómicamente diferentes, lo que nos indica una dinámica temporal de las especies marcado por la entrada y salida de especies migratorias.
La estación de primavera va acompañada con una amplia gama de recursos alimenticios, lo que permitiría la entrada de especies migratorias (Levey y Stiles, 1992); mientras que, en el otoño, el paso de las especies migratorias latitudinales y la búsqueda de alimentos por las especies se ve reflejado en el valor más bajo de riqueza y en el valor más alto de disimilitud. En invierno empieza el arribo de estas especies en búsqueda de alimento, lo que permite que vaya aumentando la diversidad y a su vez permite que haya una menor disimilitud entre estas 2 estaciones (López-Segoviano, Arenas-Navarro et al., 2018).
Sobresalen los registros de la especie en peligro de extinción Ara militaris, que se documentaron en la región con 2 individuos en otoño, 0 en invierno, 6 primavera y 87 individuos en verano; donde se les observó consumiendo frutos de Prunus capuli, que maduran en el verano (Díaz, 2005). De igual manera, se registró la presencia del colibrí migratorio latitudinal (Selasphorus rufus) solo en invierno, cuando hay mayor cantidad de flores de las cuales se alimenta (López-Segoviano, Arenas-Navarro et al., 2018). Esta especie se alimenta principalmente de las flores de Salvia iodantha (López-Segoviano, Bribiesca et al., 2018) y ha sido reportado que su migración se acopla a la fenología floral de esta planta (López-Segoviano, Arenas-Navarro et al., 2018). Se ha propuesto que la fluctuación de los recursos alimenticios es uno de los principales factores que influye en la migración de las especies de aves, ya sea altitudinal o latitudinal (Levey y Stiles, 1992; Newton, 2007), y a su vez, que la migración influye directamente en la composición de la comunidad de aves en la región (Berlanga et al., 2015).
Las especies existen en un espacio y tiempo influenciado por factores ambientales, convirtiéndose en comunidades con arreglos temporales en los que las especies interactúan (Halfter y Moreno, 2005). La disimilitud entre los muestreos podría ser consecuencia de los movimientos migratorios de las especies de aves que se reproducen en Norteamérica y llegan a la región para pasar el periodo de invierno (Berlanga et al., 2008; Del Hoyo et al., 1992; Howell y Webb, 1995; Sibley, 2001). De hecho, la región alberga 22 especies de aves migratorias de invierno. Aunado a ésto, es común que diversas especies de aves realicen movimientos migratorios altitudinales en los sistemas montañosos de América (Boyle, 2017; Levey y Stiles, 1992; Ornelas y Arizmendi, 1995). Estos movimientos son influenciados principalmente por la oferta de recursos a lo largo del gradiente altitudinal (Levey y Stiles, 1992), lo cual ocurre principalmente en especies que dependen de la estacionalidad de la fenología de las plantas de las que se alimentan; por ejemplo, las aves nectarívoras y frugívoras (Levey y Stiles, 1992).
El occidente de México se caracteriza por poseer una gran riqueza de especies de aves y además posee la mayor riqueza de especies de aves endémicas del país, producto de su rango altitudinal y su restricción biogeográfica (Kobelkowsky-Vidrio et al., 2014). Durante este estudio, se registraron 14 especies de aves endémicas de México, lo que representa el 13.46% de las aves endémicas reportadas para el país y 60.86% de aves endémicas reportadas para la región de las montañas del noroeste de México (Berlanga et al., 2008). Las aves endémicas son un componente muy importante que contribuye a elevar la riqueza de especies en México (Navarro-Sigüenza y Sánchez-González, 2003). El noroeste de México es una de las regiones con mayor número de aves endémicas (Peterson y Navarro-Sigüenza, 2000), donde los hábitats constituidos por vegetación de pino-encino, pino y mesófilo de montaña son los más ricos en endemismos (Navarro-Sigüenza et al., 2014). Medina-Macías et al. (2010) realizaron un estudio de las aves de la sierra sur de Sinaloa y Durango en un gradiente altitudinal, donde incluyeron 8 sitios (incluyendo El Palmito) distribuidos desde la selva baja al bosque de pino; sus resultados mostraron que la región de El Palmito presentó la mayor cantidad de especies endémicas. De hecho, de los sitios muestreados en dicho estudio, solo en El Palmito encontraron bosque mesófilo de montaña y bosque de pino-encino. Nuestro estudio se desarrolló en bosque mesófilo de montaña y bosque de pino-encino, pero también se establecieron puntos de conteo en bosque de pino, vegetación secundaria, cultivos y vegetación riparia.
Este estudio mostró que en la Región Prioritaria para la Conservación El Palmito se encuentran un gran número de especies endémicas de México e incluso 3 de ellas, con una categoría de riesgo (C. dickeyi, R. pinicola y S. semicollaris), entre las que destaca C. dickeyi por ser una especie microendémica, en peligro de extinción y de gran importancia para los observadores de aves de todo el mundo. La composición de la comunidad de aves en otoño presentó la mayor disimilitud con respecto al resto de las estaciones. Lo cual puede ser resultado de los movimientos migratorios de las especies de aves en la región, como producto de la fluctuación de los recursos alimenticios.
El Palmito es de gran importancia para la conservación de aves de México, tanto para las especies endémicas como para las especies migratorias latitudinales que usan la región como lugar de alimentación en invierno. Es importante recalcar la relevancia de estos estudios para planes de conservación, ya que a pesar de ser un sitio considerado con alta riqueza y un alto valor turístico, El Palmito es un ejido con manejo forestal, ganadería (no intensiva) y agricultura de temporal; por lo cual es primordial conocer la pérdida o ganancia de la diversidad.
Agradecimientos
Al ejido Forestal El Palmito por el acceso a las instalaciones y el sitio de estudio. Los autores agradecen especialmente a Valo, Santos Vázquez, Sergio Díaz-Infante, Cuauhtémoc Gutiérrez y Bricenia Rodríguez por su ayuda en el trabajo de campo. Agradecemos al Laboratorio de Ecología, UBIPRO Facultad de Estudios Superiores Iztacala, Universidad Nacional Autónoma de México. Este trabajo fue apoyado por el proyecto PAPIIT-UNAM-IN216514.
Referencias
Begon, M., Townsend, C. R. y Harper, J. L. (2006). Ecology: from individuals to ecosystems, 4 Ed. Malden, Massachusetts: Blackwell.
Berlanga, H., Gómez-de Silva, H., Vargas-Canales, V., Rodríguez-Contreras, V., Sánchez-González, L., Ortega-Álvarez R. et al. (2015). Aves de México: lista actualizada de especies y nombres comunes. México D.F.: Conabio.
Berlanga, H., Rodríguez-Contreras, V, Oliveras-de Ita, A, Escobar, M, Rodríguez, L, Vieyra, J. et al. (2008). Red de conocimientos sobre las aves de México (AVESMX). México D.F.: Conabio. Recuperdo el 01 enero, 2018 http://avesmx.conabio.gob.mx/
Boyle, W. A. (2017). Altitudinal bird migration in North America. The Auk, 134, 443–465.
Chao, A. y Jost, L. (2012). Coverage-based rarefaction and extrapolation: standardizing samples by completeness rather than size. Ecology, 93, 2533–2547.
Charney, N. y Record, S. (2009). Jost diversity measures for community data. R Package “Vegetarian” version, 1.
Clements, J., Schulenberg, T., Iliff, M., Roberson, D., Fredericks, T., Sullivan, B. et al. (2017). The eBird/Clements checklist of birds of the world: v2016. Recuperado el 01 junio, 2018 de: http://www.birds.cornell.edu/clementschecklist/download/
Del Hoyo, J., Elliot, A. y Sargatal, J. (1992). Handbook of the birds of the World. Barcelona: Lynx Editions.
Diario Oficial de la Federación (2007, 26 de febrero). Consultado en http://www.funcionpublica.gob.mx/16-2%20SEMARNAT%2007%20PRODERS%20RO
Díaz, J. (2005). Tipos de vegetación y flora del ejido el Palmito, Concordia Sinaloa. Pronatura, A.C. Culiacán, Sinaloa, México. Recuperado el 02 agosto, 2010 de: http://www.conabio.gob.mx/institucion/proyectos/resultados/VegetacionCQ014.pdf
Escalante, P., Navarro-Sigüenza, A. y Peterson, A. (1993). A geographic, ecological, and historical analysis of land bird diversity in Mexico. En A. Lot y J. Fa (Eds.), Biological diversity of Mexico: origins and distribution. New York: Oxford University Press.
González-Elizondo, M. S., González-Elizondo, M., Tena-Flores, J. A., Ruacho-González, L. y López-Enríquez, I. L. (2012). Vegetación de la sierra Madre Occidental, México: una síntesis. Acta Botanica Mexicana, 100, 351–403.
González-Tokman, D., Cultid-Medina, C., Díaz, A., Ocampo-Palacio, L. y Martinez-Garza, C. (2018). Success or failure: the role of ecological restoration on the recovery of dung beetle diversity and function in a tropical rainforest. Revista Mexicana de Biodiversidad, 89, 232–242
Halfter, G. y Moreno, C. (2005). Significado biológico de las diversidades alfa, beta y gama. Sobre diversidad biológica. En G. Halfter, J. Soberón, P. Koleff y E. Mellink (Eds.), El significado de las diversidades, Vol. 4 (pp. 5–18). Zaragoza: m3m-Monografías 3ercer Milenio/ SEA/ Conabio/ Grupo DIVERSITAS/ Conacyt.
Hill, M. O. (1973). Diversity and evenness: a unifying notation and its consequences. Ecology, 54, 427–432.
Howell, S. N. G. y Webb, S. (1995). A guide to the birds of Mexico and Northern Central America. New York: Oxford University Press.
Hsieh, T. C., Ma, K. H. y Chao, A. (2016). iNEXT: an R package for rarefaction and extrapolation of species diversity (Hill numbers). Methods in Ecology and Evolution, 7, 1451–1456.
Jost, L. (2006). Entropy and diversity. Oikos, 113, 363–375.
Kaufman, K. (2005). Kaufman Guía de campo a las aves de Norteamérica. New York: Hillstar Editions L. C.
Kobelkowsky-Vidrio, T., Ríos-Muñoz, C. A. y Navarro-Sigüenza, A. G. (2014). Biodiversity and biogeography of the avifauna of the sierra Madre Occidental, Mexico. Biodiversity and Conservation, 23, 2087–2105.
Legendre, P., Borcard, D. y Peres-Neto, P. R. (2005). Analyzing beta diversity: partitioning the spatial variation of community composition data. Ecological Monographs, 75, 435–450.
Levey, D. J. y Stiles, F. G. (1992). Evolutionary precursors of long-distance migration: resource availability and movement patterns in Neotropical landbirds. The American Naturalist, 140, 447–476.
López-Segoviano, G., Arenas-Navarro, M., Vega, E. y Arizmendi, M. C. (2018). Hummingbird migration and flowering synchrony in the temperate forests of northwestern Mexico. PeerJ, 6, e5131.
López-Segoviano, G., Bribiesca, R. y Arizmendi, M. C. (2018). The role of size and dominance in the feeding behaviour of coexisting hummingbirds. Ibis, 160, 283–292.
Magurran, A. E. (1988). Why diversity? En A. E. Magurran (Eds.), Ecological diversity and its measurement (pp. 1–5). New Jersey: Princeton University Press Princeton.
Medina-Macías, N. M., González-Bernal, M. y Navarro-Sigüenza, A. (2010). Altitudinal distribution of birds in a priority area in Sinaloa-Durango, Mexico. Revista Mexicana de Biodiversidad, 81, 487–503.
Moreno, C. E., Barragán, F., Pineda, E. y Pavón, N. P. (2011). Reanálisis de la diversidad alfa: alternativas para interpretar y comparar información sobre comunidades ecológicas. Revista Mexicana de Biodiversidad, 82, 1249–1261.
Navarro-Sigüenza, A. G., Rebón-Gallardo, M. F., Gordillo-Martínez, A., Peterson, A. T., Berlanga-García, H. y Sánchez-González, L. A. (2014). Biodiversidad de aves en México. Revista Mexicana de Biodiversidad, 85, 476–495.
Navarro-Sigüenza, A. G. y Sánchez-González, L. A. (2003). La diversidad de las aves. En F. González-García y H. de Silva Garza (Eds.), Conservación de aves. Experiencias en México (pp. 24–86). México D.F.: CIPAMEX/ National Fish & Wildlife Foundation/ Conabio.
Newton, I. (2007). The migration ecology of birds. Oxford: Academic Press
Oksanen, J., Blanchet, F., Kindt, R., Legendre, P., O’Hara, R., Simpson, G. L. et al. (2013). Vegan: community ecology package, 2011. R Package version 2.0.9, 1, 17–10.
Ornelas, J. y Arizmendi, M. C. (1995). Altitudinal migration: implications for conservation of avian Neotropical migrants in western Mexico. En M. H. Wilson y S. A. Sader (Eds.), Conservation of Neotropical migratory birds in Mexico (pp. 98–112). Maine: Agricultural and Forest Experiment Station.
Peterson, A. T. y Navarro-Sigüenza, A. (2000). Western Mexico: a significant centre of avian endemism and challenge for conservation action. Cotinga, 14, 42–46
R Core Team (2014). R: a language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. https://www.R-project.org/
Ricklefs, R. E. y Miller, G. L. (1999). Ecology. New York: W. H. Freeman and Company.
Semarnat (Secretaría de Medio Ambiente y Recursos Naturales). (2010). Norma Oficial Mexicana NOM-059-SEMARNAT-2010, Protección ambiental – Especies nativas de México de flora y fauna silvestres – Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio – Lista de especies en riesgo. Diario Oficial de la Federación. 30 de diciembre de 2010, Segunda Sección, México.
Sibley, D. (2001). The Sibley guide to birds. New York: National Audubon Society.
SMN (Servicio Meteorológico Nacional). (2000). Recuperado el 20 septiembre, 2017: http://smn.cna.gob.mx/
Van-Perlo, B. (2006). Birds of Mexico and Central America. Oxford: Princeton.
Wunderle, J. M. (1994). Métodos para contar aves terrestres del Caribe. New Orleans: Southern Forest Experiment Station, Forest Service, US Department of Agriculture.