Wibke Himmelsbach a, Rebecca Jane Friesen b, Marco Aurelio González-Tagle a, *, Andrés Eduardo Estrada-Castillón a y Luis Gerardo Cuéllar-Rodríguez a
a Universidad Autónoma de Nuevo León, Facultad de Ciencias Forestales, Carretera Nacional 85, Km 145, 67700 Linares, Nuevo León, México
b Elk Island National Park, 54401 Range Rd. 203, Fort Saskatchewan, AB, T8L 0V3, Canadá
*Autor para correspondencia: marco.gonzaleztg@uanl.edu.mx (M.A. González-Tagle)
Recibido: 5 abril 2023; aceptado: 5 febrero 2024
Resumen
Últimamente se ha descrito una disminución de la abundancia y diversidad de insectos, así como una alteración del régimen de incendios forestales. Debido a la sensibilidad de las mariposas a los cambios ambientales, se estudió la riqueza de mariposas en 2 bosques, uno afectado por un incendio y otro sin indicios de fuego. Mediante el muestreo en transectos, así como la captura de mariposas con trampas durante las 4 estaciones del año, se determinó la diversidad florística y de mariposas. El análisis de los datos obtenidos mostró que el bosque con fuego presentaba una mayor diversidad de flores y mariposas que el área control. Comparando los 2 bosques, se confirmó una disimilitud de 27% y 41% entre la riqueza de especies de flores y mariposas, respectivamente. Además, se observó una variación significativa en la presencia de flores y mariposas a lo largo del año en el área quemada, la cual no fue significativa en el área control. Por lo tanto, es importante estudiar el efecto de los incendios forestales en la diversidad vegetal y animal, y considerar sus resultados en los planes de manejo forestal.
Palabras clave: Bosque montano árido; Diversidad de flores; Diversidad de mariposas; Incendio forestal; Piroentomología; Sierra Madre Oriental
© 2024 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Post-fire butterfly diversity in a pine-oak forest in northeast Mexico
Abstract
Recently, a decrease in insect abundance and diversity has been described, as well as an alteration of the forest fire regime. Due to the sensitivity of butterflies to environmental changes, we studied the richness of butterflies in two forests, one affected by fire and the other without signs of fire. By means of transect sampling and butterfly trapping during the 4 seasons of the year, the floristic and butterfly diversity was determined. The analysis of the data obtained showed that the forest with fire had a greater diversity of flowers and butterflies than the control area. Comparing the 2 forests, a dissimilarity of 27% and 41% was confirmed between the species richness of flowers and butterflies, respectively. In addition, a significant variation in the presence of flowers and butterflies was observed throughout the year in the burned area, which was not significant in the control area. Therefore, it is important to study the effect of forest fires on plant and animal diversity, and to consider their results in forest management plans.
Keywords: Dry montane forest; Flower diversity; Butterfly diversity; Forest fire; Pyro-entomology; Sierra Madre Oriental
© 2024 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
A nivel global se debate la disminución de las poblaciones de insectos que desempeñan funciones cruciales como polinizadores (Johansson et al., 2020; Mason et al., 2021; Potts et al., 2010). En particular, las mariposas (Orden: Lepidoptera) son insectos altamente sensibles a las variaciones ambientales, como la radiación solar, el viento, el porcentaje de humedad en el aire y los cambios en la composición y estructura de la vegetación (McDermott-Long et al., 2017; Radchuk et al., 2013). Por lo tanto, su presencia o ausencia, así como su diversidad, podrían considerarse indicadores de cambios en los factores ambientales de un sitio, y por extensión, de la presencia de insectos en general (Mason et al., 2021).
En la sierra Madre Oriental de México, los incendios forestales son un fenómeno natural que actúa como un importante disruptor en los bosques montanos áridos, desempeñando un papel crucial en la ecología del paisaje (González-Tagle et al., 2008; Rodríguez-Trejo y Fulé, 2003). Estos incendios generan hábitats propicios para especies de sucesión temprana (Keeley y Pausas, 2019). Sin embargo, en tiempos recientes se ha observado un aumento en la frecuencia de incendios de alta intensidad en la región (Keeley y Pausas, 2019; Rodríguez-Trejo y Fulé, 2003; Yocom et al., 2010), así como a nivel global (Kelly et al., 2020; Mason et al., 2021). Estos incendios suelen consumir una cantidad significativa de biomasa, dejando extensas áreas sin vegetación y exponiendo el suelo a los elementos climáticos. Además de este impacto, alteran las características de los hábitats para la fauna (Gurrutxaga-San Vicente y Lozano-Valencia, 2010; Kelly y Brotons, 2017; Kelly et al., 2020; Potts et al., 2010; Pressler et al., 2019), afectando la disponibilidad de alimento (Mola y Williams, 2018; Saint-Germain et al., 2013) y limitando las oportunidades para el aprovechamiento sostenible de los recursos naturales proporcionados por la vegetación forestal.
Los incendios forestales constituyen un componente natural de la ecología de los bosques de la Sierra Madre Oriental. La evaluación de la severidad de un incendio varía según el ecosistema. En los bosques, por ejemplo, se determina dicha severidad considerando la mortalidad de los árboles, la pérdida de copas, o la quema de troncos y copas (Keeley, 2008). Esta evaluación se clasifica como baja, moderada o alta, dependiendo del impacto de la intensidad del fuego en las comunidades vegetales y su capacidad de recuperación (DellaSala, 2018). Un incendio de baja severidad se distingue por una baja intensidad térmica y efectos mínimos en los árboles del sotobosque, permitiendo que la mayoría de los árboles sobrevivan el evento ígneo (DellaSala, 2018). En contraste, un incendio de alta intensidad, con efectos severos en la vegetación, resulta en la muerte de la mayoría de los árboles en una zona específica (> 75%) (DellaSala, 2018). Por otro lado, un incendio de intensidad media se caracteriza por afectar entre 25% y 75% en la vegetación (Keeley, 2009).
En el noreste de México el régimen de incendios se caracteriza por la ocurrencia frecuente de incendios superficiales, los cuales se presentan aproximadamente cada 8.6 a 9.6 años (Yocom et al., 2010). En contraste, los incendios forestales de mayor severidad tienen una periodicidad que oscila entre 11.9 y 18.6 años (Yocom et al., 2010). La sucesión de la vegetación postincendio muestra un predominio de especies de encino (Quercus spp.) en las etapas tempranas; mientras que en los bosques maduros, los pinos (Pinus spp.) son el género dominante (González-Tagle et al., 2008). En 2016 un área de 580 ha de bosque pino-encino en el poblado de Ciénega de González (25°22’22.8” N, 100°14’46.0” O) en el Parque Nacional Cumbres de Monterrey, Nuevo León, fue afectado por un incendio clasificado de severidad moderada según la clasificación de Keeley (2009).
En general, los incendios forestales tienen un impacto significativo en la economía de las personas que residen en áreas de bajos ingresos o en entornos rurales (Visram, 2022). Esta situación, combinada con la representación mediática de los incendios forestales, ha contribuido a generar una percepción negativa entre la población en general (Doerr y Santín, 2016). En contraste, los incendios de baja o moderada severidad podrían tener efectos positivos en ciertos grupos de flora y fauna al promover la fragmentación y diversidad del paisaje (Gurrutxaga-San Vicente y Lozano-Valencia, 2010; Pausas y Keeley, 2019). Es importante destacar que los impactos de las perturbaciones en los ecosistemas pueden variar entre diferentes grupos o especies de flora y fauna, pudiendo ser tanto negativos como positivos (Hill et al., 2021; Kelly et al., 2020).
En consecuencia, resulta crucial comprender los efectos que diversas perturbaciones pueden tener en las áreas forestales, a fin de incorporarlos de manera efectiva en los planes de gestión. Por lo tanto, el propósito de este estudio es examinar el impacto que un incendio de severidad moderada ha tenido en la población de flores y mariposas en el Parque Nacional Cumbres de Monterrey, con especial atención en la diversidad específica de ambos grupos.
Materiales y métodos
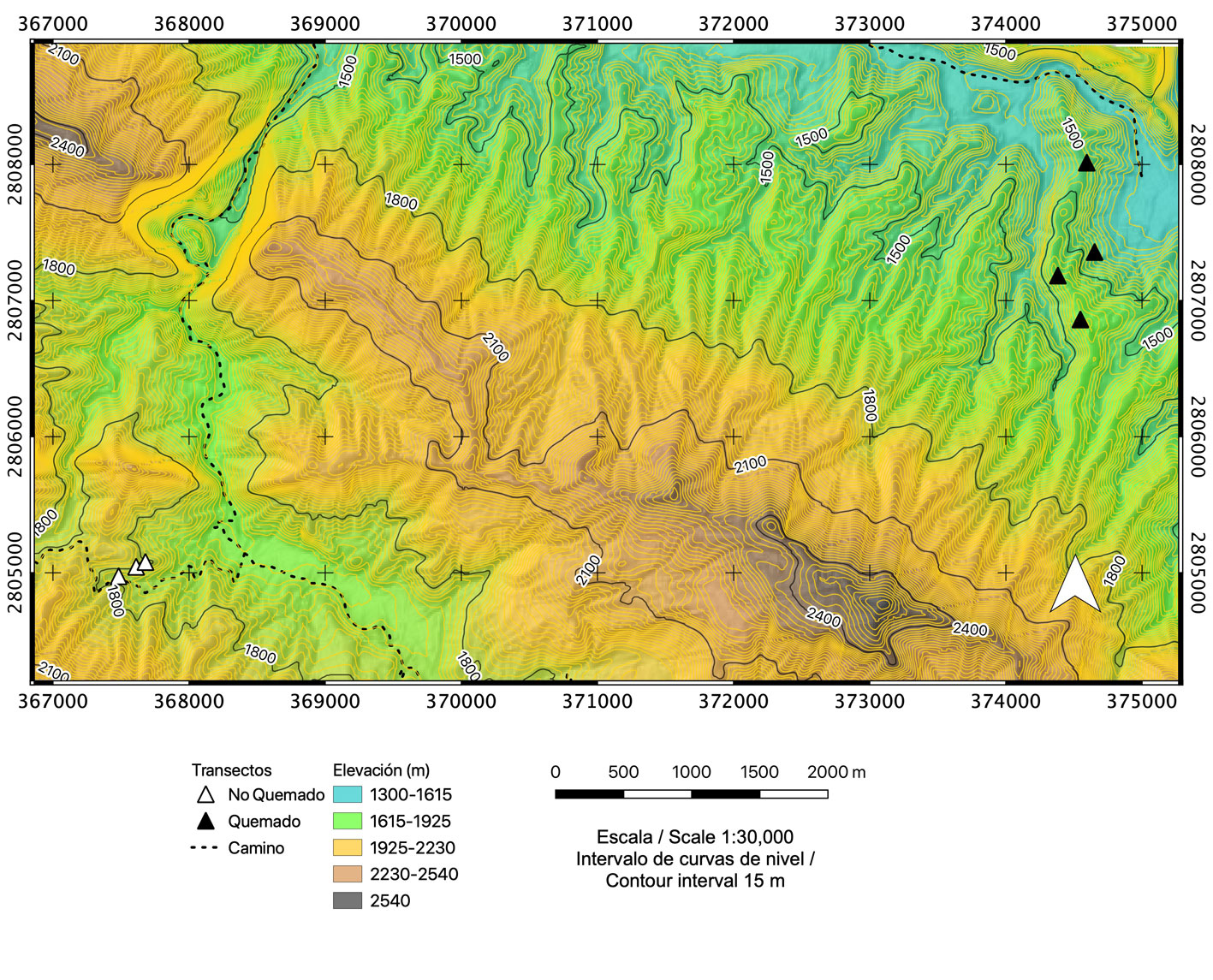
El estudio se realizó en el Parque Nacional Cumbres de Monterrey (PNCM), en Nuevo León, México (fig. 1). El PNCM abarca 8 municipios, incluido el municipio de Santiago, con una superficie de 177,395 ha entre 600 y 3,400 m snm (Cantú-Ayala et al., 2010, 2013).
Se seleccionaron un total de 8 sitios de estudio, distribuidos equitativamente entre un área afectada por un incendio de severidad moderada y un bosque sin señales de fuego, como se ilustra en la figura 1. Los 4 sitios afectados por el incendio se encuentran en las proximidades del poblado de Ciénega de González (25°22’22.8” N, 100°14’46.0” O), mientras que los 4 sitios de control se ubican cerca del poblado de Las Guacamayas (25°21’28.2” N, 100°18’45.3” O; fig. 1).
El clima en el municipio de Santiago se clasifica como templado y subhúmedo, destacándose por las precipitaciones pluviales durante el verano y una humedad media, según la información proporcionada por Conanp (2006). La temperatura promedio anual oscila entre 9 °C y 24 °C, mientras que la precipitación anual en el PNCM varía de 344 a 983 mm. Este intervalo incluye estaciones lluviosas y secas notables (Cuervo-Robayo et al., 2014; Sandoval-García et al., 2021).
El área de estudio abarcó altitudes que oscilaron entre 1,500 y 1,800 m, ubicándose en laderas con orientación hacia al este para minimizar las variaciones en el microclima. En todos los sitios seleccionados, se identificaron los suelos como litosoles, predominante en el PNCM. Estos litosoles se caracterizan por capas poco profundas de suelo que recubren roca dura o material calcáreo, así como suelos altamente rocosos (Conanp, 2006; Gómez-Murillo et al., 2016; Sandoval-García et al., 2021).
En términos generales, la vegetación característica de las regiones áridas y semi-áridas abarca una extensa porción del PNCM (Cantú-Ayala et al., 2013; Conanp, 2006). El tipo de vegetación predominante en el área de investigación corresponde a un bosque montano árido compuesto principalmente por especies de pino-encino. Entre los árboles comunes presentes, se encuentran Abies vejarii Martínez, Arbutus sp. L., Cercis canadensis L., Dasylirion sp. Zucc., Lippia sp. L., Picea sp. Link, Pinus strobiformis Engelm., P. cembroides Zucc., P. greggii Engelm. ex Parl., P. hartwegii Lindl., P. pinceana Gordon & Glend., P. pseudostrobus Lindl., P. rudis Endl., P. teocote Schiede ex Schltdl. & Cham., Quercus fusiformis Small, Q. greggii (A.DC.) Trel., Q. hypoxantha Trel., Q. laeta Liebm. y Q. saltillensis Trel. (Estrada-Castillón et al., 2013).
El área de control se ubicó en las proximidades del poblado Las Guacamayas (25°21’28.2” N, 100°18’45.3” O) dentro de un bosque de pino-encino, el cual no presenta registros ni evidencias de incendios, al menos en las últimas 2 a 3 décadas (fig. 1). Los bosques maduros de pino-encino constituyen el tipo de vegetación predominante en esta área, siendo las especies arbóreas dominantes Pinus pseudostrobus y P. teocote, con una edad aproximada de 60 años. La ausencia de rastros de incendios en el suelo, troncones derribados o fustes, así como en los árboles en pie, permite considerar que el área no ha sido afectada por incendios durante un extenso período (Meddens et al., 2018; Meigs et al., 2020), estimado en 30-60 años para el área de investigación. Adicionalmente, los bosques de pino-encino se identifican como la vegetación clímax en el área, de acuerdo con los procesos naturales de sucesión (González-Tagle et al., 2008).
Entre febrero de 2018 y enero de 2019, equipos compuestos por 3 personas llevaron a cabo un total de 10 visitas de campo, asegurándose de que transcurrieran al menos 13 días entre cada una. Para garantizar la consistencia de los datos de ambos sitios, se realizó el registro en momentos aproximadamente idénticos del día y bajo condiciones meteorológicas similares o iguales en todas las visitas. En líneas generales, las observaciones y registros de campo se llevaron a cabo en condiciones meteorológicas favorables, con temperaturas superiores a 17 °C, vientos moderados, escasas precipitaciones y niveles de nubosidad acotados, según se describe en Pollard y Yates (1993).
Se colocaron 8 transectos en total, cada uno con una longitud de 200 m, en ambas áreas de estudio, específicamente, 4 en el área afectada por el fuego y otros 4 en el área control. En los extremos de cada transecto, se delimitaron cuadrantes de 2 × 2 m (Adamidis et al., 2019; Gaigher et al., 2021; Serrat et al., 2015). En total, se designaron 16 cuadrantes de 4 m2, distribuidos equitativamente entre el sitio quemado y el sitio control, con el propósito de realizar observaciones y registros florales a lo largo de 1 año, abarcando los meses de febrero, marzo, mayo, junio, julio, agosto, noviembre de 2018 y enero de 2019.
Antes de registrar los datos en cada fecha de muestreo, se procedió a medir la velocidad del viento, la temperatura y la humedad relativa del aire en cada fecha de muestreo. Para ello, se utilizaron un termómetro de bolsillo, un dispositivo de medición para el viento de la marca Dwyer y un psicrómetro portátil (Forestry Suppliers, Jackson, MS, USA).
La estimación de los porcentajes de cobertura del sotobosque y de los pastizales se llevó a cabo de manera visual en cada cuadrante de muestreo, siguiendo las metodologías propuestas por Adamidis et al. (2019), Cleary y Genner (2004) y Johansson et al. (2020).
Por otro lado, la apertura del dosel se midió desde el centro de cada cuadrante utilizando una cubierta transparente específica para el dosel (Brown et al., 2000; Cleary y Genner, 2004; Johansson et al., 2020). Adicionalmente, se registró el número de árboles con diámetros mayores a 15 cm a la altura del pecho en cada transecto, proporcionando así información relevante para el análisis del ecosistema en estudio.
En cada fecha de muestreo, se llevaron a cabo el conteo y la identificación de todos los individuos de flores ubicados dentro de un límite de 0.5 m perpendicular a la línea media del transecto. Este proceso se realizó mediante el uso de guías de identificación (Debinski et al., 2010). Aquellos especímenes no identificados en campo fueron capturados en fotografías y posteriormente identificados en la Facultad de Ciencias Forestales de la Universidad Autónoma de Nuevo León, con el respaldo de la colección de plantas disponibles en el herbario de la institución. La identificación del material vegetal se llevó a cabo considerando tanto las partes verdes de la planta como las flores.
Se emplearon 2 métodos diferentes para el registro de las mariposas: la observación durante el recorrido a lo largo del transecto (Dennis et al., 2017; Pollard y Yates, 1993); así como un monitoreo que implicó la captura de mariposas mediante trampas, con base en la técnica de Van Sømeren-Rydon (Platt, 1969). En el muestreo a lo largo del transecto, se contabilizaron todos los individuos ubicados a 3 m del observador y a una distancia lateral de 2 m respecto al transecto. Todas las observaciones y registros de datos relacionados con flores y mariposas fueron realizados por las mismas personas, quienes utilizaron guías de identificación para llevar a cabo el proceso (Garwood y Lehman, 2005). Aquellas especies que no pudieron ser identificadas en el campo fueron fotografiadas o capturadas con redes entomológicas, contando con el permiso de los propietarios del terreno, para posteriormente ser identificadas y preservadas en el Laboratorio de Entomología de la Facultad de Ciencias Forestales.
Para llevar cabo el muestreo mediante trampas, se dispusieron 2 de éstas con cebo de plátano en cuadrantes previamente establecidos de manera aleatoria en áreas de 2 × 2 m (Platt, 1969). Este procedimiento se replicó tanto en el área afectada por el incendio como en el área de control. Para la selección del cebo, se realizaron pruebas preliminares en el campus de la Facultad de Ciencias Forestales utilizando materiales fácilmente accesibles. Finalmente, se optó por el cebo que demostró mayor eficacia al atraer una mayor diversidad de especies e individuos de mariposas.
La altura de las trampas con respecto al suelo se fijó en aproximadamente 30-50 cm, y éstas permanecieron abiertas durante 4 horas, entre las 9:30 a.m. y las 16:30 p.m. Al concluir cada sesión, se procedió a la identificación de las especies capturadas mediante la consulta de literatura especializada. Los individuos reconocidos fueron contados y liberados, los que no, se recolectaron para su análisis posterior en el Laboratorio de Entomología de la Facultad de Ciencias Forestales.
En cuanto a la identificación de las mariposas adultas, se utilizó como referencia la guía “Mariposas del Noreste de México” (Garwood y Lehman, 2005). Este enfoque metodológico permitió obtener datos precisos y detallados a escala de género sobre la composición de las especies y morfoespecies de mariposas presentes en las áreas de estudio.
Análisis de datos. Se realizó un análisis de estimación de la completitud para cada elemento (mariposas y flores) con la finalidad de comprobar que los datos muestreados fueron suficientes (López-Segoviano et al., 2019). Los análisis se realizaron con el Software R ver 4.1.2 (R Core Team, 2023) y la librería iNEXT ver 3.0.0 (Hsieh et al., 2016).
El registro de las especies encontradas y las cantidades de individuos por especie se ordenaron por área y fecha en una base de datos para su posterior análisis en el software R ver 4.1.2 (R Core Team, 2023). Los datos fueron transformados logarítmicamente (log10) con el propósito de lograr una distribución normal y la homogeneidad de varianzas. La normalidad de los datos se evaluó mediante la prueba de Shapiro-Wilk y la prueba homogeneidad de varianzas se determinó con una prueba de F (Köhler et al., 2012).
Para la comparación de la riqueza de especies de flores y de mariposas observada entre las áreas quemadas y control, se aplicó una prueba de comparación de medias (Köhler et al., 2012; Magurran, 1988). Para el caso de la riqueza de mariposas, los datos no presentaron una distribución normal y varianza homogénea por lo que se aplicó la prueba de rangos de Wilcoxon (Köhler et al., 2012; Magurran, 1988).
Para comparar la riqueza de especies —flores y mariposas— a lo largo del tiempo —febrero 2018 a enero 2019— en ambas áreas, se aplicó un análisis de varianza (Köhler et al., 2012; Magurran, 1988). En caso de existir diferencias significativas se analizaron los datos posteriormente con la prueba de Tukey (Gardener, 2017; Köhler et al., 2012). En los casos que no se cumplió la normalidad, se aplicó la prueba de Kruskal-Wallis (Köhler et al., 2012).
Para la diversidad alfa de flores y mariposas se utilizaron 3 medidas basadas en el número efectivo de especies a partir de la transformación de qD: diversidad de orden cero (q = 0) que equivale al número de especies, diversidad de orden uno (q = 1), donde el peso de cada una de las especies es proporcional a su abundancia en la muestra y la diversidad de Simpson (q = 2, la inversa de la concentración de Simpson) (Jost, 2006). EL cálculo de la diversidad alfa se realizó con el Software R ver 4.1.2 (R Core Team, 2023) y la librería iNEXT ver 3.0.0 (Hsieh et al., 2016).
Además de los índices de diversidad alfa, se analizó la semejanza en diversidad de flores y mariposas de las 2 áreas con el índice de disimilitud de Bray y Curtis (Magurran, 1988). En un análisis de la composición cualitativa de 2 grupos se indica cuánto se parecen las diversidades de especies registradas de las 2 áreas, quemada y no quemada. El índice BC varía entre 0 y 1, valores altos significan mayor similitud y valores bajos menor similitud (Clarke et al., 2014). Para facilitar la interpretación de estos valores y resaltar la disimilitud, se resta el BC de uno y se interpreta luego de la siguiente manera: valores altos representan mayor disimilitud y valores bajos mayor similitud (Gardener, 2017).
Finalmente, se calculó la correlación de Pearson entre la diversidad de especies de flores y mariposas de cada tratamiento, área quemada y área control. Para estos cálculos se tomaron los valores promedios por fecha de muestreo (Magurran, 1988; R Core Team, 2023).
Resultados
La evaluación de completitud indicó que la recolección de especies de flores y mariposas fue adecuadamente representativa (tabla 1). Los índices de SC (completitud de muestras) revelaron un valor de 0.99 en las áreas quemado (B) y control (C) para las flores. En cuanto a las mariposas, los valores de SC oscilaron alrededor de 0.98 en ambas áreas (tabla 1).
Tabla 1
Diversidad alfa y el índice de disimilitud de Bray-Curtis para evaluar la presencia de flores y mariposas en 2 áreas distintas (quemada B y no quemada C) de un bosque de pino-encino en el Parque Nacional Cumbres de Monterrey, Nuevo León, México. Se presenta la diversidad de especies de orden q0 (riqueza de especies), q1 (diversidad Shannon) y q2 (diversidad Simpson) según la clasificación de Jost (2006).
| Ensamblaje | Estimador | B | C |
| Flores | q0 (riqueza de especies) | 42 | 27 |
| q1 (diversidad Shannon) | 18.73 | 7.73 | |
| q2 (diversidad Simpson) | 13.58 | 4.90 | |
| SC (completitud) | 0.99 | 0.99 | |
| 1-BC (disimilitud) | 0.27 | ||
| Mariposas | q0 (riqueza de especies) | 49 | 24 |
| q1 (diversidad Shannon) | 18.97 | 7.43 | |
| q2 (diversidad Simpson) | 10.96 | 3.82 | |
| SC (completitud) | 0.98 | 0.96 | |
| 1-BC (disimilitud) | 0.42 |
En términos generales, se documentaron un total de 5,193 individuos de flores, distribuidos en 16 familias, 38 géneros, 42 especies y 8 morfoespecies (apéndice 1). La cantidad de individuos de mariposas identificadas ascendió a 881, distribuidos en 6 familias, 38 géneros y 40 especies y 12 morfoespecies (apéndice 2). Se observaron varios solapamientos en las especies encontradas en ambas áreas, con 16 especies de flores (30%) y 21 especies de mariposas (40%) compartidas entre ellas.
Al comparar la diversidad alfa de especies de flores y mariposas de las 2 áreas, se destacaron notables diferencias, como se muestra en la tabla 1 y figura 2. Los resultados obtenidos indican que el área quemada exhibió una mayor riqueza de especies (diversidad del orden 0) con referencia a la abundancia total de especies tanto de flores (q0 = 42 especies) como de mariposas (q0 = 49 especies). En contraste, el área no quemada mostró una riqueza de especies menor de flores (q0 = 27 especies) y de mariposas (q0 = 24 especies) (tabla 1, fig. 2). Los apéndices 1 y 2 contienen una lista de las especies de flores y mariposas observadas en las 2 áreas, respectivamente.
Igualmente, la diversidad de orden 1 (q = 1, Shannon) que pondera todas las especies proporcionalmente a su abundancia en la comunidad, fue mayor en la zona quemada tanto para las flores (q1 = 18.73) como para las mariposas (q1 = 18.97). En comparación, el área no quemada mostró una diversidad menor de flores (q1 = 7.73) y de mariposas (q1 = 7.43) (tabla 1, fig.2). Los valores de q2 (el inverso del índice de Simpson) muestran que el área quemada presentó, significativamente, un número mayor de especies dominantes de flores (13.58) y mariposas (10.96) que el área de control (4.90 y 3.82 de flores y mariposas, respectivamente) (tabla 1).
La diversidad de especies de flores resultó ser considerablemente mayor en el área quemada (B) en comparación con el área no quemada (C). La prueba de T confirma de manera estadísticamente significativa esta diferencia (p = 0.0038) entre ambas áreas. De manera similar, la disparidad en la diversidad de especies de mariposas fue altamente significativa (p = 0.00017) entre el área quemada y no quemada.
Al analizar la riqueza efectiva de especies a lo largo de un año en relación con la abundancia total de especies de flores y mariposas en el área de estudio, se observó que el número efectivo de especies de flores (q0) fue más alto en julio (15), agosto (20) y noviembre (18) en el área quemada (B), según se detalla en tabla 2. En contraste, en el área control (C), la mayor riqueza efectiva de especies de flores (q0) se registró en los meses junio (8), julio (10) y agosto (10) como se presenta en la tabla 2 y la figura 3. Se observaron tendencias similares en la diversidad de mariposas a lo largo del tiempo, con un mayor número efectivo de especies de mariposas (q0) en el área quemada y durante los meses de verano (tabla 2, fig. 3). En el área quemada (B), el número efectivo de especies de mariposas fue más alto en junio (24), julio (20) y agosto (25), mientras que, en el área de control, los meses junio (11), julio (12) y noviembre (7) presentaron la mayor riqueza efectiva de especies (tabla 2, fig. 3).
La diversidad de especies de flores moderadamente abundantes, medida mediante el exponente del índice de diversidad de Shannon (q1), varió entre 7 y 12.37 en los meses de verano (junio, julio y agosto) en el área quemada (B). En contraste, en el área de control (C), los valores más altos de estas especies se obtuvieron en los meses julio (4.09), agosto (5.15) y noviembre (5.80) (tabla 2, fig. 3). Asimismo, los meses de junio (B: 14.82 y C: 9.12), julio (B: 12.99 y C: 8.80) y agosto (B: 16.36 y C: 4.76) destacaron como los más abundantes en especies de mariposas, según los valores de q = 1 en ambas áreas (tabla 2, fig. 3).

Los valores de q2, que representan el inverso del índice de Simpson, indican que durante los meses cálidos de mayo a agosto (rango de 5.18-9.54), se observa un número significativamente mayor de especies dominantes en flores y mariposas en el área quemada, según se detalla en tabla 2. En contraste, en el área de control, los valores de q2 variaron entre 3.55 (agosto), 3.77 (mayo) y 5.63 (noviembre) para las flores (tabla 2). En ambas áreas, se registró un mayor número de especies dominantes de mariposas en los meses de junio (B: 10.23 y C: 7.9), julio (B: 10.09 y C: 6.72) y agosto (B: 11.78 y C: 4.50) (tabla 2).
El área afectada por el incendio mostró una variación notable en la riqueza de flores (p = 0.001) y mariposas (p = 0.0029) a lo largo del tiempo (tabla 3). Por el contrario, en el área no afectada (C), la variación en la riqueza de flores (valor de p = 0.086) y mariposas (valor de p = 0.054) a lo largo del tiempo no alcanzó significancia estadística (tabla 3).
Diversidad beta. Se observaron discrepancias parciales en la identidad taxonómica de las especies destacadas mediante el índice de disimilitud de Bray y Curtis, con valores de 0.27 y 0.42 para las especies de flores y mariposas, respectivamente (tabla 1). De este modo, la similitud en la composición de flores entre las 2 áreas fue de 73%, lo que implica una disimilitud de 27% (tabla 1). En contraste, la similitud en la diversidad de mariposas fue notablemente menor, alcanzando 58% en comparación con las flores. La comparación entre las 2 áreas reveló una disimilitud de 42% en la diversidad de mariposas (tabla 1).
Tabla 2
Diversidad alfa de flores y mariposas en un año para evaluar la presencia de flores y mariposas en 2 áreas diferentes (quemada B y no quemada C) de un bosque de pino-encino en el Parque Nacional Cumbres de Monterrey, Nuevo León, México. Se presenta la diversidad de especies de orden q0 (riqueza de especies), q1 (diversidad Shannon) y q2 (diversidad Simpson) según la clasificación de Jost (2006). ND = No hay datos disponibles.
| Gpo. | Área | Estimador | 2018 | 2019 | ||||||
| Feb | Mar | May | Jun | Jul | Ago | Nov | Ene | |||
| Flores | Quemada (B) | q0 (R. de especies) | 1.00 | 13.00 | 11.00 | 14.00 | 15.00 | 20.00 | 18.00 | 1.00 |
| q1 (D. Shannon) | 1.00 | 4.72 | 6.98 | 7.11 | 7.16 | 12.37 | 6.47 | 1.00 | ||
| q2 (D. Simpson) | 1.00 | 3.16 | 5.83 | 5.18 | 5.42 | 9.54 | 4.15 | 1.00 | ||
| SC (Completitud) | 1.00 | 0.98 | 0.98 | 0.98 | 0.98 | 0.98 | 0.99 | 0.98 | ||
| Control (C) | q0 (R. de especies) | ND | 8.00 | 5.00 | 8.00 | 10.00 | 10.00 | 6.00 | 2.00 | |
| q1 (D. Shannon) | ND | 1.59 | 4.09 | 2.16 | 4.09 | 5.15 | 5.80 | 1.75 | ||
| q2 (D. Simpson) | ND | 1.22 | 3.77 | 1.53 | 2.96 | 3.55 | 5.63 | 1.60 | ||
| SC (Completitud) | ND | 1.00 | 1.00 | 0.96 | 1.00 | 1.00 | 1.00 | 1.00 | ||
| Mariposas | Quemada (B) | q0 (R. de especies) | 4.00 | 18.00 | 10.00 | 24.00 | 20.00 | 25.00 | 16.00 | 5.00 |
| q1 (D. Shannon) | 4.00 | 7.35 | 7.14 | 14.82 | 12.99 | 16.36 | 5.06 | 4.37 | ||
| q2 (D. Simpson) | 4.00 | 3.94 | 5.78 | 10.23 | 10.09 | 11.78 | 2.70 | 3.77 | ||
| SC (Completitud) | 0.18 | 0.90 | 0.90 | 0.89 | 0.89 | 0.91 | 0.99 | 0.49 | ||
| Control (C) | q0 (R. de especies) | 3.00 | 6.00 | 4.00 | 11.00 | 12.00 | 5.00 | 7.00 | 2.00 | |
| q1 (D. Shannon) | 2.09 | 2.12 | 3.59 | 9.21 | 8.80 | 4.76 | 3.01 | 2.00 | ||
| q2 (D. Simpson) | 1.68 | 1.50 | 3.27 | 7.90 | 6.72 | 4.50 | 2.24 | 2.00 | ||
| SC (Completitud) | 0.81 | 0.99 | 0.76 | 0.79 | 0.68 | 0.39 | 0.95 | 0.67 |
Tabla 3
Diferencias significativas comparando la riqueza de especies de flores y mariposas a lo largo de un año en 2 áreas distintas (quemada B y no quemada C) de un bosque de pino-encino en el Parque Nacional Cumbres de Monterrey, Nuevo León, México. Resultados de los análisis de varianza (Anova) y la prueba de Kruskal-Wallis. Las diferencias son: * altamente significativas, ** sumamente significativas.
| Grupo | Área | Prueba | Anova | ||
| DF | Valor de F/chi2 | Valor de p | |||
| Flores | B | Anova | 7 | 12.15 | < 0.001** |
| C | Anova | 6 | 2.27 | 0.0864 | |
| Mariposas | B | Anova | 7 | 4.54 | 0.0029* |
| C | Kruskal-Wallis | 7 | 13.85 | 0.0539 |
El análisis de correlación (coeficiente de correlación de Pearson) entre la riqueza de flores y mariposas resultó positivo (0.80) y muy significativo (valor de p < 0.01) para los datos registrados en el área quemada (B) (tabla 4). En el área de control (C) no se encontró una relación significativa (p > 0.05) entre la diversidad de flores y mariposas presentes en el lugar (tabla 4).
Tabla 4
Coeficiente de correlación de Pearson relacionando la diversidad de flores y mariposas para las 2 áreas, quemado (B) y no quemado (C).
| Área | Coeficiente de correlación | Valor de p | Significancia |
| B quemada | 0.80 | 0.01 | Alta |
| C no quemada | 0.32 | 0.48 | Nula |
Discusión
La diversidad de especies en ambas áreas analizadas evidenció un registro total de 50 especies y morfoespecies de flores, así como 52 especies y morfoespecies de mariposas (apéndices 1, 2). Caso contrario, Casas-Pinilla et al. (2017) documentaron la presencia de 121 especies de mariposas en un bosque seco tropical en Colombia. Por otra parte, estudios a nivel global han identificado una relación significativa entre la cobertura vegetal, su composición y la diversidad de especies de mariposas (Houlihan et al., 2013; Keren et al., 2022; Matteson y Langellotto, 2010; Mukherjee et al., 2018). Sin embargo, otros estudios destacan que la reducción en la diversidad de especies de flora suele correlacionarse con una disminución en la diversidad de especies de mariposas (Mukherjee et al., 2015; Tam KinChung y Bonebrake, 2016).

Los resultados obtenidos señalan que la presencia de un área afectada por un incendio de mediana intensidad contribuye en cierta medida al aumento de la diversidad de flores y mariposas en un bosque de pino-encino en el Parque Cumbres de Monterrey, enclavado en la sierra Madre Oriental. Este incremento en diversidad podría atribuirse al cambio de la complejidad estructural y biológica a nivel de paisaje, lo cual permite el desarrollo de diversas flores en el área afectada por el fuego. Se ha documentado que la abundancia de especies de mariposas está estrechamente relacionada con la disponibilidad de plantas nectarinas y fanerógamas, las cuales desempeñan un papel crucial en su alimentación durante la etapa adulta (Berg et al., 2011; Rubene et al., 2015; Wix et al., 2019). En consecuencia, la abundancia y diversidad de mariposas nectarívoros en su fase adulta se verá favorecida positivamente por la presencia de una amplia variedad de plantas fanerógamas, como indican estudios previos (Johansson et al., 2020; Lucas et al., 2017; Wix et al., 2019). Por otra parte, las trampas utilizadas en el estudio fueron diseñadas para atraer mariposas acimófagas o frugívoras (DeVries y Walla, 2001; DeVries et al., 1997; Lucci Freitas et al., 2014). En cambio, la mayoría de las mariposas observadas en los transectos fueron del gremio alimenticio de las nectívoras.
En este estudio, las trampas fueron colocadas exclusivamente en el sotobosque. Sin embargo, vale la pena señalar que otros investigadores que exploraron la diversidad de mariposas optaron por situar sus trampas tanto en el sotobosque como en el dosel (DeVries y Walla, 2001; DeVries et al., 1997). A pesar de esta diferencia metodológica, los resultados obtenidos indicaron que la diversidad de especies de mariposas fue más notable en el sotobosque en comparación con el dosel, especialmente en lo que respecta a las especies menos comunes (DeVries y Walla, 2001; DeVries et al., 1997).
En términos generales, existe un conocimiento limitado sobre las comunidades de polinizadores en los bosques, particularmente en lo que respecta a las interacciones complejas entre la disponibilidad de fuentes nutricionales y refugio para la reproducción (Rodríguez y Kouki, 2015). Se sugiere que las investigaciones futuras aborden esta brecha mediante la inclusión de variables adicionales relacionadas con la diversidad y estructura de la vegetación en las áreas de estudio, con el fin de ofrecer explicaciones más sólidas sobre la diversidad de especies de mariposas. Asimismo, se destaca la importancia de analizar la conectividad entre áreas que proporcionan alimento y hábitats para la reproducción y el desarrollo de las larvas a nivel paisajístico. Además, se recomienda el establecimiento de métodos de muestreo adicionales para mejorar, tanto el conteo, como la identificación de especies de mariposas.
La riqueza de flores y mariposas experimentó notables variaciones a lo largo del año, destacándose 2 picos en marzo y durante los meses de verano. Esta fluctuación mostró cambios más pronunciados en el área afectada por el incendio (B), mientras que en el sitio no afectado (C) la variación de la riqueza de flores y mariposas presentó menos oscilaciones a lo largo del año. De esta manera, los incendios forestales parecen tener un impacto significativo en la diversidad temporal de flores y mariposas en un piroecosistema o un ecosistema adaptado a la presencia de incendios forestales (Harper et al., 2016). Además, al considerar a las mariposas como indicadores, su influencia se extiende a la disponibilidad de alimento para sus depredadores, como aves, mamíferos y réptiles (Harper et al., 2016).
La diversidad de mariposas mostró una correlación significativa con la diversidad de flores en el área afectada por el incendio de media severidad (B). Sin embargo, en el área de control (C) no se obtuvo una correlación significativa entre la diversidad de flores y mariposas. Parece que el incendio provocó cambios en la vegetación del estrato inferior, propiciando la presencia de flores colonizadoras cruciales para algunas especies de mariposas. Aunque se destaca este hallazgo, se sugiere un análisis cualitativo de las especies de flores y mariposas, considerando las interacciones entre la estructura del bosque y la biodiversidad (Bowd et al., 2021; Houlihan et al., 2013; Öckinger et al., 2012). En el caso de las flores, se debe tener en cuenta la sucesión y la colonización en áreas quemadas a lo largo del tiempo. Respecto a las mariposas, es esencial distinguir entre generalistas y especialistas, además de analizar la diversidad a nivel paisaje (Börschig et al., 2013; Brückmann et al., 2010b; Krauss et al., 2003).
En términos generales, el incendio de intensidad media ocurrido en 2016 parece haber creado un espacio propicio para el aumento de la diversidad paisajística y, por tanto, para el florecimiento de las poblaciones de flores y mariposas en el área. De manera similar, Houlihan et al. (2013) observaron una mayor diversidad de mariposas en áreas abiertas en comparación con bosques cerrados en Indonesia. Además, señalaron que las perturbaciones favorecían a las especies de mariposas generalistas (Houlihan et al., 2013).
En cambio, los incendios podrían desempeñar un papel crucial en la regulación de las poblaciones de insectos, como las mariposas, según estudios como el de McCullough et al. (1998). A pesar de que esta cuestión aún no ha sido profundamente explorada en México, su investigación sería fundamental para orientar estrategias de manejo del fuego y la planificación de quemas prescritas, como indican investigaciones previas (Harper et al., 2016, 2018; Pausas y Ribeiro, 2017).
Sin embargo, es importante aclarar que no se busca fomentar la aparición de incendios forestales. En cambio, el objetivo es destacar la relevancia del fuego como un elemento natural y ecológico en los bosques de pino-encino en la sierra Madre Oriental, como lo señalan Ávila-Flores et al. (2014) y González-Tagle et al. (2008). Además, se enfatiza la importancia de llevar a cabo un manejo adecuado del fuego, con la intención de prevenir incendios devastadores, preservar la diversidad biológica y mantener la integridad paisajística (He et al., 2019; Kelly y Brotons, 2017; Kelly et al., 2020; Rundel et al., 2018).
En este estudio se abordó la diversidad de mariposas en 2 bosques de encino-pino con dosel diferente en el Parque Cumbres de Monterrey, revelando en ambos sitios una diversidad relativamente baja. Una posible explicación podría derivar de la metodología empleada. Se sugiere que aumentar el número de trampas, ubicar trampas adicionales en el dosel y diversificar los tipos de cebo podrían resultar en la identificación de una mayor diversidad de especies. Además, se propone la ampliación de la descripción de la estructura y composición vegetal en los sitios de muestreo.
Las disparidades en la cobertura de copas entre ambos sitios se originaron debido a un incendio forestal de intensidad media, el cual no consumió el estrato superior del bosque, compuesta por árboles grandes de alrededor de 60 años. Como resultado, la liberación del sotobosque parece haber contribuido al aumento de flores y, por ende, de especies de mariposas. Un incendio de mayor magnitud e intensidad podría afectar negativamente las poblaciones de mariposas, dado que cambiaría drásticamente el microclima y eliminaría zonas de refugio. Esta es un área de investigación pendiente en el noreste de México.
Por otro lado, los incendios forestales forman parte de la ecología forestal en la sierra Madre Oriental y los resultados de este estudio resaltan su importancia ecológica, así como la necesidad de un manejo adecuado del fuego en los bosques. Evitar la acumulación de combustible y realizar quemas prescritos podría no solo prevenir incendios destructivos de alta intensidad, sino también fomentar la diversidad paisajística y estructural del bosque al promover poblaciones de flores y mariposas.
Agradecimientos
Al proyecto PAICyT 54CAT-2022 por el financia-
miento de la investigación. Agradecemos especialmente el valioso respaldo brindado por el técnico Guadalupe Pérez Malacara, durante la recopilación de datos en campo. Asimismo, extendemos nuestro agradecimiento a los revisores anónimos del manuscrito por sus comentarios constructivos, los cuales han contribuido significativa-
mente a la mejora del documento.
Apéndice 1. Lista de especies de flores encontradas en 2 áreas de estudio, quemada (B) y control (C; no quemada) en un bosque de pino-encino en Ciénega de González, Nuevo León. Se identificaron 35 especies y 7 morfoespecies en el área quemada (B) y 21 especies y 3 morfoespecies en el área no quemada (C).
| Área | Familia | Género | Especie/ morfoespecie |
| B | Fabaceae | Canavalia | Canavalia villosa |
| B | Rhamnaceae | Ceanothus | Ceanothus caeruleus |
| B | Asteraceae | Erigeron | Erigeron sp. 2 |
| B | Asteraceae | Erigeron | Erigeron basilobatus |
| B | Apiaceae | Eryngium | Eryngium heterophyllum |
| B | Asteraceae | Gaillardia | Gaillardia mexicana |
| B | Asteraceae | Gaillardia | Gaillardia pulchella |
| B | Polemoniaceae | Gilia | Gilia stewartii |
| B | Lamiaceae | Hedeoma | Hedeoma palmeri |
| B | Lamiaceae | Hedeoma | Hedeoma plicatum |
| B | Fabaceae | Indigofera | Indigofera miniata |
| B | Boraginaceae | Lithospermum | Lithospermum calycosum |
| B | Boraginaceae | Lithospermum | Lithospermum cobrense |
| B | Asteraceae | Macherantera | Machaeranthera sp. |
| B | Onagraceae | Oenothera | Oenothera sp. |
| B | Fabaceae | Phaseolus | Phaseolus leptostachyus |
| B | Asteraceae | Pyrrhopappus | Pyrrhopappus pauciflorus |
| B | Sapindaceae | Serjania | Serjania brachycarpa |
| B | Asteraceae | Stevia | Stevia sp. |
| B | Asteraceae | Tagetes | Tagetes lucida |
| Apéndice 1. Continúa | |||
| Área | Familia | Género | Especie/ morfoespecie |
| B | Verbenaceae | Verbena | Verbena canescens |
| B | Asteraceae | Verbesina | Verbesina sp. |
| B | Asteraceae | Vigethia | Vigethia mexicana |
| B | Asteraceae | Viguiera | Viguiera adenophylla |
| B | Asteraceae | Viguiera | Viguiera cordata |
| B | Asteraceae | Viguiera | Viguiera dentata |
| B y C | Asteraceae | Ageratina | Ageratina havanensis |
| B y C | Asclepiadaceae | Asclepias | Asclepia linearifolia o linaria |
| B y C | Rubiaceae | Bouvardia | Bouvardia ternifolia |
| B y C | Asteraceae | Dyssodia | Dyssodia pentachaeta |
| B y C | Asteraceae | Erigeron | Erigeron sp. 1 |
| B y C | Asteraceae | Erigeron | Erigeron tenellus |
| B y C | Asteraceae | Grindelia | Grindelia inuloides |
| B y C | Asteraceae | Gymnosperma | Gymnosperma glutinosa |
| B y C | Lamiaceae | Hedeoma | Hedeoma drummondii |
| B y C | Boraginaceae | Lithospermum | Lithospermum cobrense |
| B y C | Polemoniaceae | Loeselia | Loeselia scariosa |
| B y C | Apocynaceae | Mandevilla | Mandevilla karwinski |
| B y C | Lamiaceae | Scutellaria | Scutellaria potosina |
| B y C | Asteraceae | Stevia | Stevia berlandieri |
| B y C | Asteraceae | Vernonia | Vernonia greggii |
| B y C | Asteraceae | Viguiera | Viguiera sp. |
| C | Asteraceae | Aphanostephus | Aphanostephus ramosissimus |
| C | Xanthorrhoeaceae | Asphodelus | Asphodelus fistulosus |
| C | Asteraceae | Chaptalia | Chaptalia latifolia |
| C | Asteraceae | Chrysactinia | Chrysactinia mexicana |
| C | Asteraceae | Erigeron | Erigeron flagellaris calcicola |
| C | Lamiaceae | Hedeoma | Hedeoma sp. |
| C | Lamiaceae | Salvia | Salvia greggii |
| C | Fabaceae | Senna | Senna crotalarioides |
Apéndice 2. Lista de especies de mariposas encontradas en 2 áreas de estudio, quemada (B) y control (C; no quemada) en un bosque de pino-encino en Ciénega de González, Nuevo León. Se identificaron 39 especies y 10 morfoespecies en el área quemada (B) y 20 especies y 4 morfoespecies en el área no quemada (C).
| Área | Familia | Género | Especie/ morfoespecie |
| B | Nymphalidae | Adelpha | Adelpha eulalia |
| B | Nymphalidae | Adelpha | Adelpha sp. |
| B | Nymphalidae | Agraulis | Agraulis vanillae |
| B | Hesperiidae | Aguna | Aguna asander |
| Apéndice 2. Continúa | |||
| Área | Familia | Género | Especie/ morfoespecie |
| B | Hesperiidae | Astraptes | Astraptes fulgerator |
| B | Papilionidae | Battus | Battus philenor |
| B | Nymphalidae | Biblis | Biblis hyperia |
| B | Riodinidae | Calephelis | Calephelis sp. |
| B | Hesperiidae | Celaenorrhinus | Celaenorrhinus sp. |
| B | Lycaenidae | Celastrina | Celastrina argiolus |
| B | Nymphalidae | Chlosyne | Chlosyne janais |
| B | Nymphalidae | Chlosyne | Chlosyne lacinia |
| B | Nymphalidae | Chlosyne | Chlosyne sp. |
| B | Nymphalidae | Cyllopsis | Cyllopsis gemma |
| B | Nymphalidae | Danaus | Danaus plexippus |
| B | Hesperiidae | Epargyreus | Epargyreus socus orizaba |
| B | Nymphalidae | Euptoieta | Euptoieta claudia |
| B | Papilionidae | Heraclides | Heraclides thoas |
| B | Nymphalidae | Phycoides | Phyciodes mylitta |
| B | Papilionidae | Pterourus | Pterourus palamedes leontis |
| B | Papilionidae | Pterourus | Pterourus sp. |
| B | Hesperiidae | Pyrgus | Pyrgus sp. |
| B | Lycaenidae | Strymon | Strymon sp. |
| B | Hesperiidae | Thorybes | Thorybes drusius |
| B | Hesperiidae | Urbanus | Urbanus sp. |
| B | Nymphalidae | Vanessa | Vanessa atalanta |
| B | Pieridae | Zerene | Zerene cesonia |
| B | Hesperiidae | Noctuana | Noctuana lactifera |
| B y C | Pieridae | Phoebis | Phoebis agarithe |
| B y C | Pieridae | Abaeis | Abaeis nicippe |
| B y C | Nymphalidae | Anaea | Anaea troglodyta aidea |
| B y C | Nymphalidae | Anthanassa | Anthanassa texana |
| B y C | Hesperiidae | Autochton | Autochton cincta |
| B y C | Nymphalidae | Cercyonis | Cercyonis pegala |
| B y C | Nymphalidae | Chlosyne | Chlosyne theona |
| B y C | Nymphalidae | Cyllopsis | Cyllopsis pertepida |
| B y C | Nymphalidae | Danaus | Danaus gilippus |
| B y C | Lycaenidae | Echinargus | Echinargus isola |
| B y C | Hesperiidae | Erynnis | Erynnis sp. |
| B y C | Pieridae | Eurema | Eurema mexicana |
| B y C | Nymphalidae | Heliconius | Heliconius charithonia |
| B y C | Papilionidae | Heraclides | Heraclides anchisiades idaeus |
| B y C | Nymphalidae | Libytheana | Libytheana carinenta |
| B y C | Nymphalidae | Megisto | Megisto rubricata |
| Apéndice 2. Continúa | |||
| Área | Familia | Género | Especie/ morfoespecie |
| B y C | Nymphalidae | Mestra | Mestra dorcas amymone |
| B y C | Pieridae | Nathalis | Nathalis iole |
| B y C | Nymphalidae | Polygonia | Polygonia interrogationis |
| B y C | Papilionidae | Pterourus | Pterourus pilumnus |
| B y C | Hesperiidae | Urbanus | Urbanus sp. |
| C | Hesperiidae | Pyrgus | Pyrgus sp. |
| C | Hesperiidae | Thorybes | Thorybes pylades |
| C | Nymphalidae | Vanessa | Vanessa sp. |
Referencias
Adamidis, G. C., Swartz, M. T., Zografou, K. y Sewall, B. J. (2019). Prescribed fire maintains host plants of a rare grassland butterfly. Nature, 9, 1–12. https://doi.org/10.1038/s41598-019-53400-1
Ávila-Flores, D. Y., González-Tagle, M. A., Jiménez-Pérez, J., Aguirre-Calderón, O. A., Treviño-Garza, E. J. y Vargas-Larreta, B. (2014). Dendrocronopirología: análisis de la evidencia morfológica de incendios forestales. Dendrochronopyrology: analysis of the morphological evidence of forest fires. Revista Mexicana de Ciencias Forestales, 5, 136–147.
Berg, Å., Ahrné, K., Öckinger, E., Svensson, R. y Söderström, B. (2011). Butterfly distribution and abundance is affected by variation in the Swedish forest-farmland landscape. Biological Conservation, 144, 2819–2831. https://doi.org/10.1016/J.BIOCON.2011.07.035
Börschig, C., Klein, A. M., Wehrden von, H. y Krauss, J. (2013). Traits of butterfly communities change from specialist to generalist characteristics with increasing land-use intensity. Basic and Applied Ecology, 14, 547–554. https://doi.org/10.1016/j.baae.2013.09.002
Bowd, E., Blanchard, W., McBurney, L. y Lindenmayer, D. (2021). Direct and indirect disturbance impacts on forest biodiversity. Ecosphere, 12, e03823. https://doi.org/10.1002/ECS2.3823
Brown, N., Jennings, S., Wheeler, P. y Nabe-Nielsen, J. (2000). An improved method for the rapid assessment of forest understorey light environments. Journal of Applied Ecology, 37, 1044–1053. https://doi.org/10.1046/j.1365-2664.2000.00573.x
Brückmann, S. V., Krauss, J. y Steffan-Dewenter, I. (2010). Butterfly and plant specialists suffer from reduced connectivity in fragmented landscapes. Journal of Applied Ecology, 47, 799–809. https://doi.org/10.1111/J.1365-2664.2010.01828.X
Cantú-Ayala, C., González, F. N., Uvalle, J. I. y Marmolejo, J. G. (Eds.). (2010). Biodiversidad y conservación del monumento natural Cerro de la Silla, México. Monterrey: Universidad Autónoma de Nuevo León.
Cantú, Ayala., C., Marmolejo, M., J., González, S., F. y Uvalle, S., J. (2013). El Parque Nacional Cumbres de Monterrey en el contexto mexicano de la conservación. En C. Cantú-Ayala, M. Rovalo-Merino, J. Marmolejo-Moncivais, S. Ortiz-Hernández y F. Seriñá-Garza (Eds.), Historia natural del Parque Nacional Cumbres de Monterrey, México, Vol. 1 (pp. 16–26). Monterrey: Universidad Autónoma de Nuevo León.
Cantú-Ayala, C., Rovalo-Merino, M., Marmolejo-Moncivais, J., Ortiz-Hernández, S. y Seriñá-Garza, F. Eds.). (2013). El Parque Nacional Cumbres de Monterrey en el contexto de la conservación. Monterrey: Universidad Autónoma de Nuevo León.
Casas-Pinilla, L. C., Mahecha, J. O., Dumar, R. J. C. y Ríos-Málaver, I. C. (2017). Diversidad de mariposas en un paisaje de bosque seco tropical, en la Mesa de los Santos, Santander, Colombia (Lepidoptera: Papilionoidea). SHILAP Revista Lepidopterología, 45, 83–108.
Clarke, K. R., Gorley, R. N., Somerfield, P. J. y Warwick, R. M. (2014). Change in marine communities: an approach to statistical analysis and interpretation (3rd edition). PRIMER-e: Plymouth. https://updates.primer-e.com/primer7/manuals/Methods_manual_v7.pdf
Cleary, D. F. R. y Genner, M. J. (2004). Changes in rain forest butterfly diversity following major ENSO-induced fires in Borneo. Global Ecology and Biogeography, 13, 129–140. https://doi.org/10.1111/j.1466-882X.2004.00074.x
Conanp (Comisión Nacional de Áreas Naturales Protegidas). (2006). Programa de conservación y manejo, Parque Nacional Cumbres de Monterrey. Disponible en: https://www.conanp.gob.mx/anp/consulta/PCM-20DIC06.pdf
Cuervo-Robayo, A. P., Téllez-Valdés, O., Gómez-Albores, M. A., Venegas-Barrera, C. S., Manjarrez, J. y Martínez-Meyer, E. (2014). An update of high-resolution monthly climate surfaces for Mexico. International Journal of Climatology, 34, 2427–2437. https://doi.org/10.1002/JOC.3848
Curtis, R. J., Brereton, T. M., Dennis, R. L. H., Carbone, C. y Isaac, N. J. B. (2015). Butterfly abundance is determined by food availability and is mediated by species traits. Journal of Applied Ecology, 52, 1676–1684. https://doi.org/10.1111/1365-2664.12523
Debinski, D. M., Wickham, H., Kindscher, K., Caruthers, J. C. y Germino, M. (2010). Montane meadow change during drought varies with background hydrologic regime and plant functional group. Ecology, 91, 1672–1681. https://doi.org/10.1890/09-0567.1
DellaSala, D. A. (2018). Emergence of a new climate and human-caused wildfire era for western USA forests. En D.A. DellaSala (Ed.), Reference Module Earth Systems and Environmental Sciences (pp. 1–12). Elsevier. https://doi.org/10.1016/B978-0-12-409548-9.10999-6
Dennis, E. B., Morgan, B. J. T., Brereton, T. M., Roy, D. B. y Fox, R. (2017). Using citizen science butterfly counts to predict species population trends. Conservation Biology, 31, 1350–1361. https://doi.org/10.1111/cobi.12956
DeVries, P. J., Murray, D. y Lande, R. (1997). Species diversity in vertical, horizontal, and temporal dimensions of a fruit-feeding butterfly community in an Ecuadorian rainforest. Biological Journal of the Linnean Society, 62, 343–364. https://doi.org/10.1006/bijl.1997.0155
DeVries, P. J. y Walla, T. R. (2001). Species diversity and community structure in neotropical fruit-feeding butterflies. Biological Journal of the Linnean Society, 74, 1–15. https://doi.org/10.1006/bij1.2001.0571
Doerr, S. H. y Santín, C. (2016). Global trends in wildfire and its impacts: perceptions versus realities in a changing world. Philosophical Transactions of the Royal Society B: Biological Sciences, 371, 20150345. https://doi.org/10.1098/RSTB.2015.0345
Estrada-Castillón, E., Villarreal-Quintanilla, J. Á., Salinas-Rodríguez, M. M., González-Rodríguez, H., Jiménez-Pérez, J. y García-Aranda, M. A. (2013). Flora and phytogeography of Cumbres de Monterrey National Park, Mexico. Journal of the Botanical Research Institute of Texas, 7, 771–801.
Gaigher, R., Pryke, J. S. y Samways, M. J. (2021). Habitat complementarity and butterfly traits are essential considerations when mitigating the effects of exotic plantation forestry. Biodiversity and Conservation, 30, 4089–4109. https://doi.org/10.1007/S10531-021-02293-6
Gardener, M. (2017). Statistics for ecologists using R and Excel, 2nd edition. Exeter: Pelagic Publishing.
Garwood, K. y Lehman, R. (2005). Butterflies of northeastern Mexico: Nuevo Leon, San Luis Potosí, Tamaulipas: a photographic checklist, 2nd Ed. McAllen: Edition Eye Scry Publishing.
Gómez-Murillo, L. P., González-Haro, A. G., Raygoza-Martínez, A. P., Vallejo-Maldonado, G. E., Cruz-Osorno, A., Martínez-Domínguez, R. et al. (2016). Parque Nacional Cumbres de Monterrey, Programa de manejo del fuego. Disponible en: https://www.usfsmex.org/img/pdf/programas/cumbres_de_monterrey.pdf
González-Tagle, M. A., Schwendenmann, L., Pérez, J. J. y Schulz, R. (2008). Forest structure and woody plant species composition along a fire chronosequence in mixed pine–oak forest in the Sierra Madre Oriental, Northeast Mexico. Forest Ecology and Management, 256, 161–167. https://doi.org/10.1016/J.FORECO.2008.04.021
Gurrutxaga-San Vicente, M. y Lozano-Valencia, P. J. (2010). Causas de los procesos territoriales de fragmentación de hábitats. Lurralde: Investigación y Espacio, 33, 147–158.
Harper, A. R., Doerr, S. H., Santin, C., Froyd, C. A. y Sinnadurai, P. (2018). Prescribed fire and its impacts on ecosystem services in the UK. Science of the Total Environment, 624, 691–703. https://doi.org/10.1016/J.SCITOTENV.2017.12.161
Harper, C. A., Ford, W. M., Lashley, M. A., Moorman, C. E. y Stambaugh, M. C. (2016). Fire effects on wildlife in the Central Hardwoods and Appalachian regions, USA. Fire Ecology, 12, 127–159. https://doi.org/10.4996/FIREECOLOGY.1202127
He, T., Lamont, B. B. y Pausas, J. G. (2019). Fire as a key driver of Earth’s biodiversity. Biological Reviews, 94, 1983–2010. https://doi.org/10.1111/BRV.12544
Hill, G. M., Kawahara, A. Y., Daniels, J. C., Bateman, C. C. y Scheffers, B. R. (2021). Climate change effects on animal ecology: butterflies and moths as a case study. Biological Reviews, 96, 2113–2126. https://doi.org/10.1111/BRV.12746
Houlihan, P. R., Harrison, M. E. y Cheyne, S. M. (2013). Impacts of forest gaps on butterfly diversity in a Bornean peat-swamp forest. Journal of Asia-Pacific Entomology, 16, 67–73.
Hsieh, T. C., Ma, K. H. y Chao, A. (2016). iNEXT: an R package for rarefaction and extrapolation of species diversity (Hill numbers). Methods in Ecology and Evolution, 7, 1451–1456. https://doi.org/10.1111/2041-210X.12613
Johansson, V., Gustafsson, L., Andersson, P. y Hylander, K. (2020). Fewer butterflies and a different composition of bees, wasps and hoverflies on recently burned compared to unburned clear-cuts, regardless of burn severity. Forest Ecology and Management, 463, 118033. https://doi.org/
10.1016/J.FORECO.2020.118033
Jost, L. (2006). Entropy and diversity. Oikos, 113, 363–375. https://doi.org/10.1111/j.2006.0030-1299.14714.x
Keeley, J. E. (2008). Fire. En S.E. Jorgensen y B.D. Fath (Eds), Encyclopedia of Ecology, Five-Volume Set (pp. 1557–1564). Copenague: Academic Press. https://doi.org/10.1016/B978-
008045405-4.00496-1
Keeley, J. E. (2009). Fire intensity, fire severity and burn severity: a brief review and suggested usage. International Journal of Wildland Fire, 18, 116–126. https://doi.org/10.1071/WF07049
Keeley, J. E. y Pausas, J. G. (2019). Distinguishing disturbance from perturbations in fire-prone ecosystems. International Journal of Wildland Fire, 28, 282–287. https://doi.org/
10.1071/WF18203
Kelly, L. T. y Brotons, L. (2017). Using fire to promote biodiversity. Science, 355, 1264–1265. https://doi.org/10.1126/SCIENCE.AAM7672
Kelly, L. T., Giljohann, K. M., Duane, A., Aquilué, N., Archibald, S., Batllori, E. et al. (2020). Fire and biodiversity in the Anthropocene. Science, 370, eabb0355 https://doi.org/10.1126/SCIENCE.ABB0355/SUPPL_FILE/ABB0355-KELLY-SM.PDF
Keren, I., Malkinson, D., Dorman, M., Balaban, A. y Kutiel, P. B. (2022). The relationship between plant and butterfly richness and composition and socioecological drivers in five adjacent cities along the Mediterranean Coast of Israel. Journal of Urban Ecology, 8, 1–11. https://doi.org/10.1093/JUE/JUAC001
Köhler, W., Schachtel, G. y Voleske, P. (2012). Biostatistik. Eine Einführung für Biologen und Agrarwissenschaftler, 4th Ed. Berlín, Heidelberg. Springer. https://doi.org/10.1007/978-3-642-29271-2
Krauss, J., Steffan-Dewenter, I. y Tscharntke, T. (2003). How does landscape context contribute to effects of habitat fragmentation on diversity and population density of butterflies? Journal of Biogeography, 30, 889–900. https://doi.org/10.1046/J.1365-2699.2003.00878.X
López-Segoviano, G., Díaz-Verduzco, L., Arenas-Navarro, M. y Arizmendi, M. C. (2019). Diversidad estacional de aves en una región prioritaria para la conservación en el centro oeste de la Sierra Madre Oriental. Revista Mexicana de Biodiversidad, 90, e902754 https://doi.org/10.22201/ib.20078706e.2019.90.2754
Lucas, A., Bull, J. C., de Vere, N., Neyland, P. J. y Forman, D. W. (2017). Flower resource and land management drives hoverfly communities and bee abundance in seminatural and agricultural grasslands. Ecology and Evolution, 7, 8073–8086. https://doi.org/10.1002/ECE3.3303
Lucci-Freitas, A. V., Agra-Iserhard, C., Pereira-Santos, J., Oliveira-Carreira, J. Y., Bandini-Ribeiro, D. et al. (2014). Studies with butterfly bait traps: an overview. Revista Colombiana de Entomología, 40, 203–212.
Magurran, A. E. (1988). Ecological diversity and its measurement. Holanda: Springer. https://doi.org/10.1007/978-94-015-7358-0
Mason, S. C., Shirey, V., Ponisio, L. C. y Gelhaus, J. K. (2021). Responses from bees, butterflies, and ground beetles to different fire and site characteristics: a global meta-analysis. Biological Conservation, 261, 109265. https://doi.org/10.1016/j.biocon.2021.109265
Matteson, K. C. y Langellotto, G. A. (2010). Determinates of inner city butterfly and bee species richness. Urban Ecosystems, 13, 333–347. https://doi.org/10.1007/S11252-010-0122-Y
McCullough, D., Werner, R. A. y Neumann, D. (1998). Fire and insects in northern and boreal forest ecosystems on North America. Annual Review of Entomology, 43, 107–127.
McDermott-Long, O., Warren, R., Price, J., Brereton, T. M., Botham, M. S. y Franco, A. M. A. (2017). Sensitivity of UK butterflies to local climatic extremes: which life stages are most at risk? Journal of Animal Ecology, 86, 108–116. https://doi.org/10.1111/1365-2656.12594
Meddens, A. J. H., Kolden, C. A., Lutz, J. A., Smith, A. M. S., Cansler, C. A., Abatzoglou, J. T. et al. (2018). Fire refugia: What are they, and why do they matter for global change? BioScience, 68, 944–954. https://doi.org/10.1093/biosci/biy103
Meigs, G. W., Dunn, C. J., Parks, S. A. y Krawchuk, M. A. (2020). Influence of topography and fuels on fire refugia probability under varying fire weather conditions in forests of the Pacific Northwest, USA. Canadian Journal of Forest Research, 50, 636–647. https://doi.org/10.1139/cjfr-2019-0406
Mola, J. M. y Williams, N. M. (2018). Fire-induced change in floral abundance, density, and phenology benefits bumble bee foragers. Ecosphere, 9, e02056. https://doi.org/10.1002/ECS2.2056
Mukherjee, S., Banerjee, S., Basu, P., Saha, G. K. y Aditya, G. (2018). Butterfly-plant network in urban landscape: Implication for conservation and urban greening. Acta Oecologica, 92, 16–25. https://doi.org/10.1016/J.ACTAO.2018.08.003
Mukherjee, S., Banerjee, S., Saha, G. K., Basu, P. y Aditya, G. (2015). Butterfly diversity in Kolkata, India: An appraisal for conservation management. Journal of Asia-Pacific Biodiversity, 8, 210–221. https://doi.org/10.1016/J.JAPB.2015.08.001
Öckinger, E., Bergman, K. O., Franzén, M., Kadlec, T., Krauss, J., Kuussaari, M. et al. (2012). The landscape matrix modifies the effect of habitat fragmentation in grassland butterflies. Landscape Ecology, 27, 121–131. https://doi.org/10.1007/S10980-011-9686-Z/FIGURES/2
Pausas, J. G. y Keeley, J. E. (2019). Wildfires as an ecosystem service. Frontiers in Ecology and the Environment, 17, 289–295. https://doi.org/10.1002/FEE.2044
Pausas, J. G. y Ribeiro, E. (2017). Fire and plant diversity at the global scale. Global Ecology and Biogeography, 26, 889–897. https://doi.org/10.1111/GEB.12596
Platt, A. P. (1969). A lightweight collapsible bait trap for Lepidoptera. Journal of the Lepidopterists’ Society, 23, 97–101.
Pollard, E. y Yates, T. J. (1993). Monitoring butterflies for Ecology and Conservation. London: Chapman y Hall.
Potts, S. G., Biesmeijer, J. C., Kremen, C., Neumann, P., Schweiger, O. y Kunin, W. E. (2010). Global pollinator declines: trends, impacts and drivers. Trends in Ecology y Evolution, 25, 345–353. https://doi.org/10.1016/J.TREE.2010.01.007
Pressler, Y., Moore, J. C. y Cotrufo, M. F. (2019). Belowground community responses to fire: meta-analysis reveals contrasting responses of soil microorganisms and mesofauna. Oikos, 128, 309–327. https://doi.org/10.1111/OIK.05738
R Core Team. (2023). R: a language and environment for statistical computing. https://www.r-project.org/
Radchuk, V., Turlure, C. y Schtickzelle, N. (2013). Each life stage matters: The importance of assessing the response to climate change over the complete life cycle in butterflies. Journal of Animal Ecology, 82, 275–285. https://doi.org/10.1111/J.1365-2656.2012.02029.X
Rodríguez, A. y Kouki, J. (2015). Emulating natural disturbance in forest management enhances pollination services for dominant Vaccinium shrubs in boreal pine-dominated forests. Forest Ecology and Management, 350, 1–12. https://doi.org/10.1016/J.FORECO.2015.04.029
Rodríguez-Trejo, D. A. y Fulé, P. Z. (2003). Fire ecology of Mexican pines and a fire management proposal. International Journal of Wildland Fire, 12, 23–37. https://doi.org/10.1071/WF02040
Rubene, D., Schroeder, M. y Ranius, T. (2015). Diversity patterns of wild bees and wasps in managed boreal forests: Effects of spatial structure, local habitat and surrounding landscape. Biological Conservation, 184, 201–208. https://doi.org/10.1016/J.BIOCON.2015.01.029
Rundel, P. W., Arroyo, M. T. K., Cowling, R. M., Keeley, J. E., Lamont, B. B., Pausas, J. G. et al. (2018). Fire and plant diversification in mediterranean-climate regions. Frontiers in Plant Science, 9, 00851. https://doi.org/10.3389/FPLS.2018.00851
Saint-Germain, M., Drapeau, P. y Hibbert, A. (2013). Saproxylic beetle tolerance to habitat fragmentation induced by salvage logging in a boreal mixed-cover burn. Insect Conservation and Diversity, 6, 381–392. https://doi.org/10.1111/J.1752-4598.2012.00216.X
Sandoval-García, R., Jiménez-Pérez, J. Yerena-Yamallel, J. I., Aguirre-Calderón, O. A., Alanís-Rodríguez, E. y Gómez-Meza, M. V. (2021). Análisis multitemporal del uso del suelo y vegetación en el Parque Nacional Cumbres de Monterrey. Revista Mexicana de Ciencias Forestales, 12, 70-95. https://doi.org/10.29298/RMCF.V12I66.896
Serrat, A., Pons, P., Puig-Gironès, R. y Stefanescu, C. (2015). Environmental factors influencing butterfly abundance after a severe wildfire in mediterranean vegetation. Animal Biodiversity and Conservation, 38, 207–220. https://doi.org/10.32800/abc.2015.38.0207
Tam KinChung y Bonebrake, T. C. (2016). Butterfly diversity, habitat and vegetation usage in Hong Kong urban parks. Urban Ecosystems, 19, 721–733.
Visram, T. (2022). Wildfires disproportionately impact low-income homeowners. Fastcompany. Recuperado el 12 marzo, 2024 de: https://www.fastcompany.com/90775562/wildfires-disproportionately-impact-low-income-people-heres-how-communities-can-protect-them
Wix, N., Reich, M. y Schaarschmidt, F. (2019). Butterfly richness and abundance in flower strips and field margins: the role of local habitat quality and landscape context. Heliyon, 5, e01636. https://doi.org/10.1016/j.heliyon.2019.e01636
Yocom, L. L., Fulé, P. Z., Brown, P. M., Cerano, J., Villanueva-Díaz, J., Falk, D. A. et al. (2010). El Niño-southern oscillation effect on a fire regime in northeastern Mexico has changed over time. Ecology, 91, 1660–1671. https://doi.org/10.1890/09-0845.1