Rafael Vázquez-Marroquín a, b, Francisco R. Castañeda-Rivero c, Rahuel J. Chan-Chable a, Josué M. de la Cruz-Ramos d, Carlos A. Espinoza-González e y Aldo I. Ortega-Morales f, *
a Universidad Autónoma Agraria Antonio Narro, Unidad Laguna, Departamento de Posgrado, Periférico Raúl López Sánchez y Carretera a Santa Fe, 27054 Torreón, Coahuila, México
b Instituto de Salud del Estado de Chiapas, Departamento de Salud Pública, Jurisdicción Sanitaria Núm. X, Motozintla, 2a. Norte 325, 29000 Motozintla, Chiapas, México
c Centro de Investigación Científica y de Educación Superior de Ensenada, Departamento de Ecología Marina, Carretera Ensenada-Tijuana 3918, Zona Playitas, 22860 Ensenada, Baja California, México
d Secretaría de Salud del Estado de Durango, Unidad de Bioensayos y de Investigaciones Entomológicas del Estado de Durango, Av. Aldama 1150, 35000 Gómez Palacio, Durango, México
e Secretaría de Salud del Estado de Chiapas, Unidad de Bioensayos y de Investigaciones Entomológicas del Estado de Chiapas, Calle Río Shumula 228, Paraíso II, 29049 Tuxtla Gutiérrez, Chiapas, México
f Universidad Autónoma Agraria Antonio Narro, Unidad Laguna, Departamento de Parasitología, Periférico Raúl López Sánchez y Carretera a Santa Fe, 27054 Torreón, Coahuila, México
*Autor para correspondencia: agrortega@hotmail.com (A.I. Ortega-Morales)
Recibido: 27 mayo 2021; aceptado: 26 julio 2021
Resumen
Se realizaron recolectas de mosquitos (Diptera: Culicidae) en el intradomicilio y peridomicilio a lo largo de la frontera Chiapas-Guatemala durante octubre-noviembre del 2018. Se recolectaron 4,439 especímenes pertenecientes a 2 subfamilias, 18 géneros y 41 especies, una de ellas Mansonia dyari (Belkin, Heinemann y Page, 1970) es un nuevo registro estatal para Chiapas. De las 41 especies recolectadas, 21 tienen importancia en salud pública, siendo algunas de ellas los principales vectores de malaria, dengue, fiebre amarilla, chikungunya, zika, mayaro, encefalitis equina venezolana, encefalitis equina del oeste y fiebre del valle del Rift. Culex quinquefasciatus y Aedes aegypti mostraron ser las más abundantes. En algunos casos, los municipios con mayor número de especies e individuos no fueron los más diversos y equitativos, con una alta disimilitud en la composición de sus especies. El intradomicilio obtuvo las mayores abundancias de mosquitos, sin embargo, su diversidad y equitatividad fue baja a diferencia del peridomicilio, presentándose una disimilitud ligeramente alta entre sus especies. Los resultados obtenidos tienen importancia para el establecimiento de programas de vigilancia y control en los municipios fronterizos en el estado de Chiapas, ya que brindan información base de la presencia y distribución de la fauna de mosquitos.
Palabras clave: Vectores; Importancia médica; Chiapas; Nuevo registro; Mansonia
© 2023 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Diversity and distribution of mosquitoes
(Diptera: Culicidae) on the Mexico-Guatemala border
Abstract
Mosquito collection was conducted intradomiciliary and peridomiciliary along the Chiapas-Guatemala international border during October-November 2018. We collected 4,439 specimens belonging to 2 subfamilies, 18 genera and 41 species, one of which Mansonia dyari (Belkin, and Page, 1970) is a new record for Chiapas, and 21 species with medical importance were found. Culex quinquefasciatus and Aedes aegypti were the most common species. Some municipalities with the highest number of species and individuals were not the most diverse and equitable, with a high dissimilarity in species composition. The intradomiciliary collections obtained the highest abundances of species, however the diversity and evenness were low in contrast with the peridomiciliary collections, where obtained slightly high dissimilarity among species. The results obtained have importance for the establishment of surveillance and mosquito control programs in the state of Chiapas, since they provide basic information on the occurrence and distribution of mosquito fauna.
Keywords: Vectors; Medical importance; Chiapas; New record; Mansonia
© 2023 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
Los mosquitos (Diptera: Culicidae) son un grupo importante de insectos debido a su capacidad de ser vectores de patógenos que afectan la salud humana y animal. La vigilancia entomológica que involucra especies de mosquitos cuya importancia médica es conocida, es esencial para los programas de salud pública (Silver, 2008). Actualmente se han descrito más de 3,500 especies de mosquitos en el mundo (Harbach, 2013); mientras que en México se han registrado más de 240 pertenecientes a 21 géneros (Hernández-Triana et al., 2021); en Chiapas se han reportado 139 especies agrupadas en 21 géneros (Hernández-Triana et al., 2021), de los cuales 8 son de importancia médica y veterinaria: Anopheles, Aedes, Haemagogus, Psorophora, Culex, Coquillettidia, Mansonia y Sabethes (Bond et al., 2014).
Existen pocos estudios de vigilancia entomológica que analicen la distribución de los mosquitos de importancia médica (Bond et al., 2014). Recientemente se identificaron los patrones de alimentación de algunas especies de mosquitos en algunas regiones de Chiapas (Hernández-Triana et al., 2021), pero la distribución de la mayoría de las especies de mosquitos de importancia médica en el estado sigue siendo desconocida. En el 2019 se reportaron en el estado de Chiapas 2,241 casos de dengue y 410 casos de paludismo, mientras que en 2020 se observaron 324 casos de dengue y 227 casos de paludismo, siendo un estado endémico para estas enfermedades (SS, 2021).
La emergencia y reemergencia de algunas enfermedades transmitidas por mosquitos (ETM) en algunos países como México indican la necesidad de reforzar algunas medidas operativas como la vigilancia entomológica (entomo-vigilancia), la detección de arbovirus y estudios de distribución de especies vectoras, lo cual es importante para estimar el riesgo de incidencia de las enfermedades transmitidas por vectores (Ruiz-Arrondo et al., 2019).
Los estudios de distribución de especies de mosquitos permite además predecir los riesgos de infección para algunas ETM como los virus del Zika y Chikungunya, causantes de enfermedades cuyos primeros casos en México se reportaron en el estado de Chiapas (Osório et al., 2014; Díaz-González et al., 2015; Guerbois et al., 2016)Zika virus (ZIKV). Adicionalmente, la intensa movilidad de personas provenientes de Centroamérica y otros países que se dirigen hacia otras entidades del país o en su paso hacia los Estados Unidos de Norteamérica aumenta el riesgo de infección para algunas ETM (Anguiano-Téllez, 2008). El objetivo de este estudio fue conocer la distribución, abundancia, riqueza y diversidad de mosquitos en comunidades asociadas a la frontera México-Guatemala y destacar su importancia en salud pública.
Materiales y métodos
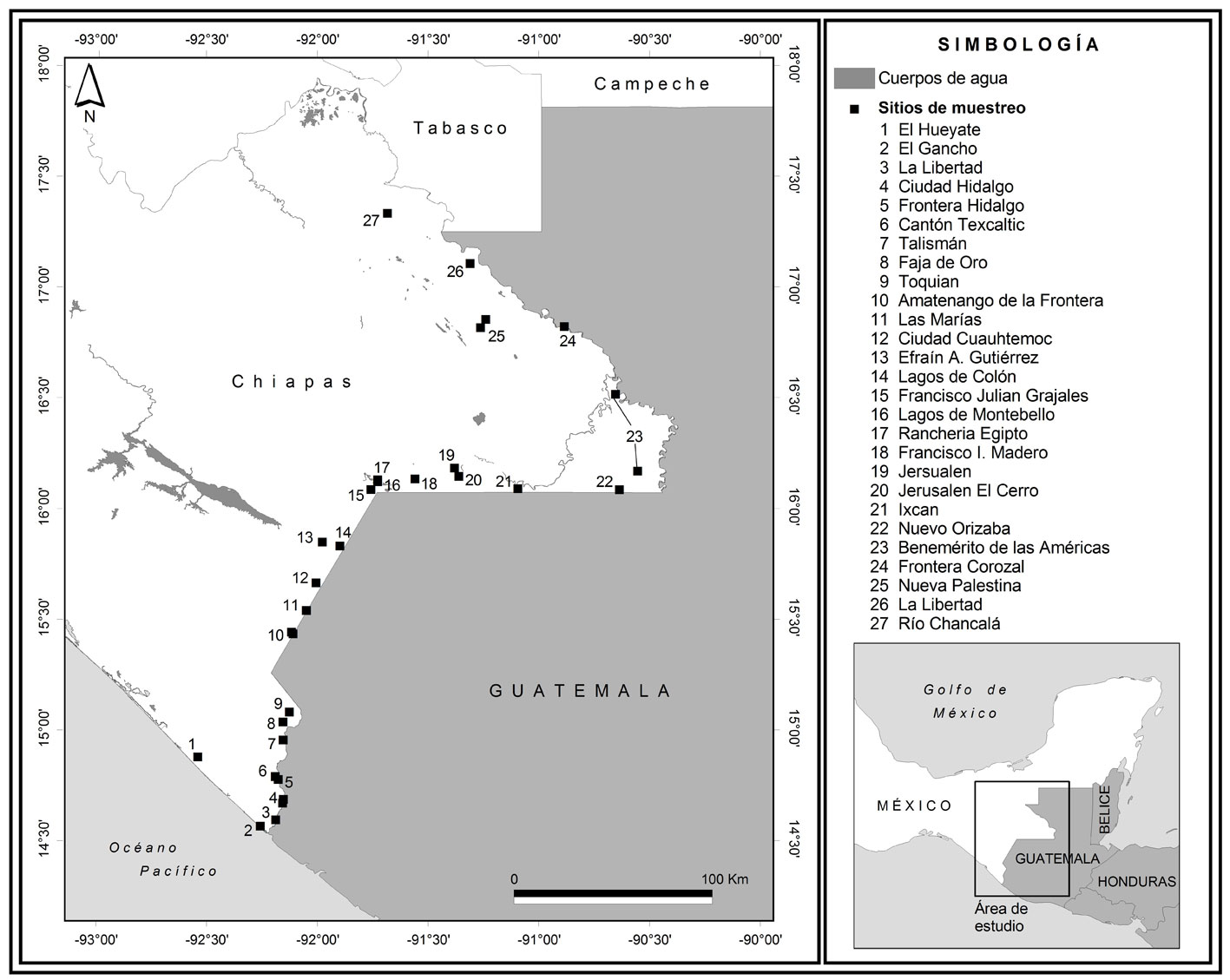
La frontera de Chiapas-Guatemala se ubica en la región sur de México (fig. 1), tiene una extensión de 654 km (Ramos-Rojas, 2016) y comprende 18 municipios. Las condiciones climáticas a través de la frontera son predominantemente cálido húmedas y cálido subhúmedas con lluvia en verano, con una temperatura media anual de 18.5 °C a 26.8 °C y una precipitación total anual de 827 a 2,309 mm con predominio de las lluvias de mayo a octubre (INEGI, 2017).
Se recolectaron mosquitos hembra y machos adultos en comunidades rurales y semiurbanas durante los meses de octubre a noviembre del 2018. Las recolectas fueron realizadas en 12 municipios fronterizos de Chiapas: Amatenango de la Frontera, Benemérito de las Américas, Cacahuatán, Comitán, Frontera Comalapa, Frontera Hidalgo, La Trinitaria, Mazatán, Ocosingo, Palenque, Suchiate y Tuxtla Chico. En cada municipio se seleccionaron al azar 1-4 localidades de muestreo, siendo un total de 27 localidades (fig. 1) y en cada localidad se seleccionaron al azar 20 viviendas, donde se realizaron las recolectas en el intradomicilio y en el peridomicilio. En cada vivienda se aspiraron mosquitos en sus sitios de reposo empleando insectZookas (BioQuip Núm. 2888A) durante 20 minutos por vivienda.
Los mosquitos adultos fueron sacrificados con vapor de trietilamina. Todos los especímenes fueron transportados al Laboratorio de Parasitología de la Universidad Autónoma Agraria Antonio Narro, Unidad Laguna (UAAAN-UL) para su fijación, montaje e identificación.
La identificación morfológica de los especímenes se realizó con un microscopio estereoscópico (Discovery V8; Zeiss, Oberkochen, Germany) y con las claves taxonómicas de Arnell (1976), Clark-Gil y Darsie (1983), Wilkerson et al. (1990) y Darsie y Ward (2005). Los mosquitos fueron depositados en la Colección de Culicidae de la Universidad Autónoma Agraria Antonio Narro (UAAAN), Unidad Laguna, bajo el número de acceso 01231018-EG – 02041118-ZA.
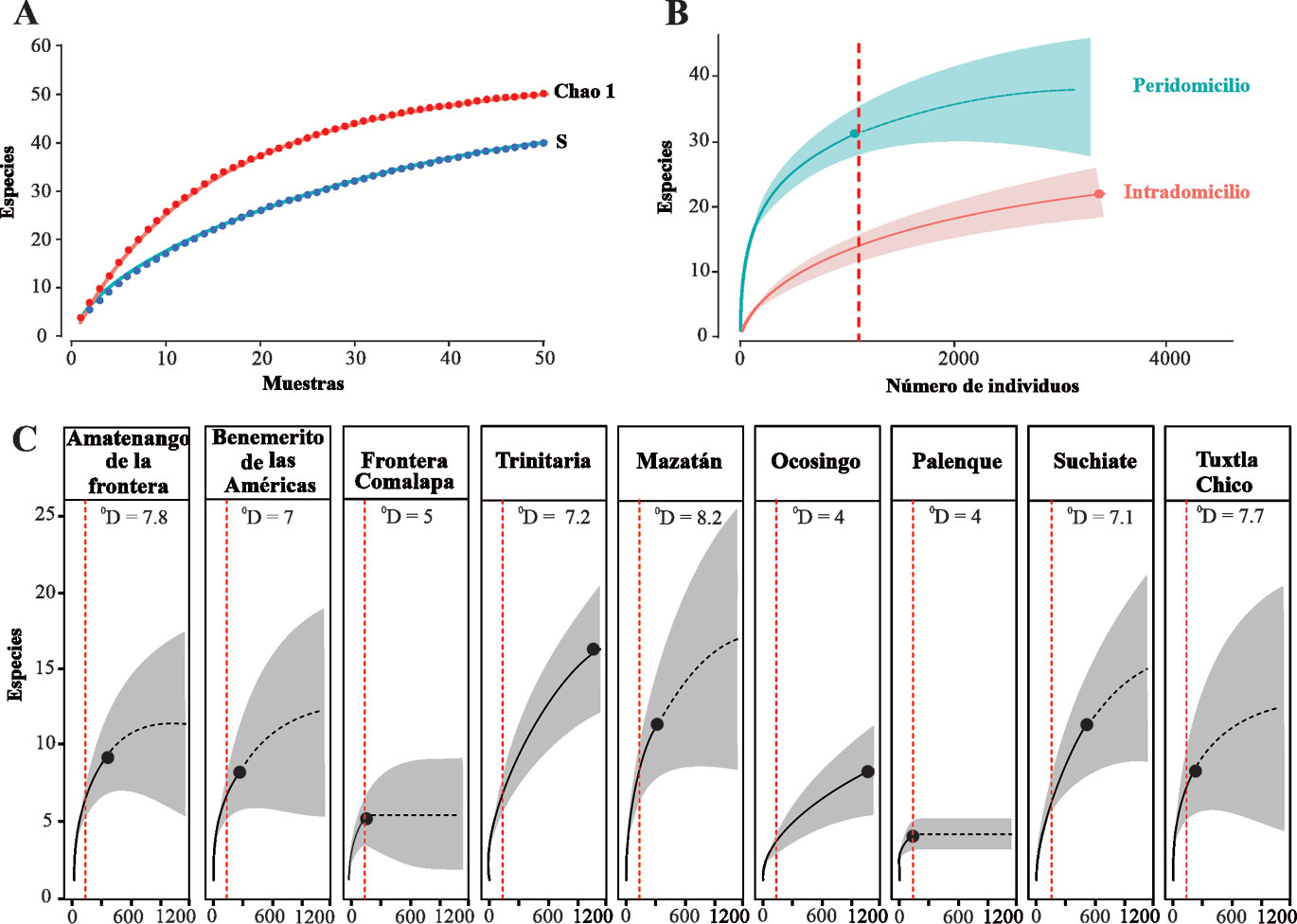
Se calculó la abundancia total y relativa de cada especie recolectada (tabla 1). La jerarquización de las especies por sus abundancias y frecuencias de aparición se basó en la interpretación gráfica de la prueba de asociación de Olmstead-Tukey (Sokal y Rohlf, 1981). Además, se usaron diagramas de curvas de rango abundancia para visualizar y determinar la riqueza, estructura y composición de especies por municipio (Magurran, 2004). Para evaluar el esfuerzo de muestreo, se construyeron curvas de acumulación de especies con 1,000 aleatorizaciones sin reemplazo considerando todas las muestras y se evaluó con el estimador no paramétrico Chao1 en el programa EstimateS 9.1.0. (Colwell, 2013).
Para comparar la riqueza de especies entre municipios se construyeron curvas de interpolación/extrapolación con relación al número de individuos con intervalos de confianza de 95% obtenidos con 1,000 aleatorizaciones usando el programa en línea iNEXT (Hsieh et al., 2016). Se estandarizó la riqueza con base al número de individuos de la muestra menor. No se consideraron los municipios Cacahoatán, Comitán y Frontera Hidalgo por presentar una abundancia baja y con pocas especies. Adicionalmente, se obtuvieron las coberturas de las muestras de cada municipio (Cm = proporción del número de individuos totales en la comunidad que pertenecen a las especies representadas en la muestra).
Para la caracterización ecológica (diversidad alfa) de las comunidades de culícidos, se estimó, por municipio y entre las recolectas intra y peridomicilio, la riqueza de especies (S), la abundancia total (N), los índices de diversidad de Shannon-Wiever (H´ = log pi), de equidad de Pielou (J´ = H/log S) y dominancia de Simpson (λ = 2) (Magurran, 2004).
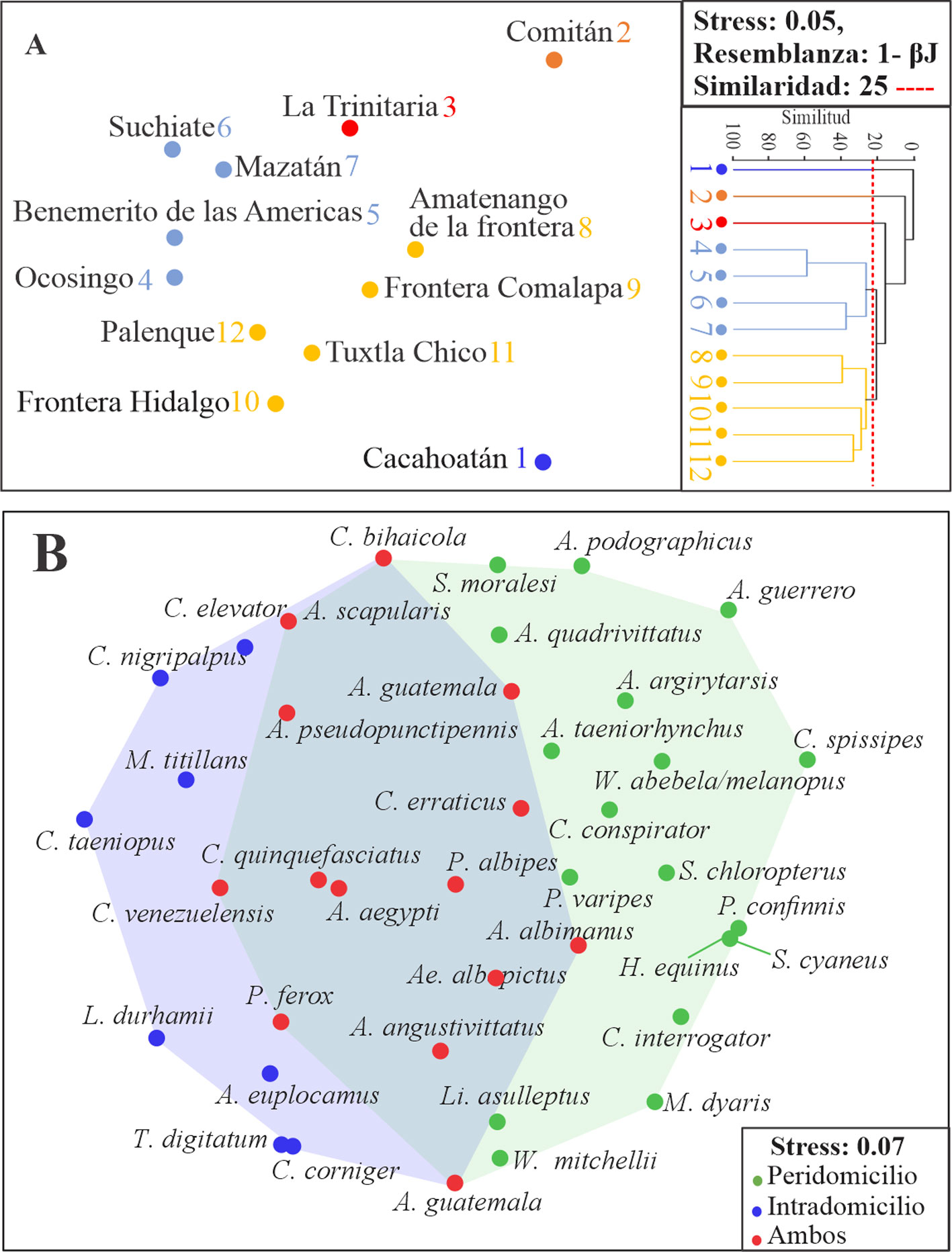
La diversidad beta —a nivel de especies para los municipios y el tipo de recolecta (intra y peridomicilio)— se midió con la disimilitud basada en el índice de similitud de Jaccard (βJ = a / b + c – a) (Magurran, 2004), y para la visualización de los resultados se utilizaron análisis de ordenación no paramétrica nMDS (Nonmetric Multidimensional Scaling) y se utilizó el programa PRIMER versión 7 (Clarke y Gorley, 2015).
Resultados
Se recolectaron un total de 4,439 especímenes (2,420 hembras y 2,019 machos), de los cuales 3,353 se obtuvieron en el intradomicilio y 1,078 en el peridomicilio. Los mosquitos recolectados pertenecen a 2 subfamilias (Anophelinae y Culicinae), 4 tribus (Aedini, Culicini, Mansoniini, Sabethini), 12 géneros (Anopheles, Aedes, Haemagogus, Psorophora, Culex, Coquillettidia, Mansonia, Limatus, Sabethes, Shannoniana, Trichoprosopon y Wyeomyia), 18 subgéneros (Anopheles, Nyssorhynchus, Howardina, Ochlerotatus, Protomacleaya, Stegomyia, Haemagogus, Grabhamia, Janthinosoma, Carrolia, Culex, Melanoconion, Phenacomyia, Rhynchotaenia, Mansonia, Sabethes, Sabethoides y Wyeomyia) y 40 especies (tabla 1). Mansonia (Mansonia) dyari Belkin, Heinemann y Page, 1970 es un nuevo registro para Chiapas.
Tabla 1
Listado taxonómico de especies recolectadas por municipio, abundancia relativa, ordenamiento de Olmstead-Turkey y tipos de recolecta.
| Especies | Municipios | N | AR | OT | Tipo de colecta | ||||||||||||
| Sc | Fh | Cc | Tc | Mz | Af | Fc | Lt | Cm | Oc | Ba | Pa | ID | PD | ||||
| A. pseudopunctipennis | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 7 | 0 | 0 | 0 | 0 | 7 | 0.16% | F | 6 | 1 |
| A. albimanus | 2 | 0 | 0 | 0 | 2 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 5 | 0.11% | F | 2 | 3 |
| A. argirytarsis | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0.02% | R | 0 | 1 |
| A. guatemala | 0 | 0 | 12 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 12 | 0.27% | A | 5 | 7 |
| A. guerrero | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 62 | 0 | 0 | 0 | 62 | 1.40% | A | 0 | 62 |
| A. quadrivittatus | 0 | 0 | 0 | 0 | 0 | 143 | 0 | 0 | 0 | 0 | 0 | 0 | 143 | 3.22% | D | 0 | 143 |
| A. angustivittatus | 0 | 11 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 5 | 8 | 1 | 26 | 0.59% | D | 5 | 21 |
| A. euplocamus | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 3 | 0.07% | F | 3 | 0 |
| A. scapularis | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 4 | 0 | 0 | 0 | 8 | 12 | 0.27% | D | 2 | 10 |
| A. taeniorhynchus | 8 | 0 | 0 | 0 | 1 | 0 | 0 | 4 | 0 | 0 | 0 | 0 | 13 | 0.29% | D | 0 | 13 |
| A. podographicus | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0.02% | R | 0 | 1 |
| A. aegypti | 116 | 20 | 0 | 12 | 7 | 118 | 76 | 8 | 0 | 123 | 38 | 47 | 565 | 12.73% | D | 551 | 14 |
| A. albopictus | 0 | 7 | 0 | 50 | 1 | 1 | 2 | 0 | 0 | 0 | 0 | 0 | 61 | 1.37% | D | 7 | 54 |
| H. equinus | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0.02% | R | 0 | 1 |
| P. confinnis | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 2 | 0.05% | R | 0 | 2 |
| P. albipes | 2 | 0 | 0 | 0 | 107 | 0 | 0 | 0 | 0 | 4 | 17 | 0 | 130 | 2.93% | D | 23 | 107 |
| P. ferox | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 2 | 0.05% | R | 1 | 1 |
| P. varipes | 0 | 0 | 0 | 0 | 186 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 187 | 4.21% | D | 0 | 187 |
| C. bihaicola | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 2 | 0 | 0 | 0 | 0 | 3 | 0.07% | R | 1 | 2 |
| Tabla 1. Continúa | |||||||||||||||||
| Especies | Municipios | N | AR | OT | Tipo de colecta | ||||||||||||
| Sc | Fh | Cc | Tc | Mz | Af | Fc | Lt | Cm | Oc | Ba | Pa | ID | PD | ||||
| C. interrogator | 0 | 16 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 17 | 0.38% | A | 0 | 17 |
| C. nigripalpus | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 1 | 0 | 0 | 0 | 0 | 3 | 0.07% | R | 3 | 0 |
| C. quinquefasciatus | 393 | 0 | 0 | 147 | 21 | 59 | 92 | 1,078 | 0 | 963 | 215 | 127 | 3,095 | 69.72% | D | 2,728 | 367 |
| C. conspirator | 0 | 0 | 0 | 0 | 6 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 6 | 0.14% | R | 0 | 6 |
| C. elevator | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0.02% | R | 1 | 0 |
| C. erraticus | 1 | 0 | 0 | 0 | 4 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 5 | 0.11% | F | 1 | 4 |
| C. spissipes | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 6 | 0 | 0 | 0 | 0 | 6 | 0.14% | R | 0 | 6 |
| C. taeniopus | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0.02% | R | 1 | 0 |
| C. corniger | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0.02% | R | 1 | 0 |
| C. venezuelensis | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 3 | 0.07% | R | 2 | 1 |
| M. dyari* | 0 | 5 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 5 | 0.11% | R | 0 | 5 |
| M. titillans | 6 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 6 | 0.14% | F | 6 | 0 |
| L. asulleptus | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0.02% | R | 0 | 1 |
| L. durhamii | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0.02% | R | 1 | 0 |
| S. cyaneus | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0.02% | R | 0 | 1 |
| S. chloropterus | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 2 | 0.05% | R | 0 | 2 |
| S. moralesi | 0 | 0 | 0 | 0 | 0 | 4 | 0 | 1 | 0 | 0 | 0 | 0 | 5 | 0.11% | F | 0 | 5 |
| T. digitatum | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0.05% | R | 2 | 0 |
| W. abebela/melanopus | 0 | 0 | 0 | 0 | 1 | 2 | 0 | 25 | 1 | 0 | 0 | 0 | 29 | 0.65% | D | 0 | 29 |
| W. guatemala | 0 | 0 | 0 | 0 | 0 | 2 | 1 | 0 | 0 | 0 | 0 | 0 | 3 | 0.07% | R | 1 | 2 |
| W. mitchellii | 0 | 0 | 3 | 7 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 10 | 0.23% | A | 0 | 10 |
| Abundancia total | 532 | 59 | 15 | 221 | 337 | 331 | 173 | 1143 | 63 | 1,099 | 283 | 183 | 4,439 | 100% | 3,353 | 1,086 | |
| Riqueza de especies | 18 | 6 | 3 | 8 | 11 | 10 | 7 | 22 | 2 | 14 | 12 | 7 | 40 | 22 | 32 |
* Nuevo registro estatal de especie para Chiapas. Sc (Suchiate), Fh (Frontera Hidalgo), Cc (Cacahoatán), Tc (Tuxtla Chico), Mz (Mazatán), Af (Amatenango de la Frontera), Fc (Frontera Comalapa), Lt (La Trinitaria), Cm (Comitán), Oc (Ocosingo), Ba (Benemérito de las Américas), Pa (Palenque). N (Total de individuos), AR (abundancia relativa). Categorización de Olmstead-Tukey (OT): R (raras), F (frecuentes), A (abundantes) y D (dominantes). ID, Intradomicilio; PD, peridomicilio.
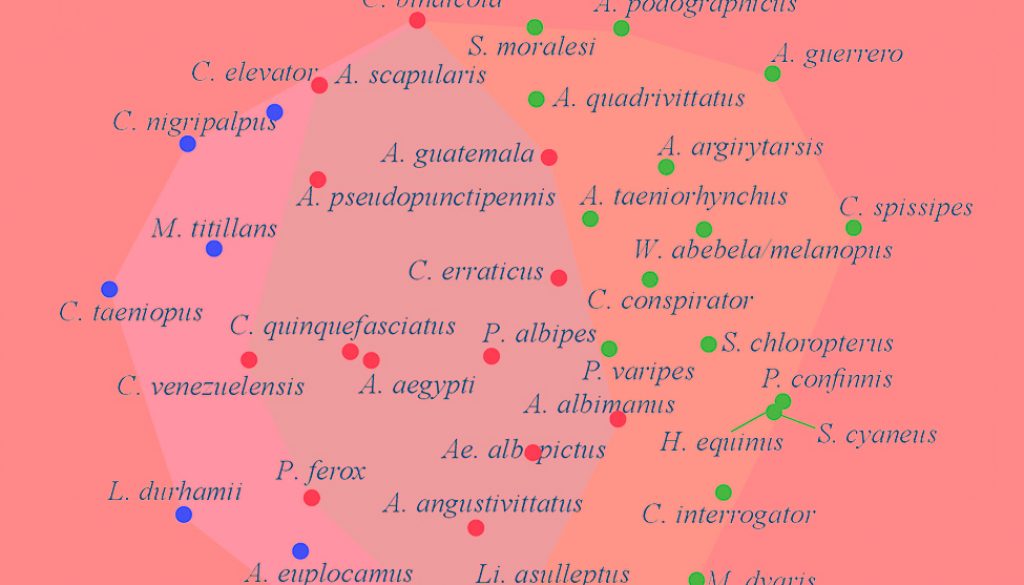
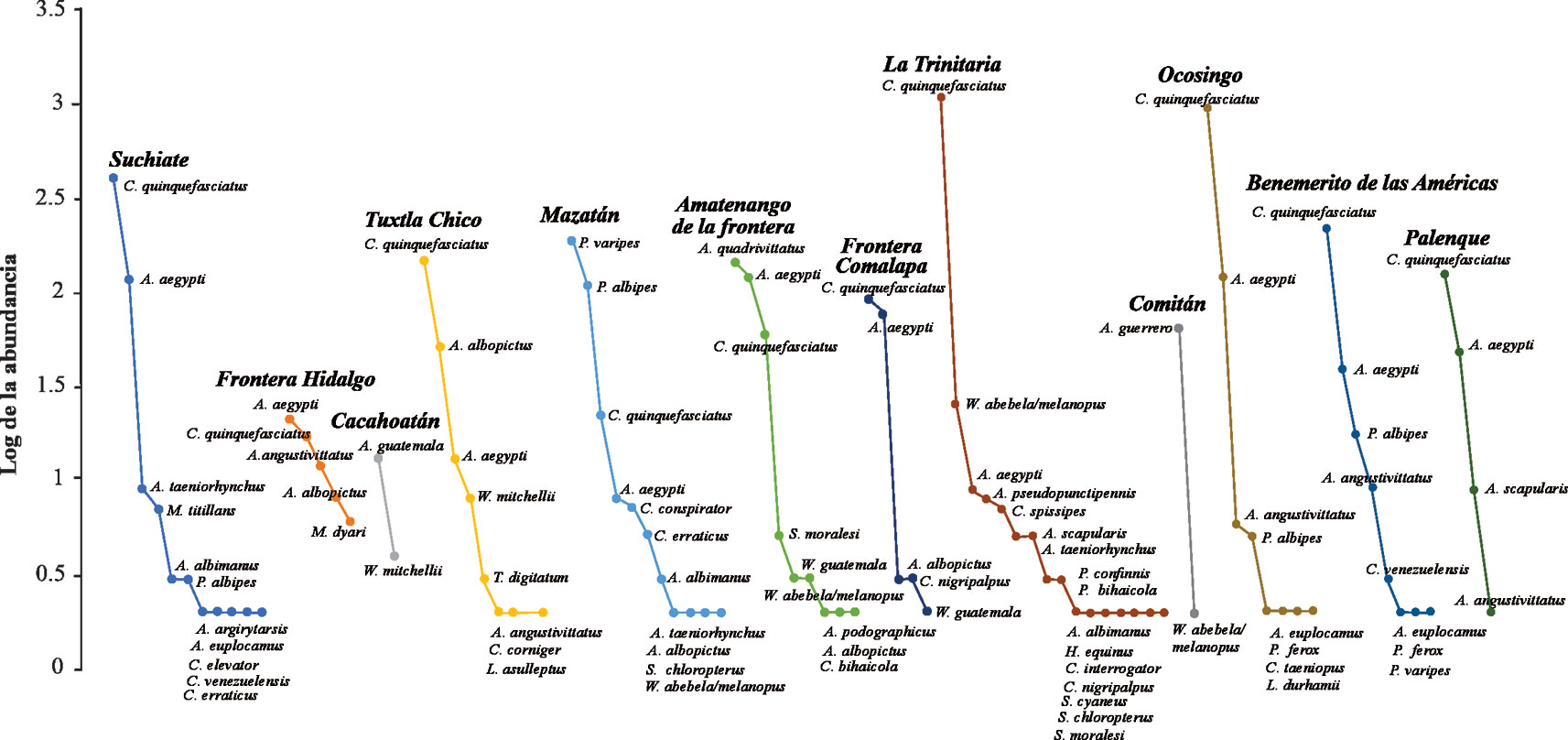
El municipio con mayor abundancia por sitio se registró en La Trinitaria con 25.7% (n = 1,143), seguido de Ocosingo con 24.8% (n = 1,099) y la menor abundancia se registró en Cacahoatán con 0.3% (n = 15). Los géneros con mayor abundancia y número de especies fueron Culex (n = 3,138 / S = 10), Aedes (n = 898 / S = 10), Psorophora (n = 321 / S = 4) y Wyeomyia (n = 42 / S = 3). Las especies más abundantes fueron Culex quinquefasciatus Say (69.72%) y Aedes aegypti (L.) (12.73%), estas especies también fueron las más representativas, reuniendo 82.45% de la abundancia total del inventario. Anopheles argyritarsis Robineau-Desvoidy, A. podographicus Dyar y Knab, Haemagogus equinus Theobald, C. elevator Dyar y Knab, C. taeniopus Dyar y Knab, C. corniger Theobald, Limatus asulleptus (Theobald), L. durhamii Theobald y Sabethes cyaneus (Fabricius) fueron recolectados únicamente en una localidad y con un solo individuo. La curva de rango-abundancia corroboró los resultados anteriores y evidenció una dominancia diferente entre las especies en los municipios de Cacahoatán (A. guatemala Berlin), Mazatán (P. varipes (Coquillett)) y Comitán (A. guerrero Berlin) con el resto de los municipios. Además, los municipios de Frontera Hidalgo, Amatenango de la Frontera, Frontera Comalapa y Palenque mostraron una uniformidad en sus especies por presentar una pendiente más suave e inclinada (fig. 2).
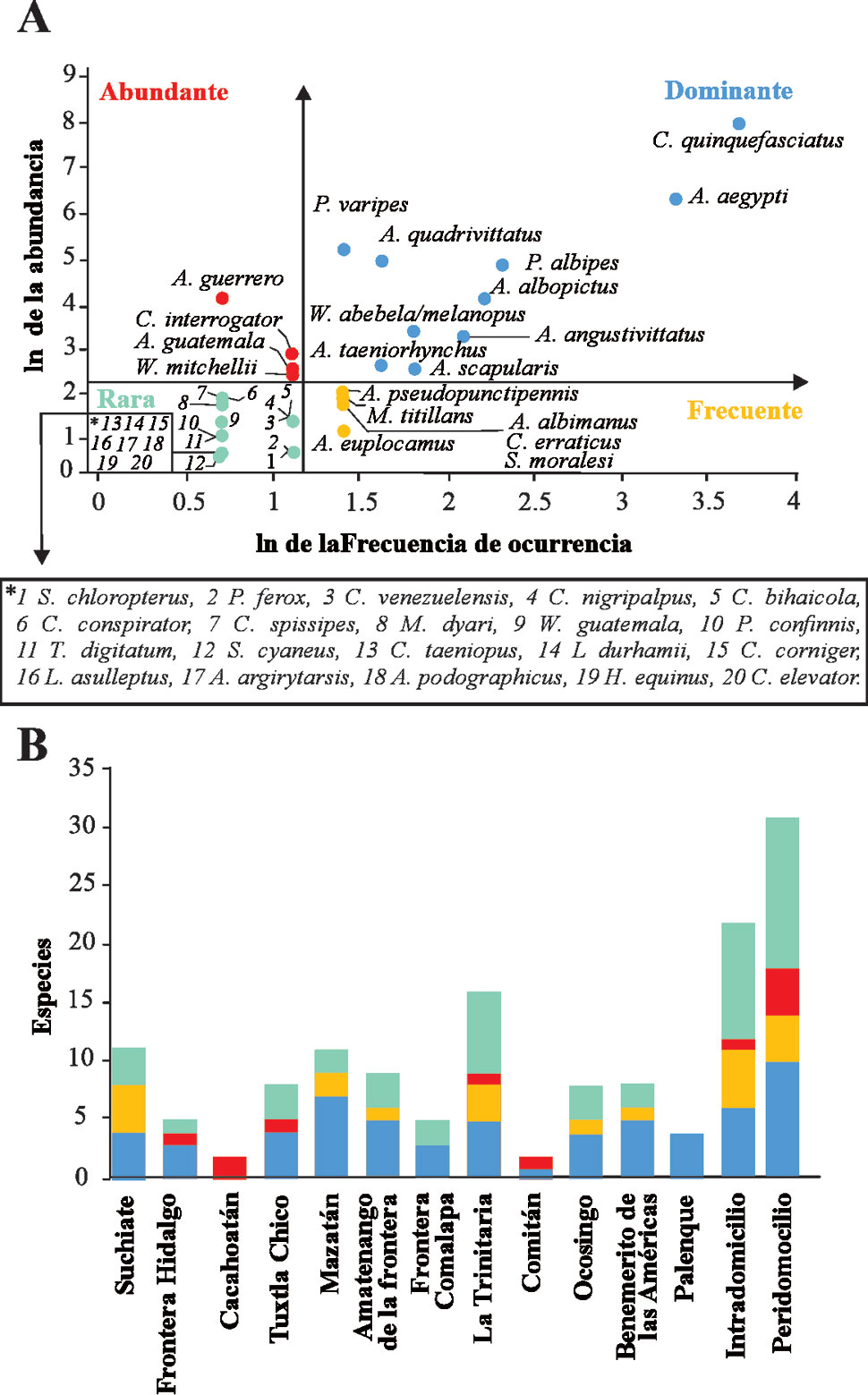
El ordenamiento de Olmstead-Tukey permitió registrar 10 especies dominantes, 6 frecuentes, 4 abundantes y 20 raras (fig. 3A), donde Mazatán obtuvo la mayor cantidad de especies dominantes (n = 7), Cacahoatán el mayor número de especies abundantes (n = 2), Suchiate el mayor número de especies frecuentes (n = 4) y la Trinitaria el mayor número de especies raras (n = 7). Ambos tipos de colecta (intradomicilio y peridomicilio) mostraron tener más especies raras, seguidamente de especies dominantes (fig. 3B).
El esfuerzo de muestreo de culícidos permitió registrar cerca de 80% de la riqueza estimada de Chao1 (n = 50 especies, fig. 4A) y en general, la cobertura obtenida para los 9 municipios y por el tipo de recolecta fue alta, representando un Cm > 83%, por lo que el inventario de especies se puede considerar completo. La mayor riqueza esperada lo presentó Mazatán (0D = 8.2), seguido de Amatenango de la Frontera (0D = 7.8) y Tuxtla chico (0D = 7.7), mientras que las riquezas esperadas respectivamente bajas fueron Palenque (0D = 4), Ocosingo (0D = 4), Frontera Comalapa (0D = 5). Para el caso del peridomicilio e intradomicilio, se observaron diferencias significativas, mostrando la mayor riqueza esperada el peridomicilio (0D = 32) (fig. 4B). Los valores altos de las riquezas esperadas mostraron ser estadísticamente diferente respecto a las riquezas esperadas bajas debido a que no traslapan sus intervalos de confianza (fig. 4C).
El mayor número de especies se registró en los municipios de la Trinitaria (S = 16), Suchiate (S = 11) y Mazatán (S = 11), mientras que Cacahoatán y Comitán registraron solo 2 especies. En algunos casos, los municipios con mayor número de especies e individuos no fueron más diversos y equitativos, ya que los valores altos de la diversidad de Shannon y la equidad de Pielou se presentaron en los municipios de Frontera Hidalgo (H´ = 1.50, J´ = 0.93, S = 5), Amatenango de la Frontera (H´ = 1.21, J´ = 0.55, S = 9) y Mazatán (H´ = 1.17, J´ = 0.49, S = 11). Los valores de la dominancia de Simpson fueron mayores en los municipios de Comitán (λ = 0.97), la Trinitaria (λ = 0.89) y Ocosingo (λ = 0.78), donde los resultados de estos 2 últimos fueron influenciados por las altas abundancias de C. quinquefasciatus (fig. 5).
La disimilitud de especies promedio (1-βJ) entre pares de comunidades de culícidos (por municipio) fue de 83.86%. El resultado del análisis de ordenación mostró que las comunidades de culícidos de Suchiate, Mazatán, Ocosingo, Benemérito de las Américas son muy parecidas en su composición de especies, en tanto Palenque, Tuxtla Chico, Frontera Hidalgo, Frontera Comalapa y Amatenango de la Frontera conforman otro grupo diferente. La Trinitaria conformó un grupo independiente muy cercano a los 2 anteriores, ya que solo compartió 10 de sus 16 especies. Cacahoatán y Comitán son los municipios con mayor disimilitud con respecto a los antes mencionados, ya que no compartieron ninguna de sus 2 especies (fig. 6A). Para el caso del peridomicilio e intradomicilio, el valor de la disimilitud fue de 1-βJ = 65%, compartiendo solo 14 especies entre ellas (fig. 6B).
En el ámbito de la salud pública, 21 de las 40 especies recolectadas son de importancia en la salud pública para la región y para México (tabla 2). La Trinitaria registró la mayor abundancia y número de especies de culícidos de importancia médica (S = 12, N = 1,114). Ocosingo obtuvo el segundo valor más alto en la abundancia (N = 1,093) con tan solo 5 especies, en comparación con Suchiate que obtuvieron el segundo valor más alto en riqueza (S = 8, N = 528). Por tipo de recolecta, el peridomicilio mostró tener más especies (n = 16) que el intradomicilio (n = 12), a diferencia de las abundancias, donde se obtuvo más individuos (n = 3,313) en el intradomicilio que el peridomicilio (n = 502). La dominancia, en ambos tipos de recolecta, estuvo representada por C. quinquefasciatus, sin embargo, se observó que A. aegypti muestra afinidad en ambientes del intradomicilio, siendo la segunda especie más abundante, a diferencia del peridomicilio donde A. albopictus (Skuse) se presentó como segunda especie más abundante.
Discusión
El presente trabajo constituye el primer estudio longitudinal realizado en la frontera Chiapas-Guatemala para caracterizar la fauna de culícidos que ingresan a alimentarse en viviendas de comunidades indígenas rurales, semi urbanas y urbanas. Se identificaron un total de 40 especies, de las cuales M. dyari representa ser un nuevo registro para Chiapas, elevando el número especies a 140. En general, se observa una alta riqueza en especies de culicinos los cuales contrastan con la baja abundancia y número de especies de anofelinos capturados en este estudio, esto se debe a que los patrones de alimentación de los anofelinos son nocturnos (Cruz et al., 2004), mientras nuestras recolectas fueron en horario diurno y muchas de las especies de culicinos capturadas son diurnas.
De las 6 especies frecuentes, 4 son de importancia médica: A. pseudopunctipennis Theobald y A. albimanus Wiedemann son los principales vectores de Plasmosium sp. responsable de ocasionar la malaria en México (Villarreal-Treviño et al., 2020), A. aegypti, A. albopictus, A. angustivittatus Dyar y Knab, A. scapularis (Rondani), A. taeniorhynchus (Wiedemann) y C. quinquefasciatus tienen importancia por ser vectores de arbovirus como dengue, fiebre amarilla, chikungunya, zika, mayaro, encefalitis equina venezolana, encefalitis equina del oeste y fiebre del valle del Rift (Linthicum et al., 2016; Mitchell, 1995; Wang et al., 2012).
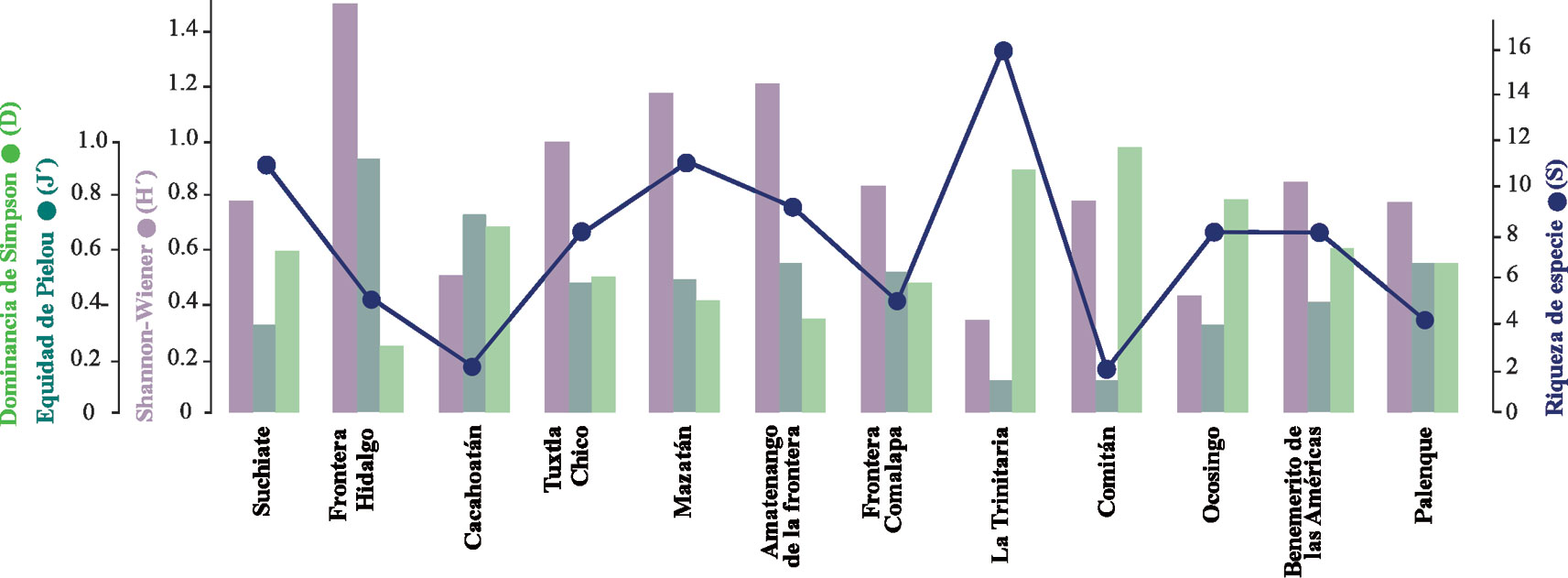
Los análisis en la composición de las especies evidenciaron una alta presencia de ejemplares pocos abundantes o frecuentes (raras) distribuidas en los diferentes municipios de estudio, esto puede deberse a la dinámica de variables climáticas, como la altitud en la que fueron recolectadas (A. guerrero y A. podographicus colectados solamente a 1,200 m snm) y el horario de muestreo. La riqueza de especies resultó ser diferente entre los municipios, concordando con las riquezas de la Trinitaria y Suchiate, en donde se visitaron más sitios y se registraron más especies. Sin embargo, en Mazatán, solo se visitó una localidad ubicada cerca de la costa, en donde fue uno de los 3 sitios con mayor número de especies. Algunos municipios con igual número de especies reportan valores muy diferentes en su diversidad (H’) y equidad (J’), llegando observar que el municipio más rico no fue el más diverso, a diferencias de los municipios con una riqueza ligeramente baja como Frontera Hidalgo (S = 5) que obtuvo una diversidad alta (H’ = 1.50). Este patrón de disminución de ambos índices se observó de igual forma con el ambiente del intradomicilio. Los índices H’ y J’ dependen no solo de la riqueza de especies, sino que son influenciados por la abundancia de los individuos que componen la muestra y sus valores se reducen cuando existe presencia de una o más especies dominantes. La evaluación de la dominancia con el índice λ mostró ser muy redundante respecto al índice J’ de forma inversa (R = -0.80, p < 0.001).
Tabla 2
Mosquitos de importancia en salud pública recolectados en la frontera México-Guatemala.
| Especie | Importancia en salud pública | Referencias |
| A. pseudopunctipennis | Malaria | Villarreal-treviño et al., 2020 |
| A. albimanus | Malaria | Villarreal-treviño et al., 2020 |
| A. argyritarsis | Malaria | Beltrán-Aguilar et al., 2011 |
| A. angustivittatus | VEEV, ILHV | Arnell, 1976; Mesa et al., 2005 |
| Dirofilaria immitis | Alvarado-Torres et al., 2019 | |
| A. scapularis | YFV | Davis et Shannon, 1929 |
| VEEV | Mesa et al., 2005 | |
| ILHV | Pauvolid-Corrêa et al., 2013 | |
| ROCV | Mitchell et al., 1986 | |
| A. taeniorhynchus | ZIKV | Ayres et al., 2019 |
| WNV | Eastwood et al., 2013 | |
| VEEV | Smith et al., 2008 | |
| EEEV | Turell et al., 1994 | |
| Dirofilaria immitis | Alvarado-Torres et al., 2019 | |
| A. aegypti | DENV; YFV | Black IV et al., 2002 |
| CHIKV | Vega-Rua et al., 2014 | |
| ZIKV | Ayres et al., 2019 | |
| VEEV | Marcondes et Ximenes, 2016 | |
| Dirofilaria immitis | Alvarado-Torres et al., 2019 | |
| WEEV | Wang et al., 2012 | |
| RVFV | Linthicum et al., 2016 | |
| MAYV | Pereira et al., 2020 | |
| A. albopictus | DENV, CHIKV, WNV, RVFV | Mitchell, 1995 |
| VEEV | Weaver et Reisen, 2010 | |
| SLEV | Mitchell, 1991 | |
| ZIKV | Fernandes et al., 2020 | |
| YFV | Kraemer et al., 2015 | |
| EEEV | Turell et al., 1994 | |
| USUV | Calzolari et al., 2010 | |
| Dirofilaria immitis | Alvarado-Torres et al., 2019 | |
| WEEV | Wang et al., 2012 | |
| MAYV | Pereira et al., 2020 | |
| OROV | Mitchell, 1991 | |
| H. equinus | YFV | Rodaniche et al., 1957 |
| P. confinnis | VEEV | Ortiz et al., 2005 |
| P. ferox | VEEV | Chamberlain et al., 1956 |
| MAYV | Forattini, 1962 | |
| EEEV | Turell et al., 2008 | |
| ILHV | Turell et al., 2005 | |
| Tabla 2. Continúa | ||
| Especie | Importancia en salud pública | Referencias |
| ROCV | Mitchell et al., 1986 | |
| RVFV | Linthicum et al., 2016 | |
| C. nigripalpus | EEEV | Mesa et al., 2005 |
| WNV | Mores et al., 2007 | |
| SLEV | Nayar et al., 2002 | |
| RVFV | Linthicum et al., 2016 | |
| C. quinquefasciatus | WNV | Sardelis et al., 2001 |
| USU | Cook et al., 2018 | |
| ZIKV | Ayres et al., 2019 | |
| SLEV | Diaz et al., 2006 | |
| Wuchereria bancrofti | Foster et Walker, 2019 | |
| MAYV | Pereira et al., 2020 | |
| WEEV | Wang et al., 2012 | |
| OROV | Segura et Castro, 2007 | |
| C. erraticus | VEEV | Mesa et al., 2005 |
| RVFV | Linthicum et al., 2016 | |
| C. spissipes | VEEV | Turell et al., 2005 |
| C. taeniopus | VEEV | Deardorff et Weaver, 2010 |
| C. venezuelensis | MAYV | Aitken, 1960 |
| OROV | Segura et Castro, 2007 | |
| M. dyari | RVFV | Linthicum et al., 2016 |
| M. titillans | VEEV | Turell et al., 2000 |
| SLEV | Beranek et al., 2018 | |
| S. cyaneus | ZIKV | Karna et al., 2018 |
| S. chloropterus | YFV | Rodaniche et al., 1957 |
| S. cyaneus | ZIKV | (Karna et al., 2018) |
| S. chloropterus | YFV | (Rodaniche et al., 1957) |
DENV: Virus dengue, CHICKV: virus chikungunya, ZIKV: virus Zika; YFV: virus de la fiebre amarilla; VEEV: virus encefalitis equina venezolana; RVFV: virus de la fiebre del valle de Rift; MAYV: virus Mayaro; EEEV: virus de encefalitis equina del este; WNV: virus del oeste del Nilo; USUV: virus Usutu; OROV: virus Oropuche; ILHV: virus Ilheus; ROCV: virus del Rocío; WEEV: virus encefalitis equina del oeste; SLEV: virus encefalitis de San Luis.
Son necesarios estudios adicionales que permitan abundar en el conocimiento de la distribución y abudancia de especies de mosquitos de importancia médica en comunidades tropicales de México, donde algunas ETM son endémicas, esta información es esencial para mejorar los programas de vigilancia entomológica en la frontera sur de México.
Agradecimientos
Al personal de la Unidad de Investigaciones Entomológicas y de Bioensayo del Estado de Chiapas (UIEB) por su valiosa participación en las recolectas de campo. Al Consejo Nacional de Ciencia y Tecnología (Conacyt) de México por la beca de doctorado a Rafael Vázquez Marroquín (Núm. de apoyo 719439).
Referencias
Alvarado-Torres, H., Viveros-Santos, V., Torres-Monzón, J. A., López-Ordóñez, T., Torres-Chable, O. M. y Casas-Martínez, M. (2019). Detección de Dirofilaria immitis (Spirurida: Onchocerdidae) en la comunidad de mosquitos (Diptera: Culicidae) de cementerios de la región Soconusco, sur de México. Entomología Médica y Forense, 6, 490–496.
Anguiano-Téllez, M. E. (2008). Chiapas: immigration, migration and migratory transit territory. Papeles de Población, 14, 199–215.
Arnell, H. J. (1976). Mosquito studies (Diptera, Culicidae) XXXIIL. A revision of the Scapularis group of Aedes (Ochlerotatus). Contributions of the American Entomological Institute, 13, 1–144.
Ayres, C. F. J., Guedes, D. R. D., Paiva, M. H. S., Morais-Sobral, M. C., Krokovsky, L., Machado, L. C. et al. (2019). Zika virus detection, isolation and genome sequencing through Culicidae sampling during the epidemic in Vitória, Espírito Santo, Brazil. Parasites and Vectors, 12, 1–9. https://doi.org/10.1186/s13071-019-3461-4
Beltrán-Aguilar, A., Ibáñez-Bernal, S., Mendoza-Palmero, F., Sandoval-Ruiz, C. A. y Hernández-Xoliot, R. A. (2011). Taxonomía y distribución de los anofelinos en el estado de Veracruz, México (Diptera: Culicidae, Anophelinae). Acta Zoológica Mexicana (N.S.), 27, 601–755. https://doi.org/10.21829/azm.2011.273778
Beranek, M. D., Gallardo, R., Almirón, W. R. y Contigiani, M. S. (2018). First detection of Mansonia titillans (Diptera: Culicidae) infected with St. Louis encephalitis virus (Flaviviridae: Flavivirus) and Bunyamwera serogroup (Peribunyaviridae: Orthobunyavirus) in Argentina. Journal of Vector Ecology, 43, 340–343. https://doi.org/10.1111/jvec.12320
Black IV, W. C., Bennett, K. E., Gorrochótegui-Escalante, N., Barillas-Mury, C. V., Fernández-Salas, I., Muñoz, M. D. L. et al. (2002). Flavivirus susceptibility in Aedes aegypti. Archives of Medical Research, 33, 379–388. https://doi.org/10.1016/S0188-4409(02)00373-9
Bond, J. G., Casas-Martínez, M., Quiroz-Martínez, H., Novelo-Gutiérrez, R., Marina, C. F., Ulloa, A. et al. (2014). Diversity of mosquitoes and the aquatic insects associated with their oviposition sites along the Pacific coast of Mexico. Parasites and Vectors, 7, 41. https://doi.org/10.1186/1756-3305-7-41
Calzolari, M., Bonilauri, P., Bellini, R., Albieri, A., Defilippo, F., Maioli, G. et al. (2010). Evidence of simultaneous circulation of west Nile and Usutu viruses in mosquitoes sampled in Emilia-Romagna region (Italy) in 2009. Plos One, 5, 1–10. https://doi.org/10.1371/journal.pone.0014324
Chamberlain, R. W., Sikes, R. K. y Nelson, D. B. (1956). Infection of Mansonia perturbans and Psorophora ferox Mosquitoes with Venezuelan Equine Encephalomyelitis Virus. (22216). Proceedings of the Society for Experimental Biology and Medicine, 91, 215–216. https://doi.org/10.3181/00379727-91-22216.
Clark-Gil, S. y Darsie Jr., R. F. (1983). The mosquitoes of Guatemala: Their identification, distribution and bionomics. Mosquito Systematics, 15, 151–269.
Clarke, K. R. y Gorley, R. N. (2015). Getting started with PRIMER v7. PRIMER-E. PRIMER-E: Plymounth, 20, 2–20.
Colwell, R. K. (2013). EstimateS: Statistical estimation of species richness and shared species from samples. Version 9 and earlier. User’s Guide and application. http://viceroy.eeb.uconn.edu/estimates
Cook, C. L., Huang, Y. J. S., Lyons, A. C., Alto, B. W., Unlu, I., Higgs, S. et al. (2018). North American Culex pipiens and Culex quinquefasciatus are competent vectors for Usutu virus. PLOS Neglected Tropical Diseases, 12, e0006732. https://doi.org/10.1371/journal.pntd.0006732
Cruz G, C., Valle T, J. y Ruiz M, A. (2004). Determinación de los hábitos de A. pseudopunctipennis y A. calderoni en dos localidades del Valle de Chao. La Libertad, Perú. Revista Peruana de Medicina Experimental y Salud Pública, 21, 223–230.
Darsie Jr., R. F. y Ward, R. A. (2005). Identification and geographical distribution of the mosquitoes of North America, North of Mexico. Gainesville, Florida: University Press of Florida.
Davis, N. C. y Shannon, R. C. (1929). Studies on yellow fever in South America: V. Transmission experiences with certain species of Culex and Aedes. Journal of Experimental Medicine, 50, 803–808. https://doi.org/10.1084/jem.50.6.803
Deardorff, E. R. y Weaver, S. C. (2010). Vector competence of Culex (Melanoconion) taeniopus for equine-virulent subtype IE strains of Venezuelan equine encephalitis virus. American Journal of Tropical Medicine and Hygiene, 82, 1047–1052. https://doi.org/10.4269/ajtmh.2010.09-0556
Díaz-González, E. E., Kautz, T. F., Dorantes-Delgado, A., Malo-García, I. R., Laguna-Aguilar, M., Langsjoen, R. M. et al. (2015). First report of Aedes aegypti transmission of chikungunya virus in the Americas. American Journal of Tropical Medicine and Hygiene, 93, 1325–1329. https://doi.org/10.4269/ajtmh.15-0450
Díaz, L. A., Ré, V., Almirón, W. R., Farías, A., Vázquez, A., Sanchez-Seco, M. P. et al. (2006). Genotype III Saint Louis encephalitis virus outbreak, Argentina, 2005. Emerging Infectious Diseases, 12, 1752–1754. https://doi.org/10.3201/eid1211.060486
Eastwood, G., Goodman, S. J., Cunningham, A. A. y Kramer, L. D. (2013). Aedes taeniorhynchus vectorial capacity informs a pre-emptive assessment of west nile virus establishment in galápagos. Scientific Reports, 3, 1–8. https://doi.org/10.1038/srep01519
Fernandes, R. S., O’connor, O., Bersot, M. I. L., Girault, D., Dokunengo, M. R., Pocquet, N. et al. (2020). Vector competence of Aedes aegypti, Aedes albopictus and Culex quinquefasciatus from Brazil and New Caledonia for three zika virus lineages. Pathogens, 9, 1–17. https://doi.org/10.3390/pathogens9070575
Forattini, O. p. (1962). Arborviroses. Arquivos Da Facultade de Higiene e Saúde Pública Da Universidade de São Paulo, 15, 109–199. https://doi.org/10.11606/issn.2358-792X.v16i
0p109-199
Foster, W. A. y Walker, E. D. (2019). Mosquitoes (Culicidae). En G. R. Mullen y L. A. Durden (Eds.), Medical and veterinary entomology, Third edition (pp. 261–325). Massachusetts: Academic Press.
Guerbois, M., Fernandez-Salas, I., Azar, S. R., Danis-Lozano, R., Alpuche-Aranda, C. M., Leal, G. et al. (2016). Outbreak of Zika virus infection, Chiapas State, Mexico, 2015, and first confirmed transmission by Aedes aegypti mosquitoes in the Americas. Journal of Infectious Diseases, 214, 1349–1356. https://doi.org/10.1093/infdis/jiw302
Harbach, R. E. (2013). Culicidae Meigen, 1818. Mosquito taxonomic inventory. Disponible en: http://mosquito-taxonomic-inventory.info
Hernández-Triana, L. M., Garza-Hernández, J. A., Ortega Morales, A. I., Prosser, S. W. J., Hebert, P. D. N., Nikolova, N. I. et al. (2021). An integrated molecular approach to untangling host–vector–pathogen interactions in mosquitoes (Diptera: Culicidae) from sylvan communities in Mexico. Frontiers in Veterinary Science, 7, 1–17. https://doi.org/10.3389/fvets.2020.564791
Hsieh, T. C., Ma, K. H. y Chao, A. (2016). iNEXT: an R package for rarefaction and extrapolation of species diversity (Hill numbers). Methods in Ecology and Evolution, 7, 1451–1456. https://doi.org/10.1111/2041-210X.12613
INEGI (Instituto Nacional de Estadísticas y Geografía). (2017). Anuario estadístico y geográfico de Chiapas 2017. Disponible en: http://internet.contenidos.inegi.org.mx/contenidos/Productos/prod_serv/contenidos/espanol/bvinegi/productos/nueva_estruc/anuarios_2017/702825092115.pdf
Karna, A. K., Azar, S. R., Plante, J. A., Yun, R., Vasilakis, N., Weaver, S. C. et al. (2018). Colonized sabethes cyaneus, a sylvatic new world mosquito species, shows a low vector competence for zika virus relative to Aedes aegypti. Viruses, 10, 1–9. https://doi.org/10.3390/v10080434
Kraemer, M. U. G., Sinka, M. E., Duda, K. A., Mylne, A. Q. N., Shearer, F. M., Barker, C. M. et al. (2015). The global distribution of the arbovirus vectors Aedes aegypti and A. albopictus. ELife, 4, 1–18. https://doi.org/10.7554/eLife.08347
Linthicum, K. J., Britch, S. C. y Anyamba, A. (2016). Rift Valley Fever: An emerging mosquito-borne disease. Annual Review of Entomology, 61, 395–415. https://doi.org/10.1146/annurev-ento-010715-023819
Magurran, A. E. (2004). Measuring biological diversity. Malden, USA: Blackwell Publishing.
Marcondes, C. B. y Ximenes, M. F. F. M. (2016). Zika virus in Brazil and the danger of infestation by Aedes (Stegomyia) mosquitoes. Revista Da Sociedade Brasileira de Medicina Tropical, 49, 4–10. https://doi.org/10.1590/0037-8682-0220-2015
Mesa, F. A., Cárdenas, J. A. y Villamil, L. C. (2005). Las encefalitis equinas en la salud pública. Disponible en: https://www.minsalud.gov.co/Documentos y Publicaciones/Libro Encefalitis Equinas UNAL.pdf
Mitchell, C. J. (1991). Vector competence of North and South American strains of Aedes albopictus for certain arboviruses: a review. Journal of the American Mosquito Control Association, 7, 446–451.
Mitchell, C. J. (1995). Geographic spread of Aedes albopictus and potential for involvement in arbovirus cycles in the Mediterranean basin. Journal of Vector Ecology, 20, 44–58.
Mitchell, C. J., Forattini, O. P. y Miller, B. R. (1986). Vector competence experiments with Rocio virus and three mosquito species from the epidemic zone in Brazil. Revista de Saúde Pública, 20, 171–177. https://doi.org/10.1590/s0034-89101986000300001
Mores, C. N., Turell, M. J., Dohm, D. J., Blow, J. A., Carranza, M. T. y Quintana, M. (2007). Experimental transmission of west nile virus by Culex nigripalpus from honduras. Vector-Borne and Zoonotic Diseases, 7, 279–284. https://doi.org/10.1089/vbz.2006.0557
Nayar, J. K., Knight, J. W. y Munstermann, L. E. (2002). Temporal and geographic genetic variation in Culex nigripalpus Theobald (Culicidae: Diptera), a vector of St. Louis encephalitis virus, from Florida. Journal of Medical Entomology, 39, 854–860. https://doi.org/10.1603/0022-2585-39.6.854
Ortiz, D. I., Anishchenko, M. y Weaver, S. C. (2005). Susceptibility of Psorophora confinnis (Diptera: Culicidae) to infection with epizootic (subtype IC) and enzootic (subtype ID) Venezuelan equine encephalitis viruses. Journal of Medical Entomology, 42, 857–863. https://doi.org/10.1603/0022-2585-41.5.987
Osório, H. C., Zé-Zé, L., Amaro, F. y Alves, M. J. (2014). Mosquito surveillance for prevention and control of emerging mosquito-borne diseases in Portugal —2008-2014. International Journal of Environmental Research and Public Health, 11, 11583–11596. https://doi.org/10.3390/ijerph111111583
Pauvolid-Corrêa, A., Kenney, J. L., Couto-Lima, D., Campos, Z. M. S., Schatzmayr, H. G., Nogueira, R. M. R. et al. (2013). Ilheus virus isolation in the Pantanal, West-Central Brazil. Plos Neglected Tropical Diseases, 7, e2318. https://doi.org/10.1371/journal.pntd.0002318
Pereira, T. N., Carvalho, F. D., De Mendonça, S. F., Rocha, M. N. y Moreira, L. A. (2020). Vector competence of Aedes aegypti, Aedes albopictus, and Culex quinquefasciatus mosquitoes for Mayaro virus. Plos Neglected Tropical Diseases, 14, 1–13. https://doi.org/10.1371/journal.pntd.0007518
Ramos-Rojas, D. N. (2016). La movilidad transfronteriza México-Guatemala desde la representación cotidiana de los trabajadores centroamericanos Mexico-Guatemala border mobility as represented in the everyday lives of Central American workers. Estudios Fronterizos, 17, 21–40. https://doi.org/10.21670/ref.2016.34.a02
Rodaniche, E. de, Galindo, P. y Johnson, C. M. (1957). Isolation of Yellow Fever virus from Haemagogus mesodentatus, H. equinus and Sabethes chloropterus captured in Guatemala in 1956. The American Society of Tropical Medicine and Hygiene, 6, 681–685.
Ruiz-Arrondo, I., McMahon, B. J., Hernández-Triana, L. M., Santibañez, P., Portillo, A. y Oteo, J. A. (2019). Surveillance of mosquitoes (Diptera, Culicidae) in a northern central region of Spain: implications for the medical community. Frontiers in Veterinary Science, 6, 86. https://doi.org/10.3389/fvets.2019.00086
Sardelis, M. R., Turell, M. J., Dohm, D. J. y O’Guinn, M. L. (2001). Vector Competence of Selected North American Culex and Coquillettidia Mosquitoes for West Nile Virus. Emerging Infectious Diseases, 7, 1018–1022. https://doi.org/10.7717/peerj.4324
SS (Secretaría de Salud). (2021). Boletín epidemiológico Sistema Nacional de Vigilancia Epidemiológica Sistema Único de Información. México. https://www.gob.mx/salud/documentos/boletinepidemiologico-sistema-nacional-de-vigilancia-epidemiologica-sistema-unico-de-informacion-231750
Segura, M. N. O. y Castro, F. C. (2007). Atlas de culicídeos na Amazônia Brasileira. Caracteísticas específicas de insectos hematófagos de familia Culicidae. Belem, Brasil: Instituto Evandro Chagas.
Silver, J. B. (2008). Mosquito ecology: field sampling methods. springer science & business media. Dordretch, Paises Bajos: Springer.
Smith, D. R., Adams, P. A., Kenney, J. L., Wang, E. y Weaver, S. C. (2008). Venezuelan equine encephalitis virus in the mosquito vector. Virology Journal, 372, 176–186.
Sokal, R. R. y Rohlf, F. J. (1981). Biometry. The principles and practice of statistics in biological research. Nueva York: Freeman. https://doi.org/10.2307/2412280
Turell, M. J., O’Guinn, M. L., Jones, J. W., Sardelis, M. R., Dohm, D. J., Watts, D. M. et al. (2005). Isolation of viruses from mosquitoes (Diptera: Culicidae) collected in the Amazon Basin region of Peru. Journal of Medical Entomology, 42, 891–898. https://doi.org/10.1093/jmedent/42.5.891
Turell, M. J., O’Guinn, M. L., Navarro, R., Romero, G. y Estrada-Franco, J. G. (2000). Vector Competence of Peruvian Mosquitoes (Diptera: Culicidae) for Epizootic and Enzootic Strains of Venezuelan Equine Encephalomyelitis Virus. Journal of Medical Entomology, 37, 306–310. https://doi.org/10.1603/0022-2585-40.3.306
Turell, M.J., O’Guinn, M. L., Dohm, D., Zyzak, M., Watts, D., Fernandez, R. et al. (2008). Susceptibility of peruvian mosquitoes to eastern equine encephalitis virus. Journal of Medical Entomology, 45, 720–725. https://doi.org/10.1603/0022-2585(2008)45[720:SOPMTE]2.0.CO;2
Turell, M. J., Beaman, J. R. y Neely, G. W. (1994). Experimental transmission of eastern equine encephalitis virus by strains of Aedes albopictus and A. taeniorhynchus (Diptera: Culicidae). Journal of Medical Entomology, 31, 287–290. https://doi.org/10.1093/jmedent/31.2.287
Vega-Rua, A., Zouache, K., Girod, R., Failloux, A. B. y Lourenco-de Oliveira, R. (2014). High level of vector competence of Aedes aegypti and Aedes albopictus from ten American countries as a crucial factor in the spread of Chikungunya virus. Journal of Virology, 88, 6294–6306. https://doi.org/10.1128/jvi.00370-14
Villarreal-Treviño, C., Ríos-Delgado, J. C., Penilla-Navarro, R. P., Rodríguez, A. D., López, J. H., Nettel-Cruz, J. A. et al. (2020). Composition and abundance of anopheline species according to habitat diversity in Mexico. Salud Publica de Mexico, 62, 388–401. https://www.medigraphic.com/pdfs/salpubmex/sal-2020/sal204g.pdf
Wang, Z., Zhang, X., Li, C., Zhang, Y., Xing, D., Wu, Y. et al. (2012). Vector competence of five common mosquito species in the People’s Republic of China for western equine encephalitis virus. Vector-Borne and Zoonotic Diseases, 12, 605–608. https://doi.org/10.1089/vbz.2011.0660
Weaver, S. C. y Reisen, W. K. (2010). Present and future arboviral threaths. Antiviral Research, 85, 1–36. https://doi.org/10.1016/j.antiviral.2009.10.008.
Wilkerson, R. C. y Strickman, D. (1990). Ilustrated key to the female Anopheline mosquitoes of Central America and México. Journal of the American Mosquito Control Association, 6, 7–33.