Natalia Fierro-Estrada a, b, Diego M. Arenas-Moreno a, c, Rafael A. Lara-Reséndiz d, Francisco J. Muñoz-Nolasco a, e, Marco A. Altamirano-Benavides f, g, Fabiola J. Gandarilla-Aizpuro a, Raúl Gómez Trejo-Pérez a, Luis E. Lozano-Aguilar a, Rufino Santos-Bibiano a, Danny Rueda-Córdova h, Paola Buitrón-López i y Fausto R. Méndez-de la Cruz a, *
a Universidad Nacional Autónoma de México, Instituto de Biología, Departamento de Zoología, Laboratorio de Herpetología, Apartado postal 70515, 04510 Ciudad de México, México
b Universidad Nacional Autónoma de México, Facultad de Estudios Superiores Iztacala, Unidad de Biotecnología y Prototipos, Laboratorio de Recursos Naturales, Avenida de los Barrios Núm. 1, Col. Los Reyes Ixtacala, 54090 Tlalnepantla, Estado de México, México
c Universidad Autónoma de Guerrero, Facultad de Ciencias Químico-Biológicas, Av. Lázarao Cárdenas s/n, Ciudad Universitaria Sur, 39086 Chilpancingo de los Bravo, Guerrero, México
d Instituto Tecnológico de Sonora, 5 de Febrero, 818, Col. Centro, 85000 Cd. Obregón, Sonora, México
e Universidad Nacional Autónoma de México, Instituto de Ecología, Laboratorio de Interacción Planta-Atmósfera, Tercer Circuito Universitario s/n, Ciudad Universitaria, Coyoacán, 04510 Ciudad de México, México
f Universidad Iberoamericana del Ecuador, Dirección de Investigación, 9 de Octubre N25-12 y Colón, Quito, Ecuador
g Universidad Central del Ecuador, Facultad de Ciencias Agrícolas, Ciudadela Universitaria-Jerónimo Leiton y Av. La Gasca s/n, Quito, Ecuador
h Dirección del Parque Nacional Galápagos, Av. Charles Darwin s/n, Puerto Ayora, Isla Santa Cruz, Ecuador
i Dirección del Parque Nacional Galápagos, Dirección de Ecosistemas, Av. Charles Darwin s/n, Puerto Ayora, Isla Santa Cruz, Ecuador
*Autor para correspondencia: faustor@ib.unam.mx (F.R. Méndez-de la Cruz)
Recibido: 8 enero 2021; aceptado: 28 julio 2022
Resumen
La temperatura es la principal variable ambiental de la que dependen las lagartijas para mantener sus procesos metabólicos, esta influencia el desempeño locomotor. Debido a esto, si la temperatura ambiental aumenta como consecuencia del cambio climático, los lacertilios podrían verse afectados fisiológica y ecológicamente. Evaluamos la eficiencia térmica y el desempeño locomotor de 3 poblaciones de Microlophus indefatigabilis. Registramos las temperaturas corporales, seleccionadas y críticas de los organismos, su desempeño locomotor y temperaturas operativas durante la temporada fría de 2017. Analizamos las temperaturas ambientales durante el fenómeno de El Niño de 1997 y 2015. Calculamos sus horas de restricción térmica durante el muestreo y ante los posibles aumentos en la temporada fría durante El Niño. Encontramos que las temperaturas corporales variaron significativamente entre poblaciones, pero conservan sus temperaturas seleccionadas, las cuales son cercanas a su temperatura óptima. Microlophus indefatigabilis tiende a termorregular y el extremo superior de su amplitud térmica está cercano a la temperatura crítica máxima. En años sin influencia de El Niño, la población con escasa cobertura vegetal presentó horas de restricción, pero con el aumento de las temperaturas ambientales, la especie podría incrementar sus horas de restricción, limitando sus horas de alimentación.
Palabras clave: Termorregulación; Temperatura óptima; Desempeño locomotor; Amplitud térmica; Islas Galápagos; Cambio climático; Restricción térmica
© 2022 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Thermal ecology of the Santa Cruz lava lizard (Microlophus indefatigabilis) from Galápagos, Ecuador: implications of the El Niño event
Abstract
Temperature is the main environmental variable that lizards depend on to maintain their metabolic processes, this influence locomotor performance. Thereafter, if the environmental temperature increases, because of climate change, the lizards could be affected physiologically and ecologically. We evaluated the thermal efficiency and locomotor performance of 3 populations of Microlophus indefatigabilis. We recorded body, selected and critical temperatures of the organisms, their locomotor performance, and operative temperatures during the cold season of 2017. We obtained the environmental temperatures during the El Niño 1997 and 2015 events. We calculated their restriction hours during the sampling year and in possible increases in the cold season during El Niño. We found that body temperatures varied significantly among populations, but keep their selected temperatures, which are close to their optimum temperature for locomotor performance. Microlophus indefatigabilis is a thermoregulator in which its maximum values are close to its critical maximum temperature. Under normal years without El Niño event, the population with scarce vegetation cover presented hours of restriction, but with the increase in environmental temperatures, the species could increase its hours of restriction, limiting its feeding hours.
Keywords: Thermorregulation; Optimal temperature; Locomotor performance; Thermal breadth; Galápagos Islands; Climate change; Thermal restriction
© 2022 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
La temperatura es la principal variable ambiental que influye en la sobrevivencia de los ectotermos, pues de ésta depende que se realicen correctamente sus procesos ecofisiológicos (Dubois et al., 2009; Huey, 1982; Huey y Slatkin, 1976). Para que estos organismos mantengan su temperatura corporal dentro de un intervalo óptimo, deben termorregular empleando diferentes estrategias. En el caso de los reptiles, la termorregulación es principalmente conductual y en menor medida mediante ajustes fisiológicos (Blouin-Demers y Nadeau, 2005; Hertz et al., 1993; Huey, 1974a; Huey y Slatkin, 1976; Labra et al., 2008). En específico, las lagartijas pueden obtener el calor mediante 2 vías: 1) tigmotermia, obtención de calor mayormente mediante conducción y 2) heliotermia, obtienen calor principalmente por radiación solar directa (Castellini, 2009; Cowles y Bogert, 1944; Willmer et al., 2005). Aunado a ésto, para lograr una termorregulación adecuada, las lagartijas dependen de la temperatura disponible en distintos micrositios en su hábitat (Hertz et al., 1993; Sinervo et al., 2010). La temperatura ambiental determina la cantidad de horas al día en las cuales las lagartijas pueden estar activas en función de sus requerimientos fisiológicos, dicho rendimiento se rige en respuesta directa de las temperaturas corporales y se ha estudiado mediante las curvas de desempeño (Huey y Slatkin, 1976; Labra et al., 2008).
Las curvas de desempeño tienen un comportamiento general, el cual inicia a partir de la temperatura crítica mínima de los organismos, se incrementa a medida que se eleva la temperatura corporal hasta llegar a la temperatura óptima y posteriormente decrece abruptamente hasta la temperatura crítica máxima (Angilletta et al., 2002). El límite crítico máximo y mínimo, así como la amplitud de cada curva, son generalmente características de cada especie (Angilletta et al., 2002; Currie et al., 1998). La amplitud del rendimiento térmico es un intervalo de temperaturas en las cuales la temperatura corporal se mantiene en niveles óptimos, mediante estrategias conductuales y en ausencia de restricciones externas (e.g., depredación, competencia). En general, las curvas con gran amplitud indican que los organismos son generalistas térmicos (i.e., euritérmicos) y, por el contrario, las curvas con una amplitud estrecha nos indican organismos especialistas (i.e., estenotérmicos; Hertz et al., 1993; Rowe et al., 2020).
Los organismos tienen una amplitud del intervalo de temperaturas en el cual son capaces de desempeñar sus funciones y actividades vitales de manera óptima (Grigg y Buckley, 2013; Huey y Slatkin, 1976). Cuando las temperaturas ambientales son más altas que el límite crítico máximo de dicho intervalo, pueden incrementar el riesgo de muerte de los organismos por sobrecalentamiento. Para evitar sobrecalentarse, las lagartijas deben resguardarse en refugios con temperaturas favorables (Sinervo et al., 2010). Si los organismos pasan demasiado tiempo en dichos refugios, su aporte energético puede llegar a ser insuficiente, lo cual puede causar efectos poblacionales negativos, especialmente en la época de reproducción, ya que puede causar interrupción en el cortejo y disminución de la energía destinada a la reproducción, lo que podría suponer consecuencias demográficas negativas para las poblaciones en años consecutivos (Sinervo et al., 2010; Vicenzi et al., 2017). Por tanto, dicho aumento en la “inactividad” forzada (también conocido como horas de restricción térmica), principalmente en la época de reproducción, podría causar la extinción local de hasta el 39% de las poblaciones de lagartijas en México para el año 2080, como consecuencia del incremento en la temperatura (Sinervo et al., 2010). Debido a lo anterior, para evaluar la sensibilidad fisiológica y el riesgo de extinción o resiliencia de las especies de lagartijas ante el cambio climático, es necesario estudiar su ecología térmica y el desempeño térmico de diferentes poblaciones (O’Connor et al., 2006).
Así como el cambio climático es una amenaza en contra de la biodiversidad, también altera los patrones meteorológicos, ya sea aumentando la probabilidad o severidad de eventos extremos (e.g., sequías, ondas de calor, heladas) ligados al calor, que a su vez, afectan los patrones de circulación del aire en la atmósfera (Stott, 2016). Particularmente, el cambio climático ha provocado alteraciones a fenómenos oceáno-atmosféricos cíclicos como El Niño-Oscilación del Sur (ENSO, por sus siglas en inglés), provocando que su fase cálida, conocida como “El Niño” sea aún más drástica (Snell y Rea, 1999). El fenómeno de El Niño se asocia con temperaturas altas en la superficie del mar en el área este del Pacífico tropical, entre las costas de Perú y Ecuador, lo que causa una disminución en la intensidad de los vientos alisios y grandes evaporaciones de agua a la atmósfera, lo cual genera lluvias y fuertes tormentas en Sudamérica, además de alterar los efectos de la corriente fría de Humboldt (Snell y Rea, 1999). Como consecuencia de dichas fluctuaciones climáticas, las interacciones ecológicas se ven fuertemente afectadas en muchas especies marinas y terrestres, principalmente de la región costera del Pacífico oriental ecuatorial, incluyendo el archipiélago de Galápagos (Snell y Rea, 1999).
Se ha documentado que el fenómeno de El Niño puede acarrear consecuencias ecológicas en las islas Galápagos (Snell y Rea, 1999). Por ejemplo, poblaciones de aves y mamíferos marinos cuya distribución límite es ecuatorial, han experimentado mortandades alarmantes, las cuales se pueden exacerbar con las actividades humanas o por el impacto de especies introducidas. Particularmente, las islas Galápagos presentan un alto grado de endemismos tanto en su flora como en su fauna, las cuales están altamente especializadas a las condiciones ambientales locales (Benavides et al., 2009; Muñoz-Barriga, 2015). Tal es el caso de las lagartijas de lava (Microlophus), uno de los grupos mejor representados en el archipiélago. Cada una de las islas principales tiene una especie diferente de lagartija, con poblaciones que se distribuyen exclusivamente en la zona costera y xerofítica (Benavides et al., 2009; Kizirian et al., 2004). El objetivo de esta investigación fue estudiar la ecología térmica de la lagartija de lava de Santa Cruz, Microlophus indefatigabilis. Particularmente, buscamos evaluar el desempeño locomotor, para así calcular su umbral térmico de actividad y las posibles horas de restricción térmica de la especie ante el aumento de la temperatura ambiental, efectos que podrían presentarse ante la incidencia del fenómeno de El Niño.
Materiales y métodos
La lagartija de lava de Santa Cruz (Microlophus indefatigabilis), es una especie endémica de las islas Galápagos que se distribuye en las islas Santa Cruz, Santa Fe, Baltra y en pequeños islotes asociados. Al igual que el resto de las especies del género Microlophus, esta especie presenta un marcado dimorfismo sexual, los machos son más robustos y de mayor tamaño que las hembras. Los machos presentan una combinación de manchas negras y anaranjadas en la garganta y en los flancos, así como una cresta dorsal que va desde la cabeza hasta la cola. Las hembras exhiben un color naranja en la cabeza, garganta y vientre, el cual es muy conspicuo durante la temporada reproductora (Stebbins et al., 1967). En este estudio consideramos a los organismos como adultos a partir de 59 mm de longitud hocico-cloaca (LHC) en machos y a partir de 57 mm de LHC en hembras (Stebbins et al., 1967).
Realizamos el estudio durante la estación fría, entre el 31 de julio y el 6 de agosto de 2017. Recolectamos organismos de M. indefatigabilis en 3 poblaciones de 2 islas. Una población en la isla Baltra (00º27’00” S, 90º16’00” O) y 2 poblaciones en la isla Santa Cruz: Punta Estrada (00°45’14.0’’ S, 90°18’41.8’’ O) y la Estación Científica Charles Darwin (referida de aquí en adelante como Estación Científica, 00º44’34.81” S, 90º18’12.40” O). Las 3 zonas de estudio presentan montículos de rocas basálticas de distintos tamaños y vegetación característica de zonas áridas de tierras bajas, con especies como monte salado (Cryptocarpus pyriformis), cactus (Opuntia echios), sesuvium (Sesuvium edmondstonei), parkinsonia (Parkinsonia aculeata), palo santo (Bursera graveolens) y el árbol de la muerte (Hippomane mancinella), entre otras (Snell et al., 1995; Stebbins et al., 1967).
Recolectamos individuos de M. indefatigabilis durante su periodo de actividad (07:00 -19:00 h, GMT-6), mediante cañas de pescar modificadas con un nudo corredizo en el extremo. Registramos su temperatura corporal (cloacal; Tc) mediante un termómetro digital de lectura rápida (Fluke modelo 51-II), con un termopar tipo T (± 0.1 °C) y descartamos aquellas lecturas en que demoramos más de 20 segundos en capturar al individuo. También registramos la temperatura del sustrato (Ts) de donde fue recolectado cada ejemplar y la temperatura del aire (Ta) a la sombra, a 5 cm de altura, así como la hora de recolecta (Hertz et al., 1993).
En la población de la Estación Científica registramos la temperatura operativa (To) mediante lectores de temperatura (HOBO®Pro v2). Colocamos 2 registradores con 2 sensores, respectivamente. Cada sensor estuvo conectado a un modelo nulo (ver más adelante). También registramos la temperatura del aire (Tair) con un tercer registrador de temperatura y humedad (HOBO®Pro v2 U23-002), con un sensor descubierto a metro y medio de altura. Finalmente, en la población de Baltra registramos la To mediante 20 registradores de temperatura (iButton®), cada uno de los cuales fue colocado dentro de un modelo nulo.
El modelo nulo fue diseñado para emular las tasas de ganancia y pérdida de calor de los organismos en ausencia de termorregulación y representan la To en diferentes microhábitats (Bakken, 1992; Dzialowski, 2005). Para calibrar los modelos nulos, sometimos a 2 organismos del género Microlophus, junto con diferentes posibles modelos a intervalos de luz artificial para incrementar su temperatura, y periodos de sombra para disminuirla. Posteriormente, analizamos las temperaturas de los organismos y los modelos nulos por medio de una correlación lineal, y seleccionamos el modelo con el coeficiente de correlación (r) más alto (Dzialowski, 2005; Hertz et al., 1993). El modelo seleccionado consistió en un tubo de policloruro de vinilo (PVC) relleno de silicón y pintado de gris, mismo que presentó una alta correlación con el organismo de referencia (r = 0.93; p < 0.001). Colocamos los modelos nulos en diferentes microhábitats donde previamente observamos individuos de M. indefatigabilis, tomando en cuenta condiciones de sol y sombra. Los modelos de la Estación Científica registraron la temperatura cada 30 minutos del 4 al 31 agosto de 2017, mientras que los modelos de Baltra registraron la temperatura cada 10 minutos entre el 5 y el 9 de agosto de 2017.
Adicionalmente, obtuvimos las temperaturas ambientales promedio (Tair) y máximas al día (Tmax) de la estación meteorológica Estación Científica Charles Darwin, correspondientes a la estación fría de 1997, 2015 y 2017 (www.darwinfoundation.org), y la Tair de cada hora entre el 5 y el 9 de agosto de 2017 de la estación meteorológica Baltra (www.windfinder.com). Cabe destacar que solo se emplearon las temperaturas del intervalo correspondiente al periodo de actividad diario de la especie.
Para conocer las temperaturas seleccionadas de la especie (Tsel; temperaturas corporales que presenta un organismo cuando se le brinda un abanico de temperaturas en ausencia de limitantes ambientales; también llamadas temperaturas preferidas), colocamos a los organismos de la Estación Científica y de Punta Estrada en un gradiente térmico bajo condiciones de laboratorio. Construimos el gradiente térmico con láminas de policarbonato con dimensiones de 1.80 x 1.00 x 0.10 m (largo-ancho-alto) y lo dividimos en 10 carriles de 0.10 m. Generamos un extremo frío de 20 °C por medio de bolsas de hielo, colocadas dentro de los carriles y un extremo caliente de 45 °C con una hilera de focos de 100 W, colocados a 30 cm de altura. Realizamos los experimentos de gradiente térmico durante un día a lo largo del periodo de actividad de la especie observado en campo.
Brindamos a los organismos 1 hora de ambientación, previa a la primera lectura de Tsel en el gradiente, y posteriormente registramos la temperatura corporal de cada organismo en intervalos de 1 hora, con un termómetro digital de lectura rápida (Fluke modelo 51-II) con un termopar tipo T (± 0.1 °C). Al final, con todas las lecturas determinamos el 50% de las Tsel centrales, usando como intervalos de Tsel los cuartiles 25% y 75% (Hertz et al., 1993). Los valores correspondientes fueron empleados como intervalos para calcular los índices de termorregulación y calidad térmica del ambiente.
Calculamos la eficiencia térmica (E) con base en el protocolo de Hertz et al. (1993). Con los datos recabados de Tc, Tsel y To, obtuvimos los siguientes parámetros necesarios para el cálculo de E. La precisión en la termorregulación (db), la cual calculamos mediante el promedio de las desviaciones de las Tc con respecto al intervalo de Tsel, es decir, la diferencia en el número absoluto entre la Tc y Tsel, donde valores altos de db implican una baja precisión, mientras que valores de 0 o cercanos a 0 representan una alta precisión en la selección de la Tc del organismo. También calculamos la calidad térmica del ambiente (de) con el promedio de las desviaciones entre cada una de las To correspondientes al intervalo de actividad y el intervalo de Tsel, los valores altos indican baja calidad térmica del ambiente, y valores cercanos a 0 representan que el ambiente es ideal para los organismos. Si el valor de Tc o de To están por debajo del intervalo de Tsel, se contrastan con el valor inferior del intervalo Tsel, de lo contrario, se contrastan con el valor superior de Tsel. Por último, obtuvimos la eficiencia de la termorregulación (E) al restar a 1 los cocientes de db/de. Si el valor final es cercano a 0, esto sugiere que el organismo presenta una tendencia al termoconformismo, mientras que los valores cercanos a 1 supondrían que el organismo termorregula activamente.
Calculamos también la eficiencia en la termorregulación de acuerdo con el índice de Blouin-Demers y Weatherhead (2001). Dicho índice estima la magnitud de la desviación del extremo termoconformista, para esto, se resta la calidad térmica del ambiente a la precisión de la termorregulación (de – db). Valores altos significan que los organismos están termorregulando activamente, mientras valores cercanos a cero indican que los organismos están comportándose como termoconformistas (Blouin-Demers
y Weatherhead, 2001).
A fin de no causar efectos de estrés térmico, determinamos las temperaturas medias críticas máximas (CTMax) y mínimas (CTMin) de la especie posteriormente a la toma de Tsel. Para la estimación de la CTMin, colocamos a 10 organismos de la Estación Científica dentro de un recipiente y este sobre hielo, para reducir gradualmente su Tc. En el caso de la CTMax, colocamos a 5 organismos de la Estación Científica debajo de una lámpara de 100 W para elevar su Tc de forma gradual. En ambos casos, los organismos fueron monitoreados y colocados sobre su dorso constantemente, y en el momento en que dejaron de reincorporarse, registramos su Tc (Du et al., 2000; Lutterschmidt y Hutchison, 1997). Inmediatamente después de registrar dichos parámetros de tolerancia, llevamos a los organismos al intervalo de Tsel, y en el caso de aquellos sometidos a la CTMax, les proporcionamos agua para rehidratarlos.
Medimos el desempeño locomotor de las 3 poblaciones a 5 distintos tratamientos de temperatura (Angilletta et al., 2002). Para ésto, resguardamos durante 30 min a cada organismo en una incubadora rústica (construida en una hielera de unicel de 31 x 24 x 22 cm, con un foco de 100 W controlado por una placa de desarrollo de hardware libre ArduinoTM Mega) a la temperatura del tratamiento, realizamos el experimento cuando cada organismo llegó a la temperatura deseada ± 0.5 °C. Colocamos a cada organismo solo en uno de los 5 tratamientos térmicos: 18, 25, 30, 35 o 38 °C. Posteriormente, colocamos a cada ejemplar en el extremo de un carril de polimetilmetacrilato (1 x 0.12 x 0.12 m) y estimulamos a cada uno a correr la longitud del mismo durante 3 ocasiones. El carril tenía un sistema de diodos infrarrojos espaciados a intervalos de 20 cm, conectados a una placa de desarrollo de hardware libre ArduinoTM Mega, los cuales estuvieron programados para registrar la velocidad (cm/s) de los organismos a su paso por el carril en una computadora portátil, de manera que promediamos la velocidad obtenida de los diodos para cada carrera, y usamos la velocidad máxima de cada ejemplar. Elegimos al azar a los organismos en cada uno de los tratamientos, pero consideramos que las 3 categorías estuvieran equitativamente representadas en cada uno de ellos. De cada ejemplar registramos la LHC y el sexo.
Construimos la curva de desempeño locomotor de M. indefatigabilis mediante un modelo aditivo generalizado (GAM) empleando la LHC como covariable, la velocidad máxima de carrera de cada organismo en alguno de los 5 tratamientos de temperaturas, y el promedio de la CTMax y de la CTMin para anclar las curvas. A partir de la curva determinamos la temperatura óptima (Topt), y con ésta calculamos 80% del umbral térmico (B80, amplitud térmica de desempeño 80) para la especie. Las estimaciones de la curva fueron realizadas con el programa R (R Core Team, 2020) usando la paquetería minpack.lm (Elzhov et al., 2016).
Calculamos la “tolerancia al calentamiento” restando el promedio de la To del periodo de actividad al promedio de la CTMax. Dicho valor se aproxima a la cantidad promedio de calentamiento ambiental que una lagartija puede tolerar antes de que el rendimiento descienda a niveles fatales. También calculamos el “margen de seguridad térmica” con la diferencia entre la Topt y el promedio de la To del periodo de actividad. Este valor indica el intervalo térmico en el cual las especies pueden disminuir o aumentar su rendimiento (Deutsch et al., 2008).
Cabe destacar que los organismos no fueron sometidos a todos los experimentos, que las 3 poblaciones no fueron muestreadas el mismo día y que todos los experimentos los realizamos al día siguiente de la captura de los ejemplares. Para la realización de las pruebas, se acondicionó un laboratorio donde mantuvimos a los ejemplares en sacos de tela individuales. Posteriormente a los experimentos, hidratamos a todos los organismos y los liberamos en el sitio donde fueron encontrados inicialmente. Todas las pruebas se realizaron con respaldo del permiso No PC-66-17 otorgado por la Dirección del Parque Nacional Galápagos.
Estimamos los efectos de El Niño en la To de la Estación Científica (sitio con abundante vegetación) y de Baltra (sitio con poca cobertura vegetal) durante las fechas de muestreo. Para ello, utilizamos regresiones lineales y no lineales entre Tair y las To de los 2 sitios. Seleccionamos el mejor modelo para las regresiones comparando los valores de Akaike (AIC) de un modelo lineal, uno potencial y uno exponencial. Después, determinamos el promedio de la Tair correspondiente a la estación fría de 2017 (TP2017) y el promedio de la Tair para la misma estación de El Niño 2015, el cual corresponde al evento más cercano al muestreo, y de El Niño 1997 (TPniño) que fue el evento más extremo del que se tiene registro en la zona (Snell y Rea, 1999; Yong, 2019). Para esto, utilizamos datos climáticos históricos de la estación meteorológica de la Estación Científica y de Baltra. A continuación, calculamos el incremento en la TP (ΔTP = TPniño – TP2017). Una vez que obtuvimos el ΔTP, sumamos este valor a las temperaturas del aire de la Estación Científica y de Baltra. Por medio de las regresiones, estimamos la To para esa misma temporada, pero bajo el supuesto de la presencia del fenómeno de El Niño. Finalmente, obtuvimos el promedio de las horas de restricción térmica (Hr, horas del día en las cuales la actividad de un organismo se ve limitada por altas temperaturas ambientales; Sinervo et al., 2010) de los sitios de estudio durante las fechas del muestreo (en 2017 y con las To reconstruidas durante un hipotético fenómeno de El Niño). Consideramos una Hr cuando la To de una hora del día supera el valor máximo de la B80.
Analizamos la normalidad y homocedasticidad de los datos mediante las pruebas Kolmogorov-Smirnov y Levene. Las Tc de los organismos de la Estación Científica fueron analizadas mediante un análisis de varianza (Andeva), mientras que la Tc de los ejemplares de Baltra y el promedio de la Tsel (entre organismos de Punta Estrada y la Estación Científica) se analizaron mediante pruebas U de Mann-Whitney. Usamos la prueba Kruskal-Wallis para comparar la Tc de los ejemplares de Punta Estrada, la Tc de las 3 poblaciones y la LHC entre tratamientos de desempeño locomotor. Hicimos una prueba DHS de Tukey para conocer entre qué poblaciones existían diferencias. Presentamos el promedio de la Tc y su desviación estándar, y el intervalo mínimo y máximo entre paréntesis. Realizamos correlaciones de Pearson entre las temperaturas ambientales (Ta y Ts) y la Tc. Realizamos los análisis en el programa SPSS 21 (SPSS Inc.), las gráficas se construyeron en el programa SigmaPlot 11.0 (Systat Software) y con la paquetería ggplot2 del programa R (R Core Team, 2020).
Resultados
Se recolectó un total de 223 individuos de M. indefatigabilis entre el 31 de julio y el 06 de agosto de 2017. De éstos, 117 ejemplares fueron capturados en la isla Santa Cruz en 2 poblaciones: Punta Estrada (n = 66) y la Estación Científica (n = 51). Asimismo, recolectamos 116 organismos en la isla Baltra. No existieron diferencias significativas en la Tc entre categorías (machos, hembras y jóvenes) en la población de Punta Estrada (H 66,2 = 2.091, p = 0.351), en la Estación Científica (F 50,2 = 1.145, p = 0.327), ni en la isla Baltra (U39,1 = 217.0, p = 0.408), por lo que agrupamos los datos por población para los siguientes análisis.
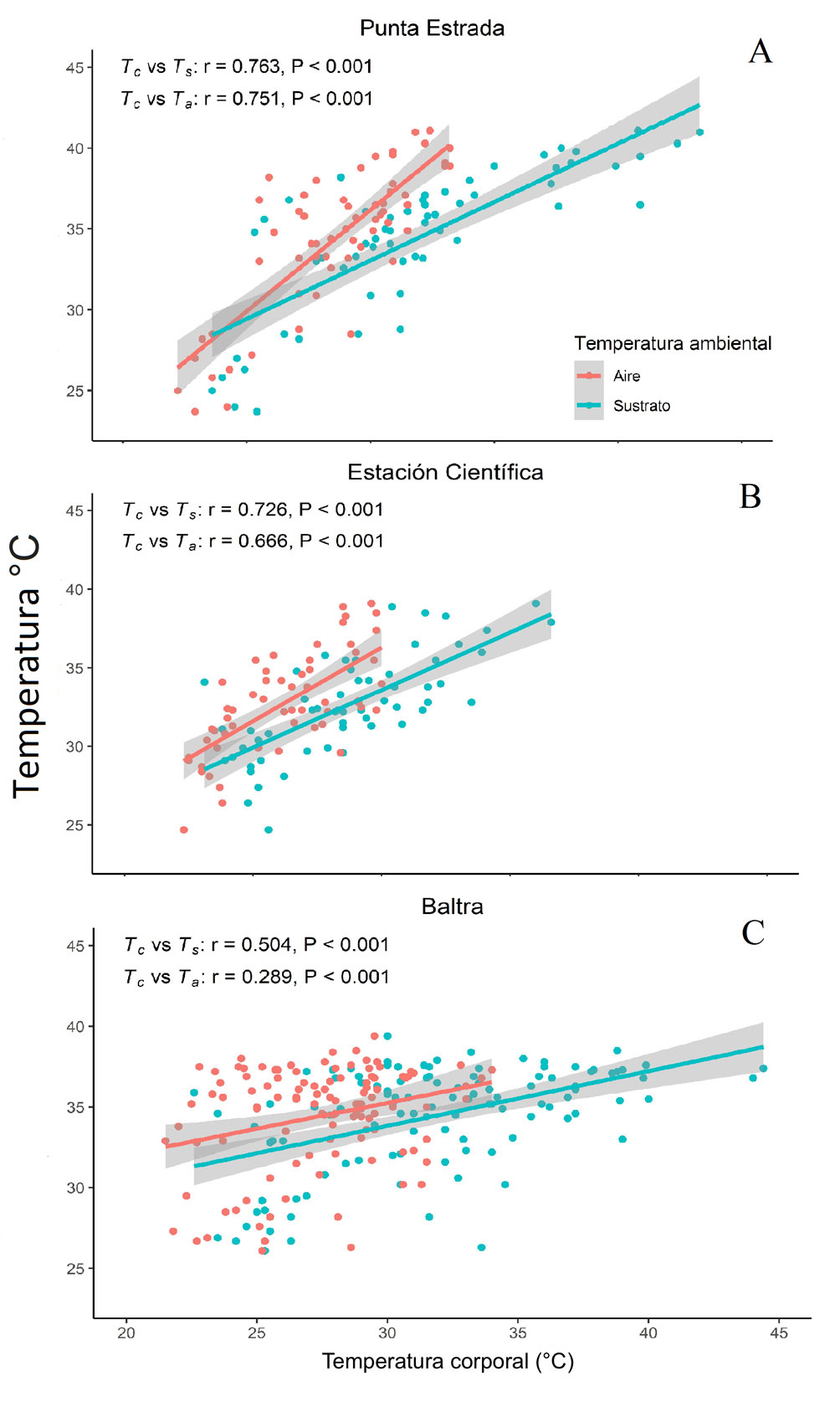
La Tc promedio para la especie fue 34 ± 3.79 °C con un intervalo entre 22.3 y 41.1 °C, mientras que la Tsel promedio para la especie fue de 30.5 °C. La Tc promedio para la Estación Científica fue 32.5 ± 3.34 °C, Punta Estrada 33.9 ± 4.76 °C y en Baltra 34.4 ± 3.19 °C. Encontramos que existen diferencias significativas entre la Tc de las 3 poblaciones (H233,2 = 13.674, p < 0.05), en específico, entre los organismos de Baltra y los de la Estación Científica (F164,1 = 1.993, p < 0.05). Por el contrario, no observamos diferencias significativas del promedio de Tsel entre la Estación Científica y Punta Estrada (U20,1 = 46.0, p = 0.762). Los organismos de las 3 poblaciones mostraron correlaciones positivas y significativas entre su Tc y las temperaturas ambientales (Ts y Ta; fig. 1).
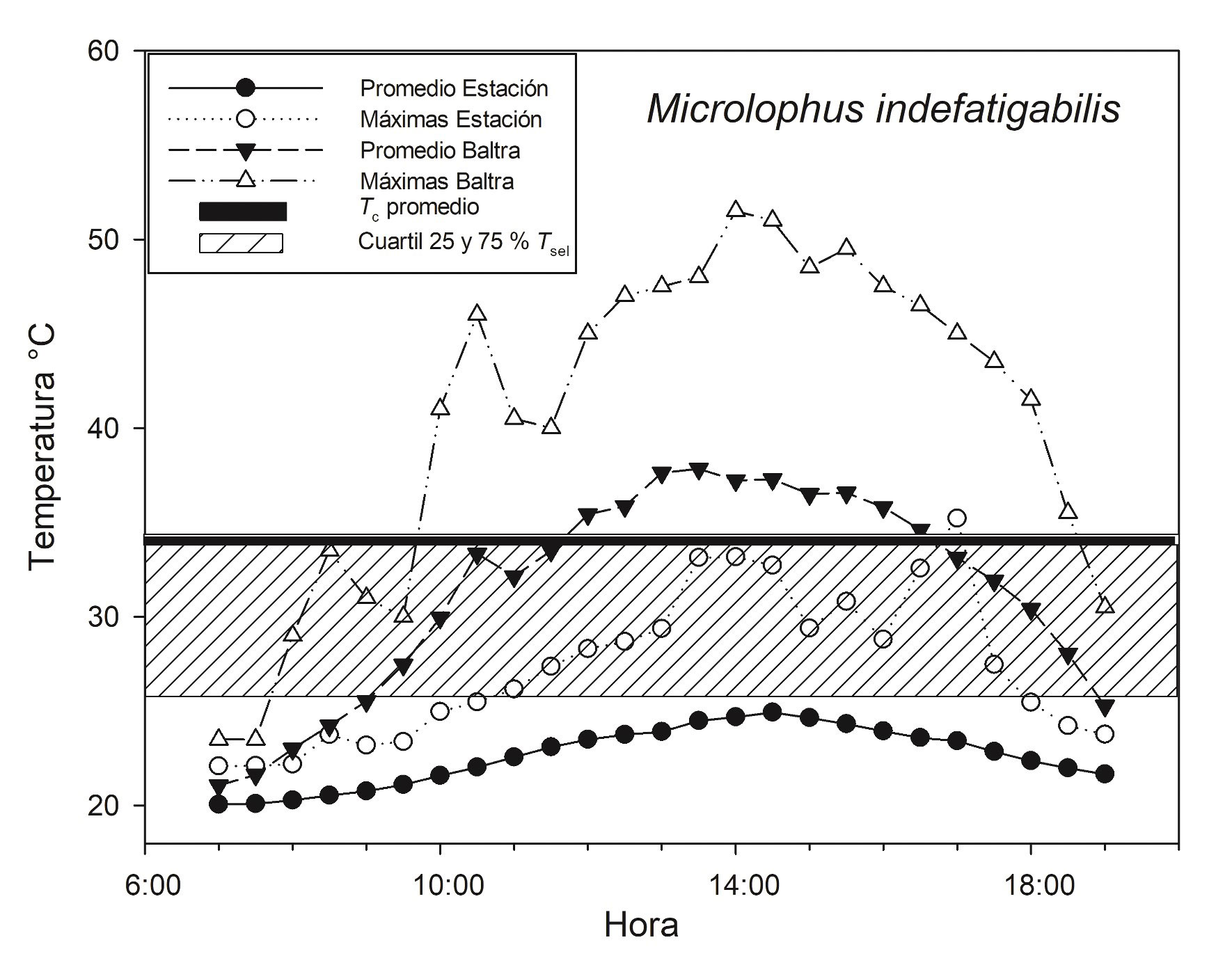
En la Estación Científica registramos 2,800 lecturas de To, mientras que en Baltra obtuvimos 6,820 tomas entre las 07:00 y las 19:00 h (fig. 2). Con las To, la Tc y los cuartiles 25% – 75% de la Tsel (26.4 – 34 °C) de la Estación Científica, calculamos la eficiencia térmica de M. indefatigabilis. De acuerdo con el índice de Hertz et al. (1993), la precisión de la termorregulación de los organismos fue alta (db = 0.8), en tanto que la calidad térmica del ambiente indica una calidad térmica moderada (de = 3.5), en consecuencia, se presenta una alta eficiencia en la termorregulación (E = 0.79). De igual forma, el índice de Blouin-Demers y Weatherhead (2001) sugiere que los organismos se esfuerzan en aumentar su Tc por lo que tienden a termorregular (de – db = 2.7).
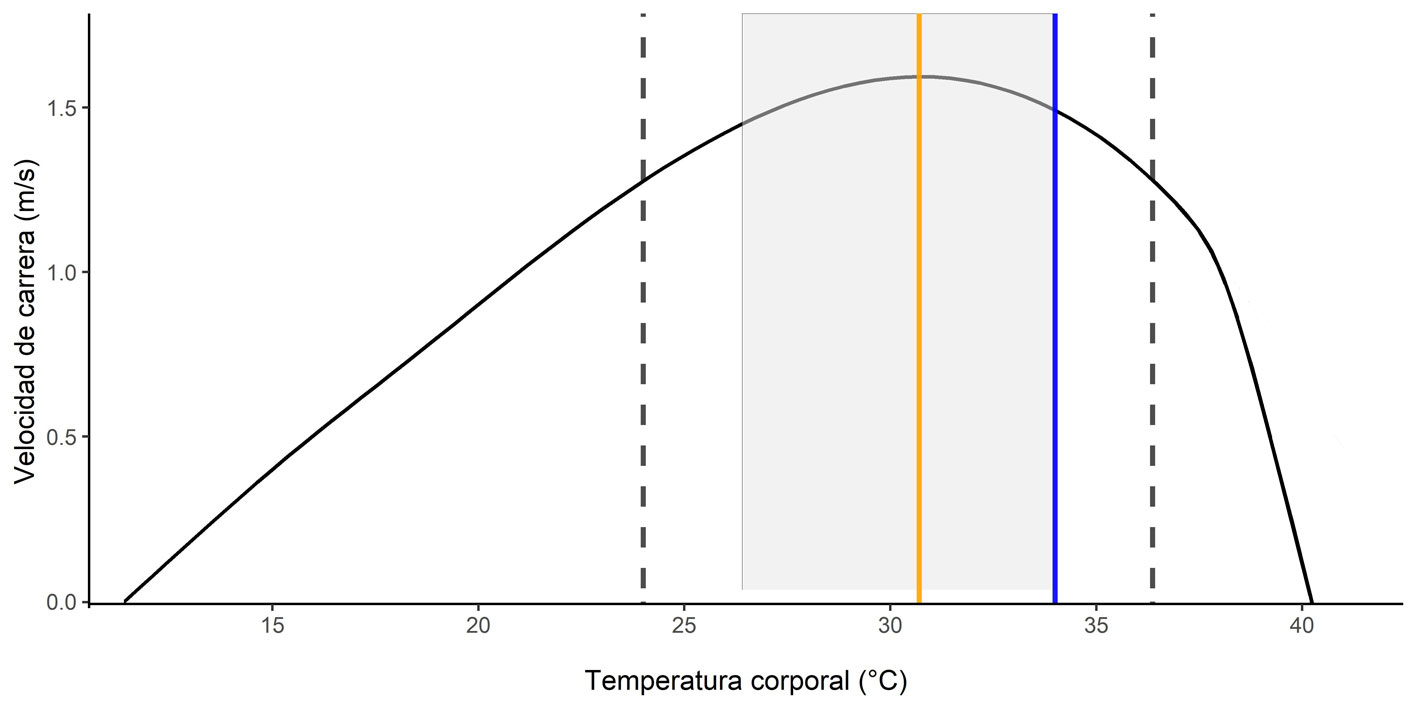
El promedio de la CTMin de M. indefatigabilis fue de 12.5 °C (11 – 14.3 ºC), mientras que el promedio de la CTMax fue de 40.6 °C (39.9 – 41.4 ºC). No hubo diferencias significativas entre la LHC de los organismos entre los tratamientos (H4 = 3.837, p = 0.429). Para el análisis de desempeño locomotor, primero probamos diferentes modelos, con los datos de velocidad máxima con distintas particiones de datos, por ejemplo: por sitio o totales, y con o sin el uso de LHC como covariable. El mejor modelo para la especie fue descrito por un modelo de la familia Gaussiana (AIC = 149.9773). La Topt del desempeño fue de 30.4 °C, la velocidad máxima fue a los 1.54 m/s, mientras que la B80 de la especie tuvo una amplitud de 11.6 °C (24.6 – 36.2 °C; fig. 3). La tolerancia al calentamiento fue de 11.3 °C y el margen de seguridad térmica de 1.09 °C.
Encontramos un ΔTP de 3.4 °C durante el fenómeno de El Niño en la estación fría, mientras que para la estación cálida fue de 1.8 °C. Por otro lado, utilizamos una regresión potencial para estimar el aumento en las To para la Estación Científica (To Niño = 0.2207*((Tair + ΔTP) ^ 1.5114)) y una regresión lineal para Baltra (To Niño = -38.494527 + (2.835572*(Tair + ΔTP)); tabla 1). Encontramos que M. indefatigabilis no presentó Hr en condiciones normales en la Estación Científica, ni cuando se presenta el fenómeno de El Niño. Sin embargo, en Baltra registramos 1 Hr promedio durante los días de muestreo, y estimamos 8.4 Hr promedio por día, durante la temporada fría de El Niño.
Tabla 1
Comparación de modelos para las regresiones entre temperaturas del aire (Tair) y To para la Estación Científica y Baltra. Todas las regresiones y los valores de la pendiente fueron significativos (p < 0.001). *Indica el mejor modelo y el que fue utilizado para estimar las To Niño.
| Estación Científica | Baltra | ||||||
| Modelo | r2 | AIC | ∆AIC | Modelo | r2 | AIC | ∆AIC |
| Lineal | 0.9 | 3218.06 | 0.961 | Lineal* | 0.83 | 243.291 | 0 |
| Potencial* | 0.9 | 3217.099 | 0 | Potencial | 0.814 | 247.461 | 4.17 |
| Exponencial | 0.899 | 3248.04 | 30.941 | Exponencial | 0.79 | 251.425 | 8.134 |
Discusión
En este estudio no encontramos diferencias significativas en la Tc de M. indefatigabilis entre jóvenes, hembras y machos, lo que concuerda con lo observado en Microlophus (Tropidurus) peruvianus y Microlophus bivittatus, las cuales tampoco presentaron diferencias significativas en la Tc entre categorías (Catenazzi et al., 2005; Huey, 1974b; Rowe et al., 2020).
El clima característico de las islas Galápagos presenta 2 temporadas, la estación cálida y lluviosa (de enero a mayo) y la estación fría, típicamente nublada y seca en las zonas bajas (de junio a diciembre; Trueman y d’Ozouville, 2010). Las lagartijas pueden presentar una Tc más baja durante las estaciones secas y frías, en comparación con las estaciones cálidas y húmedas (Rowe et al., 2020). No obstante, nosotros encontramos que el promedio de la Tc de M. indefatigabilis en la estación fría es similar a la Tc promedio observada en estudios previos para esta misma especie en la estación cálida (entre 33.7 y 35 °C; Carpenter, 1970; Stebbins et al., 1967). La Tc de M. indefatigabilis también es cercana a la de M. peruvianus (36.3, 30.6 y 33.0 °C en la estación fría y 36.1 °C en la cálida; Catenazzi et al., 2005; Huey, 1974b), pero es menor a la registrada para M. bivittatus en ambas estaciones (38.7 °C en estación cálida y 38 °C en la estación fría; Rowe et al., 2020).
Encontramos que en la estación fría la actividad de M. indefatigabilis es unimodal y que el intervalo de actividad sucede entre 22.3 y 41.1 °C de Tc. Resultados similares fueron encontrados en una población de Microlophus delanonis en la isla Española (Altamirano, 1996). Anteriormente, había sido considerado que el intervalo normal de actividad en M. indefatigabilis era bimodal entre 31 y 38 °C (Stebbins et al., 1967). No obstante, en investigaciones del género Microlophus sobresale la importancia de la cobertura de las nubes en la fluctuación de la Tc. En el caso de M. indefatigabilis anteriormente se consideró que las Tc por debajo de 29 °C correspondían a organismos recolectados en la mañana o en días con nubosidad típica en la zona (Huey, 1974b; Rowe et al., 2020; Stebbins et al., 1967). En M. bivittatus existen variaciones en las Tc de los organismos entre la hora del día, posiblemente ligadas a la presencia de nubes (Rowe et al., 2020). En consecuencia, el patrón de actividad de M. bivittatus podría ser diferente entre temporadas, años o incluso entre poblaciones en la misma temporada. Tal es el caso de M. peruvianus, que durante el invierno presenta un patrón unimodal en una población, mientras que en la otra estación es bimodal, lo que apoya la hipótesis de que los organismos reducen su actividad diaria y en consecuencia disminuyen su Tc en condiciones de mayor nubosidad (Catenazzi et al., 2005). Por otra parte, también existe evidencia de la influencia de la nubosidad en los patrones de actividad diaria en las serpientes de Galápagos (Pseudalsophis), las cuales son depredadores naturales de las lagartijas de lava (Altamirano, 1996). Nuestra investigación se realizó a principios del mes de agosto, debido a esto, el factor nubosidad podría estar influenciando los datos obtenidos, por lo que consideramos importante incluir dicho factor en estudios futuros.
Aunado a lo anterior, se pueden presentar diferencias en los patrones de actividad entre poblaciones de la misma especie. Nosotros encontramos diferencias significativas entre la Tc de la población de Baltra y la población de la Estación Científica. Como consecuencia de ésto, las Tc de Baltra fueron las más altas, mientras que las de la Estación Científica las más bajas (fig. 1). Estas diferencias se pueden explicar porque la Estación Científica mantiene un mayor grado de conservación en la vegetación, en comparación con Punta Estrada, más que por la prevalencia de actividad humana, evidente en ambos sitios. A su vez, M. peruvianus también presenta diferencias en la Tc entre poblaciones, aun en la misma temporada (Catenazzi et al., 2005).
Por otra parte, según el efecto Bogert la Tsel se conserva entre especies relacionadas, o entre poblaciones de diferentes ambientes, debido a que el comportamiento termorregulador evita la modificación fisiológica de los parámetros térmicos (Bogert, 1949; Catenazzi et al., 2005; Huey y Slatkin, 1976). Nosotros encontramos que la Tsel fue similar entre las poblaciones estudiadas. No obstante, dicha Tsel promedio de M. indefatigabilis fue menor que la temperatura documentada previamente para la misma especie y para otras especies del género como M. peruvianus (35.6 °C) y M. bivittatus (36.1 – 40°C; Catenazzi et al., 2005; Huey, 1974b; Rowe et al., 2020). Este es un estudio prospectivo y, desafortunadamente, no tuvimos la oportunidad de estudiar la Tsel de las 3 poblaciones, no obstante, los datos recabados son importantes.
Nuestros datos muestran una marcada correlación entre la Tc de M. indefatigabilis y las temperaturas ambientales (Ta y Ts; fig. 1). No obstante, observamos que existe una mayor correlación con la Ts. Esto concuerda con M. peruvianus, la cual no mostró correlación significativa entre su Tc y la Ta en un primer estudio (Huey, 1974b). Sin embargo, un estudio más reciente encontró una correlación débil con la Ta y más elevada con respecto del sustrato (Catenazzi et al., 2005).
Encontramos que M. indefatigabilis tiende al extremo termorregulador en la temporada fría. Este comportamiento es similar al presentado por M. peruvianus (E = 0.74 y E = 0.86) durante el invierno (Catenazzi et al., 2005). Aunado a ésto, nuestros resultados sugieren que M. indefatigabilis puede esforzarse y aumentar 2.7 °C su Tc con respecto a la del ambiente en la estación fría, la cual estuvo dentro de los intervalos observados para M. bivittatus en ambas estaciones (Rowe et al., 2020).
En un estudio de M. bivittatus, los autores observaron que en promedio, la To de la estación fría fue menor al intervalo de Tsel, y ésta también varió entre micrositios. Por ejemplo, la To tomada en paredes sin cobertura vegetal se encontró dentro de la Tsel en breves periodos de actividad; sin embargo, en gran parte de las horas de la tarde, la To se encontró por encima del intervalo de Tsel (Rowe et al., 2020). En este estudio encontramos que para M. indefatigabilis, el intervalo de Tsel y el promedio de la Tc están por encima del promedio de la To en la población de la Estación Científica, la cual presenta abundante cobertura vegetal. En contraparte, la Tsel al igual que el promedio de la Tc, se encuentran dentro del promedio de la To en Baltra, población que presenta escasa cobertura vegetal (fig. 2). Por consiguiente, consideramos relevante incluir la cobertura vegetal en estudios futuros debido a su implicación directa en la calidad térmica del hábitat (Neel y McBrayer, 2018).
Anteriormente, se documentó que los organismos de M. indefatigabilis se encuentran activos a fines del verano desde el amanecer hasta la puesta del sol, con excepción del mediodía (Stebbins et al., 1967). Como ya mencionamos, nosotros no observamos actividad bimodal a principios de la temporada fría. Sin embargo, Stebbins et al. (1967) comunicaron que las lagartijas que fueron observadas entre las 13:00 y 15:00 h en arbustos, en cactus y en los edificios fueron consideradas como inactivas. Contrariamente, nosotros consideramos la presencia de organismos en dichos sutratos en el horario mencionado como comportamiento activo. Anteriormente se había considerado que M. indefatigabilis puede presentar un adecuado desempeño locomotor a temperaturas inferiores de 30 °C, pero que solo se encontraba en su plena capacidad física entre los 31 y 38 °C (Stebbin et al., 1967); no obstante, nosotros encontramos que la máxima capacidad locomotora se presenta a los 30.4 °C y la B80 sugiere que los organismos pueden presentar un adecuado desempeño locomotor desde los 24.6 °C.
El cálculo de tolerancia al calentamiento sugiere que M. indefatigabilis presenta tolerancia adecuada ante el promedio de temperaturas ambientales disponibles. No obstante, M. indefatigabilis presenta un reducido margen de seguridad térmica, por lo que su desempeño podría disminuir, incluso ante ligeros aumentos de la temperatura ambiental. Esto concuerda con lo pronosticado en insectos que habitan regiones tropicales, las cuales se acercarán a temperaturas casi letales de forma veloz, debido a que dichas especies habitan en ambientes cercanos a sus temperaturas óptimas (Deutsch et al., 2008). Nuestros resultados son similares a otras especies de lagartijas tropicales, como Anolis lemurinus (margen de seguridad térmica = 1.5 °C), donde se propone que el tiempo disponible para la actividad cercana al rendimiento máximo, se reducirá ante el aumento de la temperatura ambiental (Logan at al., 2013), así como A. cristatellus y varias especies de geckos diurnos (Sphaerodactylus), en las cuales se calcula que dichos organismos ya estén experimentando Tc estresantes durante verano, iguales o superiores a sus óptimos fisiológicos, y los cálculos sugieren que el calentamiento global deprimirá aún más su rendimiento fisiológico en dicha estación (Huey et al., 2009).
Encontramos que la CTMax de M. indefatigabilis se encuentra muy cercana del límite superior de la B80. Existe escasa información respecto a estos parámetros en las especies del género Microlophus, pero este comportamiento ha sido observado en otras especies como Phrymaturus tenebrosus (Bonino et al., 2015; Cabezas-Cartes et al., 2019), la cual adicionalmente presenta su rendimiento locomotor máximo en temperaturas similares a su Tsel, similar a lo que observamos en este estudio en M. indefatigabilis. No obstante, se sabe que existen diferencias en la resistencia locomotora entre sexos de M. indefatigabilis (Miles et al., 2001; Snell et al., 1988), por lo que consideramos necesario abundar más en este tema en futuros estudios, ya que en casos como el de la lagartija Xantusia vigilis, a pesar de existir la capacidad de modificar su CTMax y su umbral térmico, se pueden presentar efectos esterilizantes y atrofia testicular permanente en organismos que son sometidos a temperaturas incluso inferiores a la CTMax (Cowles y Burleson, 1945; Kaufmann y Bennett, 1989). Otro ejemplo es Sceloporus mucronatus, en esta especie, para que exista la maduración y motilidad espermática, se requiere que la Tc sea más baja que la Tsel. Así que exceder el umbral de tolerancia térmica máxima no solo puede ser perjudicial para la reproducción, también se requiere de temperaturas por debajo de la Tsel para que ocurra la reproducción (Méndez-de la Cruz et al., 2014).
Existen 4 regiones de monitoreo a lo largo del océano Pacífico ecuatorial para el evento de El Niño. Las islas Galápagos, junto con las costas de Perú, se encuentran comprendidas en la región 1+2. En dicha región, para el mes de agosto, el evento de El Niño registrado como más fuerte fue el correspondiente a 1997, seguido del de 1972 y posteriormente el de 2015 (Yong, 2019). Durante El Niño de 1997, se registraron 3,407.6 mm de lluvia en la Estación Científica Charles Darwin, lo cual convirtió a este periodo en uno de los más lluviosos en la historia de Galápagos (Snell y Rea, 1999; Yong, 2019). Calculamos que durante este fenómeno las poblaciones de M. indefatigabilis que se ubican en sitios con poca cobertura vegetal, como es el caso de la población de Baltra, podrían presentar una mayor cantidad de Hr, en comparación con poblaciones que presentan mayor cobertura vegetal, como es el caso de la población de la Estación Científica. Por otra parte, en estudios que registran la abundancia de lagartijas, se ha observado que la disponibilidad de alimento y el número de individuos decrecen considerablemente en años donde se presenta el fenómeno de El Niño (Rodríguez-Romero y Méndez-de La Cruz, 2004; Stapley et al., 2015; Wikelski y Thom, 2000), por lo que consideramos sumamente importante profundizar más en este tema.
A pesar de que Sinervo et al. (2010), calcularon las Hr con los límites de la Tsel, estas pueden depender de las características de cada especie (helioterma, estenoterma, euriterma, etc.) y pueden variar entre las Tc (Pontes-da-Silva et al., 2018), Tsel, o B80, como en nuestro caso. Optamos por esta decisión metodológica debido a que fuera de la B80, los organismos experimentarían una reducción sustancial en sus capacidades locomotoras y, en consecuencia, en su capacidad de permanecer activos. Además, la amplitud de desempeño se aproxima más a las temperaturas mínima y máxima voluntarias, las cuales representan más fielmente los umbrales térmicos de actividad, de manera que, en ausencia de estos 2 parámetros, la amplitud térmica constituye un mejor subrogado de las ventanas térmicas de actividad que la Tsel. En todo caso, al ser la B80 un intervalo más amplio que el de Tsel, se esperaría que las Hr obtenidas con base en este criterio fuesen más conservadoras que las estimaciones basadas
en el intervalo de Tsel.
Por otra parte, en esta investigación únicamente calculamos las Hr durante la temporada fría, la cual concuerda con la época previa a la fase reproductora de la especie. Este periodo es crítico, ya que la disminución en la actividad puede provocar disminuciones en la densidad efectiva de la población para la época reproductora. El concepto de Hr está basado, principalmente, en la temporada en la que nacen las crías, ya que el aumento de la temperatura durante esta etapa hace más vulnerables a los organismos (Sinervo et al., 2010). No obstante, podemos considerar que la temporada pre-reproductora es importante porque, durante ésta, los organismos acumulan la energía necesaria para prepararse para la reproducción (Guillette y Bearce, 1986). En algunas especies como en S. mucronatus, previo a la reactivación gonadal se incrementan los cuerpos grasos de machos y hembras (Méndez-de la Cruz et al., 1993). En el caso de las hembras se utilizan los cuerpos grasos para la producción de folículos vitelogénicos y, en caso de no tener energía suficiente, algunos folículos se vuelven atrésicos y se reduce el número de crías producidas (Méndez-de la Cruz et al., 1993), llegando eventualmente a la ausencia total de crías en años muy severos (Rodríguez-Romero y Méndez-de La Cruz, 2004). Mientras que en los machos se ha propuesto que dicha energía se utiliza principalmente para la defensa del territorio (Licht, 1974). Por lo anterior debe considerarse que las Hr durante la fase pre-reproductora afectan el esfuerzo reproductor, incidiendo directamente en la capacidad de producción de crías y, eventualmente, en su colapso reproductor.
Aunado a lo anterior, encontramos en los registros de las temperaturas ambientales durante el fenómeno de El Niño, que el aumento de la temperatura ambiental es menor en la época reproductora (1.8 °C) en comparación con la temporada pre-reproductora (3.4 °C). Por lo que la presencia de Hr en esta especie, podría tener efectos perjudiciales en los organismos en la época pre-reproductora. No obstante, consideramos necesario replicar este tipo de análisis para ambas temporadas, e incluso obtener datos de To de diferentes años.
En conclusión, la lagartija de lava de Santa Cruz, M. indefatigabilis, presenta diferencias significativas entre las temperaturas corporales entre poblaciones, pero conservan sus temperaturas seleccionadas, y éstas, a su vez, son cercanas a su temperatura óptima. Su termorregulación es activa y el límite superior de su amplitud térmica se encuentra muy cercano a su temperatura crítica máxima. Ésto, aunado al incremento de las temperaturas ambientales presentes durante el fenómeno de El niño, puede provocar un aumento en el número de horas de restricción de la especie en sitios con poca cobertura vegetal, por lo menos en la temporada no reproductora. Por último, los datos sugieren que esta especie puede presentar actividad unimodal a temperaturas inferiores a las previamente mencionadas.
Agradecimientos
A Saúl Guerrero, Jesús Loc, Norberto Martínez y Guillermo Woolrich por la ayuda brindada durante el trabajo de campo, laboratorio y algunos análisis, así como por sus comentarios para mejorar el escrito. RALR agradece las becas posdoctorales UC Mexus-Conacyt (FE-14-2) y Conicet-Argentina durante el trabajo de campo y la redacción del manuscrito, respectivamente. NFE agradece la beca posdoctoral DGAPA de la UNAM brindada durante la redacción. NFE, DMAM, FJMN, FJGA y RSB agradecen al Consejo Nacional de Ciencia y Tecnología (Conacyt) por las becas de posgrado (412836, 412744, 775920, 699259, 774550, respectivamente). NFE, DMAM, FJMN, FJGA, RGTP, LELA y RSB agradecen al Posgrado en Ciencias Biológicas de la UNAM y al Programa de Apoyos para Estudiantes de Posgrado (PAEP) de la UNAM. También agradecemos a la Dirección del Parque Nacional Galápagos (DPNG) y Dirección de Gestión Ambiental del DPNG por otorgarnos el permiso de investigación científica No. PC-66-17; a la Base Aérea Militar en Isla Baltra por el apoyo logístico para realizar el muestreo en dicha isla. Agradecemos los comentarios de los revisores anónimos, los cuales ayudaron a mejorar la versión final del manuscrito. Este estudio fue realizado con el financiamiento del Fondo de Investigaciones de la Universidad Iberoamericana del Ecuador y del proyecto UNAM PAPIIT/DGAPA (IN212119).
Referencias
Altamirano, M. A. (1996). Potential influences of biotic and abiotic factors on patterns of activity in Galapagos snakes: locomotory performance or prey abundance? University of New Mexico. Recuperado de: https://digitalrepository.unm.edu/biol_etds/147
Angilletta, M. J., Hill, T. y Robson, M. A. (2002). Is physiological performance optimized by thermoregulatory behavior?: a case study of the eastern fence lizard, Sceloporus undulatus. Journal of Thermal Biology, 27, 199–204. https://doi.org/10.1016/S0306-4565(01)00084-5
Angilletta, M. J., Niewiarowski, P. H. y Navas, C. A. (2002). The evolution of thermal physiology in ectotherms. Journal of Thermal Biology, 27, 249–268.
Bakken, G. S. (1992). Measurement and application of operative and standard operative temperatures in ecology. American Society of Zoologists, 32, 194–216. https://doi.org/10.1093/icb/32.2.194
Benavides, E., Baum, R., Snell, H. M., Snell, H. L. y Sites, J. W. (2009). Island biogeography of Galápagos lava lizards (Tropiduridae: Microlophus): species diversity and colonization of the archipelago. Evolution, 63, 1606–1626. https://doi.org/10.1111/j.1558-5646.2009.00617.x
Blouin-Demers, G. y Nadeau, P. (2005). The cost–benefit model of thermoregulation does not predict lizard thermoregulatory behavior. Ecology, 86, 560–566. https://doi.org/10.1890/04-1403
Blouin-Demers, G. y Weatherhead, P. J. (2001). Thermal ecology of Black Rat snakes (Elaphe obsoleta) in a thermally challenging environmen. Ecology, 82, 3025–3043. https://doi.org/https://doi.org/10.1890/0012-9658(2001)082[3025:TEOBRS]2.0.CO;2
Bogert, C. M. (1949). Thermoregulation in reptiles, a factor in evolution. Evolution, 3, 195–211. https://doi.org/10.2307/2405558
Bonino, M. F., Moreno-Azócar, D. L., Schulte, J. A., Abdala, C. S. y Cruz, F. B. (2015). Thermal sensitivity of cold climate lizards and the importance of distributional ranges. Zoology, 118, 281–290. https://doi.org/10.1016/j.zool.2015.03.001
Cabezas-Cartes, F., Fernández, J. B., Duran, F. y Kubisch, E. L. (2019). Potential benefits from global warming to the thermal biology and locomotor performance of an endangered Patagonian lizard. PeerJ, 7, 1–17. https://doi.org/10.7717/peerj.7437
Carpenter, C. C. (1970). Miscellaneous notes on Galapagos lava lizards (Tropidurus: Iguanidae). Herpetologica, 26, 377–386.
Castellini, M. A. (2009). Thermoregulation. In Encyclopedia of Marine Mammals. Second Ed. (pp. 1166–1171). Cambridge: Academic Press.
Catenazzi, A., Carrillo, J. y Donnelly, M. (2005). Seasonal and geographic eurythermy in a coastal Peruvian lizard. Copeia, 2005, 713–723.
Cowles, R. B. y Bogert, C. M. (1944). A preliminary study of the thermal requirements of desert reptiles. American Museum of Natural History, 83, 261–296.
Cowles, R. B. y Burleson, G. L. (1945). The sterilizing effect of high temperatue on the male germ-plasm of the Yuca night lizard, Xantusia vigilis. The American Naturalist, 79, 417–435.
Currie, R. J., Bennett, W. A. y Beitinger, T. L. (1998). Critical thermal minima and maxima of three freshwater game-fish species acclimated to constant temperatures. Environmental Biology of Fishes, 51, 187–200. https://doi.org/10.1023/A:1007447417546
Deutsch, C. A., Tewksbury, J. J., Huey, R. B., Sheldon, K. S., Ghalambor, C. K., Haak, D. C. et al. (2008). Impacts of climate warming on terrestrial ectotherms across latitude. Proccedings of the National Academy of Sciences, 105, 6668–6672.
Du, W. G., Yan, S. J. y Ji, X. (2000). Selected body temperature, thermal tolerance and thermal dependence of food assimilation and locomotor performance in adult blue-tailed skinks, Eumeces elegans. Journal of Thermal Biology, 25, 197–202. https://doi.org/10.1016/S0306-4565(99)00022-4
Dubois, Y., Blouin-Demers, G., Shipley, B. y Thomas, D. (2009). Thermoregulation and habitat selection in wood turtles Glyptemys insculpta: chasing the sun slowly. Journal of Animal Ecology, 78, 1023–1032. https://doi.org/10.1111/j.1365-2656.2009.01555.x
Dzialowski, E. M. (2005). Use of operative temperature and standard operative temperature models in thermal biology. Journal of Thermal Biology, 30, 317–334. https://doi.org/10.1016/j.jtherbio.2005.01.005
Elzhov, T., Mullen, K., Spiess, A. y Bolker, B. (2016). Package “minpack. lm.” Https://Cran.R-Project.Org/Web/Packages/Minpack.Lm/Minpack.Lm.Pdf. Retrieved from https://cran.r-project.org/web/packages/minpack.lm/minpack.lm.pdf
Grigg, J. W. y Buckley, L. B. (2013). Conservatism of lizard thermal tolerances and body temperatures across evolutionary history and geography. Biology Letters, 16, 20121056. https://doi.org/10.1098/rsbl.2012.1056
Guillette, L. J. y Bearce, D. A. (1986). The reproductive and fat body cycles of the lizard, Sceloporus grammicus disparilis. Transactions of the Kansas Academy of Science (1903-), 89, 31–39. https://doi.org/10.2307/3627729
Hertz, P. E., Huey, R. B. y Stevenson, R. D. (1993). Evaluating temperature regulation by field-active ectotherms: the fallacy of the inappropriate question. The American Naturalist, 142, 796–818. https://doi.org/10.1086/285573
Huey, R. B. (1974a). Behavioral thermoregulation in lizards: importance of associated costs. Science, 184, 1001–1003. https://doi.org/10.1126/science.184.4140.1001
Huey, R. B. (1974b). Winter thermal ecology of the iguanid lizard Tropidurus peruvianus. Contributions in Science, 1974, 149–155.
Huey, R. B. (1982). Temperature, physiology, and the ecology of reptiles. En F. H. Gans, C. y Pough (Eds.), Biology of the Reptilia, Vol. 12 (pp. 25–91). Academic Press, London. https://doi.org/10.1016/j.dsr.2014.07.003
Huey, R. B., Deutsch, C. A., Tewksbury, J. J., Vitt, L. J., Hertz, P. E., Pérez, H. J. Á. et al. (2009). Why tropical forest lizards are vulnerable to climate warming. Proceedings of the Royal Society B: Biological Sciences, 276, 1939–1948. https://doi.org/10.1098/rspb.2008.1957
Huey, R. B. y Slatkin, M. (1976). Cost and benefits of lizard thermoregulation. The Quarterly Review of Biology, 51, 363–384. https://doi.org/10.1086/409470
Kaufmann, J. S. y Bennett, A. F. (1989). The effect of tempera-
ture and thermal acclimation on locomotor performance in Xantusia vigilis, the desert night lizard. Physiological Zoology, 62, 1047–1058. https://doi.org/10.1086/physzool.
62.5.30156195
Kizirian, D., Trager, A., Donnelly, M. A. y Wright, J. W. (2004). Evolution of Galapagos island lava lizards (Iguania: Tropiduridae: Microlophus). Molecular Phylogenetics and Evolution, 32, 761–769. https://doi.org/10.1016/j.ympev.2004.04.004
Labra, A., Vidal, M. A., Solís, R. y Penna, M. (2008). Ecofisiología de anfibios y reptiles. En M. A. Vidal-Maldonado y A. Labra-Lillo (Eds.), Herpetología de Chile (pp. 483–516). Science Verlag. Chile.
Licht, P. (1974). Response of Anolis lizards to food supplementation in nature. Copeia, 1974, 215–221.
Logan, M. L., Huynh, R. K., Precious, R. A. y Calsbeek, R. G. (2013). The impact of climate change measured at relevant spatial scales: new hope for tropical lizards. Global Change Biology, 19, 3093–3102. https://doi.org/10.1111/gcb.12253
Lutterschmidt, W. I. y Hutchison, V. H. (1997). The critical thermal maximum: history and critique. Canadian Journal of Zoology, 75, 1561–1574. https://doi.org/10.1139/z97-783
Méndez-de la Cruz, F. R., Guillette Jr, L. J. y Villagrán-Santa Cruz, M. (1993). Differential atresia of ovarian follicles and its effect on the clutch size of two populations of the viviparous lizard Sceloporus mucronatus. Functional Ecology, 7, 535–540. https://doi.org/10.2307/2390129
Méndez-de la Cruz, F., Manríquez-Morán, N. L., Arenas-Ríos, E. e Ibargüengoytia, N. (2014). Male reproductive cycles in lizards. En S. Rheubert, Justin L. Siegel y Dustin S. Trauth (Eds.), Reproductive biology and phylogeny of lizards and tutara (pp. 302–339). Boca Raton: CRC Press.
Méndez-Galeano, M. A., Paternina-Cruz, R. F. y Calderón-Espinosa, M. L. (2020). The highest kingdom of Anolis: thermal biology of the Andean lizard Anolis heterodermus (Squamata: Dactyloidae) over an elevational gradient in the Eastern Cordillera of Colombia. Journal of Thermal Biology, 89, 102498. https://doi.org/10.1016/j.jtherbio.2019.102498
Miles, D. B., Snell, H. L. y Snell, H. M. (2001). Intrapopulation variation in endurance of Galapagos lava lizards (Microlophus albemarlensis): evidence for an interaction between natural and sexual selection. Evolutionary Ecology Research, 3, 795–804.
Muñoz-Barriga, A. (2015). La contradicción del turismo en la conservación y el desarrollo en Galápagos – Ecuador. Estudios y Perspectivas en Turismo, 24, 399–413.
Neel, L. K. y McBrayer, L. D. (2018). Habitat management alters thermal opportunity. Functional Ecology, 32, 2029–2039. https://doi.org/10.1111/1365-2435.13123
O’Connor, M. P., Sieg, A. E. y Dunham, A. E. (2006). Linking physiological effects on activity and resource use to population level phenomena. Integrative and Comparative Biology, 46, 1093–1109. https://doi.org/10.1093/icb/icl031
Pontes-da-Silva, E., Magnusson, W. E., Sinervo, B., Caetano, G. H., Miles, D. B., Colli, G. R. et al. (2018). Extinction risks forced by climatic change and intraspecific variation in the thermal physiology of a tropical lizard. Journal of Thermal Biology, 73, 50–60. https://doi.org/10.1016/j.jtherbio.2018.01.013
R Development Core Team. (2020). R: A Language and Environment for Statistical Computing. R Foundation for Statistical Computing. Retrieved from http://www.r-
project.org
Rodríguez-Romero, F. y Méndez-de La Cruz, F. R. (2004). Reproductive arrest in Sceloporus mucronatus (Lacertilia: Phrynosomatidae) correlated with “El Niño Southern Oscillation.” Herpetological Review, 35, 121–123.
Rowe, J. W., Clark, D. L., Martin, C. E. y Valle, C. (2020). Diel and seasonal variations in the thermal biology of San Cristobal lava lizards (Microlophus bivittatus). Journal of Thermal Biology, 88, 1–9. https://doi.org/10.1016/j.jtherbio.2020.102518
Sinervo, B., Méndez-de la Cruz, F., Miles, D. B., Heulin, B., Bastiaans, E., Villagrán-Santa Cruz, M. et al. (2010). Erosion of lizard diversity by climate change and altered thermal niches. Science, 328, 894–899. https://doi.org/10.1126/science.1184695
Snell, H. L., Jennings, R. D., Snell, H. M. y Harcourt, S. (1988). Intrapopulation variation in predator-avoidance performance of Galápagos lava lizards: the interaction of sexual and natural selection. Evolutionary Ecology, 2, 353–369. https://doi.org/10.1007/BF02207566
Snell, H. L., Snell, H. M., Stone, P. A., Altamirano, M. A., Mauchamp, A. y Aldáz, I. (1995). Proyecto de diversidad biológica de las Islas Galapagos, Volumen 1. Análisis de la flora. Fundación Charles Darwin Para Las Islas Galápagos, Ecuador. https://doi.org/10.1017/CBO9781107415324.004
Snell, H. y Rea, S. (1999). The 1997-98 El Niño in Galápagos: Can 34 years of data estimate 120 years of pattern? Noticias de Galápagos, 60, 11–20.
Stapley, J., García, M. y Andrews, R. M. (2015). Long-term data reveal a population decline of the tropical lizard Anolis apletophallus, and a negative affect of El Nino years on population growth rate. Plos One, 10, 1–14. https://doi.org/10.1371/journal.pone.0115450
Stebbins, R. C., Lowenstein, J. M. y Cohen, N. W. (1967). A field study of the lava lizard (Tropidurus albemarlensis) in the Galapagos islands. Ecological Society of America, 48, 839–851. https://doi.org/10.2307/1933742
Stott, P. (2016). How climate change affects extreme weather events. Science, 352, 1517–1518. https://doi.org/10.1126/science.aaf7271
Trueman, M. y d’Ozouville, N. (2010). Characterizing the Galapagos terrestrial climate in the face of global climate change. Galapagos Research, 67, 26–37.
Wikelski, M. y Thom, C. (2000). Marine iguanas shrink to survive El Niño. Nature, 403, 37–38. https://doi.org/10.1038/47396
Willmer, P., Stone, G. y Johnston, I. (2005). Environmental physiology of animals (Second Ed.). Oxford: Blackwell Publishing.
Yong, S. M. A. (2019). Estudio hidrológico de la cuenca Samán con base en el Fenómeno El Niño 2015 – 2016. Universidad de Piura. Lima, Perú.




