Ecología térmica y riesgo de extinción ante el cambio climático de Gonatodes concinnatus (Squamata: Sphaerodactylidae), una lagartija endémica de la Amazonía occidental
Marco A. Altamirano-Benavides a, b, c, Saúl F. Domínguez-Guerrero d, e, *, Francisco J. Muñoz-Nolasco d, e, Diego M. Arenas-Moreno d, e, Rufino Santos-Bibiano d, e, Raúl Gómez-Trejo Pérez d, e, Luis E. Lozano-Aguilar d, e, Natalia Fierro-Estrada d, e, Fabiola J. Gandarilla-Aizpuro d, e, Guillermo A. Woolrich-Piña f, Norberto Martínez-Méndez g, Rafael A. Lara-Reséndiz h y Fausto R. Méndez-de la Cruz d
a Instituto de Investigaciones Científicas y Tecnológicas, Universidad Iberoamericana del Ecuador, 9 de Octubre N25-12 y Colón, Quito, Ecuador
b Estación Científica Amazónica Juri-Juri Kawsay, Universidad Central del Ecuador, Av. América N23-41 y Mercadillo, Quito, Ecuador
c Facultad de Ciencias Agrícolas, Universidad Central del Ecuador, Ciudadela Universitaria-Jerónimo Leiton y Av. La Gasca s/n, Quito, Ecuador
d Laboratorio de Herpetología 2, Departamento de Zoología, Instituto de Biología, Universidad Nacional Autónoma de México, Apartado postal 70515, Coyoacán, 04510 Ciudad de México, México
e Posgrado en Ciencias Biológicas, Instituto de Biología, Universidad Nacional Autónoma de México, Apartado postal 70515, Coyoacán, 04510 Ciudad de México, México
f Laboratorio de Zoología, División de Biología, Subdirección de Investigación y Posgrado, Instituto Tecnológico Superior de Zacapoaxtla, Carretera Acuaco-Zacapoaxtla Km. 8, Col. Totoltepec, 73680 Zacapoaxtla, Puebla, México
g Laboratorio de Bioconservación y Manejo, Departamento de Zoología, Escuela Nacional de Ciencias Biológicas del Instituto Politécnico Nacional, Prolongación de Carpio y Calle Plan de Ayala s/n, Santo Tomás, Miguel Hidalgo, 11340 Ciudad de México, México
h Centro de Investigaciones Biológicas del Noroeste, Col. Playa Palo de Santa Rita Sur s/n, 23096 La Paz, Baja California Sur, México
*Autor para correspondencia: sauldguerrero@gmail.com (S. F. Domínguez-Guerrero)
Resumen
El cambio climático (CC) podría ocasionar la extinción del 20% de las especies de lagartijas a nivel mundial para el año 2080. Sin embargo, el riesgo de extinción varía entre especies y depende de los requerimientos fisiológicos de los individuos y de la distribución geográfica de las poblaciones. En el presente trabajo evaluamos aspectos de la ecología térmica de una población del geco diurno Gonatodes concinnatus que habita en la región occidental de la selva amazónica y proyectamos su distribución potencial al presente y su riesgo de extinción para 2050 y 2070, a través de su distribución geográfica utilizando un modelo mecanicista y correlativo. Gonatodes concinnatus tuvo una temperatura corporal (Tb) de 26.8 °C (± 2.5), una temperatura seleccionada (Tsel) de 24.6 °C (± 1.6) y presentó una estrategia termoconformista. La probabilidad de extinción promedio de G. concinnatus es de 84.2% para el año 2050 y de 86.4% para el año 2070. Además, estimamos que las poblaciones de menor altitud tienen mayor probabilidad de extinción ante el CC. Consideramos que G. concinnatus es altamente susceptible al CC y resaltamos la importancia de contar con información de la fisiología térmica de ectotermos tropicales para implementar estrategias de conservación apropiadas.
Palabras clave: Calidad térmica del hábitat; Ecofisiología; Geco diurno; Horas de restricción; Termorregulación
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Thermal ecology and extinction risk due to climate change of Gonatodes concinnatus (Squamata: Sphaerodactylidae), an endemic lizard from western Amazonia
Abstract
Climate change (CC) could cause the extinction of 20% of the lizard species in the world by the year 2080. However, extinction risk is variable among species and it depends on the physiological requirements of individuals and the geographic distribution of populations. In this study, we evaluated thermal ecological aspects of a population of the diurnal gecko Gonatodes concinnatus, that inhabits in the western region of the Amazon Rainforest, and projected its potential distribution at present and his extinction risk by the year 2050 and by 2070 through a mechanistic and correlative model. We found out that G. concinnatus had a body temperature (Tb) of 26.8 °C (± 2.5), a selected body temperature (Tsel) of 24.6 °C (± 1.6) and a tendency towards thermoconformism. The probability of extinction for G. concinnatus is 84.2% by 2050 and 86.4% by 2070. Additionally, we estimated that at lower elevations, populations will have higher extinction probabilities due to CC. We consider G. concinnatus as highly sensitive to CC and we highlight the importance of having information on the thermal physiology of tropical ectotherms to implement appropriate conservation strategies.
Keywords: Habitat thermal quality; Ecophysiology; Diurnal gecko; Restriction hours; Thermoregulation
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
El cambio climático (CC) acelerado está ocasionando la extinción rápida de ectotermos a nivel mundial (Carpenter et al., 2008; Thomas et al., 2004) y uno de los grupos con mayor riesgo de extinción es el de las lagartijas (Huey et al., 2010; Sinervo et al., 2010). Algunas especies de lagartijas son heliotermas y regulan su temperatura corporal (Tb) exponiéndose u ocultándose de la radiación solar (Hertz et al., 1993; Huey y Slatkin, 1976). Otras especies son termoconformistas y su Tb varía de acuerdo con la temperatura ambiental (Huey et al., 2009). En ambos casos, cuando la temperatura ambiental es alta, los individuos se refugian para evitar que su Tb exceda su límite superior de tolerancia térmica (temperatura crítica máxima; Ctmax) y mueran por sobrecalentamiento (Cowles y Bogert, 1944; Sinervo et al., 2017). Sin embargo, si los individuos permanecen refugiados (horas de restricción térmica; hr) durante su horario de actividad (ha) el tiempo para que realicen sus actividades biológicas básicas se acorta (e.g., tiempo para forrajeo), lo cual es especialmente importante durante la temporada de reproducción, ya que las tasas de reproducción descienden, el reclutamiento poblacional disminuye o no existe y en consecuencia las poblaciones decrecen hasta su extinción (Sinervo et al., 2011).
Sinervo et al. (2010) desarrollaron un modelo “genérico” que incorpora aproximaciones mecanicistas y correlativas para proyectar el riesgo de extinción de lagartijas heliotermas o termoconformistas por medio del cálculo de las hr y encontraron que el 20% de las especies de lagartijas a nivel mundial se podrían extinguir para el año 2080, debido al aumento de la temperatura ambiental. De acuerdo con las proyecciones, algunas especies de lagartijas podrían tener un riesgo de extinción de hasta el 91% para el año 2080 (e.g., Helodermatidae), mientras que otras especies tendrían un riesgo de extinción nulo (e.g., Gekkonidae). Las diferencias en la susceptibilidad al CC entre especies se deben a 2 aspectos principales. El primero es la sensibilidad térmica, las especies con Tb < 30 °C son más susceptibles que las especies con Tb > 30 °C (Sinervo et al., 2010). El segundo es la distribución geográfica, a menor altitud o latitud, la temperatura ambiental suele ser más alta y las especies suelen presentar un mayor riesgo de extinción (Deutsch et al., 2008; Sinervo et al., 2018).
A pesar de que las proyecciones generales de riesgo de extinción a nivel de familias de lagartijas son alarmantes, éstas podrían subestimar la probabilidad de extinción a nivel de especie. Por ejemplo, Sinervo et al. (2010) proyectaron que el riesgo de extinción para los gecos de la familia Phyllodactylidae será nulo para el año 2080, pero Kubisch et al. (2016) proyectaron que el riesgo de extinción del geco Homonota darwinii (Phyllodactylidae) será del 20% para el mismo año. Por lo tanto, consideramos que es necesario proyectar y validar el modelo de riesgo de extinción a nivel específico, principalmente para las especies que, por su sensibilidad térmica y su distribución geográfica, podrían ser altamente susceptibles al CC.
En este trabajo, seleccionamos como modelo de estudio al geco diurno semiarborícola Gonatodes concinnatus (Sphaerodactylidae; fig. 1), el cual habita en la región occidental de la selva amazónica de Ecuador y Perú (Sturaro y Ávila-Pires, 2011). Gonatodes concinnatus alcanza una longitud hocico-cloaca (LHC) de entre 47.6 mm (♀) y 48.3 mm (♂), tiene una Tb promedio < 30 °C (Fitch, 1968) y habita en un intervalo altitudinal de 100-600 m y latitudinal de 0-5° (Sturaro y Avila-Pires, 2011). De acuerdo con las proyecciones de Sinervo et al. (2010), el riesgo de extinción para las especies de la familia Sphaerodactyilidae será nulo para 2050 y 2080. Sin embargo, por su baja Tb y por su estrecha distribución altitudinal y latitudinal planteamos la hipótesis de que G. concinnatus tendrá un riesgo de extinción alto ante el CC. Por lo tanto, los objetivos del presente trabajo fueron evaluar la estrategia de termorregulación de G. concinnatus, proyectar su riesgo de extinción para 2050 y 2070 bajo un escenario de cambio climático y definir si el riesgo de extinción está correlacionado con la distribución altitudinal de las poblaciones.

Materiales y métodos
Realizamos trabajo de campo durante julio de 2017 en los alrededores de la Estación Científica Amazónica Juri-Juri Kawsay de la Universidad Central del Ecuador, ubicada en el Bosque Protector del Oglán Alto, Cantón Arajuno, provincia de Pastaza, Ecuador (01°19ʼ26.95” S, 77°41’18.9” O; 604 m snm). El tipo de vegetación corresponde a un bosque pluvial premontano caracterizado por árboles con copas emergentes, entre los que destacan Ceiba pentandra, Pachira insignis, Ficus perisiana y Otoba parviflora, donde hay abundantes musgos y hepáticas en las hojas y ramas de la vegetación arbórea y arbustiva (Albuja et al., 2012; Cañadas-Cruz, 1983; Cerón et al., 2007). La temperatura promedio anual en el sitio de estudio varía entre 18 y 24 °C y la precipitación oscila entre los 4,000 y 8,000 mm anuales (Cerón et al., 2007).
Para estimar los requerimientos térmicos y la estrategia de termorregulación de G. concinnatus (fig. 1) recolectamos de forma directa individuos adultos (~ 48 mm LHC; Carvajal-Campos, 2017) entre las 0700-1900 h, horario establecido con base en la información sobre actividad diurna en otras especies del género Gonatodes (Gamble et al., 2015; Vitt et al., 2000) y confirmado para este taxón durante el trabajo de campo. Inmediatamente después de capturar a cada individuo (en un lapso no mayor a 10 s) registramos su Tb (cloacal) mediante un termopar tipo K conectado a un termómetro digital de lectura rápida (Fluke 51-II; ± 0.1 °C). Posteriormente, trasladamos a todas las lagartijas recolectadas a las instalaciones de la estación científica Juri-Juri Kawsay y las colocamos en un gradiente térmico dentro del intervalo de tiempo de 0900-1600 h para registrar la temperatura seleccionada (Tsel; Hertz et al., 1993) de cada individuo. El gradiente térmico consistió en una caja de policarbonato (100 cm de ancho × 100 cm de largo × 50 cm de alto) dividida en 10 carriles, en el cual ofrecimos a las lagartijas un intervalo de temperatura de ~ 15 °C a ~ 40 °C. Para obtener el extremo frío colocamos bolsas de hielo debajo de un extremo del gradiente y para obtener el extremo caliente colocamos 10 focos incandescentes de 100 W suspendidos a 30 cm de altura en el otro extremo del gradiente (un foco por carril). Asignamos un carril a cada individuo para evitar interacción conductual (Lara-Reséndiz et al., 2015) y registramos su Tsel cada hora con el mismo termómetro digital de lectura rápida usado en el trabajo de campo. Al terminar los registros de Tsel liberamos a los ejemplares en el sitio exacto donde los recolectamos.
Durante 6 meses consecutivos (20 de julio al 21 de diciembre de 2017), registramos las temperaturas operativas (Te; Bakken, 1992) en los microhábitats usados por G. concinnatus en el sitio de estudio. La Te se define como el producto de las interacciones entre factores biofísicos y morfológicos que influye en la temperatura corporal de un ectotermo y representa la temperatura de equilibrio que tendrían los individuos en ausencia de termorregulación conductual y fisiológica (Hertz et al., 1993; Lara-Reséndiz et al., 2015). Para registrar la Te, utilizamos 2 modelos biofísicos previamente calibrados que consistieron en tubos de policloruro de vinilo (PVC) de 100 mm de largo y 20 mm de diámetro, pintados de color gris y que emularon las tasas de ganancia y pérdida de calor (r = 0.89, p < 0.05) de los individuos adultos de la especie en estudio (ver detalles de calibración en Arenas-Moreno et al. [2018] y Lara-Reséndiz et al. [2015]). Dentro de cada modelo biofísico colocamos un sensor de temperatura ambiental modelo Hobo® U23-003 (HOBO Temp, ONSET Computer Corporation, Massachusetts) programado para registrar la temperatura cada 10 min durante el horario de actividad de los individuos. Con el objetivo de representar la variación de la temperatura microambiental colocamos los modelos de PVC en 2 sitios diferentes. El primero en un tronco bajo sombra de vegetación natural y el segundo en un tronco con exposición entre sol y sombra a través del día. Ambos microhábitats son lugares de actividad de G. concinnatus de acuerdo con nuestras observaciones durante el trabajo de campo. Es importante mencionar que, en los sitios de latitud o altitud baja, la temperatura ambiental es constante y poco variable a lo largo del año (Huey et al., 2009; Janzen, 1967) y la Te es relativamente homogénea en tiempo y espacio (Hertz, 1992; Medina et al., 2016). Por lo anterior, consideramos que los datos obtenidos durante 6 meses con 2 modelos nulos representan adecuadamente la variación anual de la Te.
Adicionalmente, registramos la temperatura ambiental (temperatura del aire a 2 m del suelo) en el sitio de estudio durante el mismo periodo e intervalos en que registramos la Te, mediante un registrador de temperatura ambiental modelo Hobo® U23-002. El registro de la temperatura ambiental lo utilizamos para validar el uso del método senoidal en el modelo de riesgo de extinción descrito a continuación.
Para proyectar el riesgo de extinción de G. concinnatus utilizamos el modelo mecanicista y correlativo de riesgo de extinción (MRE) propuesto por Sinervo et al. (2010), el cual está basado tanto en registros de presencia como en atributos ecofisiológicos. Para ello, empleamos la paquetería Mapinguari Versión 0.4.1 (Caetano et al., 2017) del lenguaje de programación R (R Development Core Team, 2018). El método de Sinervo et al. (2010) proyecta la probabilidad de presencia (distribución potencial) al presente y la probabilidad de presencia al 2050 y 2070 de lagartijas heliotermas o termoconformistas con base en el cálculo de horas de actividad (ha) y de restricción (hr) de los individuos durante su temporada de reproducción, ambas estimadas a partir de información microclimática, variables climáticas, distribución geográfica y datos fisiológicos de los organismos (Pontes-da Silva et al., 2018). Para más información del método ver detalles en Sinervo et al. (2010, 2011, 2017) y Caetano et al. (2017). Para construir el MRE empleamos el método senoidal que estima las ha y hr bajo el supuesto de que los organismos son termoconformistas y mantienen una Tb igual o cercana a la temperatura del aire (Tair). Este supuesto fue validado por medio de la estimación de la eficiencia en la termorregulación de los individuos y mediante un análisis de correlación de Spearman entre la temperatura ambiental del sitio de estudio y la Te del modelo biofísico 1 (r = 0.98) y la temperatura ambiental y la Te del modelo biofísico 2 (r = 0.96).
Los datos de presencia para estimar el MRE fueron obtenidos de los registros de distribución de G. concinnatus considerando la localidad de estudio y otras 39 localidades alejadas entre sí por al menos 2 km (criterio de Sinervo et al., 2010), de acuerdo con las localidades mencionadas para la especie de estudio en la revisión taxonómica de Sturaro y Ávila-Pirez (2011) y de las localidades registradas en el portal FaunaWebEcuador-Reptiles (Torres-Carvajal, et al., 2018; disponible en https://bioweb.bio/faunaweb/reptiliaweb/). Después obtuvimos las capas bioclimáticas de altitud y de temperatura mensual promedio mínima y máxima (Tmin y Tmax) y precipitación anual para los periodos presente y futuro (2050 y 2070) a una resolución espacial de 2.5 minutos de arco. La información climática fue descargada del portal WorldClim versión 1.4 (Hijmans et al., 2005; http://www.worldclim.org/version1) para el presente (mediante interpolaciones de datos de 1960 a 1990) y para el futuro (2050 y 2070) a partir de capas generadas por el Instituto de Meteorología MaxPlanck (MPI-ESM-LR) correspondientes a la trayectoria de concentración representativa 4.5 (Representative Concentration Pathway, RCP 4.5), misma que implica un escenario de mitigación de gases de efecto invernadero, con un pico de emisión al año 2100, seguido de una estabilización en el forzamiento radiativo y una anomalía térmica media 2.4 °C por encima de los niveles preindustriales (Thomson et al., 2011). Posteriormente, indicamos en el MRE el límite inferior (Tlower) y superior (Tupper) de tolerancia térmica de G. concinnatus, que de acuerdo con el criterio de Pontes-da Silva et al. (2018) corresponde con la Tb mínima y máxima de individuos activos en campo (20.4 °C y 29.8 °C, respectivamente). Debido a que la especie de estudio presenta reproducción continua (Carvajal-Campos, 2017) creamos capas ecofisiológicas de las ha y las hr de G. concinnatus, considerando los 12 meses del año. Estimamos la variación diaria de la Tair asumiendo una curva senoidal entre la Tmin y la Tmax y definimos las ha como el número de horas en que Tair > 20.4 °C (Tlower) y las hr como el número de horas en que Tair > 29.8 °C (Tupper) (Caetano et al., 2017; Sinervo et al., 2017).
Estimamos la probabilidad de presencia para cada pixel dentro del área de estudio para los periodos presente y futuro por medio de un modelo lineal generalizado (GLM, por sus siglas en inglés) y un modelo aditivo generalizado (GAM, por sus siglas en inglés) utilizando el paquete biomod2 (Thuiller et al., 2016), para lo cual usamos como insumos las capas ecofisiológicas de ha y hr, las capas bioclimáticas y los puntos de presencia de la especie con 1000 pseudoausencias (recomendadas por Barbet-Massin et al. (2012) para modelos GLM y GAM) y validados por medio del criterio de la curva de “característica operativa del receptor” (ROC, por sus siglas en inglés), con lo cual seleccionamos únicamente los modelos con valores mayores a 0.75 (Pontes-da Silva et al., 2018; Vicenzi et al., 2017). Para estimar el porcentaje de riesgo de extinción comparamos la probabilidad de presencia al presente (de los 40 registros de distribución G. concinnatus utilizados en este estudio) con la probabilidad de presencia en 2050 y 2070 (Pontes-da Silva et al., 2018).
Calculamos el promedio de la calidad térmica del hábitat (de), el promedio de la precisión térmica (db) y la eficiencia en la termorregulación de los individuos (E) mediante el protocolo de Hertz et al. (1993; E = 1-(db/de) y Blouin-Demmers y Weatherhead (2001; E = de–db). Para calcular los índices propuestos por Hertz et al. (1993) y Blouin-Demers y Weatherhead (2001) utilizamos los registros de Tb de los individuos, los registros de Te y el intervalo set-point (Tset; cuartiles del 25 % y 75 % de los datos centrales) de las Tsel (Tset25 y Tset75, respectivamente).
En primer lugar, de representa el promedio de la diferencia absoluta de cada Te con respecto a la Tset, donde los valores cercanos a cero indican calidad térmica del hábitat alta, es decir, que la temperatura del hábitat está dentro o cerca del intervalo de Tset de los individuos. Si Te < Tset25, entonces de = Tset25–Te; si Te está dentro de los cuartiles de Tset, entonces de = 0; y si Te > Tset75, entonces de = Te–Tset75. En segundo lugar, db representa el promedio de la diferencia absoluta de la Tb de cada individuo con respecto a la Tset, donde los valores cercanos a cero indican una precisión térmica alta, es decir, los individuos mantienen su Tb dentro o cerca del intervalo de Tset. Si la Tb < Tset25, entonces db = Tset25–Tb; si Tb está dentro de los cuartiles de Tset, entonces db = 0; y si Tb > Tset75, entonces db = Tb–Tset75. Finalmente, E representa qué tan eficientes son los individuos para termorregular. Utilizamos 2 protocolos para estimar E, ya que tienen enfoques ligeramente distintos (Lara-Reséndiz et al., 2015). Por una parte, Hertz et al. (1993) establecieron que los valores de E cercanos a 0 indican termoconformismo y los valores cercanos a 1 indican termorregulación activa. Por otra parte, Blouin-Demers y Weatherhead (2001) establecieron que E representa un valor absoluto (°C) del esfuerzo de termorregulación de los individuos. En ambos casos, los valores negativos sugieren una baja explotación del ambiente térmico en relación con la oferta térmica disponible.
Mediante análisis descriptivos calculamos el promedio y la desviación estándar (±) de Tb, Te, temperatura ambiental del sitio de estudio y Tsel. Finalmente, realizamos un análisis de correlación de Spearman entre el valor de riesgo de extinción para 2050 y 2070 de 40 pixeles (correspondientes con los registros de distribución de la especie de estudio) y la altitud, para poner a prueba si el riesgo de extinción cambia a través de la elevación.
Resultados
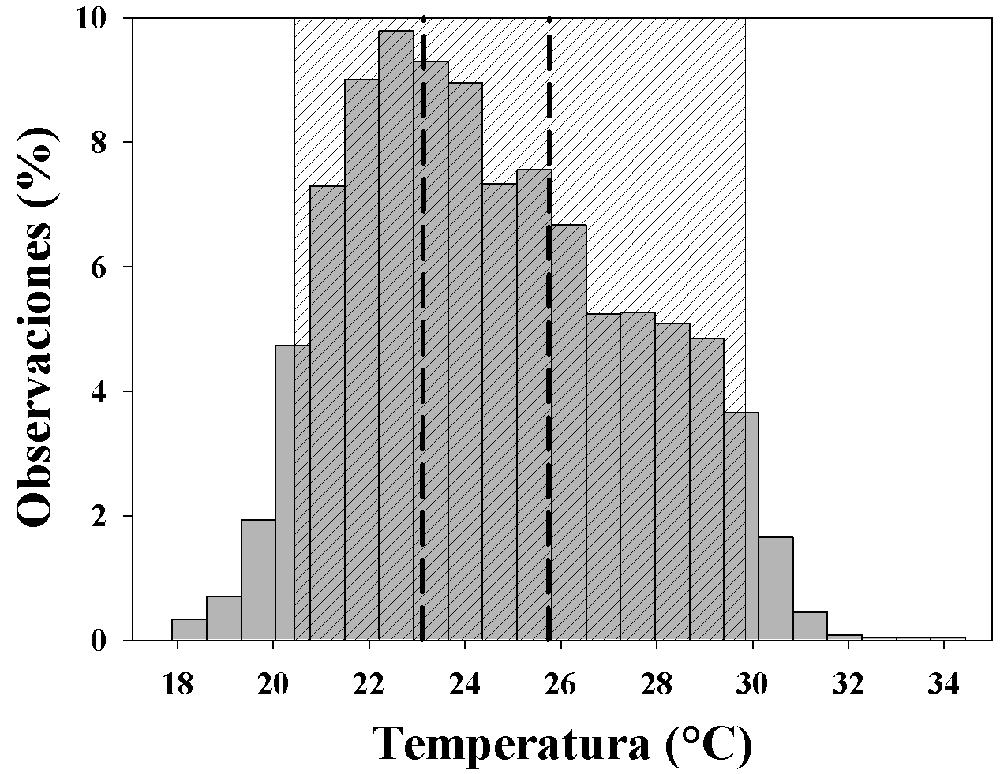
La Tb promedio de los gecos (n = 18) fue de 26.8 ± 2.5 °C (intervalo de 20.4-29.8 °C; fig. 2), la Te (n = 7690) fue de 24.6 ± 2.9 °C (intervalo de 17.9-35.9 °C; fig. 2), la Tsel (n = 18) fue de 24.6 ± 1.6 °C con cuartil Tset25 de 23.4 °C y cuartil Tset75 de 25.7 °C (fig. 2) y la temperatura ambiental (n = 3845) fue de 22.95 ± 2.6 °C. La calidad térmica del hábitat (de) en el sitio de estudio fue de 1.42 °C y la precisión térmica (db) de los organismos fue de 2.01 °C. De acuerdo con el protocolo de Hertz et al. (1993), el índice de eficiencia en la termorregulación (E) fue de -0.41 y de acuerdo con el protocolo de Blouin-Demers y Weatherhead (2001) fue de -0.59.
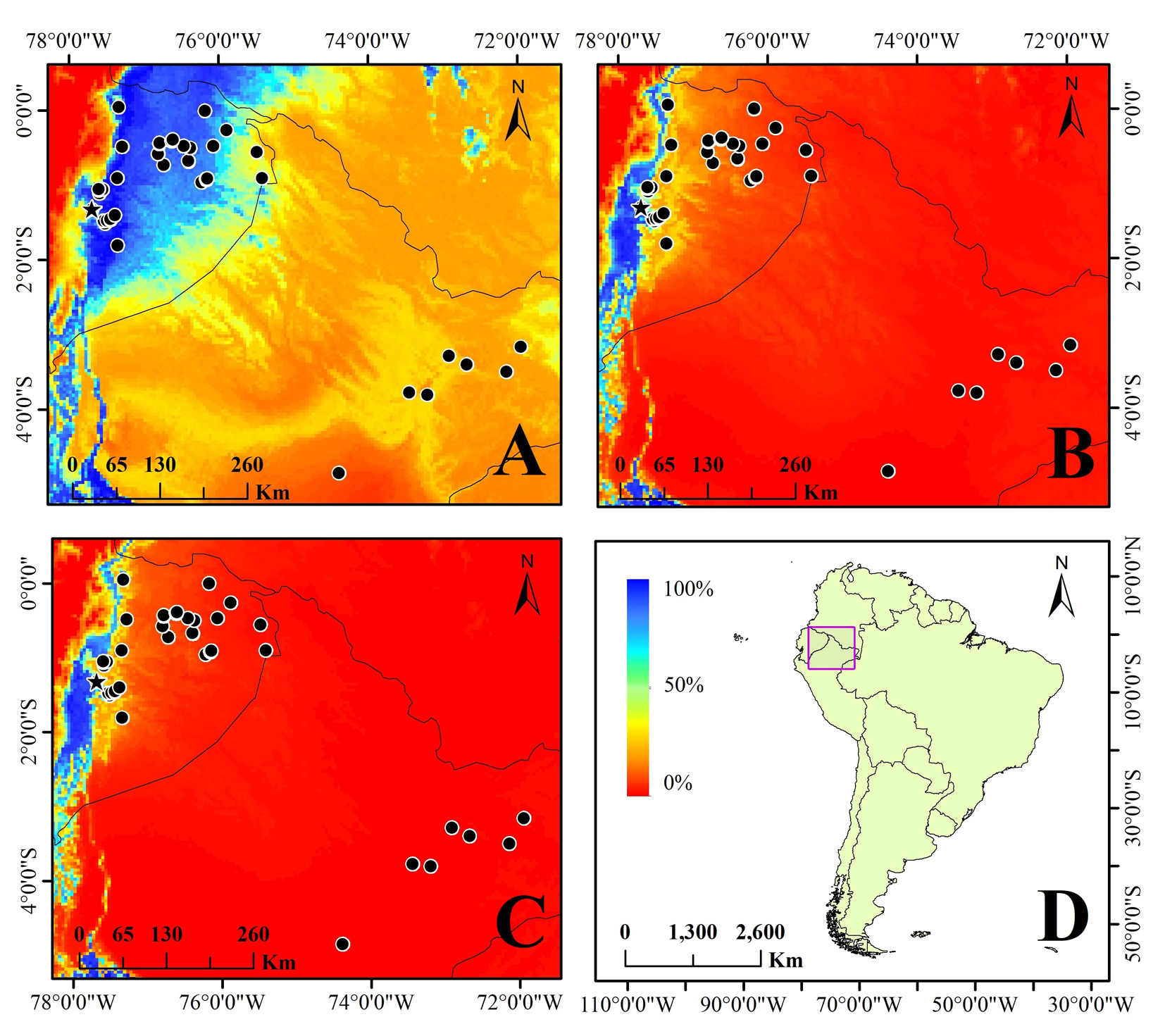
La probabilidad de presencia al presente (fig. 3A) es mayor que la proyectada a 2050 (fig. 3B) y a 2070 (fig. 3C). El porcentaje de riesgo de extinción para las poblaciones analizadas de G. concinnatus tuvo un intervalo de 12-97% (promedio de 84.2%) para 2050 y de 26-97% (promedio de 86.4%) para 2070 (tabla 1). La población del Oglán Alto fue la que presentó un menor porcentaje de riesgo de extinción ante el CC, con 12 y 26%, a 2050 y 2070, respectivamente (símbolo de estrella en la figura 3). Encontramos una correlación negativa entre la altitud de las poblaciones y su riesgo de extinción a 2050 y 2070 (r = -0.93, p < 0.05 y r = -0.96, p < 0.05, respectivamente), es decir, a menor altitud, mayor riesgo de extinción (fig. 4).
Discusión
En el presente trabajo determinamos la estrategia de termorregulación de una población del geco G. concinnatus y proyectamos su riesgo de extinción para los años 2050 y 2070 (RCP 4.5) a través de su distribución geográfica en la región occidental de la selva amazónica. Junto con el trabajo de Pontes-da-Silva et al. (2018), el presente estudio ofrece una de las primeras proyecciones de riesgo de extinción por CC a nivel de especie en lagartijas de la selva amazónica bajo un enfoque correlativo, mecanicista y biofísico. Además, es el primero en mostrar a nivel intraespecífico una correlación negativa entre el riesgo de extinción y la altitud. Consideramos que nuestros resultados podrían servir como base para nuevos estudios de vulnerabilidad ecofisiológica al CC en organismos ectotérmicos.
La conducta de termorregulación es un continuo de estrategias conductuales con 2 extremos: la termorregulación activa y el termoconformismo (Hertz et al., 1993). Por una parte, la termorregulación activa ocurre cuando los individuos mantienen su Tb dentro o cerca de su intervalo de Tset (valores de db cercanos a 0) en ambientes donde la calidad térmica del hábitat es baja. En el caso de termorreguladores activos el valor de db siempre es menor que de y se ve reflejado en valores de E cercanos a 1 (Artacho et al., 2017; Hertz et al., 1993) o en diferencias absolutas (positivas) altas entre de y db (Blouin-Demers y Weatherhead, 2001). Por otra parte, el termoconformiso ocurre cuando la Tb de los individuos es similar a la temperatura ambiental. En el caso de termoconformistas el valor de db siempre es similar al de de y se ve reflejado con valores de E (o en diferencias absolutas entre de y db) cerca de 0 (Blouin-Demers y Weatherhead, 2001; Hertz et al., 1993). El termoconformismo puede ocurrir debido a 2 razones principales. La primera es que el costo de la termorregulación activa supera los beneficios (Huey y Slatkin, 1976). La segunda es que los individuos habitan ambientes con calidad térmica alta y no necesitan termorregular. En el caso de G. concinnatus el ambiente ofrece una calidad térmica alta (de = 1.42 °C) y por ello los individuos no necesitan termorregular de forma activa, ya que el ambiente ofrece temperaturas cercanas a su Tset. Sin embargo, encontramos que la precisión térmica de los individuos (db = 2.01 °C) fue ligeramente menor a la calidad térmica del hábitat y como resultado el valor de eficiencia en la termorregulación resultó negativo (E = -0.41; Hertz et al., 1993) con una diferencia absoluta entre de y db de -0.58 °C (Blouin-Demers y Weatherhead, 2001). De acuerdo con Hertz et al. (1993) y con Blouin-Demers y Weatherhead (2001) los resultados negativos de E se pueden deber a que los individuos evaden temperaturas microambientales idóneas, como una posible forma de evasión de depredadores o por competencia intraespecífica. Consideramos que en el caso de G. concinnatus los valores negativos de E también se podrían deber a que los individuos eligen microhabitats húmedos, pero térmicamente poco favorables, ya que de forma general las lagartijas de la familia Sphaerodactylidae presentan tasas altas de deshidratación (Snyder, 1979; Nava, 2004). Es importante considerar que el tamaño de muestra y el periodo de estudio podrían limitar nuestras observaciones, sin embargo, nuestros resultados son apoyados con trabajos previos de especies tropicales (Hertz et al., 1993; Tewksbury et al., 2008). Consideramos que G. concinnatus es un termoconformista, pues el valor de E es cercano a cero (termoconformismo) con una diferencia absoluta entre de y db que no supera 1 °C. Además, nuestra consideración es consistente con resultados registrados en otras especies de gecos de la familia Sphaerodactylidae, también consideradas termoconformistas y con patrones generales de termorregulación en lagartijas que señalan que, en sitios tropicales, las lagartijas tienen tendencia termoconformista (Huey et al., 2009; Medina et al., 2016).
En un estudio previo (Sinervo et al., 2010), se proyectó que la probabilidad de extinción ante el CC para poblaciones de gecos de la familia Sphaerodactylidae es nula para el presente y futuro; sin embargo, nuestros resultados indican que la mayoría de las poblaciones de G. concinnatus tienen una probabilidad de extinción superior a 80% para 2050 y 2070 (tabla 1). La amplia diferencia entre los resultados de las proyecciones de riesgo de extinción a nivel de familia y a nivel de especies particulares denota la importancia de evaluar la vulnerabilidad de lagartijas a niveles taxonómicos específicos (e.g., Kubisch et al., 2016; Lara-Reséndiz et al., 2015; Pontes-da-Silva et al., 2018). La diferencia entre las proyecciones de Sinervo et al. (2010) para la familia Sphaerodactylidae y nuestras proyecciones para G. concinnatus se deben principalmente a los valores distintos de Tlower y Tupper utilizados entre ambas proyecciones. Para proyectar el riesgo de extinción de la familia Sphaerodactylidae, Sinervo et al. (2010) utilizaron como Tlower y Tupper los valores de Tb más bajos y altos registrados para la familia Sphaerodactylidae; 25.3 °C para Teratoscincus przewalskii (Dimitri y Borkin, 1992) y 38.6 °C para Pristurus carteri (Arnold, 1993); mientras que nosotros, al proyectar el riesgo de extinción de G. concinnatus consideramos apropiado utilizar como Tlower y Tupper los valores de Tb mínima (20.4 °C) y máxima (29.8 °C) de individuos activos en campo (Kubisch et al., 2016; Pontes-da-Silva et al., 2018). En otras palabras, las diferencias entre las proyecciones de riesgo de extinción de Sinervo et al. (2010) y las nuestras se deben a que los límites de tolerancia térmica son mayores entre especies que entre individuos de la misma especie. Al utilizar límites de tolerancia térmica amplios, las proyecciones pueden ser precisas a nivel de familia, pero se puede subestimar el riesgo de extinción intraespecífico (Kubisch et al., 2016; Pontes-da-Silva et al., 2018). Es importante señalar que delimitamos Tlower y Tupper para G. concinnatus con base en datos de individuos de una sola población, por ello es posible que estemos omitiendo variación interpoblacional (Angert et al., 2011), lo cual podría tener efecto en nuestras proyecciones. Sin embargo, la Tb documentada en otras poblaciones de G. concinnatus (Fitch, 1968) está dentro del intervalo que observamos en la población de estudio e inclusive es similar a la de otras especies del género Gonatodes (Brusch et al., 2016; Vitt et al., 2000), por lo cual consideramos que el intervalo de tolerancias térmicas que utilizamos es adecuado.
El riesgo de extinción elevado de G. concinnatus concuerda con el patrón típico de susceptibilidad ante el CC de ectotermos de baja latitud y de ambientes tropicales (Deutsch et al., 2008). Por ejemplo, Huey et al. (2009) realizaron un análisis macrofisiológico de especies de lagartijas que habitan en diferentes latitudes y encontraron que las especies de ambientes tropicales son las más vulnerables al calentamiento global. La alta susceptibilidad de G. concinnatus al CC se debe a que en los ambientes tropicales existe poca heterogeneidad térmica (Hertz, 1992; Janzen, 1967; Medina et al., 2016) y las lagartijas tienen pocas opciones de regular su Tb de forma conductual, de manera que presentan tendencia al termoconformismo (Huey et al., 2009). Además, los ectotermos de ambientes tropicales suelen presentar una Tb cercana a su Ctmax (margen de seguridad térmica bajo; Sunday et al., 2014), son especialistas térmicos con capacidades de aclimatación limitadas (Tewksbury et al., 2008) y un aumento de la temperatura ambiental podría ocasionar que los individuos mueran por sobrecalentamiento o aumenten sus horas de restricción (Sinervo et al., 2010).
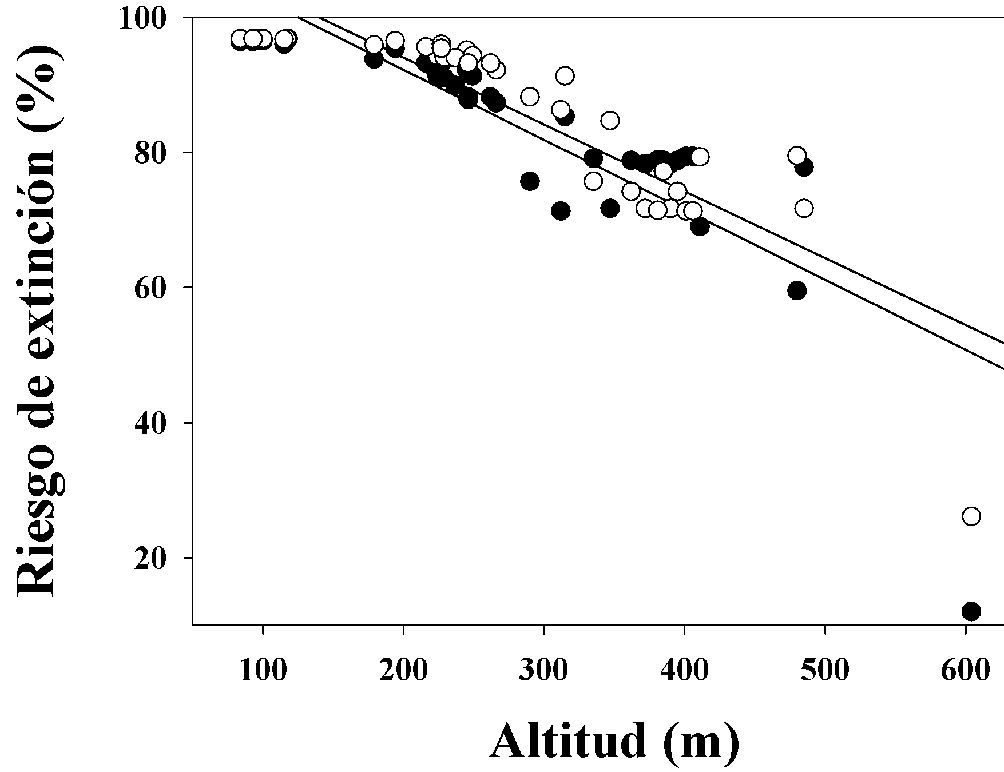
Tabla 1
Coordenadas geográficas (Long y Lat), elevación (Elev) y porcentaje de riesgo de extinción (ER_2050 y ER_2070) ante el CC proyectado para 40 poblaciones de G. concinnatus. En negritas se indica la población del bosque protector del Oglán Alto,
Cantón Arajuno, provincia de Pastaza, Ecuador.
|
Long |
Lat |
Elev |
ER_50 |
ER_70 |
Lon |
Lat |
Elev |
ER_50 |
ER_70 |
|
-77.3470 |
-1.8058 |
347 |
72% |
85% |
-76.8038 |
-0.5788 |
315 |
85% |
91% |
|
-77.5134 |
-1.5085 |
411 |
69% |
79% |
-75.4830 |
-0.5559 |
194 |
95% |
97% |
|
-77.5310 |
-1.4739 |
485 |
78% |
72% |
-76.3731 |
-0.4985 |
229 |
91% |
94% |
|
-77.4832 |
-1.4723 |
395 |
79% |
74% |
-77.2850 |
-0.4845 |
290 |
76% |
88% |
|
-77.4869 |
-1.4706 |
362 |
79% |
74% |
-76.4591 |
-0.4713 |
237 |
90% |
94% |
|
-77.4433 |
-1.4547 |
372 |
78% |
72% |
-76.0667 |
-0.4712 |
216 |
93% |
96% |
|
-77.4441 |
-1.4504 |
390 |
78% |
72% |
-76.7865 |
-0.4310 |
246 |
88% |
93% |
|
-77.3836 |
-1.4000 |
335 |
79% |
76% |
-76.6238 |
-0.4004 |
262 |
88% |
93% |
|
-77.5904 |
-1.1062 |
381 |
79% |
71% |
-76.6097 |
-0.3874 |
246 |
88% |
93% |
|
-77.6000 |
-1.0667 |
401 |
79% |
71% |
-75.8886 |
-0.2597 |
227 |
94% |
96% |
|
-77.5484 |
-1.0546 |
385 |
79% |
77% |
-76.1756 |
-0.0018 |
227 |
93% |
95% |
|
-77.6000 |
-1.0500 |
406 |
79% |
71% |
-77.3294 |
0.0492 |
480 |
60% |
80% |
|
-76.2235 |
-0.9592 |
226 |
92% |
95% |
-77.6886 |
-1.3242 |
604 |
12% |
26% |
|
-76.1572 |
-0.9221 |
245 |
92% |
95% |
-74.3831 |
-4.8512 |
118 |
97% |
97% |
|
-76.1447 |
-0.9070 |
219 |
93% |
95% |
-73.4438 |
-3.7743 |
117 |
97% |
97% |
|
-77.3515 |
-0.9025 |
312 |
71% |
86% |
-73.1998 |
-3.8050 |
99 |
97% |
97% |
|
-75.4136 |
-0.9009 |
179 |
94% |
96% |
-72.6731 |
-3.3984 |
84 |
96% |
97% |
|
-76.7267 |
-0.7264 |
266 |
87% |
92% |
-72.9132 |
-3.2852 |
100 |
97% |
97% |
|
-76.3945 |
-0.6789 |
249 |
91% |
94% |
-72.1405 |
-3.4978 |
93 |
96% |
97% |
|
-76.4004 |
-0.6690 |
224 |
91% |
94% |
-71.9478 |
-3.1609 |
115 |
96% |
97% |
Al correlacionar el riesgo de extinción de las poblaciones de G. concinnatus con la altitud, encontramos que a menor elevación mayor riesgo de extinción. Nuestros resultados a nivel intraespecífico son similares a los resultados encontrados entre especies. Por ejemplo, Sinervo et al. (2018), proyectaron que el riesgo de extinción de las especies de lagartijas del género Phrynocephalus disminuye de menor a mayor altitud. Por lo anterior, podríamos considerar que los sitios de mayor elevación serían sitios térmicamente adecuados para la especie de estudio y probablemente para otros ectotermos con características fisiológicas similares. Del total de localidades para las que proyectamos el riesgo de extinción de G. concinnatus, únicamente la población de mayor elevación tendría un riesgo de extinción bajo ante el CC, incluso para 2070; mientras que el resto de las poblaciones tendrían un riesgo de extinción alto. En este punto es importante señalar que es posible que aún existan poblaciones de G. concinnatus no documentadas en la selva amazónica, especialmente en la región norte de Perú. Sumado al riesgo de extinción ante el CC, existe una elevada tasa de deforestación de la selva amazónica (Coe et al., 2013), la cual podría acelerar la extinción de diversas especies.
A pesar del escenario desalentador de G. concinnatus ante el CC, se debe considerar que podrían existir al menos 3 mecanismos de respuesta por parte de los organismos. El primero es mediante cambios en la distribución de las poblaciones a ambientes térmicamente favorables (Bickford et al., 2010). En este escenario, es posible que algunas poblaciones de G. concinnatus puedan desplazarse y colonizar sitios de mayor altitud, principalmente hacia las zonas cercanas a la cordillera de los Andes (fig. 3). El segundo es mediante ajustes conductuales, que involucraría la modificación del horario de actividad de los individuos (optar por una estrategia catemeral o nocturna) según la calidad térmica del hábitat (Arenas-Moreno et al., 2018; Diele-Viegas et al., 2018). El tercero es mediante plasticidad fisiológica, en caso de que los individuos de G. concinnatus puedan aumentar su tolerancia al calor como respuesta al aumento de la temperatura ambiental, como puede ocurrir en otros ectotermos (Palumbi et al., 2014; Pörtner et al., 2009). De continuar con la tendencia actual de CC (IPCC, 2018), la pérdida y modificación del hábitat en la selva amazónica (Coe et al., 2013), y de no existir mecanismos de respuesta adecuados, G. concinnatus se podría sumar a las especies extintas en el presente siglo debido al cambio climático acelerado. Cabe mencionar que de acuerdo con la Lista Roja de Reptiles del Ecuador (Carrillo et al., 2005), G. concinnatus es una especie considerada como de preocupación menor (LC); por ello sugerimos reevaluar su estado de conservación, al igual que el de otros ectotermos tropicales.
En conclusión, la estrategia de termorregulación de los individuos de G. concinnatus tiende hacia el termoconformismo, es decir, depende de la temperatura y la calidad térmica del hábitat. De acuerdo con nuestras proyecciones, G. concinnatus será una especie con alto riesgo de extinción para los años 2050 y 2070. El riesgo de extinción de G. concinnatus será mayor en las poblaciones que habitan a baja altitud, y para el año 2050 es posible que la única población que persista sea la del bosque protector del Oglán Alto. Ante la susceptibilidad de los ectotermos al CC, es urgente mejorar las estrategias de mitigación y conservación para hacer frente a la pérdida de biodiversidad, especialmente en zonas megadiversas.
Agradecimientos
La investigación fue financiada por la “Cooperación Belga para el Desarrollo” a través del programa Académie de Recherche et D’Enseignement Supérieur-Universidad Central del Ecuador, el Fondo de Investigaciones de la Universidad Iberoamericana del Ecuador y por el Programa de Apoyo a Proyectos de Investigación e Innovación Tecnológica (UNAM -IN210116). SFDG, FJMN, DMAM, RSB, NFE y FJGA agradecen al Posgrado en Ciencias Biológicas-UNAM y al Conacyt por las becas de posgrado (478292, 775920, 412744, 774550, 412836 y 699259) y RALR por la beca posdoctoral Conacyt (1319). Agradecemos a Omar Torres-Carvajal, curador de la colección de reptiles del Museo de Zoología QCAZ-Pontificia Universidad Católica de Quito por permitirnos el acceso a la base de datos y a Jesús Loc Barragán por el apoyo en el trabajo de campo. Un agradecimiento a la comunidad Kichwa Pablo López del Oglán Alto, especialmente a María Tanguila y a Eliseo López por la atención brindada en la Estación Científica Amazónica Juri Juri Kawsay. Finalmente, agradecemos a los revisores anónimos y a J. Rogelio Cedeño-Vázquez (editor) por los comentarios y sugerencias para mejorar el manuscrito. El estudio se realizó bajo la autorización de investigación científica de fauna AC-FAU-DPAP/MAE-2017-006, otorgado a MAAB por la Dirección Provincial del Ambiente de Pastaza, Ecuador.
Referencias
Albuja, L., Almendáriz, A., Barriga, R., Montalvo, L. D., Cáceres, F. y Román, J. L. (2012). Fauna de vertebrados del Ecuador. Instituto de Ciencias Biológicas, Escuela Politécnica Nacional. Quito, Ecuador.
Angert, A. L., Sheth, S. N. y Paul, J. R. (2011). Incorporating population-level variation in thermal performance into predictions of geographic range shifts. Integrative and comparative Biology, 15, 733–750. https://doi.org/10.1093/icb/icr048
Arenas-Moreno, D. M., Santos-Bibiano, R., Muñoz-Nolasco, F. J., Charruau, P. y Méndez-de la Cruz, F. R. (2018). Thermal ecology and activity patterns of six species of tropical night lizards (Squamata: Xantusiidae: Lepidophyma) from Mexico. Journal of Thermal Biology, 75, 97–105. https://doi.org/10.1016/j.jtherbio.2018.06.001
Arnold, E. N. (1993). Historical changes in the ecology and behaviour of semaphore geckos (Pristurus, Gekkonidae) and their relatives. Journal of Zoology, 229, 353–384. https://doi.org/10.1111/j.1469-7998.1993.tb02642.x
Artacho, P., Saravia, J., Perret, S., Bartheld, J. L. y Le Galliard, J. F. (2017). Geographic variation and acclimation effects on thermoregulation behavior in the widespread lizard Liolaemus pictus. Journal of Thermal Biology, 63, 78–87. https://doi.org/10.1016/j.jtherbio.2016.11.001
Bakken, G. S. (1992). Measurement and application of operative and standard operative temperatures in ecology. American Zoologist, 32, 194–216. https://doi.org/10.1093/icb/32.2.194
Barbet-Massin, M., Jiguet, F., Albert, C. H. y Thuiller, W. (2012). Selecting pseudo-absences for species distribution models: how, where and how many? Methods in Ecology and Evolution, 3, 327–338. https://doi.org/10.1111/j.2041-210x.2011.00172.x
Bickford, D., Howard, S. D., Ng, D. J. J. y Sheridan, J. A. (2010). Impacts of climate change on the amphibians and reptiles of Southeast Asia. Biodiversity and Conservation, 19, 1043–1062. https://doi.org/10.1007/s10531-010-9782-4
Blouin-Demers, G. y Weatherhead, P. J. (2001). Thermal ecology of black rat snakes (Elaphe obsoleta) in a thermally challenging environment. Ecology, 82, 3025–3043. https://doi.org/10.2307/2679832
Brusch IV, G. A., Taylor, E. N. y Whitfield, S. M. (2016). Turn up the heat: thermal tolerances of lizards at La Selva, Costa Rica. Oecologica, 180, 325–334. https://doi.org/10.1007/s00442-015-3467-3
Caetano, G., Santos, J. y Sinervo, B. (2017). Mapinguari. Recuperado el 02 de agosto, 2018 de https://gabrielhoc.github.io/Mapinguari.html
Cañadas-Cruz, L. (1983). Mapa bioclimático y ecológico del Ecuador. MAG-PRONAREG-Banco Central del Ecuador. Quito.
Carpenter, K. E., Abrar, M., Aeby, G., Aronson, R. B., Banks, S., Bruckner, A., et al. (2008). One-third of reef-building corals face elevated extinction risk from climate change and local impacts. Science, 321, 560–563. https://doi.org/10.1126/science.1159196
Carrillo, E., Aldás, S., Altamirano, M., Ayala, F., Cisneros, D., Endara, A. et al. (2005). Lista roja de los reptiles del Ecuador. Fundación Novum Milenium, UICN-Sur, UICN-Comité Ecuatoriano, Ministerio de Educación y Cultura. Serie Proyecto PEEPE. Quito.
Carvajal-Campos, A. (2017). Gonatodes concinnatus. En O. Torres-Carvajal, G. Pazmiño-Otamendi y D. Salazar-Valenzuela (Eds.), Reptiles del Ecuador. Version 2018.0. Museo de Zoología, Pontificia Universidad Católica del Ecuador. Recuperado el 3 de agosto, 2018 de https://bioweb.bio/faunaweb/reptiliaweb/FichaEspecie/Gonatodes%20concinnatus
Cerón, C. E., Reyes, C. I., Montalvo, C. y Vargas, L. M. (2007). La cuenca alta del río Oglán, Pastaza-Ecuador, diversidad, ecología y flora. Quito: Editorial Universitaria.
Coe, M. T., Marthews, T. R., Costa, M. H., Galbraith, D. R., Greenglass, N. L., Hewlley, M. A. et al. (2013). Deforestation and climate feedbacks threaten the ecological integrity of south − southeastern Amazonia. Philosophical Transactions of the Royal Society B, 368, 20120155. https://doi.org/10.1098/rstb.2012.0155
Cowles, R. B. y Bogert, C. M. (1944). A preliminary study of the thermal requirements of desert reptiles. Bulletin of the American Museum of Natural History, 83, 261–296. https://doi.org/10.1086/394795
Deutsch, C. A., Tewksbury, J. J., Huey, R. B., Sheldon, K. S., Ghalambor, C. K., Haak, D. C. et al. (2008). Impacts of climate warming on terrestrial ectotherms across latitude. Proceedings of the National Academy of Sciences of the United States of America, 105, 6668–6672. https://doi.org/10.1073/pnas.0709472105
Diele-Viegas, L. M., Vitt, L. J., Sinervo, B., Colli, G. R., Werneck, F. P., Miles, D. B. et al. (2018). Thermal physiology of Amazonian lizards (Reptilia: Squamata). Plos One, 13, e0192834. https://doi.org/10.1371/journal.pone.0192834
Dimitri, V. S. y Borkin, L. (1992). On the ecology of Przewalsky’s Gecko (Teratoscincus przewalskii) in the Transaltai Gobi, Mongolia. Asiatic Herpetological Research, 4, 99–112.
Fitch, H. S. (1968). Temperature and behavior of some Equatorial lizards. Herpetologica, 24, 35–38.
Gamble, T., Greenbaum, E., Jackman, T. R. y Bauer, A. M. (2015). Into the light: diurnality has evolved multiple times in geckos. Biological Journal of the Linnean Society, 115, 896–910. https://doi.org/10.1111/bij.12536
Hertz, P. E. (1992). Temperature regulation in Puerto Rican Anolis lizards: a field test using null hypotheses. Ecology, 73, 1405–1417. https://doi.org/10.2307/1940686
Hertz, P. E., Huey, R. B. y Stevenson, R. D. (1993). Evaluating temperature regulation by field-active ectotherms: the fallacy of the inappropriate question. The American Naturalist, 142, 796–818. https://doi.org/10.1086/285573
Hijmans, R. J., Cameron, S. E., Parra, J.L., Jones, P. G. y Jarvis, A. (2005). Very high resolution interpolated climate surfaces for global land areas. International Journal of Climatology, 25, 1965–1978. https://doi.org/10.1002/joc.1276
Huey, R. B., Deutsch, C. A., Tewksbury, J. J., Vitt, L. J., Hertz, P. E., Pérez, H. J. Á. et al. (2009). Why tropical forest lizards are vulnerable to climate warming. Proceedings of the Royal Society B, 276, 1939–1948. https://doi.org/10.1098/rspb.2008.1957
Huey, R. B., Losos, J. B. Y Moritz, C. (2010). Are lizards toast ? Science, 328, 832–833. https://doi.org/10.1126/science.1190374
Huey, R. B. y Slatkin, M. (1976). Costs and benefitis of lizard thermoregulation. The Quarterly Review of Biology, 51, 363–384. https://doi.org/10.1086/409470
IPCC (Grupo Intergubernamental de Expertos sobre Cambio Climático). (2018). Summary for Policymakers. Global warming of 1.5 °C. An IPCC Special Report on the impacts of global warming of 1.5°C above pre-industrial levels and related global greenhouse gas emission pathways, in the context of strengthening the global response to the threat of climate change, sustainable development, and efforts to eradicate poverty. V. Masson-Delmotte, P. Zhai, H. O. Pörtner, D. Roberts, J. Skea, P. R. Shukla et al. Génova, Suiza: World Meteorological Organization.
Janzen, D. H. (1967). Why mountain passes are higher in the tropics. The American Naturalist, 101, 233–249. https://doi.org/10.1086/282487
Kubisch, E. L., Corbalán, V., Ibargüengoytía, N. R. y Sinervo, B. (2016). Local extinction risk of three species of lizard from Patagonia as a result of global warming. Canadian Journal of Zoology, 94, 49–59. https://doi.org/10.1139/cjz-2015-0024
Lara-Reséndiz, R. A., Gadsden, H., Rosen, P. C., Sinervo, B. y Méndez-de la Cruz, F. R. (2015). Thermoregulation of two sympatric species of horned lizards in the Chihuahuan Desert and their local extinction risk. Journal of Thermal Biology, 48, 1–10. https://doi.org/10.1016/j.jtherbio.2014.11.010
Medina, M., Fernández, J. B., Charruau, P., Méndez-de la Cruz, F. R. e Ibargüengoytia, N. (2016). Vulnerability to climate change of Anolis allisoni in the mangrove habitats of Banco Chinchorro Islands, Mexico. Journal of Thermal Biology, 58, 8–14. https://doi.org/10.1016/j.jtherbio.2016.02.005
Nava, S. S. (2004). Microhabitat selection, resource partitioning, and evaporative water loss by Dwarf Geckos, (Sphaerodactylus), on Puerto Rico (Tesis maestría). The University of Texas at El Paso, El Paso, Texas, EUA.
Palumbi, S. R., Barshis, D. J., Traylor-Knowles, N. y Bay, R. A. (2014). Mechanisms of reef coral resistance to future climate change. Science, 344, 895–898. https://doi.org/10.1126/science.1251336
Pontes-da-Silva, E., Magnusson, W. E., Sinervo, B., Caetano, G. H., Donald, B. M., et al. (2018). Extinction risks forced by climatic change and intraspecific variation in the thermal physiology of a tropical lizard. Journal of Thermal Biology, 73, 50–60. https://doi.org/10.1016/j.jtherbio.2018.01.013
Pörtner, H. O., Farrel, A. P. Knust, R., Lannig, G., Mark, F. C. y Storch, D. (2009). Adapting to climate change-response. Science, 323, 876–877. https://doi.org/10.1126/science.323.5916.876b
R Development Core Team (2018). R: a language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. http://www.R-project.org/
Sinervo, B., Méndez-de la Cruz, F., Miles, D. B., Heulin, B., Bastiaans, E., Villagrán-Santa Cruz M. et al. (2010). Erosion of lizard diversity by climate change and altered thermal niches. Science, 328, 894–899. https://doi.org/10.1126/science.1184695
Sinervo, B., Lara-Reséndiz, R. A., Miles, D. B., Lovich, J. E., Ennen, J. R. Müller, J. et al. (2017). Climate change and collapsing thermal niches of mexican endemic reptiles. White paper for the environmental working group of the UC-Mexico initiative. eScholarship: https://escholarship.org/uc/item/4xk077hp
Sinervo, B., Miles, D. B., Martínez-Méndez, N., Lara-Reséndiz, R. y Méndez-de la Cruz, F. R. (2011). Response to comment on “Erosion of lizard diversity by climate change and altered thermal niches”. Science, 332, 537. https://doi.org/10.1126/science.1195348
Sinervo, B., Miles, D. B., Wu, Y., Méndez-de la Cruz, F. R., Kirchoff, S. y Qi, Y. (2018). Climate change, thermal niches, extinction risk and maternal-effect rescue of toad-headed lizards, Phrynocephalus, in thermal extremes of the Arabian Peninsula to the Tibetan Plateau. Integrative Zoology, 13, 450–470. https://doi.org/10.1111/1749-4877.12315
Snyder, G. K. (1979). Water loss and oxygen consumption in tropical Sphaerodactylus. Oecologia, 38, 107–110. https://doi.org/10.1007/bf00347829
Sturaro, M. J. y Ávila-Pires, T. C. S. (2011). Taxonomic revision of the geckos of the Gonatodes concinnatus complex (Squamata: Sphaerodactylidae), with description of two new species. Zootaxa, 2869, 1–36. https://doi.org/10.11646/zootaxa.2869.1.1
Sunday, J. M., Bates, A. E., Kearney, M. R., Colwell, R. K., Dulvy, N. K., Longino, J. T. et al. (2014). Thermal-safety margins and the necessity of thermoregulatory behavior across latitude and elevation. Proceedings of the National Academy of Sciences of the United States of America, 111, 5610–5615. https://doi.org/10.1073/pnas.1316145111
Tewksbury, J., Huey, R. B. y Deutsch, C. A. (2008). Putting the heat on tropical animals. Science, 320, 1296–1297. https://doi.org/10.1126/science.1159328
Thomas, C. D., Cameron, A., Green, R. E., Bakkenes, M., Beaumont, L. J., Collinham, Y. C. et al. (2004). Extinction risk from climate change. Nature, 427, 145–148. https://doi.org/10.1038/nature02121
Thomson, A. M., Calvin, K. V., Smith, S. J., Kyle, G. P., Volke, A., Patel, P. et al. (2011). RCP4.5: a pathway for stabilization of radiative forcing by 2100. Climatic Change, 109, 77–94. https://doi.org/10.1007/s10584-011-0151-4
Thuiller, W., Georges, D., Engler, R. y Breiner, F. (2016). biomod2:Ensemble platform for species distribution modeling. Rpackage version 3.1-7. http://CRAN.R-project.org/package=biomod2
Torres-Carvajal, O., Pazmiño-Otamendi, G. y Salazar-Valenzuela, D. (2018). Reptiles del Ecuador. Version 2018.0. Museo de Zoología, Pontificia Universidad Católica del Ecuador. Recuperado el 31 de enero de 2018 de https://bioweb.bio/faunaweb/reptiliaweb
Vicenzi, N., Corbalán, V., Miles, D., Sinervo, B. e Ibargüengoytia, N. (2017). Range increment or range detriment? Predicting potential changes in distribution caused by climate change for the endemic high-Andean lizard Phymaturus palluma. Biological Conservation, 206, 151–160. https://doi.org/10.1016/j.biocon.2016.12.030
Vitt, L. J., Souza, R. A., Sartorius, S. S., Ávila-Pires, T. C. S. y Espósito, M. C. (2000). Comparative ecology of sympatric Gonatodes ( Squamata : Gekkonidae ) in the western Amazon of Brazil. Copeia, 2000, 83–95. https://doi.org/10.1643/0045-8511(2000)2000[0083:ceosgs]2.0.co;2



