Comparación del tamaño de letrina de dos especies de lepóridos después de un incendio en un ecosistema semiárido
José Luis González-Galvez a, Jordan Golubov c, Grecia Herrera-Meza a,d,*, María del Socorro Herrera-Meza b y Armando J. Martínez a
a Instituto de Neuroetología, Universidad Veracruzana, Av. Luis Castelazo Ayala s/n, Col. Industrial Ánimas, 91190 Xalapa Veracruz, México
b Instituto de Investigaciones Psicológicas, Universidad Veracruzana, Av. Luis Castelazo Ayala s/n, Col. Industrial Ánimas, 91190 Xalapa Veracruz, México
c Laboratorio de Ecología, Sistemática y Fisiología Vegetal, Universidad Autónoma Metropolitana-Xochimilco, Calzada del Hueso 1100, Col. Villa Quietud, Delegación Coyoacán, 04960 Ciudad de México, México
d Instituto Interdisciplinario de Investigación, Universidad de Xalapa, Km. 2 Carretera Xalapa-Veracruz, 91190 Xalapa, Veracruz, México
* Autor para correspondencia: greehem@gmail.com (G. Herrera-Meza)
Resumen
El conejo Sylvilagus floridanus (J.A. Allen, 1990) y la liebre Lepus callotis (Wagler, 1830), que cohabitan en la zona semiárida del valle de Perote, están bajo la continua presión de cambios en su hábitat por el impacto producido por incendios de tipo antrópico. Investigamos cómo el comportamiento de formación de letrinas de estos lepóridos difiere entre sitios con y sin exposición al incendio y cuáles son sus características de tamaño y composición. Nuestros resultados mostraron que el tamaño de las letrinas difiere entre conejos y liebres, y además entre sitios, ya que el sitio perturbado es donde las letrinas fueron más heterogéneas en tamaño. También registramos la presencia de letrinas mixtas en donde los conejos y liebres depositan mayor cantidad de grupos fecales después de 6 meses de haber ocurrido el incendio. Mostramos que S. floridanus y L. callotis tienen amplia plasticidad para aclimatarse a un hábitat perturbado por incendio y usan el hábitat perturbado a pesar de la pérdida temporal de la cobertura vegetal.
Palabras clave:
Hábitat; Lagomorfos; Perturbación; Conejos; Liebres; Semiárido
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Contrasting latrine sizes in two leporid species after fire in a semiarid ecosystem
Abstract
The cottontail rabbit Sylvilagus floridanus (J.A. Allen, 1990) and white-sided jackrabbit Lepus callotis (Wagler, 1830), coexist in the semiarid valley of Perote, Veracruz an area under continuous changes in land use and frequent anthropogenic impact of induced fires. We describe the formation of lagomorphs latrines, their composition, size and distribution as well as the characterization of the vegetation between conserved and fire disturbed sites. Our results show that the size of latrines differed between rabbits and hares as well as between sites. Disturbed sites had consistently more heterogeneous sized latrines. We also recorded that mixed latrines, that contained both rabbit and hare droppings, occurred only 6 months after intense fires occurred. Therefore, S. floridanus and L. callotis have a high plasticity towards habitat changes, even those associated to fire and rapidly use the disturbed habitat despite the temporary loss of vegetation cover.
Keywords:
Habitat; Lagomorphs; Disturbance; Rabbit; Hare jackrabbit; Semiarid
Los conejos y liebres silvestres definen su territorio a partir de ubicar marcas de olor en su hábitat y por la deposición de excretas en letrinas, las cuales funcionan como sitios de intercambio de información entre los individuos de la población (Monclús et al., 2009; Zollner et al., 1996). Este tipo de comportamiento suele estar asociado a la identificación del territorio usado por el individuo, así como su estatus dentro de la jerarquía social (Monclús y de Miguel, 2003; Sneddon, 1991). Por lo que características de las letrinas como tamaño, número de excretas y la ubicación espacial proporcionan indicadores del uso de hábitat de los conejos y liebres en ambientes conservados (Fowler y Kissell, 2007; Marı́n et al., 2003; Santilli et al., 2015; Zollner et al., 1996) y también en los que son perturbados por actividades humanas (Ziege et al., 2016).
Se conoce que en distintos tipos de ambientes, las letrinas de los lagomorfos también aportan información sobre la distribución local o regional de las especies (Clavijo, 2007; Lezama-Delgado et al., 2016; Putman, 1984; Ziege et al., 2016) que están estrechamente asociadas a la estructura de la vegetación, disponibilidad del alimento, refugio y heterogeneidad ambiental (Clavijo, 2007; Velázquez, 2012; Velázquez y Heil, 1996). Además los conejos y liebres son especies clave en diversos ecosistemas en los que habitan (Delibes-Mateos y Gálvez-Bravo, 2009), asimismo, contribuyen como herbívoros (Olofsson et al., 2008), dispersores de semillas (Dellafiore et al., 2006; Verdú et al., 2009) y a la zoocoria en las letrinas (Lezama-Delgado et al., 2016), por citar algunos estudios. A pesar de ello, en México aún son pocos los estudios que han evaluado aspectos de la biología y ecología conductual de estas especies.
Un aspecto a destacar también es que México, es muy diverso en la familia Lagomorfos (15 especies de conejos y liebres de las cuales 7 son endémicas; Semarnat, 2010). Además, casi la mitad de la riqueza de las especies habitan en zonas áridas y semiáridas como las liebres Lepus californicus Gray, L. alleni Mearns, L. callotis, y los conejos Sylvilagus floridanus, S. audubonii Baird, y S. bachmani Waterhouse (Semarnat, 2010). Sin embargo, las poblaciones están bajo continuas presiones como la deforestación e incendios y dicha transformación deriva hacia ganadería de libre pastoreo que es más extensiva en las zonas rurales (Farías, 2011; Sántiz et al., 2012; Semarnat-Conanp, 2012; Rizo-Aguilar et al., 2015; Velázquez et al., 1996). Hunter y Cresswell (2015) reportan que incendios inducidos para el rebrote de los pastos para alimento del ganado promueve condiciones para la presencia de Romerolagus diazi, opuesto a lo quese refiere en la literatura. Sin embargo, estás perturbaciones son muy frecuentes en México y cada vez más acentuadas en zonas áridas y semiáridas.
En este sentido, durante la última década la zona semiárida del valle de Perote- México en particular el malpais ha sido sujeta a un régimen de incendios frecuentes (Conafor, 2012, 2013) y en la cual cohabitan Sylvilagus floridanus y Lepus callotis, especies que usan y distribuyen en un gradiente de vegetación que abarca parte del bosque de coníferas, ecotono con matorral rosetófilo y pastizal (González, 2010). De ahí que si los incendios ocurren con cierta periodicidad, éstos deben estar impactando drásticamente sobre la vegetación y comportamiento de los mamíferos nativos, y si además consideramos que el hábitat utilizado por lagomorfos es un reflejo de la combinación de características bióticas y abióticas del lugar donde éstos ubican sus letrinas, entonces la perturbación debe estar modificando la conducta de deposición de excretas. El objetivo del estudio fue, por lo tanto, caracterizar las letrinas y conocer parte del uso del hábitat de S. floridanus y L. callotis haciendo un contraste entre sitios con distinto nivel de exposición a incendios.
Materiales y métodos
La zona es utilizada para la ganadería extensiva de caprinos y ha estado impactada por incendios recurrentes que son iniciados antes del periodo de lluvias, puesto que durante esta temporada es cuando los pastos nativos crecen y son consumidos por el ganado, ya que realizan el pastoreo en áreas con y sin exposición por incendio. Además, la vegetación del sitio es un matorral rosetófilo con especies predominantes como Nolina parviflora (Kunth) Baker, Yucca periculosa Baker, Agave oscura Schiede, Mammillaria magnimma Haw., M. discolor Haw. var discolor, Opuntia huajapensis Bravo y Salvia macrophylla Benth. y pastos como Aristida barbata Fourn., Boutela curtipendula (Michx.) Torr., Eragrotis sp. y Chloris submutica Kunth, entre otras (Sandoval, 1984).
Se seleccionaron 2 sitios de muestreo, específicamente, en mayo del año 2012 ocurrió un incendio que afectó 120 ha de la vegetación rosetófila y casi un año después en mayo de 2013, ocurrió otro incendio, en la misma área, que se extendió a 3,541 ha aunque hubo áreas que no fueron afectadas (Conafor,2012, 2013; Suárez, 2015). Después del segundo incendio se seleccionó un sitio denominado Sitio Perturbado (SP fig. 1A, 19°32´47” N, 97°20´49” O y 19°32´28” N, 97°20´49” O) y un segundo sitio, en otro lugar, se consideró como sitio conservado el cual por los registros (SC fig. 1A, 19°32´50” N, 97°21´49” O y 19°32´31” N, 97°21´49” O) correspondió a una área que tenía al menos 8 años de no haber estado expuesto a incendios y durante el disturbio del 2013 no fue afectado (Conafor, 2012, 2013) y a la fecha no se han registrado incendios.
El conejo castellano Sylvilagus floridanus, tiene una amplia distribución geográfica puesto que habita desde el sur de Canadá hasta el noroeste de Sudamérica (Chapman et al., 1980). También es de hábitos crepusculares y nocturnos, habita en valles, planicies, bosques de coníferas y encinos, bosques tropicales, pastizales y matorrales xerófilos, desde el nivel del mar hasta los 3,200 m snm (Escobedo-Cabrera y Lorenzo, 2011). La especie es simpátrica, en gran parte, con 4 especies de su género en México (S. brasiliensis, S. audubonii, S. insonus y S. cunicularius) y se desarrolla frecuentemente en áreas con cobertura vegetal densa y sitios rocosos (Cervantes, 1993).
Las 2 especies de estudio, están sujetas a cacería deportiva pero la caza furtiva ha contribuido ampliamente al decline de sus poblaciones (Semarnat, 2010). En Veracruz L. callotis y S. floridanus convergen en la porción norte del desierto de Tehuacán y son componentes importantes de la comunidad, por ser herbívoros secundarios y diseminadores de semillas (Campos, 2009; Ceballos, 2005).
En cada sitio se seleccionaron aleatoriamente 20 transectos de 100 m con una separación de 50 m, en los que se ubicaron las letrinas que tenían deposición de excretas frescas de conejos, liebres y mixta, 6 meses después de que ocurrió el incendio de mayo de 2013. Además, los transectos en el sitio perturbado estuvieron a una distancia de 400 m del sitio conservado. A cada letrina se le midió su longitud mayor y menor y se estimó su tamaño a partir de la ecuación de la elipse, y se identificó a qué especie correspondía con base en las características observadas de las excretas como su tamaño, forma y coloración, en particular las excretas de conejos tienen un extremo ausado a diferencia de las bola fecla de la liebre (Aranda, 2012). Ésto permitió definir si era letrina de liebre o de conejo, o de ambas especies a lo que denominamos mixta, además se consideró como letrina a las agrupaciones de excretas en sitios específicos que usan para delimitar el territorio y como lugar donde hay intercambio de información para la interacción social (Monclús y de Miguel 2003; Sneddon, 1991). Se realizó un solo muestreo en los 2 sitios de estudio, se recolectaron todas las excretas frescas depositadas en las letrinas por las 2 especies de lagomorfo, excluyendo las que tenían coloración gris o estaban muy deshidratadas. Previo a dicha recolecta se contaron los grupos fecales, el cual definimos como el conjunto de excretas que conejos y liebres suelen ubicar en las letrinas, y se registró la presencia y ausencia de excretas del ganado caprino en cada letrina, las cuales se distinguen por ser más grandes y de color verde oscuro.
En ambos sitios también se realizó la caracterización de la vegetación en 5 líneas de Canfield de 100 m establecidas al azar, las cuales estuvieron separadas 50 m. En cada línea se midió la altura y cobertura de los pastos, herbáceas, arbustos, suculentas (A. oscura y O. huajapensis) y leñosas (N. parviflora y Y. periculosa), rocas y suelo desprovisto de vegetación (superficie).
El número de letrinas de conejos, liebres y mixta se comparó entre sitios utilizando una tabla de contingencia de 2 × 3 (2 sitios y 3 tipos de letrinas) (Zar, 1996). Las variables de respuesta tamaño de la letrina, el número de grupos fecales y la presencia-ausencia (1, 0) de excretas de ganado caprino en las letrinas fueron analizadas mediante modelos lineales generalizados (MLG), con un diseño de Anova bifactorial: y = S + L + S ×L donde y, correspondió a la variable de respuesta, S con sus 2 niveles (sitio perturbado y sitio conservado), y el segundo factor fue el tipo de letrina (conejo, liebre y mixta), así como su respectiva interacción entre factores. Las variables de respuesta se ajustaron a una distribución de error tipo Poisson y en el caso de la presencia-ausencia de excretas de ganado caprino en las letrinas fue analizada utilizando un ajuste de distribución de error tipo binomial (Bolker et al., 2009; Crawley, 1993). Las variables con las que se caracterizó el hábitat fueron analizadas usando un modelo unifactorial (Anova, MLG) y debido a que no cumplían con el supuesto de normalidad y homogeneidad de varianzas las variables se transformaron a rango (Conover e Iman, 1981). Todas las variables fueron analizadas con el paquete estadístico JMP 9 (SAS Institute, Inc., Cary, North Carolina 1989-2007).
Resultados
Número de letrinas encontradas de Sylvilagus floridanus, Lepus callotis y mixtas, en el sitio perturbado (incendio) y sitio conservado en el malpaís, Perote Veracruz.
Valores promedio (m2 ± error estándar) del tamaño de letrina y grupos fecales por letrina producto de la interacción entre sitio ×tipo de letrina, en el sitio perturbado y sitio conservado en el malpaís de Perote, Veracruz. Es importante indicar que debido a que la interacción de los factores no aportó efecto significativo, no se realizaron las comparaciones múltiples de los valores promedio.
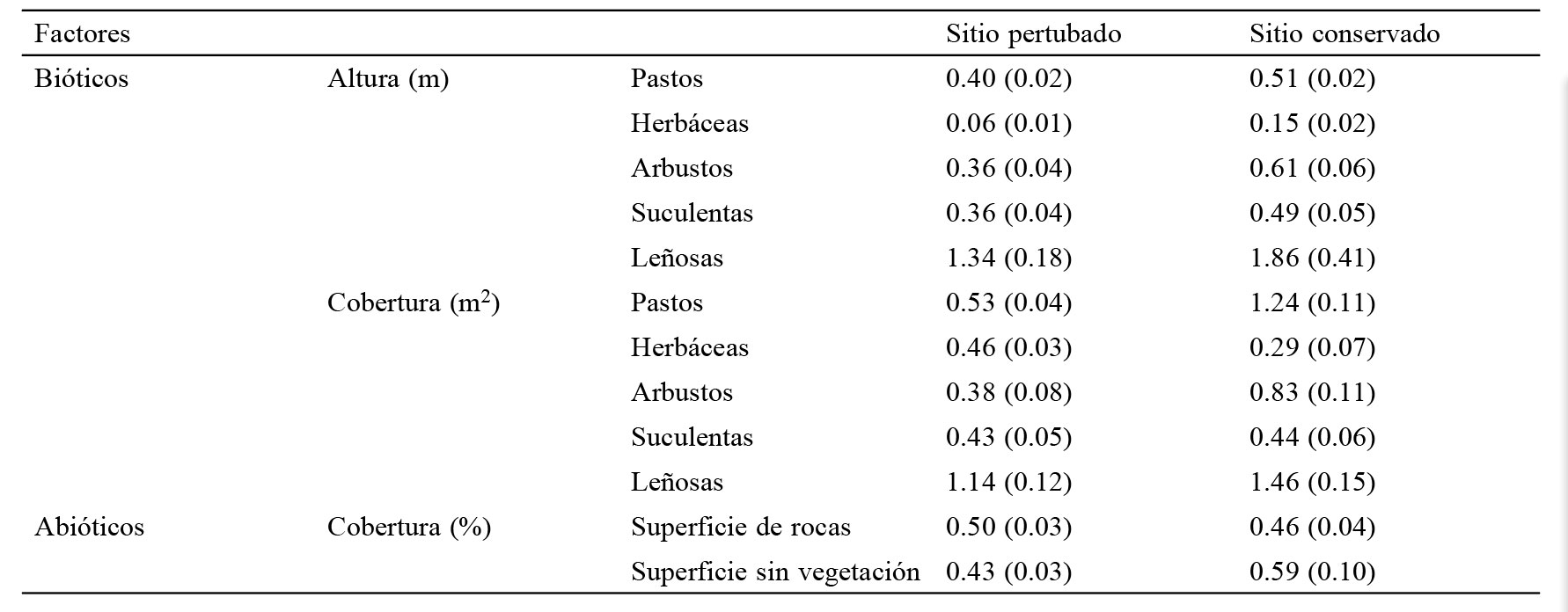
La altura y cobertura de los pastos contrastó entre sitios (F = 8.4, gl = 1, p < 0.01 y F = 45.6, gl = 1, p < 0.001, respectivamente), ya que en el sitio conservado los pastos tuvieron mayor altura y cobertura promedio, resultado esperado por el efecto del incendio. Las herbáceas también difirieron en su altura promedio al comparar entre sitios (F = 26.3, gl = 1, p < 0.001), siendo las plantas del sitio conservado las que tuvieron mayor altura promedio, pero la cobertura promedio fue mayor en el sitio perturbado (F = 5.2, gl = 1, p = 0.02). Para los arbustos, ni la altura ni la cobertura promedio difirió entre sitios (altura F= 1.9, gl = 1, p = 0.16 y cobertura F = 3.55, gl = 1, p = 0.06, respectivamente). Las especies suculentas difirieron significativamente en altura entre sitios (F = 5.2, gl = 1, p =0.02), pero no en cobertura (F= 0.2, gl = 1, p = 0.59). Además, las leñosas N. parviflora y Y. periculosa tuvieron la misma altura y cobertura promedio entre sitios (altura F = 0.6, gl = 1, p = 0.43 y cobertura F = 0.9, gl = 1, p = 0.34) ( tabla 3).
Los componentes abióticos como superficie promedio de rocas no difirió entre sitios (F= 1.31, gl = 1, p = 0.25), aunque los espacios sin vegetación fueron mayores en el Sitio Perturbado como era de esperar por el impacto del incendio (F = 5.23, gl = 1, p = 0.02, tabla 3).
Valores promedio de la altura (m) y cobertura (m2 ± error estándar) de la estructura vegetal y de la superficie de rocas, materia muerta y área desprovista de vegetación para el sitio perturbado (SP) y sitio conservado (SC) en el malpaís de Perote, Veracruz.
Discusión
Las letrinas con excretas de ambas especies de lagomorfos que se registraron en el sitio perturbado fueron las que tuvieron mayor tamaño, y es que en los estudios de uso de hábitat de conejos y liebres se ha registrado que, cuando hay mayor cobertura vegetal las letrinas son de menor tamaño con respecto a sitios de escasa vegetación (Marín et al., 2003; Monclús y de Miguel, 2003; Smith y Litvaitis, 2000). Al respecto, la menor cobertura vegetal causada por efecto del incendio provoca en parte que estas 2 especies de Lagomorpha establezcan letrinas más grandes y con los grupos fecales más esparcidos. Por lo que a partir del estado de conservación del sitio, podemos indicar que el conejo y la liebre están haciendo un uso diferencial del hábitat después del incendio; esto también debido a la menor cobertura de pastos que son la base principal de la dieta de S. floridanus y L. callotis. En este sentido, Fa et al. (1992) mencionan que la presencia de 3 especies de conejos se relaciona con la densidad de hierbas y altura de pastos, asimismo resaltan que el uso de hábitat es escaso en los pastizales que estuvieron expuestos a incendios, en lo cual coinciden nuestros resultados. Sin embargo, recientemente Hunter y Cresswell (2015) indican que los incendios provocados para que crezca el pasto favorece la presencia del conejo R. diazi, aunque en sus investigaciones previas reportan lo opuesto.
Nosotros registramos la presencia de letrinas 6 meses después del incendio, lo que sugiere por un lado que los individuos ubican nuevamente su terrtorio, posiblemente como producto de la fidelidad de los conejos y liebres a su hábitat. Además, inician su alimentación con el rebrote de los pastos nativos y herbáceas (observación personal) y de las hojas carnosas (cladodios) de Opuntia (Suárez, 2015), puesto que en el sitio conservado los pastos suelen estar marchitos por efecto de la temporada de sequía. Aunque los conejos y liebres inician la búsqueda de alimento cuando empieza el rebrote en las plantas y esto se explica en parte la presencia de excretas secas acumuladas en las letrinas. Es importante indicar también que el conejo S. floridanus, suele habitar las zonas perturbadas, ya que en estos sitios son menos vulnerables a los depredadores nativos a pesar del riesgo al desplazarse a áreas desprovistas de la vegetación que los encubre (Smith y Litvaitis, 2000). Además reportamos mayor número de letrinas de S. floridanus en el sitio perturbado y menor cantidad de letrinas de la liebre. En cambio, la liebre L. callotis usa la cobertura vegetal como protección en ambientes con pastizales extensos como en el desierto de Nuevo México (Bednarz y Cook, 1984; Bogan y Jones, 1975; Desmond, 2004). Esta respuesta es congruente con nuestros resultados, puesto que hay más letrinas de liebre en el sitio conservado, el cual tiene el mayor porcentaje de cobertura de pastos y de arbustos, aunque en el sitio perturbado también registramos tanto letrinas de conejos como de liebres, así como letrinas mixtas
que tienen grupos fecales de ambas especies de lagomorfos.
En este sentido, podemos indicar que la deposición de excretas en letrinas mixtas es un comportamiento que puede explicarse en parte por la simpatría entre especies al compartir el hábitat y los recursos alimenticios como lo sugieren en otras especies Monclús et al. (2009). Sin embargo, la frecuencia y la intensidad de los incendios en esta zona semiárida puede ser el componente que contribuye a que los conejos y liebres realicen deposición de excretas en las letrinas mixtas puesto que los incendios pueden estar restringiendo su hábitat. Otra explicación es que la simpatría de estos 2 herbívoros no demarque un uso exclusivo de las letrinas, aunque se requieren de observaciones directas para precisar la forma en que usan estás áreas en los ambientes con y sin perturbación.
Otro resultado que se obtuvo fue que la cantidad de grupos fecales es más abundante en el sitio conservado, pero son las liebres las que realizan más deposiciones en las letrinas aunque éstas son de menor tamaño en promedio; en cambio, las letrinas mixtas son más grandes y con mayor deposición de grupos fecales. González (2010), en su estudio también registró un tamaño de letrinas de las liebres similar al que medimos en el sitio sin perturbación. Además de que la distancia de las letrinas de conejos es menor a la cobertura de arbustos y pastos y las liebres ubican sus letrinas a mayor distancia de ésta (observación personal). Comportamiento de evasión que es parte de las estrategias de los conejos y liebres para su protección o para evadir a los depredadores como lo sugiere Marín et al. (2003).
Es importante enfatizar que los resultados solo muestran parte de la dinámica de uso de hábitat de S. floridanus y L callotis y se ignoran aún varios componentes conductuales de su jerarquía social. Tal como el que se ha registrado para las hembras de Oryctolagus cuniculus Linnaeus, las cuales cuando visitan las letrinas deponen más excretas; en cambio, los machos realizan pocas visitas a la letrina y son muy breves (Sneddon, 1991). Es preciso hacer notar que este patrón conductual se registró en un ambiente sin disturbio en su hábitat, por lo que sería necesario describir el comportamiento de S. floridanus y L. callotis con observaciones directas y comparar entre ambientes con y sin disturbio por incendios. No obstante, las diferencias en el tamaño de las letrinas y número de grupos fecales entre sitios y especies, es consecuencia del efecto que tiene el incendio sobre el comportamiento de los conejos y liebres. Además de que una letrina de mayor tamaño estaría posiblemente indicando que aún no hay una estrecha interacción social entre individuos.
Registramos además la presencia de excretas de ganado caprino en las letrinas de conejos y liebres, lo cual parece estar relacionado con las marcas de olor en la letrina y no al estado de conservación o perturbación del ambiente como también lo registraron en la zona González (2010) y Monclús et al. (2009) para el conejo O. cuniculus. Una hipótesis interesante de probar en este sentido, es sí el ganado caprino, a partir del proceso de quimiopercepción en las letrinas, esté respondiendo a las señales de marcaje de los lagomorfos o si la deposición de excretas del ganado solo es por el consumo de pastos y estructura vegetal que circunda a las letrinas.
Por otro lado, la estructura vegetal proporciona ventajas a S. floridanus y L. callotis en lo que se refiere a refugio como protección en contra de posibles depredadores, y por ello se esperaría que las letrinas fueran de menor tamaño y con mayor cantidad de excretas. Además, sí consideramos lo que Smith y Litvaitis (2000) mencionan sobre las estrategias de alimentación que realizan las especies simpátricas de lagomorfos, se delimitarían 2 formas diferentes de uso del hábitat a consecuencia de las modificaciones y disturbios que ocurren en su ambiente. Además de que el uso del espacio y hábitat que realizan algunas especies de liebres suele asociarse a sitios con intensa actividad agrícola (Reitz y Leonard, 1994) o áreas perturbadas como en el caso de los conejos (Smith y Litvaitis, 2000; Ziege et al., 2016).
Por lo tanto, nuestros resultados indican parte de la plasticidad conductual de los conejos y liebres para aclimatarse a los ambientes perturbados, a partir de que forman nuevas letrinas relativamente pronto en el sitio afectado por el incendio, a pesar de la baja cobertura vegetal. Además, el disturbio modifica la estrategia de alimentación de los conejos y liebres, puesto que se están alimentado de los rebrotes de pastos y herbáceas en el sitio perturbado al igual que el ganado caprino (datos sin publicar). Por lo que es posible que este sistema de interacción conduzca a una competencia por recursos, aunque aún no tenemos evidencia para demostrarlo.
En general, las letrinas de liebres y conejos contrastan en tamaño y fue en el sitio conservado donde son más pequeñas. La pérdida de la estructura vegetal por el impacto que causa el incendio es determinante en el uso de hábitat que realizan los lagomorfos y hace evidente la respuesta conductual a la perturbación. Además, a pesar de la menor cantidad de cobertura vegetal en el sitio incendiado, los conejos y liebres establecen letrinas heterogéneas en tamaño en el sitio perturbado, y consumen el renuevo de brotes de pastos, opuntias y herbáceas (datos no publicados). Por lo tanto, el hecho de que S. floridanus y L. callotis ubiquen letrinas en un sitio con disturbio es un comportamiento que nos permite inferir que tienen una mayor plasticidad en cuanto al uso de hábitat, así como una posible fidelidad al sitio.
Agradecimientos
Referencias
Bednarz, J. y Cook, J. (1984). Distribution and numbers of the white-sided jackrabbit (Lepus callotis allardi) in New Mexico. The Southwestern Naturalist, 259, 358–361.
Bello, R. (2010). Distribución y abundancia de la liebre torda Lepus callotis en el Valle de Perote, Veracruz (Tesis de Licenciatura). Facultad de Biología, Universidad Veracruzana. Xalapa, Veracruz, México.
Best, T. L. y Henry, T. H. (1993). Lepus callotis. Mammalian Species Archive, 442, 1–6.
Blackwell, P. y Macdonald, D. (2000). Shapes and sizes of badger territories. Oikos, 89, 392–398.
Bogan, M. A. y Jones, C. (1975). Observations on Lepus callotis in New Mexico. Proceedings of the Biological Society Washington, 88, 45–49.
Bolker, B. M., Brooks, M. E., Clark, C. J., Geange, S. W., Poulsen, J. R., Stevens, M. H. H. et al. (2009). Generalized linear mixed models: a practical guide for ecology and evolution. Trends in Ecology and Evolution, 24, 127–135.
Campos, J. J. (2009). Sylvilagus floridanus y Juniperus deppeana: interacción no especializada de dispersión de semillas (Tesis de maestría en Neuroetología). Instituto de Neuroetología, Universidad Veracruzana. Xalapa, Veracruz, México.
Ceballos, G. (2005). Orden Lagomorpha. En G. Ceballos y G. Oliva (Eds.), Los mamíferos silvestres de México (pp. 824–850). México D.F.: Fondo de Cultura Económica, Conabio.
Cervantes, F. (1993). Conejos y liebres silvestres de México. Ciencia y Desarrollo, 10, 58–69.
Chapman, J., Hockman, J. y Ojeda, C. (1980). Sylvilagus floridanus. Mammalian Species, 136, 1–8.
Clavijo, A. M. (2007). Uso de hábitat por dos especies simpátricas de lagomorfos en tres asociaciones vegetales del Parque Nacional La Malinche (Tesis). Facultad de Ciencias, Universidad Nacional Autónoma de México, México
D.F.
Conafor (Comisión Nacional Forestal). (2012). Reporte semanal de resultados de incendios forestales 2012. Datos acumulados del 01 de enero al 31 de diciembre de 2012. México, D.F. Recuperado el 2 de febrero, 2017 de: http://www.cnf.gob.mx:8090/snif/portal/las-demas/reportes-de-incendios-forestales
Conafor (Comisión Nacional Forestal). (2013). Reporte semanal de resultados de incendios forestales. Datos acumulados del 01 de enero al 27 de diciembre de 2013. Datos acumulados del 01 de enero al 26 de diciembre de 2013. México, D.F. Recuperado el 4 de junio, 2017 de: http://www.conafor.gob.mx:8080/documentos/docs/10/4215Reporte%20Semanal%202013%20-%20Incendios%20Forestales.pdf
Conagua (Comisión Nacional del Agua). (2010). Normas climatológicas por estación. Servicio Meteorológico Nacional, México, D.F. Recuperado el 2 de febrero, 2017 de: http://smn1.conagua.gob.mx/index.php?option=com_con tent&view=article&id=42&Itemid=75
Conover, W. e Iman, R. (1981). Rank transformations as a bridge between parametric and nonparametric statistics. The American Statistician, 35, 124–129.
Crawley, M. J. (1993). GLIM for Ecologists. Methods in ecology series. Oxford: Blackwell Scientific Publications.
Delibes-Mateos, M. y Gálvez-Bravo, L. (2009). El papel del conejo como especie clave multifuncional en el ecosistema mediterráneo de la península Ibérica. Ecosistemas, 18, 14–25.
Dellafiore, C., Muñoz, S. y Gallego, J. (2006). Rabbits (Oryctolagus cuniculus) as dispersers of Retama monosperma seeds in a coastal dune system. Ecoscience, 3, 5–10.
Desmond, M. (2004). Habitat associations and co-occurrence of Chihuahuan desert hares (Lepus californicus and L. callotis). The American Midland Naturalist, 151, 414–420.
Escobedo-Cabrera, E. y Lorenzo, C. (2011). Nuevos registros de Sylvilagus floridanus en la península de Yucatán, México. Therya, 2, 279–283.
Fa, J., Romero, F. y López-Paniagua, J. (1992). Habitat use by parapatric rabbits in a Mexican high-altitude grassland system. Journal of Applied Ecology, 29, 357–370.
Farías, V. (2011). Conceptos ecológicos, métodos y técnicas para la conservación de conejos y liebres. En O. Sánchez, P. Zamorano y H. Moya (Eds.), Temas sobre conservación de vertebrados silvestres en México (pp. 229–248). México D.F.: Semarnat.
Fowler, A. y Kissell, Jr. R. E. (2007). Winter relative abundance and habitat associations of swamp rabbits in eastern Arkansas. Southeastern Naturalist, 6, 247–258.
García, E. (1988). Modificaciones al sistema de clasificación climática de Köppen. México D.F.: Offset Larios, S.A.
Gerez-Fernández, P. (1985). Uso del suelo durante cuatrocientos años y cambio fisonómico en la zona semiárida poblano-veracruzana. Biótica, 10, 123–144.
González, G. J. L. (2010). Letrinas de Lepus callotis y Sylvilagus floridanus como indicador del uso de hábitat en dos tipos de vegetación de la zona semiárida del Valle de Perote, Veracruz (Tesis de maestría en Neuroetología). Instituto de Neuroetología, Universidad Veracruzana. Xalapa, Veracruz, México.
Hunter, M. y Cresswell, W. (2015). Factors affecting the distribution and abundance of the endangered volcano rabbit Romerolagus diazi on the Iztaccihuatl volcano, Mexico. Oryx, 49, 366–375.
IUCN (International Union for Conservation of Nature and Natural Resources) (2017). Lepus callotis. Recuperado el 4 de junio, 2017 de: http://www.iucnredlist.org/details/11792/0
King, S. R. B. y Gurnell, J. (2007). Scent-marking behavior by stallions: an assessment of function in a reintroduced population of Przewalski horses (Equus ferus prewalskii). Journal of Zoology, 272, 30–36.
Lezama-Delgado, E., Sainos-Paredes, P., López-Portillo, J., Angeles, G., Golubov, J. y Martínez, A. J. (2016). Association of Juniperus deppeana (Cupressaceae: Pinales) seeds with Mexican cottontail rabbit (Sylvilagus cunicularius; Leporidae: Lagomorpha) latrines. Journal of Natural History, 50, 2547–2555.
MacDonald, D. W. (1980). Patterns of scent marking with urine and faeces amongst carnivore communities. Symposium of the Zoological Socciety of London, 45, 107–139.
Marı́n, A. I., Hernández, L. y Laundré, J. W. (2003). Predation risk and food quantity in the selection of habitat by black-tailed jackrabbit (Lepus californicus): an optimal foraging approach. Journal of Arid Environments, 55, 101–110.
Martínez, E. (2006). Efecto del cambio climático en la distribución espacio-temporal de dos lagomorfos en México (Tesis de maestría en Ciencias Biológicas). Instituto de Biología, Universidad Autónoma de México. México, D.F.
Monclús, R., Arroyo, M., Valencia, A. y de Miguel, F. J. (2009). Red fox (Vulpes vulpes) use rabbit (Oryctolagus cuniculus) scent marks as territorial marking sites. Journal of Ethology, 27, 153–156.
Monclús, R. y de Miguel, F. J. (2003). Distribución espacial de las letrinas de conejo (Oryctolagus cuniculus) en el monte de Valdelatas (Madrid). Galemys, 15, 157–165.
Olofsson, J., de Mazancourt, C. y Crawley, M. J. (2008). Spatial heterogeneity and plant species richness at different spatial scales under rabbit grazing. Oecologia, 156, 825–834.
Putman, R. J. (1984). Facts from feces. Mammal Review, 14, 79–97.
Reitz, F. y Leonard, Y. (1994). Characteristics of European hare Lepus europaeus use of space in a French agricultural region of intensive farming. Acta Theriologica, 39, 143–157.
Rizo-Aguilar, A., Guerrero, J. A., Hidalgo-Mihart, M. G. y González-Romero, A. (2015). Relationship between the abundance of the endangered volcano rabbit Romerolagus diazi and vegetation structure in the Sierra Chichinautzin mountain range, Mexico. Oryx, 49, 360–365.
Ruiz-Aizpurua, L., Planillo, A., Carpio, A. J., Guerrero-Casado, J. y Tortosa, F. S. (2013). The use of faecal makers for the delimitation of the European rabbit’s social territories (Oryctolagus cuniculus L.). Acta Ethologica, 16, 157–162.
Sandoval, J. M. C. (1984). Estudio de la vegetación de la sierra de Mastaloyan, Veracruz, México (Tesis). Facultad de Ciencias Biológicas, Universidad Veracruzana. Xalapa, Veracruz, México.
Santilli, F., Bagliacca, M. y Paci, G. (2015). Density and habitat use of sympatric brown hares and European rabbits in a Mediterranean farmland area of Tuscansy (Central Italy). Ethology Ecology and Evolution, 27, 233–243.
Sántiz, E. C., González-Romero, A., Lorenzo, C., Gallina-Tessaro, S. y Cervantes, F. (2012). Uso y selección de asociaciones vegetales por la liebre de Tehuantepec (Lepus flavigularis) en Oaxaca, México. Therya, 3, 127–136.
Semarnat (Secretaría de Medio Ambiente y Recursos Naturales). (2010). Plan de manejo tipo de liebres y conejos. Dirección General de Vida Silvestre. Gobierno Federal del Distrito Federal, México. Subsecretaría de Gestión para la Protección Ambiental. Dirección General de Vida Silvestre. Recuperado el 2 de febrero, 2017 de: http://www.semarnat.gob.mx/archivosanteriores/temas/gestionambiental/vidasilvestre/Documents/PMT%20Enero%202011/PMT%20CONEJOS%20Y%20LIEBRES_FIN.pdf
Semarnat-Conanp (Secretaría de Medio Ambiente y Recursos Naturales-Comisión Nacional de Áreas Protegidas). (2012). Programa de acción para la conservación de la especie (PACE): Zacatuche, Romerolagus diazi. En I. C. Molina, J. L C. Romo, y M. P. Lallande (Eds.), México, D.F. Recuperado 2 de febrero, 2017 de: http://procer.conanp.gob.mx/pdf/pace_zacatuche.pdf
Smith, D. F. y Litvaitis, J. A. (2000). Foraging strategies of sympatric lagomorphs: implications for differential success in fragmented landscapes. Canadian Journal of Zoology, 78, 2134–2141.
Sneddon, I. A. (1991). Latrine use by the European rabbit (Oryctolagus cuniculus). Journal of Mammalogy, 72, 769–775.
Suárez, R. C. (2015). El crecimiento de cladodios de dos especies de Opuntia y su respuesta a la perturbación por incendio antrópico (Tesis de maestría en Ciencias). Centro de Investigaciones en Genética y Ambiente, Universidad Autónoma de Tlaxcala, Tlaxcala, México.
Velázquez, A. (2012). El contexto geográfico de los lagomorfos de México. Therya, 3, 223–238.
Velázquez, A. y Heil, G. W. (1996). Habitat suitability study for the conservation of the volcano rabbit (Romerolagus diazi). Journal of Applied Ecology, 33, 543–554.
Velázquez, A., Romero, F. y López-Paniagua, J. (1996). Ecología y conservación del conejo zacatuche (Romerolagus diazi) y su hábitat. México, D.F.: Fondo de Cultura Económica.
Verdú, J. R., Numa, C., Lobo, J. M., Martínez-Azorín, M. y Galante, E. (2009). Interactions between rabbits and dung beetles influence the establishment of Erodium praecox. Journal of Arid Environments, 73, 713–718.
Villa, R. B. y Cervantes, F. A. (2003). Los mamíferos de México. México D.F.: Instituto de Biología, Universidad Nacional Autónoma de México, Grupo Editorial Iberoamérica.
Zar, J. H. (1996). Biostatistical analysis, 4th edition. Upper Saddle River, New Jersey: Prentice Hall.
Ziege, M., Bierbach, D., Bischoff, S., Brandt, A. L., Brix, M., Greshake, B. et al. (2016). Importance of latrine communication in European rabbits shifts along a rural-to-urban gradient. BMC Ecology, 16, 1.
Zollner, P. A., Smith, W. P. y Brennan, L. A. (1996). Characteristics and adaptive significance of latrines of swamp rabbits (Sylvilagus aquaticus). Journal of Mammalogy, 77, 1049–1058.